Бициклическое гетероциклическое соединение
Номер патента: 24846
Опубликовано: 31.10.2016
Авторы: Сакураи Минору, Секиока Рюити, Моритомо Хироюки, Сираиси Нобуюки, Моритомо Аяко, Кавано Нориюки, Каваками Симпей, Судзуки Такаюки, Хамагути Ватару
Формула / Реферат
1. Соединение, представленное формулой (I), или его фармацевтически приемлемая соль:
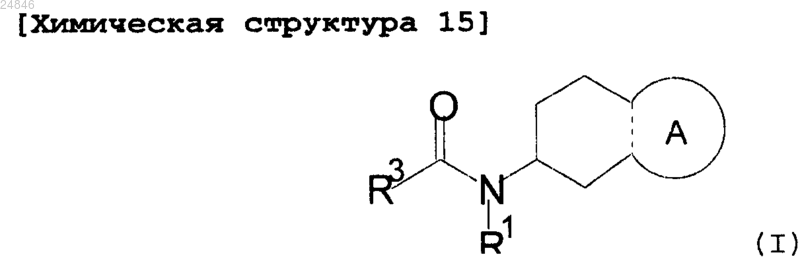
где символы представляют собой следующее:
бициклическое кольцо, которое образовано кольцом А, конденсированным с соседним кольцом, представляет собой 4,5,6,7-тетрагидроиндазол-5-ил;
R1 представляет собой циклопропил;
R3 представляет собой фенил, индолил или индазолил, которые могут быть соответственно замещены группой, выбранной из группы Q;
группа Q представляет собой группу, состоящую из галогена, C1-6алкила, галоген-C1-6алкила, -OR0, C1-6алкилен-OR0, -S-C1-6алкила, С6-14арила, 3-15-членной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из кислорода, серы и азота, и C1-6алкилен-3-15-членной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из кислорода, серы и азота (где C6-14арил и 3-15-членная гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из кислорода, серы и азота в группе Q, могут быть замещены галогеном, циано, C1-6алкилом, -OR0 или оксо); и
R0 представляет собой -Н или C1-6алкил.
2. Соединение по п.1, где R3 представляет собой фенил, который может быть замещен группой, выбранной из (i) фенила или пиридила, которые могут быть замещены соответственно галогеном или циано; (ii) галогена; (iii) C1-6алкила и (iv) -O-C1-6алкила.
3. Соединение по п.1, где R3 представляет собой индолил, который может быть замещен C1-6алкилом или -O-C1-6алкилом.
4. Соединение по п.1, выбранное из группы, состоящей из
(-)-N-циклопропил-4 -изопропокси-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бензамида,
(-)-2'-циано-N-циклопропил-6'-фтор-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бифенил-4-карбоксамида,
N-циклопропил-1-метил-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)-1Н-индол-4-карбоксамида,
N-циклопропил-7-метокси-1-метил-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)-1Н-индол-4-карбоксамида,
2'-циано-N-циклопропил-4'-фтор-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бифенил-4-карбоксамида,
2'-циано-N-циклопропил-3-фтор-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бифенил-4-карбоксамида,
N-циклопропил-2',6'-дифтор-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бифенил-4-карбоксамида,
N-циклопропил-4-(3,5-дифторпиридин-4-ил)-N-(4,5,6,7-тетрагидро-2Н-индазол-5-ил)бензамида и
N-циклопропил-4-изопропокси-2-метокси-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бензамида,
или его фармацевтически приемлемая соль.
5. Соединение по п.1, представляющее собой (-)-N-циклопропил-4-изопропокси-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бензамид, или его фармацевтически приемлемая соль.
6. Соединение по п.1, представляющее собой (-)-2'-циано-N-циклопропил-6'-фтор-N-(4,5,6,7-тетрагидро-1Н-индазол-5-ил)бифенил-4-карбоксамид, или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция, ингибирующая 11β-гидроксистероидную дегидрогеназу 1 типа, содержащая соединение по п.4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
8. Фармацевтическая композиция для профилактики или лечения деменции или боли, содержащая соединение по п.4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
9. Фармацевтическая композиция для профилактики или лечения деменции, содержащая соединение по п.4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
10. Фармацевтическая композиция для профилактики или лечения боли, содержащая соединение по п.4 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
11. Применение соединения по п.4 или его фармацевтически приемлемой соли при получении агента, ингибирующего 11β-гидроксистероидную дегидрогеназу 1 типа, или средства для профилактики или лечения деменции или боли.
12. Применение соединения по п.4 или его фармацевтически приемлемой соли для профилактики или лечения деменции или боли.
13. Средство для профилактики или лечения деменции или боли, представляющее собой соединение по п.4 или его фармацевтически приемлемую соль.
14. Способ профилактики или лечения деменции или боли, включающий введение эффективного количества соединения по п.4 или его фармацевтически приемлемой соли пациенту.
Текст
Изобретение относится к соединению, которое может быть использовано в качестве активного ингредиента фармацевтической композиции для лечения заболеваний, связанных с 11-гидроксистероидной дегидрогеназой 1 типа, таких как деменция и боль (в частности, нейропатическая боль или фибромиалгия). Обнаружено, что бициклическое гетероциклическое соединение (бициклический гетероцикл, образованный, когда циклогексановое кольцо конденсировано с 5-членным моноциклическим гетероциклом, который содержит только атом азота в качестве гетероатома), замещенное ациламиногруппой, такой как(гетеро)ароиламиногруппой и т.п., или его фармацевтически приемлемая соль обладают превосходной селективной ингибирующей активностью в отношении 11-HSD1. Соответственно,бициклическое гетероциклическое соединение по настоящему изобретению может быть использовано для лечения деменции и боли (в частности, нейропатической боли или фибромиалгии). Область техники Настоящее изобретение относится к бициклическому гетероциклическому соединению или его фармацевтически приемлемой соли, которое может быть использовано в качестве активного ингредиента фармацевтической композиции, например фармацевтической композиции для лечения заболеваний, связанных с 11-гидроксистероидной дегидрогеназой 1 типа (11-HSD1), таких как деменция (в частности,деменция альцгеймеровского типа) и боль (в частности, нейропатическая боль или фибромиалгия). Предпосылки изобретения Глюкокортикоид производится надпочечниками. Кроме того, глюкокортикоид преобразуется в активную форму из неактивной формы на тканевом уровне и действует на ткани посредством его рецепторов. 11-Гидроксистероидная дегидрогеназа (11-HSD) представляет собой фермент, который катализирует это преобразование, и известно, что существуют два подтипа фермента. 11-гидроксистероидная дегидрогеназы 1 типа (11-HSD1) является ферментом, который преобразует неактивную форму в активную форму и сильно экспрессируется в печени, и 11-гидроксистероидная дегидрогеназа 2 типа(11-HSD2) является ферментом, который преобразует активную форму в неактивную ферму и сильно экспрессируется в почках. 11-HSD1 известен также как сильно экспрессирующийся в головном мозге, но 11-HSD2 практически не экспрессируется в головном мозге (Thekkepat С. Sandeep et al., Proceedings of the NationalAcademy of Science, 2004, Vol. 101, p. 6734-6739). В качестве наличия связи между глюкокортикоидом и деменцией у пациентов были получены подтверждения об увеличении уровня активного глюкокортикоида (кортизола) в слюне или крови пациентов с болезнью Альцгеймера (Giubilei F. et al. Journal of neuroscience research, 2001, Vol. 66, p. 262-265, ZeynelA Erkut et al., Neuropsychopharmacology, 2004, Vol. 29, p. 152-157), корреляция между НРА аксиальным нарушением (John G. Csernansky et al., The American Journal of Psychiatry, 2006, Vol. 163, p. 2164-2169), а также уровнем кортизола и значением индекса атрофии головного мозга и т.п. (Giubilei F. et al., Journal ofneuroscience research, 2001, Vol. 66, p. 262-265). Кроме того, было подтверждено, что введение препарата кортизола или глюкокортикоида здоровому индивидууму или пациенту с болезнью Альцгеймера индуцирует языковое расстройство или нарушение памятиal.,Psychopharmacology, 1999, Vol. 145, p. 260-266, P. S. Aisen et al. Neurology, 2000, Vol. 54, p. 588-593). Более того, в качестве связи между 11-HSD1 и познавательной способностью, сообщалось о действии по улучшению вербальной памяти при введении неселективного ингибитора 11-HSD пациенту с сахарным диабетом II типа (Thekkepat С. Sandeep et al., Proceeding of National Academy of Science, 2004, Vol. 101,p. 6734-6739), a также о действии по ослаблению когнитивного расстройства у взрослых мышей с нокаутированным геном 11-HSD1 (Joyce L., W. Yau et al., Proceeding of the National Academy of Science, 2001,Vol. 98, p. 4716-4721) и т.п. В связи с этим ожидается, что ингибитор 11-HSD1 будет подавлять действие глюкокортикоида в мозге путем ингибирования преобразования глюкокортикоида в активный вид и, соответственно, может быть использован для лечения когнитивного расстройства, вызванного глюкокортикоидом. Кроме того, что касается деменции, ожидается, что ингибитор 11-HSD1 будет ослаблять заболевания центральной нервной системы, такие как шизофрения (X.Y. Zhang et al., Neuropsychopharmacology,2005, Vol. 30, p. 1532-1538), депрессия (Bernard J. Carroll et al., Archives of General Psychiatry, 1981,Vol. 38, p. 15-22), тревожность (Veen G. et al., Metabolism, 2009, Vol. 58, p. 821-827), посттравматическое стрессовое расстройство (PTSD) (Charney D.S. et al., Archives of General Psychiatry, 1933, Vol. 50, p. 295305), синдром дефицита внимания с гиперактивностью (AD/HD) (Hong H.J. et al Yonsei Medical Journal,2003, Vol. 44, p. 608-614), паническое расстройство (Angelika E. et al., Neuropsychopharmacology, 2006,Vol. 31, p. 2515-2522), нарушение сна (Andersen M.L. et al., Journal of sleep research, 2005, Vol. 14, p. 8390), которые тесно связаны со стрессом и проявляют расстройство ГТА-оси или увеличивают уровень кортизола в плазме. В связи с этим в качестве подтверждения наличия связи между 11-HSD1 и метаболическими расстройствами известно повышение активности 11-HSD1 в жировой ткани человека, страдающего ожирением (Rask E. et al., The Journal of Clinical EndocrinologyMetabolism, 2001, Vol. 86, p. 1418-1421), и сообщалось, что активность 11-HSD1 тесно коррелирует с BMI в качестве индекса ожирения, HOMA-IR в качестве индекса резистентности к инсулину, и уровень глюкозы в крови натощак (Lindsay R.S. et al., TheJournal of Clinical EndocrinologyMetabolism, 2003, Vol. 88, p. 2738-2744). Сообщалось также, что сверхэкспрессия 11-HSD1 у трансгенных мышей селективно в жировой ткани показывает увеличение уровня глюкокортикоида в жировой ткани и резистентность к инсулину, висцеральное ожирение, гиперлипидемию и гипертензию (Masuzaki H. et al., Science, 2001, Vol. 294, p. 2166-2170, Masuzaki H. et al., TheJournal of Clinical Investigation, 2003, Vol. 112, p. 83-90) и что мыши с нокаутированным геном 11-HSD1 показывают улучшение толерантности к глюкозе, снижение уровней триглицеридов в крови и повышение уровней HDL-холестерина (Morton N.М. et al., The Journal of Biological Chemistry, 2001, Vol. 276,p. 41293-41300). В связи с этим ожидается, что селективный ингибитор 11-HSD1 подавляет действие глюкокортикоида в ткани путем ингибирования преобразования глюкокортикоида в активный тип и, следовательно,может быть использован для лечения метаболических аномалий, таких как гипергликемия, резистентность к инсулину, ожирение, гиперлипидемия и гипертензия, вызванная глюкокортикоидом. Сообщалось также, что неселективный ингибитор 11-HSD, карбеноксолон, улучшает недостаточную секрецию инсулина, вызванную добавлением неактивного глюкокортикоида к -клэткам поджелудочной железы крыс (Davani В. et al., The Journal of Biological Chemistry, 2000, Vol. 275, p. 34841-34844),таким образом, предполагается, что ингибитор 11-HSD1 имеет возможность ослабления не только резистентности к инсулину, но также и гипергликемии путем содействия секреции инсулина. Кроме того, сообщается, что соединение триазола, обладающее ингибирующим 11-HSD1 действием, является эффективным в модели лигатуры спинального нерва как на животной модели нейропатической боли, так и на животной модели фибромиалгии, вызванной повторным введением резерпина (патентный документ 1), таким образом, предполагается, что ингибитор 11-HSD1 является эффективным для лечения боли, в частности нейропатической боли и фибромиалгии. Примеры других заболеваний, связанных с 11-HSD1, включают остеопороз (Cooper M.S. et al.,Bone, 2000, Vol. 27, p, 375-381) и глаукому (Rauz S. et al., Investigative OpthalmologyVisual Science,2001, Vol. 42, p. 2037-2042), и ожидается, что ингибитор 11-HSD1 будет эффективным для ослаблений указанных заболеваний. В патентном документе 2 описано, что соединение, представленное следующей формулой (А), обладает ингибирующим 11-HSD1 действием и может быть использовано для лечения заболеваний, таких как диабетические заболевания и метаболический синдром. Однако в соединении группа, соответствующая амидной группе соединения по настоящему изобретению, представляет собой циклический амид.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 3 описано, что соединение, представленное следующей формулой (В), обладает действием по регулированию гидроксистероидных дегидрогеназ, таких как 11-HSD1, и может быть использовано для лечения большого числа заболеваний, включая диабет, метаболический синдром и деменцию. Однако указанное соединение не включает кольцо, соответствующее кольцу А соединения по настоящему изобретению.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 4 описано, что соединение, представленное следующей формулой (С), обладает ингибирующим действием в отношении 11-HSD1, 11-HSD2, 17-HSD3 и т.п. и может быть использовано для лечения большого числа заболеваний, включая диабет, метаболический синдром и деменцию. Однако данное соединение не включает кольцо, соответствующее кольцу А соединения по настоящему изобретению.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 5 описано, что соединение, представленное следующей формулой (D), обладает действием по регулированию рецептора TRPV1 и может быть использовано для лечения боли. Однако в данном документе не описано ингибирующее 11-HSD1 действие и возможность использования соединения для лечения деменции.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 6 описано, что соединение, представленное следующей формулой (Е), обладает действием по регулированию рецептора гистамина H3 и может быть использовано для лечения большого числа заболеваний, включая ожирение, диабет, и болезнь Альцгеймера.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 7 описано, что соединение, представленное следующей формулой (F), обладает действием по регулированию стеароил-СоА десатуразы и может быть использовано для лечения гиперлипидемии, болезней системы кровообращения, диабета, ожирения, метаболического синдрома и т.п. Однако в документе не раскрывается сведений об ингибирующем 11-HSD1 действии и возможность использования соединения для лечения деменции.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 8 описано, что соединение, представленное следующей формулой (G), обладает действием по регулированию рецептора С 5 А и может быть использовано для лечения различных воспалительных заболеваний и иммунологических заболеваний. Однако в документе не описано ингибирующее 11-HSD1 действие.(см. соответствующий патентный бюллетень для описания символов в формуле). В патентном документе 9 описано, что соединение, представленное следующей формулой (Н), обладает антибактериальной активностью и может быть использовано для лечения инфекции. Однако в документе не описано ингибирующее 11-HSD1 действие и возможность использования соединения для лечения деменции.(см. соответствующий патентный бюллетень для описания символов в формуле). Уровень техники Патентные документы. Патентный документ 1: Международная публикация WO 2012/033070. Патентный документ 2: Международная публикация WO 2007/124254. Патентный документ 3: Международная публикация WO 2007/145834. Патентный документ 4: Международная публикация WO 2008/088540. Патентный документ 5: Международная публикация WO 2007/069773. Патентный документ 6: Международная публикация WO 01/068652. Патентный документ 7: Международная публикация WO 2007/050124. Патентный документ 8: Международная публикация WO 03/082826. Патентный документ 9: Международная публикация WO 2006/105289. Описание изобретения Техническая задача Задачи, решаемые изобретением Настоящее изобретение относится к новому соединению, которое может быть использовано в качестве активного ингредиента фармацевтической композиции, например фармацевтической композиции для лечения заболеваний, связанных с 11-гидроксистероидной дегидрогеназой 1 типа, таких как деменция (в частности, деменция альцгеймеровского типа) и боль (в частности, нейропатическая боль или фибромиалгия). Средства для решения задач Авторы настоящего изобретения провели тщательные исследования в отношении соединения, обладающего ингибирующим 11-HSD1 действием, что позволяет ожидать улучшение состояния при деменции (в частности, деменции альцгеймеровского типа) и боли (в частности, нейропатической боли или фибромиалгии). В результате было обнаружено, что бициклическое гетероциклическое соединение (бициклический гетероцикл образуется, когда циклогексановое кольцо конденсировано с 5-членным моноциклическим гетероциклом, содержащим только атом азота в виде гетероатома), замещенное ациламиногруппой, такой как (гетеро)ароиламиногруппа, или его фармацевтически приемлемая соль обладает превосходным селективным ингибирующим действием в отношении 11-HSD1, что позволило создать настоящее изобретение. Таким образом, настоящее изобретение относится к соединению формулы (I) или его соли и фармацевтической композиции, содержащей соединение формулы (I) или его соль и вспомогательное вещество. где бициклическое кольцо, которое образовано кольцом А, конденсированным с соседним кольцом,представляет собой 4,5,6,7-тетрагидроиндазол-5-ил;R3 представляет собой фенил, индолил или индазолил, которые могут быть, соответственно, замещены группой, выбранной из группы Q; группа Q представляет собой группу, состоящую из галогена, C1-6 алкила, галоген-C1-6 алкила, -OR0,C1-6 алкилен-OR0, -S-C1-6 алкила, C6-14 арила, 3-15-членной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из кислорода, серы и азота, и C1-6 алкилен 3-15-членной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из кислорода, серы и азота (где C6-14 арил и 3-15-членная гетероциклическая группа, содержащая 1-4 гетероатома, выбранных из кислорода, серы и азота, в группе Q может быть замещена галогеном, циано, C1-6 алкилом, -OR0 или оксо); иR0 представляет собой -Н или C1-6 алкил. Кроме того, настоящее изобретение относится к фармацевтической композиции, которая содержит соединение формулы (I), выбранное из группы, состоящей изN-циклопропил-4-изопропокси-2-метокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамида,или его соль,и предназначена для профилактики или лечения деменции (в частности, деменции альцгеймеровского типа) или боли (в частности, нейропатической боли или фибромиалгии). Кроме того, настоящее изобретение относится к фармацевтической композиции, ингибирующей 11-гидроксистероидную дегидрогеназу 1 типа, которая содержит указанное выше соединение формулы(I) или его соль и фармацевтически приемлемый носитель. Более того, настоящее изобретение относится к применению перечисленного выше соединения формулы (I) или его соли при получении агента, ингибирующего 11-гидроксистероидную дегидрогеназу 1 типа, или средства для профилактики или лечения деменции (в частности, деменции альцгеймеровского типа) или боли (в частности, нейропатической боли или фибромиалгии); применению указанного соединения формулы (I) или его соли для профилактики или лечения деменции или боли и способу профилактики или лечения деменции или боли, который включает введение эффективного количества указанного соединения формулы (I) или его соли субъекту. Кроме того, "субъект" относится к человеку или другим животным, которым требуется профилактика или лечение указанных выше заболеваний. В качестве другого варианта осуществления изобретения "субъект" относится к человеку, которому требуется профилактика или лечение вышеуказанных заболеваний. Таким образом, настоящее изобретение относится к:(1) фармацевтической композиции, содержащей соединение формулы (I), выбранное из группы, состоящей изN-циклопропил-4-изопропокси-2-метокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамида, или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель;(2) фармацевтической композиции в соответствии с (1), которая представляет собой ингибитор 11-гидроксистероидной дегидрогеназы 1 типа;(3) фармацевтической композиции в соответствии с (1), которая представляет собой средство для профилактики или лечения деменции или боли;(4) фармацевтической композиции в соответствии с (1) для профилактики или лечения деменции;(5) фармацевтической композиции в соответствии с (1) для профилактики или лечения боли;(6) применению соединения формулы (I) в соответствии с (1) или его фармацевтически приемлемой соли при получении агента, ингибирующего 11-гидроксистероидную дегидрогеназу 1 типа или средства для профилактики или лечения деменции или боли;(7) применению соединения формулы (I) в соответствии с (1) или его фармацевтически приемлемой соли для профилактики или лечения деменции или боли;(8) соединению формулы (I) в соответствии с (1) или его фармацевтически приемлемой соли для профилактики или лечения деменции или боли;(9) способу профилактики или лечения деменции или боли, включающий введение эффективного количества соединения формулы (I) в соответствии с (1) или его соли пациенту. Эффекты изобретения Соединение формулы (I) или его соль обладают ингибирующим 11-HSD1 действием и могут быть использованы в качестве средства для профилактики и/или лечения деменции (в частности, деменции альцгеймеровского типа) или боли (в частности, нейропатической боли или фибромиалгии). Варианты осуществления изобретения Здесь и далее настоящее изобретение подробно описано в деталях. В настоящем описании " алкил" относится к линейному или разветвленному алкилу, имеющему от 1 до 6 атомов углерода (здесь и далее сокращенно C1-6), например метилу, этилу, н-пропилу, изопропилу,н-бутилу, изобутилу, втор-бутилу, трет-бутилу, н-пентилу, н-гексилу или т.п. В качестве другого варианта осуществления изобретения алкил представляет собой C1-4 алкил, и согласно еще одному варианту осуществления изобретения алкил представляет собой метил, этил, н-пропил или изопропил."Алкилен" относится к линейному или разветвленному С 1-6 алкилену, например метилену, этилену,триметилену, тетраметилену, пентаметилену, гексаметилену, пропилену, метилметилену, этилэтилену,1,2-диметилэтилену, 1,1,2,2-тетраметилэтилену или т.п. В качестве другого варианта осуществления изобретения алкилен представляет собой C1-4 алкилен, и согласно еще одному варианту осуществления изобретения алкилен представляет собой метилен, этилен или триметилен."Галоген-C1-6 алкил" относится к C1-6 алкилу, замещенному одним или несколькими атомами галогена. В качестве другого варианта осуществления изобретения галоген-C1-6 алкил представляет собойC1-6 алкил, замещенный от 1 до 5 атомами галогена, и согласно еще одному варианту осуществления изобретения галоген-C1-6 алкил представляет собой фторметил, дифторметил, трифторметил, 2-фторэтил,-5 024846"Циклоалкил" относится к насыщенной С 3-10 углеводородной кольцевой группе, которая может иметь мостик. Циклоалкил представляет собой, например, циклопропил,ьциклобутил, циклопентил, циклогексил, циклогептил, циклооктил, адамантил или т.п. В качестве другого варианта осуществления изобретения циклоалкил представляет собой С 3-8 циклоалкил, и согласно еще одному варианту осуществления изобретения циклоалкил представляет собой циклопропил, циклобутил, циклопентил или циклогексил."Арил" относится к моно- - трициклической С 6-14 ароматической углеводородной кольцевой группе,например, фенилу, нафтилу, 5-тетрагидронафтилу, б-тетрагидронафтилу, 4-инденилу, 1-флуоренилу или т.п. В качестве другого варианта осуществления изобретения арил представляет собой фенил или нафтил, и согласно еще одному варианту осуществления изобретения арил представляет собой фенил."Гетероцикл" относится к 3-15-членной или в качестве другого варианта осуществления изобретения 5-10-членной моно-трициклической гетероциклической группе, содержащей от 1 до 4 гетероатомов,выбранных из кислорода, серы и азота. Гетероцикл включает насыщенные кольцевые, ароматические кольцевые и циклические группы, образованные, когда указанные кольца являются частично гидрированными. Сера или азот в виде атома кольца могут быть окислены с образованием оксида или диоксида. Гетероцикл представляет собой, в частности, пиридил, пирролил, пиразинил, пиримидинил, пиридазинил, имидазолил, триазолил, триазинил, тетразолил, тиазолил, пиразолил, изотиазолил, оксазолил,изоксазолил, тиадиазолил, оксадиазолил, тиенил, фурил, индолил, изоиндолил, бензимидазолил, индазолил, хинолил, изохинолил, хиназолинил, хикоксалинил, нафтилидил, циннолинил, фталазинил, бензотиазолил, бензизотиазолил, бензотиадиазолил, бензоксазолил, бензизоксазолил, бензофуранил, бензотиенил,карбазолил, дибензо[b,d]фуранил, дибензо[b,d]тиенил, азетидинил, пирролидинил, пиперидил, пиперазинил, азепанил, диазепанил, морфолинил, тиоморфолинил, тетрагидропиридинил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксоланил, диоксанил, тетрагидротиопиранил, индолинил, тетрагидрохинолил, тетрагидроизохинолил, дигидробензимидазолил, тетрагидробензимидазолил, тетрагидроиндазолил, тетрагидрохиноксалинил, тетрагидроциннолинил, дигидрохиноксалинил, дигидробензоксазолил,дигидробензоксазинил, дигидробензофурил, 1,3-бензодиоксолил, хроманил, хроменил, метилендиоксифенил, этилендиоксифенил, динуклидинил или т.п. В качестве другого варианта осуществления изобретения гетероцикл представляет собой 5-10-членную моно- или бициклическую гетероциклическую группу, и согласно еще одному варианту осуществления изобретения гетероцикл представляет собой пиридил, тиазолил, тиенил, фурил, индолил, бензотиенил, индазолил, пирролидинил, морфолинил, оксетанил или тетрагидропиранил."Гетероарил" относится, помимо к вышеуказанным "гетероциклам", к 5-15-членной или в качестве другого варианта осуществления изобретения 5-10-членной от моно- до трициклической ароматической гетероциклической группе, содержащей от 1 до 4 гетероатомов, выбранных из кислорода, серы и азота. Сера или азот в виде атома кольца могут быть окислены с образованием оксида или диоксида. Гетероарил, в частности, представляет собой пиридил, пирролил, пиразинил, пиримидинил, пиридазинил, имидазолил, триазолил, триазинил, тетразолил, тиазолил, пиразолил, изотиазолил, оксазолил, изоксазолил, тиадиазолил, оксадиазолил, тиенил, фурил, индолил, изоиндолил, бензимидазолил, индазолил,хинолил, изохинолил, хиназолил, хиноксалинил, нафтилидил, циннолинил, фталазинил, бензотиазолил,бензизотиазолил, бензотиадиазолил, бензоксазолил, бензизоксазолил, бензофуранил, бензотиенил, карбазолил, бензо[b,d]фурацил, бензо[b,d]тиенил или т.п. В качестве другого варианта осуществления изобретения гетероарил представляет собой 5-10-членный моно- или бициклический гетероарил, и согласно еще одному варианту осуществления изобретения гетероарил представляет собой 5-6-членный моноциклический гетероарил. В качестве другого варианта осуществления изобретения гетероарил представляет собой пиридил, тиазолил, тиенил, фурил, индолил, бензотиенил или индазолил."5-6-членный моноциклический гетероцикл, содержащий только атом азота в виде гетероатома",относится не только к вышеуказанным "гетероциклам", но также и к 5-6-членной моноциклической гетероциклической группе, содержащей только 1-3 атома азота в качестве гетероатомов и включающей насыщенное кольцо, ароматическое кольцо и циклические группы, образованные, когда указанные кольца частично гидрированы. Азот в виде кольцевого атома может быть окислен с образованием оксида. Моноциклический гетероцикл, в частности, представляет собой пирролил, пиразолил, имидазолил, триазолил, пиридил, пиридазинил, пиримидинил, пиразинил или триазинил. В качестве другого варианта осуществления изобретения моноциклический гетероцикл представляет собой пиразолил, пиридазинил или пиримидинил. В настоящем описании слова "может быть замещен" означают, что группа является незамещенной или содержит от 1 до 5 заместителей. Кроме того, слово "замещенный" обозначает, что группа содержит от 1 до 5 заместителей. Когда группа содержит множество заместителей, указанные заместители могут быть одними и теми же или отличаться друг от друга. Примеры заместителя в "ариле" или "гетероариле", которые могут быть соответственно замещенными в R3, включают группу, выбранную из следующей группы Q.-6 024846 Группа Q представляет собой группу, состоящую из галогена, C1-6 алкила, галоген C1-6 алкила, -OR0,C1-6 алкилен-OR0, -S-C1-6 алкила, C6-14 арила, 3-5-членной гетероциклической группы, содержащей 1-4 гетероатома, выбранных из кислорода, серы и азота, и C1-6 алкилен-3-5-членной гетероциклической группы,содержащей; 1-4 гетероатома, выбранных из кислорода, серы и азота. В данном документе C6-14 арил и 3-5-членная гетероциклическая группа, содержащая 1-4 гетероатомов, выбранных из кислорода, серы и азота в группе Q, может быть замещена галогеном, циано,C1-6 алкилом, -OR0 или оксо. Примеры еще одного варианта заместителя в "ариле или "гетероариле", которые могут быть соответственно замещены в R3, включают группу, выбранную из (i) фенила или пиридила, которые могут быть соответственно замещены галогеном или циано, (ii) галогена, (iii) C1-6 алкила и (iv) -O-C1-6 алкила. Варианты осуществления соединения по настоящему изобретению, представленного формулой (I),представлены далее.(3) Соединение, в котором R3 представляет собой фенил, индолил или индазолил, которые могут быть соответственно замещены группой, выбранной из группы Q, в качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой фенил, который может быть замещен группой, выбранной из (i) фенила или пиридила, которые могут быть соответственно замещены галогеном или циано, (ii) галогена, (iii) C1-6 алкила и (iv) -O-C1-6 алкила; согласно еще одному варианту осуществления изобретения соединение, в котором R3 представляет собой фенил, который может быть замещен фенилом, замещенным галогеном или циано, и может быть далее замещен галогеном; в качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой фенил, который может быть замещен фенилом, замещенным галогеном или циано в 4-м положении, и может быть далее замещен галогеном; и в качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой фенил, который может быть замещен 2-цианофенилом, который может быть замещен галогеном в 4-м положении, и может быть далее замещен галогеном.(4) В качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой фенил, замешенный C1-6 алкилом или -О-C1-6 алкилом; и в качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой фенил, замещенный -O-C1-6 алкилом.(5) В качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой индолил, который может быть замещен C1-6 алкилом или -O-C1-6 алкилом; и в качестве другого варианта осуществления изобретения соединение, в котором R3 представляет собой индол-4-ил, который может быть замещен C1-6 алкилом. или -O-C1-6 алкилом.(6) Соединение, которое представляет собой комбинацию двух или нескольких групп в соответствии с вышеуказанными вариантами осуществления изобретения (1)-(5). В качестве конкретных вариантов осуществления комбинации двух или нескольких групп в соответствии с вышеуказанными вариантами осуществления изобретения от (1) до (5) вариант осуществления (6) показан в следующих примерах (а)-(f).(c) Соединение в соответствии с (b), в котором R3 представляет собой фенил, индолил или индазолил, которые могут быть соответственно замещены группой, выбранной из группы Q.(d) Соединение в соответствии с (с), в котором R3 представляет собой фенил, который может быть замещен группой, выбранной из группы, включающей (i) фенил или пиридил, которые могут быть соответственно замещены галогеном или циано, (ii) галоген, (iii) C1-6 алкил и (iv) -O-C1-6 алкил.(е) Соединение в соответствии с (с), в котором R3 представляет собой индолил, который может быть замещен C1-6 алкилом или -O-C1-6 алкилом. Примеры конкретных соединений, охватываемых настоящим изобретением, включают следующие соединения. Соединение, выбранное из группы, включающейN-циклопропил-4-изопропокси-2-метокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамид Соединение формулы (I) может иметь таутомеры или геометрические изомеры, в зависимости от типа заместителя. В настоящем описании соединение формулы (I) в некоторых случаях описано только в одной форме изомера. Однако настоящее изобретение включает другие изомеры, разделенные изомеры или их смесь. Например, 4,5,6,7-тетрагидроиндазол-5-ил в настоящем изобретении описан в виде таутомера одного из следующих (A) и (В), но таутомеры обоих (А) и (В) также включены в настоящее изобретение.( представляет собой точку присоединения) Кроме того, в некоторых случаях соединение формулы (I) имеет асимметричные атомы углерода или хиральную ось и поэтому может быть представлено в виде оптического изомера. Настоящее изобретение включает отдельные оптические изомеры соединения формулы (I) или их смесь. Соль соединения формулы (I) относится к фармацевтически приемлемой соли соединения формулы(I) и представляет собой соль добавления кислоты или соль добавления основания, в зависимости от типа заместителя. Конкретные примеры солей включают соли добавления кислот с неорганической кислотой,такой как хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородной кислота,серная кислота, азотная кислота или фосфорная кислота, или с органической кислотой, такой как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота,миндальная кислота, винная кислота, дибензоилвинная, дитолуоилвинная, лимонная кислота,метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, аспарагиновая кислота или глутаминовая кислота, соли с неорганическим основанием, такие как соли натрия, калия, магния, кальция или алюминия, или с органическим основанием, таким как метиламин,этиламин,этаноламин, лизин или орнитин, соли с различными аминокислотами и аминокислотными производными, такими как ацетиллейцин, соли аммония и т.п. Способ получения. Соединение формулы (I) или его соль может быть получено путем применения различных известных способов синтеза, используя характерные особенности, обусловленные их основной структурой или видом заместителей. В то же время, в зависимости от типа функциональной группы, в некоторых случаях может быть эффективным предварительная замена функциональной группы на соответствующую защитную группу (группа, которая может быть легко преобразована в функциональную группу) в течение периода от стадии исходного продукта до стадии промежуточного соединения. Примеры защитной группы включают защитные группы, описанные в книге Wuts (P.G.M. Wuts) и Greene (T.W. Greene), "Greene'sProtective Groups in Organic Synthesis (4th edition, 2006)" и т.п. Защитная группа может быть использована,будучи соответствующим образом выбранной в соответствии с реакционными условиями. В этом методе защитная группа вводится, чтобы провести реакцию, и затем защитная группа может быть необязательно удалена, в результате чего может быть получено желаемое соединение. Здесь и далее будут описаны типичные способы получения соединения формулы (I). Каждый способ получения может быть осуществлен со ссылкой на ссылочный документ, включенный в соответствующее описание. Более того, способ получения по настоящему изобретению не ограничивается следующими примерами. Способ получения 1. Соединение (I) по настоящему изобретению может быть получено путем реакции амидирования между соединением (1) и соединением (2). В данной реакции соединения (1) и (2) используются в равном количестве или одно соединение используется в избыточном количестве по сравнению с другим. Смесь указанных соединений обычно перемешивают в течение от 0,1 ч до 5 дней при температурном режиме от охлаждения до нагревания,предпочтительно при температуре от -20 до 60C, в растворителе, инертном по отношению к реакции, в присутствии конденсирующего агента. Хотя это специально не ограничивается, примеры растворителя,-8 024846 используемого в данном документе, включают ароматические углеводороды, такие как бензол, толуол и ксилол, галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан и хлороформ, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран (ТТФ), диоксан и диметоксиэтан,N,N-диметилформамид (ДМФ), диметилсульфоксид (ДМСО), этилацетат, ацетонитрил, воду и смеси указанных веществ. Примеры конденсирующего агента включают 1-(3-диметиламинопропил)-3 этилкарбодиимид, дициклогексилкарбодиимид, 1,1'-карбонилдиимидазол, азид дифенилфосфата и оксихлорид фосфора и гексафторфосфатN-[(диметиламино)(3 Н-[1,2,3]триазо[4,5-b]пиридин-3 илокси)метилиден]-N-метилметанаминия (HATU), но настоящее изобретение не ограничивается указанными агентами. Для осуществления реакции в некоторых случаях является предпочтительным использование добавки (например, 1-гидроксибензотриазола). Удобным является проведение реакции в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин илиN-метилморфолин, или неорганического основания, такого как карбонат калия, карбонат натрия или гидроксид калия, с точки зрения возможности осуществления мягкого проведения реакции. Кроме того, возможно также использование способа по преобразованию карбоновой кислоты (1) в реакционноспособное производное и далее взаимодействие его с амином (2). Примеры реакционноспособного производного карбоновой кислоты включают галогенангидриды кислот, образующиеся при взаимодействии карбоновой кислоты с галогенирующим агентом, таким как оксихлорид фосфора или тионил хлорид, смешанные ангидриды кислот, образующиеся при взаимодействии карбоновой кислоты с изобутилхлорформиатом или т.п., и реакционноактивные сложные эфиры, образующиеся при конденсации карбоновой кислоты с 1-гидроксибензотриазолом или т.п. Реакция между этими реакционноспособными производными и соединением (2) может быть проведена в растворителе, инертном по отношению к реакции, таком как галогенированные углеводороды, ароматические углеводороды или простые эфиры,в условиях от охлаждения до нагревания, предпочтительно при температуре от -20 до 60C. Более того, если кольцо А представляет собой пиразол, то в некоторых случаях эффективным для осуществления реакции с использованием соединения может являться (2) введение защитной группы,такой как этоксикарбонилокси, трет-бутоксикарбонил, бензилоксикарбонил или бензилоксиметил, и последующее удаление защиты для получения соединения (I) по настоящему изобретению. В качестве реакции по удалению защитных групп может быть использован, например, способ, описанный в книге Соединение (I-а) по настоящему изобретению может быть получено путем взаимодействия соединения (3) с соединением (4) и последующего осуществления реакции циклизации между продуктом и гидразином. Взаимодействие между соединением (3) и соединением (4) может быть осуществлено в присутствии основания, такого как триэтиламин, путем использования соединения (3) и соединения (4) в равном количестве или использования одного соединения в избыточном количестве по сравнению с другим, без применения растворителя или в растворителе, инертном по отношению к реакции, при нагревании. Выбор растворителя никак не ограничивается в тех рамках, пока растворитель остается инертным по отношению к реакции, но могут быть использованы, например, простые эфиры, ароматические углеводороды и т.п. Реакция циклизации между продуктом, полученным при взаимодействии между соединением (3),соединением (4) и гидразином, может быть осуществлена без применения растворителя или в растворителе, инертном по отношению к реакции, при нагревании. Выбор растворителя никак не ограничивается в тех рамках, пока растворитель остается инертным по отношению к реакции, но могут быть использованы, например, простые эфиры, ароматические углеводороды, спирты, такие как метанол и этанол, вода и т.п. Кроме того, некоторые соединения, представленные формулой (I), также могут быть получены, исходя из соединения по настоящему изобретению, полученного способом, описанным выше, произвольно комбинируя стадии, как это может осуществить специалист в данной области, такие как ацилирование,реакция замещения, окисление, восстановление, гидролиз и амидирование. Исходные продукты, используемые для получения соединения по настоящему изобретению, могут быть получены, например, следующим способом, способом, описанным в препаративном примере далее,известными способами или способами, которые ясны специалисту в данной области, или путем применения их модифицированных методов. Синтез исходных продуктов 1. Соединение (2) может быть получено путем реакции восстановительного аминирования между соединением (5) и соединением (6). В данной реакции соединение (5) и соединение (6) используются в равном количестве или одно из указанных соединений используется в избыточном количестве по сравнению с другим. Смеси указанных веществ обычно перемешивают в течение от 0,1 ч до 5 дней при температуре -45C при нагревании до кипения с обратным холодильником, предпочтительно при температуре от 0C до комнатной температуры в растворителе, инертном по отношению к реакции, в присутствии восстановителя. Хотя это специально не ограничивается, примеры растворителя, используемого в данном документе, включают спирты,такие как метанол и этанол, простые эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан и диметоксиэтан, и смеси указанных веществ. Примеры восстановителя включают цианоборгидрид натрия,триацетоксиборгидрид натрия, боргидрид натрия и т.п. Предпочтительным является проведение реакции в присутствии дегидратирующего агента, такого как молекулярные сита или кислота, такая как уксусная кислота, хлористо-водородная кислота или в некоторых случаях комплекса титаний(IV) изопропоксид. В зависимости от реакции имин получают путем конденсации соединений (5) и (6), и в некоторых случаях он может быть выделен в виде стабильного промежуточного соединения. В этом случае соединение (2) может быть получено путем восстановительной реакции имина промежуточного соединения. Кроме того, вместо обработки соединения восстановителем реакцию можно осуществить в растворителе, таком как метанол, этанол или этилацетат, в присутствии или в отсутствие кислоты, такой как уксусная кислота или хлористо-водородная кислота, путем использования катализатора восстановления (например, палладия на углероде или никеля Ренея). В этом случае предпочтительным является проведение реакции в атмосфере водорода при давлении от нормального до 50 атм, при температурном режиме от охлаждения до нагревания. Синтез исходных продуктов 2. Соединение (3) может быть получено путем синтеза соединения (8) реакцией амидирования между соединением (1) и соединением (7) и последующим удалением защитных групп у производного кеталя,соединения (8). Реакция амидирования может быть осуществлена таким же образом, как и в способе получения 1. Для удаления защитных групп у кеталя может быть использован способ, описанный Wuts(P.G.M. Wuts) и Greene (Т.W. Greene) в книге "Greene's Protective Groups in Organic Synthesis (4th edition,2006)". Соединение формулы (I) выделяют в виде свободного соединения, его соли, гидрата, сольвата или полиморфного вещества и очищают. Соль соединения формулы (I) может быть получена путем реакции получения солей с использованием общеизвестного способа. Выделение и очистку выполняют с применением общих химических операций, таких как экстракция, фракционная кристаллизация и различные типы фракционной хроматографии. Различные изомеры могут быть получены путем подбора соответствующих исходных соединений или могут быть разделены с использованием различий в физико-химических характеристиках между изомерами. Например, оптический изомер может быть получен путем обычного оптического разделения(например, фракционной кристаллизацией с получением диастереомерной соли с оптически активным основанием или кислотой либо путем хроматографии с использованием хиральной колонки) рацемической смеси или может быть получен из соответствующего оптически активного исходного соединения. Фармакологическая активность соединения формулы (I) была подтверждена с помощью следующего исследования. Метод исследования 1. Исследование по определению ингибирующей активности 11-HSD1/11-HSD2 у человека Ингибирующую 11-HSD1 активность определяли в следующем порядке. При этом ферментную реакцию и анализ осуществляли с использованием 384-луночного планшета. Фермент был получен в соответствии с литературным источником (Walker E.A. et al., Journal of Biological Chemistry, 2001,Vol. 276, p. 21343-21350). Реакционную смесь обрабатывали таким методом, по которому различные концентрации исследуемого соединения добавляли в реакционную жидкость, содержащую 10 мМ буфер с фосфорной кислотой (рН 6,6), 200 нМ кортизон, 40 мкМ восстановленный никотинамидадениндинуклеотидфосфат (NADPH) и рекомбинантный человеческий 11-HSD1, затем инкубировали в течение 1 ч при комнатной температуре (10 мкл/лунку). Исследуемое соединение растворяли в диметилсульфоксиде(ДМСО) и концентрацию ДМСО устанавливали таким образом, чтобы она составляла 1% в реакционной жидкости. После ферментной реакции определяли кортизол с использованием гомогенной флуоресценции с временным разрешением (HTRF) для измерения ингибирующей фермент активности. Добавляли меченный XL-665 кортизол, содержащий 400 мкМ карбеноксолон и антитело к меченному криптатом кортизолу (CIS biointernational) соответственно на планшет по 5 мкл/лунка, затем инкубировали в течение 2 ч при комнатной температуре и далее определяли интенсивность флуоресценции с использованием флуороспектрометра (торговое название: Discovery, производство PerkinElraer Inc.), рассчитывая, таким образом, ингибирующую активность по соотношению интенсивности флуоресценции между двумя длинами волн (665 нМ/620 нМ). Ингибирующую 11-HSD2 активность определяли таким же образом, как и при измерении ингибирующей 11-HSD1 активности, за исключением условий ферментной реакции. Ферментную реакцию осуществляли таким методом, при котором различные концентрации исследуемых веществ добавляли в реакционную жидкость, содержащую 40 мМ трис-соляно-кислотный буфер (Трис-HCl) (рН 8,0), 200 нМ кортизола, 200 мкМ никотинамидадениндинуклеотида (NAD) и рекомбинантную человеческую 11-HSD2, затем инкубировали в течение 2 ч при температуре 37C (10 мкл/лунка). Результаты измерений были обсчитаны путем получения среднего из значений для трех лунок в одних и тех же условиях. Соотношение, полученное когда вместо исследуемого соединения добавляли ДМСО, рассматривали как 0%, и соотношение, полученное когда 11-HSD1 или 11-HSD2 не добавляли,рассматривали как составляющее 100%, в результате чего концентрация, при которой исследуемое соединение подавляет активность фермента на 50%, была рассчитана как IC50 ингибирующей активности соединения. Значения IC50 типичных соединений по настоящему изобретению показаны в табл. 1. При этом Прим. обозначает номер примера. Согласно представленным выше результатам было подтверждено, что некоторые соединения по настоящему изобретению проявляют сильную ингибирующую активность по отношению к 11-HSD1, и ингибирующая 11-HSD1 активность является селективной по сравнению с 11-HSD2. Метод исследования 2. Тест на спонтанное беспорядочное нарушение поведения, индуцированное скополамином. Исследуемые лекарственные средства вводили перорально самцам мышей ddY возраста 5-7-недель. 10 мин спустя животным внутрибрюшинно вводили скополамин при 0,5 мг/кг. Через 20 мин животное помещали в Y-лабиринт, имеющий рукава одной и той же длины и проходящий в трех направлениях, и оставляли их свободно исследовать в течение 8 мин. Во время разведки подсчитывали спонтанное поведение чередования рукавов (вводя разные перемычки 3 раза подряд) для расчета скорости спонтанного чередования (поведение спонтанное чередование/(число раз из поступающего-2)100), тем самым оценивая эффективность препарата. Результаты для типичных соединений по настоящему изобретению показаны в табл. 2. Таблица 2 В соответствии с приведенными выше результатами было подтверждено, что некоторые соединения по настоящему изобретению являются эффективными для лечения деменции. Метод исследования 3. Исследование на модели лигатуры спинального нерва. Данное исследование осуществляли в соответствии с Pain, 1992, Vol. 50, р. 355-363. Кожу и мышцы в области поясницы крыс (SD, самцы, 5-6-недельного возраста) вырезали под анестезией с применением пентобарбитала и поясничный поперечный отросток L6 удаляли для экспозиции поясничных нервов. Спинальные нервы L5 и L6 сшивали шелковой нитью, и затем рану зашивали. Процедуру осуществляли с левой стороны. Кроме того, в случае псевдооперации раны зашивали без выполнения лигирования нервов. Эффективность лекарственного средства оценивали в послеоперационные дни 7-12 с помощью исследования с нитями фон Фрея. Пороговую величину реакции определяли в соответствии с методом,описанным в Journal of Neuroscience Methods, 1994, Vol. 53, p. 55-63. Путем использования 8 типов нитей фон Фрея (от 0,41 до 15,14 г) подошву лап задней конечности крысы стимулировали и определяли 50% реакцию отдергивания методом "вверх и вниз". Исследование начинали при давлении нитей, составляющем 2,04 г, и, когда реакцию одергивания конечностей подтверждали, это рассматривали как "ответ". За день до оценки эффективности лекарственных средств животные, показывающие уменьшение пороговой величины с помощью исследования с нитями фон Фрея, были выбраны заранее, и животных распределяли на группы таким образом, чтобы разница средней величины предельного значения между соответствующими группами была сокращенной. Исследуемое вещество суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально за 1 ч до оценки эффективности препарата. Исследуемое вещество оценивали путем вычисления показателя улучшения в группе, обработанной исследуемым веществом, при условии, что предельное значение для конечности, которую подвергали процедуре, в группе псевдооперированных животных, принимали за 100%, а предельное значение для конечности, которую подвергали процедуре, в группе оперированных животных, обработанных растворителем, принимали за 0%. Результаты для типичных соединений по настоящему изобретению показаны в табл. 3. Таблица 3 В соответствии с приведенными выше результатами было подтверждено, что некоторые соединения по настоящему изобретению могут быть использованы для лечения нейропатической боли. Метод исследования 4. Исследование на модели с фибромиалгией, вызванной повторным введением резерпина. Это исследование осуществляли в соответствии с Pain, 2009, Vol. 146, p. 26-33 путем использования крыс (SD, самцы, 7-недельного возраста). Предельную величину мышечной чувствительности определяли в соответствии с методом Schaferset al. (Pain, 2003, Vol. 104, p. 579-588). Стимулирующее давление, медленно повышаемое до 250 г, применяли к икроножной мышце правой задней лапы крысы. Величина минимального стимулирующего давления, при котором крыса демонстрирует реакцию отдергивания в ответ на стимулирующее давление на правую заднюю лапу, определяли в качестве пороговой величины мышечной чувствительности (г). Измерение осуществляли 3 раза для каждого момента времени и среднюю величину принимали в качестве измеренного значения. Растворитель (0,5% водный раствор уксусной кислоты) или резерпин (1 мг/кг) вводили подкожно в заднюю часть крыс один раз в день в течение трех дней. Вводимая доза и растворителя и резерпина составляла 1 мл на 1 кг массы тела животного. Через 6 дней после начала введения растворителя или резерпина определяли пороговую величину мышечной чувствительности каждой крысы и крыс распределяли на группы таким образом, чтобы разница средней величины предельного значения между соответствующими группами была сокращенной. Оценку эффективности препарата осуществляли на следующий день. Исследуемое вещество суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально. Через 30, 60 и 120 мин после введения определяли предельное значение болевой мышечной чувствительности. Здоровым крысам препарат не вводили, а определяли только предельное значение болевой мышечной чувствительности. Эффективность лекарственного средства определял экспериментатор, который не знал, каким образом препарат был введен животным. Исследуемое вещество оценивали путем подсчета показателя улучшения в группе, которой вводили исследуемое вещество, при условии, что предельное значение болевой мышечной чувствительности здоровой крысы, измеренное в любой из моментов времени 30, 60 и 120 мин после введения, принимали за 100%, а предельное значение болевой мышечной чувствительности у резерпин-обработанной крысы, которой вводили растворитель, принимали за 0%. Результаты для типичных соединений по настоящему изобретению показаны в табл. 4. Таблица 4 В соответствии с приведенными выше результатами было подтверждено, что некоторые соединения по настоящему изобретению могут быть использованы для лечения фибромиалгии. Метод исследования 5. Фармакокинетическое исследование. 0,5% суспензию метилцеллюлозы, содержащую исследуемое вещество, вводили перорально самцам мышей в возрасте 5-недель и, спустя некоторое время после введения, отбирали кровь и мозговую ткань. Отобранный образец крови обрабатывали гепарином натрия и затем отделяли плазму, получая, таким образом, образец плазмы. Кроме того, к отобранному образцу ткани мозга добавляли буфер с фосфорной кислотой (рН 7,0) в количестве, которое превышало массу мозговой ткани в 4 раза, получая, таким образом, 20%-ный гомогенат ткани мозга. Концентрации соответствующих исследуемых веществ в плазме и ткани мозга определяли с использованием LC-MS/MS. Спустя 1 ч вводили соединение по примеру 8-1 в дозе 1 мг/кг, концентрация вещества в плазме была 153 нг/мл, и концентрация в ткани мозга была 58 нг/мл. Метод исследования 6. Фармакокинетическое исследование при нагрузке кортизоном. 0,5% раствор метилцеллюлозы или 0,5% суспензию метилцеллюлозы, содержащие исследуемое вещество, вводили перорально самцам мышей ddY в возрасте 5-недель. Через 30 мин внутрибрюшинно вводили кортизон при 1 мг/кг и 20 мин спустя отбирали ткань мозга. К отобранному образцу ткани мозга добавляли буфер с фосфорной кислотой (рН 7,0) в количестве, которое превышало массу мозговой ткани в 9 раз, получая, таким образом, 10%-ный гомогенат ткани мозга. Количество кортизола в гомогенате ткани мозга определяли с помощью ELISA и рассчитывали степень ингибирования в результате действия исследуемого вещества при условии, что количество кортизола, полученное после перорального введения мыши с 0,5%-ной метилцеллюлозой, рассматривалось как 100%. Когда соединение по примеру 8-1 вводили перорально в дозе 1 мг/кг, была получена степень ингибирования 43%. В результате соответствующих исследований, описанных выше, было подтверждено, что соединение по настоящему изобретению обладает ингибирующим 11-HSD1 действием. Данный результат ясно показывает, что соединение по настоящему изобретению может быть использовано в качестве активного ингредиента фармацевтической композиции для профилактики или лечения заболеваний, таких как деменция (в частности, деменция альцгеймеровского типа) и боль (в частности, нейропатическая боль или фибромиалгия). Кроме того, в качестве другого варианта осуществления изобретения соединение по настоящему изобретению может быть использовано в качестве активного ингредиента фармацевтической композиции для профилактики и/или лечения деменции (в частности, деменции альцгеймеровского типа). Согласно еще одному варианту осуществления изобретения соединение по настоящему изобретению может быть использовано в качестве активного ингредиента фармацевтической композиции для предупреждения и/или лечения боли (в частности, нейропатической боли или фибромиалгии). Фармацевтическая композиция, содержащая один, или два, или более видов соединения формулы(I) или его соль в качестве активного ингредиента, может быть получена с использованием наполнителей, широко известных из предшествующего уровня техники, т.е. широко известными методами с использованием наполнителей или носителей для лекарственных средств. Композицию можно вводить в любой форме, например путем перорального введения с использованием таблетки, пилюли, капсулы, гранул, порошка или жидкости и парентерального введения с использованием препарата для инъекций, такого как раствор для внутрисуставной инъекции, внутривенной инъекции и внутримышечной инъекции, суппозиториев, глазных капель, глазной мази, трансдермальной жидкости, мази, трансдермального пластыря, трансмукозальной жидкости, трансмукозального пластыря или ингаляция. В качестве твердой композиции для перорального введения используют таблетки, порошки, гранулы и т.п. В такой твердой композиции один, или два, или более видов активных ингредиентов смешивают по меньшей мере с одним видом инертного наполнителя. Композиция может содержать инертные добавки, например смазку, разрыхлитель, стабилизатор и вспомогательное вещество для растворения, в соответствии с обычными методами. Таблетка или пилюля может необязательно быть покрыта сахаром или пленкой из растворимого в желудке или кишечнике вещества. Жидкая композиция для перорального введения включает фармацевтически приемлемый коллоидный раствор, раствор, суспензию, сироп, эликсир или т.п. и содержит обычно используемый инертный разбавитель, например очищенную воду или этанол. В дополнение к инертному разбавителю, жидкая композиция может содержать вспомогательное вещество, такое как солюбилизатор, увлажнитель или суспензию, подсластитель, корригент вкуса, ароматизатор и консервант. Препарат для инъекций для парентерального введения содержит стерильный водный или неводный раствор, суспензию или коллоидный раствор. Примеры водного раствора включают дистиллированную воду для инъекций и физиологический раствор. Примеры неводного раствора включают спирты, такие как этанол. Эти композиции могут дополнительно содержать вещество, регулирующее тоничность, консервант, увлажнитель, эмульгатор, диспергатор, стабилизатор или солюбилизатор. Их стерилизуют, например, фильтрованием, при котором фильтруют через фильтр, задерживающий бактерии, смешиванием с противомикробным агентом или облучением. Кроме того, они могут быть использованы на стадии получения в виде стерильной твердой композиции, и растворяемой или суспендируемой в стерильной воде или стерильном растворителе для инъекций перед применением. Примеры средств для наружного применения включают мази, пластырь, крем, желе, припарки,спрей, лосьон, глазные капли, глазную мазь и т.п. Средство для наружного применения содержит обычно используемые основы мазей и лосьонов, водную или неводную жидкую композицию, суспензию, эмульсию и т.п. Трансмукозальные средства, такие как средства для ингаляции и средства для введения через нос,используют в твердой, жидкой или полутвердой форме, и они могут быть получены способами, извест- 14024846 ными из предшествующего уровня техники. Например, соответствующим образом могут быть добавлены известный наполнитель, рН регулятор, консервант, поверхностно-активное вещество, смазывающее вещество, стабилизатор, загуститель или т.п. Для введения могут быть использованы соответствующие устройства для ингаляции или инсуффляции. Например, с помощью известного устройства, такого как ингалятор или распылитель с измеренными дозами, соединение можно вводить отдельно или вводить в составе порошкообразной лекарственной композиции или в виде раствора или суспензии, которые представляют собой сочетание соединения с фармацевтически приемлемым носителем. Для однократного или многократного введения могут быть использованы ингалятор для сухого порошка и т.п. и сухой порошок или капсулы, содержащие порошок. Альтернативно, соединение можно вводить в виде аэрозоля под давлением с использованием соответствующего вещества для эжекции, например подходящего газа,такого как хлорфторалкан или диоксид углерода. Обычно в случае перорального введения подходящая суточная доза составляет приблизительно от 0,001 до 100 мг/кг массы тела, предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг, которую вводят один раз или два-четыре раза в виде разделенных доз. В случае внутривенного введения соответствующая суточная доза составляет приблизительно от 0,3001 до 10 мг/кг массы тела,которую вводят один раз или несколько раз в виде разделенных доз. Кроме того, трансмукозальное средство вводят один раз в день или несколько раз в день в виде разделенных доз, в дозе около от 0,001 до 100 мг/кг массы тела. Дозу соответствующим образом определяют в каждом случае с учетом симптомов,возраста, пола и т.д. Фармацевтическая композиция по настоящему изобретению содержит один или несколько типов соединения формулы (I) и его соли в качестве активного ингредиента в количестве от 0,01 до 100 мас.% и от 0,01 до 50 мас.% как вариант осуществления, даже если количество изменяется в зависимости от способа введения, лекарственной формы, места введения и типа наполнителя или добавки. Соединение формулы (I) может быть использовано одновременно с агентом для лечения или предупреждения различных заболеваний, которые считаются заболеваниями, при которых соединение формулы (I) является эффективным. При одновременном использовании соединение и агент могут быть введены одновременно, введены последовательно друг за другом или введены с желаемым промежутком времени. Препарат для одновременного введения может представлять собой комбинационное лекарственное средство или отдельные препараты. Примеры Здесь и далее способ получения соединения формулы (I) описан более подробно, основываясь на примерах, но настоящее изобретение не ограничивается соединением, описанным в следующих примерах. Кроме того, способ получения исходных соединений будет показан в препаративных примерах. Способ получения соединения формулы (I) не ограничивается способами получений конкретных примеров, представленных далее. Соединение формулы (I) также может быть получено путем комбинирования указанных способов получения или с помощью способа, который хорошо известен специалисту в данной области. Кроме того, в примерах, препаративных примерах и таблицах описанных далее, в некоторых случаях будут использованы следующие аббревиатуры. РЕх: номер препаративного примера,Ех: номер примера,Структура: структурная формула (когда имеется множество структурных формул, это обозначает,что соединение представляет собой смесь указанных соединений),Данные: физические данные (EI: EI-MS; ESP+: ESI-MS (Pos); ESN-; ESI-MS (Neg); CI+: CI-MS(Pos); APCI/ESP+: означает одновременное измерение APCI (Pos) и ESI (Pos); ЯМР-ДМСО-d6:(м.д.) характеристического пика 1 Н-ЯМР в ДМСО-d6, ЯМР-CDCl3:(м.д.) характеристического пика 1 Н-ЯМР в CDCl3,[]D: удельное оптическое вращение в D-линии натрия),Внимание: указание (Sal: соль (HCl: гидрохлорид, если эта аббревиатура не указывается для соединения, это обозначает, что соединение не содержит HCl, и цифра, которая стоит перед солью, указывает на соотношение в составе; например, если соединение описано как 2HCl, это обозначает, что соединение представляет собой дигидрохлорид, Хиральный: обозначает, что, хотя соединение описано в виде плоской структуры, поскольку его стерическая структура является неясной, соединение является хиральным),Syn: способ получения (цифра указывает, что соединение было получено с использованием соответствующего исходного продукта таким же образом, как соединение по примеру, имеющее номер, как номер соединения по примеру; когда перед номером имеется Р, это обозначает, что соединение было получено с использованием соответствующего исходного продукта таким же образом, как и соединение по препаративному примеру, имеющему тот же номер, что и номер препаративного примера; когда имеется множество номеров, это показывает, что соединение было получено путем осуществления способов получения в порядке от способа получения, соответствующего предыдущему номеру),- 15024846PSyn: способ получения (это обозначает, что соединение было получено с использованием соответствующего исходного продукта таким же образом, как соединение по препаративному примеру, имеющему такой же номер, как номер препаративного примера; когда имеется множество номеров, это показывает, что соединение было получено путем осуществления способов получения в порядке от способа получения, соответствующего предыдущему номеру. Препаративный пример 1. Гексафторфосфат(2 мл) 4-изопропокси-2-метоксибензойной кислоты (100 мг) и гидрохлорида бензил-5(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (165 мг), затем перемешивали в течение ночи при температуре 60C. После этого в реакционную смесь добавляли воду, осуществляли экстракцию с использованием этилацетата, затем промывали водой и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом магния, получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (от 30 до 100%, этилацетат/гексан), получая, таким образом, бензил-5-[циклопропил(4-изопропокси-2 метоксибензоил)амино]-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (140 мг). Препаративный пример 2. К суспензии 2'-циано-6'-фторбифенил-4-карбоновой кислоты (470 мг) в дихлорметане (9 мл) при температуре 0C добавляли оксалил хлорид (0,167 мл) и одну каплю ДМФ, затем перемешивали в течение 3 ч при комнатной температуре. После этого реакционную жидкость вновь охлаждали до 0C, добавляли диизопропилэтиламин (0,61 мл) и затем добавляли по каплям раствор трет-бутил-5(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (450 мг) в дихлорметане (4,5 мл),потом перемешивали в течение 2 ч при комнатной температуре. В реакционную жидкость добавляли воду, осуществляли экстракцию с использованием этилацетата, затем промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом магния, получая, таким образом, сырой продукт. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле (от 30 до 100%, этилацетат/гексан), получая, таким образом, трет-бутил-5-[(2'-циано-6'-фторбифенил-4-ил)карбонил](циклопропил)амино-4,5,6,7-тетрагидро 2 Н-индазол-2-карбоксилат (700 мг). Препаративный пример 3. К раствору 1-(2-метоксиэтил)-1 Н-индол-4-карбоновой кислоты (125 мг) и 1 Н-1,2,3-бензотриазола(900 мг) в дихлорметане (2 мл) при комнатной температуре добавляли тионил хлорид (890 мг). После перемешивания в течение 2 ч при комнатной температуре нерастворимое вещество удаляли путем фильтрования, затем промывали небольшим количеством толуола. К фильтрату добавляли безводный сульфат магния, затем перемешивали и потом твердое вещество удаляли путем фильтрования и фильтрат концентрировали. Полученный остаток растворяли в дихлорметане (3 мл) и добавляла к раствору трет-бутил-5(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (150 мг) и изопропилэтиламина(150 мг) в дихлорметане (2 мл), затем перемешивали в течение 16 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над безводным сульфатом магния, затем фильтровали и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан:этилацетат=10:0-4:6), получая, таким образом, трет-бутил-5-(циклопропил[1-(2-метоксиэтил)-1 Н-индол-4-ил]карбониламино)4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (34 мг) в виде бесцветного маслянистого вещества. Препаративный пример 4. Водный раствор (3 мл) тетракис-(трифенилфосфин)палладия (115 мг) и карбоната натрия (530 мг) добавляли к раствору 2-бром-3-фторбензонитрила (667 мг) и 4-(метоксикарбонил)фенилбороновой кислоты (600 мг) в диоксане (20 мл), затем перемешивали в течение ночи при температуре 100C в атмосфере аргона, после этого охлаждали до комнатной температуры, разбавляли этилацетатом, промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель упаривали при пониженном давлении. Твердый полученный сырой продукт промывали диизопропиловым эфиром и сушили при пониженном давлении, получая, таким образом, метил-2'-циано-6'-фторбифенил-4 карбоксилат (740 мг). Препаративный пример 5. В атмосфере газообразного аргона трис-(дибензилиденацетон)дипалладий (14 мг) и тетрафторборат три-трет-бутилфосфония (11 мг) добавляли к смеси 2-бром-3-фторбензонитрила (150 мг), пинаколового эфира 4-метоксикарбонил-2-метилфенилбороновой кислоты (259 мг), фторида калия (144 мг), ТГФ(1,8 мл) и воды (0,23 мл), затем перемешивали в течение 14 ч при комнатной температуре. Реакционную жидкость концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-2'-циано-6'-фтор-2 метилбифенил-4-карбоксилат (70 мг). Препаративный пример 6. Смесь 4-бром-3,5-дихлорпиридина (357 мг), 4-метоксикарбонилфенил бороновой кислоты (236 мг),комплекса 1,1'-бис-(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан (107 мг), фторида цезия (398 мг) и 1,2-диметоксиэтана (3,5 мл) перемешивали при нагревании в течение 1 ч при температуре масляной бани 80C в атмосфере газообразного аргона, затем охлаждали до комнатной температуры. Реакционную жидкость концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом,метил-4-(3,5-дихлорпиридин-4-ил)бензоат (298 мг). Препаративный пример 7. трис-(Дибензилиденацетон)дипалладий (24 мг) и 2-дициклогексилфосфино-2',6'-диметоксибифенил(43 мг) добавляли к смеси метил-3,5-диметил-4-[(трифторметил)сульфонил]оксибензоата (409 мг),2-цианофенилбороновой кислоты (385 мг), фосфата трикалия (835 мг) и толуола (2,6 мл) в атмосфере газообразного аргона, затем перемешивали при нагревании в течение 3 ч при температуре масляной бани 110C и охлаждали до комнатной температуры. В реакционную жидкость добавляли воду, затем разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили и далее концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-2'-циано-2,6-диметилбифенил-4-карбоксилат (347 мг). Препаративный пример 8. Диизопропиламид лития (2,0 М раствор в смеси гептан/ТГФ/этилбензол, 5,57 мл) добавляли к раствору 3,5-дифторпиридина (1,26 г) в ТГФ (7,5 мл) в атмосфере газообразного аргона при температуре-78C на бане сухой лед/ацетон, затем перемешивали в течение 0,5 ч и далее добавляли хлорид цинка(1,55 г), затем опять перемешивали в течение 0,5 ч при той же температуре. После повышения температуры до комнатной добавляли этил-4-бромбензоат (0,50 г) в растворе N-метилпирролидин-2-она (NMP)(7,5 мл и тетракис-(трифенилфосфин)палладий (0,50 г), затем перемешивали при нагревании в течение 8 ч при температуре масляной бани 100C и охлаждали до комнатной температуры. В реакционную жидкость добавляли 1 М соляную кислоту и затем образовавшийся осадок собирали путем фильтрования,получая, таким образом, 4-(3,5-дифторпиридин-4-ил)бензойную кислоту (препаративный пример 8-1,80 мг). Фильтрат разбавляли этилацетатом и затем промывали насыщенным солевым раствором, потом сушили и далее концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, этил-4-(3,5-дифторпиридин 4-ил)бензоат (препаративный пример 8-2, 83 мг). Препаративный пример 9. В атмосфере газообразного аргона н-бутиллитий (1,63 М раствор н-гексана, 2,41 мл) добавляли к раствору 3-хлор-5-фторпиридина (517 мг) в ТГФ (3,0 мл) с охлаждением при температуре -78C на бане сухой лед/ацетон, затем перемешивали в течение 0,5 ч и далее добавляли хлорид цинка (0,5 М раствор ТГФ, 7,86 мл), потом опять перемешивали в течение 0,5 ч при той же температуре. После повышения температуры до комнатной добавляли раствор этил-4-бромбензоата (300 мг) в ТГФ (3,0 мл.) и тетракис(трифенилфосфин) палладий (303 мг), затем перемешивали при нагревании в течение 16 ч при температуре масляной бани 60C и охлаждали до комнатной температуры. В реакционную жидкость добавляли 1 М соляную кислоту, затем разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили и потом концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, этил-4-(3-хлор-5 фторпиридин-4-ил)бензоат (194 мг). Препаративный пример 10.(Трибутилфосфоранилиден)ацетонитрил (1,38 г) добавляли к смеси метил-1 Н-индол-4 карбоксилата (500 мг), (3-метилоксетан-3-ил)метанола (583 мг) и толуола (15 мл) в атмосфере газообразного аргона, затем кипятили с обратным холодильником в течение ночи и потом охлаждали до комнатной температуры. Реакционную жидкость концентрировали при пониженном давлении, и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом,метил-1-[(3-метилоксетан-3-ил)]-1 Н-индол-4-карбоксилат (700 мг). Препаративный пример 11. 60%-ный гидрид натрия (134 мг) медленно добавляли к раствору метил-1 Н-индол-4-карбоксилата(507 мг) в ДМФ (5 мл) при охлаждении на ледяной бане, затем перемешивали в течение 30 мин. Добавляли 2-(2-оксопирролидин-1-ил)этилметансульфонат (660 мг) и температуру медленно повышали до комнатной, затем перемешивали в течение 5 ч. После этого реакционную жидкость выливали в воду, затем экстрагировали этилацетатом, промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток очищали на колонке с силикагелем, получая, таким образом, метил-1-[2-(2-оксопирролидин-1-ил)этил]-1 Н-индол-4-карбоксилат(260 мг). Препаративный пример 12. Карбонат калия (196 мг) и 1-йодпропан (482 мг) добавляли к раствору метил-1 Н-индазол-4 карбоксилата (250 мг) в ДМФ (2,5 мл), затем перемешивали в течение ночи при комнатной температуре. После этого в реакционную жидкость добавляли воду, затем экстрагировали этилацетатом и промывали насыщенным солевым раствором, получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-1-пропил-1 Н-индазол-4-карбоксилат (130 мг). Препаративный пример 13. 2,2'-Диметилоксиран (412 мг) и карбонат цезия (1,4 г) добавляли к раствору метил-1 Н-индол-4 карбоксилата (500 мг) в ДМФ (10 мл), затем перемешивали, в течение 1 ч при температуре 100C. После этого добавляли дополнительно 2,2'-диметилоксиран (411 мг), затем перемешивали в течение 1 ч, потом охлаждали до комнатной температуры. Реакционную жидкость концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-1-(2-гидрокси-2-метилпропил)-1 Н-индол-4-карбоксилат (560 мг). Препаративный пример 14. трет-Бутоксид калия (241 мг) при охлаждении льдом добавляли к раствору метил-7-метокси-1 Ниндол-4-карбоксилата (220 мг) в ДМФ (2,2 мл), затем перемешивали в течение 30 мин. После этого добавляли йодметан (183 мг), затем перемешивали в течение 3 ч при комнатной температуре. В реакционную жидкость добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле(гексан/этилацетат), получая, таким образом, метил-7-метокси-1-метил-1 Н-индол-4-карбоксилат (200 мг). Препаративный пример 15. Карбонат калия (55 мг) при комнатной температуре добавляли к раствору трет-бутил-5 циклопропил[(6-гидрокси-1-бензотиофен-3-ил)карбонил]амино 4,5,6,7-тетрагидро-2 Н-индазол-2 карбоксилата (120 мг) в ацетоне (3 мл), затем перемешивали в течение 30 мин. При охлаждении льдом добавляли йодметан (25 мкл), затем перемешивали в течение 14 ч при комнатной температуре. В реакционную жидкость добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Далее твердое вещество фильтровали, раствор концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле, получая, таким образом, трет-бутил-5 циклопропил[(6-метокси-1-бензотиофен-3-ил)карбонил]амино-4,5,6,7-тетрагидро-2 Н-индазол-2 карбоксилат (35 мг). Препаративный пример 16. При охлаждении льдом в атмосфере газообразного аргона раствор 1 М тетрабутиламмоний фторида в ТГФ (3,45 мл) добавляли к смеси метил-5-метокси-1-(триизопропилсилил)-1 Н-индол-4-карбоксилата(1,04 г) и ТГФ (10 мл), затем перемешивали в течение 1 ч при той же температуре. Добавляли йодметан(0,897 мл), затем перемешивали в течение 1 ч при той же температуре и потом в течение 12 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-5-метокси-1-метил-1 Н-индол-4-карбоксилат (205 мг). Препаративный пример 17. К раствору этил-2-ацетил-4-оксопентаноата (1,00 г) в толуоле (20 мл) добавляли 2,6-дифторбензиламин (0,710 мл) и гидрат п-толуолсульфоновой кислоты (70 мг), затем перемешивали в течение 14 ч при температуре 110C. Реакционную смесь охлаждали до комнатной температуры и добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния и растворитель упаривали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=100/0-85/15), получая, таким образом, этил-1-(2,6-дифторбензил)-2,5-диметил 1 Н-пиррол-3-карбоксилат (1, 073 г) в виде твердого вещества бледно-желтого цвета. Препаративный пример 18. 2,4-Дихлоранилин (1,37 г) добавляли к раствору этил-2-ацетил-4-оксопентаноата (1,50 г) в уксусной кислоте (10 мл), затем перемешивали в течение 14 ч при температуре 100C. Реакционную смесь концентрировали и затем к остатку добавляли насыщенный водный раствор гидрокарбоната натрия, потом экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния и потом растворитель упаривали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=100/0-90/10), получая, таким образом, этил-1-(2,4-дихлорфенил)-2,5-диметил-1 Н-пиррол-3-карбоксилат (1,469 г) в виде маслянистого вещества желтого цвета. Препаративный пример 19. К раствору этил-2-метил-1-(2-метилфенил)-1,4,5,6-тетрагидроциклопента[b]пиррол-3-карбоксилата(840 мг) в этаноле (10 мл) добавляли 4 М водный раствор гидроксида лития (5 мл), затем перемешивали в течение 2,5 дней при температуре 80C. В реакционную жидкость добавляли 1 М соляную кислоту(20 мл), затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым рас- 18024846 твором и сушили над безводным сульфатом магния и потом растворитель упаривали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=100/0-80/20 или 60/40), получая, таким образом, 2-метил-1-(2-метилфенил)-1,4,5,6-тетрагидроциклопента[b]пиррол-3 карбоксилат (225 мг) в виде твердого вещества бледно-желтого цвета. Препаративный пример 20. К суспензии метил-2'-циано-6'-фторбифенил-4-карбоксилата (733 мг) в этаноле (II мл) при комнаткой температуре добавляли 5 М водный раствор гидроксида натрия (5,7 мл), затем перемешивали в течение 30 мин при температуре 70C, потом охлаждали. Реакционную жидкость подкисляли с использованием 1 М соляной кислоты. Осадок собирали путем фильтрования, промывали водой и концентрировали при пониженном давлении, получая, таким образом, 2'-циано-6'-фторбифенил-4-карбоновую кислоту(240 мг) в ТГФ (2,6 мл) при охлаждении льдом добавляли по каплям 1 М раствор N,N,N-трибутилбутан 1-аммоний фторида (TBAF) в ТГФ (1,12 мл), затем перемешивали в течение ночи при комнатной температуре. После этого в реакционную жидкость добавляли 1 М соляную кислоту, затем перемешивали в течение 30 мин и экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором гидрокарбоната натрия и насыщенным солевым раствором, в указанном порядке, и сушили над безводным сульфатом магния, затем концентрировали при пониженном давлении, получая, таким образом, сырой, продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-1-(3,3,3-триотор-2-гидрокси-2 метилпропил)-1 Н-индол-4-карбоксилат (230 мг). Препаративный пример 22. К раствору 3-бром-4-фтор-1-бензотиофена (1,4 г) в диэтиловом эфире (20 мл) при температуре-70C в потоке азота добавляли по каплям н-бутиллитий (1,65 М раствор в ТГФ) (4,1 мл), затем перемешивали в течение 30 мин при температуре -70C. После этого реакционную жидкость помещали на сухой лед. Далее реакционную жидкость охлаждали до комнатной температуры, растворитель концентрировали при пониженном давлении. К остатку добавляли воду, затем промывали гексаном. Добавляли 1 М соляную кислоту для нейтрализации водного слоя, затем экстрагировали этилацетатом. Далее органический слой сушили над безводным сульфатом магния, твердое вещество удаляли путем фильтрования,затем концентрировали при пониженном давлении. Добавляли диэтиловый эфир, затем перемешивали и твердое вещество собирали путем фильтрования и сушили при пониженном давлении при температуре 40C, получая, таким образом, 4-фтор-1-бензотиофен-3-карбоновую кислоту (0,57 г). Препаративный пример 23. К растворуN-циклопропил-1-(3-метоксипропил)-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)-1 Ниндол-4-карбоксамида (130 мг) в дихлорметане (1,3 мл) при охлаждении льдом в атмосфере аргона добавляли трибромид бора (3,76 мл, 1 М раствор), затем перемешивали в течение 60 ч при комнатной температуре. После этого добавляли воду, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом магния, твердое веществе удаляли путем фильтрования, затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле(18,4 г),1,1-диметокси-N,Nдиметилметанамина (40 мл) и триэтиламина (40 мл) перемешивали при нагревании в течение 30 мин при температуре масляной бани 140C и легколетучие продукты упаривали. После этого добавляли 1,1-диметокси-N,N-диметилметанамин (4 С мл) и триэтиламин (40 мл), затем перемешивали при нагревании в течение 30 мин при температуре 140C. Используя соответствующие реагенты в количестве 200 мл всего, вышеописанную процедуру повторяли 5 раз. Реакционную жидкость концентрировали при пониженном давлении и к остатку добавляли этанол (100 мл) и гидразин гидрат (10,1 мл), затем перемешивали в течение 60 ч при комнатной температуре. После этого реакционную жидкость разбавляли этилацетатом, затем промывали водой 3 раза и затем насыщенным солевым раствором, сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле(180 мг), фосфата трикалия (637 мг) и толуола (1,8 мл) в атмосфере газообразного аргона, затем перемешивали при нагревании в течение 4 ч при температуре масляной бани 110C и затем реакционную жидкость охлаждали до комнатной температуры. В реакционную жидкость добавляли воду, затем разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили и концентрировали при пони- 19024846 женном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-4-(3,5-дифторпиридин-2-ил)бензоат (249 мг). Препаративный пример 26. Триацетокси боргидрид натрия (5,41 г) и уксусную кислоту (2,19 мл) добавляли к смеси (3,45 г) бензил-5-оксо-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата и его региоизомера, циклопропиламина(0,878 мл) и 1,2-дихлорэтана (70 мл) в атмосфере газообразного аргона, затем перемешивали в течение 18 ч при комнатной температуре. В реакционную жидкость добавляли воду, затем перемешивали в течение 2 ч при комнатной температуре и после этого устанавливали рН равным 8, используя насыщенный водный раствор бикарбоната, далее жидкость разделяли. Органический слой сушили и затем концентрировали при пониженном давлении. К смеси остатка и этилацетата (100 мл) добавляли раствор 4 М хлористого водорода в диоксане (4,15 мл), затем перемешивали в течение 1 ч при комнатной температуре. Осадок собирали путем фильтрования и промывали этилацетатом, получая, таким образом, смесь (3,26 г) моногидрохлорида бензил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата и его региоизомера. Препаративный пример 27. 1 М соляную кислоту (100 мл) при охлаждении льдом добавляли к смеси бензилциклопропил(1,4 диоксаспиро[4,5]дец-8-ил)карбамата (23,1 г) и ТГФ (200 мл), затем перемешивали в течение 48 ч при комнатной температуре. После этого добавляли 1 М соляную кислоту (100 мл), затем опять перемешивали в течение 10 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом, затем жидкость разделяли. Органический слой промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором и сушили, затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, бензилциклопропил(4-оксоциклогексил)карбамат (18,4 г). Препаративный пример 28. Диизопропилэтиламин (9,59 мл) и бензилоксикарбонил хлорид (6,40 мл) при охлаждении льдом в атмосфере газообразного аргона добавляли к смеси 1',4',6',7'-тетрагидроспиро[1,3-диоксолан-2,5'индазол] (6,73 г) и ТГФ (70 мл), затем перемешивали в течение 3 ч при охлаждении льдом. Реакционную жидкость разбавляли этилацетатом и далее промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, бензил 6',7'-дигидроспиро[1,3-диоксолан-2,5'-индазол]-2'(4'Н)-карбоксилат (11,1 г). Препаративный пример 29. Триэтиламин (35,3 мл), бензилхлоркарбонат (29,0 мл) и 4-диметиламинопиридин в каталитическом количестве при охлаждении льдом в атмосфере газообразного аргона добавляли к смеси N-циклопропил 1,4-диоксаспиро[4,5]декан-8-амина (20 г) и дихлорметана (200 мл), затем перемешивали в течение 1 ч при охлаждении льдом и после этого в течение 12 ч при комнатной температуре. Реакционную жидкость разбавляли хлороформом и затем промывали 1 М соляной кислотой, водой и насыщенным водным раствором бикарбоната натрия в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат),получая, таким образом, бензилциклопропил(1,4-диоксаспиро[4,5]дец-8-ил)карбамат (23,9 г). Препаративный пример 30. Смесь (17,1 г) трет-бутил-5-[(бензилокси)карбонил](циклопропиламино)-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилата и его региоизомера, 10%-ный палладий на подложке из активированного угля(1,7 г) и этанол (200 мл) перемешивали в течение 2 ч при комнатной температуре в атмосфере водорода под давлением в 1 атм. 10%-ный палладий на подложке из активированного угля удаляли из реакционной жидкости путем фильтрования и затем фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, смесь (10,5 г) моногидрохлорида трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилата и его региоизомера. Препаративный пример 31. Смесь трет-бутилдикарбоната (13,7 г) и дихлорметана (100 мл) добавляли к смеси бензилциклопропил(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)карбамата (18,0 г) и дихлорметана (200 мл) в атмосфере газообразного аргона, затем перемешивали в течение 12 ч при комнатной температуре. После этого добавляли смесь трет-бутилдикарбоната (5,3 г) и дихлорметана (10 мл), затем опять перемешивали в течение 24 ч при комнатной температуре. Реакционную жидкость концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/этилацетат), получая,таким образом, смесь (17,1 г) трет-бутил-5-[(бензилокси)карбонил](циклопропиламино-4,5,6,7 тетрагидро-2 Н-индазол-2-карбоксилата и его региоизомера. Препаративный пример 32. Триэтиламин (635 мкл) и ди-трет-бутилдикарбонат (597 мг) добавляли к раствору 4'-[циклопропил(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)карбамоил]бифенил-2-карбоновой кислоты (366 мг) в ТГФ (3,7 мл), затем перемешивали в течение 16 ч при комнатной температуре. В реакционную жид- 20024846 кость добавляли воду, затем разбавляли этилацетатом, промывали насыщенным солевым раствором, сушили и потом концентрировали при пониженном давлении, получая, таким образом, 4'-[2-(третбутоксикарбонил)-4,5,6,7-тетрагидро-2 Н-индазол-5-ил][циклопропил)карбамоилбифенил-2-карбоновую кислотуN-[(диметиламино)(3 Н-[1,2,3]триазоло[4,5-b]пиридин-3 илокси)метилиден]-N-метилметанаминия (HATU) (57 мг), диизопропилэтиламин (19 мг) и 4-диметиламинопиридин в каталитическом количестве добавляли к раствору 4'-[2-(трет-бутоксикарбонил)-4,5,6,7-тетрагидро-2 Н-индазол-5-ил](циклопропил)карбамоилбифенил-2 карбоновой кислоты (50 мг) в ДМФ (1,2 мл), затем перемешивали в течение ночи при температуре 60C. После этого в реакционную жидкость добавляли воду, затем экстрагировали этилацетатом, промывали водой и насыщенным солевым раствором в указанном порядке и сушили над безводным сульфатом магния, получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (от 30 до 100%, этилацетат/гексан), получая, таким образом, третбутил-5-(циклопропил[2'-(диметилкарбамоил)бифенил-4-ил]карбониламино)-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилат (30 мг). Препаративный пример 33. К смеси метил-2-метил-1 Н-индол-4-карбоксилата (1,17 г) и ацетонитрила (20 мл) при охлаждении льдом добавляли 1-(хлорметил)-4-фтор-1,4-диазониабицикло[2,2,2]октан дитетрафторборат (2,36 г), затем перемешивали в течение 3 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и промывали насыщенным водным раствором гидрокарбоната натрия, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат и затем гексан/хлороформ), получая, таким образом, метил-3-фтор-2 метил-1 Н-индол-4-карбоксилат (102 мг). Препаративный пример 34.N-Этил-N-изопропилпропан-2-амин (4,08 мл) и бензилхлорметиловый эфир (0,792 мл) при охлаждении льдом в атмосфере газообразного аргона добавляли к смеси 3'-метил-1',4',6',7'тетрагидроспиро[1,3-диоксолан-2,5'-индазола] (925 мг) и дихлорметана (20 мл), затем перемешивали в течение 4,5 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным, солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, смесь(1,11 г) 1'-[(бензилокси)метил]-3'-метил-1',4',6',7'-тетрагидроспиро[1,3-диоксолан-2,5'-индазол] и его региоизомера. Препаративный пример 35. К смеси 1-(8-гидрокси-1,4-диоксаспиро[4,5]дец-7-ен-7-ил)этанона (1,03 г) и этанола (10 мл) добавляли гидразин гидрат (0,756 мл), затем перемешивали в течение 12 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении, получая, таким образом, 3'-метил-1',4',6',7'-тетрагидроспирс[1,3 диоксолан-2,5'-индазол] (948 мг). Препаративный пример 36. Смесь бензилциклопропил(3-оксо-2,3,5,6,7,8-гексагидроциннолин-6-ил)карбамата (172 мг) и трихлорида фосфора (0,50 мл) перемешивали при нагревании в течение 3,5 ч при температуре масляной бани 100C в атмосфере газообразного аргона и затем охлаждали до комнатной температуры. Реакционную жидкость выливали в ледяную воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, бензил-(3-хлор-5,6,7,8-тетрагидроциннолин-6-ил)циклопропил карбамат (74 мг). Препаративный пример 37. Смесь бензил-5-[циклопропил(4-гидроксибензоил)амино]-4,5,6,7-тетрагидро-2H-индазол-2 карбоксилата (80 мг), (R)-(-)-2-бутанола (19 мкл), трифенилфосфина (63 мг) и ТГФ (1,0 мл) охлаждали ледяной водой в атмосфере газообразного аргона и добавляли диизопропилазодикарбоксилат (40%-ный раствор в толуоле, 127 мкл) и температуру повышали до комнатной, затем перемешивали в течение 6 ч. Реакционную жидкость концентрировали при пониженном давлении, и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, бензил-5-[4-[(2S)бутан-2-илокси]бензоил(циклопропил)амино]-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (18 мг). Препаративный пример 38. Фторид тетрабутиламмония (1 М раствор в ТГФ, 742 мкл) добавляли к раствору бензил-5(циклопропил 4-[(триэтилсилил)окси]бензоиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата(270 мг) в ТГФ (6,0 мл), затем перемешивали в течение 3 дней при комнатной температуре. Реакционную жидкость концентрировали при пониженном давлении, и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, бензил-5-[циклопропил(4- 21024846 гидроксибензоил)амино]-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (129 мг). Препаративный пример 39. Смесь метил-1 Н-индазол-4-карбоксилата (505 мг), йодбензола (1,17 г), йодида меди(I) (107 мг),транс-N,N'-диметилциклогексан-1,2-диамина (161 мг), фосфата трикалия (1,22 г) и диоксана (5 мл) перемешивали при нагревании в течение 8 ч при температуре масляной бани 95C. Реакционную жидкость охлаждали до комнатной температуры, затем разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Органический слой сушили и концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая,таким образом, метил-1-фенил-1 Н-индазол-4-карбоксилат (345 мг). Препаративный пример 40. Раствор трифторуксусной кислоты (111 мг) в дихлорметане (0,8 мл) при охлаждении льдом добавляли по каплям к диэтилцинку (1 М раствор в дихлорметане, 0, 97 мл), затем перемешивали в течение 20 мин. После этого в реакционную жидкость добавляли по каплям раствор дийодметана (274 мг) в дихлорметане (0,8 мл) и затем температуру повышали до комнатной температуры, потом перемешивали в течение 20 мин. После этого при охлаждении льдом добавляли по каплям раствор метил-1-[2(винилокси)этил]-1 Н-индазол-4-карбоксилата (120 мг) в дихлорметане (0,8 мл) и температуру медленно повышали до комнатной температуры, затем перемешивали в течение ночи. В реакционную жидкость добавляли воду, затем экстрагировали хлороформом. Органический слой промывали насыщенным водным раствором гидрокарбоната и насыщенным солевым раствором, в указанном порядке, и сушили над безводным сульфатом магния, затем концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии на силикагеле, получая, таким образом, метил-1-[2-(циклопропилокси)этил]1 Н-индазол-4-карбоксилат (30 мг). Препаративный пример 41. При комнатной температуре N-бромсукцинимид (1,125 г) добавляли к раствору (1-бензотиофен-6 илокси)(трет-бутил)дифенилсилана (2,34 г) в хлороформе (20 мл), затем перемешивали в течение 60 ч. После этого добавляли воду, затем экстрагировали хлороформом и органический слой концентрировали. Далее остаток очищали с помощью колоночной хроматографии на силикагеле (гексан), получая, таким образом, [(3-бром-1-бензотиофен-6-ил)окси](трет-бутил)дифенилсилан (1,16 г) в виде бесцветного маслянистого вещества. Препаративный пример 42. трет-Бутил(хлор)дифенилсилан (4,9 мл) добавляли по каплям к раствору 1-бензотиофен-6-ола(2,5 г) и диизопропилэтиламина в дихлорметане (20 мл) при охлаждении льдом, затем перемешивали в течение 16 ч при комнатной температуре. Добавляли насыщенный водный раствор хлорида аммония,затем экстрагировали хлороформом, сушили над безводным сульфатом магния. После этого растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат=10:0-95:5), получая, таким образом, (1-бензотиофен-6-илокси)(трет-бутил)дифенилсилан(5,37 г) в виде бесцветного маслянистого вещества. Препаративный пример 43. К трет-бутил-5-(циклопропил[2'-(метоксикарбонил)бифенил-4-ил]карбониламино)-4,5,6,7 тетрагидро-2 Н-индазол-2-карбоксилату (470 мг) в смеси метанола (2 мл) и ТГФ (2 мл) при комнатной температуре добавляли 4 М водный раствор гидроксида натрия (2 мл), затем перемешивали в течение ночи. После этого в реакционную жидкость добавляли 1 М соляную кислоту для нейтрализации и растворитель упаривали при пониженном давлении, получая, таким образом, 4'-[циклопропил(4,5,6,7 тетрагидро-1 Н-индазол-5-ил)карбамоил]бифенил-2-карбоновую кислоту (366 мг). Препаративный пример 44. К смеси N-циклопропил-4-изопропил-N-[4-(пирролидин-1-ил)циклогекс-3-ен-1-ил бензамида(630 мг), диизопропилэтиламина (0,367 мл) и хлороформа (17 мл) в атмосфере газообразного аргона добавляли ацетил хлорид (0,140 мл), затем перемешивали в течение 26 ч при комнатной температуре. В реакционную жидкость добавляли 1 М соляную кислоту, затем перемешивали в течение 1 ч при комнатной температуре и добавляли этилацетат для осуществления разделения жидкости. Органический слой промывали водой и насыщенным солевым раствором, в указанном порядке, и сушили, затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/этилацетат), получая, таким образом, N-(3-ацетил)-4-гидроксициклогекс-3-ен-1-ил)-Nциклопропил-4-изопропил бензамид (203 мг). Препаративный пример 45. К смеси N-циклопропил-4-изопропил-N-(4-оксоциклогексил)бензамида (500 мг), безводного сульфата магния (1,5 г) и толуола (5 мл) в атмосфере газообразного аргона добавляли пирролидин (0,846 мл),затем перемешивали в течение 24 ч при комнатной температуре. Сульфат магния удаляли из реакционной жидкости путем фильтрования, затем концентрировали при пониженном давлении и сушили, получая, таким образом, N-циклопропил-4-изопропил-N-[4-(пирролидин-1-ил)циклогекс-3-ен-1-ил]бензамид(4 мл) нагревали при кипячении с обратным холодильником в течение 28 ч. Уксусную кислоту упаривали из реакционной жидкости при пониженном давлении, затем разбавляли хлороформом и промывали водой. Органический слой сушили и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом,этил-1-бензил-2,5-диметил-1H-имидазол-4-карбоксилат (384 мг). Препаративный пример 47. Оптическое разделение рацемического трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилата (223 мг) осуществляли с помощью сверхкритической флюидной хроматографии(колонка: Chiralpak AY-H 10250 мм, производство DAICEL CORPORATION, подвижная фаза: сжиженный углекислый газ/0,1% диэтиламин в метаноле). В результате получали оптически активный трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (препаративный пример 47-1, 80,3 мг), имеющий время удерживания 6,49 мин, и оптически активный трет-бутил-5(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилат (препаративный пример 47-2,88,8 мг), имеющий время удерживания 9,32 мин. Препаративный пример 48. Смесь N-циклопропил-4-изопропил-N-(4-оксоциклогексил)бензамида (1 г), 1,1-диметокси-N,Nдиметилметанамина (2 мл) и триэтиламина (2 мл) перемешивали при нагревании в течение 30 мин при температуре масляной бани 140C и легколетучие продукты упаривали. После этого добавляли 1,1-диметокси-N,N-диметилметанамин (2 мл) и триэтиламин (2 мл), затем перемешивали при нагревании в течение 30 мин при температуре масляной бани 140C. Используя соответствующие реагенты в количестве 10 мл всего, вышеописанную процедуру повторяли 5 раз. Реакционную жидкость концентрировали при пониженном давлении. К остатку добавляли этанол (10 мл) и гидрохлорид О-метилизомочевины(769 мг), затем перемешивали в течение 1 ч при комнатной температуре, нагревали в течение 21 ч при температуре масляной бани 60C, перемешивали при нагревании в течение 12 ч при температуре масляной бани 80C и охлаждали до комнатной температуры. Реакционную жидкость разбавляли этилацетатом и затем промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, бензилциклопропил(2-метокси-5,6,7,8 тетрагидрохиназолин-6-ил)карбамат (204 мг). Препаративный пример 49. 1,65 М раствор н-бутиллития в гексане (6,96 мл) добавляли к смеси N-изопропилпропан-2-амина(1,62 мл) и ТГФ (30 мл), охлаждая на бане ацетон/сухой лед в атмосфере газообразного аргона, затем перемешивали в течение 30 мин при той же температуре. Добавляли смесь бензилциклопропил(4 оксоциклогексил)карбамата (3 г) и ТГФ (26 мл) и температуру медленно повышали до температуры охлаждения льдом в течение 3 ч, затем перемешивали в течение 10 мин при той же температуре. Затем добавляли триамид гексаметилфосфата (НМРА) (1,33 мл) и этил цианоформиат (1,13 мл), охлаждая при этом на бане ацетон/сухой лед, потом перемешивали в течение 1 ч при той же температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом,этил-5-[(бензилокси)карбонил](циклопропил)амино-2-гидроксициклогекса-1-ен-1-карбоксилат(160 мг) перемешивали при нагревании в течение 23 ч при температуре 50C в атмосфере газообразного аргона. После этого добавляли уксусную кислоту (0,5 мл), затем перемешивали при нагревании в течение 21 ч при температуре масляной бани 50C и затем в течение 7 ч при температуре масляной бани 100C. После этого добавляли уксусную кислоту (1 мл) и гидразин гидрат (0,127 мл), затем перемешивали при нагревании в течение 18 ч при температуре масляной бани 100C, и потом реакционную жидкость охлаждали до комнатной температуры. Реакционную жидкость разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, бензилциклопропил(3-оксо-2,3,5,6,7,8-гексагидроциннолин-6-ил)карбамат (343 мг). Препаративный пример 51. К смеси (117 мг) бензилциклопропил(2-метил-3-оксо-2,3,4,5,6,7-гексагидро-1 Н-индазол-5 ил)карбамата и его региоизомера и дихлорметана (2 мл) при охлаждении льдом в атмосфере газообразного аргона добавляли пиридин (0,030 мл) и этилхлорформиат (0,036 мл), затем перемешивали в течение 2 ч при той же температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали насыщенным водным раствором хлорида аммония и насыщенным солевым раствором в указанном порядке,потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной(хлороформ/метанол),получая,таким образом,этил-5[(бензилоксикарбонил](циклопропил)амино-2-метил-3-оксо-2,3,4,5,6,7-тетрагидро-1 Н-индазол-1 карбоксилат (117 мг). Препаративный пример 52. Смесь этил-5-[(бензилокси)карбонил](циклопропиламино-2-гидроксициклогекс-1-ен-1 карбоксилата (210 мг), метилгидразина (0,362 мл) и этанола (4 мл) перемешивали при нагревании в течение 3 ч и затем охлаждали до комнатной температуры. Реакционную жидкость концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, смесь (129 мг) бензилциклопропил (2-метил-3-оксо-2,3,4,5,6,7 гексагидро-1 Н-индазол-5-ил)карбамата и его региоизомера. Препаративный пример 53. К смеси 4-бром-5-метокси-1 Н-индола (1,0 г) и ДМФ (10 мл) при охлаждении льдом в атмосфере газообразного аргона добавляли трет-бутоксид калия (0,596 г), затем перемешивали в течение 1 ч при комнатной температуре. После охлаждения на ледяной бане добавляли хлор(триизопропил)силан (1,13 мл),затем перемешивали в течение 2 ч при той же температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали водой (3 раза) и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, 4-бром-5-метокси-1(триизопропилсилил)-1 Н-индол (1,72 г). Препаративный пример 54. К смеси 4-бром-5-метокси-1-(триизопропилсилил)-1 Н-индола (1,47 г) и ТГФ (30 мл) добавляли раствор 1,62 М н-бутиллития в гексане (2,85 мл), при этом охлаждая на бане сухой лед/ацетон в атмосфере газообразного аргона, затем перемешивали в течение 50 мин при той же температуре. Добавляли диметилкарбонат (0,647 мл) и температуру повышали до температуры охлаждения льдом в течение 8 ч. Реакционную жидкость разбавляли этилацетатом и затем промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом,метил-5-метокси-1-(триизопропилсилил)-1 Н-индол-4-карбоксилат (1,00 г). Препаративный пример 55. К раствору этил-5-[(бензилокси)карбонил](циклопропил)амино-2-гидроксициклогекса-1-ен-1 карбоксилата (478 мг) в этаноле (10 мл) добавляли гидразин гидрат (133 мг), затем нагревали при кипячении с обратным холодильником в течение 3 ч. После этого реакционную жидкость выливали в воду,осуществляли экстракцию 3 раза с использованием хлороформа. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/хлороформ), получая, таким образом,бензилциклопропил(3-оксо-2,3,4,5,6,7-гексагидро-1 Н-индазол-5-ил)карбамат (308 мг). Препаративный пример 56. К раствору 3-метил-1 Н-индол-4-карбоксилата (500 мг) в ДМФ (5 мл) при охлаждении льдом добавляли трет-бутоксид калия (705 мг), затем перемешивали в течение 40 мин. После этого добавляли йодметан (1,2 г), затем перемешивали в течение ночи при комнатной температуре. В реакционную жидкость добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, метил-3-диметил-1 Н-индол-4-карбоксилат (480 мг). Препаративный пример 57. Воду (1,5 мл), 2-цианофенил бороновую кислоту (231 мг), трифенилфосфин (45 мг) и карбонат натрия (416 мг) добавляли в указанном порядке, к раствору 4-бром-3-хлорбензойной кислоты (308 мг) в 1,4-диоксане (10 мл), затем перемешивали при нагревании в течение 3 ч при температуре 100C в атмосфере аргона. В реакционную жидкость добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над сульфатом магния,получая, таким образом, сырой продукт. Полученный сырой продукт очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом, 2-хлор-2'-цианобифенил-4 карбоновую кислоту (363 мг). Соединения по препаративным примерам 58-432, показанные в таблицах, описанных далее, были получены таким же способом, как и в препаративных примерах 1-57. Структуры соединений по препаративным примерам показаны в табл. 5-81, а физико-химические данные и способ получения соединений показаны в табл. 82-92 соответственно. Пример 1. Трифторуксусную кислоту (260 мг) добавляли к раствору трет-бутил-5-[(2'-цианобифенил-4 ил)карбонил](циклопропил)амино-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (110 мг) в дихлорметане (1,1 мл), затем перемешивали в течение 2 ч при комнатной температуре. После этого растворитель упаривали при пониженном давлении, затем разбавляли этилацетатом и промывали насыщенным вод- 24024846 ным раствором гидрокарбоната натрия и насыщенным солевым раствором в указанном порядке. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали на колонке с силикагелем (метанол/хлороформ), получая, таким образом, 2'-циано-N-циклопропил-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бифенил-4-карбоксамид (66 мг). Пример 2. Раствор 4 М хлористый водород/этилацетат (2 мл) добавляли к трет-бутил-5-(циклопропил[1-(2 фторэтил)-1 Н-индол-4-ил]карбониламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилату (95 мг) в смеси этилацетата (1,9 мл) и этанола (0,48 мл) при комнатной температуре, затем перемешивали в течение 2 ч. После этого реакционную жидкость концентрировали при пониженном давлении и подщелачивали с использованием насыщенного водного раствора гидрокарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, затем концентрировали при пониженном давлении. Остаток очищали на колонке с силикагелем (0%-10% метанол/хлороформ), и затем добавляли раствор 4 М хлористый водород/этилацетат,потом упаривали растворитель при пониженном давлении, получая, таким образом, гидрохлорид(5 мл) перемешивали в течение ночи при комнатной температуре. Реакционную жидкость выливали в насыщенный водный раствор бикарбонат натрия и осуществляли экстракцию с использованием хлороформа. Органический слой сушили и затем концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), затем растворяли в этилацетате. Добавляли раствор 4 М хлористый водород/этилацетат и образовавшийся осадок собирали путем фильтрования, получая, таким образом, гидрохлорид N-циклопропил-1-(1-фенилэтил)-N-(4,5,6,7 тетрагидро-1 Н-индазол-5-ил)-1 Н-индазол-4-карбоксамида (60 мг). Пример 4. К смеси 1-бензил-1 Н-индол-2-карбоновой кислоты (140 мг) и дихлорметана (5 мл) добавляли оксалил хлорид (100 мкл) и ДМФ (20 мкл), затем перемешивали в течение 1 ч при комнатной температуре и затем растворитель упаривали при пониженном давлении. К полученному азеотропной отгонкой осадку добавляли дихлорметан (5 мл) и сушили с использованием толуола и затем добавляли моногидрохлорид трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата(150 мг) и триэтиламин (200 мкл) при температуре 0C, затем перемешивали в течение 20 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. К остатку добавляли 4 М раствор хлористый водород/этилацетат (5 мл), затем перемешивали в течение 24 ч при комнатной температуре. Растворитель упаривали из реакционной жидкости при пониженном давлении и к полученному остатку добавляли этилацетат, затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором в указанном порядке, сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/этилацетат), получая, таким образом,1-бензил-N-циклопропил-N-(4,5,6,7-тетрагидро-2 Н-индазол-5-ил)-1 Н-индол-2-карбоксамид(217 мг). Пример 5. К раствору бензил-5-[циклопропил(4-изопропокси-2-метоксибензоил)амино]-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилата (140 мг) в тетрагидрофуране (1,4 мл) добавляли 5 М водный раствор гидроксида натрия, затем перемешивали в течение 2 ч при комнатной температуре. После этого реакционную жидкость нейтрализовали с помощью 1 М соляной кислоты, затем экстрагировали хлороформом, концентрировали при пониженном давлении и очищали с помощью колоночной хроматографии на силикагеле, получая, таким образом, N-циклопропил-4-изопропокси-2-метокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5 ил)бензамид (40 мг). Пример 6. Трибромид бора (1 М раствор в ТГФ, 5,3 мл) добавляли по каплям к раствору бензил-5-[(2'-циано 6'-фтор-3-метоксибифенил-4-ил)карбонил](циклопропил)амино-4,5,6,7-тетрагидро-2 Н-индазол-2 карбоксилата (300 мг) в дихлорметане (3 мл) при охлаждении льдом, затем перемешивали в течение 3 дней при комнатной температуре. После этого реакционную жидкость выливали в воду и слегка подщелачивали с использованием насыщенного водного раствора гидрокарбоната натрия, затем экстрагировали хлороформом и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле Оптическое разделение рацемического 2'-циано-N-циклопропил-6'-фтор-N-(4,5,6,7-тетрагидро-1 Ниндазол-5-ил)бифенил-4-карбоксамида (500 мг) осуществляли с помощью сверхкритической флюидной хроматографии (колонка: AS-H, элюирующий растворитель: сжиженный углекислый газ/этанол=80/20,скорость потока: 12 мл/мин). В результате получали (-)-2'-циано-N-циклопропил-6'-фтор-N-(4,5,6,7 тетрагидро-1 Н-индазол-5-ил)бифенил-4-карбоксамид (210 мг) (пример 7-1) и (+)-2'-циано-Nциклопропил-6'-фтор-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бифенил-4-карбоксамид(пример 7-2). Пример 8. Оптическое разделение рацемического N-циклопропил-4-изопропокси-N-(4,5,6,7-тетрагидро-1 Ниндазол-5-ил)бензамида (450 мг) осуществляли с помощью сверхкритической флюидной хроматографии(колонка: AY-H, элюирующий растворитель: сжиженный углекислый газ/этанол=7/3, скорость потока: 10 мл/мин). В результате получали (-)-N-циклопропил-4-изопропокси-N-(4,5,6,7-тетрагидро-1 Н-индазол 5-ил)бензамид (190 мг) (пример 8-1) и (+)-N-циклопропил-4-изопропокси-N-(4,5,6,7-тетрагидро-1 Ниндазол-5-ил)бензамид (187 мг) (пример 8-2). Пример 9. К раствору 1-(3-бромпропил)-N-циклопропил-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)-1 Н-индол-4 карбоксамида (65 мг) в смеси 1,4-диоксан (1 мл)/вода (0,25 мл) при комнатной температуре добавляли трифторацетат серебра (45 мг), затем перемешивали в течение 40 ч при комнатной температуре. Добавляли этанол и нерастворимое вещество удаляли путем фильтрования с использованием целита. Раствор концентрировали при пониженном давлении, добавляли насыщенный водный раствор гидрокарбоната натрия, затем экстрагировали этилацетатом. Растворитель концентрировали при пониженном давлении и остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол=10:0-9:1),получая, таким образом, N-циклопропил-1-(3-гидроксипропил)-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)1 Н-индол-4-карбоксамид (18 мг). Пример 10. Смесь N-циклопропил-4-изопропил-N-(4-оксоциклогексил)бензамида (500 мг), 1,1-диметокси-N,Nдиметилметанамина (1 мл) и триэтиламина (1 мл) перемешивали при нагревании в течение 30 мин при температуре масляной бани 140C и легколетучие продукты упаривали. После этого добавляли 1,1-диметокси-N,N-диметилметанамин (1 мл) и триэтиламин (1 мл), затем перемешивали при нагревании в течение 30 мин при температуре масляной бани 140C. Используя соответствующие реагенты в количестве 5 мл всего, вышеописанную процедуру повторяли 5 раз. Реакционную жидкость концентрировали при пониженном давлении. К остатку добавляли этанол (2,5 мл) и гидразин гидрат (0,243 мл), затем перемешивали в течение 12 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали водой (3 раза) и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, N-циклопропил-4-изопропил-N(4,5,6,7-тетрагидро-2 Н-индазол-5-ил)бензамид (380 мг). Пример 11. О-(7-Азабензотриазол-1-ил)-N,N,N',N'-тетраметилуроний гексафторфосфат (113 мг), диизопропилэтиламин (0,127 мл) и 4-диметиламинопиридин в каталитическом количестве добавляли к смеси моногидрохлорида N-ииклопропил-5,6,7,8-тетрагидроциннолин-6-амина (56 мг), 1-метил-1 Н-индол-4-карбоновой кислоты (52 мг) и ДМФ (2 мл) в атмосфере газообразного аргона, затем перемешивали при нагревании в течение 60 ч при температуре масляной бани 60C и затем полученный продукт охлаждали до комнатной температуры. Реакционную жидкость разбавляли этилацетатом и затем промывали водой (3 раза) и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол),получая, таким образом, N-циклопропил-1-метил-N-(5,6,7,8-тетрагидроциннолин-6-ил)-1 Н-индол-4 карбоксамид (9,3 мг). Пример 12. К смеси 4-циано-N-циклопропил-N-(4,5,6,7-тетрагидро-2 Н-индазол-5-ил)бензамида (130 мг) и этанола (5 мл) добавляли 1 М водный раствор гидроксида натрия (3 мл) и 30% водный пероксид водорода(600 мкл), затем перемешивали в течение 2,5 ч при комнатной температуре. Реакционную жидкость разбавляли хлороформом и промывали водой и насыщенным солевым раствором, потом сушили и концентрировали при пониженном давлении. К остатку добавляли 4 М раствор хлористый водород/этилацетат(5 мл), затем перемешивали в течение 24 ч при комнатной температуре. К остатку, который образовывался после упаривания растворителя из реакционной жидкости при пониженном давлении, добавляли этилацетат, затем промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором в указанном порядке, сушили и концентрировали при пониженном давлении. Остаток очищали с помощью NH-колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, N-циклопропил-N-(4,5,6,7-тетрагидро-2 Н-индазол-5-ил)терефтальамид (85 мг).(197 мг) и этанола (2 мл) добавляли гидразин гидрат (0,0840 мл), затем перемешивали в течение 72 ч при комнатной температуре. Реакционную жидкость разбавляли этилацетатом и затем промывали водой и насыщенным солевым раствором в указанном порядке, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/этилацетат метанол) и переводили в гидрохлорид с использованием 4 М раствора хлористый водород/этилацетат, получая, таким образом, моногидрохлорид N-циклопропил-4-изопропил-N-(3-метил 4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамида (130 мг). Пример 14. К смеси этил-5-циклопропил[(1-метил-1 Н-индол-4-ил)карбонил]амино-2-метил-3-оксо 2,3,4,5,6,7-гексагидро-1 Н-индазол-1-карбоксилата (64 мг), метанола (1 мл) и ТТФ (1 мл) добавляли 5 М водный раствор гидроксида натрия (0,059 мл), затем перемешивали в течение 1 ч при комнатной температуре. В реакционную жидкость добавляли 1 М соляную кислоту для нейтрализации, затем концентрировали при пониженном давлении. Остаток разбавляли хлороформом и промывали водой, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол), получая, таким образом, N-циклопропил-1-метил-N-(2-метил-3 оксо-2,3,4,5,6,7-гексагидро-1 Н-индазол-5-ил)-1 Н-индол-4-карбоксамид (28 мг). Пример 15. К смеси N-1-[(бензилокси)метил]-3-метил-4,5,6,7-тетрагидро-1 Н-индазол-5-ил]-N-циклопропил-5[2-(трифторметил)фенил]-2-фурамида (199 мг) и 6 М соляной кислоты (1 мл) в этаноле (4 мл) добавляли 10% палладий на подложке из активированного угля (20 мг), затем перемешивали в течение 3,5 ч в атмосфере азота под давлением в 1 атм. 10%-ный палладий на подложке из активированного угля удаляли из реакционной жидкости путем фильтрования, затем концентрировали при пониженном давлении. Остаток подщелачивали с использованием насыщенного водного раствора бикарбоната натрия, затем экстрагировали хлороформом. Органический слой сушили и затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (хлороформ/метанол) и переводили в гидрохлорид с использованием 4 М раствора хлористый водород/этилацетат, получая, таким образом,моногидрохлорид(0,5 мл) и ДМФ (каталитическое количество) перемешивали в течение 2 ч при температуре 50C и охлаждали до комнатной температуры. После этого добавляли раствор гидрохлорида трет-бутил-5(этиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (9,1 мг) и диизопропилэтиламина (16 мкл) в дихлорметане (0,5 мл), затем перемешивали в течение ночи при комнатной температуре. ДобавлялиPS-трис-амин (производство Biotage, 3, 90 ммоль/г, 60 мг) и хлороформ (1 мл), затем перемешивали в течение 4 ч при комнатной температуре. После фильтрации реакционной жидкости растворитель упаривали при пониженном давлении, затем растворяли в этилацетате (1 мл). Добавляли 4 M раствор хлористый водород/этилацетат (0,5 мл), затем перемешивали в течение ночи при комнатной температуре, и растворитель упаривали при пониженном давлении. Полученный остаток очищали с помощью ВЭЖХ(0,1% раствор водная муравьиная кислота/метанол), получая, таким образом, 4-(диэтиламино)-N-этил-N(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамид (6,4 мг). Пример 17. Смесь 2,5-диметил-1-(2-тиенилметил)-1 Н-пиррол-3-карбоновой кислоты (7,8 мг), оксалил хлорида(3,0 мкл), дихлорметана (0,5 мл) и ДМФ (каталитическое количество) перемешивали в течение 2 ч при температуре 50C. Затем полученный продукт охлаждали до комнатной температуры, добавляли раствор гидрохлорид трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (9,4 мг) и изопропилэтиламина (16 мкл) в дихлорметане (0,5 мл), затем перемешивали в течение ночи при комнатной температуре. Добавляли PS-трис-амин (производство Biotage, 3,90 ммоль/г, 60 мг) и хлороформ(1 мл), затем перемешивали в течение 6 ч при комнатной температуре. Далее реакционную жидкость фильтровали, растворитель упаривали при пониженном давлении, затем растворяли в этаноле (1 мл). Добавляли 4 М раствор хлористый водород/этилацетат (0,5 мл), затем перемешивали в течение ночи при комнатной температуре и растворитель упаривали при пониженном давлении. Полученный остаток очищали с помощью ВЗЖХ (0,1% раствор водная муравьиная кислота/метанол), получая, таким образом,N-циклопропил-2,5-диметил-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)-1-(2-тиенилметил)-1 Н-пиррол-3 карбоксамид (1,9 мг). Пример 18. Смесь 2'-(трифторметил)бифенил-4-карбоксилата (8,8 мг), 1-хлор-N,N,2-триметилпропениламина(4,0 мкл) и дихлорметана (0,8 мл) перемешивали в течение 1 ч при комнатной температуре. Добавляли раствор гидрохлорида трет-бутил-5-(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата(9,4 мг) в дихлорметане (0,7 мл) и пиридин (7,3 мкл), затем перемешивали в течение ночи при комнатной температуре. В реакционную жидкость добавляли воду (1,5 мл) и осуществляли экстракцию с использованием хлороформа (2 мл). Растворитель упаривали при пониженном давлении, затем растворяли в этаноле (1 мл). Добавляли 4 М раствор хлористый водород/этилацетат (0,5 мл), затем перемешивали в течение ночи при комнатной температуре и растворитель упаривали при пониженном давлении. Полученный остаток очищали с помощью ВЭЖХ (0,1% раствор водная муравьиная кислота/метанол), получая, таким образом,N-циклопропил-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)-2'-(трифторфенил)бифенил-4 карбоксамид (1,1 мг). Пример 19. Смесь 4-(1,3-бензодиоксол-5-ил)бензойной кислоты (8,0 мг), гидрохлорида трет-бутил-5(циклопропиламино)-4,5,6,7-тетрагидро-2 Н-индазол-2-карбоксилата (9,4 мг), О-(7-азабензотриазол-1-ил)N,N,N',N'-тетраметилуроний гексафторфосфат (11,4 мг), диизопропилэтиламина (16 мкл) и ДМФ (1 мл) перемешивали в течение ночи при температуре 80C. После охлаждения до комнатной температуры в реакционную жидкость добавляли воду (1,5 мл), затем экстрагировали хлороформом (2 мл). Растворитель упаривали при пониженном давлении и полученный продукт растворяли в этаноле (1 мл). Добавляли 4 М раствор хлористый водород/этилацетат (0,5 мл), затем перемешивали в течение ночи при комнатной температуре и растворитель упаривали при пониженном давлении. Полученный остаток очищали с помощью ВЗЖХ (0,1% раствор водная муравьиная кислота/метанол), получая, таким образом,4-(1,3-бензодиоксол-5-ил)-N-циклопропил-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамид (3,8 мг). Пример 20. К раствору N-циклопропил-1-(2-метоксиэтил)-N-(4,5,6,7-тетрагидро-1 Н-индаэол-5-ил)-1 Н-индол-4 карбоксамида (300 мг) в дихлорметане (3 мл) при охлаждении льдом добавляли по каплям трибромид бора (1 М раствор в ТГФ, 5,3 мл), затем перемешивали в течение 3 дней при комнатной температуре. После этого реакционную жидкость выливали в воду и слегка подщелачивали с использованием насыщенного водного раствора гидрокарбоната натрия, затем экстрагировали хлороформом и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле(метанол/хлороформ), получая, таким образом, N-циклопропил-1-(2-гидроксиэтил)-N-(4,5,6,7 тетрагидро-1 Н-индазол-5-ил)-1 Н-индол-4-карбоксамид (69 мг). Пример 21. К раствору моногидрохлорида N-циклопропил-4'-метокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5 ил)бифенил-4-карбоксамида (100 мг) в дихлорметане (2 мл) при охлаждении льдом добавляли по каплям трибромид бора (1 М раствор в ТГФ, 1,5 мл), затем перемешивали в течение 3 ч при комнатной температуре. После этого реакционную жидкость выливали в воду и слегка подщелачивали с использованием насыщенного водного раствора гидрокарбоната натрия, затем экстрагировали хлороформом и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/хлороформ), получая, таким образом, N-циклопропил-4'-гидрокси-N-(4,5,6,7 тетрагидро-1 Н-индазол-5-ил)бифенил-4-карбоксамид (88 мг). Пример 22. К раствору N-циклопропил-N-(2-метокси-5,6,7,8-тетрагидрохиназолин-6-ил)-1-метил-1 Н-индол-4 карбоксамида (79 мг) в дихлорметане (5 мл) при охлаждении льдом добавляли по каплям трибромид бора (1 М раствор в ТГФ, 0,63 мл), затем перемешивали в течение ночи при комнатной температуре. После этого реакционную жидкость выливали в воду и слегка подщелачивали с использованием насыщенного водного раствора гидрокарбоната натрия, затем экстрагировали хлороформом и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (метанол/хлороформ),получая,таким образом,N-циклопропил-1-метил-N-(2-оксо-1,2,5,6,7,8 гексагидрохиназолин-6-ил)-1 Н-индол-4-карбоксамид (23 мг). Пример 23. К раствору N-циклопропил-N-(1,4-диоксаспиро[4,5]дец-8-ил)-4-изопропоксибензамида (4,1 г) в ацетоне (33 мл) добавляли моногидрат п-тозил кислоты (434 мг) и воду (33 мл), затем перемешивали в течение 2 ч при температуре 70C, далее охлаждали до комнатной температуры, концентрировали при пониженном давлении, нейтрализовали с помощью насыщенного водного раствора гидрокарбоната натрия, экстрагировали этилацетатом, промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и концентрировали при пониженном давлении, получая, таким образом,N-циклопропил-4-изопропокси-N-(4-оксоциклогексил)бензамид(7,3 мл) и триэтиламин (7,3 мл) и легколетучие продукты упаривали дистилляцией при температуре 120C. Эту процедуру повторяли 5 раз. После этого к остатку добавляли этанол (19 мл) и добавляли гидразин моногидрат (1,67 г), затем перемешивали в течение ночи при комнатной температуре. После этого реакционную жидкость разбавляли водой и осуществляли экстракцию с использованием этилацетата. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния, затем концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (этилацетат), получая, таким образом, N-циклопропил-4 изопропокси-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бензамид (2 г). Пример 24. Раствор трет-бутил-5-(циклопропил[2'-(метоксикарбонил)бифенил-4-ил]карбониламино)-4,5,6,7 тетрагидро-2 Н-индазол-2-карбоксилата (200 мг) в ТГФ (1,5 мл) охлаждали ледяной водой в атмосфере газообразного аргона. Добавляли по каплям раствор тетрагидробората лития (17 мг) в ТГФ (1,5 мл), затем перемешивали в течение 4 ч при кипячении с обратным холодильником при температуре масляной бани 70C, охлаждали до комнатной температуры, разбавляли этилацетатом, промывали насыщенным солевым раствором, потом сушили и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (гексан/этилацетат), получая, таким образом,трет-бутил-5-(циклопропил[2'-(гидроксиметил)бифенил-4-ил]карбониламино)-4,5,6,7-тетрагидро-2 Ниндазол-2-карбоксилат (189 мг). К раствору полученного трет-бутил-5-(циклопропил[2'гидроксиметил)бифенил-4-ил]карбониламино)-4,5,6,7-тетрагидро-2 Н-икдазол-2-карбоксилата (85 мг) в дихлорметане (2 мл) добавляли трифторуксусную кислоту (199 мг), затем перемешивали в течение ночи при комнатной температуре, концентрировали при пониженном давлении, нейтрализовали с помощью насыщенного водного раствора гидрокарбоната натрия, экстрагировали хлороформом и очищали путем колоночной хроматографии на силикагеле (от 0 до 10%, метанол/хлороформ), получая, таким образом,N-циклопропил-2'-(гидроксиметил)-N-(4,5,6,7-тетрагидро-1 Н-индазол-5-ил)бифенил-4-карбоксамид(57 мг). Соединения по примерам 25-315, показанные в таблице, представленной далее, были получены таким же образом, как и в примерах 1-24. Структуры соединений по примерам показаны в табл. 93-152, а физико-химические данные и способы получения соединений показаны в табл. 153-161 соответственно. Таблица 5
МПК / Метки
МПК: A61K 31/4245, A61P 25/18, A61K 31/502, C07D 401/14, A61P 3/10, A61K 31/506, A61K 31/5377, A61P 25/04, A61P 3/04, C07D 405/14, A61P 43/00, A61K 31/517, A61K 31/497, A61K 31/4184, C07D 409/14, C07D 401/12, C07D 405/12, A61K 31/4192, A61P 19/10, A61K 31/437, A61P 25/28, A61P 3/06, C07D 471/04, C07D 413/12, C07D 403/14, C07D 409/12, C07D 231/56, A61K 31/416, A61P 25/24, C07D 403/12, A61P 27/06, A61K 31/4709, C07D 417/14, A61K 31/4439, A61K 31/501
Метки: соединение, гетероциклическое, бициклическое
Код ссылки
<a href="https://eas.patents.su/30-24846-biciklicheskoe-geterociklicheskoe-soedinenie.html" rel="bookmark" title="База патентов Евразийского Союза">Бициклическое гетероциклическое соединение</a>
Предыдущий патент: Замещенные хинолины и их применение в качестве лекарственных средств
Следующий патент: 4′-азидо,3′-фторзамещенные производные нуклеозидов в качестве ингибиторов репликации рнк вируса гепатита с
Случайный патент: Способ получения l-аргининовой соли периндоприла