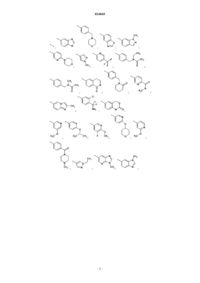
Замещенные хинолины и их применение в качестве лекарственных средств
Номер патента: 24845
Опубликовано: 31.10.2016
Авторы: Бишофф Даниель, Шэнцле Герхард, Даманн Георг, Хофманн Маттиас, Воллин Штефан Лудвиг Михаэль, Ист Стивен Питер, Маккарти Клайв, Конвер-Рейне Серж Гастон, Марлен Фредерик Жак, Клициц Ясна, Скотт Джон
Формула / Реферат
1. Соединение формулы 1
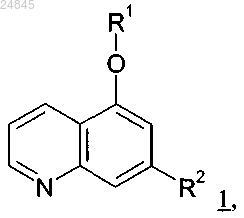
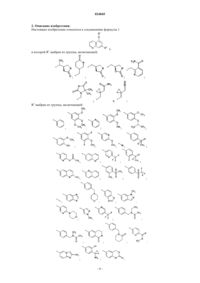
в которой R1 выбран из группы, включающей:
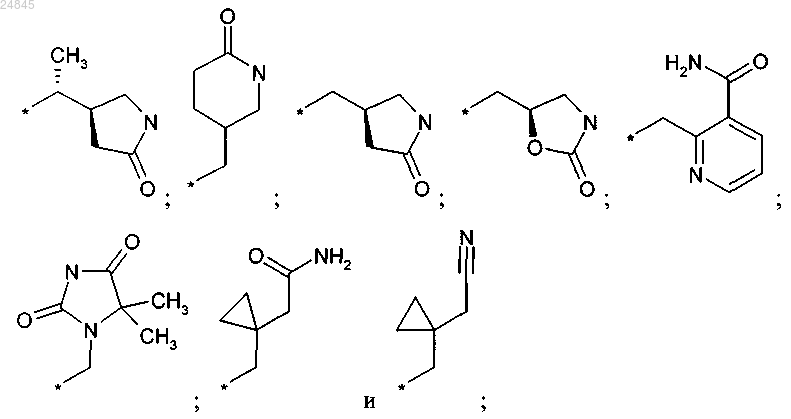
R2 выбран из группы, включающей:
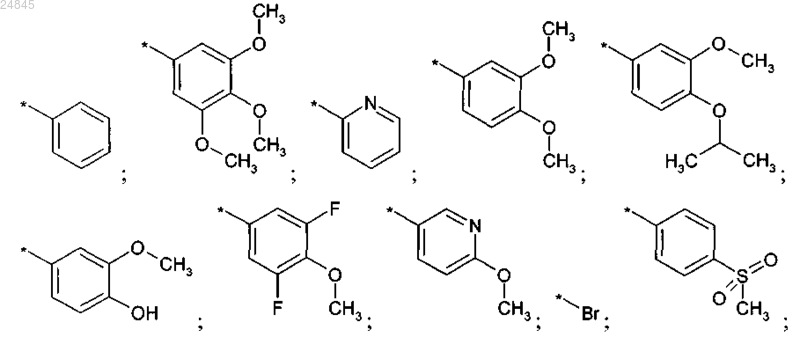

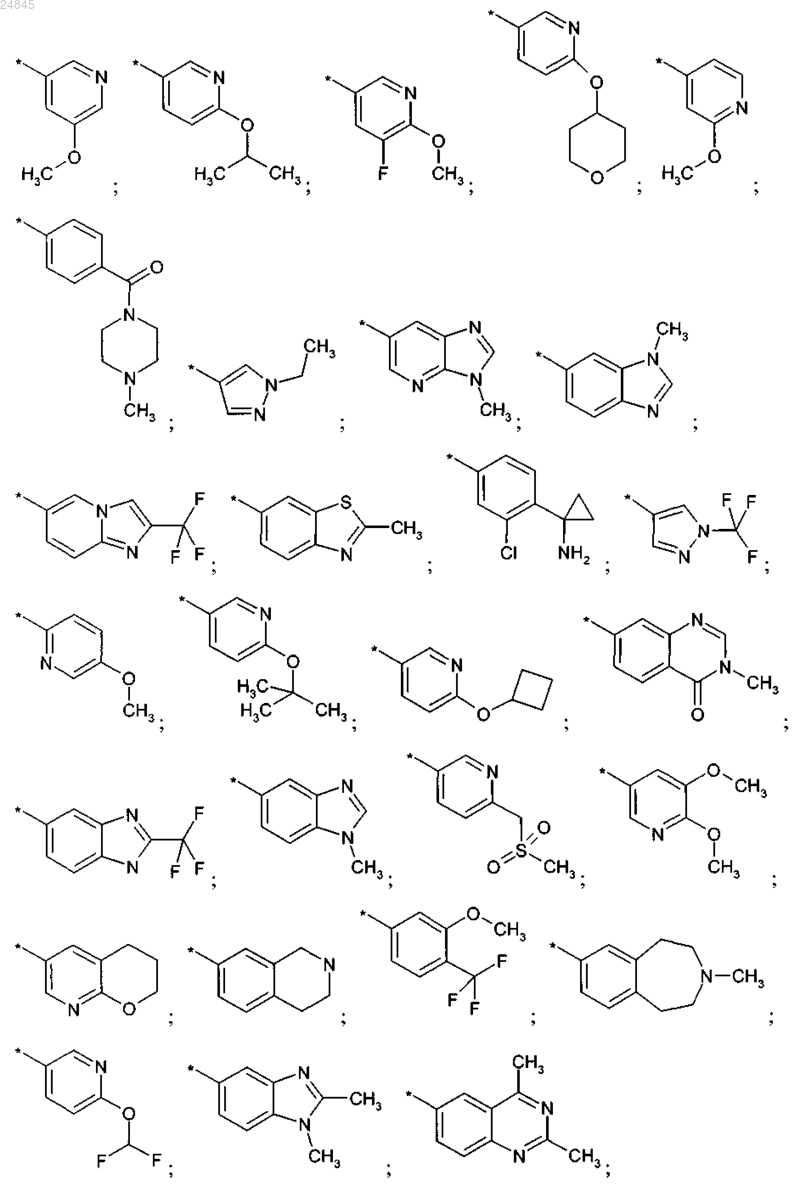
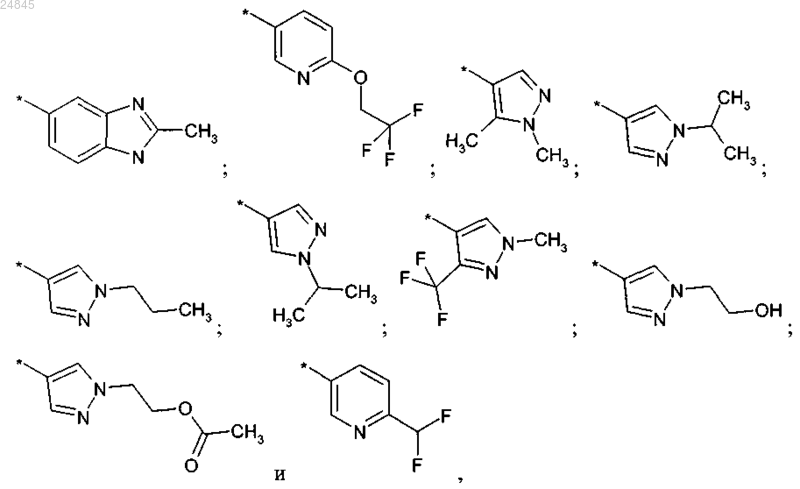
и фармакологически приемлемые соли указанных выше соединений.
2. Соединение формулы 1 по п.1, выбранное из группы, включающей:
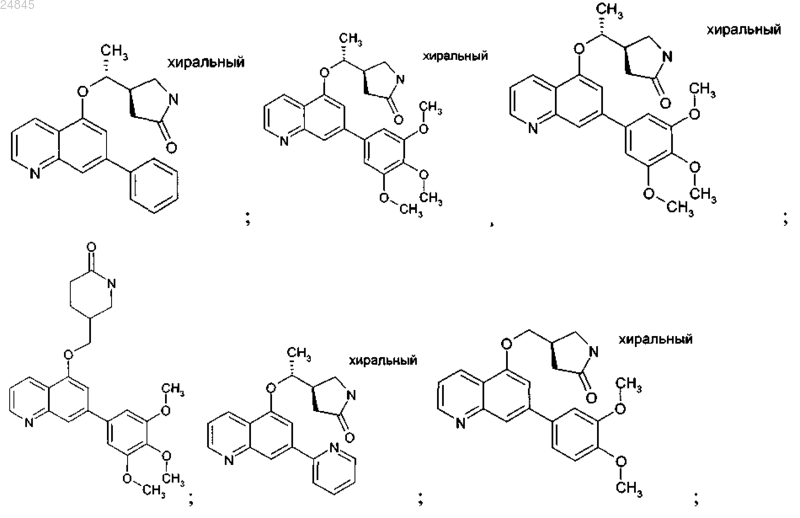

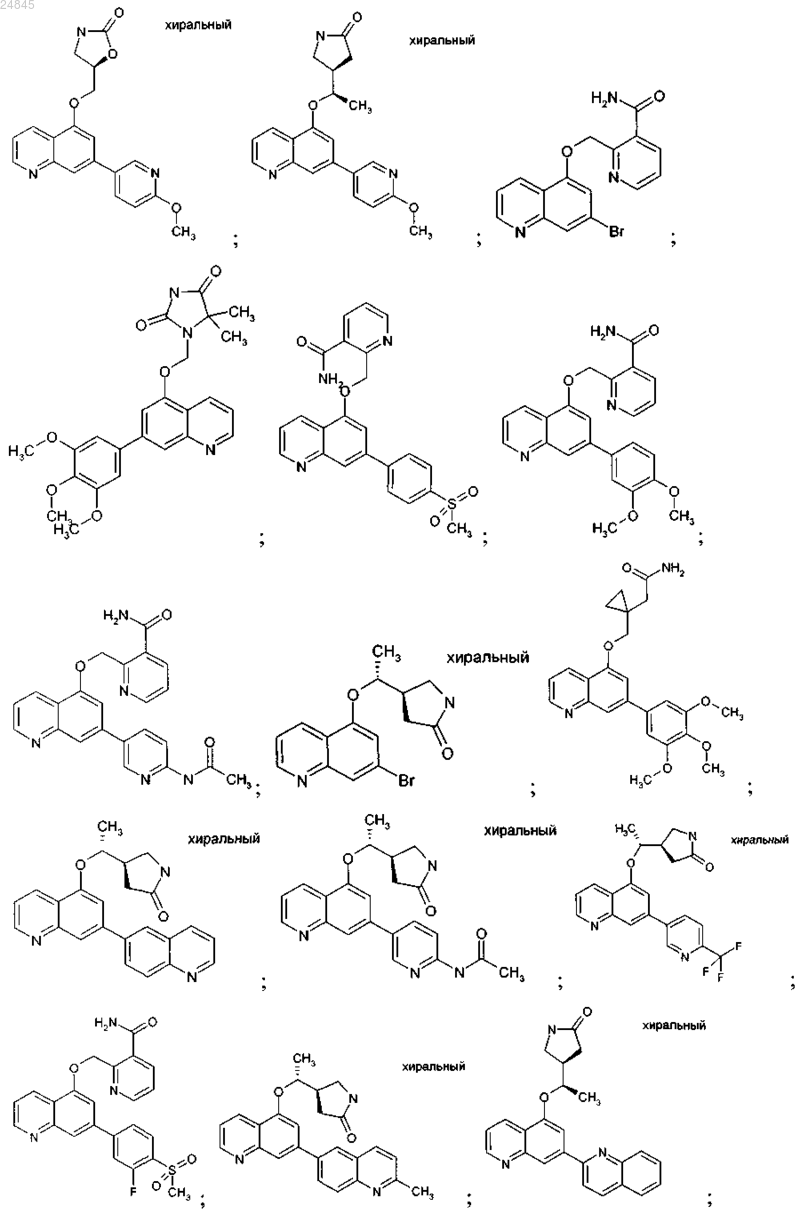
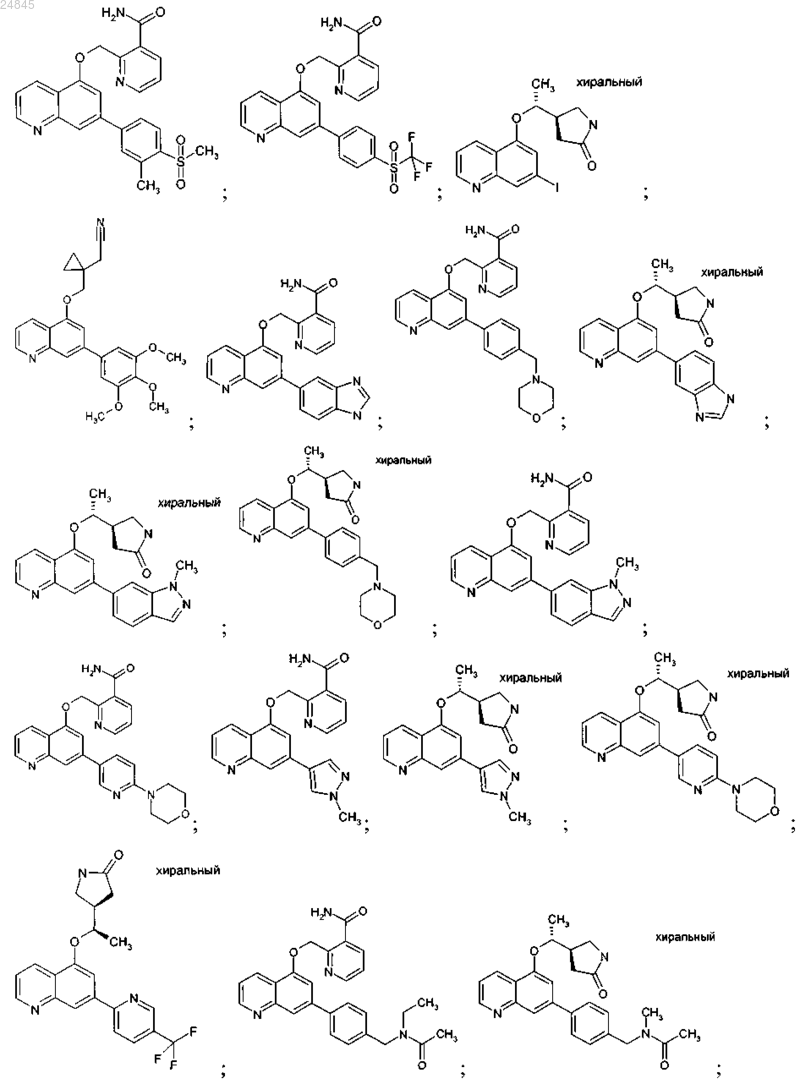
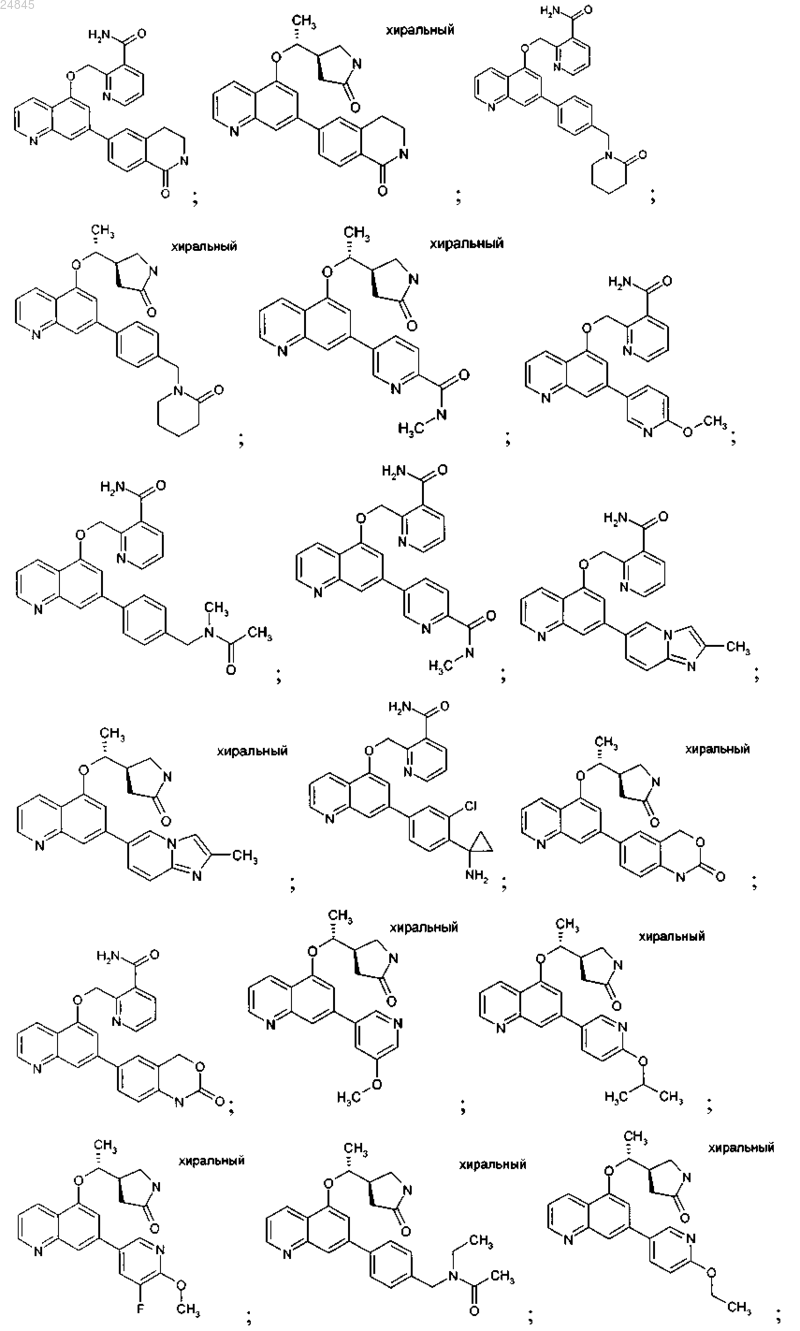
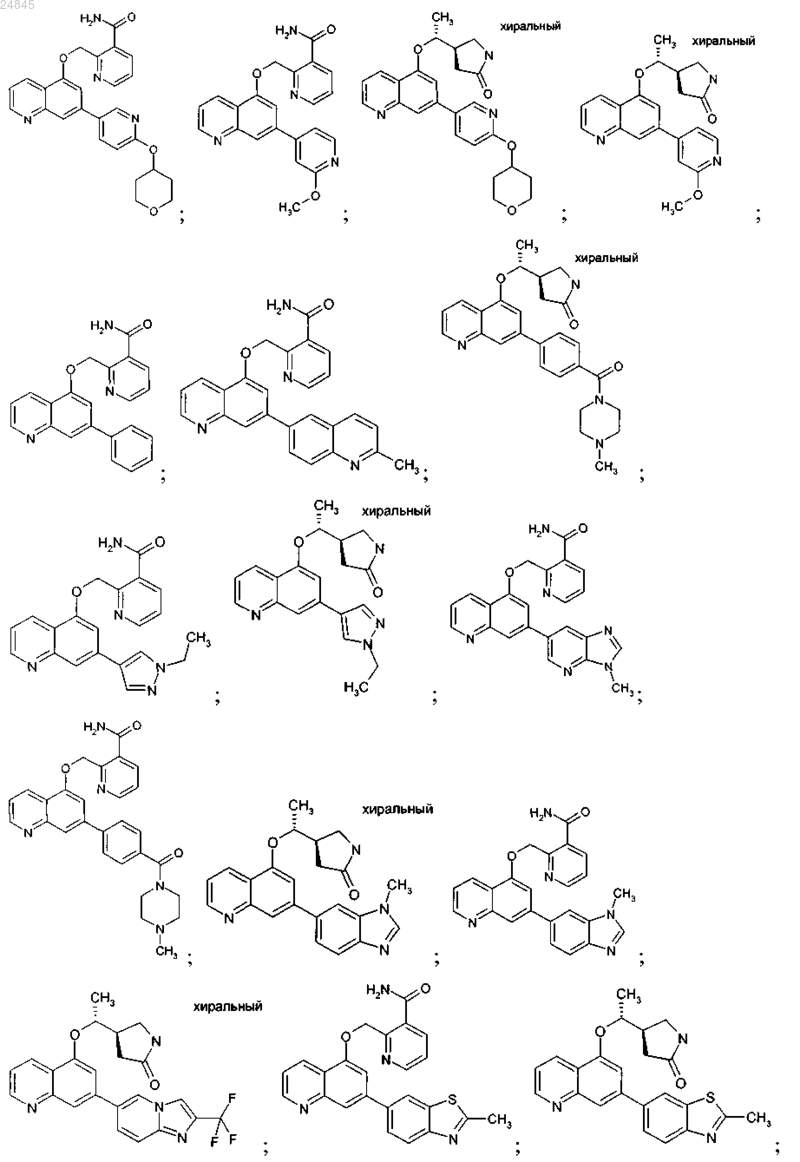
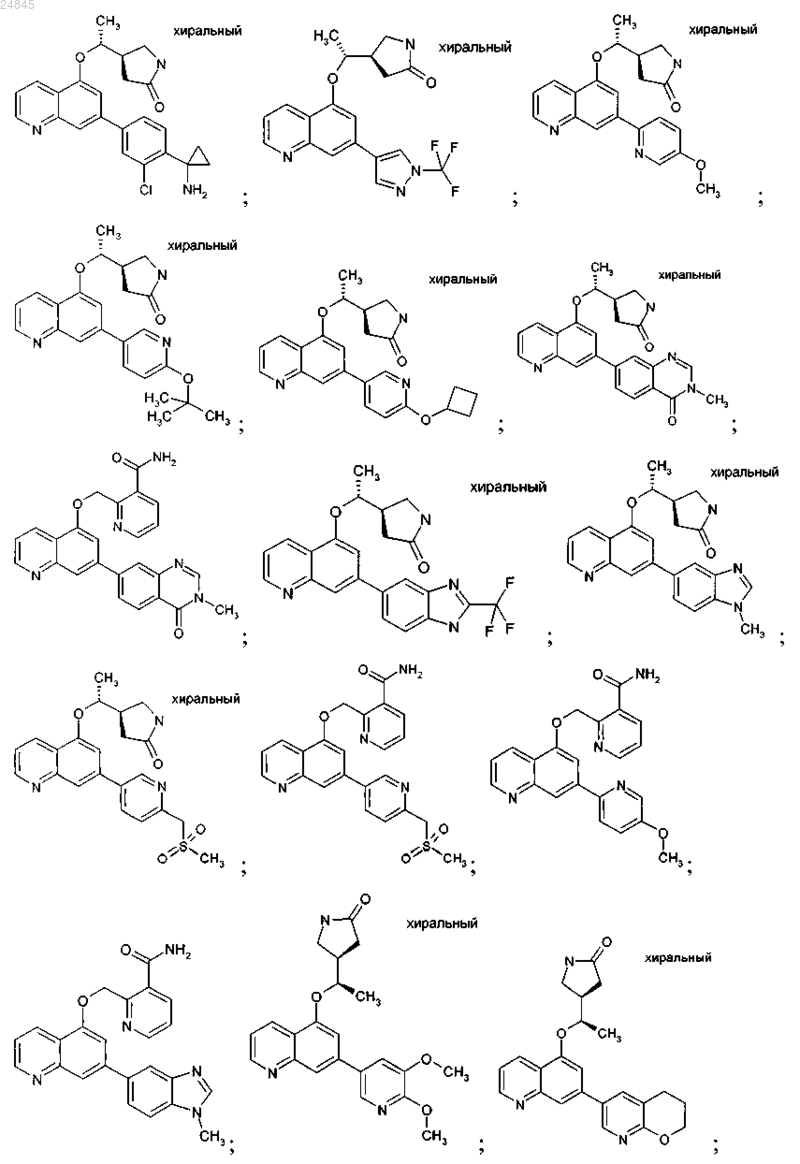
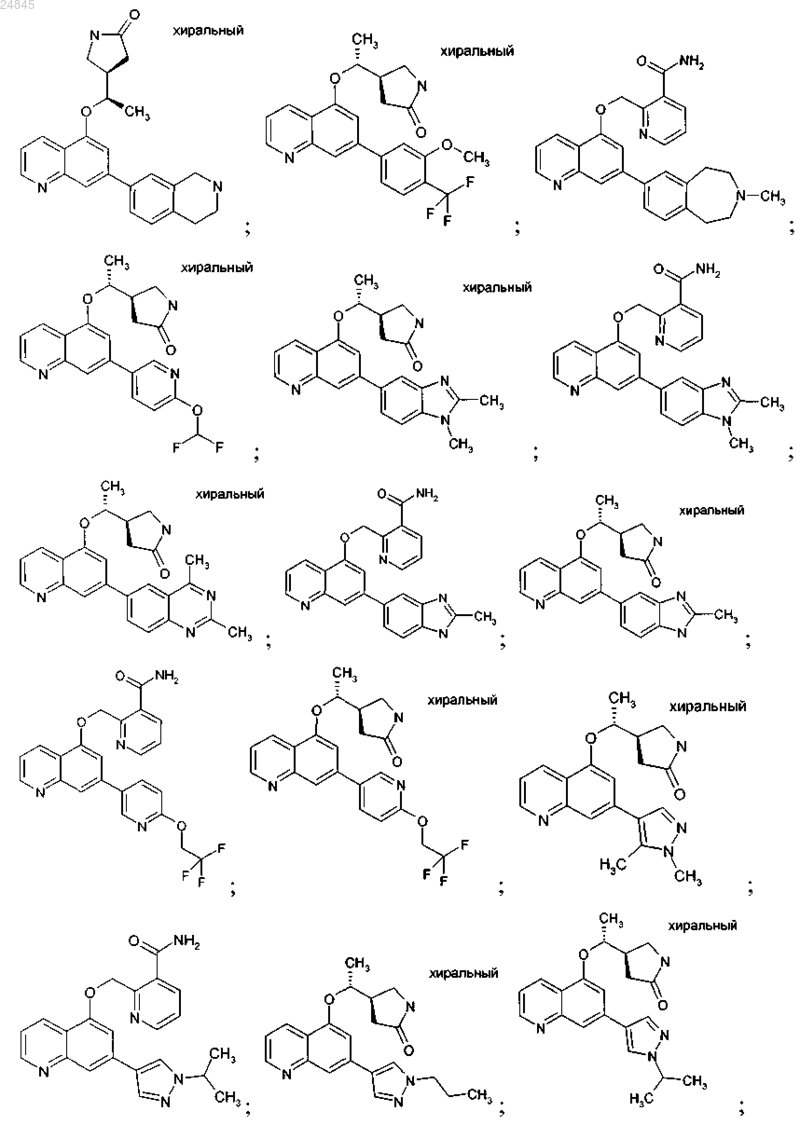

и фармакологически приемлемые соли указанных выше соединений.
3. Применение соединения по одному из пп.1, 2 для приготовления лекарственного средства, предназначенного для лечения заболевания, которое можно лечить путем ингибирования фермента SYK.
4. Применение соединения по одному из пп.1, 2 для приготовления лекарственного средства, предназначенного для лечения заболевания, выбранного из группы, включающей аллергический ринит, астму, ХОЗЛ, респираторный дистресс-синдром у взрослых, бронхит, легочную гипертензию, В-клеточную лимфому, дерматит и контактный дерматит, аллергический дерматит, аллергический риноконъюнктивит, ревматоидный артрит, антифосфолипидный синдром, болезнь Бергера, синдром Эванса, язвенный колит, аллергический гломерулонефрит, вызванный антителами, гранулоцитопению, синдром Гудпасчера, гепатит, пурпуру Шенлейна-Геноха, аллергический васкулит, иммунную гемолитическую анемию, аутоиммунную гемолитическую анемию, идиопатическую тромбоцитопеническую пурпуру, синдром Кавасаки, аллергический конъюнктивит, красную волчанку, лимфому из клеток зоны мантии, нейтропению, несемейный боковой склероз, болезнь Крона, рассеянный склероз, злокачественную миастению, остеопороз, остеолитические заболевания, остеопению, псориаз, синдром Шегрена, склеродермию, T-клеточную лимфому, уртикарию/ангионевротический отек, гранулематоз Вегенера, артериосклероз и целиакию.
5. Применение соединения по п.4, где заболевание выбрано из группы, включающей астму, ХОЗЛ, аллергический ринит, респираторный дистресс-синдром у взрослых, бронхит, аллергический дерматит, контактный дерматит, идиопатическую тромбоцитопеническую пурпуру, ревматоидный артрит, артериосклероз и аллергический риноконъюнктивит.
6. Применение соединения по одному из пп.4, 5, где заболевание выбрано из группы, включающей астму, ХОЗЛ, аллергический ринит, аллергический дерматит и ревматоидный артрит.
7. Фармацевтический препарат, отличающийся тем, что он содержат одно или большее количество соединений формулы 1 по меньшей мере по одному из пп.1 или 2.
8. Фармацевтический препарат, отличающийся тем, что он содержат одно или большее количество соединений формулы 1 по меньшей мере по одному из пп.1 или 2 в комбинации с активным веществом, выбранным из группы, включающей антихолинергетики, бета-миметики, кортикостероиды, ингибиторы PDE4, ингибиторы EGFR, антагонисты LTD4, ингибиторы CCR3, антагонисты CRTH2, антагонисты CCR1, НСПВС, ингибиторы СОХ 2 (коксибы), ингибиторы iNOS, ингибиторы HMG-CoA редуктазы и антагонисты фолиевой кислоты, такие как метотрексат.
9. Соединения, выбранные из числа описывающихся формулой В
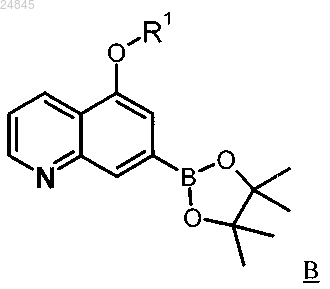
и описывающихся формулой C
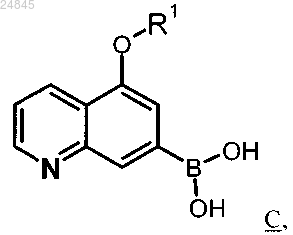
в которых R1 является таким, как определено в одном из пп.1 или 2.
Текст
Изобретение относится к новым замещенным хинолинам формулы 1 Хофманн Маттиас, Бишофф Даниель,Даманн Георг, Клициц Ясна, Шенцле Герхард, Воллин Штефан Лудвиг Михаэль (DE), Конвер-Рейне Серж Гастон, Ист Стивен Питер, Марлен Фредерик Жак, Маккарти Клайв,Скотт Джон (GB) Веселицкая И.А., Кузенкова Н.В.,Веселицкий М.Б., Каксис Р.А.,Белоусов Ю.В., Куликов А.В.,Кузнецова Е.В. (RU) в которой R1 и R2 определены в п.1 формулы изобретения, и их применению для приготовления лекарственных средств, предназначенных для лечения такого заболевания, как астма, ХОЗЛ,аллергический ринит, аллергический дерматит и ревматоидный артрит.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Настоящее изобретение относится к новым замещенным хинолинам формулы 1 и фармакологически приемлемым солям указанных выше соединений. 1. Предпосылки создания изобретения. 1.1. Ингибиторы SYK. Настоящее изобретение относится к новым замещенным хинолинам, которые ингибируют протеинкиназу Syk (тирозинкиназа селезенки), к их получению и к содержащим их препаратам и к их применению для приготовления лекарственного средства.Syk является внутриклеточной тирозинканазой, которая играет важную роль в качестве медиатора передачи сигналов различных рецепторов в B-клетках, мастоцитах, моноцитах, макрофагах, нейтрофилах, T-клетках, дендритных клетках и эпителиальных клетках. Рецепторы, в которых Syk играет важную роль в передаче сигналов, включают, например, рецепторы для IgE (FcRI) и IgG (FcR1) в мастоцитах и(ICAM1R) в эпителиальных клетках дыхательных путей, рецептор DAP12 в природных клеткахкиллерах, дендритных клетках и остеокластах, рецептор дектин-1 в субпопуляции хелперных T-клеток(клетки Th-17), а также интегриновые рецепторы для 1-, 2- и 3-интегринов в нейтрофилах, моноцитах и макрофагах (Wong et al.; Expert Opin. Investig. Drugs (2004), 13(7), 743-762; Ulanova et al.; Expert Opion.al.; Nature Immunology (2007), 8, 630-638; Slack et al., European J. Immunol. (2007), 37, 1600-1612). Наилучшим описанием являются молекулярные процессы в ходе передачи сигналов FcRI. В мастоцитах связывание IgE с FcRI приводит к сшивке рецепторов IgE и рекрутменту и активации Lyn (тирозинкиназа семейства Src). Активная Lyn фосфорилирует так называемые ITAM-мотивы (мотив активации им-3 024845 мунных рецепторов на основе тирозина), которые находятся во многих из перечисленных выше рецепторов, и, таким образом, создает центры связывания для SH2-домена Syk. В результате связывания сITAM-мотивом Syk активируется и затем фосфорилирует различные субстраты, которые необходимы для высвобождения медиаторов аллергии и воспаления, таких как, например, гистамин и-гексозаминидаза (НА), а также для синтеза липидных медиаторов, таких как, например, простагландины и лейкотриены. Вследствие ее центральной роли в различных путях передачи сигнала Syk рассматривали в качестве терапевтической мишени при различных заболеваниях, таких как, например, аллергический ринит, астма, аутоиммунные заболевания, ревматоидный артрит, остеопения, остеопороз, ХОЗЛ (хроническое обструктивное заболевание легких) и разные типы лейкозов и лимфом (Wong et al.; Expert Opin. Investig.Discovery Today (2010), Vol. 00 (0); 517-530; Efremov and Luarenti, Expert Opin Investig Drugs. (2011),20(5):623-36). Аллергический ринит и астма являются заболеваниями, связанными с аллергическими реакциями и воспалительными процессами, и в них участвуют клетки различных типов, такие как, например, мастоциты, эозинофилы, T-клетки и дендритные клетки. После воздействия аллергена активируются иммуноглобулиновые рецепторы, обладающие высоким сродством к IgE (FcRI) и IgG (FcR1), и они вызывают высвобождение провоспалительных медиаторов и бронхосуживающих средств. Таким образом, ингибитор активности киназы Syk должен ингибировать эти стадии. Ревматоидный артрит (РА) является аутоиммунным заболеванием, при котором прогрессирующе разрушается структура костей и связок, находящихся вокруг суставов. В патофизиологии РА существенную роль играют B-клетки, как это было показано, например, путем применения в терапии ритуксимаба,антител, элиминирующих B-клетки. В дополнение к ее роли в передаче сигналов BCR (который после стимулирования также индуцирует высвобождение провоспалительных медиаторов) Syk также играет важную роль в созревании и пролиферации В-клеток (Cheng et al. Nature (1995), 378, 303-306, Cornall etal., PNAS (2000), 97(4), 1713-1718). Таким образом, ингибитор активности киназы Syk может обеспечить возможность терапевтического лечения аутоиммунных заболеваний, таких как РА, и заболеваний, характеризующихся повышенным уровнем пролиферации В-клеток, таких как, например, В-клеточные лимфомы. Хроническое обструктивное заболевание легких (ХОЗЛ) характеризуется последовательным ухудшением функции легких и хроническим воспалением дыхательных путей, которое инициируется и поддерживается различными токсичными веществами и способствует развитию течения заболевания. На клеточном уровне при ХОЗЛ, в частности, происходит размножение Т-лимфоцитов, нейтрофилов, гранулоцитов и макрофагов. В частности, происходит увеличение количества CD8-позитивных лимфоцитов,что непосредственно связано с ухудшением функции легких. Другой характерной особенностью ХОЗЛ является острое ухудшение функции легких (обострение), характеризующееся наличием вирусной (например, Rhinovirus) или бактериальной (например, Streptococcus pneumoniae, Haemophilus influenzae иMoraxella catarrhalis) инфекцией. Вследствие прововоспалительного воздействия Syk в макрофагах, T-клетках и нейтрофилах, как описанного выше (см. публикацию: Wong et al.; Expert Opin. lnvestig. Drugs (2004), 13(7), 743-762 и цитированную в ней литературу), ингибитор активности киназы Syk может предоставить новый подход к лечению воспалительных процессов, лежащих в основе ХОЗЛ. Также было показано, что в эпителиальных клетках дыхательных путей Syk участвует в опосредуемом с помощью ICAM1R проникновении и последующей репликации риновируса и что siPHK (малые интерферирующие РНК) против Syk блокируют эти стадии (Wang et al.; J. Immunol. (2006), 177, 6859-6870; Lau et al.; J. Immunol. (2008), 180, 870-880). Таким образом, ингибитор активности киназы Syk также можно использовать для лечения обострений, вызванных риновирусами. Данные различных исследований указывают на то, что Syk участвует в злокачественном перерождении лимфоцитов (данные обобщены в публикации Sigh and Masuda. Annual Reports in MedicinalSyk, трансформирует B-клетки пациента, страдающего миелодиспластическим синдромом, обладающий конститутивной активностью белок слияния ITK-Syk выделяли из клеток пациентов, страдающих периферической T-клеточной лимфомой (ПТКЛ). Кроме того, конститутивно активная Syk обнаружена в клетках пациентов, страдающих В-клеточной лимфомой, в особенности острым лимфобластным лейкозом В-клеточной линии (В-ОЛЛ), фолликулярной лимфомой (ФЛ), диффузной крупноклеточной Вклеточной лимфомой (ДК-В-КЛ), лимфомами из клеток зоны мантии и В-клеточными неходжкинскими лимфомами (НХЛ), а также острым миелолейкозом (ОМЛ). На основании этих данных можно предположить, что Syk является протоонкогеном в гематопоэтических клетках и возможной мишенью при лечении некоторых лейкозов и лимфом. Идиопатическая тромбоцитопеническая пурпура (ИТП) является аутоиммунным заболеванием, при котором в тромбоцитах присутствуют аутоиммунные антитела IgG против антигенов, которые связываются с тромбоцитами и разрушают их. Пациенты, страдающие ИТП, обладают повышенной скоростью циркуляции покрытых с помощью IgG тромбоцитов посредством макрофагов в селезенку и печень. Предполагают, что вследствие провоспалительной опосредуемой с помощью FcR функции Syk в макрофагах ингибитор Syk обладает полезным лечебным воздействием при опосредуемых с помощью FcR цитопений, таких как ИТП. Действительно, по данным открытого одноцентрового исследования ингибитор Syk R788 (R406) увеличивает количество тромбоцитов у пациентов, страдающих ИТП (Podolanczuket al.; Blood (2009), 113,3154-3169). Буллезный пемфигоид (Ujiie et al. Journal of Dermatology 2010; 37:194-204) является хроническим аутоиммунным, субэпидермальным, сопровождающимся появпением волдырей заболеванием кожи, которое иногда затрагивает слизистые оболочки. Буллезный пемфигоид характеризуется присутствием аутоиммунных антител, иммуноглобулина G (IgG), специфичных по отношению к антигенам гемидесмосомального буллезного пемфигоида ВР 230 (BPAg1) и ВР 180 (BPAg2). Обыкновенная пузырчатка(Venugopal et al. Dermatol. Clin. 2011; 29:373-80) является хроническим сопровождающимся появлением волдырей заболеванием кожи, при котором повреждения кожи редко сопровождаются зудом, но часто являются болезненными. Обыкновенная пузырчатка является аутоиммунным заболеванием, вызванным аутоиммунными антителами IgG, которые действуют на десмоглеин 1 и десмоглеин 3, что приводит к нарушению связывания кератиноцитов друг с другом в эпидермисе. Оно характеризуется образованием большого количества мягких волдырей и эрозией слизистой оболочки и кожи. При обоих заболеваниях аутоиммунные антитела IgG связываются с рецептором Fc-гамма (FcRg) и активируют FcRg и передачу сигналов в прямом направлении посредством киназы Syk. Таким образом, ингибитор активности киназыSyk, который блокирует передачу сигналов FcRg в прямом направлении, можно использовать терапевтически для лечения пациентов, страдающих буллезным пемфигоидом и обыкновенной пузырчаткой. Системная красная волчанка (СКВ) является хроническим аутоиммунным заболеванием, которое, в принципе, может поразить любой орган организма. Оно характеризуется мультисистемным воспалением мелких сосудов и присутствием аутоиммунных антител. Мыши с дефицитом FcR обладают иммунитетом к некоторым типам СКВ в доклинических моделях, связанных с этим заболеванием, и это указывает на то, что ингибитор Syk может обладать полезным лечебным воздействием при СКВ вследствие провоспалительной опосредуемой с помощью FcR функции Syk в различных клетках. 1.2. Уровень техники. В патентах US3928367, 4017500, 4115395 и 4260759 описаны 5-амино-1,6-нафтиридины, обладающие фунгицидной и антибактериальной активностью. В WO 99/18077 описаны 5-пиперазинил-1,6 нафтиридины в качестве антагонистов серотонина. В патенте US7321041 описаны замещенные 1,6-нафтиридины в качестве ингибиторов SYK, хотя эти 1,6-нафтиридины обладают совершенно другой схемой замещения по сравнению с соединениями, предлагаемыми в настоящем изобретении. В РСТ/ЕР 1011050871 раскрыты 1,6-нафтиридины, которые замещены в положениях 5 и 7. В отличие от указанных публикаций настоящее изобретение относится к 5,7-дизамещенным хинолинам, а не к нафтиридинам. В WO 2006/038041 раскрыты хинолины, которые замещены в положениях 5 и 7, однако они обладают совершенно другой схемой замещения, в особенности в положении 7, по сравнению с хинолинами формулы 1, предлагаемыми в настоящем изобретении. Согласно изобретению неожиданно было установлено, что хинолины формулы 1 являются особенно подходящими для лечения воспалительных заболеваний, аллергических заболеваний, остеопороза,желудочно-кишечных заболеваний, аутоиммунных заболеваний, воспалительных заболеваний и заболеваний периферической или центральной нервной системы, предпочтительно для лечения астмы, аллергического ринита, ревматоидного артрита, аллергического дерматита и ХОЗЛ. 2. Описание изобретения. Настоящее изобретение относится к соединениям формулы 1 и фармакологически приемлемым солям указанных выше соединений. В другом особенно предпочтительном варианте осуществления настоящее изобретение относится к указанным выше соединениям формулы 1, выбранным из группы, включающей: и фармакологически приемлемым солям указанных выше соединений. В другом варианте осуществления настоящее изобретение относится к применению указанных выше соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения заболевания, которое можно лечить путем ингибирования фермента SYK. В предпочтительном варианте осуществления настоящее изобретение относится к применению указанных выше соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения заболевания, выбранного из группы, включающей аллергический ринит, астму, ХОЗЛ, респираторный дистресс-синдром у взрослых, бронхит, В-клеточную лимфому, дерматит и контактный дерматит, аллергический дерматит, аллергический риноконъюнктивит, ревматоидный артрит, антифосфолипидный синдром, болезнь Бергера, синдром Эванса, язвенный колит, аллергический гломерулонефрит,вызванный антителами, гранулоцитопению, синдром Гудпасчера, гепатит, пурпуру Шенлейна-Геноха,аллергический васкулит, иммунную гемолитическую анемию, аутоиммунную гемолитическую анемию,идиопатическую тромбоцитопеническую пурпуру, синдром Кавасаки, аллергический конъюнктивит,красную волчанку, лимфому из клеток зоны мантии, нейтропению, несемейный боковой склероз, болезнь Крона, рассеянный склероз, злокачественную миастению, остеопороз, остеолитические заболевания, остеопению, псориаз, синдром Шегрена, склеродермию, T-клеточную лимфому, уртикарию/ангионевротический отек, гранулематоз Вегенера и целиакию. В другом предпочтительном варианте осуществления настоящее изобретение относится к применению указанных выше соединений формулы 1 для приготовления лекарственного средства, предназна- 14024845 ченного для лечения заболевания, выбранного из группы, включающей астму, ХОЗЛ, аллергический ринит, респираторный дистресс-синдром у взрослых, бронхит, аллергический дерматит, контактный дерматит, идиопатическую тромбоцитопеническую пурпуру, ревматоидный артрит и аллергический риноконъюнктивит. В особенно предпочтительном варианте осуществления настоящее изобретение относится к применению указанных выше соединений формулы 1 для приготовления лекарственного средства, предназначенного для лечения заболевания, выбранного из группы, включающей астму, ХОЗЛ, аллергический риниг, аллергический дерматит и ревматоидный артрит. Настоящее изобретение также относится к фармацевтическим препаратам, отличающимся тем, что они содержат одно или большее количество соединений формулы 1. В другом варианте осуществления настоящее изобретение относится к фармацевтическому препарату, отличающемуся тем, что он содержит одно или большее количество соединений формулы 1 в комбинации с активным веществом, выбранным из группы, включающей антихолинергетики, бетамиметики, кортикостероиды, ингибиторы PDE4, ингибиторы EGFR, антагонисты LTD4, ингибиторыiNOS, ингибиторы HMG-CoA редуктазы и антагонисты фолиевой кислоты, такие как метотрексат. В другом варианте осуществления настоящее изобретение относится к соединениям, выбранным из формулы В в которых R1 определен так, как указано выше. 3. Использующиеся термины и определения. Если не указано иное, все заместители не зависят друг от друга. Если, например, может быть несколько C1-C6-алкильных групп в качестве заместителей одной группы, то в случае трех заместителей,например, C1-C6-алкилы независимо друг от друга могут представлять собой метил, н-пропил и третбутил. В объеме настоящего описания в определениях возможных заместителей они также могут быть приведены в виде структурной формулы. Звездочкав структурной формуле заместителя означает положение присоединения к остальной части молекулы. Кроме того, атом заместителя, расположенный после положения присоединения, означает атом в положении 1. Так, например, группы N-пиперидинил Если в структурной формуле заместителя звездочкаотсутствует, то каждый атом водорода может быть удален из заместителя и образовавшаяся таким образом свободная валентность может использоваться для присоединения к остальной части молекулы. Так, например,может означать 2-толил,3-толил, 4-толил и бензил. Альтернативно знаку , в объеме настоящего изобретения X1 также означает положение присоединения группы R1 к структуре формулы 1 и Х 2 означает положение присоединения группы R2 к структуре формулы 1. Термин "C1-C6-алкил" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, и термин "C1-C3-алкил" означает разветвленные и неразветвленные алкильные группы, содержащие от 1 до 3 атомов углерода."C1-C4-Алкил" соответственно означает разветвленные и неразветвленные алкильные группы, содержащие от 1 до 4 атомов углерода. Алкильные группы, содержащие от 1 до 4 атомов углерода, являются предпочтительными. Примеры таких групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил или гексил. Для указанных выше групп также необязательно могут использоваться аббревиатуры Me, Et, n-Pr, i-Pr, n-Bu, i-Bu, t-Bu и т.п. Если не указано иное, то определения пропила, бутила, пентила и гексила включают все возможные изомерные формы указанных групп. Так, например, пропил включает н-пропил и изопропил, бутил включает изобутил, втор-бутил и трет-бутил и т.п. Термин "C1-C6-алкилен" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкиленовые группы, содержащие от 1 до 5 атомов углерода, и термин "C1-C4-алкилен" означает разветвленные и неразветвленные алкиленовые группы, содержащие от 1 до 4 атомов углерода. Алкиленовые группы, содержащие от 1 до 4 атомов углерода, являются предпочтительными. Примеры таких групп включают метилен, этилен, пропилен, 1-метилэтилен, бутилен, 1-метилпропилен,1,1-диметилэтилен, 1,2-диметилэтилен, пентилен, 1,1-диметилпропилен, 2,2-диметилпропилен,1,2-диметилпропилен, 1,3-диметилпропилен или гексилен. Если не указано иное, определения пропилена, бутилена, пентилена и гексилена включают все возможные изомерные формы указанных групп с таким же количеством атомов углерода. Так, например, пропилен также включает 1-метилэтилен и бутилен включает 1-метилпропилен, 1,1-диметилэтилен, 1,2-диметилэтилен. Если углеродная цепь замещена группой, которая вместе с одним или двумя атомами углерода алкиленовой цепи образует карбоциклическое кольцо, содержащее 3, 5 или 6 атомов углерода, то она включает, в частности, следующие примеры колец: Термин "C2-C6-алкенил" (включая являющиеся частями других гругп) означает разветвленные и неразветвленные алкенильные группы, содержащие от 2 до 6 атомов углерода, и термин "C2-C4-алкенил" означает разветвленные и неразветвленные алкенильные группы, содержащие от 2 до 4 атомов углерода,при условии, что они содержат по меньшей мере одну двойную связь. Алкенильные группы, содержащие от 2 до 4 атомов углерода, являются предпочтительными. Примеры включают этинил или винил, пропенил, бутенил, пентенил или гексенил. Если не указано иное, определения пропенила, бутенила, пентенила и гексенила включают все возможные изомерные формы указанных групп. Так, например, пропенил включает 1-пропенил и 2-пропенил, бутенил включает 1-, 2- и 3-бутенил, 1-метил-1-пропенил, 1-метил-2 пропенил и т.п. Термин "C2-C6-алкенилен" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкениленовые группы, содержащие от 2 до 6 атомов углерода, и термин"C2-C4-алкенилен" означает разветвленные и неразветвленные алкиленовые группы, содержащие от 2 до 4 атомов углерода. Алкиленовые группы, содержащие от 2 до 4 атомов углерода, являются предпочтительными. Примеры таких групп включают этенилен, пропенилен, 1-метилэтенилен, бутенилен,1-метилпропенилен, 1,1-диметилэтенилен., 1,2-диметилэтенилен, пентенилен, 1,1-диметилпропенилен,2,2-диметилпропенилен, 1,2-диметилпропенилен, 1,3-диметилпропенилен или гексенилен. Если не указано иное, определения иропенилена, бутенилена, пентенилена и гексенилена включают все возможные изомерные формы указанных групп, содержащих такое же количество атомов углерода. Так, например,пропенил также включает 1-метилэтенилен и бутенилен включает 1-метилпропенилен,1,1-диметилэтенилен, 1,2-диметилэтенилен. Термин "C2-C6-алкинил" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкинильные группы, содержащие от 2 до 6 атомов углерода, и термин "C2-C4-алкинил" означает разветвленные и неразветвленные алкинильные группы, содержащие от 2 до 4 атомов углерода,при условии, что они содержат по меньшей мере одну тройную связь. Алкинильные группы, содержащие от 2 до 4 атомов углерода, являются предпочтительными. Примеры включают этинил, пропинил, бутинил, пентинил или гексинил. Если не указано иное, определения пропинила, бутинила, пентинила и гексинила включают все возможные изомерные формы указанных групп. Так, например, пропинил включает 1-пропинил и 2-пропинил, бутинил включает 1-, 2- и 3-бутинил, 1-метил-1-пропинил, 1-метил-2 пропинил и т.п. Термин "C2-C6-алкинилен" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкиниленовые группы, содержащие от 2 до 6 атомов углерода, и термин"C2-C4-алкинилен" означает разветвленные и неразветвленные алкиленовые группы, содержащие от 2 до 4 атомов углерода. Алкиленовые группы, содержащие от 2 до 4 атомов углерода, являются предпочтительными. Примеры включают этинилен, пропинилен, 1-метилэтинилен, бутинилен, 1-метилпропинилен,1,1-диметилэтинилен, 1,2-диметилэтинилен, пентинилен, 1,1-диметилпропинилен, 2,2-диметилпропинилен, 1,2-диметилпропинилен, 1,3-диметилпропинилен или гексинилен. Если не указано иное, определения пропинилена, бутинилена, пентинилена и гексинилена включают все возможные изомерные формы указанных групп, содержащих такое же количество атомов углерода. Так, например, пропинил также включает 1-метилэтинилен и бутинилен включает 1-метилпропинилен, 1,1-диметилэтинилен,1,2-диметилэтинилен. Термин "арил" (включая являющиеся частями других групп) означает ароматические кольцевые системы, содержащие от 6 до 10 атомов углерода. Примеры включают фенил или нафтил, предпочтительной арильной группой является фенил. Если не указано иное, то ароматические группы могут быть замещены одной или большим количеством групп, выбранных из группы, включающей метил, этил, изопропил, трет-бутил, гидроксигруппу, фтор, хлор, бром и йод. Термин "арил-C1-C6-алкилен" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкиленовые группы, содержащие от 1 до 6 атомов углерода, которые замещены ароматической кольцевой системой, содержащей от 6 до 10 атомов углерода. Примеры включают бензил, 1 или 2-фенилэтил или 1- или 2-нафтилэтил. Если не указано иное, то ароматические группы могут быть замещены одной или большим количеством групп, выбранных из группы, включающей метил, этил, изопропил, трет-бутил, гидроксигруппу, фтор, хлор, бром и йод. Хотя уже и включенный в термин "арил-C1-C6-алкилен", термин "гетероарил-C1-C6-алкилен" (включая такие фрагменты, являющиеся частями других групп) означает разветвленные и неразветвленные алкиленовые группы, содержащие от 1 до 6 атомов углерода, которые замещены гетероарилом. Гетероарил такого типа включает 5- или 6-членные гетероциклические ароматические группы или 5-10-членные бициклические гетероарильиые кольца, которые могут содержать 1, 2, 3 или 4 гетероатома,выбранных из группы, включающей кислород, серу и азот, и содержат количество сопряженных двойных связей, достаточное для образования ароматической системы. Ниже приведены примеры 5- или 6-членных гетероциклических ароматических групп или бициклических гетероарильных колец: Если не указано иное, то эти гетероарилы могут быть замещены одной или большим количеством групп, выбранных из группы, включающей метил, этил, изопропил, трет-бутил, гидроксигруппу, фтор,хлор, бром и йод. Ниже приведены примеры гетероарил-C1-C6-алкиленов: Термин "C1-C6-галогеналкил" (включая являющиеся частями других групп) означает разветвленные и неразветвленные алкильные группы, содержащие от 1 до 6 атомов углерода, которые замещены одним или большим количеством атомов галогенов. Термин "C1-C4-алкил" означает разветвленные и неразветвленные алкильные группы, содержащие от 1 до 4 атомов углерода, которые замещены одним или большим количеством атомов галогенов. Алкильные группы, содержащие от 1 до 4 атомов углерода, являются предпочтительными. Примеры включают CF3, CHF2, CH2F, CH2CF3. Термин "C3-C7-циклоалкил" (включая являющиеся частями других групп) означает циклические алкильные группы, содержащие от 3 до 7 атомов углерода. Примеры включают циклопропил, циклобутил,циклопентил, циклогексил или циклогептил. Если не указано иное, то циклические алкильные группы могут быть замещены одной или большим количеством групп, выбранных из группы, включающей метил, этил, изопропил, трет-бутил, гидроксигруппу, фтор, хлор, бром и йод. Термин "C3-C10-циклоалкил" также означает моноциклические алкильные группы, содержащие от 3 до 7 атомов углерода, и также бициклические алкильные группы, содержащие от 7 до 10 атомов углерода, или моноциклические алкильные группы, которые содержат по меньшей мере один C1-C3-углеродный мостик. Термин "гетероциклические кольца" или "гетероциклы" означает, если не указано иное, 5-, 6- или 7-членные насыщенные, частично насыщенные или ненасыщенные гетероциклические кольца, которые могут содержать 1, 2 или 3 гетероатома, выбранных из группы, включающей кислород, серу и азот, и одновременно это кольцо может быть связано с молекулой через атом углерода или, если он имеется,через атом азота. Хотя и включенный в термин "гетероциклические кольца" или "гетероциклы", термин"частично насыщенная гетероциклическая группа" означает 5-, 6- или 7-членные частично насыщенные кольца, которые содержат одну или две двойные связи, при этом содержится такое количество двойных связей, что не образуется ароматическая система. Примеры включают: Хотя и включенный в термин "гетероциклические кольца" или "гетероциклы", термин "гетероциклические ароматические кольца", "ненасыщенная гетероциклическая группа" или "гетероарил" означает 5- или 6-членные гетероциклические ароматические группы или 5-10-членные бициклические гетероарильные кольца, которые могут содержать 1, 2, 3 или 4 гетероатома, выбранных из группы, включающей кислород, серу и азот, и содержат количество сопряженных двойных связей, достаточное для образования ароматической системы. Примеры 5- или 6-членных гетероциклических ароматических групп включают: Если не указано иное, то гетероциклическое кольцо (или гетероцикл) может содержать кетогруппу. Примеры включают: Хотя и включенный в термин "гетероцикл", термин "бициклические гетероциклы" обычно обозначает 8-, 9- или 10-членные бициклические кольца, которые могут содержать один или большее количество гетероатомов, предпочтительно 1-4, более предпочтительно 1-3, еще более предпочтительно 1, 2, особенно предпочтительно 1 гетероатом, выбранный из группы, включающей кислород, серу и азот. Это кольцо может быть связано с молекулой через атом углерода или, если он имеется, через атом азота. Приведенные ниже указаны в качестве примера. Примеры включают: Хотя и включенный в термин "арил", термин "бициклический арил" означает 5-10-членное бициклическое арильное кольцо, которое содержит количество сопряженных двойных связей, достаточное для образования ароматической системы. Одним примером бициклического арила является нафтил. Хотя и включенный в термин "гетероарил", термин "бициклический гетероарил" означает 5-10-членное бициклическое гетероарильное кольцо, которое может содержать 1, 2, 3 или 4 гетероатома,выбранных из группы, включающей кислород, серу и азот, и содержит количество сопряженных двойных связей, достаточное для образования ароматической системы. Хотя и включенный в термин "бициклические циклоалкилы" или "бициклический арил", термин"конденсированный циклоалкил" или "конденсированный арил" означает бициклические кольца, в которых мостиком, разделяющим кольца, является непосредственная ординарная связь. Ниже приведены примеры конденсированных бициклических циклоалкилов: Хотя и включенный в термин "бициклические гетероциклы" или "бициклические гетероарилы",термин "конденсированные бициклические гетероциклы" или "конденсированные бициклические гетероарилы" означает бициклические 5-10-членные гетероциклы, которые содержат 1, 2, 3 или 4 гетероатома, выбранных из группы, включающей кислород, серу и азот, а которых мостиком, разделяющим кольца, является непосредственная ординарная связь. "Конденсированные бициклические гетероарилы" также содержат количество сопряженных двойных связей, достаточное для образования ароматической системы. Примеры включают пирролизин, индол, индолизин, изоиндол, индазол, пурин, хинолин, изохинолин, бензимидазол, бензофуран, бензопиран, бензотиазол, бензотиазол, бензоизотиазол, пиридопиримидин, птеридин, пиримидопиримидин: Термин "спирановая группа" (спиро) означает 5-10-членные спироциклические кольца, которые необязательно могут содержать 1, 2 или 3 гетероатома, выбранных из группы, включающей кислород, серу и азот, и одновременно это кольцо может быть связано с молекулой через атом углерода или, если он имеется, через атом азота. Если не указано иное, то спироциклическое кольцо может содержать оксогруппу, метильную или этильную группу. Их примеры включают:"Галоген" в объеме настоящего изобретения означает фтор, хлор, бром или йод. Если не указано иное, то фтор, хлор и бром рассматриваются как предпочтительные галогены. Соединения общей формулы 1 могут содержать кислотные группы, преимущественно карбоксигруппы, и/или основные группы, такие как, например, аминогруппы. Поэтому соединения общей формулы 1 могут существовать в виде внутренних солей, в виде солей с фармацевтически применимыми неорганическими кислотами, такими как хлористо-водородная кислота, серная кислота, фосфорная кислота, сульфоновая кислота, или органическими кислотами (такими как, например, малеиновая кислота, фумаровая кислота, лимонная кислота, винная кислота или уксусная кислота) или и виде солей с фармацевтически применимыми основаниями, такими как гидроксиды или карбонаты щелочных или щелочно-земельных металлов, гидроксиды цинка или аммония, или органическими аминами, такими как, например, диэтиламин, триэтиламин, триэтаноламин. Как указано выше, соединения формулы 1 можно превратить в их соли, для использования в фармацевтике предпочтительно в их физиологически и фармакологически приемлемые соли. С одной стороны, эти соли могут находиться в форме физиологически и фармакологически приемлемых солей присоединения с кислотами соединений формулы 1 с неорганическими или органическими кислотами. С другой стороны, если R обозначает водород, соединение формулы 1 с помощью дополнительной реакции с неорганическими основаниями также можно превратить в физиологически и фармакологически приемлемые соли, содержащие в качестве противоиона катионы щелочных или щелочно-земельных металлов. Соли присоединения с кислотами можно получить, например, с использованием хлористо-водородной кислоты, бромисто-водородной кислоты, серной кислоты, фосфорной кислоты, метансульфоновой кислоты, уксусной кислоты, фумаровой кислоты, янтарной кислоты, молочной кислоты, лимонной кислоты, винной кислоты или малеиновой кислоты. Также можно использовать смеси указанных выше кислот. Соли щелочных или щелочно-земельных металлов и соединения формулы 1, в которой R обозначает водород, предпочтительно получают с использованием гидроксидов и гидридов щелочных или щелочноземельных металлов, из которых предпочтительными являются гидроксиды и гидриды щелочных металлов, в особенности натрия и калия, и особенно предпочтительными являются гидроксиды натрия и калия. Соединения общей формулы 1 необязательно можно превратить в их соли, для использования в фармацевтике предпочтительно в их фармакологически приемлемые соли присоединения с органическими или неорганическими кислотами. Примеры подходящих для этой цели кислот включают янтарную кислоту, бромисто-водородную кислоту, уксусную кислоту, фумаровую кислоту, малеиновую кислоту,метансульфоновую кислоту, молочную кислоту, фосфорную кислоту, хлористо-водородную кислоту,серную кислоту, винную кислоту или лимонную кислоту. Также можно использовать смеси указанных выше кислот. Настоящее изобретение относится к указанным соединениям, необязательно в виде отдельных оптических изомеров, смесей отдельных энантиомеров или рацематов, в виде таутомеров, а также в виде свободных оснований или соответствующих солей присоединения с фармакологически приемлемыми кислотами, таких как, например, соли присоединения с галогенводородными кислотами, например, с хлористо-водородной или бромисто-водородной кислотой, или органическими кислотами, такими как,например, щавелевая, фумаровая, дигликолевая или метансульфоновая кислота. Соединения, предлагаемые в настоящем изобретении, необязательно могут находиться в виде рацематов, но их также можно получить в виде чистых энантиомеров, т. е. в (R)- или (S)-форме. Настоящее изобретение относится к указанным соединениям, необязательно в виде отдельных оптических изомеров, диастереоизомеров, смесей отдельных диастереоизомеров, смесей отдельных энантиомеров или рацематов, в виде таутомеров, а также в виде свободных оснований или соответствующих солей присоединения с фармакологически приемлемыми кислотами, таких как, например, соли присоединения с галогенводородными кислотами, например с хлористо-водородной или бромисто-водородной кислотой, или органическими кислотами, такими как, например, щавелевая, фумаровая, дигликолевая или метансульфоновая кислота. Настоящее изобретение относится к соответствующим соединениям формулы 1 в форме их фармакологически приемлемых солей. Эти фармакологически приемлемые соли соединений формулы 1 также могут находится в виде их соответствующих гидратов (например, моногидраты, дигидраты и т.п.), а также в виде их соответствующих сольватов. Для задач настоящего изобретения гидрат соединения формулы 1 означает кристаллическую соль соединения формулы 1, содержащую кристаллизационную воду. Для задач настоящего изобретения сольват соединения формулы 1 означает кристаллическую соль соединения формулы 1, содержащую в кристаллической решетке молекулы растворителя (например,этанола, метанола и т.п.). Специалисту в данной области техники должны быть известны стандартные методики получения гидратов и сольватов (например, перекристаллизация из соответствующего растворителя или из воды). 4. Методики получения. Соединения примеров, предлагаемые в настоящем изобретении, получали так, как показано на схемах 1-3. Схема 1PG обозначает защитную группу (например, бензил, 1-фенилэтил, 1-(4-метоксифенил)этил);R1 и R2 являются такими, как определено выше в настоящем изобретении.PG обозначает защитную группу (например, бензил, 1-фенилэтил, 1-(4-метоксифенил)этил). Схема 3 где Hal обозначает Cl, Br, I. 4.1. Исходные вещества и промежуточные продукты формул 2-4. 4.1.1. Синтез арилалкинов 2, представленных на схеме 1. Синтез 5-этинил-1,2,3-триметоксибензола (2.1) для соединений примеров 2-5, 9, 18, 23, 38. Синтез 5-этинил-1,2,3-триметоксибензола проводили по методике, описанной в публикации Стадия 1. В высушенную колбу в атмосфере аргона помещали 1 г 5-бром-1,2,3-триметоксибензола,1,14 мл триметилсилилацетилена, 1,4 мл диизопропилэтиламина (ДИПЭА) и 290 мг трифенилфосфинпалладий(II) хлорида и 39 мг йодида Cu(I). Смесь перемешивали при 80C в течение 1 ч, после охлаждения разбавляли дихлорметаном (ДХМ) и фильтровали через слой диоксида кремния. Фильтрат экстрагировали водным раствором аммиака, насыщенным рассолом и концентрировали. Остаток очищали с помощью флэш-хроматографии (SiO2: циклогексанциклогексан/этилацетат 9:1) и получали триметил 3,4,5-триметоксифенил)этинил)силан. Выход: 970 мг (масло). Данные анализа: ВЭЖХ-МС (высокоэффективная жидкостная хроматография-масс-спектрометрия)(методика Е): Rt: 1,55 мин; (М+Н): 265. Стадия 2. 230 мг триметил 3,4,5-триметоксифенил)этинил)силана, 0,9 мл тетрабутиламмонийфторида (1 моль/л в ТГФ (тетрагидрофуран растворяли в 3 мл ТГФ и перемешивали при 25C в течение 1 ч. Раствор разбавляли с помощью ДХМ и экстрагировали водой. Содержащийся в органической фазе растворитель отгоняли и остаток очищали с помощью флэш-хроматографии (10 г SiO2; циклогексанциклогексан/этилацетат 7:3). Выход: 135 мг (90% от теоретического значения). Данные анализа: ВЭЖХ-МС (методика Е): Rt: 1,15 мин, (М+Н): 193. Синтез 5-этинил-1,3-дифтор-2-метоксибензола (2.2) для соединений примеров 14, 15, 17. Смесь 2 г 5-бром-1,3-дифтор-2-метоксибензола, 1,76 г этинилтриметилсилана, 629 мг бис-(трифенилфосфин)палладий(II) дихлорида, 3,1 мл диизопропилэтиламина и 85 мг йодида меди в 20 мл ацетонитрила дегазировали, затем нагревали при 80C в течение 2 ч. Смесь разбавляли дихлорметаном и фильтровали через слой диоксида кремния, промывали разбавленным раствором аммиака и рассолом, затем сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Очистка с использованием диоксида кремния давала 1,71 г (3,5-дифтор-4-метоксифенилэтинил)триметилсилана. 1 Н ЯМР (250 МГц, CDCl3)част./млн: 0,24 (9 Н, s), 4,02 (3 Н, t, J=1,29 Гц), 6,91-7,09 (2 Н, m). 1 н. раствор тетрабутиламмонийфторида (ТБАФ) в ТГФ добавляли к 1,71 г (3,5-дифтор-4 метоксифенилэтинил)триметилсилана и смесь перемешивали при 25C в течение ночи. Растворитель удаляли в вакууме и остаток очищали с помощью флэш-хроматографии на диоксиде кремния при элюировании смесью гептан:этилацетат состава 20:1 и получали 866 мг 5-этинил-1,3-дифтор-2 метоксибензола с выходом 72%. 1 Н ЯМР (250 МГц, CDCl3)част./млн: 3,08 (1 Н, s), 4,02 (3 Н, d, J=1,22 Гц), 6,89-7,15 (2 Н, m). 4-Этинил-1-изопропокси-2-метоксибензол (2.3) (для соединений примеров 10, 11, 13, 16, 19). 4-Этинил-1-изопропокси-2-метоксибензол 2.3 синтезировали в две стадии из 4-бром-1-изопропокси-2-метоксибензола по аналогии с соединением 2.2: Н ЯМР (250 МГц, CDCl3)част./млн: 1,38 (6 Н, d, J=6,09 Гц), 3,01 (1 Н, s), 3,85 (3 Н, s), 4,56 (1 Н, m),6,82 (1 Н, d, J=8,22 Гц), 7,00 (1 Н, d, J=1,83 Гц), 7,07 (1 Н, dd, J=8,30, 1,90 Гц). 2-Этинилхинолин (2.4) для соединения примера 34. 2-Этинилхинолин 2.4 для соединения примера 34 синтезировали в две стадии из 2-бромхинолина по аналогии с соединением 2.2: Данные анализа: ВЭЖХ-МС: Rt: 1,25 (методика М), (М+Н): 154. 5-Этинил-2-метоксипиридин (2.5) для соединений примеров 20, 21. 5-Этинил-2-метоксипиридин для соединений примеров 20, 21 синтезировали в две стадии из 5-бром-2-метоксипиридина по аналогии с соединением 2.2: Н ЯМР (500 МГц, хлороформ-d)част./млн: 3,11 (1 Н, s), 3,92-3.98 (3 Н, m), 6,70 (1 Н, dd, J=8,62,0,53 Гц), 7,64 (1 Н, dd, J=8,54, 2,29 Гц), 8,32 (1 Н, d, J=2,14 Гц). Следующие арилалкины имеются в продаже: 4-этинил-1,2-диметоксибензол 2.6 для соединений примеров 7, 8, 12; 1-этинилбензол 2.7 для соединения примера 1; 2-этинилпиридин 2.8 для соединения примера 6. 4.1.2. Синтез 5-гидрокси-7-бромхинолина, представленного на схеме 2. Искомое соединение можно приобрести у фирмы Shanghai Haoyuan Chemexpress Co., Ltd. CHINA или синтезировать в две стадии с получением промежуточного продукта, известного 3-бром-5-метоксианилина (Liedholm, Brita. Acta Chemica Scandinavica, Series B: Organic Chemistry and Стадия 1. 4,0 г (0,02 моль) 3-бром-5-метоксианилина, 4,6 г (0,05 моль) глицерина, 2,46 г (0,02 моль) нитробензола и 12 мл 75% раствора серной кислоты перемешивали при 150C в течение 3 ч. Затем этот темный раствор выливали в смесь 100 г дробленого льда, 100 мл этилацетата (EtOAc) и 30 мл 30% раствора NaOH. Через 1 ч коричневое твердое вещество отфильтровывали и органический слой отделяли. После фильтрования через SiO2 и выпаривания растворителя выделяли 7-бром-5-метоксихинолин и 5-бром-7-метоксихинолин в виде смеси состава примерно 60:40 (всего 3,5 г, 74%). Эту смесь разделяли на отдельные соединения, 7-бром-5-метоксихинолин и 5-бром-7-метоксихинолин, с помощью колоночной хроматографии на силикагеле с использованием смеси бензол-EtOAc (3:1) в качестве элюента. Выход чистого 7-бром-5-метоксихинолина составлял 950 мг (27% от массы смеси). Стадия 2. 1,5 г (0,0064 моль) 7-бром-5-метоксихинолина и 48% раствор HBr (30 мл) кипятили с обратным холодильником в течение 20 ч. После охлаждения до комнатной температуры реакционную смесь выливали в 100 мл воды и подщелачивали насыщенным раствором аммиака. Продукт отфильтровывали, промывали водой и сушили в вакууме при 50C. Выход 7-бром-5-гидроксихинолина составлял 600 мг (41%). 1 Н ЯМР (400 МГц, ДМСО-d6)част./млн: 11,1 (1H, s (широкий, 8,88 (1 Н, s), 8,49 (1 Н, d), 7,68 (1H,s), 7,48 (1 Н, m), 7,18 (1H, s). 4.1.3. Синтез спиртов 3, представленных на схемах 1 и 2. СинтезN-метилморфолина и смесь перемешивали при 0C в течение 2 ч и при температуре окружающей среды в течение ночи. Реакционную смесь разбавляли этилацетатом и органическую фазу промывали 10% раствором лимонной кислоты, 5% раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили и концентрировали. Выход: 23,8 г (95% от теоретического значения). Данные анализа (методика Е): Rt: 1,12 мин, (М+Н)+: 277. Стадия 2. Реакцию проводили в атмосфере азота. 11,95 г (R)-N-метокси-5-оксо-1-R)-1-фенилэтил)пирролидин-3-карбоксамида при -10C помещали в 100 мл тетрагидрофурана. В течение 15 мин добавляли 30 мл раствора метилмагнийбромида в диэтиловом эфире (белая суспензия, при температуре 10C) и смесь перемешивали при -10C в течение 2 ч и затем нагревали до температуры окружающей среды. Смесь разбавляли этилацетатом и промывали 1 н. раствором хлористо-водородной кислоты, насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Органическую фазу сушили и концентрировали. Выход: 9,45 г (95% от теоретического значения). Реакцию проводили в атмосфере аргона. 8,5 г (26,8 ммоль) (R)-4-ацетил-1-R)-1-фенилэтил)пирролидин-2-она при -50C помещали в 40 мл дихлорметана и по каплям добавляли 40,5 мл(9-борабицикло[3.3.1]нонан)гидрид лития в тетрагидрофуране. В ходе добавления температура повышалась до -30C. Затем смесь перемешивали при -45C в течение 1 ч. Затем добавляли фосфатный буфер и смесь нагревали до температуры окружающей среды, разбавляли дихлорметаном и экстрагировали водой. Органическую фазу сушили над сульфатом магния, концентрировали и очищали с помощью препаративной ВЭЖХ (Xbridge C18). Выход: 2,60 г соединения 3.1 (30% от теоретического значения). Данные анализа (методика Е): Rt: 1,08 мин, (М+Н)+: 234. Выход: 2,60 г соединения 3.2 (30% от теоретического значения). Данные анализа (методика Е): Rt: 1,12 мин, (М+Н)+: 234. 5-(Гидроксиметил)пиперидин-2-он (3.3) (для соединения примера 5). 5-(Гидроксиметил)пиперидин-2-он (3.3) можно синтезировать в соответствии с методикой, описанной в следующей публикации: Lerchner, Andreas; Carreira, Erick M. Chemistry A European Journal (2006),12(32), 8208-8219. Синтез (R)-4-[(S)-1-гидроксиэтил]-1-[(S)-1-(4-метоксифенил)этил]пирролидин-2-она 3.4 для соединений примеров 21, 27, 29-31, 33, 34, 37, 41-43, 47-49, 51, 53, 55, 56, 61, 63, 65-69, 72, 73, 76, 78, 81, 83,85-91, 93-95, 99-102, 104, 105, 107, 109, 111, 112, 114-116, 118-120. Стадия 1. Синтез (1'R,3R/S)-1-1'-(4-метоксифенилэтил)-5-оксо-3-пирролидинкарбоновой кислоты Суспензию 100 г (R)-1-(4-метоксифенил)этиламина и 95 г итаконовой кислоты в 0,5 л 1-метил-2 пирролидинона нагревали при 80C в течение 1 ч. Раствор перемешивали при 120C в течение еще 4 ч. Реакционную смесь охлаждали до 25C и выливали в 1,5 л деминерализованной воды. Осадок отфильтровывали, промывали деминерализованной водой и сушили при 50C. Выход: 195 г (количественный выход) твердого вещества, смесь диастереоизомеров. Данные анализа (методика G): Rt: 2,6 и 2,7 мин, (М+Н)+: 264. Аналогичным образом получали 260 г 1,1-карбонилдиимидазола (КДИ) при 20C добавляли к раствору 285 г (1'R,3R/S)-1-1'-(4 метоксифенилэтил)-5-оксо-3-пирролидинкарбоновой кислоты (смесь диастереоизомеров) в 1,4 л 2-метилтетрагидрофурана. Суспензию перемешивали при 20C в течение 80 мин. Добавляли 235 мл этилдиизопропиламина (ДИПЭА) и 130 г N,O-диметилгидроксиламингидрохлорида. Суспензию перемешивали при 20C в течение 3 ч. При охлаждении добавляли 850 мл 4 н. раствора хлористо-водородной кислоты. Органическую фазу отделяли и дважды промывали с помощью 500 мл 1 н. раствора хлористоводородной кислоты. Водную фазу повторно дважды экстрагировали с помощью 500 мл этилацетата. Объединенные органические фазы сушили над сульфатом натрия. После фильтрования растворитель выпаривали при пониженном давлении. Выход: 271 г (82% от теоретического значения) (R/S)-N-метокси-5-оксо-1-[(S)-1-(4 метоксифенил)этил]пирролидин-3-карбоксамида (смесь диастереоизомеров) в виде масла. Данные анализа (методика Н): Rt: 11,1 мин (площадь пика 41%) и 13,8 мин (площадь пика 59%),(М+Н)+: 307. Стадия 3. Синтез (R/S)-4-ацетил-1-[(S)-1-(4-метоксифенил)этил]пирролидин-2-она в виде смеси диастереоизомеров. 530 мл 3 М раствора метилмагнийбромида в диэтиловом эфире медленно добавляли к охлажденному раствору 271 г (R/S)-N-метокси-5-оксо-1-[(S)-1-(4-метоксифенил)этил]пирролидин-3-карбоксамида(смесь диастереоизомеров) в 1,4 л 2-метилгетрагидрофурана таким образом, чтобы температура оставалась ниже 0C. После завершения добавления температуру поддерживали равной 0C в течение 75 мин и затем смесь нагревали до 20C. Суспензию перемешивали при 20C в течение 16 ч. При охлаждении добавляли 650 мл 4 М раствора хлористо-водородной кислоты. Органическую фазу отделяли и промывали с помощью 500 мл насыщенного раствора карбоната натрия и 500 мл насыщенного рассола. Органическую фазу сушили над сульфатом натрия. После фильтрования растворитель выпаривали при пониженном давлении. Выход: 188 г(R/S)-4-ацетил-1-[(S)-1-(4 метоксифенил)этил]пирролидин-2-она (смесь диастереоизомеров) в виде масла. Данные анализа (методика Н): Rt: 7,4 и 9,6 мин, (М+Н)+: 262. Стадия 4. Кристаллизация (R)-4-ацетил-1-[(S)-1-(4-метоксифенил)этил]пирролидин-2-она при условиях эпимеризации с использованием основания. 103 г смеси диастереоизомеров (R/S)-4-ацетил-1-[(S)-1-(4-метоксифенил)этил]пирролидин-2-она при 25C растворяли в 155 мл 1-бутанола. Добавляли 18 мл гидроксида бензилтриметиламмония (40% раствор в метаноле). Раствор перемешивали при 25C в течение 30 мин. Раствор охлаждали до 0C. Начиналось образование осадка. Суспензию перемешивали при 0C в течение 15 мин. Медленно добавляли 100 мл н-гептана и суспензию перемешивали при 0C в течение 30 мин. 4 раза повторяли добавление порций 100 мл н-гептана с последующим перемешиванием суспензии при 0C в течение 30 мин. Осадок отделяли, промывали н-гептаном и сушили при 50C. Выход: 77,1 г бежевого твердого вещества (75% от теоретического значения), обладающего диастереоизомерной чистотой 95:5 (методика Н). Для дополнительной очистки неочищенный продукт при 40C растворяли в 310 мл 2-метил-2 бутанола (температура 50C). Раствор медленно охлаждали до 0C. Начиналось образование осадка. При 0C добавляли 385 мл н-гептана и суспензию перемешивали в течение 1 ч. Осадок отфильтровывали, промывали н-гептаном и сушили при 50C. Выход: 68,7 г (67% от теоретического значения) бесцветного твердого вещества, обладающего диастереоизомерной чистотой 99:1. Данные анализа (методика Н): Rt: 6,8 мин, (М+Н)+: 262. 2,4 г димера дихлор(пентаметилциклопентадиенил)родий(III) и 2,8 г (R,R)-N-(п-толуолсульфонил)1,2-дифенилэтилендиамина [(R,R)-TsDPEN] при 25C добавляли к раствору 50 г (R)-4-ацетил-1-[(S)-1-(4 метоксифенил)этил]пирролидин-2-она в ацетонитриле. Раствор охлаждали до -15C. При этой температуре добавляли смесь 22 мл муравьиной кислоты и 135 мл триэтиламина. Реакционную смесь перемешивали при -15C в течение 22 ч и затем нагревали до 20C. При охлаждении добавляли 230 мл 4 М раствора хлористо-водородной кислоты. Водную фазу 3 раза экстрагировали этилацетатом. Органическую фазу промывали разбавленным и концентрированным рассолом и обрабатывали активированным углем. Органическую фазу сушили над сульфатом натрия. Растворитель выпаривали при пониженном давлении и получали 57,1 г бежевого твердого вещества, обладающего диастереоизомерной чистотой 97:3. Для дополнительной очистки неочищенный продукт кристаллизовали из изопропилацетата. Выход: 37,8 г (75% от теоретического значения) бежевого твердого вещества, обладающего диастереоизомерной чистотой 99:1. Данные анализа (методика I): Rt: 12,9 мин, (М+Н)+: 264. Реакцию гидрирования с переносом водорода также можно провести в 2-пропаноле при 20C. Синтез (R)-4-(гидроксиметил)-1-R)-1-фенилэтил)пирролидин-2-она (для соединений примеров 7,9, 17, 19). 5 г (1'R,3R)-1-(1'-фенилэтил)-5-оксо-3-пирролидинкарбоновой кислоты растворяли в 50 мл тетрагидрофурана, затем раствор охлаждали до 0C. В течение 30 мин по каплям добавляли 16,5 мл комплекса боран-диметилсульфид (2 М раствор в тетрагидрофуране) и раствор реакционной смеси медленно нагревали при 25C и перемешивали при 25C в течение еще 2 ч. Реакционную смесь концентрировали, разбавляли дихлорметаном и промывали раствором бикарбоната натрия. Водную фазу экстрагировали дихлорметаном (2) и объединенные органические фазы сушили над сульфатом магния и концентрировали. Выход: 5,5 г (содержание 80%, 94% от теоретического значения). Данные анализа: ВЭЖХ-МС (методика D): Rt: 1,20 мин (М+Н)+: 220. Выпускается фирмой Sigma-Aldrich. 2-(Гидроксиметил)никотинамид для соединений примеров 22, 24-26, 32, 35, 36, 39, 40, 44-46, 50, 52,54, 57-60, 62, 64, 70, 71, 74, 75, 77, 79, 80, 82, 84, 92, 96-98, 103, 106, 108, 110, 113, 117. 4178-4180. Синтез 1-хлорметил-5,5-диметилимидазолидин-2,4-диона для соединения примера 23. 0,69 мл тионилхлорида при 0C в течение 30 мин добавляли к раствору 500 мг 1-гидроксиметил-5,5 диметилимидазолидин-2,4-диона в 5 мл ДХМ, затем перемешивали при 25C в течение 16 ч. Смесь выпаривали досуха и использовали в неочищенном виде для синтеза соединения примера 23. 4.1.4. Синтез бороновых кислот, эфиров бороновых кислот и станнанов 4, представленных на схеме 2. 4.1.4.1. Синтез R2-Hal. 4-Бром-2-метил-1-(метилсульфонил)бензол для соединения примера 35. 235 мг сульфита натрия и 470 мг NaHCO3 растворяли в 1,75 мл воды и нагревали при 75C. В течение 10 мин порциями добавляли 500 мг 4-бром-2-метилбензолсульфонилхлорида (образование газа) и смесь перемешивали при 75C в течение 1 ч. Небольшими порциями добавляли 387 мг бромуксусной кислоты и 150 мкл воды и смесь перемешивали при 105C в течение ночи. После охлаждения до 25C смесь подкисляли 4 н. раствором HCl до рН 1. Полученный осадок собирали и промывали водой и получали 205 мг твердого вещества. Данные анализа: ВЭЖХ-МС: Rt: 0,73 (методика Х 001002) (М+Н): 249/251. 1-Бром-4-(трифторметилсульфонил)бензол для соединения примера 36.N-(4-Бромбензил)-N-этилацетамид для соединений примеров 50, 68. 0,568 мл N-этилацетамида растворяли в 20 мл ТГФ. Добавляли 0,67 г трет-бутоксида калия и смесь перемешивали при 50C в течение 20 мин. Затем добавляли 1 г 4-бромбензилбромида, растворенного в 5 мл ТГФ, и суспензию перемешивали при 50C в течение 2 ч. После охлаждения добавляли этилацетат и воду и органическую фазу экстрагировали водой (1), сушили и растворитель отгоняли. Продукт очищали с помощью КФХ (колоночная флэш-хроматография) (циклогексан/этилацетат: 90/1050/50) и получали 830 мг N-(4-бромбензил)-N-этилацетамида в виде масла. Данные анализа: ВЭЖХ-МС: Rt: 2,67 мин (методика С), (М+Н): 256.N-(4-Бромбензил)-N-метилацетамид для соединений примеров 51, 58. 1,316 г N-метилацетамида растворяли в 60 мл ТГФ. Добавляли 2,02 г трет-бутоксида калия и смесь перемешивали при 50C в течение 20 мин. Затем добавляли 3 г 4-бромбензилбромида, растворенного в 10 мл ТГФ, и смесь перемешивали при 50C в течение 2 ч. После охлаждения добавляли этилацетат и воду и органическую фазу экстрагировали водой (1), сушили и растворитель отгоняли и получали 2,8 г 4-Бром-1-(трифторметил)-1 Н-пиразол для соединения примера 87. получали так, как описано в WO 2008/95944. 7-Бром-3-метилхиназолин-4(3 Н)-он для соединений примеров 91, 92. 7-Бромхиназолин-4(3 Н)-он можно получить так, как описано в WO 2010/146173. 400 мг 7-бромхиназолин-4(3 Н)-она растворяли в ДМФ (N,N-диметилформамид) и 720 мг CsCO3,добавляли 130 мкл метилйодида и смесь перемешивали при 25C в течение 3 ч. Дополнительно добавляли 50 мкл метилйодида и перемешивали при 25C в течение ночи. Смесь фильтровали и маточный раствор разбавляли с помощью ДХМ и экстрагировали водой. Растворитель удаляли и получали 490 мг 7-бром-3-метилхиназолин-4(3 Н)-она в виде твердого вещества. Данные анализа: ВЭЖХ-МС: Rt: 0,66 мин (методика Х 001 004) (М+Н): 239/241. 7-Бром-3-метил-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин для соединения примера 103. 7-Бром-2,3,4,5-тетрагидро-1 Н-бензо[d]азепин можно получить так, как описано в публикации Shah,Unmesh; Lankin, Claire M; Boyle, Craig D.; Chackalamannil, Samuel; Greenlee, William J.; Neustadt,Bernard R.; Cohen-Williams, Mary E.; Higgins, Guy A.; Ng, Kwokei; Varty, Geoffrey В.; Zhang, Hongtao; Lachowicz, Jean E. Bioorganic and Medicinal Chemistry Letters, 2008, 18, 4204-4209. 2,43 г 7-бром-2,3,4,5-тетрагидро-1 Н-бензо[d]азепина растворяли в 4,055 г муравьиной кислоты и добавляли 3,2 мл раствора формальдегида. Смесь перемешивали при 70C в течение 3,5 ч и перемешивание продолжали при 25C в течение ночи. Смесь концентрировали, разбавляли водой и 10 н. растворомNaOH до щелочной реакции смеси. Затем смесь экстрагировали трет-бутилметиловым эфиром (3) и органическую фазу сушили (Na2SO4), фильтровали и концентрировали и получали 2,48 г 7-бром-3-метил 2,3,4,5-тетрагидро-1H-бензо[d]азепина в виде масла. Данные анализа: МС: (М+Н): 240 /242. 6-Бром-2,4-диметилхиназолин для соединения примера 107.N-(2-Ацетил-4-бромфенил)ацетамид можно получить можно получить так, как описано в публикации Woods, Keith W.; Fischer, John P.; Claiborne, Akiyo; Li, Tongmei; Thomas, Sheela A.; Zhu, Gui-Dong;Chemistry, 2006, 14, p. 6832-6846. 415 мг N-(2-ацетил-4-бромфенил)ацетамида и 0,624 г ацетата аммония растворяли в 5 мл ледяной уксусной кислоте и нагревали при 100C в течение 2 дней. Растворитель удаляли и остаток суспендировали в воде и экстрагировали с помощью ДХМ. Органическую фазу концентрировали и очищали с помощью КФХ (25 г SiO2, ДХМ:MeOH 100:070:30) и получали 90 мг 6-бром-2,4-диметилхиназолин в виде масла. Данные анализа: ВЭЖХ-МС: Rt: 1,26 мин (методика V003 003), (М+Н): 237/239. 5-Бром-2-(дифторметил)пиридин для соединения примера 120. 1 г 5-бромпиридин-2-карбоксальдегида растворяли в 50 мл ДХМ. Раствор охлаждали до -70C, затем в течение 20 мин по каплям добавляли 1,55 мл диэтиламинотрифторида серы. Суспензию перемешивали при комнатной температуре в течение 30 мин, затем при 0C добавляли 10 мл воды, затем медленно добавляли 20 мл насыщенного раствора NaHCO3 (образование газа). Фазы разделяли и к органической фазе добавляли 2 мл 4 н. раствора HCl в диоксане, затем ее концентрировали в вакууме и получали 1,06 г продукта в виде желтого твердого вещества. ВЭЖХ-МС: Rt: 0,72 мин (методика Х 001 004), (М+Н): 208/210. 4.1.4.2. Синтез соединений формулы 4 (R2-X) (схема 2). Синтез 2-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолина для соединений примеров 33, 75. 100 мг 6-бромхинальдина, 133 мг бис-(пинаколято)дибора, 16 мг Pd(II)Cl2(PPh3)2 и 86 мг ацетата калия суспендировали в 1 мл диоксана и смесь нагревали в микроволновой печи при 100C в течение 1 ч. После охлаждения смесь разбавляли с помощью ДХМ и экстрагировали водой (2). Органическую фазу концентрировали и получали 200 мг (94%, содержание 55%) 2-метил-6-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)хинолина в виде масла. Данные анализа: ВЭЖХ-МС (методика Х 001 002) Rt: 0,48 мин, (М+Н): 188. Следующие эфиры бороновых кислот синтезировали аналогичным образом и использовали без дополнительной очистки: 4,4.5,5-Тетраметил-2-(3-метил-4-(метилсульфонил)фенил)-1,3,2-диоксаборолан для соединения примера 35. Условия проведения реакции: 1 ч, 100C. Выход: 74% (содержание 50%). Данные анализа: ВЭЖХ-МС: Rt: 0,42 мин (методика Х 001 003), (М+Н): 215 (бороновая кислота). 4,4,5,5-Тетраметил-2-(4-(трифторметилсульфонил)фенил)-1,3,2-диоксаборолан для соединения примера 36. Условия проведения реакции: 1 ч, 100C. Выход: 93% (содержание 45%). Данные анализа: ВЭЖХ-МС: Rt: 0,72 мин (методика Х 001 003).N-Этил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)ацетамид для соединений примеров 50, 68. Условия проведения реакции: 2 ч, 100C. Выход: 93% (содержание 55%). Данные анализа: ВЭЖХ-МС: Rt: 0,87 мин (методика Х 001 002), (М+Н): 304.N-Метил-N-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил)ацетамид для соединений примеров 51, 58. Условия проведения реакции: 2 ч, 100C. Выход: 94% (содержание 45%). Данные анализа: ВЭЖХ-МС: Rt: 0,83 мин (методика Х 001 002), (М+Н): 290. 6-(4,4,5,5-Теграметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидроизохинолин-1(2 Н)-он для соединений примеров 52, 53. Условия проведения реакции: 1 ч, 100C. Выход: 87% (содержание 35%). Данные анализа: ВЭЖХ-МС- Rt: 0,81 мин (методика Х 001 002). (М+Н): 274. 1-(4-(4,4,5,5-Тетраметил-1,3,2-Диоксаборолан-2-ил)бензил)пиперидин-2-он для соединений примеров 54, 55. Условия проведения реакции: 1 ч, 100C. Выход: 92% (содержание 45%). Данные анализа: ВЭЖХ-МС: Rt: 0,87 мин (методика Х 001 003), (М+Н): 316. 2-Метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)имидазо[1.2-а]пиридин для соединений примеров 60, 61. Условия проведения реакции: 6 ч, 100C. Выход: 98% (содержание 50%). Данные анализа: ВЭЖХ-МС: Rt: 0,40 мин (методика Х 001004), (М+Н): 177 (бороновая кислота). 1-(2-Хлор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)циклопропанамин для соединений примеров 62, 86. Условия проведения реакции: 1 ч, 100C. Выход: 85% (содержание 40%). Данные анализа: ВЭЖХ-МС: Rt: 0,67 мин (методика X001 004), (М+Н): 294 и 0,24 мин (М+Н): 212 (бороновая кислота). 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-бензо[d][1,3]оксазин-2(4 Н)-он для соединений примеров 63, 64. Условия проведения реакции: 1 ч, 100C. Выход: 87% (содержание 50%). Данные анализа: ВЭЖХ-МС: Rt: 0,67 мин (методика Х 001 004), (М+Н): 276. Следующие соединения примеров синтезировали аналогично тому, как описано в примере, но без использования микроволнового излучения. 6-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-2-(трифторметил)имидазо[1,2-а]пиридин для соединения примера 83. Условия проведения реакции: 1 ч, 100C. Выход: 94% (содержание 45%). Данные анализа: ВЭЖХ-МС: Rt: 0,49 мин (методика Х 001004), (М+Н): 231 (бороновая кислота). 4-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1-(трифторметил)-1 Н-пиразол для соединения примера 87. Условия проведения реакции: 3,5 ч, 100C. Выход: 98% (содержание 55%). Данные анализа: ВЭЖХ-МС: Rt: 1,66 мин (методика V003 002), (М+Н): 263. 2-Циклобутилокси-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин для соединения примера 90. Условия проведения реакции: 1 ч, 100C. Выход: 90% (содержание 40%). Данные анализа: ВЭЖХМС: Rt: 0,50 мин (методика Х 001004), (М+Н): 194 (бороновая кислота). 3-Метил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хиназолин-4(3 Н)-он для соединений примеров 91, 92. Условия проведения реакции: 1 ч, 100C. Выход: 98% (содержание 50%). ВЭЖХ-МС: Rt:
МПК / Метки
МПК: C07D 401/14, A61P 11/06, C07D 471/04, C07D 491/04, C07D 413/14, A61K 31/4709, C07F 5/02, C07D 413/12, C07D 215/20, C07D 417/14, C07D 401/12
Метки: средств, замещенные, применение, лекарственных, качестве, хинолины
Код ссылки
<a href="https://eas.patents.su/30-24845-zameshhennye-hinoliny-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные хинолины и их применение в качестве лекарственных средств</a>
Предыдущий патент: Иммуноконъюгат и его применение для лечения рака
Следующий патент: Бициклическое гетероциклическое соединение
Случайный патент: Способ и устройство комплексного освоения месторождений континентального шельфа