Гетероциклическое соединение
Номер патента: 23931
Опубликовано: 29.07.2016
Авторы: Маеда Дзунко, Сиваку Масахико, Асано Тору, Като Кодзи, Такахаси Фумие, Козуки Йосихиро, Имада Сунао, Фукахори Хидехико
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
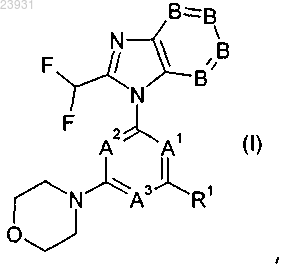
в котором
А2 и А3 представляют собой N и А1 представляет собой СН, или А1 и А3 представляют собой N и А2 представляет собой СН,
В представляют собой СН,
R1 представляет собой -NH-Y или -O--Y,
Y представляет собой неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который может быть замещен одним или несколькими заместителями, выбранными из группы D1, и
группа D1 состоит из
L5a-(неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который может быть замещенным одним или более заместителями, выбранными из группы, состоящей из С1-6 алкила, -С(О)O-С1-6 алкила, -С(О)-С1-6 алкила и оксо, где L5a представляет собой связь или -С(О)-.
2. Соединение или его фармацевтически приемлемая соль по п.1, где А2 и А3 представляют собой N и А1 представляет собой CH.
3. Соединение или его фармацевтически приемлемая соль по п.2, где R1 представляет собой -NH-Y.
4. Соединение или его фармацевтически приемлемая соль по п.3, где Y представляет собой неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который замещен -С(О)-(неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома).
5. Соединение или его фармацевтически приемлемая соль по п.1, где соединение представляет собой
[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил][(2R)-тетрагидрофуран-2-ил]метанон,
[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил](тетрагидро-2Н-пиран-4-ил)метанон,
метил-4-{[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил]карбонил}пиперидин-1-карбоксилат,
[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}окси)пирролидин-1-ил](тетрагидрофуран-3-ил)метанон,
4-{[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}окси)пирролидин-1-ил]карбонил}-1-метилпирролидин-2-он,
[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил](тетрагидрофуран-3-ил)метанон,
4-{[(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил]карбонил}-1-метилпирролидин-2-он или
4-{[3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)азетидин-1-ил]карбонил}-1-метилпирролидин-2-он.
6. Соединение или его фармацевтически приемлемая соль по п.5, где соединение представляет собой [(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил][(2R)-тетрагидрофуран-2-ил]метанон.
7. Соединение или его фармацевтически приемлемая соль по п.5, где соединение представляет собой [(3S)-3-({6-[2-(дифторметил)-1Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил}амино)пирролидин-1-ил](тетрагидро-2Н-пиран-4-ил)метанон.
8. Фармацевтическая композиция, обладающая ингибирующей PI3Kδ активностью, содержащая соединение или его фармацевтически приемлемую соль по п.5 и фармацевтически приемлемый наполнитель.
9. Фармацевтическая композиция для профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний или гематологической опухоли, содержащая соединение или его фармацевтически приемлемую соль по п.5 и фармацевтически приемлемый наполнитель.
10. Применение соединения или его фармацевтически приемлемой соли по п.5 для получения фармацевтической композиции для профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний или гематологической опухоли.
11. Применение соединения или его фармацевтически приемлемой соли по п.5 для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли.
12. Средство для профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний или гематологической опухоли, представляющее собой соединение или его фармацевтически приемлемую соль по п.5.
13. Способ профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний системной красной волчанкой или гематологической опухоли, включающий введение субъекту эффективного количества соединения или его фармацевтически приемлемой соли по п.5.
Текст
Новое отличное соединение, которое применимо в качестве средства для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли, основанное на селективном ингибирующем действии в отношении PI3K и/или ингибирующем продукцию IL-2 действии и/или ингибирующем пролиферацию В клеток действии(включая ингибирующее активацию действие). Проведен поиск соединения, обладающего селективным ингибирующим действием в отношении PI3K и/или ингибирующим продукцию IL-2 действием и/или ингибирующим пролиферацию В клеток действием (включая ингибирующее активацию действие) и было обнаружено, что гетероциклическое соединение формулы (I) где все переменные такие, как указано в формуле изобретения согласно настоящему изобретению, обладает селективным ингибирующим действием в отношении PI3K и/или ингибирующим продукцию IL-2 действием и/или ингибирующим пролиферацию В клеток действием (включая ингибирующее активацию действие). Область техники, к которой относится изобретение Настоящее изобретение относится к гетероциклическому соединению, которое применимо в качестве активного ингредиента фармацевтической композиции, например фармацевтической композиции для профилактики и/или лечения заболеваний, связанных с фосфатидилинозитол-3-киназой(PI3K). Уровень техники Фосфатидилинозитол-3-киназа (PI3K) представляет собой липид-опосредованную сигнальную киназу, которая повсеместно присутствует у всех видов, от растений или дрожжей до млекопитающих,включая людей. PI3K представляет собой фермент для фосфорилирования гидроксильной группы в 3 положении фосфатидилинозитола, фосфатидилинозитол-4-фосфата и фосфатидилинозитол-4,5 дифосфата, которые представляют собой фосфолипиды клеточной мембраны, и из каждого из указанных субстратов продуцируются фосфатидилинозитол-3-фосфат, фосфатидилинозитол-3,4-дифосфат и фосфатидилинозитол-3,4,5-трифосфат (PIP3). Продуцированные таким образом фосфорилированные фосфатидилинозитолы действуют в качестве внутриклеточного вторичного мессенджера. В частности, PIP3 вызывает миграцию различных молекул, содержащих плекстрин-гомологичные (РН) домены, в прилегающее к клеточной мембране положение с индукцией активации молекул, а потому, как предполагается,является наиболее важным фосфорилированным фосфатидилинозитолом ("The Journal of BiologicalPI3K подразделяется на три класса, классы I, II и III, в соответствии с различными характеристиками и исходя из точки зрения, что единственным ферментом, продуцирующим PIP3 in vivo, является PI3KI класса, I класс PI3K считается наиболее важным классом ("Biochimica et Biophysica Acta", 2008, Vol. 1784, p. 159-185). I класс PI3K подразделяется на IA и IB. PI3K IA класса состоит из гетеродимеров,включая сочетание каталитической субъединицы массой 110 кДа (p110,или ) и регуляторной субъединицы массой 50-85 кДа (р 85, р 85, р 55, р 55 или р 50), a PI3K IB класса представляет собой гетеродимер из каталитической субъединицы массой 110 кДа (р 110) и регуляторной субъединицы массой 101 кДа (p101) ("Nature Immunology", 2003, No. 4, p. 313-319). Здесь и далее в настоящем документе соответствующие PI3K называют PI3K, ,и , в соответствии с каталитическими субъединицами, входящими в их состав.PI3K ишироко представлены в биологическом организме, и сообщалось, что дефицит PI3K иу мышей летален для плода в обоих случаях ("The Journal of Biological Chemistry", 1999, Vol. 274, p. 10963-10968; и "Mammalian Genome", 2002, Vol. 13, p. 169-172). В результате исследований с использованием селективных в отношении подтипа соединений сообщалось, что PI3K играет важную роль в сигнальном пути инсулина, и ингибитор PI3K обуславливает резистентность к инсулину ("Cell", 2006,Vol. 125, p. 733-747). Кроме того, сообщалось, что PI3K участвует в агрегации тромбоцитов, и ингибитор PI3K обладает антитромботическим эффектом ("Nature Medicine", 2005, Vol. 11, p. 507-514). С другой стороны, все дефицитные по PI3K илимыши рождаются нормальными, и не было обнаружено никаких проблем касательно роста, продолжительности жизни, размножения и т.п. ("Science", 2000, Vol. 287, p. 1040-1046; и "Molecular and Cellular Biology", 2002, Vol. 22, p. 8580-8591). В частности, экспрессияPI3K мышей имеются существенные нарушения активации лимфоцитов. Широко известна тесная взаимосвязь между активацией лимфоцитов и иммунитетом/воспалением, и соединения, селективно ингибирующие PI3K, являются потенциальными ингибиторами иммунитета/воспаления, обладая и мощным ингибирующим активацию лимфоцитов действием, и безопасностью. Интерлейкин-2 (IL-2) представляет собой тип цитокина, который продуцируется, главным образом,активированными Т клетками. IL-2 индуцирует пролиферацию и активацию лимфоцитов через IL-2 рецептор, который представляет собой рецептор для IL-2. IL-2 является очень важной молекулой в сигнальном пути активации иммунной системы, и ингибиторы его продукции (например, такролимус и циклоспорин А) используют в клинике в качестве иммуносупрессирующих средств. Кроме того, моноклональные антитела против рецептора IL-2, такие как базиликсимаб и даклизумаб, используют в клинике в качестве иммуносупрессирующих средств. Наряду с Т клетками В клетки представляют собой одну из основных субпопуляций лимфоцитов и являются клетками, которые являются основным действующим лицом гуморального иммунитета. Известно, что гуморальный иммунитет играет исключительно важную роль в профилактике вызываемой патогенами инфекции и т.п., но при аутоиммунных заболеваниях, таких как ревматоидный артрит и т.п.,происходит аномальная активация гуморального иммунитета, которая глубоко вовлечена в патогенез. Известно что, анти-CD20 антитело, ритуксимаб, используют в клинике в качестве лекарства для лечения ревматоидного артрита. В качестве соединения, обладающего ингибирующим действием в отношении PI3K, сообщалось,например, об описанных ниже соединениях формулы (А-1) (патентный документ 1), формулы (А-2) (патентный документ 2), формулы (А-3) (патентный документ 3), формулы (В-1) (патентный документ 4),формулы (В-2) (патентный документ 5), формулы (В-3) (патентный документ 6), формулы (С) (патентный документ 7), формулы (D-1) (патентный документ 8), формулы (D-2) (патентный документ 9), фор-1 023931 мулы (Е-1) (патентный документ 10), формулы (Е-2) (патентный документ 11), формулы (Е-3) (патентный документ 12), формулы (F) (патентный документ 13), формулы (G) (патентный документ 14), формулы (Н) (патентный документ 15 и непатентный документ 1), формулы (J) (патентный документ 16) и формулы (K) (патентный документ 17). Однако описанное ниже соединение формулы (I) согласно настоящей заявке отличается от соединений формул (А-1)-(Е-3), (Н) и (K) по структуре группы R1 формулы(I). Оно отличается по структуре от соединений формул (F) и (G) в том, что содержит бензимидазолил-1 ильную группу. В качестве группы R2 формулы (J) была раскрыта гетероарильная группа, но не было конкретного раскрытия бензимидазолил-1-ильной группы и не было раскрытия соединения формулы (I) согласно настоящему изобретению в патентном документе 16. Кроме того, в каких-либо документах отсутствует описание селективного ингибирующего действия в отношении PI3K.(где R2 в формулах (А-1)-(Е-3) представляет собой дифторметильную группу или т.п. R1 и R2 в формуле (F) объединены друг с другом и с атомом N, с которым они связаны, с образованием незамещенной или замещенной морфолиногруппы, X представляет собой связь или т.п., и R3 представляет собой незамещенную или замещенную индолильную группу. R2 в формуле (G) представляет собой замещенную индол-4-ильную группу в 5 или 6 положении. R3 в формуле (Н) представляет собой дифторметильную группу или т.п. и R6 представляет собой морфолиногруппу, которая может быть замещена или т.п. В формуле (J) Y1 и Y2 представляют собой N, СН или т.п., X представляет собой NR4CR6R7 или т.п.,R1 представляет собой гетероциклическую группу или т.п. и R2 представляет собой гетероарильную группу или т.п. В формуле (K) X, Y и Z представляют собой N или СН при условии, что по меньшей мере два из X, Y и Z представляют собой N, R1 представляет собой гетероарил или т.п., R2 представляет собой гетероцикл или т.п., Q представляет собой связь, азетидинилен-4-амино или т.п., Т представляет собой -C(О)-, -C(=S)- или -S(O)2- и R5 представляет собой галоген или -O-S(О)2-R7. Применительно к другим символам может быть сделала ссылка на публикацию). Сообщалось, что описанные ниже соединения формулы (L-1) (патентный документ 18), формулы кумент 21) и формулы (L-5) (патентный документ 22) обладают противоопухолевой активностью. Кроме того, в непатентном документе 2 было сделано предположение, что вторичный амин формулы (М) обладает ингибирующей Lck активностью и ингибирующим продукцию IL-2 действием и применяется при аутоиммунных заболеваниях и реакции отторжения при трансплантации органов. Однако соединение формулы (I) согласно настоящему изобретению непременно содержит дифторметильную группу, что отличает его по структуре от соединений формул (L-1), (L-2) и (М). Оно также отличается от соединений формул (L-3) и (L-5) по структуре группы R1 формулы (I). Кроме того, оно отличается от соединений формул (L-4) по структуре заместителя на бензимидазольном кольце. Кроме того, в каких-либо документах отсутствует описание селективного ингибирующего действия в отношении PI3K.(в формуле (L-1) и X, и Y представляют собой N, или один из X и Y представляет собой N, а другой представляет собой CR7, и R6 представляет собой Н или С 1-6 алкил; в формуле (L-2) и X, и Y представляют собой N, или один из X и Y представляет собой N, а другой представляет собой CR3, и R1 представляет собой морфолиногруппу или т.п.; в формуле (L-3) X представляет собой N или СН, R1 представляет собой CHnF3-n (n равно 1 или 2), и R2 представляет собой морфолино, который может быть замещен или т.п.; в формуле (L-4) X представляет собой N или СН, и R1 представляет собой галоген или гидроксильную группу; в формуле (L-5) X представляет собой N или CH, R1 представляет собой морфолиногруппу,которая может быть замещена 1-4 C1-6 алкильными группами, и Y представляет собой C1-6 алкил; и в формуле (М) R1 представляет собой морфолиногруппу или т.п. Применительно к другим символам может быть сделала ссылка на публикацию). Кроме того, сообщалось о производном хиназолин-4-она в качестве селективного ингибитора PI3K(патентные документы 23-25), и была указана его применимость при воспалении, иммунных заболеваниях или гематологических опухолях (лейкоз и т.п.). Сообщалось о производном тиазолилмочевины в качестве других селективных ингибиторов PI3K (патентный документ 26), наряду с его применимостью при воспалении, иммунных заболеваниях или т.п. Кроме того, позже даты приоритета настоящей заявки было раскрыто изобретение, которое относится к триазиновому или пиримидиновому производному, обладающему селективным ингибирующим действием в отношении PI3K, которое является изобретением из известного уровня техники, выполненным авторами настоящего изобретения (патентный документ 27). Соединение согласно настоящему изобретению отличается от соединения, раскрытого в предшествующей заявке, по структуре группы R1 в формуле (I). Материалы, использованные при экспертизе заявки Патентные документы[Патентный документ 1] Брошюра международной публикации WO 2008/032027.[Патентный документ 2] Брошюра международной публикации WO 2008/032077.[Патентный документ 3] Брошюра международной публикации WO 2008/032086.[Патентный документ 4] Брошюра международной публикации WO 2008/032028.[Патентный документ 5] Брошюра международной публикации WO 2008/032036[Патентный документ 6] Брошюра международной публикации WO 2008/032041.[Патентный документ 7] Брошюра международной публикации WO 2008/032033.[Патентный документ 8] Брошюра международной публикации WO 2008/032060.[Патентный документ 9] Брошюра международной публикации WO 2008/032064.[Патентный документ 10] Брошюра международной публикации WO 2008/032072.[Патентный документ 11] Брошюра международной публикации WO 2008/032089.[Патентный документ 12] Брошюра международной публикации WO 2008/032091.[Патентный документ 13] Брошюра международной публикации WO 2007/042810.[Патентный документ 14] Брошюра международной публикации WO 2008/125839.[Патентный документ 15] Описание опубликованной заявки на европейский патент 1864665.[Патентный документ 16] Брошюра международной публикации WO 2009/007751.[Патентный документ 17] Брошюра международной публикации WO 2009/120094.[Патентный документ 18] Описание опубликованной заявки на европейский патент 1020462.[Патентный документ 20] Брошюра опубликованной заявки на европейский патент 1389617.[Патентный документ 21] Брошюра опубликованной заявки на европейский патент 1557415.[Патентный документ 22] Брошюра опубликованной заявки на европейский патент 1741714.[Патентный документ 23] Брошюра международной публикации WO 01/81346.[Патентный документ 24] Брошюра международной публикации WO 03/035075.[Патентный документ 25] Брошюра международной публикации WO 2005/113556.[Патентный документ 26] Брошюра международной публикации WO 2008/000421.[Патентный документ 27] Брошюра международной публикации WO 2010/092962. Непатентные документы[Непатентный документ 2] BioorganicMedicinal Chemistry Letters, 2006, Vol. 16, p. 5973-5977. Раскрытие изобретения Задачи, подлежащие решению настоящим изобретением Предоставлены фармацевтическая композиция, например фармацевтическая композиция, обладающая ингибирующим действием в отношении PI3K, в частности фармацевтическая композиция для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологических опухолей, и гетероциклическое соединение, которое применимо в качестве активного ингредиента фармацевтической композиции. Средства решения задач Авторы настоящего изобретения широко изучали селективное ингибирующее действие в отношении PI3K и/или ингибирующее продукцию IL-2 действие, и/или ингибирующее пролиферацию В клеток действие (включая ингибирующее активацию действие), и в результате они обнаружили, что новое триазиновое или пиримидиновое производное обладает превосходным селективным ингибирующим действием в отношении PI3K и/или ингибирующим продукцию IL-2 действием, и/или ингибирующим пролиферацию В клеток действием (включая ингибирующее активацию действие) и может представлять собой средство для профилактики и/или лечения реакций отторжения при трансплантации различных органов,аллергических заболеваний, аутоиммунных заболеваний и гематологических опухолей, оформив тем самым настоящее изобретение. То есть настоящее изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли и к фармацевтический композиции, содержащей соединение или его фармацевтически приемлемую соль и наполнитель(где А 2 и А 3 представляют собой N и А 1 представляет собой СН, или А 1 и А 3 представляют собой N и А представляет собой СН,В представляют собой СН,R1 представляет собой -L1-L2-Y, где -L1-L2- представляет собой -NH- или -О-,Y представляет собой неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который может быть замещен одним или несколькими заместителями, выбранными из группы D1, и группа D1 состоит изL5a-(неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который может быть замещенным одним или более заместителей, выбранных из группы, состоящей из С 1-6 алкила, -С(О)O-С 1-6 алкила, -C(О)-С 1-6 алкила и оксо), где L5a представляет собой связь или -C(О)-. Если не указано иное, то в случае, когда обозначения химических формул согласно настоящему описанию также используются в других химических формулах, одни и те же обозначения имеют одни и те же значения. 2 Кроме того, настоящее изобретение относится к фармацевтической композиции для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний,аутоиммунных заболеваний и гематологической опухоли, которая содержит в качестве активного ингредиента соединение формулы (I) или его фармацевтически приемлемую соль. Кроме того, фармацевтическая композиция включает средство для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли, которое содержит соединение формулы (I) или его фармацевтически приемлемую соль. Согласно конкретному варианту осуществления настоящее изобретение относится к средству для профилактики и/или лечения реакций отторжения при трансплантации почек, печени и сердца, согласно другому варианту осуществления - к средству для профилактики и/или лечения хронического отторжения и острого отторжения и согласно еще одному варианту осуществления - к средству для профилактики и/или лечения отторжения, связанного с антителами. Кроме того, настоящее изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой соли при производстве фармацевтической композиции для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний,аутоиммунных заболеваний и гематологической опухоли, к использованию соединения формулы (I) или его фармацевтически приемлемой соли для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли, к соединению формулы (I) или его фармацевтически приемлемой соли для профилактики и/или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний,аутоиммунных заболеваний и гематологической опухоли и к способу профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли, включающему введение субъекту эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В настоящем документе термин"субъект" представляет собой человека или любое из других животных, нуждающееся в соответствующей профилактике или лечении, и согласно конкретному варианту осуществления, нуждающегося в соответствующей профилактике или лечении человека. Кроме того, настоящее изобретение относится к селективному ингибитору PI3K, и/или к ингибитору продукции IL-2, и/или к ингибитору пролиферации В клеток, каждый из которых содержит соединение формулы (I) или его фармацевтически приемлемую соль. Эффекты настоящего изобретения Соединение формулы (I) обладает селективным ингибирующим действием в отношении PI3K и/или ингибирующим продукцию IL-2 действием, и/или ингибирующим пролиферацию В клеток действием (включая ингибирующее активацию действие), а потому может быть использовано в качестве средства для профилактики или лечения реакций отторжения при трансплантации различных органов, аллергических заболеваний, аутоиммунных заболеваний и гематологической опухоли. Варианты осуществления настоящего изобретения Ниже настоящее изобретение будет описано более подробно."С 1-6 алкил" представляет собой неразветвленный или разветвленный алкил, содержащий от 1 до 6 атомов углерода, и его примеры включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, н-гексил и т.п. Согласно другому варианту осуществления низший алкил представляет собой C1-4 алкил, согласно другому варианту осуществления - метил, этил или трет-бутил и согласно другому варианту осуществления - метил."Неароматический гетероцикл" представляет собой неароматический гетероцикл, содержащий 4-8 кольцевых членов, содержащих в качестве составляющего кольцо атома по меньшей мере один гетероатом, выбранный из О, N и S, который может содержать ненасыщенные связи в части кольца и может быть соединен мостиковой связью. Неароматический гетероцикл может быть конденсирован с бензольным кольцом или ароматическим гетероциклом. Кроме того, атом серы, который представляет собой составляющий кольцо атом, может быть окислен. Примеры неароматического гетероцикла включают азетидинил, пирролидинил, пиперидинил, пиперазинил, азепанил, диазепанил, морфолинил, тиоморфолинил, хинуклидинил, 1,1-диоксидтиоморфолинил, тетрагидропиридинил, оксэтанил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиенил, 4,5-дигидротиазолил, диоксоланил, диоксанил, тетрагидротиопиранил, тетрагидроизохинолил, оксазолидинил, тропан, 3,9-диазаспиро[5.5]ундеканил, 2,8 диазаспиро[4.5]деканил, октагидропирроло[1,2-а]пиразил, 5,6,7,8-тетрагидро-1,7-нафталидил, 3,4 дигидро-2 Н-1,4-бензоксазинил, 1,3-бензодиоксолил, хроменил, 1,4-бензтиазинил, 4,5-дигидро-1,3 тиазолил и т.п. Согласно другому варианту осуществления неароматический гетероцикл представляет собой азетидинил, пирролидинил, пиперидинил, иперазинил, морфолинил, тетрагидрофуранил, тетрагидропиранил или азепанил, согласно другому варианту осуществления - пирролидинил, пиперидинил,тетрагидропиранил или азепанил, согласно другому варианту осуществления - пиперидинил и согласно другому варианту осуществления - пирролидинил. Согласно настоящему описанию выражение "который может быть замещен" означает отсутствие замещения или замещение 1-5 заместителями. Согласно определенным вариантам осуществления это представляет собой отсутствие замещения или замещение 1-3 заместителями, согласно другому варианту осуществления отсутствие замещения или замещение 1 заместителем, и согласно другому варианту осуществления - отсутствие замещения. Кроме того, в случае множества заместителей заместители могут быть одинаковыми или отличаться друг от друга. Кроме того, согласно другому варианту осуществления, группа D1 состоит из-L5a-(неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома, который может быть замещен одним или несколькими заместителями, выбранными из группы, состоящей из С 1-6 алкила,-C(О)O-С 1-6 алкила, -С(О)-С 1-6 алкила и оксо), где L5a представляет собой связь или -C(О)-. Определенные варианты осуществления соединения формулы (I) согласно настоящему изобретению представлены ниже.(1) Согласно определенному варианту осуществления А 1, А 2 и А 3, А 1 и А 3 представляют собой N и 2 А представляет собой СН, и согласно другому варианту осуществления А 2 и А 3 представляют собой N и А 1 представляет собой CH.(2) Согласно определенному варианту осуществления В, все В представляют собой СН.(3) Согласно определенному варианту осуществления R1, R1 представляет собой -L1-L2-Y.(4) Согласно определенному варианту осуществления L1, L1 представляет собой -NH- или -O-, согласно еще одному другому варианту осуществления -NH- и, кроме того, согласно другому варианту осуществления -О-.(5) Согласно определенному варианту осуществления L2 представляет собой связь.(6) Согласно определенным вариантам осуществления Y, Y представляет собой неароматический гетероцикл, который может быть замещен одним или несколькими заместителями, выбранными из группы D1.(7) Соединение или его фармацевтически приемлемая соль, которое представляет собой сочетание любых двух или нескольких из описанных выше вариантов осуществления (1)-(6). Соединение или его фармацевтически приемлемая соль, которое представляет собой сочетание любых двух или нескольких из описанных выше вариантов осуществления (1)-(6), также включены в настоящее изобретение, как описано выше в п.(7), и его конкретные примеры также включают следующие варианты осуществления.(8) Соединение или его фармацевтически приемлемая соль, как описано в формуле (I), в которой А 2 3 и А представляют собой N и А 1 представляет собой СН.(9) Соединение или его фармацевтически приемлемая соль, как описано в п.(8), где -L1-L2- представляет собой -NH- или -О-.(10) Соединение или его фармацевтически приемлемая соль, как описано в п.(9), где Y представляет собой неароматический гетероцикл, содержащий 4-8 кольцевых членов, содержащих в качестве составляющего кольцо атома по меньшей мере один гетероатом, выбранный из О, N и S, который может быть замещен -C(О)-(неароматический гетероцикл, содержащий от 4 до 8 членов цикла, содержащий по меньшей мере 1 гетероатом, выбранный из О, N и S в качестве составляющего цикл атома). Примеры конкретных соединений, которые включены в соединение формулы (I) или его фармацевтически приемлемую соль, включают следующие соединения:[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) пирролидин-1-ил][(2R)-тетрагидрофуран-2-ил]метанон,[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) пирролидин-1-ил](тетрагидро-2 Н-пиран-4-ил)метанон,метил-4-[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4 иламино)пирролидин-1-ил]карбонилпиперидин-1-карбоксилат,[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси) пирролидин-1-ил](тетрагидрофуран-3-ил)метанон,4-[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси) пирролидин-1-ил]карбонил-1-метилпирролидин-2-он,[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) пирролидин-1-ил](тетрагидрофуран-3-ил)метанон,4-[(3S)-3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) пирролидин-1-ил]карбонил-1-метилпирролидин-2-он или 4-[3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) азетидин-1-ил]карбонил-1-метилпирролидин-2-он. В зависимости от вида заместителей соединение формулы (I) может существовать в форме таутомеров или геометрических изомеров. Согласно настоящему описанию соединение формулы (I) будет описано только в одной форме изомера, хотя настоящее изобретение включает другие изомеры, выделенные формы изомеров или их смеси. Кроме того, в некоторых случаях соединение формулы (I) может содержать асимметричные атомы углерода или осевую асимметрию, и, соответственно, оно может существовать в форме основанных на этом оптических изомеров. Настоящее изобретение включает как выделенную форму оптических изомеров соединения формулы (I), так и их смеси. Более того, в зависимости от вида заместителей фармацевтически приемлемая соль соединения формулы (I) может образовывать кислотно-аддитивную фармацевтически приемлемую соль или фармацевтически приемлемую соль с основанием, и такие соли включены в настоящее изобретение. Их конкретные примеры включают кислотно-аддитивные фармацевтически приемлемые соли с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, йодисто-водородная кислота,серная кислота, азотная кислота и фосфорная кислота, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, малеиновая кислота, молочная кислота, яблочная кислота, миндальная кислота, винная кислота, дибензилвинная кислота, дитолуолвинная кислота, лимонная кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, паратолуолсульфоновая кислота, аспарагиновая кислота и глутаминовая кислота, и соли с неорганическими основаниями, такими как натрий, калий, магний, кальций и алюминий, или с органическими основаниями, такими как метиламин,этиламин, этаноламин, лизин и орнитин, соли с различными аминокислотами, такими как ацетиллейцин,и производными аминокислот, а также соли аммония. Кроме того, настоящее изобретение также включает различные гидраты или сольваты и полиморфные кристаллические вещества соединения формулы (I) и его фармацевтически приемлемых солей. Кроме того, настоящее изобретение также включает соединения, меченные различными радиоактивными или нерадиоактивными изотопами."Селективный ингибитор PI3K" означает проявляющий мощную активность ингибитор, причем ингибирующая активность в отношении PI3K в 10 раз или более, согласно другому варианту осуществления в 30 раз или более и согласно другому варианту осуществления в 100 раз или более превышает ингибирующую активность в отношении PI3K в единицах значений IC50. Способы получения. Соединение формулы (I) и его фармацевтически приемлемые соли могут быть получены с использованием различных известных способов синтеза на основе характеристик, проистекающих из структуры остова их молекул или типа их заместителей. В некоторых случаях в процессе получения замена релевантной функциональной группы подходящей защитной группой (группа, которая может быть легко преобразована в релевантную функциональную группу) на стадии получения промежуточного вещества из исходного вещества может быть эффективной в зависимости от типа функциональной группы в технологии производства. Примеры такой функциональной группы включают аминогруппу, гидроксильную группу и карбоксильную группу, и такая защитная группа для такой функциональной группы может включать, например, защитные группы, описанные в Greene and Wuts, "Protective Groups in Organic Synthesis (3rd edition, 1999)", которые при необходимости могут быть выбраны и использоваться в зависимости от условий реакции. В таком способе после введения защитной группы и последующей реакции защитная группа может быть удалена при необходимости получения целевого соединения. Ниже будут описаны типичные способы получения соединения формулы (I). Каждый из способов получения также может проводиться в соответствии со ссылками, приложенными к настоящему описанию. Кроме того, способы получения согласно настоящему изобретению не ограничены представленными ниже примерами. Способ получения 1(где X представляет собой уходящую группу, R21 представляет собой -L1-L2-Y, где -L1-L2- представляет собой -NH- или -O-. То же следует применять и далее в настоящем документе). Соединение (I-1) согласно настоящему изобретению может быть получено посредством реакции ипсо-замещения соединения (1), например, -L1-L2-Y. Примеры уходящей группы X включают галоген, метилсульфинильные, метилсульфонильные группы и т.п. Указанное взаимодействие проводят путем использования соединения (1) и, например, соединения-L1-L2-Y в эквивалентных количествах или каждого в избытке, перемешивания их смеси в растворителе,который является инертным по отношению к реакционной смеси, или в отсутствие растворителя, в диапазоне температур от температуры охлаждения до нагревания и перегонки с обратным холодильником,предпочтительно при 0-100 С, обычно в течение 0,1 ч - 5 суток. Примеры используемого в этой реакции растворителя конкретно не ограничены, но включают такие ароматические углеводороды, как бензол,толуол, ксилол и т.п., эфиры, такие как диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и т.п., галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п., N,Nдиметилформамид, N,N-диметилацетамид, диметилсульфоксид, этилацетат, ацетонитрил и их смеси. В некоторых случаях для облегчения процесса протекания реакции является предпочтительным использование таких органических оснований, как триэтиламин, N,N-диизопропилэтиламин, N-метилморфолин и т.п., или неорганических оснований, таких как карбонат калия, карбонат натрия, карбонат цезия, гидроксид калия и т.п. В некоторых случаях для облегчения процесса протекания реакции может быть полезным проведение реакции путем нагревания реакционной смеси микроволновым облучением. Документы Соединение формулы (I-2) может быть получено путем осуществления взаимодействия соединения(2) и соединения (3). Условия реакции были теми же, что и в способе получения 1. Способ получения 3(где L12 представляет собой -низший алкинилен.) Соединение (I-3) согласно настоящему изобретению может быть получено в реакции сочетания по Соногашира соединения (4) и содержащего концевой алкин производного. Примеры уходящей группы X включают галоген и т.п. Указанное взаимодействие проводят путем использования соединения (4) и содержащего концевой алкин производного в эквивалентных количествах, или каждого в избытке, и перемешивания их смеси в растворителе, который является инертным по отношению к реакционной смеси, в температурных условиях, варьирующих от комнатной температуры до температуры нагревания, и перегонки с обратным холодильником обычно в течение 0,1 ч - 5 суток, в присутствии основания и палладиевого катализатора. Указанное взаимодействие предпочтительно проводят в атмосфере инертного газа. Примеры используемого в этой реакции растворителя конкретно не ограничены, но включают такие ароматические углеводороды, как бензол, толуол, ксилол и т.п., эфиры,такие как диэтиловый эфир, тетрагидрофуран, диоксан, диметоксиэтан и т.п., галогенированные углеводороды, такие как дихлорметан, 1,2-дихлорэтан, хлороформ и т.п., спирты, такие как метанол, этанол, 2 пропанол, бутанол и т.п., N,N-диметилформамид, диметилсульфоксид и их смешанный растворитель. В качестве основания предпочтительными являются неорганические основания, такие как карбонат калия,карбонат натрия, карбонат цезия, гидроксид калия и т.п. В качестве палладиевого катализатора, предпочтительным является тетракис(трифенилфосфин)палладий, дихлорбис(трифенилфосфин)палладий, палладий-1,1'-бис(дифенилфосфино)ферроценхлорид и т.п. Кроме того, в некоторых случаях для облегчения процесса протекания реакции может быть полезным проведение реакции путем нагревания реакционной смеси микроволновым облучением. Документыof Japan, Vol. 13 (2005) (Maruzen). Различные заместители на R1 в соединении формулы (I) могут быть легко преобразованы в другие функциональные группы путем использования соединения формулы (I) в качестве исходного вещества и посредством взаимодействий, описанных в представленных далее примерах, причем взаимодействия очевидны специалистам в данной области техники, или их модифицированными способами. Например,стадии, которые могут обычно использоваться специалистами в данной области техники, такие как Оалкилирование, N-алкилирование, окисление, восстановление, восстановительное алкилирование, образование кольца, гидролиз, амидирование, ацилирование, снятие защитных групп, эпоксилирование и т.п.,могут быть произвольно объединены и осуществлены. Получение исходного соединения. Согласно вышеуказанному способу получения исходное соединение может быть получено с использованием, например, любого их указанных ниже способов, способов, описанных в представленных далее примерах получения, известных способов или их модифицированных способов. Синтез исходных веществ 1 Настоящий способ получения представляет собой способ получения соединения (9), в котором X представляет собой S(O)m-метил в соединении (1), которое представляет собой исходное соединение в способе получения 1. Соединение (7) может быть получено путем осуществления взаимодействия соединения (5) с соединением (6). Условия реакции являются такими же, как и в способе получения 1. Соединение (8) может быть получено путем осуществления взаимодействия соединения (7) с соединением (3). Условия реакции являются такими же, как и в способе получения 1. Соединение (9) может быть получено в реакции окисления соединения (8). Указанное взаимодействие проводили с использованием соединения (9) в эквивалентном количестве или в избытке, в температурном диапазоне от охлаждения до нагревания. В качестве растворителя могут быть использованы такие растворители, как ароматические углеводороды и галогенированные углеводороды, отдельно или в виде смеси двух или нескольких видов растворителей. Примеры окислителя включают метахлорпероксибензойную кислоту, пероксиуксусную кислоту и раствор пероксида водорода. Синтез исходных веществ 2 Настоящий способ получения представляет собой способ получения соединения (13), в котором X представляет собой S(O)m-метил и R1 представляет собой R21 в соединении (2), которое представляет собой исходное соединение в способе получения 2. Соединение (11) может быть получено путем осуществления взаимодействия соединения (10) с соединением (6). Условия реакции являются такими же, как и в способе получения 1. Соединение (12) может быть получено путем осуществления реакции ипсо-замещения соединения(11), например, -L1-L2-Y. Условия реакции являются такими же, как и в способе получения 1. Соединение (13) может быть получено в реакции окисления соединения (12). Условия реакции являются такими же, как и в реакции окисления, описанной в синтезе исходного вещества 1. Другие исходные соединения (1), (2) и (4) могут быть получены, например, способами, описанными в следующих документах: WO 2002/088112, ЕР 1389617, WO 2008/032033, WO 2008/032036, WO 2008/032041 или WO 2008/032060. Соединения формулы (I) могут быть выделены и очищены в виде их свободных соединений, фармацевтически приемлемых солей, гидратов, сольватов или их полиморфных кристаллических веществ. Фармацевтически приемлемые соли соединения формулы (I) могут быть получены путем осуществления обработки в традиционной реакции образования соли. Выделение и очистку проводили путем использования обычных химических операций, таких как экстракция, фракционная кристаллизация, различные типы фракционной хроматографии и т.п. Различные изомеры могут быть получены путем выбора соответствующего исходного соединения или разделены с использованием различия в физико-химических свойствах между изомерами. Например,оптические изомеры могут быть получены посредством общего способа проведения оптического расщепления рацематов (например, фракционная кристаллизация для индукции диастереоизомерных солей с оптически активными основаниями или кислотами, хроматография с применением хиральной колонки и т.п. и другие), и, кроме того, изомеры также могут быть получены из соответствующего оптически активного исходного соединения. Фармакологическая активность соединения формулы (I) была подтверждена в тестах, представленными ниже. 1. Ингибирующая активность в отношении фермента PI3K. В этом эксперименте использовали набор для анализа PI3-киназы методом HTRF (Millipore Corporation, по каталогу 33-016) и фермент PI3K человека (Millipore Corporation, по каталогу 14-604). Способ измерений соответствовал приложенным инструкциям. Его краткое описание состоит в следующем. В 384-луночном планшете смешивали PI3K (10 нг/лунку), фосфатидилинозитол-4,5-бисфосфат (10 мкМ), АТР (30 мкМ) и тестируемое соединение (всего 20 мкл) и инкубировали при комнатной температуре в течение 30 мин. Для остановки реакции в смесь добавляли ЭДТА и биотинилированный фосфатидилинозитол-3,4,5-трифосфат. После этого в смесь добавляли меченное европием анти-GST антитело,связанный с GST домен GRP1 РН и стрептавидин-АРС, а затем инкубировали в течение ночи. Соотношение HTRF измеряли с использованием планшетного HTRF ридера. Значение IC50 соединения вычисляли логистическим методом, принимая скорость ингибирования без добавления фермента за 100% и скорость ингибирования без добавления тестируемого соединения, но с добавлением фермента за 0%. 2. Ингибирующая активность в отношении фермента PI3K. В 384-луночном планшете в реакционном буфере (50 мМ Hepes, 10 мМ NaCl, 10 мМ MgCl2, 2 мМ 14-602), фосфатидилинозитол (0,2 мкг/лунку) и тестируемое соединение (всего 10 мкл) и инкубировали при температуре 37 С в течение 3 ч. После реакции в смесь добавляли 10 мкл реагента Kinase-Glo Plus(Promega, по каталогуV3772) и измеряли люминесценцию на люминометре. Значение IC50 соединения вычисляли логистическим методом, принимая скорость ингибирования без добавления фермента за 100% и скорость ингибирования без добавления тестируемого соединения за 0%. Значения IC50 (нМ) для некоторых типичных соединений представлены в табл. 1. В этой таблице"Пример" представляет собойпримера, описанного ниже для тестируемых соединений. Таблица 1 Помеченныесоединения не охватываются формулой изобретения. 3. Тест на ингибирование продукции IL-2 у крыс in vivo. В эксперименте использовали самцов крыс LEW/CrlCrlj (Charles River Laboratories, Japan, Inc.) (в возрасте 6 недель, масса тела от 130 до 180 г). Тестируемое соединение суспендировали в 0,5% растворе метилцеллюлозы и вводили перорально в количестве 5 мл/кг. Продукцию IL-2 индуцировали путем инъекции конканавалина A (Funakoshi Corporation, по каталогуL-1000) в хвостовую вену в дозе 15 мг/кг. Тест проводили в соответствии с протоколом, представленным ниже. За 2 ч или за 16 ч до введения конканавалина А крысам перорально вводили тестируемое соединение. Через 3 ч после введения конканавалина А собирали кровь. Концентрацию IL-2 в крови определяли количественно с использованием набора ELISA (RD Systems, Inc., по каталогуDY502E). Степень ингибирования вычисляли как отношение количества IL-2, продуцируемого в получавшей тестируемое соединение группе, к количествуIL-2, продуцируемого в контрольной группе с введением растворителя. В результате было подтверждено, что при введении тестируемого соединения (10 мг/кг), например,за 2 ч до введения конканавалина А, некоторые типичные соединения примеров 10, 29, 33, 34, 37, 43-1 и А 4 демонстрировали значения ингибирующей активности, равные 77, 51, 75, 72, 81, 73 и 58% соответственно, и обладали превосходным ингибирующим продукцию IL-2 активностью. 4. Тест на ингибирование пролиферации В клеток у крыс. В 96-луночном планшете в культуральной среде RPMI-1640 с добавлением 10% FCS смешивали клетки селезенки (1,0105 клеток/лунку), полученные от самцов крыс LEW/CrlCrlj (Charles River Laboratories, Japan, Inc.), мышиный F(ab')2 фрагмент анти-крысиного IgM (3 мкг/лунку, SouthernBiotech Associates, Inc., по каталогу 3082-14) и растворенное в ДМСО тестируемое соединение (конечная концентрация ДМСО 0,1%) (всего 200 мкл). Клетки культивировали в СО 2 инкубаторе в течение 48 ч и за 4 ч до завершения культивирования в смесь добавляли [3 Н]тимидин (925 ГБк/ммоль, Moravek Biochemicals,Inc., по каталогуМТ 6038) в количестве 0,037 МБк/лунку. Клетки собирали на GF/C стеклянный фильтр с использованием харвестера клеток и измеряли радиоактивность фильтра и использованием жидкостного сцинтилляционного счетчика. Логистическим методом вычисляли значение IC50 для соединения, принимая dpm (число распадов в минуту) без добавления IgM за скорость ингибирования в 100% и dpm без добавления тестируемого соединения за скорость ингибирования в 0%. Результаты для некоторых типичных соединений представлены в табл. 2. Таблица 2 Помеченныесоединения не охватываются формулой изобретения. В представленных выше тестах было подтверждено, что некоторые типичные соединения обладают превосходным селективным ингибирующим действием в отношении PI3K, и/или ингибирующим продукцию IL-2 действием, и/или ингибирующим пролиферацию В клеток действием (включая ингибирующее активацию действие). Соответственно, соединение формулы (I) может быть использовано в качестве средства для профилактики или лечения реакций отторжения при трансплантации различных органов,аллергических заболеваний, аутоиммунных заболеваний и/или гематологических опухолей. Кроме того, поскольку соединение формулы (I) представляет собой ингибитор PI3K, обладающий существенно более мощным ингибирующим действием в отношении PI3K, чем ингибирующее действие в отношении PI3K, оно может являться превосходным иммуносупрессирующим средством, не вызывающим резистентности к инсулину, основанной на ингибирующем действии в отношении PI3K. Различные типы органов включают почки, печень и сердце. Реакция отторжения при трансплантации органов включает хроническое отторжение и острое отторжение, и ее механизм в основном классифицируют на отторжение, связанное с антителами, и отторжение, связанное с Т клетками. Соединение формулы (I) или его фармацевтически приемлемая соль применимы, в частности, в качестве средства для профилактики и/или лечения отторжения, связанного с антителами. Фармацевтическая композиция, содержащая в качестве активного ингредиента один или два или несколько видов соединения формулы (I) или его фармацевтически приемлемая соль, может быть приготовлена с использованием наполнителей, которые обычно используют в данной области техники, то есть наполнителей для фармацевтических препаратов, носителей для фармацевтических препаратов и т.п., в соответствии с обычно применяемыми способами. Введение может быть выполняться либо путем перорального введения посредством таблеток, пилюль, капсул, гранул, порошков, растворов и т.п., либо путем парентерального введения, такого как применение инъекций, таких как внутрисуставная, внутривенная и внутримышечная инъекции, суппозиториев, глазных капель, глазных мазей, чрескожных жидких препаратов, мазей, чрескожных пластырей,чресслизистых жидких препаратов, чресслизистых пластырей, средств для ингаляций и т.п. Твердую композицию для применения при пероральном введения используют в форме таблеток,порошков, гранул и т.п. В такой твердой композиции один или несколько активных ингредиентов смешивают по меньшей мере с одним неактивным наполнителем, таким как лактоза, маннит, глюкоза, гидроксипропилцеллюлоза, микрокристаллическая целлюлоза, крахмал, поливинилпирролидон и/или алюмометасиликат магния. В стандартном способе композиция может содержать неактивные добавки, такие как смазка, такая как стеарат магния, разрыхлитель, такой как карбоксиметилкрахмал натрия, стабилизатор или средство, способствующее растворимости. При необходимости, таблетки или пилюли могут быть покрыты сахаром или пленкой из желудочно-растворимого или кишечно-растворимого вещества. Жидкая композиция для перорального введения включает фармацевтически приемлемые эмульсии,растворы, суспензии, сиропы, эликсиры и т.п. и также содержит обычно используемые инертные разбавители, например очищенную воду и этанол. В дополнение к инертному разбавителю жидкая композиция также может содержать вспомогательные средства, такие как средство, способствующее растворимости, увлажнитель, и средство, способствующее суспендированию, подсластители, вкусоароматизаторы, отдушки или антисептики. Инъекции для парентерального введения включают стерильные водные или неводные растворы,суспензии и эмульсии. Водный растворитель включает, например, дистиллированную воду для инъекций и физиологический солевой раствор. Примеры неводного растворителя включают пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, спирты, такие как этанол, полисорбат 80 (Японская Фармакопея) и т.п. Такая композиция может дополнительно содержать средство, регулирующее тоничность, антисептик, увлажнитель, эмульгатор, средство, способствующее диспергированию,стабилизатор или средство, способствующее растворимости. Композиции стерилизуют, например, путем фильтрования через задерживающий бактерии фильтр, смешивания с бактерицидом или облучения. Кроме того, композиции также могут быть использованы путем приготовления стерильной твердой композиции и ее растворения или суспендирования в стерильной воде или стерильном растворителе для инъекций перед ее применением. Средство для наружного применения включает мази, пластыри, кремы, желе, припарки, спреи,лосьоны, глазные капли и глазные мази. Средства содержат обычно используемые основы для мазей,основы для лосьонов, водные и неводные жидкие препараты, суспензии и эмульсии. Примеры основ для мазей или основ для лосьонов включают полиэтиленгликоль, пропиленгликоль, белый вазелин, обесцвеченный пчелиный воск, полиоксиэтиленгидрогенизованное касторовое масло, глицерилмоностеарат, стеариловый спирт, цетиловый спирт, лауромакрогол и сорбитансесквиолеат. В качестве чресслизистых средств, таких как средство для ингаляций и трансназальное средство,используют средства в твердом, жидком или полутвердом состояния, которые могут быть приготовлены в соответствии с общепринятым известным способом. Например, соответствующим образом может быть добавлен известный наполнитель, а также средство для регулирования уровня рН, антисептик, поверхностно-активное вещество, смазка, стабилизатор, загуститель и т.п. Для введения может быть использовано подходящее устройство для ингаляции или нагнетания воздуха. Например, соединение может быть введено отдельно или в порошковой составленной смеси или в виде раствора или суспензии в сочетании с фармацевтически приемлемым носителем, с использованием известного устройства или распылителя,такого как устройство для ингаляции с дозированным введением. Для однократного или многократного введения может применяться порошковый ингалятор и т.п. и может быть использован сухой порошок или капсула, содержащая порошок. В качестве альтернативы средство может быть в форме, такой как аэрозольный спрей под давлением, в котором используют подходящий пропеллент, например подходя- 13023931 щий газ, такой как хлорфторалкан, гидрофторалкан и углекислый газ. Как правило, при пероральном введении суточная доза составляет соответственно приблизительно от 0,001 до 100 мг/кг, предпочтительно от 0,1 до 30 мг/кг и более предпочтительно от 0,1 до 10 мг/кг массы тела, введенных одной порцией или 2-4 отдельными порциями. В случае внутривенного введения соответствующим образом вводят суточную дозу приблизительно от 0,0001 до 10 мг/кг массы тела, один раз в сутки или дважды или несколько раз в сутки. Кроме того, чресслизистое средство вводят в дозе приблизительно от 0,001 до 100 мг/кг массы тела один раз в сутки, или дважды, или несколько раз в сутки. Доза соответствующим образом определяется на основании конкретного случая, принимая во внимание симптомы, возраст, пол и т.п. Несмотря на вариации, зависящие от путей введения, лекарственных форм, участков введения или типов наполнителей и добавок, фармацевтическая композиция согласно настоящему изобретению содержит от 0,01 до 100 вес.%, а в некоторых вариантах осуществления от 0,01 до 50 вес.% одного или нескольких видов соединения формулы (I) или его фармацевтически приемлемой соли, которое представляет собой активный ингредиент. Соединение формулы (I) может быть использовано в сочетании с различными средствами для лечения или профилактики заболеваний, при которых соединение формулы (I) считается эффективным. При таком сочетанном применении лекарства могут быть введены одновременно или отдельно, последовательно или через желаемые временные интервалы. Составы для одновременного введения могут быть либо смешанными, либо иметь раздельные формы. Примеры Здесь и далее в тексте способы получения соединения формулы (I) и его исходных соединений будут описаны более детально со ссылкой на примеры, но настоящее изобретение не ограничивается соединениями, описанными ниже в примерах. Кроме того, в примерах получения будут описаны способы получения каждого из исходных соединений. Кроме того, способы получения соединения формулы (I) не ограничиваются способами получения в представленных ниже конкретных примерах, но соединение формулы (I) может быть получено путем сочетания способов получения или некоторого способа, который очевиден специалисту в данной области техники. Кроме того, в некоторых случаях в представленных ниже примерах получения, примерах и таблицах могут использоваться следующие сокращения. Рех -примера получения; Ex -примера; Syn -примера, полученного тем же способом; Psynпримера получения, полученного тем же способом; Str - структурная формула; DAT - физикохимические данные; ESI+ - значения m/z при масс-спектрометрии (ионизация ESI, данные представлены в виде (М+Н)+, если не указано иное); ESI- - значения m/z (ионизация ESI, данные представлены в виде(М+Н)-, если не указано иное); ЯМР 1 -(м.д.) при 1H-ЯМР в ДМСО-d6; ЯМР 2 -(м.д.) при 1H-ЯМР вCDCl3; с - синглет (спектр); д - дублет (спектр); т - триплет (спектр); кв. - квартет (спектр); ушир. - уширенный (спектр) (например: ушир.с); RT - время удерживания (мин) при ВЭЖХ; [М] в примерах получения и примерах - [моль/л]; препаративная SFC - препаративная сверхкритическая жидкостная хроматография, DEA - диэтиламин. Кроме того, например, описание "26+44" в колонке Syn таблиц с примерами указывает на то, что данное получение проводят тем же способом, что и описанный в примере 26, а затем получают продукт тем же способом, что и описанный в примере 44, в качестве исходного вещества. Кроме того, в таблицах примеров получения, например, в колонке PSyn примера получения 148 присутствует обозначение Syn. 87, что означает, что соединение примера получения 148 получают тем же способом, что и описанный в примере 87. В таблицах примеров, например, в колонке Syn примера 295 присутствует обозначениеPSyn. 8, что означает, что соединение примера 295 получают тем же способом, что и описанный в примере получения 8. В структурной формуле HCl означает гидрохлорид, и цифра перед HCl означает молярное отношение. Например, 2HCl означает дигидрохлорид. Кроме того, в структурной формуле Me означает метильную группу, Et означает этильную группу, Ph означает фенильную группу, iBu означает изобутильную группу, tBu означает трет-бутильную группу, и Boc означает трет-бутоксикарбонильную группу. Содержащееся обозначение в структуре соединения указывает на то, что соединение является оптически активным веществом. Пример получения 1. К раствору 4,6-дихлор-2-(метилсульфанил)пиримидина (5 г) в N,N-диметилформамиде (50 мл) добавляли карбонат калия (5,3 г) и 2-(дифторметил)-1 Н-бензимидазол (3,9 г) и перемешивали смесь при комнатной температуре в течение 5 ч. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 1-[6-хлор-2(метилсульфанил)пиримидин-4-ил]-2-(дифторметил)-1 Н-бензимидазола (5,49 г) в виде белого порошка. Пример получения 2. К раствору 1-[6-хлор-2-(метилсульфанил)пиримидин-4-ил]-2-(дифторметил)-1 Н-бензимидазола (2,2 г) в N,N-диметилформамиде (11 мл) добавляли карбонат калия (1,4 г) и морфолин (0,88 мл) и перемеши- 14023931 вали смесь при комнатной температуре в течение 1 ч. К реакционному раствору добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 2-(дифторметил)-1-[2-(метилсульфанил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (2,1 г) в виде белого порошка. Пример получения 3. К раствору 2-(дифторметил)-1-[2-(метилсульфанил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (3 г) в дихлорметане (60 мл) при охлаждении на льду добавляли метахлорпероксибензойную кислоту (75% влажность, 1,9 г) и перемешивали смесь при 0 С в течение 15 мин. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 2-(дифторметил)1-[2-(метилсульфинил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (2,8 г) в виде бледножелтого аморфного вещества. Пример получения 4. К раствору 2-(дифторметил)-1-[2-(метилсульфанил)-6-морфолин-4-илпиримидин-4-ил]-1 Нбензимидазола (2,1 г) в дихлорметане (21 мл) при охлаждении на льду добавляли метахлорпероксибензойную кислоту (75% влажность, 2,7 г) и перемешивали смесь при 0 С в течение 15 мин. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали дихлорметаном. Органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 2(дифторметил)-1-[2-(метилсульфонил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (2,27 г) в виде бледно-желтого аморфного вещества. Пример получения 15. 2-(Дифторметил)-1-[2-(метилсульфанил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазол (2,1 г) растворяли в хлористом метилене (21 мл), при охлаждении на льду добавляли метахлорпероксибензойную кислоту (75% влажность, 2,7 г), а затем перемешивали при 0 С в течение 15 мин. Добавляли насыщенный водный бикарбонат натрия, а затем экстрагировали хлористым метиленом. Экстракты промывали водой и насыщенным солевым раствором, органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением 2-(дифторметил)-1-[2(метилсульфонил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (2,27 г) в виде бледно-желтого аморфного вещества. Пример 1 (не охватываются формулой изобретения). Смесь 2-дифторметил-1-[2-(метилсульфонил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола(770 мг), трет-бутил-(3S)-3-аминопирролидин-1-карбоксилата (525 мг), карбоната калия (390 мг) и N,Nдиметилацетамида (19 мл) перемешивали в микроволновом реакторе при 100 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, затем вливали в воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=80/20-50/50) с получением трет-бутил-(3S)-3-(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-илпиримидин-2-иламино)пирролидин-1-карбоксилата (310 мг) в виде бледно-желтого аморфного вещества. Пример 22 (не охватываются формулой изобретения). Смесь 2-(дифторметил)-1-[2-(метилсульфонил)-6-морфолин-4-илпиримидин-4-ил]-1 Н-бензимидазола (100 мг) , 1-бензил-3-(метиламино)пирролидина (93 мг), карбоната калия (50 мг) и N,Nдиметилацетамида (2,5 мл) перемешивали в микроволновом реакторе при 100 С в течение 1 ч. Реакционную смесь охлаждали до комнатной температуры, затем вливали воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=80/20-50/50). Целевые фракции объединяли и концентрировали в условиях пониженного давления. Остаток растворяли в 1,4-диоксане и добавляли 4 М раствор (61 мкл) хлороводорода в 1,4-диоксане. Затем добавляли диизопропиловый эфир (10 мл). Полученный порошок собирали путем фильтрования, промывали диизопропиловым эфиром и сушили в условиях пониженного давления с получением гидрохлорида пирролидин-3-ил]пиримидин-2-амина (58 мг) и N,N-диметилформамида (1,2 мл) добавляли фенилацетальдегид (21 мг), триацетоксиборгидрид натрия (75 мг) и уксусную кислоту (0,29 мл) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=80/20-50/50, а затем хлороформ/метанол=100/0-80/20) с получением 4[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-[(3S)-1-(2-фенилэтил)пирролидин-3 ил]пиримидин-2-амина (30 мг) в виде белого порошка. Пример 43 (не охватываются формулой изобретения). К раствору 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-(пиперидин-4-илметил) пиримидин-2-амина (400 мг) в 1,2-дихлорэтане (8 мл) добавляли 4-фторциклогексанон (210 мг) и перемешивали смесь при комнатной температуре в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия (382 мг), а затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=70/30-40/60) с получением двух типов представленных ниже соединений, каждого в виде белого порошка. 4-[2-(Дифторметил)-1 Н-бензимидазол-1-ил]-N-[1-(транс-4-фторциклогексил)пиперидин-4 ил]метил-6-(морфолин-4-ил)пиримидин-2-амин (109 мг). Значение Rf при проведении ТСХ на аминосиликагеле (гексан/этилацетат=50/50) для этого соединения составляло 0,35. 4-[2-(Дифторметил)-1 Н-бензимидазол-1-ил]-N-[1-(цис-4-фторциклогексил)пиперидин-4-ил]метил-6-(морфолин-4-ил)пиримидин-2-амин (87 мг). Значение Rf при проведении ТСХ на аминосиликагеле (гексан/этилацетат=50/50) для этого соединения составляло 0,28. Полученный выше 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-N-[1-(транс-4-фторциклогексил) пиперидин-4-ил]метил-6-(морфолин-4-ил)пиримидин-2-амин (80 мг) растворяли в смеси хлороформа(1,5 мл) и метанола (0,3 мл) и добавляли 4 М раствор (0,37 мл) хлороводорода в 1,4-диоксане. Смесь перемешивали при комнатной температуре в течение 10 мин. Реакционную смесь концентрировали с получением дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-N-[1-(транс-4-фторциклогексил) пиперидин-4-ил]метил-6-(морфолин-4-ил)пиримидин-2-амина (соединение примера 43-1, 87 мг) в виде белого порошка. Аналогичным образом, из полученного выше 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-N-[1(цис-4-фторциклогексил)пиперидин-4-ил]метил-6-(морфолин-4-ил)пиримидин-2-амина (62 мг) получали дигидрохлорид 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-N-[1-(цис-4-фторциклогексил)пиперидин-4-ил]метил-6-(морфолин-4-ил)пиримидин-2-амина (соединение примера 43-2, 70 мг) в виде белого порошка. Пример 44 (не охватываются формулой изобретения). К смеси 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)-N-[(1-фенилпиперидин-4 ил)метил]пиримидин-2-амина (38 мг), хлороформа (0,75 мл) и метанола (0,35 мл) добавляли 4 М раствор(0,2 мл) хлороводорода в 1,4-диоксане и перемешивали смесь при комнатной температуре в течение 10 мин. Реакционную смесь концентрировали в условиях пониженного давления с получением дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)-N-[(1-фенилпиперидин-4-ил)метил] пиримидин-2-амина (43 мг) в виде белого порошка. Пример 45 (не охватываются формулой изобретения). К смеси дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-[(3S)пирролидин-3-ил]пиримидин-2-амина (75 мг) и N,N-диметилформамид (1,5 мл) добавляли 2(диметиламино)этилбромид (26 мг) и карбонат калия (85 мг) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50-0/100, а затем хлороформ/метанол=100/0-80/20). Целевые фракции объединяли и концентрировали в условиях пониженного давления. Остаток растворяли в 1,4-диоксане (0,5 мл) и добавляли 4 М раствор (80 мкл) хлороводорода в 1,4-диоксане. Затем добавляли диизопропиловый эфир (10 мл). Полученный порошок собирали путем фильтрования, промывали диизопропиловым эфиром и сушили в условиях пониженного давления с получением дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-N-(3S)-1-[2-(диметиламино) этил]пирролидин-3-ил-6-морфолин-4-илпиримидин-2-амин (10 мг) в виде белого порошка. Пример 52 (не охватываются формулой изобретения). К смеси 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-(пиперидин-4-илметил) пиримидин-2-амина (100 мг) и этанола (2 мл) добавляли 2-(фторметил)оксиран (19 мкл) и N,Nдиизопропилэтиламин (79 мкл) и перемешивали смесь в микроволновом реакторе при 120 С в течение 1 ч. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (этилацетат/гексан) с получением 1-4-[(4-[2-(дифторметил)-1 Н-бензимидазол 1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)метил]пиперидин-1-ил-3-фторпропан-2-ола (81 мг) в виде белого порошка. Пример 53. К смеси трет-бутил-(3S)-3-(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-илпиримидин-2-иламино)пирролидин-1-карбоксилата (300 мг) и 1,4-диоксана (3 мл) добавляли 4M раствор (1,5 мл) хлороводорода в 1,4-диоксане и перемешивали смесь при комнатной температуре в течение 2 ч. К реакционной смеси добавляли диизопропиловый эфир (10 мл). Полученный порошок собирали путем фильтрования, промывали диизопропиловым эфиром и сушили в условиях пониженного давления с получением дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-[(3S)пирролидин-3-ил]пиримидин-2-амина (354 мг) в виде бледно-желтого порошка. Пример 54. К смеси трет-бутил-4-(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-илпиримидин-2 иламино)пиперидин-1-карбоксилата (42 мг) и метанол (0,84 мл) добавляли 4 М раствор хлороводорода в 1,4-диоксане и перемешивали смесь при комнатной температуре в течение 4 ч. Реакционную смесь нейтрализовали добавлением насыщенного водного раствора бикарбоната натрия и экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50) с получением 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4 ил-N-пиперидин-4-илпиримидин-2-амина (27 мг) в виде бледно-желтого порошка. Пример 66 (не охватываются формулой изобретения). К смеси 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-пиперидин-4-илпиримидин-2-амина (18 мг) и N,N-диметилформамида (0,36 мл) добавляли N,N-диметилглицин (4,8 мг), 1 гидроксибензотриазол (6,2 мг) и N-[3-(диметиламино)пропил]-N'-этилкарбодиимида гидрохлорид (8,8 мг) и перемешивали смесь при комнатной температуре в течение 6 ч. К реакционной смеси добавляли воду, а затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на аминосиликагеле (этилацетат, а затем хлороформ/метанол=96/4). Целевые фракции объединяли и концентрировали в условиях пониженного давления. Остаток отверждали путем добавления небольшого количества диизопропилового эфира с получением 4-[2-(дифторметил)-1 Нбензимидазол-1-ил]-N-1-[(диметиламино)ацетил]пиперидин-4-ил]-6-морфолин-4-илпиримидин-2-амин(9 мг) в виде белого порошка. Пример 71 (не охватываются формулой изобретения). К смеси 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-(пиперидин-4-илметил)1,3,5-триазин-2-амина (50 мг) и пиридина (2 мл) добавляли уксусный ангидрид (14 мкл) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли толуол, а затем концентрировали в условиях пониженного давления. Остаток растворяли в дихлорметане, добавляли силикагель, а затем концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат, а затем хлороформ/метанол) с получением N-[(1 ацетилпиперидин-4-ил)метил]-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-1,3,5-триазин-2-амина (44 мг) в виде белого порошка. Пример 74 (не охватываются формулой изобретения). К смеси 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил-N-(пиперидин-4 илметил)пиримидин-2-амина (50 мг) и 1,2-диметоксиэтана (1 мл) добавляли бромбензол (24 мкл),трис(дибензилиденацетон)дипалладий(0) (6,5 мг), дициклогексил(2',4',6'-триизопропилбифенил-2 ил)фосфин (11 мг) и фосфат калия (96 мг) и перемешивали смесь в микроволновом реакторе при 130 С в течение 1 ч. Реакционную смесь фильтровали через целит, добавляли к фильтрату силикагель, а затем концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат) с получением 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6(морфолин-4-ил)-N-[(1-фенилпиперидин-4-ил)метил]пиримидин-2-амина (39 мг) в виде белого порошка. Пример 80 (не охватываются формулой изобретения). Смесь трет-бутил-4-[(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(метилсульфинил)пиримидин 4-илокси)метил]пиперидин-1-карбамата (240 мг), морфолина (0,3 мл) и N,N-диметилацетамида (2 мл) перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором,а затем сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления, а затем очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат=70/30-50/50) с получением трет-бутил-4-[(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2(морфолин-4-ил)пиримидин-4-илокси)метил]пиперидин-1-карбамата (246 мг) в виде белого порошка. Пример 82 (не охватываются формулой изобретения). 1-[4-Хлор-6-(морфолин-4-ил)пиримидин-2-ил]-2-(дифторметил)-1 Н-бензимидазол (100 мг) растворяли в диметилформамиде (1 мл), добавляли 3-метоксипроп-1-ин (45 мкл), тетракис(фенилфосфин)палладий(0) (16 мг), йодид меди(I) (1,3 мг) и карбонат калия (227 мг), а затем перемешивали в микроволновом реакторе при 80 С в течение 1 ч. Добавляли водный раствор хлорида аммония и хлороформ, органический слой экстрагировали, промывали насыщенным солевым раствором, а затем сушили над безводным сульфатом магния. Затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=60/40). Добавляли смесь диизопропилового эфира и гексана, полученное твердое вещество собирали путем фильтрования, а затем промывали гексаном с получением 2-(дифторметил)-1-[4-(3-метоксипропп-1-ин-1-ил)-6-(морфолин-4 ил)пиримидин-2-ил]-1 Н-бензимидазола (10 мг) в виде желтого порошка. Пример 83 (не охватываются формулой изобретения). Метил-транс-4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2 иламино)метил]циклогексанкарбоксилат (150 мг) растворяли в смеси метанола (750 мкл) и тетрагидрофурана (750 мкл), добавляли 1 М водный раствор гидроксида натрия (899 мл), а затем перемешивали при комнатной температуре в течение 2 ч. После завершения реакции при охлаждении на льду добавляли 1 М соляную кислоту до тех пор, пора реакционный раствор не становился слегка кислым, а затем перемешивали при 0 С в течение 1 ч. Полученное твердое вещество собирали путем фильтрования и промывали гексаном с получением транс-4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)метил]циклогексанкарбоновой кислоты (74 мг) в виде белого порошка. Пример 84 (не охватываются формулой изобретения).(919 мг) растворяли в тетрагидрофуране (1,4 мл), охлаждали до 0 С под потоком азота, по каплям добавляли 1,6 М раствор (0,7 мл) гексаметилдисилазана лития в тетрагидрофуране, а затем перемешивали при 0 С в течение 2 ч. Затем по каплям добавляли 1,6 М раствор (0,7 мл) гексаметилдисилазана лития в тетрагидрофуране, а затем перемешивали при 0 С в течение 1 ч. Добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Растворитель выпаривали в условиях пониженного давления и очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат=70/30-0/100) с получением трет-бутил(3S)-1-[транс-4-(6-[2-(дифторметил)-1 Нбензимидазол-1-ил]-2-(морфолин-4-ил)пиридин-4-илокси)циклогексил]-2-оксопирролидин-3-илкарбамата (154 мг). Пример 85 (не охватываются формулой изобретения).(81 мкл) и 2,2-диметилоксиран (36 мкл), а затем перемешивали при 120 С в течение 1 ч и при 140 С в течение 1 ч с использованием микроволнового реактора. Реакционный раствор концентрировали и очищали остаток методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=20/80, а затем хлороформ/метанол=98/2) с получением 1-(4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)метил]бицикло[2,2,2]окт-1-иламино)-2-метилпропан-2-ола (148 мг) в виде белого аморфного вещества. Пример 86 (не охватываются формулой изобретения). 1-(транс-4-[(4-[2-(Дифторметил)-6-метил-1 Н-бензимидазол-1-ил]-6-[(3S)-3-метилморфолин-4 ил]пиримидин-2-иламино)метил]циклогексиламино)-2-метилпропан-2-ол (100 мг) растворяли в тетрагидрофуране (2 мл), добавляли ди-1 Н-имидазол-1-илметанон (131 мг) и триэтиламин (50 мкл), а затем перемешивали в течение 3 ч при нагревании с обратным холодильником. После завершения реакции добавляли воду, а затем экстрагировали этилацетатом. Экстракты промывали насыщенным солевым раствором и сушили над безводным сульфатом магния, а затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=60/40) с получением 3-транс-4-[(4-[2-(дифторметил)-6-метил-1 Н-бензимидазол-1-ил]6-[(3S)-3-метилморфолин-4-ил]пиримидин-2-иламино)метил]циклогексил-5,5-диметил-1,3-оксазолидин-2-она (100 мг) в виде белого порошка. Пример 87 (не охватываются формулой изобретения). К (3S)-3-амино-1-[транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси)циклогексил]пирролидин-2-ону (75 мг), триэтиламину (22 мкл) и дихлорметану (750 мкл) добавляли метилхлоркарбонат (12 мкл), а затем перемешивали при комнатной температуре в течение 1 ч. После завершения реакции добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, а затем суши- 18023931 ли над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол) с получением метил(3S)-1-[транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4 илокси)циклогексил]-2-оксопирролидин-3-илкарбамата (55 мг) в виде белого порошка. Пример 88 (не охватываются формулой изобретения). К (3S)-3-амино-1-[транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси)циклогексил]пирролидин-2-ону (75 мг), N-этил-N-изопропилпропан-2-амину (73 мкл) и 1,2-дихлорэтану (750 мкл) добавляли метансульфонилхлорид (17 мкл), а затем перемешивали при комнатной температуре в течение 1 ч. После завершения реакции добавляли насыщенный водный раствор бикарбоната натрия, а затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором, а затем сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле(82 мг) в виде бледно-желтого порошка. Пример 89 (не охватываются формулой изобретения). 2-Бром-N-[транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4 илокси)циклогексил]ацетамид (100 мг) суспендировали в диметилформамиде (2 мл), добавляли карбонат калия (30 мг) и циклобутиламин (60 мкл), а затем перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, а затем экстрагировали этилацетатом. Экстракты промывали водой и насыщенным солевым раствором, органический слой сушили над безводным сульфатом натрия и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом хроматографии на аминосиликагеле (гексан/этилацетат=40/60-10/90) с получением циклобутил-N-[транс 4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси)циклогексил] глицинамида (79 мг). Пример 90 (не охватываются формулой изобретения). транс-4-(6-[2-(Дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси) циклогексанамин (200 мг) растворяли в этаноле (4 мл), добавляли ацетальдегид (28 мкл), а затем перемешивали при комнатной температуре в течение 5 ч. Добавляли боргидрид натрия (34 мг), а затем дополнительно перемешивали при комнатной температуре в течение 1 ч. Добавляли воду и этилацетат, органический слой промывали насыщенным солевым раствором, а затем сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50-0/100, а затем хлороформ/метанол=100/0-98/2) с получением транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2(морфолин-4-ил)пиримидин-4-илокси)-N-этилциклогексанамина (84 мг). Пример 91 (не охватываются формулой изобретения).N-[2-(циклопентилсульфанил)этил]-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)1,3,5-триазин-2-амин (60 мг) растворяли в хлористом метилене (1,2 мл), при 0 С добавляли метахлорпероксибензойную кислоту (75% влажность, 32 мг), а затем перемешивали в течение 10 мин. Добавляли воду, а затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=20/80, а затем метанол/хлороформ=98/2-90/10) с получением N-[2-(циклопентилсульфинил)этил]-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)-1,3,5-триазин-2-амина (53 мг) в виде белого порошка. Пример 92 (не охватываются формулой изобретения). 2-(Дифторметил)-1-[6-(1,4-диоксаспиро[4.5]дека-8-илметокси)-2-(метилсульфанил)пиримидин-4 ил]-1 Н-бензимидазол (1,3 г) растворяли в дихлорметане (20 мл), при 0 С добавляли метапероксибензойную кислоту (75% влажность, 712 мг), а затем перемешивали в течение 30 мин. К реакционному раствору добавляли насыщенный водный бикарбонат натрия, а затем экстрагировали хлороформом. Экстракты промывали водой и насыщенным солевым раствором, органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток растворяли в диметилформамиде (10 мл), добавляли морфолин (1,22 мл), а затем перемешивали при комнатной температуре в течение 2 ч. Реакционный раствор вливали в воду, а затем экстрагировали этилацетатом. Экстракты промывали водой и насыщенным солевым раствором, органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=95/5-80/20) с получением 2(дифторметил)-1-[6-(1,4-диоксаспиро[4.5]дека-8-илметокси)-2-(морфолин-4-ил)пиримидин-4-ил]-1 Нбензимидазола (1,21 г) в виде белого порошка. Пример 93 (не охватываются формулой изобретения). 2-(Дифторметил)-1-[6-(1,4-диоксаспиро[4.5]дека-8-илметокси)-2-(морфолин-4-ил)пиримидин-4-ил]1 Н-бензимидазол (1,2 г) растворяли в смеси тетрагидрофурана (12 мл) и воды (12 мл), добавляли моногидрат 4-метилбензолсульфоновой кислоты (2,27 г), а затем перемешивали при комнатной температуре в течение 3 ч. К реакционному раствору добавляли насыщенный водный бикарбонат натрия, а затем экстрагировали этилацетатом. Экстракты промывали водой и насыщенным солевым раствором, органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=80/20-49/60) с получением 4-[(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин 4-ил)пиримидин-4-илокси)метил]циклогексанона (941 мг) в виде белого порошка. Пример 94 (не охватываются формулой изобретения).N-[2-(Циклопентилсульфанил)этил]-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4 ил)-1,3,5-триазин-2-амин (60 мг) растворяли в хлористом метилене (1,2 мл), при 0 С добавляли метапероксибензойную кислоту (75% влажность, 73 мг), а затем перемешивали в течение 10 мин. Добавляли воду, а затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50-0/100) с получением N-[2(циклопентилсульфонил)этил]-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)-1,3,5 триазин-2-амина (58 мг) в виде белого порошка. Пример 237 (не охватываются формулой изобретения). К раствору[3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4 илокси)азетидин-1-ил](цис-4-гидроксициклогексил)метанона (60 мг) в хлористом метилене (1,2 мл) при охлаждении на льду добавляли реагент Десс-Мартина (53 мг), а затем перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли этилацетат и насыщенный водный раствор бикарбоната натрия, органический слой экстрагировали, промывали насыщенным солевым раствором, а затем сушили над безводным сульфатом магния и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол=100/0-90/10) с получением 4-[3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2(морфолин-4-ил)пиримидин-4-илокси)азетидин-1-ил]карбонилциклогексанона (20 мг). Пример 238 (не охватываются формулой изобретения). 4-(Морфолин-4-илметил)бензолсульфонамид (35 мг) растворяли в N,N-диметилацетамиде (1,25 мл),добавляли 60% гидрид натрия (24 мг), а затем перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавляли 1-[6-хлор-2-(морфолин-4-ил)пиримидин-4-ил]-2-(дифторметил)1 Н-бензимидазол (50 мг), а затем перемешивали при 120 С в течение 1 ч. Смесь охлаждали до комнатной температуры, затем добавляли насыщенный водный раствор хлорида натрия, этилацетат и тетрагидрофуран, затем нейтрализовали добавлением 10% водного раствора гидросульфата калия, а затем экстрагировали органический слой. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Осушитель удаляли путем фильтрования, а затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (гексан/этилацетат=20/80-0/100, а затем хлороформ/метанол=100/0-80/20) с получениемN-6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил-4(морфолин-4-илметил)бензолсульфонамида (13 мг). Пример 239 (не охватываются формулой изобретения). транс-4-(6-[2-(Дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино) циклогексанкарбоновую кислоту (232 мг) растворяли в тетрагидрофуране (2,3 мл), при 0 С добавляли изобутилхлороформиат (70 мкл) и 4-метилморфолин (60 мкл), а затем перемешивали при 0 С в течение 30 мин и при комнатной температуре в течение 2 ч. Затем при 0 С добавляли 28% водный аммиак (300 мкл), а затем перемешивали в течение 2 ч. Растворитель выпаривали в условиях пониженного давления и очищали методом хроматографии на силикагеле (гексан/этилацетат=40/60-0/100 и хлороформ/метанол=100/0-95/5) с получением транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4 ил)пиримидин-4-иламино)циклогексанкарбоксамида (230 мг). Пример 240 (не охватываются формулой изобретения). К раствору N-4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-илциклогексан-1,3-диамина (70 мг) в диметилацетамиде (1,4 мл) добавляли триэтиламин (56 мкл) и бис(2 бромметил)эфир (31 мкл), а затем перемешивали при 120 С в течение 2 ч с использованием микроволнового реактора. К реакционному раствору добавляли воду, а затем экстрагировали этилацетатом. Экстракты промывали водой и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния, удаляли осушитель путем фильтрования, а затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле(гексан/этилацетат=60/40-20/80) с получением 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин 4-ил)-N-[3-(морфолин-4-ил)циклогексил]пиримидин-2-амина (42 мг). Пример 241 (не охватываются формулой изобретения). К смеси дигидрохлорида 4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-морфолин-4-ил)-N-[(3S)пирролидин-3-ил]пиримидин-2-амина (100 мг) и хлористого метилена (1 мл) под потоком азота и при охлаждении на льду добавляли триэтиламин (0,1 мл) и бензоилхлорид (28,5 мкл), а затем перемешивали при той же температуре в течение 4 ч. К реакционной смеси добавляли воду (30 мл), а затем экстрагиро- 20023931 вали этилацетатом (100 мл). Органический слой промывали насыщенным солевым раствором (50 мл) и сушили над безводным сульфатом натрия. Осушитель удаляли путем фильтрования и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол=100/0-90/10). Остаток отверждали этилацетатом и диизопропиловым эфиром, а затем собирали путем фильтрования и сушили с получением [(3S)-3-(4-[2-(дифторметил)-1 Нбензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)пирролидин-1-ил](фенил)метанона(66 мг) в виде белого порошка. Пример 242 (не охватываются формулой изобретения). К раствору транс-N-4-[2-(дифторметил)-6-метил-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-илциклогексан-1,4-диамина (150 мг) в этаноле (3 мл) добавляли 1 Н-1,2,3-бензотриазол-1 илметанол (59 мг), а затем перемешивали при комнатной температуре в течение 5 ч. К этой смеси добавляли боргидрид натрия (25 мг), а затем дополнительно перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором хлорида натрия и сушили над безводным сульфатом магния. Осушитель удаляли путем фильтрования, а затем выпаривали растворитель в условиях пониженного давления. Остаток разделяли и очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50-0/100 и хлороформ/метанол=100/0-98/2) с получением транс-N'-4-[2(дифторметил)-6-метил-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-ил-N,N-диметилциклогексан-1,4-диамина (50 мг) (соединение примера 242-1) и транс-N-4-[2-(дифторметил)-6-метил 1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-ил-N'-метилциклогексан-1,4-диамина (100 мг)(соединение примера 242-2). Пример 243 (не охватываются формулой изобретения). К раствору транс-N-4-[2-(дифторметил)-6-метил-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-илциклогексан-1,4-диамина (50 мг) в хлористом метилене (1 мл) добавляли триэтиламин (46 мкл) и 4-хлорбутирилхлорид (16 мкл), а затем перемешивали в течение 1 ч на водяной бане. Реакционный раствор концентрировали в условиях пониженного давления, добавляли к остатку тетрагидрофуран(5 мл) и 60% гидрид натрия (13 мг), а затем перемешивали при 0 С в течение 30 мин и при комнатной температуре в течение 1 ч. К реакционному раствору добавляли воду, а затем экстрагировали этилацетатом, экстракты промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом магния. Осушитель удаляли путем фильтрования, а затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=50/50-0/100 и хлороформ/метанол=100/0-90/10) с получением 1-[транс-4-(4-[2-(дифторметил)-6-метил-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)циклогексил]пирролидин-2-она (40 мг). Пример 244 (не охватываются формулой изобретения). К смеси трет-бутил-N-4-[2-(дифторметил)-1 Н-бензимидазо-1-ил]-6-(морфолин-4-ил)пиримидин-2 ил-L-аланината (80 мг) и хлористого метилена (3 мл) добавляли 4 М раствор хлороводорода в 1,4 диоксане (0,84 мл), а затем перемешивали в течение 4 ч. После завершения реакции растворитель выпаривали в условиях пониженного давления, а затем сушили с получением гидрохлорида N-4-[2(дифторметил)-1 Н-бензимидазо-1-ил]-6-(морфолин-4-ил)пиримидин-2-ил-L-аланина (83 мг). Пример 245 (не охватываются формулой изобретения). К раствору 2-(бензилокси)этил(3S)-1-[транс-4-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2(морфолин-4-ил)пиримидин-4-илокси)циклогексил]-2-оксопирролидин-3-илкарбамата (84 мг) в метаноле (1 мл) добавляли 10% палладированный уголь (50% влажность, 84 мг), а затем перемешивали при комнатной температуре в течение ночи в атмосфере водорода при давлении 3 атм. Катализатор удаляли и концентрировали фильтрат в условиях пониженного давления. Остаток очищали методом хроматографии на силикагеле (хлороформ/метанол=100/0-92/8) с получением 2-гидроксиэтил(3S)-1-[транс-4-(6[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси)циклогексил]-2 оксопирролидин-3-илкарбамата (30 мг). Пример 246 (не охватываются формулой изобретения). К смеси метил-2-4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2 иламино)метил]пиперидин-1-илциклопентанкарбоксилата (50 мг) и тетрагидрофурана (1 мл) при 0 С добавляли 1,06 М раствор метиллития в диэтиловом эфире, а затем перемешивали при той же температуре в течение 4 ч. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния, а затем концентрировали в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на аминосиликагеле (гексан/этилацетат=1/2-0/100) с получением 2-(2-4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)метил]пиперидин-1-илциклспентил)пропан-2-ола (11,1 мг). Пример 247 (не охватываются формулой изобретения). транс-4-(6-[2-(Дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси) циклогексанол (100 мг) суспендировали в N,N-диметилформамиде (4 мл), добавляли 1,1'- 21023931 карбонилдиимидазол (73 мг), а затем перемешивали при 60 С в течение 2 ч. Затем добавляли 1,1'карбонилдиимидазол (182 мг), а затем перемешивали при 60 С в течение 2 ч. К этой смеси при комнатной температуре добавляли карбонат гуанидина (405 мг), а затем перемешивали при комнатной температуре в течение ночи. Добавляли воду, затем экстрагировали этилацетатом, органический слой промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия, а затем выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (10% МеОН в хлороформе/хлороформ=10/90-90/10) с получением транс-4-(6-[2(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-илокси)циклогексилкарбамимидилкарбамата (103 мг). Пример 248 (не охватываются формулой изобретения). Смесь 2-(дифторметил)-1-[2-(метилсульфонил)-6-(морфолин-4-ил)пиримидин-4-ил]-1 Н-бензимидазола (200 мг), гидрохлорида метил-[(3S)-1-(транс-4-аминоциклогексил)-2-оксопирролидин-3 ил]карбамата (214 мг), карбоната калия (135 мг), N-этил-N-диизопропилпропан-2-амина (0,38 мл) и N,Nдиметилацетамида (3 мл) перемешивали при 100 С в течение 6 ч. После охлаждения к реакционному раствору добавляли воду, а затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Осушитель удаляли путем фильтрования и выпаривали растворитель в условиях пониженного давления. Остаток очищали методом колоночной хроматографии на силикагеле (хлороформ/метанол=100/0-80/20) с получением метил-(3S)1-[транс-4-(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино) циклогексил]-2-оксопирролидин-3-илкарбамата (102 мг) в виде белого порошка. Пример 249 (не охватываются формулой изобретения).N-(Азетидин-3-ил)-6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4 амин (100 мг) растворяли в N,N-диметилформамиде (1 мл), добавляли 4-метоксициклогексанкарбоновую кислоту (43 мг), гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония (HATU) (142 мг) и N,N-диизопропилэтиламин (213 мкл), а затем перемешивали при комнатной температуре з течение 3 ч. К реакционной смеси добавляли воду (100 мл), а затем экстрагировали этилацетатом (100 мл). Экстракты промывали водой и насыщенным солевым раствором, а затем сушили над безводным сульфатом магния. Осушитель удаляли путем фильтрования, а затем выпаривали растворитель в условиях пониженного давления. Остаток разделяли и очищали методом колоночной хроматографии на силикагеле(гексан/этилацетат=50/50-0/100 хлороформ/метанол=100/0-80/20) с получением [3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино)азетидин-1-ил](цис-4-метоксициклогексил)метанона (26 мг) (соединение примера 249-1) и [3-(6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-иламино)азетидин-1-ил](транс-4-метоксициклогексил)метанона (7,1 мг) (соединение примера 249-2). Пример 422 (не охватываются формулой изобретения). К смеси метил-2-4-[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2 иламино)метил]пиперидин-1-илциклопентанкарбоксилата (50 мг) и тетрагидрофурана (1 мл) при 0 С добавляли 1,01 М раствор диизобутилалюминия в толуоле (240 мкл), а затем перемешивали при той же температуре в течение 6 ч. К реакционной смеси добавляли метанол и декагидрат сульфата натрия, а затем перемешивали при комнатной температуре в течение 1 ч. Нерастворимые вещества удаляли путем фильтрования, затем концентрировали в условиях пониженного давления и очищали остаток методом колоночной хроматографии на силикагеле (гексан/этилацетат=50/50-0/100) с получением целевого (2-4[(4-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-6-(морфолин-4-ил)пиримидин-2-иламино)метил]пиперидин-1-илциклопентил)метанола (33 мг). Пример 432 (не охватываются формулой изобретения). РацематN-6-[2-(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил-1(тетрагидро-2 Н-пиран-4-ил)азепан-4-амина (300 мг) оптически расщепляли с использованием суперкритической жидкостной хроматографии с получением оптически активных веществ, N-6-[2(дифторметил)-1 Н-бензимидазол-1-ил]-2-(морфолин-4-ил)пиримидин-4-ил-1-(тетрагидро-2 Н-пиран-4 ил)азепан-4-аминов (135 мг, время удерживания 6,76 мин) и (137 мг, время удерживания 8,03 мин) в виде аморфных белых вещества соответственно.SFC фракционирование: AD-H/4,6250 мм/CO2 75%, МеОН (0,1% DEA) 25%/поток 3 мл/мин/конц. 2 мг/мл/время удерживания 6,76 мин, 8,03 мин. Пример А 1 (не охватываются формулой изобретения). К раствору 1-метилпиперидин-4-амина (4,6 мг) в N,N-диметилформамиде (200 мкл) добавляли раствор N,N-диизопропилэтиламина (8,7 мкл) в N,N-диметилформамиде (50 мкл) и раствор 1-[4-хлор-6(морфолин-4-ил)-1,3,5-триазин-2-ил]-2-(дифторметил)-1 Н-бензимидазола (9,2 мг) в N,N-диметилформамиде (300 мкл), а затем перемешивали при 80 С в течение ночи. К реакционной смеси при комнатной температуре добавляли насыщенный водный раствор бикарбоната натрия и хлороформ, затем проводили разделение жидких фаз и концентрировали органический слой в условиях пониженного давления. Остаток очищали методом препаративной ВЭЖХ с получением 4-[2-(дифторметил)-1 Н- 22023931 бензимидазолил]-N-(1-метилпиперидин-4-ил)-6-(морфолин-4-ил)-1,3,5-триазин-2-амина (11,1 мг). Пример В 1 (не охватываются формулой изобретения). К раствору 1-(4-гидроксифенил)этанона (5,4 мг) в N,N-диметилформамиде (200 мкл) добавляли карбонат калия (6,9 мг) и раствор 1-[4-хлор-6-(морфолин-4-ил)-1,3,5-триазин-2-ил]-2-(дифторметил)-1 Нбензимидазола (9,2 мг) в N,N-диметилформамиде (300 мкл), а затем перемешивали при 80 С в течение ночи. К реакционному раствору при комнатной температуре добавляли воду и хлороформ, затем проводили разделение жидких фаз и упаривали органический слой в условиях пониженного давления. Остаток очищали методом препаративной ВЭЖХ с получением 1-[4-(4-[2-(дифторметил)-1 Н-бензимидазол-1 ил]-6-(морфолин-4-ил)-1,3,5-триазин-2-илокси)фенил]этанона (1,4 мг). Условия проведения ВЭЖХ для определения времени удерживания в примере А 1 представлены ниже. Колонки: Wakosil-II 5 C18AR (Wako Pure Chemical Industries, Ltd.) (диаметр частиц: 5 мкм, внутренний диаметр: 2,0 мм, длина: 30 мм). Подвижная фаза: раствор А - 5 мМ водный раствор трифторуксусной кислоты, раствор В - метанол. Скорость потока: 1,2 мл/мин; длина волны обнаружения: 254 нм; температура колонки: 35,0 С; инъецируемое количество: 5 мкл. Таблица 3 Соединения примеров получения и примеров, представленные ниже в таблицах, получали способом, аналогичным описанным выше для примеров получения и примеров. Химические структурные формулы, способы получения и физико-химические данные соединений примеров получения представлены в табл. 4-34. Кроме того, химические структурные формулы соединений примеров представлены в табл. 35-139, и способы получения и физико-химические данные соединений примеров представлены в табл. 140-161. Более того, структуры и физико-химические данные соединений примеров, полученных способом,аналогичным представленному в примере А 1, представлены в табл. 162-306. Примеры, помеченные знакомв табл. 35-337 не охватываются формулой изобретения. Таблица 4
МПК / Метки
МПК: C07D 471/04, C07D 471/10, C07D 417/14, A61K 31/55, C07D 401/14, A61P 19/02, C07D 409/14, A61K 31/5377, C07D 403/14, A61P 37/06, A61P 17/06, A61K 31/541, C07D 413/14, A61P 37/02, A61P 37/08, A61P 43/00, C07D 405/14, A61P 11/06, C07D 403/04, A61P 35/02, A61P 1/04, A61P 29/00
Метки: соединение, гетероциклическое
Код ссылки
<a href="https://eas.patents.su/30-23931-geterociklicheskoe-soedinenie.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклическое соединение</a>
Предыдущий патент: Аппарат для очистки воды методом перекристаллизации
Следующий патент: Лечение заболеваний, связанных с гиперпроницаемостью сосудов
Случайный патент: Способ получения циталопрама












