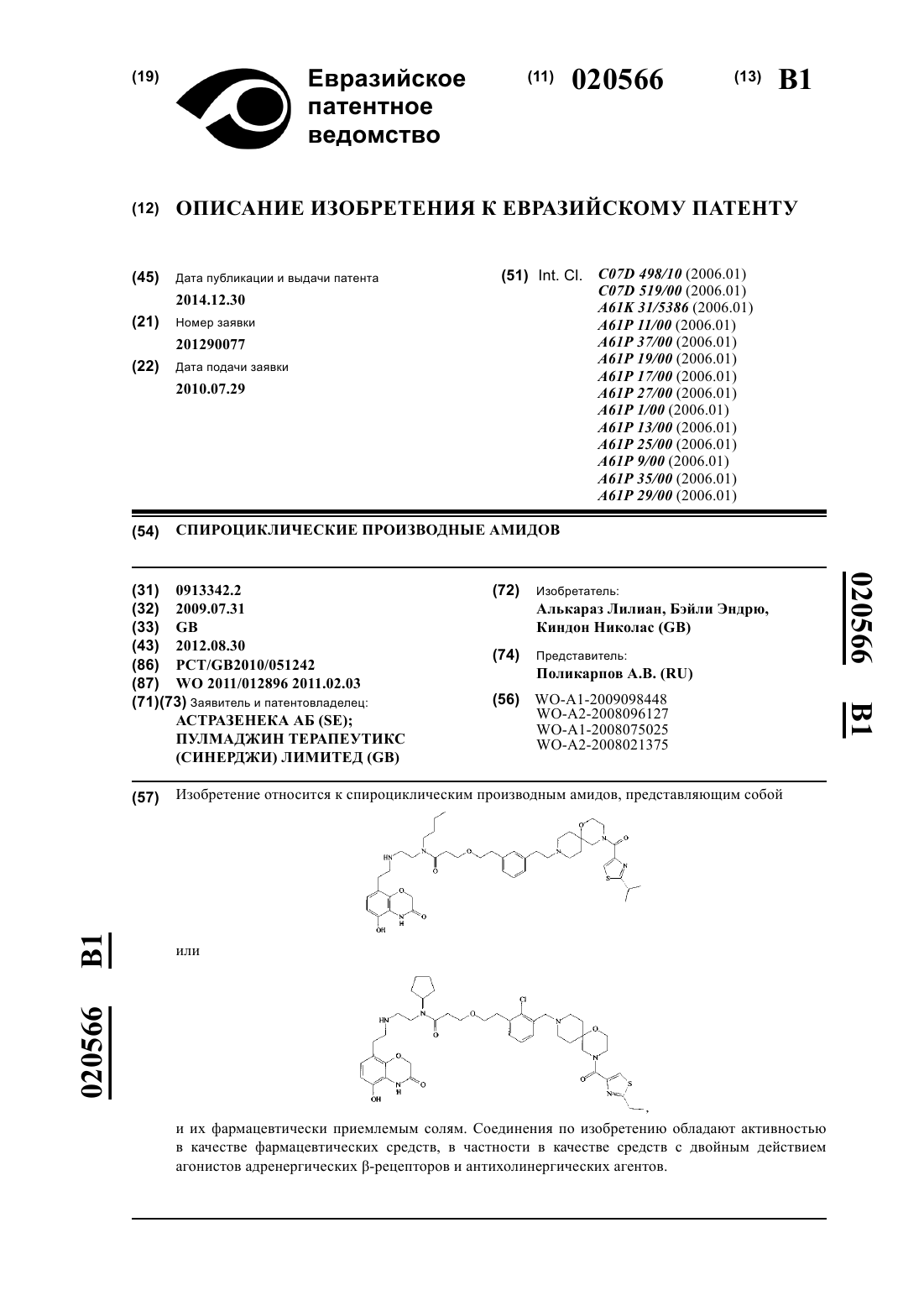
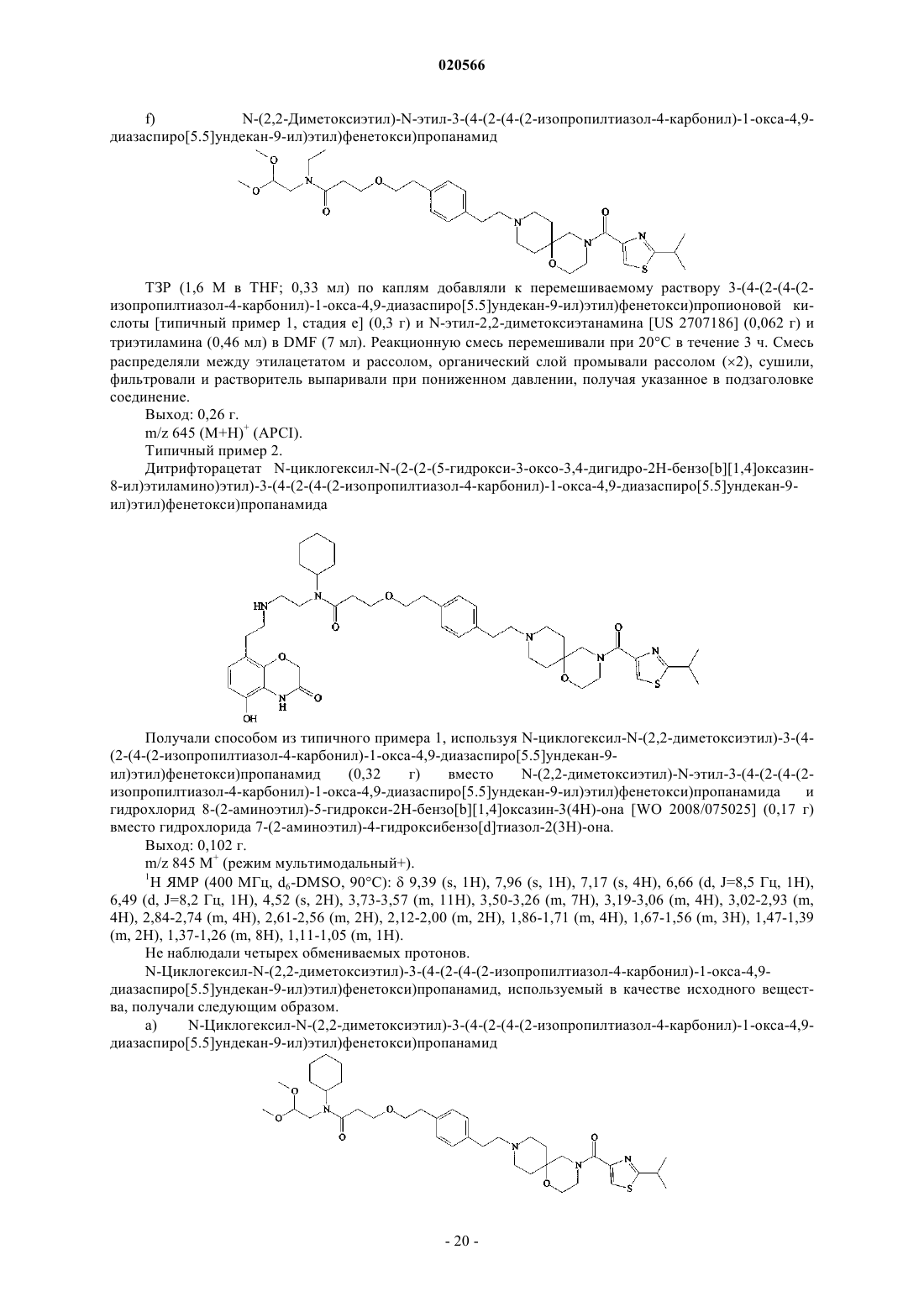
Спироциклические производные амидов
Формула / Реферат
1. Соединение, представляющее собой
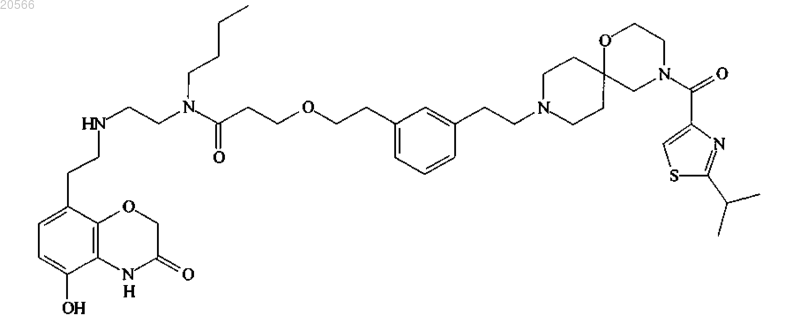
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой
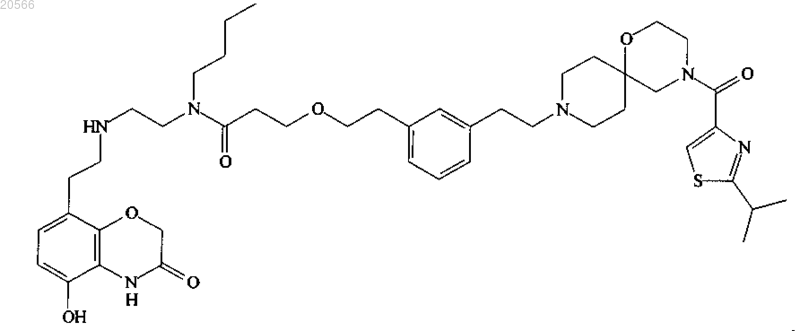
3. Соединение, представляющее собой
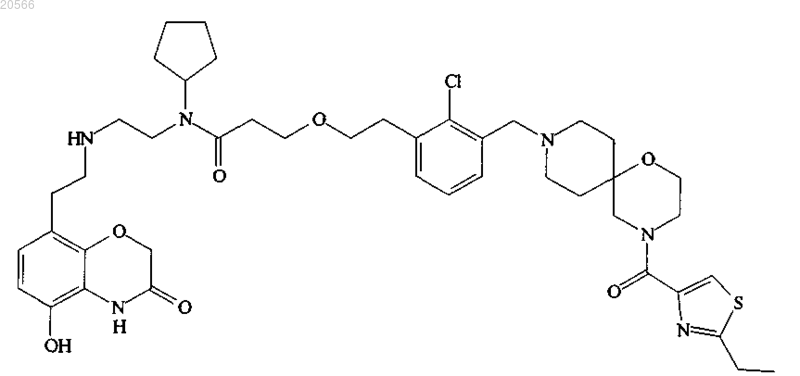
или его фармацевтически приемлемая соль.
4. Соединение по п.3, представляющее собой
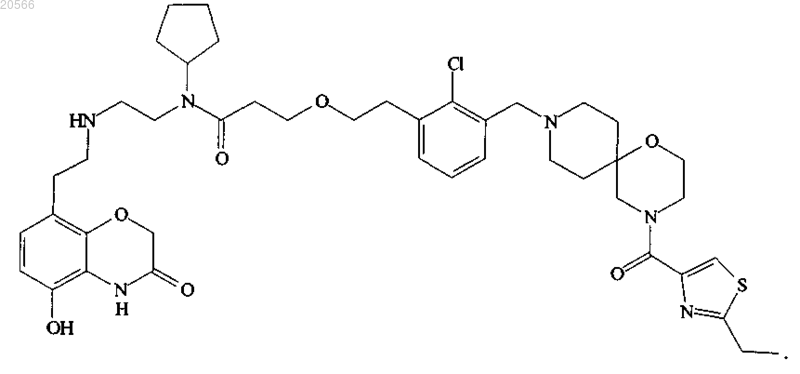
Текст
и их фармацевтически приемлемым солям. Соединения по изобретению обладают активностью в качестве фармацевтических средств, в частности в качестве средств с двойным действием агонистов адренергических -рецепторов и антихолинергических агентов. Настоящее изобретение относится к спироциклическим производным амидов. Первая линия терапии для ряда легочных расстройств, включая хроническую обструктивную болезнь легких (COPD) и астму, осуществляется посредством применения бронходилататоров. Антагонисты мускариновых рецепторов (антихолинергические средства) представляют собой бронходилататоры,которые проявляют свою эффективность посредством снижения вагусного холинергического тонуса,основного обратимого компонента сужения дыхательных путей при COPD. Агонисты-адренорецепторов также являются бронходилататорами благодаря своей способности функционально антагонизировать бронхоконстрикторные ответы на ряд медиаторов, включая ацетилхолин. Помимо улучшения функции легких, эти агенты оказывают благоприятное воздействие при диспноэ (одышке), на качество жизни, толерантность к физической нагрузке и уменьшают обострения. В ряде клинических исследований продемонстрировано, что совместное введение антихолинергического средства и агониста 2-рецептора более эффективно, чем одного из этих двух индивидуальных компонентовonce daily in patients with COPD", Eur. Respir. J., vol. 26, p. 214-222). Одиночная молекула, обладающая активностями в отношении как мускариновых, так и 2-рецепторов (МАВА), может обеспечить дополнительную пользу пациентам с диагнозом COPD в плане эффективности и профиля побочных эффектов,чем любой из двух взятых по отдельности агентов. Кроме того, молекула, обладающая двойной активностью, также может обеспечить пользу в плане удобства применения и соблюдения больным режима и схемы лечения по сравнению с совместным применением схем лечения взятыми по отдельности агентами. Одиночный агент также может быть полезен с позиции изготовления композиции по сравнению с двумя отдельными соединениями, также предоставляя возможность, в сочетании с другим терапевтическим средством, для терапии тройного действия. Теперь согласно первому аспекту изобретения авторами изобретения предложено соединение,представляющее собой или его фармацевтически приемлемую соль. Подходящим образом соединение по первому аспекту изобретения представляет собой Согласно второму аспекту изобретения авторами изобретения предложено соединение, представляющее собой или его фармацевтически приемлемую соль. Подходящим образом соединение по второму аспекту изобретения представляет собой Понятно, что некоторые соединения по настоящему изобретению могут существовать в сольватированных, например гидратированных, а также несольватированных формах. Следует понимать, что в настоящем изобретении раскрыты все такие сольватированные формы. Таутомеры и их смеси также входят в объем настоящего изобретения. Соединения по изобретению обладают активностью в качестве фармацевтических средств, в частности в качестве средств с двойным действием агонистов адренергических -рецепторов и антихолинергических агентов, включая антагонисты мускариновых рецепторов (M1, M2 и M3), в частности M3 антагонистов. Заболевания и состояния, которые могут быть подвергнуты лечению соединениями по изобретению и их фармацевтически приемлемыми солями, включают: 1) дыхательные пути: обструктивные заболевания дыхательных путей, включая астму, в том числе бронхиальную, аллергическую, наследственную, приобретенную, индуцированную физической нагрузкой, индуцированную лекарственным средством (включая индуцированную приемом аспирина и NSAID(нестероидные противовоспалительные средства и индуцированную пылью астму, как перемежающуюся, так и персистирующую и всех степеней тяжести, и другие случаи гиперчувствительности дыхательных путей; хроническую обструктивную болезнь легких (COPD); бронхит, в том числе инфекционный и эозинофильный бронхит; эмфизему; бронхоэктаз; муковисцидоз; саркоидоз; экзогенный аллергический альвеолит (farmer's lung) и родственные заболевания; гиперчувствительный пневмонит; фиброз легких, в том числе криптогенный фиброзирующий альвеолит, идиопатические интерстициальные пневмонии, фиброз, являющийся осложнением противоопухолевой терапии и хронической инфекции, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнения легочной трансплантации; васкулитоподобные (vasculitic) и тромботические расстройства легочной сосудистой сети и легочную гипертензию; противокашлевую активность, в том числе в лечении хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенного кашля; острый и хронических ринит, в том числе медикаментозный ринит и вазомоторный ринит; круглогодичный и сезонный аллергический ринит, в том числе нервный ринит (rhinitis nervosa) (сенную лихорадку); назальный полипоз; острую вирусную инфекцию, в том числе насморк и инфекцию вследствие респираторного синцитиального вируса, вируса гриппа, коронавируса (включая SARS (атипичная пневмония и аденовируса; или эозинофильный эзофагит; 2) кости и суставы: поражения кожи ревматического или подагрического происхождения(arthritides), ассоциированные с остеоартритом/остеоартрозом или включающие остеоартрит/остеоартроз,как первичный, так и вторичный по отношению, например к врожденной дисплазии тазобедренного сустава; цервикальный и поясничный спондилит и боль в нижней области спины и шее; остеопороз; ревматоидный артрит и болезнь Стилла; серонегативные спондилоартропатии, в том числе анкилозирующий спондилит, псориатический артрит, реактивный артрит и недифференцируемую спондилоартропатию; септический артрит и другие ассоциированные с инфекцией артропатии и заболевания кости, такие как туберкулез, в том числе болезнь Потта и синдром Понсе; острый и хронический индуцируемый отложением кристаллов синовит, в том числе подагрический артрит, заболевание вследствие отложения пирофосфата кальция и воспаление сухожилий, синовиальной сумки и синовиальной жидкости, ассоциированное с апатитом кальция; болезнь Бехчета; первичный и вторичный синдром Шегрена; системный склероз и ограниченную склеродермию; системную красную волчанку, заболевание соединительной ткани смешанного типа и недифференцируемое заболевание соединительной ткани; воспалительные миопатии, в том числе дерматомиозит и полимиозит; ревматическую полимиалгию; юношеский артрит,в том числе идиопатические воспалительные поражения кожи ревматического происхождения для суставов любой локализации и ассоциированные синдромы, ревматическую атаку и ее системные осложнения; васкулитиды (vasculitides), в том числе гигантоклеточный артериит, синдром Такаясу, синдром Чарга-Штраусс, полиартериит узлов, микроскопический полиартериит и васкулитиды, ассоциированные с вирусной инфекцией, реакциями гиперчувствительности, криоглобулинами и парапротеинами; боль в нижней части спины; семейную средиземноморскую лихорадку, синдром Макла-Уэльса, семейную ирландскую лихорадку, болезнь Кикучи; индуцированные приемом лекарств артралгии, воспаления кожи при тендините (tendonitides) и миопатии; 3) боль и ремоделирование соединительной ткани при скелетно-мышечных расстройствах вследствие травмы (например, повреждения при занятиях спортом) или болезни: поражения кожи ревматического или подагрического происхождения (например, ревматоидный артрит, остеоартрит, подагрическую или кристаллическую артропатию), другое суставное заболевание (такое как дегенерация межпозвонкового диска или дегенерация височно-нижнечелюстного сустава), нарушение ремоделирования кости (такое как остеопороз, болезнь Педжета или остеонекроз), полихондрит (polychondritits), склеродермию,расстройство соединительной ткани смешанного типа, спондилоартропатии или периодонтальное заболевание (такое как периодонтит); 4) кожа: псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматозы и реакции гиперчувствительности замедленного типа; фито- и фотодерматит; себоррейный дерматит,герпетиформный дерматит, красный плоский лишай, склеротический и атрофический лишай, гангренозную пиодермию, кожный саркоид, дискоидную красную волчанку, пузырчатку, пемфигоид, врожденный буллезный эпидермолиз, крапивницу, ангионевротические отеки, васкулитиды, токсические эритемы,кожные эозинофилии, гнездную алопецию, мужское (male-pattern) облысение, синдром Свита, болезнь Вебера-Крисчена, мультиформную эритему; целлюлит, как инфекционный, так и неинфекционный; панникулит; кожные лимфомы, немеланомный рак кожи и другие диспластические поражения; индуцированные приемом лекарств расстройства, в том числе стойкую лекарственную эритему; 5) глаза: блефарит; конъюнктивит, в том числе круглогодичный и весенний аллергический конъюнктивит; ирит; передний и задний увеит; хориоидит; аутоиммунные, дегенеративные или воспалительные расстройства, воздействующие на сетчатку; офтальмит, в том числе симпатический офтальмит; саркоидоз; инфекции, в том числе вирусные, грибковые и бактериальные; 6) желудочно-кишечный тракт: глоссит, гингивит, периодонтит; эзофагит, в том числе рефлюксэзофагит; эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, колит, в том числе неспецифический язвенный колит, проктит, зуд заднего прохода; спастические боли в животе (coeliac disease), синдром раздраженного кишечника и пищевые аллергии, которые проявляются вдали от кишечника (например, мигрень, ринит и экзема); 7) абдоминальная область: гепатит, в том числе аутоиммунный, алкогольный и вирусный; фиброз и цирроз печени; холецистит; панкреатит как острый, так и хронический; 8) мочеполовая система: нефрит, в том числе интерстициальный и гломерулонефрит; нефротический синдром; цистит, в том числе острый и хронический (интерстициальный) цистит и язву Ханнера; острый и хронический уретрит, простатит, эпидидимит, оофорит и сальпингит; вульвовагинит; болезнь Пейрони; эректильную дисфункцию (как мужскую, так и женскую); 9) отторжение трансплантата: острое и хроническое, например после трансплантации почки, сердца, печени, легкого, костного мозга, кожи или сетчатки либо после переливания крови; или хроническое заболевание "трансплантат против хозяина"; 10) ЦНС (центральная нервная система): болезнь Альцгеймера и другие приводящие к слабоумию расстройства, в том числе CJD (болезнь Крейтцфельдта-Якоба) и nvCJD (новый вариант CJD); амилоидоз; множественный склероз и другие демиелинизирующие синдромы; церебральный атеросклероз и васкулит; височный артериит; тяжелую псевдопаралитическую миастению; острую и хроническую боль(острую, перемежающуюся или устойчивую либо центрального, либо периферического происхождения),в том числе висцеральную боль, головную боль, мигрень, невралгию тройничного нерва, атипичную лицевую боль, суставную и костную боль, боль, являющуюся результатом рака и опухолевой инвазии, невропатические болевые синдромы, в том числе диабетические, постгерпетические и ВИЧассоциированные невропатии; нейросаркоидоз; осложнения в центральной и периферической нервной системе вследствие злокачественных, инфекционных или аутоиммунных процессов; 11) другие аутоиммунные и аллергические расстройства, в том числе тиреоидит Хашимото, болезнь Грейвса, болезнь Аддисона, сахарный диабет, идиопатическую тромбоцитопеническую пурпуру, эози-3 020566 нофильный фасцит, гипер-IgE-синдром, антифосфолипидный синдром; 12) другие расстройства с участием воспалительного или иммунологического компонента, в том числе синдром приобретенного иммунодефицита (СПИД), лепру, синдром Сезари и паранеопластические синдромы; 13) сердечно-сосудистая система: атеросклероз, воздействующий на коронарное и периферическое кровообращение; перикардит; миокардит, воспалительные и аутоиммунные кардиомиопатии, в том числе миокардиальный саркоид; ишемические реперфузионные поражения; эндокардит, вальвулит и аортит,в том числе инфекционный (например, сифилитический); васкулитиды; заболевания проксимальных и периферических вен, в том числе флебит и тромбоз, включая тромбоз глубоких вен и осложнения варикозных вен; 14) онкология: лечение обычных видов рака, в том числе опухолей предстательной железы, молочной железы, легкого, яичников, поджелудочной железы, кишечника и толстой кишки, желудка, кожи и головного мозга и злокачественных новообразований, воздействующих на костный мозг (включая лейкозы) и лимфопролиферативные системы, например лимфомы Ходжкина и неходжкинской лимфомы; включая предупреждение и лечение метастатического заболевания и опухолевых рецидивов и паранеопластических синдромов; и 15) желудочно-кишечный тракт: спастические боли в животе, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, язвенный колит, микроскопический колит, перемежающийся колит, расстройство "раздраженный кишечник" (irritable bowel disorder), синдром раздраженного кишечника, невоспалительную диарею, пищевые аллергии, которые проявляются вдали от кишечника, например, мигрень, ринит и экзема. Таким образом, в настоящем изобретении раскрыты соединения или их фармацевтически приемлемые соли, как они определены ранее, для применения в терапии. Кроме того, в настоящем изобретении раскрыто применение соединений или их фармацевтически приемлемых солей, как они определены ранее, в изготовлении лекарственного средства для применения в терапии. В контексте настоящего описания термин "терапия" также включает "профилактику", если не представлены конкретные указания на обратное. Термины "терапевтический" и "терапевтически" следует истолковывать соответственно. Ожидается, что профилактика будет особенно релевантна в отношении лечения субъектов, которые пострадали от предшествующего приступа рассматриваемого заболевания или состояния, либо которые иным образом считаются имеющими повышенный риск рассматриваемого заболевания или состояния. Как правило, субъекты с риском развития конкретного заболевания или состояния включают субъектов,имеющих наследственную историю данного заболевания или состояния, или субъектов, которые были идентифицированы путем генетического тестирования или скрининга как особенно чувствительные к развитию этого заболевания или состояния. Кроме того, в настоящем изобретении раскрыт способ лечения или снижения риска возникновения воспалительного заболевания или состояния (в том числе обратимого обструктивного заболевания или состояния дыхательных путей), включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения или его фармацевтически приемлемой соли, как они определены ранее. В частности, соединения по данному изобретению могут быть использованы в лечении респираторного дистресс-синдрома взрослых (ARDS), легочной эмфиземы, бронхита, бронхоэктаза, хронической обструктивной болезни легких (COPD), астмы или ринита. Для вышеупомянутых терапевтических применений вводимая дозировка будет, несомненно, изменяться в зависимости от используемого соединения, способа введения, желаемого лечения и показанного расстройства. Например, суточная дозировка соединения по изобретению, если его вводят ингаляцией,может находиться в диапазоне от 0,05 до 100 мкг/кг массы тела. Альтернативно, если соединение вводят перорально, тогда суточная дозировка соединения по изобретению может находиться в диапазоне от 0,01 до 100 мг/кг массы тела. Соединения по изобретению и их фармацевтически приемлемые соли могут быть использованы как таковые, но в общем случае будут введены в форме фармацевтической композиции, в которой соединение/соль (активный ингредиент) по изобретению находится вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. Традиционные методики выбора и изготовления подходящих фармацевтических композиций описаны, например, в "Pharmaceticals - The Science of Dosage FormDesigns", M.E. Aulton, Churchill Livingstone, 1988. В зависимости от способа введения фармацевтическая композиция предпочтительно будет содержать от 0,05 до 99 мас.% (массовых процентов), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и даже еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, где все массовые проценты даны в расчете на общую массу композиции. Кроме того, в настоящем изобретении также раскрыта фармацевтическая композиция, содержащая соединение по изобретению или его фармацевтически приемлемую соль, как они определены ранее, вме-4 020566 сте с фармацевтически приемлемым адъювантом, разбавителем или носителем. Кроме того, в настоящем изобретении раскрыт способ изготовления фармацевтической композиции, включающий смешивание соединения по изобретению или его фармацевтически приемлемой соли,как они определены ранее, с фармацевтически приемлемым адъювантом, разбавителем или носителем. Фармацевтические композиции можно вводить местно (например, на кожу или в легкое и/или дыхательные пути) в форме, например кремов, растворов, суспензий, гидрофторалкановых (HFA) аэрозолей и сухих порошковых композиций, например композиций в ингаляторном устройстве, известном какTurbuhaler; или системно, например, путем перорального введения в форме таблеток, капсул, сиропов,порошков или гранул; или путем парентерального введения в форме растворов или суспензий; или путем подкожного введения; или путем ректального введения в форме суппозиториев; или трансдермально. Сухие порошковые композиции или находящиеся под давлением HFA-аэрозоли соединений по изобретению можно вводить пероральной или назальной ингаляцией. Для ингаляции желательно, чтобы соединение было тонкоизмельченным. Тонкоизмельченное соединение предпочтительно имеет массмедианный диаметр (mass median diameter) меньше 10 мкм и может быть суспендировано в пропеллентной смеси с помощью диспергирующего вещества, такого как жирная C8-C20-кислота или ее соль (например, олеиновая кислота), соль желчных кислот, фосфолипид, алкилсахарид, перфторированное или полиэтоксилированное поверхностно-активное вещество либо другое фармацевтически приемлемое диспергирующее вещество. Соединения по изобретению также можно вводить посредством сухого порошкового ингалятора. Такой ингалятор может представлять собой ингалятор разового или многократного дозирования и может представлять собой приводимый в действие дыханием сухой порошковый ингалятор. Одна из возможностей заключается в смешивании тонкоизмельченного соединения по изобретению с веществом-носителем, например, моно-, ди- или полисахаридом, сахарным спиртом или другим полиолом. Подходящими носителями являются сахара, например лактоза, глюкоза, раффиноза, мелезитоза,лактит, мальтит, трегалоза, сахароза, маннит; и крахмал. Альтернативно, тонкоизмельченное соединение может иметь покрытие из другого вещества. Кроме того, порошковую смесь можно распределять в твердые желатиновые капсулы, каждая из которых содержит желаемую дозу активного соединения. Другая возможность заключается в превращении тонкоизмельченного порошка в сферы, которые разрушаются при процедуре вдыхания. Таким сферонизированным порошком можно заполнить резервуар для лекарственного средства ингалятора многократного дозирования, например, известного какTurbuhaler, в котором дозатор отмеряет желаемую дозу, которая затем вдыхается пациентом. С использованием этой системы активный ингредиент, с веществом-носителем или без него, доставляется пациенту. Для перорального введения соединение по изобретению можно смешивать с адъювантом или носителем, например лактозой, сахарозой, сорбитом, маннитом; крахмалом, например картофельным крахмалом, кукурузным крахмалом или амилопектином; производным целлюлозы; связующим веществом, например желатином или поливинилпирролидоном; и/или смазывающим веществом, например стеаратом магния, стеаратом кальция, полиэтиленгликолем, воском, парафином и т.п., и затем прессовать в таблетки. Если необходимы таблетки с покрытием, на ядра, приготовленные, как описано выше, можно нанести покрытие с помощью концентрированного сахарного раствора, который может содержать, например,аравийскую камедь, желатин, тальк и диоксид титана. Альтернативно, на таблетку можно нанести покрытие из подходящего полимера, растворенного в высоколетучем органическом растворителе. Чтобы изготовить мягкие желатиновые капсулы, соединение по изобретению можно смешивать,например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы соединения при использовании обоих вышеупомянутых эксципиентов для таблеток. Жидкие или полутвердые композиции соединения по изобретению также могут быть внесены в твердые желатиновые капсулы. Жидкие композиции для перорального применения могут быть в форме сиропов или суспензий, например растворов, содержащих соединение по изобретению, поддерживающий баланс сахар и смесь этанола, воды, глицерина и пропиленгликоля. Возможно, что такие жидкие композиции могут содержать окрашивающие агенты, корригенты, сахарин и/или карбоксиметилцеллюлозу в качестве загустителя или другие эксципиенты, известные специалистам в данной области. В частности, соединения по настоящему изобретению и их соли могут быть применены в лечении воспалительных заболеваний, таких как (но этим не ограничиваясь) ревматоидный артрит, остеоартрит,астма, аллергический ринит, хроническая обструктивная болезнь легких (COPD), псориаз и воспалительное заболевание кишечника, и эти соединения по изобретению можно комбинировать со следующими агентами: нестероидными противовоспалительными агентами (далее NSAID), включая неселективные ингибиторы циклооксигеназы СОХ-1/СОХ-2, применяемые местно или системно (такие как пироксикам,диклофенак, пропионовые кислоты, как, например, напроксен, флурбипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, как, например, мефенамовая кислота, индометацин, сулиндак, азапропазон, пиразолоны, как, например фенилбутазон, салицилаты, как, например аспирин); селективными ингибито-5 020566 рами СОХ-2 (такими как мелоксикам, целекоксиб, рофекоксиб, валдекоксиб, люмарококсиб, парекоксиб и эторикоксиб); циклооксигеназа-ингибирующими донорами оксида азота (CINOD); глюкокортикостероидами (вводимыми любыми местным, пероральным, внутримышечным, внутривенным или внутрисуставным путями); метотрексатом, лефлуномидом; гидроксихлорохином, d-пеницилламином, ауранофином или другими парентеральными либо пероральными препаратами золота; аналгетиками; диацереином; средствами внутрисуставной терапии, такими как производные гиалуроновой кислоты; и пищевыми добавками, такими как глюкозамин. Соединения по изобретению также можно вводить вместе с другими соединениями, применяемыми для лечения вышеупомянутых состояний. Следовательно, далее в настоящем изобретении раскрыта комбинированная терапия, где соединение по изобретению или его фармацевтически приемлемую соль, либо фармацевтическую композицию,либо композицию, содержащую соединение по изобретению, вводят одновременно, или последовательно, или в виде комбинированного препарата с другим терапевтическим агентом или агентами для лечения одного или более чем одного из перечисленных выше состояний. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с цитокином или агонистом либо антагонистом функции цитокинов(включая агенты, которые действуют на цитокиновые пути передачи сигнала, такие как модуляторы системы SOCS (супрессоров цитокиновой передачи сигнала, включая альфа-, бета- и гамма-интерфероны; инсулиноподобный фактор роста I типа (IGF-1); интерлейкины (IL), включая IL1-17, и антагонисты или ингибиторы интерлейкинов, такие как анакинра; ингибиторы фактора некроза опухоли альфа (TNF-),такие как анти-TNF-моноклональные антитела (например, инфликсимаб, адалимумаб и CDP-870), и антагонисты TNF-рецептора, включая иммуноглобулиновые молекулы (такие как этанерсепт) и низкомолекулярные агенты, такие как пентоксифиллин. Помимо этого в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с моноклональным антителом, направленным на В-лимфоциты (таким как CD20 (ритуксимаб), MRA-aIL16R) или Т-лимфоциты (CTLA4(цитотоксический Т-лимфоцитарный антиген 4)-Ig, HuMaxIL-15). Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с модулятором функции хемокиновых рецепторов, таким как антагонист CR1, CR2, CR2A, CR2B, CR3, CR4, CR5, CR6, CR7, CR8, CR9, CR10 и CR11 (для семейства С-С);CXCR1, CXCR2, CXCR3, CXCR4 и CXCR5 (для семейства С-Х-С) и CX3CR1 для семейства С-Х 3-С. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с ингибитором матриксных металлопротеаз (MMP), т.е. стромелизинов, коллагеназ и желатиназ, а также аггреканазы; особенно, коллагеназы-1 (MMP-1), коллагеназы-2(MMP-8), коллагеназы-3 (MMP-13), стромелизина-1 (MMP-3), стромелизина-2 (MMP-10) и стромелизина-3 (MMP-11) и MMP-9 и MMP-12, включая такие агенты, как доксициклин. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и ингибитора биосинтеза лейкотриенов, ингибитора 5-липоксигеназыSB-210661; пиридинил-замещенное соединение 2-цианонафталина, такое как L-739010; соединение 2-цианохинолина, такое как L-746530; или соединение индола либо хинолина, такое как MK-591,MK-886 и BAY1005. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и антагониста рецептора лейкотриенов (LT) B4, LTC4, LTD4 и LTE4,выбранного из группы, состоящей из фенотиазин-3-онов, таких как L-651392; амидиновых соединений,таких как CGS-25019 с; бензоксаламинов, таких как онтазоласт; бензолкарбоксимидамидов, таких как(MK-679), RG-12525, Ro-245913, иралукаст (CGP 45715A) и BAY7195. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и ингибитора фосфодиэстеразы (PDE), такого как метилксантанин,включая теофиллин и аминофиллин; селективного ингибитора изоферментов PDE, включая ингибиторPDE4, ингибитор изоформы PDE4D или ингибитор PDE5. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и антагониста гистаминовых рецепторов 1 типа, такого как цетиризин, лоратадин, дезлоратадин, фексофенадин, акривастин, терфенадин, астемизол, азеластин, левокабастин, хлорфенирамин, прометазин, циклизин или мизоластин, применяемые перорально, местно или парентерально. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и ингибитора протонного насоса (такого как омепразол) или гастропротекторного антагониста гистаминового рецептора 2 типа. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и антагониста гистаминового рецептора 4 типа. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и сосудосуживающего симпатомиметического агента, являющегося агонистом альфа-1/альфа-2 адренергических рецепторов, такого как пропилгекседрин, фенилэфрин, фенилпропаноламин, эфедрин, псевдоэфедрин, нафазолина гидрохлорид, оксиметазолина гидрохлорид,тетрагидрозолина гидрохлорид, ксилометазолина гидрохлорид, трамазолина гидрохлорид или этилнорэпинефрина гидрохлорид. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и хромона, такого как хромогликат натрия или недокромил-натрий. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с глюкокортикоидом, таким как флунизолид, триамцинолона ацетонид, беклометазона дипропионат, будесонид, флутиказона пропионат, циклезонид или мометазона фуроат. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли с агентом, который модулирует ядерный рецептор гормонов, такой как PPAR (рецепторы, активируемые пролифератором пероксисом). Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли вместе с иммуноглобулином (Ig) или Ig-препаратом либо антагонистом или антителом, модулирующим функцию Ig, таким как анти-IgE (например, омализумаб). Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и другого применяемого системно или местно противовоспалительного агента, такого как талидомид или его производное, ретиноид, дитранол или кальципотриол. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и комбинаций аминосалицилатов и сульфапиридина, таких как сульфасалазин, месалазин, балсалазид и олсалазин; и иммуномодулирующих агентов, таких как тиопурины и кортикостероиды, такие как будесонид. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли вместе с антибактериальным агентом, таким как производное пенициллина, тетрациклин, макролид, бета-лактам, фторхинолон, метронидазол, ингалируемый аминогликозид; противовирусным агентом, включая ацикловир, фамцикловир, валацикловир, ганцикловир, цидофовир, амантадин, римантадин, рибавирин, занамивир и осельтамавир; ингибитором протеаз, таким как индинавир, нелфинавир, ритонавир и саквинавир; нуклеозидным ингибитором обратной транскриптазы,таким как диданозин, ламивудин, ставудин, зальцитабин или зидовудин; или ненуклеозидным ингибитором обратной транскриптазы, таким как невирапин или эфавиренз. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и сердечно-сосудистого средства, такого как блокатор кальциевых каналов, блокатор бета-адренорецепторов, ингибитор ангиотензин-превращающего фермента (АСЕ),антагонист рецепторов ангиотензина-2; снижающего уровень липидов агента, такого как статин или фибрат; модулятора морфологии клеток крови, такого как пентоксифиллин; тромболитического средства или антикоагулянта, такого как ингибитор агрегации тромбоцитов. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и агента, действующего на ЦНС, такого как антидепрессант (например, сертралин), антипаркинсоническое лекарственное средство (например, депренил, L-дофа, ропинирол, прамипексол, ингибитор МАОВ (моноаминоксидаза В), такой как селегин и расагилин, ингибиторcomP (катехол-о-метилтрансфераза), такой как тасмар, ингибитор А-2, ингибитор обратного захвата дофамина, антагонист NMDA (N-метил-D-аспартат), агонист никотина, агонист дофамина или ингибитор нейрональной синтазы оксида азота) или лекарственное средство против болезни Альцгеймера, такое как донепезил, ривастигмин, такрин, ингибитор СОХ-2, пропентофиллин или метрифонат. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли и агента для лечения острой или хронической боли, такого как аналгетик центрального или периферического действия (например, опиоид или его производное), карбамазепин, фенитоин, вальпроат натрия, амитриптилин или другие антидепрессанты, парацетамол или нестероидное противовоспалительное средство. Кроме того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли вместе с применяемым парентерально или местно (включая ингаляцию) местным анестезирующим агентом, таким как лигнокаин или его производное. Соединение по настоящему изобретению или его фармацевтически приемлемая соль также могут быть применены в комбинации со средством против остеопороза, включая гормональное средство, такое как ралоксифен, или бифосфонат, такой как алендронат. Более того, в настоящем изобретении раскрыта комбинация соединения по изобретению или его фармацевтически приемлемой соли вместе с (1) ингибитором триптазы; (2) антагонистом фактора активации тромбоцитов (PAF); (3) ингибитором интерлейкин-превращающего фермента (ICE); (4) ингибитором IMPDH (инозинмонофосфат-дегидрогеназы); (5) ингибиторами молекул адгезии, включая антагонист VLA-4 (очень позднего антигена 4); (6) катепсином; (7) ингибитором киназ, таким как ингибитор тирозинкиназы (такой как Btk (тирозинкиназа Брутона), Itk (IL-2-индуцируемая тирозинкиназа Т-клеток), Jak3 (янус-киназа 3) или MAP, например, гефитиниб или иматиниба мезилат), серин/треониновой киназы (например, ингибитор МАР-киназы (митоген-активируемой протеинкиназы),такой как p38, JNK (c-Jun-N-концевая киназа), протеинкиназа A, B или C либо IKK (IkB-киназа или киназы, вовлеченной в регуляцию клеточного цикла, (такой как циклинзависимая киназа); (8) ингибитором глюкозо-6-фосфат-дегидрогеназы; (9) антагонистом кинин-B1- или B2-рецептора; (10) противоподагрическим средством, например колхицином; (11) ингибитором ксантиноксидазы, например аллопуринолом; (12) средством, способствующим выведению мочевой кислоты, например пробенецидом, сульфинпиразоном и бензбромароном; (13) средством, усиливающим секрецию гормона роста; (14) трансформирующим фактором роста (TGFP); (15) тромбоцитарным фактором роста (PDGF); (16) фактором роста фибробластов, например основным фактором роста фибробластов (bFGF); (17) гранулоцитарномакрофагальным колониестимулирующим фактором (GM-CSF); (18) капсаициновым кремом; (19) антагонистом тахикининового NK1- или NK3-рецептора, таким как NKP-608C, SB-233412 (талнетант) илиD-4418; (20) ингибитором эластазы, таким как UT-77 или ZD-0892; (21) ингибитором TNF-альфапревращающего фермента (ТАСЕ); (22) ингибитором индуцибельной синтазы оксида азота (iNOS);(23) молекулой-гомологом хемоатграктантного рецептора, экспрессируемой на ТН 2-клетках(Т-хелперных клетках 2 типа) (такой как антагонист CRTH2); (24) ингибитором P38; (25) агентом, модулирующим функцию Toll-подобных рецепторов (TLR); (26) агентом, модулирующим активность пуринергических рецепторов, таких как Р 2 Х 7; (27) ингибитором активации фактора транскрипции, такого какNFB (ядерный фактор-B), API (активаторный белок 1) или STAT (передатчики сигнала и активаторы транскрипции); или (28) агонистом глюкокортикоидного рецептора (GR-рецептора). Кроме того, в настоящем изобретении раскрыта комбинация (например, для лечения COPD, астмы или аллергического ринита) соединения по изобретению и одного или более чем одного агента, выбранного из списка, содержащего нестероидный агонист глюкокортикоидного рецептора (GR-рецептора); ингибитор PDE4, в том числе ингибитор изоформы PDE4; модулятор функции хемокиновых рецепторов (такой как антагонист рецептора CR1); стероид (такой как будесонид) и ингибитор функции киназы p38. Соединение по изобретению или его фармацевтически приемлемую соль также можно использовать в комбинации с существующим терапевтическим агентом для лечения рака, например, подходящие агенты включают:(1) антипролиферативное/антинеопластическое лекарственное средство или его комбинацию, которые используются в медицинской онкологии, такие как алкилирующий агент (например, цисплатин, карбоплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бусульфан или нитрозомочевина); антиметаболит (например, антифолат, такой как фторпиримидин, подобный 5-фторурацилу или тегафуру, ралтитрексед, метотрексат, цитозинарабинозид, гидроксимочевина, гемцитабин или паклитаксел); противоопухолевый антибиотик (например, антрациклин, такой как адриамицин, блеомицин, доксорубицин, дауномицин, эпирубицин, идарубицин, митомицин-С, дактиномицин или митрамицин); антимитотический агент (например, винка-алкалоид, такой как винкристин, винбластин, виндезин или винорелбин, или таксоид, такой как таксол или таксотер); или ингибитор топоизомеразы (например, эпиподофиллотоксин, такой как этопозид, тенипозид, амсакрин, топотекан или камптотецин);(2) цитостатический агент, такой как антиэстроген (например, тамоксифен, торемифен, ралоксифен,дролоксифен или иодоксифен), негативный регулятор эстрогеновых рецепторов (например, фулвестрант), антиандроген (например, бикалутамид, флутамид, нилутамид или ципротерона ацетат), антагонист(3) агент, ингибирующий инвазию раковых клеток (например, ингибитор металлопротеиназы, подобный маримастату, или ингибитор функции рецептора урокиназного активатора плазминогена);(4) ингибитор функции факторов роста, например антитело к факторам роста (например, антиerbb2-антитело трастузумаб или анти-erbb1-антитело цетуксимаб [С 225]), ингибитор фарнезилтрансферазы, ингибитор тирозинкиназ или ингибитор серин/треонинкиназ, ингибитор семейства эпидермального фактора роста (например, ингибитор тирозинкиназ семейства EGFR (рецептор эпидермального фактора роста), такой как N-(3-хлор-4-фторфенил)-7-метокси-6-(3-морфолинопропокси)хиназолин-4-амин (гефи-8 020566 тиниб, AZD 1839), N-(3-этинилфенил)-6,7-бис-(2-метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) или 6-акриламидо-N-(3-хлор-4-фторфенил)-7-(3-морфолинопропокси)хиназолин-4-амин (CI 1033), ингибитор семейства факторов роста тромбоцитов или ингибитор семейства факторов роста гепатоцитов;(5) антиангиогенное средство, такое как средство, ингибирующее эффекты сосудистого эндотелиального фактора роста (например, антитело против фактора роста эндотелиальных клеток сосудов бевацизумаб, соединение, раскрытое в WO 97/22596, WO 97/30035, WO 97/32856 или WO 98/13354), или соединение, действующее по другому механизму (например, линомид, ингибитор функции интегринов(6) агент, вызывающий повреждение сосудов, такой как комбретастатин А 4 или соединение, раскрытое в WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 или WO 02/08213;(7) агент, используемый в антисмысловой терапии, например такой, который направлен на одну из мишеней, приведенных выше, как, например ISIS 2503, в анти-ras антисмысловой терапии;(8) агент, используемый в генотерапевтическом подходе, например, подходах по замене аберрантных генов, таких как аберрантный p53 или аберрантный BRCA1 (ген 1 рака молочной железы) либоBRCA2, подходах GDEPT (ген-направленная ферментативная пролекарственная терапия), например с применением цитозиндезаминазы, тимидинкиназы или бактериального фермента нитроредуктазы, и подходах по повышению толерантности пациента к химиотерапии или лучевой терапии, таких как генная терапия множественной лекарственной устойчивости; или(9) агент, используемый в иммунотерапевтическом подходе, например подходах ex vivo и in vivo по повышению иммуногенности опухолевых клеток пациента, как, например, трансфекция цитокинами,такими как интерлейкин-2, интерлейкин-4 или гранулоцитарно-макрофагальный колониестимулирующий фактор, подходах по снижению Т-клеточной анергии, подходах с использованием трансфицированных иммунных клеток, таких как цитокин-трансфицированные дендритные клетки, подходах с использованием цитокин-трансфицированных опухолевых клеточных линий и подходах с использованием антиидиотипических антител. Вышеупомянутые соединения по изобретению могут быть преобразованы в их фармацевтически приемлемую соль, например соль присоединения кислоты, такую как гидрохлорид (например, дигидрохлорид), гидробромид (например, дигидробромид), трифторацетат (например, дитрифторацетат), сульфат, фосфат, ацетат, фумарат, малеат, тартрат, лактат, цитрат, пируват, сукцинат, оксалат, метансульфонат или п-толуолсульфонат. Теперь данное изобретение будет проиллюстрировано посредством ссылки на следующие далее примеры, в которых использовали следующие общие методы, но этим не ограничивается. Общие методы. Если не указано иное, то исходные вещества имелись в продаже. Все растворители и имеющиеся в продаже реагенты были химически чистыми и были использованы по получении. Все операции проводили при температуре окружающей среды, т.е. в диапазоне 17-28C, и, где целесообразно, в атмосфере инертного газа, такого как азот. Нагревание "микроволнами" относится к нагреванию до постоянной температуры с использованием микроволнового излучения с переменной мощностью в микроволновом реакторе СЕМ Discover. Реакции гидрирования проводили, используя систему Bchi Peteric или систему ThalesNano H-Cube, как подробно описано. Концентрирование всех растворов осуществляли путем упаривания при пониженном давлении (в вакууме), например используя роторный испаритель BchiRotavapor. Тонкослойную хроматографию (TLC) проводили, используя алюминиевые или стеклянные пластины с покрытием диоксида кремния (размер частиц меньше 63 мкм; пористость 60; площадь поверхности около 500 м 2/г) с флуоресцентным (УФ 254) индикатором. После элюирования проводили визуализацию пластин либо посредством облучения при УФ 254, либо посредством проявления с использованием подходящего индикатора, такого как йод (предварительно адсорбированного на диоксиде кремния), водный раствор перманганата калия или водный раствор нитрата церия(IV)-аммония. Примеры препаратов индикаторов можно найти в "Experimental Organic Chemistry: Preparative and Microscale", 2nd Ed.(Harwood, L., Moody, C. and Percy, I.), WileyBlackwell, 1998. Аналитическую HPLC проводили, используя либо колонку Waters XBridge C8 (3,5 мкм) с элюированием градиентом ацетонитрила в 0,1%-ном водном растворе трифторуксусной кислоты, или в 0,1%-ном водном растворе муравьиной кислоты, или в 0,1%-ном водном растворе ацетата аммония, или в 0,1%-ном водном растворе аммиака; либо колонку Waters XBridge C18 (3,5 мкм) с градиентом ацетонитрила в 0,1%-ном водном растворе аммиака; либо колонку Waters Symmetry C18 (3,5 мкм) с градиентом ацетонитрила в 0,1%-ном водном растворе трифторуксусной кислоты; либо колонку WatersSunfire C8 (3,5 мкм) с градиентом ацетонитрила в 0,1%-ном водном растворе трифторуксусной кислоты; либо колонку Phenomenex Gemini C18 (3 мкм) с градиентом ацетонитрила в 0,1%-ном водном растворе трифторуксусной кислоты. УФ-спектры элюируемых пиков измеряли, используя диодную матрицу на системе Agilant 1100 или эквивалентной системе. Жидкостную хроматографию среднего давления (MPLC) на диоксиде кремния (размер частиц меньше 63 мкм; пористость 60; площадь поверхности около 500 м 2/г) проводили, используя предварительно заполненные колонки Biotage FLASH или им эквивалентные, например колонки диоксида кремния Thomson SINGLE StEP, Biotage Isolute, Teledyne Isco RediSep или Silicycle UltraPure, при рекомендованных скоростях потока растворителя и загрузках образца. Чистоту фракций определяли либо посредством TLC, либо аналитической HPLC. Препаративную HPLC проводили, используя градиент ацетонитрила или метанола в 0,1 или 0,2%ном водном растворе TFA, водном растворе муравьиной кислоты или водном растворе аммиака, используя колонку Phenomenex Gemini NX С 18 (30100 мм, 5 мкм), колонку Waters Sunfire Prep C8XBridge С 8 (30100 мм, 5 мкм) в качестве стационарной фазы при скорости потока 30-35 мл/мин, как подробно описано. Фракции собирали после детекции посредством УФ-спектроскопии при такой длине волны, как 220 или 254 нм. Чистоту фракций определяли либо посредством TLC, либо аналитическойH ЯМР-спектры регистрировали на приборе Bruker Avance 600 (600 МГц), Bruker DRX 500(500 МГц) или Varian Unitylnova 500, 400 или 300 МГц. В качестве стандартов использовали либо центральные пики хлороформа-d (CDCl3; H 7,27 млн-1), диметилсульфоксида-d6 (d6-DMSO; H 2,50 млн-1) или метанола-d4 (CD3OD; H 3,31 млн-1), либо внутренний стандарт тетраметилсилана (TMS; H 0,00 млн 1). Масс-спектры регистрировали на Agilent MSD (масс-спектральный детектор) (+ve и -ve для APCI (химической ионизации при атмосферном давлении) и/или электрораспыления (например, в мультимодальном режиме, вслед за аналитической HPLC. Все другие способы осуществляли, используя стандартные лабораторные методы, например, как подробно описано в "Experimental Organic Chemistry: Preparative and Microscale", 2nd Ed. (Harwood, L.,Moody, С. and Percy, I.), WileyBlackwell, 1998. Сокращения или термины, использованные в примерах, имеют следующие значения: г - граммы,ч - час(ы),мин - минута(ы),мл - миллилитры,AIBN - азо-бис-изобутиронитрил,CDI - 1,1'-карбонилдиимидазол,DCM - дихлорметан,DMF - N,N'-диметилформамид,DMSO - диметилсульфоксид,HATU - гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N'N'-тетраметилурония,HCl - хлористый водород/соляная кислота,HPLC - высокоэффективная жидкостная хроматография,основание Хюнига - N,N-диизопропилэтиламин,IPA - изопропанол,MeOH - метанол,МТВЕ - метил-трет-бутиловый эфир,NBS - N-бромсукцинимид,NCS - N-хлорсукцинимид,NMP - 1-метилпирролидин-2-он,к.т. - комнатная температура,T3P - ангидрид 2-пропанфосфоновой кислоты,TBAF - фторид тетрабутиламмония,TFA - трифторуксусная кислота,THF - тетрагидрофуран,Tosic-65 - связанная с макропористым полимером ионообменная смола, поставляемая Biotage AB,Тритон-В - гидроксид бензилтриметиламмония. Получение синтетических промежуточных соединений А) Получение сегментов ароматического линкера. Ароматическое промежуточное соединение 5. 3-(2-(трет-Бутилдиметилсилилокси)этил)-2-фторбензальдегид Раствор 2-(2-фторфенил)этанола (5,5 г) и имидазола (8,0 г) в DMF (50 мл) охлаждали в ледяной воде, обрабатывали трет-бутилдиметилхлорсиланом (6,52 г), затем извлекали из охлаждающей бани и перемешивали при комнатной температуре в течение 3,5 ч. Раствор выливали в воду и три раза экстрагировали диэтиловым эфиром. Объединенные органические экстракты три раза промывали водой, один раз рассолом, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении, что позволило получить указанное в подзаголовке соединение в виде бесцветного масла. Выход: 9,9 г. 1b) 3-(2-(трет-Бутилдиметилсилилокси)этил)-2-фторбензальдегид. Раствор 2,2,6,6-тетраметилпиперидина (11,0 г) в безводном THF (200 мл) охлаждали до -78C и обрабатывали бутиллитием (37,5 мл), непрерывно добавляя его в течение 5 мин с помощью шприца. Раствор перемешивали при -78C в течение 15 мин и затем обрабатывали раствором трет-бутил(2 фторфенетокси)диметилсилана [ароматическое промежуточное соединение 5, стадия а] (9,9 г) в THF(25 мл), добавляя его по каплям в течение 15 мин. Затем раствор перемешивали при -78C в течение 2 ч,далее обрабатывали раствором DMF (9 мл) в THF (25 мл), добавляя его по каплям в течение 10 мин. Раствор перемешивали при -78C в течение 1 ч, затем охлаждающую баню убирали и раствор оставляли нагреваться до комнатной температуры в течение ночи. Реакционную смесь выливали в водный HCl(0,5 М) и три раза экстрагировали этилацетатом. Объединенные органические фазы три раза промывали водой, один раз рассолом, затем сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, что позволило получить указанное в заголовке соединение. Выход: 10,1 г. 1H ЯМР (400 МГц, CDCl3):10,41 (s, 1H), 7,79-7,74 (m, 1H), 7,55 (td, J=7,4; 1,6 Гц, 1H), 7,22 (t,J=7,6 Гц, 1H), 3,88 (t, J=6,5 Гц, 2H), 2,96 (t, J=6,6 Гц, 2H), 0,88 (s, 9H), 0,00 (s, 6H). Ароматическое промежуточное соединение 7. 2-Хлор-5-(2-гидроксиэтил)бензальдегид Раствор 5-(бромметил)-2-хлорбензойной кислоты [WO 2001/044170] (1,75 г) в DMF (20 мл) обрабатывали раствором цианистого калия (0,91 г) в воде (7 мл) и полученный раствор перемешивали при комнатной температуре в течение 3 суток. Смесь разбавляли водой и дважды экстрагировали этилацетатом. Органические фазы отбрасывали, тогда как водную фазу осторожно подкисляли концентрированной соляной кислотой (5 мл), пропуская всю высвобождающуюся HCN через раствор хлорной извести с помощью потока азота. После перемешивания в течение 20 мин водную фазу дважды дополнительно экстрагировали этилацетатом. Объединенные органические фазы три раза промывали водой, один раз рассолом, затем сушили над безводным сульфатом магния и концентрировали в вакууме, что позволило получить неочищенное указанное в подзаголовке соединение в виде коричневого твердого вещества. Выход: 1,25 г. Гидроксид калия (0,969 г) в воде (10 мл) добавляли к раствору 2-хлор-5-(цианометил)бензойной кислоты [ароматическое промежуточное соединение 7, стадия а] (1,25 г) в этаноле (10 мл) и полученную смесь нагревали при температуре дефлегмации в течение 2,25 ч, затем оставляли охлаждаться. Смесь концентрировали в вакууме для удаления этанола и затем разбавляли водой и дважды промывали этилацетатом. Органические фазы отбрасывали, тогда как водную фазу подкисляли до pH 1 концентрированной соляной кислотой и дважды экстрагировали этилацетатом. Объединенные экстракты сушили над безводным сульфатом магния и концентрировали в вакууме, что позволило получить указанное в подзаголовке соединение в виде коричневой смолы. Выход: 1,38 г. 1 Раствор боран-диметилсульфидного комплекса (2 M в THF; 6,50 мл) порциями в течение 5 мин добавляли к раствору 5-(карбоксиметил)-2-хлорбензойной кислоты [ароматическое промежуточное соединение 7, стадия b] (1,37 г) в безводном THF (20 мл) при комнатной температуре. Полученный выделяющий пузырьки газа раствор перемешивали при комнатной температуре в течение 1,5 ч, затем нагревали до температуры дефлегмации в течение 1 ч. Охлажденную смесь гасили, добавляя порциями метанол(5 мл) в течение 5 мин. Раствор перемешивали при комнатной температуре в течение 2 ч и затем очищали флэш-хроматографией на диоксиде кремния, элюируя 5%-ным метанолом в дихлорметане, что позволило получить указанное в подзаголовке соединение в виде бесцветного масла. Выход: 0,933 г. 1He наблюдали двух обмениваемых протонов.[ароматическое промежуточное соединение 7, стадия с] (0,200 г) в DCM (5 мл) и полученную суспензию перемешивали при комнатной температуре в течение ночи. Смесь затем фильтровали через целит, хорошо промывая остаток DCM. Фильтрат и промывки концентрировали в вакууме, что позволило получить указанное в подзаголовке соединение в виде бесцветного масла. Выход: 0,197 г. 1H ЯМР (400 МГц, CDCl3):10,47 (s, 1H), 7,80 (d, J=2,1 Гц, 1H), 7,42 (d, J=2,1 Гц, 1H), 7,41 (s, 1H),3,89 (br t, J=5,9 Гц, 2H), 2,90 (t, J=6,4 Гц, 2H), 1,42 (br s, 1H). Ароматическое промежуточное соединение 9. 3-(2-Гидроксиэтил)фенетилметансульфонат Метансульфонилхлорид (0,67 мл) в DCM (2 мл) по каплям при 0C добавляли к перемешиваемому раствору 2,2'-(1,3-фенилен)диэтанол (1,30 г) и триэтиламина (1,36 мл) в DCM (30 мл). Реакционную смесь перемешивали в течение 1 ч при 0C и затем промывали водой. Водный слой повторно экстрагировали DCM и объединенные органические фазы сушили, фильтровали и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния,используя 3%-ный метанол в дихлорметане в качестве растворителя. Фракции, содержащие продукт,упаривали досуха, что позволило получить указанное в заголовке соединение. Выход: 0,52 г. 1 Ароматическое промежуточное соединение 10. 4-(2-Гидроксиэтил)фенетилметансульфонат Получали способом, описанным для получения ароматического промежуточного соединения 9, используя 2,2'-(1,4-фенилен)диэтанол (1,30 г) вместо 2,2'-(1,3-фенилен)диэтанола. Выход: 0,56 г. 1H ЯМР (400 МГц, d6-DMSO):7,21-7,14 (m, 4H), 4,60 (t, J=5,3 Гц, 1H), 4,38 (t, J=6,8 Гц, 2H), 3,603,55 (m, 2H), 3,10 (s, 3H), 2,95 (t, J=6,8 Гц, 2H), 2,69 (t, J=7,2 Гц, 2H). Ароматическое промежуточное соединение 11. 2-Хлор-3-(2-гидроксиэтил)бензальдегидN-бромсукцинимида (28,7 г) в хлорбензоле (250 мл) и полученную смесь нагревали до 85C в течение 4 ч. Смесь разбавляли этилацетатом (100 мл) и промывали 10%-ным водным рассолом (3100 мл). Органический слой сушили над сульфатом магния, фильтровали и упаривали. Бежевое твердое вещество перекристаллизовывали из смеси этилацетат (примерно 75 мл)/изогексан (примерно 250 мл), получая указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 25,3 г. 1He наблюдали одного обмениваемого протона. Раствор 3-(бромметил)-2-хлорбензойной кислоты [ароматическое промежуточное соединение 11,стадия а] (13,2 г) в DMF (150 мл) обрабатывали раствором цианистого калия (7,23 г) в воде (50 мл) и полученный раствор перемешивали при комнатной температуре в течение ночи. Смесь разбавляли водой(200 мл) и осторожно подкисляли концентрированной соляной кислотой (25 мл), пропуская всю высвобождающуюся HCN через раствор хлорной извести с помощью потока азота. После перемешивания в течение 2 ч водную фазу экстрагировали этилацетатом (3250 мл). Объединенные органические фазы промывали водой (3250 мл) и рассолом (250 мл), сушили над сульфатом магния, фильтровали и упаривали, получая указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 10,3 г. 1 Концентрированную серную кислоту (60 мл) по каплям добавляли к ледяной воде (75 мл) и полученный раствор добавляли к 2-хлор-3-(цианометил)бензойной кислоте [ароматическое промежуточное соединение 11, стадия b] (14 г). Полученную суспензию нагревали до температуры дефлегмации (165C) в течение 30 мин, в течение которых исходное вещество растворялось и наблюдалось образование нового осадка. Реакционную смесь оставляли охлаждаться, разбавляли водой (250 мл) и экстрагировали этилацетатом (3500 мл). Объединенные органические фазы промывали водой (250 мл) и рассолом (250 мл),- 13020566 затем сушили над сульфатом магния и упаривали, получая указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 13,7 г. 1He наблюдали двух обмениваемых протонов. Раствор борандиметилсульфидного комплекса (2 M в THF, 220 мл) добавляли порциями в течение 5 мин к суспензии 3-(карбоксиметил)-2-хлорбензойной кислоты [ароматическое промежуточное соединение 11, стадия с] (18,9 г) в безводном THF (800 мл) при комнатной температуре. Полученную выделяющую пузырьки газа суспензию перемешивали при комнатной температуре в течение 30 мин, затем нагревали до температуры дефлегмации в течение 60 мин и оставляли охлаждаться до комнатной температуры в течение ночи. Смесь гасили, добавляя порциями метанол (100 мл) в течение 15 мин, и перемешивали до прекращения выделения пузырьков газа. Добавляли концентрированную водную HCl (25 мл),смесь перемешивали в течение 30 мин и концентрировали при пониженном давлении. Липкий остаток распределяли между этилацетатом (500 мл) и водным HCl (2 М, 200 мл). Фазы разделяли и водную фазу экстрагировали этилацетатом (2300 мл). Объединенные органические фазы промывали рассолом(300 мл), сушили над сульфатом магния, фильтровали и упаривали, получая указанное в подзаголовке соединение в виде желтого масла. Выход: 17,8 г. 1e) 2-Хлор-3-(2-гидроксиэтил)бензальдегид. Диоксид марганца(IV) (43,1 г) добавляли к слабой (slight) суспензии 2-(2-хлор-3(гидроксиметил)фенил)этанола [ароматическое промежуточное соединение 11, стадия d] (18,5 г) в хлороформе (500 мл) и полученную суспензию нагревали при температуре дефлегмации в течение 2 ч. Реакционную смесь охлаждали, фильтровали через целит и фильтрующую набивку промывали DCM(3300 мл). Объединенные промывки и фильтрат упаривали и остаток очищали флэш-хроматографией на диоксиде кремния, элюируя градиентом изогексан:этилацетат от 3:1 до 1:1. Фракции, содержащие продукт, объединяли и упаривали, получая указанное в заголовке соединение в виде белого твердого вещества. Выход: 12,00 г. 1 Пентасульфид фосфора (15,2 г) добавляли к суспензии пропионамида (20 г) в метил-третбутиловом эфире (900 мл) и смесь перемешивали в течение 18 ч. Смесь фильтровали через целит и концентрировали в вакууме, что позволило получить указанное в подзаголовке соединение в виде желтого масла. Выход: 15,8 г. 1 Этил-3-бром-2-оксопропаноат (24,7 мл) по каплям при 0-10C в атмосфере азота добавляли в течение 10 мин к раствору пропантиоамида [карбоновая кислота 1, стадия а] (15,8 г) в этаноле (150 мл). По окончании добавления смесь перемешивали при температуре окружающей среды в течение 18 ч. Смесь концентрировали в вакууме, остаток разбавляли водой и экстрагировали в этилацетат (3). Объединенные экстракты промывали рассолом, сушили над сульфатом магния, фильтровали и растворитель удаляли. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния, градиент элюирования 10-, 15- и 20%-ный этилацетат в изогексане. Фракции, содержащие продукт, упаривали досуха, что позволило получить указанное в подзаголовке соединение в виде бледно-зеленого твердого вещества. Выход: 16,0 г. 1H ЯМР (400 МГц, CDCl3):8,06 (s, 1H), 4,42 (q, J=7,1 Гц, 2H), 3,10 (q, J=7,5 Гц, 2H), 1,44-1,38 (m,6H). с) 2-Этилтиазол-4-карбоновая кислота. Концентрированную HCl (75 мл) добавляли к суспензии этил-2-этилтиазол-4-карбоксилата [карбоновая кислота 1, стадия b] (16 г) в воде (75 мл) и смесь перемешивали при 100C в течение 24 ч. Смесь охлаждали и концентрировали в вакууме. Остаток растирали с ацетоном, твердое вещество собирали фильтрованием и сушили в вакууме, что позволило получить указанное в заголовке соединение в виде серого твердого вещества. Выход: 14,4 г.H ЯМР (400 МГц, d6-DMSO):8,31 (s, 1H), 3,01 (q, J=7,5 Гц, 2H), 1,31 (t, J=7,6 Гц, 3H). Не наблюдали одного обмениваемого протона. Карбоновая кислота 2. 2-Циклопентилтиазол-4-карбоновая кислотаCDI (8,5 г) добавляли к раствору циклопентанкарбоновой кислоты (5,2 мл) в DMF (40 мл). Полученную смесь перемешивали в течение 1 ч и охлаждали в ледяной бане. Добавляли гидрохлорид этил-2-амино-3-меркаптопропаноата (8,88 г), затем триэтиламин (10 мл). Полученную смесь оставляли нагреваться до к.т. и перемешивали в течение ночи. Реакционную смесь гасили насыщенным раствором бикарбоната натрия (50 мл) и слои разделяли. Водный слой экстрагировали DCM (2100 мл). Объединенные органические растворы промывали рассолом (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Полученное твердое вещество очищали хроматографией на силикагеле, элюируя градиентом изогексан:этилацетат от 4:1 до 1:1. Фракции, содержащие продукт, объединяли и упаривали,получая указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 7,7 г. 1 Моногидрат тозиловой кислоты (0,78 г) добавляли к раствору этил-2-(циклопентанкарбоксамидо)3-меркаптопропаноата [карбоновая кислота 2, стадия а] (5 г) в толуоле (40 мл). Полученную смесь нагревали при температуре дефлегмации в условиях Дина и Старка в течение 6 ч. Реакционную смесь оставляли охлаждаться, затем толуольный раствор промывали насыщенным раствором бикарбоната натрия(20 мл) и растворитель выпаривали. Остаток азеотропно отгоняли с толуолом. Полученное белое твердое вещество очищали хроматографией на силикагеле, элюируя смесью 9:1 изогексан:этилацетат. Фракции,- 15020566 Диоксид марганца (24 г) добавляли к раствору этил-2-циклопентил-4,5-дигидротиазол-4 карбоксилата [карбоновая кислота 2, стадия b] (3,2 г) в ацетонитриле (100 мл) и полученную смесь нагревали при температуре дефлегмации в течение ночи. Реакционную смесь оставляли охлаждаться и фильтровали через набивку целита. Фильтрующую набивку промывали ацетонитрилом (2100 мл) и объединенные фильтрат и промывки упаривали. Остаток очищали хроматографией на силикагеле, элюируя смесью 9:1 изогексан:этилацетат. Фракции, содержащие продукт, объединяли, упаривали и повторно растворяли в этаноле (20 мл). Добавляли суспензию палладия на угле (5%-ную; 0,66 г) в воде (0,5 мл) и полученную суспензию перемешивали в атмосфере водорода под давлением 5 бар (500 кПа) в течение 2 ч. Смесь фильтровали через набивку целита, которую промывали этанолом (350 мл). Объединенные фильтрат и промывки упаривали, получая указанное в подзаголовке соединение в виде прозрачного масла. Выход: 0,9 г. 1d) 2-Циклопентилтиазол-4-карбоновая кислота. Моногидрат гидроксида лития (0,67 г) добавляли к раствору этил-2-циклопентилтиазол-4 карбоксилата [карбоновая кислота 2, стадия с] (0,9 г) в смеси THF (40 мл) и воды (10 мл). Полученную смесь перемешивали в течение ночи. Реакционную смесь подкисляли водным HCl (2 М; 10 мл) и растворитель выпаривали. Остаток распределяли между рассолом (50 мл) и этилацетатом (50 мл) и слои разделяли. Водную фазу экстрагировали этилацетатом (250 мл). Объединенные органические растворы сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в заголовке соединение в виде бледно-желтого твердого вещества. Выход: 0,77 г. 1 2-Этилбутаноилхлорид (5 г) осторожно по каплям добавляли к охлажденному во льду 35%-ному водному аммиаку (50 мл) и полученную суспензию перемешивали в течение 1 ч. Реакционную смесь экстрагировали DCM (3100 мл). Объединенные органические фазы промывали рассолом (100 мл), сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 3,4 г. 1 Получали согласно способу получения карбоновой кислоты 1, стадия а, используя 2-этилбутанамид Получали согласно способу получения карбоновой кислоты 1, стадия b, используя 2-этилбутантиоамид [карбоновая кислота 3, стадия b] (3,8 г) вместо пропантиоамида. Выход: 2,8 г. 1d) 2-(Пентан-3-ил)тиазол-4-карбоновая кислота. Получали согласно способу получения карбоновой кислоты 2, стадия d, используя этил-2-(пентан 3-ил)тиазол-4-карбоксилат [карбоновая кислота 3, стадия с] (2,8 г) вместо этил-2-циклопентилтиазол-4 карбоксилата. Выход: 2,3 г. 1 2,2-Диметоксиацетальдегид (60%-ный в воде; 8,7 мл) добавляли к (R)-3-метилбутан-2-амину (5,0 г) в метаноле (25 мл) и смесь перемешивали при температуре окружающей среды в течение ночи. Добавляли суспензию палладия на угле (5%-ную; 1,2 г) в воде (10 мл) и смесь гидрировали под давлением 5 бар(500 кПа) при перемешивании в течение 3 ч. Смесь фильтровали через целит и фильтрующую набивку промывали метанолом (3100 мл). Объединенные фильтрат и промывки концентрировали до объема примерно 10 мл и затем добавляли толуол (200 мл). Смесь концентрировали, добавляли дополнительное количество толуола (200 мл) и смесь концентрировали еще один раз, получая указанное в заголовке соединение в виде желтого масла. Выход: 8,0 г. 1(d, J=6,7 Гц, 3H). Не наблюдали одного обмениваемого протона. Амин 6. Получали согласно способу получения амина 2, используя циклопентанамин (5,0 г) вместо (R)-3 метилбутан-2-амина. Выход: 9,4 г. 1He наблюдали одного обмениваемого протона. Получение конечных соединений. Все следующие далее конечные соединения выделяли в виде их дитрифторацетатных солей, если не указано иное. Типичный пример 1. Дитрифторацетат Моногидрат тозиловой кислоты (0,54 г) добавляли в виде одной порции к растворуN-(2,2-диметоксиэтил)-N-этил-3-(4-(2-(4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9 диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропанамида (0,26 г) в DCM (7 мл). Смесь перемешивали в течение 2 ч при 20C. Осторожно добавляли насыщенный раствор бикарбоната натрия (10 мл) и полученную смесь энергично перемешивали в течение 10 мин. Смесь экстрагировали DCM, органический слой промывали насыщенным раствором бикарбоната натрия (2) и рассолом, затем сушили, фильтровали и концентрировали при пониженном давлении. Остаток растворяли в метаноле (10 мл) и обрабатывали уксусной кислотой (0,023 мл), затем гидрохлоридом 7-(2-аминоэтил)-4-гидроксибензо[d]тиазол-2(3H)она (Org. Proc. Res. Dev., 2004, 8(4), 628) (0,15 г). Эту смесь перемешивали при 20C в течение 10 мин и затем охлаждали в ледяной бане. Добавляли цианоборгидрид натрия (0,038 г) и реакционную смесь перемешивали при 20C в течение 18 ч. Растворитель выпаривали при пониженном давлении и остаток очищали флэш-хроматографией на диоксиде кремния, используя в качестве растворителя 8%-ный метанол в дихлорметане, содержащем 1% '880' водного аммиака. Остаток очищали далее препаративнойHPLC (Sunfire, градиент: 40-70% метанола в 0,2%-ной водной TFA). Фракции, содержащие желаемый продукт, упаривали досуха, что позволило получить указанное в заголовке соединение в виде белого твердого вещества. Выход: 0,105 г.H ЯМР (400 МГц, d6-DMSO, 90C):7,96 (s, 1H), 7,17 (s, 4H), 6,85 (d, J=8,2 Гц, 1H), 6,75 (d,J=8,2 Гц, 1H), 3,77-3,52 (m, 12H), 3,43-3,27 (m, 7H), 3,20-3,08 (m, 6H), 3,00-2,93 (m, 2H), 2,87-2,82 (m, 2H),2,80-2,75 (m, 2H), 2,59-2,53 (m, 2H), 2,13-2,02 (m, 2H), 1,88-1,73 (m, 2H), 1,36 (d, J=6,9 Гц, 6H), 1,09 (t,J=6,7 Гц, 3H). Не наблюдали пяти обмениваемых протонов. Раствор 2-изопропилтиазол-4-карбоновой кислоты (1 г) и гидрохлорида трет-бутил-1-окса-4,9 диазаспиро[5.5]ундекан-9-карбоксилата (Wu Xi PharmaTech.) (1,71 г) в DMF (30 мл) охлаждали в ледяной бане и обрабатывали триэтиламином (2,44 мл), затем HATU (2,89 г). Ледяную баню удаляли и смесь перемешивали при 20C в течение 1 ч. Смесь распределяли между этилацетатом и рассолом, органический слой дважды промывали рассолом, сушили над сульфатом натрия, фильтровали и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния, используя 70%-ный этилацетат в изогексане в качестве растворителя. Фракции, содержащие продукт, упаривали досуха, что позволило получить указанное в подзаголовке соединение. Выход: 2,0 г. 1 Раствор трет-бутил-4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9 карбоксилата [типичный пример 1, стадия а] (2,3 г) в смеси дихлорметана (40 мл) и трифторуксусной кислоты (10 мл) оставляли стоять при 20C в течение 30 мин. Добавляли толуол (50 мл) и растворители выпаривали, затем этот процесс повторяли со следующей порцией толуола (50 мл). Остаток растирали с эфиром. Затем смолу растворяли в ацетонитриле и растворитель выпаривали, что позволило получить указанное в подзаголовке соединение. Выход: 1,64 г. Карбонат калия (0,634 г) добавляли к раствору трифторацетата (2-изопропилтиазол-4-ил)(1-окса 4,9-диазаспиро[5.5]ундекан-4-ил)метанона [типичный пример 1, стадия b] (0,971 г) и 4-(2-гидроксиэтил)фенетилметансульфоната [ароматическое промежуточное соединение 10] (0,56 г) в ацетонитриле (20 мл) и воде (0,3 мл). Реакционную смесь нагревали при 60C в течение 1 суток. Растворитель выпаривали при пониженном давлении и остаток распределяли между водой и этилацетатом. Водный слой повторно экстрагировали этилацетатом, объединенные органические фазы сушили, фильтровали и растворитель выпаривали при пониженном давлении. Неочищенный продукт очищали флэшхроматографией на диоксиде кремния, используя в качестве растворителя 2%-ный метанол в дихлорметане с 1% триэтиламина. Фракции, содержащие продукт, упаривали досуха, что позволило получить указанное в подзаголовке соединение. Выход: 0,68 г. 1(9-(4-(2-гидроксиэтил)фенетил)-1-окса-4,9-диазаспиро[5.5]ундекан-4-ил)(2-изопропилтиазол-4 ил)метанона [типичный пример 1, стадия с] (0,62 г) в толуоле (20 мл). Растворитель удаляли при пониженном давлении и остаток азеотропно отгоняли с толуолом. Полученную маловязкую жидкость со следами толуола обрабатывали по каплям трет-бутилакрилатом (0,225 г). Реакционную смесь перемешивали при 20C в течение 18 ч. Смесь очищали флэш-хроматографией на диоксиде кремния, используя в качестве растворителя 2%-ный метанол в дихлорметане с 1% триэтиламина. Фракции, содержащие продукт,упаривали досуха, что позволило получить указанное в подзаголовке соединение. Выход: 0,550 г. Трифторуксусную кислоту (10 мл) добавляли к раствору трет-бутил-3-(4-(2-(4-(2-изопропилтиазол 4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропаноата [типичный пример 1,стадия d] (0,55 г) в DCM (20 мл) и полученный раствор оставляли стоять при 20C в течение 1 ч. Добавляли толуол (30 мл) и растворители выпаривали при пониженном давлении. Остаток азеотропно отгоняли с ацетонитрилом (2), получая указанное в подзаголовке соединение. Выход: 0,60 г. ТЗР (1,6 М в THF; 0,33 мл) по каплям добавляли к перемешиваемому раствору 3-(4-(2-(4-(2 изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропионовой кислоты [типичный пример 1, стадия е] (0,3 г) и N-этил-2,2-диметоксиэтанамина [US 2707186] (0,062 г) и триэтиламина (0,46 мл) в DMF (7 мл). Реакционную смесь перемешивали при 20C в течение 3 ч. Смесь распределяли между этилацетатом и рассолом, органический слой промывали рассолом (2), сушили,фильтровали и растворитель выпаривали при пониженном давлении, получая указанное в подзаголовке соединение. Выход: 0,26 г. Получали способом из типичного примера 1, используя N-циклогексил-N-(2,2-диметоксиэтил)-3-(4(2-(4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9 ил)этил)фенетокси)пропанамид(m, 2H), 1,37-1,26 (m, 8H), 1,11-1,05 (m, 1H). Не наблюдали четырех обмениваемых протонов.HATU (0,23 г) добавляли в виде одной порции к охлажденному на льду раствору 3-(4-(2-(4-(2 изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропионовой кислоты [типичный пример 1, стадия е] (0,3 г) и N-(2,2-диметоксиэтил)циклогексанамина[WO 2008/075025] (0,087 г) и триэтиламина (0,26 мл) в DMF (10 мл). Смесь перемешивали при 20C в течение 1 ч, после чего распределяли между этилацетатом и рассолом. Органический слой промывали рассолом (2), сушили, фильтровали и растворитель выпаривали при пониженном давлении, что позволило получить указанное в подзаголовке соединение. Выход: 0,32 г. Получали способом из типичного примера 1, используя N-(2,2-диметоксиэтил)-3-(4-(2-(4-(2 этилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)-N-пропилпропанамидH ЯМР (400 МГц, CD3OD):7,92 (s, 1H), 7,21-7,14 (m, 4H), 6,89 (d, J=8,2 Гц, 1H), 6,73 (d, J=8,2 Гц,1H), 3,91-2,96 (m, 28H), 2,89 (t, J=8,0 Гц, 2H), 2,81 (t, J=7,1 Гц, 2H), 2,62 (t, J=6,6 Гц, 2H), 2,30-2,21 (m,2H), 1,85-1,72 (m, 2H), 1,65-1,54 (m, 2H), 1,38 (t, J=7,6 Гц, 3H), 0,91 (t, J=7,3 Гц, 3H). Не наблюдали пяти обмениваемых протонов.T3P (1,6 М в THF; 51,3 мл) по каплям добавляли к перемешиваемой суспензии гидрохлорида третбутил-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилата (WuXi PharmaTech.) (18,1 г), 2-этилтиазол-4 карбоновой кислоты [карбоновая кислота 1] (12 г) и триэтиламина (52 мл) в DMF (120 мл) в атмосфере азота и смесь перемешивали при температуре окружающей среды в течение 20 ч. Смесь разбавляли водой и экстрагировали в этилацетат (3). Объединенные экстракты последовательно промывали 10%-ным рассолом, 30%-ным рассолом и насыщенным рассолом, сушили над сульфатом магния, фильтровали и растворитель удаляли. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния,элюируя этилацетатом. Фракции, содержащие продукт, упаривали досуха, что позволило получить указанное в подзаголовке соединение в виде желтого масла. Выход: 24,0 г. Получали способом из типичного примера 1, стадия b, используя трет-бутил-4-(2-этилтиазол-4 карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилат [типичный пример 3, стадия а] (24,0 г) вме- 21020566 сто трет-бутил-4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилата. Растирание с эфиром позволило получить белое твердое вещество, которое собирали фильтрацией и сушили, получая указанное в подзаголовке соединение. Выход: 27,7 г. 1 Раствор 2-(4-(2-бромэтил)фенил)этанола [Organometallics, 2002, 21(20), 4217] (1,71 г) в NMP (5 мл) добавляли к суспензии трифторацетата (2-этилтиазол-4-ил)(1-окса-4,9-диазаспиро[5.5]ундекан-4 ил)метанона [типичный пример 3, стадия b] (3,0 г) и карбоната цезия (5,60 г) в NMP (10 мл) и смесь перемешивали при 75C в атмосфере азота в течение 4 ч. Добавляли дополнительное количество 2-(4-(2 бромэтил)фенил)этанола (0,65 г) и смесь перемешивали при 75C в течение 18 ч. Смесь охлаждали, разбавляли водой и экстрагировали в этилацетат (3). Объединенные экстракты промывали 10%-ным рассолом, 30%-ным рассолом и насыщенным рассолом, сушили над сульфатом магния, фильтровали и растворитель удаляли. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния, последовательно элюируя 50%-ным этилацетатом в изогексане с 5% триэтиламина, затем 100%-ным этилацетатом с 5% триэтиламина, затем 10%-ным метанолом в этилацетате с 5% триэтиламина. Фракции, содержащие продукт, упаривали досуха, что позволило получить указанное в подзаголовке соединение в виде желтого масла. Выход: 1,90 г.[типичный пример 3, стадия с] (1,9 г) и трет-бутилакрилата (1,32 мл) в ацетонитриле (1,5 мл) и смесь перемешивали при температуре окружающей среды в течение 4 ч. Смесь концентрировали в вакууме и неочищенный продукт очищали флэш-хроматографией на диоксиде кремния, градиент элюирования 50-75% этилацетата в изогексане с 5% триэтиламина. Фракции, содержащие продукт, упаривали досуха,что позволило получить указанное в подзаголовке соединение в виде бесцветного масла. Выход: 2,19 г. Получали способом из типичного примера 1, стадия е, используя трет-бутил-3-(4-(2-(4-(2 этилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропаноат [типичный пример 3, стадия d] (2,2 г) вместо трет-бутил-3-(4-(2-(4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9 диазаспиро[5.5]ундекан-9-ил)этил)фенетокси)пропаноата. Выход: 3,36 г. 1(m, 3H), 3,74-3,67 (m, 4H), 3,64-3,56 (m, 1H), 3,35-3,27 (m, 1H), 3,10-3,00 (m, 6H), 2,85 (t, J=6,5 Гц, 2H),2,61-2,55 (m, 2H), 2,21-2,13 (m, 2H), 2,03-1,92 (m, 6H), 1,45-1,34 (m, 3H). Не наблюдали одного обмениваемого протона.(0,50 г), N-(2,2-диметоксиэтил)пропан-1-амина [Liebigs Annalen der Chemie, 1979, 11, 1818] (0,12 г) и триэтиламина (0,56 мл) в дихлорметане (5 мл) при 0C в атмосфере азота и смесь перемешивали при температуре окружающей среды в течение 2 ч. Смесь промывали водой, органическую фазу отделяли, сушили,фильтровали и концентрировали в вакууме, что позволило получить указанное в подзаголовке соединение в виде оранжевого масла. Выход: 0,43 г. Моногидрат п-толуолсульфоновой кислоты (0,219 г) добавляли к раствору N-циклогептил-N-(2,2 диметоксиэтил)-3-(2-фтор-3-4-(2-изопропилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9 ил)метил)фенетокси)пропанамида (0,165 г) в тетрагидрофуране (2 мл) и полученную смесь перемешивали в течение ночи при к.т. Затем этот раствор добавляли к суспензии гидрохлорида 8-(2-аминоэтил)-5 гидрокси-2 Н-бензо[b][1,4]оксазин-3(4H)-она [WO 2008/075025] (0,056 г) и бикарбоната натрия (0,116 г) в смеси NMP (2 мл) и воды (0,2 мл). Полученный мутный раствор перемешивали в течение 10 мин. Затем добавляли уксусную кислоту (0,013 мл), после чего триацетоксиборгидрид натрия (0,122 г) и полученную смесь перемешивали в течение ночи. Реакционную смесь распределяли между 2-метилтетрагидрофураном (15 мл) и насыщенным раствором бикарбоната натрия (15 мл). Органическую фазу отделяли, промывали 10%-ным водным рассолом (215 мл), сушили над сульфатом натрия,фильтровали и упаривали. Остаток очищали флэш-хроматографией на диоксиде кремния, градиент элюирования смесью дихлорметан:метанол:'880' водный аммиак от 97,25:2,5:0,25 до 92,3:7:0,7. Фракции,содержащие продукт, объединяли и упаривали. Полученную смолу очищали далее препаративной HPLC(Sunfire, градиент: 35-60% метанола в 0,2%-ной водной TFA). Фракции, содержащие продукт, объединяли, упаривали и растирали с эфиром, получая указанное в заголовке соединение в виде белого твердого вещества. Выход: 0,069 г.H ЯМР (500 МГц, d6-DMSO, 90C):9,39-9,29 (m, 1H), 8,81-8,40 (m, 2H), 7,99-7,87 (m, 1H), 7,497,37 (m, 2H), 7,24-7,12 (m, 1H), 6,73-6,61 (m, 1H), 6,56-6,44 (m, 1H), 4,58-4,48 (m, 2H), 4,38-4,29 (m, 2H),3,86-3,59 (m, 11H), 3,49-3,00 (m, 11H), 2,91-2,78 (m, 4H), 2,64-2,55 (m, 2H), 2,10-1,98 (m, 2H), 1,85-1,30 (m,19H), 1,13-1,04 (m, 1H). Не наблюдали двух обмениваемых протонов. 3-(2-(трет-Бутилдиметилсилилокси)этил)-2-фторбензальдегид [ароматическое промежуточное соединение 5] (4,07 г) добавляли к трифторацетату (2-изопропилтиазол-4-ил)(1-окса-4,9 диазаспиро[5.5]ундекан-4-ил)метанона [типичный пример 1, стадия b] (6,10 г) в смеси N-метил-2 пирролидинона (50 мл) и уксусной кислоты (0,83 мл) и перемешивали в течение 30 мин. Затем добавляли триацетоксиборгидрид натрия (4,58 г) и смесь перемешивали в течение ночи. Реакционную смесь выливали в воду (100 мл), pH подводили до 8, используя насыщенный раствор бикарбоната натрия, и смесь экстрагировали этилацетатом (3100 мл). Объединенные органические фазы промывали водой(3100 мл) и рассолом (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали флэш-хроматографией на диоксиде кремния, используя в качестве растворителя смесь 77,5:17,5:5 изогексан:этилацетат:триэтиламин, с получением указанного в подзаголовке соединения в виде прозрачного масла. Выход: 5,35 г. 1[типичный пример 7, стадия а] (5,35 г) в THF (50 мл) и полученную смесь перемешивали в течение 1 ч. Растворитель выпаривали и остаток распределяли между этилацетатом (100 мл) и водой (100 мл). Слои разделяли и водную фазу экстрагировали этилацетатом (2100 мл). Объединенные органические фазы промывали рассолом (100 мл), сушили над сульфатом натрия, фильтровали и упаривали. Неочищенное вещество очищали флэш-хроматографией на диоксиде кремния, градиент элюирования от смеси 4:1 изогексан:этилацетат до 100%-ного этилацетата, получая указанное в подзаголовке соединение в виде прозрачного масла. Выход: 3,90 г. 1 Получали способом из типичного примера 1, стадия d, используя (9-(2-фтор-3-(2 гидроксиэтил)бензил)-1-окса-4,9-диазаспиро[5.5]ундекан-4-ил)(2-изопропилтиазол-4-ил)метанон [типичный пример 7, стадия b] (3,85 г) вместо (9-(4-(2-гидроксиэтил)фенетил)-1-окса-4,9 диазаспиро[5.5]ундекан-4-ил)(2-изопропилтиазол-4-ил)метанона. Неочищенный продукт очищали флэшхроматографией на диоксиде кремния, градиент элюирования от смеси 1:1 этилацетат:изогексан с 5% триэтиламина до смеси 95:5 этилацетат:триэтиламин. Фракции, содержащие продукт, упаривали досуха,что позволило получить указанное в подзаголовке соединение. Выход: 3,95 г.TFA (10 мл) осторожно добавляли к раствору трет-бутил-3-(2-фтор-3-4-(2-изопропилтиазол-4 карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)метил)фенетокси)пропаноата [типичный пример 7,стадия с] (3,95 г) в DCM (40 мл). Полученную смесь перемешивали в течение 2 ч. Растворитель выпаривали и остаток дважды азеотропно отгоняли с ацетонитрилом. Остаток растворяли в свежеперегнанном 2-метилтетрагидрофуране (100 мл) и промывали 3 раза смесью рассола и насыщенного раствора бикарбоната натрия (10:1; 100 мл). Органическую фазу сушили над сульфатом натрия, фильтровали и упаривали. Остаток 3 раза азеотропно отгоняли с изогексаном, получая указанное в подзаголовке соединение в виде белой пены. Выход: 2,92 г.[WO 2008/075025] (0,050 г) в DMF (0,5 мл). Полученный темный раствор перемешивали в течение ночи при к.т. Растворитель выпаривали и остаток распределяли между этилацетатом (25 мл) и 20%-ным водным рассолом (25 мл). Органический слой отделяли и промывали 20%-ным водным рассолом (225 мл). Органический раствор упаривали и остаток очищали хроматографией на силикагеле, градиент элюирования смесью изогексан:этилацетат:триэтиламин от 65:30:5 до 47,5:47,5:5. Фракции, содержащие продукт, объединяли и упаривали, получая указанное в подзаголовке соединение в виде масла. Выход: 0,165 г. Раствор N-бензил-N-(2,2-диметоксиэтил)-3-(2-фтор-3-4-(2-изопропилтиазол-4-карбонил)-1-окса 4,9-диазаспиро[5.5]ундекан-9-ил)метил)фенетокси)пропанамида (0,114 г) в смеси воды (1 мл) и уксусной кислоты (1 мл) нагревали при 50C в течение 2 ч. Смесь осторожно добавляли к насыщенному раствору бикарбоната натрия (30 мл) и полученную водную смесь экстрагировали этилацетатом (325 мл). Объединенные органические фазы промывали рассолом, сушили над сульфатом натрия, фильтровали и упаривали. Остаток растворяли в NMP (1 мл) и добавляли к раствору гидрохлорида 8-(2-аминоэтил)-5 гидрокси-2 Н-бензо[b][1,4]оксазин-3(4H)-она [WO 2008/075025] (0,039 г) и бикарбоната натрия (0,013 г) в смеси NMP (1 мл) и воды (0,2 мл). Затем добавляли уксусную кислоту (1 мл) и смесь перемешивали в течение 10 мин. Затем добавляли триацетоксиборгидрид натрия (0,085 г) и смесь перемешивали в течение ночи при к.т. Реакционную смесь распределяли между 2-метилтетрагидрофураном (15 мл) и насыщенным раствором бикарбоната натрия (15 мл). Органическую фазу отделяли, промывали 10%-ным вод- 25020566 ным рассолом (215 мл), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали флэш-хроматографией на диоксиде кремния, градиент элюирования смесью дихлорметан:метанол:'880' водный аммиак от 97,25:2,5:0,25 до 92,3:7:0,7. Фракции, содержащие продукт, объединяли и упаривали. Полученную смолу очищали далее препаративной HPLC (Sunfire, градиент: 35-60% метанола в 0,2%ной водной TFA). Фракции, содержащие продукт, объединяли, упаривали и растирали с эфиром, получая указанное в заголовке соединение в виде белого твердого вещества. Выход: 0,029 г.H ЯМР (500 МГц, d6-DMSO, 90C):9,34 (s, 1H), 8,64-8,27 (m, 1H), 7,93 (s, 1H), 7,42-7,14 (m, 8H),6,64 (d, J=8,4 Гц, 1H), 6,48 (d, J=8,3 Гц, 1H), 4,60 (s, 2H), 4,49 (s, 2H), 4,27-4,20 (m, 2H), 3,73-2,98 (m, 21H),2,88-2,78 (m, 4H), 2,66-2,59 (m, 2H), 2,04-1,95 (m, 2H), 1,81-1,70 (m, 2H), 1,35 (d, J=6,8 Гц, 6H). Не наблюдали трех обмениваемых протонов. Получали способом из типичного примера 7, стадия е, используя N-бензил-2,2-диметоксиэтанамин Получали из (9-(2-фтор-3-(2-гидроксиэтил)бензил)-1-окса-4,9-диазаспиро[5.5]ундекан-4-ил)(2(пентан-3-ил)тиазол-4-ил)метанона (0,32 г), используя способы, аналогичные описанным для типичных примеров 1-3. Выход: 0,11 г.H ЯМР (400 МГц, d6-DMSO, 90C):9,40 (s, 1H), 7,96 (s, 1H), 7,41 (t, J=7,2 Гц, 2H), 7,19 (t,J=7,7 Гц, 1H), 6,66 (d, J=8,5 Гц, 1H), 6,48 (d, J=8,5 Гц, 1H), 4,53 (s, 2H), 4,34-4,20 (m, 2H), 3,72-3,61 (m,10H), 3,52 (t, J=6,5 Гц, 2H), 3,32 (q, J=7,0 Гц, 2H), 3,14-3,03 (m, 8H), 2,97-2,90 (m, 1H), 2,87 (t, J=6,9 Гц,2H), 2,82 (t, J=7,8 Гц, 2H), 2,55 (t, J=6,7 Гц, 2H), 2,08-1,95 (m, 2H), 1,82-1,64 (m, 6H), 1,13-1,02 (m, 3H),0,84 (t, J=7,4 Гц, 6H). Не наблюдали четырех обмениваемых протонов. Раствор трифторуксусного ангидрида (9,6 мл) в DCM (10 мл) по каплям добавляли в течение периода времени 15 мин к перемешиваемому раствору триэтиламина (15,2 мл) и гидрохлорида трет-бутилокса-4,9-диазаспиро[5.5]ундекан-9-карбоксилата (WuXi PharmaTech) (9,95 г) в DCM (100 мл) при 0C в атмосфере азота. Полученный раствор перемешивали при 0C в течение 30 мин. Добавляли дополнительное количество триэтиламина (2,5 мл), затем дополнительное количество трифторуксусного ангидрида (1,6 мл) в DCM (10 мл) и перемешивание при 0C продолжали в течение 1 ч. Добавляли воду(100 мл) и смесь энергично перемешивали в течение 10 мин. Органический слой отделяли, сушили и растворитель выпаривали при пониженном давлении. Остаток растворяли в DCM (100 мл) и раствор обрабатывали трифторуксусной кислотой (25 мл). Эту смесь оставляли стоять при 20C в течение 10 мин и затем разбавляли толуолом (40 мл). Растворители удаляли при пониженном давлении и остаток азеотропно отгоняли с дополнительным количеством толуола (2), получая указанное в подзаголовке соединение. Выход: 14,0 г.N-метил-2-пирролидиноне (50 мл). Полученную смесь перемешивали в течение 15 мин, затем охлаждали в ледяной бане. Затем добавляли триацетоксиборгидрид натрия (5,64 г) и смесь перемешивали в течение ночи. Реакционную смесь гасили добавлением смеси насыщенного раствора бикарбоната натрия и рассола (1:5) и четыре раза экстрагировали этилацетатом. Объединенные органические фазы сушили(MgSO4), фильтровали и концентрировали в вакууме, что позволило получить масло. Это масло растворяли в THF (100 мл) и обрабатывали TBAF (1 M в THF; 18 мл). Полученный раствор перемешивали при комнатной температуре в течение 50 мин, затем добавляли дополнительное количество TBAF (1 M вTHF; 18 мл) и смесь перемешивали в течение следующих 100 мин. Затем раствор концентрировали в вакууме, что позволило получить масло. Это масло растворяли в метаноле (100 мл), раствор обрабатывали'880' водным аммиаком (20 мл), перемешивали при комнатной температуре в течение 50 мин, затем концентрировали в вакууме, получая масло. Это масло растворяли в метаноле и концентрировали на диоксиде кремния для флэш-хроматографии в вакууме. Полученный порошок очищали флэшхроматографией на диоксиде кремния, элюируя смесью '880' водный аммиак:метанол:дихлорметан(1:10:89), что позволило получить указанное в подзаголовке соединение в виде желтого масла. Выход: 5,8 г; чистота 60%. Использовали в неочищенном виде.HATU (0,35 г) добавляли к бесцветному раствору 2-(3-(1-окса-4,9-диазаспиро[5.5]ундекан-9 илметил)-2-фторфенил)этанола [типичный пример 9, стадия b] (0,364 г), 2-(пентан-3-ил)тиазол-4 карбоновой кислоты [карбоновая кислота 3] (0,141 г) и триэтиламина (0,30 мл) в DMF (10 мл), предварительно охлажденному в ледяной воде. Полученную желтую смесь перемешивали в ледяной воде в течение 1 ч, затем при комнатной температуре в течение 1 ч. Раствор выливали в смесь воды и рассола и дважды экстрагировали этилацетатом. Объединенные органические экстракты три раза промывали водой, один раз рассолом, затем сушили (MgSO4), фильтровали и концентрировали на диоксиде кремния для флэш-хроматографии в вакууме. Полученный порошок очищали флэш-хроматографией на диоксиде кремния, элюируя смесью триэтиламин:метанол:дихлорметан (1:2:97), что позволило получить указанное в подзаголовке соединение. Выход: 0,324 г. Моногидрат п-толуолсульфоновой кислоты (0,51 г) добавляли к раствору 3-(2-хлор-3-4-(2 этилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-ил)метил)фенетокси)-N-(2,2 диметоксиэтил)-N-этилпропанамида (0,35 г) в THF (5 мл) и полученную смесь перемешивали в течение 15 мин при к.т. Затем этот раствор добавляли к суспензии гидрохлорида 7-(2-аминоэтил)-4 гидроксибензо[d]тиазол-2(3H)-она (Org. Proc. Res. Dev. 2004, 8(4), 628) (0,20 г) и бикарбоната натрия(0,29 г) в смеси NMP (2 мл) и воды (0,2 мл). Полученный мутный раствор перемешивали в течение 10 мин, затем добавляли триацетоксиборгидрид натрия (0,34 г) и полученную смесь перемешивали в течение ночи. Реакционную смесь распределяли между этилацетатом (15 мл) и насыщенным раствором бикарбоната натрия (15 мл). Органическую фазу отделяли, промывали 10%-ным рассолом (215 мл), сушили над сульфатом натрия, фильтровали и упаривали. Остаток очищали флэш-хроматографией на диоксиде кремния, градиент элюирования смесью дихлорметан:метанол:'880' водный аммиак от 97,25:2,5:0,25 до 92,3:7:0,7. Фракции, содержащие продукт, объединяли и упаривали. Полученную смолу очищали далее препаративной HPLC (Gemini NX, градиент: 27-62% метанола в 0,1%-ной водной TFA). Фракции, содержащие продукт, объединяли и упаривали, получая указанное в заголовке соединение в виде белой пены. Выход: 0,17 г.(m, 1H), 7,36-7,30 (m, 1H), 6,87-6,81 (m, 1H), 6,77-6,71 (m, 1H), 4,36-4,23 (m, 2H), 3,75-2,54 (m, 30H), 2,061,94 (m, 2H), 1,83-1,68 (m, 2H), 1,38-1,29 (m, 3H), 1,16-1,03 (m, 3H). Не наблюдали четырех обмениваемых протонов. 3-(2-Хлор-3-4-(2-этилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9 ил)метил)фенетокси)-N-(2,2-диметоксиэтил)-N-этилпропанамид, используемый в качестве исходного вещества, получали следующим образом. а) трет-Бутил-4-(2-этилтиазол-4-карбонил)-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилатT3P (1,6 М в THF; 51 мл) по каплям добавляли к перемешиваемой суспензии гидрохлорида третбутил-1-окса-4,9-диазаспиро[5.5]ундекан-9-карбоксилата (WuXi PharmaTech) (18 г), 2-этилтиазол-4 карбоновой кислоты [карбоновая кислота 1] (12,0 г) и триэтиламина (52 мл) в DMF (120 мл) в атмосфере азота и смесь перемешивали при температуре окружающей среды в течение 20 ч. Смесь разбавляли водой и экстрагировали в этилацетат (3). Объединенные экстракты последовательно промывали 10%-ным рассолом, 30%-ным рассолом и насыщенным рассолом, сушили над сульфатом магния, фильтровали и растворитель удаляли. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния,элюируя этилацетатом. Чистые фракции упаривали досуха, что позволило получить указанное в подзаголовке соединение в виде желтого масла. Выход: 24 г.(100 мл) и смесь перемешивали при температуре окружающей среды в течение 18 ч. Реакционную смесь разбавляли толуолом (50 мл) и концентрировали в вакууме. Остаток растворяли в дихлорметане (50 мл),добавляли TFA (50 мл) и смесь перемешивали в течение 4 ч. Смесь разбавляли толуолом (50 мл), концентрировали в вакууме, остаток растирали с эфиром и выпавшее в осадок твердое вещество собирали фильтрацией и сушили, что позволило получить указанное в подзаголовке соединение в виде белого твердого вещества. Выход: 28 г. 1 К суспензии 2-хлор-3-(2-гидроксиэтил)бензальдегида [ароматическое промежуточное соединение 11] (1,5 г) и трифторацетата (2-этилтиазол-4-ил)(1-окса-4,9-диазаспиро[5.5]ундекан-4-ил)метанона [типичный пример 26, стадия b] (4,25 г) в тетрагидрофуране (50 мл) добавляли триэтиламин (2,5 мл) в виде одной порции. Смесь перемешивали в течение 0,5 ч, затем добавляли триацетоксиборгидрид натрия(2,58 г) в виде одной порции и полученный раствор перемешивали в течение 2 ч. Реакционную смесь распределяли между этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (50 мл). Смесь энергично встряхивали в течение 10 мин и слои разделяли. Водную фазу экстрагировали этилацетатом(100 мл). Объединенные органические растворы промывали рассолом, сушили над сульфатом натрия,фильтровали и упаривали. Остаток очищали флэш-хроматографией на диоксиде кремния, используя в качестве растворителя смесь 95:5 этилацетат:триэтиламин. Фракции, содержащие продукт, объединяли и упаривали, получая указанное в подзаголовке соединение в виде прозрачного масла. Выход: 3,40 г. 1(3,2 г) и трет-бутилакрилата (1,5 мл) в ацетонитриле (1 мл) и полученную смесь перемешивали в течение ночи при к.т. Растворитель выпаривали и остаток очищали флэш-хроматографией на диоксиде кремния с градиентом элюирования от смеси 1:1:0,05 этилацетат:изогексан:триэтиламин до смеси 95:5 этилацетат:триэтиламин, получая указанное в подзаголовке соединение в виде прозрачного масла. Выход: 3,2 г.(30 мл) и полученную смесь перемешивали в течение 2 ч, затем упаривали. Остаток распределяли между этилацетатом (100 мл) и насыщенным раствором бикарбоната натрия (50 мл). Фазы разделяли и водную фазу еще раз промывали этилацетатом (2100 мл). Водную фазу затем подкисляли, используя уксусную кислоту, и экстрагировали этилацетатом (3100 мл). Объединенные органические растворы сушили над сульфатом натрия, фильтровали и упаривали, получая указанное в подзаголовке соединение в виде белой пены.
МПК / Метки
МПК: A61P 13/00, A61P 35/00, A61P 27/00, A61P 25/00, C07D 519/00, A61K 31/5386, A61P 17/00, A61P 9/00, A61P 29/00, A61P 37/00, A61P 11/00, A61P 19/00, A61P 1/00, C07D 498/10
Метки: спироциклические, амидов, производные
Код ссылки
<a href="https://eas.patents.su/30-20566-spirociklicheskie-proizvodnye-amidov.html" rel="bookmark" title="База патентов Евразийского Союза">Спироциклические производные амидов</a>
Предыдущий патент: Пуриновые соединения
Следующий патент: Борт шины для грузового автомобиля малой грузоподъемности
Случайный патент: Сельскохозяйственная полимерная композиция, способ ее получения и применение