Производные индазолил-эфиров или -амидов для лечения расстройств, опосредованных глюкокортикоидными рецепторами
Номер патента: 16895
Опубликовано: 30.08.2012
Авторы: Дамен Ян, Ревинкель Хартмут, Маккерречер Даррен, Хенрикссон Кристер, Лепистё Матти, Тафлин Камилла, Ханссон Томас, Нильссон Стинабритт, Иванова Светлана, Габос Балинт, Мунк Ав Розеншёльд Магнус, Эдман Карл, Бергер Маркус, Хеммерлинг Мартин, Эрикссон Андерс
Формула / Реферат
1. Соединение формулы (I)
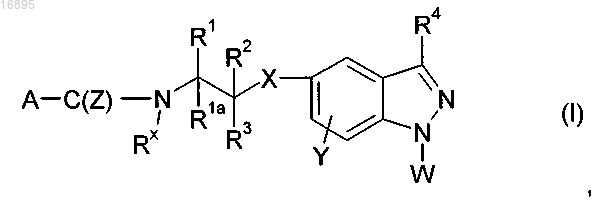
где A представляет собой C1-3гидроксиалкил, C3-5циклоалкил, C1-3галогеноалкил или NR5R6C(O);
R1 и R1a независимо выбраны из водорода, C1-4алкила, C1-4гидроксиалкила, C1-4алкил-OC1-4алкила и C1-4галогеноалкила или R1 и R1a вместе представляют собой оксо;
R2 представляет собой водород или C1-4алкил;
R3 представляет собой C5-10арил, C5-10арил-C1-4алкил, C5-10арил-O, C5-10арил-OC1-4алкил или C5-10гетероарил, которые возможно могут быть замещены одним или более заместителями, независимо выбранными из B;
В представляет собой гидрокси, C1-4алкил, C1-4алкокси, C1-4алкил-C1-4тиоалкил, C1-4тиоалкил, C3-6циклоалкил-S, C1-3алкил-S(O)n-C1-4алкил, C1-3алкил-S(O)n, C1-4галогеноалкил или галогено;
n равно 1 или 2;
R4 представляет собой водород;
W представляет собой фенил, C1-4алкил, C3-7циклоалкил, пиридинил, пиридазинил или пиримидинил, каждый из которых возможно может быть замещен одним или более заместителями, независимо выбранными из C1-3гидроксиалкила, C3-6гетероциклоалкил-C1-4алкила, галогено, C1-4алкил-OC(O) и NR10R11-C1-4алкила;
X представляет собой O или S;
Y представляет собой водород, галогено или C1-4алкил;
Z представляет собой O или S;
R5, R6, R10 и R11 независимо выбраны из водорода, C1-6-алкилС(О), NHR7C(O) и C1-6алкила;
R7 представляет собой водород, C1-6алкил, C1-6алкил-OC(O)-C1-3алкил, C5-10гетероарил-C1-3алкил или C3-6 циклоалкил;
гетероциклоалкил относится к полностью насыщенной моноциклической углеводородной кольцевой системе, имеющей один или два гетероатома, независимо выбранных из кислорода, азота или серы, и C5-10 гетероарил относится к моно- или бициклическому ароматическому или частично ароматическому кольцу с 5-10 атомами и содержащему один или два гетероатома, независимо выбранных из кислорода, азота или серы,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где
A представляет собой C1-3гидроксиалкил, C3-5циклоалкил, C1-3галогеноалкил или NR5R6C(O);
R1 и R1a независимо выбраны из водорода и C1-3алкила;
R2 представляет собой водород;
R3 представляет собой C5-10арил, C5-10арил-O-C1-2алкил или C5-10гетероарил, которые возможно могут быть замещены одним или более заместителями, независимо выбранными из B;
B представляет собой C1-3алкокси или C1-3алкил-S(O)n;
n равно 2;
R4 представляет собой водород;
W представляет собой фенил, который возможно замещен одним или более галогено;
X представляет собой O;
Y представляет собой водород;
Z представляет собой O;
R5 и R6 независимо выбраны из водорода и C1-3алкила и
Rx представляет собой водород,
или его фармацевтически приемлемая соль.
3. Соединение по любому из пп.1, 2, где
R2 представляет собой водород;
R4 представляет собой водород;
X представляет собой O;
Y представляет собой водород и
Z представляет собой O.
4. Соединение по любому из пп.1-3, где W представляет собой фенил, который замещен галогено.
5. Соединение по любому из пп.1-4, где
X представляет собой O и
Z представляет собой O.
6. Соединение по п.1, представляющее собой 2,2,2-трифтор-N-[(1R,2S)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(3-метоксифенил)пропан-2-ил]ацетамид или его фармацевтически приемлемую соль.
7. Соединение по п.1, представляющее собой N-[(1R*,2S*)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(6-метоксипиридин-3-ил)пропан-2-ил]циклопропанкарбоксамид или его фармацевтически приемлемую соль.
8. Соединение по п.1, представляющее собой N-[(1R,2S)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(6-метоксипиридин-3-ил)пропан-2-ил]циклопропанкарбоксамид или его фармацевтически приемлемую соль.
9. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по любому из пп.1 или 8, и фармацевтически приемлемый адъювант, разбавитель или носитель.
10. Комбинация соединения формулы (I) или его фармацевтически приемлемой соли по любому из пп.1 или 8 и одного или более агентов, выбранных из списка, включающего
ингибитор PDE4;
избирательный агонист β2-адренорецептора;
антагонист мускаринового рецептора;
стероид;
модулятор функционирования хемокиновых рецепторов;
ингибитор функционирования киназы р38;
ингибитор матриксных металлопротеиназ, наиболее предпочтительно направленно действующий на ММР-2, -9 или ММР-12; или
ингибитор нейтрофильных сериновых протеаз, наиболее предпочтительно нейтрофильной эластазы или протеазы 3;
причем комбинация обладает активностью модулятора глюкокортикоидного рецептора.
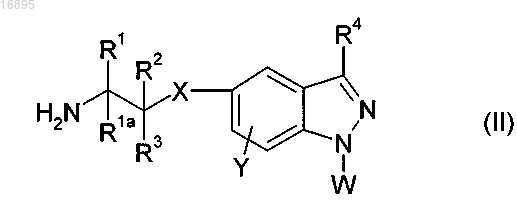
11. Способ получения соединений формулы (I) по п.1, при котором осуществляют сочетание соединения формулы (II)
с ацилирующими реагентами формулы (IIIa) или формулы (IIIb)
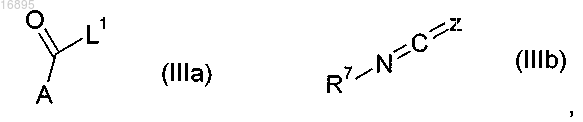
где R1, R1a, R2, R3, R4, R7, A, W, X, Y и Z такие, как определено в п.1, a L1 представляет собой уходящую группу или, когда L1=OH, уходящую группу, образованную в результате реакции реагента сочетания.
Текст
В изобретении предложено соединение формулы (I) Бергер Маркус (DE), Дамен Ян,Эрикссон Андерс, Габос Балинт,Ханссон Томас, Хеммерлинг Мартин,Хенрикссон Кристер, Иванова Светлана, Лепист Матти (SE),Маккерречер Даррен (GB), Мунк Ав Розеншльд Магнус, Нильссон Стинабритт (SE), Ревинкель Хартмут Изобретение относится к новым производным индазолил-эфиров или -амидов, к фармацевтическим композициям, содержащим такие производные, к способам получения таких новых производных и к применению таких производных в качестве лекарственных средств.(71)(73) Заявитель и патентовладелец: АСТРАЗЕНЕКА АБ (SE); БАЙЕР ШЕРИНГ ФАРМА АКТИЕНГЕЗЕЛЛЬШАФТ (DE) 016895 Настоящее изобретение относится к новым производным индазолилэфиров или -амидов, к фармацевтическим композициям, содержащим такие производные, к способам получения таких новых производных и к применению таких производных в качестве лекарственных средств (например, в лечении воспалительного болезненного состояния). Сульфонамидные производные раскрыты как противовоспалительные в WO 2004/019935 иWO 2004/050631. Фармацевтически активные сульфонамиды также раскрыты в Arch. Pharm. (1980), 313,166-173, J. Med. Chem. (2003), 46, 64-73, J. Med. Chem. (1997), 40, 996-1004, EP 0031954, EP 1190710(WO 200124786), US 5861401, US 4948809, US 3992441 и WO 99/33786. Известно, что некоторые нестероидные соединения взаимодействуют с глюкокортикоидным рецептором (GR), и результатом этого взаимодействия является устранение воспаления (см., например,US 6323199). Такие соединения могут демонстрировать четкое разделение между противовоспалительным действием и метаболическим действием, что ставит их выше стероидных и нестероидных глюкокортикоидов, о которых сообщалось ранее. Настоящее изобретение предусматривает дополнительные нестероидные соединения в качестве модуляторов (например, агонистов, антагонистов, частичных агонистов или частичных антагонистов) глюкокортикоидного рецептора. Эти новые соединения обладают улучшенными свойствами, такими как избирательность, эффективность и т.д. по сравнению с известными соединениями. Согласно настоящему изобретению предложено соединение формулы (I)R1 и R1a независимо выбраны из водорода, C1-4 алкила, C1-4 гидроксиалкила, C1-4 алкил-OC1-4 алкила иC1-4 галогеноалкила или R1 и R1a вместе представляют собой оксо;R2 представляет собой водород или C1-4 алкил;C5-10 гетероарил, которые возможно могут быть замещены одним или более заместителями, независимо выбранными из B; В представляет собой гидрокси, C1-4 алкил, C1-4 алкокси, C1-4 алкил-C1-4 тиоалкил, C1-4 тиоалкил,C3-6 циклоалкил-S, C1-3 алкил-S(O)nC1-4 алкил, C1-3 алкил-S(O)n, C1-4 галогеноалкил или галогено;W представляет собой фенил, C1-4 алкил, C3-7 циклоалкил, пиридинил, пиридазинил или пиримидинил, каждый из которых возможно может быть замещен одним или более заместителями, независимо выбранными из C1-3 гидроксиалкила, C3-6 гетероциклоалкил-C1-4 алкила, галогено, C1-4 алкил-OC(O) иR5, R6, R10 и R11 независимо выбраны из водорода, C1-6 алкил-С(О), NHR7C(O) и C1-6 алкила иC3-6 циклоалкил; гетероциклоалкил относится к полностью насыщенной моноциклической углеводородной кольцевой системе, имеющей один или два гетероатома, независимо выбранных из кислорода, азота или серы, иC5-10 гетероарил относится к моно- или бициклическому ароматическому или частично ароматическому кольцу с 5-10 атомами и содержащему один или два гетероатома, независимо выбранных из кислорода,азота или серы,или его фармацевтически приемлемая соль. В одном из воплощений изобретение относится к соединениям формулы (I), гдеR1 и R1a независимо выбраны из водорода и C1-3 алкила;R3 представляет собой C5-10 арил, C5-10 арил-OC1-2 алкил или C5-10 гетероарил, которые возможно могут быть замещены одним или более заместителями, независимо выбранными из B; В представляет собой C1-3 алкокси или C1-3 алкил-S(O)n;W представляет собой фенил, который возможно замещен одним или более галогено;R5 и R6 независимо выбраны из водорода и C1-3 алкила иRx представляет собой водород, или их фармацевтически приемлемым солям. В еще одном воплощении, относящемся к соединениям формулы (I), R2 представляет собой водород; R4 представляет собой водород; X представляет собой O; Y представляет собой водород и Z представляет собой O. В еще одном воплощении, относящемся к соединениям формулы (I), W представляет собой фенил,который замещен галогено. В еще одном воплощении, относящемся к соединениям формулы (I), X представляет собой O и Z представляет собой O. Соединение формулы(I),представляющее собой 2,2,2-трифтор-N-[(1R,2S)-1-[1-(4 фторфенил)индазол-5-ил]окси-1-(3-метоксифенил)пропан-2-ил]ацетамид, или его фармацевтически приемлемая соль являются предпочтительными. Соединение формулы (I), представляющее собойN-[(1R,2S)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(6-метоксипиридин-3-ил)пропан-2 ил]циклопропанкарбоксамид, или его фармацевтически приемлемая соль также являются предпочтительными. Кроме того, предпочтительными являются соединение формулы (I), представляющее собойN-[(1R,2S)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(6-метоксипиридин-3-ил)пропан-2 ил]циклопропанкарбоксамид, или его фармацевтически приемлемая соль. Во избежание неясности следует иметь в виду, что если в данном описании группа определена выражением "как определено ниже", "как определено выше", то указанная группа охватывает встречающееся первым и самое широкое определение, а также каждое и все остальные определения для этой группы. Во избежание неясности следует иметь в виду, что в данном описании "C1-6" означает углеродную группу, имеющую 1, 2, 3, 4, 5 или 6 атомов углерода. В этом описании, если не указано иное, термин "алкил" включает алкильные группы как с прямой,так и с разветвленной цепью и может представлять собой, без ограничений, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил или изогексил. "C1-4 алкил" имеет от 1 до 4 атомов углерода и может представлять собой, без ограничений, метил,этил, н-пропил, изопропил или трет-бутил. Термин "C0" в "C0-4 алкил" относится к случаю, когда атом углерода отсутствует. Термин "алкокси", если не указано иное, относится к радикалам общей формулы -O-R, где R выбран из углеводородного радикала. Термин "алкокси" может включать, без ограничений, метокси, этокси, пропокси, изопропокси, бутокси, трет-бутокси, изобутокси, циклопропилметокси, аллилокси или пропаргилокси. В данном описании, если не указано иное, термин "циклоалкил" относится к возможно замещенной,частично или полностью насыщенной моноциклической, бициклической или мостиковой углеводородной кольцевой системе. "C1-6 циклоалкил" может представлять собой, без ограничений, циклопропил,циклобутил, циклопентил или циклогексил. В данном описании, если не указано иное, термины "галогено" и "галоген" могут означать фтор(фторо), йод (йодо), хлор (хлоро) или бром (бромо). В данном описании, если не указано иное, термин "галогеноалкил" означает алкильную группу, как определено выше, которая замещена галогено, как определено выше. Термин "C1-6 галогеноалкил" может охватывать, без ограничений, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил или фторхлорметил. Термин "C1-3 галогеноалкил-O" или "C1-3 галогеноалкокси" может охватывать, без ограничений,фторметокси, дифторметокси, трифторметокси, фторэтокси или дифторэтокси. В этом описании, если не указано иное, термин "тиоалкил" означает алкильную группу, как определено выше, которая замещена атомом серы. Термин "C1-6 тиоалкил" может включать, без ограничений,метилсульфанил, этилсульфанил или пропилсульфанил. Термин "циклоалкил-S" означает атом серы, замещенный циклоалкилом, как определено выше, такой как, например, циклопропилсульфанил в примере 15. Термин "C1-4 алкил-C1-4 тиоалкил" или "C1-4 алкил-SC1-4 алкил" означает алкильную группу с атомом серы между атомами углерода. Термин "C1-4 алкил-C1-4 тиоалкил" может включать, без ограничений, этилсульфанилметил, как в примере 25. В данном описании, если не указано иное, термин "C5-10 арил" относится к ароматической или частично ароматической группе, имеющей от 5 до 10 атомов углерода, такой как, например, фенил или нафтил. Когда фенил замещен группой OCH2O, OCH2CH2O или OCH2CH2, тогда эти группы связаны с соседними атомами углерода на фенильном кольце. Во избежание неясности группа R3, определенная как C5-10 арил, например фенил, замещенный группой C1-2 алкил-S(O)n, включает фенил, замещенный метилсульфонильной группой, как в примере 12. И группа R7, определенная как C5-10 гетероарил-C1-3 алкил, включает фурилметильную группу, как в примере 105.-2 016895 Следует иметь в виду, что по всему тексту описания количество и природа заместителей на кольцах в соединениях по изобретению выбраны таким образом, чтобы избежать стерически нежелательных комбинаций. Соединения по настоящему изобретению были названы с помощью компьютерной программы(ACDLabs 8,0/Name(IUPAC. Соединения формулы (I) могут иметь асимметрический центр и быть хиральными по своей природе. Если соединение является хиральным, то оно может существовать в форме единственного стереоизомера, например энантиомера, или оно может существовать в форме смесей этих стереоизомеров в любых соотношениях, включая рацемические смеси. Таким образом, все энантиомеры, диастереомеры, рацематы и их смеси входят в объем изобретения. Разные оптические изомеры могут быть выделены разделением рацемической смеси соединений с использованием общепринятых методов, например фракционной кристаллизацией или ВЭЖХ. Альтернативно, оптические изомеры могут быть получены в результате асимметрического синтеза или синтеза из оптически активных исходных веществ. Соединения формулы (I) выше могут быть превращены в их фармацевтически приемлемые соли, предпочтительно соли присоединения кислоты, такие как гидрохлорид, гидробромид,фосфат, сульфат, ацетат, аскорбат, бензоат, фумарат, гемифумарат, фуроат, сукцинат, малеат, тартрат,цитрат, оксалат, ксинафоат, метансульфонат, п-толуолсульфонат, бензолсульфонат, этансульфонат,2-нафталинсульфонат, мезитиленсульфонат, соль с азотной кислотой, 1,5-нафталин-дисульфонат,п-ксилолсульфонат, аспартат или глутамат. Они также могут включать соли присоединения основания, такие как соли щелочных металлов, например натриевая или калиевая соли, соли щелочно-земельных металлов, например кальциевая или магниевая соли, соли переходных металлов, такие как цинковая соль, соли с органическими аминами, например соль с триэтиламином, диэтиламином, морфолином, N-метилпиперидином, N-этилпиперидином,пиперазином, прокаином, дибензиламином, N,N-дибензилэтиламином, холином или 2-аминоэтанолом,или с аминокислотами, например лизином или аргинином. Соединения формулы (I) и их фармацевтически приемлемые соли могут существовать в сольватированных формах, например в гидратированной форме, а также в несолватированных формах, или в виде сокристаллов, и настоящее изобретение охватывает все такие формы. Способ. Соединения формулы (I) можно получить, используя или адаптируя способы, известные в данной области, или используя или адаптируя способ, описанный в разделе "Примеры" ниже. Исходные вещества для препаративных способов либо имеются в продаже, либо их можно получить, используя или адаптируя способы, описанные в литературе. Одно из воплощений относится к способу получения соединений формулы (I), при котором осуществляют сочетание соединения формулы (II) с ацилирующими реагентами формулы (IIIa) или формулы (IIIb) где R1, R1a, R2, R3, R4, R7, A, W, X, Y и Z такие, как определено для соединений формулы (I);L1 представляет собой уходящую группу (такую как галогено (например, хлоро) или, когда L1 = OH,уходящую группу, образованную в результате реакции реагента сочетания (такого как HATU с карбоновой кислотой). Реакция может быть осуществлена в подходящем растворителе (таком как пиридин, THF или DMF(диметилформамид в присутствии подходящего основания (такого как три(C1-6 алкил)амин, например диизопропилэтиламин, или пиридин) и при подходящей температуре (от -10 до 50C).-3 016895 В настоящем изобретении раскрыт способ получения соединений формулы (II), при котором осуществляют стадии а), или б), или в).a) Соединение формулы (II), где X представляет собой O или S, может быть получено в результате сочетания соединения формулы (IV)L2 представляет собой уходящую группу (такую как галоген или трифлат),с соединением формулы (V)G соответствует R3 или защищенному предшественнику R3. Эта реакция может быть осуществлена в подходящем растворителе (например, в ароматическом растворителе, таком как толуол, или в полярном, апротонном растворителе, таком как DMF или бутиронитрил) в присутствии подходящего основания (такого как алкоксид щелочного металла, например третбутоксид натрия, или карбонат цезия), предпочтительно в присутствии подходящего металлического катализатора, такого как йодид меди(I), при подходящей температуре (например, в пределах от 80C до 120C). б) Соединение формулы (II) может быть получено в результате взаимодействия соединения формулы (VII)G соответствует R3 или защищенному производному R3;L3 представляет собой уходящую группу (такую как галоген, мезилат или тозилат). Эта реакция может быть осуществлена в подходящем растворителе (таком как DCM, DMF или ацетонитрил) в присутствии подходящего основания (такого как карбонат щелочного металла, например карбонат цезия или карбонат калия) при подходящей температуре (например, в пределах от -10 до 50C). в) Соединение формулы (II) может быть получено в результате взаимодействия соединения формулы (VIII) с соединением формулы (IX)PG представляет собой подходящую защитную группу, такую как ВОС, Ms, Ns, Ts или родственные карбонильные или сульфонильные остатки. Эта реакция может быть осуществлена в подходящем растворителе, таком как DCM или толуол, в присутствии подходящего основания, такого как NaH или KOtBu, с последующим проведением стадии удаления защитной группы, используя или адаптируя способы, описанные в литературе. В конкретном случае соединения формулы (V) для получения соединения формулы (II) может быть использовано соединение формулы (X) где R1, R1a и G такие, как определено для соединения формулы (V).-4 016895 Соединения формулы (X) могут быть получены в результате взаимодействия нуклеофила G-M с карбонильным соединением формулы (XI) с последующим восстановлением и удалением защитной группы промежуточного соединения формулы (XII) где R1, R1a и R3 такие, как определено для соединения формулы (I);G соответствует R3 или защищенному предшественнику R3;L представляет собой уходящую группу (такую как алкокси, метокси(метил)амино); М представляет собой металл, такой как Li или Mg-галогенид. Присоединение нуклеофила может быть осуществлено в подходящем апротонном растворителе, таком как THF, при умеренной температуре от -10 до 50C. Последующие стадии восстановления и удаления защитных групп могут быть осуществлены, используя или адаптируя способы, описанные в литературе. Альтернативно, соединения формулы (X) могут быть получены в результате взаимодействия нуклеофила G-M с альдегидом формулы (XIII) и последующего удаления защитной группы где R1, R1a и R3 такие, как определено для соединения формулы (I);G соответствует R3 или защищенному предшественнику R3;PG представляет собой защитную группу или водород; М представляет собой металл, такой как щелочной металл (например, Li) или Mg-галогенид. Реакция может быть осуществлена по известным протоколам для присоединения карбанионов к альдегидам. Другим путем получения соединения формулы (X) является взаимодействие нитроалкилов формулы (XIV) с альдегидами формулы (XV) с последующим восстановлением функциональной нитрогруппы где R1 и R1a и R3 такие, как определено для соединения формулы (I);G соответствует R3 или защищенному предшественнику R3;PG представляет собой защитную группу или водород. Обе стадии могут быть проведены, используя или адаптируя способы, описанные в литературе. Медицинское применение. Благодаря своей способности связываться с глюкокортикоидным рецептором соединения формулы(I) полезны в качестве противовоспалительных агентов и могут также оказывать противоаллергическое,иммунодепрессивное и антипролиферативное действие. Так, соединения формулы (I) или их фармацевтически приемлемые соли могут быть использованы в качестве лекарственных средств для лечения или профилактики одного или более следующих патологических состояний (болезненных состояний) у млекопитающего (например, человека):(1) легочные заболевания, которые протекают с воспалительным, аллергическим и/или пролиферативным процессами: хронические обструктивные легочные заболевания любого происхождения, главным образом бронхиальная астма, хроническое обструктивное заболевание легких,бронхиты различного происхождения,респираторный дистресс-синдром взрослых (ARDS), острый респираторный дистресс-синдром,бронхоэктазы,все формы реструктурированных заболеваний легких, главным образом аллергический альвеолит,все формы отека легких, главным образом токсический отек легких,саркоидозы и гранулематозы, например саркома Бека;(2) ревматические заболевания/аутоиммунные заболевания/дегенеративные заболевания суставов,которые сопровождаются с воспалительными, аллергическими и/или пролиферативными процессами: все формы ревматических заболеваний, в частности ревматоидный артрит, острая ревматическая лихорадка, ревматическая полимиалгия, коллагеновые болезни, болезнь Бехчета,реактивный артрит,воспалительные заболевания мягких тканей различного происхождения,артритические симптомы при дегенеративных заболеваниях суставов (артрозы),травматические артритиды,-5 016895 диффузные болезни соединительной ткани различного происхождения, например системная красная волчанка, дискоидная эритематозная волчанка, склеродермия, полимиозит, дерматомиозит, нодозный полиартериит, височный артериит,синдром Шегрена-Ларссона, синдром Стилла, синдром Фелти,витилиго,ревматизм мягких тканей;(3) аллергии, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: все формы аллергических реакций, например отек Квинке, укусы насекомых, аллергические реакции на фармацевтические агенты, производные крови, контрастную среду и т.п., анафилактический шок,крапивница, контактный дерматит (например, аллергический и ирритативный), аллергические сосудистые заболевания,аллергический васкулит,воспалительный васкулит;(5) дерматологические заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: атопический дерматит (главным образом у детей),эксфолиативный дерматит,псориаз,эритематозные заболевания, инициированные различными вредными факторами, например радиацией, химическими веществами, ожогами и т.п.,кислотные ожоги,буллзные дерматозы, такие как, например, аутоиммунная вульгарная пузырчатка, буллзный пемфигоид,заболевания лихеноидной группы,зудящие (например, аллергической природы),все формы экземы, такие как, например, атопическая экзема или себорейная экзема,розацеа,вульгарный пемфигус,экссудативная многоформная эритема,нодозная эритема,баланит,зуд, например аллергический,проявление сосудистых заболеваний,вульвит,воспалительная потеря волос, такая как очаговая алопеция,кожная Т-клеточная лимфома,сыпи любого происхождения или дерматозы,псориаз и парапсориазные группы,красный волосистый питириаз;(7) заболевания печени, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: острый распад клеток печени,острый гепатит различного происхождения, например индуцированный вирусами, токсическими агентами или фармацевтическими агентами,хронический агрессивный и/или хронический периодический гепатит,(8) желудочно-кишечные заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: гранулематозный энтерит (болезнь Крона),гастрит,рефлюксный эзофагит,язвенный колит,гастроэнтерит различного происхождения, например нативные спру;(11) заболевания в области уха-горла-носа, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: аллергический ринит, сенная лихорадка,наружный отит, например вызванный контактным дерматитом, инфекцией и т.д.,средний отит;(12) неврологические заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: церебральный отек, главным образом вызванный опухолью отек,рассеянный склероз,острый энцефаломиелит,различные формы судорог, например детская кивательная судорога,менингит,повреждение спинного мозга,инсульт;(14) опухолевые заболевания, которые сопровождаются воспалительными, аллергическими и/или пролиферативными процессами: острый лимфатический лейкоз,злокачественная лимфома,лимфогранулематоз,лимфосаркома,экстенсивные метастазы, главным образом при раке молочной железы и раке простаты;(18) заместительная терапия, которая сопровождается воспалительными, аллергическими и/или пролиферативными процессами, с врожденной первичной надпочечниковой недостаточностью, например врожденной надпочечниковой гиперплазией,приобретенной первичной надпочечниковой недостаточностью, например аддисоновой болезнью,аутоиммунным адреналитом, метаинфекцией, опухолями, метастазами и т.д.,-7 016895 врожденной вторичной надпочечниковой недостаточностью, например врожденным гипопитуитаризмом,приобретенной вторичной надпочечниковой недостаточностью, метаинфекцией, опухолями, метастазами и т.д.;(20) боли воспалительного происхождения, например люмбаго. В дополнение к вышеуказанному соединения формулы (I) также могут быть использованы для лечения таких расстройств, как диабет типа I (инсулинозависимый диабет), синдром Гийена-Барре, рестеноз после чрескожной транслюминальной ангиопластики, болезнь Альцгеймера, острая и хроническая боль, артериосклероз, реперфузионное повреждение, термическое повреждение, вторичные множественные повреждения органов после травмы, острый гнойный менингит, некротический энтероколит и синдромы, ассоциированные с гемодиализом, лейкоферезом, трансфузией гранулоцитов, синдром конуса,первичный и вторичный гиперальдостеронизм, повышенное удержание натрия, повышенная экскреция магния и калия (диурез), повышенное удержание воды, гипертензия (изолированная систолическая и комбинированная систолическая/диастолическая), аритмии, миокардиальный фиброз, инфаркт миокарда,синдром Бартера, расстройства, ассоциированные с избыточными уровнями катехоламинов, диастолическая и систолическая застойная сердечная недостаточность (CHF), периферические сосудистые заболевания, диабетическая нефропатия, цирроз с отеком и асцитом, эзофагеальный варикоз, мышечная слабость, повышенная пигментация меланина кожи, потеря массы, гипотензия, гипогликемия, синдром Кушинга, ожирение, нетолерантность к глюкозе, гипергликемия, сахарный диабет, остеопороз, полиурия,полидипсия, воспаление, аутоиммунные расстройства, отторжение тканей, ассоциированное с органным трансплантатом, злокачественности, такие как лейкозы и лимфомы, ревматическая лихорадка, гранулематозный полиартериит, ингибирование миелоидных клеточных линий, иммунная пролиферация/апоптоз, супрессия и регуляция HPA-оси, гиперкортизолемия, модулирование баланса цитокиновTh1/Th2, хроническое почечное заболевание, гиперкальциемия, острая надпочечниковая недостаточность, хроническая первичная надпочечниковая недостаточность, вторичная надпочечниковая недостаточность, врожденная надпочечниковая гиперплазия, синдром Литла, системное воспаление, воспалительное заболевание кишечника, гранулематоз Вегенера, гигантоклеточный артрит, остеоартрит, ангионевротический отек, тендинит, бурсит, аутоиммунный хронический активный гепатит, гепатит, цирроз печени, панникулит, воспаление кист, гангренозная пиодермия, эозинофильный фасцит, рецидивирующий полихондрит, саркоидозная болезнь Свита, реактивная лепра типа 1, капиллярная гемангиома, плоский лишай, узловатая эритема, акне, гирсутизм, токсический эпидермический некролиз, мультиформная эритема, психозы, когнитивные расстройства (такие как расстройства памяти), расстройства настроения(такие как депрессия и биполярное расстройство), тревожные расстройства и расстройства личности. Используемый здесь термин "застойная сердечная недостаточность" (CHF) или "застойное сердечное заболевание" относится к болезненному состоянию сердечно-сосудистой системы, при котором сердце не способно эффективно нагнетать адекватный объем крови, чтобы удовлетворить потребности тканевых и органных систем. Обычно CHF характеризуется недостаточностью левого желудочка (систолическая дисфункция) и накоплением жидкости в легких, причиной которых считается одно или более чем одно сердечное или сердечно-сосудистое болезненное состояние, включая коронарную артериальную болезнь, инфаркт миокарда, гипертензию, диабет, болезнь сердечного клапана и кардиомиопатию. Термин "диастолическая застойная сердечная недостаточность" относится и состоянию CHF, которое характеризуется ухудшением способности сердца должным образом расслабляться и наполняться кровью. Напротив, термин "систолическая застойная сердечная недостаточность" относится к состояниюCHF, которое характеризуется ухудшением способности сердца должным образом сокращаться и выталкивать кровь. Специалистам в данной области должно быть понятно, что физиологические расстройства могут присутствовать как "хроническое" состояние или "острый" эпизод. Используемый здесь термин "хронический" означает состояние медленного прогрессирования и длительной продолжительности. Как таковое, хроническое состояние лечат, когда оно диагностировано, и лечение продолжают на всем протяжении протекания заболевания. Напротив, термин "острый" означает обостренный эпизод или приступ,короткий, сменяющийся периодом ремиссии. Таким образом, лечение физиологических расстройств предусматривает как острые эпизоды, так и хронические состояния. При остром эпизоде соединение вводят при появлении симптомов и прекращают, когда симптомы исчезают. В настоящем изобретении раскрыты соединения формулы (I) или их фармацевтически приемлемые соли для применения в терапии (такой как терапия, описанная выше). Также в настоящем изобретении раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для использования в лечении болезненного состояния, опосредованного глюкокортикоидным рецептором (такого как болезненное состояние, описанное выше).-8 016895 Также в изобретении раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для использования в лечении воспалительного состояния (например, артритического). Также в изобретении раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для использования в лечении астмы. Также в изобретении раскрыто применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для использования в лечении COPD. Также в настоящем изобретени раскрыты соединения формулы (I) или их фармацевтически приемлемые соли для применения в лечении воспалительных состояний, астмы и/или COPD. Кроме того, в настоящем изобретении раскрыт способ лечения болезненного состояния, опосредованного глюкокортикоидным рецептором (такого как болезненное состояние, описанное выше), воспалительного состояния, астмы и/или COPD, у млекопитающего (например, человека), включающий введение млекопитающему, нуждающемуся в таком лечении, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В контексте настоящего описания изобретения термины "терапия" и "лечение" также охватывают профилактику и предупреждение, если нет никаких конкретных иных указаний. Термины "терапевтический" и "терапевтически" следует толковать соответственно. В данном описании изобретения, если не указано иное, термины "ингибитор" и "антагонист" означают соединение, которое любым способом частично или полностью блокирует путь трансдукции, приводящий к продуцированию ответной реакции агонистом. Агонист может быть полным или частичным агонистом. Термин "расстройство", если не указано иное, означает любое состояние и заболевание, ассоциированное с активностью глюкокортикоидного рецептора. Фармацевтическая композиция. Для того чтобы использовать соединение формулы (I) или его фармацевтически приемлемую соль для терапевтического лечения млекопитающего, указанный активный ингредиент обычно готовят в соответствии со стандартной фармацевтической практикой в виде фармацевтической композиции. Поэтому в другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль (активный ингредиент) и фармацевтически приемлемый адъювант, разбавитель или носитель. В настоящем изобретении раскрыто применение фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, для лечения болезненного состояния,опосредованного глюкокортикоидным рецептором (такого как болезненное состояние, описанное выше),воспалительного состояния, астмы и/или COPD. Также в настоящем изобретении раскрыт способ приготовления указанной композиции, включающий смешивание активного ингредиента с фармацевтически приемлемым адъювантом, разбавителем или носителем. В зависимости от способа введения фармацевтическая композиция может содержать от 0,05 до 99 мас.%, например от 0,05 до 80 мас.%, предпочтительно от 0,10 до 70 мас.% (например, от 0,10 до 50 мас.%) активного ингредиента (все массовые проценты рассчитаны от общей массы композиции). Фармацевтическую композицию по настоящему изобретению можно водить стандартным способом для болезненного состояния, которое требуется лечить, например, местным (например, в легкое и/или дыхательные пути или на кожу), пероральным, ректальным или парентеральным введением. Таким образом, соединение формулы (I) или его фармацевтически приемлемая соль могут быть приготовлены в форме, например, аэрозоля, порошка (например, сухого или диспергируемого), таблетки, капсулы, сиропа, гранулы, водного(ой) или масляного(ой) раствора или суспензии, (липидной) эмульсии, суппозитория, мази, крема, капель или стерильного инъецируемого водного или масляного раствора или суспензии. Подходящей фармацевтической композицией по изобретению является композиция, пригодная для перорального введения в стандартной лекарственной форме, например в форме таблетки или капсулы,содержащей от 0,1 мг до 10 г активного ингредиента. В другом аспекте фармацевтическая композиция по изобретению представляет собой композицию,пригодную для внутривенной, подкожной, внутрисуставной или внутримышечной инъекции. В одном воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят перорально. В другом воплощении соединения формулы (I) или их фармацевтически приемлемые соли вводят ингаляцией. Буферы, фармацевтически приемлемые сорастворители, такие как полиэтиленгликоль, полипропиленгликоль, глицерин или этанол, или комплексообразующие агенты, такие как гидроксипропил-циклодекстрин, могут быть использованы для способствования приготовления препарата.-9 016895 Вышеуказанные препараты могут быть приготовлены по стандартным методикам, общеизвестным в фармацевтической области. Таблетки могут быть покрыты энтеросолюбильной оболочкой общепринятыми способами, например нанесением покрытия из ацетата-фталата целлюлозы. Данное изобретение также относится к комбинированным терапиям или композициям, где соединение формулы (I) или его фармацевтически приемлемую соль или фармацевтическую композицию, содержащую соединение формулы (I) или его фармацевтически приемлемую соль, вводят одновременно(возможно в одной и той же композиции) или последовательно с одним или более агентами для лечения любого из вышеуказанных болезненных состояний. Например, для лечения ревматоидного артрита, остеоартрита, COPD, астмы или аллергического ринита соединения формулы (I) или их фармацевтически приемлемые соли могут быть объединены с одним или более агентами для лечения такого состояния. В случае когда такая комбинация предназначена для введения ингаляцией, тогда один или более агентов выбраны из списка, включающего ингибитор PDE4, в том числе ингибитор изоформы PDE4D; селективный агонист 2-адренорецептора, такой метапротеренол, изопротеренол, изопреналин, альбутерол, сальбутамол, формотерол, сальметерол, тербуталин, орципреналин, битолтерола мезилат, пирбутерол или индакатерол; антагонист мускаринового рецептора (например, антагонист M1, M2 или M3, такой как избирательный антагонист M3), такой как ипратропия бромид, тиотропия бромид, окситропия бромид, пирензепин или телензепин; стероид (такой как будесонид); модулятор функционирования хемокиновых рецепторов (например, антагонист рецептора CCR1); ингибитор функционирования киназы p38; ингибитор матриксных металлопротеиназ, наиболее предпочтительно направлено воздействующий на ММР-2, -9 или ММР-12; или ингибитор нейтрофильных сериновых протеаз, наиболее предпочтительно нейтрофильной эластазы или протеиназы 3. В другом воплощении изобретения, если такая комбинация предназначена для лечения COPD, астмы или аллергического ринита, то соединения формулы (I) или их фармацевтически приемлемые соли можно вводить ингаляцией или пероральным путем, и другой агент, например ксантин (такой как аминофиллин или теофиллин), можно вводить ингаляцией или пероральным путем. Соединения формулы (I) или их фармацевтически приемлемые соли и другой агент, например ксантин, можно вводить вместе. Их можно вводить последовательно или их можно вводить по отдельности. Примеры Приведенные ниже примеры иллюстрируют изобретение. В примерах использованы следующие сокращения:DMSO - диметилсульфоксид; ХИАД-МС - масс-спектрометрия с химической ионизацией при атмосферном давлении;HATU - O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат; к.т. - комнатная температура, которая представляет собой температуру от 16 до 25C. Общие способы. ЯМР-спектры регистрировали на приборе Varian Mercury-VX 300 МГц или на приборе Varian Inova 400 МГц. Центральные пики хлороформа-d (H 7,27 м.д. (миллионные доли, ацетона (H 2,05 м.д.), дихлорметана-d2 (H 5,32 м.д.) или DMSO-d6 (H 2,50 м.д.) использовали в качестве внутренних стандартов. Альтернативно, ЯМР-спектры регистрировали на приборе Varian Inova Unity 500 МГц. 1H-ЯМРэксперименты выполняли с использованием подавления двойного пика остаточного растворителя и H2O. Для ЖХ/МС-анализа использовали следующий метод: прибор Agilent 1100; колонка Waters Symmetry 2,130 мм; ХИАД-МС; скорость потока 0,7 мл/мин; длина волны 254 нм. Растворитель А: вода + 0,1% TFA. Растворитель Б: ацетонитрил + 0,1% TFA; градиент 15-95%/Б 2,7 мин, 95% Б 0,3 мин. Для ГХ-МС-анализа использовали следующий метод. Масс-спектры низкого разрешения и точную массу регистрировали на системе Hewlett-PackardGC/MS, оснащенной камерой электрораспылительной ионизации (ЭРИ), 70 эв.- 10016895 Для ЖХ-анализа использовали следующий метод. Метод А: прибор Agilent 1100; колонка: Kromasil C18 1003 мм, размер частиц 5 мкм. Растворитель А: 0,1%TFA/вода. Растворитель Б: 0,08% TFA/ацетонитрил; скорость потока: 1 мл/мин; градиент 10-100%/Б 20 мин, 100% Б 1 мин. Поглощение измеряли при 220, 254 и 280 нм. Колонку Kromasil KR-100-5-C18 (25020 мм, Akzo Nobel) и смесь ацетонитрил/вода (0,1% TFA) при скорости потока 10 мл/мин использовали для препаративный ВЭЖХ. Если не указано иное, исходные вещества коммерчески доступны. Все растворители и коммерческие реагенты были химически чистыми и их использовали, как только они были получены. Пример 1. К перемешиваемому раствору (1S,2R)-1-[1-(4-фторфенил)-1H-индазол-5-ил]окси-1-фенилпропан 2-амина (18 мг, 50 мкмоль) в дихлорметане (2 мл) добавляли триэтиламин (100 мкл), затем добавляли циклопропанкарбонилхлорид (15 мг, 150 мкмоль). Перемешивание продолжали в течение 20 мин при к.т., затем растворитель удаляли при пониженном давлении и продукт очищали полупрепаративной ВЭЖХ. Выход 20 мг (95%). ХИАД-МС: m/z 430 [MH+]. 1 Указанное в заголовке соединение получали способом, описанным в JobBuchwald: Org. Lett. 2002, 4 (21), 3703-3706. 1-(Фторфенил)-5-йодиндазол (43 мг, 0,12 ммоль), (1R,2S)-норэфедрин (16 мг, 0,1 ммоль), йодид меди(I) (2,2 мг, 5 мол.%) и карбонат цезия (84 мг, 0,26 ммоль) суспендировали в бутиронитриле (1 мл). Реакционный сосуд закрывали и смесь перемешивали при 125C. Протекание реакции отслеживали по результатам ВЭЖХ (R.P. C-18, градиент 20-90% CH3CN в воде, 0,1% TFA). Через 7,5 ч добавляли дополнительное количество (1R,2S)-норэфедрина (70 мг), йодида меди(I) (16 мг) и карбоната цезия (136 мг) и перемешивание продолжали при 125C. Через 2 ч весь 1-(фторфенил)-5-йодиндазол был израсходован и смесь охлаждали, фильтровали и упаривали. Флэш-хроматография (SiO2), градиент 0-30% MeOH в К перемешиваемому раствору (1S,2R)-1-[1-(4-фторфенил)-1H-индазол-5-ил]окси-1-фенилпропан 2-амина (18 мг, 50 мкмоль) в дихлорметане (2 мл) добавляли триэтиламин (100 мкл), затем добавляли 2 хлор-1,1-диметил-2-оксоэтилацетат (24 мг, 150 мкмоль). Перемешивание продолжали в течение 20 мин при к.т., затем растворитель удаляли при пониженном давлении и остаток растворяли в этаноле (1 мл). Добавляли водный раствор гидроксида натрия (1 M, 1 мл) и смесь перемешивали при 80C в течение 30 мин. Затем ее охлаждали до к.т., подкисляли TFA и концентрировали при пониженном давлении. Продукт очищали полупрепаративной ВЭЖХ. Выход 22 мг (96%). ХИАД-МС: m/z 448 [MH+]. 1 1-(Фторфенил)-5-йод-1H-индазол (338 мг, 1 ммоль), (1R,2S)-2-амино-1-(3-метоксифенил)пропан-1 ол (220 мг, 1,2 ммоль), йодид меди(I) (19 мг, 100 мкмоль, 10 мол.%) и карбонат цезия (764 мг, 2 ммоль) суспендировали в бутиронитриле (2 мл). Реакционный сосуд закрывали и смесь перемешивали при 125C в течение 5 ч. Затем смесь охлаждали, осадок извлекали фильтрованием и промывали этилацетатом (10 мл). Объединенные органические растворы концентрировали при пониженном давлении. Продукт выделяли флэш-хроматографией на силикагеле (градиент 0-30% MeOH в EtOAc) с получением указанного в подзаголовке соединения (148 мг, 38%). ХИАД-МС: m/z 392 [MH+]. 1 К перемешиваемому раствору трет-бутил-[(1S,2R)-2-гидрокси-2-(3-метоксифенил)-1 метилэтил]карбамата (317 мг, 1,13 ммоль) в дихлорметане (3 мл) добавляли воду (3 мл) и TFA (5 мл) с получением прозрачного раствора. Эту смесь перемешивали при к.т. в течение 1 ч, затем вливали в воду(30 мл). Водный слой промывали дихлорметаном (30 мл) и делали щелочным (рН приблизительно 10) добавлением 10 н. водного раствора NaOH. Добавляли рассол (20 мл) и раствор экстрагировали дихлорметаном (330 мл). Экстракты сушили Na2SO4 и растворитель удаляли при пониженном давлении с получением указанного в подзаголовке соединения в виде бесцветного масла. Выход 179 мг (88%). ХИАД-МС: m/z 182 [MH+]. 1 Это соединение синтезировали способом, описанным в J. Yin et al., J. Org. Chem., 71, 840-843(2006). Смесь трет-бутил-[(1S)-2-(3-метоксифенил)-1-метил-2-оксоэтил]карбамата (13,6 г, 48,7 ммоль),изопропоксида алюминия (1,99 г, 9,70 ммоль), 2-пропанола (41 мл, 535 ммоль) в толуоле (63 мл) перемешивали в атмосфере аргона при 50C в течение ночи. ЖХ/МС показала полное превращение в спирт. Смесь распределяли между этилацетатом (200 мл) и соляной кислотой (1 М, 200 мл). Органическую фазу промывали водой (200 мл), сушили над сульфатом магния и концентрировали с получением указанного в подзаголовке соединения в виде сиропа (13,5 г). Соединение использовали на следующей стадии без дополнительной очистки. 1(777 мг, 3,3 ммоль) в сухом THF (50 мл) добавляли раствор бром(3-метоксифенил)магния (1 М в THF,10 мл, 10 ммоль). Эту смесь перемешивали при к.т. в течение 5 ч, затем гасили насыщенным водным раствором NH4Cl (50 мл). После перемешивания в течение 30 мин слои разделяли и водный слой экстрагировали этилацетатом (50 мл). Объединенные органические слои сушили с использованием Na2SO4 и растворитель удаляли в вакууме. Указанное в подзаголовке соединение выделяли флэш-хроматографией на силикагеле (н-гептан/этилацетат, градиент с 20 до 50% этилацетата). Выход 471 мг (94%). 1 К перемешиваемому раствору трет-бутил-[(1S,2R)-2-(4-этилфенил)-2-гидрокси-1-метилэтил]карбамата (450 мг, 1,51 ммоль) в ацетонитриле (10 мл) добавляли водный раствор HCl (6 н., 3 мл) и перемешивание продолжали в течение 3,5 ч. Затем смесь разбавляли водой (10 мл) и ацетонитрил удаляли в вакууме. Смесь промывали дихлорметаном (20 мл). Водный слой затем делали щелочным (pH приблизительно 10) добавлением водного раствора NaOH (10 н.) и экстрагировали дихлорметаном (320 мл). Объединенные органические экстракты сушили с использованием Na2SO4, растворитель удаляли в вакууме с получением белого твердого вещества, 280 мг (97%). ХИАД-МС: m/z 180 [MH+]. 1(81 мг, 0,4 ммоль), 2-пропанола (1,32 г, 22 ммоль) и толуола (2,6 мл, 1,3 мл/ммоль) нагревали в закупоренной пробирке при 50C в течение ночи. Затем реакционную смесь охлаждали при комнатной температуре, гасили водным раствором HCl (1 н., 10 мл) и разбавляли этилацетатом (10 мл). Слои разделяли и- 15016895 органический слой промывали водой (80 мл), сушили с использованием Na2SO4 и концентрировали. Растирание с н-гептаном (30 мл) дало указанное в подзаголовке соединение в виде бесцветного осадка(137 мг). н-Гептановый раствор концентрировали при пониженном давлении и остаток очищали флэшхроматографией на силикагеле с получением второй порции указанного в подзаголовке соединенияH-ЯМР (400 МГц, CDCl3):7,26 (d, J=8,1 Гц, 2 Н, частично скрыт сигналом растворителя), 7,19 (d,J=8,1 Гц, 2H), 4,83 (d, J=2,7 Гц, 1H), 4,62 (br.s, 1H), 4,01 (br.s, 1H), 2,65 (q, J=7,5 Гц, 2H), 1,47 (s, 9H), 1,24 К перемешиваемой суспензии стружек магния (243 мг, 10 ммоль) в сухом THF (10 мл) добавляли раствор 1-бром-4-этилбензола (1,85 г, 10 ммоль) в сухом THF (10 мл), затем добавляли небольшой кристаллик йода. Реакционную смесь нагревали с обратным холодильником в течение 4 ч, затем охлаждали до к.т. По каплям добавляли раствор N2-(трет-бутоксикарбонил)-N-метокси-N-метил-L-аланинамида(464 мг, 2 ммоль) в сухом THF (15 мл) и перемешивание продолжали в течение 5 ч при к.т. Затем реакционную смесь гасили насыщенным водным раствором NH4Cl (25 мл), перемешивали в течение 30 мин и слои разделяли. Водный слой экстрагировали этилацетатом (50 мл). Объединенные органические слои сушили с использованием Na2SO4 и растворитель удаляли при пониженном давлении с получением указанного в подзаголовке соединения в виде бесцветного масла, 718 мг, чистота 70% (по данным ЯМР). Полученное соединение использовали на следующей стадии без дополнительной очистки. 1 Метоксиацетилхлорид (10 мкл, 0,11 ммоль) добавляли к суспензии (1R,2S)-1-[1-(4-фторфенил)-1Hиндазол-5-ил]окси-1-[4-(метилтио)фенил]пропан-2-амина гидрохлорида (40 мг, 0,09 ммоль) и триэтиламина (42 мкл, 0,3 ммоль) в THF (1 мл). Эту реакционную смесь перемешивали при к.т. в течение 30 мин и затем гасили добавлением воды. Смесь разбавляли небольшим объемом MeCN с получением раствора. Эту сырую смесь очищали полупрепаративной ВЭЖХ с использованием колонки KromasilC18 25020 мм, 5 мкм. Скорость потока 10 мл/мин, градиент 20-90% MeCN в воде 20 мин, затем изократическая концентрация до тех пор, пока не элюировался продукт. Для детектирования использовали УФ= 254 нм. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 30 мг (69%). ХИАД-МС: m/z 480,1 [MH+]. 1(5 мл) и толуоле (2 мл). Реакционный сосуд закрывали и смесь перемешивали при 125C в течение 6 ч. Реакционную смесь охлаждали и распределяли между EtOAc и водой. Водную фазу экстрагировали один раз EtOAc. Объединенные органические фазы концентрировали и очищали полупрепаративной ВЭЖХ с использованием колонки Kromasil C18 25020 мм, 5 мкм. Скорость потока 10 мл/мин, градиент 20-90%MeCN в воде 20 мин. Для детектирования использовали УФ = 254 нм. Фракции с продуктом объединяли и растворители удаляли выпариванием. Это вещество дополнительно очищали путем растворения вEtOAc и нанесения его на короткую колонку с диоксидом кремния. Примеси вымывали, используяMeOH/EtOAc (полученный разбавлением 1 объема коммерчески доступного 7 н. NH3 в MeOH 19 объемами EtOAc). Растворители выпаривали и остаточное вещество выпаривали из MeOH несколько раз. Остаточное вязкое вещество растворяли в MeCN и добавляли 5-6 н. HCl в 2-пропаноле. Растворитель затем удаляли выпариванием с получением указанного в подзаголовке соединения в виде твердой соли бежевого цвета. Выход 300 мг (25%). ХИАД-МС: m/z 408,1 [MH+-HCl]. 1(1,24 г, 33 ммоль) и эту смесь перемешивали при комнатной температуре в течение 19 ч. Растворители удаляли выпариванием, добавляли воду (75 мл), смесь экстрагировали DCM (275 мл), органическую фазу сушили над Na2SO4, фильтровали и концентрировали. Остаточное масло растворяли в Et2O и добавляли 5-6 н. HCl в 2-пропаноле (10 мл). Выпавшую в осадок соль собирали и промывали эфиром. Получили гидрохлоридную соль, 1,46 г (выход 96%). ЯМР показала, что продукт представляет собой смесь двух возможных диастереомеров в соотношении 84:16. Основной диастереомер выделяли препаративной ВЭЖХ с использованием колонки XTerra Prep MS C18 OBD, 5 мкм, 1950 мм, градиент 10-30%MeCN в (вода + 2 мл NH3/л) 20 мин. Самые чистые фракции объединяли и лиофилизировали с получением указанного в подзаголовке соединения в виде бесцветного твердого вещества. Выход 595 мг (45%). ХИАД-МС: m/z 198,1 [MH+]. 1N-этилдиизопропиламина (120 мкл, 0,7 ммоль) в THF (2 мл). Эту реакционную смесь перемешивали при к.т. в течение 1 ч и добавляли еще одну порцию реагентов, N-этилдиизопропиламина (120 мкл,0,7 ммоль) и ацетоксиацетилхлорида (32 мкл, 0,3 ммоль). Еще через 15 мин реакцию гасили добавлением воды. Реакционную смесь концентрировали и очищали полупрепаративной ВЭЖХ с использованием колонки Kromasil C18 25020 мм, 5 мкм. Скорость потока 10 мл/мин, градиент 20-90% MeCN в воде 20 мин, затем изократическая конечная концентрация до тех пор, пока не элюировался продукт. Для детектирования использовали УФ = 254 нм. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 67 мг (60%). ХИАД-МС: m/z 508,1 [MH+]. 1(водн.) (1 мл). Этот раствор перемешивали при к.т. в течение 1 ч. MeOH удаляли выпариванием, остаточное вещество разбавляли водой и образовавшуюся суспензию лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 36 мг (89%). ХИАД-МС: m/z 465,9 [MH+]. 1(1 мл, 12,14 ммоль) и эту смесь перемешивали при 60C в течение 1,5 ч. Реакционную смесь лиофилизировали с получением сырого продукта в виде вязкого масла. Этот сырой продукт дополнительно очищали ВЭЖХ с использованием колонки XBridge Prep C18 5 мкм OBD 30150 мм [скорость потока = 20 мл/мин, градиент 10-60% MeCN в (H2O + 2 мл NH3/л) 30 мин, для детектирования использовали УФ = 220 нм]. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества.(128 мкл, 1,02 ммоль) и эту смесь перемешивали в течение 5 мин. Добавляли этилтрифторацетат(83 мкл, 0,7 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. Реакционную смесь упаривали и остаточное вещество очищали полупрепаративной ВЭЖХ с использованием колонки Kromasil C18 25020 мм, 5 мкм. Скорость потока 10 мл/мин, градиент 20-90% MeCN в воде 20 мин, затем изократическая конечная концентрация до тех пор, пока не элюировался продукт. Для детектирования использовали УФ = 254 нм. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 128 мг (74%). ХИАД-МС: m/z 504,1 [MH+] 1(1R,2S)-2-Амино-1-[4-(этилтио)фенил]пропан-1-ол (526 мг, 2,49 ммоль), 1-(фторфенил)-5 йодиндазол (676 мг, 2 ммоль), CuI (24 мг, 0,13 ммоль) и Cs2CO3 (1,6 г, 5 ммоль) суспендировали в бутиронитриле (5 мл) и толуоле (0,5 мл). Реакционный сосуд закупоривали и смесь перемешивали при 125C в течение 6 ч. Реакционную смесь охлаждали и распределяли между EtOAc и водой. Водную фазу экстрагировали один раз EtOAc. Органическую фазу фильтровали через короткую колонку с диоксидом кремния и примеси вымывали EtOAc. Сырой промежуточный продукт элюировали с использованием смеси 0,35 н. NH3 5% MeOH/EtOAc (полученной разбавлением 1 объема коммерчески доступного 7 н. NH3 в MeOH 19 объемами EtOAc). Растворители удаляли выпариванием с получением 515 мг сырого промежуточного амина, (1R,2S)-1-[1-(4-фторфенил)-1H-индазол-5-ил]окси-1-[4(этилтио)фенил]пропан-2-амина. ХИАД-МС: m/z 422,1 [MH+], основная примесь представляет собой непрореагировавший (1R,2S)-2 амино-1-[4-(этилтио)фенил]пропан-1-ол. Сырой амин растворяли в MeOH (15 мл) и обрабатывали избытком 1,1,3,3-тетраметилгуанидина(629 мкл, 5 ммоль) и этилтрифторацетата (595 мкл, 5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, концентрировали и очищали ВЭЖХ с использованием колонкиKromasil 100-10-C18 25050 мм. Скорость потока 40 мл/мин, градиент 50-90% MeCN в воде 10 мин,затем изократическая конечная концентрация в течение 30 мин, пока не элюировался продукт. Для детектирования использовали УФ = 254 нм. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 380 мг (36%). ХИАД-МС: m/z 518,1 [MH+].(0,67 г, 17,7 ммоль) и эту смесь перемешивали при комнатной температуре в течение 19 ч. Растворители удаляли выпариванием и остаточное вещество суспендировали в воде (50 мл) и экстрагировали DCM(250 мл). Органическую фазу сушили над Na2SO4, фильтровали и концентрировали, остаточное масло растворяли в Et2O. Добавление 5-6 н. HCl в 2-пропаноле привело к выпадению в осадок гидрохлоридной соли. Эту соль собирали фильтрацией, промывали диэтиловым эфиром и сушили до постоянной массы. Получили 845 мг (97%) указанного в подзаголовке соединения в форме гидрохлоридной соли и в виде смеси 85:15 двух возможных диастереомеров. Основной диастереомер выделяли препаративной ВЭЖХ с использованием колонки XTerra PrepMS C18 OBD, 5 мкм, 1950 мм. Градиент 10-30% MeCN в смеси (вода + 2 мл NH3/л) 20 мин. Самые чистые фракции объединяли и лиофилизировали с получением указанного в подзаголовке соединения в виде бесцветного твердого вещества. Выход 526 мг (71%). ХИАД-МС: m/z 212,1 [MH+]. 1(62 мг, 0,14 ммоль) растворяли в MeOH (2 мл) и добавляли 1,1,3,3-тетраметилгуанидин (100 мкл,0,8 ммоль) и этилтрифторацетат (83 мкл, 0,7 ммоль). Эту смесь перемешивали при комнатной температуре в течение 2 ч, растворители удаляли выпариванием и остаточное вещество обрабатывали водой и несколькими каплями разбавленной HCl (водн.) до слегка кислотной реакции. Образовавшуюся суспензию экстрагировали DCM и EtOAc, органические фазы объединяли, концентрировали и очищали полупрепаративной ВЭЖХ с использованием колонки Kromasil C18 25020 мм, 5 мкм. Скорость потока 10 мл/мин, градиент 50-90% MeCN в воде 15 мин, затем изократическая конечная концентрация, пока не элюировался продукт. Для детектирования использовали УФ = 254 нм. Фракции, содержащие продукт,объединяли и лиофилизировали с получением указанного в заголовке соединения в виде бесцветного твердого вещества. Выход 59 мг (79%). ХИАД-МС: m/z 530,1 [MH+]. 1(1R,2S)-2-Амино-1-[4-(циклопропилтио)фенил]пропан-1-ол (103 мг, 0,46 ммоль), 1-(фторфенил)-5 йодиндазол (170 мг, 0,5 ммоль), CuI (5 мг, 0,03 ммоль) и Cs2CO3 (325 мг, 1 ммоль) суспендировали в бутиронитриле (1 мл) и толуоле (0,5 мл). Реакционный сосуд закупоривали и смесь перемешивали при 125C в течение 18 ч. Реакционную смесь охлаждали, разбавляли EtOAc (5 мл) и промывали водой(21 мл). Органическую фазу фильтровали через короткую колонку с диоксидом кремния, примеси вы- 20016895 мывали EtOAc и сырой продукт элюировали с использованием смеси 0,35 н. NH3 5% MeOH/EtOAc(полученной разбавлением 1 объема коммерчески доступного 7 н. NH3 в MeOH 19 объемами EtOAc). Растворители удаляли выпариванием и вещество дополнительно очищали препаративной ВЭЖХ с использованием колонки XTerra Prep MS C18 OBD, 5 мкм, 1950 мм. Градиент 20-80% MeCN в смеси (вода+ 2 мл NH3/л) 15 мин. Фракции, содержащие продукт, объединяли и лиофилизировали с получением указанного в подзаголовке соединения в виде гигроскопического твердого вещества. Выход 62 мг (31%). ХИАД-МС: m/z 434,1 [MH+]. 1 Указанное в подзаголовке соединение получали в две стадии, следуя методике, описанной в М. Osorio-Olivares et al. Tetrahedron: Asymmetry. 14 (2003), 1473-1477 и M. Osorio-Olivares et al. Bioorg.Med. Chem. 12 (2004). 4055-4066. К перемешиваемому раствору N-(трифторацетил)-L-аланилхлорида (6,5 г, 32 ммоль) и циклопропилфенилсульфида (5 г, 33,28 ммоль) в DCM (30 мл) добавляли AlCl3 (4,27 г, 32 ммоль). Эту реакционную смесь перемешивали при комнатной температуре в течение 17 ч, охлаждали в бане лед-вода и гасили, медленно добавляя 1 н. HCl (водн.) (50 мл). Смесь экстрагировали DCM (250 мл), органическую фазу сушили над MgSO4, фильтровали и упаривали с получением сырого продукта в виде масла. Добавления гептана было недостаточно для получения твердого вещества. Масло растворяли в DCM и фильтровали через короткую силикагелевую колонку для удаления примесей. Сырой продукт содержал следы целевого (S)-2-трифторацетамидо-1-(4-циклопропилтиофенил)-1-пропанона, ГХ/МС, m/z = 317. Это сырое вещество растворяли в 99,5% EtOH (100 мл), добавляли NaBH4 (1,95 г, 51,5 ммоль), смесь перемешивали при к.т. в течение 19 ч. ЖХ/МС-анализ показал следы целевого продукта, ХИАД-МС: m/z 224 [MH+]. Растворители удаляли выпариванием, добавляли воду (100 мл) и образовавшуюся суспензию экстрагировали DCM. Органическую фазу концентрировали и остаток очищали препаративной ВЭЖХ с использованием колонки XTerra Prep MS C18 OBD, 5 мкм, 1950 мм. Градиент 10-40% MeCN в смеси (вода + 2 мл NH3/л) 20 мин. Фракции, содержащие продукт, объединяли и очистку повторяли более одного раза, как указано выше. Самые чистые фракции объединяли и лиофилизировали с получением указанного в подзаголовке соединения в виде бесцветного гигроскопического твердого вещества. Выход 103 мг (1,4%). ХИАД-МС: m/z 224,1 [MH+]. 1 Получен способом, описанным в примере 1, с использованием соответствующего исходного вещества. Получен способом, описанным в примере 1, с использованием соответствующего исходного вещества.(410 мл) и гидрировали с использованием реактора гидрирования H-Cube (нанотехнология THALES),оснащенного картриджем с 10% Pd/C. Устанавливали скорость потока 0,8 мл/мин, температуру 80C и высший уровень генерации водорода. После упаривания раствора диастереомеры разделяли препаративной ВЭЖХ (XTerrra C18, 1950 мм) с использованием градиента 5-30% ацетонитрила в воде (+1% NH3) с получением указанного в подзаголовке соединения 17b (448 мг, 24%). 1 В круглодонную колбу загружали безводный сульфат магния (4,77 г, 40 ммоль) и нитроэтан (15 мл). Колбу вакуумировали и заполняли аргоном. Реакционную смесь энергично перемешивали с получением гомогенной суспензии, затем добавляли 6-метоксиникотинальдегид (2,37 г, 18 ммоль в 5 мл нитроэтана). После перемешивания в течение 5 мин добавляли 2,5,8,9-тетрааза-1-фосфабицикло[3.3.3]ундекан,2,8,9 трис-(1-метилэтил) (1082 мг, 3,6 ммоль). Реакционную смесь перемешивали в течение ночи при к.т., затем очищали флэш-хроматографией (SiO2, гептан-этилацетат). Выход 2,22 г (58%). ХИАД-МС: m/z 213,1 [MH+]. Получен способом, описанным в примере 1, с использованием соответствующего исходного вещества. Рацемическую смесь N-[(1R,2S)-1-[1-(4-фторфенил)индазол-5-ил]окси-1-(6-метоксипиридин-3 ил)пропан-2-ил]циклопропанкарбоксамида (16) разделяли на колонке Thales SFC, Chiralpak IA (75% CO2,25% MeOH), собирая продукт, элюирующийся вторым. 1(300 мг, 0,56 ммоль) и триэтиламину (0,235 мл, 1,69 ммоль) в THF (6 мл) при к.т. Через 20 мин добавляли еще одну порцию триэтиламина (0,103 мл, 0,74 ммоль) и трифторуксусного ангидрида (0,050 мл,0,35 ммоль). Эту реакционную смесь перемешивали в течение еще 20 мин, концентрировали, разбавляли 10%-ным NaHSO4 (водн.) и экстрагировали EtOAc. Органическую фазу промывали 10%-ным NaHSO4(водн.). Сырой продукт дополнительно очищали методом ВЭЖХ. Выход 230 мг (79%). Выполняли хиральный анализ с использованием колонки Chiralpak IB, 1500,46 мм, 15%(246 мг, 1,00 ммоль), 1-(4-фторфенил)-5-йод-1H-индазола (406 мг, 1,20 ммоль), йодида меди(I) (38,1 мг,0,20 ммоль) и Cs2CO3 (979 мг, 3,00 ммоль) в бутиронитриле (3 мл) нагревали в течение 5 ч при 100C в герметично закрытой реакционной пробирке, заполненной аргоном. Реакционную смесь охлаждали, распределяли между DCM (20 мл) и водой (5 мл), добавляли рассол (5 мл). Водную фазу экстрагировали еще одной порцией DCM (20 мл). Объединенные DCM-фазы (40 мл) фильтровали через колонку с 10 г диоксида кремния с использованием EtOAc (40 мл) для промывки колонки. Сырой продукт вымывали из колонки, используя 0,35 М NH3 в 5% MeOH/EtOAc (150 мл). Растворители удаляли выпариванием. Сырой продукт дополнительно очищали методом ВЭЖХ. Фракции, содержащие продукт, подвергали сублимационной сушке с получением TFA-соли целевого продукта. ЯМР показал 4 мол.% второй серии сигналов, исходящих от диастереомера. Выход 125 мг (23%). ХИАД-МС: m/z 420,1 [MH+-TFA]. 1(40 мл) при 40C и перемешивали в течение 3 ч. Реакционной смеси давали возможность достичь комнатной температуры и концентрировали ее упариванием. Добавляли диэтиловый эфир и соль собирали фильтрованием и промывали диэтиловым эфиром. Было обнаружено, что соль является гигроскопичной. Выход 2,10 г (85%). ХИАД-МС: m/z 210 [MH+-HCl]. 1 Осуществляли диастереоселективное каталитическое восстановление Меервейна-Пондорфа-Верлея(22 мл) перемешивали при 50C в атмосфере аргона в течение 16 ч. Реакционную смесь вливали в 1 МHCl (150 мл) и эту смесь экстрагировали EtOAc (250 мл). Органическую фазу промывали водой(250 мл) и рассолом (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Сырой продукт очищали флэш-хроматографией на диоксиде кремния с использованием смеси EtOAc:тексан (1:2) в качестве элюента. Фракции, содержащие продукт, объединяли. Растворитель удаляли выпариванием с получением целевого продукта в виде бесцветного твердого вещества. Выход 3,19 г (84%). ХИАД-МС: m/z 236, 210, 192 [MH+-tBu-18, MH+-BOC, МН+-BOC-18]. Суспензию (S)-трет-бутил-1-(метокси(метил)амино)-1-оксопропан-2-илкарбамата (3 г, 12,92 ммоль) в THF (30 мл) помещали в защитную атмосферу аргона и охлаждали до температуры от -15 до -20C,добавляли изопропилмагнийхлорид, 2 М в THF (6,5 мл, 13,00 ммоль), поддерживая температуру ниже-10C. Суспензия начала растворяться, температуре давали возможность достичь 0C, добавляли свежеприготовленный раствор (2,3-дигидробензо[b][1,4]диоксин-6-ил)магнийбромида, 0,7 М в THF (20 мл,14,00 ммоль). Температуре давали возможность достичь комнатной температуры, реакционную смесь перемешивали в течение 17 ч. 1 н. HCl (300 мл) охлаждали на ледяной бане до 10C, реакционную смесь вливали в кислотный водный раствор, добавляли ТВМЕ (трет-бутилметиловый эфир) (300 мл) и эту смесь переносили в разделительную воронку. Водную фазу подвергали обратной экстракции ТВМЕ(200 мл). Эфирные фазы промывали водой, рассолом и сушили (Na2SO4). Сырой продукт очищали флэшхроматографией с использованием смеси ТВМЕ:гептан (1:2) в качестве элюента. Фракции, содержащие продукт, объединяли и растворители удаляли выпариванием с получением указанного в подзаголовке соединения в виде светло-желтого вязкого масла/смолы. Выход 3,76 г (95%). ХИАД-МС: m/z 208,1 [MH+-ВОС]. 1(50 мг, 0,11 ммоль), 1,1,3,3-тетраметилгуанидин (100 мкл, 0,79 ммоль) и этилтрифторацетат (200 мкл,1,68 ммоль) в MeOH (2,5 мл) перемешивали при к.т. в течение 1 ч. Реакционную смесь концентрировали упариванием. Остаточное вещество очищали методом ВЭЖХ. Выход 37 мг (65%). ХИАД-МС: m/z 508,1 [MH+]. 1 Указанное в подзаголовке соединение получали способом, аналогичным способу, описанному в примере 19 (стадия 19 а).(38,1 мг, 0,20 ммоль) в бутиронитриле (3 мл) нагревали в течение 19 ч при 125C в герметично закрытой реакционной пробирке, заполненной аргоном. После окончательной очистки методом ВЭЖХ полученное вещество выделили в виде коричневатой гидрохлоридной соли из трет-бутилметилового эфира/HCl. трет-Бутил-(1R,2S)-1-гидрокси-1-(нафталин-2-ил)пропан-2-илкарбамат (588 мг, 1,95 ммоль) растворяли в этилацетате (20 мл). В этот прозрачный раствор добавляли 1,5 н. HCl/EtOAc (10 мл, 15,00 ммоль) и эту реакционную смесь перемешивали при 40C в течение 2 ч. Полученной суспензии давали возможность охладиться до к.т., соль извлекали фильтрованием, промывали диэтиловым эфиром и сушили на воронке Бюхнера. Выход 588 мг (85%). ХИАД-МС: m/z 202 [MH+-HCl]. 1 Указанное в заголовке соединение получали способом, аналогичным способу, описанному в примере 19 (стадия 19 с), начиная с трет-бутил-[(1S)-1-метил-2-(2-нафтил)-2-оксоэтил]карбамата (350 мг,1,17 ммоль). Отличием было то, что реакционную смесь перемешивали при 50C в течение 19 ч, сырое вещество очищали флэш-хроматографией на диоксиде кремния с использованием градиента от 0 до 30% Указанное в подзаголовке соединение получали способом, аналогичным способу, описанному в примере 19 (стадия 19d ), начиная с (S)-трет-бутил-1-(метокси(метил)амино)-1-оксопропан-2 илкарбамата (1,86 г, 8 ммоль) и свежеприготовленного 1 М раствора 2-нафтилмагнийбромида в THF(8 мл, 8 ммоль). Полученное вещество подвергали кристаллизации из гептана. Выход 350 мг (14%). ХИАД-МС: m/z 200 [MH+-ВОС]. 1 Ацетоксиацетилхлорид (13 мкл, 0,12 ммоль) добавляли в перемешиваемую смесь (1R,2S)-1-(1-(4 фторфенил)-1H-индазол-5-илокси)-1-(нафталин-2-ил)пропан-2-амина гидрохлорида (20 а) (50 мг,- 26016895 0,11 ммоль) и N,N-диизопропилэтиламина (60 мкл, 0,34 ммоль) в THF (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Добавляли воду (0,5 мл), 28%-ный (водн.) NH3(0,5 мл) и MeOH (0,5 мл) с получением прозрачного однофазного раствора. Эту смесь перемешивали в течение ночи при к.т. Реакционную смесь концентрировали, остаточное вещество очищали методом ВЭЖХ. Выход 32 мг (61%). ХИАД-МС: m/z 470,1 [MH+]. 1(50 мг, 0,12 ммоль), 1,1,3,3-тетраметилгуанидин (100 мкл, 0,79 ммоль) и этилтрифторацетат (200 мкл,1,68 ммоль) в MeOH (2,5 мл) перемешивали при к.т. в течение 1 ч. Реакционную смесь концентрировали упариванием и остаточное вещество очищали методом ВЭЖХ. Выход 41 мг (72%). ХИАД-МС: m/z 486,1 [MH+]. 1 Указанное в подзаголовке соединение получали способом, аналогичным способу, описанному в примере 19 (стадия 19 а). Смесь (1R,2S)-2-амино-1-(3-этилфенил)пропан-1-ола гидрохлорида (22b, 216 мг,1,00 ммоль), 1-(4-фторфенил)-5-йод-1H-индазола (406 мг, 1,20 ммоль), карбоната цезия (979 мг,3,00 ммоль) и йодида меди(I) (38,1 мг, 0,20 ммоль) в бутиронитриле (3 мл) нагревали в течение 19 ч при 125C в герметично закрытой реакционной пробирке, заполненной аргоном. После окончательной очистки методом ВЭЖХ полученное вещество растворяли в трет-бутилметиловом эфире и осаждали в форме гидрохлоридной соли путем добавления 6-7 н. раствора HCl в 2-пропаноле. Выход 199 мг (46%). ХИАД-МС: m/z 390,1 [MH+-HCl]. 1 Указанное в подзаголовке соединение было получено в две стадии способом, аналогичным способу,описанному в примере 19 (стадии 19b+19c), начиная с (S)-трет-бутил-1-(3-этилфенил)-1-оксопропан-2 илкарбамата (22 с, 700 мг, 2,52 ммоль). Выход 425 мг (78%). ХИАД-МС: m/z 180 [MH+-HCl]. 1 Указанное в подзаголовке соединение было получено способом, аналогичным способу, описанному в примере 19 (стадия 19d), начиная с (S)-трет-бутил-1-(метокси(метил)амино)-1-оксопропан-2 илкарбамата (0,7 г, 3,01 ммоль) и свежеприготовленного 0,9 М раствора (3-этилфенил)магнийбромида в Указанное в заголовке соединение было получено способом, аналогичным способу, описанному в примере 21, начиная с (1R,2S)-1-(3-этилфенил)-1-(1-(4-фторфенил)-1H-индазол-5-илокси)пропан-2-амина гидрохлорида (22 а) (50 мг, 0,12 ммоль) и ацетоксиацетилхлорида (14 мкл, 0,13 ммоль). Выход 37 мг (70%). ХИАД-МС: m/z 448,1 [MH+]. 1(120 мг,0,25 ммоль) и триэтиламина (103 мкл, 0,74 ммоль) в THF (6 мл) при к.т. Через 20 мин добавляли еще одну порцию триэтиламина (103 мкл, 0,74 ммоль) и трифторуксусного ангидрида (42 мкл, 0,30 ммоль). Эту реакционную смесь перемешивали в течение еще 80 мин, концентрировали, разбавляли 10%-нымNaHSO4 (водн.) и экстрагировали EtOAc. Органическую фазу промывали еще одной порцией 10%-ногоNaHSO4 (водн.) и концентрировали. Сырой продукт дополнительно очищали препаративной ВЭЖХ. Выход 89 мг (77%). ХИАД-МС: m/z 472,1 [MH+]. 1 Указанное в подзаголовке соединение было получено способом, аналогичным способу, описанному в примере 19 а, начиная с (1R,2S)-2-амино-1-м-толилпропан-1-ола гидрохлорида (202 мг, 1,00 ммоль). Выход 125 мг (25%). ХИАД-МС: m/z 376,1 [MH+-TFA]. 1 трет-Бутил-(1R,2S)-1-гидрокси-1-м-толилпропан-2-илкарбамат (2,31 г, 8,71 ммоль) растворяли в этилацетате (30 мл), добавляли 1,5 М HCl в EtOAc (20 мл, 30,00 ммоль) и эту смесь перемешивали при 50C в течение 90 мин. Реакционной смеси давали возможность достичь комнатной температуры, одновременно перемешивая в течение 30 мин, и растворители удаляли выпариванием. Остаточное вещество обрабатывали EtOAc (5-10 мл), добавляли диэтиловый эфир (60-70 мл) и образовавшуюся суспензию перемешивали в течение 30 мин при к.т. Твердую HCl-соль собирали фильтрованием и промывали диэтиловым эфиром. Было обнаружено, что эта соль является гигроскопической и ее переносили в сушильный шкаф и сушили при пониженном давлении при 40C. Выход 1,68 г (95%). ХИАД-МС: m/z 166 [MH+-HCl]. 1 Указанное в подзаголовке соединение было получено в две стадии способом, аналогичным способу,описанному в примере 19 (стадии 19c+19d), начиная с (S)-трет-бутил-1-(метокси(метил)амино)-1 оксопропан-2-илкарбамата (2,323 г, 10 ммоль) и 1,0 М раствора м-толилмагнийбромида в THF (12,00 мл,12,00 ммоль). Выход 2,33 г (88%). ХИАД-МС: m/z 166,1 [MH+-ВОС]. 1(200 мкл, 1,68 ммоль) в MeOH (2,5 мл) перемешивали при к.т. в течение 1 ч. Реакционную смесь концентрировали упариванием и остаточное вещество очищали ВЭЖХ.
МПК / Метки
МПК: C07D 413/12, C07D 405/12, C07D 231/56, C07D 401/12, A61K 31/4709, A61K 31/416, C07D 403/12, A61P 17/06, A61P 37/00, C07D 417/12, A61P 29/00, A61P 11/06, C07D 409/12
Метки: глюкокортикоидными, амидов, лечения, рецепторами, расстройств, опосредованных, производные, индазолил-эфиров
Код ссылки
<a href="https://eas.patents.su/30-16895-proizvodnye-indazolil-efirov-ili-amidov-dlya-lecheniya-rasstrojjstv-oposredovannyh-glyukokortikoidnymi-receptorami.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индазолил-эфиров или -амидов для лечения расстройств, опосредованных глюкокортикоидными рецепторами</a>
Предыдущий патент: Способ производства чайных продуктов
Следующий патент: Новый способ получения кристаллической формы v агомелатина
Случайный патент: Галогенированные селективные модуляторы андрогеновых рецепторов и способы их применения












