Производные амидов 6,7-дигидро-5h-имидазо[1,2-a]имидазол-3-карбоновой кислоты
Номер патента: 19990
Опубликовано: 30.07.2014
Авторы: Ковальски Дженнифер А., Маккиббен Брайан, Хоуран Джошуа Кортни, Лолор Майкл Дейвид, Брунетт Стивен Ричард, Миллер Крейг Эндрью, Барбоса Антонио Дж.М., Лемьё Рене Марк
Формула / Реферат
1. Соединение формулы I
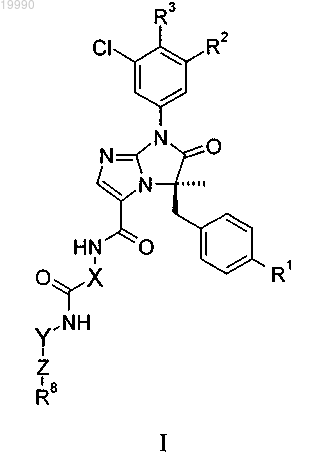
в которой R1 выбран из группы, включающей -CN, -OCF3, -CF3, галоген;
R2 обозначает -Cl или -CF3;
R3 обозначает Н или галоген;
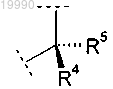
X обозначает группу
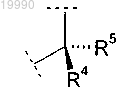
в которой R4 выбран из группы, включающей:
(A) -Н;
(B) C1-C3-алкил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:
b) -OR9;
h) гетероарил, необязательно замещенный C1-C3-алкилом;
R5 обозначает Н или C1-C3-алкил или
R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3-7 атомов углерода;
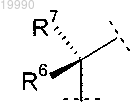
Y обозначает группу
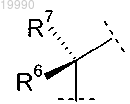
в которой R6 обозначает Н или C1-C3-алкил;
R7 обозначает Н или C1-C3-алкил или
R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3-7 атомов углерода;
Z обозначает гетероарил;
R8 выбран из группы, включающей:
(A) C6-C10-арил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:
(a) C1-C3-алкил, необязательно содержащий следующие заместители: -OR9, -NR9R10 или -NR9SO2R10;
(b) C3-C7-циклоалкил, необязательно содержащий заместитель -OR9;
(a) -OR9;
(с) галоген;
(d) -C(O)NR9R10;
(e) -SO2NR9R10;
(f) -NR9(CO)R10;
(g) -SO2R9;
(h) -NR9R10;
(i) -CN;
(j) -C(O)OR9;
(k) -NR9SO2R10;
(l) -C(O)R9;
(B) гетероарил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:
(a) C1-C3-алкил, необязательно содержащий следующие заместители: -OR9 или галоген;
(b) C3-C7-циклоалкил;
(a) -OR9;
(с) галоген;
(h) -NR9R10;
(i) -CN;
R9 выбран из группы, включающей Н или C1-C5-алкил;
R10 выбран из группы, включающей Н или C1-C5-алкил;
где "гетероарил" означает ароматическое 5-8-членное моноциклическое или 8-11-членное бициклическое кольцо, содержащее 1-4 гетероатома, выбранных из группы, включающей N, О и S;
или его фармацевтически приемлемая соль.
2. Соединение формулы I по п.1, в которой
R1 выбран из группы, включающей -CN, -OCF3, -Br, -Cl или -CF3;
R2 обозначает -Cl или -CF3;
R3 обозначает -F или Н;
X обозначает группу
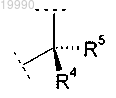
в которой R4 выбран из группы, включающей:
(A) C1-C2-алкил, необязательно замещенный группой -ОН;
(B) (1-метил-1Н-имидазол-5-ил)метил;
(C) (1-метил-1Н-имидазол-4-ил)метил;
R5 обозначает Н или -CH3 или
R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;
Y обозначает группу
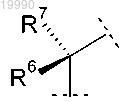
в которой R6 обозначает Н или -CH3;
R7 обозначает Н или -CH3 или
R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;
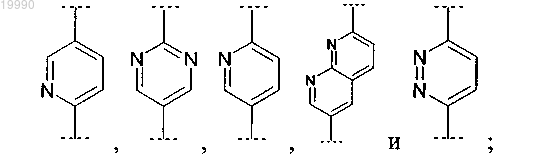
Z выбран из группы, включающей:
(A) пиридинил;
(B) пиримидинил;
(С) нафтиридинил;
(D) пиридазинил;
(E) оксадиазолил;
R8 выбран из группы, включающей:
(A) фенил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:
(a) -OR9;
(b) -CH2OR9;
(c) -С(О)ОН;
(d) -C(O)NR9R10;
(e) -SO2CH3;
(f) -NHSO2CH3;
(g) -SO2NR9R10;
(h) -F;
(i) -NHC(O)CH3;
(j) -CH2NHSO2CH3;
(k) -C(O)CH3;
(l) -Cl;
(m) -CN;
(n) -CH3;
(o) -CH2N(CH3)2;
(p) 1-гидроксициклопропил;
(B) пиридинил, необязательно моно- или дизамещенный группами -СН3, -СН2ОН, -NH2, -ОН, -Cl, -F, -CN,
-CF3 или циклопропилом;
(C) 1H-пиразолил, необязательно моно-, ди- или тризамещенный группой -СН3 или циклопропилом;
(D) пиримидинил, необязательно замещенный группой -CH3;
(E) изоксазолил, необязательно замещенный группой -CH3;
(F) имидазо[1,2-a]пиридинил, необязательно замещенный группой -CH3;
(G) 1H-пирроло[2,3-b]пиридинил;
(Н) тиазолил, необязательно моно- или дизамещенный группами -CH3 или -Cl;
(I) оксадиазолил, необязательно замещенный циклопропилом;
(J) фуранил;
(K) хинолинил;
(L) 1H-имидазолил, необязательно замещенный группой -CH3;
(М) 1H-триазолил;
(N) 1H-пирролил, необязательно замещенный группой -CH3;
(О) оксазолил;
(Р) 2-оксо-2Н-пиридин-1-ил;
(Q) 1H-индолил;
R9 обозначает Н или -CH3;
R10 обозначает Н или -CH3;
или его фармацевтически приемлемая соль.
3. Соединение формулы I по п.1, в которой
R1 выбран из группы, включающей -CN, -OCF3, -Br, -Cl или -CF3;
R2 обозначает -Cl или -CF3;
R3 обозначает -F или -Н;
X обозначает группу
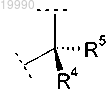
в которой R4 выбран из группы, включающей
(A) -СН3;
(B) -СН2ОН;
(С) -СН(ОН)СН3;
(D) (1-метил-1Н-имидазол-5-ил)метил;
(Е) (1-метил-1Н-имидазол-4-ил)метил;
R5 обозначает Н или -CH3 или
R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;
Y обозначает группу
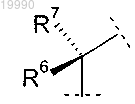
в которой R6 обозначает -CH3;
R7 обозначает Н или -CH3 или
R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;
Z выбран из группы, включающей
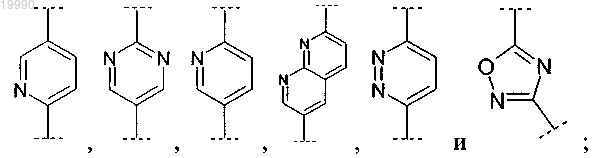
R8 выбран из группы, включающей:
(А) фенил, замещенный одной группой, выбранной из группы, включающей:
(a) -ОН;
(b) -CH2OR9;
(c) -С(О)ОН;
(d) -C(O)NR9R10;
(e) -SO2CH3;
(f) -NHSO2CH3;
(g) -SO2NH2;
(h) -F;
(i) -NHC(O)CH3;
(j) -CH2NHSO2CH3;
(k) -C(O)CH3;
(B) пиридинил, необязательно содержащий следующие заместители: -CH3, -СН2ОН, -NH2, -ОН, -Cl, -F; -CN или циклопропил;
(C) 1H-пиразол-4-ил, необязательно моно-, ди- или тризамещенный группой -CH3 или циклопропилом;
(D) пиримидин-5-ил, необязательно замещенный группой -CH3;
(E) изоксазол-4-ил, необязательно замещенный группой -CH3;
(F) 2-имидазо[1,2-а]пиридин-6-ил, необязательно замещенный группой -CH3;
(G) 1H-пирроло[2,3-b]пиридин-5-ил;
(Н) 1H-пиразол-3-ил;
(I) тиазол-5-ил, необязательно замещенный группой -CH3;
(J) тиазол-4-ил;
(K) 2-циклопропил-1,3,4-оксадиазол-5-ил;
(L) фуран-3-ил;
(М) хинолин-3-ил;
(N) 1H-имидазол-2-ил, необязательно замещенный группой -CH3;
(О) 1-метил-1H-имидазол-5-ил;
(Р) 1H-имидазолил;
(Q) 1H-1,2,4-триазолил;
R9 обозначает Н или -CH3;
R10 обозначает Н или -CH3;
или его фармацевтически приемлемая соль.
4. Соединение формулы I по п.1, в которой
R1 выбран из группы, включающей -CN, -OCF3 или -Br;
R2 обозначает -Cl или -CF3;
R3 обозначает -F или Н;
X обозначает группу
в которой R4 выбран из группы, включающей:
(A) -СН3;
(B) -СН2ОН;
(С) -СН(ОН)СН3;
R5 обозначает Н или
R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;
Y обозначает группу
в которой R6 обозначает -CH3;
R7 обозначает Н или
R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;
Z выбран из группы, включающей
R8 выбран из группы, включающей:
(A) фенил, замещенный одной группой, выбранной из группы, включающей:
(a) -ОН;
(b) -СН2ОН;
(c) -С(О)ОН;
(d) -C(O)NR9R10;
(e) -SO2CH3;
(f) -NHSO2CH3;
(g) -SO2NH2;
(B) пиридинил, необязательно содержащий следующие заместители: -CH3, -СН2ОН, -NH2, -ОН, -Cl, -F;
(C) 1H-пиразол-4-ил, необязательно моно-, ди- или тризамещенный группой -CH3 или циклопропилом;
(D) 2-метилпиримидин-5-ил;
(E) изоксазол-4-ил;
(F) имидазо[1,2-a]пиридин-6-ил;
(G) 1H-пирроло[2,3-b]пиридин-5-ил;
R9 обозначает Н или -CH3;
R10 обозначает Н или -CH3;
или его фармацевтически приемлемая соль.
5. Соединение формулы I по п.1, в которой
R1 выбран из группы, включающей -CN и -OCF3;
R2 обозначает -Cl;
R3 обозначает -F;
X обозначает группу
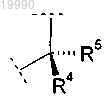
в которой R4 обозначает -СН3 или -СН(ОН)СН3;
R5 обозначает Н или
R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;
Y обозначает группу
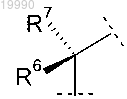
в которой R6 обозначает -CH3;
R7 обозначает Н или
R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;
Z выбран из группы, включающей
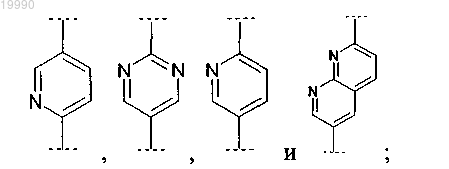
R8 выбран из группы, включающей:
(A) фенил, замещенный одной группой, выбранной из группы, включающей:
(a) -ОН и
(b) -СН2ОН;
(B) пиридин-3-ил, замещенный в положении 6 группой -CH3 или -CH2OH;
(C) 1H-пиразол-4-ил, необязательно моно- или дизамещенный группой -CH3;
или его фармацевтически приемлемая соль.
6. Соединение, выбранное из числа соединений, приведенных в представленной таблице
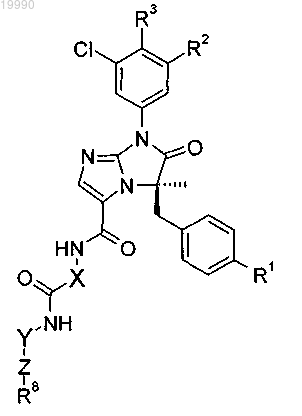
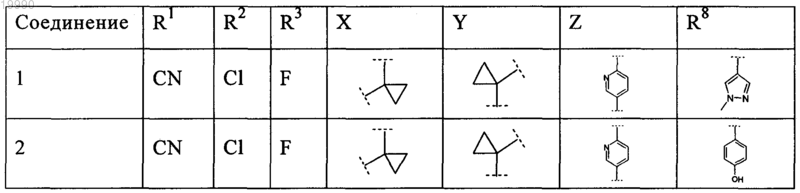
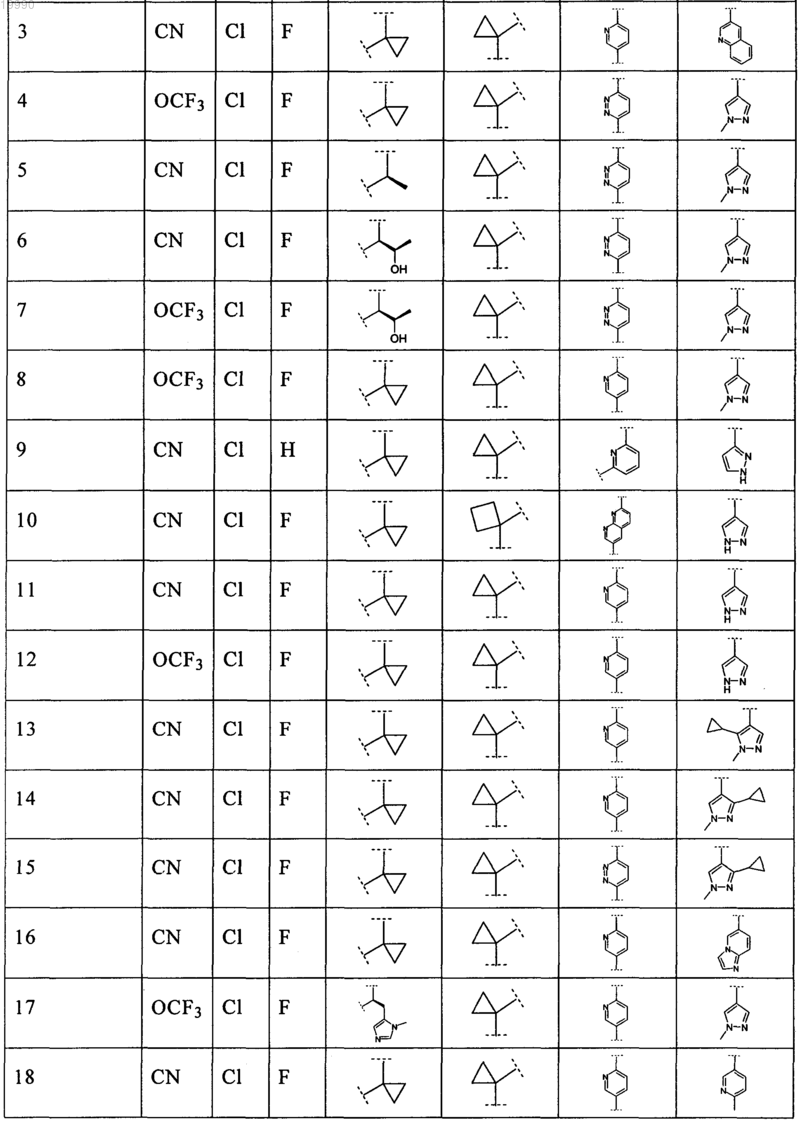

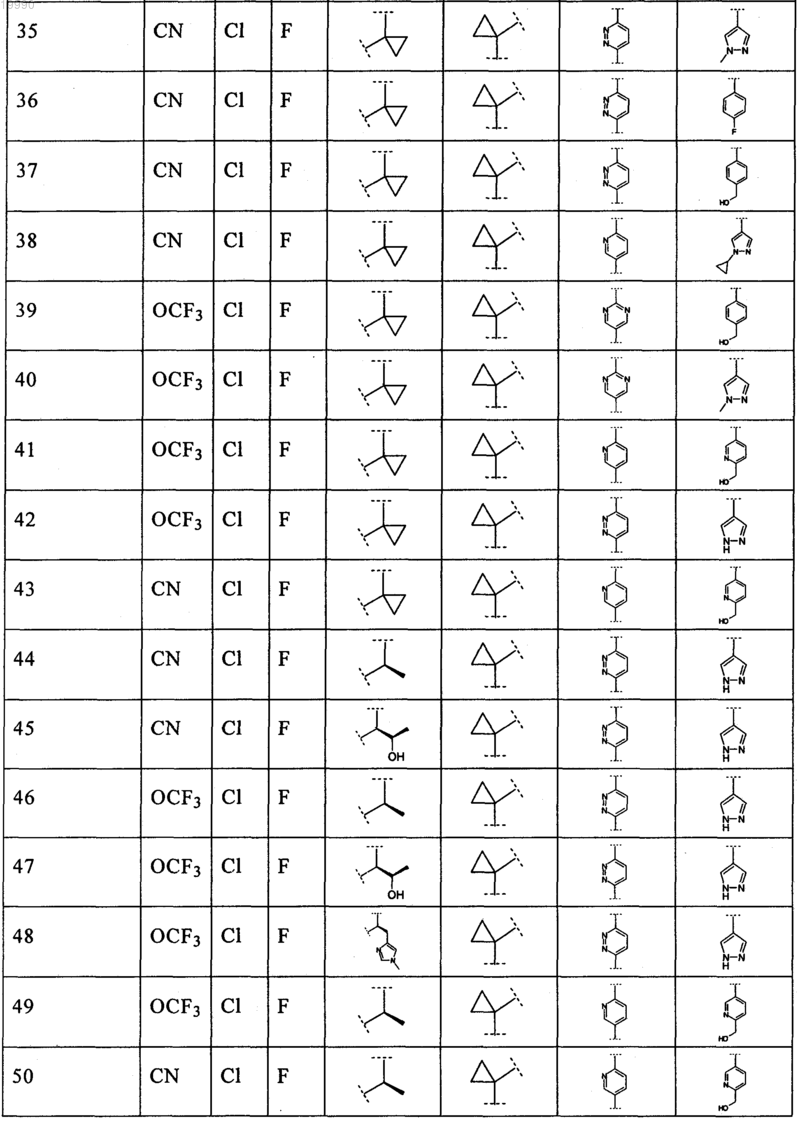
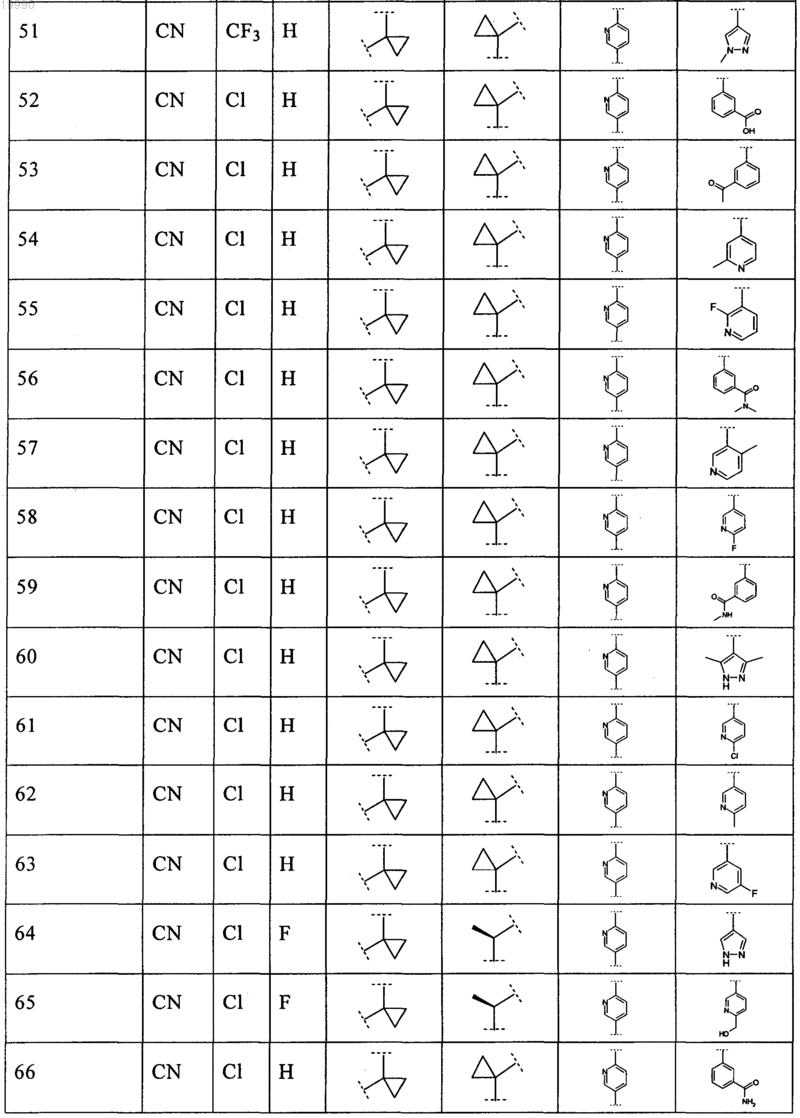
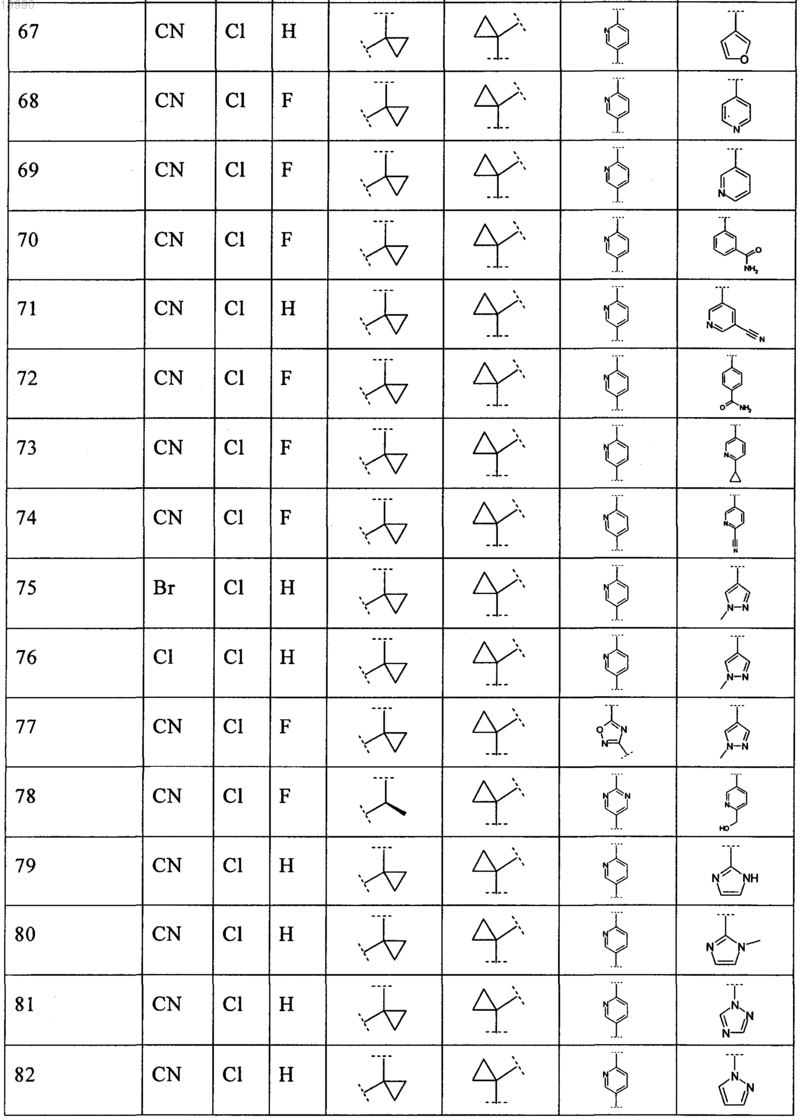

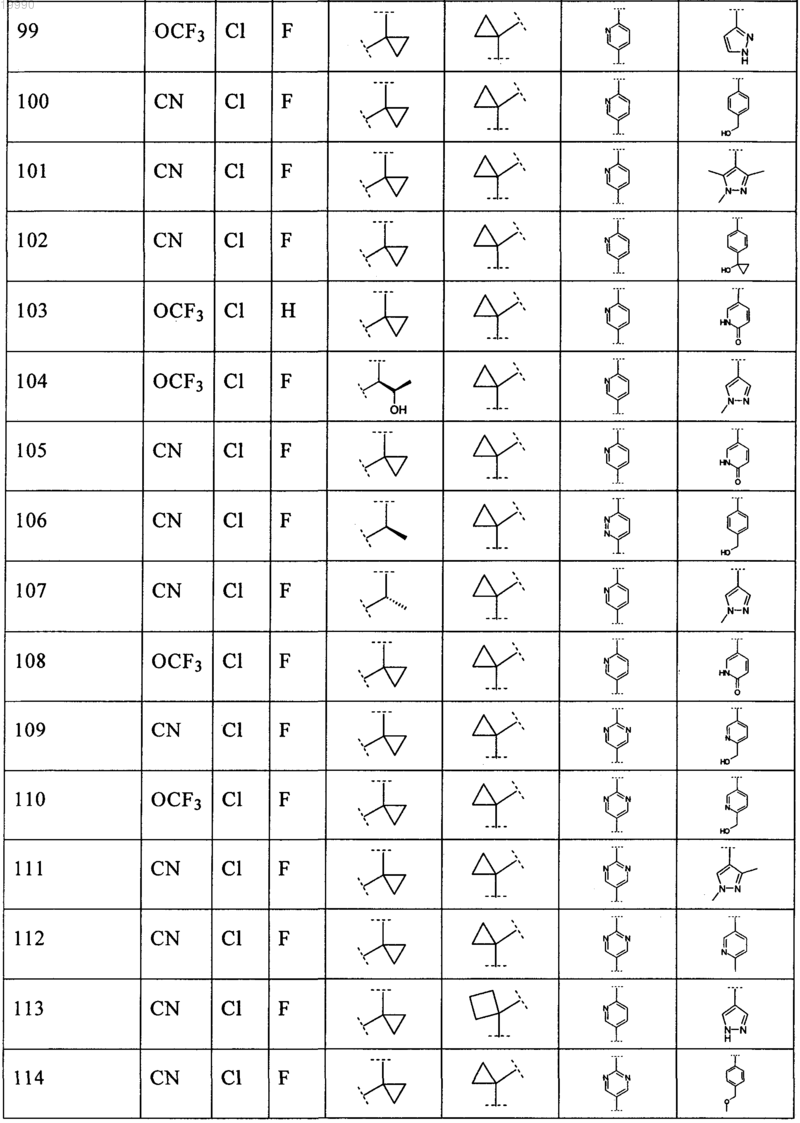
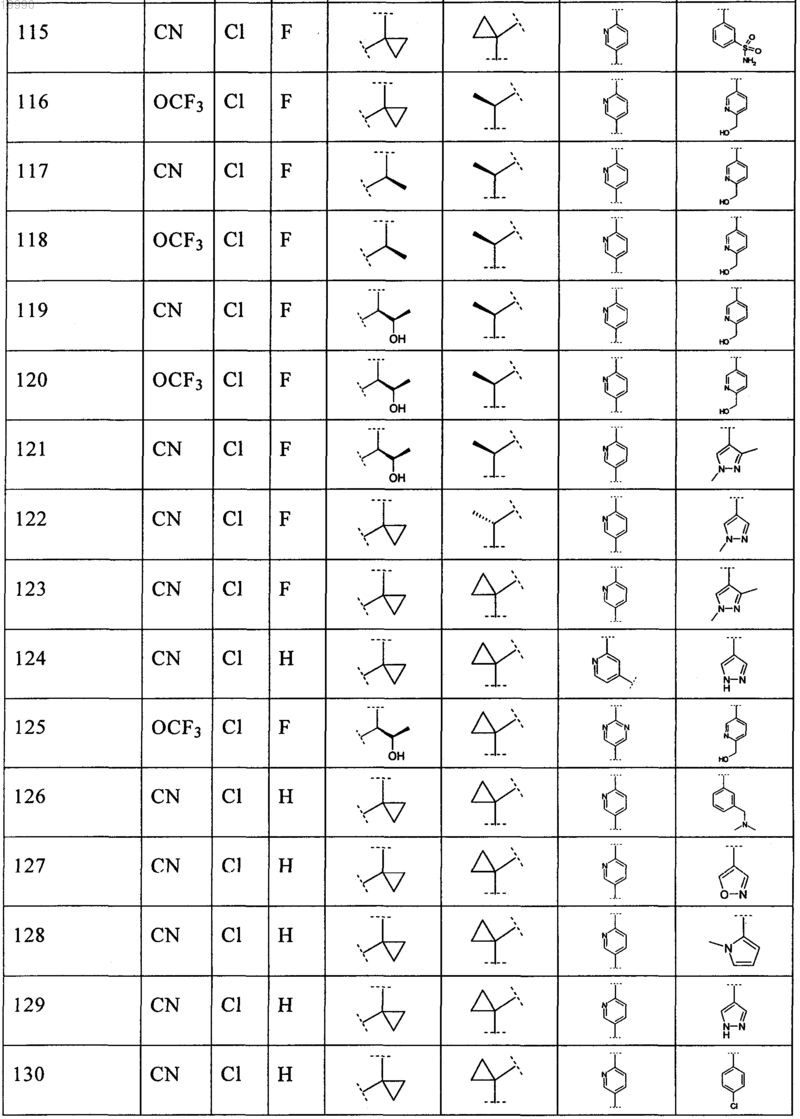
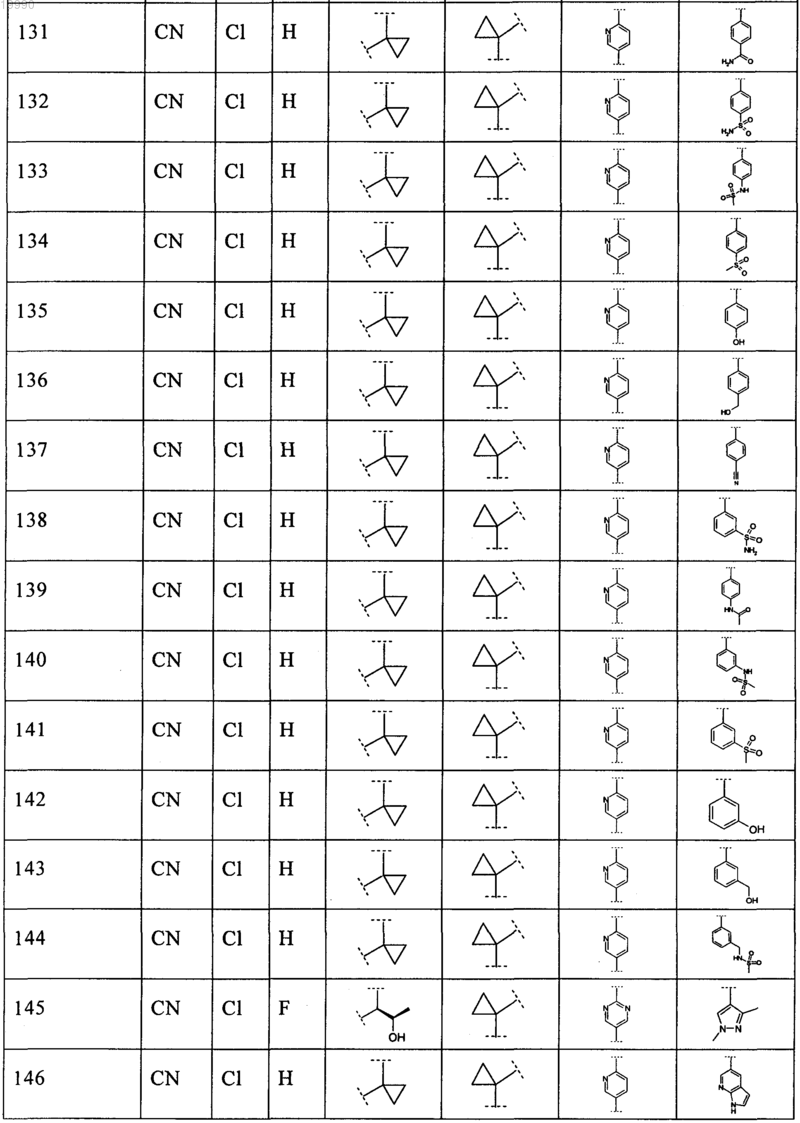
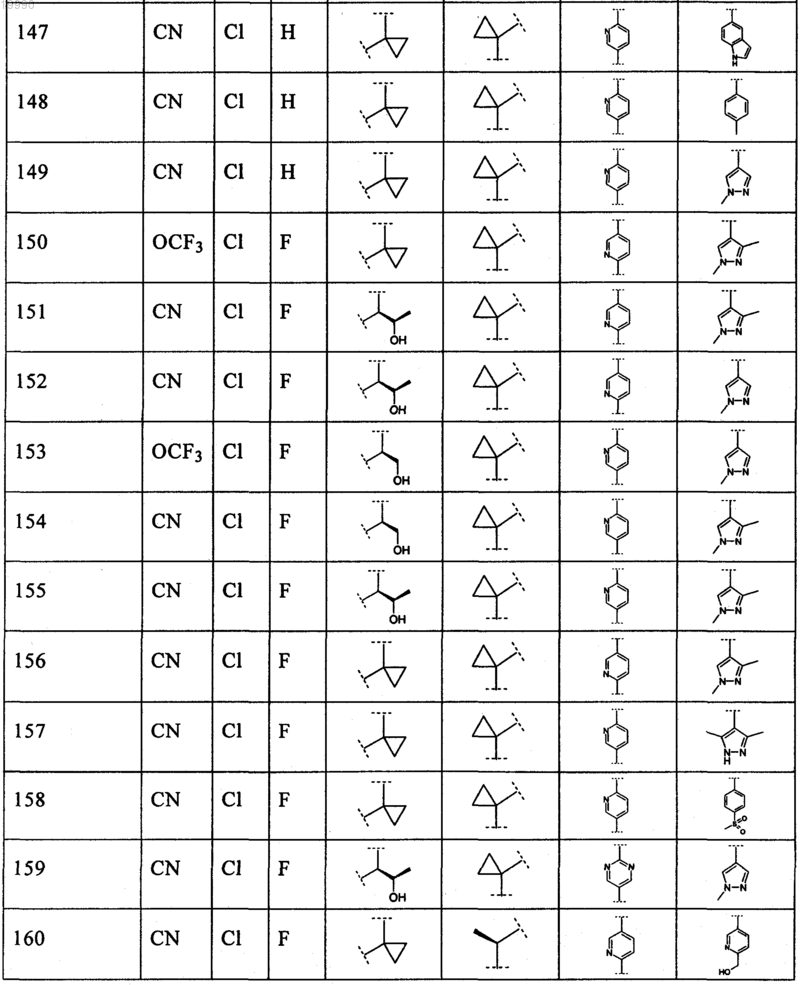
или его фармацевтически приемлемая соль.
7. Соединение по п.6, выбранное из числа соединений 1, 2, 4-8, 10-16, 18, 20, 21, 23, 27, 28, 30-35, 37-47, 49-52, 54, 56, 58, 60-62, 64-66, 68-70, 72, 75, 78, 87-90, 93, 96, 100, 101, 103-106, 108-112, 115-121, 123, 125, 127, 129, 131-136, 138, 141-143, 145, 146 и 149-160, или его фармацевтически приемлемая соль.
8. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель или вспомогательное вещество.
9. Применение соединения по п.1 в качестве лекарственного средства.
10. Применение соединения по п.1 в качестве лекарственного средства для лечения воспаления или воспалительного патологического состояния.
11. Применение соединения по п.1 в качестве лекарственного средства для лечения синдрома расстройства дыхания у взрослых, шока, отравления кислородом, синдрома поражения множества органов после сепсиса, синдрома поражения множества органов после травмы, реперфузионного поражения ткани вследствие искусственного кровообращения, инфаркта миокарда, острого гломерулонефрита, васкулита, реактивного артрита, дерматоза с острыми воспалительными компонентами, удара, термического ожога, гемодиализа, лейкафереза, некротизирующего энтероколита или синдрома, связанного с трансфузией гранулоцитов, псориаза, отторжения трансплантата органа/ткани, реакции трансплантат против хозяина, аутоиммунного заболевания, синдрома Рейно, аутоиммунного тиреоидита, дерматита, рассеянного склероза, ревматоидного артрита, инсулинозависимого сахарного диабета, увеита, воспалительной болезни кишечника, болезни Крона, язвенного колита, или системной красной волчанки, или астмы.
Текст
В изобретении описаны производные амида 6,7-дигидро-5 Н-имидазо[1,2-а]имидазол-3 карбоновой кислоты, оказывающие значительное ингибирующее воздействие на взаимодействиеCAMs с лейкоинтегринами и поэтому применимые для лечения воспалительного заболевания.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Предпосылки создания изобретения 1. Область техники, к которой относится изобретение Настоящее изобретение в целом относится к группе новых производных амидов 6,7-дигидро-5 Нимидазо[1,2-а]имидазол-3-карбоновой кислоты, к синтезу этих соединений, к их применению для лечения воспалительных заболеваний и к фармацевтическим композициям, содержащим эти соединения. 2. Уровень техники Исследования, проведенные в последнее десятилетие, способствовали изучению молекулярных явлений, сопровождающих взаимодействия между клетками в организме, в особенности участвующих в перемещении и активации клеток иммунной системы (см. публикацию von Andrian U.H., et al. N. Engl J.Med 2000; 343(14):1020-1034). Белки, находящиеся на поверхности клеток, и в особенности внутриклеточные адгезионные молекулы ("ICAMs") и "лейкоинтегрины", включая LFA-1, МАС-1 и р 150,95 (по номенклатуре ВОЗ (Всемирная организация здравоохранения) называющиеся CD18/CD11a, CD18/CD11b и CD18/CD11 с соответственно) явились объектами фармацевтических исследований и разработок с целью вмешательства в процессы выхождения лейкоцитов в травмированные положения и перемещения лейкоцитов к определенным мишеням. В частности, в настоящее время полагают, что до выхождения лейкоцитов, что является обязательным компонентом воспалительного ответа, происходит активация интегринов, постоянно экспрессирующихся на лейкоцитах, и затем происходит сильное взаимодействие лиганд/рецептор между интегринами (например, LFA-1) и одной или несколькими разными внутриклеточными адгезионными молекулами (ICAMs), обозначаемыми, как ICAM-1, ICAM-2 или ICAM-3, которые экспрессируются на поверхностях эндотелиальных клеток кровеносных сосудов и на других лейкоцитах. Взаимодействие ICAMs с лейкоинтегринами является жизненно важной стадией при нормальном функционировании иммунной системы. Для иммунные процессов, таких как презентация антигена, опосредуемая Т-клетками цитотоксичность и выхождение лейкоцитов, всегда необходима межклеточная адгезия, опосредуемая с помощью ICAMs, взаимодействующих с лейкоинтегринами. См. публикацииKishimoto, T.K.; Rothlein; R.R. Adv. Pharmacol. 1994, 25, 117-138 и Diamond, M.; Springer, T. Current Biology, 1994, 4, 506-532. Выявлена группа индивидуумов, у которых отсутствует надлежащее экспрессирование лейкоинтегринов, это патологическое состояние названо "Дефицит адгезии лейкоцитов I" (ДАЛ) (Anderson, D.С.; etal., Fed. Proc. 1985, 44, 2671-2677 и Anderson, D.С.; et al., J. Infect. Dis. 1985, 152, 668-689). У этих индивидуумов неспособен проявляться нормальный воспалительный и/или иммунный ответ(ы) вследствие неспособности их клеток к адгезии к клеточным субстратам. Эти данные показывают, что иммунные реакции ослабляются, когда лимфоциты неспособны к нормальной адгезии вследствие отсутствия функциональных адгезионных молекул семейства CD18. Вследствие того, что у пациентов, у которых наблюдается ДАЛ и у которых отсутствуют CD18, неспособны к иммунному ответу, было предположено, что антагонизм взаимодействий CD18/CD11/ICAM также подавляет иммунный ответ. Роль LFA-1 в перемещении и активации иммунных клеток надежно установлена подтверждена исследованиями на мышах с дефицитом LFA-1 и блокирующими анти-LFA-1 антителами. In vitro лимфоциты с дефицитом LFA-1 характеризуются нарушениями агрегации и пролиферации. In vivo одновременно наблюдается ослабление реакций гиперчувствительности задержанного типа (ГЗТ). При исследованиях с использованием моделей трансплантатов органов на животных показана эффективность анти-LFA-1 антител. Совместно эти данные свидетельствуют о роли LFA-1 в инициировании и/или развитии воспалительных ответов (Giblin,P.A. et al. Curr. Pharm. Design, 2006, 12: 2771-2795). Показано, что антагонизм взаимодействия между ICAMs и лейкоинтегринами можно реализовать с помощью средств, воздействующих на любой из компонентов. В частности, блокирование CAMs, таких как, например, ICAM-1, или лейкоинтегринов, таких как, например, LFA-1, антителами, действующими на любую или обе эти молекулы, эффективно подавляет воспалительные ответы. Модели in vitro воспалительного и иммунного ответа, подавляемого антителами к ICAMs или лейкоинтегринам, включают вызванную антигеном или митогеном пролиферацию лимфоцитов, гомотипическую агрегацию лимфоцитов, опосредуемый Т-клетками цитолизис и антиген-специфическую индуцированную переносимость. О важности результатов исследований in vitro свидетельствуют данные исследований in vivo с использованием антител к ICAM-1 или LFA-1. В многочисленных исследованиях трансплантатов, включая трансплантаты сердца, кишечника, островков и роговицы, после лечения с помощью анти-LFA-1 по отдельности или в комбинации с анти-ICAM-l наблюдалось увеличение длительности жизнеспособности трансплантата (см., например, Nakakura E.K. et al., Transplantation 1993; 55(2):412-417). Анти-LFA-1 антитела также проявили благоприятные характеристики в моделях на животных для рассеянного склероза, волчанки и воспалительного артрита (см., например, Kobayashi Y. et al., Cell Immunol 1995; 164(2):295-305). Первым исследованным в клинических условиях средством, направленным на LFA-1, являлись антиLFA-1 антитела. Одулимомаб проявил эффективность при клинических исследованиях трансплантата костного мозга (Stoppa A.M. et al., Transpl Int 1991; 4(1):3-7) и при клинических исследованиях трансплантата почки (Hourmant M. et al., Transplantation 1994; 58(3):377-380). Гуманизированные анти-LFA-1 антитела раптива (анти-CD11a, hu1124, эфализумаб), продающиеся для лечения псориаза, в клинических условиях подтвердили предположение о роли LFA-1 (Leonardi C.L. et al., J. Am Acad Dermatol 2005;-1 019990 52(3 Pt 1):425-433). Таким образом, в предшествующем уровне техники показано, что большие молекулы белков, которые препятствуют связыванию ICAMs с лейкоинтегринами, могут быть полезны для ослабления воспалительных и иммунных ответов, часто связанных с патогенезом многих аутоиммунных и воспалительных заболеваний. Однако в качестве терапевтических средств белки обладают значительными недостатками, включая непригодность для перорального введения и возможную иммунологическую реактивность, что ограничивает применение этих молекул для длительного введения. Кроме того, лекарственные средства на основе белков обычно дороги в производстве. Отсюда следует, что малые молекулы, обладающие способностью, сходной со способностью больших молекул белков непосредственно препятствовать связыванию ICAMs с лейкоинтегринами, должны быть предпочтительными терапевтическими средствами. В литературе описаны различные малые молекулы, влияющие на взаимодействие ICAMs с лейкоинтегринами. Например, в патенте US 6355664 (и соответствующей WO 98/39303), 6710664, 6977267,7199125 и WO 2006065908 раскрыт класс малых молекул, содержащих гидантоиновое ядро, которые являются ингибиторами взаимодействия LFA-1 с ICAM-1. В патенте US 6492408 (и соответствующей WO 01/07440 А 1), патенте US 6844360, патенте US 6852748, WO 2006/107941 и WO 2007/027233 раскрыты соединения, обладающие такой же активностью и которые содержат другое - 6,7-дигидро-5 Нимидазо[1,2-а]имидазольное ядро. Кроме того, в патентах US 6673825 и 6974815 и в публикации заявки на патент 20060052434 раскрыты малые молекулы, содержащие уразольное, гексагидробензимидазольное и пирролизильное ядро соответственно, которые являются ингибиторами взаимодействия LFA-1 сICAM-1. Краткое изложение сущности изобретения Настоящее изобретение относится к новому классу производных амидов 6,7-дигидро-5 Нимидазо[1,2-а]имидазол-3-карбоновой кислоты и к способам их получения. Эти соединения применимы для лечения воспалительных патологических состояний, поскольку они оказывают значительное ингибирующее воздействие на взаимодействие ICAMs и лейкоинтегринов. Они также обладают улучшенным метаболическим профилем по сравнению с известными антагонистами LFA-1 при сохранении эффективного функционального антагонизма по отношению к LFA-1 в цельной крови. Таким образом, настоящее изобретение также относится к применению этих соединений для лечения воспалительных патологических состояний и к фармацевтическим композициям, содержащим их в качестве активных ингредиентов. Подробное описание изобретения Все термины при использовании в описании настоящего изобретения, если не указано иное, следует понимать в их обычных значениях, известных в данной области техники. Например, "C1-C4-алкил" означает насыщенный алифатический углеводородный одновалентный радикал, содержащий 1-4 атома углерода, такой как метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил или трет-бутил. Все алкильные группы следует понимать, как разветвленные или неразветвленные, если это возможно в структуре и если не указано иное. Другие более конкретные определения приведены ниже. Термин "C3-C6-циклоалкил" означает циклический насыщенный углеводородный одновалентный радикал, содержащий в кольце 3-6 атомов углерода, такой как циклопропил, циклобутил, циклопентил и циклогексил. Термины "гетероцикл" или "гетероциклил" означают стабильный неароматический 4-8-членный (но предпочтительно 5- или 6-членный) моноциклический или неароматический 8-11-членный бициклический гетероциклический радикал, который может быть насыщенным или ненасыщенным. Каждый гетероцикл состоит из атомов углерода и одного или большего количества, предпочтительно от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Гетероцикл может быть присоединен через любой атом цикла, если это приводит к стабильной структуре. Если не указано иное, гетероциклы включают, но не ограничиваются только ими, например, пирролидинил, пирролидинонил, пирролинил, морфолинил, тиоморфолинил, тиоморфолинилсульфоксид, тиоморфолинилсульфон, диоксаланил,пиперидинил, пиперазинил, тетрагидрофуранил, тетрагидропиранил, тетрагидрофуранил, 1,3 диоксоланон, 1,3-диоксанон, 1,4-диоксанил, пиперидинонил, тетрагидропиримидонил, пентаметиленсульфид, 5-оксо-4,5-дигидроизоксазол-3-ил, пентаметиленсульфоксид, пентаметиленсульфон, тетраметиленсульфид, тетраметиленсульфоксид и тетраметиленсульфон. Термин "арил" означает ароматическое углеводородное кольцо (кольца), содержащее от 6 до 10 кольцевых атомов углерода (например, C6-C10-арил). Термин арил включает моноциклические кольца и бициклические кольца, в которых по меньшей мере одно кольцо является ароматическим. Неограничивающие примеры арилов включают фенил, инданил, инденил, бензоциклобутанил, дигидронафтил, тетрагидронафтил, нафтил, бензоциклогептанил и бензоциклогептенил. Термин "гетероарил" следует понимать, как означающий ароматическое 5-8-членное моноциклическое или 8-11-членное бициклическое кольцо, содержащее 1-4 гетероатома, таких как N, О и S. Если не указано иное, такие гетероарилы включают тиенил, фуранил, изоксазолил, оксазолил, тиазолил, тиадиазолил, оксадиазолил, 3-гидрокси-1 Н-пиразол-5-ил, 5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил, 5-оксо-4,5 дигидро-1,2,4-тиадиазол-3-ил, 3-гидроксиизоксазол-5-ил, тетразолил, пиразолил, пирролил, имидазолил,-2 019990 пиридинил, пиримидинил, пиразинил, пиридазинил, пиранил, хиноксалинил, индолил, бензимидазолил,бензоксазолил, бензотиазолил, бензотиенил, хинолинил, хиназолинил, нафтиридинил, индазолил, триазолил, пиразоло[3,4-b]пиримидинил, пуринил, пирроло[2,3-b]пиридинил, пиразоло[3,4-b]пиридинил, туберцидинил, оксазо[4,5-b]пиридинил и имидазо[4,5-b]пиридинил. Любой являющийся гетероатомом атом азота в гетероарильном кольце может представлять собой окисленный атома азота, например, с образованием четвертичного атома азота. Термин "галоген" при использовании в настоящем описании следует понимать, как означающий бром, хлор, фтор или йод, предпочтительно фтор или хлор. Соединениями, предлагаемыми в настоящем изобретении, являются только такие, которые предполагаются "химически стабильными", что должно быть очевидно для специалистов в данной области техники. Например, соединение, которое содержит "свободную валентность", или "карбанион" не является соединением, соответствующим способам, раскрытым в настоящем изобретении. Обычно в объем настоящего изобретения входят все таутомерные и изомерные формы и их смеси,например отдельные геометрические изомеры, стереоизомеры, энантиомеры, диастереоизомеры, рацематы, рацемические и нерацемические смеси стереоизомеров, смеси диастереоизомеров или смеси любых из указанных выше форм химических структур или соединений, если в названии соединения или структуре специально не указана стереохимическая конфигурация или изомерная форма. Любое соединение,предлагаемое в настоящем изобретении, содержащее один или большее количество асимметрических атомов углерода, может существовать в виде рацемата или рацемической смеси, отдельного энантиомера, диастереоизомерной смеси или отдельного диастереоизомера, или смеси любых из указанных выше форм. Все такие изомерные формы этих соединений явно включены в настоящее изобретение. Каждый стереогенный атом углерода может находиться в R- или S-конфигурации, а соединение может включать комбинацию конфигураций. Некоторые из соединений формулы (I) могут существовать более чем в одной таутомерной форме. Настоящее изобретение включает способы, в которых применяются все такие таутомеры. Кроме того, соединения, предлагаемые в настоящем изобретении, и их соли включают асимметрические атомы углерода и поэтому могут существовать в виде отдельных стереоизомеров, рацематов и в виде смесей энантиомеров и диастереоизомеров. Обычно такие соединения получаются в виде рацемической смеси. Однако при необходимости такие соединения можно получить или выделить в виде чистых стереоизомеров, т.е. в виде отдельных энантиомеров или диастереоизомеров или обогащенных стереоизомером смесей по методикам, хорошо известным в данной области техники. Например, отдельные стереоизомеры соединений получают путем синтеза из оптически активных исходных веществ, содержащих необходимые хиральные центры, или путем получения смесей энантиомерных продуктов с последующим выделением или разделением, таким как превращение в смеси диастереризомеров с последующим разделением или перекристаллизацией, с использованием хроматографических методик, с использованием хиральных разделяющих реагентов или путем прямого разделения энантиомеров на хиральных хроматографических колонках. Исходные вещества, обладающие определенной стереохимической структурой, имеются в продаже или их получают по описанным ниже методикам и разделяют по методикам,хорошо известным в данной области техники. Получение чистых энантиомеров или смесей с необходимым энантиомерным избытком (ЭИ) или энантиомерной чистотой проводят по одной или большему количеству следующих методик (а) выделения или разделения энантиомеров или (b) энантиоселективного синтеза, известных специалистам в данной области техники, или с помощью их комбинаций. Такие методики разделения обычно основаны на хиральном распознавании и включают, например, хроматографию с использованием хиральных стационарных фаз, энантиоселективного комплексообразования хозяин-гость, разделения или синтеза с использованием хиральных вспомогательных веществ, энантиоселективного синтеза, ферментативного и неферментативного кинетического разделения или самопроизвольной энантиоселективной кристаллизации. Такие методики в целом описаны в публикациях Chiral Separation Techniques: A Practical ApproachWileySons, 1999; и Satinder Ahuja, Chiral Separations by Chromatography, Am. Chem. Soc, 2000. Кроме того, также существуют хорошо известные методики количественного определения энантиомерного избытка и чистоты, например ГХ (газовая хроматография), ВЭЖХ (высокоэффективная жидкостная хроматография), КЭ (капиллярный электрофорез) или ЯМР (спектроскопия ядерного магнитного резонанса) и определения абсолютной конфигурации и конформации, например КД (круговой дихроизм), ДОВ (дисперсия оптического вращения), рентгенография кристаллов и ЯМР. Соединения, предлагаемые в настоящем изобретении, включают соединения формулы (I), описанные в настоящем изобретении, а также их фармацевтически приемлемые соли. Термин "соль" означает ионную форму исходного соединения или продукта реакции исходного соединения с подходящей кислотой или основанием с получением соли исходного соединения с кислотой или основанием. Соли соединений, предлагаемых в настоящем изобретении, можно синтезировать из исходного соединения, которое содержит основной или кислотный фрагмент, по обычным химическим методикам. Обычно соли получают по реакции исходного соединения, находящегося в форме свободного основания или кислоты, со-3 019990 стехиометрическим количеством или с избытком необходимой солеобразующей неорганической или органической кислоты или основания в подходящем растворителе или в различных комбинациях растворителей. Термин "фармацевтически приемлемая соль" означает соль соединения, предлагаемого в настоящем изобретении, которая в соответствии с квалифицированной медицинской оценкой пригодна для применения в соприкосновении с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п., в соответствии с разумным соотношением польза/риск, обычно растворимая или диспергируемая в воде или в масле и эффективная для своего предназначения. Термин включает фармацевтически приемлемые соли присоединения с кислотами и фармацевтически приемлемые соли присоединения с основаниями. Поскольку соединения, предлагаемые в настоящем изобретении, применимы и в форме свободного основания, и в форме соли, то на практике применение в форме соли эквивалентно применению в форме свободного основания. Перечень подходящих солей приведен, например, в публикации S.M. Birge et al., J. Pharm. Sci., 1977, 66, p. 1-19, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки. Примеры кислот, подходящих для получения солей, включают хлористо-водородную, бромистоводородную, угольную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную, гликолевую,молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевую кислоту, которые сами по себе не являются фармацевтически приемлемыми, можно использовать при получении солей, использующихся в качестве промежуточных продуктов при получении соединений, предлагаемых в настоящем изобретении, и их фармацевтически приемлемых солей присоединения с кислотами. Соли, полученные из подходящих оснований, включают соли щелочного металла (например, натрия), щелочно-земельного металла (например, магния), аммония и N-(C1-C4-алкил)4+. Одним вариантом осуществления настоящего изобретения являются соединения формулы I(B) C1-C3-алкил, необязательно замещенный одной или двумя группами, выбранными из группы,включающей: а) C3-C6-циклоалкил;(E) фенил, необязательно содержащий следующие заместители: галоген -OR9, -CN или -CF3;R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3-7 атомов углерода, и один атом углерода указанного углеводородного кольца необязательно может быть заменен на -О-, -S-, -S(O)-, -SO2-, -NH-, -NCH3-, или -NC(O)CH3-;R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3-7 атомов углерода, и один атом углерода указанного углеводородного кольца необязательно может быть заменен на -О-, -S-, -S(O) -, -SO2-, -NH-, -NCH3- или -NC(O)CH3-;Z обозначает арил или гетероарил;(A) арил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:(a) C1-C3-алкил, необязательно содержащий следующие заместители: -OR9, -NR9R10 или 9(b) C3-C7-циклоалкил, необязательно содержащий следующие заместители: -OR9 или -NR9R10;(B) гетероарил, необязательно замещенный одной или двумя группами, выбранными из группы,включающей:(a) C1-C3-алкил, необязательно содержащий следующие заместители: - OR9, NR9R10 или галоген;(b) C3-C7-циклоалкил, необязательно содержащий следующие заместители: -OR9, NR9R10;R10 выбран из группы, включающей Н, C1-C5-алкил или C3-C7-циклоалкил; или их фармацевтически приемлемая соль. Другим вариантом осуществления является соединение формулы I, в которой(A) C1-C2-алкил, необязательно замещенный группой -ОН;R4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;(A) фенил, необязательно замещенный одной или двумя группами, выбранными из группы, включающей:(B) пиридинил, необязательно моно- или дизамещенный группами -СН 3, -СН 2 ОН, -NH2, -ОН, -Cl,-F, -CN, -CF3 или циклопропилом;(C) 1H-пиразолил, необязательно моно-, ди- или тризамещенный группой -СН 3 или циклопропилом;(D) пиримидинил, необязательно замещенный группой -СН 3;(E) изоксазолил, необязательно замещенный группой -СН 3;(F) имидазо[1,2-a]пиридинил, необязательно замещенный группой -СН 3;(Н) тиазолил, необязательно моно- или дизамещенный группами -СН 3 или -Cl;(L) 1H-имидазолил, необязательно замещенный группой -CH3;(N) 1H-пирролил, необязательно замещенный группой -CH3;R10 обозначает Н или -CH3; или его фармацевтически приемлемая соль. Другим вариантом осуществления является соединение формулы I, в которойR4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;(B) пиридинил, необязательно содержащий следующие заместители: -СН 3, -СН 2 ОН, -NH2, -ОН, -Cl,-F; -CN или циклопропилом;(C) 1H-пиразол-4-ил, необязательно моно-, ди- или тризамещенный группой -СН 3 или циклопропилом;(D) пиримидин-5-ил, необязательно замещенный группой -СН 3;(E) изоксазол-4-ил, необязательно замещенный группой -СН 3;(F) 2-имидазо[1,2-a]пиридин-6-ил, необязательно замещенный группой -CH3;(I) тиазол-5-ил, необязательно замещенный группой -CH3;(N) 1H-имидазол-2-ил, необязательно замещенный группой -CH3;R10 обозначает Н или -CH3; или его фармацевтически приемлемая соль. Еще одним вариантом осуществления является соединение формулы I, в которой R1 выбран изR4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;(B) пиридинил, необязательно содержащий следующие заместители: -CH3, -СН 2 ОН, -NH2, -ОН, -Cl,(C) 1H-пиразол-4-ил, необязательно моно-, ди- или тризамещенный группой -CH3 или циклопропи(D) 2-метилпиримидин-5-ил;R10 обозначает Н или -CH3; или его фармацевтически приемлемая соль. Еще одним вариантом осуществления является соединение формулы I, в которойR4 и R5 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 атома;R6 и R7 вместе с атомом углерода, с которым они связаны, образуют насыщенное углеводородное кольцо, содержащее 3 или 4 атома;(C) 1H-пиразол-4-ил, необязательно моно- или дизамещенный группой -CH3; или его фармацевтически приемлемая соль. Ниже приведены типичные соединения, предлагаемые в настоящем изобретении, которые можно получить по методикам, описанным на общих схемах синтеза, в примерах синтеза и по методикам, известным в данной области техники. Таблица 1 В другом варианте осуществления настоящее изобретение относится к соединению, выбранному из числа соединений, описанных в табл. 1, или к его фармацевтически приемлемым солям. В другом варианте осуществления настоящее изобретение относится к соединению, выбранному из числа соединений 1, 2, 4-8, 10-16, 18, 20, 21, 23, 27, 28, 30-35, 37-47, 49-52, 54, 56, 58, 60-62, 64-66, 68-70,72, 75, 78, 87-90, 93, 96, 100, 101, 103-106, 108-112, 115-121, 123, 125, 127, 129, 131-136, 138, 141-143, 145,146 и 149-160, приведенных в табл. 1, или к его фармацевтически приемлемым солям. Общие методики синтеза. Соединения, предлагаемые в настоящем изобретении, можно получить по описанным ниже методикам. Если не указано иное, то на всех приведенных ниже схемах группы R1-R8, Y и Z являются такими,как определено выше для соединения общей формулы I. Оптимальные условия проведения реакций и длительность реакций могут меняться в зависимости от конкретных использующихся реагентов. Если не указано иное, то растворители, температуры, давления и другие условия проведения реакций могут быть легко выбраны специалистом с общей подготовкой в данной области техники. Конкретные методики приведены в разделе "Примеры синтеза". Обычно за протеканием реакции при необходимости можно следить с помощью тонкослойной хроматографии (ТСХ) или ВЭЖХ-МС (высокоэффективная жидкостная хроматография-масс-спектрометрия). Промежуточные и конечные продукты можно очистить с помощью хроматографии на силикагеле, перекристаллизации и/или ВЭЖХ с обращенной фазой. Во всех случаях в методиках очистки с помощью ВЭЖХ использовали смеси, содержащие 0-100% ацетонитрила в воде и содержащие 0,1% муравьиной кислоты или 0,1% ТФК (трифторуксусная кислота), и одну из следующих колонок:f) колонка Phenomenex Gemini Axia C18 5 мкм 30100 мм. Исходные вещества и реагенты имеются в продаже или специалист в данной области техники может их получить по методикам, описанным в химической литературе. Соединения формулы I можно получить из промежуточного продукта II так, как показано на схемеI. Синтез промежуточного продукта II описан в следующих патентах US: 6492408, 6414161, 6844360 и 6852748, а также в публикациях заявок на патенты US 2006/0025447 и 2007/0173517. Необходимую- 19019990 группу R1 в соединениях формулы II можно ввести с использованием соответствующим образом замещенных реагентов, так как описано в публикациях Wu et al., патент US6492408 и Frutos et al.,US 6414161. Синтез соединений формулы I из промежуточного продукта II представлен на схеме I. Схема I Как показано выше, соединение формулы II превращают в соединение формулы III в условиях реакции Гриньяра и по реакции с СО 2 или по катализируемой с помощью Pd реакции карбоксилирования. Соединение формулы I получают из карбоновой кислоты III по реакции образования амида с подходящим образом замещенным промежуточным продуктом V или по двустадийной методике, по которой образование промежуточного продукта IV происходит до конечной реакции образования амида с промежуточным продуктом VII или путем превращения IV в IX путем образования амида с последующим перекрестным сочетанием. Промежуточные продукты (V, VI, VII и VIII) имеются в продаже, их можно легко получить из имеющихся в продаже исходных веществ по методикам, известным в данной области техники, или раскрытым в настоящем изобретении. Исходный продукт формулы I можно дополнительно модифицировать по методикам, известным в данной области техники, и получить дополнительные соединения, предлагаемые в настоящем изобретении. Некоторые примеры приведены в разделе "Примеры синтеза". Примеры синтеза Синтез промежуточных продуктов. Общая методика - синтез гетероциклического циклопропиламина. 1-(6-Бромпиридин-3-ил)циклопропиламин-бис-трифторацетат Круглодонную колбу объемом 2 л сушили в вакууме и продували с помощью Ar. Затем ее снабжали механической мешалкой и выдерживали в потоке Ar. В эту колбу добавляли безводный ТГФ (тетрагидрофуран) (750 мл), затем Ti(Oi-Pr)4 (72,8 мл, 246 ммоль). Раствор продували с помощью Ar и нагревали при 50 С. К смеси добавляли 6-бромникотинонитрил (30 г, 164 ммоль), затем по каплям добавляли (в течение 40 мин) 1 М этилмагнийбромид в ТГФ (410 мл, 410 ммоль). Реакционную смесь перемешивали при 50 С. Через 3 ч реакционную смесь охлаждали до комнатной температуры и 3 М HCl (примерно 350- 20019990 мл) добавляли. Смесь переносили в делительную воронку и промывали эфиром (3500 мл). Водный слой выдерживали в течение ночи. Затем водный слой подщелачивали (рН 10) с помощью 2 М NaOH. Густой гетерогенный раствор разбавляли с помощью EtOAc (500 мл) и полученный раствор энергично перемешивали в течение 5 мин. Гетерогенный раствор выдерживали и при этом слои медленно разделялись. Органический слой сливали и эту методику экстракции повторяли (2). Органические слои объединяли,промывали рассолом (150 мл), сушили над MgSO4 и концентрировали в вакууме и получали 17 г темнооранжево-красного масла. 16,1 г неочищенного масла очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле (340 г силикагеля, 0-10% МеОН в CH2Cl2) и получали 5,94 г 1-(6 бромпиридин-3-ил)циклопропиламин в виде оранжевого масла, которое медленно кристаллизовалось;m/z 213,3/215,3. 1-(6-Бромпиридин-3-ил)циклопропиламин (1,16 г, 4,6 ммоль) растворяли в CH2Cl2 (20 мл). Последовательно добавляли Et3N (0,78 мл, 5,6 ммоль) и Boc2O (1,11 г, 5,1 ммоль). Реакционную смесь перемешивали при комнатной температуре. Через 20 ч реакционную смесь разбавляли с помощью CH2Cl2 (20 мл) и водой (20 мл). Смесь встряхивали и слои разделяли. Водный слой экстрагировали с помощьюCH2Cl2 (1100 мл). Гетерогенный слой CH2Cl2 отделяли, промывали рассолом, сушили над MgSO4, фильтровали, концентрировали и получали 1,4 г трет-бутилового эфира [1-(6-бромпиридин-3 ил)циклопропил]карбаминовой кислоты в виде оранжевого твердого вещества. трет-Бутиловый эфир [1(6-бромпиридин-3-ил)циклопропил]карбаминовой кислоты (800 мг, 2,55 ммоль) растворяли в CH2Cl2 (10 мл). По каплям добавляли ТФК (5 мл). Через 4 ч реакционную смесь концентрировали в вакууме и получали 1,5 г искомого соединения в виде коричневого масла; m/z 213,1/215,1. Следующие соединения получали по методикам, аналогичным описанным выше: 1-(6-йодпиридин-2-ил)циклопропиламин-бис-трифторацетат; 1-(5-йодпиридин-2-ил)циклопропиламин-бис-трифторацетат; 1-(4-йодпиридин-2-ил)циклопропиламин-бис-трифторацетат; трет-бутиловый эфир (1-фуран-2-илциклопропил)карбаминовой кислоты. 3-Циклопропил-1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол Смесь циклопропилметилкетона (7,0 мл, 70,7 ммоль) и диметоксиметилдиметиламина (18,7 мл,141,5 ммоль, 2 экв.) нагревали при 100C в течение 16 ч. Смесь концентрировали в высоком вакууме в течение 1 ч и получали (Е)-1-циклопропил-3-диметиламинопропенон в виде желтого масла (2,7 г, 28%),которое использовали на следующей стадии без дополнительной очистки. К смеси (Е)-1-циклопропил-3-диметиламинопропенона (1,5 г, 10,8 ммоль) и NaOAc (1,3 г, 16,2 ммоль) в этаноле (10 мл) добавляли раствор гидразина (0,6 мл, 11,9 ммоль) и раствор выдерживали при 70 С в течение ночи. Смесь концентрировали, твердое вещество отфильтровывали, промывали с помощью CH2Cl2, фильтрат концентрировали при пониженном давлении и получали смесь 5-циклопропил-1 метил-1H-пиразола и 3-циклопропил-1-метил-1 Н-пиразола в виде желтого твердого вещества (950 мг,72%). Неочищенное вещество использовали на следующей стадии без дополнительной очистки. К смеси пиразолов (3,9 г, 31,9 ммоль) в CHCl3 (10 мл) при комнатной температуре по каплям добавляли неразбавленный бром (1,2 мл, 23,4 ммоль) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь выливали в 2 мл насыщенного водного раствора NaHCO3. Органический слой разбавляли с помощью CH2Cl2 (10 мл), промывали рассолом, сушили над MgSO4, концентрировали и получали неочищенный продукт (4,2 г, 66%). Остаток очищали с помощью колоночной хроматографии (15%EtOAc/гексаны) и получали каждый чистый региоизомер (860 мг, 27% и 560 мг, 18% соответственно).NOE ЯМР однозначно определял конфигурацию региоизомеров. При перемешивании к раствору 4-бром-3-циклопропил-1-метил-1H-пиразола (500 мг, 2,5 ммоль) в ТГФ (10 мл) при -78 С по каплям добавляли 2,5 М раствор n-BuLi (1,4 мл, 3,5 ммоль) и полученный светло-желтый раствор перемешивали в течение 30 мин. К смеси добавляли раствор 2-изопропокси 4,4,5,5-тетраметил-1,3,2-диоксаборолана (1,1 мл, 5,5 ммоль) в ТГФ (1 мл) и смесь нагревали до комнатной температуры в течение 30 мин. Реакцию останавливали насыщенным водным раствором NH4Cl. Смесь экстрагировали с помощью EtOAc (50 мл), промывали рассолом, сушили над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии с- 21019990 нормальной фазой на силикагеле (5% МеОН-CH2Cl2, Rf=0,35) и получали 3-циклопропил-1-метил-4(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразол (294 мг, 48%) в виде желтого масла. Следующее соединение получали по методикам, аналогичным описанным выше: 5-циклопропил-1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразол-1-[5-(2 метилимидазо[1,2-a]пиридин-6-ил)пиридин-2-ил]циклопропиламиндигидрохлоридPd(dppf)Cl2 дихлорметан и 1,3 мл 1 М K3PO4 в воде. Смесь нагревали при 110C в микроволновой печи в течение 10 мин. Смесь охлаждали и коричневую органическую фазу отделяли, разбавляли с помощьюEtOAc и фильтровали через диатомовую землю. Фильтрат концентрировали и очищали с помощью ВЭЖХ с обращенной фазой (10-40% MeCN/вода+0,1% ТФК) и получали 61 мг выход (40%) третбутилового эфира 1-[5-(2-метилимидазо[1,2-а]пиридин-6-ил)пиридин-2-ил]циклопропилкарбаминовой кислоты в виде бледно-коричневого порошкообразного вещества. трет-Бутиловый эфир 1-[5-(2-метилимидазо[1,2-а]пиридин-6-ил)пиридин-2-ил]циклопропилкарбаминовой кислоты (21 мг, 0,06 ммоль) растворяли в 0,5 мл CH2Cl2 и добавляли 1 мл 4 М HCl в диоксане. Полученную суспензию перемешивали в течение 1 ч. Смесь концентрировали и получали неочищенный 1-[5-(2-метилимидазо[1,2-а]пиридин-6-ил)пиридин-2-ил]циклопропиламиндигидрохлорид. Вещество использовали в последующих реакциях без очистки. 1-[(R)-1-(6-Бромпиридин-3-ил)этилкарбамоил]циклопропиламид(S)-(-)-2-метилпропан-2-сульфиновой кислоты (1,45 г, 11,72 ммоль) и этоксид титана(IV) (4,15 мл, 19,99 ммоль). Смесь нагревали при 110C в микроволновой печи. Через 2 ч смесь разбавляли эфиром (20 мл) и водой (6 мл). Смесь перемешивали в течение 10 мин. Слои разделяли и органический слой сушили над сульфатом магния, фильтровали, концентрировали и получали остаток. Неочищенный остаток очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле с использованием смеси этилацетатдихлорметан (0-40%) и получали [1-(6-бромпиридин-3-ил)-эт-(Е)-илиден]амид 2-метилпропан-2 сульфиновой кислоты (2,0 г, 66%).- 22019990 К охлажденному (-78C) раствору [1-(6-бромпиридин-3-ил)-эт-(Е)-илиден]амида 2-метилпропан-2 сульфиновой кислоты (1,0 г, 3,30 ммоль) в ТГФ (25 мл) по каплям добавляли раствор три-вторбутилборогидрида лития в ТГФ (L-Selectride, 3,30 мл, 3,30 ммоль). После добавления этого реагента смесь становилась темной. Через 3 ч реакцию останавливали насыщенным водным раствором хлорида аммония (30 мл) и экстрагировали этилацетатом (325 мл). Объединенные органические слои промывали рассолом (330 мл), сушили над сульфатом магния, фильтровали и концентрировали. Неочищенное вещество очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле при элюировании смесью этилацетат-дихлорметан (0-100%) и получали [(R)-1-(6-бромпиридин-3-ил)этил]амид 2 метилпропан-2-сульфиновой кислоты (700 мг, 70%) в виде желтоватого твердого вещества. К раствору [(R)-1-(6-бромпиридин-3-ил)этил]амида 2-метилпропан-2-сульфиновой кислоты (650 мг,2,13 ммоль) в МеОН (5 мл) добавляли 4,0 М HCl в диоксане (5,32 мл, 21,30 ммоль). Прозрачную реакционную смесь перемешивали при комнатной температуре в течение 2,5 ч. За это время реакционная смесь становилась мутной. Добавляли эфир (20 мл) и смесь перемешивали в течение 10 мин и затем фильтровали, промывали эфиром (20 мл) и получали соль с HCl (R)-1-(6-бромпиридин-3-ил)этиламина (500 мг,87%) в виде белого твердого вещества. К раствору полученной выше соли с HCl (R)-1-(6-бромпиридин-3-ил)этиламина (500 мг, 1,82 ммоль) в ДМФ (диметилформамид) (10 мл) добавляли 1-[(R)-5-(4-цианобензил)-7-(3,5-дихлор-4 фторфенил)-5-метил-6-оксо-6,7-дигидро-5 Н-имидазо[1,2-а]имидазол-3-карбонил]аминоциклопропанкарбоновую кислоту (900 мг, 1,66 ммоль) и диизопропилэтиламин (ДИПЭА) (1,45 мл, 8,30 ммоль). Смесь перемешивали при комнатной температуре в течение 5 мин. К смеси добавляли HATU (694 мг, 1,83 ммоль) и прозрачную желтую смесь перемешивали в течение 17 ч. Смесь разбавляли этилацетатом (35 мл) и промывали водой (8 мл). Органическую фазу промывали 5% водным раствором NaCl (210 мл) и рассолом (20 мл), сушили над Na2SO4, фильтровали, концентрировали и получали бледно-желтое масло. Неочищенное масло очищали с помощью флэш-хроматографии на силикагеле при элюировании с помощью 1-6% МеОН/CH2Cl2 и получали 1,3 г искомого соединения в виде желтого вспененного вещества. 1-[5-(5-Циклопропил-1,2,4-оксадиазол-3-ил)пиридин-2-ил]циклопропиламингидрохлорид Во флакон объемом 8 мл помещали циклопропанкарбоновую кислоту (78,5 мкл, 0,99 ммоль) и ДМФ (1,0 мл). Во флакон добавляли карбонилдиимидазол (КДИ) (176 мг, 1,09 ммоль) при комнатной температуре. Прозрачную реакционную смесь перемешивали в течение 2 ч и затем добавляли в другой флакон объемом 8 мл, содержащий трет-бутиловый эфир 1-[5-(N-гидроксикарбамимидоил)пиридин-2 ил]циклопропилкарбаминовой кислоты (430 мг, 1,47 ммоль) в 1,0 мл ДМФ. Полученную бледножелтую реакционную смесь перемешивали при комнатной температуре в течение 30 мин и затем нагревали при 100C в течение 16 ч. В прозрачной бледно-оранжевой реакционной смеси реакцию останавливали водой (10 мл) и экстрагировали этилацетатом (220 мл). Органические вещества промывали водой(215 мл) и рассолом (15 мл), сушили над Na2SO4, фильтровали, концентрировали и получали неочищенное масло. Неочищенное масло очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле при элюировании с помощью 0-35% EtOAc/гексаны и получали трет-бутиловый эфир 1-[5-(5 циклопропил-1,2,4-оксадиазол-3-ил)пиридин-2-ил]циклопропилкарбаминовой кислоты (86 мг, 26%) в виде белого твердого вещества. К раствору трет-бутилового эфира 1-[5-(5-циклопропил-1,2,4-оксадиазол-3-ил)пиридин-2 ил]циклопропилкарбаминовой кислоты (80 мг, 0,23 ммоль) в CH2Cl2 (10 мл) добавляли 4 М HCl (2 мл, 8 ммоль). После перемешивания в течение ночи дополнительно добавляли 4 М HCl (0,1 мл, 0,4 ммоль). Всего через 42 ч к реакционной смеси добавляли диэтиловый эфир (10 мл) и перемешивание продолжали в течение 10 мин. Суспензию реакционной смеси фильтровали и твердое вещество промывали эфиром(10 мл) и получали соль с HCl 1-[5-(5-циклопропил-1,2,4-оксадиазол-3-ил)пиридин-2 ил]циклопропиламина (40 мг) в виде белого твердого вещества. В сухой колбе в атмосфере аргона 2-фтор-5-йодпиридин (3,85 г, 17,3 ммоль) и циклобутанкарбонитрил (1,40 г, 17 ммоль) растворяли в сухом толуоле (15 мл). Раствор охлаждали до 0C и в течение 15 мин по каплям добавляли бис(триметилсилил)амид (1,0 М, 19 мл, 19 ммоль) натрия. Через 1 ч раствору давали нагреться до комнатной температуры и перемешивали в течение 26 ч. Реакционную смесь разбавляли насыщенным водным раствором NH4Cl (10 мл) и CH2Cl2 (10 мл). Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (210 мл). Объединенные органические слои сушили над MgSO4,фильтровали и концентрировали в вакууме и получали 4,0 г 1-(5-йодпиридин-2-ил)циклобутан карбонитрил в виде вязкого светло-коричневого масла; m/z 285,4 [М+Н]+. 1-(5-Йодпиридин-2-ил)циклобутан карбонитрил (4,0 г, 14 ммоль) объединяли с водой (5,0 мл), ледяной АсОН (5,0 мл) и концентрировали серной кислотой (5,0 мл). Гомогенный раствор кипятили с обратным холодильником (наружная баня: 115C). Через 5 ч раствор охлаждали до комнатной температуры и выливали в воду (10 мл) и Et2O (15 мл). Слои разделяли и слой, содержащий Et2O, отбрасывали. Значение рН водного слоя доводили до 4,5-5 путем добавления 2 М водного раствора NaOH и затем экстрагировали с помощью CH2Cl2 (350 мл). Объединенные слои, содержащие CH2Cl2, промывали рассолом,сушили над MgSO4, фильтровали, концентрировали и получали 3,92 г 1-(5-йодпиридин-2-ил)циклобутан карбоновой кислоты; m/z 304,4 [М+Н]+. 1-(5-Йодпиридин-2-ил)циклобутанкарбоновую кислоту (3,92 г, 12,9 ммоль) объединяли с третBuOH (6,1 мл, 65 ммоль), Et3N (9,0 мл, 65 ммоль) и ДФФА (дифенилфосфорилазид) (3,1 мл, 14 ммоль). Реакционную смесь кипятили с обратным холодильником (наружная баня: 85C) в течение 1,5 ч. Летучие вещества удаляли в вакууме и неочищенную реакционную смесь очищали с помощью флэшхроматографии с нормальной фазой на силикагеле (580% EtOAc/гексаны) и получали трет-бутиловый эфир 1,1 г [1-(5-йодпиридин-2-ил)циклобутил]карбаминовой кислоты в виде твердого вещества; m/z 375,4 [М+Н]+. К смеси трет-бутилового эфира [1-(5-йодпиридин-2-ил)циклобутил]карбаминовой кислоты (0,46 г,1,23 ммоль), трет-бутилового эфира 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиразол-1 карбоновой кислоты (0,4 г, 1,35 ммоль) и комплекса PdCl2(dppf)Cl2 дихлорметан (0,2 г, 0,25 ммоль) в ДМЭ/H2O/EtOH (4 мл, 7:3:2) в герметизируемой пробирке для микроволновой печи добавляли 1 М K3PO4(1,5 мл, 1,5 ммоль). Пробирку герметизировали и нагревали в микроволновой печи при 100C в течение 10 мин и затем 120C в течение 20 мин. Добавляли 2 М NaOH (2 мл) и перемешивали в течение 10 мин. Раствор экстрагировали с помощью EtOAc (100 мл). Органическую фазу промывали рассолом, сушили над MgSO4, фильтровали через диатомовую землю и концентрировали. Неочищенное масло очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле при элюировании с помощью 0-6% МеОН/CH2Cl2 и получали трет-бутиловый эфир 1-[5-(1 Н-пиразол-4-ил)пиридин-2 ил]циклобутилкарбаминовой кислоты (0,40 г) в виде коричневого твердого вещества; m/z 315,5 [М+Н]+. К раствору трет-бутилового эфира 1-[5-(1 Н-пиразол-4-ил)пиридин-2 ил]циклобутилкарбаминовой кислоты (300 мг, 0,96 ммоль) в CH2Cl2 (5 мл) добавляли ТФК (0,37 мл, 4,8- 24019990 ммоль). Через 15 ч добавляли 4 М HCl в диоксане (1,2 мл, 4,8 ммоль). Через 1 ч реакционную смесь концентрировали в вакууме и получали 303 мг искомого соединения; m/z 215,4 [М+Н]+. 5-[6-(1-Амино-1-метилэтил)пиридазин-3-ил]пиридин-2-илметанолдигидрохлорид Раствор 6-хлорпиридазин-3-карбонитрила (получали в соответствии с MacDonald et al.,WO 2008/068277) (100 мг, 0,71 ммоль) в сухом ТГФ (3,6 мл) охлаждали до -50C в бане твердый диоксид углерода/ацетон. Шприцем одной порцией добавляли метилмагнийбромид (1,0 М в MePh/ТГФ, 0,54 мл,0,75 ммоль). Охлаждающую баню удаляли и реакционную смесь перемешивали в течение 1,5 ч. К реакционной смеси добавляли насыщенный водный раствор NH4Cl и эту смесь экстрагировали с помощьюEtOAc (3). Объединенные органические вещества сушили над MgSO4 и концентрировали. Полученный остаток очищали с помощью флэш-хроматографии (диоксид кремния, 04% МеОН/CH2Cl2) и получали 34 мг 1-(6-хлорпиридазин-3-ил)-этанона в виде коричневого полужидкого вещества; m/z 157,3 [М+Н]+. К раствору 1-(6-хлорпиридазин-3-ил)-этанона (34 мг, 0,22 ммоль) в сухом ТГФ (1,0 мл) добавляли амид 2-метилпропан-2-сульфиновой кислоты (29 мг, 0,24 ммоль). Одной порцией добавляли Ti(OEt)4(0,090 мл, 0,43 ммоль) и реакционную смесь нагревали при 60C в течение 1 ч. К реакционной смеси добавляли воду и полученную взвесь фильтровали через слой диатомовой земли. Фильтрат сушили надNa2SO4, концентрировали и получали [1-(6-хлорпиридазин-3-ил)-эт-(Е)-илиден]амид 2-метилпропан-2 сульфиновой кислоты в виде неочищенного остатка, который использовали без очистки; m/z 260,5[М+Н]+. Неочищенный [1-(6-хлорпиридазин-3-ил)-эт-(Е)-илиден]амид 2-метилпропан-2-сульфиновой кислоты (56 мг, 0,22 ммоль) растворяли в сухом ТГФ (2,2 мл) и охлаждали до -20C в атмосфере инертного газа. Шприцем одной порцией добавляли метилмагнийбромид (1,0 М в MePh/ТГФ, 0,26 мл, 0,26 ммоль) и реакционную смесь перемешивали -20C в течение 1,5 ч. К реакционной смеси добавляли насыщенный водный раствор NH4Cl (4 мл) и EtOAc (7 мл). Слои разделяли и водный слой экстрагировали с помощьюEtOAc (25 мл). Объединенные органические слои сушили над Na2SO4, концентрировали и затем очищали с помощью флэш-хроматографии (диоксид кремния, 04% МеОН/CH2Cl2). 15 мг неочищенной [1-(6 хлорпиридазин-3-ил)-1-метилэтил]амида 2-метилпропан-2-сульфиновой кислоты выделяли в виде светло-коричневого твердого вещества. Это вещество использовали без дополнительной очистки. Неочищенный [1-(6-хлорпиридазин-3-ил)-1-метилэтил]амид 2-метилпропан-2-сульфиновой кислоты (15 мг, 0,054 ммоль) объединяли с комплексом Pd(dppf)Cl2 дихлорметан (4,7 мг, 0,006 ммоль), 1 МK3PO4 (0,07 мл, 0,07 ммоль) и 2-(гидроксиметил)пиридин-5-бороновой кислотой (18 мг, 0,12 ммоль) в сосуде для микроволновой печи. Добавляли смесь 7:3:2 ДМЭ/H2O/EtOH (1 мл). Сосуд продували аргоном и герметизировали. Затем этот сосуд нагревали в микроволновом реакторе в течение 15 мин при 140C. Реакционную смесь разбавляли с помощью 2 мл воды и экстрагировали с помощью EtOAc 44 мл. Объединенные органические слои сушили над MgSO4, фильтровали и концентрировали. Очистка с помощью флэш-хроматографии с нормальной фазой на силикагеле (04% МеОН/CH2Cl2) давала 4 мг 1-[6-(6-гидроксиметилпиридин-3-ил)пиридазин-3-ил]-1-метилэтиламида 2-метилпропан-2 сульфиновой кислоты в виде коричневого твердого вещества. 1-[6-(6-Гидроксиметилпиридин-3 ил)пиридазин-3-ил]-1-метилэтиламид 2-метилпропан-2-сульфиновой кислоты (4 мг, 0,011 ммоль) растворяли в CH2Cl2 (0,25 мл) и добавляли 4 М HCl в диоксане (2 мл, 8 ммоль). Через 45 мин растворитель удаляли в потоке N2 и получали 5-[6-(1-амино-1-метилэтил)пиридазин-3-ил]пиридин-2 илметанолдигидрохлорид в виде неочищенного светло-коричневого твердого остатка. Его использовали без дополнительной очистки. 3-Диметиламино-2-йодпропеналь К раствору 3-диметиламинопропеналя (1,5 мл, 15 ммоль) в CH2Cl2 (60 мл) при комнатной темпера- 25019990 туре одной порцией добавляли N-йодсукцинимид (3,38 г, 15 ммоль) в виде твердого вещества. Реакционную смесь перемешивали в течение 1 ч, затем добавляли CH2Cl2 (25 мл). Реакционную смесь промывали насыщенным водным раствором Na2S2O3 (175 мл) и водой (250 мл). Органическую фазу сушили надNa2SO4, концентрировали и получали черное твердое вещество. Перекристаллизовали из смеси 3-Диметиламинопропеналь (50 мл, 500 ммоль) растворяли в CHCl3 (400 мл) при комнатной температуре. Шприцем в течение 5 мин добавляли неразведенный бром (25,7 мл, 500 ммоль). Через 30 мин реакционную смесь выливали в 200 мл насыщенного водного раствора Na2S2O3 и 200 мл насыщенного раствора NaHCO3. Эту смесь экстрагировали с помощью CH2Cl2 (3100 мл). Объединенные органические слои сушили над MgSO4, концентрировали и получали темное твердое вещество. Это твердое вещество растворяли в EtOAc (200 мл) и нерастворимые вещества отфильтровывали. Фильтрат концентрировали в вакууме и полученное твердое вещество промывали смесью 50% EtOAc/гексаны и получали 50,0 г искомого соединения в виде бледно-желтого твердого вещества; m/z 178,28 [М+Н]+. 1-[1-(5-Йодпиримидин-2-ил)циклопропилкарбамоил]циклопропиламид (R)-5-(4-цианобензил)-7(3,5-дихлор-4-фторфенил)-5-метил-6-оксо-6,7-дигидро-5 Н-имидазо[1,2-а]имидазол-3-карбоновой кислоты К суспензии 1-[(трет-бутоксикарбонил)амино]циклопропанкарбоновой кислоты (1,7 г, 8,43 ммоль),HATU (3,5 г, 9,3 ммоль) и 1-аминоциклопропанкарбонитрилгидрохлорида (1,0 г, 8,43 ммоль) в ТГФ (34 мл) добавляли триэтиламин (3,5 мл, 25,3 ммоль). Желтую суспензию перемешивали при комнатной температуре в течение 18 ч, затем большую часть ТГФ удаляли в вакууме. Оставшуюся взвесь разбавляли с помощью 150 мл 10% (мас./мас.) водного раствора Na2CO3 и 150 мл EtOAc. Слои разделяли и органическую фазу промывали 10% (мас./мас.) водным раствором Na2CO3 (2100 мл). Органическую фазу промывали рассолом (175 мл), сушили над Na2SO4, фильтровали, концентрировали и получали неочищенное светло-оранжевое твердое вещество. Это твердое вещество растирали с Et2O и белое твердое вещество отфильтровывали с использованием Et2O для промывки и получали 1,8 г трет-бутилового эфира [1-(1 цианоциклопропилкарбамоил)циклопропил]карбаминовой кислоты в виде почти белого твердого вещества; m/z 266,5 [М+Н]+. К раствору трет-бутилового эфира [1-(1-цианоциклопропилкарбамоил)циклопропил]карбаминовой кислоты (250 мг, 0,942 ммоль) в безводном EtOH (2,4 мл) шприцем одной порцией добавляли NaOEt (21 мас.% в EtOH, 0,70 мл, 1,9 ммоль). Оранжевую реакционную смесь перемешивали в течение 1 ч. К оранжевому раствору добавляли твердый NH4Cl (202 мг, 3,77 ммоль) и NH3 (7 M в МеОН, 0,14 мл, 0,94 ммоль). Реакционный сосуд герметизировали и перемешивали при комнатной температуре в течение 15 ч. Полученную суспензию фильтровали и промывая с помощью EtOH. Фильтрат концентрировали, полученное твердое вещество растирали с EtOAc и получали 182 мг гидрохлорида трет-бутилового эфира[1-(1-карбамимидоилциклопропилкарбамоил)циклопропил]карбаминовой кислоты в виде белого твердого вещества; m/z 283,6 [М+Н]+. К раствору гидрохлорида трет-бутилового эфира[1-(1- 26019990 карбамимидоилциклопропилкарбамоил)циклопропил]карбаминовой кислоты (1,65 г, 5,2 ммоль) в безводном EtOH (21 мл) добавляли 3-диметиламино-2-йодпропеналь (1,3 г, 5,63 ммоль) и 2 М диметиламин в ТГФ (3,36 мл, 6,7 ммоль). Сосуд закрывали и нагревали при 70C в течение ночи. Через 18 ч EtOH удаляли в вакууме и темно-оранжевый остаток растирали с 5% /iPrOH в EtOAc. Желтое твердое вещество отфильтровывали. Фильтрат концентрировали в вакууме и очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле (05% МеОН/CH2Cl2) и получали черное масло. Это масло обрабатывали с помощью Et2O и осаждали белое твердое вещество. Твердое вещество отфильтровывали и фильтрат повторно обрабатывали и получали еще порцию немного более темного твердого вещества. Всего выделяли 426 мг трет-бутилового эфира 1-[1-(5-йодпиримидин-2-ил)циклопропилкарбамоил]циклопропилкарбаминовой кислоты; m/z 445,5 [М+Н]+. трет-Бутиловый эфир 1-[1-(5-йодпиримидин-2-ил)циклопропилкарбамоил]циклопропилкарбаминовой кислоты (426 мг, 0,96 ммоль) растворяли в CH2Cl2 (2 мл) и добавляли 4 М HCl в диоксане 3 мл, 6 ммоль). Через 90 мин летучие вещества удаляли при 60C в потоке N2. Полученное белое твердое вещество сушили в вакууме в течение ночи и получали 400 мг неочищенного [1-(5-йодпиримидин-2 ил)циклопропил]амиддигидрохлорида 1-аминоциклопропанкарбоновой кислоты. Это вещество использовали без дополнительной очистки. К [1-(5-йодпиримидин-2-ил)циклопропил]амиддигидрохлориду 1-аминоциклопропанкарбоновой кислоты (400 мг, 0,96 ммоль) добавляли 1 мл сухого ТГФ и триэтиламин (0,71 мл, 3,98 ммоль). Неочищенный (R)-5-(4-цианобензил)-7-(3,5-дихлор-4-фторфенил)-5-метил-6-оксо-6,7-дигидро-5H-имидазо[1,2a]имидазол-3-карбонилхлорид (476 мг, 1,0 ммоль) растворяли в 2 мл сухого ТГФ и переносили в колбу с реакционной смесью. Через 2 ч растворитель удаляли при 55C в потоке N2. Полученную взвесь разбавляли с помощью EtOAc (75 мл) и промывали 10% водным раствором лимонной кислоты (75 мл) и насыщенным водным раствором NaHCO3 (75 мл). Органический слой сушили над Na2SO4, концентрировали и получали светло-оранжевое вспененное вещество. Это твердое вещество очищали с помощью флэшхроматографии с нормальной фазой на силикагеле (13% МеОН/CH2Cl2) и получали 767 мг искомого соединения в виде желтовато-коричневого порошкообразного вещества; m/z 785,5. 1-(5-Бромпиримидин-2-ил)циклопропиламиндигидрохлорид Гидрохлорид трет-бутилового эфира [1-(1-карбамимидоилциклопропилкарбамоил)циклопропил]карбаминовой кислоты (1,0 г, 4,2 ммоль) (получали из (1-цианоциклопропил)карбаминовой кислоты трет-бутилового эфира по методике, аналогичной использованной для получения трет-бутилового эфира[1-(1-карбамимидоилциклопропилкарбамоил)циклопропил]карбаминовой кислоты) и 2-бром-3 диметиламиноакролеин (1,1 г, 6,36 ммоль) объединяли в EtOH (2 мл) в герметизированной пробирке. Реакционный сосуд закрывали и смесь нагревали при 80C в течение 24 ч. Полученной черной смеси давали охладиться до комнатной температуры. Затем к раствору реакционной смеси добавляли метанол(20 мл). Твердые вещества отфильтровывали и полученный раствор сушили при пониженном давлении. Остаток разбавляли с помощью 50 мл CH2Cl2 и твердое вещество удаляли. Раствор концентрировали и очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле (0 50% EtOAc в гексанах) и получали 800 мг трет-бутилового эфира [1-(5-бромпиримидин-2-ил)циклопропил]карбаминовой кислоты в виде почти белого твердого вещества. трет-Бутиловый эфир [1-(5-бромпиримидин-2-ил)циклопропил]карбаминовой кислоты (1,18 г, 3,76 ммоль) растворяли в CH2Cl2 (5 мл) при комнатной температуре. Добавляли 4 М HCl в диоксане (9,4 мл,37,6 ммоль). Через 2 ч растворители удаляли с помощью потока N2 и получали искомое соединение в виде твердого вещества; m/z 216,3. Неочищенное вещество использовали без очистки на следующих стадиях. Общая методика. Реакция Судзуки/удаление защитной группы Boc. 1-[5-(1-Метил-1H-пиразол-4-ил)пиридин-2-ил]циклопропиламиндигидрохлорид- 27019990 мг, 1,39 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола (433 мг, 2,1 ммоль) и комплекса Pd(dppf)Cl2 дихлорметан (113 мг, 0,14 ммоль) в 1,5 мл ДМЭ/Н 2 О/EtOH (7:3:2) в герметизируемой пробирке для микроволновой печи добавляли 1 М водный раствор K3PO4 (2,1 мл). Пробирку герметизировали и нагревали в микроволновой печи при 100C в течение 10 мин. Неочищенную реакционную смесь фильтровали через слой силикагеля, промывали с помощью МеОН и концентрировали. Остаток подвергали распределению между 30 мл EtOAc и 10 мл воды. Органическую фазу промывали рассолом, сушили над Na2SO4, фильтровали, концентрировали и получали масло. Это вещество очищали с помощью флэш-хроматографии с нормальной фазой на силикагеле (03,5% МеОН/CH2Cl2) и получали 0,55 г трет-бутилового эфира 1-[5-(1-метил-1H-пиразол-4-ил)пиридин-2 ил]циклопропилкарбаминовой кислоты в виде коричневого твердого вещества. Соединение использовали на следующих стадиях без дополнительной очистки. К раствору трет-бутилового эфира 1-[5-(1-метил-1H-пиразол-4-ил)пиридин-2 ил]циклопропилкарбаминовой кислоты (1,1 г, 3,5 ммоль) в CH2Cl2 (15 мл) добавляли 4,0 М HCl в диоксане (4,35 мл, 17,5 ммоль). После перемешивания в течение ночи к раствору дополнительно добавляли 4,0 М HCl в диоксане (4,35 мл, 17,5 ммоль). Еще через 12 ч раствор концентрировали в вакууме и получали 800 мг искомого соединения. Следующие соединения получали по методикам, аналогичным описанным выше: 1-[5-(6-метилпиридин-3-ил)пиримидин-2-ил]циклопропиламин; 5-[2-(1-аминоциклопропил)пиримидин-5-ил]пиридин-2-илметанол; 1-[5-(1,3-диметил-1H-пиразол-4-ил)пиримидин-2-ил]циклопропиламин; 1-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]циклопропиламин; 1-[5-(4-метансульфонилфенил)пиридин-2-ил]циклопропиламин; 4-[6-(1-аминоциклопропил)пиридин-3-ил]фенилметанол;EtOH (96%, 1,5 мл) и шприцем одной порцией добавляли 3-диметиламинопропеналь (0,10 мл, 1,0 ммоль). Суспензию перемешивали при 70C в течение 16 ч затем ей давали охладиться до комнатной температуры. Реакционную смесь разбавляли насыщенным водным раствором NaHCO3 (3 мл) и экстрагировали с помощью EtOAc (45 мл). Объединенные органические слои сушили над Na2SO4, концентрировали в роторном испарителе без нагревания образца и получали 1-циклопропил-1 Н-пиразол в виде летучей жидкости, которую использовали без дополнительной очистки; m/z 109,4 [М+Н]+. К раствору неочищенного 1-циклопропил-1H-пиразола (108 мг, 1,00 ммоль) в CHCl3 (4 мл) при комнатной температуре шприцем добавляли Br2 (51 мкл, 1,0 ммоль). Оранжевый раствор перемешивали в течение 1 ч. Реакционную смесь разбавляли насыщенным водным раствором Na2S2O3 (3 мл) и насыщенным водным раствором NaHCO3 (3 мл). Смесь экстрагировали с помощью CH2Cl2 (35 мл). Объединенные органические слои сушили над Na2SO4, концентрировали в роторном испарителе без нагревания образца и получали 4-бром-1-циклопропил-1H-пиразол в виде летучей светло-желтой жидкости, которую использовали без дополнительной очистки; m/z 187,3 [М+Н]+.Pd(dppf)Cl2 дихлорметан (89 мг, 0,11 ммоль) объединяли в сосуде для микроволновой печи. Добавляли 4 бром-1-циклопропил-1H-пиразол и ДМФ (4 мл) и сосуд продували аргоном и герметизировали. Реакционную смесь нагревали в микроволновой печи в течение 60 мин при 150C. Реакционную смесь разбавляли с помощью 10 мл воды и экстрагировали с помощью 310 мл EtOAc. Объединенные органические слои сушили над Na2SO4, концентрировали и получали 120 мг искомого соединения в виде темного масла; m/z 235,4 [М+Н]+. 1-[6-(1-Метил-1 Н-пиразол-4-ил)пиридазин-3-ил]циклопропиламиндигидрохлорид К раствору трет-бутилового эфира (1-фуран-2-илциклопропил)карбаминовой кислоты (4,30 г, 19,3 ммоль) в безводном ДМФ (77 мл) при комнатной температуре одной порцией добавляли Nйодсукцинимид (4,77 г, 21,2 ммоль) в виде твердого вещества. Реакционную смесь перемешивали в течение 2,5 ч и за это время возникала темно-красная окраска. Реакционную смесь разбавляли насыщенным водным раствором Na2S2O3 (75 мл), водой (75 мл) и диэтиловым эфиром (100 мл). Слои разделяли и водный слой экстрагировали диэтиловым эфиром (2100 мл). Объединенные органические слои сушили надNa2SO4 и концентрировали. Полученное твердое вещество растирали с гексанами и получали 4,9 г [1-(5 йод-фуран-2-ил)циклопропил]карбаминовой кислоты трет-бутилового эфира в виде светло-желтого порошкообразного вещества; m/z 350,5 [М+Н]+. трет-Бутиловый эфир [1-(5-йод-фуран-2-ил)циклопропил]карбаминовой кислоты (200 мг, 0,57 ммоль), комплекс Pd(dppf)Cl2 дихлорметан (46 мг, 0,057 ммоль), K3PO4 (145 мг, 0,69 ммоль) и 1-метил-4(4,4,5,5-тетраметил-1,3,2-диоксаборолан)-1H-пиразол (179 мг, 0,86 ммоль) помещали в сосуд для микроволновой печи. Добавляли ДМЭ (1,5 мл), воду (0,6 мл), EtOH (0,5 мл) и сосуд продували аргоном и затем герметизировали. Реакционную смесь нагревали в микроволновой печи при 100C в течение 10 мин. Реакционную смесь разбавляли водой (5 мл) и экстрагировали с помощью EtOAc (35 мл). Органическую фазу сушили над MgSO4, фильтровали, концентрировали и получали черный остаток. Очистка с помощью флэш-хроматографии с нормальной фазой на силикагеле (04,5% МеОН/CH2Cl2) давала 226 мг 1[5-(1-метил-1H-пиразол-4-ил)фуран-2-ил]циклопропилкарбаминовой кислоты трет-бутилового эфира;m/z 304,6 [М+Н]+, в виде красного полужидкого остатка. В круглодонной колбе трет-бутиловый эфир 1-[5-(1-метил-1H-пиразол-4-ил)фуран-2 ил]циклопропилкарбаминовой кислоты (226 мг, 0,745 ммоль) растворяли в смеси ТГФ (12,4 мл) и воды(1,3 мл). Колбу охлаждали до -35C в бане твердый диоксид углерода/ацетон (смесь становилась густой взвесью) и затем одной порцией добавляли N-бромсукцинимид (146 мг, 0,819 ммоль) в виде твердого вещества. Реакционная смесь сразу приобретала ярко-желтый цвет. Реакционную смесь перемешивали в течение 15 мин при этой температуре и затем одной порцией шприцем добавляли безводный гидразин(0,21 мл, 6,7 ммоль). Баню со льдом удаляли и реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Летучие вещества удаляли при 50C в потоке N2. Полученный остаток очищали с помощью флэш-хроматографии (диоксид кремния, 90100% EtOAc/гексаны) и получали 51 мг третбутилового эфира 1-[6-(1-метил-1H-пиразол-4-ил)пиридазин-3-ил]циклопропилкарбаминовой кислоты в виде ярко-желтого твердого вещества; m/z 316,6 [М+Н]+. трет-Бутиловый эфир 1-[6-(1-метил-1H-пиразол-4-ил)пиридазин-3-ил]циклопропилкарбаминовой кислоты (51 мг, 0,16 ммоль) растворяли в CH2Cl2 (1 мл) и добавляли 4 М HCl в диоксане (2 мл, 4 ммоль). Через 2 ч растворители удаляли в потоке N2 и получали искомое соединение в виде оранжевого твердого вещества; m/z 216,4 [М+Н]+. Следующие соединения получали по методикам, аналогичным описанным выше: 1-[6-(4-фторфенил)пиридазин-3-ил]циклопропиламиндигидрохлорид; m/z 230,4 [М+Н]+; 4-[6-(1-аминоциклопропил)пиридазин-3-ил]фенилметанол; m/z 242,3 [М+Н]+; 1-[6-(1 Н-пиразол-4-ил)пиридазин-3-ил]циклопропиламиндигидрохлорид; m/z 202,4 [М+Н]+; 1-[6-(3-циклопропил-1-метил-1 Н-пиразол-4-ил)пиридазин-3-ил]циклопропиламиндигидрохлорид;
МПК / Метки
МПК: A61K 31/4375, C07D 471/04, A61P 29/00, A61K 31/506, A61K 31/501, A61K 31/4439, C07D 487/04
Метки: амидов, производные, 6,7-дигидро-5h-имидазо[1,2-a]имидазол-3-карбоновой, кислоты
Код ссылки
<a href="https://eas.patents.su/30-19990-proizvodnye-amidov-67-digidro-5h-imidazo12-aimidazol-3-karbonovojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Производные амидов 6,7-дигидро-5h-имидазо[1,2-a]имидазол-3-карбоновой кислоты</a>












