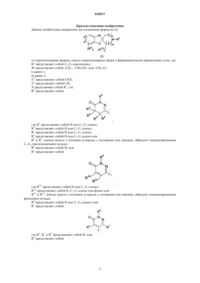
Замещенные спироциклические производные пиперидина как лиганды гистамин-3 (h3) рецептора
Номер патента: 18537
Опубликовано: 30.08.2013
Авторы: Данду Реддеппаредди, Сундар Бабу Г., Хадкинз Роберт Л.
Формула / Реферат
1. Соединение формулы (I)
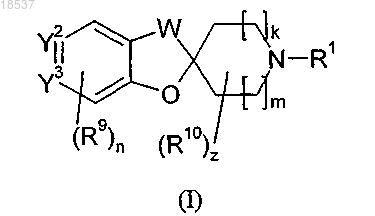
или его стереоизомерная форма, смесь стереоизомерных форм или его фармацевтически приемлемая соль, где
R1 представляет собой С3-С8-циклоалкил;
W представляет собой -CH2-, -CH2CH2- или -CH2-O-;
k равно 1;
m равно 1;
Y2 представляет собой CHX;
Y3 представляет собой CH;
X представляет собой R2, где
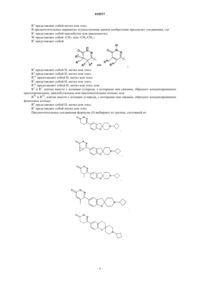
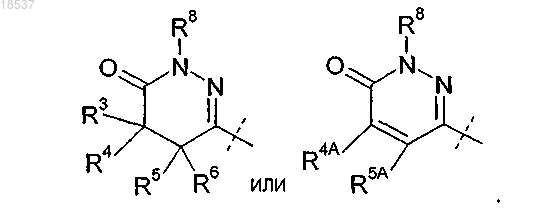
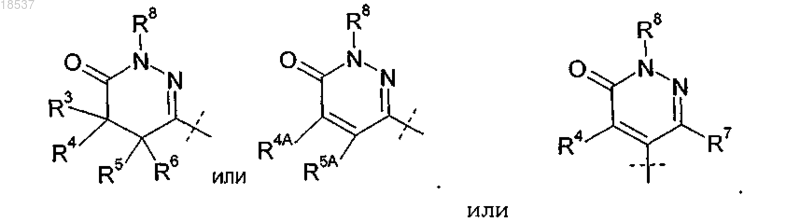
R2 представляет собой
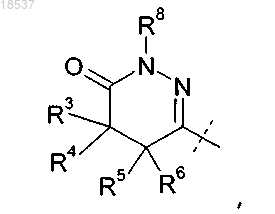
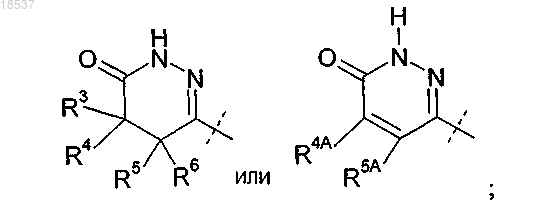
где R3 представляет собой H или C1-C4-алкил;
R4 представляет собой H или C1-C4-алкил;
R5 представляет собой H или C1-C4-алкил;
R6 представляет собой H или C1-C4-алкил или
R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное C3-C6-циклоалкильное кольцо;
R8 представляет собой H; или
R2 представляет собой
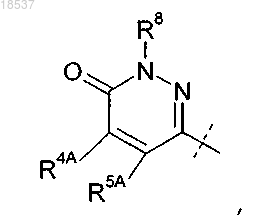
где R4A представляет собой H или C1-C4-алкил;
R5A представляет собой Н, C1-C4-алкил или фенил или
R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;
R8 представляет собой H или C1-C6-алкил; или
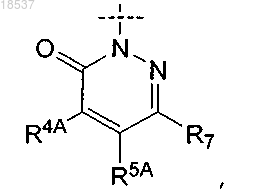
R2 представляет собой
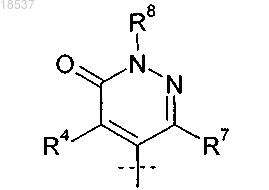
где R4, R7 и R8 представляют собой H; или
R2 представляет собой
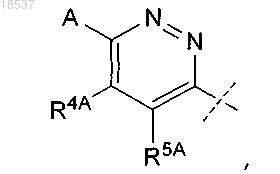
где A представляет собой F, Cl или Br;
R4A и R5A представляют собой H; или
X представляет собой -OR2, где
R2 представляет собой
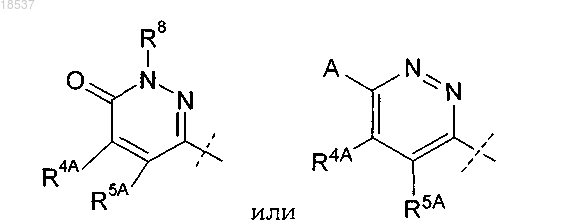
где R4A представляет собой H;
R5A представляет собой H;
R8 представляет собой H;
A представляет собой F, Cl или Br; или
X представляет собой -O-(C1-C3-алкил)-R2, где указанный C1-С3-алкил необязательно замещен -OH; где
R2 представляет собой
где R4A, R5A и R7 представляют собой H;
R9 представляет собой C1-C4-алкил;
n равно 0 или 1;
z равно 0.
2. Соединение по п.1, где W представляет собой -CH2- или -CH2-CH2-.
3. Соединение по п.1, где R2 представляет собой
4. Соединение по п.1, где R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное циклопропильное или циклобутильное кольцо.
5. Соединение по п.1, где R2 представляет собой

где R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо.
6. Соединение по п.1, где X представляет собой R2 или -OR2.
7. Соединение по п.1, где R8 представляет собой H.
8. Соединение по п.1, где R9 представляет собой метил.
9. Соединение по п.1, где n равно 0.
10. Соединение по п.1, где R1 представляет собой циклобутил или циклопентил.
11. Соединение по п.1, где R2 представляет собой
12. Соединение по п.11, где R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное циклопропильное или циклобутильное кольцо.
13. Соединение по п.11, где R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо.
14. Соединение по п.11, где R8 представляет собой H.
15. Соединение по п.1, где
R2 представляет собой
где R3 представляет собой H, метил или этил;
R4 представляет собой H, метил или этил;
R4A представляет собой H, метил или этил;
R5 представляет собой H, метил или этил;
R5A представляет собой H, метил или этил; или
R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное C3-C6-циклоалкильное кольцо; или
R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;
R6 представляет собой H, метил или этил;
R9 представляет собой метил или этил.
16. Соединение по п.1, где
R1 представляет собой циклобутил или циклопентил;
W представляет собой -CH2- или -CH2-CH2-;
R2 представляет собой
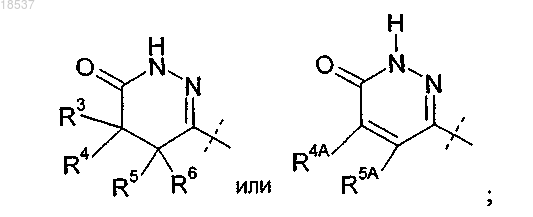
R3 представляет собой H, метил или этил;
R4 представляет собой H, метил или этил;
R4A представляет собой H, метил или этил;
R5 представляет собой H, метил или этил;
R5A представляет собой H, метил или этил; или
R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное циклопропильное, циклобутильное или циклопентильное кольцо; или
R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;
R6 представляет собой H, метил или этил;
R9 представляет собой метил или этил.
17. Соединение по п.1, выбранное из группы, состоящей из
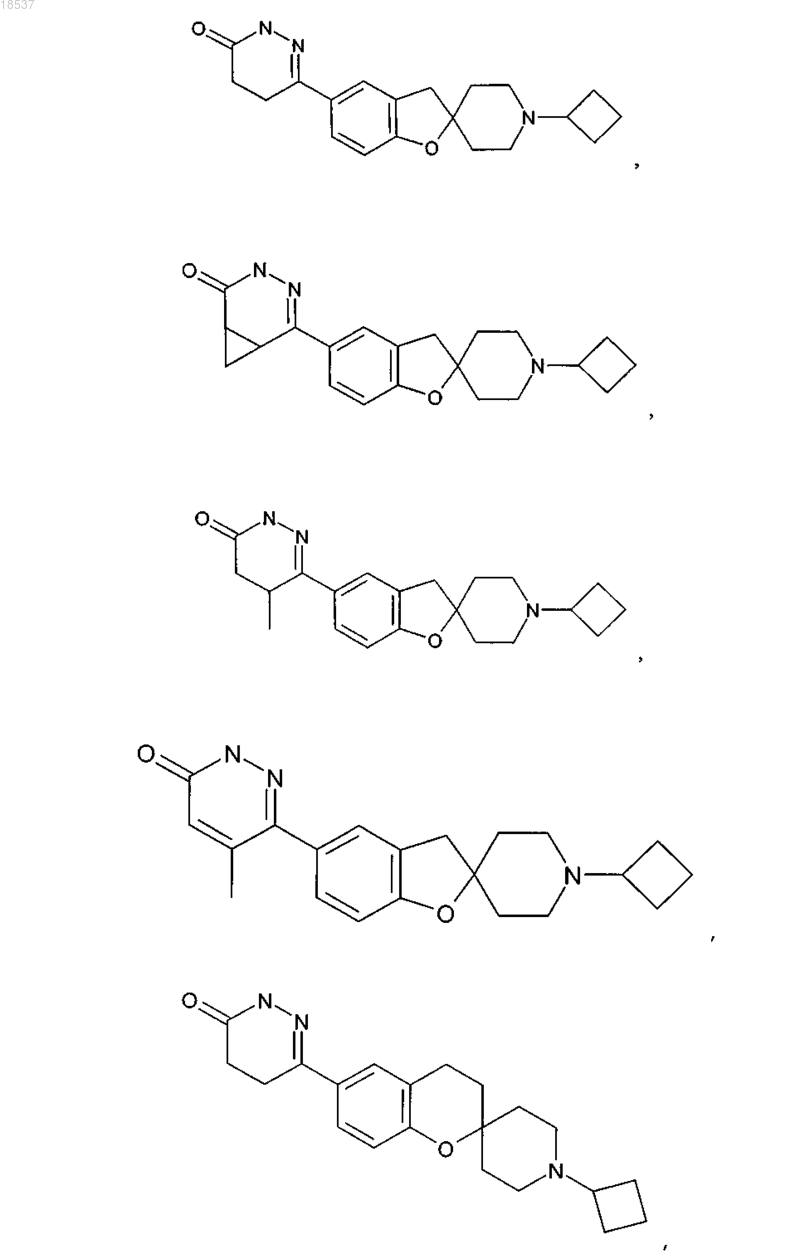
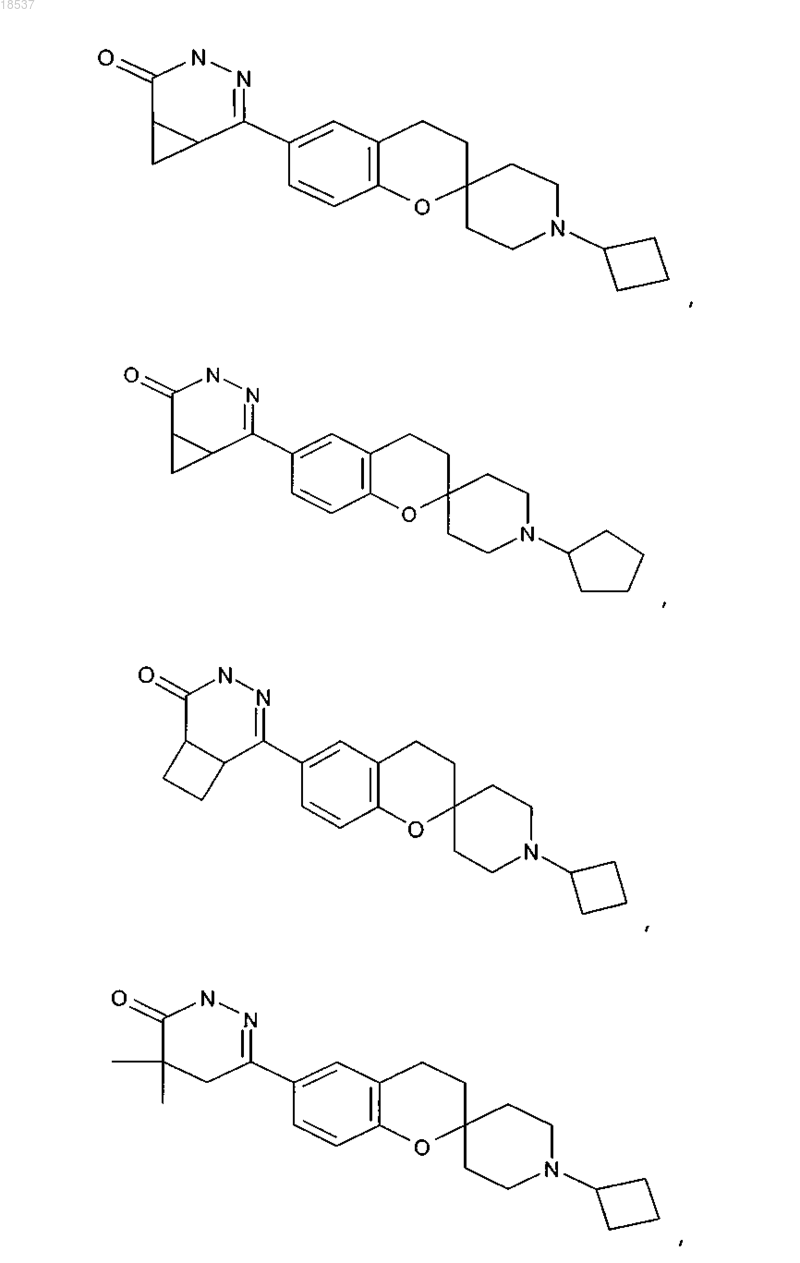
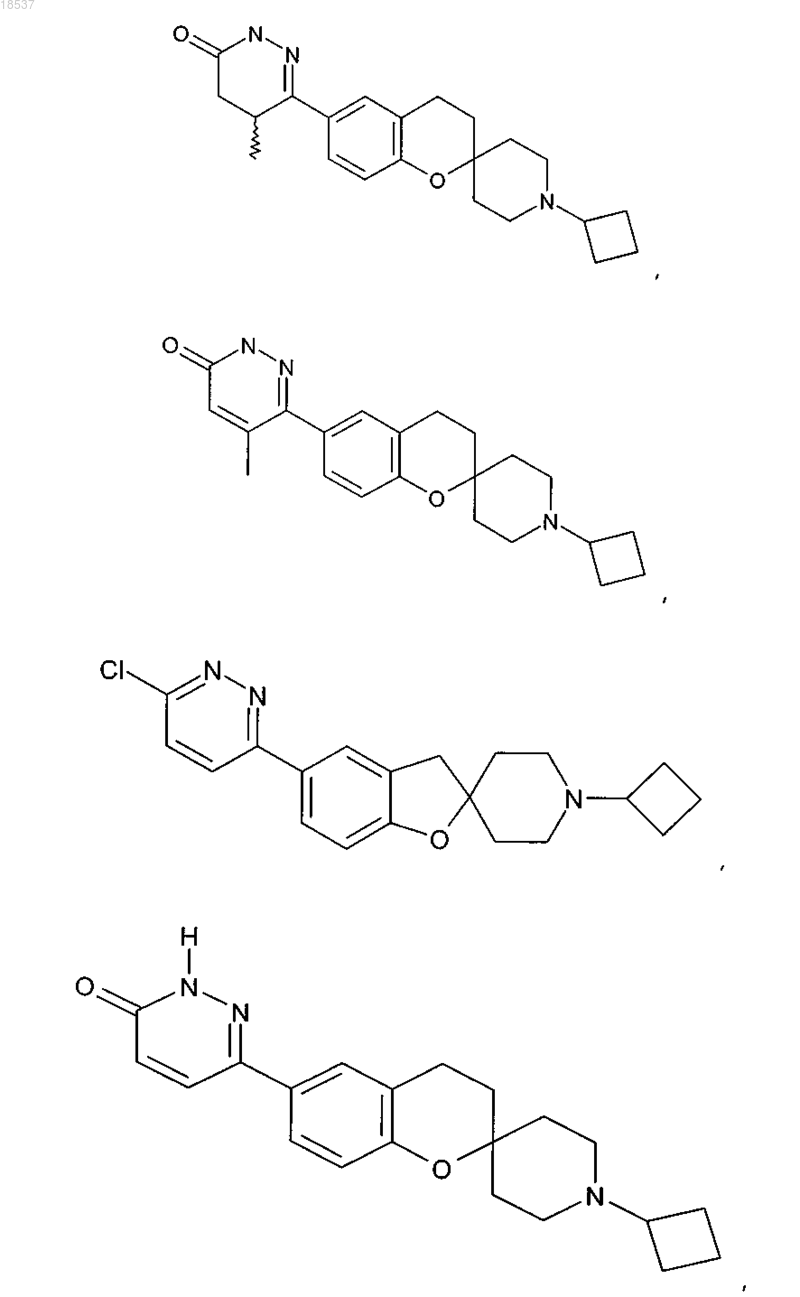

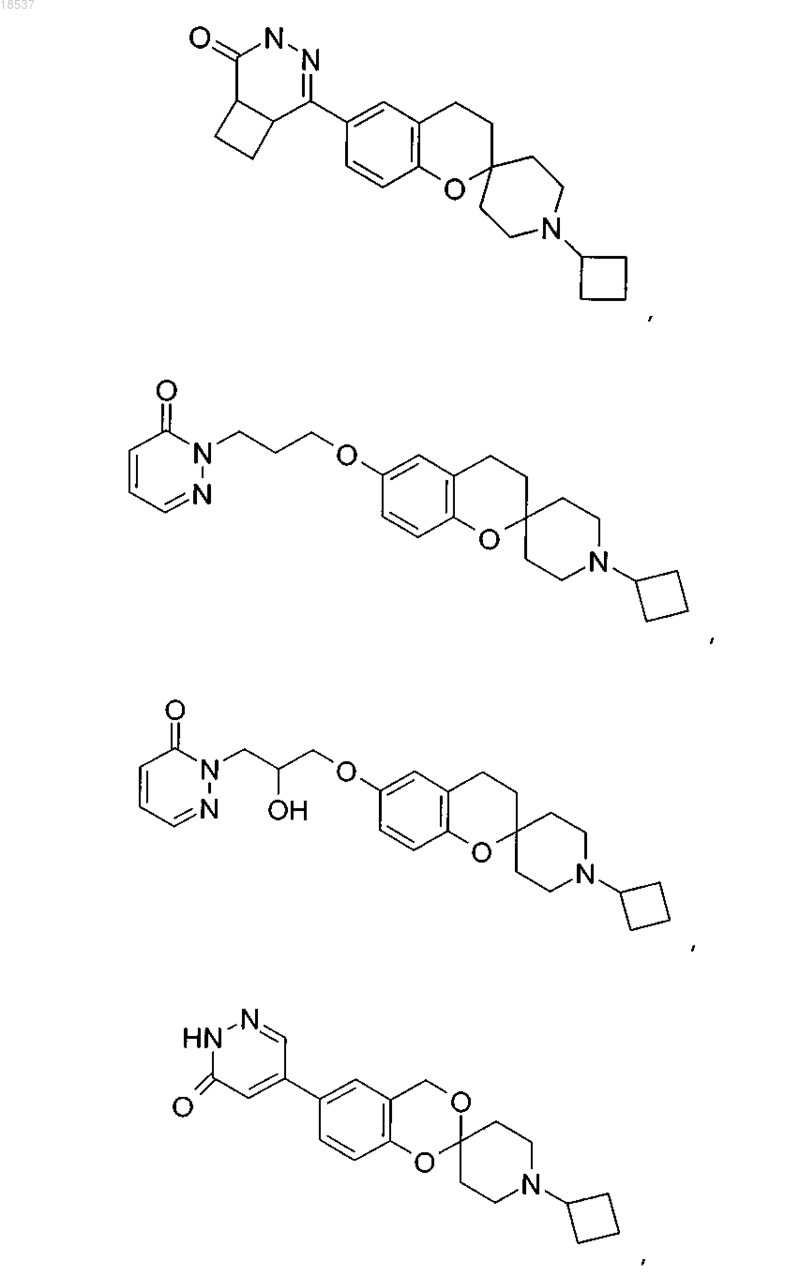
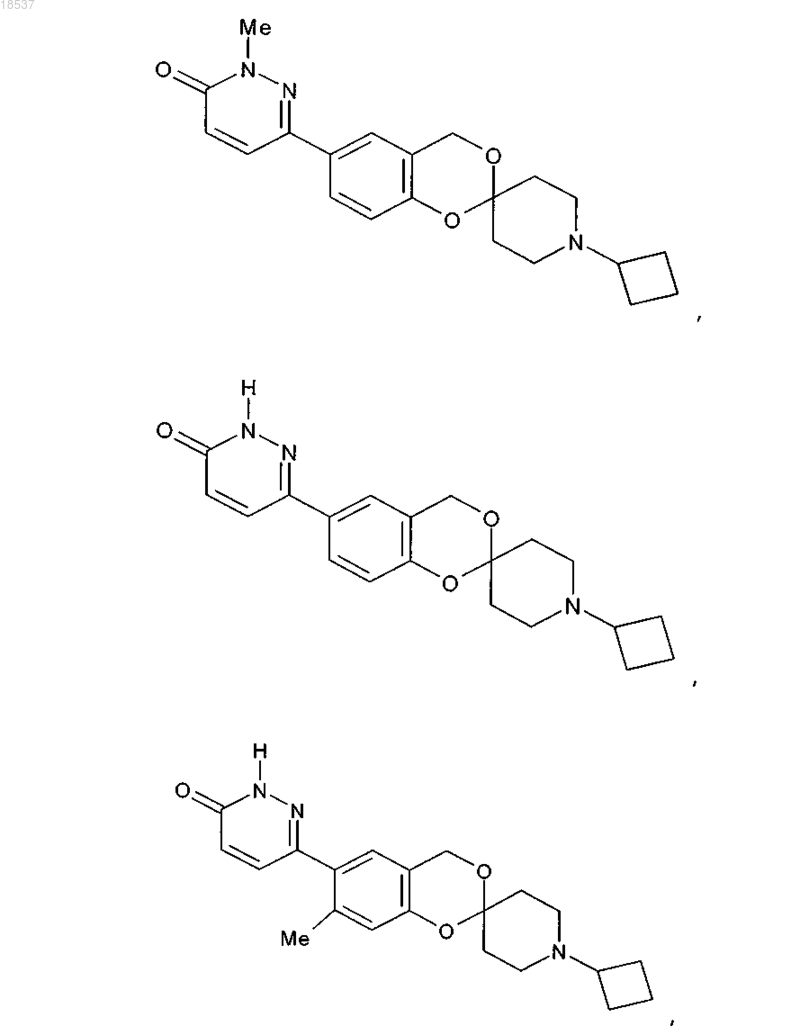
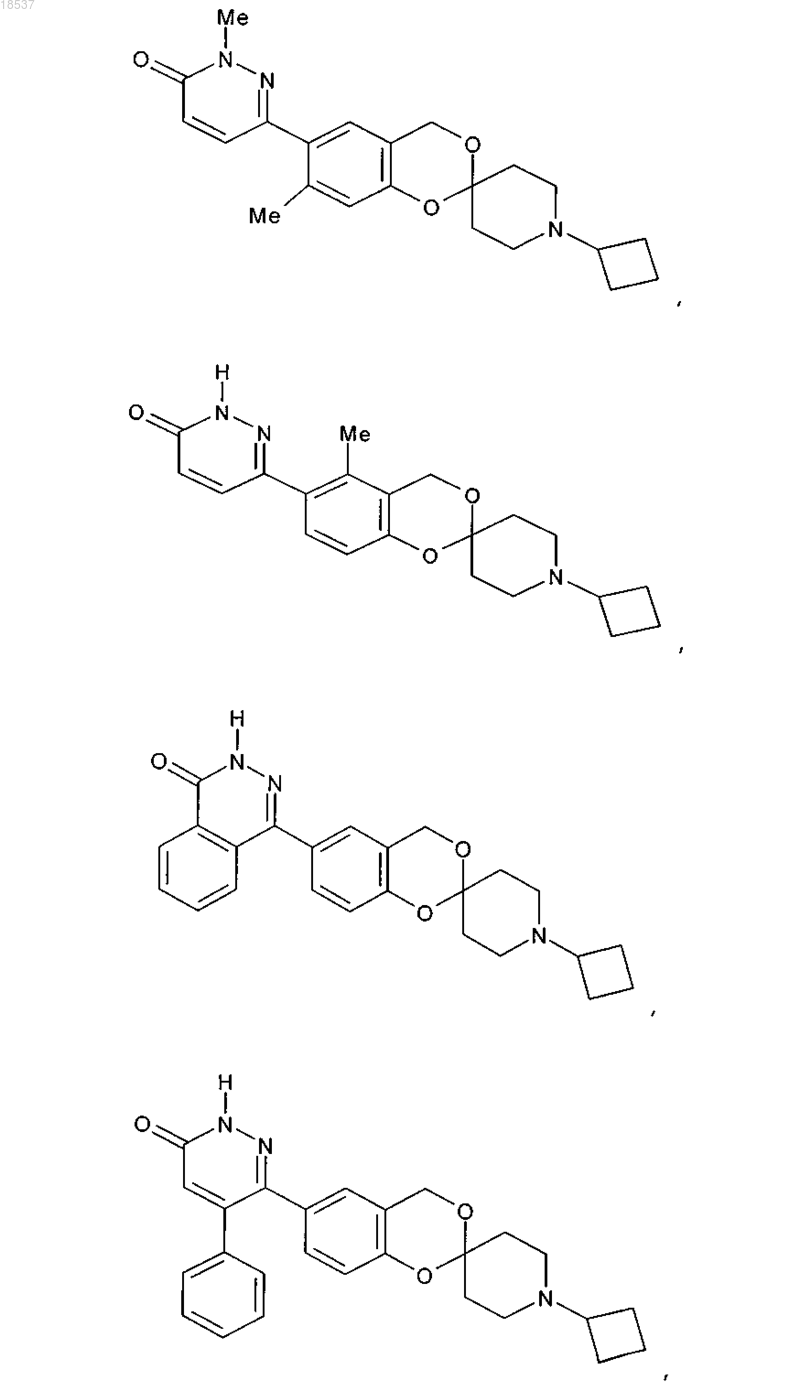
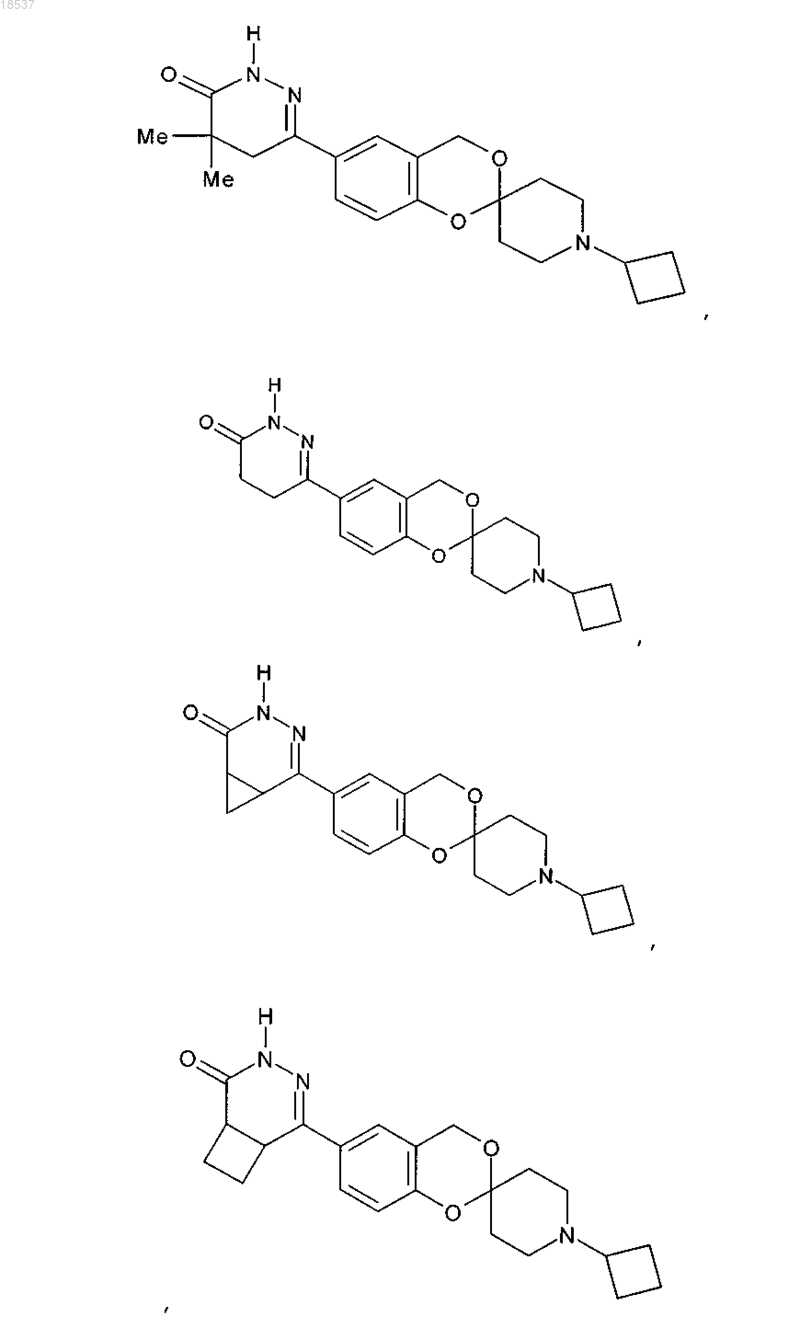
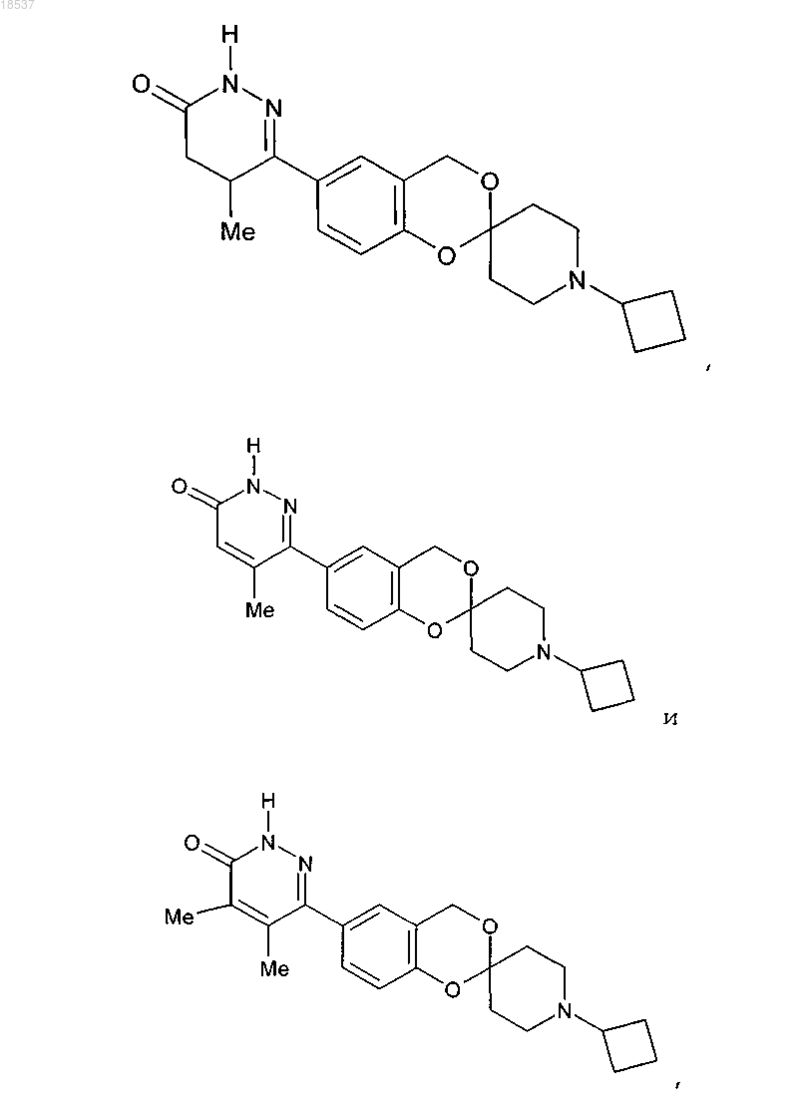
или его стереоизомерная форма, смесь стереоизомерных форм или фармацевтически приемлемая соль.
18. Фармацевтическая композиция, содержащая соединение по п.1 или его стереоизомерную форму, смесь стереоизомерных форм или фармацевтически приемлемую соль и один или несколько фармацевтически приемлемых наполнителей.
19. Способ лечения заболевания, выбранного из группы, состоящей из нарколепсии или расстройства сна/пробуждения, расстройства пищевого поведения, нарушения питания, ожирения, нарушений познавательной способности, расстройств пробуждения, расстройств памяти, расстройства настроения, изменения внимания/настроения, гиперактивности, ассоциированной с дефицитом внимания (ADHD), болезни Альцгеймера/деменции, шизофрении, боли, стресса, мигрени, морской болезни, депрессии, психических расстройств, эпилепсии, расстройств желудочно-кишечного тракта, респираторных расстройств, воспалительных заболеваний и инфаркта миокарда, где указанный способ включает введение индивидууму, нуждающемуся в лечении, терапевтически эффективного количества соединения по п.1 или его стереоизомерной формы, смеси стереоизомерных форм или фармацевтически приемлемой соли.
20. Способ по п.19, где указанным заболеванием является нарколепсия или расстройство сна/пробуждения.
21. Способ по п.19, где указанным заболеванием является гиперактивность, ассоциированная с дефицитом внимания.
22. Способ по п.21, где указанным заболеванием является нарушение познавательной способности.
Текст
ЗАМЕЩЕННЫЕ СПИРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИПЕРИДИНА КАК ЛИГАНДЫ ГИСТАМИН-3 (H3) РЕЦЕПТОРА Изобретение обеспечивает соединения формулы (I) их применение в качестве Н 3 антагонистов/обратных агонистов, способы их получения и их фармацевтические композиции. Область изобретения Данное изобретение относится к замещенным спироциклическим производным пиперидина, их применению в качестве H3 антагонистов/обратных агонистов, способам их получения и их фармацевтическим композициям. Предпосылки изобретения Публикации, цитируемые по всему данному раскрытию, включены в него в полном объеме посредством ссылки. Гистамин является хорошо установленным модулятором нейронной активности. По меньшей мере о четырех подтипах гистаминовых рецепторов сообщено в литературе - H1, Н 2, Н 3, Н 4. Гистаминовые Н 3 рецепторы играют ключевую роль в нейротрансмиссии в центральной нервной системе. Н 3 рецептор был обнаружен в 1983 первоначально на гистамин-содержащих нейронах, где, как было показано, он выполнял пресинаптическую функцию, регулируя высвобождение и синтез биогенного амина, гистамина (Arrang et al., 1983) сейчас хорошо установленного нейротрансмиттера. Н 3 рецепторы преимущественно экспрессируются в мозге, локализируясь в коре головного мозга, миндалевидной железе, гиппокампе, полосатом теле, таламусе и гипоталамусе. Н 3 рецепторы также пресинаптически локализованы на гистаминергических нервных окончаниях и действуют как ингибирующие ауторецепторы (Alguacil и PerezGarcia, 2003; Passani et al., 2004; Leurs et al., 2005; Celanire et al., 2005; Witkin и Nelson, 2004). При активации данных рецепторов с помощью гистамина ингибируется высвобождение гистамина. Н 3 рецепторы также можно обнаружить в периферии (кожа, легкое, сердечно-сосудистая система, кишечник, желудочно-кишечный тракт и т.д.). Н 3 рецепторы также вовлечены в пресинаптическую регуляцию высвобождения ацетилхолина, допамина, ГАБК (гамма-аминобутановая кислота), глутамата и серотонина (см.Repka-Ramirez, 2003; Chazot и Hann, 2001; Leurs et al., 1998). H3 рецептор демонстрирует высокую степень конститутивной или спонтанной активности (например, рецептор активен в отсутствие агонистической стимуляции) in vitro и in vivo, таким образом, лиганды рецептора могут демонстрировать агонистические, нейтрально антагонистические или обратно агонистические эффекты. Размещение и функция гистаминергических нейронов в ЦНС предполагает, что соединения, взаимодействующие с Н 3 рецептором, могут быть полезными во многих терапевтических применениях, которые включают нарколепсию или расстройства сна/бодрствования, пищевое поведение, расстройства питания, ожирение, познание, стимулирование, память, расстройства настроения, изменение внимания настроения, синдром дефицита внимания с гиперактивностью (СДВГ), болезнь Альцгеймера/деменцию,шизофрению, боль, стресс, мигрень, морскую болезнь, депрессию, психические расстройства и эпилепсию (Leurs et al., 2005; Witkin и Nelson, 2004, Hancock и Fox, 2004; Esbenshade et al., 2006). H3 антагонист/обратный агонист может быть важен при желудочно-кишечных расстройствах, респираторных расстройствах, таких как астма, воспаления и инфаркт миокарда.Ohtake et al. (US 2006/0178375 A1) раскрыли соединения, которые, по сообщениям, проявляют агонистическую или обратно агонистическую активность к гистаминовым Н 3 рецепторам и могут быть полезны при лечении или профилактике ожирения, диабетов, нарушений гормональной секреции или расстройств сна.Celanire et al. (WO 2006/103057 A1 и WO 2006/103045) раскрыли соединения, включающие фрагмент оксазолина или тиазолина, способы их получения, их фармацевтические композиции и их применения в качестве Н 3 лигандов.Bertrand et al. (WO 2006/117609 A2) раскрыли новые лиганды гистаминового Н 3 рецептора, способы их получения и их терапевтические применения.Schwartz et al. (WO 2006/103546 A2) раскрыли определенные способы лечения болезни Паркинсона,синдрома обструктивного апноэ во сне, нарколепсии, деменции с тельцами Леви и/или сосудистой деменции с помощью не-имидазольных алкиламиновых производных, которые являются антагонистами Н 3 рецепторов гистамина.Apodaca et al. (EP 1311482 В 1) раскрыли определенные не-имидазольные арилоксипиперидины в качестве лигандов Н 3 рецептора, их синтез и их применение для лечения расстройств и состояний, опосредствованных гистаминовым рецептором.Xu et al. раскрыли определенные 6-замещенные фенил-4,5-дигидро-3(2H)пиридазиноны, их синтез и активность, ингибирующую агрегацию тромбоцитов кроликов, вызванную АДФ (аденозиндифосфорная кислота) in vitro.Barker et al. (US 2006/0217375) раскрывают спиро[бензодиоксан]овые соединения в качестве активных антагонистов орексин-1 рецептора и потенциально полезных в профилактике и лечении расстройств,имеющих отношение к орексин-1 рецептору, и расстройств, имеющих отношение к орексин-2 рецептору. Таким образом, существует потребность в новых классах соединений, которые взаимодействуют с Н 3 рецептором. Краткое описание изобретения Данное изобретение направлено на соединения формулы (I) и стереоизомерные формы, смеси стереоизомерных форм и фармацевтически приемлемые соли, гдеR4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;z равно 0. Данное изобретение также направлено на фармацевтическую композицию, содержащую соединение формулы (I), а также способы фармацевтического применения соединения формулы (I), конкретно в способах лечения различных заболеваний. Детальное описание иллюстративных вариантов осуществления В предпочтительных вариантах осуществления данное изобретение предлагает соединения формулы (I) или стереоизомерную форму, смеси стереоизомерных форм или их фармацевтически приемлемые соли, где W представляет собой -CH2- или -CH2-CH2-. В предпочтительных вариантах осуществления данное изобретение предлагает новые соединения формулы (I) и стереоизомерные формы, смеси стереоизомерных форм или их фармацевтически приемлемые соли, где R2 представляет собой В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где R4 иR , взятые вместе с атомами углерода, с которым они связаны, образуют конденсированное циклопропильное или циклобутильное кольцо. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где R2 представляет собой 5 где R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где X представляет собой R2 или -OR2. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где R8 представляет собой H. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где R9 представляет собой метил. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где n равно 0. Предпочтительные варианты осуществления данного изобретения включают таковые, где R1 представляет собой циклобутил или циклопентил. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, где R2 представляет собой Также предпочтительными в данном изобретении являются такие соединения, где R4 и R5, взятые вместе с атомами углерода, с которым они связаны, образуют конденсированное циклопропильное или циклобутильное кольцо. Также предпочтительными являются такие соединения, где R4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо. В других предпочтительных соединениях данного изобретения R8 представляет собой H. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, гдеR4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;R9 представляет собой метил или этил. В предпочтительных вариантах осуществления данное изобретение предлагает соединения, гдеR1 представляет собой циклобутил или циклопентил;R4 и R5, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное циклопропильное, циклобутильное или циклопентильное кольцо; илиR4A и R5A, взятые вместе с атомами углерода, с которыми они связаны, образуют конденсированное фенильное кольцо;R9 представляет собой метил или этил. Предпочтительные соединения формулы (I) выбирают из группы, состоящей из или их стереоизомерной формы, смеси стереоизомерных форм или фармацевтически приемлемой соли. В другом варианте осуществления данное изобретение обеспечивает фармацевтические композиции, включающие соединение по настоящему изобретению и одно или более фармацевтически приемлемых наполнителей. В дополнительном варианте осуществления данное изобретение обеспечивает способ лечения расстройства, выбранного из группы, содержащей нарколепсию или расстройства сон/бодрствование, расстройства пищевого поведения, расстройства питания, ожирение, когнитивные расстройства, расстройства пробуждения, расстройства памяти, расстройства настроения, изменение внимания настроения,синдром дефицита внимания с гиперактивностью (СДВГ), болезнь Альцгеймера/деменцию, шизофрению, боль, стресс, мигрень, морскую болезнь, депрессию, психические расстройства, эпилепсию, желудочно-кишечные расстройства, респираторные расстройства, воспаление и инфаркт миокарда, включающий введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения данного изобретения. В предпочтительном варианте осуществления данное изобретение обеспечивает способ лечения нарколепсии или расстройств сон/бодрствование. В предпочтительном варианте осуществления данное изобретение обеспечивает способ лечения синдрома дефицита внимания с гиперактивностью. В предпочтительном варианте осуществления данное изобретение обеспечивает способ лечения нарушения познавательной способности. Таким образом, соединения данного изобретения пригодны для применения в терапии. Соединения данного изобретения могут найти применение в производстве лекарственного средства для лечения расстройства, выбранного из группы, содержащей нарколепсию или расстройства сон/бодрствование, расстройства пищевого поведения, расстройства питания, ожирение, когнитивные расстройства, расстройства пробуждения, расстройства памяти, расстройства настроения, изменение внимания настроения, синдром дефицита внимания с гиперактивностью (СДВГ), болезнь Альцгеймера/деменцию, шизофрению, боль, стресс, мигрень, морскую болезнь, депрессию, психические расстройства, эпилепсию, желудочно-кишечные расстройства, респираторные расстройства, воспаление и инфаркт миокарда. Определения. В формулах, описанных и заявленных здесь, имеется в виду, что когда какой-либо символ появляется больше, чем один раз в отдельной формуле или заместителе, его значение в каждом случае является независимым от других. Следующие выражения и термины имеют указанные значения. Применяемое здесь выражение "приблизительно" указывает на диапазон величин от 10% заданной величины. Например, фраза "приблизительно 50" включает 10% 50, или от 45 до 55. Фраза "от приблизительно 10 до 100" включает 10% от 10 и 10% от 100, или от 9 до 110. Применяемый здесь диапазон величин в форме "x-y", или "от x до y", или "с x по y" включает целые числа x, y и целые числа между ними. Например, фразы "1-6", или "от 1 до 6", или "с 1 по 6" обозначают,что включены целые числа 1, 2, 3, 4, 5 и 6. Предпочтительные варианты осуществления включают каждое индивидуальное целое число в диапазоне, также как любую субкомбинацию целых чисел. Например,предпочтительные целые числа для "1-6" могут включать 1, 2, 3, 4, 5, 6, 1-2, 1-3, 1-4, 1-5, 2-3, 2-4, 2-5, 2-6 и т.д. Как применяют здесь "стабильное соединение" или "стабильная структура" указывает на соединение, которое является достаточно устойчивым, чтобы выдержать отделение до полезной степени чистоты реакционной смеси, и предпочтительно способно к формулированию в эффективное терапевтическое средство. Данное изобретение относится только к стабильным соединениям. Применяемое здесь "замещенный" указывает на какой-либо один или более атомов водорода на указанном атоме, замененный выбранным из группы, упомянутой здесь как "заместитель", при условии,что валентность замещенного атома не будет превышена и что замещение приведет к стабильному соединению. Примеры предпочтительных заместителей представляют собой -OH, алкил, циклоалкил, алкокси, галоген, галогеналкил, арил, гетероарил и гетероциклил. Применяемое здесь выражение "алкил" указывает на алкильную группу с неразветвленной или разветвленной цепью, имеющую от 1 до 8 углеродных атомов, такую как метил, этил, пропил, изопропил,бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, неопентил, 1-этилпропил, 3-метилпентил, 2,2 диметилбутил, 2,3-диметилбутил, гексил, октил и т.д. Алкильная часть групп, включающих алкил, имеет такое же значение, как алкил, определенный выше. Обозначение, такое как "C1-C6-алкил", указывает на алкильную группу с неразветвленной или разветвленной цепью, имеющую от 1 до 6 углеродных атомов,такую как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил,неопентил, 1-этилпропил, 3-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, гексил и т.д. Низшие алкильные группы, которые являются предпочтительными, являются алкильными группами, определенными выше, которые включают от 1 до 4 углеродных атомов. Обозначение, такое как "C1-C4-алкил", указывает на алкильный радикал, включающий от 1 до 4 углеродных атомов, такой как метил, этил, пропил,изопропил, бутил, изобутил, втор-бутил и трет-бутил. Обозначение, такое как "C1-C3-алкил", указывает на алкильный радикал, включающий от 1 до 3 углеродных атомов, такой как метил, этил, пропил и изопропил. Алкильные группы могут быть замещенными или незамещенными. Предпочтительные заместители включают -OH и алкокси. Применяемое здесь выражение "алкенил" указывает на неразветвленную цепь или разветвленные углеводородные цепи от 2 до 8 углеродных атомов, имеющие по меньшей мере одну углеродуглеродную двойную связь. Обозначение "C2-C8-алкенил" указывает на алкенильный радикал, включающий от 2 до 8 углеродных атомов. Примеры алкенильных групп включают этенил, пропенил, изопропенил, 2,4-пентадиенил и т.д. Алкенильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "алкинил" указывает на неразветвленную цепь или разветвленные углеводородные цепи от 2 до 8 углеродных атомов, имеющие по меньшей мере одну углерод-углеродую тройную связь. Обозначение "C2-C8-алкинил" указывает на алкинильный радикал, включающий от 2 до 8 углеродных атомов. Примеры включают этинил, пропинил, изопропинил, 3,5-гексадиинил и т.д. Алкинильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "C1-C4-галогеналкил" указывает на "алкильную" группу, которая определена здесь, замещенную одним или более атомов галогена, чтобы формировать стабильное соединение. Примеры галогеналкилов включают, но не ограничиваются, -CF3, -CHF2, -CH2F и CF2CF3. Применяемое здесь выражение "C1-C4-алкокси" указывает на "алкильную" группу, которая определена здесь, связанную с атомом кислорода. Алкоксигруппы могут быть замещенными или незамещенными. Применяемое здесь выражение "галоген" указывает на F, Cl, Br и I. Предпочтительно галогенные заместители представляют собой F и Cl. Применяемое здесь выражение "арилалкил" или "аралкил" указывает на алкильную группу, которая представляет собой замещенную арильную группу. Обозначение "C7-C15-арилалкил" указывает на арилалкильный радикал, включающий от 7 до 15 углеродных атомов. Примеры арилалкильных групп включают, но не ограничиваются, бензил, фенилэтил, дифенилметил, дифенилэтил, нафтилметил и т.д., предпочтительно бензил. Арилалкильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "циклоалкил" указывает на насыщенную или частично насыщенную моно- или бициклическую алкильную кольцевую систему, содержащую от 3 до 10 углеродных атомов. Определенные варианты осуществления включают от 3 до 6 углеродных атомов и другие варианты осуществления включают 5 или 6 углеродных атомов. Обозначение, такое как "C5-C7-циклоалкил", указывает на циклоалкильный радикал, включающий от 5 до 7 кольцевых углеродных атомов. Примеры циклоалкильных групп включают такие группы, как циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклооктил, пиненил и адамантанил. Циклоалкильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "арил" указывает на замещенную или незамещенную, моно- или бициклическую углеводородную ароматическую кольцевую систему, имеющую от 6 до 12 кольцевых углеродных атомов. Примеры включают фенил и нафтил. Предпочтительные арильные группы включают незамещенные или замещенные фенильные и нафтильные группы. Арильные группы могут быть замещенными или незамещенными. Применяемые здесь выражения "гетероцикл", "гетероциклический" или "гетероцикличный" относятся к замещенной или незамещенной карбоциклической группе, в которой один или больше кольцевых углеродных атомов заменены по меньшей мере одним гетероатомом, таким как -O-, -N- или -S-. Определенные варианты осуществления включают 3-6-членные кольца и другие варианты осуществления включают 5 или 6-членные кольца. Гетероатомы азота и серы могут быть факультативно окислены, и азот может быть факультативно замещен в неароматических кольцах. Гетероциклы предназначены включать гетероарильные и гетероциклоалкильные группы. Гетероциклические группы могут быть замещенными или незамещенными. Применяемое здесь выражение "гетероарил" указывает на ароматическую группу или кольцевую систему, содержащую от 5 до 10 кольцевых углеродных атомов, в которой один или больше кольцевых углеродных атомов замещены по меньшей мере одним гетероатомом, таким как О, N или S. Определенный вариант осуществления включает 5 или 6-членные кольца. Примеры гетероарильных групп включают пирролил, фуранил, тиенил, пиразолил, имидазолил, тиазолил, изотиазолил, изооксазолил, оксазолил,оксадиазолил, триазолил, оксатриазолил, фуразанил, тетразолил, пиридил, пиразинил, пиримидинил,пиридазинил, триазинил, пиколинил, имидазопиридинил, индолил, изоиндолил, имидазолил, бензофуранил, изобензофуранил, пуринил, хиназолинил, хинолил, изохинолил, бензоимидазолил, бензотиазолил,бензотиофенил, тианафтенил, бензоксазолил, бензооксадиазолил, бензизооксазолил, циннолинил, фталазинил, нафтиридинил и хиноксалинил. Гетероарильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "гетероциклоалкил" указывает на циклоалкильную группу, в которой один или больше кольцевых углеродных атомов заменены по меньшей мере одним гетероатомом,таким как О, N, S, SO и SO2. Определенные варианты осуществления включают 3-6-членные кольца, и другие варианты осуществления включают 5 или 6-членные кольца. Примеры гетероциклоалкильных групп включают азетидинил, пирролидинил, пирролинил, имидазолидинил, имидазолинил, оксазолидинил, пиразолидинил, пиразолинил, пиразалинил, пиперидинил, пиперазинил, гексагидропиримидинил,морфолинил, тиоморфолинил, дигидробензофуранил, тетрагидрофуранил, тетрагидропиранил, дигидрооксазолил, дитиолил, оксатиолил, диоксазолил, оксатиазолил, пиранил, оксазинил, оксатиазинил и оксадиазинил. Включенными в определение "гетероциклоалкил" являются слитые кольцевые системы, включающие, например, кольцевые системы, в которых ароматическое кольцо представляет собой слитое с гетероциклоалкильным кольцом. Примеры таких слитых кольцевых систем включают, например, фталамид, фталевый ангидрид, индолин, изоиндолин, тетрагидроизохинолин, хроман, изохроман, хромен и изохромен. Гетероциклоалкильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "пиридазин-3-он часть" указывает на 6-10-членную гетероциклоалкильную кольцевую систему, содержащую группу пиридазин-3-она и факультативно второе слитое кольцо. Второе слитое кольцо, если присутствует, представляет собой факультативно замещенное или незамещенное фенильное кольцо, замещенное или незамещенное C3-C6-циклоалкильное кольцо, замещенную или незамещенную 5-6-членную слитую гетероарильную кольцевую систему, содержащую один, два или три гетероатома, которые выбраны из N, О и S, или замещенную или незамещенную 5-6 членную слитую гетероциклоалкильную кольцевую систему, содержащую один, два или три гетероатома, которые выбраны из N, О и S. Примеры второго слитого кольца включают, но не ограничиваются,фенил, тиенил, пирролил, оксазолил, пиридинил, циклопропил, циклобутил, циклопентил и циклогексил. Применяемое здесь выражение "арилалкил" указывает на алкильную группу, которая замещена арильной группой. Примеры арилалкильных групп включают, но не ограничиваются, бензил, бромбензил, фенилэтил, бензгидрил, дифенилметил, трифенилметил, дифенилэтил, нафтилметил и т.д. Арилалкильные группы могут быть замещенными или незамещенными. Применяемое здесь выражение "аминокислота" указывает на группу, включающую и аминогруппу,и карбоксильную группу. Варианты осуществления аминокислот включают -амино, -амино, аминокислоты. -Аминокислоты имеют общую формулу HOOC-CH(боковая цепь)-NH2. Аминокислоты могут быть в их D-, L- или рацемической конфигурациях. Аминокислоты включают встречающиеся в природе и не встречающиеся в природе части. Встречающиеся в природе аминокислоты включают стандартные 20 -аминокислот, встречающиеся в белках, такие как глицин, серин, тирозин, пролин, гистидин, глутамин и т.д. Встречающиеся в природе аминокислоты могут также включать неаминокислоты(такие как -аланин, -аминобутановая кислота, гомоцистеин и т.д.), редкие аминокислоты (такие как 4 гидроксипролин, 5-гидроксилизин, 3-метилгистидин и т.д.) и небелковые аминокислоты (такие как цитруллин, орнитин, канаванин и т.д.). Не встречающиеся в природе аминокислоты хорошо известны в данной области техники и включают аналоги природных аминокислот; см. Lehninger, A.L. Biochemistry, 2nded.; Worth Publishers: New York, 1975; 71-77, открытие которых включено здесь посредством ссылки. Не встречающиеся в природе аминокислоты также включают -аминокислоты, где боковые цепи заменены синтетическими производными. В определенных вариантах осуществления группы заместителей для соединения данного изобретения включают остаток аминокислоты после удаления гидроксильной части ее карбоксильной группы; то есть группы формулы -C(=O)CH(боковая цепь)-NH2. Представленные боковые цепи встречающихся в природе и не встречающихся в природе -аминокислот включают представленные в табл. А. Таблица A Применяемое здесь выражение "субъект" указывает на теплокровное животное, такое как млекопитающее, предпочтительно человек, или ребенок человека, который поражен или имеет возможность быть пораженным одним или более болезнями и состояниями, описанными здесь. Применяемое здесь "терапевтически эффективное количество" указывает на количество соединения данного изобретения, которое эффективно для проведения профилактики или лечения симптомов отдельного расстройства. Такие расстройства включают, но не ограничиваются, те патологические и неврологические расстройства, связанные с аберрантной активностью рецепторов, описанных здесь, где лечение или профилактика содержит ингибирование, стимулирование или увеличение их активности посредством контакта рецептора с соединением данного изобретения. Применяемое здесь выражение "фармацевтически приемлемый" указывает на те соединения, материалы, композиции и/или лекарственные формы, которые в пределах здравого медицинского суждения,подходят для контакта с тканями людей и животных без избыточной токсичности, болезненной чувствительности, аллергической реакции или других осложнений, соизмеримых с приемлемым соотношением польза/риск. Фармацевтически приемлемые соединения, материалы, композиции и/или лекарственные формы должны быть в списке признанных полностью безвредными Generally Recognized as Safe (GRAS). Применяемое здесь выражение "стандартная доза" указывает на единичную дозу, которую можно ввести пациенту и которая может быть легко обработана и упакована, оставаясь физически и химически стабильной стандартной дозой, включающей в себя или активное соединение, или фармацевтически при- 15018537 емлемую композицию, как описано здесь. Все другие выражения, применяемые в описании данного изобретения, имеют свои значения, которые являются хорошо известными в данной области техники. В другом аспекте данное изобретение относится к фармацевтически приемлемым солям соединений, описанных выше. Применяемое здесь "фармацевтически приемлемые соли" включает соли соединений данного изобретения, полученные из комбинации таких соединений с нетоксичной кислотой или солей присоединения основания. Соли присоединения кислоты включают неорганические кислоты, такие как хлороводородная, бромоводородная, йодоводородная, серная, азотная и фосфорная кислоты, а также органические кислоты,такие как уксусная, лимонная, пропионовая, винная, глутаминовая, салициловая, щавелевая, метансульфоновая, пара-толуенсульфоновая, сукциновая и бензойная кислоты, и связанные неорганические и органические кислоты. Соли присоединения основания включают те полученные из неорганических оснований, таких как аммония и щелочных и щелочно-земельных металлов гидроксиды, карбонаты, бикарбонаты и подобное,а также соли, полученные из основных органических аминов, таких как алифатические и ароматические амины, алифатические диамины, гидроксиаминоспирты и подобное. Такие основания, полезные в получении солей данного изобретения, таким образом, включают гидроксид аммония, карбонат калия, бикарбонат натрия, гидроксид кальция, метиламин, диэтиламин, этилендиамин, циклогексиламин, этаноламин и подобное. В дополнение к фармацевтически приемлемым солям другие соли включены в изобретение. Эти соли могут служить в качестве промежуточных соединений в очистке соединения, в получении других солей или в идентификации и составлении характеристики соединения или промежуточных соединений. Фармацевтически приемлемые соли соединений данного изобретения могут также существовать в виде различных сольватов, таких как водные, метанольные, этанольные, диметилформамидные, этилацетатные и подобное. Смеси таких сольватов могут также быть получены. Источник такого сольвата может быть от растворителя кристаллизации, свойственного растворителя получения или кристаллизации или случайного такого растворителя. Такие сольваты находятся в области данного изобретения. Данное изобретение также охватывает фармацевтически приемлемые пролекарства, раскрытые здесь. Применяемое здесь "пролекарство" обозначает, что включают какие-либо соединения, которые преобразовываются метаболическими способами в организме субъекта в активное средство, которое имеет формулу в рамках данного изобретения. Так как пролекарство, как известно, повышает многочисленные желаемые фармацевтические свойства (например, растворимость, биодоступность, производство и т.д.), соединения данного изобретения могут доставляться в форме пролекарства. Общепринятые способы выбора и получения подходящих производных пролекарства описаны, например, в Prodrugs, Sloane,K.B., Ed.; Marcel Dekker: New York, 1992, включено сюда по ссылке в полном объеме. Известно, что соединения данного изобретения могут существовать в различных стереоизомерных формах. Как таковые, соединения данного изобретения включают и диастереомеры и энантиомеры. Соединения обычно получают как рацематы и могут легко применяться как таковые, но индивидуальные энантиомеры могут быть выделены или синтезированы общепринятыми способами, если это желательно. Такие рацематы и индивидуальные энантиомеры и их смеси формируют часть данного изобретения. Хорошо известно в данной области техники как получать и выделять такие оптически-активные формы. Индивидуальные стереоизомеры могут быть получены с помощью стереоспецефического синтеза, применяя энантиомерно чистые или энантиомерно обогащенные исходные вещества. Специфические стереоизомеры либо исходные вещества, либо продукты могут быть разделены и восстановлены способами, известными в данной области техники, такими как разделение рацемических форм, нормально-,обратнофазной и хиральной хроматографией, перекристаллизацией, ферментативным разделением или фракционной перекристаллизацией дополнительных солей, образованных с помощью реагентов, применяемых для этой цели. Полезные способы разделения и восстановления индивидуальных стереоизомеров описаны в Eliel, E.L.; Wilen, S.H Stereochemistry of Organic Compounds; Wiley: New York, 1994, и Jacques,J., et al. Enantiomers, Racemates, and Resolutions; Wiley: New York, 1981, каждая включена сюда по ссылке в полном объеме. Кроме того, известно, что функциональные группы, присутствующие в соединениях формулы (I),могут включать защитные группы. Например, заместители боковой цепи аминокислоты соединений формулы I могут быть замещены защитными группами, такими как бензилоксикарбонильная или третбутоксикарбонильная группы. Защитные группы известны, как таковые, как химические функциональные группы, которые могут быть селективно присоединены к и удалены от функциональностей, таких как гидроксильные группы и карбоксильные группы. Данные группы присутствуют в химическом соединении, чтобы приводить такую функциональность в инертное состояние в условиях химической реакции, которой соединение подвергают. Любая из множества защитных групп может применяться в настоящем изобретении. Предпочтительные группы для защиты лактамов включают силильные группы,такие как трет-бутилдиметилсилил ("TBDMS"), диметоксибензилгидрильную ("DMB"), ацильную, бензильную ("Bn") и метоксибензильную группы. Предпочтительные группы для защиты гидроксильных групп включают TBS, ацил, бензил, бензилоксикарбонил ("CBZ"), трет-бутилоксикарбонил ("Boc") и метоксиметил. Многие другие стандартные защитные группы, которые применяются специалистом в данной области техники, могут быть найдены в Greene, T.W. and Wuts, P.G.M., "Protective Groups in Organic Synthesis" 2d. Ed., WileySons, 1991. Синтез. Соединения данного изобретения могут быть получены рядом способов, хорошо известных специалисту в данной области техники, которые включают, но не ограничиваются, описанные ниже, или через модификацию данных способов, применяя стандартные способы, известные специалисту в данной области техники органического синтеза. Все способы, раскрытые в связи с настоящим изобретением, рассмотрены, чтобы применяться на практике в любом масштабе, включая милиграммовый, граммовый,многограммовый, килограммовый, многокилограммовый или коммерческий промышленный масштаб. Схема 1 Конденсация 4-оксибутановой кислоты или эфирного промежуточного соединения общей структуры А, или ее производного, с гидразином или R8 N-замещенным производным гидразина в растворителе,таком как этанол или 2-пропанол, обеспечивает путь к 4,5-дигидропиридазинону общей структуры В. Кетокислотные промежуточные соединения с замещением в 4- и 5-положении известны и могут быть легко получены. Пиридазиноны с R3/4a и R5/5a, слитые с гетероарильной или циклоалкильной группами,синтезируют из соответствующих ангидридов или кислот-эфиров. В случаях, когда R1 представляет собой защитную группу, снятие защиты дает соединения с R1=H, общей структуры C. Стандартные преобразования группы NH в соединениях общей структуры С при помощи алкилирования или реакций восстановительного аминирования дают примеры общей структуры D. 4,5-Дигидропиридазиноны структуры D могут быть окислены в ароматический пиридазинон общей структуры Е, применяя MnO2, CuCl2,ДДХ (2,3-дихлоро-5,6-дициано-1,4-бензохинон), оксид селена, ДМСО (диметилсульфоксид)/основание или натрий 3-нитробензосульфонат в присутствии натрий гидроксида. NH (R8=H) пиридазиноны могут быть алкилированы алкильными или замещенными алкильными группами, применяя R8-галид, основание, например K2CO3, Cs2CO3 или NaH, в инертном растворителе, таком как ДМФ (диметилформамид),ТГФ (тетрагидрофуран) или CH3CN. Примеры, где R8 представляет собой H, могут быть преобразованы по аналогиям, где R8 представляет собой арил или гетероарил с помощью стандартной палладиевой или медной реакций, применяя соответствующие галоидарил или гетероарил галид. Схема 2 Примеры арилпиридазинона данного изобретения могут также быть синтезированы, применяя стандартную химию кросс-сочетания Suzuki. Спиро бороэфирные производные общей структуры F, подвергаемые реакции кросс-сочетания, катализируемой палладием (реакция Suzuki) с пиридазинпроизводным общей структуры G или пиридазиноном структуры H, где R4a, R5a или R7 группа может быть галогеном, предпочтительно Br или I, дают примеры общей структуры J и K. Примеры спиро-пирролидина, -азепина и -3-пиперидина данного изобретения могут быть синтезированы, применяя способы, описанные в примерах спиро-4-пиперидина, исходя из N-Boc-3- 17018537 пирролидинона, N-Вос-гексагидро-1H-азепин-4-она или N-Boc-3-пиперидона соответственно, вместо NBoc-4-пиперидона. Примеры Другие особенности данного изобретения станут очевидными в течение последующих описаний типичных вариантов осуществления, как показано ниже. Данные примеры представлены для иллюстрации данного изобретения и не предназначены ограничивать его. Пример 1. 6-(1-Циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-4,5-дигидро-2Hпиридазин-3-он Раствор спиро[бензофуран-2(3H)-4'-пиперидин]а (8 г, 40 ммоль) в метиленхлориде (70 мл) обрабатывают пиридином (8 мл, 100 ммоль) и трифторуксусным ангидридом (7 мл, 50 ммоль) при 10C. Смесь перемешивают при 10C в течение 2 ч, затем нейтрализуют 1 N HCl и экстрагируют дважды метиленхлоридом. Объединенный органический слой высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить 1'-трифторацетил-спиро[бензофуран-2(3H)-4'-пиперидин] (10,86 г, 91%), масс-спектр m/z=286 Смесь продукта этапа 1 (0,51 г, 1,8 ммоль) и этилсукцинилхлорида (0,25 мл, 1,8 ммоль) в метиленхлориде (2 мл) охлаждают до 0C. Олово тетрахлорид (1 М раствор в метиленхлориде) (2,32 мл, 2,32 ммоль) добавляют при 10C, перемешивают в течение 30 мин, затем нейтрализуют водным 2 N HCl при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенный органический слой промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют. Продукт очищают при помощи ISCO хроматографии с силикагелем (40 г колонка), применяя 20% EtOAc в гексане, чтобы получить 1'-трифторацетил-5-(3-этоксикарбонилпропаноил)спиро[бензофуран-2(3H)-4'-пиперидин] (0,61 г,83%), масс-спектр m/z=414 (M+H). Этап 3. Синтез 6-(спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-4,5-дигидро-2H-пиридазин-3-она Смесь продукта этапа 2 (0,61 г, 1,5 ммоль) и гидразин моногидрата (0,57 мл, 11 ммоль) в изопропаноле (7 мл) нагревают при 110C в течение 15 ч. Изопропанол испаряют при пониженном давлении и разделяют между насыщенным водным раствором бикарбонат натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить 6-(спиро[бензофуран 2(3H)-4'-пиперидин]-5-ил)-4,5-дигидро-2H-пиридазин-3-он (0,4 г, 95%), масс-спектр m/z=286 (M+H). Неочищенное вещество применяют для следующей реакции без дополнительной очистки. Этап 4. Синтез 6-(1-циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-4,5-дигидро-2Hпиридазин-3-она Раствор продукта этапа 3 (0,4 г, 1,4 ммоль) в смеси ДМФ (2 мл) и MeOH (10 мл) перемешивают в атмосфере аргона. Циклобутанон (0,42 мл, 6,4 ммоль), цианоборогидрид натрия (0,35 г, 5,6 ммоль) и уксусную кислоту (0,2 мл, 3,17 ммоль) последовательно добавляют и перемешивают при 60C в течение 15 ч. Реакционную смесь концентрируют при пониженном давлении и разделяют между водным 1 М рас- 18018537 твором карбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (40 г колонка) хроматографии, применяя 5-10% метанол в метиленхлориде до 10% метанол,включающий 4 мл гидроксида аммония в метиленхлориде. Восстановленный чистый продукт растворяют в метиленхлориде и промывают насыщенным водным раствором бикарбоната натрия, солевым раствором, высушивают (Na2SO4), фильтруют и концентрируют. Продукт кристаллизуют из смеси метиленхлорида, этанола, эфира и гексана, чтобы получить пример 1 (6-(1-циклобутил-спиро[бензофуран-2(3H)4'-пиперидин]-5-ил)-4,5-дигидро-2H-пиридазин-3-он) (94 мг, 20%, 96% чистота), Тпл. (температура плавления) 207-209C (метиленхлорид, этанол, эфир и гексан), масс-спектр m/z=340 (M+H); 1 Н ЯМР (400 МГц, CDCl3):1,57-2,15 (м, 12H), 2,37-2,56 (м, 2H), 2,60 (т, J=16,16 Гц, 2H), 2,76-2,87 Данное соединение получают, применяя способ, описанный для примера 1, применяя циклопропандикарбоновой кислоты ангидрид, что дает 1'-циклобутил-5-(3,4-диаза-бицикло[4,1,0]гептен-2-он-5 ил)спиро[бензофуран-2(3H)-4'-пиперидин]; Тпл. 189-191C, масс-спектр m/z=352 (M+H); 1 Смесь 1'-трифторацетил-спиро[бензофуран-2(3H)-4'-пиперидин]а (3,1 г, 11 ммоль) и пропаноилхлорида (1 мл, 10 ммоль) в метиленхлориде (25 мл) охлаждают до 10C. Олово тетрахлорид (1 М раствор в метиленхлориде) (14,14 мл, 14,11 ммоль) добавляют при 10C и перемешивают при 10C в течение 30 мин, затем нейтрализуют водным 2 N HCl при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4),фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (120 г) хроматографии, применяя 22% EtOAc в гексане, чтобы получить 1'трифторацетил-5-(пропаноил)спиро[бензофуран-2(3H)-4'-пиперидин] (2,2 г, 59%), масс-спектр m/z=342 Раствор 1'-трифторацетил-5-(пропаноил)спиро[бензофуран-2(3H)-4'-пиперидин]а (2,2 г, 6,45 ммоль) в тетрагидрофуране (22 мл) охлаждают до 0C. Литий диизопропиламид (2 М раствор в ТГФ (тетрагидрофуран (3,56 мл, 7,09 ммоль) добавляют по каплям и нагревают до комнатной температуры в течение 30 мин. Реакционную смесь охлаждают до 0C, этил бромацетат (0,79 мл, 7,1 ммоль) добавляют по каплям и нагревают до комнатной температуры в течение 30 мин, затем нейтрализуют водной 1 М HCl кислотой при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный 1'-трифторацетил-5-(3-метил-4-оксоэтилбутират)спиро[бензофуран-2(3H)-4'пиперидин] (3,34 г), масс-спектр m/z=428 (M-55).(3,34 г, 7,8 ммоль) и гидразин моногидрата (3 мл, 60 ммоль) в изопропаноле (25 мл) нагревают при 110C в течение 15 ч. Изопропанол испаряют при пониженном давлении и разделяют между насыщенным водным раствором бикарбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают(Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный 6-(спиро[бензофуран-2(3H)-4'пиперидин]-5-ил)-5-метил-4,5-дигидро-2H-пиридазин-3-он (1,4 г, 60%), масс-спектр m/z=300 (М+H). Неочищенное вещество применяют для следующей реакции без дополнительной очистки. Этап 4. Синтез 6-(1-циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-5-метил-4,5-дигидро 2H-пиридазин-3-она Раствор продукта этапа 3 (6-(спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-5-метил-4,5-дигидро-2Hпиридазин-3-она) (1,4 г, 4,7 ммоль) в смеси ДМФ (2 мл) и MeOH (10 мл) перемешивают в атмосфере аргона. Циклобутанон (1,4 мл, 19 ммоль), цианоборогидрид натрия (1,2 г, 19 ммоль) и уксусную кислоту(0,65 мл, 11,36 ммоль) последовательно добавляют и перемешивают при 60C в течение 13 ч. Реакционную смесь концентрируют при пониженном давлении и разделяют между водным 1 М раствором карбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (120 г колонка) хроматографии, применяя от 5 до 10% метанола в метиленхлориде, чтобы получить чистый продукт. Чистый продукт кристаллизуют из смеси метиленхлорида, этанола, эфира и гексана, чтобы получить 6-(1-циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-5-метил-4,5-дигидро-2Hпиридазин-3-он (512 мг, 31%, 98% чистота), Тпл. 213-215C (метиленхлорид, этанол, эфир и гексан), массспектр m/z=354 (M+H); 1 Смесь 6-(1-циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-5-метил-4,5-дигидро-2Hпиридазин-3-она (202 мг, 0,57 ммоль) и карбоната цезия (372 мг, 1,14 ммоль) в диметилсульфоксиде (8,5 мл) нагревают при 130C 4 ч. Смесь охлаждают до комнатной температуры и разделяют между водой и метиленхлоридом. Натрий хлорид добавляют к смеси и водный слой экстрагируют дважды метиленхлоридом. Объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4),фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (80 г) хроматографии, применяя 5-10% метанол в метиленхлориде до 10% метанол,включающий 1% гидроксид аммония в метиленхлориде. Восстановленный продукт растворяют в метиленхлориде и промывают насыщенным водным раствором бикарбоната натрия, солевым раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить чистый продукт. Чистый продукт кристаллизуют из смеси метиленхлорида, метанола, эфира и гексана, чтобы получить пример 4 (6(циклобутил-спиро[бензофуран-2(3H)-4'-пиперидин]-5-ил)-5-метил-2H-пиридазин-3-он) (42 мг, 21%,96% чистота), Тпл. 243-245C, масс-спектр m/z=352 (M+H); 1 Раствор 3,4-дигидро-спиро[бензопиран-2,4'-пиперидин]аHCl (7 г, 30 ммоль) в метиленхлориде (60 мл) обрабатывают пиридином (10 мл, 100 ммоль) и трифторуксусным ангидридом (4,5 мл, 32 ммоль) при 10C. Смесь перемешивают при 10C в течение 3 ч, затем нейтрализуют 1 N HCl и экстрагируют дважды метиленхлоридом. Объединенные органические вещества высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO(330 г колонка) хроматографии, применяя 12-18% этилацетат в гексане, чтобы получить чистый 1'трифторацетил-3,4-дигидро-спиро[бензопиран-2,4'-пиперидин] (7,48 г, 72%), масс-спектр m/z=300(0,90 г, 7 ммоль) добавляют при 0C и смесь нагревают при 80C в течение 16 ч, затем нейтрализуют водным 1 N HCl при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют,чтобы получить неочищенный 1'-трифторацетил-6-(4-оксобутановая кислота)спиро[3,4 дигидробензопиран-2,4'-пиперидин] (0,97 г), масс-спектр m/z=400 (M+H) и 399 (M-H). Этап 3. Синтез 6-(4,5-дигидро-2H-пиридазин-3-он-6-ил)спиро[3,4-дигидробензопиран-2,4'пиперидин]а Смесь 1'-трифторацетил-6-(4-оксобутановая кислота)спиро[3,4-дигидробензопиран-2,4'пиперидин]а (0,97 г, 2,4 ммоль) и гидразин моногидрата (2,5 мл, 80 ммоль) в изопропаноле (12 мл) нагревают при 110C в течение 19 ч. Изопропанол испаряют при пониженном давлении и азеотропно перегоняют три раза с бензолом, чтобы получить неочищенный 6-(4,5-дигидро-2H-пиридазин-3-он-6 ил)спиро[3,4-дигидробензопиран-2,4'-пиперидин] (0,92 г), масс-спектр m/z=300 (М+H). Неочищенный продукт применяют для следующей реакции без дополнительной очистки. Этап 4. 1'-Циклобутил-6-(4,5-дигидро-2H-пиридазин-3-он-6-ил)спиро[3,4-дигидробензопиран-2,4'пиперидин] Раствор продукта этапа 3 (0,92 г, 3,10 ммоль) в смеси ДМФ (2 мл) и MeOH (6 мл) перемешивают в атмосфере аргона.(0,42 мл, 7,4 ммоль) последовательно добавляют и перемешивают при 60C в течение 20 ч. Реакционную смесь концентрируют при пониженном давлении и разделяют между водным 1 М раствором карбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют,чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (40 г колонка) хроматографии, применяя 4,5-10% метанол в метиленхлориде до 10% метанол, включающий 4 мл гидроксид аммония в метиленхлориде, чтобы получить чистый продукт. Восстановленный продукт растворяют в метиленхлориде и промывают насыщенным раствором бикарбоната натрия, солевым раствором, высушивают (Na2SO4), фильтруют и концентрируют. Чистый продукт кристаллизуют из смеси метиленхлорида, этанола, эфира и гексана, чтобы получить 1'-циклобутил-6-(4,5-дигидро-2H-пиридазин-3 он-6-ил)спиро[3,4-дигидробензопиран-2,4'-пиперидин] (39 мг, 95% чистота), Тпл. 242-243,5C (метиленхлорид, этанол, эфир и гексан), масс-спектр m/z=354 (M+H); 1 Смесь 1'-трифторацетил-спиро[3,4-дигидробензопиран-2,4'-пиперидин]а (1,49 г, 4,98 ммоль) и пропаноилхлорида (0,4 мл, 5 ммоль) в метиленхлориде (13 мл) охлаждают до 10C. Тетрахлорид олова (1 М раствор в метиленхлориде) (0,76 мл, 6,5 ммоль) добавляют при 10C и перемешивают при 10C в течение 20 мин, затем нейтрализуют водным 2 N HCl при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4),фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (80 г колонка) хроматографии, применяя 17-35% EtOAc в гексане, чтобы получить 1'трифторацетил-6-(пропаноил)спиро[3,4-дигидробензопиран-2,4'-пиперидин] (1,42 г, 81%), масс-спектр Раствор продукта этапа 1 (1'-трифторацетил-6-(пропаноил)спиро[3,4-дигидробензопиран-2,4'пиперидин]) (1,4 г, 3,9 ммоль) в тетрагидрофуране (13 мл) охлаждают до 0C. Литий диизопропиламид,(2 М раствор в ТГФ) (2,16 мл, 4,33 ммоль) добавляют по каплям и нагревают до комнатной температуры в течение 30 мин. Реакционную смесь охлаждают снова до 0C, этилбромацетат (0,48 мл, 4,30 ммоль) добавляют по каплям и нагревают до комнатной температуры в течение 30 мин, затем нейтрализуют водным 1 М HCl кислоты при 0C. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный 1'-трифторацетил-6-(3-метил-4-оксоэтилбутират)спиро[3,4- 23018537 Смесь продукта этапа 2 (2,21 г, 5,01 ммоль) и гидразин моногидрата (1,5 мл, 30 ммоль) в изопропаноле (15 мл) нагревают при 110C в течение 36 ч. Изопропанол испаряют при пониженном давлении и азеотропно перегоняют дважды с бензолом, чтобы получить неочищенный продукт (2,45 г), масс-спектрm/z=314 (М+H). Вещество применяют для следующей реакции без дополнительной очистки. Этап 4. Синтез 1-циклобутил-6-(5-метил-4,5-дигидро-2H-пиридазин-3-он-6-ил)спиро[3,4 дигидробензопиран-2,4'-пиперидин]а Раствор продукта этапа 3 (2,45 г, 7,82 ммоль) в смеси ДМФ (5 мл) и MeOH (15 мл) перемешивают в атмосфере аргона. Циклобутанон (1,8 мл, 24 ммоль), цианоборогидрид натрия (1,2 г, 19 ммоль) и уксусную кислоту (0,90 мл, 20 ммоль) последовательно добавляют и перемешивают при 60C в течение 24 ч. Реакционную смесь концентрируют при пониженном давлении и разделяют между водным 1 М раствором карбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощиISCO (40 г) хроматографии, применяя 2-10% метанол в метиленхлориде до 10% метанол, включающего 4 мл гидроксид аммония в метиленхлориде, чтобы получить чистый продукт. Восстановленный чистый продукт растворяют в метиленхлориде и промывают насыщенным раствором бикарбоната натрия, солевым раствором, высушивают (Na2SO4), фильтруют и концентрируют. Чистый продукт кристаллизуют из смеси метиленхлорида, этанола, эфира и гексана, чтобы получить 1-циклобутил-6-(5-метил-4,5-дигидро 2H-пиридазин-3-он-6-ил)спиро[3,4-дигидробензопиран-2,4'-пиперидин]: (550 мг, 19%, 95% чистота), Тпл. 207-209C (метиленхлорид, этанол, эфир и гексан), масс-спектр m/z=368 (M+H); 1 Н ЯМР (400 МГц, CDCl3):1,26 (д, J=7,33 Гц, 3H), 1,61-2,01 (м, 12H), 2,02-2,14 (м, 2H), 2,19-2,32 Смесь примера 12 (103 мг, 0,28 ммоль) и карбоната цезия (536 мг, 1,60 ммоль) в диметилсульфоксиде (6 мл) нагревают при 100-110C в течение 27 ч. Смесь охлаждают до комнатной температуры и разделяют между водой и метиленхлоридом. Натрий хлорид добавляют к смеси, и водный слой экстрагируют три раза метиленхлоридом. Объединенные органические вещества промывают соляным раствором,высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Неочищенный продукт очищают при помощи ISCO (40 г колонка) хроматографии, применяя 5-10% метанол в метиленхлориде до 10% метанол, включающий 4% гидроксид аммония в метиленхлориде. Восстановленный продукт растворяют в метиленхлориде и промывают насыщенным водным раствором бикарбоната натрия, солевым раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить чистый продукт. Чистый продукт кристаллизуют из смеси метиленхлорида, этанола, эфира и гексана, чтобы получить 1'-циклобутил-6-(5-метил-2H-пиридазин-3-он-6-ил)спиро[3,4-дигидробензопиран-2,4'пиперидин] (32 мг, 21%, 93% чистота), Тпл. 270-272C (метиленхлорид, этанол, эфир и гексан), массспектр m/z=366 (M+H); 1 В сухую, круглодонную колбу добавляют трис-(дибензилиденацетон)дипалладий(0) (22 мг, 0,024 ммоль) и трициклогексилфосфин (28,0 мг, 0,1 ммоль) в N2 атмосфере. Диоксан (6 мл) добавляют и темный раствор перемешивают в течение 30 мин при комнатной температуре. К данному темному коричневатому раствору добавляют 4,4,5,5,4',4',5',5'-октаметил-[2,2']би 1,3,2]диоксабороланил] (0,20 г, 0,79 ммоль), ацетат калия (0,10 г, 1,02 ммоль) и раствор 1'-циклобутил-5-бром-спиро[бензофуран-2(3H)-4'пиперидин]а (245,00 мг, 0,76 ммоль) в диоксане (5 мл) в таком порядке. Смесь продувают N2 в течение 10 мин и нагревают до 80C. Кипятят в течение 14 ч, после чего ЖХ масс-спектр показывает отсутствие бромида с ожидаемой m/z 370 массой для боролана. Неочищенный боролановое промежуточное соединение подвергают реакции сочетания Suzuki, когда добавляют 3,6-дихлорпиридазина (0,55 г, 3,69 ммоль), (PH3P)4Pd (85 мг, 0,073 ммоль), ТГФ (15 мл), EtOH (5 мл) и насыщенную водным NaHCO3 (8 мл). После 10 ч ВЖХ показывает ожидаемый продукт как основной пик. Реакцию концентрируют и очищают при помощи ISCO хроматографии (DMC/MeOH/NH4OH), чтобы получить продукт, бежевое твердое вещество (80 мг, 28%). Тпл. 193-194C, масс-спектр: m/z 356 (М+1). 1 Н ЯМР (CDCl3):7,97 (с, 1 Н), 7,73-7,77 (м, 2H), 7,52 (дд, J=8,8, 1,5 Гц, 1 Н), 6,9 (д, J=8,4 Гц, 1 Н),3,1 (с, 2H), (2,8, м, 1 Н), 2,4-2,6 (уш.с, 4 Н)1,65-2,15 (м, 10H). Пример 16. 1'-Циклобутил-5-(6-оксо-1,6-дигидропиридазин-3-ил)спиро[бензофуран-2(3H)-4'пиперидин](75,00 мг, 0,2108 ммоль) в уксусной кислоте (5,0 мл, 88 ммоль) добавляют ацетат натрия (10000 мг, 1,219 ммоль) и кипятят в течение 3 ч. Смесь испаряют, остаток выпаривают совместно с толуолом (210 мл) и затем хроматографируют при помощи ISCO хроматографии (DMC (дихлорметан)/MeOH/NH4OH), чтобы получить соединение, указанное в заглавии, 50 мг (68%). Тпл. 227-228C, масс-спектр: m/z 338 (М+1). 1 1'-трет-Бутилоксикарбонил-4-оксо-6-гидрокси-спиро[3 Н-бензопиран-2,4'-пиперидин]. Раствор 2,5-дигидроксиацетофенон (15 г, 98 ммоль), 4-оксопиперидин-1-карбоновой кислоты третбутиловый эфир (20 г, 100 ммоль) и пирролидин (21 мл, 260 ммоль) в метаноле (146 мл) перемешивают при кипении в течение 23 ч и концентрируют под вакуумом, чтобы получить красное маслообразное неочищенное вещество. Маслообразное неочищенное вещество очищают при помощи ISCO (330 г колонка) хроматографии, применяя 27-80% этилацетата в гексане, чтобы получить продукт этапа 1 (27 г, 82%),Тпл. 72-74C (этилацетат, эфир и гексан), масс-спектр m/z=332 (M-H). Этап 2 1'-трет-Бутилоксикарбонил-4,6-дигидрокси-спиро[3 Н-бензопиран-2,4'-пиперидин]. Раствор продукта этапа 1 (4,51 г, 13,5 ммоль) в метаноле (50 мл) охлаждают до 15C и медленно добавляют натрий борогидрид, смесь дополнительно перемешивают в течение 30 мин и затем концентрируют. Неочищенный остаток разделяют между метиленхлоридом и водой и водный слой экстрагируют дважды метиленхлоридом. Объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить продукт этапа 2 (4,1 г, 90%), Тпл. 171173C (этилацетат, эфир и гексан), масс-спектр m/z=334 (M-Н). Этап 3 6-Гидрокси-спиро[3 Н-бензопиран-2,4'-пиперидин]. Раствор продукта этапа 2 (23,5 г, 70,1 ммоль) и триэтилсилана (49 мл, 310 ммоль) в метиленхлориде(150 мл) охлаждают до 10C. Трифторуксусную кислоту (78 мл, 1000 ммоль) добавляют по каплям и дополнительно перемешивают при комнатной температуре в течение 15 ч. Смесь концентрируют под вакуумом и затем азеотропно перегоняют дважды с толуолом, чтобы получить янтарного цвета маслообразное вещество, которое оставляют под вакуумом и получают твердый продукт. Неочищенный продукт растирают со смесью гексан:эфир (1:1 соотношение, 175 мл), чтобы получить чистый продукт, который высушивают при 80C, чтобы получить желто-коричневое твердое вещество в виде ТФА (трифторацетат) соли (21 г, 90%), Тпл. 208-210C (эфир и гексан), масс-спектр m/z=220 (M+H). Этап 4 1'-Циклобутил-4-гидрокси-спиро[3,4-дигидробензопиран-2,4'-пиперидин]. Раствор продукта этапа 3 (0,76 г, 3,5 ммоль) в смеси ДМФ (2 мл) и MeOH (10 мл) перемешивают в атмосфере аргона. Циклобутанон (1,00 мл, 10 ммоль), уксусную кислоту (0,4 мл, 7 ммоль) цианоборогидрид натрия (0,9 г, 10 ммоль) последовательно добавляют и перемешивают при 60C в течение 15 ч. Реакционную смесь концентрируют при пониженном давлении и разделяют между водным 1 М раствором карбоната натрия и метиленхлоридом. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенный продукт. Восстановленный чистый продукт растворяют в метиленхлориде и промывают насыщенным водным раствором бикарбоната натрия, солевым раствором,высушивают (Na2SO4), фильтруют и концентрируют. Продукт кристаллизуют из смеси метиленхлорида,этанола, эфира и гексана, чтобы получить продукт этапа 4 (0,5 г, 53%), Тпл. 211-213C (метиленхлорид,этанол, эфир и гексан), масс-спектр m/z=274 (M+H). Этап 5. Пример 17. В раствор продукта этапа 4 (200 мг, 0,73 ммоль) в диметилсульфоксиде (10 мл) добавляют гидрид натрия (35 мг, 1,4 ммоль) при комнатной температуре. После перемешивают в течение 30 мин и затем при комнатной температуре 3,6-дихлорпиридазин (218 мг, 1,46 ммоль) добавляют и реакционную смесь нагревают до 60C в течение 1 ч и выливают раствор в солевой раствор при комнатной температуре. Водный слой экстрагируют четыре раза метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить неочищенное вещество. Неочищенное вещество очищают при помощи ISCO (40 г) хроматографии, применяя смесь метанола в метиленхлориде, чтобы получить пример 17 (250 мг, 87%), Тпл. 128-130C (метиленхлорид, метанол, эфир и гексан), масс-спектр m/z=386 (M+H). Пример 18. 6-Спиро[3,4-дигидробензопиран-2,4'-пиперидин]-6-илокси-2H-пиридазин-3-он Смесь примера 17 (209 мг, 0,54 ммоль) и натрий ацетата (32 мг, 0,39 ммоль) в уксусной кислоте (5 мл) нагревают до 110-115C в течение 7 ч. Реакционную смесь концентрируют и дважды азеотропно перегоняют с толуолом, затем разделяют между метиленхлоридом и водным раствором, насыщенным бикарбонатом натрия. Водный слой экстрагируют дважды метиленхлоридом и объединенные органические вещества промывают соляным раствором, высушивают (Na2SO4), фильтруют и концентрируют, чтобы получить относительно чистый продукт. Чистый продукт кристаллизуют из смеси метиленхлорида, метанола, эфира и гексана, чтобы получить 6-(3,4-дигидро-спиро[2H-1-бензопиран-2,4'-пиперидин]-6 илокси)-2H-пиридазин-3-он в виде грязно-белого твердого вещества (170 мг, 76%), Тпл. 233-235C (метиленхлорид, метанол, эфир и гексан), масс-спектр m/z=368 (M+H); 1(0,34 г, 0,89 ммоль), тетракис(трифенилфосфин)палладий(0) (0,088 г, 0,076 ммоль), K2CO3 (0,53 г, 3,8 ммоль) в 1,2-диметоксиэтане (8 мл) и воду (8 мл). Реакционную смесь продувают N2 в течение 25 мин и затем кипятят в течение 16 ч. Реакционную смесь охлаждают до комнатной температуры, добавляют небольшое количество NaCNBH3 и перемешивают в течение 5 мин. Реакционную смесь разбавляютCH2Cl2/MeOH (100 мл, 3:1), затем промывают насыщенным раствором NaHCO3, солевым раствором и высушивают (Na2SO4). Продукт очищают при помощи преп. ТСХ (тонкослойная хроматография) (6%H ЯМР (ДМСО): 12,95 (с, 1 Н), 8,25 (с, 1 Н), 7,6 (с, 1 Н), 7,45 (д, 1 Н), 6,95 (с, 1 Н), 6,8 (д, 1 Н), 2,8 (м,3H), 2,2-2,3 (уш., 2H), 1,95-2,0 (уш., 2H), 1,6-1,9 (м, 11H), масс-спектр m/z 352 (M+1) Последующие примеры синтезируют, применяя способы примера 19 с 6-хлор-2-метил-2Hпиридазин-3-оном (пример 20) и 3-хлор-6-метоксипиридазином (пример 21). Рацемический пример 10 разделяют на два изомера, применяя хиральную хроматографию; ChiralCelOJ-H и 0,1% диэтиламин в 35% метанол/CO2. Индивидуальные изомеры определены как пример 22 (пик А элюируется первым из хиральной колонки) и пример 23 (пик В элюируется вторым из хиральной колонки).(7 мл) добавляют NaH (88 мг, 3,7 ммоль). После 0,5 ч 2-(3-хлорпропил)-2H-пиридазин-3-он (0,2 г, 1,15 ммоль) добавляют и реакционную смесь нагревают до 60C в течение 1 ч, концентрируют, разделяют между DMC и водными NaHCO3, NaCl растворами и высушивают Na2SO4. Продукт очищают с помощью хроматографии с силикагелем (5-12% MeOH/DMC), чтобы получить 360 мг (80%). Тпл. 207-209C (HCl соль), масс-спектр m/z=410 (M+H). Пример 25. 1'-Циклобутил-6-[3-(2-пиридазин-3-он)-2-гидроксипропилокси]-спиро[3,4 дигидробензопиран-2,4'-пиперидин] Данное соединение синтезируют, применяя способ примера 24 и 2-оксиранилметил-2H-пиридазин 3-он. Тпл. 201-203C (HCl соль), масс-спектр m/z=426 (M+H). Последующие примеры синтезируют из 6-бром-1'-циклобутил-спиро[1,3-бензодиоксин-2,4'пиперидин]а, применяя способы примеров 19-21.
МПК / Метки
МПК: A61K 31/501, A61P 25/00, C07D 491/10
Метки: замещенные, пиперидина, лиганды, производные, спироциклические, рецептора, гистамин-3
Код ссылки
<a href="https://eas.patents.su/30-18537-zameshhennye-spirociklicheskie-proizvodnye-piperidina-kak-ligandy-gistamin-3-h3-receptora.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные спироциклические производные пиперидина как лиганды гистамин-3 (h3) рецептора</a>
Предыдущий патент: Фармацевтический препарат, содержащий толперизон
Следующий патент: Солнцезащитное остекление, обладающее повышенным коэффициентом светопропускания
Случайный патент: Система выращивания растений