Производные пиримидина в качестве ингибиторов киназы
Номер патента: 20730
Опубликовано: 30.01.2015
Авторы: Чэнь Бэй, Цзян Сончунь, Ян Кюньйон, Хе Сяосюй, Ли Кристиан Чохуа, Марсилье Томас Х.III, Лу Вэньшу
Формула / Реферат
1. Соединение формулы (1)

или его таутомер или физиологически приемлемая соль;
где кольцо Е необязательно может содержать двойную связь;
один из Z1, Z2 и Z3 обозначает NR6, N(R6)+-O- или S(O)1-2, а другие обозначают CR2;
R1 обозначает галоген или необязательно галогенированный C1-С6-алкил;
R2 обозначает пиридин-2-онил, азепан-2-онил или моноциклический 5-6-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, О и S, каждый из которых необязательно замещен R9, где R9 обозначает C1-С6-алкил, C1-С6-галогеналкил или С3-С7-циклоалкил;
R3 и R4 каждый обозначает Н;
R5 обозначает галоген, гидроксигруппу, C1-С6-алкил, C1-С6-алкоксигруппу, галогензамещенный C1-С6-алкил, галогензамещенную C1-С6-алкоксигруппу, цианогруппу или C(O)O0-1R ;
R6 обозначает Н; C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, каждый из которых необязательно может быть замещен галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7, (CR2)pNR(CR2)POR7, (CR2)pNR-L-C(O)R8, C(O)(CR2)qOR8,
-C(O)O-(CR2)p-NRR7, -C(O)-(CR2)p-OR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7, -L-C(O)NR(CR2)pOR7, -L-C(O)-(CR2)q-NR-C(O)-R8, -L-C(O)NR(CR2)pSR7, -L-C(O)NR(CR2)pS(O)1-2R8, -L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7, -L-S(O)2NR(CR2)pNR(R7) или -L-S(O)2NR(CR2)pOR7;
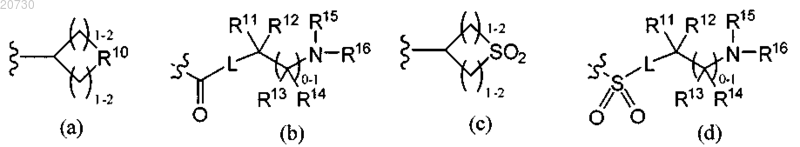
альтернативно, R6 обозначает радикал, выбранный из формулы (а), (b), (с) или (d):
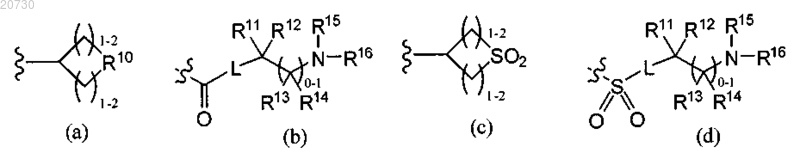
R10 обозначает О, S, NR17, где R17 обозначает Н, C1-С6-алкил, SO2R8a или CO2R8a;
R11, R12, R13, R14, R15 и R16 независимо выбраны из группы, включающей Н, C1-С6-алкоксигруппу, C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой или гидроксигруппами; или R11 и R12, R12 и R15, R15 и R16, R13 и R14, или R13 и R15 вместе с атомами, к которым они присоединены, могут образовать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5; или R11 и R12 вместе с атомом углерода, к которому они присоединены, могут образовать циклопропил или циклобутил; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовать 2,2,6,6-тетраметилпиперидинил-1-ил;
L обозначает (CR2)1-4 или связь;
Y обозначает С3-С7-карбоциклическое кольцо, С6-С10-арил или 5-10-членный гетероарил, содержащий 1-4 гетероатома, выбранных из N, О и S, или 4-10-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, каждое из которых необязательно замещено 1-3 группами R5;
R7, R8 и R8а независимо обозначают C1-С6-алкил, С2-С6-алкенил или С2-С6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой, гидроксигруппой или цианогруппой; (CR2)qY или C1-С6-алкоксигруппу; или R7 обозначает Н;
каждый R независимо обозначает Н или C1-С6-алкил;
R и R7 вместе с N в каждом NRR7 может образовать 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5;
m равно 2-4;
р равно 1-4; и q равно 0-4.
2. Соединение по п.1 формулы (2)
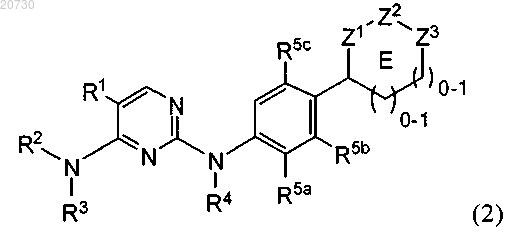
где один из R5a, R5b и R5c обозначает Н, а другие независимо обозначают галоген, C1-С6-алкил, C1-С6-алкоксигруппу, галогензамещенный C1-С6-алкил, цианогруппу или C(O)O0-1R8, где R8 обозначает C1-С6-алкил; и
R1, R2, R3, R4, E, Z1, Z2 и Z3 являются такими, как определено в п.1.
3. Соединение по п.2, в котором Z3 обозначает NR6 или N(R6)+-O- и Z1 и Z2 обозначают СН2.
4. Соединение по п.3, в котором R6 обозначает Н, C1-С6-алкил, необязательно замещенный галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7, C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7, -L-C(O)-(CR2)q-NR-C(O)-R8, -L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7 или радикал, выбранный из формулы (а), (b), (с) или (d)
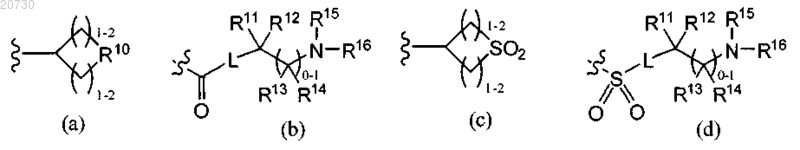
R10 обозначает О, S, NR17, где R17 обозначает Н, C1-С6-алкил, SO2R8a или CO2R8a и R8a обозначает C1-С6-алкил; и
R7, R8, R11, R12, R13, R14, R15, R16, R, L, Y, р и q являются такими, как определено в п.1.
5. Соединение по любому из пп.1-4, в котором R2 обозначает пиразолил, изоксазолил, пиридин-2-онил или азепан-2-онил, каждый из которых замещен C1-С6-алкилом, C1-С6-галогеналкилом или С3-С7-циклоалкилом.
6. Соединение по п.1 формулы (3)
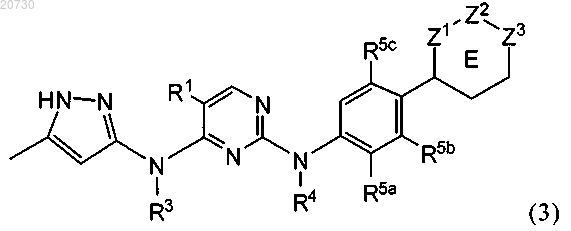
или его таутомер;
где R5b обозначает Н; и R5a и R5c независимо обозначают галоген, C1-С6-алкил, C1-С6-алкоксигруппу, галогензамещенный C1-С6-алкил, цианогруппу или C(O)O0-1R8, где R8 обозначает C1-С6-алкил;
Z1 и Z2 обозначают СН2;
Z3 обозначает NR6 или N(R6)+-O-;
R6 обозначает Н, C1-С6-алкил, необязательно замещенный галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7, C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7, -L-C(O)-(CR2)q-NR-C(O)-R8,
-L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7 или радикал, выбранный из формулы (а), (b), (с) или (d)
R10 обозначает О, S, NR17, где R17 обозначает Н, C1-С6-алкил, SO2R8a или CO2R8a и R8a обозначает C1-С6-алкил; и
R1, R3, R4, R7, R8, R11, R12, R13, R14, R15, R16, R, L, Y, p, q и Е являются такими, как определено в п.1.
7. Соединение по п.6, в котором R5a обозначает галоген и R5c обозначает C1-С6-алкил.
8. Соединение по п.6, в котором R6 обозначает C1-С6-алкил или радикал формулы (а) или (с); и R10 обозначает О.
9. Соединение по любому из пп.1-8, в котором R1 обозначает галоген.
10. Соединение по п.1, которое выбрано из группы, включающей
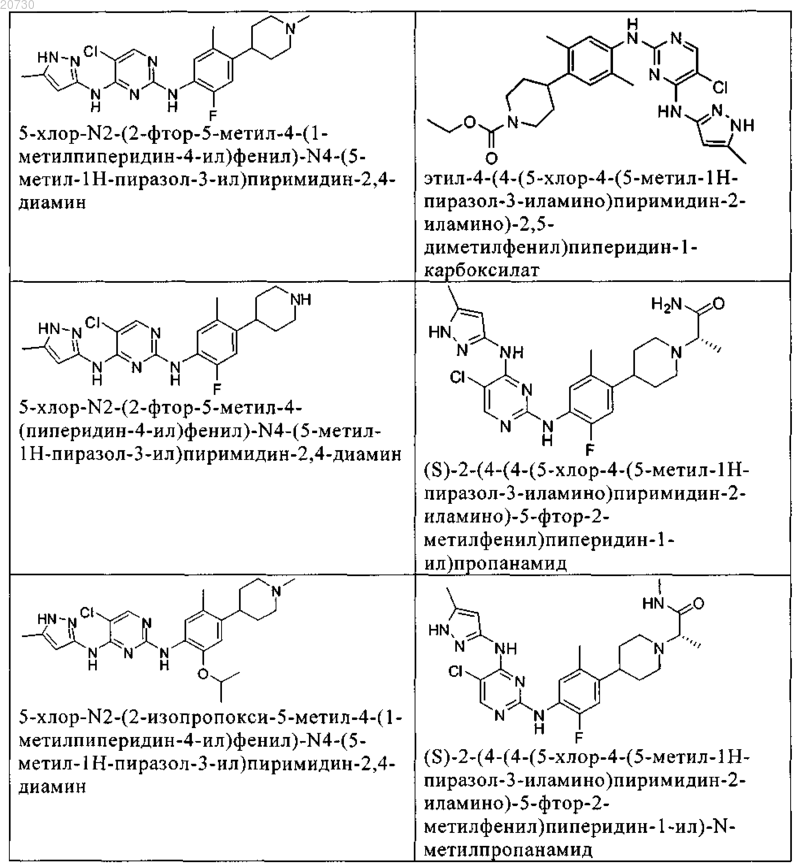
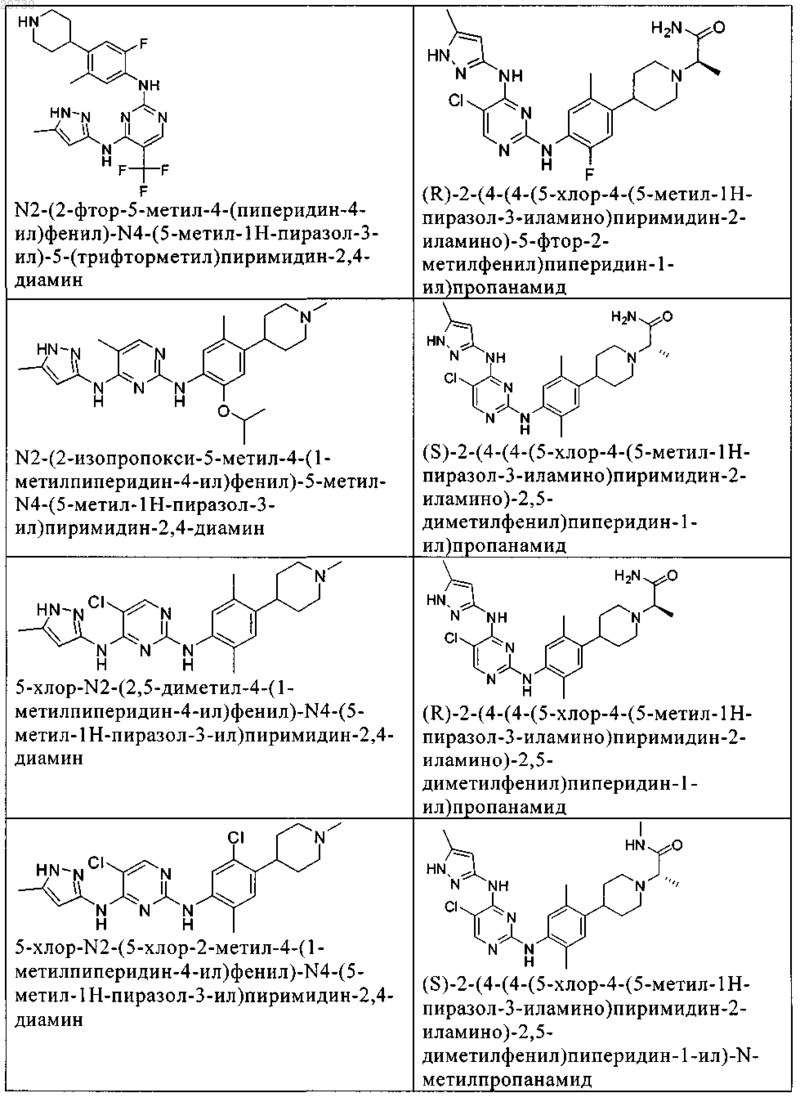
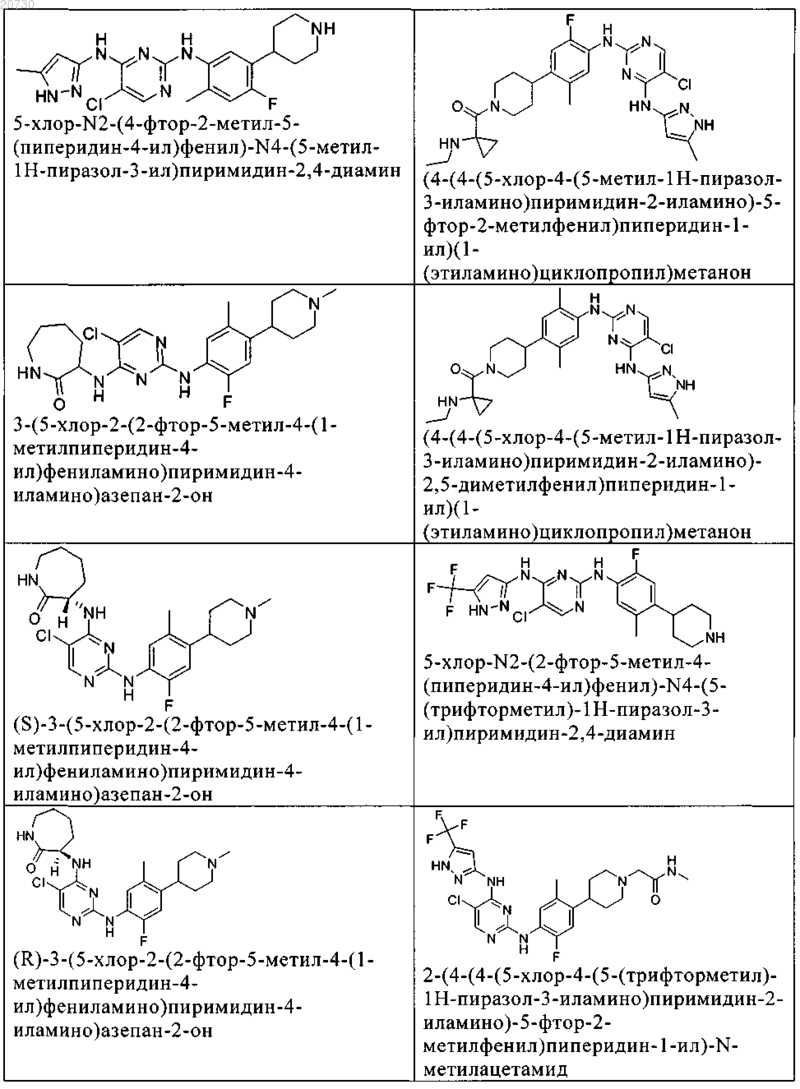
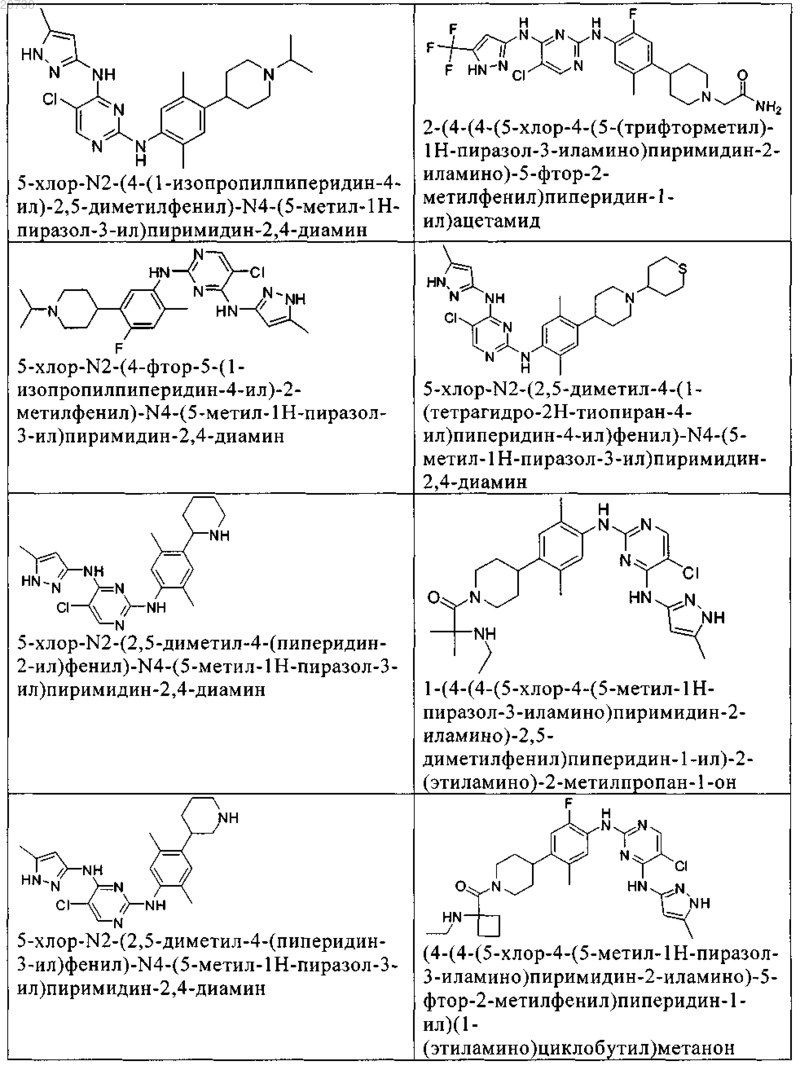
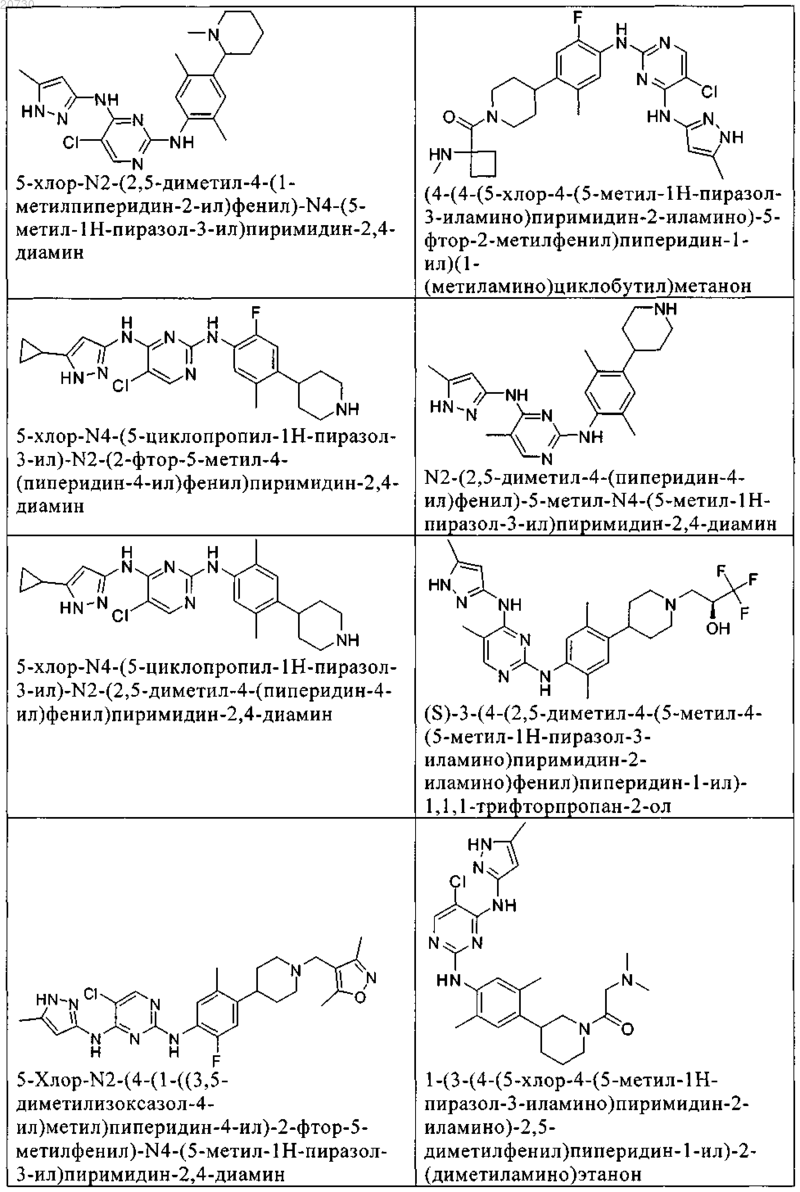
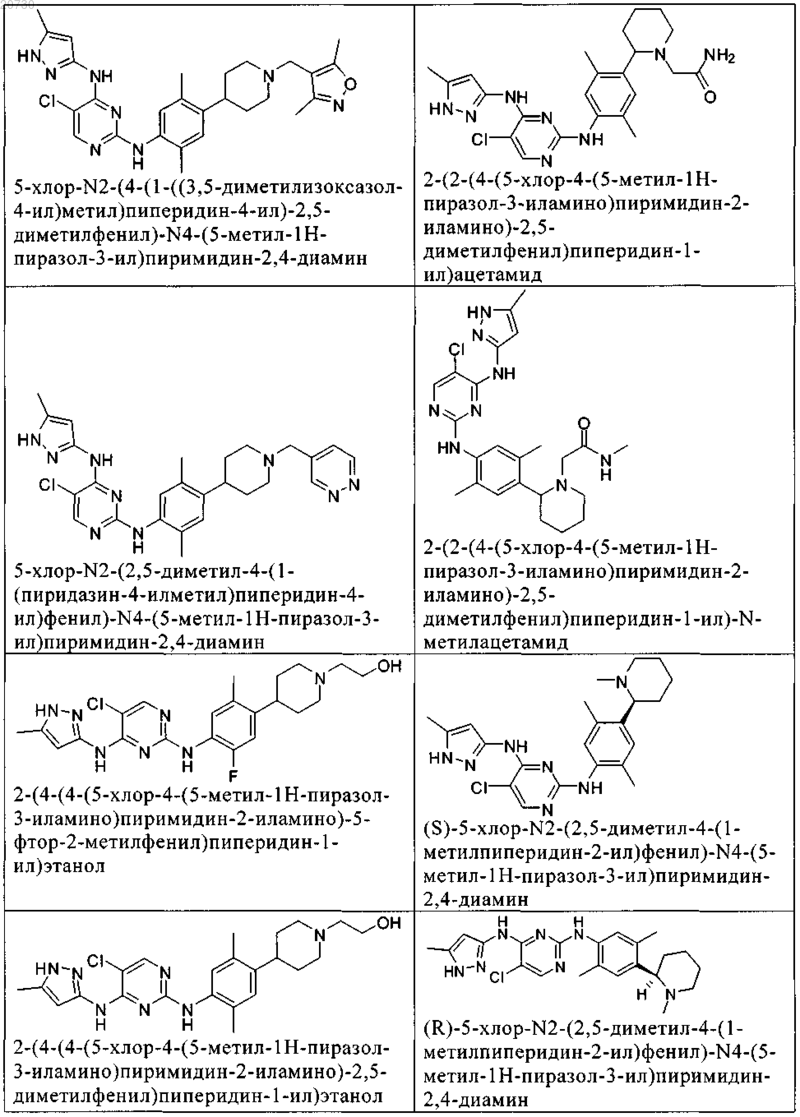
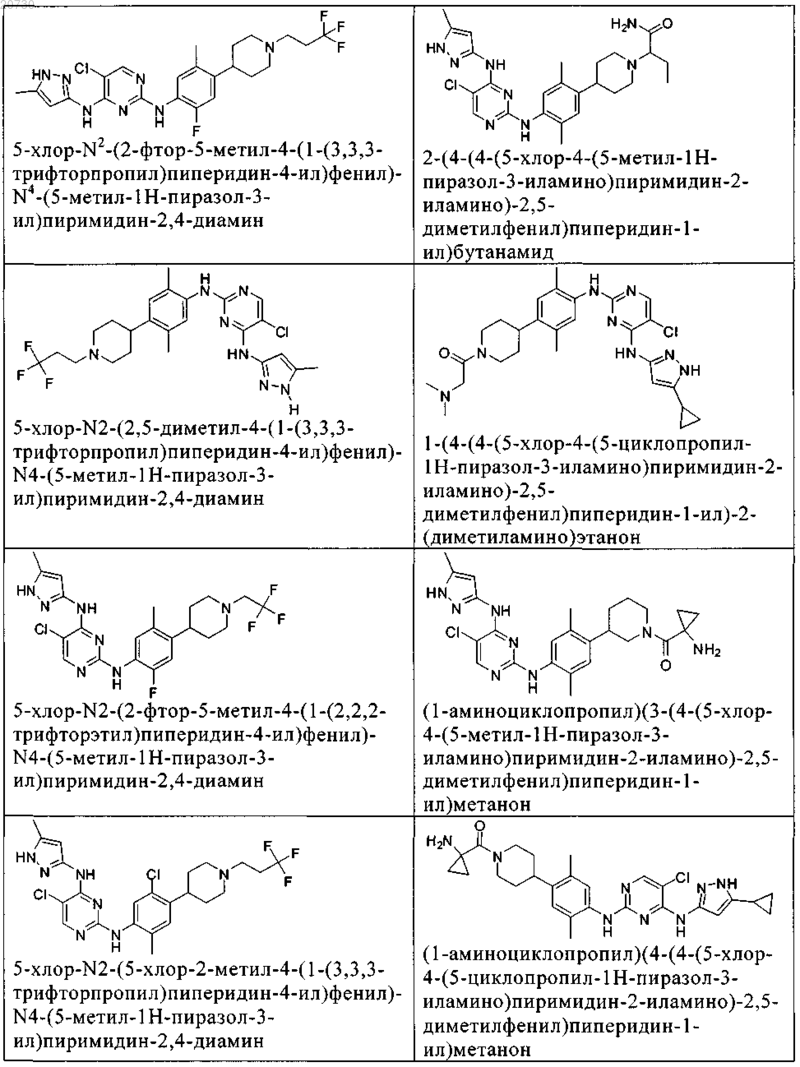
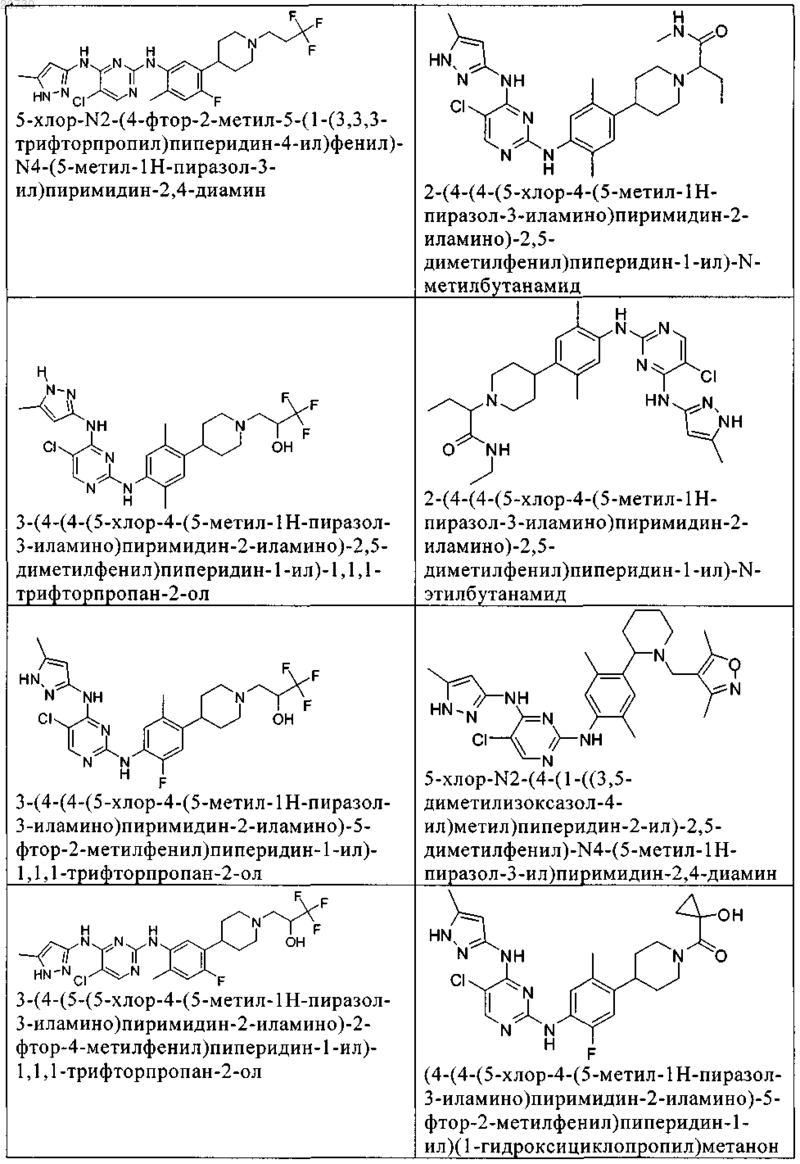
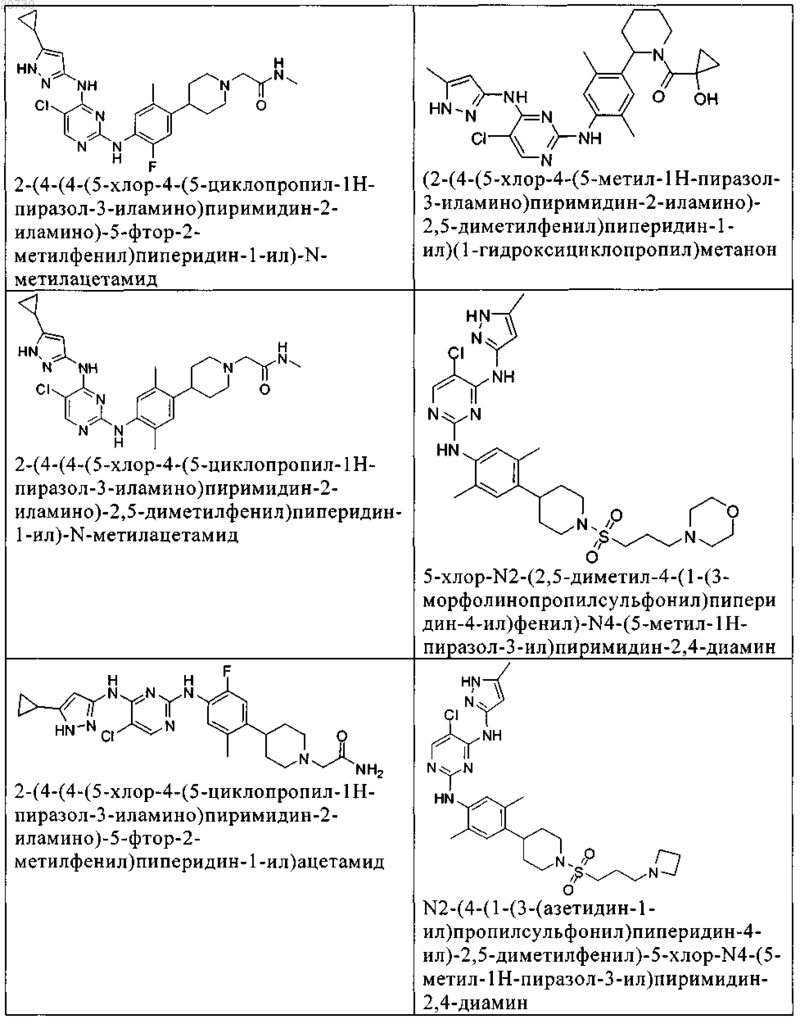
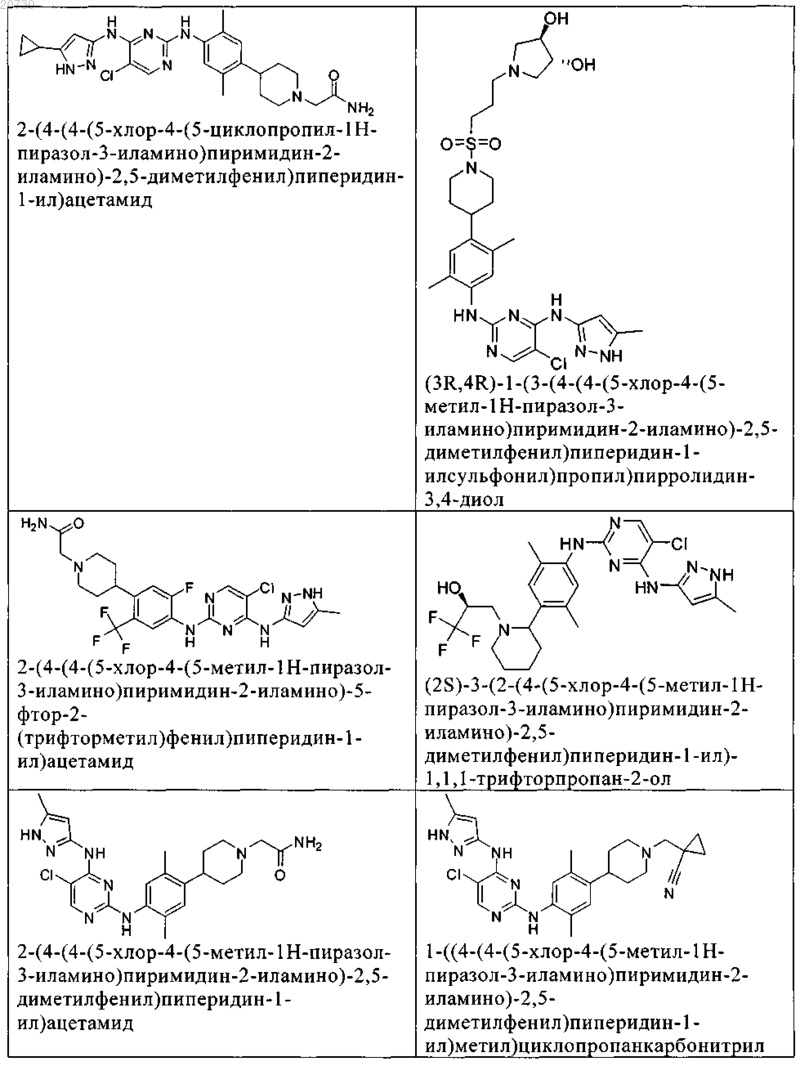
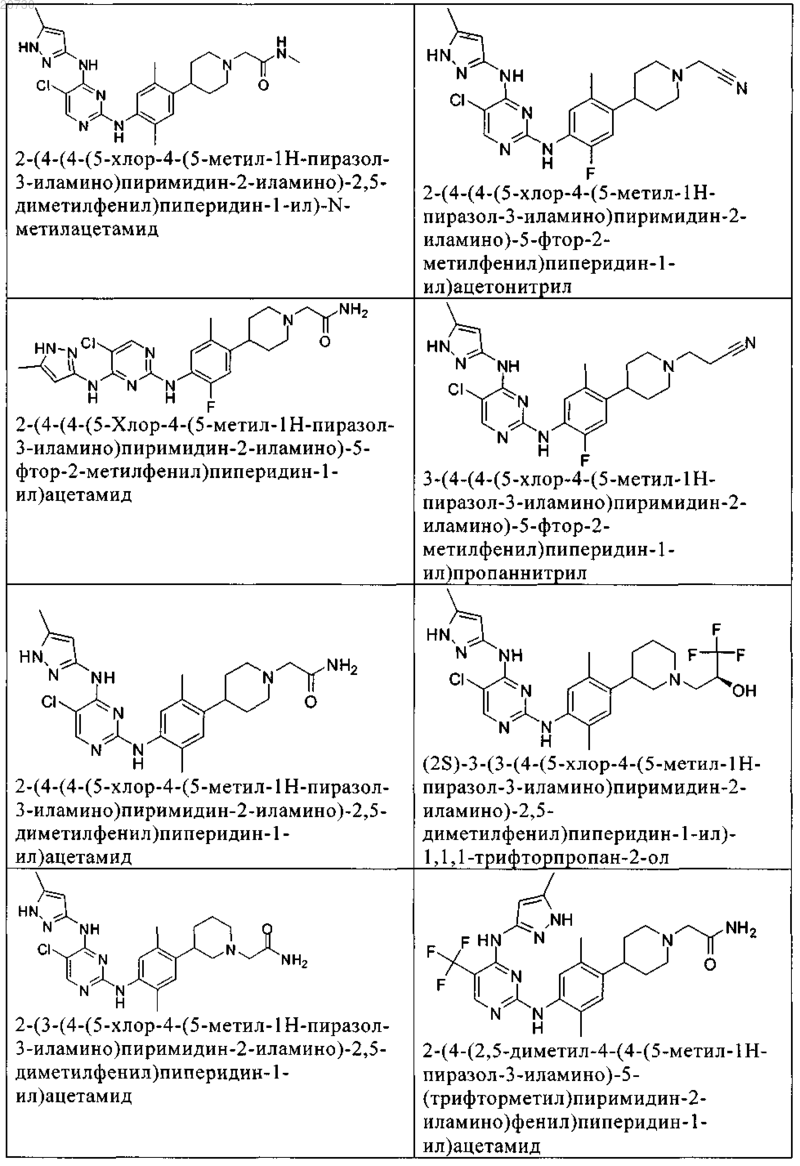

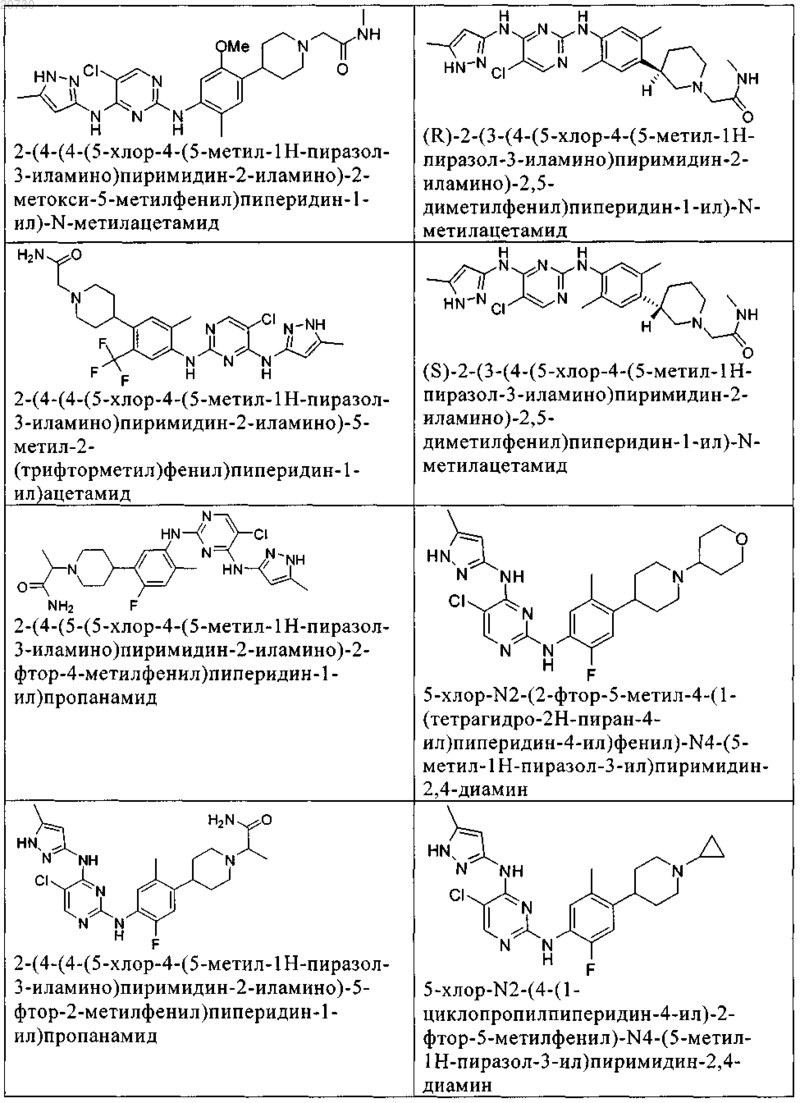
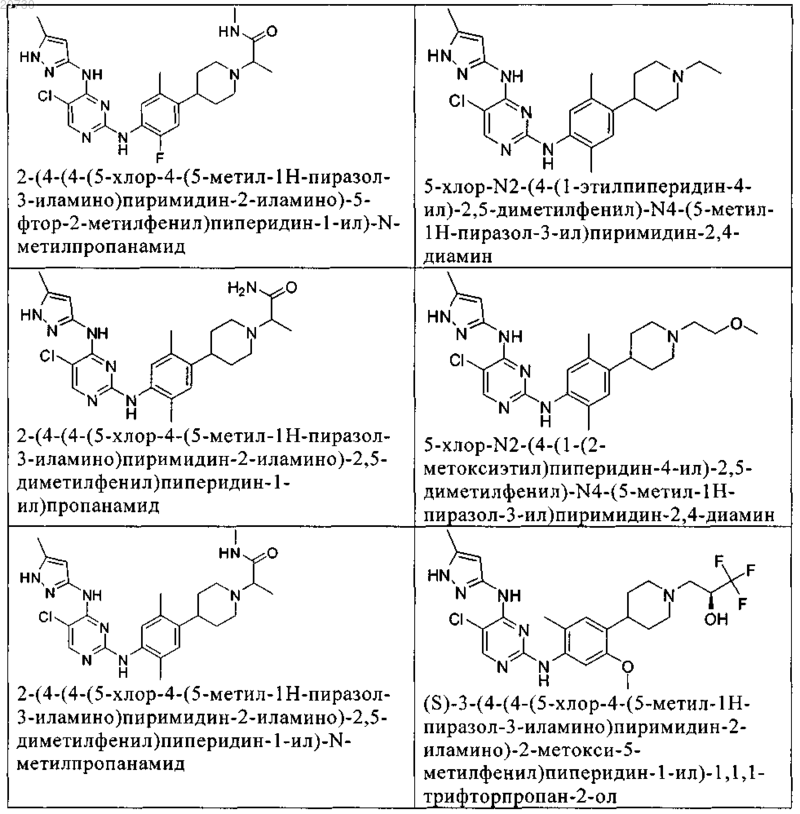
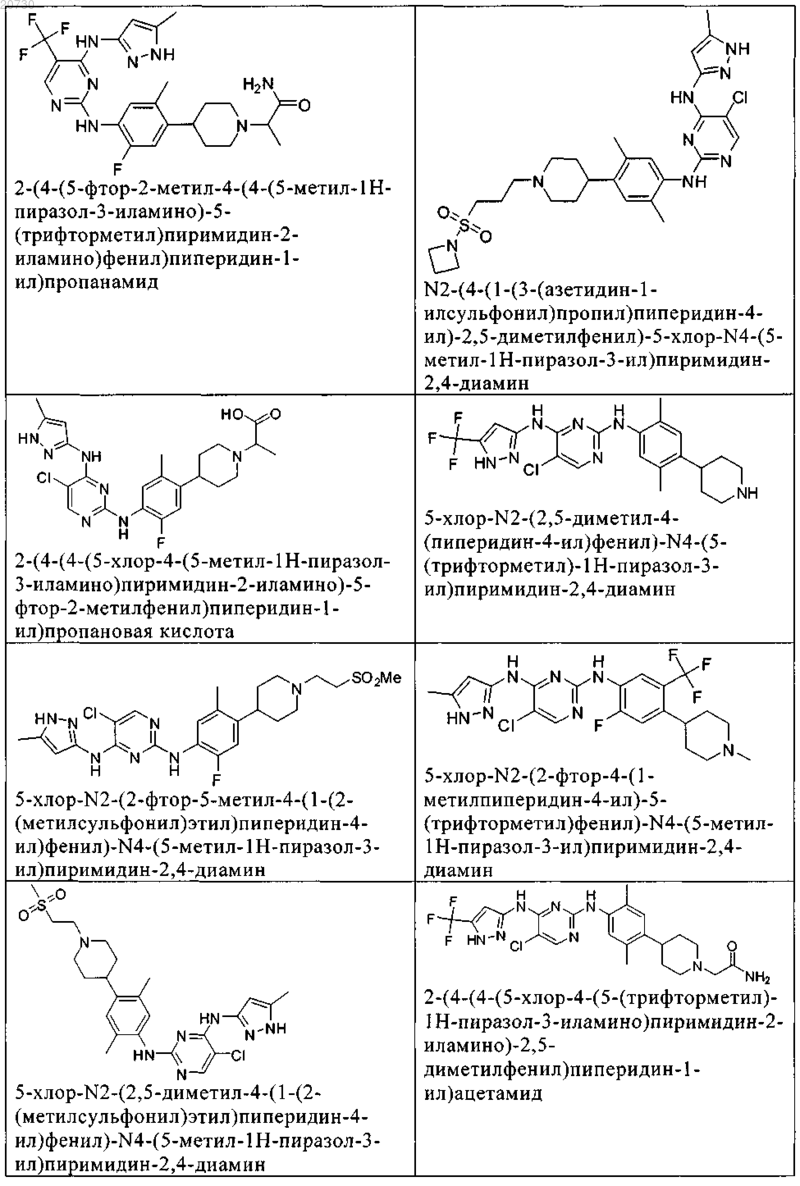
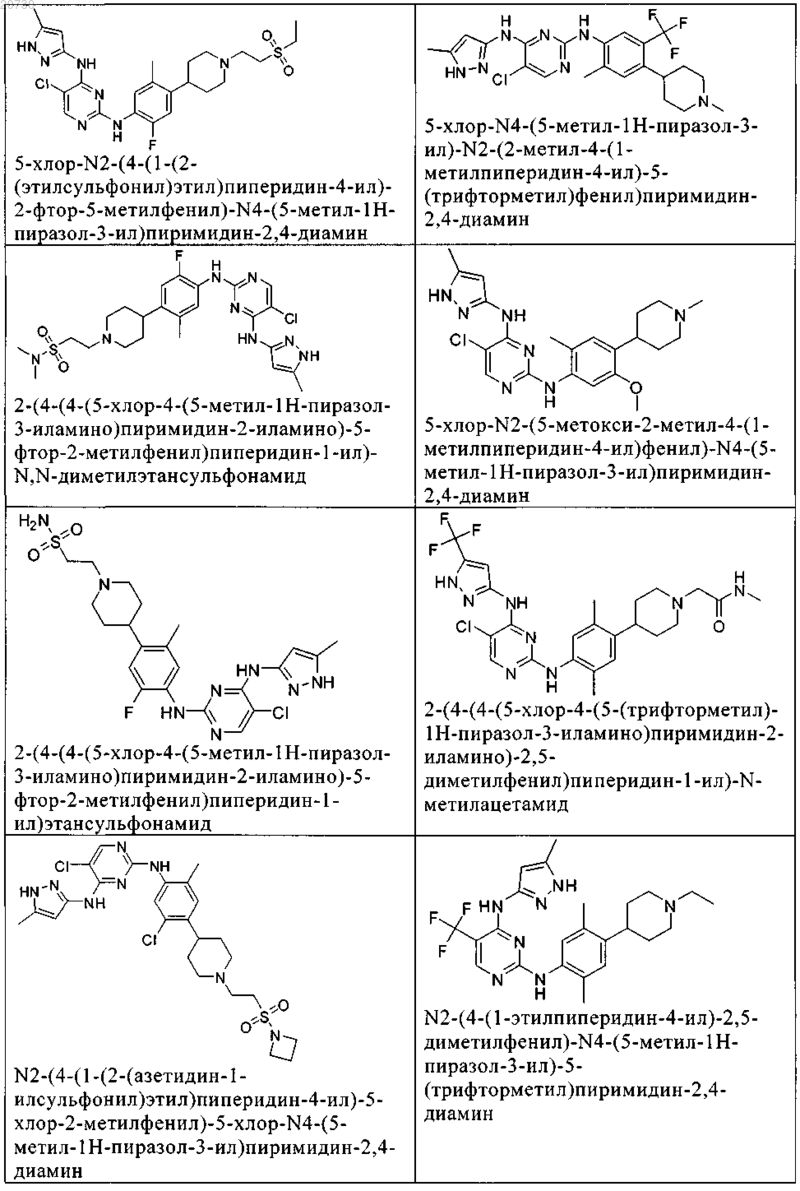

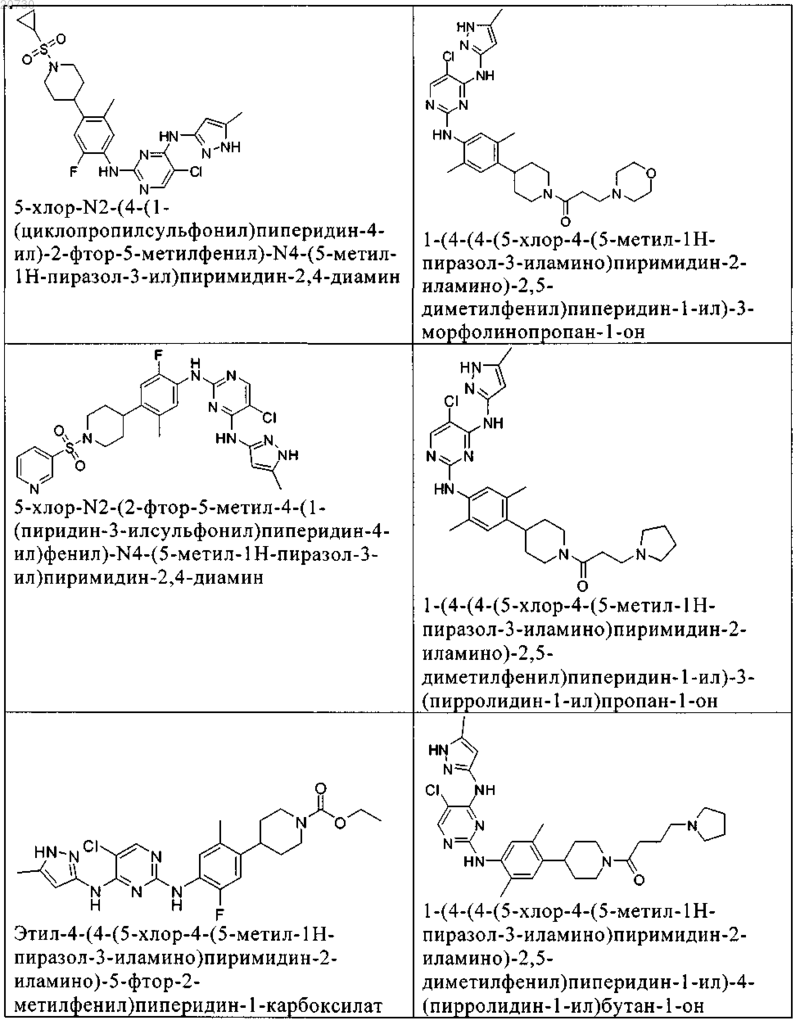
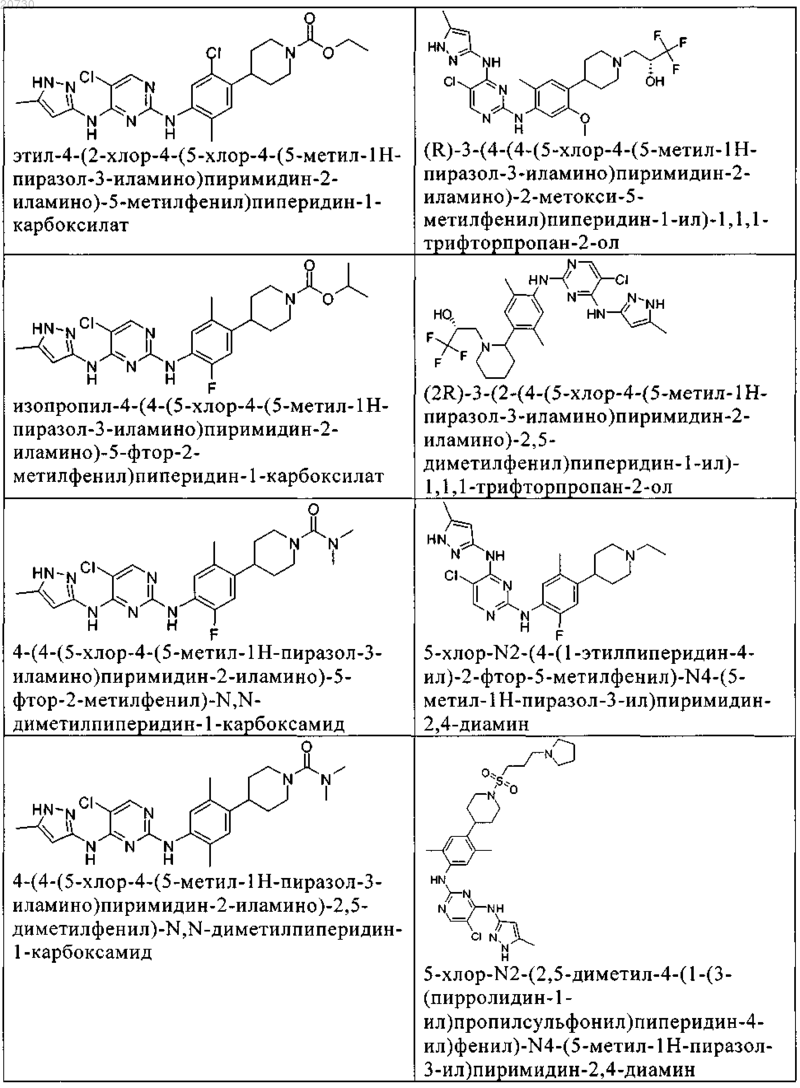
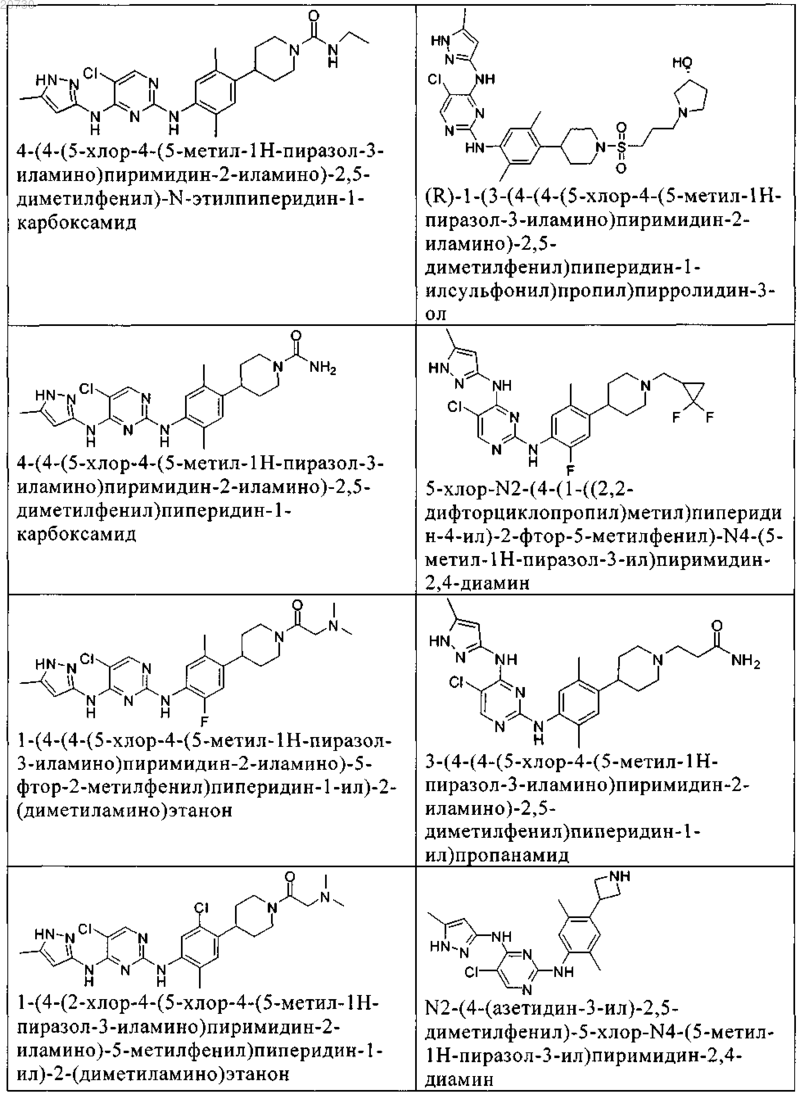

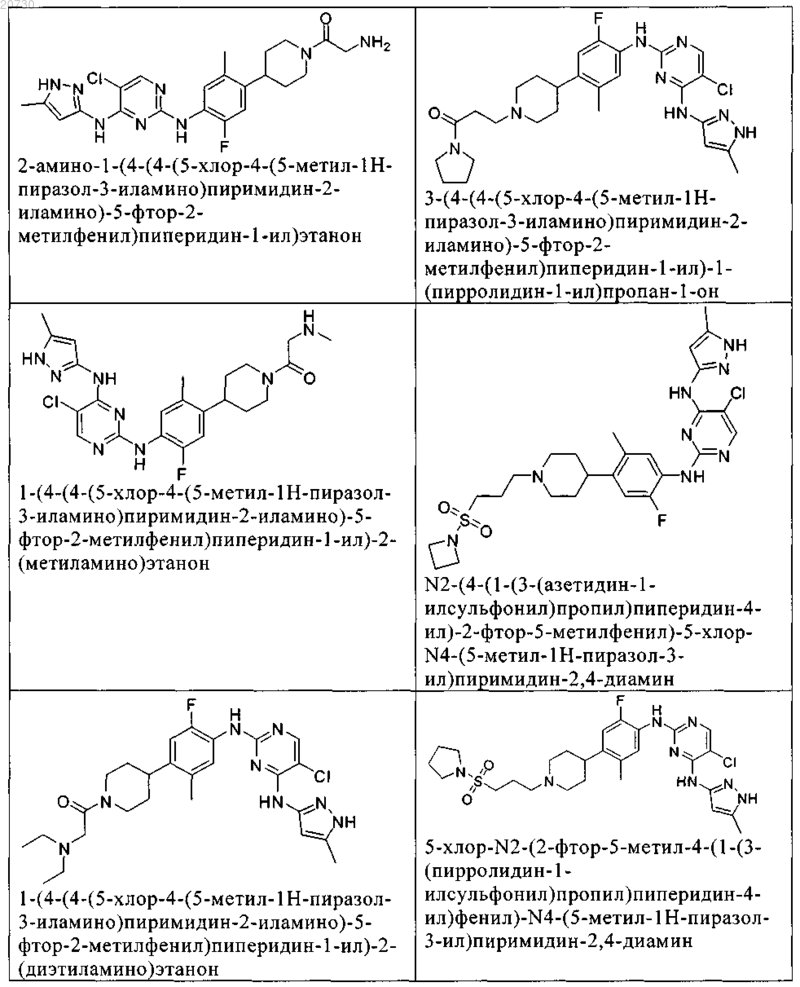
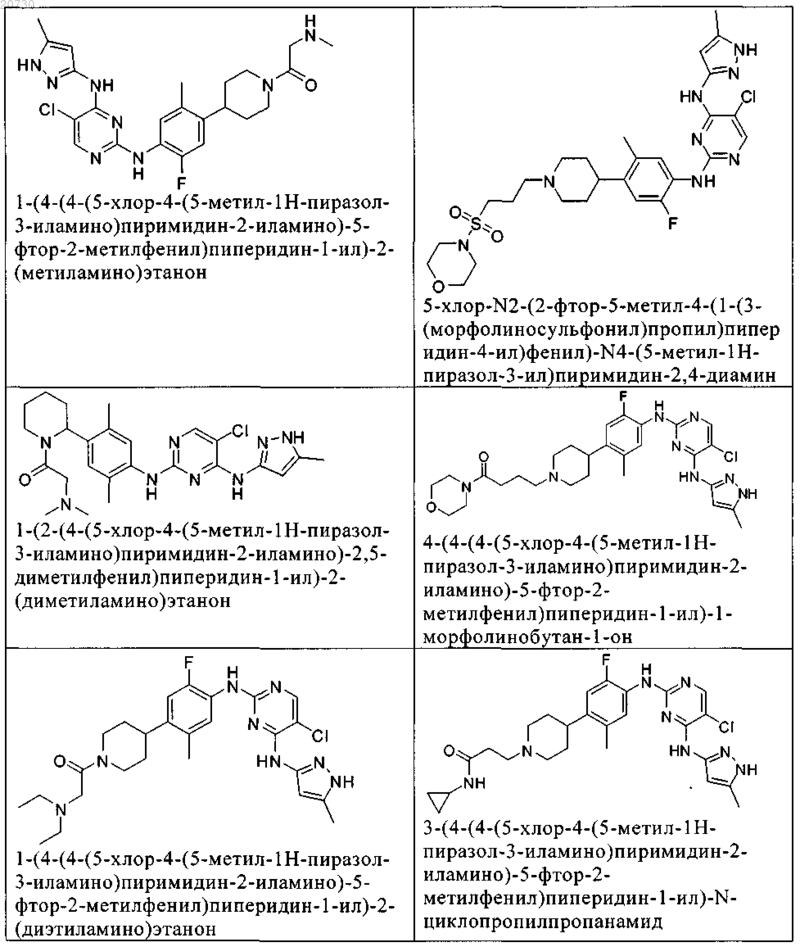
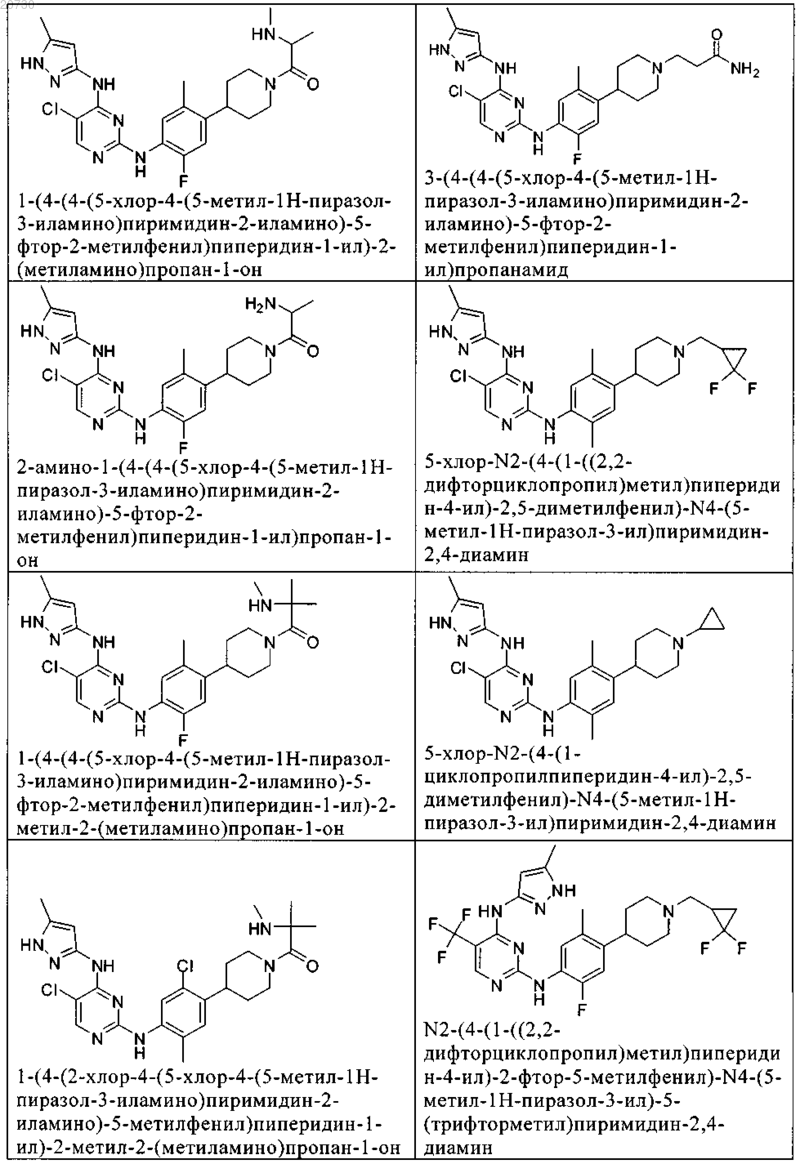
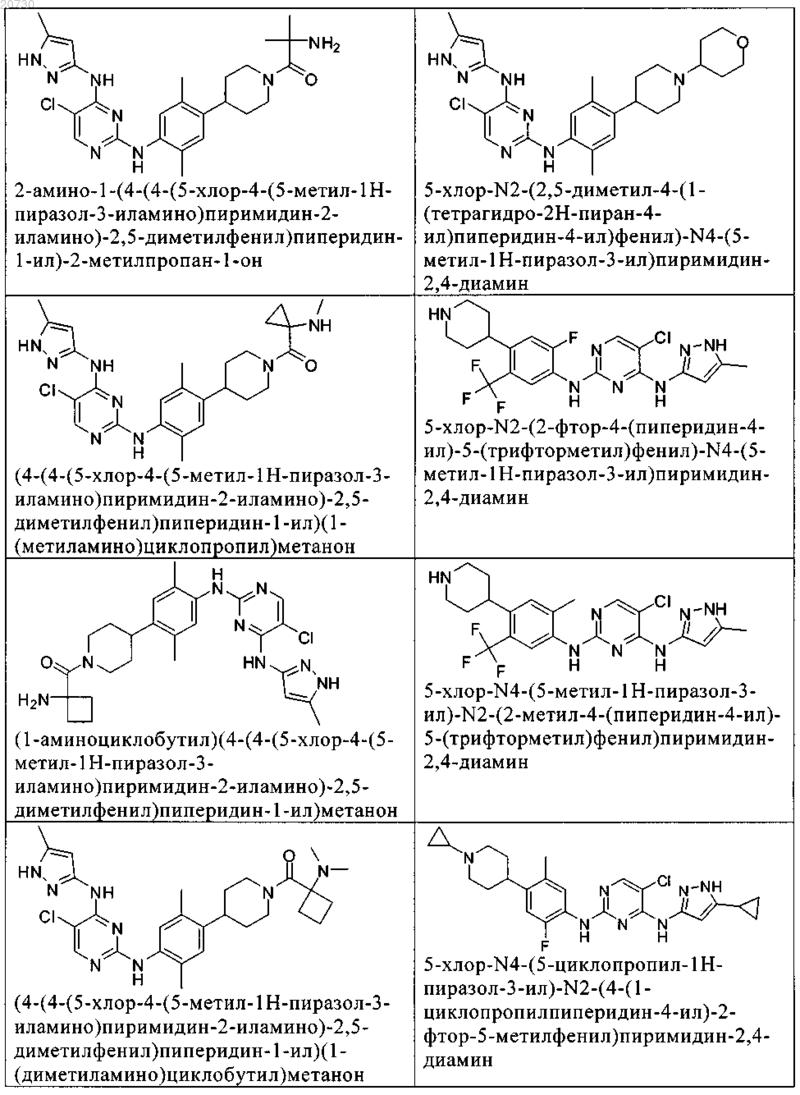
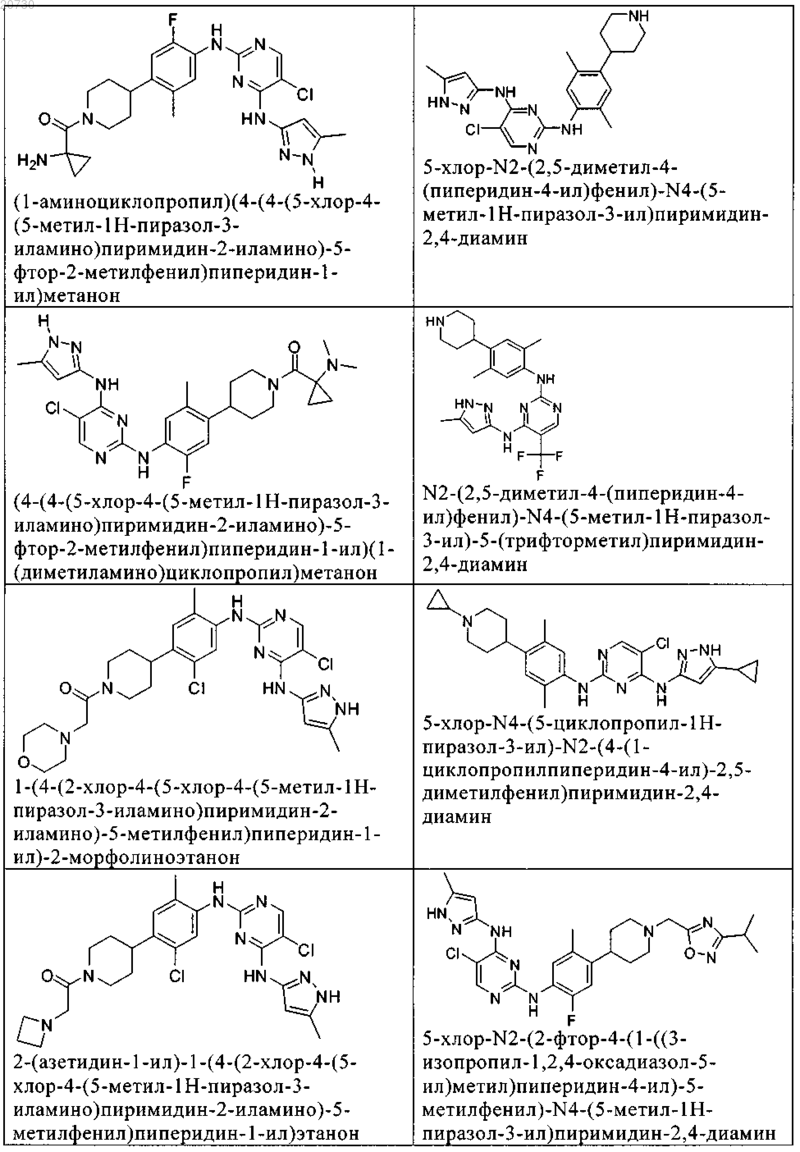
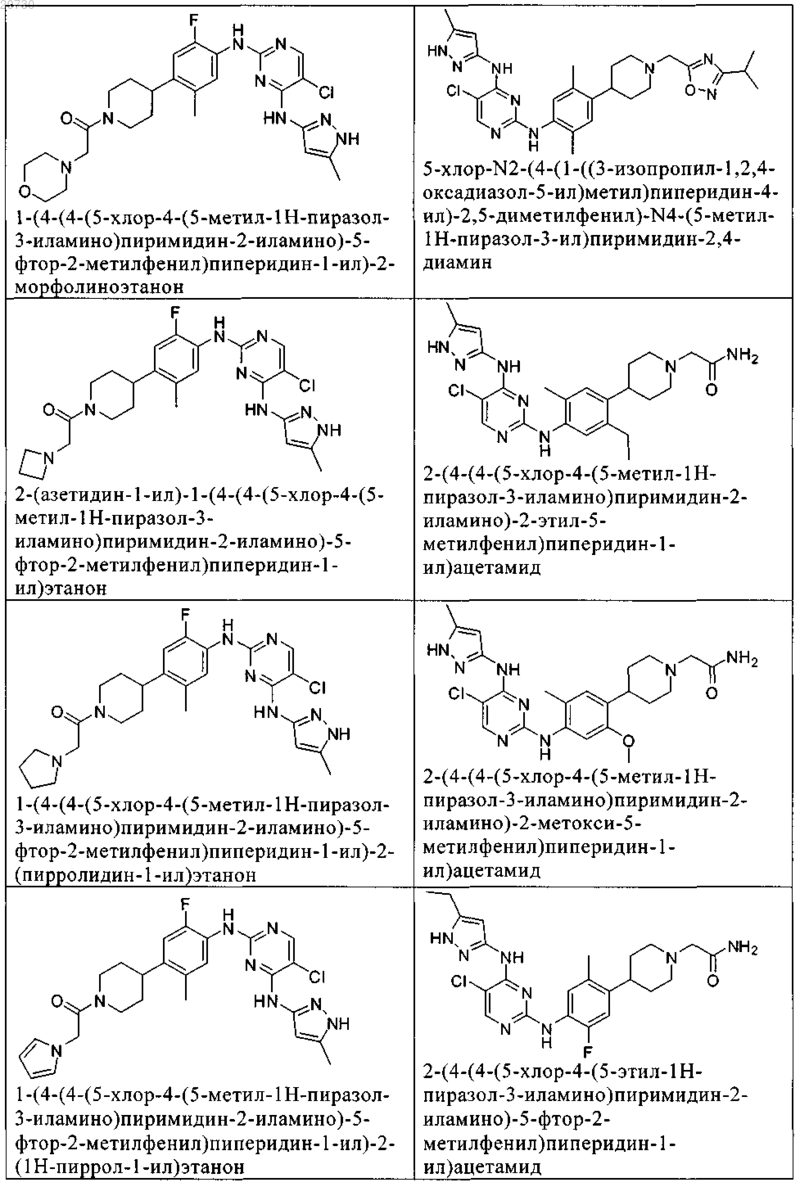
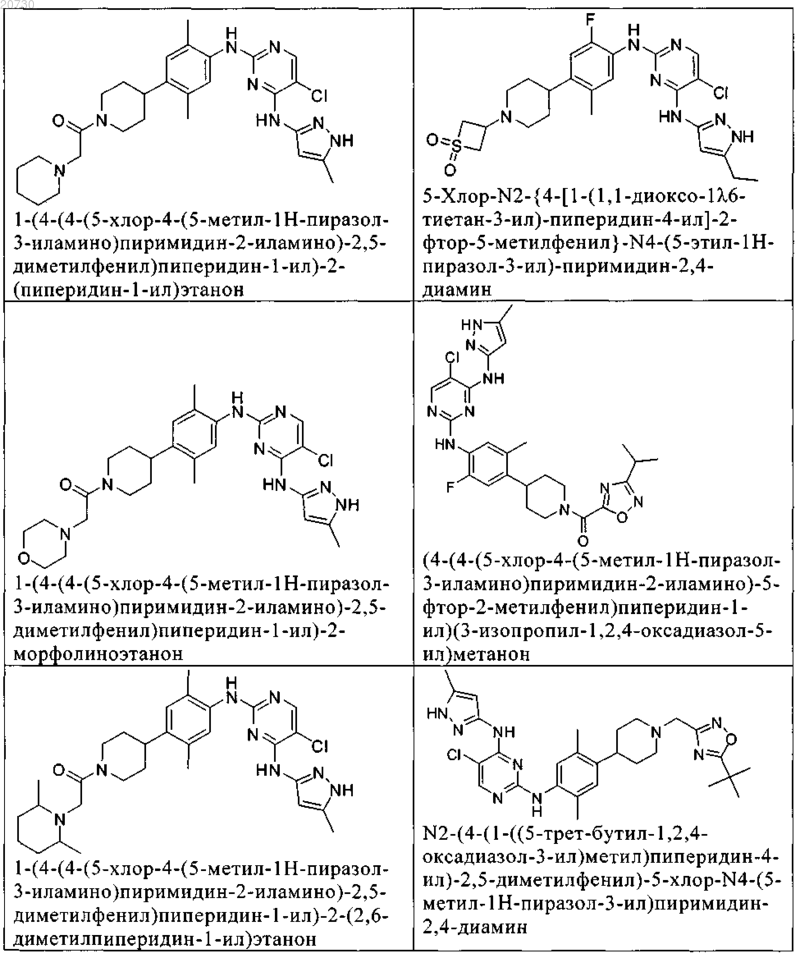
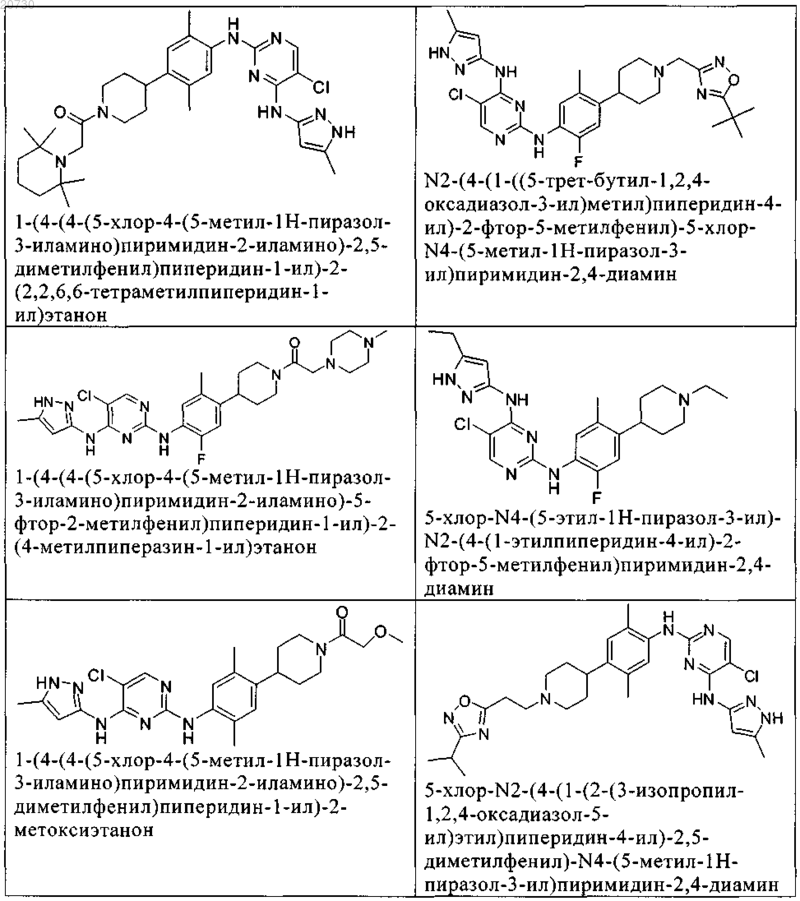
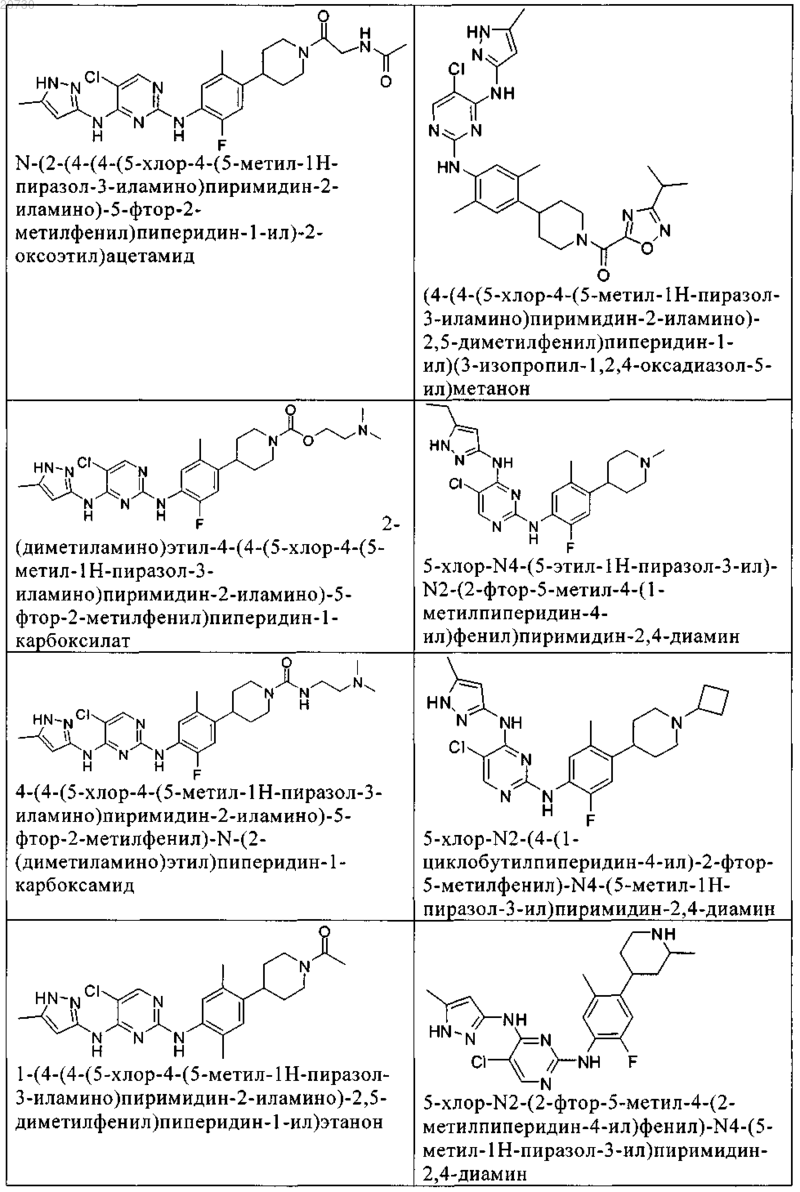
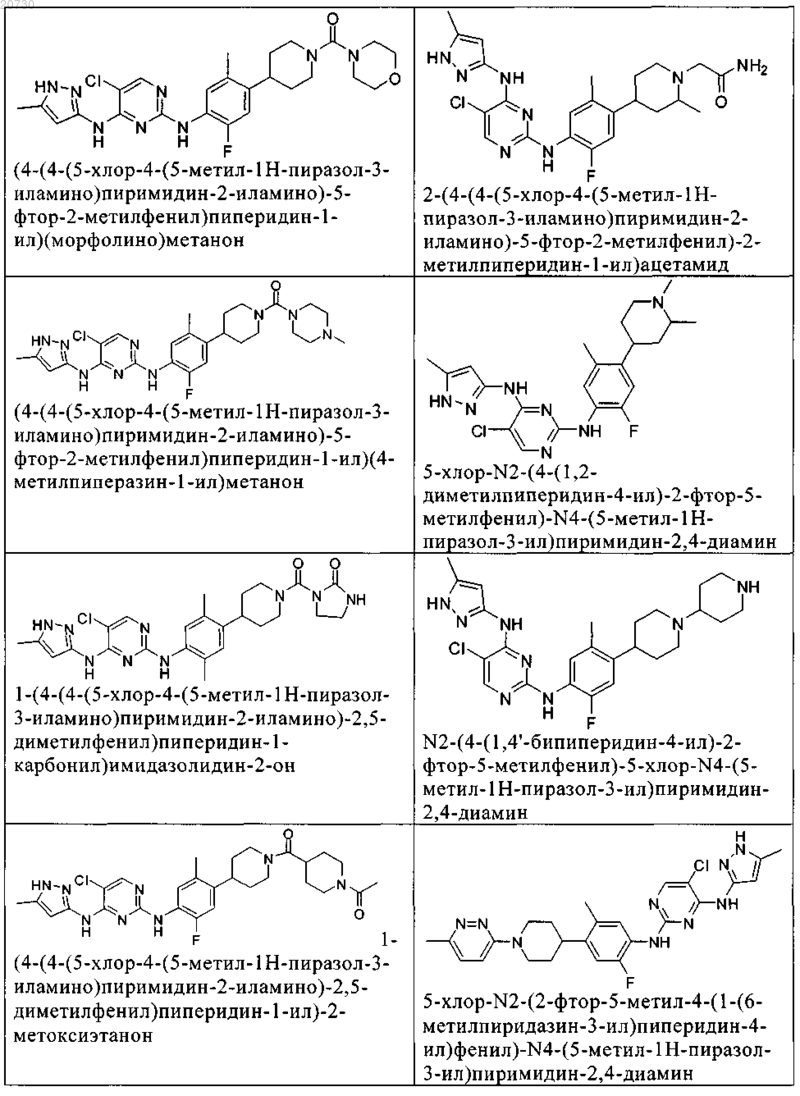
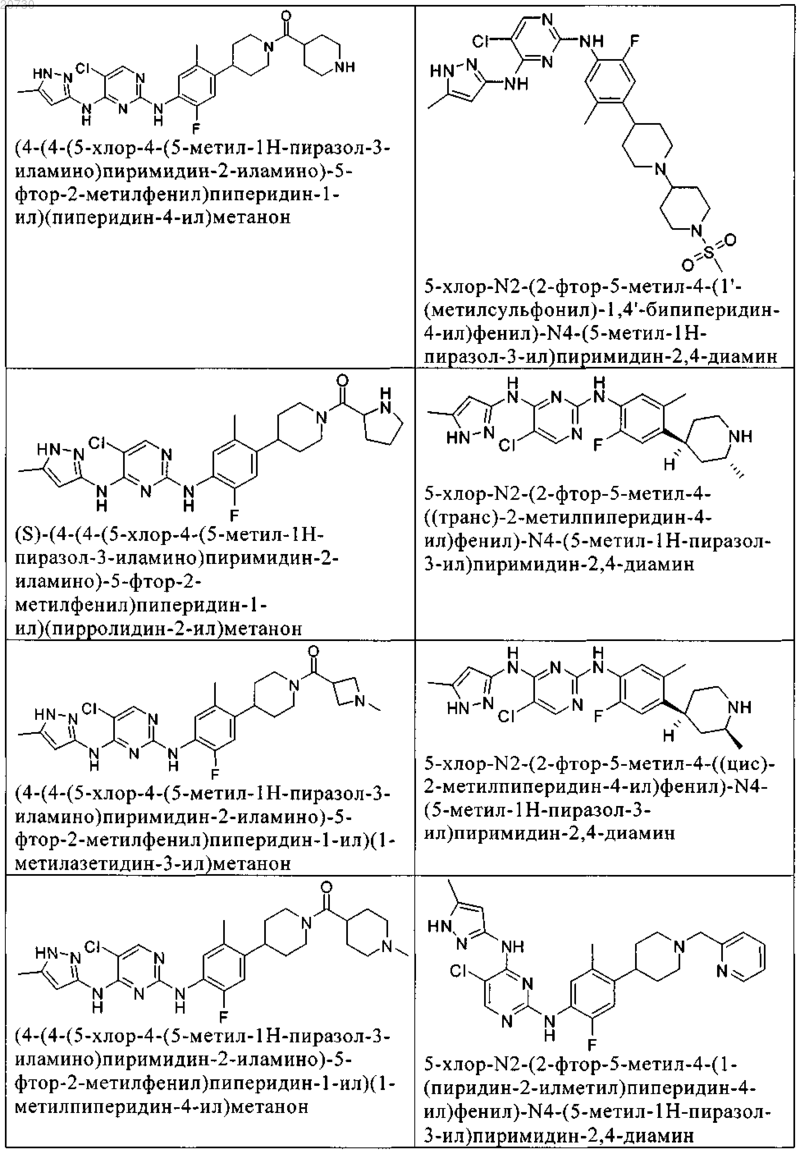

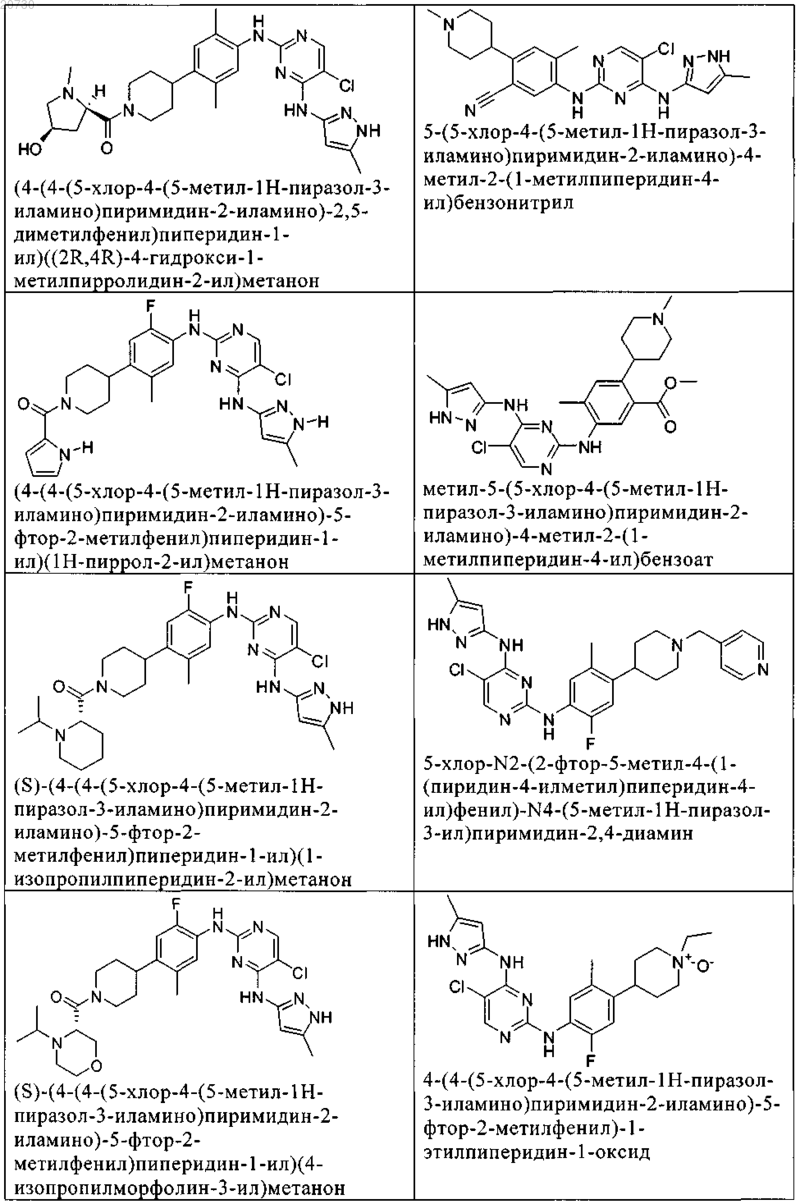
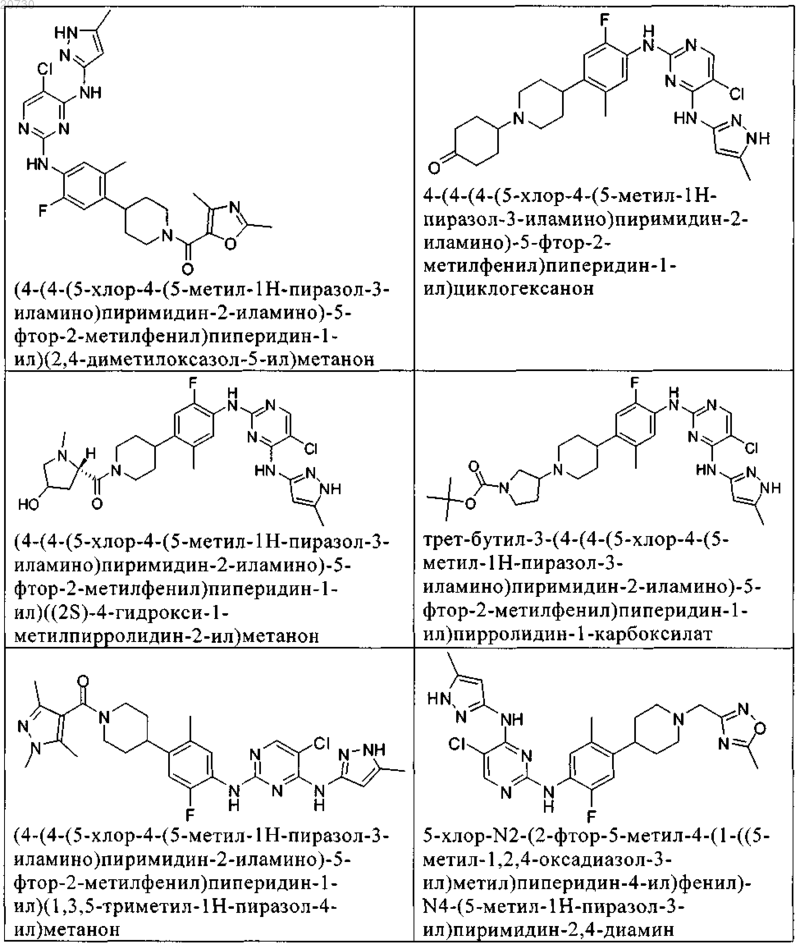
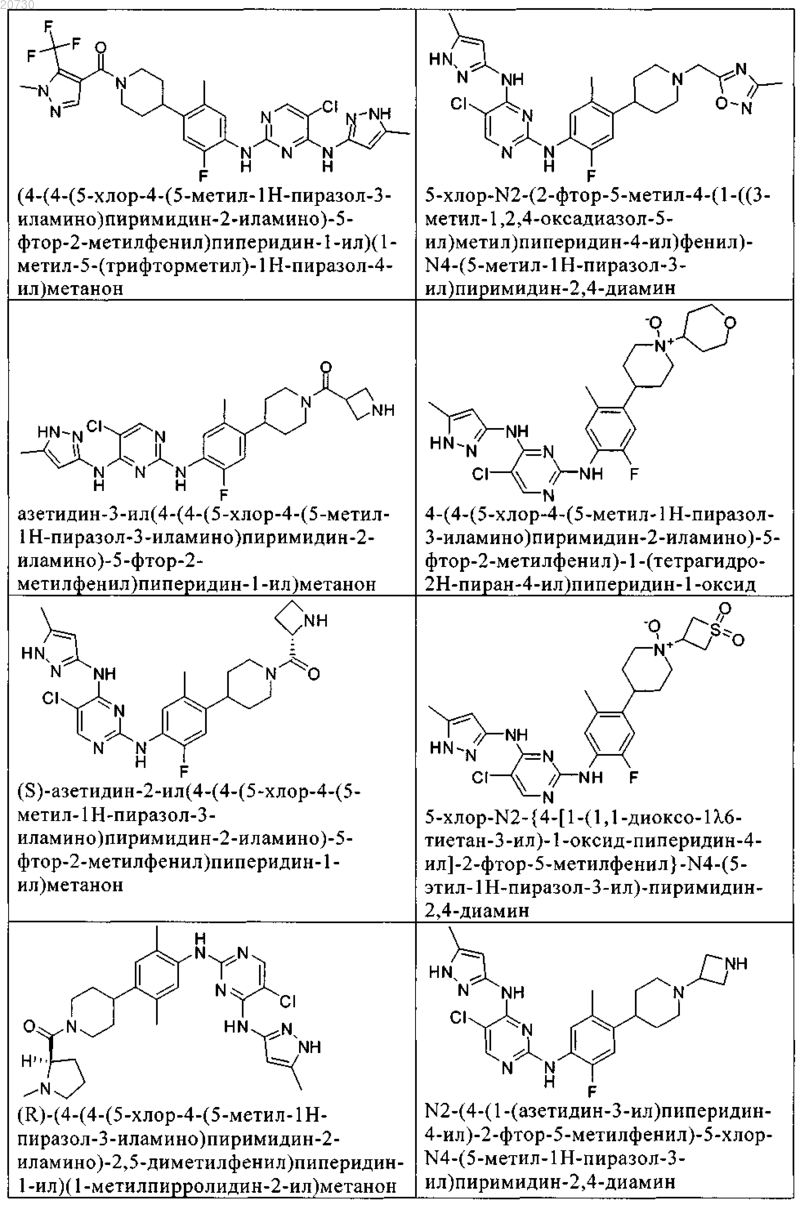
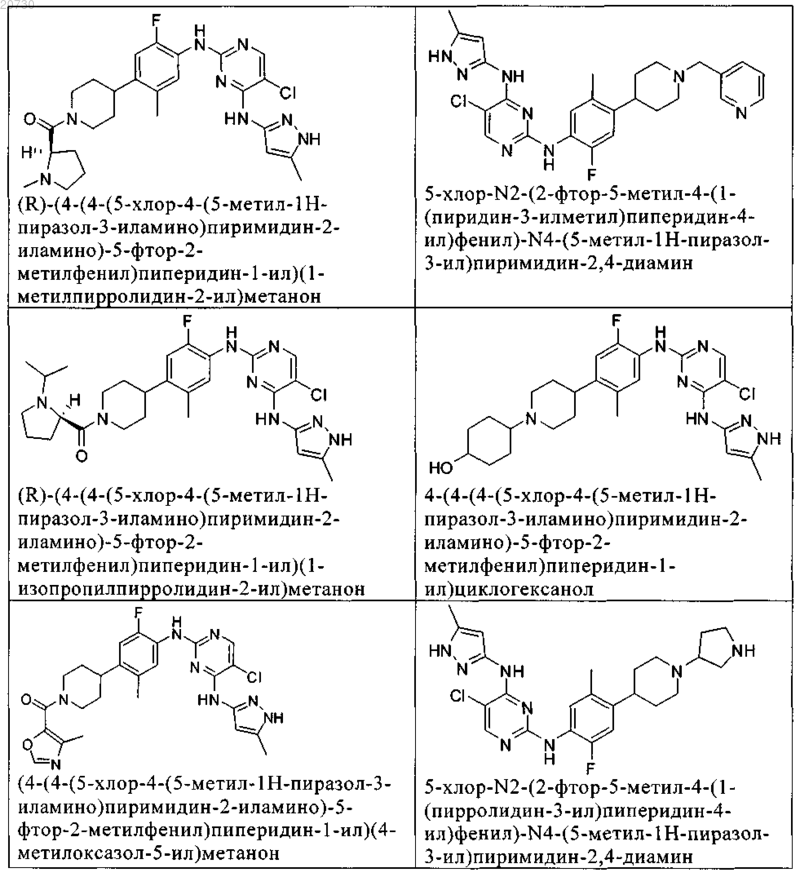
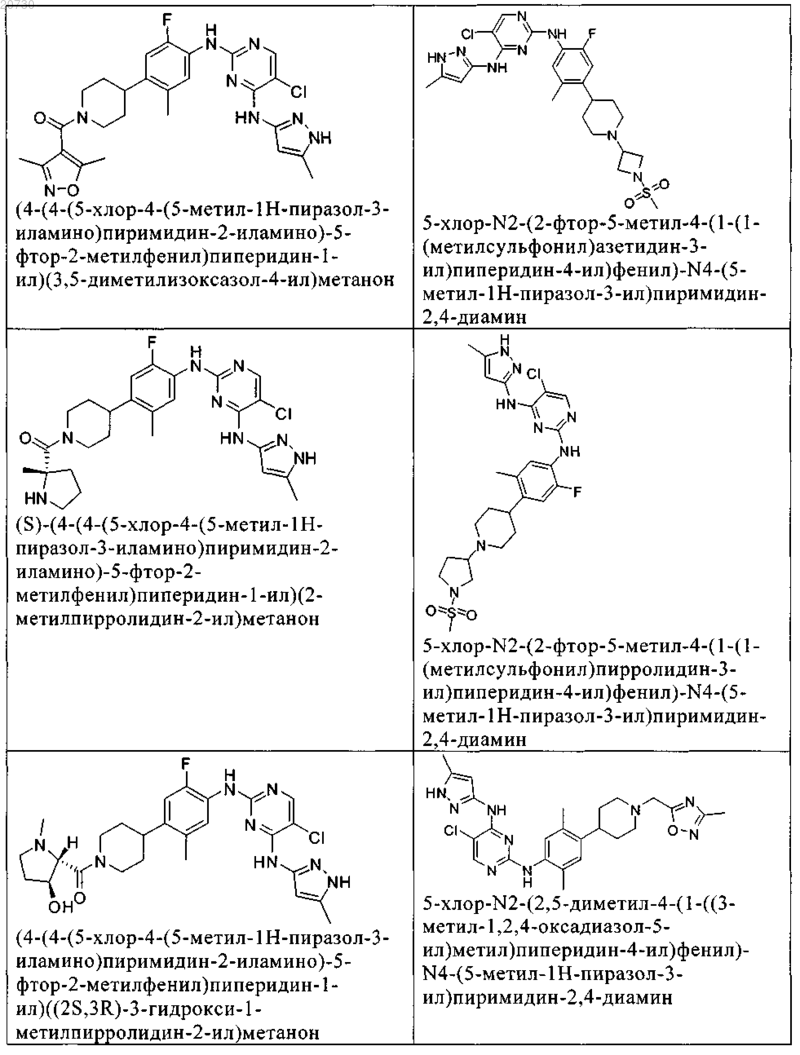
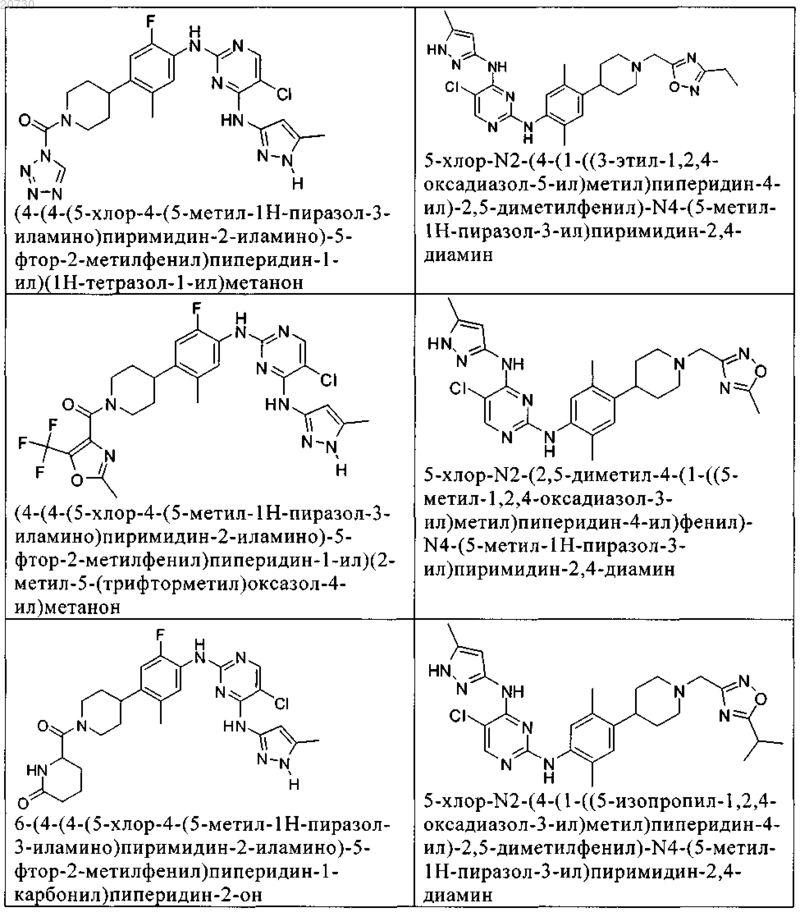
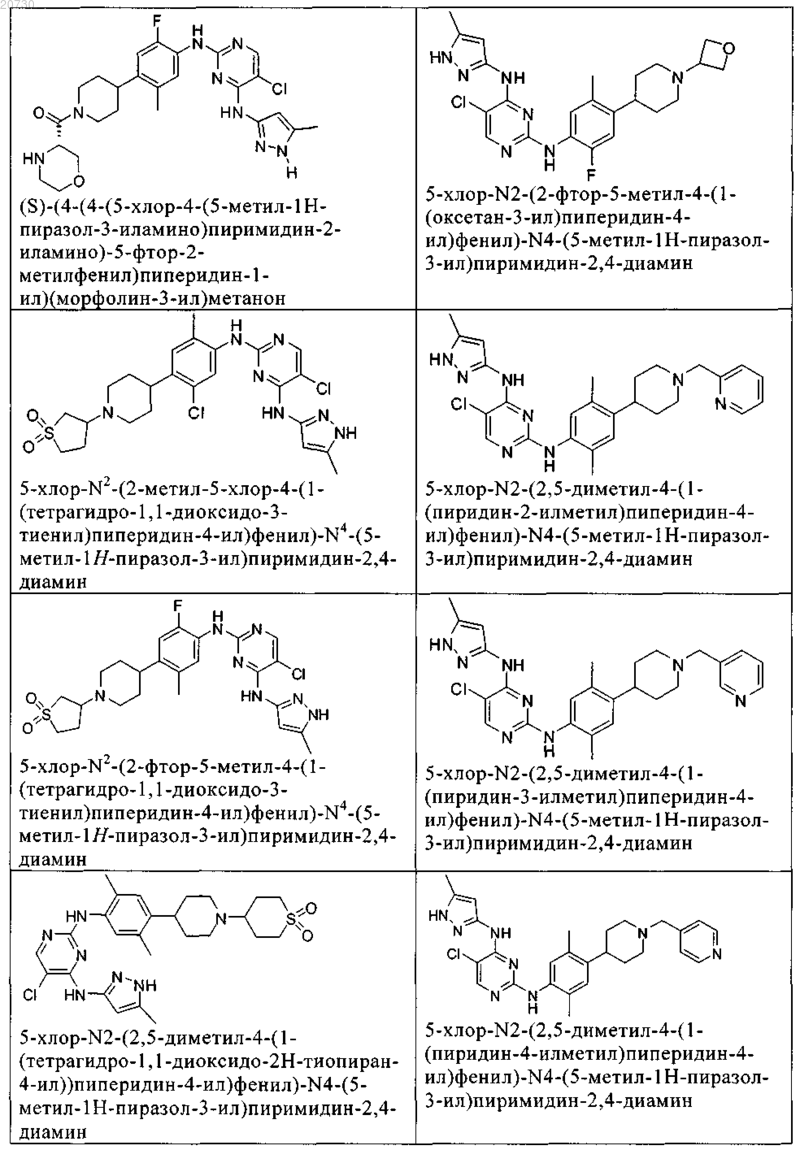


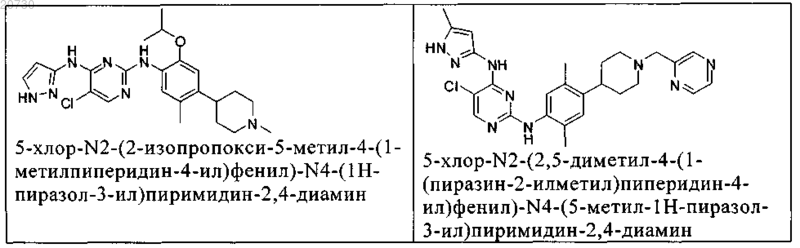
11. Соединение по пп.1-10, где указанное соединение представляет собой 5-хлор-N2-(2-фтор-5-метил-4-(1-(1,1-диоксидо-3-тиетанил)пиперидин-4-ил)фенил)-N4-(5-метил-1Н-пиразол-3-ил)пиримидин-2,4-диамин или его физиологически приемлемая соль.
12. Соединение по пп.1-10, где указанное соединение представляет собой 5-хлор-N2-(2-фтор-5-метил-4-(1-(тетрагидро-2Н-пиран-4-ил)пиперидин-4-ил)фенил)-N4-(5-метил-1Н-пиразол-3-ил)пиримидин-2,4-диамин или его физиологически приемлемая соль.
13. Соединение по пп.1-10, где указанное соединение представляет собой 5-хлор-N2-(4-(1-этилпиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1Н-пиразол-3-ил)пиримидин-2,4-диамин или его физиологически приемлемая соль.
14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 в терапевтически эффективном количестве и физиологически приемлемый носитель, предназначенная для лечения патологического состояния, опосредуемого IGF-1R, у страдающего от него млекопитающего, где указанным патологическим состоянием является множественная миелома, нейробластома, синовиальная саркома, печеночно-клеточная саркома, саркома Юинга или солидная опухоль, выбранная из группы, включающей остеосаркому, меланому и опухоль молочной железы, почки, предстательной железы, колоректальную опухоль, опухоль щитовидной железы, яичников, поджелудочной железы, легких, матки или желудочно-кишечную опухоль.
15. Применение соединения по любому из пп.1-13 или его физиологически приемлемой соли для лечения патологического состояния, опосредуемого IGF-1R, у страдающего от него млекопитающего, где указанным патологическим состоянием является множественная миелома, нейробластома, синовиальная саркома, печеночно-клеточная саркома, саркома Юинга или солидная опухоль, выбранная из группы, включающей остеосаркому, меланому и опухоль молочной железы, почки, предстательной железы, колоректальную опухоль, опухоль щитовидной железы, яичников, поджелудочной железы, легких, матки или желудочно-кишечную опухоль.
16. Применение соединения по любому из пп.1-13 или его физиологически приемлемой соли для приготовления лекарственного средства, предназначенного для лечения патологического состояния, опосредуемого IGF-1R или киназой анапластической лимфомы, где указанным патологическим состоянием является аутоиммунное заболевание, реакция трансплантат против хозяина, инфекционное заболевание или пролиферативное клеточное нарушение.
17. Применение соединения по любому из пп.1-13 или его физиологически приемлемой соли в комбинации со вторым терапевтическим средством, которое является химиотерапевтическим средством, для лечения опосредуемого IGF-1R патологического состояния у страдающего от него млекопитающего, где указанным патологическим состоянием является множественная миелома, нейробластома, синовиальная саркома, печеночно-клеточная саркома, саркома Юинга или солидная опухоль, выбранная из группы, включающей остеосаркому, меланому и опухоль молочной железы, почки, предстательной железы, колоректальную опухоль, опухоль щитовидной железы, яичников, поджелудочной железы, легких, матки или желудочно-кишечную опухоль.
18. Применение соединения по любому из пп.1-13 или его физиологически приемлемой соли в комбинации со вторым терапевтическим средством, которое является химиотерапевтическим средством, для приготовления лекарственного средства, предназначенного для лечения патологического состояния, опосредуемого IGF-1R или киназой анапластической лимфомы, где указанным патологическим состоянием является аутоиммунное заболевание, реакция трансплантат против хозяина, инфекционное заболевание или пролиферативное клеточное нарушение.
Текст
В патенте описаны новые производные пиримидина и содержащие их фармацевтические композиции и способы применения таких соединений. Например, производные пиримидина,предлагаемые в настоящем изобретении, можно применять для лечения, облегчения протекания или предупреждения патологического состояния, которое реагирует на ингибирование инсулиноподобного фактора роста (IGF-1R) или киназы анапластической лимфомы (ALK). Перекрестная ссылка на родственные заявки По настоящей заявке испрашивается приоритет по предварительным заявкам U.S.61/075583,поданной 25 июня 2008 г., и 61/155434, поданной 25 февраля 2009, каждая из которых во всей своей полноте включена в настоящее изобретение в качестве ссылки. Область техники, к которой относится изобретение Изобретение относится к ингибиторам протеинкиназы, точнее к новым производным пиримидина и к содержащим их фармацевтическим композициям и к их применению в качестве лекарственных средств. Уровень техники Передача сигнала инсулиноподобного фактора роста (IGF-1) в значительной степени связана с раком и рецептор IGF-1 (IGF-1R) является преобладающим фактором. IGR-1R важен для преобразования опухоли и жизнеспособности злокачественных клеток, но лишь частично участвует в росте нормальных клеток. Предположено, что воздействие на IGF-1R является перспективным путем лечения рака (Larsson etal., Br. J. Cancer 92:2097-2101 (2005. Киназа анапластической лимфомы (ALK), представитель семейства инсулиновых рецепторов рецепторных тирозинкиназ, участвует в онкогенезе гематопоэтических и негематопоэтических опухолей. Описано аберрантное экспрессирование полноразмерных рецепторных белков ALK в нейробластомах и глиобластомах; и белки слияния ALK обнаруживаются в анапластической крупноклеточной лимфоме. Исследование белков слияния ALK также указало на увеличение вероятности разработки новых терапевтических средств лечения пациентов с ALK-позитивными злокачественными новообразованиями (Pulford et al., Cell. Mol. Life Sci. 61:2939-2953 (2004. Вследствие появления новых данных о роли IGF-1R и ALK постоянно необходимы соединения, которые можно использовать для лечения и предупреждения заболевания, которое реагирует на ингибирование IGF-1R и ALK. Описание изобретения Изобретение относится к новым производным пиримидина и содержащим их фармацевтическим композициям и к их применению в качестве лекарственных средств. Одним объектом настоящего изобретения является соединение формулы (1) или его физиологически приемлемая соль; где кольцо Е необязательно может содержать двойную связь; один из Z1, Z2 и Z3 обозначает NR6, N(R6)+-O- или S(O)1-2, а другие обозначают CR2;R1 обозначает галоген или необязательно галогенированный C1-С 6-алкил;R2 обозначает пиридин-2-онил, азепан-2-онил или моноциклический 5-6-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, О и S, каждый из которых необязательно замещен R9, где R9 обозначает C1-С 6-алкил, C1-С 6-галогеналкил или С 3-С 7 циклоалкил;R6 обозначает Н; C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7, (CR2)pNR(CR2)pOR7, (CR2)pNR-L-C(O)R8, C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, -C(O) -(CR2)p-OR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7,-L-C(O)NR(CR2)pOR7, -L-C(O)-(CR2)q-NR-C(O)-R8, -L-C(O)NR(CR2)pSR7, -L-C(O)NR(CR2)pS(O)1-2R8,-L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7, -L-S(O)2NR(CR2)pNR(R7) или -L-S(O)2NR(CR2)pOR7; альтернативно, R6 обозначает радикал, выбранный из формулы (а), (b), (с) или (d):R11, R12, R13, R14, R15 и R16 независимо выбраны из группы, включающей Н, C1-С 6-алкоксигруппу,C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой или гидроксигруппами; или R11 и R12, R12 и R15, R15 и R16, R13 и R14, или R13 иR15 вместе с атомами, к которым они присоединены, могут образовать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5; или R11 и R12 вместе с атомом углерода, к кото-1 020730 рому они присоединены, могут образовать циклопропил или циклобутил; или R15 и R16 вместе с атомом азота, к которому они присоединены, могут образовать 2,2,6,6-тетраметилпиперидинил-1-ил;Y обозначает С 3-С 7-карбоциклическое кольцо, С 6-С 10-арил или 5-10-членный гетероарил, содержащий 1-4 гетероатома, выбранных из N, О и S, или 4-10-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, каждое из которых необязательно замещено 1-3 группами R5;R7, R8 и R8a независимо обозначают C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой, гидроксигруппой или цианогруппой; (CR2)qY или C1-С 6-алкоксигруппу; или R7 обозначает Н; каждый R независимо обозначает Н или C1-С 6-алкил;R и R7 вместе с N в каждом NRR7 может образовать 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5;m равно 2-4; р равно 1-4; и q равно 0-4. В одном варианте осуществления настоящее изобретение относится к соединению формулы (2) где один из R5a, R5b и R5c обозначает Н, а другие независимо обозначают галоген, C1-С 6-алкил, C1 С 6-алкоксигруппу, галогензамещенный C1-С 6-алкил, цианогруппу или C(O)O0-1R8, где R8 обозначает C1 С 6-алкил; и R1, R2, R3, R4, E, Z1, Z2 и Z3 являются такими, как определено для формулы (1). В некоторых примерах Z3 в приведенной выше формуле (2) обозначает NR6 или N(R6)+-O-; и Z1 и Z2 обозначают СН 2. В других примерах R6 обозначает Н, C1-С 6-алкил, необязательно замещенный галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, L-Y, (CR2)p-CN; (CR2)pNR(R7),-(CR2)p-C(O)OR7,C(O)(CR2)qOR8,-C(O)O-(CR2)p-NRR7,-L-C(O)R7,-L-C(O)-NRR7,7 8 8 7R7, R8, R10, R11, R12, R13, R14, R15, R16, R, L, Y, p и q являются такими, как определено для формулы В приведенной выше формуле (1) и (2) R2 может обозначать пиразолил, изоксазолил, пиридин-2 онил или азепан-2-онил, каждый из которых замещен C1-С 6-алкилом, C1-С 6-галогеналкилом или С 3-С 7 циклоалкилом. В другом варианте осуществления настоящее изобретение относится к соединению формулы (3)R6 обозначает Н, C1-С 6-алкил, необязательно замещенный галогеном и/или гидроксигруппами;-(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7,C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7, -L-C(O)(CR2)q-NR-C(O)-R8, -L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7 или радикал, выбранный из формулы (а), (b), (с) или (d):R1, R3, R4, R7, R8, R10, R11, R12, R13, R14, R15, R16, R, L, Y, p, q и Е являются такими, как определено для формулы (1). В приведенной выше формуле (3) R5a может обозначать галоген и R5c обозначает C1-С 6-алкил. В некоторых примерах R6 обозначает C1-С 6-алкил или радикал формулы (а) или (с); и R10 обозначает О. В приведенной выше формуле (1), (2) и (3) R1 может обозначать галоген. В предпочтительных примерах R1 обозначает хлор. В других примерах R3 и R4 обозначают Н. Другим объектом настоящего изобретения являются фармацевтические композиции, содержащие соединение формулы (1), (2) и (3) и физиологически приемлемый инертный наполнитель. Еще одним объектом настоящего изобретения являются способы ингибирования IGF-1R в клетке,включающие взаимодействие клетки с соединением формулы (1), (2) и (3) или содержащей его фармацевтической композицией в эффективном количестве. Альтернативно, настоящее изобретение относится к применению соединения формулы (1), (2) и (3),и необязательно в комбинации со вторым терапевтическим средством, для приготовления лекарственного средства, предназначенного для лечения патологического состояния, опосредуемого IGF-1R или ALK. Соединения, предлагаемые в настоящем изобретении, можно вводить, например млекопитающему, страдающему от аутоиммунного заболевания, реакции трансплантат против хозяина, инфекционного заболевания или пролиферативного клеточного нарушения. В предпочтительных примерах соединения, предлагаемые в настоящем изобретении, можно использовать по отдельности или в комбинации с химиотерапевтическим средством для лечения пролиферативного клеточного нарушения, включая, но не ограничиваясь только ими, множественную миелому, нейробластому, синовиальную саркому, печеночноклеточную саркому, саркому Юинга или солидную опухоль, выбранную из группы, включающей остеосаркому, меланому и опухоль молочной железы, почки, предстательной железы, колоректальную опухоль, щитовидной железы, яичников, поджелудочной железы, легких, матки или желудочно-кишечную опухоль. Определения"Алкил" означает фрагмент и структурный элемент других групп, например, галогензамещенного алкила и алкоксигруппы, и он может обладать линейной или разветвленной цепью. Необязательно замещенный алкил, алкенил или алкинил при использовании в настоящем изобретении может быть необязательно галогенирован (например, CF3) или содержащиеся в нем один или большее количество атомов углерода могут быть замещены или заменены гетероатомом, таким как NR, О или S (например,-ОСН 2 СН 2 О-, алкилтиогруппы, тиоалкоксигруппа, алкиламины и т.п.)."Арил" означает моноциклическое или конденсированное бициклическое ароматическое кольцо,содержащее атомы углерода. "Арилен" означает двухвалентный радикал, образованный из арильной группы. Например, арильная группа может представлять собой фенил, инденил, инданил, нафтил, или 1,2,3,4-тетрагидронафталинил, который необязательно может быть замещен в орто-, мета- или параположении."Гетероарил" при использовании в настоящем изобретении является таким, как определенный выше арил, в котором один или большее количество элементов кольца представляет собой гетероатом. Например, гетероарильным заместителем для использования в соединениях, предлагаемых в настоящем изобретении, может быть моноциклический или бициклический 5-10-членный гетероарил, содержащий 1-4 гетероатома, выбранных из N, О и S. Примеры гетероарилов включают, но не ограничиваются только ими, пиридил, пиразинил, индолил, индазолил, хиноксалинил, хинолинил, бензофуранил, бензопиранил,бензотиопиранил, бензо[1,3]диоксол, имидазолил, бензоимидазолил, пиримидинил, фуранил, оксазолил,изоксазолил, триазолил, бензотриазолил, тетразолил, пиразолил, тиенил, пирролил, изохинолинил, пуринил, тиазолил, тетразинил, бензотиазолил, оксадиазолил, бензоксадиазолил и т.п."Карбоциклическое кольцо" при использовании в настоящем изобретении означает насыщенное или частично ненасыщенное моноциклическое, конденсированное бициклическое или мостиковое полициклическое кольцо, содержащее атомы углерода, которые необязательно могут быть замещены, например, с помощью =О. Примеры карбоциклических колец включают, но не ограничиваются только ими,циклопропил, циклобутил, циклопентил, циклогексил, циклопропилен, циклогексанон и т.п."Гетероциклическое кольцо" при использовании в настоящем изобретении является таким, как определенное выше карбоциклическое кольцо, в котором один или большее количество кольцевых атомов углерода представляет собой гетероатом. Например, гетероциклическое кольцо может представлять собой 4-7-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, или их комбинацию, такую как S(O) или S(O)2. Примеры гетероциклических колец включают, но не ограничиваются только ими, азетидинил, морфолиновую группу, пирролидинил, пирролидинил-2-он, пиперазинил, пиперидинил, пиперидинилон, 1,4-диокса-8-азаспиро[4.5]дец-8-ил, 1,2,3,4-тетрагидрохинолинил и т.п. Гетероциклические кольца при использовании в настоящем изобретении могут включать бициклические амины и бициклические диамины. При использовании в настоящем изобретении атом Н в любых замещающих группах (например,-3 020730 СН 2) включает все его подходящие изотопы, например Н, 2 Н и 3 Н. Термин "фармацевтическая комбинация" при использовании в настоящем изобретении означает препарат, который получен смешиванием или объединением активных ингредиентов, и включает и фиксированные, и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" означает, что активные ингредиенты, например, соединение формулы (1) и дополнительное средство, оба вводят пациенту одновременно в виде одного препарата или дозированной формы. Термин(1) дополнительное средство, оба вводят пациенту в виде отдельных препаратов одновременно, по отдельности или последовательно без наложения специальных ограничений по времени, и при таком введении в организме пациента создаются терапевтически эффективные уровни активных ингредиентов. Последнее также относится к смешанному лечению, например с введением трех или более активных ингредиентов."Млекопитающее" означает любое животное, относящееся к млекопитающим, включая людей, домашних и сельскохозяйственных животных и животных в зоопарках, животных, использующихся в занятиях спортом, или комнатных животных, таких как собаки, кошки, крупный рогатый скот, лошади, овцы,свиньи, козы, кролики и т.п. В предпочтительных примерах млекопитающим является человек. Термин "введение" соединения, предлагаемого в настоящем изобретении, означает доставку соединения, предлагаемого в настоящем изобретении, и его пролекарств субъекту, нуждающемуся в лечении. Введение "в комбинации с" одним или большим количеством дополнительных терапевтических средств включает совместное (одновременное) и последовательное введение в любом порядке и по любому пути введения."Эффективное количество" соединения означает количество, достаточное для достижения конкретной заданной цели. "Эффективное количество" для заданной цели можно определить эмпирически и стандартным образом. Термин "терапевтически эффективное количество" означает количество соединения (например, антагониста IGF-1R), эффективное для лечения опосредуемого IGF-1R нарушения у субъекта или млекопитающего. В случае рака, терапевтически эффективное количество лекарственного препарата может уменьшить количество раковых клеток, уменьшить размер опухоли, подавить (т.е. до некоторой степени замедлить и предпочтительно остановить) инфильтрацию раковых клеток в периферийные органы, подавить (т. е. до некоторой степени замедлить и предпочтительно остановить) метастазирование опухоли, до некоторой степени подавить рост опухоли и/или до некоторой степени смягчить один или большее количество симптомов, связанных с раком. Смотри также определение "лечения" в настоящем изобретении. В соответствии со степенью предупреждения роста и/или уничтожения имеющихся раковых клеток лекарственный препарат может быть цитостатическим и/или цитотоксическим. Термин "рак" означает физиологическое состояние млекопитающих, которое обычно характеризуется нерегулируемым ростом/пролиферацией клеток. Примеры рака включают, но не ограничиваются только ими: карциному, лимфому, бластому и лейкоз. Более конкретные примеры рака включают, но не ограничиваются только ими: хронический лимфолейкоз (CLL), рак легких, включая немелкоклеточный(NSCLC), молочной железы, яичников, шейки матки, эндометрия, предстательной железы, колоректальный, интестинальный карциноидный, мочевого пузыря, желудка, поджелудочной железы, печени (гепатоцеллюлярный), гепатобластому, пищевода, аденокарциному легких, мезотелиому, синовиальную саркому, остеосаркому, плоскоклеточную карциному головы и шеи, ювенильную носоглоточную ангиофиброму, липосаркому, рак щитовидной железы, меланому, базально-клеточную карциному (ВСС), медуллобластому и десмому."Лечить" или "лечение", или "облегчение протекания" означает терапевтические и профилактические или предупредительные меры, при которых задачей является предупреждение или замедление (ослабление) целевого патологического состояния или заболевания, или нарушения. Нуждающиеся в лечении включают тех, кто уже страдает от нарушения, а также тех, которые подвержены нарушению, и тех,у которых необходимо предупредить нарушение (провести профилактику). Если заболеванием, опосредуемым IGF-1R, является рак, то субъект или млекопитающее успешно подвергается лечению или у него уменьшается масса опухоли, если после введения терапевтического количества антагониста IGF-1R, соответствующего способам, предлагаемым в настоящем изобретении, у субъекта проявляется наблюдающееся и/или измеримое уменьшение или отсутствие одного или большего количества из следующих проявлений: уменьшение количества или отсутствие раковых клеток, уменьшение размера опухоли, подавление (т.е. до некоторой степени замедление и предпочтительно остановка) инфильтрации раковых клеток в периферийные органы, включая распространение рака в мягкие ткани и кости, подавление (т.е. до некоторой степени замедление и предпочтительно остановка) метастазирования опухоли, до некоторой степени подавление роста опухоли, и/или до некоторой степени смягчение одного или большего количества симптомов, связанных с конкретным типом рака, снижение заболеваемости и смертности и улучшение качества жизни. В соответствии со степенью предупреждения роста и/или уничтожения имеющихся раковых клеток антагонист IGF-1R может быть цитостатическим и/или цитотоксическим. Пациент также может ощутить ослабление этих признаков или симптомов."Носители" при использовании в настоящем изобретении включают фармацевтически приемлемые носители, инертные наполнители и стабилизаторы, которые при использующихся дозах и концентрациях нетоксичны по отношению к клеткам или млекопитающему, подвергающимся их воздействию. Часто физиологически приемлемым носителем является забуференный водный раствор. Примеры физиологически приемлемых носителей включают буферы, такие как фосфатный, цитратный и основанные на других органических кислотах; антиоксиданты, включая аскорбиновую кислоту; обладающие небольшой молекулярной массой(менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, в том числе глюкоза, манноза или декстрины; хелатные реагенты, такие как ЭДТК (этилендиаминтетрауксусная кислота); гидроксисахара, такие как маннит или сорбит; солеобразующие противоионы, такие как ион натрия; и/или неионогенные поверхностно-активные вещества, такие как TWEEN, полиэтиленгликоль (ПЭГ) и PLURONICS."Химиотерапевтическое средство" является химическим соединением, применимым для лечения рака. Примеры химиотерапевтических средств включают алкилирующие средства, такие как тиотепа и ЦИТОКСАН циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метиламеламины,включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в особенности буллатацин и буллатацинон); дельта-9-тетрагидроканнабинол(включая синтетический аналог топотекан (ГИКАМТИН), СРТ-11 (иринотекан, КАМПТОСАР), ацетилкамптотецин, скополектин и 9-аминокамптотецин); бриостатин; каллистатин; СС-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); подофиллотоксин; подофиллиновая кислота; тенипозид; криптофицины (в особенности криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги, KW-2189 и СВ 1-ТМ 1); элейтеробин; панкратистатин; саркодиктин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин,ифосфамид, мехлорэтамин, мехлорэтаминоксид гидрохлорид, мелфалан, новэмбихин, фенестерин, преднимустин, трофосфамид, урацилизотиоцианат; нитрозомочевины, такие как кармустин, хлорзотоцин,фотемустин, ломустин, нимустин и ранимнустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в особенности калихеамицин гамма-1I и калихеамицин омега-I1 (см., например,Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994; динемицин, включая динемицин А; эсперамицин; а также хромофор неокарзиностатина и родственные хромофоры хромпротеинового энедиинового антибиотика), аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин,каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5 оксо-L-норлейцин, доксорубицин АДРИАМИЦИН (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин С, микофеноловая кислота, ногаламицин,оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин,стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; пиримидин аналоги, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, дромостанолонпропионат,эпитиостанол, мепитиостанол, тестолактон; средства, снижающие секрецию надпочечников, такие как аминоглютетимид, митотан, трилостан; средства, увеличивающие содержание фолиевой кислоты, такие как фролиновая кислота; ацеглатон; альдофосфамид гликозид; аминолевулиновая кислота; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элфомитин; эллиптинийацетат; эпотилон; этоглуцид; нитрат галлия; гидроксимочевина; лентинан; лонидаинин; майтансиноиды, такие как майтансин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лосоксантрон; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновая кислота; триазиквон; 2,2',2"-трихлортриэтиламин; трихотецены (в особенности токсин Т-2, верракурин А, роридин А и ангуидин); уретан; виндезин (ЭЛДИЗИН, ФИЛДЕЗИН); дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид ("Ara-С"); тиотепа; таксоиды,например, паклитаксел ТАКСОЛ (Bristol-Myers Squibb Oncology, Princeton, N.J.), АБРАКСАН, не содержащий кремофора полученный с помощью генной инженерии из альбумина препарат наночастиц паклитаксела (American Pharmaceutical Partners, Schaumberg, I11.) и доксетаксел ТАКСОТЕР (RhonePoulenc Rorer, Antony, France); хлорамбуцил; гемцитабин (ГЕМЗАР); 6-тиогуанин; меркаптопурин; метотрексат; содержащие платину аналоги, такие как цисплатин и карбоплатин; винбластин (ВЕЛБАН); платина; этопозид (VP-16); ифосфамид; митоксантрон; винкристин (ОНКОВИН); оксалиплатин; лейко-5 020730 ворин; винорелбин (НАВЕЛБИН); новантрон; эдатрексат; дауномицин; аминоптерин; ибандронат; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; капецитабин (КСЕЛОДА); фармацевтически приемлемые соли, кислоты или производные любых из указанных выше, а также комбинации двух или большего количества из указанных выше, такие как CHOP, аббревиатура комбинированного средства, включающего циклофосфамид, доксорубицин,винкристин и преднизолон, и ФОЛФОКС, аббревиатура режима лечения оксалиплатином(ЭЛОКСАТИН) вместе с 5-FU и лейковорином. Кроме того, "химиотерапевтическое средство" может включать антигормональные средства, которые действуют путем регулирования, уменьшения, блокирования или подавления воздействия гормонов,которые могут стимулировать рост рака, и часто используются в качестве системного или воздействующего на весь организм лечения. Ими могут быть сами гормоны. Примеры включают антиэстрогены и селективные модуляторы эстрогенового рецептора (SERMs), включая, например, тамоксифен (включая тамоксифен НОЛВАДЕКС), ралоксифен ЭВИСТА, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен ФАРЕСТОН; антипрогестероны; понижающие регуляторы эстрогенового рецептора (ERDs); средства, которые действуют путем подавления или остановки действия яичников, например, агонисты рилизинг-фактора лютеинизирующего гормона (LHRH),такие как ЛУПРОН и лейпролидацетат ЭЛИГАРД, госерелинацетат, бусерелинацетат и триптерелин; другие антиандрогены, такие как флутамид, нилутамид и бикалутамид; и ингибиторы ароматазы, которые ингибируют фермент ароматазу, который регулирует продуцирование эстрогена в надпочечниках,такие как, например, 4(5)-имидазолы, аминоглютетимид, мегэстролацетат МЕГАСЕ, экземестан АРОМАЗИН, форместан, фадрозол, ворозол РИВИСОР, летрозол ФЕМАРА и анастрозол АРИМИДЕКС. Кроме того, такое определение химиотерапевтических средств включает бисфосфонаты, такие как клодронат (например, БОНЕФОС или ОСТАК), этидронат ДИДРОКАЛ, NE-58095,золедроновая кислота/золедронат ЗОМЕТА, алендронат ФОСАМАКС, памидронат АРЕДИА, тилудронат СКЕЛИД или ризедронат АКТОНЕЛ; а также троксацитабин (аналог 1,3-диоксоланового нуклеозида цитозина); антисмысловые олигонуклеотиды, в особенности те, которые ингибируют экспрессирование генов на путях передачи сигналов, участвующих в аберрантной пролиферации клеток,такие как, например, PKC-альфа, Raf, H-Ras и рецептор эпидермального фактора роста (EGF-R); вакцины, такие как вакцина ТЕРАТОП и вакцины для генной терапии, например, вакцина АЛЛОВЕКТИН,вакцина ЛЕЙВЕКТИН и вакцина ВАКСИД; ингибитор топоизомеразы 1 ЛУРТОТЕКАН; АБАРЕЛИКС rmRH; лапатинибдитозилат (ErbB-2 и EGFR небольшая молекула - двойной ингибитор тирозинкиназы, также известный, как GW572016); и фармацевтически приемлемые соли, кислоты или производные любых из указанных выше. Способы осуществления изобретения Изобретение относится к новым производным пиримидина и к содержащим их фармацевтическим композициям и к способам применения таких соединений. Одним объектом настоящего изобретения является соединение формулы (1) или его физиологически приемлемая соль; где кольцо Е необязательно может содержать двойную связь; один из Z1, Z2 и Z3 обозначает NR6, N(R6)+-O- или S(O)1-2, а другие обозначают CR2;R1 обозначает галоген или необязательно галогенированный C1-С 6-алкил;R2 обозначает пиридин-2-онил, азепан-2-онил или моноциклический 5-6-членный гетероарил, содержащий 1-3 гетероатома, выбранных из N, О и S, каждый из которых необязательно замещен R9, где R9 обозначает C1-С 6-алкил, C1-С 6-галогеналкил или С 3-С 7-циклоалкил;R6 обозначает Н; С 1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном и/или гидроксигруппами; -(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7, (CR2)pNR(CR2)pOR7, (CR2)pNR-L-C(O)R8, C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, -C(O)-(CR2)p-OR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7,-L-C(O)NR(CR2)pOR7, -L-C(O)-(CR2)q-NR-C(O)-R8, -L-C(O)NR(CR2)pSR7, -L-C(O)NR(CR2)pS(O)1-2R8,-L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7, -L-S(O)2NR(CR2)pNR(R7) или -L-S(O)2NR(CR2)pOR7; альтернативно, R6 обозначает радикал, выбранный из формулы (а), (b), (с) или (d)R11, R12, R13, R14, R15 и R16 независимо выбраны из группы, включающей Н, C1-С 6-алкоксигруппу,C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой или гидроксигруппами; или R11 и R12, R12 и R15, R15 и R16, R13 и R14, или R13 иR15 вместе с атомами, к которым они присоединены, могут образовать 3-7-членное насыщенное, ненасыщенное или частично ненасыщенное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5; или R11 и R12 вместе с атомами, к которым они присоединены, могут образовать 3-4-членное насыщенное кольцо; или R15 и R16 вместе с атомами, к которым они присоединены, могут образовать 6-членное насыщенное кольцо, содержащее в качестве гетероатома N, замещенное 4 метильными групами;Y обозначает С 3-С 7-карбоциклическое кольцо, С 6-С 10-арил или 5-10-членный гетероарил, содержащий 1-4 гетероатома, выбранных из N, О и S, или 4-10-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, каждое из которых необязательно замещено 1-3 группами R5;R7, R8 и R8a независимо обозначают C1-С 6-алкил, С 2-С 6-алкенил или С 2-С 6-алкинил, каждый из которых необязательно может быть замещен галогеном, аминогруппой, гидроксигруппой или цианогруппой; (CR2)qY или C1-C6-алкоксигруппу; или R7 обозначает Н; каждый R независимо обозначает Н или C1-С 6-алкил;R и R7 вместе с N в каждом NRR7 может образовать 5-6-членное кольцо, содержащее 1-3 гетероатома, выбранных из N, О и S, и необязательно замещенное оксогруппой и 1-3 группами R5;m равно 2-4; р равно 1-4; и q равно 0-4. В одном варианте осуществления настоящее изобретение относится к соединению формулы (2) в которой один из R5a, R5b и R5C обозначает Н, а другие независимо обозначают галоген, C1-С 6 алкил, C1-С 6-алкоксигруппу, галогензамещенный С 1-С 6-алкил, цианогруппу или C(O)O0-1R8, где R8 обозначает C1-С 6-алкил; иR1, R2, R3, R4, E, Z1, Z2 и Z3 являются такими, как определено для формулы В другом варианте осуществления настоящее изобретение относится к соединению формулы (3)R6 обозначает Н, C1-С 6-алкил, необязательно замещенный галогеном и/или гидроксигруппами;-(CR2)p-OR7, -(CR2)p-CH(OH)CtF2t+1, где t равно 1-3, (CR2)p-CN; (CR2)p-NR(R7), -(CR2)p-C(O)OR7,C(O)(CR2)qOR8, -C(O)O-(CR2)p-NRR7, L-Y, -L-C(O)R7, -L-C(O)-NRR7, -L-C(O)-NR-(CR2)p-NRR7, -L-C(O)(CR2)q-NR-C(O)-R8, -L-S(O)2R8, -L-S(O)2-(CR2)q-NRR7 или радикал, выбранный из формулы (а), (b), (с) или (d)R1, R3, R4, R7, R8, R10, R11, R12, R13, R14, R15, R16, R, L, Y, p, q и Е являются такими, как определено для формулы (1).-7 020730 В каждой из приведенных выше формул любой асимметрический атом углерода может находиться в (R)-, (S)- или (R,S)-конфигурации. Таким образом, эти соединения могут находиться в виде смесей изомеров или в виде чистых изомеров, например, в виде чистых энантиомеров или диастереоизомеров. В объем настоящего изобретения также входят возможные таутомеры соединений, предлагаемых в настоящем изобретении. Любая формула, приведенная в настоящем изобретении, также характеризует немеченые формы, а также изотопно-меченые формы соединений. Изотопно-меченые соединения обладают структурами,описывающимися формулами, приведенными в настоящем изобретении, за исключением того, что один или большее количество атомов заменены на атомы, обладающими указанными атомными массами или массовыми числами. Примеры изотопов, которые можно вводить в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 18F 31P, 32P, 35S, 36Cl, 125I соответственно. В объем настоящего изобретения входят различные изотопно-меченые соединения, предлагаемые в настоящем изобретении, например, в которые включены радиоактивные изотопы, такие как 3 Н, 13 С, и 14 С. Такие изотопно-меченые соединения применимы для изучения метаболизма (предпочтительно содержащие 14 С), кинетики реакций (содержащие, например, 2 Н или 3 Н), в методологиях детектирования и визуализации [таких как позитронная эмиссионная томография (ПЭТ) или однофотонная эмиссионная компьютерная томография (ОФЭКТ), включая исследование распределения лекарственного средства или субстрата в тканях или лучевую терапию пациентов. В частности, содержащее 18F или меченое им соединение может быть особенно предпочтительным для исследований с помощью ПЭТ или ОФЭКТ. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т. е. 2 Н), может обеспечить некоторые терапевтические преимущества, обусловленные их более высокой метаболической стабильностью, например, увеличенной длительностью полувыведения in vivo или возможностью использования меньших доз. Изотопно-меченые соединения, предлагаемые в настоящем изобретении, и их пролекарства обычно можно получить по методикам, раскрытым в схемах или в примерах и синтезах, описанных ниже, путем замены не содержащего изотопа реагент на легко доступный изотопно-меченый реагент. В каждой из приведенных выше формул каждый необязательно замещенный фрагмент может содержать в качестве заместителей C1-С 6-алкил, С 2-С 6-алкенил или С 3-С 6-алкинил, каждый из которых необязательно может быть галогенирован или необязательно может содержать атом углерода, который может быть заменен или замещен N, S, О, или их комбинации (например, гидрокси-С 1-С 8-алкил, C1-C8 алкокси-С 1-С 8-алкил); галоген, аминогруппу, амидиновую группу, C1-С 6-алкоксигруппу; гидроксигруппу, метилендиоксигруппу, карбоксигруппу; C1-C8-алкилкарбонил, С 1-С 8-алкоксикарбонил, карбамоил,C1-C8-алкилкарбамоил, сульфамоил, цианогруппу, оксогруппу, нитрогруппу, или необязательно замещенное карбоциклическое кольцо, гетероциклическое кольцо, арил или гетероарил, описанные выше. Фармакология и применение Соединения, предлагаемые в настоящем изобретении, и их фармакологически приемлемые соли при исследованиях с помощью проводимых in vitro анализов киназы в бесклеточной системе и в клеточной системе обнаруживают ценные фармакологические характеристики и поэтому применимы в качестве лекарственных средств. В одном объекте соединения, предлагаемые в настоящем изобретении, могут ингибировать рецептор инсулиноподобного фактора роста 1 (IGF-1R) и могут использоваться для лечения опосредуемыхIGF-1R заболеваний. Примеры опосредуемых IGF-1R заболеваний включают, но не ограничиваются только ими, пролиферативные заболевания, такие как опухолевые, такие как, например опухоли молочной железы, почек, предстательной железы, колоректальные опухоли, щитовидной железы, яичников,поджелудочной железы, нейронные, легких, матки и желудочно-кишечные опухоли, а также остеосаркомы и меланомы. Эффективность соединений, предлагаемых в настоящем изобретении, в качестве ингибиторов активности тирозинкиназы IGF-1R можно продемонстрировать с помощью клеточного ИМФА(иммуноферментного анализа) с захватом. При этом анализе определяют активность соединений, предлагаемых в настоящем изобретении, по отношению к индуцированному инсулиноподобным фактором роста 1 (IGF-1) аутофосфорилированию IGF-1R. В другом объекте соединения, предлагаемые в настоящем изобретении, могут ингибировать тирозинкиназную активность киназы анапластической лимфомы (ALK) и слитого белка NPM-ALK. Эта протеинтирозинкиназа образуется из нуклеофосмина (NPM) и киназы анапластической лимфомы (ALK) вследствие слияния генов, что делает протеинтирозинкиназную активность ALK не зависящей от лигандов. NPM-ALK играет ключевую роль при передаче сигналов для целого ряда гематопоэтических и других клеток человека, приводящих к заболеваниям кроветворной системы и неопластическим заболеваниям, например, к анапластической крупноклеточной лимфоме (ALCL) и неходжкинским лимфомам(IMT) и нейробластомам (Duyster J et al. 2001 Oncogene 20, 5623-5637). В дополнение к NPM-ALK при заболеваниях кроветворной системы и неопластических заболеваниях человека обнаружены другие слияния генов; преимущественно TPM3-ALK (слитый белок, образовавшийся из немышечного тропомиозина и ALK).-8 020730 Ингибирование тирозинкиназной активности ALK можно продемонстрировать с помощью известных методик, например с использованием рекомбинантного киназного домена ALK по аналогии с анализом киназы VEGF-R, описанным в работе J. Wood et al. Cancer Res. 60, 2178-2189 (2000). Анализы киназыin vitro с использованием протеинкиназы GST-ALK обычно проводят в 96-луночных планшетах в виде анализа вещества по степени его связывания с мембранным фильтром в системе, включающей 20 мМ(Sigma Р-0275), 1% ДМСО (диметилсульфоксид), 25 нг фермента ALK. Системы инкубируют в течение 10 мин при температуре окружающей среды. Реакции останавливают путем добавления 50 мкл 125 мМ ЭДТК и реакционную смесь переносят в планшет MAIP Multiscreen (Millipore, Bedford, MA, USA), предварительно смоченный метанолом, и повторно регидратируют в течение 5 мин с помощью Н 2 О. После промывки (0,5% Н 3 РО 4) планшеты исследуют с помощью жидкостного сцинтилляционного счетчика. Значения IC50 рассчитывают по выраженному в процентах ингибированию с помощью линейного регрессионного анализа. Соединения, предлагаемые в настоящем изобретении, могут активно ингибировать рост NPM-ALK человека, сверхэкспрессированных в мышиных клетках BaF3 (DSMZ Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Braunschweig, Germany). Экспрессирование NPM-ALK выполняют путем трансфекции клеток линии BaF3 экспрессирующим вектором pCIneo (Promega Corp., Madison WI,USA), кодирующим NPM-ALK, с последующим отбором резистентных клеток G418. Жизнеспособность нетрансфицированных клеток BaF3 зависит от IL-3. В отличие от этого клетки BaF3 с экспрессированной NPM-ALK (ниже в настоящем изобретении обозначаемые, как BaF3 -NPM-ALK) могут пролиферировать при отсутствии IL-3, поскольку они получают пролиферативный сигнал с помощью киназы NPMALK. Поэтому предполагаемые ингибиторы киназы NPM-ALK устраняют сигнал роста, что приводит к антипролиферативному воздействию. Однако антипролиферативную активность предполагаемых ингибиторов киназы NPM-ALK можно преодолеть путем добавления IL-3, который предоставляет сигнал роста по механизму, не зависящему от NPM-ALK. Аналогичная клеточная система, в которой используется киназа FLT3, описана в работе Е Weisberget al. Cancer Cell; 1, 433-443 (2002). Ингибирующую активность соединений формулы I можно определить следующим образом. КлеткиBaF3-NPM-ALK (15000/на лунку планшета для микротитрования) переносят в 96-луночные планшеты для титрования микроорганизмов. Исследуемое соединение [растворенное в диметилсульфоксиде(ДМСО)] добавляют в серии концентраций (серии разведений) таким образом, чтобы конечная концентрация ДМСО не превышала 1% (об./об.). После добавления планшеты инкубируют в течение 2 дней и в это время контрольные культуры, к которым не добавлены исследуемые соединения, способны претерпеть 2 цикла деления клеток. Рост клеток BaF3-NPM-ALK измеряют с помощью окрашивания посредством Yopro [T Idziorek et al. J. Immunol. Methods; 185: 249-258 (1995)]: в каждую лунку добавляют 25 мкл литического буфера, содержащего 20 мМ цитрата натрия, рН 4,0, 26,8 мМ хлорида натрия, 0,4%NP40, 20 мМ ЭДТК и 20 мМ. Лизис клеток завершается через 60 мин при комнатной температуре и полное количество Yopro, связанного с ДНК, определяют путем проведения измерений с помощью 96 луночного устройства считывания Cytofluor II (PerSeptive Biosystems) при следующих настройках: длина волны возбуждения (нм) 485/20 и длина волны испускания (нм) 530/25. Соединения, предлагаемые в настоящем изобретении, также можно использовать для лечения и/или предупреждения острых или хронических воспалительных заболеваний или нарушений или аутоиммунных заболеваний, таких как ревматоидный артрит, остеоартрит, системная красная волчанка, тиреоидит Хашимото, рассеянный склероз, злокачественная миастения, диабет (типа I и II) и связанные с ними нарушения, респираторных заболеваний, таких как астма, или воспалительного поражения печени, воспалительного поражения почечных клубочков, кожных проявлений иммунологически обусловленных нарушений или заболеваний, воспалительных и гиперпролиферативных заболеваний кожи (таких как псориаз, атопический дерматит, аллергический контактный дерматит, раздражающий контактный дерматит,а также экзематозный дерматит, себорейный дерматит), воспалительных заболеваний глаз, таких как,синдром Шегрена, кератоконъюнктивит или увеит, воспалительной болезни кишечника, болезни Крона или язвенного колита. В соответствии с вышеприведенным настоящее изобретение относится к:(1) соединению, предлагаемому в настоящем изобретении, предназначенному для применения в качестве лекарственного средства, предназначенного для лечения патологического состояния, опосредуемого IGF-1R или киназой анапластической лимфомы, где указанным патологическим состоянием является аутоиммунное заболевание, реакция трансплантат против хозяина, инфекционное заболевание или пролиферативное клеточное нарушение.(2) соединению, предлагаемому в настоящем изобретении для применения в качестве ингибитораIGF-1R, например для применения при любом из конкретных показаний, указанных выше в настоящем изобретении;(3) фармацевтической композиции, предназначенной, например для применения при любом из показаний, указанных выше в настоящем изобретении, включающей в качестве активного ингредиента соединение, предлагаемое в настоящем изобретении, совместно с одним или большим количеством фармакологически приемлемых разбавителей или носителей;(4) применению соединения, предлагаемого в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения или предупреждения заболевания или патологического состояния, при котором играет активную роль или в котором участвует активация IGF-1R;(5) применению соединения, предлагаемого в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения или предупреждения заболевания, которое реагирует на ингибирование киназы анапластической лимфомы;(6) применению в соответствии с разделом (5), при котором подвергающееся лечению заболевание выбрано из группы, включающей анапластическую крупноклеточную лимфому, неходжкинские лимфомы, воспалительные миофибробластические опухоли, нейробластомы и неопластические заболевания;(7) применению в соответствии с разделом (8) или (9), в котором соединением является любое из соединений, описанных в настоящем изобретении в примерах, или его физиологически приемлемая соль; Введение и фармацевтические композиции Обычно соединения, предлагаемые в настоящем изобретении, вводят в терапевтически эффективных количествах по любым из использующихся и обычных путей, известных в данной области техники,по отдельности или в комбинации с одним или большим количеством терапевтических средств. Терапевтически эффективное количество может меняться в широких пределах в зависимости от тяжести заболевания, возраста и относительного состояния здоровья субъекта, активности использующегося соединения и других факторов, известных специалистам с общей подготовкой в данной области техники. Например, для лечения опухолевых заболеваний и нарушений иммунной системы необходимая доза также меняется в зависимости от пути введения, конкретного подвергающегося лечению патологического состояния и необходимого эффекта. Обычно указывают, что при системном лечении удовлетворительные результаты получаются при суточных дозах, равных от примерно 0,1 до примерно 100 мг/(кг массы тела) или предпочтительно примерно от 0,03 до 2,5 мг/(кг массы тела). Показанная суточная доза для крупных млекопитающих, например, людей находится в диапазоне от примерно 0,5 мг до примерно 2000 мг или, более предпочтительно от примерно 0,5 мг до примерно 100 мг/(кг массы тела) и обычно вводится, например, в виде разделенных доз до 4 раз в сутки или в форме пролонгированного действия. Разовые дозированные формы, подходящие для перорального введения, содержат примерно от 1 до 50 мг активного ингредиента. Соединения, предлагаемые в настоящем изобретении, можно вводить в форме фармацевтических композиций любым обычным путем, например энтерально, например перорально, например в форме таблеток или капсул; парентерально, например в форме растворов или суспензий для инъекций; или местно, например в виде лосьонов, гелей, мазей или кремов, или в назальной форме или форме суппозитория. Фармацевтические композиции, содержащие соединение, предлагаемое в настоящем изобретении, в свободной форме или в форме фармакологически приемлемой соли вместе по меньшей мере с одним фармакологически приемлемым носителем или разбавителем, можно приготовить обычным образом с помощью технологий смешивания, гранулирования, нанесения покрытий, растворения или лиофилизации. Например, фармацевтические композиции, содержащие соединение, предлагаемое в настоящем изобретении, вместе по меньшей мере с одним фармакологически приемлемым носителем или разбавителем, можно приготовить обычным образом путем смешивания с фармакологически приемлемым носителем или разбавителем. Разовые дозированные формы для перорального введения содержат от примерно 0,1 до примерно 500 мг активного вещества. В одном варианте осуществления фармацевтические композиции представляют собой растворы активного ингредиента, включая суспензии или дисперсии, такие как водные изотонические растворы. В случае лиофилизированных композиций, содержащих только активный ингредиент или активный ингредиент вместе с носителем, таким как маннит, перед использованием можно приготовить дисперсии или суспензии. Фармацевтические композиции могут быть стерилизованы и/или содержать вспомогательные вещества, такие как консервирующие, стабилизирующие, смачивающие или эмульгирующие агенты,стимуляторы растворения, соли для регулирования осмотического давления и/или буферные вещества. Подходящие растворы или суспензии могут содержать агенты, повышающие вязкость, включая, но не ограничиваясь только ими, натриевую соль карбоксиметилцеллюлозы, карбоксиметилцеллюлозу, декстран, поливинилпирролидон, желатины или солюбилизаторы, например, Tween 80 (полиоксиэтилен(20) сорбитанмоноолеат). Суспензии в масле в качестве компонента-масла включают растительные, синтетические или полусинтетические масла, применяющиеся для инъекций. Примеры включают жидкие эфиры кислот, которые в качестве компонента-кислоты включают длинноцепочечную жирную кислоту, содержащую от 8 до 22,предпочтительно от 12 до 22 атомов углерода, например, лауриновую кислоту, тридекановую кислоту,миристиновую кислоту, пентадекановую кислоту, пальмитиновую кислоту, маргариновую кислоту, стеа- 10020730 риновую кислоту, арахидиновую кислоту, бегеновую кислоту или соответствующие ненасыщенные кислоты, например, олеиновую кислоту, элаидиновую кислоту, эруковую кислоту, брассидиновую кислоту или линолевую кислоту и при необходимости могут содержать антиоксиданты, например, витамин Е, 3 каротин или 3,5-ди-трет-бутил-4-гидрокситолуол. Компонент-спирт этих эфиров жирных кислот может содержать 6 атомов углерода и может быть одноатомным или многоатомным, например, одно-, двух- или трехатомным спиртом. Подходящие компоненты-спирты включают, но не ограничиваются только ими,метанол, этанол, пропанол, бутанол или пентанол или их изомеры, гликоль и глицерин. Другие подходящие эфиры жирных кислот включают, но не ограничиваются только ими, этилолеат,изопропилмиристат, изопропилпальмитат, LABRAFIL М 2375 (полиоксиэтиленглицерин), LABRAFIL M 1944 CS (ненасыщенные полигликолированные глицериды, полученные алкоголизом абрикосового масла и содержащие глицериды и сложный эфир полиэтиленгликоля), LABRASOL (насыщенные полигликолированные глицериды, полученные алкоголизом триглицеридов, обладающих цепью средней длины, и содержащие глицериды и сложный эфир полиэтиленгликоля; все выпускающиеся фирмойGaKefosse, France) и/или MIGLYOL 812 (триглицериды насыщенных жирных кислот, обладающих длинами цепей от C8 до С 12, выпускающиеся фирмой Hls AG, Germany), и растительные масла, такие как хлопковое масло, миндальное масло, оливковое масло, касторовое масло, кунжутное масло, соевое масло или арахисовое масло. Фармацевтические композиции, предназначенные для перорального введения, можно приготовить,например, путем объединения активного ингредиента с одним или большим количеством твердых носителей, при необходимости с гранулированием полученной смеси и обработкой смеси или гранул путем включения дополнительных инертных наполнителей и формированием таблеток или ядер таблеток. Подходящие носители включают, но не ограничиваются только ими, наполнители, такие как сахара,например, лактоза, сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, трикальцийфосфат или гидрофосфат кальция, а также связующие, такие как крахмалы, например,кукурузный, пшеничный, рисовый или картофельный крахмал, метилцеллюлоза, гидроксипропилметилцеллюлоза, натриевая соль карбоксиметилцеллюлозы и/или поливинилпирролидон, и/или, при желании,разрыхлители, такие как указанные выше крахмалы, а также карбоксиметилкрахмал, сшитый поливинилпирролидон, альгиновая кислота и ее соли, такие как альгинат натрия. Дополнительные инертные наполнители включают агенты, улучшающие сыпучесть, и смазывающие вещества, например, кремниевая кислота, тальк, стеариновая кислота или ее соли, такие как стеарат кальция или магния, и/или полиэтиленгликоль или их производные. На ядра таблеток могут быть нанесены подходящие, необязательно энтеросолюбильные, покрытия,для образования которых, в частности, используются концентрированные растворы сахара, которые могут включать гуммиарабик, тальк, поливинилпирролидон, полиэтиленгликоль и/или диоксид титана, или растворы образующих покрытия веществ в подходящих органических растворителях или смесях растворителей, или для получения энтеросолюбильных покрытий, растворы подходящих производных целлюлозы, таких как фталат ацетилцеллюлозы или фталат гидроксипропилметилцеллюлозы. В таблетки или покрытия для таблеток могут быть добавлены красители или пигменты, например, для опознавания или указания разных доз активного ингредиента. Фармацевтические композиции, предназначенные для перорального введения, также включают капсулы из твердого желатина, состоящие из желатина, а также мягкие герметизированные капсулы, состоящие из желатина и пластификатора, такого как глицерин или сорбит. Твердые капсулы могут содержать активный ингредиент в виде гранул, например, в смеси с наполнителями, такими как кукурузный крахмал, связующими и/или веществами, придающими скользкость, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах активный ингредиент предпочтительно растворен или суспендирован в подходящих жидких инертных наполнителях, таких как нелетучие масла,вазелиновое масло или жидкие полиэтиленгликоли или сложные эфиры жирных кислоты и этилен- или пропиленгликоля, к которым также можно прибавить стабилизаторы и моющие средства, например, типа сложного эфира полиоксиэтиленсорбитановой жирной кислоты. Фармацевтические композиции, подходящие для ректального введения, представляют собой, например, суппозитории, которые содержат активный ингредиент и основу для суппозитория. Подходящими основами для суппозиториев являются, например, натуральные и синтетические триглицериды, парафиновые углеводороды, полиэтиленгликоли или высшие алканолы. Фармацевтические композиции, подходящие для парентерального введения, могут представлять собой водные растворы активного ингредиента, находящегося в растворимой в воде форме, например,растворимая в воде соль, или водные суспензии для инъекций, которые содержат вещества, повышающие вязкость, например, натриевую соль карбоксиметилцеллюлозы, сорбит и/или декстран, и, при необходимости, стабилизаторы. Активный ингредиент, необязательно совместно с инертными наполнителями, может находиться в форме лиофилизата и перед парентеральным введением может быть превращен в раствор путем добавления подходящих растворителей. Растворы, такие как использующиеся, например,для парентерального введения, также можно использовать в качестве растворов для вливания. Приготов- 11020730 ление препаратов, предназначенных для инъекций, обычно выполняют в стерильных условиях, разливая в ампулы или флаконы и герметизируя контейнеры. Соединения, предлагаемые в настоящем изобретении, можно вводить в виде единственного активного ингредиента или совместно с другими лекарственными препаратами, применяющимися для лечения неопластических заболеваний, или применяющимися в иммуномодулирующих режимах. Например, соединения, предлагаемые в настоящем изобретении, согласно настоящему изобретению можно применять в комбинации с фармацевтическими композициями, эффективными при различных заболеваниях, описанных выше, например, с циклофосфамидом, 5-фторурацилом, флударабином, гемцитабином, цисплатином, карбоплатином, винкристином, винбластином, этопозидом, иринотеканом, паклитакселом, доцетакселом, рутиксаном, доксорубицином, нефитинибом или иматинибом; или также с циклоспоринами,рапамицинами, аскомицинами или их иммунодепрессивными аналогами, например, циклоспорином А,циклоспорином G, FK-506, сирлимусом или эверолимусом, кортикостероидами, например, преднизоном,циклофосфамидом, азатиопреном, метотрексатом, солями золота, сульфасалазином, противомалярийными средствами, брехинаром, лефлуномидом, мизорибином, микофенольной кислотой, микофенолятом,мотефилом, 15-дезоксиспергвалином, иммунодепрессивными моноклональными антителами, например,моноклональными антителами для рецепторов лейкоцитов, например, МНС, CD2, CD3, CD4, CD7, CD25,CD28, CD40, CD45, CD58, CD80, CD86, CD152, CD137, CD154, ICOS, LFA-1, VLA-4 или их лигандами,или другими иммуномодуляторными соединениями, например, CTLA4Ig. Способы получения соединений, предлагаемых в настоящем изобретении Общие методики получения соединений, предлагаемых в настоящем изобретении, описаны ниже в примерах. В описанных реакциях реакционноспособные функциональные группы, например, гидроксигруппа, аминогруппа, иминогруппа, тиогруппа или карбоксигруппа, если они необходимы в конечном продукте, могут быть защищены для исключения их нежелательного участия в реакциях. Можно использовать обычные защитные группы в соответствии со стандартной практикой (см. например, T.W. Greeneand P. G. M. Wuts in "Protective Groups in Organic Chemistry", John Wiley и Sons, 1991). Соединения, предлагаемые в настоящем изобретении, включая их соли, также можно получить в виде гидратов, или их кристаллы могут включать, например, растворитель, использовавшийся при кристаллизации (они представляют собой сольваты). Соли обычно можно превратить в соединения в свободной форме, например, обработкой подходящими основными реагентами, например, карбонатами щелочных металлов, гидрокарбонатами щелочных металлов или гидроксидами щелочных металлов, такими как карбонат калия или гидроксид натрия. Соединение, предлагаемое в настоящем изобретении, в форме соли присоединения с основанием можно превратить в соответствующую свободную кислоту путем обработки подходящей кислотой (например, хлористо-водородной кислотой и т.п.). Вследствие близкого родства новых соединений в свободной форме и соединениями в форме их солей, включая соли, которые можно использовать в качестве промежуточных продуктов, например, при очистке или идентификации новых соединений, любое указание на свободные соединения следует понимать и как указание на соответствующие соли, если это является подходящим. Соли соединений, предлагаемых в настоящем изобретении, с солеобразующей группой можно получить по известным методикам. Таким образом, соли присоединения с кислотами соединений формулы(1), (2) и (3) можно получить путем обработки кислотой или подходящим анионообменным реагентом. Фармакологически приемлемые соли соединений, предлагаемых в настоящем изобретении, можно получить, например, в виде солей присоединения с органическими или неорганическими кислотами из соединений формулы (1), (2) и (3), содержащих основной атом азота. Подходящие неорганические кислоты включают, но не ограничиваются только ими, галогенводородные кислоты, такие как хлористо-водородная кислота, серная кислота или фосфорная кислота. Подходящие органические кислоты включают, но не ограничиваются только ими, карбоновые, фосфоновые,сульфоновые и сульфаминовые кислоты, например, уксусная кислота, пропионовая кислота, октановая кислота, декановая кислота, додекановая кислота, гликолевая кислота, молочная кислота, фумаровая кислота, янтарная кислота, адипиновая кислота, пимелиновая кислота, пробковая кислота, азелаиновая кислота, яблочная кислота, винная кислота, лимонная кислота, аминокислоты, такие как глутаминовая кислота или аспарагиновая кислота, малеиновая кислота, гидроксималеиновая кислота, метилмалеиновая кислота, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная кислота, салициловая кислота, 4-аминосалициловая кислота, фталевая кислота, фенилуксусная кислота, миндальная кислота,коричная кислота, метан- или этансульфоновая кислота, 2-гидроксиэтансульфоновая кислота, этан-1,2 дисульфоновая кислота, бензолсульфоновая кислота, 2-нафталинсульфоновая кислота, 1,5-нафталиндисульфоновая кислота, 2-, 3- или 4-метилбензолсульфоновая кислота, метилсерная кислота, этилсерная кислота, додецилсерная кислота, N-циклогексилсульфаминовая кислота, N-метил-, N-этил- или Nпропилсульфаминовая кислота, или другие органические протонные кислоты, такие как аскорбиновая кислота. Для целей выделения и очистки также можно использовать фармакологически неприемлемые соли, например, пикраты или перхлораты. Для терапевтического применения используют только фармакологически приемлемые соли или свободные соединения (если они применимы в виде фармацевтических препаратов).- 12020730 Соединения, предлагаемые в настоящем изобретении, в неокисленной форме можно получить из Nоксидов соединений, предлагаемых в настоящем изобретении, путем обработки восстановительным реагентом (например, серой, диоксидом серы, трифенилфосфином, борогидридом лития, борогидридом натрия, трихлоридом, трибромидом фосфора и т.п.) в подходящем инертном органическом растворителе(например, ацетонитриле, этаноле, водном растворе диоксана и т.п.) при температуре от 0 до 80 С. Пролекарственные производные соединений, предлагаемых в настоящем изобретении, можно получить по методикам, известным специалистам с общей подготовкой в данной области техники (дополнительные подробности см., например, в публикации Saulnier et al., (1994), Bioorganic and MedicinalChemistry Letters, Vol. 4, p. 1985). Например, подходящие пролекарства можно получить по реакции не являющегося производным соединения, предлагаемого в настоящем изобретении, с подходящим карбамоилирующим реагентом (например, 1,1-ацилоксиалкилкарбанохлоридатом, паранитрофенилкарбонатом и т.п.). Защищенные производные соединений, предлагаемых в настоящем изобретении, можно получить по методикам, известным специалистам с общей подготовкой в данной области техники. Подробное описание методик, применимых для введения защитных групп и их удаления, приведено в публикации Т. W.Greene, "Protecting Groups in Organic Chemistry", 3rd edition, John Wiley и Sons, Inc., 1999. Соединения, предлагаемые в настоящем изобретении, можно получить в виде отдельных стереоизомеров с помощью реакции рацемической смеси соединения с оптически активным разделяющим реагентом с образованием пары диастереоизомерных соединений, разделения диастереоизомеров и выделения оптически чистых энантиомеров. Разделение энантиомеров можно провести с использованием ковалентных диастереоизомерных производных соединений, предлагаемых в настоящем изобретении, или путем использования диссоциирующих комплексов (например, кристаллических солей диастереоизомеров). Диастереоизомеры обладают разными физическими характеристиками (например, температурами плавления, температурами кипения, растворимостями, реакционной способностью и т.п.) и их можно легко разделить с использованием этих различий. Диастереоизомеры можно разделить с помощью фракционной кристаллизации, хроматографии или, по методикам разделения, основанным на различиях их растворимостей. Затем оптически чистый энантиомер вместе с разделяющим реагентом извлекают по любой возможной методике, которая не приводит к рацемизации. Более подробное описание методик,пригодных для выделения стереоизомерных соединений из их рацемической смеси, приведено в публикации Jean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates и Resolutions", John Wiley And(b) необязательного превращения солевой формы соединения, предлагаемого в настоящем изобретении, в несолевую форму;(c) необязательного превращения неокисленной формы соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемый N-оксид;(e) необязательного выделения индивидуального изомера соединения, предлагаемого в настоящем изобретении, из смеси изомеров;(f) необязательного превращения не являющегося производным соединения, предлагаемого в настоящем изобретении, в фармацевтически приемлемое пролекарственное производное; и(g) необязательного превращения пролекарственного производного соединения, предлагаемого в настоящем изобретении, в его не являющуюся производным форму. Если получение исходных веществ специально не описано, то эти соединения являются известными или их можно получить по методикам, аналогичным известным в данной области техники или раскрытым в приведенных ниже примерах. Специалист в данной области техники должен понимать, что описанные выше превращения являются только типичными примерами методик получения соединений,предлагаемых в настоящем изобретении, и что также можно использовать другие хорошо известные методики. Настоящее изобретение дополнительно описано, но без наложения ограничений, с помощью приведенных ниже примеров, которые иллюстрируют получение соединений, предлагаемых в настоящем изобретении. Промежуточный продукт 1. 2,5-Дихлор-N-(5-метил-1 Н-пиразол-3-ил)пиримидин-4-амин- 13020730 Растворитель удаляли в вакууме. Полученный остаток подвергали распределению между EtOAc (350 мл) и водой (100 мл). Слой, содержащий EtOAc, промывали водой (3), насыщенным водным раствором(472,2 мг, 4,86 ммоль) и карбоната натрия (2,06 г, 19,4 ммоль) в 100 мл EtOH перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали в вакууме. Неочищенное твердое вещество подвергали распределению между EtOAc и водой. Объединенные органические экстракты сушили (Na2SO4), концентрировали в вакууме и очищали с помощью хроматографии на диоксиде кремния Смесь 5-метил-1 Н-пиразол-3-амина (3,00 г, 30,9 ммоль), 2,4-дихлор-5-метилпиримидина (5,03 г,30,9 ммоль, 1 экв.) и Na2CO3 (3,60 г, 34,0 ммольь, 1,1 экв.) в EtOH (100 мл) нагревали при 40 С в течение 24 ч. Растворитель удаляли в вакууме. Полученный остаток подвергали распределению между EtOAc(350 мл) и водой (100 мл). Слой, содержащий EtOAc, промывали водой (3), насыщенным водным раствором NaCl (1), сушили над Na2SO4 и концентрировали в вакууме. Полученный неочищенный продукт обрабатывали ультразвуком в Et2O (200 мл) и полученный осадок собирали фильтрованием. Этот порошок дополнительно промывали с помощью Et2O и получали продукт, 2-хлор-5-метил-N-(5-метил-1 Нпиразол-3-ил)пиримидин-4-амин; ЭРМС m/z 224,1 (М + Н+). Промежуточный продукт 4. Н-(2,5-Дихлорпиримидин-4-ил)-5-метилизоксазол-3-амин Смесь 5-метилизоксазол-3-амина (98 мг, 1,0 ммоль), 2,4,5-трихлорпиримидина (344 мкл, 3,0 ммоль) и карбоната натрия (106 мг, 1,0 ммоль) в 3 мл EtOH нагревали при 60 С в течение ночи. Реакционную смесь концентрировали и затем подвергали распределению между EtOAc и рассолом. Собранные органические экстракты сушили (Na2SO4), концентрировали в вакууме и очищали с помощью хроматографии на силикагеле (МеОН/ДХМ (дихлорметан): 1/9) и получали N-(2,5-дихлорпиримидин-4-ил)-5 метилизоксазол-3-амин; ЭРМС m/z 245,0 (М + Н+). Промежуточный продукт 5. 2,5-Дихлор-N-(5-циклопропил-1 Н-пиразол-3-ил)пиримидин-4-амин Смесь 5-циклопропил-1 Н-пиразол-3-амина (246 мг, 2,00 ммоль), 2,4,5-трихлорпиримидина (367 мг,2,00 ммоль, 1 экв.) и Na2CO3 (233 мг, 2,20 ммоль, 1,1 экв.) в EtOH (10 мл) нагревали при 40 С в течение 16 ч. Неочищенную реакционную смесь разбавляли с помощью EtOAc и последовательно промывали: водой (3) и насыщенным водным раствором NaCl (1). Образовавшийся слой, содержащий EtOAc , сушили над Na2SO4 и затем концентрировали в вакууме и получали 2,5-дихлор-N-(5-циклопропил-1 Нпиразол-3-ил)пиримидин-4-амин; ЭРМС m/z 270,0 (М + Н+). Промежуточный продукт 6. 3-(2,5-Дихлорпиримидин-4-иламино)азепан-2-он- 14020730 Смесь аминокапролактама (256 мг, 2,0 ммоль), 2,4,5-трихлорпиримидина (366 мг, 2,0 ммоль, 1 экв.) и NaHCO3 (168 мг, 2 ммоль, 1 экв.) в смеси МеОН (12 мл) и Н 2 О (6 мл) перемешивали при комнатной температуре в течение 15 ч. Полученный осадок собирали с помощью вакуумного фильтрования и промывали небольшими количествами МеОН и воды и получали продукт, 3-(2,5 дихлорпиримидин-4-иламино)азепан-2-он; ЭРМС m/z 275,0 (М + Н+). Промежуточный продукт 7. 3-(2,5-Дихлорпиримидин-4-иламино)пиридин-2(1 Н)-он Смесь 3-аминопиридин-2(1 Н)-она (99 мг, 0,90 ммоль), 2,4,5-трихлорпиримидин (165 мг, 0,90 ммоль,1 экв.) и NaHCO3 (76 мг, 0,90 ммоль, 1 экв.) в смеси МеОН (6 мл) и Н 2 О (3 мл) перемешивали при комнатной температуре в течение 24 ч. Полученный осадок собирали с помощью вакуумного фильтрования и промывали небольшими количествами МеОН и воды и получали продукт, 3-(2,5-дихлорпиримидин-4 иламино)пиридин-2(1 Н)-он; ЭРМС m/z 257,0 (М + Н+). Промежуточный продукт 8. 2,5-Дихлор-N-(5-метил-1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-3 ил)пиримидин-4-амин(дигидропиридин) (4,25 г, 50 ммоль). После перемешивания в течение ночи реакционная смесь становилась прозрачной. После концентрирования остаток растворяли в этилацетате и промывали насыщенным водным раствором Na2CO3. Затем органический слой промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме и получали 2,5-дихлор-N-(5-метил-1-(тетрагидро-2 Н-пиран-2-ил)-1 Нпиразол-3-ил)пиримидин-4-амин в виде светло-желтого твердого вещества, которое использовали в последующих реакциях без дополнительной очистки; ЭРМС m/z 244 (М-ТНР+Н+); ТСХ (тонкослойная хроматография) Rf=0,6 (диоксид кремния; 1:1 этилацетат/гексаны; исходное вещество Rf=0,2). Промежуточный продукт 9. 2,5-Дихлор-N-(5-(трифторметил)-1H-пиразол-3-ил)пиримидин-4-амин Стадия 1. 5-(Трифторметил)-1H-пиразол-3-амин. Смесь (E)-4-амино-4-этокси-1,1,1-трифторбут-3-ен-2-она (5,00 г, 27 ммоль) и гидразина (1,05 г) в безводном EtOH (20 мл) перемешивали при 80 С в герметизированном сосуде в течение ночи. Реакцию останавливали водой (50 мл) и экстрагировали с помощью EtOAc (100 мл, затем 250 мл). Слои, содержащие EtOAc, объединяли и последовательно промывали водой (25 мл), рассолом (25 мл), сушили надNa2SO4 и выпаривали и получали светло-коричневый маслообразный остаток. Неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (градиентный режим 30-100% EtOAc в гексанах) и получали 5-(трифторметил)-1H-пиразол-3-амин в виде почти белого твердого вещества; ЭРМСm/z 152,0 (М+Н+). Стадия 2. 2,5-Дихлор-N-(5-(трифторметил)-1H-пиразол-3-ил)пиримидин-4-амин. Смесь 5-(трифторметил)-1H-пиразол-3-амин (500 мг, 3,3 ммоль), 2,4,5-трихлорпиримидин (607 мг,3,3 ммоль) и карбоната натрия (525 мг, 5 ммоль) в безводном EtOH (10 мл) перемешивали при КТ. Через день ЖХМС (жидкостная хроматография - масс-спектрометрия) показывала, что реакция не завершилась. Добавляли дополнительное количество 2,4,5-трихлорпиримидина (0,15 мл) и карбоната натрия (525 мг) и реакцию проводили в течение еще 2 дней. Растворитель выпаривали, и остаток экстрагировали с помощью ДХМ (320 мл). Объединенные слои, содержащие ДХМ, промывали рассолом (10 мл), сушили над Na2SO4 и выпаривали. Неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (градиентный режим 0-50% EtOAc в гексанах) и получали 2,5-дихлор-N-(5-(трифторметил)-1Hпиразол-3-ил)пиримидин-4-амин в виде светло-желтовато-коричневого твердого вещества; ЭРМС m/z 297,9 (М+Н+). Промежуточный продукт 10. 2,5-Дихлор-N-(5-этил-1H-пиразол-3-ил)пиримидин-4-амин Смесь 5-этил-1H-пиразол-3-амина (1,00 г, 6,77 ммоль), 2,4,5-трихлорпиримидина (1,24 г, 6,77 ммоль) и Na2CO3 (1,79 г, 16,9 ммоль) в изопропаноле (15 мл) перемешивали в герметизированном сосуде при КТ в течение 2 дней. Добавляли воду (10 мл). Твердое вещество собирали фильтрованием, промывали водой (10 мл) и сушили и получали 2,5-дихлор-N-(5-этил-1 Н-пиразол-3-ил)пиримидин-4-амин в виде светло-желтого твердого вещества; ЭРМС m/z 258,0 (М+Н+). К раствору 2-хлор-4-метил-1-(трифторметил)бензола (6,65 г, 34,1 ммоль) в концентрированной серной кислоте (25 мл) при 0 С добавляли нитрат калия (3,46 г, 34,1 ммоль) в серной кислоте (15 мл). После перемешивания при 0 С в течение 1,5 ч, реакционную смесь выливали в 500 мл воды со льдом. Осадок собирали фильтрованием и промывали большими количествами воды и получали 1-хлор-5-фтор-4-нитро 2-(трифторметил)бензол в виде оранжевого твердого вещества; 1 Н ЯМР (400 МГц, хлороформ-d)8,356 По той же методике, что и описанная для промежуточного продукта 11, с использованием в качестве исходного вещества 2-бром-4-метилбензонитрила, 2-бром-4-метил-5-нитробензонитрил получали в виде желтого твердого вещества; 1 Н ЯМР (400 МГц, хлороформ-d)8,290 (s, 1H), 7,742 (s, 1H), 2,683 (s,3 Н). Промежуточный продукт 13. 5-Амино-2-бром-4-метилбензонитрил К раствору 2-бром-4-метил-5-нитробензонитрила (500 мг, 2,07 ммоль) в этаноле (20 мл) добавляли хлорид олова (785 мг, 4,14 ммоль). Смесь кипятили с обратным холодильником в течение 5 ч. После охлаждения до комнатной температуры добавляли триэтиламин (1,01 г, 10 ммоль). Смесь концентрировали и очищали с помощью хроматографии на диоксиде кремния (градиентный режим 30-50% этилацетат в гексанах) и получали 5-амино-2-бром-4-метилбензонитрил в виде бежевого твердого вещества; ЭРМС По той же методике, что и описанная для промежуточного продукта 11, с использованием в качестве исходного вещества метил-2-бром-4-метилбензоата, искомое соединение получали в виде белого твердого вещества; 1 Н ЯМР (400 МГц, хлороформ-d)8,505 (s, 1H), 7,711 (s, 1H), 3,967 (s, 3 Н), 2,640 (s,3 Н). Промежуточный продукт 15. Метил-5-амино-2-бром-4-метилбензоат По той же методике, что и описанная для промежуточного продукта 13, искомое соединение получали в виде бежевого твердого вещества; ЭРМС m/z 244 (М + Н+). Промежуточный продукт 16. 4-Бром-5-метокси-2-метиланилин(30 мл) при 0 С по каплям добавляли ацетилхлорид (0,57 г, 7,2 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию останавливали насыщенным водным раствором хлорида аммония и экстрагировали с помощью ДХМ. Органический слой сушили над Na2SO4 и концентрировали и получали N-(5-метокси-2-метилфенил)ацетамид в виде кристаллов игольчатой формы. Неочищенный продукт использовали на следующей стадии без дополнительной очистки. Стадия 2. N-(4-Бром-5-метокси-2-метилфенил)ацетамид. К раствору N-(5-метокси-2-метилфенил)ацетамида в уксусной кислоте (40 мл) медленно добавлялиBr2 (3 г, 19 ммоль). Смесь закрывали и перемешивали при 50 С в течение 5 ч. Реакционную смесь охлаж- 16020730 дали до комнатной температуры, затем реакцию останавливали водным раствором сульфита натрия и экстрагировали этилацетатом (350 мл). Объединенный органический слой сушили над Na2SO4 и концентрировали и получали неочищенный N-(4-бром-5-метокси-2-метилфенил)ацетамид в виде коричневого масла, которое использовали на следующей стадии без дополнительной очистки. Стадия 3. 4-Бром-5-метокси-2-метиланилин.HCl (30 мл). Смесь кипятили с обратным холодильником при 95 С в течение ночи. После охлаждения до комнатной температуры смесь выливали в воду со льдом и подщелачивали до рН 12 концентрированным водным раствором NaOH. Затем смесь экстрагировали этилацетатом (350 мл). Объединенный органический слой сушили над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (15% этилацетата в гексанах) и получали 4-бром-5-метокси-2-метиланилин в виде бежевого твердого вещества; 1 Н ЯМР (400 МГц, CDCl3) 7,20 (s, 1 Н), 6,37 (s, 1H), 4,6 (br, 2H), 3,82(1,92 г, 19,6 ммоль) в 60 мл 1,4-диоксана дегазировали и продували азотом. Реакционную смесь нагревали при 80 С в течение ночи и затем охлаждали до комнатной температуры. Смесь подвергали распределению между EtOAc и водой и собранные органические экстракты сушили (Na2SO4), концентрировали в вакууме и очищали с помощью хроматографии на диоксиде кремния (EtOAc/гексаны: 20/80) и получали 2-фтор-5-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин; ЭРМС m/z 252,2 (М + Н+). Промежуточный продукт 18. 2-Изопропокси-5-метил-4-(1-метилпиперидин-4-ил)фениламин(20 мл) добавляли нитрат калия (2,67 г, 26,4 ммоль) в серной кислоте (5 мл) при 0 С. После перемешивания при 0 С в течение 1 ч реакционную смесь разбавляли водой, экстрагировали этилацетатом (340 мл). Объединенные органические фазы последовательно промывали насыщенным раствором бикарбоната натрия и рассолом и затем сушили над Na2SO4. Неочищенный продукт, полученный после концентрирования, очищали с помощью колоночной хроматографии на силикагеле с использованием смеси растворителей гексаны/EtOAc (95/5) и получали 1-бром-5-фтор-2-метил-4-нитробензол в виде оранжевого твердого вещества. 1 Н ЯМР (400 МГц, хлороформ-d)7,93 (d, 1 Н, J= 7,6 Гц), 7,50 (d, 1 Н, J= 10 Гц), 2,43(s, 3 Н). Стадия 2. 1-Бром-5-изопропокси-2-метил-4-нитробензол. К раствору 1-бром-5-фтор-2-метил-4-нитробензола (стадия 1, 1,5 г, 6,4 ммоль) в 2-пропаноле (30 мл) добавляли карбонат цезия (5,3 г, 16 ммоль). Смесь нагревали при 50 С в течение ночи. Смесь концентрировали и подвергали распределению между этилацетатом и водой. Органический слой концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле с использованием 5% этилацетата в гексанах и получали 1-бром-5-изопропокси-2-метил-4-нитробензол в виде желтого твердого вещества. Стадия 3. 4-(5-Изопропокси-2-метил-4-нитрофенил)пиридин. К смеси 1-бром-5-изопропокси-2-метил-4-нитробензола (стадия 2, 1 г, 3,65 ммоль), пиридин-4 бороновой кислоты (490 мг, 4 ммоль), 2-дициклогексилфосфино-2',6'-диметоксибифенила (300 мг, 0,73 ммоль) и фосфата калия (1,55 г, 7,3 ммоль) в смеси растворителей диоксана (15 мл) и воды (7,5 мл) добавляли трис(дибензилиденацетон)дипалладий(0) (334 мг, 0,36 ммоль). Эту смесь герметизировали и продували азотом в течение 3 мин и затем нагревали при 120 С в течение 5 ч. Смесь охлаждали до комнатной температуры, фильтровали и фильтрат концентрировали. После концентрирования неочищенный продукт очищали с помощью колоночной флэш-хроматографии на силикагеле (60% этилацетат в гексанах) и получали 4-(5-изопропокси-2-метил-4-нитрофенил)пиридин в виде желтого твердого вещества: ЭРМС m/z 273,2 (М + Н+). Стадия 4. 4-(5-Изопропокси-2-метил-4-нитрофенил)-1-метилпиридиниййодид. 4-(5-Изопропокси-2-метил-4-нитрофенил)-пиридин (стадия 3, 217 мг, 0,797 ммоль) растворяли в безводном ТГФ (9 мл). Добавляли йодметан (0,10 мл, 1,61 ммоль, 2 экв.) и реакционную смесь переме- 17020730 шивали при 40 С в герметизированной пробирке в течение 2 дней. Летучие вещества удаляли в вакууме и получали 4-(5-изопропокси-2-метил-4-нитрофенил)-1-метилпиридиниййодид в виде коричневого твердого вещества: ЭРМС m/z 287,1 (М+). Стадии 5 и 6. 2-Изопропокси-5-метил-4-(1-метилпиперидин-4-ил)фениламин. 4-(5-Изопропокси-2-метил-4-нитрофенил)-1-метилпиридиниййодид (стадия 4, 0,697 ммоль) растворяли в СН 3 ОН (20 мл) и охлаждали до 0 С. Медленно добавляли NaBH4 (264 мг, 6,97 ммоль, 10 экв.). После завершения этого добавления охлаждающую баню удаляли и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакцию останавливали путем медленного добавления 1 н. водного раствора HCl (14 мл). СН 3 ОН частично удаляли в вакууме. Полученный остаток подвергали распределению между EtOAc и 1 н. водным раствором NaOH. Добавляли дополнительное количество 50% водного раствора NaOH, пока значение рН водного слоя не становилось больше 12. Слой, содержащийEtOAc, промывали 1 н. водным раствором NaOH (2), затем органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. После концентрирования неочищенный продукт (175 мг) растворяли в уксусной кислоте (10 мл). ТФК (0,15 мл, 3 экв.) и добавляли PtO2 (53 мг, 30% мас./мас.) и реакционную смесь по давлением Н 2, равным 50 фунт-сила/дюйм 2, на 14 ч помещали во встряхивающий аппарат Парра. Реакционную смесь фильтровали и фильтрат концентрировали в вакууме. Полученный остаток подвергали распределению между EtOAc и 1 н. водным раствором NaOH. Добавляли дополнительное количество 50% водного раствора NaOH, пока значение рН водного слоя не становилось больше 12. Слой, содержащий EtOAc, промывали 1 н. водным раствором NaOH (2), затем органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме и получали 2 изопропокси-5-метил-4-(1-метилпиперидин-4-ил)-фениламин, который использовали на следующих стадиях без дополнительной очистки: ЭРМС m/z 263,2 (М + Н+). Промежуточный продукт 19. трет-Бутил-4-(4-амино-5-фтор-2-метилфенил)пиперидин-1-карбоксилат Стадия 1. трет-Бутиловый эфир 4-трифторметансульфонилокси-3,6-дигидро-2 Н-пиридин-1 карбоновой кислоты. Раствор N-трет-бутоксикарбонил-4-пиперидона (10,17 г, 0,05 моль) в ТГФ (100 мл) при энергичном перемешивании в атмосфере N2 по каплям добавляли к охлажденному (-78 С) раствору ДАЛ (диизопропиламид лития) (40 мл 1,5 М раствора в циклогексанах, 0,06 моль) в ТГФ (100 мл). Реакционную смесь выдерживали при -78 С в течение 30 мин и затем добавляли раствор фенилтрифторсульфонимида (19,85 г, 0,055 моль) в ТГФ (50 мл). Затем реакционную смесь нагревали до комнатной температуры и перемешивали в течение 3 ч. Реакцию останавливали при 0 С с помощью 100 мл насыщенного водного раствора NH4Cl и фильтровали через целит. Фильтрат добавляли к 100 мл EtOAc и слои разделяли. Органический слой промывали с помощью Н 2 О, сушили над MgSO4 и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле (0-30% EtOAc в гексанах в качестве элюента и проверяли с помощью ТСХ с окрашиванием посредством 2% раствора KMnO4 в EtOH) и получали третбутиловый эфир 4-трифторметансульфонилокси-3,6-дигидро-2 Н-пиридин-1-карбоновой кислоты в виде желтого масла. Стадия 2. трет-Бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2 Н)карбоксилат. Раствор трет-бутил-4-(трифторметилсульфонилокси)-5,6-дигидропиридин-1(2 Н)-карбоксилата (16,0 г, 48,2 ммоль) в ДМСО (200 мл) обрабатывали бис(пинаколято)дибором (12,6 г, 49,6 ммоль), ацетатом калия (14,65 г, 149 ммоль) и Pd(dppf)Cl2 (790 мг, 0,96 ммоль). Раствор продували с помощью N2 (газ) в течение 5 мин и затем герметизировали и нагревали при 80 С в течение 15 ч. Реакционную смесь охлаждали до комнатной температуры и выливали в воду со льдом. Смесь экстрагировали этилацетатом (3100 мл). Объединенную органическую фазу промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с помощью хроматографии на силикагеле (15% этилацетат в гексанах) и получали трет-бутил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6 дигидропиридин-1(2 Н)-карбоксилат в виде белого твердого вещества. Стадии 3 и 4. трет-Бутил-4-(4-амино-5-фтор-2-метилфенил)пиперидин-1-карбоксилат. К смеси 5'-хлор-N,2'-диметил-4'-нитробифенил-4-карбоксамида (204 мг, 1 ммоль), трет-бутил-4(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2 Н)-карбоксилата (370 мг, 1,2 ммоль) и карбоната натрия (742 мг, 7 ммоль) в ДМФ (диметилформамид)/Н 2 О (12/3 мл) добавляли тетракис(трифенилфосфин)палладий(0) (58 мг, 5 ммол.%). Пробирку для проведения реакции герметизировали, смесь продували с помощью N2 в течение 3 мин и затем нагревали при 90 С в атмосфере N2 в течение ночи. Реакционную смесь охлаждали до комнатной температуры, и выливали в насыщенный водный- 18020730 раствор хлорида аммония. Неочищенную реакционную смесь экстрагировали этилацетатом (315 мл). Органические экстракты объединяли, промывали рассолом и концентрировали. Неочищенный продукт очищали с помощью хроматографии на силикагеле (20% этилацетат в гексанах) и получали трет-бутил-4(4-амино-5-фтор-2-метилфенил)-5,6-дигидропиридин-1(2 Н)-карбоксилат в виде желтого масла. Полученное масло растворяли в метанол (20 мл). К раствору добавляли Pd/C (10%). Реакционную смесь дегазировали и несколько раз продували с помощью Н 2 и перемешивали в атмосфере Н 2 (1 атм.) в течение ночи. Смесь фильтровали и концентрировали и получали трет-бутил-4-(4-амино-5-фтор-2-метилфенил) пиперидин-1-карбоксилат в виде белого твердого вещества. ЭРМС m/z 207 (М -Вос+ Н+). Промежуточный продукт 20. 2,5-Диметил-4-(пиперидин-2-ил)анилин К смеси 1-бром-2,5-диметил-4-нитробензола (185 мг, 1 ммоль) и 2-(трибутилстаннил)пиридина (202 мг, 1,1 ммоль) в ДМФ (4 мл) добавляли тетракис(трифенилфосфин)палладий(0) (58 мг, 5 ммоль.%). Пробирку для проведения реакции герметизировали, смесь продували с помощью N2 в течение 3 мин и затем нагревали при 120 С в атмосфере N2 в течение ночи. Реакционную смесь охлаждали до комнатной температуры и выливали в насыщенный водный раствор хлорида аммония. Неочищенную реакционную смесь экстрагировали этилацетатом (315 мл). Органические экстракты объединяли, промывали рассолом и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (60% этилацетат в гексанах) и получали 2-(2,5-диметил-4-нитрофенил)пиридин в виде белого твердого вещества. Полученное твердое вещество растворяли в смеси уксусная кислота/ТФК (трифторуксусная кислота) (15 мл/200 мкл). К этому раствору добавляли PtO2 (10% мас./мас). Реакционную смесь дегазировали и несколько раз продували с помощью Н 2 и в течение ночи перемешивали в атмосфере водорода при давлении 1 атм. Смесь фильтровали и концентрировали и получали 2,5-диметил-4(пиперидин-2-ил)анилин в виде желтого масла. ЭРМС m/z 205 (М + Н+). Промежуточный продукт 21. трет-Бутил-3-(4-амино-2,5-диметилфенил)азетидин-1-карбоксилат Стадия 1. трет-Бутил-3-(2,5-диметил-4-нитрофенил)азетидин-1-карбоксилат. Получали из трет-бутил-3-йодазетидин-1-карбоксилата и 1-бром-2,5-диметил-4-нитробензола по общей методике, описанной в публикации Billotte, S. Synlett 1998, 379. Стадия 2. трет-Бутил-3-(4-амино-2,5-диметилфенил)азетидин-1-карбоксилат. трет-Бутил-3-(2,5-диметил-4-нитрофенил)азетидин-1-карбоксилат восстанавливали в трет-бутил-3(4-амино-2,5-диметилфенил)азетидин-1-карбоксилат посредством стандартного гидрирования с помощью Ni Ренея при комнатной температуре с использованием МеОН в качестве растворителя. Промежуточный продукт 22. 5-Этил-2-метил-4-(пиперидин-4-ил)анилин Стадия 1. трет-Бутил-4-(4-амино-5-метил-2-винилфенил)-5,6-дигидропиридин-1 (2 Н)-карбоксилат. К смеси 4-бром-5-хлор-2-метиланилина (500 мг, 2,27 ммоль), трет-бутил-4-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)-5,6-дигидропиридин-1(2 Н)-карбоксилата (840 мг, 3,73 ммоль) и карбоната натрия (2,52 г, 15,9 ммоль) в ДМФ/Н 2 О (20/5 мл) добавляли тетракис(трифенилфосфин)палладий(0) (131 мг, 5 мол.%). Пробирку для проведения реакции герметизировали, смесь продували с помощью N2 в течение 3 мин и затем нагревали при 100 С в атмосфере N2 в течение ночи. Реакционную смесь охлаждали до комнатной температуры и выливали в насыщенный водный раствор хлорида аммония. Неочищенную реакционную смесь экстрагировали этилацетатом (315 мл). Органические экстракты объединяли, промывали рассолом и концентрировали. Неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (80% этилацетата в гексанах) и получали трет-бутил-4-(4-амино-2-хлор-5 метилфенил)-5,6-дигидропиридин-1(2 Н)-карбоксилат в виде желтого твердого вещества. Этот полученный продукт (322 мг, 1 ммоль) растворяли в смеси диоксан/NMP (N-метилпирролидон) (безводная, 4 мл,3/1). К этому раствору добавляли трибутил(винил)станнан (380 мг, 1,2 ммоль), фторид цезия (304 мг, 2 ммоль) и бис(три-трет-бутилфосфин)палладий (51 мг, 10 мол.%). Эту смесь продували с помощью N2 в течение 3 мин и затем нагревали в герметизированной пробирке при 120 С в течение ночи. Смесь охлаждали до комнатной температуры и разбавляли этилацетатом. Полученную смесь последовательно про- 19020730 мывали насыщенным водным раствором хлорида аммония и рассолом и в заключение сушили над сульфатом натрия. После концентрирования неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (10% этилацетата в гексанах) и получали трет-бутил-4-(4-амино-5-метил-2 винилфенил)-5,6-дигидропиридин-1(2 Н)-карбоксилат в виде светло-желтого масла; ЭРМС m/z 215,2 (М Boc + Н+). Стадия 2. 5-Этил-2-метил-4-(пиперидин-4-ил)анилин. Продукт, полученный на предыдущей стадии, растворяли в метаноле (20 мл). К этому раствору добавляли концентрированный водный раствор HCl (200 мкл) и оксид платины (23 мг, 0,1 ммоль). Реакционную смесь дегазировали и несколько раз продували с помощью Н 2 и в течение 3 ч энергично перемешивали в атмосфере Н 2 при давлении, равном 1 атм. Смесь фильтровали и концентрировали и получали 5-этил-2-метил-4-(пиперидин-4-ил)анилин в виде желтого твердого вещества. ЭРМС m/z 219,2 (М + Н+). Промежуточный продукт 23. 2,5-Диметил-4-(пиперидин-3-ил)анилин Стадия 1. 2,5-Диметил-4-(пиридин-3-ил)анилин. Суспензию 4-бром-2,5-диметиланилина (4,00 г, 20 ммоль), пиридин-3-илбороновой кислоты (2,70 г,11 ммоль), Pd2(dba)3 (0,55 г, 0,6 ммоль), 2-дициклогексилфосфино-2',6'-диметоксибифенила (0,98 г, 1,2 ммоль) и Na2CO3 (10,6 г, 100 ммоль) в n-BuOH (50 мл) в течение 15 мин дегазировали потоком аргона. Колбу для проведения реакции герметизировали и помещали в нагретую масляную баню (115 С). После перемешивания в течение ночи реакционную смесь охлаждали и фильтровали. Осадок на фильтре промывали с помощью ДХМ и фильтрат концентрировали в вакууме. Полученный остаток растворяли вEtOAc (150 мл). Раствор в EtOAc последовательно промывали водой (20 мл), рассолом (20 мл), сушили над Na2SO4 и выпаривали. Неочищенный продукт очищали с помощью хроматографии на диоксиде кремния (градиентный режим 0-50% EtOAC в гексанах) и получали 2,5-диметил-4-(пиридин-3-ил)анилин в виде желтого твердого вещества; ЭРМС m/z 199,1 (М+Н+). Стадия 2. 2,5-Диметил-4-(пиперидин-3-ил)анилин. 2,5-Диметил-4-(пиридин-3-ил)анилин (403 мг, 2,03 ммоль) растворяли в МеОН (5 мл) и концентрированном водном растворе HCl (1 мл), затем добавляли PtO2 (40 мг). Колбу продували с помощью Н 2 и реакционную смесь энергично перемешивали при КТ в атмосфере Н 2 (1 атм.). Через 2 дня ЖХМС указывала на завершение реакции. Катализатор удаляли фильтрованием и оставшийся раствор концентрировали в вакууме и получали 2,5-диметил-4-(пиперидин-3-ил)анилин в виде белого твердого вещества, которое можно использовать в последующих реакциях без дополнительной очистки; ЭРМС m/z 205,2 К раствору 1-(трет-бутоксикарбониламино)циклопропанкарбоновой кислоты (201 мг, 1,0 ммоль) в ДМФ (2 мл) при 0 С добавляли NaH (120 мг, 3,0 ммоль). Полученную смесь перемешивали при 0 С в течение 10 мин, затем добавляли MeI (568 мг, 4,0 ммоль). Затем смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. К смеси добавляли насыщенный водный раствор NH4Cl (20 мл) и раствор экстрагировали с помощью EtOAc (310 мл). Объединенные органические слои концентрировали и остаток растворяли в МеОН (3 мл) с добавлением NaOH (3 н., 1 мл). Эту смесь перемешивали при 80 С в течение 1 ч и охлаждали до комнатной температуры. Прозрачный раствор сразу очищали с помощью препаративной ОФ-ВЭЖХ (высокоэффективная жидкостная хроматография с обращенной фазой) и получали 1-(трет-бутоксикарбонил(метил)амино)циклопропанкарбоновую кислоту. ЭРМС m/z 238,2 (М Стадия 1. (R)-2-Бромпропаноилхлорид. В атмосфере азота, к раствору (R)-2-бромпропановой кислоты (5,0 г, 32,68 ммоль) в 100 мл ДХМ добавляли тионилхлорид (7,1 мл, 98,04 ммоль) и 1 мл ДМФ последовательно при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение ночи и концентрировали в вакууме. Полученный неочищенный продукт использовали непосредственно на следующей стадии без дополнительной очистки.(R)-2-Бромпропаноилхлорид медленно добавляли к 37% водному раствору гидроксида аммония,охлажденному до 0 С. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 ч. Продукт экстрагировали с помощью EtOAc и собранные органические экстракты сушили(R)-2-Бромпропаноилхлорид медленно добавляли к водному раствору метиламина, охлажденному до 0 С. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 ч. Продукт экстрагировали с помощью EtOAc и собранные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали (R)-2-бром-N-метилпропанамид. Промежуточный продукт 27. 1-(Трет-бутоксикарбонил(этил)амино)циклопропанкарбоновая кислота(201,2 мг, 1,0 ммоль) в 4 мл ДМФ при 0 С добавляли NaH (120,0 мг, 3,0 ммоль). После перемешивания в течение 30 мин к реакционной смеси добавляли йодэтан (0,4 мл, 5,0 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали распределению между EtOAc и водой. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали неочищенный этил-1-(трет бутоксикарбонил(этил)амино)циклопропанкарбоксилат, который использовали на следующей стадии без дополнительной очистки. Стадия 2. 1-(трет-Бутоксикарбонил(этил)амино)циклопропанкарбоновая кислота. Неочищенный продукт, полученный на стадии 1, растворяли в смеси EtOH (4,0 мл) и воды (1,0 мл). К реакционной смеси добавляли LiOH (82,0 мг, 2,0 ммоль). Реакционную смесь нагревали при 120 С в микроволновом реакторе в течение 10 мин. Реакционную смесь концентрировали в вакууме и неочищенный продукт подвергали распределению между EtOAc и водой. Водный слой нейтрализовывали 4 н. водным раствором HCl до рН 4 и затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали 1-(трет бутоксикарбонил(этил)амино)циклопропанкарбоновую кислоту. Промежуточный продукт 28. 1-(Трет-бутоксикарбонил(этил)амино)циклобутанкарбоновая кислота(430,0 мг, 2,0 ммоль) в 4 мл ДМФ добавляли NaH (240,0 мг, 6,0 ммоль) при 0 С. После перемешивания в течение 30 мин, йодэтан (0,8 мл, 10,0 ммоль) добавляли к реакционной смеси. Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали распределению между EtOAc и водой. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали неочищенный этил-1-(трет-бутоксикарбонил(этил)амино)циклобутанкарбоксилат. Стадия 2. 1-(Трет-бутоксикарбонил(этил)амино)циклобутанкарбоновая кислота. Неочищенный продукт, полученный на стадии 1, растворяли в EtOH (4,0 мл) и воде (1,0 мл). К реакционной смеси добавляли LiOH (164,0 мг, 4,0 ммоль). Реакционную смесь нагревали при 120 С в микроволновом реакторе в течение 10 мин. Реакционную смесь концентрировали в вакууме и неочищенное вещество подвергали распределению между EtOAc и водой. Водный слой нейтрализовывали 4 н. водным раствором HCl до рН 4 и затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали 1-(трет-бутоксикарбонил(этил)амино) циклобутанкарбоновую кислоту. Промежуточный продукт 29. 1-(Трет-бутоксикарбонил(метил)амино)циклобутанкарбоновая кислота(430,0 мг, 2,0 ммоль) в 4 мл ДМФ при 0 С добавляли NaH (240,0 мг, 6,0 ммоль). После перемешивания в течение 30 мин к реакционной смеси добавляли йодметан (0,62 мл, 10,0 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь подвергали распределению между EtOAc и водой. Объединенные органические экстракты сушили(Na2SO4) и концентрировали в вакууме и получали неочищенный метил- 1-(трет-бутоксикарбонил(этил) амино)циклобутанкарбоксилат. Стадия 2. 1-(трет-Бутоксикарбонил(метил)амино)циклобутанкарбоновая кислота. Неочищенный продукт, полученный на стадии 1, растворяли в МеОН (4,0 мл) и воде (1,0 мл). К реакционной смеси добавляли LiOH (164,0 мг, 4,0 ммоль). Реакционную смесь нагревали при 120 С в микроволновом реакторе в течение 10 мин. Реакционную смесь концентрировали в вакууме и неочищенное вещество подвергали распределению между EtOAc и водой. Водный слой нейтрализовывали 4 н. водным раствором HCl до рН 4 и затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали 1-(трет-бутоксикарбонил(метил)амино) циклобутанкарбоновую кислоту. Промежуточный продукт 30. 2-Бромбутанамид В атмосфере азота к раствору 2-бромбутановой кислоты (2,0 г, 12,0 ммоль) в ДХМ (50 мл) при 0 С последовательно добавляли тионилхлорид (2,6 мл, 35,9 ммоль) и 0,5 мл ДМФ. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и затем охлаждали до 0 С. Медленно добавляли тридцать (30) мл 37% водного раствора гидроксида аммония. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 ч, затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили В атмосфере азота, к раствору 2-бромбутановой кислоты (2,0 г, 12,0 ммоль) в ДХМ (50 мл) при 0 С последовательно добавляли тионилхлорид (2,6 мл, 35,9 ммоль) и 0,5 мл ДМФ. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и затем охлаждали до 0 С. Медленно добавляли тридцать (30) мл 40% водного раствора метиламина. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 ч, затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали 2-бром-N-метилбутанамид. Промежуточный продукт 32. 2-Бром-N-этилбутанамид В атмосфере азота, к раствору 2-бромбутановой кислоты (2,0 г, 12,0 ммоль) в ДХМ (50 мл) при 0 С последовательно добавляли тионилхлорид (2,6 мл, 35,9 ммоль) и 0,5 мл ДМФ. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали в вакууме и затем охлаждали до 0 С. Медленно добавляли тридцать (30) мл 40% водного раствора этиламина. Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение 2 ч, затем экстрагировали с помощью EtOAc. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме и получали 2-бром-N-этилбутанамид. Промежуточный продукт 33. 1-(Метилсульфонил)азетидин-3-он(5/5 мл) одной порцией при 0 С добавляли ангидрид метансульфоновой кислоты (1,14 г, 6,57 ммоль). После перемешивания в течение 2 ч реакционную смесь разбавляли насыщенным водным растворомNaHCO (5 мл) и экстрагировали с помощью ДХМ (325 мл). Объединенные слои, содержащие ДХМ,промывали рассолом (5 мл), сушили над Na2SO4 и выпаривали и получали 1-(метилсульфонил)азетидин 3-он в виде почти белого твердого вещества, которое использовали без дополнительной очистки; 1 Н ЯМР(промежуточный продукт 19, 166 мг, 0,54 ммоль) в 2-пропаноле (15 мл) обрабатывали концентрированным водным раствором HCl (14 капель). Смесь герметизировали и нагревали в микроволновой печи при 130 С в течение 60 мин. Смесь концентрировали и получали 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4 ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде желтого твердого вещества. Порцию неочищенного продукта очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества; ЭРМС m/z 416,1 (М + Н+). Оставшийся неочищенный продукт использовали на следующей стадии без дополнительной очистки. Стадия 2. К раствору неочищенного продукта, полученного на предыдущей стадии, в ТГФ (5 мл) и метаноле (5 мл) последовательно добавляли формальдегид (100 мкл, 1,3 ммоль) и 10 капель АсОН. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем одной порцией добавляли цианоборогидрид натрия (175 мг, 2,78 ммоль) и реакционную смесь перемешивали в течение еще 30 мин. Реакцию останавливали насыщенным водным раствором NH4Cl и концентрировали в вакууме и получали маслообразный остаток. Остаток очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлорN2-(2-фтор-5-метил-4-(1-метилпиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4 диамин в виде белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)10,33 (br, 1H), 9,90 (br, 1H),9,60 (br, 1H), 8,22 (s, 1 Н), 7,56 (d, 1 Н), 7,00 (d, 1 Н), 6,20 (s, 1 Н), 3,53-3,50 (m, 2 Н), 3,16-3,10 (m, 2 Н), 2,972,92 (m,1 Н), 2,81 (d, 3 Н), 2,26 (s, 3 Н), 2,16 (s, 3 Н), 1,94-1,91 (m, 2 Н), 1,83-1,73 (m, 2 Н); ЭРМС m/z 430,1 Смесь 2,5-дихлор-N-(5-метил-1 Н-пиразол-3-ил)пиримидин-4-амина (промежуточный продукт 1,132 мг, 0,54 ммоль) и трет-бутил-4-(4-амино-5-фтор-2-метилфенил)пиперидин-1-карбоксилата (промежуточный продукт 19, 166 мг, 0,54 ммоль) в 2-пропаноле (15 мл) обрабатывали концентрированным водным раствором HCl (14 капель). Смесь герметизировали и нагревали в микроволновой печи при 130 С в течение 60 мин. Смесь концентрировали и получали 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4 ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде желтого твердого вещества. Порцию неочищенного продукта очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества; ЭРМС m/z 416,1 (М + Н+). Примеры 3 и 4.-3-(5-Хлор-2-(2-фтор-5-метил-4-(1-метилпиперидин-4-ил)фениламино)пиримидин-4 иламино)азепан-2-он синтезировали по той же последовательности методик, что и описанные в примере 1, с использованием промежуточного продукта 6 и промежуточного продукта 19. Хиральное разделение рацемической смеси проводили с помощью ВЭЖХ с нормальной фазой на колонке ChiralPaK AD с ис- 23020730 пользованием следующей системы растворителей: гексаны (80%) и iPrOH (20%) с добавлением 0,1% диэтиламина. Очищенные фракции, соответствующие двум пикам энантиомеров, собирали по отдельности:(S)-3-(5-хлор-2-(2-фтор-5-метил-4-(1-метилпиперидин-4-ил)фениламино)пиримидин-4-иламино)азепан 2-он и (R)-3-(5-хлор-2-(2-фтор-5-метил-4-(1-метилпиперидин-4-ил)фениламино)пиримидин-4-иламино) азепан-2-он; оба пика: ЭРМС m/z 461,2 (М + Н+). Пик первого элюирующегося вещества (RT = 7,26 мин.) и пик последнего элюирующегося вещества (RT = 10,17 мин.) произвольно приписаны (S)- и (R)энантиомеру соответственно. Пример 5. 5-Хлор-N2-(4-(1-3,5-диметилизоксазол-4-ил)метил)пиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (19) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (83 мкл, 0,6 ммоль) в ДМФ (1,5 мл) добавляли 4(хлорметил)-3,5-диметилизоксазол (35 мг, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФВЭЖХ и получали 5-хлор-N2-(4-(1-3,5-диметилизоксазол-4-ил)метил)пиперидин-4-ил)-2-фтор-5 метилфенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества. 1H ЯМР (400 МГц, MeOD-d4) 8,12 (s, 1 Н), 7,75 (d, 1H), 7,03 (s, 1H), 6,27 (s, 1H), 4,25 (s, 2H), 3,69-3,67 (m,2H), 3,27-3,20 (m, 3H), 2,54 (s, 3H), 2,37 (s, 3H), 2,34 (s, 3H), 2,30 (s, 3H), 2,10-1,95 (m, 4 Н); ЭРМС m/z 525,1 (M + H+). Пример 6. 2-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)этанол (22)(0,7 мл). Сосуд для проведения реакции герметизировали и нагревали в микроволновой печи при 100 С в течение 20 мин. После охлаждения до комнатной температуры реакционную смесь концентрировали и неочищенный продукт очищали с помощью препаративной ОФ-ВЭЖХ и получали 2-(4-(4-(5-хлор-4-(5 метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)этанол в виде белого твердого вещества: ЭРМС m/z 460,2 (М + Н+). Пример 7. 5-Хлор-N2-(2-фтор-5-метил-4-(1-(3,3,3-трифторпропил)пиперидин-4-ил)фенил)-N4-(5 метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (24)(102,0 мкл, 0,60 ммоль) в 2 мл ДМФ перемешивали в течение ночи. Реакционную смесь очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2-(2-фтор-5-метил-4-(1-(3,3,3-трифторпропил) пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин. ЭРМС m/z 512,2 (М + Н+). Пример 8. 3-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)-1,1,1-трифторпропан-2-ол (30) Смесь 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил) пиримидин-2,4-диамина (50,0 мг, 0,12 ммоль) и 2-(трифторметил)оксирана (67,8 мг, 0,60 ммоль) в 2 мл ДМФ перемешивали в течение ночи. Реакционную смесь очищали с помощью препаративной ОФ-ВЭЖХ и получали 3-(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)-1,1,1-трифторпропан-2-ол. ЭРМС m/z 528,2 (М + Н+). Пример 9. 2-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-ил)ацетамид (39) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (50 мкл, 0,36 ммоль) в ДМФ (1,5 мл) добавляли 2 бромацетамид (33 мг, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали 2(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)ацетамид в виде белого твердого вещества: 1 Н ЯМР (400 МГц, MeOD-d4)8,11 (s, 1H), 7,76 (d 1H), 7,09 (d, 1H), 6,27 (s, 1H), 4,0 (s, 2H), 3,75-3,73 (m, 2H), 3,22-3,13 (m, 3 Н), 2,34 (s, 3 Н), 2,30 (s, 3 Н), 2,04 К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (83 мкл, 0,6 ммоль) в ДМФ (1,5 мл) добавляли метилвинилсульфон (38 мг, 0,36 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали 5 хлор-N2-(2-фтор-5-метил-4-(1-(2-(метилсульфонил)этил)пиперидин-4-ил)фенил)-N4-(5-метил-1Hпиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества. ЭРМС m/z 522,1 (М + Н+). Пример 11. 5-Хлор-N2-(2-фтор-5-метил-4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (62) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (50 мкл, 0,36 ммоль) в ДМФ (1,5 мл) добавляли метансульфонилхлорид (18 мкл, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2-(2-фтор-5-метил-4-(1-(метилсульфонил)пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества: ЭРМС m/z 494,2 (М + Н+). Пример 12. Этил-4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-карбоксилат (66) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (50 мкл, 0,36 ммоль) в ДМФ (1,5 мл) добавляли этилхлорформиат (26 мг, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали этил-4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-карбоксилат в виде белого твердого вещества: 1 Н ЯМР (400 МГц, MeOD-d4)8,13 (s, 1H), 7,54 К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (83 мкл, 0,6 ммоль) в ДМФ (1,5 мл) добавляли диметилкарбамилхлорид (39 мг, 0,36 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали- 25020730 4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)-N,Nдиметилпиперидин-1-карбоксамид в виде белого твердого вещества. ЭРМС m/z 487,2 (М + Н+). Пример 14. 1-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-ил)-2-(диметиламино)этанон (73) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль) и триэтиламина (50 мкл, 0,36 ммоль) в ДМФ (1,5 мл) добавляли 2(диметиламино)ацетилхлорид (38 мг, 0,24 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФВЭЖХ и получали 1-(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-ил)-2-(диметиламино)этанон в виде белого твердого вещества: 1 Н ЯМР (400 МГц, MeOD-d4)8,08 (s, 1 Н), 7,71 (d, 1H), 7,03 (d, 1H), 6,26 (s, 1H), 4,71-4,67 (m, 2H), 3,81-3,77 (m, 2H),3,14-3,12 (m, 2H), 2,98 (s, 3H), 2,96 (s, 3H), 2,90-2,83 (m, 1H), 2,34 (s, 3H), 2,28 (s, 3H), 1,87 (d, 2H), 1,761,55 (m, 2H); ЭРМС m/z 501,2 (M + H+). Пример 15. 1-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)-2-(4-метилпиперазин-1-ил)этанон (105) К раствору 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил) пиримидин-2,4-диамина (100,0 мг, 0,24 ммоль) в 4 мл ДХМ последовательно добавляли 2-хлорацетилхлорид (23,0 мкл, 0,29 ммоль) и триэтиламин (67,0 мкл, 0,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч затем промывали рассолом. Органический экстракт сушили над Na2SO4, затем концентрировали в вакууме и получали неочищенный продукт. Неочищенный продукт смешивали с 1-метилпиперазином (116,0 мг, 1,16 ммоль) в 3 мл ДМФ и реакционную смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь очищали с помощью препаративной ВЭЖХ и получали 1-(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-ил)-2-(4-метилпиперазин-1-ил)этанон. ЭРМС m/z 556,3 (М + Н+). Пример 16. Азетидин-3-ил(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)5-фтор-2-метилфенил)пиперидин-1-ил)метанон (131) К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,12 ммоль), диизопропилэтиламина (50 мкл, 0,36 ммоль) и HATU (О-(7 азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат) (55 мг, 0,14 ммоль) в ДМФ (1,5 мл) добавляли 1-(трет-бутоксикарбонил)азетидин-3-карбоновую кислоту (29 мг, 0,14 ммоль). После перемешивания при комнатной температуре в течение 4 ч смесь разбавляли метанолом (1 мл) и концентрированным водным раствором HCl (1 мл). Смесь перемешивали при 50 С в течение 30 мин. Смесь фильтровали и очищали с помощью препаративной ОФ-ВЭЖХ и получали азетидин-3-ил(4-(4-(5-хлор-4-(5 метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)метанон в виде белого твердого вещества. 1 Н ЯМР (400 МГц, MeOD-d4)8,08 (s, 1 Н), 7,68 (d, 2H), 7,04 (d, 2H), 6,26- 26020730 К 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин 2,4-диамину (30 мг, 0,072 ммоль) в EtOH (0,5 мл) добавляли тиофен-2,3-дигидро-1,1-диоксид (17 мг,0,144 ммоль). Полученную смесь затем нагревали при 130 С в течение 2 ч. После охлаждения до комнатной температуры смесь концентрировали и очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2-(2-фтор-5-метил-4-(1-(тетрагидро-1,1-диоксидо-3-тиенил)пиперидин-4-ил)фенил)-N4-(5 метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин. ЭРМС m/z 534,2 (М + Н+). Пример 18. 5-Хлор-N2-(2,5-диметил-4-(1-(тетрагидро-1,1-диоксидо-2 Н-тиопиран-4-илпиперидин 4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (146) Стадия 1. К раствору 5-хлор-N2-(2,5-диметил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол 3-ил)пиримидин-2,4-диамина (30 мг, 0,073 ммоль) в ацетонитриле (1 мл) добавляли CS2CO3 (47 мг, 0,15 ммоль) и 4-йодтетрагидро-2 Н-тиопиран (48 мг, 0,22 ммоль). Затем эту смесь перемешивали при 80 С в течение 16 ч. После охлаждения до комнатной температуры смесь обрабатывали насыщенным водным раствором NH4Cl (3 мл) и экстрагировали с помощью EtOAc (33 мл). Органические слои объединяли и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (градиентный режим 08% МеОН/CH2Cl2 с NH3) и получали 5-хлор-N2-(2,5-диметил-4-(1-(тетрагидро-2 Н-тиопиран-4-ил)пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества. ЭРМС m/z 512,2 (М + Н+). Стадия 2. К 5-хлор-N2-(2,5-диметил-4-(1-(тетрагидро-2 Н-тиопиран-4-ил)пиперидин-4-ил)фенил)N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамину (18 мг, 0,035 ммоль) в CH2Cl2 (1 мл) при 0 С добавляли МХПБК (мета-хлорпероксибензойная кислота) (16 мг, 0,71 ммоль). Затем смесь нагревали до комнатной температуры и перемешивали в течение 30 мин; затем добавляли насыщенный водный раствор NaHCO3 (3 мл) и неочищенный продукт экстрагировали с помощью CH2Cl2 (33 мл). Объединенные органические слои концентрировали и очищали с помощью препаративной тонкослойной хроматографии (силикагель, 12 % MeOH/CH2Cl2 с NH3) и получали 5-хлор-N2-(2,5-диметил-4-(1-(тетрагидро-1,1 диоксидо-2 Н-тиопиран-4-илпиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4 диамин. ЭРМС m/z 544,2 (М + Н+). Пример 19. 5-Хлор-N2-(2-фтор-5-метил-4-(1-(1,1-диоксидо-3-тиетанил)пиперидин-4-ил)фенил)-N4(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (148) К 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин 2,4-диамину (30 мг, 0,072 ммоль) в МеОН (1 мл) добавляли 3-бромтиетан-1,1-диоксид (15 мг, 0,079 ммоль), затем ТЭА (15 мг). Полученную смесь перемешивали при комнатной температуре в течение 5 ч и затем концентрировали. Полученный остаток очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2-(2-фтор-5-метил-4-(1-(1,1-диоксидо-3-тиетанил)пиперидин-4-ил)фенил)-N4-(5-метил-1 Нпиразол-3-ил)пиримидин-2,4-диамин. 1 Н ЯМР (400 МГц, ДМСО-d6 + 1 капля D2O)8,02 (s, 1 Н), 7,37 (s,1 Н), 7,02 (s, 1 Н), 6,23 (s, 1 Н), 4,28-4,22 (m, 2 Н), 4,12-4,07 (m, 2 Н), 3,22-3,18 (m, 1 Н), 2,95-2,92 (m, 2 Н),2,68-2,62 (m, 1 Н), 2,22 (s, 3 Н), 2,13 (s, 3 Н), 2,07-2,01 (m, 2 Н), 1,71-1,55 (m, 4 Н). ЭРМС m/z 520,2 (М + Н+). Пример 20. 5-Хлор-N2-(4-(1-(5-этилпиримидин-2-ил)пиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5 метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин (149)- 27020730 К смеси 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (0,10 ммоль) и триэтиламина (83 мкл, 0,6 ммоль) в ДМФ (1,5 мл) добавляли 2-хлор-5 этилпиримидин (27 мг, 0,20 ммоль). Смесь нагревали в микроволновой печи при 120 С в течение 10 мин. Реакционную смесь фильтровали и фильтрат очищали с помощью препаративной ОФ-ВЭЖХ и получали 5-хлор-N2-(4-(1-(5-этилпиримидин-2-ил)пиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1 Нпиразол-3-ил)пиримидин-2,4-диамин в виде белого твердого вещества. ЭРМС m/z 522,2 (М + Н+). Пример 21. 4-(4-(5-Хлор-4-(5-метил-1H-пиразол-3-иламино)пиримидин-2-иламино)-2,5-диметилфенил)пиперидин-2-он (151) Стадия 1. В пробирку для проведения реакции в микроволновой печи объемом 5 мл добавляли 2(2,5-диметил-4-нитрофенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (143 мг, 0,516 ммоль, получали из 1 бром-2,5-диметил-4-нитробензола по стандартной методике), 1-(4-метоксибензил)-5,6-дигидропиридин 2(1 Н)-он (56 мг, 0,26 ммоль, получали по методике, аналогичной описанной в публикации Lerchner etc. inChem. Eur. J. 2006, 12, 8208), димер хлор(1,5-циклооктадиен)родия(I) (13 мг, 0,026 ммоль), KOH (0,13 мл 1 н. водного раствора) и диоксан (1,2 мл). Пробирку дегазировали, заполняли с помощью N2 и герметизировали. Затем пробирку для проведения реакции нагревали при 100 С в микроволновом реакторе в течение 10 мин. Затем пробирку для проведения реакции открывали, смесь обрабатывали насыщенным водным раствором NH4Cl (3 мл) и экстрагировали с помощью EtOAc (34 мл). Органические слои объединяли и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (силикагель,градиентный режим 0%70% EtOAc/гексан) и получали 4-(2,5-диметил-4-нитрофенил)-1-(4-метоксибензил)пиперидин-2-он. ЭРМС m/z 369,2 (М + Н+). Стадия 2. К 4-(2,5-диметил-4-нитрофенил)-1-(4-метоксибензил)пиперидин-2-ону (63 мг, 0,17 ммоль) в МеОН (10 мл) добавляли 10% мас./мас. Pd/C (6 мг), смесь дегазировали и перемешивали в атмосфере Н 2 при комнатной температуре в течение 14 ч. После удаления катализатора фильтрованием фильтрат концентрировали и получали 4-(4-амино-2,5-диметилфенил)-1-(4-метоксибензил)пиперидин-2 он в виде бледно-желтоватого масла. ЭРМС m/z 339,2 (М + Н+). Стадия 3. К смеси 4-(4-амино-2,5-диметилфенил)-1-(4-метоксибензил)пиперидин-2-она (23 мг,0,094 ммоль) и 2,5-дихлор-N-(5-метил-1 Н-пиразол-3-ил)пиримидин-4-амина (29 мг, 0,086 ммоль) в iPrOH(1 мл) добавляли HCl (60 мкл, 4 н. в диоксане). Затем сосуд для проведения реакции герметизировали и нагревали при 130 С в течение 4 ч. После охлаждения до комнатной температуры смесь обрабатывали насыщенным водным раствором NaHCO3 (3 мл) и экстрагировали с помощью EtOAc (34 мл). Органические слои объединяли и концентрировали. Остаток очищали с помощью колоночной флэшхроматографии (силикагель, градиентный режим 0-10% МеОН/CH2Cl2) и получали 4-(4-(5-хлор-4-(5 метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-2,5-диметилфенил)-1-(4-метоксибензил)пиперидин-2-он. ЭРМС m/z 546,2 (М + Н+). Стадия 4. Раствор 4-(4-(5-хлор-4-(5-метил-1H-пиразол-3-иламино)пиримидин-2-иламино)-2,5 диметилфенил)-1-(4-метоксибензил)пиперидин-2-она (45 мг) в ТФК (0,5 мл) нагревали при 100 С в течение 24 ч. После охлаждения до комнатной температуры смесь концентрировали и очищали с помощью препаративной ОФ-ВЭЖХ и получали 4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2 иламино)-2,5-диметилфенил)пиперидин-2-он. ЭРМС m/z 426,2 (М + Н+). Пример 22. 5-Хлор-N2-(2-фтор-4-(4-метилпиперазин-1-ил)-5-(трифторметил)фенил)-N4-(5-метил 1H-пиразол-3-ил)пиримидин-2,4-диамин (157) Стадия 1. В пробирку для проведения реакции в микроволновой печи добавляли 4-бром-2-фтор-5(трифторметил)анилин (256 мг, 1,0 ммоль), 1-метилпиперазин (300 мг, 3 ммоль) Pd2(dba)3 (91,5 мг, 0,1 ммоль), ди-трет-бутил(2',4',6'-триизопропилбифенил-2-ил)фосфин (60 мг, 0,2 ммоль), NaOtBu (144 мг, 1,5 ммоль) и ТГФ (3 мл). Затем пробирку для проведения реакции дегазировали и заполняли с помощью N2,пробирку нагревали при 120 С в микроволновом реакторе в течение 40 мин. Затем смесь выливали в насыщенный водный раствор NH4Cl (10 мл) и экстрагировали с помощью EtOAc (310 мл). Органические(силикагель, градиентный режим MeOH/CH2Cl2, 0-10%) и получали 2-фтор-4-(4-метилпиперазин-1-ил)-5(трифторметил)анилин в виде белого твердого вещества. ЭРМС m/z 278,1 (М +Н+). Стадия 2. К смеси 2-фтор-4-(4-метилпиперазин-1-ил)-5-(трифторметил)анилина (37 мг, 0,133 ммоль) и 2,5-дихлор-N-(5-метил-1 Н-пиразол-3-ил)пиримидин-4-амина (36 мг, 0,147 ммоль) в iPrOH (1 мл) добавляли HCl (100 мкл, 4 н. в диоксане). Затем сосуд для проведения реакции герметизировали и нагревали при 130 С в течение 4 ч. После охлаждения до комнатной температуры смесь обрабатывали насыщенным водным раствором NaHCO3 (5 мл) и экстрагировали с помощью EtOAc (35 мл). Органические слои объединяли и концентрировали. Остаток очищали с помощью препаративной тонкослойной хроматографии (силикагель, 8% MeOH/CH2Cl2) и получали 5-хлор-N2-(2-фтор-4-(4 метилпиперазин-1-ил)-5-(трифторметил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамин. ЭРМС m/z 485,2 (М + Н+). Пример 23. (S)-2-(4-(4-(5-Метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)пропанамид (163) Смесь 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3 ил)пиримидин-2,4-диамина (50,0 мг, 0,12 ммоль), (R)-2-бромпропанамида (90,6 мг, 0,60 ммоль), и триэтиламина (102,0 мкл, 0,60 ммоль) в 2 мл ДМФ нагревали при 150 С в микроволновом реакторе в течение 30 мин. Реакционную смесь сразу же очищали с помощью препаративной ОФ-ВЭЖХ и получали (S)2-(4-(4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1 ил)пропанамид; ЭРМС m/z 487,2 (М + Н+). Пример 24. (S)-2-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2 метилфенил)пиперидин-1-ил)-N-метилпропанамид (164) Смесь 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (50,0 мг, 0,12 ммоль), (R)-2-бром-N-метилпропанамида (100,0 мг, 0,60 ммоль) и триэтиламина (102,0 мкл, 0,60 ммоль) в 2 мл ДМФ нагревали при 150 С в микроволновом реакторе в течение 30 мин. Реакционную смесь сразу же очищали с помощью препаративной ОФ-ВЭЖХ и получали (S)2-(4-(4-(5-хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)-N-метилпропанамид; ЭРМС m/z 501,2 (М + Н+). Пример 25. (S)-2-(4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-2,5-диметилфенил)пиперидин-1-ил)пропанамид (166)(102,0 мкл, 0,60 ммоль) в 2 мл ДМФ нагревали при 150 С в микроволновом реакторе в течение 30 мин. Реакционную смесь сразу же очищали с помощью препаративной ОФ-ВЭЖХ и получали (S)-2-(4-(4-(5 хлор-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-2,5-диметилфенил)пиперидин-1-ил)пропанамид; ЭРМС m/z 483,2 (М + Н+). Пример 26. (4-(4-(5-Хлор-4-(5-метил-1 Н-пиразол-3-иламино)пиримидин-2-иламино)-5-фтор-2-метилфенил)пиперидин-1-ил)(1-(этиламино)циклопропил)метанон (169) Смесь 5-хлор-N2-(2-фтор-5-метил-4-(пиперидин-4-ил)фенил)-N4-(5-метил-1 Н-пиразол-3-ил)пиримидин-2,4-диамина (67,3 мг, 0,17 ммоль), 1-(трет-бутоксикарбонил(этил)амино)циклопропанкарбоновой кислоты (38,0 мг, 0,17 ммоль), HATU (63,0 мг, 0,17 ммоль) и диизопропилэтиламина (57 мкл, 0,34 ммоль) в 1 мл ДМФ перемешивали при комнатной температуре в течение ночи. Реакционную смесь подвергали распределению между EtOAc и водой, объединенные органические экстракты сушили (Na2SO4) и затем концентрировали в вакууме. Полученную неочищенную смесь растворяли в 5 мл ДХМ и 4 мл ТФК и
МПК / Метки
МПК: C07D 403/14, A61K 31/506, C07D 401/14, C07D 403/12, C07D 409/14, C07D 413/14
Метки: ингибиторов, пиримидина, качестве, производные, киназы
Код ссылки
<a href="https://eas.patents.su/30-20730-proizvodnye-pirimidina-v-kachestve-ingibitorov-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина в качестве ингибиторов киназы</a>
Предыдущий патент: Способ получения предшественника катализатора, способ получения катализатора
Следующий патент: Аминоазагетероциклические карбоксамиды
Случайный патент: Эластомерная смесь, содержащая диеновый эластомер, модифицированный аминоалкоксисилановой группой, резиновая композиция и способы их получения


































