Производные пиримидина в качестве ингибиторов репликации вируса иммунодефицита человека
Номер патента: 2973
Опубликовано: 26.12.2002
Авторы: Де Корт Барт, Янссен Поль Адриан Жан, Койманс Люсьен Мария Хенрикус, Кукла Майкл Джозеф, Хэрес Ян, Андрис Кунрад Йозеф Лодевейк Марсель, Ван Акен Кун Жанн Альфонс, Лудовики Дональд Уилльям, Хо Чих Юнг, Де Жонж Марк Рене, Янссен Марсель Огюст Констант
Формула / Реферат
1. Применение соединения формулы
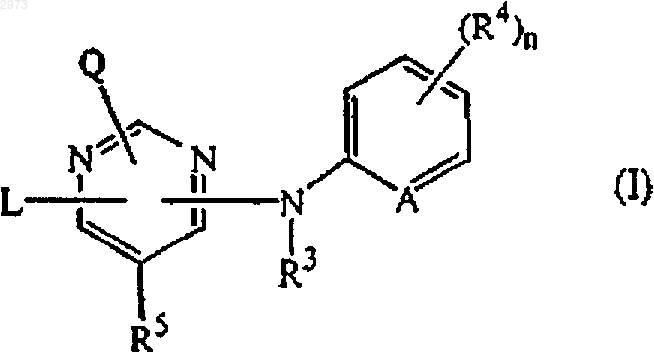
его N-оксида, фармацевтически приемлемой соли присоединения или стереохимически изомерной формы, где А является СН или N;
n равен 0, 1, 2, 3 или 4;
Q является водородом или -NR1R2;
R1 и R2, каждый независимо, выбран из водорода, гидрокси, C1-12aлкила, С1-12алкилокси, С1-12алкилкарбонила, С1-12алкилоксикарбонила, где каждая из указанных С1-12алкильных групп необязательно и каждая независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6алкилокси, гидроксиС1-6алкилокси, циано, арила и Het; или
R1 и R2, взятые вместе, могут образовывать моно- или ди(С1-12алкил)аминоС1-4алкилиден;
R3 является водородом или C1-6алкилом; и
каждый R4 независимо является гидрокси, галогеном, С1-6алкилом, C1-6алкилокси, циано, аминокарбонилом, нитро, амино, тригалогенметилом, тригалогенметилокси или C1-6алкилом, замещенным циано или аминокарбонилом;
R5 - водород или С1-4алкил;
L - C1-10алкил, замещенный фенилом, где указанный фенил может быть замещен одним, двумя, тремя, четырьмя или, где возможно, пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6алкила, C1-6алкилокси, циано, аминокарбонила, амино, тригалогенметила, тригалометилокси и C1-6 алкилкарбонила; или
L является -X1-R6 или -X2-Alk-R7, где
R6 и R7, каждый независимо, является фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6алкила, C1-6алкилокси, C1-6алкилкарбонила, циано, аминокарбонила, амино, тригалогенметилокси и тригалогенметила; и X1 и X2, каждый независимо, является -NR3-, -О-, -S-, -S(=O)- или -S(=O)2-;
Alk является С1-4алкандиилом;
арил является фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6алкила, C1-6алкилокси, циано, нитро и трифторметила;
Het - алифатический или ароматический гетероциклический радикал;
где указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый указанный алифатический гетероциклический радикал необязательно может быть замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила, пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал необязательно может быть замещен гидрокси;
для производства лекарственного средства для лечения от ВИЧ (вируса иммунодефицита человека) инфекции.
2. Применение соединения по п.1, где n равен, по крайней мере, 1 и, по крайней мере, один R4 является циано.
3. Применение соединения по п.1 или 2, где соединение имеет формулу (I-1) или (I'-1)
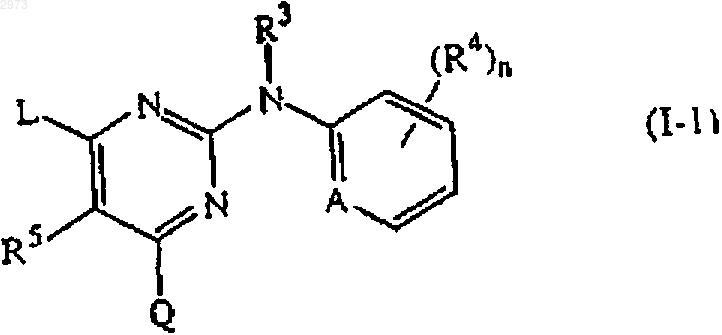
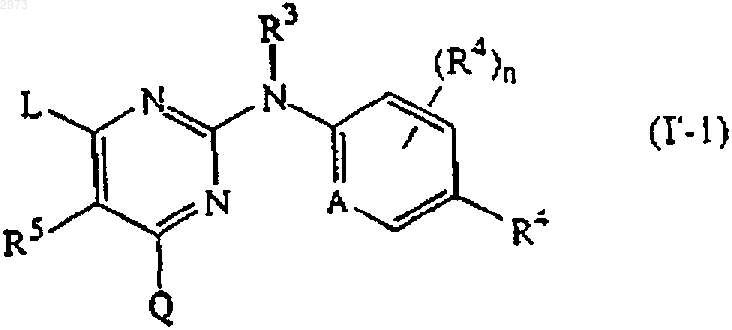
где R4' является галогеном, C1-6алкилом, циано, аминокарбонилом, нитро, тригалогенметилом, тригалогенметилокси или C1-6алкилом, замещенным циано или аминокарбонилом;
n' равен 0, 1, 2 или 3.
4. Соединение формулы

его N-оксид, фармацевтически приемлемая соль присоединения или стереохимически изомерная форма, где L, Q, R3, R4, R5 и А являются такими, как определены для формулы (I), и R4' является галогеном, C1-6алкилом, циано, аминокарбонилом, нитро, тригалогенметилом, тригалогенметилокси или C1-6алкилом, замещенным циано или аминокарбонилом;
n' равен 0, 1, 2 или 3;
при условии, что Q и L отличаются от анилино, 2,4,6-тринитроанилино, 3-метоксианилино, 4-метоксианилино, 3,4-диметоксианилино, 3-хлор-4-фторанилино, 4-цианоанилино, 2-(C1-6алкил)анилино, 4-(C1-6алкил)анилино, 3-хлоранилино, 4-броманилино, 4-нитроанилино и 4-хлоранилино.
5. Соединение по п.4, где соединение имеет формулу
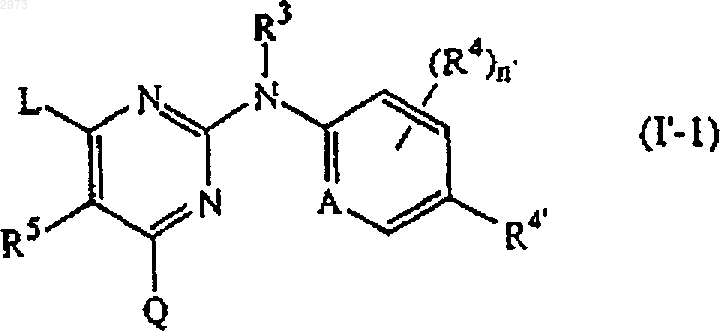
6. Соединение по п.5, где R4' является циано, аминокарбонилом или C1-6алкилом, замещенным циано или аминокарбонилом.
7. Соединение по любому из пп.4-6, в котором L является 2,6-дихлорбензилом, или L является -X-R6, в котором X1 является -NR3, -S- или -О- и R6 - 2,4,6-трихлорфенил, 2,4,6-триметилфенил, 2,4-дибром-3,5-дихлорфенил, 2,4-дибром-6-фторфенил, 2,4-дихлор-6-метилфенил, 2,6-дибром-4-изопропилфенил, 2,6-дибром-4-метилфенил, 2,6-дибром-4-проп-1-илфенил, 2,6-дихлор-4-цианофенил, 2,6-дихлор-4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил, 2,6-дихлорфенил, 2,6-диметил-4-(1,1-диметилэтил)фенил, 2,6-диметилфенил, 2-бром-4-фтор-6-метилфенил, 2-бром-6-хлор-4-фторфенил, 4-бром-2,6-диметилфенил, 4-хлор-2,6-диметилфенил, 4-циано-2,6-диметилфенил; или L является X2-Alk-R7, где X2-Alk является -NH-CH2- и R7 - фенил.
8. Соединение по любому из пп.4-7, где Q является водородом, L является -X1-R6, где X1 является -NH- и R6 является 2,4,6-триметилфенилом или 4-циано-2,6-диметилфенилом, NR3 (необязательно замещенный фенил или пиридил) фрагмент представляет п-цианоанилино и находится во 2-ом положении пиримидинового кольца.
9. Соединение по любому из п.4 или 5, где R4' - галоген, циано, аминокарбонил или цианоС1-6алкил; n' является нулем, А является СН, R3 - водород; R5 - водород или метил; Q - водород или NHR1; L представляет C1-10алкил, замещенный фенилом, или 2,4,6-трихлорфенилом, или 2,4,6-триметилфенилом, или 2,4-дибром-3,5-дихлорфенилом, или 2,4-дибром-6-фторфенилом, или 2,4-дихлор-6-метилфенилом, или 2,6-дибром-4-изопропилфенилом, или 2,6-дибром-4-метилфенилом, или 2,6-дибром-4-проп-1-илфенилом, или 2,6-дихлор-4-цианофенилом, или 2,6-дихлор-4-трифторметоксифенилом, или 2,6-дихлор-4-трифторметилфенилом, или 2,6-дихлорфенилом, или 2,6-диметил-4-(1,1-диметилэтил)фенилом, или 2,6-диметилфенилом, 2-бром-4-фтор-6-метилфенилом, или 2-бром-6-хлор-4-фторфенилом, или 4-бром-2,6-диметилфенилом, или 4-хлор-2,6-диметилфенилом, или 4-циано-2,6-диметилфенилом; или L представляет -X1-R6 или -X2-Alk-R7, где R6 и R7, каждый независимо, представляют фенил, 2,4,6-трихлорфенил, 2,4,6-триметилфенил, 2,4-дибром-3,5-дихлорфенил, 2,4-дибром-6-фторфенил, 2,4-дихлор-6-метилфенил, 2,6-дибром-4-изопропилфенил, 2,6-дибром-4-метилфенил, 2,6-дибром-4-проп-1-илфенил, 2,6-дихлор-4-цианофенил, 2,6-дихлор-4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил, 2,6-дихлорфенил, 2,6-диметил-4-(1,1-диметилэтил) фенил, 2,6-диметилфенил, 2-бром-4-фтор-6-метилфенил, 2-бром-6-хлор-4-фторфенил, 4-бром-2,6-диметилфенил, 4-хлор-2,6-диметилфенил или 4-циано-2,6-диметилфенил.
10. Соединение по п.4, представляющее собой
4-[[4-амино-6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]бензонитрил;
6-[(2,6-дихлорфенил)метил]-N2-(4-фторфенил)-2,4-пиримидиндиамин;
4-[[4-[(2,4-дихлорфенил)метил]-6-[(4-гидроксибутил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[(3-гидроксипропил)амино]-2-пиримидинил]амино]бензонитрил;
N-[2-[(4-цианофенил)амино]-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]ацетамид;
N-[2-[(4-цианофенил)амино]-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]бутанамид;
4-[2-амино-6-[(2,6-дихлорфенокси)-4-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[(2-гидрокси-2-фенилэтил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[[3-(2-оксо-1-пирролидинил)пропил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[[2-(2-гидроксиэтокси)этил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[(2,3-дигидроксипропил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-(гидроксиамино)-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2-цианоэтил)амино]-6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)метил]-6-[[2-(1-пирролидинил)этил]амино]-2-пиримидинил] амино]бензонитрил;
4-[[4-амино-6-[(2,6-дихлорфенил)метил]-5-метил-2-пиримидинил]амино]бензонитрил;
N2-(4-бромфенил)-6-[(2,6-дихлорфенил) метил]-5-метил-2,4-пиримидиндиамин;
4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[2-[(2,4,6-триметилфенил)амино]-4-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[4-[(2,4,6-триметилфенокси)-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дихлорфенил)тио]-2-пиримидинил]амино]бензонитрил;
4-[[4-[[(2,6-дибром)-4-(1-метилэтил)фенил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[[2,6-дихлор-4-(трифторметил)фенил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4-дихлор-6-метилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[2-[(цианофенил)амино]-4-пиримидинил]амино]-3,5-диметилбензонитрил;
4-[[4-[(2,4-дибром-6-фторфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-6-[(2,6-дихлорфенил)метил]-5-метил-2-пиримидинил]амино]бензацетонитрил;
4-[[4-[метил(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-трихлорфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-трихлорфенил)тио]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-трихлорфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-6-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-амино-6-[(2,4,6-триметилфенил)амино]-4-пиримидинил]амино]бензонитрил;
4-[[4-(2-бром-4-хлор-6-метилфенокси)-2-пиримидинил]амино]бензонитрил;
4-[[4-[(4-хлор-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
3,5-дихлор-4-[[2-[(4-цианофенил)амино]-4-пиримидинил]амино]бензонитрил;
4-[[4-[[2,6-дихлор-4-(трифторметокси)фенил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[[2,4-дибром-3,6-дихлорфенил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[[2,6-дибром-4-пропилфенил]амино]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензамид;
4-[[4-[(4-(1,1-диметилэтил)-2,6-диметилфенил)амино]-2-пиримидинил]амино]бензонитрил;
4-[[2-[(4-цианофенил)амино]-4-пиримидинил]окси]-3,5-диметилбензонитрил;
4-[[4-[(4-хлор-2,2-диметилфенил)амино]-5-метил-2-пиримидинил]амино]бензонитрил;
4-[[2-[(4-цианофенил)амино]-5-метил-4-пиримидинил]амино-3,5-диметил]бензонитрил;
4-[[4-[[4-(1,1-диметилэтил)-2,6-диметилфенил]амино]-5-метил-2-пиримидинил]амино]бензонитрил;
4-[[4-[[4-бром-2,6-диметилфенил]амино]-5-метил-2-пиримидинил]амино]бензонитрил;
4-[[5-метил-4-[(2,4,6-триметилфенил)тио]-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,6-дибром-4-пропилфенил)амино]-5-метил-2-пиримидинил]амино]бензонитрил;
4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензамид, N3-оксид;
N2-(4-хлорфенил)-N4-(2,4,6-триметилфенил)-2,4-пиримидиндиамин;
4-[[4-[[2,6-дибром-4-(1-метилэтил)фенил]амино]-5-метил-2-пиримидинил]амино]бензонитрил;
4-[[2-[(4-цианофенил)амино]-5-метил-4-пиримидинил]амино]-3,5-диметилбензонитрил;
4-[[4-[(фенилметил)амино]-2-пиримидинил]амино]бензонитрил;
его N-оксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму.
11. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.4-10.
12. Способ получения фармацевтической композиции по п.11, отличающийся тем, что терапевтически эффективное количество соединения по любому из пп.4-10 тщательно смешивают с фармацевтически приемлемым носителем.
13. Способ получения соединения по п.4, отличающийся тем, что включает взаимодействие интермедиата формулы (II-А), где W1 - подходящая уходящая группа, с аминопроизводным формулы (III) необязательно в растворителе в реакционноинертной атмосфере и необязательно в присутствии кислоты
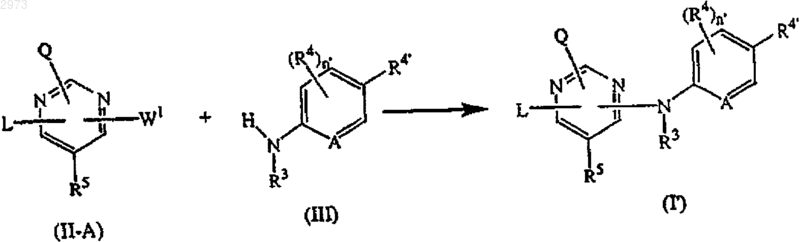
где Q, R3, R4, R4', R5, А, n' и L являются такими, как определены в п.4;
с получением соединений формулы (I') или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды.
14. Способ получения соединения по п.4, отличающийся тем, что включает взаимодействие интермедиата формулы (II-B), где W1 - подходящая уходящая группа, с аминопроизводным формулы (VI), необязательно в растворителе в реакционноинертной атмосфере и необязательно в присутствии кислоты
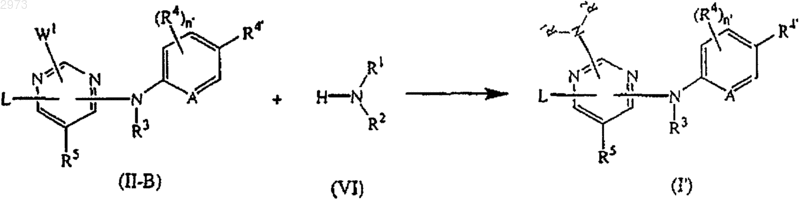
где A, L, R1, R2, R3, R4, R4', R5 и n' являются такими, как определены в п.4;
с получением соединений формулы (I') или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды.
15. Способ получения соединения по п.4, отличающийся тем, что включает взаимодействие интермедиата H-X-R6 с интермедиатом формулы (II-C) в подходящем растворителе, необязательно в присутствии подходящей кислоты или основания, где A, Q, X1, R3, R4, R4', R5, R6 и n' являются такими, как определены в п.4;
с получением соединений формулы (I'), где L является -X-R6, причем указанные соединения представлены формулой (I'-с),
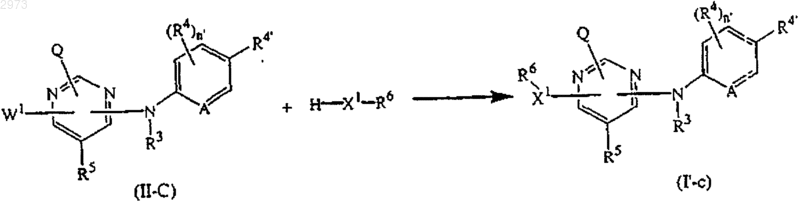
или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды.
16. Применеэшх соединения по п.4 в качестве лекарственного средства.
17. Комбинированный препарат для одновременного, раздельного или последовательного применения в анти-ВИЧ-лечении, содержащий (а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение.
18. Комбинированный препарат для одновременного, раздельного или последовательного применения в анти-ВИЧ-лечении, содержащий (а) соединение формулы (I') по п.4 и (b) другое антиретровирусное соединение.
19. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение.
20. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение формулы (I') по п.4 и (b) другое антиретровирусное соединение.
21. Соединение формулы (II'-В)
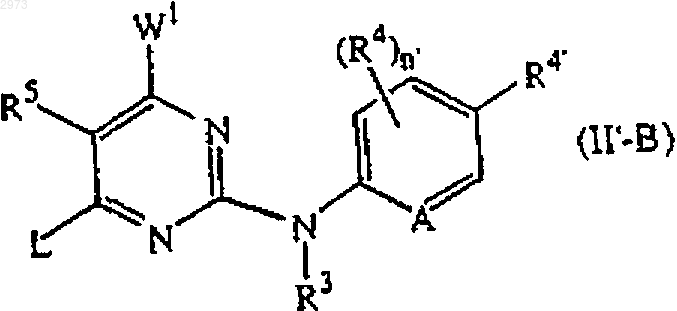
где R3, R4, R4', n', А и L являются такими, как определены в п.4 и W1 является галогеном.
22. Применение соединений по любому из пп.1-3 для производства лекарственного средства для лечения от ВИЧ-инфекции, устойчивой к множественным лекарственным средствам.
23. Применение соединений по любому из пп.1-3 для производства лекарственного средства для лечения от ВИЧ-инфекции, устойчивой по отношению к ненуклеозидным ингибиторам обратной транскриптазы, отличным от определенных в пп.1-3.
24. Применение соединений по любому из пп.1-3 для производства лекарственного средства для лечения от ВИЧ-1-инфекции, устойчивой по отношению к ненуклеозидным ингибиторам обратной транскриптазы, отличным от определенных в пп.1-3.
25. Соединение по п.10, которое представляет собой 4-[[2-[(цианофенил)амино]-4-пиримидинил]амино]-3,5-диметилбензонитрил, его N-оксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму.
26. Соединение по п.10, которое представляет собой 4-[[4-[(2,4,6-триметилфенил)амино]-2-пиримидинил]амино]бензонитрил, его N-оксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму.
Текст
1 Настоящее изобретение касается производных пиримидина, проявляющих ингибирующие свойства ВИЧ-репликации. Кроме того,изобретение относится к способам их получения и фармацевтическим композициям, содержащим их. Изобретение также относится к применению указанных соединений в производстве лекарственных средств, полезных при лечении субъектов, страдающих от ВИЧ (вируса иммунодефицита человека) инфекции. Соединения, структурно похожие на соединения настоящего изобретения, раскрыты в предшествующем уровне техники.JP-9 068 784 раскрывают ряд тризамещенных пиримидинов, используемых в фотографических материалах. JP-8 199 163 описывает тризамещенные пиримидины, используемые в органических электролюминисцентных приборах.J.Indian Chem. Soc. (1975), 52(8), 774-775 раскрывает синтез некоторых бис(ариламино) пиримидинов. J. Heterocycl. Chem. (1973), 10(2) 167-171 описывает конденсацию различных аминопиримидинов с пикрилгалогенидами, J.Org. Chem. (1961), 26, 4433-4440 раскрывает некоторые триаминопиримидины в качестве промежуточных соединений в синтезе триазолоWO 91/18887 раскрывает диаминопиримидины в качестве ингибиторов секреции желудочной кислоты. Неожиданно обнаружено, что соединения формулы (I) эффективно ингибируют репликацию вируса иммунодефицита человека (ВИЧ) и,соответственно, могут быть полезны при лечении ВИЧ-инфицированных индивидуумов. Настоящее изобретение касается применения соединений формулы их N-оксидов, фармацевтически приемлемых солей присоединения и стереоизомерных форм,где А является СН или N;Q является водородом или -NR1R2;R1 и R2, каждый независимо, выбран из водорода, гидрокси, С 1-12 алкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,где каждая из вышеупомянутых С 1-12 алкильных групп необязательно и каждая независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси, циано, арила и Het; илиR3 является водородом или C1-6 алкилом; и каждый R4 независимо является гидрокси, галогеном, C1-6 алкилом, C1-6 алкилокси,циано, аминокарбонилом, нитро, амино, тригалогенметилом, тригалогенметилокси или C1-6 алкилом, замещенным циано или аминокарбонилом;L - C1-10 алкил, замещенный фенилом, где указанный фенил может быть замещен одним,двумя, тремя, четырьмя или, где возможно, пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила,C1-6 алкилокси, циано, аминокарбонила, амино,тригалогенметила, тригалогенметилокси и C1-6 алкилкарбонила; илиR6 и R7, каждый независимо, является фенилом или фенилом, замещенным одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила, циано, аминокарбонила, нитро,амино, тригалогенметилокси и тригалогенметила; иAlk - С 1-4 алкандиил; арил является фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси, циано, нитро и трифторметила;Het - алифатический или ароматический гетероциклический радикал; при этом указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила, морфолинила,тетрагидрофуранила и тетрагидротиенила, где каждый указанный алифатический гетероциклический радикал необязательно может быть замещен оксо группой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила, пиримидинила, пиразинила и пиридазинила, где каждый указанный ароматический гетероциклический радикал необязательно может быть замещен гидрокси; для производства лекарственного средства для лечения от ВИЧ (вируса иммунодефицита человека) инфекции. Это изобретение также касается соединений формулы их N-оксидов, фармацевтически приемлемых солей присоединения или стереохимически 3 изомерных форм, где L, Q, R3, R4, R5 и А - такие,как определены для формулы (I), иR4' - галоген, C1-6 алкил, циано, аминокарбонил, нитро, тригалогенметил, тригалогенметилокси или C1-6 алкил, замещенный циано или аминокарбонилом;n' равен 0, 1, 2 или 3; при условии, что Q и L отличны от анилино, 2,4,6-тринитроанилино, 3-метоксианилино,4-метоксианилино, 3,4-диметоксианилино, 3 хлор-4-фторанилино, 4-цианоанилино, 2-(C1-6 алкил)анилино, 4-(C1-6 алкил)анилино, 3-хлоранилино, 4-броманилино, 4-нитроанилино и 4 хлоранилино. При использовании в предыдущих определениях и далее галоген означает фтор, хлор,бром и йод; С 1-4 алкил как группа или часть группы охватывает прямые или разветвленные насыщенные углеводородные радикалы, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил и тому подобные; C1-6 алкил как группа или часть группы охватывает прямые или разветвленные насыщенные углеводородные радикалы, такие как даны в определении C1-4 алкила, также как и их высшие гомологи, содержащие 5 или 6 атомов углерода, такие как, например, пентил или гексил; C1-10 алкил как группа или часть группы охватывает прямые или разветвленные насыщенные углеводородные радикалы, такие как,даны в определении C1-6 алкила, также как и их высшие гомологи, содержащие 7-10 атомов углерода, такие как, например, гептил, октил, нонил или децил; С 1-12 алкил как группа или часть группы охватывает прямые или разветвленные насыщенные углеводородные радикалы, такие как, даны в определении C1-10 алкила, также как и их высшие гомологи, содержащие 11 или 12 атомов углерода, такие как, например, ундецил или додецил и им подобные; С 1-4 алкилиден как группа или часть группы означает бивалентные прямые или разветвленные углеводороды с 1-4 атомами углерода, такие как, например, метилен, этилиден, пропилиден, бутилиден и им подобные; С 1-4 алкандиил как группа или часть группы охватывает такие радикалы, как определены для С 1-4 алкилидена, также как и другие бивалентные прямые и разветвленные углеводороды с 1-4 атомами углерода, такие как, например, 1,2-этандиил, 1,3-пропандиил, 1,4 бутандиил и им подобные; С 3-7 циклоалкил как группа или часть группы является общим для циклопропила, циклобутила, циклопентила,циклогексила и циклогептила. Должно быть понятно, что три заместителя[L, Q и NR3 (необязательно замещенный фенил или пиридил)] на пиримидиновом кольце могут занимать любой из свободных положений пиримидинового кольца. Так, при данной следующей нумерации пиримидинового кольца три заместителя могут быть присоединены к пиримидиновому кольцу тремя различными путями: 2-L, 4-Q, 6-NR3 (необязательно замещенный фенил или пиридил); или 4-L', 2-Q, 6-NR3 (необязательно замещенный фенил или пиридил); или 6-L, 4-Q, 2-NR3 (необязательно замещенный фенил или пиридил). Положения 4 и 6 эквивалентны по отношению друг к другу. Например, структура с замещением 6-L, 4-Q, 2-NR3 (необязательно замещенный фенил или пиридил), которая является предпочтительным примером замещения, эквивалентна по отношению к структуре с замещением 4-L, 6-Q, 2-NR3 (необязательно замещенный фенил или пиридил). Указанная подгруппа соединений представлена формулой Интересной группой соединений являются соединения формулы: Особенно интересны те соединения формулы (I'-1), где L и Q отличаются от анилино,2,4,6-тринитроанилино, 4-(C1-6 алкил)анилино, 4 броманилино, 4-нитроанилино и 4-хлоранилино; и наиболее интересны те соединения формулы(I'-1), где R4' - циано, аминокарбонил или C1-6 алкил, замещенный циано или аминокарбонилом. Упоминаемые здесь соли присоединения предназначены для включения терапевтически активных солевых форм присоединения, которые соединения настоящего изобретения способны образовать с подходящими кислотами,такими как, например, неорганические кислоты,такие как галоидоводородные кислоты, например, хлористо-водородная или бромистоводородная кислоты; серная; азотная, фосфорная или им подобные; или органические кислоты, такие как, например, уксусная, пропановая,гликолевая, молочная, пировиноградная, щавелевая, малоновая, янтарная, малеиновая, фумаровая, малоновая, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, паратолуолсульфоновая, циклоаминовая,салициловая, парааминосалициловая, памовая и подобные кислоты. Фармацевтически приемлемые соли присоединения, упоминаемые выше, также предназначены для включения терапевтически активных нетоксичных основных, в частности, соле 5 вых форм присоединения металла или амина,которые соединения настоящего изобретения способны образовывать. Указанные соли удобно получать обработкой соединений настоящего изобретения, содержащих кислотные атомы водорода подходящим органическим или неорганическим основанием такие как, например,соли аммония, соли щелочного и щелочноземельного металла, например, соли лития, натрия, калия, магния, кальция и им подобные,соли органических оснований, например, бензатина, N-метил-D-глюкамина, соли гидрабамина,и соли с аминокислотами, например, такими как аргинин, лизин и тому подобные. Наоборот, указанные формы солей можно обработкой подходящим основанием или кислотой превращать в свободную кислотную или основную форму. Термин соли присоединения также включает гидраты и формы присоединения растворителя, которые соединения настоящего изобретения способны образовывать. Примерами таких форм являются гидраты, алкоголяты и им подобные. Выше используемый термин стереохимически изомерные формы соединений настоящего изобретения означает все возможные соединения, образованные такими же атомами с той же самой последовательностью связей, но имеющими разные третичные структуры, которые не являются равнозначными, которыми могут обладать соединения настоящего изобретения. Если иначе не упоминается или не отмечается, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми указанное соединение может обладать. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. При определении объема притязаний настоящего изобретения подразумевается, что все стереохимически изомерные формы соединений настоящего изобретения, как в чистом виде, так и в виде смеси друг с другом охватываются данным изобретением. Некоторые соединения настоящего изобретения могут также существовать в их таутомерных формах. Подразумевается, что такие формы, хотя явно не указаны в вышеприведенной формуле, также включены в объем настоящего изобретения. Всякий раз при использовании термин соединения настоящего изобретения означает,что он включает соединения формул (I), (I-1),(I'), (I'-1), а также их N-оксиды, фармацевтически приемлемые соли присоединения и все стереоизомерные формы. Интересна группа, содержащая те соединения настоящего изобретения, где Q - NR1R2,каждый R4 независимо является гидрокси, галогеном, C1-6 алкилом, C1-6 алкилокси, циано, аминокарбонилом, нитро, амино, тригалогенмети 002973 6 лом или тригалогенметилокси; L - C1-10 алкил,замещенный фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, циано, аминокарбонила, амино, тригалогенметила, тригалогенметилокси и C1-6 алкилкарбонила; или L является -X-R6, где R6 фенил или фенил, замещенный одним, двумя,тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила, циано и трифторметила; при условии, что соединения(bb) N2,N4-дифeнилпиpимидин-2,4,6-триилтриамин не включены. Соответственно, так же интересно в этой указанной выше группе, когда Q может быть водородом. Особую группу соединений составляют соединения формулы (I) или (I'), где n равно, по крайней мере, 1 и, по крайней мере, один R4 является циано; предпочтительно, n равно 1 и R4 является циано, замещенным в пара-положении по отношению к NR3 фрагменту. Другая особая группа соединений включает те соединения формулы (I) или (I'), которые отличны от(e) N4-(2-метилфенил)-6-(фенилметил)-2,4 пиримидиндиамина; их N-оксиды, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы. Интересной группой соединений являются те соединения настоящего изобретения, где NR3(замещенный фенил или пиридил) фрагмент находится в 4- или 6-положении пиримидинового кольца. Другой интересной группой являются те соединения настоящего изобретения, где каждый R4 независимо является гидрокси, галогеном, C1-6 алкилокси, циано, аминокарбонилом,нитро, амино, тригалогенметилом или тригалогенметилокси; R6 -фенил или фенил, замещенный одним, двумя или тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкилокси, C1-6 алкилкарбонила, циано и трифторметила; и арил является фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкилокси, циано, нитро и трифторметила. Предпочтительно Q является NR1R2, где 1R - водород, гидрокси, C1-6 алкил, С 1-12 алкилокси, С 1-12 алкилкарбонил, C1-12 алкилоксикарбонил; и R2 - гидрокси, С 1-12 алкил, C1-12 алкилокси, С 1-12 алкилкарбонил, С 1-12 алкилоксикарбонил; где каждая из выше упомянутых C1-12 алкильных групп необязательно и каждая независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6-алкилокси, гидроксиС 1-6 алкилокси, циано, арила и Het; или R1 и R2, взятые вместе, могут образовывать моно- или ди(С 1-12 алкил) аминоС 1-4 алкилиден. 8 Предпочтительно L является C1-10 алкилом,замещенным фенилом, где указанный фенил может быть замещен одним, двумя, тремя, четырьмя или, где возможно, пятью заместителями, из которых каждый независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси,циано, аминокарбонила, амино, тригалогенметила, тригалогенметилокси и C1-6 алкилкарбонила; или L является -X1-R6 или -X2-Alk-R7, и когда X1 является NR3, тогда R6 является фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из тригалогенметилокси. Предпочтительно R4 или R4' является нитро, тригалогенметилокси или C1-6 алкилом, замещенным циано или аминокарбонилом. Предпочтительно R6 - фенил или фенил,замещенный одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкилокси, циано, аминокарбонила, амино, тригалогенметилокси или тригалогенметила. Предпочтительно, как Q, так и R5 являются водородом. Предпочтительно L является C1-10 алкилом,замещенным фенилом, где указанный фенил может быть замещен одним, двумя, тремя, четырьмя или, где возможно, пятью заместителями, из которых каждый независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси,циано, аминокарбонила, амино, тригалогенметила и C1-6 алкилкарбонила; или L является -Х 1R6 или -X2-Alk-R7; и R5 - водород. Особыми группами соединений являются те группы, в которых удовлетворяются одно или более следующих условий:(iii) Q является NR1R2, где R1 и R2, каждый независимо, выбран из водорода, гидрокси, С 1-12 алкила, С 1-12 алкилокси, C1-12 алкилкарбонила,С 1-12 алкилоксикарбонила, где каждая выше упомянутая С 1-12 алькильная группа необязательно и каждая независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси,циано, C1-6 алкилокси, гидроксиС 1-6 алкилокси,арила и Het; или(v) R4 - циано, аминокарбонил, амино, нитро, гидрокси, галоген, C1-6 алкил или цианоС 1-6 алкил;(vi) R4 является циано, аминокарбонилом,галогеном, C1-6 алкилом или цианоС 1-6 алкилом;(viii) L - C1-10 алкил, замещенный фенилом,замещенным одним или двумя галогенами; илиL является -X1-R6, где R6 -фенил, замещенный одним, двумя или тремя заместителями, вы 9 бранными из C1-6 алкила, трифторметила, трифторметокси, циано и галогена, и Х 1 является -S-,-О- или NR3-; или L является X2-Alk-R7; и R7 фенил, замещенный одним, двумя или тремя заместителями, выбранными из C1-6 алкила, циано, и галогена, и X2 является NH. Другими особыми соединениями являются те соединения настоящего изобретения, где L содержит фенил, 2,6-дизамещенный фенил,2,4,6-тризамещенный фенил или 2,3,4,5 тетразамещенный фенилю. Предпочтительно, когда L содержит фенил, 2,4,6-тригалогенфенил, 2,4,6-триС 1-4 алкилфенил, 2,3,4,5-тетрагалогенфенил; 2,4-дигалоген-6-С 1-4 алкилфенил,2,6-дигалоген-4-C1-4 алкилфенил, 2,6-дигалоген-4-цианофенил, 2,6 дигалоген-4-трифторметоксифенил, 2,6-дигалоген-4-трифторметилфенил,2,6-диС 1-4 алкил-4 галогенфенил, 2,6-диС 1-4 алкил-4-цианофенил,2,6-дигалогенфенил или 2,6-диС 1-4 алкилфенил; более предпочтительно, когда L содержит фенил, 2,4,6-трихлорфенил, 2,4,6-триметилфенил,2,4-дибром-3,5-дихлорфенил,2,4-дибром-6 фторфенил,2,4-дихлор-6-метилфенил,2,6 дибром-4-изопропилфенил, 2,6-дибром-4-метилфенил, 2,6-дибром-4-проп-1-илфенил, 2,6-дихлор-4-цианофенил,2,6-дихлор-4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил,2,6-дихлорфенил, 2,6-диметил-4-(1,1-диметилэтил)фенил, 2,6-диметилфенил, 2-бром-4-фтор 6-метилфенил, 2-бром-6-хлор-4-фторфенил, 4 бром-2,6-диметилфенил,4-хлор-2,6-диметилфенил или 4-циано-2,6-диметилфенил. Более предпочтительными соединениями являются соединения настоящего изобретения,где L-2,6-дихлорбензил, или L является -Х 1-R6,где X1 является -NR3-, -S- или -О-, а R6 -2,4,6 трихлорфенил, 2,4,6-триметилфенил, 2,4-дибром-3,5-дихлорфенил,2,4-дибром-6-фторфенил, 2,4-дихлор-6-метилфенил, 2,6-дибром-4 изопропилфенил,2,6-дибром-4-метилфенил,2,6-дибром-4-проп-1-ил-фенил,2,6-дихлор-4 цианофенил,2,6-дихлор-4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил, 2,6 дихлорфенил, 2,6-диметил-4-(1,1-диметилэтил) фенил, 2,6-диметилфенил, 2-бром-4-фтор-6 метилфенил, 2-бром-6-хлор-4-фторфенил, 4 бром-2,6-диметилфенил,4-хлор-2,6-диметилфенил, 4-циано-2,6-диметилфенил; или L является X2-Alk-R7; где X2-Alk- является -NH-СН 2- иR7 является фенилом. Еще более предпочтительными соединениями являются те соединения формулы (I), гдеR3 - водород, А - СН, n = 1, и R4 - галоген, метил или циано и находится в 4-положении фенильного кольца. Предпочтительными соединениями являются те соединения настоящего изобретения,когда L является 2,6-дихлорбензилом и NR3 (необязательно замещенный фенил или пиридил) фрагмент представляет п-цианоанилино и занимает 2 положение пиримидинового кольца. 10 Другими предпочтительными соединениями являются те соединения настоящего изобретения, где Q - водород, L является -X1-R6, где X1 является -NH, а R6 - 2,4,6-триметилфенил или 4 циано-2,6-диметилфенил, и NR3 (необязательно замещенный фенил или пиридил) фрагмент представляет п-цианоанилино и занимает 2 положение примидинового кольца. Еще более предпочтительными соединениями являются те соединения настоящего изобретения, где L является X2-Alk-R7, когда X2 является -NH-, Alk является метиленом, а R7 фенил, 2,6-дихлорфенил, 2,4,6-триметилфенил или 4-циано-2,6-диметилфенил. Наиболее предпочтительными являются те соединения формулы (I1-1), когда R4 - галоген,циано, аминокарбонил или цианоС 1-6 алкил; n = нулю, А является СН, R3 - водород; R5 -водород или метил; Q - водород или NHR1; и L содержит фенил, 2,4,6-трихлорфенил, 2,4,6-триметилфенил, 2,4-дибром-3,5-дихлорфенил, 2,4-дибром-6 фторфенил, 2,4-дихлор-6-метилфенил, 2,6-дибром-4-изопропилфенил, 2,6-дибром-4-метилфенил, 2,6-дибром-4-проп-1-ил-фенил, 2,6-дихлор-4-цианофенил,2,6-дихлор-4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил,2,6-дихлорфенил, 2,6-диметил-4-(1,1-диметилэтил)фенил, 2,6-диметилфенил, 2-бром-4-фтор 6-метилфенил, 2-бром-6-хлор-4-фторфенил, 4 бром-2,6-диметилфенил, 4-хлор-2,6-диметилфенил или 4-циано-2,6-диметилфенил. Самыми предпочтительными являются: 4-4-амино-6-[(2,6-дихлорфенил)метил]-2 пиримидинил]амино]бензонитрил; 6-[(2,6-дихлорфенил)метил]-N2-(4-фторфенил)-2,4-пиримидиндиамин; 4-4-[(2,4-дихлорфенил)метил]-6-[(4-гидроксибутил)амино]-2-пиримидинил]амино]бензонитрил; 4-4-[(2,6-дихлорфенил)метил]-6-[(3-гидроксипропил)амино]-2-пиримидинил]амино] бензонитрил;N2-(4-хлорфенил)-N4-(2,4,6-триметилфенил)-2,4-пиримидиндиамин; 4-4-2,6-дибром-4-(1-метилэтил)фенил] амино]-5-метил-2-пиримидинил]амино]бензонитрил; 4-2-[(4-цианофенил)амино]-5-метил-4 пиримидинил]амино]-3,5-диметилбензонитрил; 4-4-[(фенилметил)амино]-2-пиримидин] амино]бензонитрил; их N-оксиды, фармацевтически приемлемые соли присоединения и стереохимически изомерные формы. Соединения формулы (I) можно получить согласно способам, известным из уровня техники. В частности, соединения формулы (I') обычно можно получить взаимодействием соединения формулы (II-A), где W1 -подходящая уходящая группа, например такая, как галоген, с аминопроизводным формулы (III), необязательно в растворителе, например таком, как вода, 2 пропанол,диэтиловый эфир,1-метил-2 пирролидинон и им подобные, и, необязательно,в присутствии кислоты, например такой, как,например, 1 N хлористо-водородная кислота в диэтиловом эфире. Реакцию удобнее выполнять в реакционно инертной атмосфере, например,такой как освобожденный от кислорода аргон или азот. В этом и следующем получении, продукты реакции можно выделить из реакционной среды и затем, в случае необходимости, очистить в соответствии с методиками, широко известными из уровня техники, такими как, например, экс 13 тракция, кристаллизация, дистилляция, растирание и хроматография. Аналогично вышеописанной реакции, HNR1R2 (VI) может также реагировать с промежуточным соединением формулы (II-В). Подходящими растворителями для вышеописанной реакции являются, например, 2 пропанол или 1,4-диоксан. В случае, когда Q является NR1R2 и R2 содержит гидроксильный фрагмент, удобнее проводить вышеописанную реакцию с защищенной формой промежуточного соединения (VI), где гидроксильная часть несет подходящую защитную группу Р, например, бензил, и впоследствии защитную группу удаляют в соответствии с известными из уровня техники методиками,например, взаимодействием с ВВr3 в дихлорметане в атмосфере азота. Кроме того, возможно взаимодействие HX1-R6 с промежуточным соединением формулы(II-C) в подходящем растворителе, например таком, как 1,4-диоксан, с получением соединения формулы (I'), где L является -X1-R6, причем указанные соединения представлены формулой Для того, чтобы увеличить скорость реакции в зависимости от природы X1, можно использовать подходящее основание или кислоту. Например, в случае, когда X1 является -О-, в качестве подходящего основания можно использовать гидрид натрия; или в случае, когдаX1 является NR3, в качестве подходящей кислоты можно использовать НСl. Далее соединения формулы (I') можно получить превращением соединений формулы (I') друг в друга в соответствии с известными из уровня техники реакциями превращений. Например, соединение формулы (I'), где Q является NR1R2, и R1 и R2, взятые вместе, образуют моно- или ди(С 1-12 алкил)аминоС 1-4-алкилиден, причем указанные соединения представлены формулой (I'-а), можно получить взаимодействием соединения формулы (I'), где R1 и R2 являются водородом, с интермедиатом формулы(IV) или его функциональным производным.Q является NR1R2, и R1 и R2 являются водородом, далее можно подвергнуть реакции с ацилгалогенидом или с алкилхлорформиатом в реакционноинертном растворителе, например, таком как дихлорметан, в присутствии подходящего основания, например, такого как пиримидин, с образованием соответствующего амида, и, соответственно, карбаматного производного. Некоторые соединения формулы (I') и некоторые промежуточные соединения настоящего изобретения могут содержать асимметрический атом углерода. Чистые стереохимически изомерные формы указанных соединений и указанных интермедиатов могут быть получены с применением способов, известных из уровня техники. Например, диастереоизомеры можно разделить физическими способами, такими как избирательная кристаллизация или хроматографические методы, например, противоточное распределение, жидкостная хроматография и тому подобные способы. Энантиомеры можно получить из рацемических смесей, во первых,превращением указанных рацемических смесей с подходящими разделяющими агентами, например, такими как хиральные кислоты, в смеси диастереомерных солей или соединений; с последующим физическим разделением указанных смесей диастереомерных солей или соединений,например, избирательной кристаллизацией или хроматографическими методами, например,жидкостной хроматографией и подобными способами; и, наконец, превращением указанных разделенных диастереомерных солей или соединений в соответствующие энантиомеры. Чистые стереохимические изомерные формы можно также получить из чистых стереохимически изомерных форм соответствующих интермедиатов и исходных материалов, при условии, если только протекание реакций происходит стереоспецифически. Альтернативный способ разделения энантиомерных форм соединений формулы (I') и интермедиатов включает жидкостную хроматографию, в особенности жидкостную хроматографию с использованием хиральной стационарной фазы. Вышеописанные способы для получения соединений формулы (I') или их подгрупп, могут быть также использованы для получения соединений формулы (I). Некоторые промежуточные и исходные соединения являются известными соединениями и могут быть коммерчески доступны или их можно получить в соответствии с известными из уровня техники методиками. Интермедиаты формулы (II-A), где Q является NR1R2, причем указанные интермедиаты представлены формулой (II-A-1), могут быть получены взаимодействием производного пиримидина формулы (V), где W2 является подходящей уходящей группой, например, такой как 15 галоген, с HNR1R2 (VI) в инертном по отношению к реакции растворителе, например, таком как 1,4-диоксан, 2-пропанол и им подобные. Возможно образование различных региоспецифических изомеров и их разделение друг от друга с использованием подходящих методов разделения, таких как, например, хроматография. Интермедиаты формулы (II-B) можно получить аналогично получению соединениям формулы (I'), исходя из промежуточных соединений формулы (II-А) и (III). Особая подгруппа промежуточных соединений формулы (II-В) представлена формулой Особыми интермедиатами формулы (II'-В) являются те, где W1 - галоген, в особенности,атом хлора. Интермедиаты формулы (V), где Q является NR1R2, L является L'-CH2 и присоединен во 2 положении пиримидинового кольца и W2 является хлором, причем указанные интермедиаты представлены формулой (V-a), можно получить взаимодействием имидамида формулы (VII) со сложным эфиром пропандионовой кислоты формулы (VIII) в растворителе, таком как, например, этанол, и в присутствии, например, натрия, с последующим взаимодействием полученного таким образом интермедиата формулы Интермедиаты формулы (V), где Q является NR1R2 и L является L'-CH2 и присоединен в 4 или 6 положении пиримидинового кольца и W2 является хлором, причем указанные интермедиаты представлены формулой (V-b), можно получить взаимодействием интермедиата формулы (X) с мочевиной или его функциональным производным в растворителе, таком как, например, этанол, и в присутствии, например, натрия,с последующим взаимодействием полученного таким образом интермедиата формулы (XI) с Интермедиаты формулы (V), где Q является NR1R2 и L является L'-CH2 и присоединен в любом положении пиримидинового кольца,причем указанные интермедиаты представлены формулой (V-c), можно получить взаимодействием интермедиата формулы (XII-1), для Q являющегося NR1R2, и формулы (XII-2), для Q являющегося водородом, где W2 является подходящей уходящей группой, например, такой как галоген, с интермедиатом формулы (XIII),где W3 - подходящая уходящая группа, такая как, например, галоген, в соответствии с методикой реакции Гриньяра. Интермедиаты формулы (V), где Q является NR1R2 и L является -O-R6 или -NH-R6 и присоединен в 4 или 6 положении пиримидинового кольца, причем указанные интермедиаты представлены формулой (V-d), можно получить взаимодействием интермедиата формулы (XIV) с интермедиатом формулы (XII), где W2 является подходящей уходящей группой, например,такой как галоген, в инертном по отношению к реакции растворителе, таком как, например,тетрагидрофуран или 1,4-диоксан, и в присутствии подходящего основания, такого как, например, гидроксид калия или диизопропилэтанамин, или гидрид натрия. Интермедиаты формул (V-a) - (V-d) можно получить аналогично соединениям формулы (I'),где Q является водородом. Для этой цели на пиримидиновом кольце соответствующего исходного материала присутствует на одну уходящую группу W2 меньше. Соединения формулы (I') и некоторые интермедиаты могут иметь один или более стереообразующих центров в структуре, представленные в R или S конфигурации. Соединения формулы (I'), полученные выше описанными способами, могут быть синтезированы в виде смеси стереоизомерных форм,в частности, в форме рацемических смесей энантиомеров, которые можно отделить друг от друга следующими известными из уровня техники процедурами. Рацемические соединения 17 формулы (I') можно перевести в соответствующие диастеореомерные солевые формы реакцией с подходящей хиральной кислотой. Указанные диастереомерные солевые формы впоследствии разделяют, например, селективной или фракционной перекристаллизацией и выделяют оттуда энантиомеры подщелачиванием. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, при условии, если только реакция протекает стереоспецифично. В том случае, если желателен конкретный стереоизомер, указанное соединение следует синтезировать стереоспецифическими способами получения. В этих способах предпочтительно используют энантиомерно чистые исходные материалы. Соединения настоящего изобретения и интермедиаты формулы (II'-B) проявляют антиретровирусные свойства, в особенности против вируса человеческого иммунодефицита (ВИЧ),который является этиологическим агентом синдрома приобретенного иммунного дефицита(СПИД) человека. У человека ВИЧ-вирус предпочтительно заражает клетки Т-4 и разрушает их или изменяет их нормальную деятельность,особенно координацию иммунной системы. В результате, зараженный пациент имеет сверхпониженное число Т-4 клеток, которые, кроме того, ведут себя аномально. Следовательно, иммунологическая защитная система не способна побороть инфекции и новообразования, и ВИЧинфицированные субъекты обычно умирают от условно-патогенных инфекционных заболеваний, таких как пневмония или от рака. Другие состояния, обусловленные ВИЧ-инфекцией,включают тромбоцитопению, саркому Капоши(пигментную ксеродерму) и инфекцию центральной нервной системы, характеризующуюся прогрессирующей демиелиниезацией, заканчивающейся слабоумием и такими симптомами,как прогрессирующая дизартрия, атаксия и дезориентация. Кроме того, ВИЧ-инфекция также связана с периферической невропатией, прогрессивной генерализованной лимфаденопатией(ARC). Настоящие соединения также проявляют активность против ВИЧ-1 штаммов, которые обладают устойчивостью по отношению к известным из уровня техники ненуклеозидным ингибиторам обратной транскриптазы. Кроме того, они не имеют или обладают слабым сродством связывания -1 кислотным гликопротеином человека. Из-за своих антиретровирусных свойств, в частности, анти-ВИЧ-свойств, особенно их ан 002973 18 ти-ВИЧ-1-активности, соединения настоящего изобретения полезны при лечении ВИЧинфицированных особей и профилактике этих особей. В основном, соединения настоящего изобретения могут быть полезны при лечении теплокровных животных, инфицированных вирусами, чье существование опосредовано или зависит от фермента обратной транскриптазы. Состояния, которые можно предупредить или лечить с помощью соединений настоящего изобретения, особенного состояния, связанные с ВИЧ и другими патогенными ретровирусами,включают СПИД, СПИД-ассоциированный комплекс (ARC), прогрессивную генерализованную лимфаденопатию (PGL), также как хронические заболевания ЦНС, вызванные ретровирусами, например, такие как опосредованное ВИЧ слабоумие и множественный (рассеянный) склероз. Следовательно, соединения настоящего изобретения или любая их подгруппа могут использоваться в качестве лекарственных средств против выше упомянутых состояний. Указанное использование в качестве лекарственного средства или способ лечения включает системное введение ВИЧ-инфицированных субъектам количества соединения, эффективного для борьбы с состояниями, вызванными ВИЧ и другими патогенными вирусами, особенно ВИЧ-1. Из соединений настоящего изобретения или любой их подгруппы можно составить различные фармацевтические формы в соответствии с целями введения. В качестве подходящих композиций здесь можно перечислить все композиции, обычно используемые для систематически вводимых лекарств. Для получения фармацевтической композиции этого изобретения сочетают эффективное количество определенного соединения, необязательно в виде соли присоединения, в качестве активного ингредиента при тщательном перемешивании с фармацевтически приемлемым носителем, в которой носитель может иметь широкое разнообразие форм в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции желательны в единичной дозированной форме, пригодной, в частности, для введения перорально, ректально, подкожно или для парентеральной инъекции. Например, при получении композиции в пероральной дозированной форме, можно использовать любую обычную фармацевтическую среду, такую как, например,воду, гликоли, масла, спирты и им подобные, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазки, связующие вещества, разрыхлители и им подобные в случае порошков,пилюль, капсул и таблеток. Очевидно, что таблетки и капсулы из-за легкости введения, представляют наиболее благоприятную пероральную дозированную единичную форму, в которой 19 используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, в большей части, хотя могут включать и другие ингредиенты, например, для дополнительной растворимости. Можно получить инъекционные растворы, например, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Можно также приготовить инъекционные суспензии, в которых используют подходящие жидкие носители, суспендирующие агенты и им подобное. Также включенными являются твердые формы препаратов, которые предполагают непосредственно перед использованием превратить в жидкую форму препарата. В композициях, пригодных для подкожного введения, носитель необязательно включает увеличивающий проницаемость агент и/или смачивающий агент, необязательно в сочетании с малыми количествами подходящих добавок любой природы, причем добавки не должны наносить существенный вредных эффект коже. Особенно благоприятно составлять вышеназванные фармацевтические композиции в дозированной единичной форме для легкого введения и унификации дозы. Используемая здесь дозированная единичная форма относится к физически раздельным единицам, подходящим в качестве разовых доз, причем каждая единица содержит предопределяющее количество активного ингредиента, рассчитанного для получения желаемого терапевтического действия в сочетании с необходимым фармацевтическим носителем. Примерами таких дозированных единичных форм являются таблетки (включающие таблетки без оболочки или покрытые оболочкой таблетки), капсулы, пилюли, пакетики порошка,облатки, инъекционные растворы или суспензии и им подобные, и их отдельные составляющие. Специалисты в лечении ВИЧ-инфекции могут определить эффективное ежедневное количество из представленных здесь результатов испытаний. В основном предполагается, что эффективное ежедневное количество составляет от 0,01 до 50 мг/кг веса тела, более предпочтительно от 0,1 до 10 мг/кг веса. Может быть подходяще вводить необходимую дозу в виде двух,трех, четырех или более суб-доз при подходящих интервалах в течение дня. Указанные субдозы могут быть составлены как единичные дозированные формы, например, содержащие 11000 мг, и в особенности 5-200 мг активного ингредиента на единичную дозированную форму. Точная доза и частота введения зависит как от конкретного соединения формулы (I),конкретного состояния, которое лечит, тяжести заболевания, возраста, веса и основного физического состояния отдельного пациента, так и от других возможных, индивидуально взятых, ле 002973 20 карственных средств, хорошо известных для специалиста в данной области. Более того, очевидно, что указанное эффективное ежедневное количество можно уменьшить или увеличить в зависимости от реакции субъекта на лечение и/или в зависимости от оценки врачом прописанного соединения настоящего изобретения. Следовательно, вышеупомянутый уровень эффективного ежедневного количества - только общая установка, и не предназначена для ограничения объема или использования изобретения в любой степени. Кроме того, в качестве лекарственных средств можно использовать комбинацию антиретровирусного соединения и соединения настоящего изобретения. Таким образом, настоящее изобретение также относится к продукту,содержащему (а) соединение настоящего изобретения и (б) другое антиретровирусное соединение, как комбинированному препарату для одновременного, раздельного или последовательного использования в анти-ВИЧ лечении. Различные лекарства можно сочетать в едином препарате вместе с фармацевтически приемлемыми носителями. Упомянутые другие антиретровирусные соединения могут быть известными антиретро вирусными соединениями, такими как нуклеозидные ингибиторы обратной транскриптазы, например, зидовудин (3'-азидо-3'деокситимидин, AZT), диданозин (дидеоксиинозин; ddI), зальцитабин (дидеоксицитидин,ddC) или ламивудин (3'-тиа-2'-3'-дидеоксицитидин, ЗТС) и им подобные; ненуклеотидные ингибиторы обратной транскриптазы, такие как сурамин, фоскарнет-натрия (тринатрий фосфоноформиат), невирапин (11-циклопропил-5,11 дигидро-4-метил-6 Н-дипиридо[3,2-b:2'3'-е][1,4] диазепин-6-он), сустива (эфавиренз), такрин(-анилинофенилацетамид) типа, например, [(2-нитрофенил)амино]-2,6-дихлорфенилацетамид и им подобные; ТАТ-ингибиторы, например, RO-5-3335 и ему подобные; ингибиторы протеазы, например, индинавир, ритановир, саквиновир и им подобные; ингибиторы NMDAрецептора, например, пентамидин; ингибитор гликозидазы, например, каста-носпермин и ему подобные, ингибитор РНКаз Н, например, декстран (сульфат декстрана) и ему подобные; или иммуномодулирущие агенты, например, левамизол, тимопентин и им подобные. Следующие примеры предназначены для иллюстрации настоящего изобретения Экспериментальная часть А. Промежуточные соединения. 21 Пример А 1. а) Раствор 2,6-дихлорбензилхлорида (0,102 моля) в 1,1-диэтиловом эфире (10 мл) прикапывают к магнию (0,102 моля) в 1,1-диэтиловом эфире (60 мл). Реакцию инициируют добавлением 2 капель 1,2-дибромэтана. После того, как большая часть магния растворится, добавляют 2,4,6-трихлорпиримидин (0,051 моля) в 1,1 диэтиловом эфире (30 мл). Смесь оставляют на ночь при перемешивании при комнатной температуре. Растворитель упаривают и остаток очищают флэш колоночной хроматографией на силикагеле (элюент: СН 2 Сl2/гексан 1/2). Желаемую фракцию собирают и растворитель упаривают, получая 3,3 г (21%) 2,4-дихлор-6-[(2,6 дихлорфенил)метил]пиримидин (интерм.1; т.пл. 106-107 С). в) Интермедиат (1) (0,0081 моля) в 2 пропаноле (100 мл) нагревают до полного растворения. Затем раствор помещают в трубку под давлением и барботируют NН 3-газ в течение 20 мин. Затем смесь нагревают при 80 С 16 ч. Растворитель упаривают, получая остаток двух соединений: 2-хлор-6-[(2,6-дихлорфенил)метил]4-пиримидинамина (интерм.2) и 4-хлор-6-[(2, 6 дихлорфенил)метил]-2-пиримидинаминаa) К смеси -этил 2,6-дихлорфенил-метилоксобутаноата (0,02 мол) в NaOC2H5 в этаноле, (1 М; 0,040 моля; 40 мл) добавляют мочевину (0,03 моля). Реакционную смесь перемешивают при кипячении с обратным холодильником в течение ночи. Растворитель упаривают, добавляют воду и смесь нейтрализуют 0,3N НОАс. Осадок отфильтровывают и растирают в порошок с эфиром, а затем с Н 2 О, затем отфильтровывают и сушат, получают 2,2 гb) Смесь интермедиата (4) (0,0095 моля) в хлорокиси фосфора (50 мл) перемешивают при кипячении с обратным холодильником в течение ночи. Избыток хлорокиси фосфора упаривают. К остатку добавляют ледяную воду. Образовавшийся белый осадок отфильтровывают и сушат. Остаток очищают флэш колоночной хроматографией на силикагеле (элюент:СН 2 Сl2). Желаемую фракцию собирают и растворитель упаривают, получают 2,06 г (67%) 2,4-дихлор-6[(2,6-дихлорфенил)метил]-5-метилпиримидинаc) 4-хлор-6-[(2,6-дихлорфенил)метил]-5 метил-2-пиримидинамин (интерм. 6) и 2-хлор-6[(2,6-дихлорфенил)метил]-5-метил-4-пиримидинамин (интерм.7) получают из интермедиата 5 в соответствии с методикой, описанной в примере A1b. Пример A3. а) К раствору 2,6-дихлорфенилэтанимидамида НСl (1:1), (0,0042 моля) в этаноле (20 22 мл) при перемешивании сначала добавляют по каплям раствор натрия (0,013 моля) в этаноле(10 мл), а затем диэтиловый эфир пропандиовой кислоты (0,0109 моля). Реакционную смесь перемешивают и кипятят с обратным холодильником в течение 4 ч и затем в течение ночи при комнатной температуре. После прибавления дополнительного эквивалента диэтилового эфира пропандиовой кислоты (реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи), растворитель упаривают и остаток фильтровывают, промывают водой и сушат, получают 0,87 г (76,4%) 2-[(2,6 дихлорфенил)метил]-4,6-пиримидиндиола (интерм.8).b) 6-Хлор-2-[(2,6-дихлорфенил)метил]-4 пиримидинамин (интерм.9) получают, исходя из интермидиата 8 в соответствии с методикой,описанной в примере A.1.b, A.2.b и А.2.с. Пример А 4. К раствору интермидиата (1) (0,008 моля) в 1,4-диоксане (20 мл) под аргоном прибавляют 4 амино-1-бутанол (1,57 мл). Реакционную смесь перемешивают 2 ч при комнатной температуре. Растворитель упаривают. Остаток очищают флэш колоночной хроматографией на силикагеле (градиент элюента:СН 2 Сl2/СН 3 ОН: от 100/0 до 98/2). Чистые фракции собирают и растворитель упаривают, получают 2,05 г смеси 4-2 хлор-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]амино]-1-бутанола (интерм.10) и 4-4-хлор 6-[(2,6-дихлорфенил)метил]-2-пиримидинил]амино]-1-бутанола (интерм.11). Пример А 5.a) К раствору 2,6-дихлорфенола (0,035 моля) в тетрагидрофуране (100 мл) прибавляют гидроксид калия в этаноле (10%; 0,035 мол). Смесь перемешивают и прибавляют 2,4,6 трихлорпиримидина (0,044 моля). Смесь перемешивают в течение ночи при 60 С. Реакцию останавливают 1N раствором NaOH. Водный слой экстрагируют несколько раз этилацетатом,органические слои объединяют и промывают 3N раствором NaOH и насыщенным NaCl, сушат и концентрируют. Остаток перекристаллизовывают из CH2Cl2/гeкcaн. Осадок отфильтровывают и сушат, получают 5,98 г 2,4-дихлор-6(2,6-дихлорфенокси)пиримидина (55%) (интерм.12).b) Реакция в атмосфере аргона. 2,4,6-Триметиланилин (0,0678 моля) прибавляют к 2,4-дихлорпиримидину (0,0664 моля) в 1,4-диоксане (100 мл). Прибавляют N,N-ди(1 метилэтил)этанамин (0,0830 моля). Реакционную смесь перемешивают и кипятят с обратным холодильником 4 дня и растворитель упаривают. Остаток растворяют в CH2Cl2, промывают насыщенным раствором NaHCO3, затем сушат(Na2SO4), фильтруют, растворитель упаривают и получают 17,1 г твердого остатка. Этот твердый остаток растворяют в СН 2 Сl2:гексан (1:1, 150 мл), полученный раствор концентрируют до 100 23 мл, затем фильтруют. Остаток очищают колоночной хроматографией на KP-Sil(элюент:CH2Cl2). Желаемые фракции собирают и растворитель упаривают. Менее полярную фракцию перемешивают 3 ч в CH2Cl2 и фильтруют,получают 0,44 г 4-хлор-N-(2,4,6-триметилфенил)-2-пиридинамина (интермедиат 48). Вторую фракцию перекристаллизовывают из ацетонитрила, отфильтровывают и сушат, получают 2 хлор-N-(2,4,6-триметилфенил)-4-пиридинамина(0,00135 моля) в CH2Cl2 (19 мл) добавляют 1 мл пиридина. Прикалывают раствор хлорангидрида хлоруксусной кислоты (0,001375 моля) в СН 2 Сl2(0,5 мл) на ледяной бане. Смесь перемешивают при комнатной температуре 2 ч. Прибавляют еще хлорангидрид хлоруксусной кислоты(0,00625 моля) в CH2Cl2 (0,5 мл). Смесь оставляют на ночь в холодильнике. Растворитель упаривают, остаток обрабатывают насыщенным раствором Nа 2 СО 3 и смесь экстрагируют СН 2 Сl2. Отделенный органический слой сушат,фильтруют и концентрируют. Остаток очищают флэш колоночной хроматографией на силикагеле (элюент; CH2Cl2/CH3OH/NH4OH 99/1/0,1). Отбирают желаемые фракции и упаривают растворитель, получают 0,22 г (36,5%) 2-хлор-N-[6[(2,6-дихлорфенил)метил]-2-[(4-цианофенил) амино]-4-пиримидинил]ацетамида (интерм.13). Пример A7 Смесь 4-[(4-хлор-2-пиримидинил)амино] бензонитрила (0,005 моля) и нитрила тетрафторбората (0,0025 моля) в ацетонитриле (5 мл) перемешивают 4 ч при комнатной температуре. Материал разлагают насыщенным бикарбонатом (50 мл) на раздробленном льду. Смесь оставляют до достижения комнатной температуры и отфильтровывают желтое твердое вещество. Твердое вещество абсорбируют на силикагеле и очищают колоночной хроматографией (элюент: 30%, 50%, 60%, 70% CH2Cl2 в гексанах). Упаривают растворитель из желаемой фракции и остаток сушат, получают 0,89 г (64%) 3-нитро-4-[(4 хлор-2-пиримидинил)амино]бензонитрила (интерм.51). Пример А 8. Смесь 2,6-дихлор-N-(2,4,6-триметилфенил)-4-пиримидинамина (0,00376 моля) в 2,0 М растворе NН 3 в 2-пропаноле (25 мл) и 0,5 М раствора NН 3 в диоксане (25 мл) нагревают под давлением при 110-115 С 24 ч. Растворитель упаривают и остаток хроматографируют на Biotage (элюент: 1:1 СН 2 Сl2:гексан). Отбирают желаемые фракции и упаривают растворитель,получают смесь 0,523 г 2-хлор-N4-(2,4,6 триметилфенил)-4-пиримидиндиамина (интерм. 53) и 0,101 г 6-хлор-N4-(2,4,6-триметилфенил)2,4-пиримидиндиамина (интерм. 50). 24 В табл. 1 и 2 перечислены промежуточные соединения, которые получены аналогично одному из выше представленных примеров. Таблица 1 а(19) (0,004 моля) и 4-аминобензонитрила (0,0084 моля) помещают в запаяную трубку и нагревают 16 ч при 160 С под аргоном. Реакционную смесь оставляют остывать до комнатной температуры, растворяют в СН 2 Сl2/СН 3 ОН 90/10 (20 мл) и добавляют 5 г силикагеля. Затем упаривают растворитель, остаток очищают флэш колоночной хроматографией на силикагеле (градиент элюента:СН 2 Сl2/СН 3 ОН: от 100/0 до 97/3). Отбирают желаемую фракцию и упаривают растворитель, получают 0,31 г (18,1%) 4-4-[(2,6 дихлорфенил)метил]-6-[(3-гидроксипропил) амино]-2-пиримидинил]амино]бензонитрила(соединение 3). Пример В 2. Интермедиаты (47) и (22) (0,00399 моля) и 4-аминобензонитрила (0,0012 моля) в 1-метил-2 пирролидиноне (3 мл) перемешивают 16 ч при 130 С под аргоном. Затем реакционную смесь охлаждают до комнатной температуры и разлагают водой (200 мл). Образуется осадок, который перемешивают 16 ч и отделяют фильтрованием через целит. Осадок растворяют в CH3OH/CH2Cl2 (10%, 200 мл), сушат над К 2 СО 3, фильтруют и упаривают. Полученный материал далее очищают флэш колоночной хроматографией на силикагеле (градиент элюента: СН 2 Сl2/СН 3 ОН: от 100/0 до 95/5). Отбирают желаемые фракции и упаривают растворитель, получают 0,43 г(0,00277 моля) в 1-метил-2-пирролидиноне (4 мл) в атмосфере азота. Реакционную смесь греют 5 мин. Затем добавляют 4-аминобензонитрил(0,0061 моля) и реакцию нагревают при 100 С 16 ч. Затем реакционную смесь охлаждают до комнатной температуры и разбавляют этилацетатом (10 мл). Органический слой промывают водой с NaOH (1N; 2 х 100 мл), H2O (2 х 100 мл),соленой водой (50 мл), соответственно, сушат,фильтруют и фильтрат упаривают. Сырой материал очищают флэш колоночной хроматографией (элюент:2,5-7,5% метанол, содержащий 10%NH4OH в CH2Cl2). Отбирают желаемые фракции и упаривают растворитель. Остаток сушат, получают 0,16 г (12, 0%) 4-4-[(2,6-дихлорфенил) метил]-6-2-(1-пирролидинил)этил]амино]-2 пиримидинил]амино]бензонитрила (соединение 13; т.пл. 80-85 С). Пример В 4. Взвесь интермедиата (14) (0,005 моля) вCH2Cl2 (150 мл) интенсивно перемешивают и охлаждают до 0 С под азотом. Шприцом вводят ВВr3 (0,015 моля). Реакционную смесь интенсивно перемешивают 2 ч. Реакционную смесь повторно охлаждают до 0 С и разлагают NaOH(водн. 1N, 25 мл). Бифазная частично разложенная смесь дает осадок, который отфильтровывают и сушат, получают 2,5 г (91%) дигидробромида-пентагидрата 4-4-[(2,6-дихлорфенил) метил]-6-(гидроксиамино)-2-пиримидинил] амино]бензонитрила (соединение 15; т.пл. 240244 С). Пример В 5. К 4-4-амино-6-[(2,6-дихлорфенил)метил]2-пиримидинил]амино]бензонитрилу(0,0008 моля) прибавляют 1,2-диметокси-N,N-диметилметанамин (0,152 моля). Реакционную смесь перемешивают 2 дня при комнатной температуре и затем концентрируют. Сырой продукт очищают флэш хроматографией на силикагеле(элюент: CH2Cl2/CH3OH 99/1). Отбирают желаемую фракцию и упаривают растворитель. Полученный остаток растирают с гексаном, получают 0,15 г (42%) N'-[2-[(4-цианофенил) амино]-6-[(2,6-дихлорфенил)метил]-4-пиримидинил]-N,N'-диметилметанимидамида (соединение 26; т.пл. 175-180 С). Пример В 6. К интермедиату (13) (0,00047 моля) в тетрагидрофуране (20 мл) прибавляют пиперидин(0,12 мл). Смесь перемешивают при комнатной температуре 4 ч. Дополнительно прибавляют пиперидин (0,14 мл). Смесь перемешивают еще 2 ч. Растворитель упаривают. Остаток очищают флэш хроматографией на силикагеле (элюент: СН 2 Сl2/СН 3 ОН/NH4 ОН 99/1/0,1). Отбирают желаемые фракции и упаривают растворитель,получают 0,05 г (21,5%) N-[6-[(2,6-дихлорфенил)метил]-2-[(4-цианофенил)амино]-4-пири 27 мидинил]-1-пиперидинацетамида (соединение 25; т.пл. 175-180 С). Пример В 7. К смеси 4-4-амино-6-[(2,6-дихлорфенил) метил]-2-пиримидинил]амино]бензонитрила(0,014 моля). Прикапывают раствор октаноил хлорида (1,5 экв.) в CH2Cl2 (0,5 мл). Смесь перемешивают при комнатной температуре 2 ч. Прикапывают дополнительный раствор октаноил хлорида (3,5 экв.) в СН 2 Сl2. Смесь перемешивают. Растворитель упаривают. Остаток обрабатывают насыщенным водным растворомNаНСО 3 и смесь экстрагируют CH2Cl2. Отделенный органический слой сушат, фильтруют и растворитель упаривают с получением сырого продукта. Остаток перекристаллизовывают из СНСl3 и гексана, получают 0,443 г (68,6%) N-[6[(2,6-дихлорфенил)метил]-2-[(4-цианофенил) амино]-4-пиримидинил]октанамида (соединение 17; т.пл. 135-137 С). Пример В 8.a) Смесь интермедиата 49 (0,082 моля) и 5,4N НСl в 2-пропаноле (0,086 моля) в воде (300 мл) перемешивают при 40-45 С более 30 мин. Добавляют 4-аминобензонитрил (0,242 моля) при 40-45 С. Реакционную смесь перемешивают и кипятят с обратным холодильником 4,5 ч, затем охлаждают до комнатной температуры. Смесь подщелачивают порционным добавлением NаНСО 3. Смесь экстрагируют этилацетатом. Органический слой отделяют, промывают рассолом, сушат, фильтруют и растворитель упаривают. Эту фракцию перемешивают в абсолютном этаноле (100 мл), отфильтровывают, промывают этанолом (50 мл), затем сушат, получают 23,1 г (86%) 4-4-[(2,4,6-триметилфенил) амино]-2-пиримидил]амино]бензонитрила (соединение 52).b) Смесь 4-[(4-хлор-2-пиримидинил)амино]бензонитрила (0,021 моля) и НСl в 2 пропаноле (0,0095 моля) в воде (30 мл) перемешивают один час при 45 С. Прибавляют 4 амино-3,5-диметилбензонитрил (0,025 моля) и реакционную смесь перемешивают и кипятят с обратным холодильником в течение ночи. Смесь охлаждают до комнатной температуры,затем нейтрализуют NаНСО 3. Эту смесь экстрагируют этилацетатом. Отделенный органический слой промывают рассолом, сушат, фильтруют и растворитель упаривают. Остаток перекристаллизовывают из СН 3 СN, отфильтровывают и сушат. Остаток в кипящем СН 2 Сl2 (20 мл),затем отфильтровывают и сушат. Остаток кристаллизуют из метилизобутилкетона, отфильтровывают и сушат, получают 0,3 г 4-2[(цианофенил)амино]-4-пиримидинил]амино]3,5-диметилбензонитрила (соединение 69). Пример В 9.(10 мл) и нагревают под аргоном до тех пор,пока не упарится весь диэтиловый эфир. Трубку запаивают и нагревают 2,5 дня при 170 С. Добавляют силикагель и упаривают растворитель. Остаток очищают флэш колоночной хроматографией на силикагеле (градиент элюента:CH2Cl2:CH3OH:NH4OH 100:0:0 к 99:0,9:0,1). Отбирают необходимые фракции и упаривают растворитель. Остаток перекристаллизовывают из ацетонитрила, отфильтровывают и сушат, получают 0,22 г (15,9%) 4-4-[(2,6-дибром-4-метилфенил)амино]-2-пиримидинил]амино]бензонитрила(соединение 61).b) 4-4-[(4-Хлор-5-метил)-2-пиримидинил] амино]бензонитрил (0,01541 моля), 4-амино-3,5 диметилбензонитрил (0,00219 моля), 1-метил-2 пирролидинон (4 мл), 1,4-диоксан (15 мл) и диизопропилэтиламин (0,0154 моля) загружают в колбу в потоке аргона и нагревают 16 ч при 160230 С. Прибавляют СН 2 Сl2 и 1N NaOH, смесь перемешивают 1 ч и фильтрат с получением коричневого твердого вещества . Фильтрат СН 2 Сl2 отделяют, упаривают и очищают флэш колоночной хроматографиейCH3OH/CH2Cl2). Объединенные желаемые фракции упаривают и остаток перемешивают в СН 2 Сl2. Твердый осадок отфильтровывают, объединяют с коричневым твердым веществоми перекристаллизовывают из ацетонитрила. Осадок фильтруют и сушат, получают 1,57 г (29%) 4-2-[(4-цианофенил)амино]-5-метил-4-пиримидинил]амино]-3,5-диметилбензонитрила (соединение 89). с) Трифторметансульфонат 2-[(4-цианофенил)амино]-4-пиримидинила (0,0022 моля) и 2,6-дихлор-4-(трифторметил)-бензамин (0,0044 моля) добавляют в 1,4-диоксан (2,5 мл) и нагревают в запаяной трубке под аргоном при 170 С 40 ч. Затем температуру реакционной смеси доводят до комнатной. Добавляют силикагель и упаривают растворитель. Остаток очищают флэш колоночной хроматографией на силикагеле (градиент элюента: СН 2 Сl2:СН 3 ОН:NН 4 ОН от 100:0:0 до 97:2,7:0,3). Отбирают необходимые фракции и упаривают растворитель. Остаток перекристаллизовывают из ацетонитрила, отфильтровывают и сушат, получают 0,086 г(30 мл) прибавляют 2,4,6 триметилфенол (0,006 моля). Смесь перемешивают 15 мин при комнатной температуре до образования чистого раствора. Добавляют 4-[(4 хлор-2-пиримидинил)амино]бензо нитрил (0,004 моля) и реакционную смесь нагревают при температуре кипения с обратным холодильником под аргоном в течение 15 ч. Температуру реакционной смеси доводят до комнатной, добавля 29 ют 0,5 мл воды, затем 4 г силикагеля и упаривают растворитель. Остаток очищают флэш колоночной хроматографией на силикагеле (градиент элюента: СН 2 Сl2:СН 3 ОН от 100:0 до 97:3). Отбирают чистые фракции и растворитель упаривают, получают 1,18 г (89,4%) 4-4-(2,4,6 триметилфенокси)-2-пиримидинил]амино]бензонитрила (соединение 58). Пример В 11. В кипящем этаноле (8 мл) перемешивают соединение (52) (0,0015 моля). Прибавляют 6 М НСl в 2-пропаноле (0,0015 моля) и дают выкристаллизоваться соли в течение ночи при комнатной температуре. Осадок отфильтровывают,промывают 2-пропанолом, сушат, получают 0,47 г (86%) гидрохлорида (1:1) 4-4-[(2,4,6 триметилфенил)амино]-2-пиримидинил]амино]бензонитрила (соединение 53). Пример В 12. Смесь соединения (52) (0,00303 моля) и очищают флэш колоночной хроматографией на силикагеле (градиент элюента:СН 2 Сl2:СН 3 ОН от 100:0 до 95:5). Отбирают необходимые фракции и растворитель упаривают, получают 0,586 г (56%) 4-4-[(2,4,6-триметилфенил)амино]-2 пиримидинил]амино]бензамида(соединение 100). Фильтраточищают ВЭЖХ с обращенной фазой (градиент элюента: (0,5% ацетат аммония в Н 2 О) / СН 3 СN 90/10)/СН 3 ОН/СН 3 СN (0 мин) 75/25/0, (44 мин) 0/50/50, (57 мин) 0/0/100,(61,1-70 мин 75/25/0). Собирают три желаемые фракции и упаривают их растворители, получают 0,18 г(соединение 107). В табл. 3, 4, 5 и 6 перечислены соединения формулы (I), которые были получены в соответствии с одним из выше приведенных примеров. С. Фармакологический пример. Пример С.1. Для in vitro оценки анти-ВИЧ агентов используют быстрое, чувствительное и автоматизированное испытание. ВИЧ-1 трансформированная линия Т 4-клеток, МЕ-4, для которой предварительно было показано (Коянаджи с сотр., Int. J.Cancer, 36, 445-451, 1985), что она высоко чувствительна и доступна для ВИЧинфекции, служила в качестве клеточной линии мишени. Ингибирование ВИЧ-индуцированного цитопатического эффекта используют в качестве конечной точки. Жизнеспособность как ВИЧтак и ложноинфицированных клеток оценивают спектрофотометрически посредством уменьшения in situ 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолий бромида (МТТ). Определяют 50% цитотоксическую концентрацию (CC50 в мкмолей) как концентрацию соединения, которая уменьшает поглощение ложноинфицированного контрольного образца на 50%. Процент защиты, достигаемой с помощью соединения в ВИЧ-инфицированных клетках, вычисляют по формуле:(ОDт)ВИЧ - (ОDс)ВИЧ, выраженный в %,(ОDc)ЛОЖ - (ОDс)ВИЧ,в которой (ОDт)ВИЧ - оптическая плотность, измеренная при данной концентрации испытуемого соединения в ВИЧ-инфицированных клетках;(ODс)ВИЧ - оптическая плотность, измеренная для контрольных нелеченных ВИЧинфицированных клеток; (ОDс)ЛОЖ - оптическая плотность, измеренная для контрольных нелеченных ложноинфицированных клеток; все значения оптической плотности определяют при 540 нм. Дозу, при которой достигается 50%-ная защита в соответствии с выше приведенной формулой, определяют как 50%-ную ингибирующую концентрацию (IC50 в мкМ). Отношение CC50 к IC50 определяют как индекс селективности (SI). Показано, что соединения формулы (I) эффективно ингибируют ВИЧ-1. Определенные значения IC50, CC50, и SI перечислены в ниже представленной табл. 7. 34 ляют 100 г микрокристаллической целлюлозы и 15 г гидрогенированного растительного масла. Все хорошо перемешивают и прессуют в таблетки с получением 10000 таблеток, каждая из которых содержит 10 мг активного ингредиента. Покрытие. К раствору 10 г метилцеллюлозы в 75 мл денатурированного этанола добавляют раствор 5 г этилцеллюлозы в 150 мл дихлорметана. Затем прибавляют 75 мл дихлорметана и 2,5 мл 1,2,3-пропантриола. Расплавляют 10 г полиэтиленгликоля и растворяют в 75 мл дихлорметана. Последний раствор добавляют к первому и затем туда прибавляют 2,5 г октадеканоата магния, 5 г поливинилпирролидона и 30 мл концентрированной суспензии красителя и все гомогенезируют. Содержимое таблеток покрывают таким образом полученной смесью в аппаратуре для покрытия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулыD. Примеры композиций. Следующие составы служат примером типичных фармацевтических композиций, подходящих для регулярного введения животным или человеку в соответствии с настоящим изобретением. Активный ингредиент (A.I.), используемый в этих примерах, относится к соединению формулы (I) или его фармацевтически приемлемой соли присоединения. Пример D.1: таблетки, покрытые оболочкой. Приготовление ядра таблетки. Смесь 100 г A.I., 570 г лактозы и 200 г крахмала хорошо перемешивают и затем увлажняют раствором 5 г додецилсульфата натрия и 10 г поливинилпирролидона в примерно 200 мл воды. Влажную порошковую смесь просеивают, сушат и просеивают снова. Затем прибав его N-оксида, фармацевтически приемлемой соли присоединения или стереохимически изомерной формы, где А является СН или N;Q является водородом или -NR1R2;R1 и R2, каждый независимо, выбран из водорода, гидрокси, C1-12aлкила, С 1-12 алкилокси,С 1-12 алкилкарбонила, С 1-12 алкилоксикарбонила,где каждая из указанных С 1-12 алкильных групп необязательно и каждая независимо может быть замещена одним или двумя заместителями, каждый из которых независимо выбран из гидрокси, C1-6 алкилокси, гидроксиС 1-6 алкилокси, циано, арила и Het; илиR3 является водородом или C1-6 алкилом; и каждый R4 независимо является гидрокси,галогеном, С 1-6 алкилом, C1-6 алкилокси, циано,аминокарбонилом, нитро, амино, тригалогенметилом, тригалогенметилокси или C1-6 алкилом,замещенным циано или аминокарбонилом;L - C1-10 алкил, замещенный фенилом, где указанный фенил может быть замещен одним,двумя, тремя, четырьмя или, где возможно, пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила,C1-6 алкилокси, циано, аминокарбонила, амино,тригалогенметила, тригалометилокси и C1-6 алкилкарбонила; илиR6 и R7, каждый независимо, является фенилом или фенилом, замещенным одним, двумя, 35 тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, гидрокси, C1-6 алкила, C1-6 алкилокси, C1-6 алкилкарбонила, циано, аминокарбонила, амино, тригалогенметилокси и тригалогенметила; иAlk является С 1-4 алкандиилом; арил является фенилом или фенилом, замещенным одним, двумя, тремя, четырьмя или пятью заместителями, каждый из которых независимо выбран из галогена, C1-6 алкила, C1-6 алкилокси, циано, нитро и трифторметила;Het - алифатический или ароматический гетероциклический радикал; где указанный алифатический гетероциклический радикал выбран из пирролидинила, пиперидинила, гомопиперидинила, пиперазинила,морфолинила, тетрагидрофуранила и тетрагидротиенила, где каждый указанный алифатический гетероциклический радикал необязательно может быть замещен оксогруппой; и указанный ароматический гетероциклический радикал выбран из пирролила, фуранила, тиенила, пиридила, пиримидинила, пиразинила и пиридазинила,где каждый указанный ароматический гетероциклический радикал необязательно может быть замещен гидрокси; для производства лекарственного средства для лечения от ВИЧ (вируса иммунодефицита человека) инфекции. 2. Применение соединения по п.1, где n равен, по крайней мере, 1 и, по крайней мере, одинR4 является циано. 3. Применение соединения по п.1 или 2,где соединение имеет формулу (I-1) или (I'-1) где R4' является галогеном, C1-6 алкилом, циано,аминокарбонилом, нитро, тригалогенметилом,тригалогенметилокси или C1-6 алкилом, замещенным циано или аминокарбонилом; его N-оксид, фармацевтически приемлемая соль присоединения или стереохимически изомерная форма, где L, Q, R3, R4, R5 и А являются такими,как определены для формулы (I), и R4' является галогеном, C1-6 алкилом, циано, аминокарбонилом, нитро, тригалогенметилом, тригалогенме 002973 36 тилокси или C1-6 алкилом, замещенным циано или аминокарбонилом;n' равен 0, 1, 2 или 3; при условии, что Q и L отличаются от анилино, 2,4,6-тринитроанилино, 3-метоксианилино, 4-метоксианилино, 3,4-диметоксианилино, 3-хлор-4-фторанилино, 4-цианоанилино,2-(C1-6 алкил)анилино, 4-(C1-6 алкил)анилино, 3 хлоранилино, 4-броманилино, 4-нитроанилино и 4-хлоранилино. 5. Соединение по п.4, где соединение имеет формулу 6. Соединение по п.5, где R4' является циано, аминокарбонилом или C1-6 алкилом, замещенным циано или аминокарбонилом. 7. Соединение по любому из пп.4-6, в котором L является 2,6-дихлорбензилом, или L является -X-R6, в котором X1 является -NR3, -Sили -О- и R6 - 2,4,6-трихлорфенил, 2,4,6 триметилфенил, 2,4-дибром-3,5-дихлорфенил,2,4-дибром-6-фторфенил, 2,4-дихлор-6-метилфенил,2,6-дибром-4-изопропилфенил,2,6 дибром-4-метилфенил,2,6-дибром-4-проп-1 илфенил, 2,6-дихлор-4-цианофенил, 2,6-дихлор 4-трифторметоксифенил, 2,6-дихлор-4-трифторметилфенил, 2,6-дихлорфенил, 2,6-диметил-4(1,1-диметилэтил)фенил, 2,6-диметилфенил, 2 бром-4-фтор-6-метилфенил,2-бром-6-хлор-4 фторфенил, 4-бром-2,6-диметилфенил, 4-хлор 2,6-диметилфенил, 4-циано-2,6-диметилфенил; или L является X2-Alk-R7, где X2-Alk является-NH-CH2- и R7 - фенил. 8. Соединение по любому из пп.4-7, где Q является водородом, L является -X1-R6, где X1 является -NH- и R6 является 2,4,6-триметилфенилом или 4-циано-2,6-диметилфенилом,NR3 (необязательно замещенный фенил или пиридил) фрагмент представляет п-цианоанилино и находится во 2-ом положении пиримидинового кольца. 9. Соединение по любому из п.4 или 5, гдеR4' - галоген, циано, аминокарбонил или цианоС 1-6 алкил; n' является нулем, А является СН,R3 - водород; R5 - водород или метил; Q - водород или NHR1; L представляет C1-10 алкил, замещенный фенилом,или 2,4,6-трихлорфенилом, или 2,4,6-триметилфенилом, или 2,4 дибром-3,5-дихлорфенилом, или 2,4-дибром-6 фторфенилом, или 2,4-дихлор-6-метилфенилом или 2,6-дибром-4-изопропилфенилом, или 2,6 дибром-4-метилфенилом, или 2,6-дибром-4 проп-1-илфенилом, или 2,6-дихлор-4-цианофенилом,или 2,6-дихлор-4-трифторметоксифенилом, или 2,6-дихлор-4-трифторметилфенилом, или 2,6-дихлорфенилом, или 2,6 диметил-4-(1,1-диметилэтил)фенилом, или 2,6 диметилфенилом,2-бром-4-фтор-6 37 метилфенилом или 2-бром-6-хлор-4 фторфенилом, или 4-бром-2,6-диметилфенилом,или 4-хлор-2,6-диметилфенилом, или 4-циано 2,6-диметилфенилом; или L представляет -X1-R6 или -X2-Alk-R7, где R6 и R7, каждый независимо,представляют фенил, 2,4,6-трихлорфенил, 2,4,6 триметилфенил, 2,4-дибром-3,5-дихлорфенил,2,4-дибром-6-фторфенил,2,4-дихлор-6 метилфенил,2,6-дибром-4-изопропилфенил,2,6-дибром-4-метилфенил, 2,6-дибром-4-проп-1 илфенил, 2,6-дихлор-4-цианофенил, 2,6-дихлор 4-трифторметоксифенил,2,6-дихлор-4 трифторметилфенил, 2,6-дихлорфенил, 2,6 диметил-4-(1,1-диметилэтил) фенил,2,6 диметилфенил, 2-бром-4-фтор-6-метилфенил, 2 бром-6-хлор-4-фторфенил,4-бром-2,6 диметилфенил,4-хлор-2,6-диметилфенил или 4-циано-2,6-диметилфенил. 10. Соединение по п.4, представляющее собой 4-4-амино-6-[(2,6-дихлорфенил)метил]-2 пиримидинил]амино]бензонитрил; 6-[(2,6-дихлорфенил)метил]-N2-(4-фторфенил)-2,4-пиримидиндиамин; 4-4-[(2,4-дихлорфенил)метил]-6-[(4-гидроксибутил)амино]-2-пиримидинил]амино]бензонитрил; 4-4-[(2,6-дихлорфенил)метил]-6-[(3-гидроксипропил)амино]-2-пиримидинил]амино] бензонитрил;N2-(4-хлорфенил)-N4-(2,4,6-триметилфенил)-2,4-пиримидиндиамин; 4-4-2,6-дибром-4-(1-метилэтил)фенил] амино]-5-метил-2-пиримидинил]амино]бензонитрил; 4-2-[(4-цианофенил)амино]-5-метил-4 пиримидинил]амино]-3,5-диметилбензонитрил; 4-4-[(фенилметил)амино]-2-пиримидинил]амино]бензонитрил; его N-оксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму. 11. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.4-10. 12. Способ получения фармацевтической композиции по п.11, отличающийся тем, что терапевтически эффективное количество соединения по любому из пп.4-10 тщательно смешивают с фармацевтически приемлемым носителем. 13. Способ получения соединения по п.4,отличающийся тем, что включает взаимодействие интермедиата формулы (II-А), где W1 подходящая уходящая группа, с аминопроизводным формулы (III) необязательно в растворителе в реакционноинертной атмосфере и необязательно в присутствии кислоты где Q, R3, R4, R4', R5, А, n' и L являются такими,как определены в п.4; с получением соединений формулы (I') или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды. 14. Способ получения соединения по п.4,отличающийся тем, что включает взаимодействие интермедиата формулы (II-B), где W1002973 где A, L, R1, R2, R3, R4, R4', R5 и n' являются такими, как определены в п.4; с получением соединений формулы (I') или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или, наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды. 15. Способ получения соединения по п.4,отличающийся тем, что включает взаимодействие интермедиата H-X-R6 с интермедиатом формулы (II-C) в подходящем растворителе,необязательно в присутствии подходящей кислоты или основания, где A, Q, X1, R3, R4, R4',R5, R6 и n' являются такими, как определены в п.4; с получением соединений формулы (I'), гдеL является -X-R6, причем указанные соединения представлены формулой (I'-с), или, при желании, превращают соединения формулы (I') друг в друга последующими известными из уровня техники превращениями, и затем, при желании, превращают соединения формулы (I') в терапевтически активную нетоксичную соль присоединения кислоты обработкой кислотой, или в терапевтически активную нетоксичную соль присоединения основания обработкой основанием, или наоборот, превращают соль присоединения кислоты в свободное основание обработкой щелочью, или превращают соль присоединения основания в свободную кислоту обработкой кислотой; и, при желании, получают его стереохимически изомерные формы или N-оксиды. 16. Применение соединения по п.4 в качестве лекарственного средства. 17. Комбинированный препарат для одновременного, раздельного или последовательного(а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение. 18. Комбинированный препарат для одновременного, раздельного или последовательного применения в анти-ВИЧ-лечении, содержащий(а) соединение формулы (I') по п.4 и (b) другое антиретровирусное соединение. 19. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение формулы (I) по п.1 и (b) другое антиретровирусное соединение. 20. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активных ингредиентов (а) соединение формулы (I') по п.4 и (b) другое антиретровирусное соединение. 21. Соединение формулы (II'-В) где R3, R4, R4', n', А и L являются такими, как определены в п.4 и W1 является галогеном. 22. Применение соединений по любому из пп.1-3 для производства лекарственного средст 42 ва для лечения от ВИЧ-инфекции, устойчивой к множественным лекарственным средствам. 23. Применение соединений по любому из пп.1-3 для производства лекарственного средства для лечения от ВИЧ-инфекции, устойчивой по отношению к ненуклеозидным ингибиторам обратной транскриптазы, отличным от определенных в пп.1-3. 24. Применение соединений по любому из пп.1-3 для производства лекарственного средства для лечения от ВИЧ-1-инфекции, устойчивой по отношению к ненуклеозидным ингибиторам обратной транскриптазы, отличным от определенных в пп.1-3. 25. Соединение по п.10, которое представляет собой 4-2-[(цианофенил)амино]-4-пиримидинил]амино]-3,5-диметилбензонитрил, егоN-оксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму. 26. Соединение по п.10, которое представляет собой 4-4-[(2,4,6-триметилфенил)амино]2-пиримидинил]амино]бензонитрил, его Nоксид, фармацевтически приемлемую соль присоединения или стереохимически изомерную форму.
МПК / Метки
МПК: C07D 239/50, A61P 31/18, A61K 31/505
Метки: репликации, иммунодефицита, вируса, пиримидина, ингибиторов, человека, качестве, производные
Код ссылки
<a href="https://eas.patents.su/22-2973-proizvodnye-pirimidina-v-kachestve-ingibitorov-replikacii-virusa-immunodeficita-cheloveka.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина в качестве ингибиторов репликации вируса иммунодефицита человека</a>












