Производные пиримидина, применимые в качестве ингибиторов pi3 киназы, и способы их применения
Номер патента: 18083
Опубликовано: 30.05.2013
Авторы: Визманн Марион, Кнапп Марк, Пик Тереса, Фантл Уэнди, Хендриксон Томас, Ни Чжицзи, Волива Чарлз, Аталлах Гордана, Нг Саймон, Синь Сяхуа, Фрейзьер Келли, Уагман Аллан, Чжан Яньчэнь, Смит Аарон, Берджер Маттью, Пфистер Кейт, Меритт Ханне, Верхаген Джоелл, Иванович Эдуин, Луи Алисия, Бартулис Сара, Пекки Сабина, Барсанти Пол, Пун Даниэль
Формула / Реферат
1. Соединение формулы I
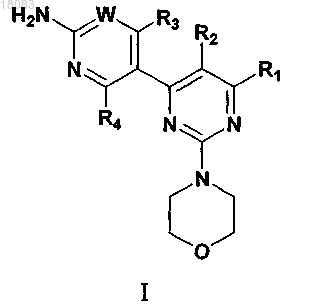
или его стереоизомер, таутомер или фармацевтически приемлемая соль, в которой
W выбран из СН и N;
R1 выбран из группы, включающей:
(1) замещенный и незамещенный гетероциклил, представляющий собой 3- или 4-членное кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;
(2) -NR1aH, где R1a представляет собой замещенный и незамещенный гетероциклил, представляющий собой 3- или 4-членное кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;
R2 представляет собой Н;
R3 выбран из Н и CF3;
R4 представляет собой Н;
где "замещенный" означает замещение водорода одним или несколькими одновалентными или двухвалентными радикалами, выбранными из гидроксигруппы, нитрогруппы, аминогруппы, иминогруппы, цианогруппы, галогена, тиогруппы, сульфонила, тиоамидной группы, амидиновой группы, имидиновой группы, оксогруппы, оксамидиновой группы, метоксамидиновой группы, гуанидиновой группы, сульфонамидной группы, карбоксигруппы, формила, C1-6алкила, замещенного C1-6алкила, галоген-C1-6алкила, C1-6алкиламиногруппы, галоген-C1-6алкиламиногруппы, C1-6алкоксигруппы, галоген-C1-6алкоксигруппы, C1-6алкокси-C1-6алкила, C1-6алкилкарбонила, аминокарбонила, фенилкарбонила, фенил-C1-6алкилкарбонила, C1-6алкилтиогруппы, C1-6аминоалкила, C1-6цианоалкила, фенила, бензила, пиридила, пиразолила, пиррола, тиофена, имидазолила, где заместители замещенного алкила выбраны из -CH3, -С2Н5, -СН2ОН,
-ОН, -ОСН3, -ОС2Н5, -OCF3, -ОС(=О)СН3, -OC(=O)NH2, -OC(=O)N(CH3)2, -CN, -NO2, -C(=О)СН3, -СО2Н,
-СО2СН3, -CONH2, -NH2, -N(CH3)2, -NHSO2CH3, -NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3,
-SO2NH2, галогена.
2. Соединение по п.1 структуры
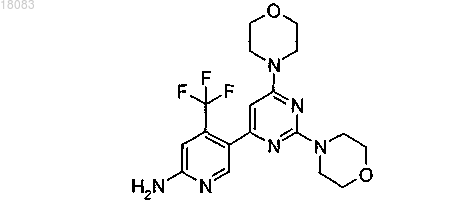
или его фармацевтически приемлемая соль.
3. Соединение по п.1 структуры
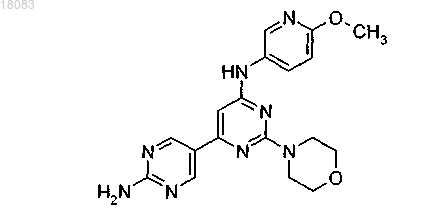
или его фармацевтически приемлемая соль.
4. Соединение по п.1 структуры
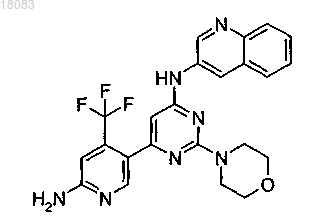
или его фармацевтически приемлемая соль.
5. Соединение по п.1 структуры
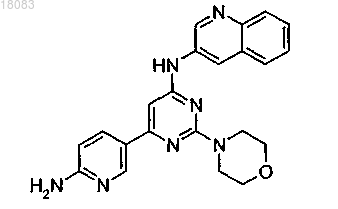
или его фармацевтически приемлемая соль.
6. Соединение по п.1 структуры
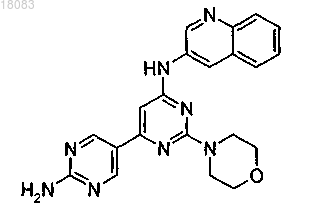
или его фармацевтически приемлемая соль.
7. Способ ингибирования фосфорилирования Akt у человека или животного, включающий введение человеку или животному соединения по любому из пп.1-6 в эффективном количестве.
8. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение по любому из пп.1-6 или его фармацевтически приемлемую соль в эффективном количестве.
9. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и соединение по любому из пп.1-6 в количестве, эффективном для ингибирования активности PI3-K при введении человеку или животному.
10. Фармацевтическая композиция по п.9, эффективная для ингибирования активности PI3-K-α при введении человеку или животному.
11. Фармацевтическая композиция по п.9, дополнительно включающая по меньшей мере одно дополнительное средство для лечения рака.
12. Фармацевтическая композиция по п.11, в которой по меньшей мере одним дополнительным средством для лечения рака является ваталаниб, иматиниб, гефитиниб, эрлотиниб, пертузумаб, трастузумаб, капецитабин, иринотекан, паклитаксел, цисплатин, карбоплатин, фульвестрант, дексаметазон, бевацизумаб и доцетаксел.
13. Способ лечения патологического состояния путем ингибирования активности PI3-K, включающий введение человеку или животному, нуждающемуся в таком лечении, соединения по любому из пп.1-6 в эффективном количестве.
14. Способ по п.13, в котором соединение обладает значением IC50, характеризующим ингибирование PI3-K, равным менее 1 мкМ.
15. Способ по п.13, в котором патологическим состоянием является рак.
16. Способ ингибирования активности PI3-K у человека или животного, включающий введение человеку или животному фармацевтической композиции, включающей соединение по любому из пп.1-6 в количестве, эффективном для ингибирования активности PI3-K у человека или животного.
17. Способ лечения ракового заболевания у человека или животного, включающий введение человеку или животному фармацевтической композиции, включающей соединение по любому из пп.1-6 в количестве, эффективном для ингибирования активности PI3-K у человека или животного.
18. Способ по п.17, дополнительно включающий введение человеку или животному по меньшей мере одного дополнительного средства для лечения рака.
19. Способ по п.18, в котором по меньшей мере одним дополнительным средством для лечения рака является ваталаниб, иматиниб, гефитиниб, эрлотиниб, пертузумаб, трастузумаб, капецитабин, иринотекан, паклитаксел, цисплатин, карбоплатин, фульвестрант, дексаметазон, бевацизумаб и доцетаксел.
20. Способ по п.17, в котором раком является рак молочной железы, рак мочевого пузыря, колоректальный рак, глиома, глиобластома, рак легких, гепатоцеллюлярный рак, рак желудка, меланома, рак щитовидной железы, рак эндометрия, рак почек, рак шейки матки, рак поджелудочной железы, рак пищевода, рак предстательной железы, рак головного мозга или рак яичников.
21. Способ ингибирования фосфорилирования Akt, включающий взаимодействие соединения по любому из пп.1-6 с клеткой.
22. Способ по п.21, в котором соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 1 мкМ.
23. Применение соединения по любому из пп.1-6 для лечения рака.
24. Применение соединения по любому из пп.1-6 для приготовления лекарственного средства, предназначенного для лечения рака.
25. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли в качестве фармацевтического средства.
Текст
Изобретение относится к ингибиторам фосфатидилинозит (PI) 3-киназы формулы I и к их фармацевтически приемлемым солям; к композициям, содержащим эти ингибиторы вместе с фармацевтически приемлемым носителем, по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством; и к применению этих ингибиторов, по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством, для профилактики или лечения пролиферативных заболеваний, характеризующихся аномальной активностью факторов роста, протеинсерин/треонинкиназ и фосфолипидкиназ. Область техники, к которой относится изобретение Настоящее изобретение относится к новым ингибиторам фосфатидилинозит (PI) 3-киназы и их фармацевтически приемлемым солям; к композициям этих соединений с фармацевтически приемлемым носителем, по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством; к применению этих соединений, по отдельности или в комбинации по меньшей мере с одним дополнительным терапевтическим средством, для профилактики или лечения целого ряда заболеваний, предпочтительно характеризующихся аномальной активностью факторов роста, рецепторов тирозинкиназ, протеинсерин/треонинкиназ, связанных с белком G рецепторов, фосфолипидкиназ и фосфатаз. Уровень техники Фосфатидилинозит-3-киназы (PI3K) представляют собой семейство липидных и сериновых/треониновых киназ, которые катализируют перенос фосфата в D-3'-положение инозитсодержащих липидов с образованием фосфоинозит-3-фосфата (PIP), фосфоинозит-3,4-дифосфата (PIP2) и фосфоинозит-3,4,5-трифосфата (PIP3) которые, в свою очередь, действуют в качестве вторичных мессенджеров в каскадах передачи сигналов путем вовлечения белков, которые содержат гомологичные плекстринуFYVE, Phox и другие связывающие фосфолипиды домены, в различные передающие сигналы комплексы, которые часто присутствуют на плазматической мембране Vanhaesebroeck et al., Annu. Rev. Biochem 70:535 (2001); Katso et al., Annu. Rev. Cell Dev. Biol. 17:615 (2001. Среди PI3K, принадлежащих двум классам, которые являются подклассами класса 1, PI3K класса 1 А представляют собой гетеродимеры,состоящие из каталитической субъединицы p110 (изоформы , , ), конститутивно ассоциированной с регуляторной субъединицей, которая может представлять собой p85, p55, p50, p85 или p55. Подкласс, представляющий собой класс 1 В, состоит из одного представителя семейства, а именно гетеродимера, который включает каталитическую субъединицу p110, ассоциированную с двумя регуляторными субъединицами р 101 или р 84 (Fruman et al., Annu Rev. Biochem. 67:481 (1998); Suire et al., Curr. Biol. 15:566 (2005. Модулярные домены субъединиц p85/55/50 включают домены, гомологичные Src (SH2),которые связывают остатки фосфотирозина в контексте специфической последовательности на активированном рецепторе и цитоплазматических тирозинкиназах, что приводит к активации и локализацииPI3K класса 1 A. PI3K класса 1 В активируются непосредственно сшитыми с протеином G рецепторами, с которыми связывается широкое разнообразие пептидных и непептидных лигандов (Stephens et al., Cell 89:105 (1997; Katso et al., Annu. Rev. Cell Dev. Biol. 17:615-675 (2001. В результате образовавшиеся фосфолипидные продукты PI3K класса 1 связывают рецепторы, расположенные выше в пути передачи сигнала с расположенными ниже в пути передачи сигнала клеточными элементами, оказывающими воздействие на пролиферацию, выживание, хемотаксис, направленную миграцию клеток, подвижность, метаболизм, воспалительные и аллергические ответы, транскрипцию и трансляцию (Cantley et al., Cell 64:281 (1991); Escobedo and Williams, Nature 335:85 (1988); Fantl et al., Cell 69:413 (1992. Во многих случаях PIP2 и PIP3 приводят к рекрутменту Akt, человеческого продукта, гомологичного вирусному онкогену v-Akt, на плазматической мембране, где он действует в качестве узловой точки для многих внутриклеточных путей передачи сигналов, важных для роста и выживания (Fantl et al., Cell 69:413-423(1992); Bader et al., Nat Rev. Cancer 5:921 (2005); Vivanco and Sawyer, Nat. Rev. Cancer 2:489(2002. Аномальная регуляция PI3K, которая часто повышает выживание благодаря активации Akt, является одним из наиболее превалирующих явлений при раке у человека и, как установлено, происходит на нескольких уровнях. У гена-супрессора опухолей PTEN, который дефосфорилирует фосфоинозитиды в 3'-положении инозитного кольца и поэтому обладает способностью антагонизировать активность PI3K,во многих типах опухолей отсутствует функциональная активность. В других типах опухолей происходит амплификация генов, кодирующих изоформу p110, PIK3CA и Akt, и повышенный уровень экспрессии белковых продуктов этих генов был продемонстрирован при некоторых видах рака человека. Кроме того, для некоторых видов рака человека описаны мутации и транслокации субъединицы p85, которая служит для повышающей регуляции комплекса р 85-p110. И, наконец, установлено, что соматические миссенс-мутации PIK3CA, которые активируют пути дальнейшей передачи сигнала, достаточно часто встречаются при многих видах рака человека (Kang et al., Proc. Natl. Acad. Sci. USA 102:802 (2005);Samuels et al., Science 304:554 (2004); Samuels et al., Cancer Cell 7:561-573(2005. Эти данные свидетельствуют о том, что нарушение регуляции фосфоинозит-3-киназы и компонентов, находящихся выше и ниже в этом пути передачи сигнала, является одним из наиболее распространенных видов нарушения регуляции, ассоциированных с раком и пролиферативными заболеваниями человека (Parsons et al., Nature 436:792(2005); Hennessey et al., Nature Rev. Drug Dis. 4:988-1004 (2005. Краткое изложение сущности изобретения Настоящее изобретение относится к новым ингибиторам фосфатидилинозит 3-киназы (PI3K), к фармацевтическим композициям, которые включают эти соединения, к способам ингибирования фосфатидилинозит 3-киназы (PI3K) и к способам лечения пролиферативных заболеваний. В одном варианте осуществления настоящее изобретение относится к новым ингибиторам фосфатидилинозит 3-киназы (PI3K), которые являются соединениями на основе пиримидина и к их фармацевтически приемлемым солям. Пиримидины и их фармацевтически приемлемые соли являются ингибито-1 018083 рами PI3K и применимы для лечения клеточных пролиферативных заболеваний. В одном варианте осуществления настоящее изобретение относится к соединению формулы I или его стереоизомеру, таутомеру или фармацевтически приемлемой соли, в которойW выбран из СН и N;(1) замещенный и незамещенный гетероциклил, представляющий собой 3-или 4-членное кольцо,содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;(2) -NR1aH, где R1a представляет собой замещенный и незамещенный гетероциклил, представляющий собой 3- или 4-членное кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота,кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;R4 представляет собой Н; где "замещенный" означает замещение водорода одним или несколькими одновалентными или двухвалентными радикалами, выбранными из гидроксигруппы, нитрогруппы, аминогруппы, иминогруппы, цианогруппы, галогена, тиогруппы, сульфонила, тиоамидной группы, амидиновой группы, имидиновой группы, оксогруппы, оксамидиновой группы, метоксамидиновой группы, имидиновой группы, гуанидиновой группы, сульфонамидной группы, карбоксигруппы, формила, C1-6 алкила, замещенногоC1-6 алкила, галоген-C1-6 алкила, C1-6 алкиламиногруппы, галоген-C1-6 алкиламиногруппы, C1-6 алкоксигруппы, галоген-C1-6 алкоксигруппы, C1-6 алкокси-C1-6 алкила, C1-6 алкилкарбонила, аминокарбонила, фенилкарбонила, фенил-C1-6 алкилкарбонила, C1-6 алкилтиогруппы, C1-6 аминоалкила, C1-6 цианоалкила, фенила, бензила, пиридила, пиразолила, пиррола, тиофена, имидазолила, где заместители замещенного алкила выбраны из -CH3, -С 2 Н 5, -СН 2 ОН, -ОН, -ОСН 3, -ОС 2 Н 5, -OCF3, -ОС(=О)СН 3, -OC(=O)NH2,-OC(=O)N(CH3)2, -CN, -NO2, -С(=О)СН 3, -СО 2 Н, -СО 2 СН 3, -CONH2, -NH2,-N(CH3)2, -NHSO2CH3,-NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3, -SO2NH2, галогена. В более предпочтительном варианте осуществления W обозначает СН. В другом варианте осуществления W обозначает N. В другом варианте осуществления R1 обозначает замещенный или незамещенный морфолинил; еще более предпочтительно, если R1 обозначает незамещенный присоединенный по атому N морфолинил. В другом варианте осуществления R1 обозначает замещенный или незамещенный тетрагидропиран. В другом варианте осуществления R1 обозначает замещенный или незамещенный тетрагидрофуран. В другом варианте осуществления R3 обозначает трифторметил. Другой вариант осуществления относится к способу ингибирования фосфорилирования Akt у человека или животного, включающему введение человеку или животному эффективного количества соединения, соответствующего любому из вариантов осуществления, предлагаемых в настоящем изобретении. Другой вариант осуществления относится к композиции, включающей фармацевтически приемлемый носитель и такое количество соединения, соответствующего любому из вариантов осуществления,предлагаемых в настоящем изобретении, которое при введении эффективно для ингибирования активности PI3-K у человека или животного. В более предпочтительном варианте осуществления настоящего изобретения композиция при введении эффективна для ингибирования активности PI3-K-альфа у человека или животного. Другой вариант осуществления относится к композиции, включающей фармацевтически приемлемый носитель, такое количество соединения, соответствующего любому из вариантов осуществления,предлагаемых в настоящем изобретении, которое при введении эффективно для ингибирования активности PI3-K у человека или животного, и по меньшей мере одно дополнительное средство для лечения рака. В более предпочтительном варианте осуществления настоящего изобретения по меньшей мере одним дополнительным средством для лечения рака является ваталаниб (РТК-787), иматиниб или гефитиниб. Альтернативно, по меньшей мере одно дополнительное средство для лечения рака может быть выбрано из группы, включающей ингибиторы киназы, антиэстрогены, антиандрогены, другие ингибиторы, химиотерапевтические противораковые лекарственные средства, алкилирующие средства, хелатные средства, модификаторы биологического ответа, противораковые вакцины и средства антисмысловой терапии (группы А-J), перечисленные ниже. Кроме того, по меньшей мере одно дополнительное средство для лечения рака выбрано из группы, включающей лучевую терапию, аналоги нуклеозидов и антимитотические средства. Другой вариант осуществления относится к способу лечения патологического состояния путем модуляции активности PI3-K, включающему введение человеку или животному, нуждающемуся в таком лечении, эффективного количества соединения, соответствующего любому из вариантов осуществления,предлагаемых в настоящем изобретении. В более предпочтительном варианте осуществления соединение обладает значением IC50, характеризующим ингибирование PI3K, равным менее 1 мкМ. В другом более предпочтительном варианте осуществления патологическим состоянием является рак. Другой вариант осуществления относится к способу ингибирования активности PI3-K у человека или животного, включающему введение человеку или животному композиции, включающей такое количество соединения, соответствующего любому из вариантов осуществления, предлагаемых в настоящем изобретении, которое эффективно для ингибирования активности PI3-K у человека или животного. Другой вариант осуществления относится к способу лечения ракового заболевания у человека или животного, включающему введение человеку или животному композиции, включающей такое количество соединения, соответствующего любому из вариантов осуществления, предлагаемых в настоящем изобретении, которое эффективно для ингибирования активности PI3-K у человека или животного. Более предпочтительный вариант осуществления дополнительно включает введение человеку или животному по меньшей мере одного дополнительного средства для лечения рака. В другом варианте осуществления по меньшей мере одним дополнительным средством для лечения рака является ваталаниб, иматиниб или гефитиниб. Альтернативно, по меньшей мере одно дополнительное средство для лечения рака может быть выбрано из группы, включающей ингибиторы киназы, антиэстрогены, антиандрогены, другие ингибиторы, химиотерапевтические противораковые лекарственные средства, алкилирующие средства,хелатные средства, модификаторы биологического ответа, противораковые вакцины и средства антисмысловой терапии (группы A-J), перечисленные ниже. В другом варианте осуществления любого из указанных выше вариантов раком является рак молочной железы, рак мочевого пузыря, колоректальный рак, глиома, глиобластома, рак легких, гепатоцеллюлярный рак, рак желудка, меланома, рак щитовидной железы, рак эндометрия, рак почек, рак шейки матки, рак поджелудочной железы, рак пищевода, рак предстательной железы, рак головного мозга или рак яичников. Другой вариант осуществления относится к способу ингибирования фосфорилирования Akt, включающему взаимодействие соединения, соответствующего любому из вариантов осуществления, предлагаемых в настоящем изобретении, с клеткой. В более предпочтительном варианте осуществления соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 1 мкМ. Предпочтительно соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 0,5 мкМ. Предпочтительно соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 0,1 мкМ. Другой вариант осуществления относится к применению соединения, соответствующему любому из вариантов осуществления, предлагаемых в настоящем изобретении, для лечения рака. Другой вариант осуществления относится к применению соединения, соответствующего любому из вариантов осуществления, предлагаемых в настоящем изобретении, для приготовления лекарственного средства, предназначенного для лечения рака. Настоящее изобретение также относится к композициям, наборам, способам применения и способам получения, описанным в подробном описании настоящего изобретения. Краткое описание чертежей Указанные выше варианты осуществления и многие из дополнительных преимуществ настоящего изобретения станут понятнее, когда само изобретение станет понятнее после рассмотрения приведенного ниже подробного описания совместно с прилагаемыми чертежами, на которых представлено следующее: на фиг. 1 приведена зависимость, иллюстрирующая подавление роста опухоли типичным соединением, предлагаемым в настоящем изобретении, при использовании двух доз и проведено сопоставление с растворителем в качестве контроля; на фиг. 2 приведена зависимость, иллюстрирующая подавление роста опухоли типичным соединением, предлагаемым в настоящем изобретении, при использовании трех доз и проведено сопоставление с растворителем в качестве контроля; на фиг. 3 приведена зависимость, иллюстрирующая подавление роста опухоли типичным соединением, предлагаемым в настоящем изобретении, при использовании двух доз и проведено сопоставление с растворителем в качестве контроля; на фиг. 4 приведена зависимость, иллюстрирующая подавление роста опухоли типичным соединением, предлагаемым в настоящем изобретении, при использовании двух доз и проведено сопоставление с растворителем в качестве контроля; на фиг. 5 приведена зависимость, иллюстрирующая подавление роста опухоли типичным соединением, предлагаемым в настоящем изобретении, и проведено сопоставление с растворителем в качестве контроля. Подробное описание предпочтительных вариантов осуществления Фосфотидилинозит-3-киназа (PI3K) опосредует сигнал от различных факторов роста, регулируя пролиферацию и выживание клеток. Установлено, что сериновая/треониновая (Ser/Thr, или S/T) протеинкиназа, обозначенная, как Akt, является расположенной ниже в пути передачи сигнала мишенью PI3 киназы. Рекрутмент этой протеинкиназы на клеточной мембране происходит в результате взаимодействия ее гомологичного плекстрину домена с PI3K-продуктами, такими как фосфатидилинозит-3,4,5 трифосфат (PIP3) и фосфатидилинозит-3,4-бифосфат (PIP2), при этом она активируется путем фосфорилирования ее каталитического домена с помощью зависящей от 3-фосфоинозитида киназы-1 (PDK-1).Akt дополнительно активируется в результате фосфорилирования серина в ее С-концевом гидрофобном мотиве, вероятно, другой киназой (PDK-2). Активация Akt приводит к оказанию действия ниже в пути передачи сигнала, приводящего к регулировке дополнительных киназ, многие из которых участвуют в клеточных процессах, контролирующих выживание, пролиферацию, метаболизм и рост, а также трансляцию. PI3K может регулировать также клеточные процессы, которые воздействуют на трансформацию,клеточную пролиферацию, перегруппировку цитосклета и выживание, благодаря параллельному пути, в котором не участвует Akt (Hennessy et al., Nat. Rev. Drug Disc. 4:988-1004 (2005. Два из этих путей представляют собой пути активации низкомолекулярных ГТФ-связывающих (ГТФ - гуанозинтрифосфат) белков Cdc42 и Rac1 и активацию сывороточной и индуцируемой глюкокортикоидом киназы (SGK).Cdc42 и Rac1, которые регулируют движение цитоскелета и клеточную подвижность и могут функционировать в качестве онкогенов при их сверхэкспресии, также связаны с путем RAS. Таким образом, активность PI3K приводит к образованию 3'-фосфатидилинозитсодержащих липидов, которые являются узловой точкой, стимулирующей разнообразие расположенных ниже путей передачи сигналов. То, что эти пути, в частности, влияют на такие характеристики клеток, как пролиферация, выживание, подвижность и морфология, нарушение которых часто происходит при раке, пролиферативных заболеваниях, тромбоцитарных заболеваниях и воспалении, показывает, что соединения, ингибирующиеPI3K (и их изоформы), применимы в виде отдельного средства или в комбинации для лечения этих заболеваний. Для рака в литературе имеется много публикаций, посвященных нарушениям регуляции путиPI3K/Akt, в том числе о сверхэкспрессировании гена PIK3CA, активирующих мутациях гена PIK3CA,сверхэкспрессировании Akt, мутациях PDK-1 и делециям/инактивации PTEN (Parsons et al., Nature 436:792 (2005); Hennessy et al., Nat. Rev. Drug Disc. 4:988 (2005); Stephens et al., Curr. Opin. Pharmacol. 5:1(2005); Bonneau and Longy, Human Mutation 16:109 (2000) и Ali et al., J. Natl. Can. Inst. 91:1922 (1999. Последние данные показывают, что PIK3CA часто (30%) мутирует в различных солидных опухолях у людей (Samuels and Ericson, Curr. Opin. Oncology 18:77 (2005 и наиболее частые из этих мутаций стимулируют рост клеток и инвазию (Samuels et al., Cancer Cell 7:561 (2005) и подвергаются трансформации(2005. Таким образом, ингибиторы PI3K, в особенности изоформа p110, кодируемая PIK3CA, и ее мутантные формы должны быть применимы для лечения раковых заболеваний, связанных с этими мутациями и нарушениями регуляции. Настоящее изобретение относится к новым соединениям, которые действуют в качестве ингибиторов серинтреонинкиназ, липидкиназ и более предпочтительно в качестве ингибиторов функции фосфатидилинозит 3-киназы (PI3K). Соединения, предлагаемые в настоящем изобретении, можно включить в фармацевтические композиции, которые применимы для лечения пациентов, нуждающихся в ингибитореPI3K, в особенности в предпочтительных вариантах осуществления изобретение относится к композициям и способам уменьшения пролиферации клеток и усиления гибели клеток при лечении рака. Один вариант осуществления настоящего изобретения относится к новым ингибиторам фосфатидилинозит 3-киназы (PI3K) и к их фармацевтически приемлемым солям. Ингибиторами PI3K являются соединения на основе пиримидина. Пиримидины и их фармацевтически приемлемые соли являются ингибиторами PI3K и применимы для лечения клеточных пролиферативных заболеваний. В одном варианте осуществления настоящего изобретения предлагаются ингибиторы фосфатидилинозит 3-киназы (PI3K) формулы (I) или их стереоизомеры, таутомеры или фармацевтически приемлемые соли, в которойW выбран из СН и N;(1) замещенный и незамещенный гетероциклил, представляющий собой 3-или 4-членное кольцо,содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота, кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;(2) -NR1aH, где R1a представляет собой замещенный и незамещенный гетероциклил, представляющий собой 3- или 4-членное кольцо, содержащее гетероатом, выбранный из азота, кислорода и серы, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из азота,кислорода или серы, где любое из указанных гетероциклических колец может быть сконденсировано с бензольным кольцом;R4 представляет собой Н; где "замещенный" означает замещение водорода одним или несколькими одновалентными или двухвалентными радикалами, выбранными из гидроксигруппы, нитрогруппы, аминогруппы, иминогруппы, цианогруппы, галогена, тиогруппы, сульфонила, тиоамидной группы, амидиновой группы, имидиновой группы, оксогруппы, оксамидиновой группы, метоксамидиновой группы, имидиновой группы, гуанидиновой группы, сульфонамидной группы, карбоксигруппы, формила, C1-6 алкила, замещенногоC1-6 алкила, галоген-C1-6 алкила, C1-6 алкиламиногруппы, галоген-C1-6 алкиламиногруппы, C1-6 алкоксигруппы, галоген-C1-6 алкоксигруппы, C1-6 алкокси-C1-6 алкила, C1-6 алкилкарбонила, аминокарбонила, фенилкарбонила, фенил-C1-6 алкилкарбонила, C1-6 алкилтиогруппы, C1-6 аминоалкила, C1-6 цианоалкила, фенила, бензила, пиридила, пиразолила, пиррола, тиофена, имидазолила, где заместители замещенного алкила выбраны из -CH3, -С 2 Н 5, -СН 2 ОН, -ОН, -ОСН 3, -ОС 2 Н 5, -OCF3, -OC(=O)CH3, -OC(=O)NH2,-OC(=O)N(CH3)2, -CN, -NO2, -C(=O)CH3, -CO2H, -CO2CH3, -CONH2, -NH2,-N(CH3)2, -NHSO2CH3,-NHCOCH3, -NHC(=O)OCH3, -NHSO2CH3, -SO2CH3, -SO2NH2, галогена. В одном варианте осуществления W обозначает СН. В другом варианте осуществления W обозначает N. В другом варианте осуществления R1 обозначает замещенный или незамещенный морфолинил; еще более предпочтительно, если R1 обозначает незамещенный присоединенный по атому N морфолинил. В другом варианте осуществления R1 обозначает замещенный или незамещенный тетрагидропиран. В другом варианте осуществления R1 обозначает замещенный или незамещенный тетрагидрофуран. В одном варианте осуществления R1 обозначает замещенный или незамещенный пиперидин. В одном варианте осуществления R1 обозначает замещенный или незамещенный пирролидин. В одном варианте осуществления R3 обозначает трифторметил. Предпочтительные соединения согласно настоящему изобретению представляют собой или их фармацевтически приемлемые соли. Следует понимать, что соединения, предлагаемые в настоящем изобретении, могут обладать таутомерией. Поскольку химические структуры в настоящей заявке могут представлять только одну из возможных таутомерных форм, следует понимать, что настоящее изобретение включает любую таутомер-5 018083 ную форму изображенной структуры. Синтез типичных ингибиторов PI3K, предлагаемых в настоящем изобретении, описан в методиках,приведенных в представленном ниже разделе, посвященном примерам, а получение типичных соединений описано в примерах 1-31. Типичные ингибиторы PDK, предлагаемые в настоящем изобретении, приведены в табл. 1. Другой вариант осуществления настоящего изобретения относится к способу ингибирования фосфорилирования Akt, включающему введение соединения формулы I нуждающемуся в нем человеку. Другой вариант осуществления относится к способу лечения рака, реагирующего на ингибирование фосфорилирования Akt, включающему введение соединения формулы I. Другой вариант осуществления относится к способу ингибирования фосфорилирования Akt, включающему взаимодействие клетки с соединением формулы I. Другой вариант осуществления относится к способу ингибирования фосфорилирования Akt, включающему пероральное введение соединения формулы I нуждающемуся в нем человеку. В более предпочтительном варианте осуществления человек страдает от рака. В более предпочтительном варианте осуществления рак реагирует на лечение соединением, которое ингибирует фосфорилирование Akt. В другом варианте осуществления соединение является биологически доступным при пероральном введении. Другой вариант осуществления относится к способу лечения рака, включающему пероральное введение соединения формулы I, в котором указанное соединение способно ингибировать активность Akt. В некоторых вариантах осуществления способа ингибирования PI3K с применением ингибитораPI3K, предлагаемого в настоящем изобретении, значение IC50 соединения, характеризующее ингибирование PI3K, меньше или равно 1 мМ. Предпочтительно значение IC50 меньше или равно 100 мкМ, меньше или равно 25 мкМ, меньше или равно 10 мкМ, меньше или равно 1 мкМ, меньше или равно 0,1 мкМ,меньше или равно 0,050 мкМ или меньше или равно 0,010 мкМ. Соединения, предлагаемые в настоящем изобретении, также применимы в исследованиях, в которых оценивают относительную активность при ингибировании киназы PI3. При таких исследованиях соединение, предлагаемое в настоящем изобретении, можно использовать для определения относительной ингибирующей активности при сопоставлении со вторым соединением. При таком применении соединение, предлагаемое в настоящем изобретении, используется в количестве, достаточном для того,чтобы специалист в данной области техники смог обнаружить ингибирование киназы PI3. Такое количество в настоящем изобретении иногда называется "эффективным ингибирующим количеством". Предпочтительно ингибирующее количество является количеством, которое уменьшает активность киназыPI3 примерно на 50% по сравнению с активностью при отсутствии соединения. Затем другие соединения можно оценить как обеспечивающие большее или меньшее ингибирование при такой же концентрации и установить порядок относительной активности. Такая информация полезна для определения изменений структуры и других изменений при изучении исследуемого соединения с целью улучшения его активности. Соответственно настоящее изобретение относится к способу ингибирования активности киназы PI3,который включает взаимодействие указанной киназы PI3 с эффективным ингибирующим количеством соединения, предлагаемого в настоящем изобретении, раскрытого в настоящем изобретении. Некоторые варианты осуществления относятся к способам ингибирования фосфорилирования Akt с использованием соединения, предлагаемого в настоящем изобретении, обладающего значением EC50,характеризующим ингибирование pAkt, равным менее примерно 1 мкМ. Предпочтительно соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 0,5 мкМ. Предпочтительно соединение обладает значением EC50, характеризующим ингибирование pAkt, равным менее примерно 0,1 мкМ. В некоторых вариантах осуществления компоненты, предлагаемые в настоящем изобретении, способны ингибировать фосфорилирование Akt. В некоторых вариантах осуществления компоненты, предлагаемые в настоящем изобретении, способны ингибировать фосфорилирование Akt у человека или животного (т.е. in vivo). Один вариант осуществления относится к способу уменьшения активности pAkt у человека или животного. В этом способе соединение, предлагаемое в настоящем изобретении, вводят в количестве, эффективном для уменьшения активности pAkt. В некоторых вариантах осуществления способа ингибирования PI3K с применением ингибитораPI3K, предлагаемого в настоящем изобретении, значение EC50 для соединения равно от 1 до 10 нМ. Предпочтительно значение EC50 равно от 10 до 50 нМ, от 50 до 100 нМ, от 100 нМ до 1 мкМ, от 1 до 25 мкМ или от 25 до 100 мкМ. Соединения, предлагаемые в настоящем изобретении, также применимы в исследованиях, в которых оценивают относительную активность при ингибировании фосфорилирования Akt. При таких исследованиях соединение, предлагаемое в настоящем изобретении, можно использовать для определения относительной ингибирующей активности при сопоставлении со вторым соединением. При таком применении соединение, предлагаемое в настоящем изобретении, используется в количестве, достаточном для того, чтобы специалист в данной области техники смог обнаружить ингибирование фосфорилирова-6 018083 ния Akt. Такое количество в настоящем изобретении иногда называется "эффективным ингибирующим количеством". В предпочтительном варианте осуществления настоящего изобретения ингибирущее количество является количеством, которое уменьшает активность при фосфорилировании Akt примерно на 50% по сравнению с активностью при отсутствии соединения. Затем другие соединения можно оценить,как обеспечивающие большее или меньшее ингибирование при такой же концентрации, и установить порядок относительной активности. Такая информация полезна для определения изменений структуры и других изменений при изучении исследуемого соединения с целью улучшения его активности. Соответственно настоящее изобретение относится к способу ингибирования фосфорилирования Akt, который включает взаимодействие клетки с эффективным ингибирующим количеством соединения, предлагаемого в настоящем изобретении, описанного в настоящем изобретении. Активность киназы PI3 также можно ингибировать в клетке, что включает взаимодействие указанной клетки с эффективным ингибирующим количеством соединения, заявленного в настоящем изобретении. В другом варианте осуществления настоящее изобретение относится к способам лечения, опосредуемого с помощью PI3K нарушения. В одном способе эффективное количество ингибитора PI3K вводят нуждающемуся в нем пациенту (например, человеку или животному) для опосредования (или модуляции) активности PI3K. Соединения, предлагаемые в настоящем изобретении, применимы в фармацевтических композициях, предназначенных для использования в медицине и ветеринарии, когда показано ингибирование PI3K,например, для лечения клеточных пролиферативных заболеваний, таких как опухолевые и/или рост раковых клеток, опосредуемых с помощью PI3K. В частности, эти соединения применимы для лечения раковых заболеваний человека или животного (например, мыши), включая, например, раковые заболевания легких и бронхов, предстательной железы, молочной железы, поджелудочной железы, прямой кишки,щитовидной железы, печени и внутрипеченочных желчных протоков, гепатоцеллюлярные заболевания,желудка, глиому/глиобластому, эндометрия, меланому, почек и почечных лоханок, мочевого пузыря,тела матки, шейки матки, яичников, множественную миелому, пищевода, острый миелолейкоз, хронический миелолейкоз, лимфолейкоз, миелолейкоз головного мозга, полости рта и глотки, гортани, тонкого кишечника, неходжкинскую лимфому, меланому и ворсинчатую аденому ободочной кишки. Средства, которые характеризуются селективным ингибированием PI3 киназы гамма, являются особенно подходящими для лечения воспалительных или обструктивных заболеваний дыхательных путей, приводящих, например, к уменьшению поражения ткани, воспаления дыхательных путей, бронхиальной гиперреактивности, ремоделирования или прогрессирования заболевания. Воспалительные или обструктивные заболевания дыхательных путей включают астму любого типа и генеза, включая наследственную астму (неаллергическую) и приобретенную (аллергическую) астму, слабую астму, астму средней тяжести, тяжелую астму, бронхиальную астму, астму напряжения, профессиональную астму и астму,вызванную бактериальной инфекцией. Лечение астмы также следует понимать, как включающее лечение субъектов, например, в возрасте менее 4 или 5 лет, у которых наблюдается свистящее дыхание и которым поставлен или может быть поставлен диагноз "бронхит младенцев", установившейся категории пациентов, вызывающих большую обеспокоенность медиков, которых в настоящее время часто называют страдающими от зарождающейся астмы или ранней стадии астмы ("синдром бронхита младенцев"). Соединения, предлагаемые в настоящем изобретении, которые более селективны по отношению к одной изоформе киназы PI3 (, , , ), чем по отношению к другой изоформе, представляют собой соединения, которые предпочтительно ингибируют одну изоформу. Например, соединение может ингибировать изоформу альфа более предпочтительно, чем изоформу гамма. Альтернативно, соединение может ингибировать изоформу гамма более предпочтительно, чем изоформу альфа. Для определения селективности соединения проводят определение активности соединения с помощью биологических методик,описанных в настоящем изобретении. Например, значение IC50 или значение EC50 соединения определяют для двух или большего количества изоформ киназы PI3, например альфа и гамма, с помощью биологических методик 1 и 2 соответственно. Затем полученные данные сопоставляют для определения селективности исследуемого соединения. Предпочтительно, если соединения, предлагаемые в настоящем изобретении, селективнее по отношению к одной изоформе по меньшей мере в 2, 5 или 10 раз, чем по отношению ко второй изоформе. Еще более предпочтительно, если соединения, предлагаемые в настоящем изобретении, селективнее по отношению к одной изоформе по меньшей мере в 50 или 100 раз, чем по отношению ко второй изоформе. Еще более предпочтительно, если соединения, предлагаемые в настоящем изобретении, селективнее по отношению к одной изоформе по меньшей мере в 1000 раз, чем по отношению ко второй изоформе. Воспалительные или обструктивные заболевания и патологические состояния дыхательных путей также включают острое поражение легких у взрослых (ОПЛ), острый респираторный дистресс синдром взрослых (ОРДС), кистозный фиброз, хроническое обструктивное легочное заболевание, заболевание дыхательных путей или легких (ХОЛЗ, ХОЗД, ХОЗЛ), включая фиброз легких, хронический бронхит или связанную с ним одышку, эмфизему, а также обострение гиперреактивности дыхательных путей, явившееся следствием лечения другим лекарственным средством, в частности другим средством ингаляционной терапии, бронхит любого типа и генеза, включая, например, острый, арахиновый, катаральный, кру-7 018083 позный, хронический или гнойный туберкулезный бронхит. Другие воспалительные или обструктивные заболевания дыхательных путей включают пневмокониоз (воспалительное, обычно профессиональное,заболевание легких, часто сопровождающееся обструкцией дыхательных путей, хронической или острой,и вызываемое повторяющимся вдыханием пыли) любого типа или генеза, например алюминоз, антракоз,асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз. Средства, которые характеризуются селективным ингибированием PI3K, также применимы для лечения связанных с эозинофилами нарушений, например эозинофилии, в частности, связанных с эозинофилами нарушений дыхательных путей (например, включающих болезненную инфильтрацию эозинофилов тканей легких), включая гиперэозинофилию, поскольку она влияет на дыхательные пути и/или легкие, а также, например, связанных с эозинофилами нарушений дыхательных путей, следующих за синдромом Леффлера или одновременных с ним, эозинофильной пневмонии, заражения паразитами (в частности, многоклеточными) (включая тропическую эозинофилию), бронхолегочного аспергиллеза, нодозного полиартериита (включая синдром Черджа-Строса), эозинофильной гранулемы и связанных с эозинофилами нарушений, влияющих на дыхательные пути, вызванных реакцией на лекарственное средство. Средства, которые характеризуются селективным ингибированием PI3K, также применимы для лечения воспалительных или аллергических патологических состояний кожи, например псориаза, контактного дерматита, атопического дерматита, гнездной алопеции, многоформной эритемы, герпетриформного дерматита, склеродермы, витилиго, аллергического васкулита, уртикарии, буллезного пемфигоида,красной волчанки, пузырчатки, врожденного буллезного эпидермолиза и других воспалительных или аллергических патологических состояний кожи. Такие средства также можно применять для лечения других заболеваний или патологических состояний, в частности заболеваний или патологических состояний, включающих воспалительный компонент, например, для лечения заболеваний и патологических состояний глаз, таких как конъюнктивит,сухой кератоконъюнктивит и весенний конъюнктивит, заболеваний, влияющих на нос, включая аллергический ринит, и воспалительного заболевания с участием аутоиммунных реакций или обладающих аутоиммунным компонентом или этиологией, включая аутоиммунные заболевания крови (например, гемолитической анемии, апластической анемии, истинной эритроцитарной анемии и идиопатической тромбоцитопении), системной красной волчанки; полихондрии, склеродермы, гранулематоза Вегенера, дерматомиозита, хронического активного гепатита, злокачественной миастении, синдрома Стивенса-Джонсона,идиопатического спру, аутоиммунного воспалительного заболевания кишечника (например, язвенного колита и болезни Крона), эндокринной офтальмопатии, диффузного токсического зоба, саркоидоза, альвеолита, хронического гиперчувствительного пневмонита, рассеянного склероза, первичного биллиарного цирроза, увеита (переднего и заднего), интерстициального фиброза легких, псориатического артрита и гломерулонефрита (с нефротическим синдромом и без него, например, включая идиопатический нефротический синдром или нефропатию с минимальными изменениями). Такие средства могут подавлять образование лейкоцитов, предпочтительно нейтрофилов и В- и Тлимфоцитов. Типичные патологические состояния, которые можно лечить, включают патологические состояния, характеризующиеся нежелательной функцией нейтрофилов, выбранные из группы, включающей стимулированную выработку супероксидных радикалов, стимулированный экзоцитоз и хемотаксическую миграцию, предпочтительно без подавления фагоцитарной активности или уничтожения бактерий нейтрофилами. Такие средства могут нарушать функцию остеокластов и ослаблять нарушения, связанные с резорбцией кости, например остеопороз. Такие средства применимы для лечения заболеваний, которые включают септический шок, отторжение аллотрансплантата после трансплантации, заболевания костей, такие как, но не ограничиваясь только ими, ревматоидный артрит, анкилозирующий спондилоартрит, остеоартрит, ожирение, рестеноз,диабет, например сахарный диабет типа I (юношеский диабет) и сахарный диабет типа II, диарейные заболевания. Опосредуемое PI3K патологическое состояние или нарушение может быть выбрано из группы,включающей сердечно-сосудистые заболевания, атеросклероз, гипертензию, тромбоз глубоких вен, удар,инфаркт миокарда, нестабильную стенокардию, тромбоэмболию, эмболию легких, тромболитические заболевания, острую артериальную ишемию, тромботические окклюзии периферийных сосудов и ишемическую болезнь сердца, реперфузионные поражения, ретинопатию, такую как диабетическая ретинопатия или вызванная кислородом гипербарическая ретинопатия, и патологические состояния, характеризующиеся повышенным внутриглазным давлением или секрецией внутриглазной жидкости, такие как глаукома. Как отмечено выше, поскольку PI3K выступают в качестве узла вторых мессенджеров, который объединяет параллельные пути передачи сигналов, появляется все больше данных о том, что комбинация ингибитора PI3K с ингибиторами других путей будет применима для лечения рака и пролиферативных заболеваний у людей. Примерно у 20-30% людей, страдающих раком молочной железы, сверхэкспрессируется Her-2/neuErbB2, мишень для лекарственного препарата трастузумаб. Хотя показано, что трастузумаб приводит к длительным реакциям у некоторых пациентов, у которых экспрессируется Her2/neu-ErbB2, реакция наблюдается только у части этих пациентов. Последние исследования показали, что такую ограниченную реакцию можно существенно улучшить с помощью комбинации трастузумаба с ингибиторами пути PI3K или PI3K/Akt (Chan et al., Breast Can. Res. Treat. 91:187 (2005), Woods Ignatoski et al., Brit. J. Cancer 82:666(2000), Nagata et al., Cancer Cell 6:117 (2004. При различных злокачественных заболеваниях людей происходят активирующие мутации или наблюдается повышенное содержание Her1/EGFR и для воздействия на эту рецепторную тирозинкиназу разработан целый ряд антител и небольших молекул-ингибиторов, в том числе тарцева, гефитиниб и эрбитукс. Однако, хотя ингибиторы EGFR проявляют противоопухолевую активность по отношению к некоторым опухолям человека (например, NSCLC), они не увеличивают общую выживаемость для всех пациентов, у которых имеются опухоли, экспрессирующие EGFR. Это можно объяснить тем, что для многих мишеней Her1/EGFR, расположенных ниже в пути передачи сигнала, включая путь PI3K/Akt, с высокой частотой происходят мутации или нарушения регуляции при различных злокачественных проявлениях. Например, по данным исследований in vitro гефитиниб подавляет рост линии клеток аденокарциномы. Однако можно выбрать субклоны этих линий клеток, которые резистентны к воздействию гефитиниба и у которых наблюдается усиленная активация пути PI3/Akt. Дезактивация или ингибирование этого пути делает резистентные субклоны чувствительными к гефитинибу (Kokubo et al., Brit. J. Cancer 92:1711 (2005. Кроме того, в модели рака молочной железы in vitro с использованием линии клеток, у которых скрыта мутация PTEN и происходит сверэкспрессирование EGFR, ингибирование и путиPI3K/Akt, и EGFR приводит к синергетическому эффекту (She et al., Cancer Cell 8:287-297(2005. Эти результаты показывают, что комбинация гефитиниба и ингибиторов пути PI3K/Akt должна быть привлекательной для лечения рака. В модели ксенотрансплантата глиобластомы комбинация АЕЕ 778 (ингибитор Her-2/neu/ErbB2,VEGFR и EGFR) и RAD001 (ингибитор mTOR, расположенной ниже в пути передачи сигнала мишениAkt) приводит к большей суммарной эффективности, чем при использовании этих средств по отдельности (Goudar et al., Mol. Cancer. Ther. 4:101-112 (2005. Антиэстрогены, такие как тамоксифен, подавляют рост рака молочной железы, вызывая остановку клеточного цикла, для которой необходимо воздействие ингибитора p27Kip клеточного цикла. Недавно показано, что активация пути киназы Ras-Raf-MAP меняет состояние фосфорилирования p27Kip, так что ослабляется его ингибирующее воздействие при остановке клеточного цикла, что способствует резистентности к антиэстрогенам (Donovan, et al., J. Biol. Chem. 276:40888, 2001). Как показано в публикацииDonovan et al., ингибирование сигнального пути MAPK путем лечения ингибитором MEK обращает аномальное состояние фосфорилирования р 27 в случае стойких к гормону линий клеток рака молочной железы и тем самым восстанавливает чувствительность к гормону. Аналогичным образом, фосфорилирование p27Kip посредством Akt устраняет его воздействие при остановке клеточного цикла (Viglietto et al.,Nat Med. 8:1145 (2002. В соответствии с этим в одном варианте осуществления соединения формулы (I) можно использовать для лечения зависящих от гормонов типов рака, таких как рак молочной и предстательной железы, путем устранения стойкости к гормонам, обычно наблюдающейся для этих типов рака при использовании обычных противораковых средств. При раковых заболеваниях крови, таких как хронический миелолейкоз (ХМЛ), транслокация хромосом ответственна за конститутивно активированную BCR-Abl тирозинкиназу. Страдающие этими заболеваниями пациенты реагируют на иматиниб, небольшую молекулу ингибитор тирозинкиназы, вследствие ингибирования активности киназы Abl. Однако на прогрессирующей стадии заболевания многие пациенты сначала реагируют на иматиниб, но затем происходит рецидив вследствие приводящих к резистентности мутаций в домене киназы Abl. Исследования in vitro показали, что для оказания воздействияBCR-Abl использует пути киназы Ras-Raf. Кроме того, ингибирование на том же пути более одной киназы приводит к дополнительной защите от мутаций, приводящих к резистентности. Поэтому в одном варианте осуществления настоящего изобретения соединения формулы (I) применяют в комбинации по меньшей мере с одним дополнительным средством, таким как иматиниб (Gleevec), для лечения раковых заболеваний крови, таких как хронический миелолейкоз (ХМЛ), с целью обращения или предупреждения резистентности по меньшей мере к одному дополнительному средству. Поскольку активация пути PI3K/Akt способствует выживанию клеток, ингибирование этого пути в сочетании со средствами, которые способствуют апоптозу раковых клеток, включая лучевую терапию и химиотерапию, приведет к улучшенному ответу (Ghobrial et al., CA Cancer J. Clin 55:178-194 (2005. Примером является комбинации ингибитора киназы PI3 с карбоплатином, которая обнаруживает синергетический эффект при исследованиях пролиферации и апоптоза in vitro, а также при исследованиях эффективности воздействия на опухоль in vivo с использованием модели ксенотрансплантата рака яичников (Westfall и Skinner, Mol. Cancer Ther 4:1764-1771 (2005. Появляется все больше данных о том, что ингибиторы PI3-киназ классов 1 А и 1 В могут иметь терапевтическую ценность не только при раке и пролиферативных заболеваниях, но и при других типах заболеваний. Установлено, что ингибирование p110, изоформы PI3K, являющейся продуктом генаPIK3CB, может участвовать в индуцируемой сдвигом активации тромбоцитов (Jackson et al., NatureMedicine 11:507-514 (2005. Таким образом, ингибитор PI3K, который ингибирует p110, можно применять в качестве единственного средства или в сочетании с антитромботической терапией. Изоформаp110, которая является продуктом гена PIK3CD, является важной для В-клеточной функции и дифференцировки (Clayton et al., J. Exp. Med. 196:753-763 (2002, а также для зависящих и независящих от Тклеток иммунных ответов (Jou et al., Mol. Cell Biol. 22:8580-8590 (2002 и дифференцировки мастоцитов(Ali et al., Nature 431:1007-1011 (2004. Таким образом, можно ожидать, что ингибиторы p110 могут оказаться ценными при лечении связанных с В-клетками аутоиммунных заболеваний и астмы. И, наконец, ингибирование p110, изоформы, являющейся продуктом гена PI3KCG, приводит к пониженному Тклеточному, но не В-клеточному ответу (Reif et al., J. Immunol. 173:2236-2240 (2004, и эффективность ингибирования этой изоформы продемонстрирована на созданных на животных моделях аутоиммунных заболеваний (Camps et al., Nature Medicine 11:936-943 (2005), Barber et al., Nature Medicine 11:933-935(2005. Настоящее изобретение относится к фармацевтическим композициям, включающим по меньшей мере один ингибитор PI3K (например, соединение формулы I) совместно с фармацевтически приемлемым носителем, пригодным для введения человеку или животному, по отдельности или вместе с другими противораковыми средствами. В одном варианте осуществления настоящее изобретение относится к способам лечения людей или животных, страдающих от клеточного пролиферативного заболевания, такого как рак. Настоящее изобретение относится к способам лечения человека или животного, нуждающегося в таком лечении, включающим введение субъекту терапевтически эффективного количества ингибитора PI3K (например, соединение формулы I), по отдельности или в комбинации с другими противораковыми средствами. В частности, композиции можно приготовить совместно в виде комбинированного лекарственного средства или вводить по отдельности. Противораковые средства включают, но не ограничиваются только ими, одно или большее количество средств, приведенных ниже. А. Ингибиторы киназы. Ингибиторы киназы, предназначенные для применения в качестве противораковых средств, включают ингибиторы киназ рецептора эпидермального фактора роста (EGFR), такие как небольшие молекулы хиналозинов, например гефитиниб (US 5457105, US 5616582 и US 5770599), ZD-6474 (WO 01/32651),эрлотиниб (тарцева, US 5747498 и WO 96/30347) и лапатиниб (US 6727256 и WO 02/02552); ингибиторы киназ рецептора сосудистого эндотелиального фактора роста (VEGFR), включая SU-11248 (WO 01/60814), SU-5416 (US 5883113 и WO 99/61422), SU-6668 (US 5883113 и WO 99/61422), CHIR-258 (US 6605617 и US 6774237), ваталаниб или PTK-787 (US 6258812), VEGF-Trap (WO 02/57423), B43-GenisteinAG-13925,пирроло[2,1f][1,2,4]триазины, ZK-304709, Веглин, VMDA-3601, EG-004, СЕР-701 (US 5621100), Cand5 (WO 04/09769); ингибиторы Erb2 тирозинкиназы, такие как пертузумаб (WO 01/00245), трастузумаб и ритуксимаб; ингибиторы Akt протеинкиназы, такие как RX-0201; ингибиторы протеинкиназы С (PKC), такие как LY-317615 (WO 95/17182) и перифосин (US 2003/171303); ингибиторы киназы Raf/Map/MEK/Ras,включая сорафениб (BAY 43-9006), ARQ-350RP, LErafAON, BMS-354825 AMG-548 и другие, раскрытые в WO 03/82272; ингибиторы киназ рецептора фактора роста фибробластов (FGFR); ингибиторы клеточно-зависимых киназ, включая CYC-202 и росковитин (WO 97/20842 и WO 99/02162); ингибиторы киназ рецептора тромбоцитарного фактора роста (PGFR), такие как CHIR-258, 3G3 mAb, AG-13736, SU-11248 и SU6668; и ингибиторы киназы Bcr-Abl и белков слияния, такие как STI-571 или Глеевек (иматиниб).B. Антиэстрогены. Воздействующие на эстрогены средства, предназначенные для применения в противораковой терапии, включают селективные модуляторы эстрогенного рецептора (СМЭР), включая тамоксифен, торемифен, ралоксифен; ингибиторы ароматазы, включая Аримидекс или анастрозол; негативные регуляторы эстрогенного рецептора (НРЭ), включая Фаслодекс или фульвестрант.C. Антиандрогены. Воздействующие на андрогены средства, предназначенные для применения в противораковой терапии, включают флутамид, бикалутамид, финастерид, аминоглютетамид, кетоконазол и кортикостероиды.D. Другие ингибиторы. Другие ингибиторы, предназначенные для применения в качестве противораковых средств, включают ингибиторы протеинфарнезилтрансферазы, включая типифарниб или R-115777 (US 2003/134846 иWO 97/21701), BMS-214662, AZD-3409 и FTI-277; ингибиторы топоизомеразы, включая мербарон и дифломотекан (BN-80915); ингибиторы митотических кинезиновых белков шпильки (КБШ), включая SB743921 и MKI-833; модуляторы протеазы, такие как бортезомиб или Велкаде (US 5780454), XL-784; и ингибиторы циклооксигеназы 2 (СОХ-2), включая нестероидные противовоспалительные лекарственные средства I (НСПВЛС).E. Химиотерапевтические противораковые лекарственные средства. Конкретные противораковые химиотерапевтические средства включают анастрозол (Аримидекс),бикалутамид (Казодекс), блеомицин сульфат (Бленоксан), бусульфан (Милеран), бусульфан для инъекций (Бусульфекс), капецитабин (Кселода), N4-пентоксикарбонил-5-дезокси-5-фторцитидин,карбоплатин (Параплатин), кармустин (BiCNU), хлорамбуцил (Лейкеран), цисплатин (Платинол),кладрибин (Лейстатин), циклофосфамид (Цитоксан или Неосар), цитарабин, цитозинарабинозид(Цитосар-U), липосомный цитарабин для инъекций (DepoCyt), дакарбазин (DTIC-Dome), дактиномицин (актиномицин D, космеган), даунорубицингидрохлорид (Церубидин), липосомный даунорубицинцитрат для инъекций (DaunoXome), дексаметазон, доцетаксел (Таксотер, US 2004/073044), доксорубицингидрохлорид (Адриамицин, Рубекс), этопозид (Верезид), флударабинфосфат (Флудара),5-фторурацил (Адруцил, Эфудекс), флутамид (Эйлексин), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевина (Гидреа), идарубицин (Идамицин), ифосфамид (IFEX), иринотекан(Глиадел), тамоксифен цитрат (Нолвадекс), тенипозид (Вумон), 6-тиогуанин, тиотепа, трирапазамин (Тиразон), топотекангидрохлорид для инъекций (Гикамптин), винбластин (Велбан), винкристин (Онковин) и винорелбин (Навелбин).F. Алкилирующие средства. Алкилирующие средства, предназначенные для применения в качестве противораковых средств,включают VNP-40101M или клоретизин, оксалиплатин (US 4169846, WO 03/24978 и WO 03/04505), глуфосфамид, мафосфамид, этопофос (US 5041424), преднимустин, треосульфан, бусульфан, ирофлувен(ацилфульвен), пенкломедин, пиразолоакридин (PD-115934), О 6-бензилгуанин, децитабин (5-аза-2 дезоксицитидин), бросталлицин, митомицин С (MitoExtra), TLK-286 (Телцита), темозоломид, трабектедин (US 5478932), АР-5280 (композиция на основе платины - цисплатин), порфиромицин и клеаразидG. Хелатные средства. Хелатные средства, предназначенные для применения в качестве противораковых средств, включают тетратиомолибдат (WO 01/60814), RP-697, химерик Т 84.66 (сТ 84.66), гадофосвесет (Вазовист),дефероксамин и блеомицин необязательно в сочетании с электропорацией (ЭПР). Н. Модификаторы биологического ответа. Модификаторы биологического ответа, такие как иммунномодуляторы, предназначенные для применения в качестве противораковых средств, включают стауроспорин и его макроциклические аналоги,включая UCN-01, СЕР-701 и мидостаурин (см. WO 02/30941, WO 97/07081, WO 89/07105, US 5621100,WO 93/07153, WO 01/04125, WO 02/30941, WO 93/08809, WO 94/06799, WO 00/27422, WO 96/13506 иWO 88/07045), скваламин (WO 01/79255), DA-9601 (WO 98/04541 и US 6025387), алемтузумаб, интерфероны (например, IFN-, IFN- и т.п.), интерлейкины, предпочтительно IL-2 или алдеслейкин, а также IL1, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12 и их активные биологические варианты, содержащие аминокислотные последовательности, составляющие более 70% от нативной последовательности человека, алтретамин (Гексален), SU 101 или лефлумонид (WO 04/06834 и US 6331555), имидазохинолины, такие как ресихимод и имихимод (US 4689338, US 5389640, US 5268376, US 4929624, US 5266575, US 5352784, US 5494916, US 5482936, US 5346905, US 5395937, US 5238944 и US 5525612), и небольшие молекулы, модулирующие иммунофармацевтические средства, включая бензазолы, антрахиноны, тиосемикарбазоны и триптантрины (WO 04/87153, WO 04/64759 и WO 04/60308).I. Противораковые вакцины. Противораковые вакцины включают Авицин (Tetrahedron Letters 26, 1974 2269-70), ореговомабGM-CSF и вакцины на основе моноцитогенов Listeria.J. Средства антисмысловой терапии. Противораковые средства также включают антисмысловые композиции, такие как AEG-35156(GEM-640), АР-12009 и АР-11014 (TGF-бета-2-специфические антисмысловые олигонуклеотиды), AVI4126, AVI-4557, AVI-4472, облимерсен (Генасенсе), JFS2, апринокарсен (WO 97/29780), GTI-2040 (антисмысловой олигонуклеотид, воздействующий на R2 рибонуклеотид-редуктазы мРНК) (WO 98/05769),GTI-2501 (WO 98/05769), капсулированные в липосомах антисмысловые олигодезоксинуклеотиды c-Raf(LErafAON) (WO 98/43095) и Sirna-027 (основанные на иммунной РНК лекарственные средства, воздействующие на VEGFR-1 мРНК). Соединения, которые характеризуются ингибированием PI3K, также можно объединить в фарма- 11018083 цевтической композиции с бронхолитическими или антигистаминными лекарственными веществами. Такие бронхолитические лекарственные средства включают антихолинергические или антимускариновые средства, в частности ипратропийбромид, окситропийбромид и тиотропийбромид, и агонисты -2 адренорецептора, такие как салбутамол, тербуталин, салметерол и предпочтительно формотерол. Совместно применяющиеся терапевтические антигистаминные лекарственные вещества включают цетиризингидрохлорид, клемастинфумарат, прометазин, лоратидин, деслоратидин, дифенилгидрамин и фексофенадингидрохлорид. Эффективность средства при подавлении воспалительных патологических состояний, например воспалительных заболеваний дыхательных путей, можно продемонстрировать на моделях животных,например модели мышей или крыс, предназначенных для исследования воспаления дыхательных путей или других воспалительных патологических состояний, например, как это описано в публикациях Szarkaet al., J. Clin. Invest. (1995) 96:2924-2931 и Cernadas et al. (1999) Am. J. Respir. Cell Mol. Biol. 20:1-8. Средства, ингибирующие PI3K, также применимы в качестве совместно применяющихся терапевтических средств, предназначенных для использования в комбинации с другими лекарственными веществами, такими как противовоспалительные, бронхорасширяющие или антигистаминные лекарственные вещества, предпочтительно для лечения обструктивных или воспалительных заболеваний дыхательных путей, такими как указанные выше, например, в качестве средств, усиливающих терапевтическую активность таких лекарственных средств, или в качестве средств, обеспечивающих снижение необходимой дозы или ослабление возможных побочных эффектов таких лекарственных средств. Такое средство можно смешивать с другим лекарственным веществом в фиксированной фармацевтической композиции или можно вводить отдельно, до, одновременно или после другого лекарственного вещества. Поэтому средство, ингибирующее PI3K, можно применять в комбинации с противовоспалительным, бронхорасширяющим или антигистаминным лекарственным веществом, причем указанное средство и указанное лекарственное вещество находятся в одной или в разных фармацевтических композициях. Такие противовоспалительные лекарственные средства включают стероиды, в частности глюкокортикостероиды,такие как будезонид, бекламетазон, флутиказон, циклезонид или мометазон, антагонисты LTB4, такие как описанные в US 5451700, антагонисты LTD4, такие как монтелукаст и зафирлукаст, агонисты допаминового рецептора, такие как каберголин, бромокриптин, ропинирол и 4-гидрокси-7-[2-2-3-(2 фенилэтокси)пропил]сульфонил]этил]амино]этил]-2(3H)-бензотиазолон и их фармацевтически приемлемые соли (гидрохлоридом является Виозан AstraZeneca) и ингибиторы PDE4, такие как арифло(Schering-Plough), арофиллин (Almirall Prodesfarma) и PD189659 (Parke-Davis). Такие бронхорасширяющие лекарственные средства включают антихолинергические или антимускариновые средства, в частности ипратропийбромид, окситропийбромид и тиотропийбромид, и агонисты бета-2 адренорецептора, такие как салбутамол, тербуталин, салметерол и предпочтительно формотерол и их фармацевтически приемлемые соли и соединения (в свободной форме или в форме соли или сольвата) формулы I, описанного в публикации международной заявки WO 00/75114, которая включена в настоящее изобретение в качестве ссылки, предпочтительно соединения, указанные в примерах в этой публикации, предпочтительно соединение формулы и его фармацевтически приемлемые соли. Совместно применяющиеся терапевтические антигистаминные лекарственные вещества включают цетиризингидрохлорид, ацетаминофен, клемастинфумарат,прометазин, лоратидин, деслоратидин, дифенилгидрамин и фексофенадингидрохлорид. Комбинации средств, ингибирующих PI3K, и стероидов, агонистов бета-2, ингибиторов PDE4 или антагонистов LTD4 можно использовать, например, для лечения ХОЗЛ или предпочтительно астмы. Комбинации средств,ингибирующих PI3K, и антихолинергических или антимускариновых средств, ингибиторов PDE4, агонистов допаминового рецептора или антагонистов LTB4 можно использовать, например, для лечения астмы или предпочтительно ХОЗЛ. Другими полезными комбинациями средств, ингибирующих PI3K, с противовоспалительными лекарственными средствами являются комбинации с антагонистами хемокиновых рецепторов, напримерCCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 и CCR10, CXCR1, CXCR2, CXCR3,CXCR4, CXCR5, предпочтительно с антагонистами CCR-5, такие как выпускающиеся фирмой ScheringPlough антагонисты SC-351125, SCH-55700 и SCH-D, выпускающиеся фирмой Takeda антагонисты, такие как N-4-6,7-дигидро-2-(4-метилфенил)-5 Н-бензоциклогептен-8-ил]карбонил]амино]фенил]метил]тетрагидро-N,N-диметил-2H-пиран-4-аминийхлорид (TAK-770) и антагонисты CCR-5, описанные в US 6166037 (в особенности в пп.18 и 19 формулы изобретения), WO 00/66558 (в особенности в п.8 формулы изобретения) и WO 00/66559 (в особенности в п.9 формулы изобретения). Соединения, предлагаемые в настоящем изобретении, также можно объединить в фармацевтической композиции с соединениями, которые применимы для лечения тромболитического заболевания,заболевания сердца, удара и т.п. (например, аспирин, стрептокиназа, активатор плазминогена ткани, урокиназа, атикоагулянты, лекарственные средства, препятствующие агрегации тромбоцитов (например,плавикс, клопидогрелбисульфат), статин (например, липитор или кальциевая соль аторвастатина), злкор(симвастатин), крестор (росувастатин и т.п.), бета-блокаторами (например, атенолол), норваск (амлодипинбезилат) и ингибитором ацтилхолинэстеразы (АХЭ) (например, лизиноприл). Соединения, ингибирующие PI3K, также можно объединить в фармацевтической композиции с соединениями, которые применимы для лечения гипертензии, такими как, ингибиторы АХЭ, средства,снижающие содержание липидов, такие как статины, липитор (кальциевая соль аторвастатина), блокаторы кальциевых каналов, такие как норваск (амлодипинбезилат). Соединения, предлагаемые в настоящем изобретении, также можно использовать в комбинации с фибратами, бета-блокаторами, ингибиторамиNEPI, антагонистами ангиотензинового рецептора 2 и средствами, препятствующими агрегации тромбоцитов. Для лечения воспалительных заболеваний, включая ревматоидный артрит, соединения, ингибирующие PI3K, можно комбинировать с такими средствами, как ингибиторы TNF-, такие как анти-TNF моноклональные антитела (такие как ремикаде, CDP-870) и D2E7 (HUMIRA) и молекулы иммуноглобулина слияния рецептора TNF (такие как эмбрел), ингибиторы IL-1, антагонисты рецептора растворимого IL-1R (например, кинерет или ингибиторы ICE), нестероидные противовоспалительные лекарственные средства (НСПВЛС), пироксикам, диклофенак, напроксен, флурбипрофен, фенопрофен, кетопрофен, ибупрофен, фенаматы, мефенаминовая кислота, индометацин, сулиндак, апазон, пиразолоны,фенилбутазон, аспирин, ингибиторы СОХ-2 (такие как целебрекс (целекоксиб), прексиг (лумиракоксиб,ингибиторы металлопротеазы (предпочтительно селективные ингибиторы ММР-13), р 27 ингибиторы ,ингибиторы, нейротин, прегабалин, применяющийся в низкой дозе метотрексат, лефлуномид,гидроксихлорхин, d-пеницилламин, ауранофин или вводимые парентерально или перорально препараты золота. Соединения, ингибирующие PI3K, также можно использовать в комбинации с имеющимися терапевтическими средствами, предназначенными для лечения остеоартрита. Средства, подходящие для использования в комбинации, включают стандартные нестероидные противовоспалительные лекарственные средства I (далее НСПВЛС), такие как пироксикам, диклофенак, пропионовые кислоты, такие как напроксен, флурбипрофен, фенопрофен, кетопрофен и ибупрофен, фенаматы, такие как мефенаминовая кислота, индометацин, сулиндак, апазон, пиразолоны, такие как фенилбутазон, салицилаты, такие как аспирин, ингибиторы СОХ-2, такие как целекоксиб, валдекоксиб, лумиракоксиб и эторикоксиб, анальгетики и средства для внутриглазной терапии, такие как кортикостероиды и гиалуроновые кислоты, такие как гиаглан и синвиск. Соединения, ингибирующие PI3K, также можно использовать в комбинации с противовирусными средствами, такими как вирацепт, AZT, ацикловир и фамцикловир, и антисептиками, такими как валант. Соединения, ингибирующие PI3K, также можно использовать в комбинации со средствами, действующими на центральную нервную систему (ЦНС), такими как антидепрессанты (сертралин), лекарственные средства для лечения болезни Паркинсона (такие как депренил, L-дора, реквип, мирапекс, ингибиторы МАОВ, такие как селегин и расагилин, ингибиторы comP, такие как тасмар, ингибиторы А-2,ингибиторы повторного всасывания допамина, антагонисты NMDA, агонисты никотина, агонисты допамина и ингибиторы нейронной синтазы оксида азота) и лекарственные средства для лечения болезни Альцгеймера, такие как донеперил, такрин, , ,ингибиторы, нейротин, прегабалин, ингибиторы СОХ 2, пропентофиллин или метрифонат. Соединения, ингибирующие PI3K, также можно использовать в комбинации со средствами для лечения остеопороза, такими как эвиста (ралоксифенгидрохлорид), дролоксифен, лазофоксифен или фосамакс, и иммунодепрессантными средствами, такими как FK-506 и рапамицин. Предлагаемые соединения можно использовать в виде наборов, которые включают одно или большее количество соединений согласно настоящему изобретению. Типичные наборы включают ингибиторPI3K, предлагаемый в настоящем изобретении (например, соединение формулы I), и листок-вкладыш или другую маркировку, содержащую указания для лечения клеточного пролиферативного заболевания путем введения ингибирующего PI3K количества соединения. Приведенные ниже определения предназначены для того, чтобы лучше понять изобретение."Алкил" означает алкильные группы, которые не содержат гетероатомы. Этот термин включает алкильные группы с линейной цепью, такие как метил, этил, пропил, бутил, пентил, гексил, гептил, октил,нонил, децил, ундецил, додецил и т.п. Термин также включает обладающие разветвленной цепью изомеры линейных алкильных групп, включая, но не ограничиваясь только ими, следующие, приведенные в качестве примеров: -CH(CH3)2, -CH(CH3)(CH2CH3), -CH(CH2CH3)2, -C(CH3)3, -C(CH2CH3)3,-CH2CH(CH3)2, -CH2CH(CH3)(CH2CH3), -CH2CH(CH2CH3)2, -CH2C(CH3)з, -CH2C(CH2CH3)3, -CH(CH3)- 13018083CH(CH3)(CH2CH3),-CH2CH2CH(CH3)2,-CH2CH2CH(CH3)(CH2CH3),-CH2CH2CH(CH2CH3)2,-CH2CH2C(CH3)3,-CH2CH2C(CH2CH3)3,-CH(CH3)СН 2-CH(CH3)2,-CH(CH3)CH(CH3)CH(CH3)2,-CH(CH2CH3)CH(CH3)CH(CH3)(CH2CH3) и др. Таким образом, выражение "алкильные группы" включает первичные алкильные группы, вторичные алкильные группы и третичные алкильные группы. Предпочтительные алкильные группы включают обладающие линейной и разветвленной цепью алкильные группы, содержащие от 1 до 12 атомов углерода или от 1 до 6 атомов углерода. Алкильные группы могут быть замещенными. "Замещенный алкил" означает алкильную группу,определенную выше, в которой одна или большее количество связей с атомом (атомами) углерода или водорода заменены на связь с атомом, не являющимся атомом водорода и атомом углерода. Примерами заместителей замещенного алкила являются: -CH3, -С 2 Н 5, -СН 2 ОН, -ОН, -ОСН 3, -ОС 2 Н 5, -OCF3,-OC(=O)CH3, -OC(=O)NH2, -OC(=O)N(CH3)2, -CN, -NO2, -C(=O)CH3, -CO2H, -СО 2 СН 3, -CONH2, -NH2,-N(CH3)2, -NHSO2CH3, -NHCOCH3, -NHC(=O)OCH3, -NHSO-2CH3, -SO2CH3, -SO2NH2, галоген."Алкоксигруппа" означает RO-, в которой R обозначает алкил. Типичные примеры алкоксигрупп включают метоксигруппу, этоксигруппу, трет-бутоксигруппу, трифторметоксигруппу и т.п."Галоген" означает хлоридную, бромидную, фторидную и йодидную группы. Термин "галогеналкил" означает алкильный радикал, замещенный одним или большим количеством атомов галогенов."Аминогруппа" в настоящем изобретении означает группу -NH2. Термин "алкиламиногруппа" в настоящем изобретении означает группу -NRR', в которой R обозначает алкил и R' обозначает водород или алкил."Аминокарбонил" в настоящем изобретении означает группу -C(O)-NH2."Карбонил" означает двухвалентную группу -С(О)-."Гуанидиновая группа" или "гуанидил" означает фрагменты, образованные из гуанидина, H2NC(=NH)-NH2. Такие фрагменты включают присоединенные по атому азота, обладающему формальной двойной связью (положение "2" гуанидина, например диаминометиленаминогруппу, (H2N)2C=NH-, и присоединенные по атому азота, обладающему формальной ординарной связью (положения "1" и/или "3" гуанидина, например H2N-C(=NH)-NH-. Атомы водорода, присоединенные к одному или большему количеству атомов азота, могут быть заменены на подходящий заместитель, такой как алкил, арил или арилалкил."Замещенный гетероцикл", "гетероциклическая группа", "гетероцикл" или "гетероциклил" при использовании в настоящем изобретении означают любое 3-или 4-членное кольцо, содержащее гетероатом,выбранный из группы, включающей азот, кислород и серу, или 5- или 6-членное кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу; где 5-членное кольцо содержит 0-2 двойных связей и 6-членное кольцо содержит 0-3 двойных связей; где атомы азота и серы необязательно могут быть окислены; где атомы азота и серы необязательно могут кватернизованы; и включает любую бициклическую группу, в которой любое из указанных выше гетероциклических колец сконденсировано с бензольным кольцом. Примеры гетероциклильных групп включают, но не ограничиваются только ими, ненасыщенные 3-8-членные кольца, содержащие 1-4 атома азота, такие как, но не ограничиваясь только ими, пирролил, дигидропиридил, пиримидил, пиразинил, тетразолил (например,1H-тетразолил, 2 Н-тетразолил); конденсированные ненасыщенные гетероциклические группы, содержащие 1-4 атома азота, такие как, но не ограничиваясь только ими, изоиндолил, индолинил, индолизинил,хинолил, индазолил; ненасыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-3 атома азота, такие как, но не ограничиваясь только ими, оксадиазолил (например, 1,2,4-оксадиазолил, 1,3,4 оксадиазолил, 1,2,5-оксадиазолил); насыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-3 атома азота, такие как, но не ограничиваясь только ими, морфолинил; ненасыщенные конденсированные гетероциклические группы, содержащие 1-2 атома кислорода и 1-3 атома азота, например бензоксадиазолил, бензоксазинил (например, 2 Н-1,4-бензоксазинил); ненасыщенные 3-8-членные кольца,содержащие 1-3 атома серы и 1-3 атома азота, такие как, но не ограничиваясь только ими, тиадиазолил(например, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2-тиадиазолил); насыщенные 3-8 членные кольца, содержащие 1-2 атома серы и 1-3 атома азота, такие как, но не ограничиваясь только ими, тиазолодинил; насыщенные и ненасыщенные 3-8-членные кольца, содержащие 1-2 атома серы, такие как, но не ограничиваясь только ими, дигидродитиенил, дигидродитионил, тетрагидротиофен, тетрагидротиопиран; ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома серы и 1-3 атома азота, такие как, но не ограничиваясь только ими, бензотиадиазолил, бензотиазинил(например, 2 Н-1,4-бензотиазинил), дигидробензотиазинил (например, 2 Н-3,4-дигидробензотиазинил),ненасыщенные 3-8-членные кольца, содержащие атомы кислорода, такие как, но не ограничиваясь только ими, фурил; ненасыщенные конденсированные гетероциклические кольца, содержащие 1-2 атома кислорода, такие как бензодиоксолил (например, 1,3-бензодиоксолил); ненасыщенные 3-8-членные кольца,содержащие атом кислорода и 1-2 атома серы, такие как, но не ограничиваясь только ими, дигидроокса- 14018083 тиенил; насыщенные 3-8-членные кольца, содержащие 1-2 атома кислорода и 1-2 атома серы, такие как 1,4-оксатиан; ненасыщенные конденсированные кольца, содержащие 1-2 атома серы, такие как бензодитиенил; и ненасыщенные конденсированные гетероциклические кольца, содержащие атом кислорода и 12 атома кислорода, такие как бензоксатиенил. Предпочтительные гетероциклические группы включают,например, диазепинил, пиррил, пирролинил, пирролидинил, пиразолил, пиразолинил, пиразолидинил,имидазолил, имидазолинил, имидазолидинил, пиридил, пиперидинил, пиразинил, пиперазинил, N-метил пиперазинил, азетидинил, N-метилазетидинил, пиримидинил, пиридазинил, оксазолил, оксазолидинил,изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолидинил, изотиазолил, изотиазолидинил,индолил, хинолинил, изохинолинил, бензимидазолил, бензотиазолил, бензоксазолил, фурил, тиенил,триазолил и бензотиенил. Гетероциклильные группы также включают описанные выше, в которых один или большее количество атомов S кольца связан двойной связью с одним или двумя атомами кислорода(сульфоксиды и сульфоны). Например, гетероциклильные группы включают тетрагидротиофен, тетрагидротиофеноксид и тетрагидротиофен-1,1-диоксид. Предпочтительные гетероциклильные группы содержат 5 или 6 элементов кольца. Более предпочтительные гетероциклильные группы включают пиперазин, 1,2,3-триазол, 1,2,4-триазол, тетразол, тиоморфолин, гомопиперазин, оксазолидин-2-он, пирролидин 2-он, хинуклидин и тетрагидрофуран. Гетероциклические группы могут быть присоединены в разных положениях, как это должно быть очевидно специалистам в области органической и медицинской химии в связи с раскрытием в настоящем изобретении где R обозначает Н или гетероциклический заместитель, описанный в настоящем изобретении. Типичные гетероциклические группы включают, например, имидазолил, пиридил, пиперазинил,азетидинил, тиазолил, фуранил, триазолил, бензимидазолил, бензотиазолил, бензоксазолил, хинолинил,изохинолинил, хиназолинил, хиноксалинил, фталазинил, индолил, нафтпиридинил, индазолил и хинолизинил."Необязательно замещенный" или "замещенный" означает замещение водорода одним или большим количеством одновалентных или двухвалентных радикалов. Подходящие замещающие группы включают, например, гидроксигруппу, нитрогруппу, аминогруппу, иминогруппу, цианогруппу, галоген, тиогруппу, сульфонил, тиоамидную группу, амидиновую группу, имидиновую группу, оксогруппу, оксамидиновую группу, метоксамидиновую группу, имидиновую группу, гуанидиновую группу, сульфонамидную группу, карбоксигруппу, формил, алкил, замещенный алкил, галогеналкил, алкиламиногруппу, галогеналкиламиногруппу, алкоксигруппу, галогеналкоксигруппу, алкоксиалкил, алкилкарбонил, аминокарбонил, фенилкарбонил, фениллакилкарбонил, алкилтиогруппу, аминоалкил, цианоалкил, фенил, бензил, пиридил, пиразолил, пиррол, тиофен, имидазолил и т.п. Если замещенный заместитель включает группу, обладающую линейной цепью, то замещение может происходить внутри цепи (например, 2-гидроксипропил, 2-аминобутил и т.п.) или в конце цепи (например, 2-гидроксиэтил, 3-цианопропил и т.п.). Замещенные заместители могут представлять собой обладающую линейной цепью, разветвленную или циклическую группировку ковалентно связанных атомов углерода или гетероатомов. Термин "защищенная" для гидроксигрупп, аминогрупп и сульфгидрильных групп означает формы этих функциональных групп, которые защищены от нежелательных реакций защитными группами, известными специалистам в данной области техники, такими как указанные в публикации Protective Groupsin Organic Synthesis, Greene, T.W.; Wuts, P.G.M., John WileySons, New York, NY, (3rd Edition, 1999),которые можно вводить или удалять по приведенным в них методикам. Примеры защищенных гидроксигрупп включают, но не ограничиваются только ими, силиловые простые эфиры, такие как получаемые по реакции гидроксигруппы с реагентом, таким как, но не ограничиваясь только ими, третбутилдиметилхлорсилан, триметилхлорсилан, триизопропилхлорсилан, триэтилхлорсилан; замещенные метиловые и этиловые простые эфиры, такие как, но не ограничиваясь только ими, метоксиметиловый эфир, метилтиометиловый эфир, бензилоксиметиловый эфир, трет-бутоксиметиловый эфир, 2 метоксиэтоксиметиловый эфир, тетрагидропираниловые простые эфиры, 1-этоксиэтиловый эфир, аллиловый эфир, бензиловый эфир; сложные эфиры, такие как, но не ограничиваясь только ими, бензоил- 15018083 формиат, формиат, ацетат, трихлорацетат и трифторацетат. Примеры защищенных аминогрупп включают, но не ограничиваются только ими, амиды, такие как формамид, ацетамид, трифторацетамид и бензамид; имиды, такие как фталимид и дитиосукцинимид; и др. Примеры защищенных сульфгидрильных групп включают, но не ограничиваются только ими, простые тиоэфиры, такие как S-бензиловый тиоэфир и S-4-пиколиловый тиоэфир; замещенные S-метилпроизводные, такие как гемитио-, дитио- и аминотиоацетали; и др."Защищенная карбоксигруппа" означает карбонильную группу, которая этерифицирована одной из обычно применяющихся сложноэфирных групп, использующихся для блокирования или защиты карбоксигруппы, когда проводят реакции, в которых участвуют другие функциональные группы соединения. Кроме того, карбоксигруппу для ее защиты можно связать с твердой подложкой и соединение остается связанным с твердой подложкой в виде карбоксилата, пока оно не будет отщеплено с помощью методик гидролиза с высвобождением соответствующей свободной кислоты. Типичные защищенные карбоксигруппы включают, например, алкиловые эфиры, вторичные амиды и т.п. Некоторые соединения, предлагаемые в настоящем изобретении, содержат асимметрично замещенные атомы углерода. Такие асимметрично замещенные атомы углерода могут привести к соединениям,предлагаемым в настоящем изобретении, представляющим собой смеси стереоизомеров по конкретному асимметрично замещенному атому углерода или отдельный стереоизомер. Поэтому рацемические смеси,смеси диастереоизомеров, а также отдельные диастереоизомеры соединений, предлагаемых в настоящем изобретении, включены в настоящее изобретение. Термины "S-" и "R- конфигурация" при использовании в настоящем изобретении обладают значениями, определенными в публикации IUPAC 1974"Recommendations for Section E, Fundamental Stereochemistry", Pure Appl. Chem. 45:13-30, 1976. Обозначенияииспользуются для определения положений циклов в циклических соединениях.-Положение в рассматриваемой плоскости является положением, в котором предпочтительный заместитель расположен в положении с меньшим номером. Заместители, расположенные с противоположной стороны рассматриваемой плоскости, отмечают символом . Следует отметить, что эти обозначения отличаются от обозначений циклических стереоизомеров, для которых означает "ниже плоскости" и обозначает абсолютную конфигурацию. Термины - и -конфигурация при использовании в настоящем изобретении обладают значениями, определенными в публикации "Chemical Abstracts IndexGuide," Appendix IV, paragraph 203, 1987. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает соли нетоксичной кислоты или соли нетоксичного щелочно-земельного металла пиримидинов, предлагаемых в настоящем изобретении. Эти соли можно получить in situ при окончательном выделении и очистке пиримидинов или путем раздельных реакций основных или кислотных групп с подходящей органической или неорганической кислотой или основанием соответственно. Типичные соли включают, но не ограничиваются только ими, следующие: ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, фумарат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат, лактат, малеат, метансульфонат,никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат,пивалат, пропионат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат и ундеканоат. Кроме того, основные азотсодержащие группы можно кватернизировать такими реагентами, как алкилгалогениды, такие как метил-, этил-, пропил- и бутилхлориды, -бромиды и -йодиды; диалкилсульфаты, такие как диметил-, диэтил-, дибутил- и диамилсульфаты, галогениды с длинными цепями, такие как децил-, лаурил-, миристил- и стеарилхлориды, -бромиды и -йодиды, арилалкилгалогениды, такие как бензил- и фенетилбромиды и др. Таким образом получают растворимые или диспергирующиеся в воде или масле продукты. Примеры кислот, которые можно использовать для получения фармацевтически приемлемых солей присоединения с кислотами, включают такие неорганические кислоты, как хлористо-водородная кислота, бромисто-водородная кислота, азотная кислота, серная кислота и фосфорная кислота, и такие органические кислоты, как муравьиная кислота, уксусная кислота, трифторуксусная кислота, фумаровая кислота, винная кислота, щавелевая кислота, матеиновая кислота, метансульфоновая кислота, янтарная кислота, яблочная кислота, метансульфоновая кислота, бензолсульфоновая кислота и п-толуолсульфоновая кислота, лимонная кислота, и аминокислоты, такие как аспарагиновая кислота и глутаминовая кислота. Соли присоединения с основаниями можно получить in situ при окончательном выделении и очистке пиримидинов или путем раздельных реакций кислотных групп карбоновых кислот с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, или с аммиаком либо с первичным, вторичным или третичным органическим амином. Фармацевтически приемлемые соли включают, но не ограничиваются только ими, соли, содержащие катионы щелочных и щелочно-земельных металлов, такие как соли натрия, лития, калия, кальция, магния, алюминия и т.п., а также нетоксичные соли аммония, четвертичного аммония и аминов, включая, но не ограничиваясь только ими, соли аммония, тетраметиламмония, тетраэтиламмония, метиламина, диметиламина, три- 16018083 метиламина, триэтиламина, этиламина и т.п. Другие типичные органические амины, применяющиеся для получения солей присоединения с основаниями, включают диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин, пиридин, пиколин, триэтаноламин и т.п. и основные аминокислоты, такие как аргинин, лизин и орнитин. Термин "фармацевтически приемлемый сложный эфир" означает сложные эфиры, которые гидролизуются in vivo, и включают такие, которые легко разрушаются в организме человека с высвобождением исходного соединения или его соли. Подходящие сложноэфирные группы включают, например, образованные из фармацевтически приемлемых алифатических карбоновых кислот, предпочтительно алканкарбоновых, алкенкарбоновых, циклоалканкарбоновых и алкандикарбоновых, в которых каждый алкильный или алкенильный фрагмент предпочтительно содержит не более 6 атомов углерода. Типичные примеры предпочтительных сложных эфиров включают, но не ограничиваются только ими, формиаты,ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты. Термин "фармацевтически приемлемые пролекарства" означает соединения, которые с медицинской точки зрения применимы для взаимодействия с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п., характеризуются разумным соотношением польза/риск и эффективные для применения по назначению, а также, когда это возможно,цвиттерионные формы соединений. Термин "пролекарство" означает соединения, которые быстро подвергаются превращению in vivo и образуют исходные соединения указанной выше формулы, например,путем гидролиза в крови. Подробное обсуждение приведено в публикациях Higuchi T. and V. Stella, "Prodrugs as Novel Delivery Systems", A.C.S. Symposium Series 14 и "Bioreversible Carriers in Drug Design", in"Лечение" в контексте настоящего изобретения означает ослабление симптомов, связанных с нарушением или заболеванием, или остановку дальнейшего развития или ухудшения этих симптомов, или предупреждение или профилактику заболевания или нарушения. Например, при лечении пациентов, которым необходим ингибитор PI3K, успешное лечение может включать уменьшение пролиферации капилляров, питающих опухоль или пораженную ткань, ослабление симптомов, связанных с ростом рака или опухоли, пролиферацией капилляров или пораженной ткани, остановку пролиферации капилляров или остановку прогрессирования заболевания, такого как рак, или роста раковых клеток. Лечение также может включать введение фармацевтических композиций, предлагаемых в настоящем изобретении, в сочетании с другими методиками лечения. Например, соединения и фармацевтические композиции,предлагаемые в настоящем изобретении, можно вводить до, во время или после хирургического вмешательства и/или лучевой терапии. Соединения, предлагаемые в настоящем изобретении, также можно вводить совместно с другими противораковыми лекарственными средствами, включая применяющиеся при антисмысловой и генной терапии. При использовании в настоящем изобретении "ограничение" и "лечение" заменяют термины "ограничивать" и "лечить" и при использовании в настоящем изобретении они включают предупредительное(например, профилактическое) и паллиативное лечение или проведение предупредительного или паллиативного лечения. Термин "нарушение, опосредуемое PI3K" означает нарушение, которое можно эффективно лечить путем ингибирования PI3K. Термин "клеточные пролиферативные заболевания" означает заболевания, включающие, например,рак, опухоль, гиперплазию, рестеноз, гипертрофию сердца, иммунное нарушение и воспаление. Термин "рак" означает раковые заболевания, которые можно эффективно лечить путем ингибирования PI3K, включая, например, раковые заболевания легких и бронхов, предстательной железы, молочной железы, поджелудочной железы, ободочной и прямой кишки, щитовидной железы, печени и внутрипеченочных желчных протоков, гепатоцеллюлярные заболевания, желудка, глиому/глиобластому, эндометрия, меланому, почек и почечных лоханок, мочевого пузыря, тела матки, шейки матки, яичников,множественную миелому, пищевода, острый миелолейкоз, хронический миелолейкоз, лимфолейкоз,миелолейкоз головного мозга, полости рта и глотки, гортани, тонкого кишечника, неходжкинскую лимфому, меланому и ворсинчатую аденому ободочной кишки. Ингибиторы PI3K, предлагаемые в настоящем изобретении, описанные в настоящем изобретении,можно вводить в виде солей присоединения с кислотами. Эти соли обычно получают по реакции соединения, если оно является основанием, с подходящей кислотой, такой как описана выше. Соли быстро получают с высокими выходами при умеренных температурах и часто их получают просто выделением соединения из подходящего кислого промывочного раствора на заключительной стадии синтеза. Солеобразующую кислоту растворяют в подходящем органическом растворителе или смеси воды и органического растворителя, такого как алканол, кетон или сложный эфир. С другой стороны, если соединение,предлагаемое в настоящем изобретении, необходимо получить в виде свободного основания, то его выделяют на заключительной стадии из щелочного промывочного раствора в соответствии с обычной практикой. Предпочтительной методикой получения гидрохлоридов является растворение свободного основания в подходящем растворителе и тщательная сушка раствора, например, над молекулярными ситами,- 17018083 с последующим пропусканием газообразного хлорида водорода. Также следует понимать, что можно вводить аморфные формы ингибиторов PI3K. Изотопно-меченые ингибиторы PI3K представляют собой соединения, которые по структуре идентичны раскрытым выше, но в которых один или большее количество атомов заменены на атом, обладающий атомной массой или атомным номером, отличным от обычно встречающегося в природе. Примеры изотопов, которые можно вводить в соединения, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора и хлора, такие как 2 Н, 3 Н, 13 С, 14 С, 15N, 18 О, 17 О, 31 Р, 32 Р, 35S, 18F и 36Cl соответственно. Некоторые изотопно-меченые соединения, например, такие, в которые введены радиоактивные изотопы, такие как 3H и 14 С, применимы в лекарственных средствах и/или при анализах распределения в тканях. Тритированные, т.е. содержащие изотоп 3 Н, и углерод-14, т.е. 14 С, являются особенно предпочтительными, поскольку их легко приготовить и обнаружить. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может обеспечить некоторые терапевтические преимущества,обусловленные их более высокой метаболической стабильностью, например увеличенной длительностью полувыведения или возможностью использования меньших доз, и поэтому при некоторых условиях они могут быть предпочтительными. Изотопно-меченые соединения и их пролекарства обычно можно получить по известным или стандартным методикам и путем замены не содержащего изотопа реагента на легкодоступный изотопно-меченый реагент. Соединения, предлагаемые в настоящем изобретении, применимы для подавления роста раковых клеток in vitro или in vivo. Соединения можно использовать по отдельности или в композициях совместно с фармацевтически приемлемым носителем или инертным наполнителем. Фармацевтические композиции, предлагаемые в настоящем изобретении, включают терапевтически эффективное количество ингибитора фосфатидилинозит 3-киназы, описанного в настоящем изобретении, приготовленного совместно с одним или большим количеством фармацевтически приемлемых носителей. При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" означает нетоксичный, инертный твердый, полужидкий или жидкий носитель, разбавитель, капсулирующее вещество или вспомогательное вещество любого типа, использующееся для приготовления композиций. Некоторыми примерами веществ, которые могут выступать в качестве фармацевтически приемлемых носителей, являются сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетилцеллюлоза; порошкообразная трагакантовая камедь; солод; желатин; тальк; инертные наполнители, такие как масло какао и воска для изготовления суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; сложные эфиры, такие как этилолеат и этиллаутрат; агар-агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновая кислота; апирогенная вода; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также окрашивающие агенты, агенты, обеспечивающие отделение от пресс-форм, агенты для нанесения покрытий, подсластители, вкусовые добавки и отдушки, консерванты и антиоксиданты, которые также могут содержаться в композиции в соответствии с решением составителя композиции. Другие подходящие фармацевтически приемлемые инертные наполнители описаны в публикации "Remington's Pharmaceutical Sciences", Mack Pub. Co., New Jersey, 1991, которая включена в настоящее изобретение в качестве ссылки. Соединения, предлагаемые в настоящем изобретении, можно вводить людям и другим животным перорально, парентерально, сублингвально, с помощью аэрозоля или ингаляции спрея, ректально, интрацистернально, вагинально, внутрибрюшинно, трансбуккально или местно в виде разовых доз композиций, при необходимости содержащих обычные нетоксичные фармацевтически приемлемые носители,вспомогательные вещества и растворители. Местное введение также может включать применение средств чрескожного введения, таких как чрескожные пластыри или устройства для ионофореза. Термин"парентерально" при использовании в настоящем изобретении включает подкожные инъекции, внутривенные, внутримышечные, надчревные инъекции и вливание. Технологии приготовления композиций хорошо известны в данной области техники и описаны, например, в публикации Remington: The Science and Practice of Pharmacy, Mack Publishing Company, Easton,Pa., 19th Edition (1995). Фармацевтические композиции, предлагаемые для применения в настоящем изобретении, могут представлять собой стерильные апирогенные жидкие растворы или суспензии, капсулы с покрытием, суппозитории, лиофилизированные порошки, чрескожные пластыри и другие формы, известные в данной области техники. Препараты для инъекции, например стерильные водные или масляные суспензии для инъекции,можно приготовить с использованием известных в данной области техники подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекции также может представлять собой стерильный раствор, суспензию или эмульсию для инъекции в нетоксичном парентерально приемлемом разбавителе или растворителе, например раствор в 1,3-пропандиоле или 1,3 бутандиоле. В число приемлемых носителей и разбавителей, которые можно использовать, входят вода,- 18018083 раствор Рингера, соответствующий ФСША (Фармакопея США) и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используют стерильные нелетучие масла. Для этой цели можно использовать любое жидкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для приготовления средств для инъекции используют жирные кислоты, такие как олеиновая кислота. Композиции для инъекции можно стерилизовать, например,фильтрованием через задерживающий бактерии фильтр или путем введения стерилизующих средств и получить стерильные твердые композиции, которые перед использованием можно растворить или диспергировать в стерильной воде или другой стерильной среде для инъекции. Для продления воздействия лекарственного средства часто желательно замедлить всасывание лекарственного средства, введенного с помощью подкожной или внутримышечной инъекции. Это можно выполнить путем использования жидкой суспензии кристаллического или аморфного вещества, плохо растворимого в воде. В этом случае скорость всасывания лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и использующейся кристаллической формы. Альтернативно, замедлить всасывание введенного парентерально лекарственного средства можно путем растворения или суспендирования лекарственного средства в масляном носителе. Вводимые путем инъекции формы-депо готовят путем формирования микрокапсулирующих матриц лекарственного средства в биологически разлагающихся полимерах, таких как полилактид-полигликолид. Путем подбора отношения количества лекарственного средства к количеству матрицы и конкретного использующегося полимера можно регулировать скорость высвобождения лекарственного средства. Примеры других биологически разлагающихся полимеров включают поли(ортоэфиры) и поли(ангидриды). Вводимые путем инъекции композиции-депо также можно приготовить путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма. Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно приготовить путем смешивания соединений, предлагаемых в настоящем изобретении, с подходящими не оказывающими раздражающее воздействие инертными наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела, и поэтому плавятся в прямой кишке или полости влагалища и высвобождают активное соединение. Твердые дозированные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В таких твердых дозированных формах активное соединение смешивают по меньшей мере с одним инертным фармацевтически приемлемым инертным наполнителем или носителем,таким как цитрат натрия или дикальцийфосфат и/или а) наполнителями или средствами, увеличивающими объем, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и камедь акации, с) влагоудерживающими веществами, такими как глицерин, d) агентами, обеспечивающим распадаемость, такими как агар-агар, карбонат кальция, картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, е) агентами, замедляющими растворение, такими как парафин, f) ускорителями впитывания, такими как четвертичные аммониевые соединения, g) смачивающими агентами, такими как, например, пропанол и моностеарат гликоля, h) впитывающими средствами, такими как каолин и бентонитовая глина и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль дозированная форма также может включать буферные агенты. Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в заполненных капсулах из мягкого или твердого желатина с применением таких инертных наполнителей,как лактоза или молочный сахар, а также обладающие большой молекулярной массой полиэтиленгликоли и т.п. Твердые дозированные формы в виде таблеток, драже, капсул, пилюль и гранул можно изготовить с покрытиями или оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в технологии приготовления фармацевтических средств. Они необязательно могут содержать агенты, придающие непрозрачность, а также могут обладать таким составом, чтобы активный ингредиент (ингредиенты) высвобождался только или предпочтительно на определенном участке кишечника,необязательно в замедленном режиме. Примеры веществ, которые можно использовать для таких целей,включают полимерные вещества и воска. Активные соединения также можно использовать в микрокапсулированном виде с одним или большим количеством инертных наполнителей, указанных выше. Твердые дозированные формы в виде таблеток, драже, капсул, пилюль и гранул можно изготовить с покрытиями или оболочками, такими как энтеросолюбильные покрытия, покрытия, регулирующие высвобождение, и другие покрытия, хорошо известные в технологии приготовления фармацевтических средств. В таких твердых дозированных формах активное соединение можно смешать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие дозированные формы могут включать, что является обычной практикой, дополнительные вещества, не являющиеся инертными разбавителями, например смазывающие вещества для таблеток и другие средства, использующиеся в таблетках, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль дозированные формы также могут включать буферные агенты. Они необязательно могут содержать агенты, придающие непрозрачность, а также могут обладать таким составом, чтобы активный ингредиент (ингредиенты) высвобождался только или предпочтительно на определенном участке кишечника, необязательно в замедленном режиме. Примеры веществ, которые можно использовать для таких целей, включают полимерные вещества и воска. Жидкие дозированные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям жидкие дозированные формы могут содержать инертные разбавители, обычно использующиеся в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, EtOAc, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности,хлопковое, арахисовое, кукурузное, из зародышей, оливковое, касторовое, кунжутное масла), глицерин,тетрагидрофурфуриловый спирт, полиэтиленгликоли, и сложные эфиры сорбита и жирных кислот и их смеси. Кроме инертных разбавителей композиции для перорального введения также могут содержать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты,подсластители, вкусовые добавки и отдушки. Дозированные формы для местного или чрескожного введения соединений, предлагаемых в настоящем изобретении, включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, формы для ингаляции и пластыри. Активный компонент в стерильных условиях смешивают с фармацевтически приемлемым носителем и любыми консервантами или буферными веществами, которые могут потребоваться. Офтальмологические композиции, глазные капли и т.п. также входят в объем настоящего изобретения. Мази, пасты, кремы и гели в дополнение к активному соединению,предлагаемому в настоящем изобретении, могут содержать инертные наполнители, такие как животные и растительные жиры, масла,воска, парафины, крахмал, трагакантовую камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Композиции, предлагаемые в настоящем изобретении, также можно приготовить для введения в виде жидкого аэрозоля или сухого порошка для вдыхания. Жидкие аэрозольные композиции можно измельчать до частиц такого размера, чтобы они могли попадать в концевые и дыхательные бронхиолы. Аэрозольные композиции можно вводить с помощью устройств, формирующих аэрозоли, таких как струйное устройство, колеблющаяся пористая пластинка или ультразвуковое распыляющее устройство,предпочтительно выбранное из числа способных формировать частицы аэрозоля, обладающие средним диаметром, в основном находящимся в диапазоне от 1 до 5 мкм. Кроме того, предпочтительно, чтобы композиция обладала сбалансированной осмоляльностью, ионной силой и концентрацией хлорида и наименьшим объемом, из которого в инфицированное положение можно ввести эффективную дозу соединений, предлагаемых в настоящем изобретении. Кроме того, предпочтительно, чтобы аэрозольная композиция не оказывала неблагоприятное воздействие на функционирование дыхательных путей и не приводила к нежелательным побочным эффектам. Формирующие аэрозоли устройства, пригодные для введения аэрозольных композиций, включают,например, струйные, содержащие колеблющуюся пористую пластинку, или ультразвуковые распыляющие устройства и ингаляторы для сухих порошков с электропитанием, которые способны распылять композиции, предлагаемые в настоящем изобретении, с образованием частиц аэрозоля, обладающих размером, в основном находящимся в диапазоне 1-5 мкм. Выражение "в основном" означает, что не менее 70%, но предпочтительно более 90% всех образовавшихся частиц аэрозоля обладают размером, находящимся в диапазоне 1-5 мкм. Струйное распыляющее устройство действует за счет давления воздуха, который разделяет жидкий раствор на капельки аэрозоля. Распыляющие устройства, содержащие колеблющуюся пористую пластинку, действуют за счет звуковой волны, образуемой колеблющейся пористой пластинкой, которая экструдирует капельки растворителя через пористую пластинку. Ультразвуковое распыляющее устройство действует с помощью пьезоэлектрического кристалла, который с помощью сдвигового усилия разделяет жидкость на капельки аэрозоля. Имеются различные подходящие устройства, включая, например, содержащие колеблющуюся пористую пластинку распыляющие устройства(Medic-Aid Ltd., West Sussex, England), струйные распыляющие устройства PARI LC и PARI LC STAR(Omron Healthcare, Inc., Vernon Hills, Illinois). Соединения, предлагаемые в настоящем изобретении, также можно приготовить для использования в виде порошков и спреев местного действия, которые в дополнение к соединениям, предлагаемым в настоящем изобретении, могут содержать инертные наполнители, такие как лактозу, тальк, кремниевую кислоту, гидроксид алюминия, силикаты кальция и порошкообразный полиамид или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды. Чрескожные пластыри обладают тем дополнительным преимуществом, что обеспечивают регулируемое введение соединения в организм. Такие дозированные формы можно приготовить путем растворения или диспергирования соединения в подходящей среде. Для увеличения потока соединения через кожу также можно использовать средства, улучшающие впитывание. Скорость можно регулировать путем использования регулирующей скорость мембраны или путем диспергирования соединения в полимерной матрице или геле. Соединения, предлагаемые в настоящем изобретении, также можно вводить в виде липосом. Как известно в данной области техники, липосомы обычно получают из фосфолипидов или других липидов. Липосомы формируются моно- или многослойными гидратированными жидкими кристаллами, которые диспергированы в водной среде. Можно использовать любой нетоксичный физиологически приемлемый и подвергающийся метаболизму липид, способный образовывать липосомы. Композиции, предлагаемые в настоящем изобретении, в дополнение к соединению, предлагаемому в настоящем изобретении, могут содержать стабилизаторы, консерванты, инертные наполнители и т.п. Предпочтительными липидами являются фосфолипиды и фосфатидилхлориды (лецитины), натуральные и синтетические. Методики приготовления липосом известны в данной области техники; см., например,публикацию Prescott (ed.), "Methods in Cell Biology," Volume XIV, Academic Press, New York, 1976, p. 33et seq. Эффективные количества соединений, предлагаемых в настоящем изобретении, обычно представляют собой любые количества, достаточные для ингибирования активности PI3K, обнаруживаемого с помощью любой из методик исследования, описанных в настоящем изобретении, с помощью других методик исследования активности PI3K, известных специалистам с общей подготовкой в данной области техники, или обнаруживаемого по подавлению или ослаблению симптомов рака. Количество активного ингредиента, которое можно объединить с носителями с получением разовой дозированной формы, будет меняться в зависимости от подвергающегося лечению реципиента и конкретного пути введения. Однако следует понимать, что точная доза для любого конкретного пациента будет зависеть от множества факторов, включая активность конкретного использующегося соединения, возраста, массы тела, общего состояния здоровья, пола, диеты, времени введения, пути введения, скорости выведения, комбинации лекарственных средств и тяжести конкретного заболевания, подвергающегося лечению. В каждом случае терапевтически эффективное количество можно легко определить с помощью стандартных исследований и на основании своей профессиональной подготовки решение принимает лечащий врач. В способах лечения, предлагаемых в настоящем изобретении, рост опухоли ослабляется или предупреждается у пациента, такого как человек или низшее млекопитающее, путем введения пациенту терапевтически эффективного количества соединения, предлагаемого в настоящем изобретении, в таких количествах и в течение такого времени, которые необходимы для получения необходимого результата."Терапевтически эффективное количество" соединения, предлагаемого в настоящем изобретении, означает количество соединения, достаточное для борьбы с ростом опухоли при разумном соотношении польза/риск, относящемся к любому медикаментозному лечению. Однако следует понимать, что полную суточную дозу соединений и композиций, предлагаемых в настоящем изобретении, будет определять лечащий врач на основании тщательного медицинского анализа. Конкретная терапевтически эффективная доза для любого конкретного пациента будет зависеть от множества факторов, включая подвергающееся лечению нарушение и тяжесть нарушения, активность конкретного использующегося соединения,конкретную использующуюся композицию, возраст, массу тела, общее состояние здоровья, пол и диету пациента, время введения, путь введения и скорость выведения конкретного использующегося соединения, длительность лечения, лекарственные средства, использующиеся в комбинации или совместно с конкретным использующимся соединением, и аналогичные факторы, хорошо известные в медицине. Терапевтически эффективная доза обычно представляет собой полную суточную дозу, вводимую реципиенту в виде одной или разделенных доз в количествах, которые могут составлять, например, от 0,001 до 1000 мг/(кг массы тела) в сутки и более предпочтительно от 1,0 до 30 мг/(кг массы тела) в сутки. Разовая доза композиции может составлять доли таких количеств, так чтобы в сумме они образовывали суточную дозу. Обычно режимы лечения, предлагаемые в настоящем изобретении, включают введение пациенту, нуждающемуся в таком лечении, от примерно 10 до примерно 2000 мг в сутки соединения (соединений), предлагаемого в настоящем изобретении, в виде одной или нескольких доз. Соединения могут быть использованы в виде набора, который включает одно или большее количество соединений, предлагаемых в настоящем изобретении. Типичные наборы включают ингибитор PI3K,предлагаемый в настоящем изобретении (например, соединение формулы I) и листок-вкладыш или другую маркировку, содержащую указания по лечению клеточного пролиферативного заболевания путем введения ингибирующего PI3K количества соединения. Термин "набор" означает контейнер для размещения фармацевтических композиций и также может включать разделенные контейнеры, такие как разделенный флакон или разделенный пакет из фольги. Контейнер может обладать любой обычной формой, известной в данной области техники, и может быть изготовлен из любого фармацевтически приемлемого материала, например из бумаги, или представлять собой картонную коробку, стеклянный или пластмассовый флакон или банку, повторно закрывающийся пакет (например, для помещения таблеток, укладываемых в другой контейнер) или блистерную упаков- 21018083 ку, содержащую отдельные дозированные формы, "выдавливаемые" в соответствии с режимом лечения. То, какой контейнер применяют, зависит от конкретной использующейся дозированной формы, например стандартную картонную коробку обычно не используют для жидкой суспензии. Для продажи одной дозированной формы можно использовать более одного контейнера в одной упаковке. Например, таблетки могут находиться во флаконе, который сам помещен в коробку. Примером такого набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в области упаковок и широко используются для упаковки разовых фармацевтических дозированных форм (таблеток, капсул и т.п.). Блистерные упаковки обычно представляют собой лист относительно жесткого материала, покрытого фольгой, предпочтительно состоящей из прозрачной пластмассы. Во время изготовления упаковки в пластмассовой фольге формируют углубления. Размер и форма углублений соответствуют размеру и форме отдельных упаковываемых таблеток или капсул или они могут обладать размерами и формой, позволяющими поместить в них несколько упаковываемых таблеток и/или капсул. Затем таблетки или капсулы помещают в углубления и лист относительно жесткого материала прикрепляют к пластмассовой фольге со стороны, противоположной направлению, в котором формируют углубления. В результате таблетки или капсулы по отдельности или по несколько штук, в зависимости от того, что необходимо, герметизированы в углублениях между пластмассовой фольгой и листом. Предпочтительно, чтобы прочность листа была такой, чтобы таблетки или капсулы можно было извлечь из блистерной упаковки, нажимая пальцами на углубления, так чтобы в листе на месте углубления образовывалось отверстие. Таблетку или капсулу можно извлечь через это отверстие. Может быть желательным предоставление письменной памятки, которая содержит информацию и/или инструкции для врача, фармацевта или другого медицинского работника, или субъекта, например,в виде номеров, расположенных рядом с таблеткой или капсулой, и номера соответствуют дням, в которые следует принимать отмеченные таким образом таблетки или капсулы, или в виде карточки, которая содержит информацию такого же типа. Другим примером такой памятки является календарь, напечатанный на карточке, например, такой как "Первая неделя, понедельник, вторник", "Вторая неделя, понедельник, вторник, ". Очевидны другие варианты памятки. "Суточной дозой" может быть одна таблетка или капсула или несколько таблеток или капсул, которые следует принимать в течение суток. Если набор содержит отдельные композиции, то суточная доза одной или большего количества композиций набора может включать одну таблетку или капсулу, а суточная доза другой одной или большего количества композиций набора может включать несколько таблеток или капсул. Предпочтительно набор представляет собой раздаточное устройство, предназначенное для выдачи суточных доз по одной в порядке их применения. Предпочтительно, чтобы раздаточное устройство содержало памятку, чтобы облегчить соблюдение режима. Примером такой памятки является механический счетчик, который показывает количество выданных суточных доз. Другим примером такой памятки является работающая от батарейки память на микросхеме, соединенная с жидкокристаллическим дисплеем или с устройством, выдающим звуковой напоминающий сигнал, которое, например, выводит дату приема последней дозы и/или напоминает о том, когда необходимо принять следующую дозу. Наборы в дополнение к ингибитору PI3K могут содержать одно или большее количество дополнительных фармацевтически активных соединений. Предпочтительно, если дополнительным соединением является другой ингибитор PI3K или другое соединение, применимое для лечения рака, ангиогенеза или борьбы с ростом опухоли. Дополнительные соединения можно вводить в той же дозированной форме,что и ингибитор PI3K, или в разных дозированных формах. Аналогичным образом, дополнительные соединения можно вводить в то же время, что и ингибитор PI3K, или в разные моменты времени. Настоящее изобретение будет лучше понято с помощью представленных ниже примеров, которые приведены для иллюстрации, а не для ограничения настоящего изобретения. Примеры В приведенных ниже примерах соединения, предлагаемые в настоящем изобретении, синтезировали по методикам, описанным в настоящем изобретении, или по другим методикам, которые известны в данной области техники. Соединения и/или промежуточные продукты характеризовали с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Waters Millenium с модулем разделения 2695 Separation Module (Milford, MA). Для анализа использовали колонки Alltima C18 с обращенной фазой, 4,650 мм, скорость потока 2,5 мл/мин, выпускающиеся фирмой Alltech (Deerfield, IL). Использовали элюирование в градиентном режиме, обычно начиная от смеси 5% ацетонитрил/95% вода и заканчивая 100% ацетонитрилом с длительностью режима, составляющей 40 мин. Все растворители, содержащие 0,1% трифторуксусной кислоты (ТФК). Соединения детектировали по поглощению в ультрафиолетовой (УФ) области спектра при длине волны 220 или 254 нм. Использовали растворители для ВЭЖХ, выпускающиеся фирмами Burdick and Jackson (Muskegan, MI) или Fisher Scientific(Pittsburgh, PA). В некоторых случаях чистоту определяли с помощью тонкослойной хроматографии(ТСХ) с использованием стеклянных или пластмассовых пластин, покрытых силикагелем, таких как, например, гибкие пластины Baker-Flex Silica Gel 1B2-F. Данные ТСХ легко получали путем визуального детектирования при ультрафиолетовом освещении или путем использования хорошо известной методики окрашивания парами йода или различных других методик окрашивания. Масс-спектрометрические исследования проводили на одном из двух приборов для ЖХ/МС: WatersSystem (Alliance HT HPLC и Micromass ZQ масс-спектрометр; колонка: Eclipse XDB-C18, 2,150 мм; система растворителей: 5-95% (или 35-95%, или 65-95%, или 95-95%) ацетонитрил в воде с прибавлением 0,05% ТФК; скорость потока 0,8 мл/мин; диапазон молекулярных масс 200-1500; разность потенциалов на конусе 20 В; температура колонки 40C), или Hewlett Packard System (Series 1100 HPLC; колонка:Eclipse XDB-C18, 2,150 мм; система растворителей: 1-95% ацетонитрил в воде с прибавлением 0,05% ТФК; скорость потока 0,8 мл/мин; диапазон молекулярных масс 150-850; разность потенциалов на конусе 50 В; температура колонки 30C). Приведенные массы относятся к протонированным исходным ионам. Исследования с помощью ЖХ/МС проводили на приборе Hewlett Packard (НР 6890 Series газовый хроматограф с селективным по массе детектором 5973; инжектируемый объем: 1 мкл; начальная температура колонки: 50C; конечная температура колонки: 250C; время линейного повышения: 20 мин; скорость потока газа: 1 мл/мин; колонка: 5% фенилметилсилоксан, Model No. HP 190915-443, размеры: 30,0250,25 м). Исследования с помощью ядерного магнитного резонанса (ЯМР) проводили для некоторых соединений на приборе Varian 300 МГц NMR (Palo Alto, CA). В качестве стандарта использовали триметилсилан или известный химический сдвиг растворителя. Некоторые образцы соединений исследовали при повышенных температурах (например, 75C), чтобы повысить растворимость образца. Чистоту некоторых соединений, предлагаемых в настоящем изобретении, исследовали с помощью элементного анализа (Desert Analytics, Tucson, AZ). Температуры плавления определяли на приборе Laboratory Devices Mel-Temp apparatus (Holliston,MA). Препаративные разделения проводили с помощью хроматографической системы Flash 40 и KP-Sil,60A (Biotage, Charlottesville, VA) или с помощью колоночной флэш-хроматографии с использованием силикагеля (230-400 меш) в качестве насадки, или с помощью ВЭЖХ с использованием Waters 2767Sample Manager, C-18 колонки с обращенной фазой, 3050 мм, скорость потока 75 мл/мин. Типичными растворителями, использованными для системы Flash 40 Biotage и колоночной флэш-хроматографии,являлись дихлорметан, метанол, этилацетат, гексан, ацетон, водный раствор аммиака (или гидроксид аммония) и триэтиламин. Типичными растворителями, использованными для ВЭЖХ с обращенной фазой, являлись ацетонитрил в разных концентрациях и вода с прибавлением 0,1% трифторуксусной кислоты. Следует понимать, что органические соединения, предлагаемые в настоящем изобретении, могут обладать таутомерией. Поскольку химические структуры в настоящей заявке могут представлять только одну из возможных таутомерных форм, следует понимать, что настоящее изобретение включает любую таутомерную форму изображенной структуры. Следует понимать, что настоящее изобретение не ограничивается вариантами осуществления, представленными в настоящем изобретении для иллюстрации, а включает все его формы, соответствующие объему приведенного выше описания. АббревиатураNMP - N-метил-2-пирролидон; КТ - комнатная температура; ТГФ - тетрагидрофуран. Общие методики синтеза ингибиторов PI3K Приведены методики получения соединений формулы I. Эти методики включают реакцию 4 галоген-2-морфолинопиримидина с замещенной пиридинильной или пиримидинильной группой, содержащей реакционноспособный сложноэфирный бороновый заместитель, в присутствии палладиевого катализатора. В одном варианте осуществления замещенная пиридинильная или пиримидинильная группа,содержащая реакционноспособный сложноэфирный бороновый заместитель, содержит группу -NH2 в пара-положении к сложноэфирной бороновой группе. В другом варианте осуществления замещенная пиридинильная или пиримидинильная группа, содержащая реакционноспособный сложноэфирный боро- 23018083 новый заместитель, содержит группу -NH2 в пара-положении к сложноэфирной бороновой группе и другой не являющийся водородом заместитель - в орто-положении к сложноэфирной бороновой группе. В некоторых вариантах осуществления не являющийся водородом заместитель представляет собой -CF3,-CN, -NH2, галоген или замещенный или незамещенный C1-C3-алкил. В другом варианте осуществления 4-галоген-2-морфолинопиримидиновая группа представляет собой 4-галоген-6-гетероциклил-2-морфолинопиримидиновую группу. В другом варианте осуществления 4-галоген-2-морфолинопиримидиновая группа представляет собой 4-галоген-6-гетероциклилокси-2 морфолинопиримидиновую группу. В другом варианте осуществления 4-галоген-2 морфолинопиримидиновая группа представляет собой 4-галоген-6-гетероариламино-2 морфолинопиримидиновую группу. В другом варианте осуществления 4-галоген-2 морфолинопиримидиновая группа представляет собой 4-хлор-2,6-диморфолинопиримидин. В другом варианте осуществления пиридинилбороновый сложный эфир представляет собой 4(трифторметил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин-2-амин. В другом варианте осуществления палладиевым катализатором является аддукт Pd(dppf)Cl2 с дихлорметаном. В другом варианте осуществления 4-галоген-6-гетероциклил-2-морфолинопиримидиновую группу получают по реакции гетероциклильной группы с 4,6-дигалоген-2-морфолинопиримидиновой группой. В другом варианте осуществления 4-хлор-2,6-диморфолинопиримидиновую группу получают по реакции 4,6-дихлор-2-морфолинопиримидин с морфолином. В другом варианте осуществления 4,6-дихлор-2 морфолинопиримидиновую группу получают по реакции 2-морфолинопиримидин-4,6-диола с POCl3. В другом варианте осуществления 2-морфолинопиримидин-4,6-диол получают по реакции морфолин-4 карбоксамидина с диэтилмалонатом в присутствии основания, такого как этоксид натрия. В другом варианте осуществления замещенную пиридинильную или пиримидинильную группу, содержащую реакционноспособный сложноэфирный бороновый заместитель, получают по реакции замещенной пиридинильной или пиримидинильной группы, содержащей бромидный заместитель, с дибороновым сложным эфиром, таким как 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)1,3,2-диоксаборолан. В другом варианте осуществления замещенную пиридинильную или пиримидинильную группу, содержащую бромидный заместитель, получают по реакции замещенной пиридинильной или пиримидинильной группы с N-бромсукцинимидом (NBS). В другом варианте осуществления настоящее изобретение относится к способу получения 4-хлор 2,6-диморфолинопиримидина, включающему реакцию морфолина с 2,4,6-трихлорпиримидином в подходящем растворителе. В более предпочтительном варианте осуществления растворителем является полярный апротонный растворитель. Еще более предпочтительно, если растворителем является ТГФ. В другом более предпочтительном варианте осуществления 4-хлор-2,6-диморфолинопиримидин прибавляют в течение не менее 10 мин, или не менее 20 мин, или 30 мин к раствору, содержащему морфолин. Альтернативно, морфолин прибавляют к раствору, содержащему 4-хлор-2,6-диморфолинопиримидин. Еще более предпочтительно, если раствор охлаждают до температуры ниже 20C, или ниже 10C, или ниже 5C,или ниже 0C. Более предпочтительно, если во время или после прибавления 4-хлор-2,6 диморфолинопиримидина раствору дают нагреться до температуры выше 20C, или выше 25C, или выше 30C. В другом варианте осуществления после объединения морфолина и 4-хлор-2,6 диморфолинопиримидина реакцию останавливают путем прибавления водного раствора. Более предпочтительно, если не менее чем через 10 ч, или не менее чем через 20 ч, или не менее чем через 30 ч, или не менее чем через 40 ч, или не менее чем через 50 ч, или примерно через 64 ч после объединения морфолина и 4-хлор-2,6-диморфолинопиримидина реакцию останавливают путем прибавления водного раствора. Более предпочтительно, если после остановки реакции раствор очищают с помощью колоночной хроматографии. Еще более предпочтительно, если колонка содержит силикагель. В другом варианте осуществления 4-хлор-2,6-диморфолинопиримидин вводят в реакцию с 2-аминопиридильным или 2 аминопиримидильным фрагментом и получают соединение формулы III. Соединения, предлагаемые в настоящем изобретении, содержащие пиримидиновое ядро, такие как соединения формулы I, можно получить с помощью целого ряда методик, известных специалисту в данной области техники. В одной методике содержащие подходящие функциональные группы амины можно ввести в реакцию сочетания с 4,6-дихлор-2-морфолинопиримидином по реакциям нуклеофильного ароматического замещения или по реакции кросс-сочетания Бухвальда-Хартвига (Hartwig et al., Tetrahedron Letters 36, (1995) 3609), и Ar обозначает арильные или гетероарильные фрагменты. Затем для получения конечного продукта можно провести сочетание по Судзуки (Suzuki et al., Chem. Commun. (1979) 866) при известных условиях, например путем обработки содержащих функциональные группы бороновых эфиров по следующим схемам: Из 2,4,6-трибромпиримидина: реакция SNAr (или Бухвальда), содержащих функциональные группы ариламинов с 2,4,6-трибромпиримидином предпочтительно дает 4-замещенные продукты. Замещение морфолином в положение 2 после реакции Судзуки дает конечные аналоги пиримидина Альтернативно, можно использовать несколько сочетаний по Судзуки и получить арильные или гетероарильные группы, присоединенные непосредственно к пиримидиновому ядру в положениях 4 и 6; или можно сначала провести сочетание по Судзуки и затем провести реакцию нуклеофильного ароматического замещения или реакцию кросс-сочетания Бухвальда-Хартвига, как это показано на следующей схеме: Более предпочтительные методики синтеза соединений, предлагаемых в настоящем изобретении, в особенности соединений формулы I, приведены в представленных ниже методиках и примерах. Методика 1. Синтез 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2-иламина В сухую колбу объемом 500 мл прибавляли 2-амино-5-бромпиримидин (10 г, 57,5 ммоль), ацетат калия (16,9 г, 172 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2 диоксаборолан (16,1 г, 63,0 ммоль) и диоксан (300 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном(Pd(dppf)Cl2CH2Cl2) (2,34 г, 2,87 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 4 ч в атмосфере аргона. После охлаждения до комнатной температуры прибавляли EtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические экстракты промывали с помощью H2O (2300 мл), насыщенным раствором NaCl (300 мл), сушили над Na2SO4 и фильтровали через слой силикагеля толщиной 5 см. Дополнительное количествоEtOAc использовали для промывки продукта. После концентрирования растворителя неочищенное вещество обрабатывали смесью 1:3 дихлорметана с гексаном (40 мл), фильтровали, промывали гексаном и получали светло-желтое твердое вещество (8,5 г, 75%). ЖХ/МС (m/z): 140 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта во время ЖХ). 1 Н ЯМР (CDCl3):8,58 (s, 2H), 5,74 (s, 2H), 1,32 (s,12H). Методика 2. Синтез 2-аминометил-5-бромпиримидина Метиламин (2,0 М в метаноле, 40 мл, 80 ммоль) прибавляли к 5-бром-2-хлорпиримидину (5,6 г, 29,0 ммоль) в герметизируемом сосуде для проведения реакции. После выпускания газа в течение нескольких минут сосуд герметизировали, помещали позади защитного экрана и нагревали при 115C на масляной бане в течение 48 ч. После охлаждения летучие вещества удаляли в вакууме. Вещество растворяли вCH2Cl2 (200 мл) и промывали с помощью 1 М NaOH (40 мл). Водный слой дополнительно экстрагирова- 25018083 ли с помощью CH2Cl2 (250 мл). Объединенные органические вещества сушили над MgSO4, фильтровали и концентрировали и получали почти белое твердое вещество (5,1 г, 93%). ЖХ/МС (m/z): 188,0/190,0 В сухую колбу объемом 500 мл прибавляли 2-метиламино-5-бромпиримидин (9,5 г, 50,5 ммоль),ацетат калия (15,1 г, 154,4 ммоль), 4,4,5,5,-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)1,3,2-диоксаборолан (14,1 г, 55,5 ммоль) и диоксан (280 мл). Через раствор пропускали аргон в течение 15 мин и затем прибавляли аддукт 1,1'-бис-(дифенилфосфино)ферроценпалладий(II)хлорида с дихлорметаном (2,05 г, 2,51 ммоль). Реакционную смесь кипятили с обратным холодильником при 115 С на масляной бане в течение 4 ч в атмосфере аргона. После охлаждения до комнатной температуры прибавлялиEtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические вещества промывали с помощью H2O (2300 мл), насыщенным раствором NaCl (300 мл), сушили надNa2SO4, фильтровали и растворители удаляли в вакууме. Очистка с помощью хроматографии на SiO2(50% EtOAc/гексаны) давала почти белое твердое вещество (7,66 г, 64%). ЖХ/МС (m/z): 154 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта in situ во время ЖХ). 1H ЯМР (CDCl3):8,58 (s,2H), 5,56 (s, 1H), 3,02 (d, 3H), 1,32 (s, 12H). Методика 3. Синтез 5-бром-4-метилпиримидин-2-иламина К раствору 4-метилпиримидин-2-иламина (10,9 г, 100 ммоль) в хлороформе (400 мл) прибавляли Nбромсукцинимид (17,8 г, 100 ммоль). Раствор перемешивали в темноте в течение 15 ч и затем его прибавляли к CH2Cl2 (1400 мл), промывали с помощью 1 н. NaOH (3200 мл) и насыщенным раствором NaCl В сухую колбу объемом 1 л прибавляли 5-бром-4-метилпиримидин-2-иламин (18,8 г, 100 ммоль),ацетат калия (29,45 г, 300 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)1,3,2-диоксаборолан (26,7 г, 105 ммоль) и диоксан (500 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли аддукт 1,1'-бис-(дифенилфосфино)ферроценпалладий(II) хлорида с дихлорметаном (4,07 г, 5 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 18 ч в атмосфере аргона. После охлаждения до комнатной температуры прибавлялиEtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические экстракты промывали с помощью H2O (2300 мл), насыщенным раствором NaCl (300 мл), сушили надNa2SO4, концентрировали и очищали с помощью хроматографии на SiO2 (EtOAc в качестве элюента) и получали 18,1 г почти белого твердого вещества. По данным 1 Н ЯМР вещество представляло собой смесь состава 5:1 боронатного сложного эфира и 4-метилпиримидин-2-иламина в качестве побочного продукта. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС (m/z): 154 (МН+ бороновой кислоты,образовавшийся при гидролизе продукта in situ во время ЖХ). 1H ЯМР (CDCl3):8,52 (s, 1H), 5,14 (bs,2H), 2,56 (d, 3H), 1,32 (s, 12H). Методика 4. Синтез 5-бром-4-(трифторметил)-2-пиридиламина ляли N-бромсукцинимид (12,0 г, 67,4 ммоль). Раствор перемешивали в темноте в течение 2 ч и затем его прибавляли к CH2Cl2 (200 мл) и 1 н. NaOH (200 мл). После перемешивания слои разделяли и органический слой промывали насыщенным раствором NaCl (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью хроматографии на SiO2 (0-5% EtOAc/ В сухую колбу объемом 500 мл прибавляли 5-бром-4-(трифторметил)-2-пиридиламин (11,8 г, 49,0 ммоль), ацетат калия (14,4 г, 146,9 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан 2-ил)-1,3,2-диоксаборолан (13,6 г, 53,9 ммоль) и диоксан (300 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли аддукт 1,1'-бис-(дифенилфосфино)ферроценпалладий(II) хлорида с дихлорметаном (2,0 г, 2,45 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 8 ч в атмосфере аргона. После охлаждения до комнатной температуры диоксан удаляли в вакууме. Прибавляли EtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические экстракты концентрировали и неочищенное вещество частично очищали с помощью хроматографии на SiO2 (30-40% EtOAc/гексаны). После удаления растворителя прибавляли гексаны (75 мл); после обработки ультразвуком полученное твердое вещество отфильтровывали и сушили в высоком вакууме в течение 3 дней и получали 2,4 г почти белого твердого вещества. По данным 1 Н ЯМР вещество представляло собой смесь состава 5:1 боронатного сложного эфира и 2-амино-4 трифторметилпиридина в качестве побочного продукта. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС (m/z): 207 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта in situ во время ЖХ). 1 Н ЯМР (CDCl3):8,50 (s, 1H), 6,72 (s, 1H), 4,80 (bs, 2H), 1,34 (s, 12H). Методика 5. Синтез 5-бром-4-(трифторметил)пиримидин-2-амина К раствору 2-амино-4-трифторметилпиримидина (8,0 г, 49,1 ммоль) в хлороформе (300 мл) прибавляли N-бромсукцинимид (8,9 г, 50 ммоль). Раствор перемешивали в темноте в течение 16 ч и затем прибавляли дополнительное количество N-бромсукцинимида (4,0 г, 22,5 ммоль). После перемешивания в течение еще 4 ч раствор прибавляли к CH2Cl2 (200 мл) и 1 н. NaOH (200 мл). После перемешивания слои разделяли и органический слой промывали насыщенным раствором NaCl (100 мл), сушили над Na2SO4,фильтровали, концентрировали и получали 10,9 г (82%) 5-бром-4-(трифторметил)-2-пиримидиламина. ЖХ/МС (m/z): 242/244 (МН+). 1H ЯМР (CDCl3):8,52 (s, 1H), 5,38 (bs, 2H). Синтез 5-(4,4,5,5-тетраметил(1,3,2-диоксаборолан-2-ил-4-(трифторметил)пиримидин-2-иламина В сухую колбу объемом 500 мл прибавляли 5-бром-4-(трифторметил)-2-пиримидиламин (10,1 г,41,7 ммоль), ацетат калия (12,3 г, 125,2 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)-1,3,2-диоксаборолан (11,6 г, 45,9 ммоль) и диоксан (150 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли 1,1'-бис-(дифенилфосфино)ферроценпалладий(II) хлорид (1,7 г, 2,1 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 6 ч в атмосфере аргона. После охлаждения до комнатной температуры диоксан удаляли в вакууме. Прибавляли EtOAc (500 мл), полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические экстракты концентрировали и неочищенное вещество очищали с помощью хроматографии на SiO2 (30-40% EtOAc/гексаны) и получали 4,40 г почти белого твердого вещества. По данным 1 Н ЯМР вещество представляло собой смесь состава 1:1 боронатного сложного эфира и 2-амино-4 трифторметилпиримидина в качестве побочного продукта. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС (m/z): 208 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта in К раствору 4-хлор-2-пиридиламина (6,0 г, 46,7 ммоль) в хлороформе (180 мл) прибавляли Nбромсукцинимид (8,3 г, 46,7 ммоль). Раствор перемешивали в темноте в течение 2 ч и затем его прибавляли к CH2Cl2 (800 мл) и 1 н. NaOH (100 мл). После перемешивания слои разделяли и органический слой промывали с помощью насыщенного раствора NaCl (100 мл), сушили над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью хроматографии на SiO2 (25-35% В сухую колбу объемом 500 мл прибавляли 5-бром-4-хлор 2-пиридиламин (7,3 г, 35,8 ммоль), ацетат калия (10,3 г, 105 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2 диоксаборолан (10,1 г, 39,8 ммоль) и диоксан (150 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли аддукт 1,1'-бис-(дифенилфосфино)ферроценпалладий(II) хлорида с дихлорметаном(0,85 г, 1,04 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 6 ч в атмосфере аргона. После охлаждения до комнатной температуры диоксан удаляли в вакууме. Затем прибавляли EtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические экстракты концентрировали и неочищенное вещество очищали с помощью хроматографии на SiO2 (EtOAc в качестве элюента). После удаления растворителя прибавляли смесь 3:1 гексаны/CH2Cl2 (100 мл). После обработки ультразвуком полученное твердое вещество отфильтровывали и концентрировали в вакууме и получали 2,8 г белого твердого вещества. По данным 1 Н ЯМР вещество представляло собой смесь состава 10:1 боронатного сложного эфира и 2-амино-4-хлорпиридина в качестве побочного продукта. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС (m/z): 173(МН+ бороновой кислоты, образовавшийся при гидролизе продукта in situ во время ЖХ). 1 Н ЯМР К раствору 2,4-диаминопиримидина (1,0 г, 9,1 ммоль) в хлороформе (30 мл) прибавляли Nбромсукцинимид (1,62 г, 9,08 ммоль). Раствор перемешивали в темноте в течение 12 ч и затем его прибавляли к CH2Cl2 (150 мл) и 1 н. NaOH (50 мл). Образовавшееся твердое вещество отфильтровывали,промывали водой, концентрировали в вакууме и получали 1,4 г (74%) 5-бромпиримидин-2,4-диамина. ЖХ/МС (m/z): 189/191 (МН+). 1 Н ЯМР (ДМСО-d6) (ДМСО-диметилсульфоксид):7,78 (s, 1H), 6,58 (bs,2H), 6,08 (bs, 2H). Синтез 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиримидин-2,4-диамина В сухую колбу объемом 1 л прибавляли 5-бромпиримидин-2,4-диамин (30,0 г, 158,7 ммоль), ацетат калия (45,8 г, 466,7 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2 диоксаборолан (51,2 г, 202,2 ммоль) и диоксан (500 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли 1,1'-бис-(дифенилфосфино)ферроценпалладий(II)хлорид (2,5 г, 3,11 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 16 ч в атмосфере аргона. После охлаждения до комнатной температуры твердое неорганическое вещество отфильтровывали, промывали с помощью EtOAc (1 л). Органический фильтрат концентрировали в вакууме и к полученному твердому веществу прибавляли дихлорметан (1 л). После обработки ультразвуком твердое вещество отфильтровывали. Твердое вещество представляло собой дебромированный 2,4- 28018083 диаминопиримидин. Фильтрат, содержащий искомый боронатный сложный эфир, концентрировали в вакууме. К этому остатку прибавляли диэтиловый эфир (100 мл). После обработки ультразвуком раствор фильтровали, промывали дополнительным количеством диэтилового эфира (50 мл), полученное твердое вещество сушили в высоком вакууме и получали искомый 2,4-диаминопиримидил-5-боронатный сложный эфир (10,13 г, 27%). По данным 1 Н ЯМР вещество представляло собой смесь состава 4:1 2,4 диаминопиримидил-5-боронатного сложного эфира и 2,4-диаминопиримидина в качестве побочного продукта. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС (m/z): 155 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта in situ во время ЖХ). 1 Н ЯМР (CDCl3+CD3OD):8,16 (s, 1H), 1,34 (s, 12H). Методика 8. Синтез 4-метоксипиримидин-2-иламина К раствору 4,6-дихлор-2-аминопиримидина (5,0 г, 30,5 ммоль) в метаноле (100 мл) прибавляли 25% метоксид натрия (6,59 г, 30,5 ммоль). Раствор кипятили с обратным холодильником в течение 20 ч и затем метанол удаляли в вакууме. Остаток растворяли в EtOAc (350 мл), промывали с помощью H2O (100 мл) и насыщенным раствором NaCl (100 мл), сушили над Na2SO4, фильтровали, концентрировали и получали 4,4 г (90%) 4-хлор-6-метоксипиримидин-2-иламина. К раствору 4-хлор-6-метоксипиримидин-2-иламина (4,4 г, 27,7 ммоль) в EtOAc (200 мл) и этаноле(150 мл), прибавляли диизопропилэтиламин (9,6 мл, 55,3 ммоль) и 10% палладия на угле (2,9 г, 2,77 ммоль). Гетерогенный раствор перемешивали в атмосфере подаваемого из баллона H2 в течение 14 ч,затем раствор фильтровали через слой целита и летучие вещества удаляли в вакууме. Остаток растворяли в EtOAc (200 мл), промывали насыщенным раствором Na2CO3 (100 мл) и насыщенным раствором NaClN-бромсукцинимид (2,62 г, 14,7 ммоль). После перемешивания в темноте в течение 5 ч раствор прибавляли к CH2Cl2 (200 мл) и 1 н. NaOH (100 мл). После перемешивания слои разделяли и органический слой промывали насыщенным раствором NaCl (100 мл), сушили над Na2SO4, фильтровали, концентрировали и получали 2,88 г (96%) 5-бром-4-метоксипиримидин-2-иламина. ЖХ/МС (m/z): 204/206 (МН+). 1H ЯМР В сухую колбу объемом 200 мл прибавляли 5-бром-4-метоксипиримидин-2-иламин (2,88 г, 14,1 ммоль), ацетат калия (4,16 г, 42,4 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан 2-ил)-1,3,2-диоксаборолан (3,76 г, 14,8 ммоль) и диоксан (75 мл). Через раствор в течение 15 мин пропускали аргон и затем прибавляли аддукт 1,1'-бис-(дифенилфосфино)ферроценпалладий(II) хлорида с дихлорметаном (0,58 г, 0,71 ммоль). Реакционную смесь кипятили с обратным холодильником при 115C на масляной бане в течение 21 ч в атмосфере аргона. После охлаждения до комнатной температуры диоксан удаляли в вакууме. Прибавляли EtOAc (500 мл) и полученную взвесь обрабатывали ультразвуком и фильтровали. Дополнительное количество EtOAc (500 мл) использовали для промывки твердого вещества. Объединенные органические вещества концентрировали и неочищенное вещество очищали с помощью хроматографии на SiO2 (EtOAc в качестве элюента) и получали 2,4 г почти белого твердого вещества. По данным 1 Н ЯМР вещество представляло собой смесь состава 1:1 боронатного сложного эфира и 4-метоксипиримидин-2-иламина. Вещество использовали в последующих реакциях Судзуки. ЖХ/МС(m/z): 170 (МН+ бороновой кислоты, образовавшийся при гидролизе продукта in situ во время ЖХ). 1 Н ЯМР (CDCl3):8,42 (s, 1H), 5,22 (bs, 2H), 3,90 (s, 3H), 1,34 (s, 12H).
МПК / Метки
МПК: C07D 405/12, C07D 417/12, A61P 35/00, C07D 401/04, C07D 405/14, A61K 31/506, C07D 401/14
Метки: качестве, пиримидина, производные, применения, киназы, ингибиторов, применимые, способы
Код ссылки
<a href="https://eas.patents.su/30-18083-proizvodnye-pirimidina-primenimye-v-kachestve-ingibitorov-pi3-kinazy-i-sposoby-ih-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиримидина, применимые в качестве ингибиторов pi3 киназы, и способы их применения</a>
Предыдущий патент: Препаративная форма для лечения гиперактивности при дефиците внимания, фармацевтическая композиция на ее основе и способ лечения гиперактивности при дефиците внимания
Следующий патент: Виросомоподобные везикулы, содержащие антигены, производные от gp41, и их применение
Случайный патент: Композиция, содержащая антагонист рецептора прогестерона и чистый антиэстроген, предназначенная для профилактики и лечения гормонзависимых заболеваний












