Аминопиримидины в качестве syk ингибиторов
Номер патента: 22790
Опубликовано: 31.03.2016
Авторы: Машасек Мишелль Р., Андресен Брайан М., Берч Джейсон, Эллис Джон Майкл, Чайлдерс Калин Конрад, Сиу Тони, Робишо Жоэль С., Ли Чаоминь, О'бойл Брендан М., Гуэй Даниель, Ромео Эрик, Троттер Б.Уэсли, Готье Жак Ив, Фишер Кристиан, Ройтершан Майкл Х., Аррингтон Кеннет Л., Дюпон-Годе Кристина, Донофрио Энтони, Герин Дэвид Джозеф, Хайдл Эндрю М., Отте Райан Д., Петрокки Алессия, Лим Чжонгвон, Коте Бернар, Нортруп Алан Б., Фурнье Жан-Франсуа, Алтман Майкл Д., Каттар Соломон, Ноулес Сандра Ли, Чжоу Хуа, Таока Брендон М., Ди Франческо Мария Эмилия
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
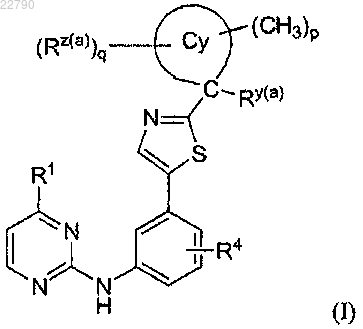
в которой
р равно 0-4;
q равно 0, 1 или 2;
Су выбран из С4-7циклоалкила, оксетанила, пирролидинила, пиперидинила и азепанила;
R1 выбран из Н, C1-4алкила, С1-4галогеналкила, С3-6циклоалкила и OC1-4алкила;
R4 выбран из Н, С1-4алкила и С3-4циклоалкила;
Ry(a) представляет собой ОН;
Rz(a) выбран из (А) С1-4алкила, необязательно замещенного одной-тремя группами, независимо выбранными из ОН, NH2, CN, CO2Ra(a) и CONH2, (В) С1-3фторалкила, (С) галогена, (D) CN, (E) СОС1-4алкила (необязательно замещенного одной или двумя группами, независимо выбранными из ORa(a), CN, CO2Ra(a), CONRa(a)Ra(a) и NRa(a)Ra(a)), (F) СО-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из этинила, CO2Ra(a), CN, F и ОН), (G) СО-С3-6циклоалкила (необязательно замещенного ОН или CO2Ra(a)), (H) С0-3алкил-CO2Ra(a), (I) -C(O)NRb(a)Rc(a), (J) -ORa(a), (K) -OC(O)Ra(a), (L) -NRb(a)Rc(a), (M) -NHC(O) С1-4алкила (необязательно замещенного одной-тремя ОН или CONRa(a)Ra(a)), (N) -NHSO2C1-3алкила, (О) -NHSO2NH2, (Р) оксо; (Q) 1,3,4-оксадиазол-2(3H)-она, (R) 1,2,4-оксадиазол-5(4Н)-она, (S) SO2NH2, (Т) SO2C1-3алкилa, (U) SO2C1-3галогеналкила и (V) SO2Ph;
Ra(a) представляет собой Н или C1-4алкил;
Rb(a) и Rc(a) независимо выбраны из (А) Н, (В) С3-6циклоалкила, необязательно замещенного ОН, (С) гетероарила, выбранного из имидазолила, пиридила и индолила, (D) тетрагидрофуранила, (Е) бензила, (F) фенила, необязательно замещенного одной или двумя группами, независимо выбранными из (СН2)0-2ОН и F, (G1) С1-4алкила и (G2) С1-4галогеналкила, в которых каждый из (G1) и (G2) необязательно замещен одной-тремя группами, независимо выбранными из (i) ОН, (ii) С3-6циклоалкила, необязательно замещенного одной или двумя группами, независимо выбранными из С1-4алкила, CONH2, CO2H и СН2ОН, (iii) CONH2, (iv) SO2NH2, (v) SO2C1-4алкила, (vi) CN, (vii) ОС1-4алкила, (viii) CO2H, (ix) NRa(a)C(О)С1-4алкила, (х) фенила, необязательно замещенного одной или двумя группами, независимо выбранными из (СН2)0-2OH, SO2NH2, CF3, F и Cl, (xi) 1-пирролидинила, необязательно замещенного оксо, (xii) 1-имидазолидинила, необязательно замещенного оксо, (xiii) 1-пиперидинила, необязательно замещенного оксо, и (xiv) 4-морфолинила; или
Rb(a) и Rc(a) вместе с атомом азота, с которым они соединены, образуют 6- или 7-членный гетероцикл, возможно содержащий 1 дополнительный гетероатом, выбранный из N, О и S, где упомянутый гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из оксо, CN, (СН2)0-2ОН, ацетила, бензила, SO2C1-4алкила, CONH2, метоксиметила, карбоксиметила, CO2Ra(a) и С1-4алкила.
2. Соединение по п.1, в котором Су представляет собой циклогексил.
3. Соединение по п.2, в котором р равно 0, 1 или 2; q равно 1 и Rz(a) выбран из CO2Ra(a), CONRb(a)Rc(a) и NHC(О)С1-4алкила, необязательно замещенного ОН.
4. Соединение по п.1, имеющее формулу (Ia), или его фармацевтически приемлемая соль
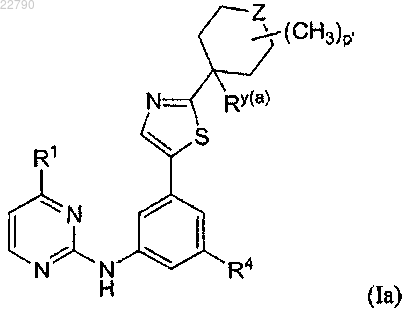
в которой
Z представляет собой -CRz(b)Rz(c)-, -N(Rz(d))-, -CH2-N(Rz(d))- или -NHC(O)-;
p' равно 0-3, при условии, что р' равно 0, когда Z представляет собой -NHC(O)-;
Rz(b) выбран из (А) Н, (В) С1-4алкила, необязательно замещенного одной-тремя группами, независимо выбранными из ОН, NH2, CN, CO2Ra(a) и CONH2, (С) галогена, (D) CN, (E) -C(O)Ra(a), (F) -C(O)2Ra(a), (G) -C(O)NRb(a)Rc(a), (H) -ORa(a), (I) -OC(O)Ra(a), (J) -NRb(a)Rc(a), (K) -NHC(О)С1-4алкила (необязательно замещенного OH), (L) -NHSO2C1-3алкила, (М) -NHSO2NH2, (N) 1,3,4-оксадиазол-2(3H)-она и (О) 1,2,4-оксадиазол-5(4Н)-она;
Rz(c) представляет собой Н или метил;
Rz(d) выбран из (А) Н, (В) C1-4алкила, необязательно замещенного группой, выбранной из CO2Ra(a) и CONH2, (С) C1-3фторалкила, (D) COC1-4алкила (необязательно замещенного одной или двумя группами, независимо выбранными из ORa(a), CN, CO2Ra(a), CONRa(a)Ra(a) и NRa(a)Ra(a)), (E) СО-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из этинила, CO2Ra(a), CN, F и ОН), (F) СО-С3-6циклоалкила (необязательно замещенного ОН или CO2Ra(a)), (G) С0-3алкил-CO2Ra(a), (H) CONRa(a)Ra(a), (I) CONH-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из С1-4алкила, CN и Cl), (J) CONH-С3-6циклоалкила, (K) SO2NH2, (L) SO2C1-3алкила, (М) SO2C1-3галогеналкила и (N) SO2Ph; и
R1, R4, Ry(a), Ra(a), Rb(a) и Rc(a) представляют собой, как определено в п.1.
5. Соединение по п.4, в котором Z представляет собой -CHRz(b)-, и р' равно 0, 1 или 2; и Rz(b) представляет собой СО2Н, CONHRb(a), NHC(O)С1-4алкил (необязательно замещенный ОН).
6. Соединение по п.4, в котором Rz(b) представляет собой СО2Н, CONH2 или NHC(О)С1-4алкил (необязательно замещенный ОН).
7. Соединение по п.1, выбранное из группы, состоящей из
(1R,4S)-4-[5-(3-циклопропил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2-диметилциклогексанкарбоновой кислоты;
(1S,4R)-4-[5-(3-циклопропил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2-диметилциклогексанкарбоновой кислоты;
(1S,4R)-4-гидрокси-2,2-диметил-4-{5-[3-метил-5-(4-метилпиримидин-2-иламино)фенил]-1,3-тиазол-2-ил}циклогексанкарбоновой кислоты;
(1S,4R)-4-[5-(3-{[4-(дифторметил)пиримидин-2-ил]амино}-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2-диметилциклогексанкарбоновой кислоты;
(1S,4R)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(пропан-2-илокси)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоксамида;
транс-4-гидрокси-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
цис-4-гидрокси-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
5-гидрокси-5-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]азепан-2-она;
(1S,4R)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
(1R,4S)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
(1S,4S)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
(1R,4R)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновой кислоты;
(1R,4S)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоксамида и
(1S,4R)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоксамида
или их фармацевтически приемлемых солей.
8. Соединение по п.5 или его фармацевтически приемлемая соль, где Rz(b) представляет собой СО2Н.
9. Соединение по п.1, которое представляет собой (1S,4R)-4-гидрокси-2,2-диметил-4-[5-(3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил)-1,3-тиазол-2-ил]циклогексанкарбоновую кислоту, или его фармацевтически приемлемая соль.
10. Соединение по п.9 в форме свободной кислоты.
11. Соединение по п.1, которое представляет собой (1S,4R)-4-гидрокси-2,2-диметил-4-{5-[3-метил-5-(4-метилпиримидин-2-иламино)фенил]-1,3-тиазол-2-ил}циклогексанкарбоновую кислоту, или его фармацевтически приемлемая соль.
12. Соединение по п.1, которое представляет собой 4-гидрокси-2,5-диметил-4-(5-{3-метил-5-[(4-метилпиримидин-2-ил)амино)]фенил]-1,3-тиазол-2-ил}циклогексанкарбоновую кислоту, или его фармацевтически приемлемая соль.
13. Соединение по п.1, которое представляет собой 4-гидрокси-2,5-диметил-4-[5-{3-метил-5-{[4-(трифторметил)пиримидин-2-ил]амино}фенил}-1,3-тиазол-2-ил]циклогексанкарбоновую кислоту, или его фармацевтически приемлемая соль.
14. Фармацевтическая композиция для лечения или предотвращения SYK(тирозинкиназа селезенки)-опосредованного заболевания, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
15. Лекарственное средство для лечения или предотвращения SYK(тирозинкиназа селезенки)-опосредованного заболевания, содержащее терапевтически эффективное количество соединения по п.1.
16. Лекарственное средство по п.15, в котором SYK-опосредованное заболевание представляет собой ревматоидный артрит.
17. Лекарственное средство по п.15, в котором SYK-опосредованное заболевание представляет собой рак.
Текст
Алтман Майкл Д., Андресен Брайан М., Аррингтон Кеннет Л., Чайлдерс Калин Конрад, Ди Франческо Мария Эмилия, Донофрио Энтони, Эллис Джон Майкл, Фишер Кристиан,Герин Дэвид Джозеф, Хайдл Эндрю Настоящее изобретение относится к новым пиримидинаминам формулы (I), которые являются потенциальными ингибиторами SYK (тирозинкиназы селезенки) и являются пригодными для лечения и предотвращения заболеваний, опосредованных упомянутым ферментом, таких как рак и ревматоидный артрит. Кроме того, настоящее изобретение относится к фармацевтической композиции и лекарственному средству, содержащим такие соединения(71)(73) Заявитель и патентовладелец: МЕРК ШАРП ЭНД ДОМЭ КОРП. Уровень техники Тирозинкиназа селезенки (SYK) представляет собой белковую тирозинкиназу, которую описывают в качестве ключевого медиатора иммунорецепторной передачи сигнала у хозяина воспалительных клеток, включая тучные клетки, В-клетки, макрофаги и нейтрофилы. Данные иммунорецепторы, включая Fc рецепторы и рецептор В-клеток, являются важными и при аллергических заболеваниях, и при аутоиммунных заболеваниях, опосредованных антителами, и, таким образом, фармакологическое вмешательство в функционирование SYK может предположительно лечить данные заболевания. Аллергический ринит и астма представляют собой заболевания, связанные с реакциями гиперчувствительности и воспалительными осложнениями, включающими большое число типов клеток, включая тучные клетки, эозинофилы, Т-клетки и дендритные клетки. После воздействия аллергена иммуноглобулиновые рецепторы с высокой аффинностью к IgE и IgG становятся перекрестно-связанными и активируют последующие процессы в тучных клетках и других типах клеток, приводя к высвобождению провоспалительных медиаторов и кининов дыхательных путей. В тучных клетках, например, IgE рецепторное перекрестное связывание аллергеном приводит к высвобождению медиаторов, включая гистамин из заранее сформированных гранул, а также к синтезу и высвобождению недавно синтезированных липидных медиаторов, включая простагландины и лейкотриены.SYK киназа представляет собой несвязанную с рецептором тирозинкиназу, которая является важной в преобразовании последующих клеточных сигналов, связанных с перекрестно-связаннымиFc.epsilon.R1 и/или Fc.epsilon.R1 рецепторами, и располагается в начале сигнального каскада. В тучных клетках, например, ранняя последовательность Fc.epsilon.R1 сигнализирования после перекрестного связывания аллергена с рецептор-IgE комплексами включает вначале Lyn (тирозинкиназа Src семейства) и затем SYK. Следовательно, можно было бы ожидать, что ингибиторы SYK активности ингибируют все последующие сигнальные каскады, посредством этого ослабляя немедленную аллергическую реакцию и побочные эффекты, вызванные высвобождением провоспалительных медиаторов и кининов (Wong et al. 2004, Expert Opin. Investig. Drugs (2004), 13(7), 743-762). Недавно было показано, что SYK киназный ингибитор R112 (Rigel), вводимый интраназально в фазе I/II исследования для лечения аллергического ринита, давал статистически значимое снижение PGD2,ключевого иммунного модулятора, который в большой степени взаимосвязан с улучшением аллергической ринореи, а также он был безопасным по ряду индикаторов, таким образом, обеспечивая первыми данными о клинической безопасности и эффективности местного SYK киназного ингибитора (Meltzer,Eli О.; Berkowitz, Robert В.; Grossbard, Elliott B., Journal of Allergy and Clinical Immunology (2005), 115(4),791-796). В более недавних клинических исследованиях фазы II аллергического ринита (Clinical Trials.gov Identifier NCT0015089) было показано, что R112 не обладает эффективностью относительно плацебо. Ревматоидный артрит (RA) представляет собой аутоиммунное заболевание, которому подвергаются приблизительно 1% популяции. Он характеризуется воспалением суставов, приводящим к подтачивающему здоровье разрушению кости и хряща. Недавние клинические испытания с ритуксимабом, который вызывает обратимое обеднение В-клетками (J.С.W. Edwards et al. 2004, New Eng. J., Med., 350: 25722581), показали, что функционирование В-клеток в качестве мишени является подходящей терапевтической стратегией для аутоиммунных заболеваний, таких как RA. Клинические результаты взаимосвязаны со снижением количества аутоантител (или ревматоидного фактора), и данные исследования предполагают, что функционирование В-клеток и, действительно, синтез аутоантител являются центральными для текущей патологии при заболевании. Исследования с применением мышей с недостатком тирозинкиназы селезенки (SYK) показали важную роль данной киназы в функционировании В-клеток. Недостаток SYK характеризуется остановкой развития В-клеток (М. Turner et al. 1995 Nature 379: 298-302 и Cheng et al. 1995, Nature 378: 303-306). Данные исследования вместе с исследованиями на зрелых В-клетках с недостатком SYK (Kurasaki et al. 2000, Immunol. Rev. 176: 19-29) показывают, что SYK требуется для дифференциации и активации Вклеток. Следовательно, ингибирование SYK у RA пациентов, вероятно, будет блокировать функционирование В-клеток и посредством этого ослаблять синтез ревматоидного фактора. Добавлением к ролиSYK в функционировании В-клеток и также важности для лечения RA является требование в SYK активности при сигнализировании Fc рецептора (FcR). Предполагается, что FcR активация иммунными комплексами при RA будет способствовать высвобождению большого количества провоспалительных медиаторов. Настоящее изобретение относится к новым соединениям, которые являются ингибиторами SYK киназной активности. Следовательно, данные соединения обладают потенциальной терапевтической пользой для лечения заболеваний, связанных с нарушенной SYK активностью, в частности для лечения и предотвращения заболеваний, опосредованных SYK. Данные заболевания могут включать воспаление,аллергические и аутоиммунные заболевания, например астму, хроническую обструктивную болезнь легких (ХОБЛ), синдром расстройства дыхания у взрослых (ARDS), язвенный колит, болезнь Крона, бронхит, дерматит, аллергический ринит, псориаз, склеродермию, крапивницу, ревматоидный артрит, идиопатическую тромбоцитопеническую пурпуру (ИТП), рассеянный склероз, рак, ВИЧ и волчанку. Сущность настоящего изобретения Настоящее изобретение относится к новым соединениям, которые представляют собой эффективные ингибиторы SYK, а также к содержащим их фармацевтическим композициям. В качестве SYK ингибиторов соединения настоящего изобретения являются пригодными для лечения и предотвращения заболеваний и расстройств, опосредованных SYK белком; данные заболевания и расстройства включают, но не ограничиваются, астму, ХОБЛ, ревматоидный артрит, рак и идиопатическую тромбоцитопеническую пурпуру. Подробное описание настоящего изобретения Настоящее изобретение относится к соединениям формулы (I) или их фармацевтически приемлемой солиRz(a) выбран из (А) С 1-4 алкила, необязательно замещенного одной-тремя группами, независимо выбранными из ОН, NH2, CN, CO2Ra(a) и CONH2, (В) C1-3 фторалкила, (С) галогена, (D) CN, (E) СОС 1-4 алкила(необязательно замещенного одной или двумя группами, независимо выбранными из ORa(a), CN, CO2Ra(a),CONRa(a)Ra(a) и NRa(a)Ra(a, (F) СО-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из этинила, CO2Ra(a), CN, F и ОН), (G) СО-С 3-6 циклоалкила (необязательно замещенного ОН или CO2Ra(a, (Н) С 0-3 алкил-CO2Ra(a), (I) -C(O)NRb(a)Rc(a), (J) -ORa(a), (K) -OC(O)Ra(a), (L)Rb(a) и Rc(a) независимо выбраны из (А) Н, (В) С 3-6 циклоалкила, необязательно замещенного ОН, (С) гетероарила, выбранного из имидазолила, пиридила и индолила, (D) тетрагидрофуранила, (Е) бензила, (F) фенила,необязательно замещенного одной или двумя группами, независимо выбранными из (СН 2)0-2 ОН и F, (G1) С 1-4 алкила и (G2) С 1-4 галогеналкила, в которых каждый из (G1) и (G2) необязательно замещен одной-тремя группами, независимо выбранными из (i) ОН, (ii) C3-6 циклоалкила, необязательно замещенного одной или двумя группами, независимо выбранными из С 1-4 алкила, CONH2, CO2H и СН 2 ОН, (iii) CONH2, (iv) SO2NH2,(V) SO2C1-4 алкила, (vi) CN, (vii) ОС 1-4 алкила, (viii) CO2H, (ix) NRa(a)C(О)С 1-4 алкила, (х) фенила, необязательно замещенного одной или двумя группами, независимо выбранными из (СН 2)0-2 ОН, SO2NH2, CF3, F и Cl, (xi) 1 пирролидинила, необязательно замещенного оксо, (xii) 1-имидазолидинила, необязательно замещенного оксо,(xiii) 1-пиперидинила, необязательно замещенного оксо, и (xiv) 4-морфолинила; илиRb(a) и Rc(a) вместе с атомом азота, с которым они соединены, образуют 6- или 7-членный гетероцикл, возможно содержащий 1 дополнительный гетероатом, выбранный из N, О и S, где упомянутый гетероцикл необязательно замещен одной или двумя группами, независимо выбранными из оксо, CN,(СН 2)0-2 ОН, ацетила, бензила, SO2C1-4 алкила, CONH2, метоксиметила, карбоксиметила, CO2Ra(a) иC1-4 алкила. В одну подгруппу формулы (I) включены соединения, в которых Су представляет собой циклогексил. В одном аспекте циклогексил замещен группой, выбранной из CO2Ra(a), CONRb(a)Rc(a) и NHC(О)С 1-4 алкила, необязательно замещенного ОН, и упомянутый циклогексил необязательно дополнительно замещен одной или двумя метильными группами. В другую подгруппу формулы (I) включены соединения, в которых Су представляет собой пиперидинил. В одном аспекте атом азота пиперидинила замещен группой, выбранной из (i) COC1-4 алкила (необязательно замещенного ORa(a), CN, CO2Ra(a), CONRa(a)Ra(a) и NRa(a)Ra(a, (ii) СО-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из этинила, CO2Ra(a), CN, F и ОН), (iii) СО-С 3-6 циклоалкила (необязательно замещенного ОН или CO2Ra(a, (iv) С 0-3 алкил-CO2Ra(a), (v) CONRa(a)Ra(a), (vi) CONH-фенила (необязательно замещенного одной или двумя группами, независимо вы-2 022790 бранными из С 1-4 алкила, CN и Cl), (vii) CONH-С 3-6 циклоалкила, (viii) SO2NH2, (ix) SO2C1-3 алкила, (х)SO2C1-3 галогеналкила и (xi) SO2Ph. В другую подгруппу формулы (I) включены соединения, в которых Су представляет собой азепанил. В одном аспекте азепанил замещен оксогруппой во втором положении кольца. В другую подгруппу формулы (I) включены соединения, в которых Ry(а) представляет собой ОН. В одном аспекте Су представляет собой циклогексил. В одном варианте его осуществления циклогексил замещен группой, выбранной из CO2Ra(a), CONHRb(a) и NHC(О)С 1-4 алкила, необязательно замещенного ОН, и упомянутый циклогексил необязательно дополнительно замещен одной или двумя метильными группами. В другом аспекте Су представляет собой 2-оксоазепанил. Настоящее изобретение относится к дополнительным соединениям формулы (Ia) или их фармацевтически приемлемой солиRz(b) выбран из (А) Н, (В) С 1-4 алкила, необязательно замещенного одной-тремя группами, независимо выбранными из ОН, NH2, CN, CO2Ra(a) и CONH2, (С) галогена, (D) CN, (E) -C(O)Ra(a), (F) -C(O)2Ra(a),(G) -C(O)NRb(a)Rc(a), (H) -ORa(a), (I) -OC(O)Ra(a), (J) -NRb(a)Rc(a), (K) -NHC(O)С 1-4 алкила (необязательно замещенного OH), (L) -NHSO2 алкила, (М) -NHSO2NH2, (N) 1,3,4-оксадиазол-2(3H)-она и (О) 1,2,4 оксадиазол-5(4 Н)-она;CONH2, (С) C1-3 фторалкила, (D) СОС 1-4 алкила (необязательно замещенного одной или двумя группами, независимо выбранными из ORa(a), CN, CO2Ra(a), CONRa(a)Ra(a) и NRa(a)Ra(a, (E) СО-фенила (необязательно замещенного одной или двумя группами, независимо выбранными из этинила, CO2Ra(a), CN, F и ОН), (F) СО-С 3-6 циклоалкила (необязательно замещенного ОН или CO2Ra(a, (G) С 0-3 алкил-CO2Ra(a), (H) CONRa(a)Ra(a),(I) CONH-фенила (необязательно замещенного одной или двумя группами, независимо выбранными изR1, R4, Ry(a), Ra(a), Rb(a) и Rc(a) представляют собой, как определено для формулы I. В одну подгруппу формулы (Ia) включены соединения, в которых Z представляет собой -NHC(O)-. В одном варианте его осуществления Ry(a) представляет собой ОН. В другую подгруппу формулы (Ia) включены соединения, в которых Z представляет собой-CHRz(b)-, и р' равно 0, 1 или 2. В одном его аспекте Rz(b) представляет собой СО 2 Н. В другом его аспектеRz(b) представляет собой CONHRb(a); в одном варианте осуществления Rz(b) представляет собой CONH2, в другом варианте осуществления Rz(b) представляет собой CONH(СН 2)3-(2-оксо-1-пирролидинил). В другом его аспекте Rz(b) представляет собой NHC(О)C1-4 алкил (необязательно замещенный ОН); в одном варианте осуществления Rz(b) представляет собой NHC(O)CH2OH. В одну подгруппу формулы (Ia) включены соединения, в которых Z представляет собой -CHRz(b)-, p' равно 0, 1 или 2, и Ry(a) представляет собой ОН или CONH2. В одном его аспекте Rz(b) представляет собой СО 2 Н. В другом его аспекте Rz(b) представляет собой CONHRb(a); в одном варианте осуществления Rz(b) представляет собой CONH2, в другом варианте осуществления Rz(b) представляет собой CONH(СН 2)3-(2 оксо-1-пирролидинил). В другом его аспекте Rz(b) представляет собой NHC(О)С 1-4 алкил (необязательно замещенный ОН); в одном варианте осуществления Rz(b) представляет собой NHC(O)CH2OH. Типичные соединения настоящего изобретения являются следующими (предполагается, что каждое соединение включает свои фармацевтически приемлемые соли): или их фармацевтически приемлемая соль. Настоящее изобретение также включает соединения (1S,4R)-4-гидрокси-2,2-диметил-4-5-[3-метил 5-(4-метилпиримидин-2-иламино)фенил]-1,3-тиазол-2-илциклогексанкарбоновую кислоту, 4-гидрокси 2,5-диметил-4-(5-3-метил-5-[(4-метилпиримидин-2-ил)амино)]фенил]-1,3-тиазол-2-илциклогексанкарбоновую кислоту и 4-гидрокси-2,5-диметил-4-[5-3-метил-5-[4-(трифторметил)пиримидин-2-ил]аминофенил-1,3-тиазол-2-ил]циклогексанкарбоновую кислоту или их фармацевтически приемлемую соль. В настоящей заявке различные термины являются такими, как определено ниже."Алкил" относится к углеводородному радикалу с нормальной или разветвленной цепью, содержащему указанное количество атомов углерода. Примеры "алкила" включают, но не ограничиваются, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, н-пентил, изопентил и подобные."Алкенил" относится к углеводородному радикалу с нормальной или разветвленной цепью, содержащему по меньшей мере одну двойную связь углерод-углерод и содержащему указанное количество-4 022790 атомов углерода. Примеры "алкенила" включают, но не ограничиваются этенил, пропенил, н-бутенил, 3 метилбут-2-енил и н-пентенил."Алкинил" относится к углеводородному радикалу с нормальной или разветвленной цепью, содержащему по меньшей мере одну тройную связь углерод-углерод и содержащему указанное количество атомов углерода. Примеры "алкинила" включают, но не ограничиваются этинил, пропинил, 2-бутинил и 3-метилбутинил."Циклоалкил" относится к насыщенному кольцу, содержащему указанное количество кольцевых атомов углерода и несодержащему гетероатом. Аналогичным образом термин "С 3-8 циклоалкил" относится к насыщенному кольцу, содержащему 3-8 кольцевых атома углерода. Примеры "циклоалкильных" групп, пригодных в настоящем изобретении, включают, но не ограничиваются, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил."Галогеналкил" относится к алкильной группе, как определено выше, в которой один и вплоть до всех атомов водорода замещены галогеном; галоген представляет собой, как определено в настоящем изобретении. Примеры данных галогеналкильных групп с разветвленной или нормальной цепью, пригодных в настоящем изобретении, включают, но не ограничиваются, метил, этил, пропил, изопропил,изобутил и н-бутил, замещенные независимо одним или более атомами галогена, например фтором, хлором, бромом и йодом. Примеры "галогеналкила" включают, но не ограничиваются, фторметил, дифторметил, трифторметил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил и перфтор-н-пропил."Гидроксиалкил" относится к алкильной группе, как определено выше, в которой один атом водорода при каждом атоме углерода может быть замещен гидроксигруппой. Примеры "гидроксиалкила" включают, но не ограничиваются, гидроксиметил, гидроксиэтил, пропан-1,2-диол."Гетероциклический" или "гетероциклил" относится к неароматическому насыщенному или частично ненасыщенному моноциклическому кольцу, в котором один-три кольцевые атомы независимо выбраны из N, S и О. Примеры гетероцикла включают, но не ограничиваются, азиридин, азетидин, пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин, имидазолидин, оксазолидин, тиазолидин, дигидроазепин, тетрагидроазепин, азепан, диазепан, дигидродиазепин, тетрагидродиазепин, оксетан, тетрагидрофуран, дигидропиран, пиран, тетрагидропиран, тетрагидротиофен, тетрагидротиопиран, дигидротиопиран, 1,3-диоксан, 1,4-диоксан, 1,3-диоксолан."Гетероарил" относится к ароматическим моноциклическим группам и конденсированным бициклическим ароматическим кольцам, содержащим 1, 2, 3 или 4 гетероатома, выбранные из N, О и S. Примеры гетероарильных групп включают, но не ограничиваются, фуран, тиофен, пиррол, имидазол, пиразол, триазол, тетразол, тиазол, изотиазол, оксазол, изоксазол, оксадиазол, тиадиазол, пиридин, пиридазин, пиразин, пиримидин. Предполагается, что термин "композиция", как в фармацевтической композиции, включает продукт,содержащий активный ингредиент (ингредиенты) и инертный ингредиент (ингредиенты) (фармацевтически приемлемые вспомогательные вещества), которые образуют носитель, а также любой продукт, который появляется в результате, прямо или косвенно, смешения, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. Соответственно,фармацевтические композиции настоящего изобретения включают любую композицию, образованную смешением соединения формулы (I) и фармацевтически приемлемых вспомогательных веществ. Как применяют в настоящем изобретении, термин "необязательно" обозначает то, что впоследствии описанное событие (события) может происходить или может не происходить, и включает и событие (события), которые происходят, и события, которые не происходят. Как применяют в настоящем изобретении, термин "замещенный одной или более группами" относится к замещению указанным заместителем или заместителями, многократному замещению, вплоть до замещения всех атомов водорода одинаковыми или различными заместителями, если это позволительно,если в явной форме не указано число заместителей. Когда число заместителей не указано в явной форме,предполагается один или более заместителей. Каждую переменную независимо определяют каждый раз, когда она встречается в пределах определений родовой структурной формулы. Например, когда присутствует более чем один Rz(a) заместитель в Су кольце, каждый заместитель независимо выбирают для каждого случая, и каждый заместитель может быть аналогичным или отличным от другого (других). В качестве другого примера для группыNRa(a)Ra(a) каждое значение двух Ra(a) групп может быть одинаковым или различным. Как применяют в настоящем изобретении, когда обозначение "С 0" или "(СН 2)0" определяет заместитель, оно показывает связь между заместителем и остатком молекулы. Таким образом, термин"С 0-3 алкил-СО 2 Н" обозначает, что карбоксигруппа или непосредственно соединена с остатком молекулы,или что между ними имеется промежуточная C1-3 алкильная группа. Термин "SYK ингибитор" применяют для обозначения, соединения, которое ингибирует SYK фермент. Термин "SYK опосредованное заболевание" или "расстройство или заболевание или симптом, опо-5 022790 средованный нарушенной SYK активностью" применяют для обозначения любого заболевания, опосредованного или модулируемого SYK киназными механизмами. Данные заболевания могут включать воспаление, аллергические и аутоиммунные заболевания, например астму, хроническое обструктивное заболевание легких (ХОБЛ), респираторный дистресс-синдром взрослых (РДСВ), язвенный колит, болезнь Крона, бронхит, дерматит, аллергический ринит, псориаз, склеродермию, крапивницу, ревматоидный артрит, рассеянный склероз, рак, ВИЧ и волчанку, в частности астму, хроническое обструктивное заболевание легких (ХОБЛ), респираторный дистресс-синдром взрослых (РДСВ), аллергический ринит и ревматоидный артрит. Как применяют в настоящем изобретении, "соединение настоящего изобретения" обозначает соединение формулы (I) или его соль. Соединение формулы (I) может содержать асимметрические или хиральные центры и, следовательно, существовать в различных стереоизомерных формах. Предполагается, что все стереоизомерные формы соединений формулы (I), а также их смеси, включая рацемические смеси, образуют часть настоящего изобретения. Диастереомерные смеси можно разделить на их отдельные диастереомеры на основе их физико-химических различий способами, известными специалистам в данной области техники, такими как, например, хроматографией и/или фракционной кристаллизацией. Энантиомеры можно разделить превращением энантиомерной смеси в диастереомерную смесь реакцией с подходящим оптически активным соединением (например, хиральным вспомогательным веществом, таким как хиральный спирт или хлорангидрид кислоты Мошера), разделением диастереомеров и превращением (например, гидролизом) отдельных диастереомеров в соответствующие чистые энантиомеры. Также некоторые из соединений формулы (I) могут представлять собой атропоизомеры (например, замещенные биарилы) и их считают частью настоящего изобретения. Некоторые из соединений, описанных в настоящем изобретении, содержат олефиновые двойные связи, и, если не указано особо, предполагается, что они включают и Е и Z геометрические изомеры. В то время как варианты осуществления для каждой переменной в общем перечислены выше отдельно для каждой переменной, настоящее изобретение также включает такие соединения, в которых несколько или каждый вариант осуществления в формуле (I) выбран из каждого из вариантов осуществления, перечисленных выше. Следовательно, предполагается, что настоящее изобретение включает все комбинации вариантов осуществления для каждой переменной. Соединения настоящего изобретения могут быть в форме и/или могут вводиться в виде фармацевтически приемлемой соли (для ознакомления с подходящими солями см. Berge et al., J. Pharm. Sci. 1977,66, 1-19). Обычно, соли настоящего изобретения представляют собой фармацевтически приемлемые соли. Соли, включенные в термин "фармацевтически приемлемые соли", относятся к нетоксичным солям соединений настоящего изобретения. Подходящие фармацевтически приемлемые соли могут включать соли присоединения кислоты или основания. Фармацевтически приемлемую соль присоединения кислоты можно получить реакцией соединения формулы (I) с подходящей неорганической или органической кислотой (такой как бромоводородная,хлороводородная, серная, азотная, фосфорная, янтарная, малеиновая, муравьиная, уксусная, пропионовая, фумаровая, лимонная, винная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая, птолуолсульфокислота, бензолсульфокислота, метансульфокислота, этансульфокислота, нафталинсульфокислоты, такие как 2-нафталинсульфокислоты, или гексановая кислота), необязательно в подходящем растворителе, таком как органический растворитель, для получения соли, которую обычно выделяют,например, кристаллизацией и фильтрацией. Фармацевтически приемлемая соль присоединения кислоты соединения формулы (I) может содержать или быть, например, гидробромидной, гидрохлоридной, сульфатной, нитратной, фосфатной, сукцинатной, малеатной, формиатной, ацетатной, пропионатной, фумаратной, цитратной, тартратной, лактатной, бензоатной, салицилатной, глутаматной, аспартатной, птолуолсульфонатной, бензолсульфонатной, метансульфонатной, этансульфонатной, нафталинсульфонатной (например, 2-нафталинсульфонатной) или гексаноатной солью. Фармацевтически приемлемую соль присоединения основания можно получить реакцией соединения формулы (I) с подходящим неорганическим или органическим основанием. Соли, полученные из неорганических оснований, включают соли алюминия, аммония, кальция, меди, железа (+3), железа (+2),лития, магния, марганца (+2), марганца (+3), калия, натрия, цинка и т.д. Особенно предпочтительными являются соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы,прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и подобные. Другие фармацевтически неприемлемые соли, например оксалаты или трифторацетаты, можно также применять, например, для выделения соединений настоящего изобретения, и они включены в объ-6 022790 ем настоящего изобретения. Настоящее изобретение включает в свой объем все возможные стехиометрические и нестехиометрические формы соединений формулы (I). В соединениях формулы (I) атомы могут иметь свой природный изотопный состав, или один или более атомов могут быть искусственно обогащены конкретным изотопом, имеющим то же атомное число, но атомную массу или массовое число, отличные от атомной массы или массового числа, преимущественно обнаруживаемого в природе. Предполагается, что настоящее изобретение включает все подходящие изотопные варианты соединений общей формулы (I). Например, отличные изотопные формы водорода (Н) включают протий (1 Н) и дейтерий (2 Н). Протий представляет собой преобладающий изотоп водорода, присутствующий в природе. Обогащение дейтерием может давать определенную терапевтическую пользу, такую как увеличение in vivo периода полуразложения или снижение требующихся доз,или может обеспечивать соединением, пригодным в качестве стандарта для получения характеристик биологических образцов. Изотопно-обогащенные соединения общей формулы (I) можно получить без дополнительного экспериментирования общепринятыми способами, хорошо известными специалистам в данной области техники, или способами, аналогичными тем, что описаны на схемах и в примерах в настоящем изобретении, применяя подходящие изотопно-обогащенные реагенты и/или промежуточные соединения. Считают, что соединения формулы (I) и их соли являются ингибиторами SYK активности и, таким образом, являются потенциально пригодными для лечения заболеваний и состояний, связанных с нарушенной SYK активностью. Соединение формулы (I) или его фармацевтически приемлемые соли и фармацевтические композиции можно применять для лечения или предотвращения ряда состояний или заболеваний, опосредованных тирозинкиназой селезенки (SYK). Данные состояния и заболевания включают, но не ограничиваются: (1) артриты, в том числе ревматоидный артрит, ювенильный артрит, псориатический артрит и остеоартрит, (2) астму и хроническое обструктивное заболевание легких, в том числе эмфиземы, (3) аутоиммунные заболевания или расстройства, в том числе те, которые указаны как аутоиммунные заболевания одного органа или одного типа клеток, те, которые указаны как включающие системные аутоиммунные расстройства, например системная красная волчанка, иммунная тромбоцитопеническая пурпура, ревматоидный артрит, рассеянный склероз, (4) рак или опухоли, в том числе солидные опухоли, и лимфомы и лейкемии; (5) глазные болезни, включая кератоконъюнктивит, весенний конъюнктивит, увеит, кератит,СКК (сухость глаз), аллергический конъюнктивит, (6) кишечные воспаления, аллергии или заболевания,включая болезнь Крона и/или неспецифический язвенный колит, воспаление кишечника; (7) заболевания кожи, в том числе атопический дерматит, экзему, псориаз, склеродермию, зуд и другие зудящие состояния кожи; (8) аллергические реакции, включая анафилактический шок, аллергический ринит, аллергический дерматит, аллергическую крапивницу, отек Квинке, аллергическую астму или аллергические реакции на укусы насекомых, пищевые, лекарственные препараты, или пыльцу; (9) отторжение трансплантата. Таким образом, настоящее изобретение относится к соединениям формулы (I) и их солям для применения в терапии, в частности для лечения заболеваний и состояний, опосредованных нарушенной SYK активностью. Нарушенная SYK активность, на которую ссылаются в настоящем изобретении, представляет собой любую SYK активность, которая отклоняется от нормальной SYK активности, ожидаемой у конкретного млекопитающего. Нарушенная SYK активность может принимать форму, например, ненормального увеличения активности или отклонения по временным показателям и/или контроля SYK активности. Затем данная нарушенная активность может быть результатом, например, повышенной экспрессии или мутации протеинкиназы, приводящей к нарушенной или неконтролируемой активности. В следующем варианте осуществления настоящее изобретение относится к способам регулирования, модулирования или ингибирования SYK для предотвращения и/или лечения заболеваний, связанных с нерегулируемой SYK активностью. В следующем варианте осуществления настоящее изобретение относится к способу лечения млекопитающего, страдающего от заболевания, опосредованного SYK активностью, который включает введение упомянутому млекопитающему эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В следующем варианте осуществления настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного препарата для лечения заболевания, опосредованного SYK активностью. В следующем варианте осуществления упомянутое заболевание, опосредованное SYK активностью,представляет собой астму. В следующем варианте осуществления упомянутое заболевание представляет собой ревматоидный артрит. В еще следующем варианте осуществления упомянутое заболевание представляет собой рак. В следующем варианте осуществления упомянутое заболевание представляет собой конъюнктивит. Когда это возможно, для применения в терапии соединение формулы (I), а также его соли можно вводить в виде неочищенного вещества, можно предоставлять активный ингредиент в виде фармацевти-7 022790 ческой композиции. Соответственно, кроме того, настоящее изобретение относится к фармацевтической композиции, которая содержит соединение формулы (I) и его соли и один или более фармацевтически приемлемых носителей, разбавителей или вспомогательных веществ. Соединения формулы (I) и их соли являются, как описано выше. Носитель (носители), разбавитель (разбавители) или вспомогательное вещество (вспомогательные вещества) должны быть приемлемыми в том смысле, что они являются совместимыми с другими ингредиентами состава и невредными для их реципиента. Согласно другому аспекту настоящее изобретение также относится к способу получения фармацевтической композиции,включающему смешение соединения формулы (I) или его соли, с одним или более фармацевтически приемлемыми носителями, разбавителями или вспомогательными веществами. Фармацевтические композиции настоящего изобретения могут присутствовать в единичной лекарственной форме, содержащей предварительно определенное количество активного ингредиента на одну дозу. Данная единичная доза может содержать, например, 5 мкг-1 г, предпочтительно 1-700 мг, более предпочтительно 5-100 мг соединения формулы (I) в зависимости от заболевания, подвергаемого лечению, пути введения и возраста, веса и состояния пациента. Следовательно, данные единичные дозы можно вводить более одного раза в день. Предпочтительные единичные дозовые композиции являются композициями, содержащими дневную дозу или поддозу (для введения более одного раза в день), как излагается в настоящем изобретении выше, или их подходящую часть, активного ингредиента. Более того, данные фармацевтические композиции можно получить любым из способов, хорошо известных в области фармацевтики. Фармацевтические композиции настоящего изобретения можно приспособить для введения любым подходящим путем, например пероральным (включая буккальный или сублингвальный), ингаляционным, назальным, через глаза или парентеральным (включая внутривенный и внутримышечный) путем. Данные композиции можно получить любым способом, известным в области фармацевтики, например,смешением активного ингредиента с носителем (носителями) или вспомогательным веществом (вспомогательными веществами). В следующем варианте осуществления настоящее изобретение относится к фармацевтической композиции, приспособленной для введения пероральным путем, для лечения, например, ревматоидного артрита. В следующем варианте осуществления настоящее изобретение относится к фармацевтической композиции, приспособленной для введения назальным путем, для лечения, например, аллергического ринита. В следующем варианте осуществления настоящее изобретение относится к фармацевтической композиции, приспособленной для введения ингаляционным путем, для лечения, например, астмы, ХОБЛ или синдрома острой дыхательной недостаточности. Фармацевтические композиции настоящего изобретения, которые приспособлены для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки; порошков или гранул; растворов или суспензий в водных или неводных жидкостях; пригодных в пищу пен или взбитых масс; или жидких эмульсий масло в воде или жидких эмульсий вода в масле. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент можно смешивать с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и подобные. Порошки получают измельчением соединения до подходящего мелкого размера и смешением с аналогично измельченным фармацевтическим носителем, таким как пищевой сахар, например крахмал или маннитол. Могут также присутствовать ароматизаторы, консерванты, диспергирующие агенты и красители. Капсулы получают приготовлением порошковой смеси, как описано выше, и заполнением ее в полученные желатиновые оболочки. Регуляторы сыпучести и смазывающие вещества, такие как коллоидный оксид кремния, тальк, стеарат магния, стеарат кальция или твердый полиэтиленгликоль, можно добавлять к порошковой смеси перед стадией заполнения оболочек. Разрыхлители или солюбилизаторы,такие как агар-агар, карбонат кальция или карбонат натрия можно также добавлять для увеличения доступности лекарственного средства при усвоении капсулы. Более того, при желании или при необходимости подходящие связующие, смазывающие вещества,разрыхлители и красители можно также вводить в смесь. Подходящие связующие включают крахмал,желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристое вещество из кукурузы, природные и синтетические смолы, такие как камедь, трагакант или альгинат натрия, карбоксиметилцеллюлозу, полиэтиленгликоль, воски и подобные. Смазывающие вещества, применяемые в данных лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия,хлорид натрия и подобные. Разрыхлители включают, без ограничений, крахмал, метил целлюлозу, агар,бентонит, ксантановую камедь и подобные. Таблетки формулируют, например, получение порошковой смеси, гранулированием или комкованием, добавлением смазывающего вещества и разрыхлителя и сдавливанием в таблетки. Порошковую смесь получают смешением соединения, измельченного подходящим образом, с разбавителем или основой, такой как описано выше, и, необязательно, со связующим,такими как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем рас-8 022790 творения, таким как парафин, ускорителем поглощения, такими как четвертичная соль, и/или абсорбирующим агентом, таким как бентонит, каолин или фосфат дикальция. Порошковую смесь можно гранулировать смачиванием связующим, таким как патока, крахмальная паста, клейкие вещества акации или растворы целлюлозных или полимерных материалов и пропускать через сито. В качестве альтернативы гранулированию, порошковую смесь можно пропускать через таблетировочную машину, и полученную в результате не полностью образовавшуюся массу разбивать на гранулы. Гранулы можно смазывать для предотвращения слипания с формующими таблетки головками посредством добавления стеариновой кислоты, стеаратной соли, талька или минерального масла. Затем смазанную смесь прессуют в таблетки. Соединения настоящего изобретения можно также смешивать с легкосыпучим инертным носителем и прессовать в таблетки непосредственно, не проводя стадии гранулирования или комкования. Можно также обеспечивать прозрачным или непрозрачным защитным покрытием, состоящим из герметизирующего покрытия шеллака, покрытием из сахара или полимерного вещества и глянцевым покрытием из воска. Краситель можно добавлять к данным покрытиям для различения различных единичных доз. Пероральные жидкости, такие как растворы, сиропы и эликсиры можно получить в единичной лекарственной форме так, чтобы указанное количество содержало предварительно определенное количество соединения. Сиропы можно получить растворением соединения в подходящем образом ароматизированном водном растворе, тогда как эликсиры получают с применением нетоксичной спиртовой среды. Суспензии можно формулировать диспергированием соединения в нетоксичной среде. Можно также добавлять солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленсорбитольные эфиры, консерванты, вкусовые добавки, такие как масло мяты перечной, или природные подсластители, или сахарин, или другие искусственные подсластители, и подобные. Лекарственные формы для введения ингаляцией можно удобно получить в виде аэрозолей или сухих порошков. Что касается композиций, подходящих и/или приспособленных для введения ингаляцией, предпочтительно, чтобы соединение или соль формулы (I) было в форме с уменьшенным размером частиц, и более предпочтительно формы с уменьшенным размером получают или их можно получить микронизацией. Предпочтительный размер частиц соединения или соли или сольвата с уменьшенным размером частиц (например, микронизированного) определяется D50 величиной, равной приблизительно от 0,5 до приблизительно 10 микрон (например, как измерено, применяя лазерную дифракцию). Аэрозольные составы, например для введения ингаляцией, могут содержать раствор или тонкую суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные составы можно получить в единичных или многодозовых количествах в стерильной форме в герметичной емкости, которая может быть баллончиком или сменным баллончиком для применения с распылительным устройством или ингалятором. Альтернативно герметизированная емкость может представлять собой устройство для однократного распыления, такое как ингалятор для носа с одной дозой или аэрозольный распылитель, снабженный мерным клапаном (ингалятор отмеренных доз), который предполагается выкидывать после использования всего содержимого емкости. Когда лекарственная форма содержит аэрозольный распылитель, она предпочтительно содержит подходящий пропеллент под давлением, такой как сдавленный воздух, диоксид углерода или органический пропеллент, такой как гидрофторуглерод HFC). Подходящие HFC пропелленты включают 1,1,1,2,3,3,3-гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы могут также быть в форме насосных распылителей. Аэрозоль под давлением может содержать раствор или суспензию активного соединения. Это может требовать введения дополнительных вспомогательных веществ, например, корастворителей и/или поверхностно-активных веществ, для улучшения дисперсных характеристик и гомогенности составов в виде суспензии. Составы в виде растворов могут также требовать добавление корастворителей, таких как этанол. Другие вспомогательные вещества можно также вводить для увеличения, например, стабильности и/или улучшения вкуса и/или характеристик массы тонкодисперсных частиц (количества и/или профиля) состава. Что касается фармацевтических композиций, подходящих и/или приспособленных для введения ингаляцией, предпочтительно, чтобы фармацевтическая композиция представляла собой композиции для ингаляции на основе сухого порошка. Данная композиция может содержать порошковую основу, такую как лактоза, глюкоза, трегалоза, маннитол или крахмал, соединение формулы (I) или его соль или сольват (предпочтительно в форме с уменьшенным размером частиц, например в микронизированной форме), и необязательно модификатор свойств, такой как L-лейцин или другая аминокислота, и/или соли металлов стеариновой кислоты, такие как стеарат магния или кальция. Предпочтительно композиции для ингаляции на основе сухого порошка содержат сухую порошковую смесь лактозы и соединения формулы (I) или его соли. Лактоза предпочтительно представляет собой гидрат лактозы, например моногидрат лактозы, и/или предпочтительно представляет собой лактозу для ингаляции высшего сорта. Предпочтительно размер частиц лактозы определяют так, чтобы 90% или более (по весу или по объему) частиц лактозы являлись меньшими чем 1000 микрон (микрометров) (например, 10-1000 микрон, например 30-1000 микрон) в диаметре, и/или 50% или более частиц лактозы являлись меньшими чем 500 микрон (например, 10-500 микрон) в диаметре. Более предпочтительно размер частиц лактозы определяют так, чтобы-9 022790 90% или более частиц лактозы являлись меньшими чем 300 микрон (например, 10-300 микрон, например, 50-300 микрон) в диаметре, и/или 50% или более частиц лактозы являлись меньшими чем 100 микрон в диаметре. Необязательно, размер частиц лактозы определяют так, чтобы 90% или более частиц лактозы являлись меньшими чем 100-200 микрон в диаметре и/или 50% или более частиц лактозы являлись меньшими чем 40-70 микрон в диаметре. Предпочтительно, чтобы приблизительно от 3 до приблизительно 30% (например, приблизительно 10%) (по весу или по объему) частиц являлись меньшими чем 50 микрон или меньшими чем 20 микрон в диаметре. Например, без ограничения, подходящая лактоза для ингаляции представляет собой Е 9334 лактозу (10% мелких частиц) (Borculo Domo Ingredients, Hanzeplein 25, 8017 J D Zwolle, Netherlands). Необязательно, в частности, для композиций на основе сухого порошка для ингаляции фармацевтическая композиция для введения ингаляцией может вводиться в ряд герметизированных емкостей для доз (например, содержащие композицию на основе сухого порошка), закрепленных по длине ленты или полоски внутри подходящего устройства для ингаляции. Емкость является разрываемой или открываемой пробкой по требованию, и дозу, например, композиции на основе сухого порошка можно вводить ингаляцией с помощью устройства, такого как DISKUS устройство (GlaxoSmithKline). Другие ингаляторы с сухим порошком являются хорошо известными специалистам в данной области техники, и многие данные устройства являются имеющимися в продаже, так типичные устройства включают Aerolizer(SkyePharma), Twisthaler (Schering-Plough), Turbuhaler (AstraZeneca), Ultrahaler (Aventis) и подобные. Лекарственные формы для назального введение можно удобно формулировать в виде аэрозолей,растворов, капель, гелей или сухих порошков. Фармацевтические композиции, приспособленные для введения ингаляцией, включают тонкодисперсную пыль или аэрозоль, которые можно получать различными типами аэрозолями под давлением с отмеренными дозами, распылителями и инсуффляторами. Что касается фармацевтических композиций, подходящих и/или приспособленных для интраназального введения, соединение формулы (I) или его фармацевтически приемлемую соль или сольват можно формулировать в виде жидкого состава для доставки из распылителя для жидкости. Данные распылители для жидкости могут содержать, например, дозировочное сопло или дозировочное отверстие,через которое распыляется отмеренная доза жидкого состава при приложении пользователем силы к насосному механизму распылителя для жидкости. Данные распылители для жидкости обычно снабжаются контейнером с большим количеством отмеренных доз жидкого состава, причем дозы распыляются при последующем срабатывании насоса. Дозировочное сопло или отверстие можно компоновать для помещения в ноздри пользователя для распыления спрея жидкого состава в носовую полость. Далее идут примеры типичных фармацевтических лекарственных форм для соединений настоящего изобретения- 10022790 Ясно, что когда соединение настоящего изобретения вводят в комбинации с другими терапевтическими агентами, обычно вводимыми ингаляционным, внутривенным, пероральным или интраназальным путем, данную полученную в результате фармацевтическую композицию можно вводить теми же способами. Ясно, что в добавление к ингредиентам, конкретно упоминаемым выше, композиции могут содержать другие агенты, общепринятые в данной области техники, принимая во внимание тип рассматриваемого состава, например, те, что подходят для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения настоящего изобретения будет зависеть от ряда факторов, включая, например, возраст и вес млекопитающего, определенное заболевание, требующее лечения, и его тяжесть, свойства состава и путь введения, и будет, в конце концов, определяться по усмотрению лечащего врача или ветеринара. Однако эффективное количество соединения формулы (I) для лечения заболеваний или состояний, связанных с нарушенной SYK активностью, будет обычно в диапазоне 5 мкг-100 мг/кг веса тела реципиента (млекопитающего) в день и более обычно в диапазоне 5 мкг-10 мг/кг веса тела в день. Данное количество будет вводиться в виде одной дозы в день или более обычно в виде нескольких (таких как две, три, четыре, пять и шесть) поддоз в день так, чтобы суммарная дневная доза была такой же. Эффективное количество его соли или сольвата, можно определить как часть эффективного количества соединения формулы (I) per se. Соединения настоящего изобретения и их соли можно применять отдельно или в комбинации с другими терапевтическими агентами для лечения заболеваний и состояний, связанных с нарушеннойSYK активностью. Таким образом, комбинационные терапии согласно настоящему изобретение включают введение по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли и применение по меньшей мере одного другого фармацевтически активного агента. Соединение(соединения) формулы (I) и другой фармацевтически активный агент (агенты) можно вводить вместе или раздельно и при введении раздельно введение можно осуществлять одновременно или последовательно в любом порядке. Количества соединения (соединений) формулы (I) и другого фармацевтически активного агента (агентов) и относительные сроки введения будут выбирать так, чтобы достигнуть требуемого комбинированного терапевтического эффекта. Для лечения воспалительных заболеваний, ревматоидного артрита, псориаза, воспалительного заболевания кишечника, ХОБЛ, астмы и аллергического ринита соединение формулы (I) можно комбинировать с одним или более из других активных агентов, таких как: (1) TNF- ингибиторы; (2) неселективные СОХ-1/СОХ-2 ингибиторы; (3) СОХ-2 ингибиторы; (4) другие агенты для лечения ревматоидного артрита, включая метотрексат, лефлуномид, сульфасалазин, азатиоприн, циклоспорин, такролимус, пеницилламик, буцилламин, актарит, мизорибин, лобензарит, циклозонид, гидроксихлорохин, dпеницилламин, ауротиомалат, ауранофин или парентеральное или пероральное золото, циклофосфамид,лимфостат-В, BAFF/APRIL ингибиторы и CTLA-4-Ig или его миметики; (5) ингибитор биосинтеза лейкотриенов, ингибитор 5-липоксигеназы (5-LO) или антагонист белка, активирующего 5-липооксигеназу(FLAP); (6) агонист LTD4 рецептора; (7) PDE4 ингибитор; (8) антагонисты антигистаминового HI рецептора; (9) агонист 1- и 2-адренорецепторов; (10) антихолинергические средства; (11) агонисты адренорецепторов; (12) миметик инсулиноподобного фактора роста I (1GF-1); (13) глюкокортикостероиды; (14) ингибиторы киназ, такие как ингибиторы Янус-киназ (JAK1, и/или JAK2, и/или JAK3, и/илиIL-1 ингибитор анакинра и IL-6 ингибитор тоцилизумаб. Для лечения рака соединение формулы (I) можно комбинировать с одним или более противораковых агентов (примеры данных агентов можно найти в Cancer Principles and Practice of Oncology V.T. Devita and S. Hellman (редакторы), 6 издание (15 февраля 2001), Lippincott WilliamsWilkins Publishers). Специалист в данной области техники будет способен определить, какие комбинации агентов будут пригодны, на основе конкретных характеристик лекарственных средств и рака, подвергаемого лечению. Данные противораковые агенты включают, но не ограничиваются, следующие: (1) модулятор рецептора эстрогена; (2) другие гормональные агенты, включая ингибиторы ароматазы; (3) модулятор рецептора андрогена; (4) модулятор ретиноидного рецептора; (5) антипролиферативное средство; (6) ингибитор фенилпротеинтрансферазы; (7) ингибитор HMG-CoA редуктазы; (8) ингибитор ангиогенеза; (9) PPARагонисты, PPAR- агонисты; (10) ингибитор врожденной множественной лекарственной резистентности;(11) ингибитор клеточной пролиферации и сигнализации выживания; (12) бифосфонаты; (13) ингибиторы -секретазы, (14) агенты, которые взаимодействуют с рецепторными тирозинкиназами (RTK); (14) агент, который влияет на контрольную точку клеточного цикла, включая ингибиторы ATR, ATM, Chk1 иChk2 киназы и cdk и cdc киназные ингибиторы; (15) BTK ингибиторы; (16) PARP; (17) mTOR ингибиторы; и (18) цитотоксические/цитостатические агенты, обычно применяемые для лечения рака, такие как антрациклины, соединения платины, таксаны, подофиллотоксины, алкалоиды барвинка, нитрозомочевины, блеомицин, митомицин С, вориностат, камптотецины и подобные. Специалисту в данной области техники ясно, что при необходимости можно применять другой те- 11022790 рапевтический ингредиент (ингредиенты) в виде соли, например в виде соли щелочного металла или амина или в виде солей присоединения кислоты, или пролекарств, или в виде эфиров, например эфиров низших алкилов, или в виде сольватов, например гидратов, для оптимизирования активности и/или стабильности и/или физических характеристик, таких как растворимость, терапевтического ингредиента. Также ясно, что при необходимости терапевтические ингредиенты можно применять в оптически чистой форме. Комбинации, на которые ссылаются выше, можно удобно предоставлять для применения в форме фармацевтической композиции, и таким образом фармацевтические композиции, содержащие комбинацию, как определено выше вместе с фармацевтически приемлемым разбавителем или носителем, представляют собой следующий аспект настоящего изобретения. Данные комбинации особенно заслуживают рассмотрения при респираторных заболеваниях и их удобно приспосабливать для интраназального введения или введения ингаляцией. Отдельные соединения данных комбинаций можно вводить или последовательно или одновременно в различных или комбинированных фармацевтических композициях. Предпочтительно вводить отдельные соединения одновременно в комбинированной фармацевтической композиции. Подходящие дозы известных терапевтических агентов будут легко определяться специалистом в данной области техники. Биологический анализ Гомогенный флуоресцентный анализ с временным разрешением (HTRF) для рекомбинантного SYK фермента Рекомбинантный GST-hSYK химерный белок применяли для оценки эффективности соединений по ингибированию активности человеческой SYK. Рекомбинантный человеческий GST-SYK (Carna Biosciences 08-176) (5 пМ конечная концентрация) выдерживали с различными концентрациями ингибитора,разбавленного в DMSO (0,1% конечная концентрация) в течение 10 мин при комнатной температуре в 15 мМ Tris-HCl (pH 7,5), 0,01% tween 20, 2 мМ DTT в 384-луночных планшетах. Для того чтобы вызвать реакцию, биотинилированный субстратный пептид (250 нМ конечная концентрация), который содержит участок фосфорилирования для SYK, добавляли с магнием (5 мМ конечная концентрация) и АТР (25 мкМ конечная концентрация). Конечный объем реакции составлял 10 мкл. Фосфорилирование пептида протекало в течение 45 мин при комнатной температуре. Для прекращения реакции и обнаружения фосфорилированного продукта 2 нМ европий-антифосфотирозин антитела (Perkin Elmer AD0161) и 70 нМSA-APC (Perkin-Elmer CR130-100) добавляли вместе в 15 мМ Tris pH 7,5, 40 мМ EDTA, 0,01% tween 20. Конечный объем раствора для прекращения реакции составлял 10 мкл. Полученные в результате HTRF сигналы измеряли через 30 мин на En Vision (Perkin-Elmer) ридере, применяя протокол для флуоресценции с временным разрешением. IC50 определяли из 10-дозового титрования (10 мкМ-0,508 нМ) и логистической кривой с четырьмя параметрами, построенной, применяя Merck Assay Data Analyzer. rhSYK активность (IC50) выражают как(100 нМ или меньше),(между 100 и 1000 нМ), + (между 1 и 10 мкМ). Соединения настоящего изобретения можно получить рядом способов, включающим стандартные химические реакции. Любая ранее определенная величина будет продолжать иметь ранее определенное значение, если не указано особо. Иллюстративные общие синтетические способы приведены ниже, и затем конкретные соединения настоящего изобретения получают в примерах. Соединения общей формулы (I) можно получить способами, известными в области органического синтеза, как описано частично в следующих синтетических схемах. Ясно, что на всех схемах, описанных ниже, применяют защитные группы для чувствительных или реакционноспособных групп при необходимости в соответствии с общими принципами химии. С защитными группами манипулируют согласно общим способам органического синтеза (Т.W. Green and P.G.M. Wuts (1991) Protecting Groups in OrganicSynthesis, John WileySons). Данные группы удаляют на подходящей стадии синтеза соединения, применяя способы, легко доступные специалисту в данной области техники. Выбор защитных групп, а также условий реакций и порядка реакционных стадий, должны согласовываться с получением соединений формулы (I). Специалист в данной области техники может оценить, присутствует ли стереоцентр в соединениях формулы (I). Соответственно, настоящее изобретение включает все возможные стереоизомеры и включает не только смеси стереоизомеров (такие как рацемические соединения), но также отдельные стереоизомеры. Когда соединение требуется в виде отдельного энантиомера, его можно получить стереоспецифическим синтезом или разделением конечного продукта или любого подходящего промежуточного соединения. Разделение конечного продукта, промежуточного соединения или исходного вещества можно осуществлять любым подходящим способом, известным в данной области техники (см.,например, Stereochemistry of Organic Compounds E.L. Eliel, S.H. Wilen, and L.N. Mander (WileyInterscience, 1994). В следующих схемах R5 представляет фрагмент Кольцо, обозначенное как "А", представляет собой подходящее кольцо в пределах определения Су и является необязательно замещенным как Су. Следующие сокращения применяют на схемах и в примерах: Ас=Ацетил; АсОН=уксусная кислота; Соединения формулы (I) можно получить конденсацией по Сузуки бороновых эфиров (1) с тиазолбромидами (2). Бороновые эфиры (1) можно получить реакцией 2-хлорпиримидинов (3) и 3 броманилинов (82) для получения соответствующих N-(3-бромфенил)пиримидин-2-аминов (83) с последующей конденсацией по Мияура с бис-(пинаколато)дибором. Соединения формулы (I) можно также получить реакцией 2-хлорпиримидинов (3) и тиазолзамещенных анилинов (4) в присутствии Pd катализатора или альтернативно SNAr реакцией. Тиазолзамещенные анилины (4), в свою очередь, можно получить в условиях конденсации по Сузуки, применяя бромтиазол и нитрофенилбороновый эфир, с последующим восстановлением нитрогруппы до аминогруппы, применяя стандартные условия, известные для восстановления нитроароматических соединений до анилинов, такие как гидрирование, катализируемое Pd. Соединения формулы (I) можно также получить реакцией Хека бромзамещенных анилинов (83) с замещенными тиазолами (84). Бромзамещенные анилины (83) можно получить SNAr реакцией между 2-хлорпиримидинами (3) и замещенными броманилинами (82). Соединения формулы (I) можно также получить из соединений (5). Тиазол (5) обрабатывают сильным основанием, таким как LDA, и затем кетонами для получения спиртов (6); сульфиминами для получения сульфинамидов (9), которые можно расщепить в кислых условиях для получения аминов (10). Спирты (6) можно фторировать, применяя фторирующий агент, такой как DAST или deoxofluor, для получения соединений (11). Схема 5 Амины (10) можно обработать (а) сульфамидом для получения соединений (14); (b) цианатом калия в присутствии уксусной кислоты для получения мочевин (15); (с) ацилирующими агентами, такими как хлорангидриды кислоты, и карбоновыми кислотами в присутствии конденсирующего агента для получения амидов (17). Схема 6 Кетали (18), полученные из соединений (5) и 1,4-диоксаспиро[4,5]декан-8-она, можно обработатьHCl для получения кетонов (19), которые затем можно восстановить боргидридом натрия или обработать реактивом метил Гриньяра для получения диолов (20) или (22) соответственно. Альтернативно, кетали(13) или кетоны (19) обрабатывают азидом натрия и метансульфокислотой для получения лактама (21) после перегруппировки. Алкилирование соединений (21) с последующим деблокированием силилового эфира промежуточного соединения дает спирты (90). Схема 8 Соединения (4) можно получить из 2-амино-1-(3-нитрофенил)этанона (23). Амидная конденсация с- 14022790 кислотой дает соединения (24), которые обрабатывают реагентом Лавессона, что приводит в результате к образованию нитрофенилов (25). Восстановление, опосредованное палладием, нитроаренов (25) водородом дает анилины (4). Схема 10 Дегидрирование соединений (49) реагентом Итона дает циклоалкены (50), которые дают диолы (93) после дигидроксилирования. Схема 12 Бромиды (67) подвергают конденсации по Соногашира с TMS-ацетиленом, и последующее деблокирование силила дает ацетиленовые соединения (69), которые восстанавливают, получая соединения(70). Конденсация, опосредованная палладием, (67) с циклопропилборонатом (полученным согласно литературным данным; см. J.A. Huertas, R. Leon-Colon, G. Tetrahedron Lett. 2000, 41, 4251-4255) дает циклопропильное соединение (68). Схема 14 Получение 2-хлорпиримидиновых элементов структуры, исходя из 2,4-дихлорпиримидинов (71),показано на схеме 14. Функционализация пиримидина с помощью конденсации по Сузуки дает замещенные 2-хлорпиримидины (73), тогда как опосредованная основанием SNAr реакция с замещенным спиртовым нуклеофилом дает эфиры (72). Соединения (76) получают конденсацией, катализируемой железом,реагентов Гриньяра с соединениями (71). На схеме R представляет собой алкил или циклоалкил. Схема 15- 15022790 Конденсация соединения (4) с 2-хлор-4-(метилсульфанил)пиримидином (78) давала анилины (79),которые окисляли до сульфонов (8) mCPBA. Замещение сульфонового фрагмента спиртами или тиолами в основных условиях давало соединения (81). Схема 16 Реакция кислот (94) с гидразинкарбоксамидом дает 1,3,4-оксадиазол (97). Альтернативно, амидная конденсация с кислотами (94) дает амиды (98). Дегидрирование амидов (98) сульфамоильной солью дает нитрилы (99). Циклизация нитрилов (99) с гидроксидом аммония дает 1,2,4-оксадиазолы (100). Схема 20 Реакция 2-хлортиазола с (111) в присутствии NaHMDS с последующим бромированием дает (112). Конденсация по Сузуки (1) с (112) дает (113). Гидролиз (113) дает амид (114) и восстановление (113) DIBAL дает амин (115). Схема 22 Кетон (120) реагирует с трет-бутилсульфамидом в присутствии этоксида титана, давая (121). Депротонирование соединения (5) LDA с последующим добавлением (121) и затем расширением цикла действием кислотой и азидом дает (122). Соединения формулы (I), а также промежуточные соединения для их синтеза можно получить согласно способам, описанным на схемах, в способах получения промежуточных соединений и примерах в настоящем изобретении, применяя подходящие соединения, и они дополнительно поясняются следующими конкретными промежуточными соединениями и примерами. Примерные соединения являются представителями настоящего изобретения, и их не следует понимать как ограничивающие объем настоящего изобретения любым способом. Примеры дополнительно иллюстрируют подробности получения соединений настоящего изобретения. Специалисту в данной области техники ясно, что известные варианты защитных групп, реагентов, а также условий и способов следующих способов получения мож- 16022790 но применять для получения промежуточных соединений и соединений настоящего изобретения. Также ясно, что когда химический реагент не является имеющимся в продаже, специалист в данной области техники может легко получить данный химический реагент, или следуя, или изменяя известные способы,описанные в литературе. Все температуры даны в градусах Цельсия, если не указано особо. Массспектры (MS) получали или с помощью масс-спектроскопии с электроспрей ионизацией (ESI) или массспектроскопией с химической ионизацией при атмосферном давлении (APCI). Получение промежуточных соединений и модельных соединений Промежуточное соединение 1. 1-(5-Бром-1,3-тиазол-2-ил)циклобутанол Стадия 1. Комплекс хлорид изопропилмагния/хлорид лития (1,3 М в THF, 582 мл, 756 ммоль) охлаждали до 0 С. Добавляли тиазол (53,2 мл, 749 ммоль) в течение 15 мин, что приводило в результате к оранжево-красному раствору. Перемешивали в течение 20 мин при 0 С, затем удаляли охлаждающую баню и нагревали до комнатной температуры. Перемешивали дополнительные 2 ч, затем повторно охлаждали до 0 С. Добавляли циклобутанол (53,3 мл, 713 ммоль) в течение 50 мин. Удаляли охлаждающую баню и нагревали до комнатной температуры и перемешивали 20 мин при данной температуре. Реакционную смесь охлаждали до 0 С и медленно добавляли насыщенный водный хлорид аммония. Смесь разбавляли EtOAc, слои разделяли и органическую часть промывали водой. Водный слой промывали этилацетатом. Объединенные органические фракции сушили над MgSO4 и концентрировали в вакууме для получения 127,5 г вещества, содержащего 1-(1,3-тиазол-2-ил)циклобутанол, который применяли без дополнительной очистки. Стадия 2. Продукт стадии 1 (171,9 г, 1,107 моль) растворяли в DMF (860 мл) и охлаждали до 0 С. Добавляли NBS (236 г, 1,32 7 моль) и перемешивали 1 ч при 0 С. Удаляли охлаждающую баню и нагревали до комнатной температуры с последующим LC до исчезновения исходных соединений. Раствор выливали в охлажденную воду (2 л), содержащую Na2SO3 (30 г), промывали МТВЕ (1 л). Смесь перемешивали 10 мин, затем разбавляли МТВЕ (1,5 л) и водой (500 мл). Слои разделяли и промывали органическую часть водой (2 л). Водные фракции экстрагировали МТВЕ (2 л). Объединенные органические экстракты сушили над MgSO4 и концентрировали в вакууме для получения оранжевого масла. Разбавляли в гексане при 50 С (1 л). Перемешивали при медленном охлаждении. Добавляли затравку кристаллов, и кристаллизация начиналась в районе 35 С. Перемешивали в течение ночи при комнатной температуре. Охлаждали до -20 С и перемешивали 20 мин. Фильтровали, промывая гексаном при -20 С. Сушили в атмосфере азота для получения 1-(5-бром-1,3-тиазол-2-ил)циклобутанола (172,9 г, 739 ммоль, 67%). Фильтрат и все оставшееся вещество в колбе разбавляли CH2Cl2 и концентрировали в вакууме. Добавляли гексан, концентрировали до 300 мл, охлаждали до комнатной температуры и добавляли затравку кристаллов. Начиналась кристаллизация. Охлаждали до -10 С и фильтровали, промывая гексаном при-10 С. Вторую порцию кристаллов сушили на воздухе, получая 1-(5-бром-1,3-тиазол-2-ил)циклобутанол(38,8 г, 166 ммоль, 15%). Маточник после второй фильтрации концентрировали и очищали колоночной хроматографией на силикагеле (Biotage EtOAc/Hex), затем сушили в вакууме для получения 1-(5-бром 1,3-тиазол-2-ил)циклобутанола (10,6 г, 45 ммоль, 4%). В сумме получали 1-(5-бром-1,3-тиазол-2-ил)циклобутанол (222 г, 948 ммоль, 86%). 1H ЯМР (400 МГц, CDCl3)7,58 (с, 1 Н); 3,56 (уш.с, 1 Н); 2,69-2,60(м, 2 Н); 2,47-2,36 (м, 2 Н); 2,09-1,87 (м, 2 Н). Промежуточное соединение 2. N-(3-бром-5-метилфенил)-4-(трифторметил)пиримидин-2-амин Раствор 3-бром-5-метиланилина (162,5 г, 873,66 ммоль) в 1,4-диоксане (2 л) получали и последовательно добавляли 2-хлор-4-(трифторметил)пиримидин (182 г, 994,54 ммоль) и метансульфокислоту (97,5 г, 1,02 моль). Полученный в результате раствор кипятили с обратным холодильником в течение ночи. Полученную в результате смесь охлаждали и концентрировали в вакууме. Остаток разбавляли 2 л воды,затем доводили рН до 7-8 водным раствором бикарбоната натрия с последующей экстракцией EtOAc(22 л). Органические слои объединяли, промывали водой (22 л), сушили над безводным сульфатом натрия и концентрировали в вакууме. Это давало в результате N-(3-бром-5-метилфенил)-4(трифторметил)пиримидин-2-амин (200 г, 602 ммоль, 69%) в виде светло-желтого твердого остатка.MS(ESI): [М+Н]+ 334,0. 1H ЯМР (400 МГц, CDCl3)8,68 (д, J=4,9 Гц, 1 Н); 7,79 (с, 1 Н); 7,30 (с, 2 Н); 7,107,06 (м, 2 Н); 2,36 (с, 3H). Промежуточное соединение 3. N-[3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]4-(трифтсрметил)пиримидин-2-амин К раствору промежуточного соединения 2 (250 г, 753,01 ммоль) в 1,4-диоксане (3 л) добавляли 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (225 г, 885,83 ммоль), KOAc (225 г, 2,30 моль) и Pd(dppf)Cl2 (19 г, 25,23 ммоль). Полученный в результате раствор кипятили с обратным холодильником в течение ночи. Твердый остаток фильтровали. Фильтрат обесцвечивали пропусканием через колонку с силикагелем. Фракции собирали и концентрировали в вакууме. Это давало в результате 110 г чистого и 150 г неочищенного продукта. Неочищенный продукт обесцвечивали снова активированным углем для получения дополнительных 125 г чистого продукта. Это давало в результате N-[3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-(трифторметил)пиримидин-2-амин (235 г, 620 ммоль, 82%) в виде белого твердого остатка. MS APCI; [М+Н]+ m/z 380. 1H ЯМР(1 Н, с), 7,753 (1 Н, с), 8,608-8,621 (1 Н, д, J=5,2 Гц). Промежуточное соединение 4. N-[3-метил-5-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин 2-амин К раствору промежуточного соединения 3 (80 г, 211,08 ммоль) в 1,4-диоксане (800 мл) добавляли 5 бром-1,3-тиазол (28 г, 171,78 ммоль), Pd(dppf)Cl2 (8 г, 10,62 ммоль) и раствор карбоната натрия (44,7 г,421,70 ммоль) в воде (447 мл). Полученный в результате раствор кипятили с обратным холодильником в течение 1 ч. Затем его охлаждали и концентрировали в вакууме. Остаток разбавляли EtOAc (500 мл) и фильтровали. Фильтрат промывали соляным раствором (2300 мл) и водой (2300 мл). Органический слой сушили над безводным сульфатом натрия и концентрировали в вакууме. Неочищенный продукт кристаллизовали из EtOAc:DCM в соотношении 1:5 для получения 34 г продукта. Маточник наносили на колонку с силикагелем и элюировали смесью дихлорметан/этилацетат (2:1). Это давало в результате N[3-метил-5-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2-амин (42 г, 125 ммоль, 73%) в виде бледно-желтого твердого остатка. MS APCI: [М+Н]+ m/z 337. 1H ЯМР (400 МГц, CD3COCD3, м.д.) 2,413(3H, с), 7,250-7,263 (2 Н, м), 7,636 (1 Н, с), 8,204-8,213 (2 Н, м), 8,834-8,846 (1 Н, д, J=4,8 Гц), 8,970 (1 Н, с),9,210 (1 Н, уш.с). rhSYK активность=. Промежуточное соединение 5. N-(3-бромфенил)-4-(трифторметил)пиримидин-2-амин Получали раствор 3-броманилина (250 г, 1,46 моль) в 1,4-диоксане (2,5 л) и добавляли последовательно 2-хлор-4-(трифторметил)пиримидин (267 г, 1,47 моль) и метансульфокислоту (155 г, 1,61 моль). Полученный в результате раствор грели при 100 С в течение ночи. Полученную в результате смесь охлаждали и концентрировали в вакууме. Остаток доводили до рН 7-8 водным раствором бикарбоната натрия. Твердый остаток фильтровали и фильтрат экстрагировали EtOAc (4500 мл). Органические слои объединяли, промывали водой (22 л), сушили над безводным сульфатом натрия и концентрировали в вакууме. Это давало в результате N-(3-бромфенил)-4-(трифторметил)пиримидин-2-амин (200 г, 629 ммоль, 43%) в виде светло-желтого твердого остатка. MS APCI: [М+Н]+ m/z 319. 1H ЯМР (500 МГц,CDCl3)8,68 (д, J=4,9 Гц, 1 Н); 7,95 (с, 1 Н); 7,53-7,50 (м, 1 Н); 7,44 (уш.с, 1 Н); 7,22 (м, 2 Н); 7,08 (д, J=4,9 Гц, 1 Н). Промежуточное соединение 6. N-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-(трифторметил)пиримидин-2-амин К раствору промежуточного соединения 5 (200 г, 631 ммоль) в 1,4-диоксане (2 л) добавляли 4,4,5,5 тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (177 г, 697 ммоль),KOAc (187 г, 1,91 моль) и Pd(dppf)Cl2 (24 г, 32 ммоль). Полученный в результате раствор грели при 100 С в течение 2 ч. Реакционную смесь охлаждали и твердый остаток фильтровали. Фильтрат концентрировали в вакууме. Остаток наносили на колонку с силикагелем и элюировали этилацетат/петролейный эфир (1:10). Это давало в результате N-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-(трифторметил)пиримидин-2-амин (140 г, 384 ммоль, 61%) в виде белого твердого остатка. MSPd(dppf)Cl2 (1,01 г, 1,23 ммоль) и промежуточное соединение 6 (9,0 г, 25 ммоль) объединяли в колбе и откачивали из нее воздух и повторно заполняли азотом (3). Последовательно добавляли 2-Ме THF (90 мл), 5-бромтиазол (4,45 г, 27,1 ммоль) и водный карбонат натрия (24,7 мл, 49,3 ммоль). Колбу герметично закрывали и грели при 80 С в течение 15 ч. Коричневый раствор охлаждали до комнатной температуры, затем разбавляли водой и EtOAc. Слои разделяли и водную часть экстрагировали EtOAc (2). Объединенные органические фракции промывали насыщенным водным NaHCO3, затем соляным раствором,затем сушили над Na2SO4 и концентрировали в вакууме. Растирание с CH2Cl2 и сбор бежевого твердого остатка фильтрацией давали 5,94 г требуемого продукта. Маточник концентрировали в вакууме и затем очищали колоночной хроматографией на силигеле (CH2Cl2-40% EtOAc:CH2Cl2), получая дополнительные 1,41 г требуемого продукта. В сумме N-[3-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2-амин(7,35 г, 22,8 ммоль, 93%) выделяли в виде бежевого твердого остатка. MS APCI: [М+Н]+ m/z 323. 1H ЯМР(600 МГц, DMSO-d6, м.д.)10,32 (с, 1 Н), 9,06 (с, 1 Н), 8,82 (д, J=4,8 Гц, 1 Н), 8,20 (д, J=8,2 Гц, 1 Н), 8,20 (с,1 Н), 7,64 (д, J=7,5 Гц, 1 Н), 7,40-7,31 (м, 2 Н), 7,27 (д, J=4,9 Гц, 1 Н). rhSYK активность=. Промежуточное соединение 9. N-[3-(2-бром-1,3-тиазол-5-ил)-5-метилфенил]-4-(трифторметил)пиримидин-2-амин Диизопропиламид лития (1,8 М в THF/гептан/этилбензол, 11,4 мл, 20,5 ммоль) охлаждали до -70 С. Медленно добавляли в течение 15 мин промежуточное соединение 4 (2,3 г, 6,8 ммоль) в THF (23 мл),сохраняя температуру равной -65 С. Реакционную смесь перемешивали в течение 30 мин после добавления и затем добавляли бром (0,53 мл, 10,3 ммоль). Реакционную смесь перемешивали в течение 30 мин и затем гасили 20 мл воды и нагревали до комнатной температуры. Реакционную смесь разбавляли EtOAc(50 мл). Слои разделяли и органическую часть промывали Na2SO3 (10% водный), соляным раствором,сушили над MgSO4 и концентрировали в вакууме. Очистка колоночной хроматографией (ISCO, сухая- 18022790 загрузка с силикагелем, гексан-50% EtOAc:гексан) для получения N-[3-(2-бром-1,3-тиазол-5-ил)-5 метилфенил]-4-(трифторметил)пиримидин-2-амина (1,88 г, 4,53 ммоль, 66%). MS APCI: [M+H]+ m/z 414,8, 416,8. 1H ЯМР (600 МГц, CDCl3)8,64 (д, J=4,9, 1H), 7,88 (с, 1 Н), 7,74 (с, 1 Н), 7,33 (c, 1H), 7,05 (т,J=6,4, 1H), 7,01 (с, 1 Н), 2,38 (с, 3H). Промежуточное соединение 10. N-[3-бром-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]4-(трифторметил)пиримидин-2-амин Стадия 1. К раствору 3,5-диброманилина (4,47 г, 17,8 ммоль) и 2-хлор-4-(трифторметил)пиримидина (2,36 мл, 19,6 ммоль) добавляли п-толуолсульфокислоту (4,06 г, 21,4 ммоль), что приводило в результате к образованию густой суспензии. Данную смесь грели при 100 С в течение ночи, в течение данного времени она становилась темно-красным раствором. Смесь разбавляли 200 мл EtOAc и промывали 200 мл насыщенного NaHCO3 (водн.) и 200 мл соляного раствора. Органический слой сушили(Na2SO4) и концентрировали в вакууме. Очистка хроматографией на силикагеле (220 г; загрузка вес/толуол; 100:0-85:15 гексан:EtOAc в течение 45 мин) давала N-(3,5-дибромфенил)-4-(трифторметил)пиримидин-2-амин (5,85 г, 14,7 ммоль, 83%) в виде светло-желтого твердого остатка. MS APCI:[М+Н]+ m/z 397,8. 1 Н ЯМР (400 МГц, CDCl3)8,72 (д, J=4,9 Гц, 1 Н); 7,84 (с, 2 Н); 7,39 (с, 1 Н); 7,34 (с,1 Н); 7,14 (д, J=4,9 Гц, 1 Н). Стадия 2. К раствору продукта стадии 1 (2,0 г, 5,0 ммоль) в DMSO (10,1 мл) добавляли 4,4,5,5 тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (1,4 г, 5,5 ммоль),KOAc (1,48 г, 15,1 ммоль) и Pd(dppf)Cl2 (123 мг, 0,151 ммоль) и смесь грели при 125 С в течение 30 мин в СВЧ-печи. Смесь разбавляли 100 мл EtOAc и промывали 2100 мл 1:1 Н 2 О:соляной раствор. Органический слой сушили (Na2SO4) и концентрировали в вакууме. Очистка хроматографией на силикагеле (80 г; загрузка вес/CH2Cl2; 100:0-70:30 гексан:EtOAc в течение 40 мин) давала N-[3-бром-5-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)фенил]-4-(трифторметил)пиримидин-2-амин (755 мг, 1,70 ммоль, 34%) в виде грязно-белого твердого остатка. 1 Н ЯМР (500 МГц, DMSO-d6)8,86 (д, J=4,9 Гц, 1 Н), 8,25 (с, 1 Н), 7,96(12,8 мл) перемешивали в течение 15 мин. Затем добавляли промежуточное соединение 10 (755 мг, 1,70 ммоль), 5-бром-1,3-тиазол (760 мкл, 8,50 ммоль), фторид калия (296 мг, 5,10 ммоль) и воду (4,25 мл) и смесь грели при 75 С в течение ночи. После охлаждения до комнатной температуры смесь разбавляли 100 мл EtOAc и промывали 100 мл соляного раствора. Светло-желтый твердый остаток оставался нерастворенным на стенках делительной воронки, который соответственно промывали 100 мл THF. Объединенные органические экстракты сушили (Na2SO4) и концентрировали в вакууме. Очистка хроматографией на силикагеле (40 г; сухая загрузка; 100:0-50:50 гексан:EtOAc в течение 25 мин) давала N-[3-бром-5(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2-амин (449 мг, 1,12 ммоль, 66%) в виде грязнобелого твердого остатка. MS APCI: [М+Н]+ m/z 403,0. 1 Н ЯМР (400 МГц, (CD3)2CO)9,46 (с, 1 Н); 9,03 (с,1 Н); 8,89 (д, J=4,9 Гц, 1 Н); 8,32-8,26 (м, 2 Н); 8,16 (с, 1 Н); 7,59 (с, 1 Н); 7,33 (д, J=4,9 Гц, 1 Н). rhSYK активность=. Промежуточное соединение 15. 1-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]циклобутанол Стадия 1. Диоксан (720 мл) в 1 л трехгорлой круглодонной колбе дегазировали в течение 30 мин. Добавляли к дегазированному раствору в атмосфере N2 (г) 3-бром-5-метиланилин (60 г, 193 ммоль), бис(пинаколато)дибор (96 г, 377 ммоль), ацетат калия (42,7 г, 435 ммоль), X-Phos (8,3 г, 17,41 ммоль) иPd2dba3 (3,99 г, 4,35 ммоль). После перемешивания в течение 10 мин при комнатной температуре реакционную смесь грели при температуре внутри колбы, равной 80 С. Через приблизительно 4 ч колбонагреватель удаляли и заменяли баней с ледяной водой. Реакционную смесь охлаждали до 30 С и затем фильтровали через слой целита (промывая 500 мл МТВЕ). Содержимое переносили в 4-л делительную воронку, содержащую 500 мл рН 8 фосфатного буфера, 500 мл соляного раствора и дополнительные 500 мл МТВЕ. Слои разделяли и органическую фазу промывали 1 л 1:1 смеси соляного раствора и воды. Водные слои объединяли и последовательно экстрагировали второй 500 мл порцией МТВЕ. Объединенные органические фазы обрабатывали 100 г MgSO4 и полученную в результате смесь перемешивали в течение 20 мин. Затем ее фильтровали и концентрировали в вакууме. Полученный в результате остаток очищали хроматографией на силикагеле (Biotage, 0-25% этилацетат в гексане) для получения 3-метил-5-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)анилина (66 г, 255 ммоль, 88%) в виде светло-оранжевого твердого остатка. MS APCI: [М+Н]+ m/z 234,2. Стадия 2. В 500-мл трехгорлую круглодонную колбу добавляли 2-метил THF (720 мл) и водный раствор карбоната натрия (2 М, 367 мл, 734 ммоль). Раствор дегазировали в течение 30 мин. Продукт стадии 1 (90 г, 367 ммоль), промежуточное соединение 1 (86 г, 367 ммоль) и PdCl2(dppf) (8,05 г, 11 ммоль) добавляли к дегазированному раствору в атмосфере N2 (г). Полученную в результате смесь перемешивали в течение 5 мин при комнатной температуре и затем грели при 80 С. Через приблизительно 9 ч колбонагреватель удаляли и реакционную смесь охлаждали до 30 С. Реакционную смесь фильтровали- 19022790 через слой SolkaFloc, применяя воду (500 мл) и этилацетат (500 мл) для осуществления переноса. Затем фильтрат переносили в делительную воронку, применяя дополнительные 500 мл этилацетат и 250 мл соляного раствора для завершения переноса. Слои разделяли, органический слой промывали смесью воды и соляного раствора (500 и 250 мл соответственно), и затем водный слой экстрагировали обратно этилацетатом (400 мл). Органические слои объединяли, сушили над MgSO4 (100 г), фильтровали и концентрировали в вакууме для получения коричневого кристаллического остатка. Данное вещество кристаллизовали из горячего этилацетата (250 мл при 60 С), применяя гексан в качестве антирастворителя (750 мл) для получения 1-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]циклобутанола (88 г, 338 ммоль, 92%). MS(326 мл) и колбу дегазировали N2 в течение 1,5 ч перед добавлением комплекса дихлорида 1,1'-бис(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (3,67 г, 4,50 ммоль). Реакцию грели при 100 С в течение ночи и затем охлаждали до комнатной температуры. Реакционную смесь фильтровали через слой целита, промывая этилацетатом. Слои разделяли и водный слой экстрагировали обратно этилацетатом, сушили над Na2SO4 и концентрировали. Остаток очищали хроматографией (0-40% этилацетата в гексане). 3-Метил-5-(1,3-тиазол-5-ил)анилин выделяли в виде желтовато-коричневого твердого остатка(15,33 г, 81 ммоль, 90%). MS ESI: [M+H]+ m/z 191,1. 1H ЯМР (500 МГц, CDCl3)8,71 (с, 1 Н), 8,02 (с, 1 Н),6,80 (с, 1 Н), 6,71 (с, 1 Н), 6,50 (с, 1 Н), 3,71 (с, 2 Н), 1,79 (с, 3H). Промежуточное соединение 18. 4-метил-N-[3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенил]пиримидин-2-амин Стадия 1. Уксусную кислоту (0,234 мл, 4,08 ммоль) добавляли к 2-хлор-4-метилпиримидину (0,5 г,3,89 ммоль) и 3-бром-5-метиланилину (1,096 г, 3,89 ммоль), суспендированным в диоксане (7,78 мл). Реакционную смесь грели при 120 С в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и непосредственно очищали колоночной хроматографией на силикагеле, элюируя смесью этилацетат/гексан для получения N-(3-бром-5-метилфенил)-4-метилпиримидин-2-амина (1,08 г, 3,89 ммоль, количественный) в виде белого твердого остатка. MS ESI: [М+Н]+ m/z 278,0 и 280,0. Стадия 2. В 40-мл пробирку помещали продукт стадии 1 (500 мг, 1,798 ммоль), бис-(пинаколато)дибор (502 мг, 1,977 ммоль), комплекс дихлорида 1,1'-бис-(дифенилфосфино)ферроценпалладия(II) и дихлорметана (44,0 мг, 0,054 ммоль) и ацетат калия (529 мг, 5,39 ммоль). Твердый остаток растворяли в DMSO (7,19 мл) и грели при 120 С. После перемешивания в течение 2 ч смесь охлаждали до комнатной температуры. Реакцию разбавляли этилацетатом, промывали насыщенным водным раствором NaHCO3 и соляным раствором. Органические слои сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане для получения 4-метил-N-[3-метил-5-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)фенил]пиримидин-2-амина (331 мг, 1,018 ммоль, 56,6% выход) в виде оранжевого масла. MS ESI: [М+Н]+ m/z 326,2. 1H ЯМР (500 МГц, DMSO-d6)9,40 (с, 1 Н), 8,31 (д, J=5,0 Гц, 1 Н),7,77 (с, 2 Н), 7,07 (с, 1 Н), 6,70 (д, J=5,0 Гц, 1 Н), 2,33 (с, 3H), 2,26 (с, 3H), 1,27 (с, 12 Н). Промежуточное соединение 19. 4-Метил-N-[3-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин-2-амин В пробирку для СВЧ-печи помещали промежуточное соединение 18 (218 мг, 0,670 ммоль), 5-бром 1,3-тиазол (59,9 мкл, 0,670 ммоль), Pd2(dba)3 (30,7 мг, 0,034 ммоль), X-Phos (32,0 мг, 0,067 ммоль) и карбонат цезия (437 мг, 1,341 ммоль). Систему продували Ar (г) четыре раза перед добавлением диоксана(918 мкл) и воды (92 мкл). Снова систему продували пять раз перед тем, как герметично закрыть пробирку, и треть ее при 100 С. LCMS показала 60% требуемого продукта, 35% продукта, несодержащего бора, и оставшееся непрореагировавшее исходное соединение. Реакционную смесь разбавляли этилацетатом, фильтровали через слой целита и концентрировали. Полученный в результате остаток очищали колоночной хроматографией на силикагеле (Biotage, 0-20% этилацетат в гексане) для получения 4-метилN-[3-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин-2-амина (105 мг, 0,372 ммоль, 55,5%). MS ESI: [M+H]+(11,55 мл). Систему продували Ar (г) три раза перед герметизацией и нагреванием при 120 С в течение 3 ч. Смесь охлаждали и перемешивали в течение ночи. Светло-коричневый твердый остаток собирали фильтрацией и сушили в вакуумной печи в течение ночи для получения N-(3-бром-5-метилфенил)-4 метоксипиримидин-2-амина (1,7 г, 5,78 ммоль, 100% выход) в виде коричневого твердого остатка. MS- 20022790 Стадия 2. В 10-20-мл пробирку для СВЧ-печи помещали продукт стадии 1 (1,6 г, 5,44 ммоль), бис(пинаколато)дибор (1,519 г, 5,98 ммоль), комплекс дихлорида 1,1'-бис-(дифенилфосфино)ферроценпалладия(II) с дихлорметаном (0,133 г, 0,163 ммоль), ацетат калия (1,602 г, 16,32 ммоль) и DMSO (10,88 мл. Систему продували пять раз Ar (г) перед герметизацией пробирки и грели ее при 120 С в течение 1 ч. Реакцию охлаждали до комнатной температуры, разбавляли этилацетатом, фильтровали через слой целита и концентрировали досуха. Полученный в результате остаток очищали колоночной хроматографией на силикагеле (Biotage, 5-60% этилацетата в гексане) для получения 4-метокси-N-[3-метил-5-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидин-2-амина (900 мг, 2,64 ммоль, 48,5% выход) в виде коричневого твердого остатка. MS ESI: [M+H]+ m/z 342,1. 1H ЯМР (500 МГц, DMSO-d6)9,46 (с,1 Н), 8,17 (д, J=5,8 Гц, 1 Н), 8,04 (с, 1 Н), 7,62 (с, 1 Н), 7,06 (с, 1 Н), 6,25 (д, J=5,8 Гц, 1H), 3,92 (с, 3H), 2,26 (с,3H), 1,26 (с, 12 Н). Промежуточное соединение 21. 4-Метокси-N-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин-2-амин В круглодонную колбу добавляли 2-хлор-4-метоксипиримидин (1,58 г, 10,93 ммоль), промежуточное соединение 20 (2 г, 10,51 ммоль), карбонат цезия (6,85 г, 21,02 ммоль) и дегазированный диоксан(0,912 г, 1,577 ммоль). Систему снова продували три раза Ar (г) и затем грели при 90 С в течение 2 ч. Реакцию охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении, и остаток непосредственно очищали колоночной хроматографией на силикагеле (0-100%, 10:1 этилацетат:метанол в гексане) для получения 4-метокси-N-[3-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин-2 амина (3,1 г, 10,39 ммоль, 99%). MS ESI: [М+Н]+ m/z 299,1. 1 Н ЯМР (600 МГц, CDCl3)8,72 (с, 1 Н), 8,13(с, 3H), 2,37 (с, 3H). Промежуточное соединение 24. Метил 2,2-диметил-4-оксоциклогексанкарбоксилат Стадия 1. Метил-3-оксобутаноат (232 г, 2,00 моль) и параформальдегид (30 г, 999,00 ммоль) объединяли и к смеси добавляли пиперидин (10 г, 117,44 ммоль). Полученный в результате раствор перемешивали в течение 2 ч при 0 С. Раствор грели при 60 С в течение 2 ч, экстрагировали Et2O (3) и органические слои объединяли и сушили над Na2SO4. Фильтровали и концентрировали в вакууме. Это давало в результате 370 г (неочищенный) диметил 2-метил-6-оксоциклогекс-1-ен-1,3-дикарбоксилата в виде коричневого масла. MS: [M+H]+ m/z 227. Стадия 2. К раствору метилата натрия (90 г, 1,67 моль) в метаноле (300 мл) добавляли по каплям продукт стадии 1 (150 г, 663,04 ммоль) в метаноле (150 мл) при перемешивании в течение 5 мин. Полученный в результате раствор грели при 80 С в течение 30 мин и смесь концентрировали в вакууме. Затем реакционную смесь гасили добавлением смеси Н 2 О/лед (120 мл), затем разбавляли уксусной кислотой(130 мл). Полученный в результате раствор экстрагировали Et2O (3) и органические слои объединяли и сушили над Na2SO4, фильтровали и концентрировали в вакууме. Конечный продукт очищали перегонкой при пониженном давлении (5 мм Hg) и фракцию собирали при 110-120 С. Это давало в результате 100 г(88%) метил 2-метил-4-оксоциклогекс-2-енкарбоксилата в виде желтого масла. MS: [M+H]+ m/z 169. Стадия 3. Йодид меди (121,8 г, 63 9,54 ммоль) добавляли к Et2O (800 мл). Добавляли по каплям при-40 С в течение 3 ч метиллитий (1,6 М в диэтиловом эфире, 800 мл, 1,28 моль). Добавляли раствор продукта стадии 2 (53,8 г, 319,88 ммоль) в Et2O (400 мл) при -40 С в течение 2 мин. Полученный в результате раствор перемешивали 5 ч при -20 С. Гасили добавлением насыщенного водного хлорида аммония(2,5 л). Экстрагировали EtOAc (32 л). Объединенные органические экстракты сушили над Na2SO4,фильтровали и концентрировали в вакууме. Остаток очищали элюированием с колонки с силикагелем 1:20 EtOAc/PE системой растворителей. Это давало в результате 45 г (73%) метил 2,2-диметил-4 оксоциклогексанкарбоксилата в виде желтого масла. MS: [M+H]+ m/z 185. 1H ЯМР (600 МГц, CDCl3)3,49 (с, 3H), 2,43-2,40 (м, 1 Н), 2,35-2,29 (м, 1 Н), 2,21-2,17 (м, 1 Н), 2,11-2,04 (м, 1 Н), 2,00-1,96 (м, 1 Н),1,91-1,85 (м, 1 Н), 0,35 (с, 3H), 0,77 (с, 3H). Промежуточное соединение 25. Рацемический цис-метил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси 2,2-диметилциклогексанкарбоксилат Стадия 1. н-Бутиллитий (2,2 мл, 5,5 ммоль, 2,5 М раствор в гексане) добавляли по каплям в течение 12 мин к раствору тиазола (0,515 г, 6,05 ммоль) в тетрагидрофуране (15 мл) при -78 С. Через 30 мин непрозрачную желтую суспензию переносили в течение 5 мин через охлажденную сухим льдом канюлю к раствору промежуточного соединения 24 (1,013 г, 5,5 ммоль) в тетрагидрофуране (15 мл) при -78 С. Полученный в результате желтый раствор выдерживали при -78 С в течение 1 ч, переносили в баню в течение 15 мин и затем охлаждали до -78 С. Добавляли водный насыщенный раствор хлорида аммония (10 мл) и смесь нагревали до комнатной температуры. Двухфазную смесь распределяли между этилацетатом(50 мл) и водой (5 мл); слои разделяли и водный слой экстрагировали этилацетатом (15 мл). Объединенные органические слои промывали соляным раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенное вещество очищали хроматографией на силикагеле (Biotage 100 г SNAP колонка, 90:10-65:35 гексан:этилацетат) для получения рацемического цис-метил-4-гидрокси-2,2-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата в виде белого твердого остатка (1,08 г, 73% выход).MS APCI: [М+Н]+ m/z 270,1. Стадия 2. К раствору продукта стадии 1 (0,35 г, 1,3 ммоль) в N,N-диметилформамиде (1,9 мл) добавляли N-бромсукцинимид (0,254 г, 1,429 ммоль). Через 3 ч добавляли дополнительную порцию Nбромсукцинимида (0,046 г, 0,258 ммоль). После дополнительного часа реакционную смесь распределяли между этилацетатом (25 мл), водным насыщенным тиосульфатом натрия (10 мл) и водой (5 мл). Слои разделяли и органический слой промывали водой (35 мл) и соляным раствором (10 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Неочищенный продукт очищали хроматографией на силикагеле (Biotage 100 г SNAP колонка, 95:5-75:25 гексан:этилацетат) для получения рацемического цис-метил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-2,2-диметилциклогексанкарбоксилата в виде белого твердого остатка (286,8 мг, 63% выход). MS APCI: [М+Н]+ m/z 348,0, 350,0. 1H ЯМР (500 МГц, CDCl3)7,58 (с, 1 Н); 3,69 (с, 3H); 2,45 (с, 1 Н); 2,36 (м, 1 Н); 2,21 (м, 1 Н); 1,94 (м, 3H); 1,75 (м, 2 Н); 1,19 (с, 3H); 1,06 (с, 3H). Промежуточное соединение 26. 5-Бром-2-(1-метоксициклобутил)-1,3-тиазол Гидрид натрия (60% дисперсия в минеральном масле) (47,0 мг, 1,175 ммоль) добавляли при 0 С к раствору промежуточного соединения 1 (250 мг, 1,068 ммоль) в DMF (3 мл) и THF (3 мл), и смесь реагировала в течение 1 ч. Добавляли метилйодид (0,080 мл, 1,281 ммоль), и смесь дополнительно реагировала в течение 2 ч. Реакционную смесь выливали в разбавленный водный NH4Cl и экстрагировали дважды диэтиловым эфиром. Органические фракции концентрировали и остаток пропускали через слой силикагеля, элюируя 1:10 этилацетат:гексан для получения 2-бром-5-(1-метоксициклобутил)-1,3-тиазола (225 мг, 85%). 1 Н ЯМР (500 МГц, (CD3)2CO)7,73 (с, 1 Н); 3,19 (с, 3H); 2,54-2,40 (м, 4 Н); 1,92-1,82 (м, 2 Н). Промежуточное соединение 27. 2-Хлор-4-этилпиримидин Этилмагнийбромид (1,0 М в THF, 71,4 мл, 71,4 ммоль) добавляли по каплям при -78 С к раствору 2,4-дихлорпиримидина (10 г, 67,1 ммоль) в THF (125 мл). После перемешивания в течение 1 ч добавляли насыщенный водный NH4Cl при -78 С и реакцию нагревали до комнатной температуры при перемешивании. Затем реакционную смесь экстрагировали этилацетатом. Органический слой промывали насыщенным водным NaHCO3, затем сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом и гексаном для получения 2-хлор-4-этилпиримидин (5,031 г, 18,70 ммоль, 27,9%) в виде 53:47 региоизомерной смеси. Промежуточное соединение 29. 2-Хлор-4-циклопропилпиримидин 2,4-Дихлорпиримидин (15 г, 101 ммоль), циклопропилбороновую кислоту (8,65 г, 101 ммоль),PdCl2(dppf)-CH2Cl2 аддукт (8,22 г, 10,07 ммоль) и фосфат калия (53,4 г, 252 ммоль) объединяли в 1-л круглодонной колбе, добавляли THF (503 мл), и суспензию кипятили с обратным холодильником при перемешивании в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, концентрировали до 100 мл при пониженном давлении, экстрагировали этилацетатом, промывали насыщенным водным NaHCO3, соляным раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле, элюируя этилацетатом в гексане для получения 2-хлор-4-циклопропилпиримидина (10,124 г, 58,3 ммоль, 57,9%) в виде 89:11 смеси региоизомеров. Промежуточное соединение 32. 4-Метил-N-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидин-2-амин В колбу, содержащую 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (1,50 г, 6,85 ммоль) и 2-хлор-4-метилпиримидин (1,01 г, 7,87 ммоль), добавляли диоксан (69 мл) и метансульфокислоту (0,51 мл, 7,87 ммоль). Реакцию грели при 100 С в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, промывали водой, сушили над сульфатом магния, фильтровали и концентрировали. Флэш-хроматографию применяли для очистки, получая 4-метил-N-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидин-2-амин (1,23 г, 3,95 ммоль, 58% выход). MS ESI:[М+Н]+ m/z 312. 1H ЯМР (500 МГц, DMSO-d6)9,48 (с, 1 Н), 8,30 (д, J=5,0 Гц, 1 Н), 7,98 (д, J=8,0 Гц, 1 Н),7,95 (с, 1 Н), 7,29-7,20 (м, 2 Н), 6,71 (д, J=5,0 Гц, 1H), 2,33 (с, 3H), 1,28 (с, 12 Н). Промежуточное соединение 35. 4-Этил-N-[3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенил]пиримидин-2-амин Стадия 1. В 1-л 3-горлую колбу, содержащую 3-бром-5-метиланилин (60 г, 290 ммоль), бис(пинаколато)дибор (96 г, 377 ммоль), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (8,3 г, 17,4 ммоль), дибензилиденацетон палладия (3,99 г, 4,35 ммоль) и ацетат калия (42,7 г, 435 ммоль), добавляли 1,4-диоксан (720 мл), который дегазировали барботированием азота в течение 30 мин. После продувки колбы азотом в течение 2 мин реакционную смесь грели при температуре внутри колбы 80 С в течение 4 ч. После охлаждения реакционную смесь фильтровали через слой целита и затем целит промывали метилтрет-бутиловым эфиром (500 мл). Полученный в результате раствор разбавляли метилтретбутиловым эфиром (500 мл), рН 8 фосфатным буфером (500 мл) и соляным раствором (500 мл). Слои разделяли и органический слой промывали полунасыщенным соляным раствором (1 л). Водные слои,которые держали отдельно, последовательно экстрагировали обратно метилтрет-бутиловым эфиром (500- 22022790 мл). Объединенные органические экстракты сушили над сульфатом магния, фильтровали и концентрировали. Неочищенное вещество очищали флэш-хроматографией на силикагеле (0-90% этилацетат/гексан) и полученный в результате светло-оранжевый твердый остаток сушили в течение ночи в атмосфере азота для получения 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (67,7 г, 255 ммоль, 88% выход, 90% чистота). MS ESI: [М+Н]+ m/z 234,1. Стадия 2. Раствор 2-хлор-4-этилпиримидина (0,98 г, 7,00 ммоль), продукта стадии 1 (1,794 г, 7,70 ммоль) и метансульфокислоты (0,50 мл, 7,70 ммоль) в 1,4-диоксане (30 мл) герметично закрывали в 100 мл пробирке, выдерживающей большое давление, с завинчивающейся крышкой и грели при 110 С в течение 15 ч. Колбу охлаждали, добавляли дополнительную порцию 2-хлор-4-этилпиримидина (0,145 г,1,05 ммоль) и колбу повторно герметично закрывали и грели в течение следующих 6,5 ч. Реакционную смесь охлаждали, разбавляли этилацетатом (70 мл), промывали насыщенным водным раствором бикарбоната натрия (25 мл) и соляным раствором (25 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Полученный в результате красновато-коричневый твердый остаток 4-этил-N-[3-метил-5(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]пиримидин-2-амина (3,44 г в виде 80:20 в/в смесь с 1,4-диоксаном) применяли без дополнительной очистки. MS ESI: [М+Н]+ m/z 340,1. Промежуточное соединение 36. N-[3-Циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2 ил)фенил]-4-метилпиримидин-2-амин Стадия 1. Раствор 3,5-диброманилина (2,93 г, 11,67 ммоль), 2-хлор-4-метилпиримидина (1,5 г, 11,67 ммоль) и уксусной кислоты (0,701 мл, 12,25 ммоль) в 1,4-диоксане (23,5 мл) герметично закрывали в герметичной колбе в атмосфере аргона и грели при 120 С в течение 17 ч. После охлаждения до комнатной температуры реакционную смесь распределяли между этилацетатом (100 мл) и насыщенным водным раствором бикарбоната натрия (40 мл). Слои разделяли и органический слой промывали соляным раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Флэш-хроматография на силикагеле (10-30% этилацетат/гексан) давала N-(3,5-дибромфенил)-4-метилпиримидин-2-амин (3,6 г, 9,97 ммоль, 85% выход, 95% чистота) в виде светло-желтого твердого остатка. MS ESI: [M+H]+ m/z 343,8. Стадия 2. Смесь 1,4-диоксана (40 мл) и водного карбоната натрия (2 М, 10,50 мл, 20,99 ммоль) барботировали аргоном в течение 15 мин и затем выливали в колбу, содержащую продукт стадии 1 (3,6 г,9,97 ммоль, 85% выход, 95% чистота и PdCl2(dppf)-CH2Cl2 аддукт (0,686 г, 0,840 ммоль). Добавляли циклопропилбороновую кислоту (1,037 г, 12,07 ммоль) с последующим присоединением холодильника, и все систему помещали в атмосферу аргона с помощью пяти циклов вакуумирования/продувки аргоном. Реакционную смесь кипятили с обратным холодильником в течение 18 ч и затем охлаждали до комнатной температуры и разбавляли этилацетатом (100 мл) и насыщенном водным бикарбонатом натрия. Слои разделяли и органический слой промывали соляным раствором, сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали обращено-фазовой ВЭЖХ (45-80% ацетонитрил/вода с 0,10%TFA буфером). Фракции, содержащие требуемый продукт, разбавляли этилацетатом и насыщенным водным бикарбонатом натрия. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали для получения N-(3-бром-5-циклопропилфенил)-4-метилпиримидин-2-амина (443,6 мг,1,31 ммоль, 13% выход) в виде коричневого масла. MS ESI: [M+H]+ m/z 306,0. Стадия 3. Раствор продукта стадии 2 (443,6 мг, 1,458 ммоль), бис-(пинаколато)дибора (407 мг, 1,604 ммоль), PdCl2(dppf)-CH2Cl2 аддукта (119 мг, 0,146 ммоль) и ацетата калия (429 мг, 4,37 ммоль) в диметилсульфоксиде грели в атмосфере аргона в СВЧ-печи в течение 10 мин при 150 С. Реакционную смесь разбавляли диэтиловым эфиром (40 мл), этилацетатом (40 мл) и насыщенным водным раствором бикарбоната натрия (30 мл) и затем фильтровали для удаления твердых веществ, которые не растворились. Слои разделяли и органический слой промывали водой (325 мл) и соляным раствором (25 мл), сушили над сульфатом натрия, фильтровали и концентрировали. Полученный в результате неочищенный продукт очищали хроматографией на силикагеле (5-30% этилацетат/гексан) для получения N-[3 циклопропил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-4-метилпиримидин-2-амина (186,1 мг, 0,53 ммоль, 36% выход, приблизительно 75% чистота) в виде белого твердого остатка. Вещество применяли в следующих стадиях в данной неочищенной форме. MS ESI: [M+H]+ m/z 352,2. Промежуточное соединение 39. (4-Дифторметилпиримидин-2-ил)-[3-метил-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]амин Стадия 1. К раствору ангидрида дифторуксусной кислоты (50 г, 287 ммоль) в CH2Cl2 (300 мл), охлажденному до -20 С, добавляли DMAP (0,351 г, 2,87 ммоль) с последующим добавлением этилвинилового эфира (13,8 мл, 144 ммоль) при такой скорости, чтобы температура внутри колбы не превышала-10 С. После завершения содержимое колбы перемешивали при 0 С в течение 12 ч перед медленным нагреванием до комнатной температуры в течение следующих 6 ч. Добавляли воду вместе с CH2Cl2, слои разделяли и органический слой промывали последовательно водным насыщенным NaHCO3 и затем соляным раствором. Органический слой сушили MgSO4, фильтровали, концентрировали в вакууме. Затем остаток растворяли в EtOH (162 мл), погружали в ледяную баню и затем добавляли мочевину (17,25 г,287 ммоль) с последующим добавлением концентрированной HCl (43 мл) при такой скорости, чтобы температура внутри колбы не превышала 20 С. После завершения добавления охлаждающую баню удаляли и полученную в результате смесь перемешивали в течение 18 ч перед концентрированием в вакуу- 23022790 ме. Добавляли EtOH и смесь концентрировали второй раз, затем повторяли 2 EtOAc. Остаток разбавляли EtOAc (100 мл), гетерогенную смесь перемешивали в течение 10 мин и затем растворитель декантировали. Это повторяли еще дважды, затем светло-коричневый твердый остаток сушили в вакууме в течение 48 ч перед разбавлением оксихлоридом фосфора (215 мл, 2310 ммоль). Полученную в результате суспензию грели при 105 С в течение 90 мин, в течение которых наблюдалось, что смесь становится гомогенной. Реакционную смесь охлаждали до комнатной температуры, выливали осторожно в 4-л охлажденную колбу, содержащую 2 л льда и температурный зонд. Смесь перемешивали в течение 1 ч до прекращения выделения тепла, после чего содержимое переносили в делительную воронку с дополнительным CH2Cl2. Слои разделяли, водный слой экстрагировали CH2Cl2 (2). Затем объединенные органические фракции сушили MgSO4, фильтровали и концентрировали в вакууме (200 мм рт.ст., 40 С) до оранжевого масла. Продукт помещали в вакуум в течение 1 мин для получения 2-хлор-4-дифторметилпиримидина (31 г, 62,5 вес.% раствор в CH2Cl2 по 1 Н ЯМР, 118 ммоль). 1H ЯМР (600 МГц, CDCl3)8,82 (д, J=5,0 Гц, 1H), 7,57 (д, J=5,0 Гц, 1H), 6,51 (т, J=54,4 Гц, 1 Н). Стадия 2. Продукт стадии 1 (4,75 г, 23 ммоль) и 3-бром-5-метиланилин (5,59 г, 30 ммоль) разбавляли диоксаном (33 мл), к которому добавляли АсОН (1,32 мл, 23 ммоль). Полученную в результате смесь кипятили с обратным холодильником и перемешивали в течение 30 ч, после чего ее повторно охлаждали до комнатной температуры, разбавляли CH2Cl2 и наносили на силикагель для очистки флэшхроматографией для получения N-(3-бром-5-метилфенил)-4-(дифторметил)пиримидин-2-амина (5,2 г,16,6 ммоль). 1H ЯМР (600 МГц, CDCl3)8,58 (д, J=4,9 Гц, 1H), 7,75 (с, 1 Н), 7,32 (с, 1 Н), 7,21 (с, 1 Н), 7,066,92 (м, 2 Н), 6,50-6,27 (м, 1 Н), 2,30 (с, 3H). Стадия 3. Продукт стадии 2 (0,5 г, 1,6 ммоль), бис-(пинаколато)дибор (0,4 65 г, 1,8 3 ммоль), ацетат калия (0,469 г, 4,78 ммоль) и PdCl2(dppf)-CH2Cl2 аддукт (0,065 г, 0,08 ммоль) разбавляли дегазированным диоксаном (3,5 мл) и кипятили с обратным холодильником в течение 2 ч, затем повторно охлаждали до комнатной температуры. Смесь разбавляли CH2Cl2 и добавляли воду. Слои разделяли, органический слой сушили над MgSO4, фильтровали и концентрировали в вакууме и неочищенный остаток очищали флэшхроматографией для получения(4-дифторметилпиримидин-2-ил)-[3-метил-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]амина (550 мг, 1,52 ммоль) MS ESI: [M+H]+ m/z 362,1. 1H ЯМР (600 МГц, CDCl3)8,56 (д, J=4,1 Гц, 1 Н), 7,74 (с, 1 Н), 7,59 (с, 1 Н), 7,45 (с, 1 Н), 7,35 (с, 1 Н), 6,94 (д, J=4,2 Гц,1H), 6,38 (т, J=55,0 Гц, 1H), 2,36 (с, 3H), 1,33 (с, 12 Н). Промежуточное соединение 41. N-[3-циклопропил-5-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2-амин В колбу добавляли N-[3-(бромметил)-5-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2 амин (523 мг, 1,30 ммоль), циклопропилбороновую кислоту (336 мг, 3,91 ммоль), фосфат калия (968 мг,4,56 ммоль), Pd(OAc)2 (15 мг, 0,07 ммоль) и трициклогексилфосфин (37 мг, 0,13 ммоль). Добавляли дегазированный толуол (10 мл) и воду (0,5 мл) и раствор вакуумировали и затем продували аргоном 5 раз. Затем смесь грели в СВЧ-печи при 130 С в течение 30 мин. Реакцию разбавляли этилацетатом, промывали водой, сушили над сульфатом магния, фильтровали и концентрировали. Флэш-хроматографию применяли для очистки и получения N-[3-циклопропил-5-(1,3-тиазол-5-ил)фенил]-4-(трифторметил)пиримидин-2-амина (384 мг, 1,06 ммоль, 81% выход). MS ESI: [M+H]+ m/z 363. 1H ЯМР (500 МГц, DMSOd6)10,23 (с, 1 Н), 9,06 (с, 1 Н), 8,83 (д, J=4,8 Гц, 1 Н), 8,23 (с, 1 Н), 7,92 (с, 1 Н), 7,41 (с, 1 Н), 7,28 (д, J=4,9 Гц, 1H), 7,12 (с, 1 Н), 2,03-1,80 (м, 1 Н), 1,05-0,92 (м, 2 Н), 0,78-0,61 (м, 2 Н). Промежуточное соединение 43. 4-Циклопропил-N-[3-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин-2 амин К раствору 4-циклопропил-N-(3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиримидин-2-амина (750 мг, 2,14 ммоль) в 2-метилтетрагидрофуране (10,7 мл) добавляли 5-бромтиазол (406 мг, 2,35 ммоль), PdCl2(dppf)-CH2Cl2 (87 мг, 0,11 ммоль) и водный карбонат натрия (2 М, 2,14 мл). Реакционную смесь герметично закрывали и продували N2 в течение 5 мин. Реакционную смесь перемешивали при 80 С в течение 16 ч и охлаждали до комнатной температуры. Добавляли воду и экстрагировалиEtOAc (3). Объединенные органические слои сушили (сульфат магния), концентрировали и очищали флэш-хроматографией для получения 4-циклопропил-N-[3-метил-5-(1,3-тиазол-5-ил)фенил]пиримидин 2-амина (600 мг, 1,95 ммоль, 91% выход) в виде грязно-белого твердого остатка. MS ESI: [M+H]+ m/z 309,1. 1H ЯМР (500 МГц, DMSO-d6)9,49 (с, 1 Н), 9,06 (с, 1 Н), 8,26 (д, J=5,0 Гц, 1 Н), 8,19 (с, 1 Н), 8,04 (с,1 Н), 7,43 (с, 1 Н), 7,10 (с, 1 Н), 6,82 (д, J=5,0 Гц, 1H), 2,29 (с, 3H), 2,00 (м, 1 Н), 1,17-0,93 (м, 4 Н). Промежуточное соединение 44. 4-Изопропил-N-(3-метил-5-(тиазол-5-ил)фенил)пиримидин-2-амин К раствору 4-изопропил-N-(3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пиримидин-2-амина (500 мг, 1,42 ммоль) в 2-метилтетрагидрофурана (7,1 мл) добавляли 5-бромтиазол (318 мг, 1,84 ммоль), PdCl2(dppf)-CH2Cl2 (58 мг, 0,07 ммоль) и водный карбонат натрия (2 М, 1,42 мл). Реакционную смесь герметично закрывали и продували N2 в течение 5 мин. Реакционную смесь перемешивали при 80 С в течение 16 ч и охлаждали до комнатной температуры. Добавляли воду и экстрагировалиEtOAc (3). Объединенные органические слои сушили над сульфатом магния, концентрировали в вакууме и очищали флэш-хроматографией для получения 4-изопропил-N-(3-метил-5-(тиазол-5-ил)фе- 24022790 нил)пиримидин-2-амина (366 мг, 1,18 ммоль, 83% выход) в виде грязно-белого твердого остатка. MS ESI:[М+Н]+ m/z 311,1. 1H ЯМР (500 МГц, DMSO-d6)9,59 (с, 1 Н), 9,05 (с, 1 Н), 8,38 (д, J=4,7 Гц, 1 Н), 8,19 (с,1 Н), 8,13 (с, 1 Н), 7,51 (с, 1 Н), 7,11 (с, 1 Н), 6,77 (д, J=5,1 Гц, 1 Н), 2,87 (м, 1 Н), 2,30 (с, 3H), 1,25 (д, J=6,8 Гц, 6H). Промежуточное соединение 46. 3-Метил-N-(пентафторэтил)фенил]-5-(1,3-тиазол-5-ил)анилин К раствору 2-хлор-4-(пентафторэтил)пиримидина (61 мг, 0,26 ммоль) и 3-метил-5-(1,3-тиазол-5 ил)анилина (50 мг, 0,26 ммоль) в дегазированном 1,4-диоксане (1,1 мл) добавляли ксантфос (23 мг, 0,039 ммоль), Pd(OAc)2 (5,9 мг, 0,026 ммоль) и Cs2CO3 (172 мг, 0,53 ммоль) и реакционную смесь грели при 100 С в течение 30 мин. После охлаждения реакционную смесь распределяли между EtOAc (10 мл) и насыщенным водным бикарбонатом натрия. Слои разделяли и водную фазу экстрагировали EtOAc (10 мл). Объединенные органические фазы промывали насыщенным водным хлоридом натрия (10 мл), сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка на силикагеле (20-60% этилацетата в гексане) давала 3-метил-N-[3-(пентафторэтил)фенил]-5-(1,3-тиазол-5 ил)анилин (13 мг, 13%) в виде бесцветной пены. MS ESI: [M+H]+ m/z 387,0. Промежуточное соединение 54. 2-Хлор-4-(пропан-2-илокси)пиримидин К раствору 2,4-дихлорпиримидина (5,0 г, 34 ммоль) в 2-пропаноле (84 мл) добавляли Cs2CO3 (12 г,37 ммоль) и смесь перемешивали при комнатной температуре в течение 16 ч. Затем реакционную смесь грели при 65 С в течение 3 ч, после чего реакционную смесь фильтровали и концентрировали. Очистка на силикагеле, применяя градиентную систему растворителей 0-10% EtOAc/гексан, давала 2-хлор-4(пропан-2-илокси)пиримидин (2,4 г, 41%) в виде бесцветного масла. 1H ЯМР (500 МГц, CDCl3)8,23 (д,J=5,7 Гц, 1H), 6,56 (д, J=5,7 Гц, 1H), 5,38 (гепт, J=6,2 Гц, 1H), 1,34 (д, J=6,2 Гц, 6H). Промежуточное соединение 55. 4-трет-Бутил-2-хлорпиримидин В сухую колбу, содержащую 2-хлорпиримидин (1,0 г, 8,7 ммоль), добавляли безводный Et2O (8,7 мл) и раствор охлаждали до -30 С. Добавляли по каплям трет-BuLi (1,7 М раствор в н-пентане, 5,7 мл, 9,6 ммоль) и реакционную смесь выдерживали при -30 С в течение 30 мин. Реакционную смесь нагревали до 0 С и перемешивали при данной температуре в течение 30 мин, после чего реакцию прекращали добавлением по каплям раствора уксусной кислоты (0,60 мл, 10,5 ммоль) в THF (3 мл) и воды (1 мл). Реакционную смесь выдерживали при 0 С и добавляли раствор DDQ (2,38 г, 10,5 ммоль) в THF (8,7 мл). Через 15 мин добавляли NaOH (1 M, 1 мл) и воду (10 мл) и черную реакционную смесь переносили в делительную воронку, содержащую EtOAc (50 мл) и воду (50 мл). Слои разделяли и водный слой экстрагировали один раз EtOAc (50 мл). Объединенные органические фазы промывали насыщенным водным хлоридом натрия (50 мл), сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Нанесение маслянистого черного остатка на силикагель с последующей хроматографией на силикагеле, применяя градиентную систему растворителей 530% EtOAc/гексан, давали 4-трет-бутил-2 хлорпиримидин (1,00 г, 67%) в виде бледно-желтого масла. 1 Н ЯМР (500 МГц, CDCl3)8,49 (д, J=5,2 Гц,1H), 7,24 (д, J=5,2 Гц, 1 Н), 1,33 (с, 9 Н). Промежуточное соединение 62. 2-Хлор-4-(1-фторэтил)пиримидин К раствору 1-(2-хлорпиримидин-4-ил)этанола (150 мг, 0,950 ммоль) в дихлорметане (3 мл) при 0 С добавляли по каплям трифторид диэтиламиносеры (183 мг, 1,14 ммоль) и перемешивали в течение 3 ч. Раствор разбавляли дихлорметаном, промывали насыщенным водным NaHCO3, сушили над MgSO4 и концентрировали досуха. Очистка на силикагеле флэш-хроматографией (0-50% EtOAc/гексан) давала 2 хлор-4-(1-фторэтил)пиримидин (75 мг, 0,467 ммоль, 49% выход) в виде желтого масла. MS ESI: [M+H]+m/z 161,0. 1H ЯМР (500 МГц, CDCl3)8,67 (д, J=4,2 Гц, 1H), 7,46 (д, J=4,2 Гц, 1 Н), 5,58 (дк, J=6,7 Гц, 48,1 Н), 1,74-1,57 (м, 3H). Промежуточное соединение 70. 2-Хлор-4-(дифторметил)пиримидин В 500-мл 3-горлую круглодонную колбу, продутую и заполненную азотом, помещали раствор 2 хлорпиримидин-4-карбальдегида (15,0 г, 104 ммоль, 1,00 экв., 98%) в дихлорметане (200 мл). За этим следовало добавление по каплям трифторида бис-(2-метоксиэтил)аминосеры (46,0 г, 208 ммоль, 2,00 экв.,100%) при перемешивании при 0 С в течение 30 мин. Полученный в результате раствор перемешивали в течение 2 ч при 0 С, затем гасили добавлением 50 мл воды. Полученный в результате раствор экстрагировали 3100 мл дихлорметаном. Органические слои объединяли, сушили над безводным сульфатом натрия и концентрировали в вакууме. Остаток наносили на колонку с силикагелем и элюировали(1,2 М в THF, 37,7 мл, 45 ммоль). Медленно добавляли раствор тиазола (3,5 г, 41 ммоль) в THF (20 мл). Реакционную смесь перемешивали в течение 1 ч. Добавляли раствор трет-бутил-4-оксоциклогексанкарбоксилата (12,23 г, 62 ммоль) в THF (20 мл), и реакционную смесь перемешивали в течение 3 ч. За- 25022790 тем, реакцию прекращали медленным добавлением насыщенного хлорида аммония и разбавляли этилацетатом. Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали. Флэш-хроматографию применяли для очистки и получения трет-бутил-4-гидрокси-4-(1,3-тиазол-2 ил)циклогексанкарбоксилата (9,25 г, 33 ммоль, 79% выход). MS ESI: [M+H]+ m/z 284,1. Стадия 2. В колбу, содержащую продукт стадии 1 (9,25 г, 33 ммоль), добавляли DMF (36 мл) и затем N-бромсукцинимид (6,97 г, 32 ммоль). Реакционную смесь перемешивали до завершения LCMS. Реакцию разбавляли водой и этилацетатом. Органический слой отделяли, сушили над сульфатом магния,фильтровали и концентрировали. Флэш-хроматографию применяли для очистки и получения трет-бутил 4-(5-бром-1,3-тиазол-2-ил)-4-гидроксициклогексанкарбоксилата (9,24 г, 25,5 ммоль, 78% выход). MS ESI:(1,6 г, 6,96 ммоль), продукт стадии 2 (2,52 г, 6,96 ммоль), дициклогексил[2',4',6'-три(пропан-2-ил)бифенил-2-ил]фосфан (0,33 г, 0,70 ммоль), Pd2(dba)3 (0,32 г, 0,35 ммоль), карбонат цезия (6,80 г, 20,9 ммоль),добавляли дегазированную смесь диоксана (23 мл) и воды (2,3 мл). Раствор вакуумировали и затем продували аргоном 5 раз, затем грели при 100 С в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатомом, промывали водным насыщенным бикарбонатом натрия, сушили над сульфатом магния, фильтровали и концентрировали. Флэш-хроматографию применяли для очистки и получения трет-бутил-4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидроксициклогексанкарбоксилата. MS ESI: [M+H]+ m/z 389. Промежуточное соединение 72. Этил-4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2 метилциклогексанкарбоксилат В круглодонную колбу, содержащую 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (402 мг, 1,7 ммоль), этил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-2-метилциклогексанкарбоксилат(400 мг, 1,1 ммоль), Pd2(dba)3 (105 мг, 0,11 ммоль), X-Phos (55 мг, 0,11 ммоль) и Cs2CO3 (1,12 г, 3,45 ммоль) добавляли 4,3 мл дегазированной смеси 10:1 1,4-диоксан/H2O. Реакционную смесь грели при 100 С в течение 16 ч, затем охлаждали и распределяли между EtOAc (50 мл) и насыщенным водным бикарбонатом натрия (50 мл). Слои разделяли и водную фазу экстрагировали один раз EtOAc (50 мл). Объединенные органические фазы промывали соляным раствором (50 мл), сушили над безводным MgSO4,фильтровали и концентрировали при пониженном давлении. Очистка полученного в результате остатка на силикагеле давала этил-4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2 метилциклогексанкарбоксилат (344 мг, 80%) в виде бесцветной пены. MS ESI: [M+H]+ m/z 375,2. Промежуточное соединение 74. цис-Метил-4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2-диметилциклогексанкарбоксилат цис-Метил-4-(5-бром-13-тиазол-2-ил)-4-гидрокси-2,2-диметилциклогексанкарбоксилат (1,372 г, 3,94 ммоль), 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (0,918 г, 3,94 ммоль), карбонат цезия (3,85 г, 11,82 ммоль), X-Phos (0,188 г, 0,394 ммоль) и Pd2(dba)3 (0,180 г, 0,197 ммоль) помещали в колбу и вакуумировали/продували N2 три раза. Диоксан (13 мл) и воду (1,3 мл) дегазировали барботированием N2 и добавляли в реакционный сосуд. Полученную в результате реакционную смесь перемешивали при 100 С в течение 16 ч и затем разбавляли EtOAc (25 мл), промывали насыщенным воднымNaHCO3 (25 мл), соляным раствором (25 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией (2-12% EtOAc в гексане) для получения цис-метил-4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2-диметилциклогексанкарбоксилата (1,33 г, 3,54 ммоль, 90% выход) в виде оранжевой пены. MS ESI: [M+H]+ m/z 375,1.1H ЯМР (500 МГц, CD3OD)7,80 (с, 1 Н), 6,78-6,74 (м, 2 Н), 6,53 (уш.с, 1 Н), 3,68 (с, 3H), 2,45-2,36 (м, 2 Н), 2,25-2,12 (м,4 Н), 2,01-1,94 (м, 2 Н), 1,76-1,62 (м, 2 Н), 1,19 (с, 3H), 1,04 (с, 3H). Промежуточное соединение 75. 8-[5-(3-Амино-5-метилфенил)-1,3-тиазол-2-ил]-1,4-диоксаспиро[4,5]декан-8-ол Стадия 1. Тиазол (25,0 мл, 352 ммоль) разбавляли THF (300 мл) и охлаждали до -78 С. Добавляли нBuLi (220 мл, 352 ммоль) при такой скорости, чтобы температура внутри колбы не превышала -65 С. Образовывалась желтая суспензия, которую дополнительно выдерживали в течение 40 мин. Реакцию выдерживали в течение 20 мин, затем добавляли по каплям через трубку для добавления 1,4-диоксаспиро[4,5]декан-8-он (50 г, 320 ммоль) в виде раствора в THF (420 мл). Через 2 ч реакцию прекращали добавлением воды, охлаждающую баню удаляли и смесь перемешивали до того, как температура внутри колбы достигала 0 С. Смесь разбавляли EtOAc и слои разделяли с последующим экстракцией водной части EtOAc. Объединенные органические фракции сушили MgSO4, фильтровали и концентрировали до вязкого оранжевого масла. Добавляли EtOAc и концентрировали до 100 мл. Добавляли по каплям гексан через капельную воронку. Смесь перемешивали в течение 1 ч, затем охлаждали до -10 С и фильтровали. Белый осадок на фильтре промывали гексаном (2), затем сушили в атмосфере азота для получения 8(1,3-тиазол-2-ил)-1,4-диоксаспиро[4,5]декан-8-ола (66 г, 85%) в виде белого твердого остатка. Стадия 2. Продукт стадии 1 (60,5 г, 251 ммоль) разбавляли DMF (365 мл). Добавляли N-бромсукцинимид (49,1 г, 276 ммоль) и раствор грели при 50 С и перемешивали в течение 2 ч. Реакционную- 26022790 смесь удаляли от нагревательного источника и охлаждали до 45 С и добавляли по каплям Н 2 О (600 мл),содержащую 15,8 г Na2SO3, получая твердый остаток. Смесь перемешивали при комнатной температуре в течение 1 ч, затем фильтровали и промывали 2 Н 2 О (300 мл). Остаток на фильтре сушили в течение ночи в атмосфере азота для получения 8-(5-бром-1,3-тиазол-2-ил)-1,4-диоксаспиро[4,5]декан-8-ола (68,2 г, 85%) в виде белого твердого остатка. Стадия 3. 3-Метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилин (2,00 г, 8,58 ммоль),продукт стадии 2 (2,75 г, 8,58 ммоль), X-Phos (0,409 г, 0,858 ммоль), карбонат цезия (8,39 г, 25,7 ммоль),и Pd2(dba)3 (0,393 г, 0,429 ммоль) помещали в колбу, продутую аргоном. Добавляли дегазированный диоксан (30 мл) и воду (3 мл) и реакционную смесь грели при 100 С в течение 40 ч. Затем реакционную смесь охлаждали до комнатной температуры, гасили насыщенным водным бикарбонатом натрия и экстрагировали EtOAc (3). Объединенные органические фракции сушили над Na2SO4 и концентрировали в вакууме. Очистка флэш-хроматографией (40-100% EtOAc:гексан) давала 8-[5-(3-амино-5-метилфенил)1,3-тиазол-2-ил]-1,4-диоксаспиро[4,5]декан-8-ол (1,93 г, 65%) в виде коричневой пены. MS ESI: [M+H]+m/z 347. Промежуточное соединение 77. 4-[5-(3-Амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2,3 триметилциклогексанкарбоновая кислота Диизопропиламид лития (5110 мкл, 9,20 ммоль) добавляли при -78 С к раствору 3-метил-5-(1,3 тиазол-5-ил)анилина (500 мг, 2,63 ммоль) в THF (7 мл). Реакционную смесь нагревали до -60 С при выдерживании в течение 30 мин. Раствор охлаждали до -78 С и добавляли порциями 2,2,3-триметил-4 оксоциклогексанкарбоновую кислоту (600 мг, 3,26 ммоль) в THF (6 мл), поддерживая температуру внутри колбы ниже -65 С. Через 5 мин при -78 С реакционную смесь нагревали до комнатной температуры,разбавляли EtOAc и промывали водным насыщенным хлоридом аммония (3). Объединенную водную часть экстрагировали 10% IPA:CHCl3 (3). Объединенные органические слои сушили при пониженном давлении для получения 4-[5-(3-амино-5-метилфенил)-1,3-тиазол-2-ил]-4-гидрокси-2,2,3-триметилциклогексанкарбоновой кислоты (121 мг, 12%) в виде желтого масла. MS ESI: [M+H]+ m/z 375. Промежуточное соединение 78. цис-1-[5-(3-Амино-5-метилфенил)-1,3-тиазол-2-ил]циклогексан-1,4 диол Стадия 1. Тиазол (25,02 мл, 352 ммоль) разбавляли THF (300 мл) и охлаждали до -78 С. Добавляли н-BuLi (1,6 М, 220 мл, 532 ммоль) при такой скорости, чтобы температура внутри колбы не превышала-65 С. Смесь выдерживали в течение 20 мин, затем добавляли 1,4-диоксаспиро[4,5]декан-8-он (50 г, 320 ммоль) в виде раствора в THF (420 мл) по каплям через делительную воронку. Смесь перемешивали в течение 2 ч и затем гасили водой. Колбу удаляли из охлаждающей бани и реакционную смесь перемешивали до достижения 0 С. Смесь переносили в делительную воронку с EtOAc и соляным раствором и затем экстрагировали EtOAc. Объединенные органические фракции сушили MgSO4, фильтровали и концентрировали до оранжевого вязкого масла. Масло разбавляли EtOAc и концентрировали до 100 мл. Мешалку вносили в колбу и добавляли через капельную воронку по каплям гексан. Смесь перемешивали в течение 1 ч, затем охлаждали до -10 С и фильтровали. Фильтрат промывали гексаном (2) и сушили для получения 8-(1,3-тиазол-2-ил)-1,4-диоксаспиро[4,5]декан-8-ола (66 г, 274 ммоль, 85% выход). Стадия 2. Продукт стадии 1 (60,5 г, 251 ммоль) разбавляли DMF (5 мл). К данному раствору добавляли NBS (49,1 г, 276 ммоль). Реакцию грели при 50 С в течение 2 ч. Реакцию охлаждали до 45 С и добавляли по каплям Н 2 О (600 мл), содержащую Na2SO3 (15,8 г, 125 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем фильтровали и промывали Н 2 О (2, 300 мл). Фильтрат сушили в атмосфере азота для получения 8-(5-бром-1,3-тиазол-2-ил)-1,4-диоксаспиро[4,5]декан-8-ола (68,15 г, 213 ммоль, 85% выход). Стадия 3. Продукт стадии 2 (15 г, 46,8 ммоль) разбавляли THF (10 мл). Добавляли HCl (6 N, 78 мл) и перемешивали при 60 С в течение 3 ч. Реакцию охлаждали до комнатной температуры и добавлялиNaOH (6 N, 78 мл). Реакцию разбавляли EtOAc. Слои разделяли и водный слой экстрагировали обратноEtOAc (2). Объединенные органические слои сушили (MgSO4) и упаривали. Остаток разбавляли EtOAc для переноса и концентрировали до 20 мл при добавлении по каплям гексана (60 мл). Суспензию охлаждали до комнатной температуры, перемешивали в течение 1 ч, затем фильтровали, промывали гексаном(215 мл) и сушили для получения 4-(5-бром-1,3-тиазол-2-ил)-4-гидроксициклогексанона (11,25 г, 40,8 ммоль, 87% выход). Стадия 4. Продукт стадии 3 (6,5 г, 23,54 ммоль) разбавляли THF (10 мл), затем охлаждали до -76 С. Добавляли по каплям LiBH4 (2 М в THF, 14,1 мл, 28,2 ммоль), сохраняя температуру внутри колбы-75 С. Реакционную смесь перемешивали в течение 1 ч и гасили водным насыщенным NH4Cl. Реакционную смесь разбавляли EtOAc. Слои разделяли и водный слой экстрагировали обратно EtOAc (2). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Флэшхроматография и сушка в вакууме давали цис-1-(5-бром-1,3-тиазол-2-ил)циклогексан-1,4-диол (5,2 г,18,69 ммоль, 79% выход) в виде белого твердого остатка. Стадия 5. В пробирку помещали 3-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилинPd2(dba)3 (0,165 г, 0,180 ммоль), X-Phos (0,112 г, 0,360 ммоль), диоксан (14,62 мл) и воду (1,462 мл). Смесь реагировала в атмосфере аргона при 110 С в течение 5 ч. Реакцию разбавляли этилацетат и переносили в делительную воронку. Органический слой промывали водным насыщенным NaHCO3 и соляным раствором. Органический слой сушили над Na2SO4, фильтровали и концентрировали. Неочищенный остаток очищали флэш-хроматографией на силикагеле (0-20% MeOH/DCM) для получения цис-1-[5-(3 амино-5-метилфенил)-1,3-тиазол-2-ил]циклогексан-1,4-диола (871,5 мг, 2,86 ммоль, 79% выход). MS ESI:[М+Н]+ m/z 305,1. Промежуточное соединение 80. Метиловый эфир 4-(5-бромтиазол-2-ил)-4-гидрокси-транс-2-метилциклогексанкарбоновой кислоты Стадия 1. К охлажденному (-78 С) раствору метилового эфира транс-2-метил-4-оксо-циклогексанкарбоновой кислоты (13 г, 76 ммоль) и тиазола (10,9 мл, 153 ммоль) в THF (130 мл) добавляли по каплям н-BuLi (2,5 М в гексане, 30,6 мл, 76 ммоль) при такой скорости, чтобы температура внутри колбы сохранялась-70 С. Реакционную смесь перемешивали в течение 30 мин, добавляли МеОН (3,1 мл, 76 ммоль) и реакцию нагревали до комнатной температуры и разбавляли водой и EtOAc. Слои разделяли, органический слой сушили MgSO4, фильтровали и наносили на силикагель концентрированием в вакууме. Неочищенный остаток очищали флэш-хроматографией для получения метилового эфира транс-4-гидрокситранс-2-метил-4-тиазол-2-илциклогексанкарбоновой кислоты (4,1 г, 16 ммоль) вместе с другим диастереомером (7,0 г, 27 ммоль). Стадия 2. К раствору продукта стадии 1 (4,1 г, 16 ммоль) в DMF (30 мл) добавляли NBS (3,43 г, 19,3 ммоль). После прекращения первичного выделения теплоты реакционную смесь грели при 50 С и перемешивали в течение 1 ч. Затем ее охлаждали до комнатной температуры и добавляли воду (280 мл, содержащие 7 г сульфита натрия), с последующим добавлением EtOAc. Слои разделяли и водный слой экстрагировали EtOAc (2). Объединенные органические фракции промывали Н 2 О, сушили MgSO4, фильтровали и наносили на силикагель концентрированием в вакууме. Неочищенный остаток очищали флэшхроматографией для получения метилового эфира 4-(5-бромтиазол-2-ил)-транс-4-гидрокси-транс-2-метилциклогексанкарбоновой кислоты (4,75 г, 16,1 ммоль), MS ESI: [M+H]+ m/z 333,9. Промежуточное соединение 81. Пропан-2-ил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-2,6-диметилциклогексанкарбоксилат Стадия 1. Пропан-2-ил 2,6-диметил-4-оксоциклогекс-2-ен-1-карбоксилат (20 г, 95,1 ммоль) получали согласно литературной методике (J. Org. Chem. 2007, 72(4), 1458-1453), применяя изопропилацетоацетат вместо этилацетоацетата, и разбавляли EtOH (300 мл). К полученному в результате раствору в атмосфере азота добавляли 5% Pd/C (0,8 г), после чего колбу встряхивали при первоначальном давлении водорода 50 пси в течение 2 ч. Затем реакционное содержимое фильтровали через целит, применяя дополнительный EtOH, концентрировали в вакууме и очищали флэш-хроматографией для получения пропан 2-ил 2,6-диметил-4-оксоциклогексанкарбоксилата (5,2 г, 24,5 ммоль). Стадия 2. Продукт стадии 1 (5,2 г, 24,5 ммоль) разбавляли THF (50 мл), к которому добавляли тиазол (2,63 мл, 36,7 ммоль). Полученный в результате раствор охлаждали до -78 С и добавляли по каплям н-BuLi (2,5 М в гексане, 10,3 мл, 25,7 ммоль) при такой скорости, чтобы поддерживать температуру внутри колбы-65 С. После завершения добавления реакционную смесь перемешивали в течение дополнительного 1 ч, затем гасили добавлением воды и нагревали до комнатной температуры. ДобавлялиEtOAc, слои разделяли и органический слой сушили MgSO4, фильтровали, концентрировали в вакууме и неочищенный остаток очищали флэш-хроматографией для получения пропан-2-ил-4-гидрокси-2,6 диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата (2,0 г, 6,7 ммоль). Стадия 3. К раствору продукта стадии 2 (2,0 г, 6,7 ммоль) в DMF (16 мл) добавляли NBS (1,38 г,7,73 ммоль) и полученный в результате раствор грели при 55 С. Через 60 мин реакцию охлаждали и добавляли раствор сульфита натрия (500 мг) в воде (30 мл) с последующим добавлением EtOAc. Слои разделяли, водный слой экстрагировали обратно EtOAc (2). Объединенные органические фракции сушили над MgSO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали флэшхроматографией для получения пропан-2-ил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-2,6-диметилциклогексанкарбоксилата (2,2 г, 5,85 ммоль) MS ESI: [M+H]+ m/z 375,9. Промежуточное соединение 82. Пропан-2-ил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-2,6-диметилциклогексанкарбоксилат Стадия 1. Пропан-2-ил 2,6-диметил-4-оксоциклогекс-2-ен-1-карбоксилат (20 г, 95,1 ммоль) получали согласно литературной методике (J. Org, Chem. 2007, 72(4), 1458-1453), применяя изопропилацетооацетат вместо этилацетооацетата, и разбавляли EtOH (300 мл). К полученному в результате раствору в атмосфере азота добавляли 5% Pd/C (0,8 г), после чего колбу встряхивали при первоначальном давлении водорода 50 пси в течение 2 ч. Затем реакционное содержимое фильтровали через целит, применяя дополнительный EtOH, концентрировали в вакууме и очищали флэш-хроматографией для получения пропан-2-ил 2,6-диметил-4-оксоциклогексанкарбоксилата (6,4 г, 30,1 ммоль). Стадия 2. Продукт стадии 1 (6,4 г, 30,1 ммоль) разбавляли THF (65 мл), к которому добавляли тиазол (3,24 мл, 45,2 ммоль). Полученный в результате раствор охлаждали до -78 С и добавляли по каплям- 28022790 н-BuLi (2,5 М в гексане, 12,7 мл, 31,7 ммоль) при такой скорости, чтобы поддерживать температуру внутри колбы-65 С. После завершения добавления реакционную смесь перемешивали в течение дополнительного 1 ч, затем гасили добавлением воды и нагревали до комнатной температуры. ДобавлялиEtOAc, слои разделяли и органический слой сушили MgSO4, фильтровали, концентрировали в вакууме и неочищенный остаток очищали флэш-хроматографией для получения полностью цис-пропан-2-ил-4 гидрокси-2,6-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата (4,45 г, 15,0 ммоль). Стадия 3. К раствору полностью цис-пропан-2-ил-4-гидрокси-2,6-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата (4,4 г, 14,8 ммоль) в DMF (34 мл) добавляли NBS (3,03 г, 17,0 ммоль) и полученный в результате раствор грели при 55 С. Через 60 мин реакцию охлаждали и добавляли раствор сульфита натрия (500 мг) в воде (30 мл) с последующим добавлением EtOAc. Слои разделяли и водный слой экстрагировали обратно EtOAc (2). Объединенные органические фракции сушили MgSO4, фильтровали и концентрировали в вакууме. Неочищенный остаток очищали флэш-хроматографией для получения неочищенного продукта. Продукт перемешивали в некотором количестве гексана, фильтровали и промывали большим количеством гексана для получения полностью цис-пропан-2-ил-4-(5-бром-1,3-тиазол 2-ил)-4-гидрокси-2,6 диметилциклогексанкарбоксилата (2,4 г, 6,38 ммоль) MS ESI: [М+30 Н]+ m/z 375,9. Промежуточное соединение 84(а). Этил-4-гидрокси-3-метил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилат Промежуточное соединение 84(b). Этил-4-гидрокси-3,5-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилат Промежуточное соединение 84(с). Этил-4-гидрокси-3,3-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилат Стадия 1. бис-(Триметилсилил)амид лития (41,1 мл, 41,1 ммоль) добавляли при -78 С к раствору этил 4-оксоциклогексанкарбоксилата (7 г, 41,1 ммоль) в THF (153 мл), обеспечивая, чтобы температура ни в коем случае не превышала -70 С. После добавления реакцию выдерживали в течение 30 мин перед медленным добавлением йодметана (15 мл, 240 ммоль). Реакционную смесь выдерживали ниже -70 С в течение 10 мин перед медленным нагреванием до комнатной температуры в течение 1 ч. Затем реакционную смесь грели при 50 С в течение 5 ч. Источник нагревания удаляли и реакционную смесь выдерживали при комнатной температуре в течение 14 ч. Раствор смешивали с водой и экстрагировали три раза EtOAc. Объединенный органический слой сушили при пониженном давлении для получения темнокрасного масла (9 г). Неочищенный продукт применяли непосредственно в следующей стадии без дополнительной очистки. Стадия 2. Неочищенное темно-красное масло (9 г) из предыдущей стадии смешивали с тиазолом(4,41 мл, 61,7 ммоль) в THF (150 мл) и охлаждали до -78 С. Добавляли н-бутиллитий (2,5 М, 16,46 мл,41,1 ммоль) и раствор выдерживали при -78 С в течение 1 ч, затем нагревали до комнатной температуры. Реакцию гасили добавлением воды и экстрагировали три раза CH2Cl2. Объединенный органический слой сушили при пониженном давлении и очищали колоночной хроматографией на силикагеле (5-100%(2,69 г, 24%) в виде коричневого масла и смеси этил 4-гидрокси-3,5-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата и этил 4-гидрокси-3,3-диметил-4-(1,3-тиазол-2-ил)циклогексанкарбоксилата (1,09 г,9%) в виде коричневого масла. MS ESI: [M+H]+ m/z 270 (для 84 а)+284 (для 84 b/с). Промежуточное соединение 85. Этил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-3-метилциклогексанкарбоксилатN-Бромсукцинимид (2222 г, 12,48 ммоль) добавляли к раствору промежуточного соединения 84(а)(2,69 г, 9,99 ммоль) в DMF (10,51 мл). Реакцию выдерживали при комнатной температуре в течение 2 ч. Затем реакцию гасили водным насыщенным бикарбонатом натрия и смешивали с водой. Смесь экстрагировали CH2Cl2 (3). Объединенные органические слои концентрировали при пониженном давлении и очищали флэш-хроматографией на силикагеле (0-30% EtOAc:гексан) для получения этил 4-(5-бром-1,3 тиазол-2-ил)-4-гидрокси-3-метилциклогексанкарбоксилата (2,27 г, 65%) в виде желтого масла. MS ESI:N-Бромсукцинимид (1,01 г, 5,64 ммоль) добавляли к раствору промежуточного соединения 34(b) и промежуточного соединения 84 (с) (1,09 г, 3,85 ммоль) в DMF (5,94 мл). Реакционную смесь выдерживали при комнатной температуре в течение 2 ч и затем гасили водным насыщенным бикарбонатом натрия и смешивали с водой. Смесь экстрагировали три раза CH2Cl2. Объединенные органические слои концентрировали при пониженном давлении и очищали флэш-хроматографией (0-40% Et2O:гептан) для получения этил-4-(5-бром-1,3-тиазол-2-ил)-4-гидрокси-3,5-диметилциклогексанкарбоксилата и этил-4-(5-бром 1,3-тиазол-2-ил)-4-гидрокси-3,3-диметилциклогексанкарбоксилата (1,04 г, 75%) в виде желтого масла.MS ESI: [M+H]+ m/z 362, 364. 240 мг данного вещества дополнительно очищали, применяя хиральную
МПК / Метки
МПК: A61P 29/00, A61P 11/00, C07D 417/14, A61P 35/00, A61P 11/06, C07D 417/12, A61K 31/497
Метки: качестве, ингибиторов, аминопиримидины
Код ссылки
<a href="https://eas.patents.su/30-22790-aminopirimidiny-v-kachestve-syk-ingibitorov.html" rel="bookmark" title="База патентов Евразийского Союза">Аминопиримидины в качестве syk ингибиторов</a>
Предыдущий патент: Система и способ управления затворными очками
Следующий патент: Способ нанесения антифрикционных покрытий на боковую поверхность рельса
Случайный патент: Экспрессирующие векторы, содержащие ie2-промотор мсмv












