Производные 3-(3-пиримидин-2-илбензил)-1,2,4-триазоло[4,3-b]пиридазина в качестве ингибиторов met киназы
Номер патента: 19534
Опубликовано: 30.04.2014
Авторы: Дорш Дитер, Штибер Франк, Шадт Оливер, Блаукат Андрее
Формула / Реферат
1. Соединения формулы I
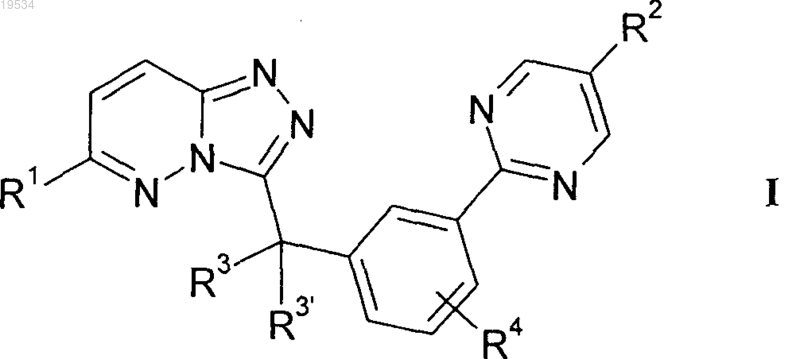
в которой R1 означает тиазолил, тиофенил, фуранил, пирролил, оксазолил, изоксазолил, оксадиазолил, пиразолил, имидазолил, тиадиазолил, пиридазинил, пиразинил, пиридинил или пиримидинил, где эти радикалы могут также быть моно-, ди- или тризамещенными Hal, [C(R5)2]nOR5 и/или А, или означает фенил, который является моно-, ди- или тризамещенным Hal и/или CN, или означает А;
R2 означает O[C(R5)2]nOR5, Het, -[C(R5)2]nHet или O[C(R5)2]nHet;
R3, R3', каждый независимо друг от друга, означают Н, F или А, вместе также означают алкилен, имеющий 2-5 атомов С;
R4 означает Н;
R5 означает Н или А;
А означает неразветвленный или разветвленный алкил, имеющий 1-6 атомов С;
Ar означает фенил, который является моно-, ди- или тризамещенным Hal и/или CN;
Het означает пиперидинил, пирролидинил, морфолинил, пиперазинил, оксазолидинил, пиразолил, пиридинил, пиримидинил, фурил, тиенил, оксазолил, оксадиазолил, имидазолил, пирролил, изоксазолил или имидазолидинил, где эти радикалы могут также быть моно- или дизамещенными A, [C(R5)2]nOR5 и/или [C(R5)2]nHet1;
Het1 означает пиперидинил, пирролидинил, морфолинил, пиперазинил, оксазолидинил или имидазолидинил, где эти радикалы могут также быть моно- или дизамещенными =O и/или А;
Hal означает F, Cl, Br или I;
n означает 1, 2, 3 или 4;
и их фармацевтически приемлемые соли.
2. Соединения по п.1, выбранные из группы, включающей
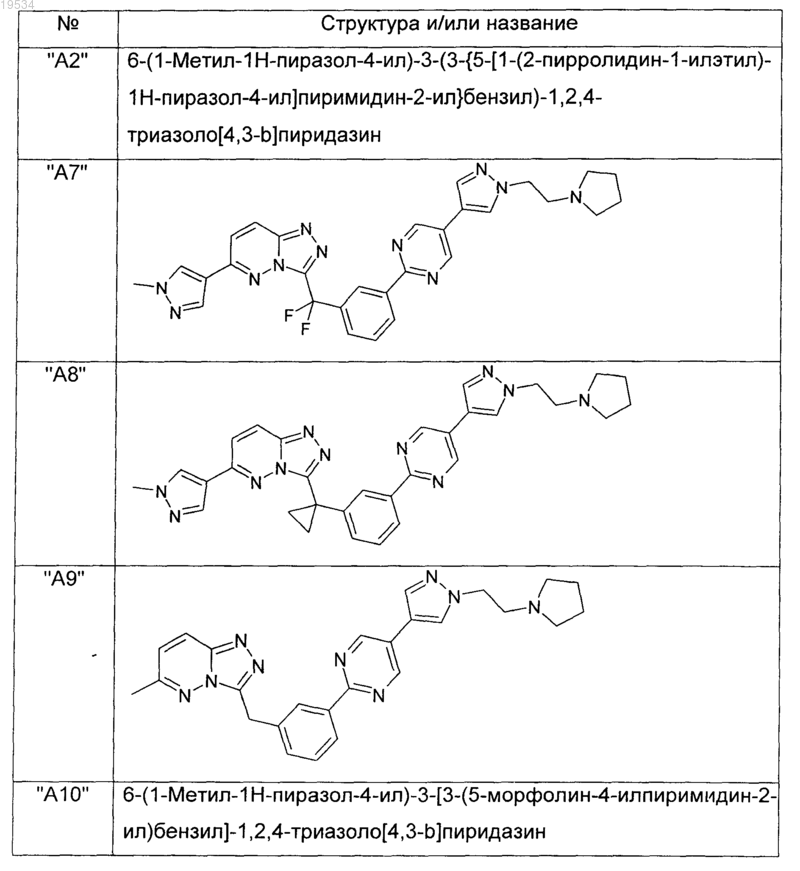
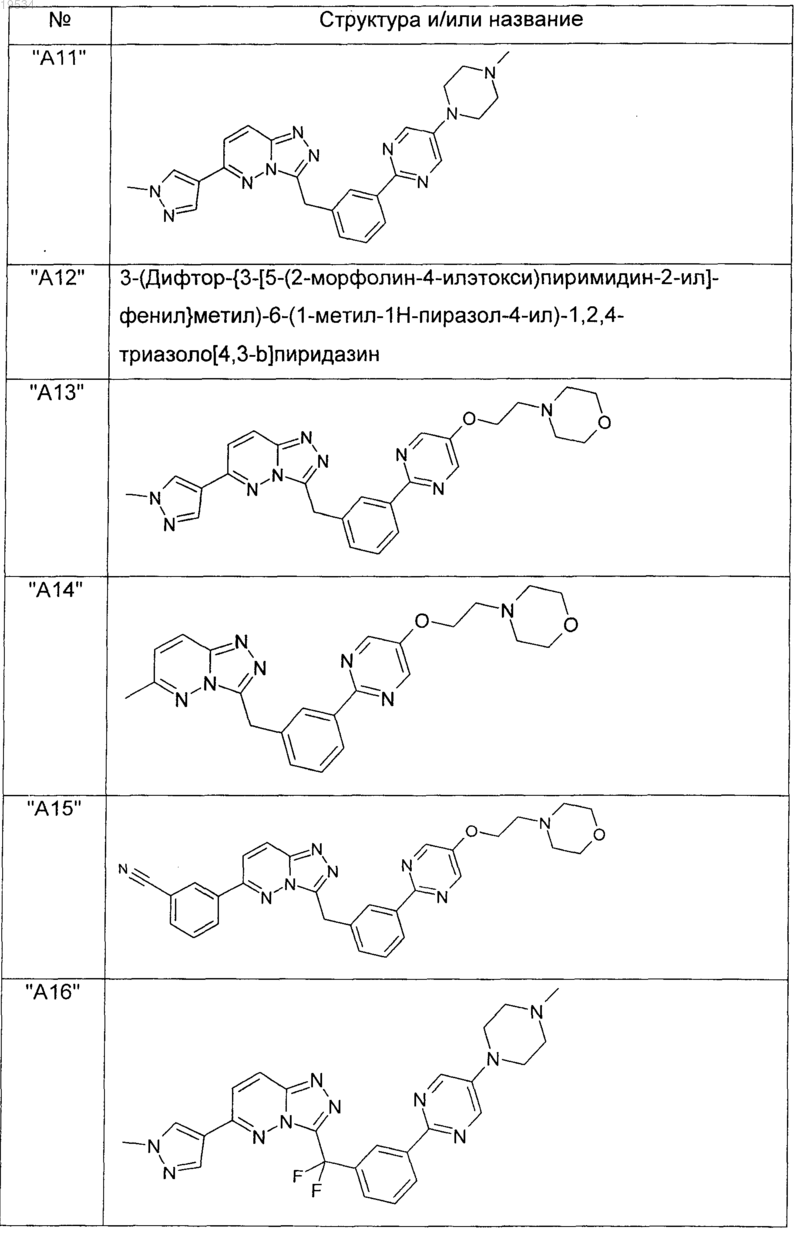
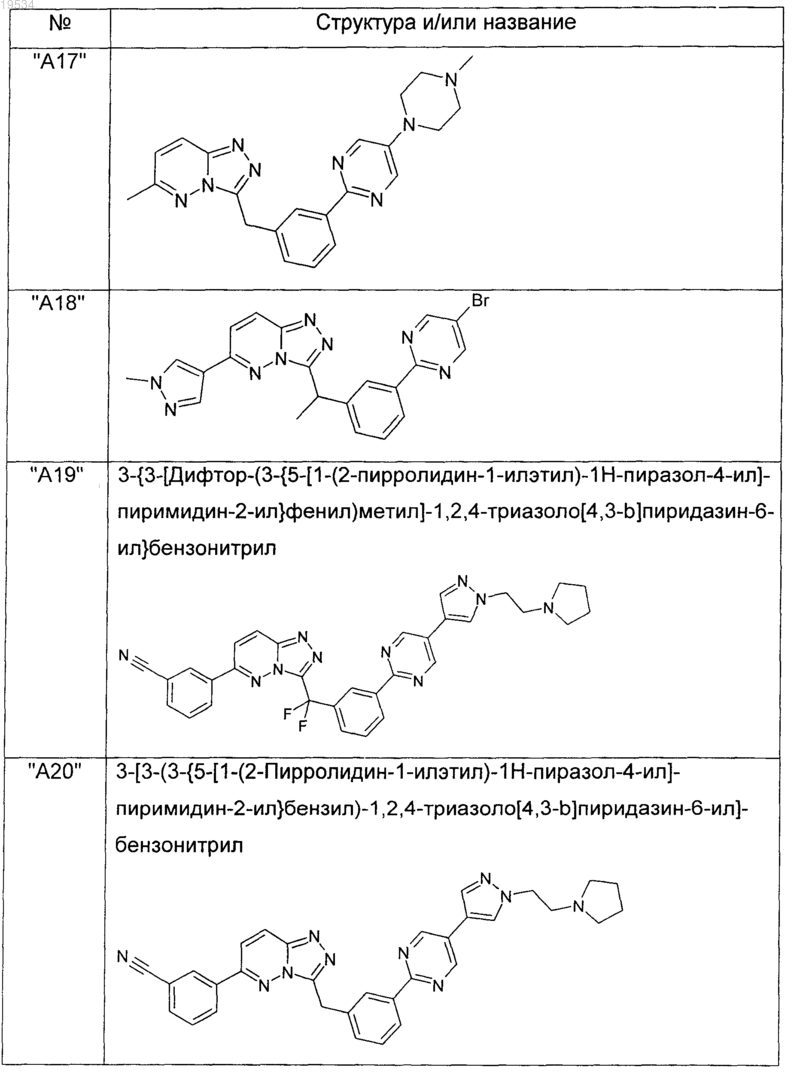
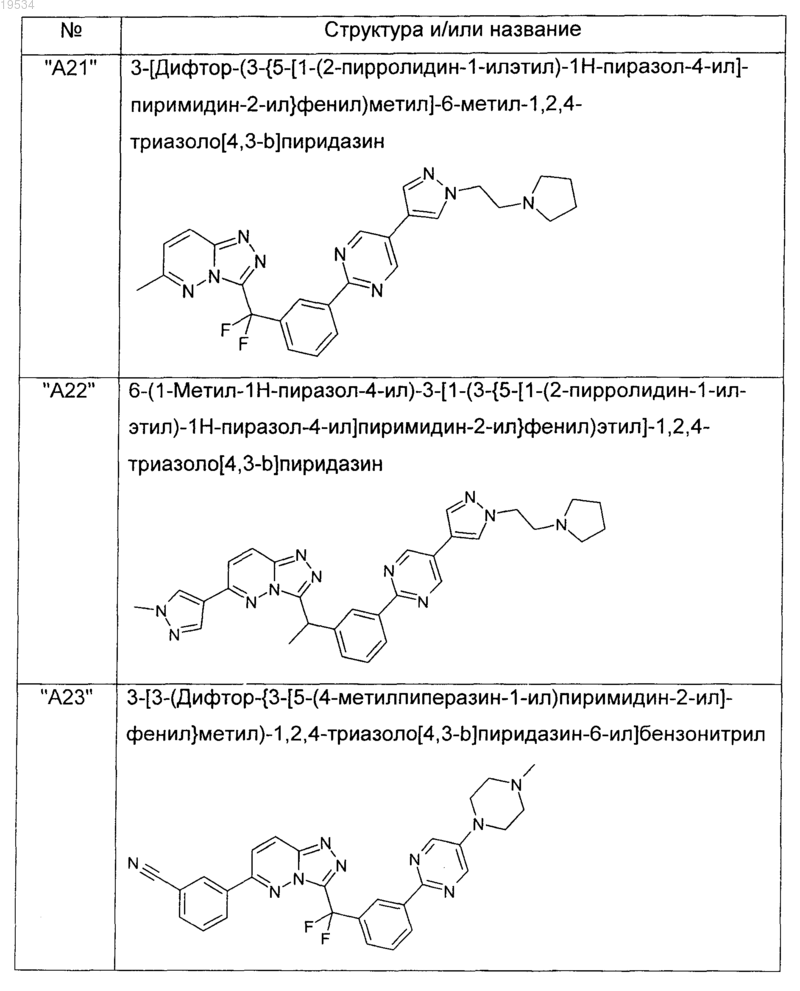
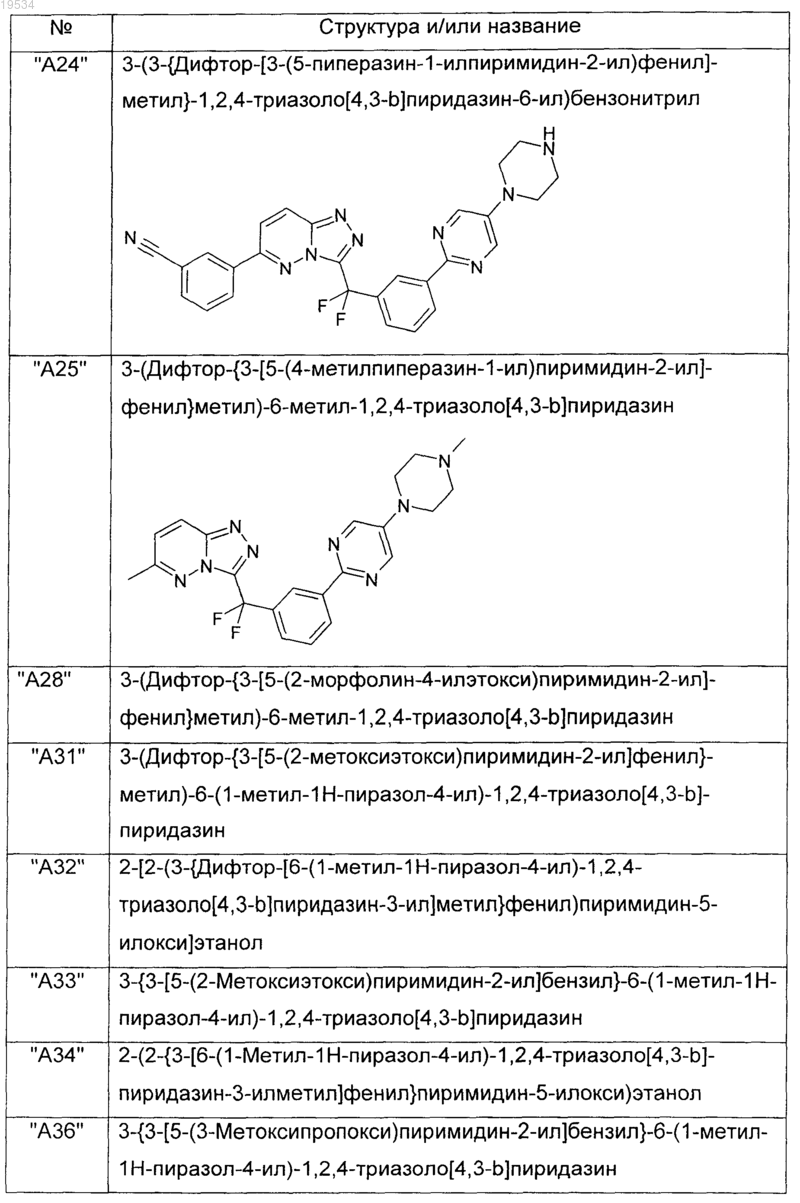
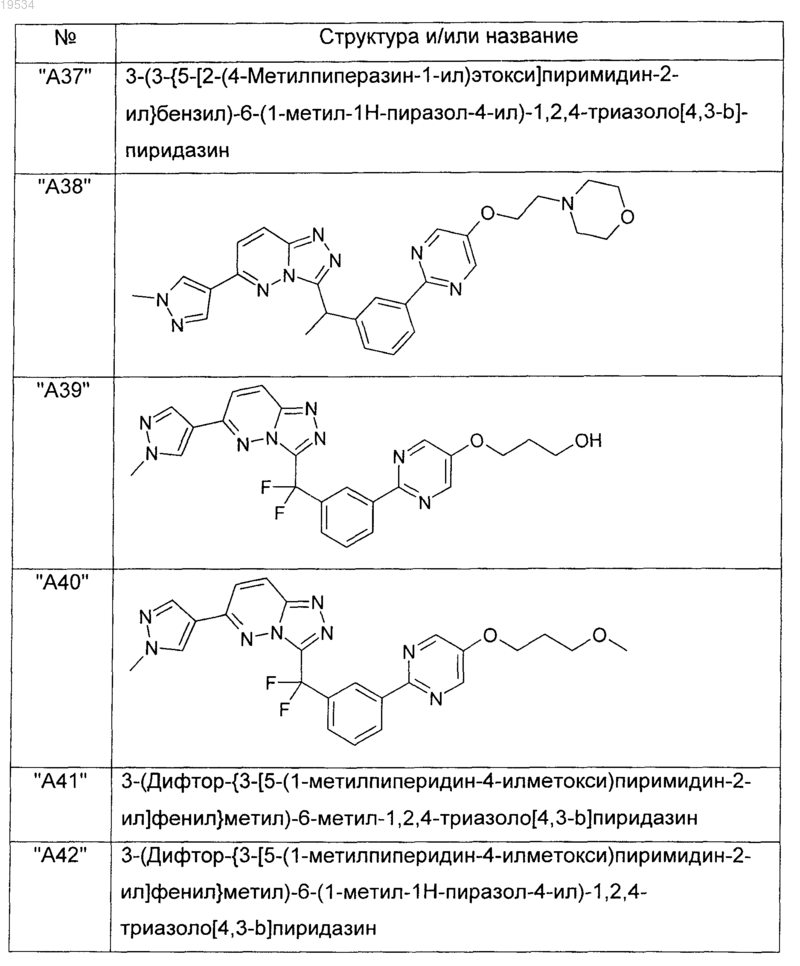
и их фармацевтически приемлемые соли.
3. Способ получения соединений формулы I по пп.1, 2 и их фармацевтически приемлемых солей, характеризующийся тем, что соединение формулы II

в которой R1, R3, R3' и R4 имеют значения, указанные в п.1; и
L означает радикал бороновой кислоты или эфира бороновой кислоты,
реагирует с соединением формулы III
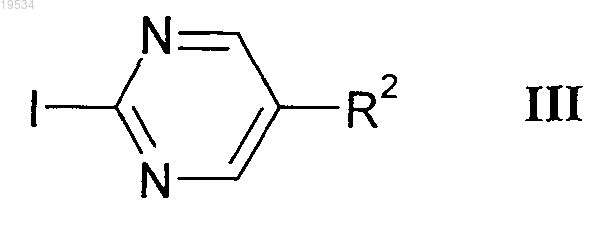
в которой R2 имеет значения, указанные в п.1, и при необходимости радикал R2 превращают в другой радикал R2 путем замещения атома галогена амино-, алкокси- или арильным радикалом,
и/или основание или кислоту формулы I превращают в одну из их солей.
4. Лекарственные средства, включающие по меньшей мере одно соединение формулы I по пп.1, 2 и/или их фармацевтически приемлемые соли и необязательно инертные наполнители и/или вспомогательные средства.
5. Применение соединений по пп.1, 2 и их фармацевтически приемлемых солей для получения лекарственного средства для лечения заболеваний, в которых играют роль ингибирование, регулирование и/или модуляция сигнальной трансдукции киназы.
6. Применение по п.5 для получения лекарственного средства для лечения заболеваний, на которые действуют ингибированием Met киназы с помощью соединений по пп.1, 2.
7. Применение по п.5 или 6, где заболевание, подвергаемое лечению, является солидным новообразованием.
8. Применение по п.7, где солидное новообразование происходит из группы опухолей плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, мозга, простаты, урогенитального тракта, лимфатической системы, гортани и/или легкого.
9. Применение по п.7, где солидное новообразование происходит из группы моноцитарной лейкемии, аденокарциномы легкого, мелкоклеточной карциномы легких, рака поджелудочной железы, глиобластомы и карциномы молочной железы.
10. Применение по п.7, где солидное новообразование происходит из группы аденокарциномы легкого, мелкоклеточной карциномы легкого, рака поджелудочной железы, глиобластомы, карциномы толстой кишки и карциномы молочной железы.
11. Применение по п.5 или 6, где заболевание, подвергаемое лечению, является новообразованием крови и иммунной системы.
12. Применение по п.11, где новообразование происходит из группы острой миелоидной лейкемии, хронической миелоидной лейкемии, острой лимфатической лейкемии и/или хронической лимфатической лейкемии.
Текст
Изобретение относится к соединениям формулы (I), где значения R1, R2, R3, R3, R4 определены далее, которые являются ингибиторами тирозинкиназ, в особенности Met киназы, и могут быть применены, в частности, для лечения новообразований.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) Предпосылки создания изобретения Задача изобретения состояла в том, чтобы найти новые соединения, имеющие ценные свойства, в особенности те, которые могут быть применены для получения лекарственных средств. Настоящее изобретение относится к соединениям и применению соединений, в которых играет роль ингибирование, регулирование и/или модуляция сигнальной трансдукции киназ, в частности тирозинкиназ и/или серин/треонинкиназ, кроме того к фармацевтическим композициям, которые содержат эти соединения, и к применению соединений для лечения заболеваний, вызванных киназой. В особенности, настоящее изобретение относится к соединениям и к применению соединений, в которых играет роль ингибирование, регулирование и/или модуляция Met киназой. Одним из принципиальных механизмов, с помощью которого осуществляется клеточная регуляция,является трансдукция внеклеточных сигналов сквозь мембрану, которые по очереди модулируют биохимические пути обмена в пределах клетки. Фосфорилирование белка представляет одно направление, которым внутриклеточные сигналы распространяются от молекулы к молекуле, окончательно приводя к клеточной реакции. Эти каскады сигнальной трансдукции являются высокорегулируемыми и часто совпадают, что является очевидным из существования множества протеинкиназ, также как и фосфатаз. Фосфорилирование белков осуществляется преимущественно возле остатков серина, треонина или тирозина, и протеинкиназы поэтому были классифицированы по их специфике места фосфорилирования, т.е. серин/треонинкиназы и тирозинкиназы. Поскольку фосфорилирование является таким распространенным процессом в пределах клеток и поскольку клеточные фенотипы находятся в значительной степени под влиянием активности этих путей обмена, в настоящее время считается, что множество болезненных состояний и/или болезней приписываются или к аберрантной активации, или к функциональным мутациям в молекулярных компонентах каскадов киназы. Следовательно, значительное внимание было уделено характеристике этих белков и соединений, которые могут модулировать их активность (см. обзор вWeinstein-Oppenheimer et al., Pharma.Therap., 2000, 88, 229-279). Роль рецептора тирозинкиназы Met в онкогенезе человека и возможности ингибирования HGF(фактор роста гепатоцитов) зависимой Met активации описана в S. Berthou et al., Oncogene, vol. 23, No. 31, с. 5387-5393 (2004). Там же описан ингибитор SU11274 - пирролиндольное соединение, которое является потенциально подходящим для борьбы с раком. Другой ингибитор Met киназы для раковой терапии описан в J.G. Christensen et al., Cancer Res., 2003, 63(21), 7345-55. Дополнительный ингибитор тирозинкиназы для борьбы с раком описан в Н. Hov et al., Clinical Cancer Research, vol. 10, 6686-6694 (2004). Соединение РНА-665752 - производное индола направлено против рецептора HGF c-Met. Кроме того, там же описано, что HGF и Met производят значительный вклад в злокачественный процесс различных форм рака, таких как, например, множественная миелома. Исходя из этого, является желательным синтез небольших соединений, которые специфически ингибируют, регулируют и/или модулируют сигнальную трансдукцию тирозинкиназ и/или серин/треонинкиназ, в особенности Met киназу, что является целью настоящего изобретения. Было найдено, что соединения соответственно изобретению и их соли имеют очень ценные фармакологические свойства, будучи высоко толерантными. Настоящее изобретение особенно относится к соединениям формулы I, которые ингибируют, регулируют и/или модулируют сигнальную трансдукцию Met киназой, к композициям, которые содержат эти соединения, и к способам применения их для лечения заболеваний, вызванных Met киназой, таких как ангиогенез, рак, образование, рост и распространение опухоли, атеросклероз, глазные заболевания, такие как дегенерация желтого пятна, вызванная возрастом, хороидальная неоваскуляризация и диабетическая ретинопатия, воспалительные заболевания, артрит, тромбоз, фиброз, гломерулонефрит, нейродегенерация, псориаз, рестеноз, заживление ран, отторжение трансплантата, метаболические заболевания и заболевания иммунной системы, аутоиммунные заболевания, цирроз, диабет и заболевания кровеносных сосудов, такие как нестабильность и проницаемость, и т.п. у млекопитающих. Солидные опухоли, в особенности быстрорастущие опухоли, могут лечиться ингибиторами Met киназы. Эти солидные опухоли включают моноцитарную лейкемию, карциному мозга, урогенитальную,лимфатической системы, желудка, ларингеальную и легкого, включая аденокарциному легкого и мелкоклеточную карциному легкого. Настоящее изобретение направлено на процессы для регулирования, модуляции или ингибированияMet киназы для предупреждения и/или лечения заболеваний, связанных с нерегулируемой или нарушенной активностью Met киназы. В особенности соединения формулы I также могут быть использованы для лечения определенных форм рака. Соединения формулы I могут, кроме того, быть использованы для обеспечения аддитивного или синергетического эффектов в определенных существующих схемах химиотерапии рака и/или могут быть использованы для восстановления эффективности определенных существующих схем химиотерапии и радиотерапии рака. Соединения формулы I могут, кроме того, быть использованы для выделения и исследования активности или экспрессии Met киназы. В дополнение, они являются особенно подходящими для применения в способах диагностики болезней, связанных с нерегулируемой или нарушенной активностью Met киназы. Может быть показано, что соединения соответственно изобретению имеют антипролиферативное действие in vivo в ксенотрансплантатной модели опухоли. Соединения соответственно изобретению вводятся пациенту, имеющему гиперпролиферативную болезнь, например, чтобы ингибировать рост опухоли, чтобы уменьшить воспаление, связанное с лимфопролиферативной болезнью, ингибировать отторжение трансплантата или неврологическое повреждение из-за восстановления тканей и т.д. Настоящие соединения являются подходящими для профилактических или терапевтических целей. Как использовано здесь, термин "лечение" подразумевает и предупреждение заболевания, и лечение уже имеющихся заболеваний. Предупреждение пролиферации добиваются введением соединений соответственно изобретению, предшествуя развитию явных болезней, например, чтобы предупредить рост опухолей, предупредить рост метастаза, уменьшить рестеноз, связанный с сердечно-сосудистой хирургией, и т.д. Альтернативно, соединения применяются для лечения текущих заболеваний стабилизацией или улучшением клинических симптомов пациента. Носитель или пациент может принадлежать к любому виду млекопитающих, например виду приматов, особенно человека; грызунов, включая мышей, крыс или хомяков; кроликов; лошадей, коров, собак,котов и т.д. Животные модели интересны для экспериментальных исследований, обеспечивая модель для лечения болезни человека. Склонность особой клетки к лечению соединениями соответственно изобретению может быть определена тестами in vitro. Обычно культура клетки комбинируется с соединением соответственно изобретению при различных концентрациях в течение периода времени, который является достаточным,чтобы позволить активным компонентам индуцировать клеточную смерть или ингибировать миграцию,как правило, между около одного часа и одной недели. In vitro тестирование может быть проведено, используя выращенные клетки из образца биопсии. Жизнеспособные клетки, оставшиеся после лечения,потом подсчитывают. Доза меняется в зависимости от особенности используемого соединения, особенности болезни, состояния пациента и т.д. Терапевтическая доза обычно достаточно существенна, чтобы уменьшить нежелательную клеточную популяцию в ткани мишени, пока поддерживается жизнеспособность пациента. Лечение главным образом продолжается до тех пор, пока происходит существенное уменьшение, например по меньшей мере около 50% уменьшение клеточной нагрузки, и может быть продолжено до тех пор,пока, по существу, нежелательных клеток больше не обнаружено в теле. Для определения пути обмена сигнальной трансдукции и для обнаружения взаимодействия между различными путями обмена сигнальной трансдукции различные ученые развивали подходящие модели или модельные системы, например модели клеточной культуры (например, Khwaja et al., EMBO, 1997,16, 2783-93) и модели трансгенных животных (например, White et al., Oncogene, 2001, 20, 7064-7072). Для определения некоторых этапов в каскаде сигнальной трансдукции могут быть применены взаимодействующие соединения для того, чтобы смодулировать сигнал (например, Stephens et al., Biochemical J.,2000, 351, 95-105). Соединения соответственно изобретению также могут быть применены как реагенты для тестирования зависимых от киназ путей обмена сигнальной трансдукции у животных и/или в моделях клеточных культур или при клинических болезнях, упомянутых в этом изобретении. Измерение активности киназы является методикой, которая хорошо известна специалисту в данной области техники. Генерические тестовые системы для определения активности киназы, использующие субстраты, например гистон (например, Alessi et al., FEBS Lett., 1996, 399, 3, с. 333-338) или основной миелиновый белок, описаны в литературе (например, Campos-Gonzalez, R. и Glenney, Jr., J.R. 1992, J.Biol. Chem., 267, с. 14535). Для идентификации ингибиторов киназы допустимы различные системы анализа. В сцинтилляционном анализе сближения (Sorg et al., J. of Biomolecular Screening, 2002, 7, 11-19) и Flashplate анализе измеряется радиоактивное фосфорилирование белка или пептида в качестве субстрата АТФ. В присутствии соединения-ингибитора определяется уменьшение радиоактивного сигнала или его отсутствие. Кроме того, методики резонансного переноса энергии флуоресценции с однородным временным разрешением (HTR-FRET) и флуоресцентной поляризации (FP) являются подходящими в качестве способов анализа (Sills et al., J. of Biomolecular Screening, 2002, 191-214). Другие нерадиоактивные способы твердофазного иммуноферментного анализа используют специфические фосфоантитела (phospho ABs). Фосфоантитела связывают только фосфорилированный субстрат. Это связывание может быть определено хемилюминесценцией, в котором используется вторичное конъюгированное с пероксидазой антиовечье антитело (Ross et al., 2002, Biochem. J.). Много болезней связано с регулированием клеточной пролиферации и клеточной смертью (апоптоз). Рассматриваемые состояния включают, но не ограничиваются, следующими. Соединения соответственно изобретению являются подходящими для лечения различных состояний, при которых пролиферация и/или миграция гладкомышечных клеток и/или воспалительных клеток в пределах интимального слоя сосуда приводит к ограничению потока крови через этот сосуд, например, в случае неоинтимальных окклюзионных поражений. Рассматриваемые сосудистые заболевания окклюзионного графта включают атеросклероз, коронарную сосудистую болезнь после пересадки, стеноз венозного трансплантата, перианастомозный протезный рестеноз, рестеноз после ангиопластики или помещения стента и т.п. Уровень техники Другие производные триазолопиридазина описаны в качестве ингибиторов МЕТ киназы в WO 2007/064797, WO 2007/075567, WO 2007/138472, WO 2008/008539, WO 2008/051805. Краткое описание изобретения Изобретение относится к соединениям формулы I в которой R1 означает тиазолил, тиофенил, фуранил, пирролил, оксазолил, изоксазолил, оксадиазолил, пиразолил, имидазолил, тиадиазолил, пиридазинил, пиразинил, пиридинил или пиримидинил, где эти радикалы могут также быть моно-, ди- или тризамещенными Hal, [C(R5)2]nOR5 и/или А, или означает фенил, который является моно-, ди- или тризамещенным Hal и/или CN, или означает А;R3, R3', каждый независимо друг от друга, означают Н, F или А, вместе также означают алкилен,имеющий 2-5 атомов С;R5 означает Н или А; А означает неразветвленный или разветвленный алкил, имеющий 1-6 атомов С;Het означает пиперидинил, пирролидинил, морфолинил, пиперазинил, оксазолидинил, пиразолил,пиридинил, пиримидинил, фурил, тиенил, оксазолил, оксадиазолил, имидазолил, пирролил, изоксазолил или имидазолидинил, где эти радикалы могут также быть моно- или дизамещенными A, [C(R5)2]nOR5 и/или [C(R5)2]nHet1;Het1 означает пиперидинил, пирролидинил, морфолинил, пиперазинил, оксазолидинил или имидазолидинил, где эти радикалы могут также быть моно- или дизамещенными =O и/или А;n означает 1, 2, 3 или 4; и к их фармацевтически приемлемым солям. Соединения формулы I также могут существовать в виде гидратов и сольватов, а также в виде фармацевтически приемлемых производных. Соединения формулы I могут существовать в оптически активных формах, таких как стереоизомеры, энантиомеры, рацематы, диастереомеры, а также в виде гидратов и сольватов таких соединений и их фармацевтически приемлемых производных. Сольваты соединений подразумевают аддукты инертных молекул растворителя с соединениями, которые формируются под действием их взаимной силы притяжения. Сольватами являются, например, моно- или дигидраты или алкоголяты. Фармацевтически приемлемые производные подразумевают, например, соли соединений соответственно изобретению, а также так называемые пролекарственные соединения. Пролекарственные производные подразумевают соединения, которые могут быть модифицированы при помощи, например, алкильных или ацильных групп, сахаров или олигопептидов и которые являются быстро расщепляемыми в организме, чтобы образовывать эффективные соединения. Они также включают биодеструктирующиеся полимерные производные соединений, как описано,например, в Int. J. Pharm., 115, 61-67 (1995). Выражение "эффективное количество" означает количество лекарственного средства или фармацевтического активного компонента, которое вызывает в ткани, системе, животном или человеке биологическую или медицинскую реакцию, которая является искомой или желательной, например, исследователю или медику. В дополнение, выражение "терапевтически эффективное количество" означает количество, которое сравнимо с соответствующим субъектом, который не получая это количество имеет следующий результат - улучшенное лечение, исцеление, предотвращение или устранение болезни, синдрома, состояния,недуга, расстройства или побочных эффектов или сокращения прогресса болезни, недуга или расстройства. Термин "терапевтически эффективное количество" также охватывает количества, которые являются эффективными для возрастания нормальной физиологической функции. Соединения формулы I могут существовать в виде смесей двух диастереоизомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Они являются особенно предпочтительными смесями стереизомерных соединений. Изобретение также относится к способу получения соединений формулы I и их фармацевтически приемлемых солей, которые характеризуются тем, что соединение формулы IIL означает радикал бороновой кислоты или эфира бороновой кислоты,реагирует с соединением формулы III в которой R2 имеет значения, указанные выше,и при необходимости радикал R2 превращают в другой радикал R2 путем замещения атома галогена амино-, алкокси- или арильным радикалом и/или основание или кислоту формулы I превращают в одну из их солей. Выше и ниже радикалы R1, R2, R3, R3' и R4 имеют значения, указанные для формулы I, если специально не указано иначе. А означает алкил, неразветвленный (линейный) или разветвленный, имеющий 1, 2, 3, 4, 5 или 6 атомов С. Предпочтительно А означает метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, пентил, 1-, 2-или 3-метилбутил, 1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-,2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1 метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил, также предпочтительно, например, трифторметил. Особенно предпочтительно А означает метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил.Ar предпочтительно означает 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дифторфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4 или 3,5-дихлорфенил, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- или 3,5-дибромфенил, 2,3,4-, 2,3,5-, 2,3,6-, 2,4,6- или 3,4,5 трихлорфенил, п-йодфенил, 4-фтор-3-хлорфенил, 2-фтор-4-бромфенил или 2,5-дифтор-4-бромфенил. Независимо от дополнительных заместителей Het означает, например, 2- или 3-фурил, 2- или 3 тиенил, 1-, 2- или 3-пирролил, 1-, 2, 4- или 5-имидазолил, 1-, 3-, 4- или 5-пиразолил, 2-, 4- или 5 оксазолил, 3-, 4- или 5-изоксазолил, 2-, 3- или 4-пиридил, 2-, 4-, 5- или 6-пиримидинил, предпочтительно 1,2,3-оксадиазол-4- или -5-ил, 1,2,4-оксадиазол-3- или -5-ил. Гетероциклические радикалы могут также быть частично или полностью гидрогенизированы. Независимо от дополнительных заместителей Het, таким образом, может также означать, например 2,3-дигидро-2-, -3-, -4- или -5-фурил, 2,5-дигидро-2-, -3-, -4- или 5-фурил, тетрагидро-2- или -3-фурил,тетрагидро-2- или -3-тиенил, 2,3-дигидро-1-, -2-, -3-, -4- или -5-пирролил, 2,5-дигидро-1-, -2-, -3-, -4- илиHal предпочтительно означает F, Cl или Br, а также I, особенно предпочтительно F или Cl. Во всем изобретении все радикалы, которые встречаются больше чем один раз, могут быть одинаковыми или разными, то есть являются независимыми друг от друга. Соединения формулы I могут иметь один или больше хиральных центров и могут, следовательно,встречаться в различных стереизомерных формах. Формула I охватывает все эти формы. Следовательно, изобретение относится, в особенности, к соединениям формулы I, в которых по меньшей мере один из упомянутых радикалов имеет одно из предпочтительных значений, указанных выше. Соединения формулы I, а также исходные соединения для их получения, могут быть получены, по сути, известными способами, описанными в литературе (например, в стандартных работах, таких какHouben-Weyl, Methoden der organischen Chemie [Methods of Organic Chemistry], Georg-Thieme-Verlag,Stuttgart), уточненными для условий реакции, которые известны, и подходящими для указанных реакций. Применение разновидностей также может быть сделано здесь, известных по существу, которые, однако,не упомянуты здесь более подробно. Соединения формулы I предпочтительно могут быть получены взаимодействием соединения формулы II с соединением формулы III. Реакцию проводят в условиях, которые известны специалисту в данной области техники для реакции Сузуки. Исходные соединения формул II и III являются общеизвестными. Если они являются неизвестными,тем не менее, они могут быть получены, по сути, известными способами. В соединениях формулы II L предпочтительно означает Реакцию проводят в стандартных условиях сочетания по Сузуки. В зависимости от используемых условий время реакции составляет между несколькими минутами и 14 днями, температура реакции приблизительно между 30 и 140 С, обычно между 0 и 100 С, в особенности приблизительно между 60 и приблизительно 90 С. Подходящими инертными растворителями являются, например, углеводороды, такие как гексан,петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен,1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол,этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (THF) или диоксан; гликолевые простые эфиры, такие как монометиловый или моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (DMF); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (DMSO); сероуглерод; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси упомянутых растворителей. Особое предпочтение отдают этанолу, толуолу, диметоксиэтану. Соединения формулы I могут, кроме того, предпочтительно быть получены путем замещения радикала R2 другим радикалом R2. Предпочтительно атом галогена замещают амино-, алкокси- или арильным радикалом. Реакцию предпочтительно проводят в условиях сочетания по Сузуки. Кроме того, является возможным превращение соединения формулы I в другое соединение формулы I путем превращения радикала R2 в другой радикал R2, например, восстановлением нитрогруппы до аминогруппы (например, гидрированием на никеле Реннея или палладий-на-угле в инертном растворителе, таком как метанол или этанол). Кроме того, свободные аминогруппы могут быть проацилированы общепринятым способом с применением хлорангидрида кислоты или ангидрида или проалкилированы с применением незамещенного или замещенного алкилгалогенида преимущественно в инертном растворителе, таком как дихлорметан или THF, и/или в присутствии основания, такого как триэтиламин или пиридин, при температурах между-60 и 30 С. Соединения формулы I могут, кроме того, быть получены выделением их из их функционализированных производных сольволизом, в особенности гидролизом, или гидрогенолизом. Предпочтительными исходными соединениями для сольволиза или гидрогенолиза являются такие,которые содержат соответствующие защищенные амино- и/или гидроксильные группы вместо одной или больше свободной амино- и/или гидроксильных групп, предпочтительно те, которые несут аминозащитную группу вместо атома Н, связанного с атомом N, например, те, которые соответствуют формуле I, но содержат NHR'-группу (в которой R' означает аминозащитную группу, например ВОС или CBZ) вместоNH2-группы. Предпочтение, кроме того, отдано исходным соединениям, которые несут гидроксильную защитную группу вместо атома Н гидроксильной группы, например, те, которые соответствуют формуле I, но содержат RO-фенильную группу (в которой R" означает гидроксильную защитную группу) вместо гидроксифенильной группы. Также возможно присутствие в молекуле исходного соединения множества одинаковых или различных защищенных амино- и/или гидроксильных групп. Если имеющиеся защитные группы являются различными друг от друга, они во многих случаях могут быть сняты селективно. Термин "аминозащитная группа" вообще известен и относится к группам, которые являются подходящими для защиты (блокирования) аминогруппы от химических реакций, но которые являются легко удаляемыми после того, как желаемая химическая реакция была выполнена в другом месте в молекулы. Обычными такими группами являются, в особенности, незамещенная или замещенная ацильная, арильная, аралкоксиметильная или аралкильная группы. Поскольку аминозащитные группы удаляют после желаемой реакции (или ряда реакций), их тип и размер, кроме того, не являются принципиальными; тем не менее, предпочтение дается таким, которые имеют 1-20, в особенности 1-8 атомов углерода. Термин"ацильная группа" следует понимать в самом широком смысле в связи с настоящим способом. Он включает ацильные группы, полученные из алифатических, аралифатических, ароматических или гетероциклических карбоновых кислот или сульфоновых кислот, и, в особенности, алкоксикарбонильные, арилоксикарбонильные и особенно аралкоксикарбонильные группы. Примерами таких ацильных групп являются алканоил, такой как ацетил, пропионил и бутирил; аралканоил, такой как фенилацетил; ароил, такой как бензоил и толил; арилоксиалканоил, такой как такой как РОА; алкоксикарбонил, такой как метокси-5 019534 карбонил, этоксикарбонил, 2,2,2-трихлорэтоксикарбонил, ВОС и 2-йодэтоксикарбонил; аралкоксикарбонил, такой как CBZ ("карбобензокси"), 4-метоксибензилоксикарбонил и FMOC; и арилсульфонил, такой как Mtr, Pbf и Pmc. Предпочтительными аминозащитными группами являются ВОС и Mtr, кроме того,CBZ, Fmoc, бензил и ацетил. Термин "гидроксильная защитная группа", вообще, известен и относится к группам, которые являются подходящими для защиты гидроксильной группы от химических реакций, но которые являются легкоудаляемыми после того, как желаемая химическая реакция была выполнена в другом месте в молекулы. Обычными такими группами являются, в особенности, незамещенная или замещенная арильная,аралкильная или ацильная группы, кроме того, также алкильные группы. Природа и размер гидроксильных защитных групп не являются решающими, поскольку их удаляют после желаемой реакции или ряда реакций; предпочтение дается группам, имеющим 1-20, в особенности 1-10 атомов углерода. Примерами гидроксильных защитных групп являются, в частности, трет-бутоксикарбонил, бензил, п-нитробензоил,п-толуолсульфонил, трет-бутил и ацетил, где бензил и трет-бутил являются особенно предпочтительными. СООН-группы в аспарагиновой кислоте и глутаминовой кислоте являются предпочтительно защищенными в виде их трет-бутильных сложных эфиров (например, Asp(OBut. Соединения формулы I освобождают из их функционализированных производных в зависимости от использованной защитной группы, например, применяя сильные кислоты, преимущественно применяяTFA или перхлорную кислоту, а также применяя другие сильные неорганические кислоты, такие как хлористо-водородная кислота или серная кислота, сильные органические карбоновые кислоты, такие как трихлоруксусная кислота, или сульфоновые кислоты, такие как бензол- или п-толуолсульфоновая кислота. Возможно наличие дополнительного инертного растворителя, но он является всегда обязательным. Подходящими инертными растворителями являются предпочтительно органические, например, карбоновые кислоты, такие как уксусная кислота, простые эфиры, такие как тетрагидрофуран или диоксан, амиды, такие как DMF, галогенированные углеводороды, такие как дихлорметан, кроме того, также спирты,такие как метанол, этанол или изопропанол, и вода. Кроме того, подходящими являются смеси вышеупомянутых растворителей. TFA предпочтительно применяют в избытке без добавления дополнительного растворителя, и перхлорную кислота предпочтительно применяют в виде смеси уксусной кислоты и 70% перхлорной кислоты в соотношении 9:1. Температура реакции для расщепления преимущественно находится между около 0 и около 50 С, предпочтительно между 15 и 30 С (комнатная температура).BOC, OBut, Pbf, Pmc и Mtr группы могут, например, предпочтительно быть сняты, применяя TFA в дихлорметане или применяя приблизительно от 3 до 5 N HCl в диоксане при 15-30 С, и FMOC группу можно снять, применяя приблизительно от 5 до 50% раствор диметиламина, диэтиламина или пиперидина в DMF при 15-30 С. Тритильную группу используют для защиты аминокислот гистидин, аспаргин, глутамин и цистеин. Они расщепляются в зависимости от желаемого конечного продукта, применяя смесь TFA/10% тиофенол, со снятием тритильной группы со всех упомянутых аминокислот; применяя смеси TFA/анизол илиTFA/тиоанизол, снимают тритильную группу с His, Asn и Gln, тогда как она сохраняется для Cys боковой цепи.Pbf (пентаметилбензофуранил) группу используют для защиты Arg. Ее снимают, применяя, например, TFA в дихлорметане. Удаляемые при гидрогенолизе защитные группы (например, CBZ или бензил) могут быть сняты,например, обработкой водородом в присутствии катализатора (например, катализатор на основе благородного металла, такого как палладий, преимущественно на носителе, таком как уголь). Подходящие здесь растворители указаны выше, в особенности, например, спирты, такие как метанол или этанол, или амиды, такие как DMF. Гидрогенолиз, как правило, проводят при температурах между около 0 и 100 С и давлении между около 1 и 200 бар, предпочтительно при 20-30 С и 1-10 бар. Гидрогенолиз CBZ группы хорошо получается, например, на 5-10% Pd/C в метаноле или применяя формиат аммония (вместо водорода) на Pd/C в смеси метанол/DMF при 20-30 С. Фармацевтические соли и другие формы. Указанные соединения согласно изобретению могут быть использованы в их конечной несолевой форме. С другой стороны, настоящее изобретение также охватывает применение этих соединений в виде их фармацевтически приемлемых солей, которые могут быть получены их различных органических и неорганических кислот и оснований при помощи известных в технике способов. Фармацевтически приемлемые солевые формы соединений формулы I в основном могут быть получены известными способами. Если соединение формулы I содержит карбоксильную группу, одна из подходящих солей может быть образована взаимодействием соединения с подходящим основанием с получением соответствующей соли присоединения основания. Такими основаниями являются, например,гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этоксид калия и пропоксид натрия; и различные органические основания,такие как пиперидин, диэтаноламин и N-метилглутамин. Алюминиевые соли соединений формулы I также включают. В случае конкретных соединений формулы I соли присоединения кислот могут быть образованы обработкой этих соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например галогенидами водорода, такими как хлористый водород, бромистый водород или йодистый водород, другие минеральные кислоты и их соответствующие соли, такие как сульфат,нитрат или фосфат и т.п., и алкил- и моноарилсульфонаты, такие как этансульфонат, толуолсульфонат и бензолсульфонат, и другие органические кислоты и их соответствующие соли, такие как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и т.п. Таким образом, фармацевтически приемлемые соли присоединения кислот соединений формулы I включают следующие: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит,бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкопентаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2 гидроксиэтансульфонат, йодид, изетионат, изобутират, лактат, лактобионат, малат, малеат, малонат,миндально-кислый, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат,фосфат, фосфонат, фталат, но это не представляет ограничения. Кроме того, основные соли соединений согласно изобретению включают алюминиевые, аммониевые, кальциевые, медные, железные(III), железные(II), литиевые, магниевые, марганцевые(III), марганцевые(II), калиевые, натриевые и цинковые соли, но это не предназначено для ограничения. Из вышеупомянутых солей предпочтение дается аммониевым; щелочным натриевым и калиевым солям, щелочноземельным кальциевым и магниевым солям. Соли соединений формулы I, которые получены из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, также включая встречающиеся в природе замещенные амины,циклические амины, и катионообменные смолы, например аргинин, бетаин, кофеин, хлорпрокаин, холин,N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин,глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглюмин, N-метил-Dглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтаноламин, триэтиламин, триметиламин, трипропиламин и трис-(гидроксиметил)метиламин (трометамин), но это не предназначено для ограничения. Соединения настоящего изобретения, которые содержат основные азотсодержащие группы, могут быть кватернизированы с применением агентов, таких как (С 1-С 4)алкилгалогениды, например метил,этил, изопропил и трет-бутилхлорид, бромид и йодид; ди(С 1-С 4)алкилсульфаты, например диметил, диэтил и диамилсульфат; (С 10-С 18)алкилгалогениды, например децил, додецил, лаурил, миристил и стеарилхлорид, бромид и йодид; и арил(С 1-С 4)алкилгалогениды, например бензилхлорид и фенэтилбромид. Согласно изобретению с применением этих солей могут быть приготовлены и водо- и маслорастворимые составы. Вышеупомянутые фармацевтические соли, которые предпочтительно включают ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изетионат, миндально-кислый, меглюмин, нитрат, олеат, фосфонат, пивалат, фосфат натрия, стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин, но это не предназначено для ограничения. Особое предпочтение отдают гидрохлориду, дигидрохлориду, гидробромиду, малеату, мезилату,фосфату, сульфату и сукцинату. Соли присоединения кислот основных соединений формулы I получают введением свободной основной формы в контакт с достаточным количеством необходимой кислоты, что приводит к формированию соли общепринятым способом. Свободное основание может быть регенерировано введением солевой формы в контакт с основанием и отделением свободного основания общепринятым способом. Свободные основные формы отличаются в определенном отношении от соответствующих солевых форм,вследствие того в отношении некоторых физических свойств, таких как растворимость в полярных растворителях; с целью изобретения, тем не менее, соли иными словами согласуются с соответствующими их свободными основными формами. Как упомянуто, фармацевтически приемлемые соли присоединения основания соединений формулы I образованы с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительными металлами являются натрий, калий, магний и кальций. Предпочтительными органическими аминами являются N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислотных соединений согласно изобретению получены введением свободной кислотной формы в контакт с достаточным количеством необходимого основания, что приводит к формированию соли общепринятым способом. Свободная кислота может быть регенерирована введением солевой формы в контакт с кислотой и выделением свободной кислоты общепринятым способом. Свободные кислотные формы отличаются в определенном отношении от соответствующих солевых форм, вследствие того в отношении некоторых физических свойств, таких как растворимость в полярных растворителях; с целью изобретения, тем не менее, соли иными словами согласуются с их соответствующими свободными кислотными формами. Если соединение согласно изобретению содержит более одной группы, способной образовать фармацевтически приемлемые соли этого типа, изобретение также охватывает множественные соли. Обычно множественные солевые формы включают, например, битартрат, диацетат, дифумарат, димеглюмин,дифосфат, динатрий и тригидрохлорид, но это не предназначено для ограничения. Относительно вышеизложенного можно заметить, что выражение "фармацевтически приемлемая соль" в представленной связи подразумевает активный компонент, который включает соединение формулы I в форме одной из ее солей, в особенности, если эта солевая форма придает улучшенные фармакокинетические свойства активному компоненту по сравнению со свободной формой активного компонента или какой-либо другой солевой формой активного компонента, используемой ранее. Фармацевтически приемлемая солевая форма активного компонента может также обеспечить этот активный компонент для первого раза желательное фармакокинетическое свойство, которого оно не имело ранее и может даже иметь положительное влияние на фармакодинамику этого активного компонента относительно его терапевтической эффективности в теле. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически приемлемые соли и необязательно инертные наполнители и/или вспомогательные средства. Фармацевтические препараты могут быть введены в форме единиц дозирования, которые содержат заданное количество активного компонента на единицу дозирования. Такая единица может содержать,например, 0,5-1 мг, предпочтительно 1-700 мг, особенно предпочтительно 5-100 мг соединения соответственно изобретению в зависимости от условий лечения, способа введения и возраста, веса и состояния пациента или фармацевтические препараты могут быть введены в форме единиц дозирования, которые содержат заданное количество активного компонента на единицу дозирования. Предпочтительно препараты единичного дозирования являются такими, которые содержат дневную дозу или полдозы, как определено выше, или соответствующую фракцию этого активного компонента. Кроме того, фармацевтические препараты этого типа могут быть приготовлены, используя процесс, который в целом известен в фармацевтической области. Фармацевтические препараты могут быть адаптированы для введения любым желаемым подходящим способом, например перорально (включая буккальный или сублингвальный), ректальный, назальный, топический (включая буккальный, сублингвальный или трансдермальный), вагинальный или парентеральный (включая подкожный, внутримышечный, внутривенный или интрадермальный) способы. Такие составы могут быть приготовлены, используя все процессы, известные в фармацевтической области,например комбинированием активного компонента с экципиентом(ами) или адъювантом(ами). Фармацевтические препараты, адаптированные для перорального введения, могут быть введены как отдельные единицы, такие как, например, капсулы или таблетки; порошки или гранулы; растворы или суспензии в водной или неводной жидкостях, пищевые пены или вспененные продукты или жидкие эмульсии "масло-в-воде" или жидкие эмульсии "вода-в-масле". Таким образом, например, в случае перорального введения в форме таблеток или капсул активный компонент может быть комбинирован с пероральным, нетоксическим и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки готовятся измельчением соединения до подходящего малого размера и перемешиванием его с фармацевтическим наполнителем, измельченным подобным образом, таким как, например, пищевой углевод, такой как, например,крахмал или маннит. Ароматизатор, консервант, дисперсант и краситель могут также присутствовать. Капсулы производятся приготовлением порошковой смеси, как описано выше, и наполнением ею сформированных желатиновых оболочек. Глиданты и лубриканты, такие как, например, высокодисперсная силикатная кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме,могут быть добавлены в порошковую смесь до операции наполнения. Разрыхлитель или солюбилизатор,такие как, например, агар-агар, карбонат кальция или карбонат натрия, могут также быть добавлены для того, чтобы улучшить пригодность лекарственного средства после принятия капсулы. В дополнение, если желательно или необходимо, также могут быть введены в смесь подходящие связывающие вещества, лубриканты и разрыхлители, а также красители. Подходящие связывающие вещества включают крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза,подсластители, сделанные из кукурузы, природной или синтетической смолы, такие как, например, камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Лубриканты, используемые в этих формах дозировки, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Разрыхлители включают, не будучи ограниченными этим, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Таблетки формируются, например, приготовлением порошковой смеси, гранулированием или сухим прессованием смеси, добавлением лубриканта и разрыхлителя и прессованием однородной смеси, чтобы получить таблетки. Порошковая смесь готовится перемешиванием соединения, измельченного подходящим способом,-8 019534 с разбавителем или основой, как описано выше, и необязательно со связывающим веществом, таким как,например, карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин, ускорителем абсорбции, таким как, например, соль четвертичного основания, и/или поглотителем, таким как, например, бентонит, каолин или гидрофосфат кальция. Порошковая смесь может быть гранулирована смачиванием ее связывающим веществом, таким как, например, сироп, крахмальная паста, клей из гуммиарабика или растворы целлюлозы либо полимерных материалов, и прессования ее через сито. Как альтернатива гранулированию порошковая смесь может быть пропущена через машину для таблетирования, дающую комочки неоднородной формы, которые дробятся, чтобы сформировать гранулы. Гранулы могут быть покрыты лубрикантом добавлением стеариновой кислоты, стеарата, талька или минерального масла для того, чтобы предупредить налипание к таблеточной пресс-форме. Смесь, покрытая лубрикантом, потом поддается прессованию, чтобы получить таблетки. Соединения соответственно изобретению также могут быть комбинированы с сыпучим инертным наполнителем и потом сразу поданы прессованию без применения этапов гранулирования или сухого прессования. Может присутствовать прозрачный или матовый защитный слой, состоящий из шеллачного герметизирующего слоя, слоя сахара или полимерного материала и глянцевого слоя воска. Красители могут быть добавлены к этим покрывающим слоям для того, чтобы способствовать различию между разными единицами дозирования. Пероральные жидкости, такие как, например, раствор, сиропы или эликсиры, могут быть приготовлены в форме единиц дозирования таким образом, чтобы данное количество содержало заданное количество соединения. Сиропы могут быть приготовлены растворением соединения в водном растворе с подходящим ароматизатором, в то время как эликсиры готовятся, используя нетоксическую спиртовую среду. Суспензии могут быть сформулированы диспергированием соединения в нетоксической среде. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как, например, этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматизирующие добавки, такие как, например, мятное масло или природные подсластители либо сахарин, или другие искусственные подсластители и т.п. Препараты единичного дозирования для перорального введения могут, если желательно, быть инкапсулированы в микрокапсулы. Состав также может быть приготовлен таким путем, который продлевает или задерживает освобождение, таким как, например, покрытие или заливание аэрозольным материалом на полимерах, воске и т.п. Соединения формулы I и их соли также могут быть введены в форме липосомных систем доставки,таких как, например, маленькие моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть сформированы из различных фосфоролипидов,таких как, например, холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их соли также могут быть доставлены, используя моноклональные антитела как индивидуальные носители, с которыми связаны молекулы соединения. Соединения также могут быть связаны с растворимыми полимерами как целенаправленными лекарственными носителями. Такие полимеры могут включать поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид полилизин, замещенный радикалами пальмитоил. Соединения могут, кроме того, быть связаны с классом биодеградируемых полимеров, которые являются подходящими для достижения контролируемого освобождения лекарственного средства, например полимолочная кислота, поли-эпсилон-капролактон, полигидроксимасляная кислота,полиортоэфиры, полиацетали, полидигидроксипирены и сшитые или амфипатные блок-кополимеры гидрогелей. Фармацевтические препараты, адаптированные для трансдермального введения, могут быть введены как независимые пластыри для длительного, закрытого контакта с эпидермисом реципиента. Таким образом, например, активный компонент может быть доставлен из пластыря ионотофорезом, как описано в общих терминах в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические соединения, адаптированные для топического введения, могут быть сформулированы как мази, кремы, суспензии, лосьоны, пудры, растворы, пасты, гели, спреи, аэрозоли или масла. Для лечения глаз или другой внешней ткани, например рта и кожи, составы предпочтительно применяют как топическую мазь или крем. В случае состава, чтобы получить мазь, активный компонент может быть применен или с парафиновой, или с водорастворимой кремовой основой. Альтернативно,активный компонент может быть сформулирован, чтобы дать крем с кремовой основой "масло-в-воде" или основой "вода-в-масле". Фармацевтические препараты, адаптированные для топического применения на глаза, включают глазные капли, в которых активный компонент растворен или суспендирован в подходящем носителе, в особенности в водном растворителе. Фармацевтические препараты, адаптированные для топического применения в рот, включают таблетки для рассасывания, пастилки и полоскания для рта. Фармацевтические препараты, адаптированные для ректального введения, могут быть введены в форме суппозиториев или клизм. Фармацевтические препараты, адаптированные для назального введения, в которых веществоноситель является твердым, содержат крупный порошок, имеющий размер частицы, например, в переделах 20-500 мкм, который вводится способом, в котором используется нюханье, т.е. быстрая ингаляция через назальные отверстия из контейнера, содержащего порошок, прижатого близко к носу. Подходящие составы для введения в качестве назального спрея или каплей для носа с жидкостью в качестве веществаносителя включают раствор активного компонента в воде или масле. Фармацевтические препараты, адаптированные для введения ингаляцией, включают мелкодисперсные пудры или аэрозоли, которые могут быть получены различными типами герметичных флаконов с аэрозолями, небулайзерами или инсуффляторами. Фармацевтические препараты, адаптированные для вагинального введения, могут быть введены как пессарии, тампоны, кремы, гели, пенные или орошающие составы. Фармацевтические препараты, адаптированные для парентерального введения, включают водные и безводные стерильные растворы для инъекций, содержащие антиоксиданты, буферные системы, антисептики и раствор, посредством которого состав делается изотоническим, с кровью реципиента, которого лечат; и водные и неводные стерильные суспензии, которые могут содержать суспензионную среду и загуститель. Составы могут быть введены через однодозовый или многодозовый контейнер, например, в виде запаянных ампул или виал и храниться в сухозамороженном (лиофилизированном) состоянии, так что только добавление стерильного жидкого носителя, например воды для инъекционных целей, являлось бы необходимым непосредственно перед применением. Инъекционные растворы и суспензии, приготовленные в соответствии с рецептом, могут быть приготовлены из стерильных порошков, гранул и таблеток. Само собой разумеется, что в дополнение к вышеупомянутым особенно перечисленным элементам составы также могут включать другие вещества, обычные в области техники относительно особого типа состава; таким образом, например, составы, которые являются подходящими для перорального приема,могут содержать ароматизатор. Терапевтически эффективное количество соединения формулы I зависит от числа факторов, включая, например, возраст и вес животного, точное состояние, которое нуждается в лечении, и его серьезность, природа состава и способ введения, и главное, определено лечение доктором или ветеринаром. Впрочем, эффективное количество соединения соответственно изобретению для лечения неопластического роста, например, карциномы толстой кишки или молочной железы составляет, главным образом, в пределах от 0,1 до 100 мг/кг массы тела больного (млекопитающего) на день и особенно обычно в пределах от 1 до 10 мг/кг массы тела на день. Таким образом, фактическое количество на день для взрослого млекопитающего, весящего 70 кг, обычно является между 70 и 700 мг, где это количество может быть введено как разовая доза на день или чаще серией частичных доз (таких как, например, две, три, четыре,пять или шесть) на день, таким образом, чтобы общая дневная доза являлась такой же. Эффективное количество соли или сольвата либо его физиологически функциональной производной может быть определено как часть эффективного количества соединения соответственно изобретению per se. Можно допустить, что подобные дозы являются подходящими для лечения других состояний перечисленных выше. Соединение формулы I и/или его фармацевтически приемлемые соли могут быть использованы в форме лекарственного средства, также содержащего по меньшей мере еще один лекарственно активный компонент. Соединение формулы I и/или его фармацевтически приемлемые соли могут быть использованы в форме комплекта (набора), содержащего отдельные упаковки:(a) эффективного количества соединения формулы I и/или его фармацевтически приемлемых солей и(b) эффективного количества дополнительного лекарственного активного компонента. Комплект может содержать подходящие контейнеры, такие как коробки, индивидуальные бутылки,мешочки или ампулы. Комплект может, например, содержать отдельные ампулы, каждая вмещающая эффективное количество соединения формулы I и/или его фармацевтически приемлемых солей и эффективное количество дополнительного лекарственного активного компонента в растворенной или лиофилизированной форме. Применение. Настоящие соединения являются подходящими как фармацевтически активные компоненты для млекопитающих, особенно для людей, в лечении заболеваний, вызванных тирозинкиназой. Эти заболевания включают пролиферацию опухолевых клеток, патологическую реваскуляризацию (или ангиогенез), которая способствует росту солидных опухолей, глазную реваскуляризацию (диабетическая ретинопатия, дегенерация желтого пятна, вызванная возрастом, и т.п.) и воспаление (псориаз, ревматоидный артрит и т.п.). Настоящее изобретение включает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предупреждения рака. Предпочтительные формы для лечения карциномы происходят из группы церебральной карциномы, карциномы мочеполового пути, карциномы лимфатической системы, карциномы желудка, ларингеальной карциномы и карциномы легкого. Дополнительной группой предпочтительных форм рака является моноцитарная лейкемия, аденокарцинома легкого, мелкоклеточная карцинома легкого, рак поджелудочной,глиобластома и карцинома яичника. Также настоящее изобретение включает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предупреждения болезни, в которую вовлечен ангиогенез. Такая болезнь, в которую вовлечен ангиогенез, является глазной болезнью, такой как ретинальная васкуляризация, диабетическая ретинопатия, дегенерация желтого пятна, вызванная возрастом и т.п. Настоящее изобретение включает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предупреждения воспалительных заболеваний, которые также попадают под объем настоящего изобретения. Примеры таких воспалительных заболеваний включают ревматоидный артрит, псориаз, контактный дерматит, замедленную аллергическую реакцию и т.п. Также настоящее изобретение включает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предупреждения заболевания, вызванного тирозинкиназой, или состояния, вызванного тирозинкиназой у млекопитающего, где терапевтически активное количество соединения соответственно изобретению вводится больному млекопитающему, которому требуется такое лечение. Терапевтическое количество варьируется в зависимости от болезни и может быть определено специалистом в данной области техники без чрезмерного усилия. Настоящее изобретение также включает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предупреждения ретинальной васкуляризации. Соединения формулы I могут быть использованы для лечения или предупреждения глазных болезней, таких как диабетическая ретинопатия и дегенерация желтого пятна, вызванная возрастом. Соединения формулы I могут быть использованы для лечения или предупреждения воспалительных заболеваний, таких как ревматоидный артрит, псориаз, контактный дерматит и замедленная аллергическая реакция, также как и для лечения или предупреждения патологий кости, выбранных из группы, включающей остеасаркому, остеоартрит и рахит. Выражение "заболевания или состояния, вызванные тирозинкиназой" относится к патологическим состояниям, которые зависят от активности одной или более тирозинкиназ. Тирозинкиназы прямо или косвенно участвуют в сигнальной трансдукции путей обмена различных клеточных активностей, включая пролиферацию, адгезию и миграцию, а также дифференциацию. Заболевания, связанные с активностью тирозинкиназы, включают пролиферацию опухолевых клеток, патологическую реваскуляризацию,которая способствует росту солидных опухолей, глазной реваскуляризации (диабетическая ретинопатия,дегенерация желтого пятна, вызванная возрастом, и т.п.) и воспаления (псориаз, ревматоидный артрит и т.п.). Соединения формулы I могут быть введены пациентам для лечения рака, в особенности быстрорастущих опухолей. Изобретение, таким образом, относится к применению соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственного средства для лечения болезней, в которых играет роль ингибирование, регулирование и/или модуляция сигнальной трансдукции киназы. Предпочтительно здесь подразумевается Met киназа. Предпочтительным является применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственного средства для лечения болезней, в которых играет роль ингибирование тирозинкиназ. Особенно предпочтительным является применение соединений формулы I и их фармацевтически приемлемых солей для приготовления лекарственного средства для лечения болезней, в которых играет роль ингибирование Met киназы. Наиболее предпочтительным является применение соединений формулы I и их фармацевтически приемлемых солей для лечения болезни, которая представляет собой солидное новообразование. Солидное новообразование предпочтительно происходит из группы опухолей легкого, плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы,кишечника, печени, мозга, простаты, урогенитального тракта, лимфатической системы, желудка и/или гортани. Солидное новообразование особенно предпочтительно происходит из группы аденокарциномы легкого, мелкоклеточной карциномы легких, рака поджелудочной, глиобластомы, карциномы толстой кишки и карциномы молочной железы. Предпочтение, кроме того, отдается применению для лечения опухоли крови и иммунной системы,предпочтительно для лечения опухоли выбранной из группы острой миелоидной лейкемии, хронической миелоидной лейкемии, острой лимфатической лейкемии и/или хронической лимфатической лейкемии. Соединения формулы I могут быть введены в комбинации с другими известными лекарственными препаратами, включая антираковые препараты. Как используется здесь, термин "антираковый препарат" относится к любому препарату, который вводится пациенту с раком с целью лечения рака. Антираковое лечение, как упомянуто здесь, может быть использовано как самостоятельная терапия или может включать, в дополнение к соединению согласно настоящему изобретению, обычную хирургическую операцию или радиотерапию либо химиотерапию. Такая химиотерапия может включать одну или больше следующих категорий противоопухолевых препаратов:(i) антипролиферативные/антинеопластические/ДНК-повреждающие препараты и их комбинации,как используется в медицинской онкологии, такие как алкилирующие препараты (например, цис-платин,карбоплатин, циклофосфамид, азотистый иприт, мелфалан, хлорамбуцил, бусульфан и нитрозомочевина); антиметалболиты (например, антифолаты, такие как фторопиримидины типа 5-фтороурацил и тегафур, ралтитрексед, метотрексат, цитозина арабинозид, гидроксимочевина и гемцитабин); противоопухолевые антибиотики (например, антрациклины, типа адриамицина, блеомицина, доксорубицина, дауномицина, эпирубицина, идарубицина, митомицина-С, дактиномицина, митрамицина); антимитотические препараты (например, алкалоиды барвинка, типа винкристина, винбластина, виндезина и винорелбина, и таксоиды, типа таксола и таксотера); ингибиторы топоизомеразы (например, эпидофиллотоксины, типа этопозида и тенипозида, амсакрина, топотекана, иринотекана и камптотецина) и препараты, дифференцирующие клетку (например, полностью транс-ретиноевая кислота, 13-цис-ретиноевая кислота и фенретинид);(ii) цитостатические препараты, такие как антиэстрогены (например, тамоксифен, торемифен, ралоксифен, дролоксифен и иодоксифен), негативные регуляторы эстрогенового рецептора (например,фулвестрант), антиандрогены (например, бикалутамид, флутамид, нилутамид и ацетат ципротерона),антагонисты LHRH (рилизинг-фактор лютеинизирующего гормона) или агонисты LHRH (например, гозерелин, лейпрорелин и бусерелин), прогестероны (например, ацетат мегестрола), ингибиторы ароматазы(iii) препараты, которые ингибируют инвазию раковой клетки (например, ингибиторы металлопротеиназы, типа маримастата, и ингибиторы функции рецептора урокиназы активатора плазмогена);(iv) ингибиторы функции фактора роста, например, такие ингибиторы включают антитела фактора роста, антитела рецептора фактора роста (например, антитело анти-erbb2 трастузумаб [Herceptin] и антитело анти-erbbl цетуксимаб [С 225]), ингибиторы фарнесилтрансферазы, ингибиторы тирозин киназы и ингибиторы серин/треонин киназы, например ингибиторы семейства фактора роста эпидермиса (например, ингибиторы EGFR семейства тирозин киназы, такие как N-(3-хлор-4-фторфенил)-7-метокси-6(3-морфолинопропокси)хиназолин-4-амин (гефинитиб, AZD1839), N-(3-этинилфенил)-6,7-бис-(2 метоксиэтокси)хиназолин-4-амин (эрлотиниб, OSI-774) и 6-акрилоамидо-N-(3-хлор-4-фторфенил)-7-(3 морфолинопропокси)хиназолин-4-амин (CI 1033, например ингибиторы семейства фактора роста тромбоцитов и, например, ингибиторы семейства фактора роста гепатоцитов;(v) антиангиогенные препараты, такие как те, которые ингибируют эффекты фактора роста эндотелия сосудов (например, антитело фактора роста эндотелия сосудов бевацизумаб [Avastin], соединения,такие как те, что раскрыты в WO 97/22596, WO 97/30035, WO 97/32856 и WO 98/13354) и соединения,которые работают по другим механизмам (например, линомид, ингибиторы функции интегрина v3 и ангистатин);(vi) сосудоповреждающие препараты, такие как комбретастатин А 4, и соединения, раскрытые в WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 и WO 02/08213;(vii) антисмысловая терапия, например, такая, которая наведена на цели, перечисленные выше, такая как ISIS 2503, анти-Ras антисенс;(viii) подходы генной терапии, включая, например, подходы для замещения аберрантных генов, таких как аберрантный р 53 или аберрантный BRCA1 или BRCA2, подходы GDEPT (ферментативная пролекарственная ген-управляемая терапия), такие как те, что используют цитозин дезаминазу, тимидин киназу или бактериальный фермент нитроредуктазы, и подходы для увеличения толерантности пациента к химиотерапии или радиотерапии, такие как мультирезистентная генная терапии; и(ix) подходы иммунотерапии, включая, например, ex-vivo и in-vivo подходы для увеличения иммуногенности опухолевых клеток пациента, такие как транфекция цитокинами, такими как интерлейкин 2,интерлейкин 4 или гранулоцитарно-моноцитарный колониестимулирующий фактор, подходы для уменьшения анергии Т-клетки, подходы, использующие трансфицированные иммуноциты, такие как цитокин-трансфицированные дендритные клетки, подходы, использующие цитокин-трансфицированные опухолевые клеточные линии, и подходы, использующие антиидиотипические антитела. Лекарственные средства из табл. 1 ниже являются предпочтительно, но не исключительно, применимыми в комбинации с соединениями формулы I. Комбинированное лечение такого типа может быть достигнуто при помощи одновременного, последовательного или отдельного распределения отдельных компонентов лечения. Комбинированные продукты такого типа могут использовать соединения согласно изобретению. Анализы. Соединения формулы I, описанные в примерах, были протестированы с помощью анализов, описанных ниже, и было найдено, что они имеют ингибирующую активность в отношении киназы. Другие анализы, которые известны из литературы, могут легко быть применены специалистом в данной области техники (см., например, Dhanabal et al., Cancer Res., 59:189-197; Xin et al., J. Biol. Chem., 274:9116-9121;Cancer Inst., 52:413-427; Nicosia et al., In Vitro, 18:538- 549). Измерение активности Met киназы. Соответственно данным производителя (Met, active, Upstate, кат. No. 14-526) Met киназу экспрессировали для целей производства белка в клетках насекомого (Sf21; S. frugiperda) и последующей очистки аффинной хроматографией как "N-концевого 6His-меченого" рекомбинантного человеческого белка в экпрессирующем бакуловирусном векторе. Активность киназы может быть измерена, используя различные доступные измерительные системы. В способе сцинтилляционного сближения (Sorg et al., J. of Biomolecular Screening, 2002, 7, 11-19), вFlashplate способе или тесте связывания на фильтрах радиоактивная фосфорилизация белка или пептида как субстрата измеряется, используя меченные радионуклидами АТФ (32 Р-АТФ, 33 Р-АТФ). В случае присутствия ингибирующего соединения может быть определено уменьшение радиоактивного сигнала или полное его отсутствие. Кроме того, как способы анализа могут быть применены методики резонансного переноса энергии флуоресценции с однородным временным разрешением (HTR-FRET) и флуоресцентной поляризации (FP) (Sills et al., J. Biomolecular Screening, 2002, 191-214). Другие нерадиоактивные способы твердофазного иммуноферментного анализа используют специфические фосфоантитела (phospho ABs). Фосфоантитело связывает только фосфорилированный субстрат. Это связывание может быть детектировано хемилюминесценцией, используя вторичное конъюгированное с пероксидазой антитело (Ross et al., 2002, Biochem. J.).Flashplate способ (Met киназа). Используемыми тестовыми планшетами являлись 96-ячеечные Flashplate микротитрационные планшеты от Perkin Elmer (кат.SMP200). Компоненты реакции киназы, описанные ниже, вносились пипеткой на аналитический планшет. Met киназа и субстрат поли Ala-Glu-Lys-Tyr, (pAGLT, 6:2:5:1), инкубировались на протяжении 3 ч, при комнатной температуре с меченным радионуклидом 33 Р-АТФ в присутствии и в отсутствие тестируемых соединений в общем объеме 100 мкл. Реакция прекращалась,используя 150 мкл 60 мМ раствора ЭДТА. После инкубации на протяжении дополнительных 30 мин при комнатной температуре супернатанты фильтровали откачиванием и ячейки промывали три раза 200 мкл 0,9% раствором NaCl каждый раз. Измерение скачка радиоактивности определяли при помощи прибора измерения сцинтилляции (Topcount NXT, Perkin-Elmer). Используемое полное значение являлось реакцией без ингибитора киназы. Она должна быть в пределах 6000-9000 cpm (число импульсов в 1 мин). Используемое фармакологическое нулевое значение является страуроспорином в конечной концентрации 0,1 мМ. Ингибирующие значения (IC50) определены, используя программу RS1MTS. Условия реакции киназы на ячейку: 30 мк буфера для анализа 10 мкл субстрата, который будет тестироваться в буфере для анализа с 10% ДМСО 10 мкл АТФ (конечная концентрация 1 мкМ точно, 0,35 мкКи 33 Р-АТФ) 50 мкл смеси Met киназа/субстрат в буфере для анализа; (10 нг фермент/ячейка, 50 нгpAGLT/ячейка). Используемые растворы. Буфер для анализа: 50 мМ HEPES (N-2-гидроксиэтилпиперазин-N-2-этансульфоновая кислота),3 мМ хлорида магния,3 мкМ ортованадата натрия,3 мМ хлорида марганца(II),1 мМ дитиотреитола (DTT) рН 7,5 (чтобы установить, используется ли гидроксид натрия). Тормозящий раствор: 60 мМ Titriplex III (ЭДТА),33In-vivo тесты. Экспериментальная методика. Женские особи мышей Balb/C (breeder: Charles River Wiga) 5 недель по прибытии. Они были акклиматизированы до наших условий содержания на протяжении 7 дней. Каждой мыши впоследствии было введено подкожно в область таза 4 млн TPR-Met/NIH3T3 клеток в 100 мкл PBS (фосфатно-солевой буферный раствор) (без Са и Mg). После 5 дней животные были случайным образом поделены на 3 группы таким образом, что каждая группа из 9 мышей имела среднее значение объема опухоли 110 мкл(пределы: 55-165). 100 мкл среды (0,25% метилцеллюлозы/100 мМ ацетатного буфера, рН 5,5) были введены ежедневно контрольной группе и 200 мг/кг "А 56" или "А 91", растворенных в среде (объем также 100 мкл/животное), были введены ежедневно группам, которые поддавались лечению, в каждом случае желудочным зондом. После 9 дней контрольные образцы имели среднее значение объема 1530 мкл, и эксперимент был закончен. Измерение объема опухоли. Длина (L) и ширина (В) были измерены, используя штангенциркуль с нониусом, и объем опухоли был рассчитан по формуле LВВ/2. Условия содержания: 4 или 5 животных на клетку, кормление коммерческой едой для мышей(Sniff). Выше и ниже, все температуры определяются в С. В следующем примере "обычное исследование" означает: вода добавляется, если необходимо, рН корректируется, если необходимо, до значений между 2 и 10, в зависимости от состава конечного продукта, смесь экстрагируется этилацетатом или дихлорметаном, фазы разделяются, органическая фаза высушивается над сульфатом натрия и испаряется и остаток очищается хроматографически на силикагеле и/или кристаллизацией. Rf значения на силикагеле; элюент: этилацетат/метанол 9:1. Масс-спектрометрия (MS):EI (ионизация электронным ударом) М+,FAB (бомбардировка ускоренными атомами) (М+Н)+,ESI (ионизация электрораспылением) (М+Н)+,APCI-MS (химическая ионизация при атмосферном давлении-масс-спектрометрия) (М+Н)+,т.пл.=температура плавления [С]. Способы ВЭЖХ. Способ А: градиент: 4,5 мин/расход: 3 мл/мин 99:01-0:100,вода+0,1 об.%, TFA (трифторуксусная кислота): ацетонитрил+0,1 об.% TFA (трифторуксусная кислота),0,0-0,5 мин: 99:01,0,5-3,5 мин: 99:010:100,3,5-4,5 мин: 0:100. Колонка: Chromolith SpeedROD RP18e 50-4,6. Длина волны: 220 нм. Способ В: градиент: 4,2 мин/ расход: 2 мл/мин 99:01-0:100,вода+0,1 об.% TFA (трифторуксусная кислота): ацетонитрил+0,1 об.% TFA (трифторуксусная кислота),0,0-0,2 мин: 99:01,0,2-3,8 мин: 99:010:100,3,8-4,2 мин: 0:100. Колонка: Chromolith Performance RP18e; 100 мм длины,внутренний диаметр 3 мм,Длина волны: 220 нм. Время удерживания Rt в минутах [мин]. Пример 1. Получение 3-[3-(5-бромпиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4 триазоло[4,3-b]пиридазина ("А 1") осуществляли аналогично следующей схеме: 1.1. 2,70 кг (18,0 моль) йодида натрия прибавляли порциями при комнатной температуре к смеси 5,0 л воды и 11,3 л 57% водной йодисто-водородной кислоты (75,2 моль). Затем к раствору прибавляли порциями 2,00 кг (13,4 моль) 3,6-дихлорпиридазина, поддерживая температуру 20 С. Реакционную смесь перемешивали при 20 С в течение 18 ч. К реакционной смеси прибавляли 10 л трет-бутилметилового эфира и 4 л воды. Органическую фазу отделяли, промывали водой и водным раствором сульфита натрия. Органическую фазу выпаривали, прибавляли гептан, полученный осадок отфильтровывали с отсасыванием и промывали гептаном. Остаток сушили в вакууме: 3-хлор-6-йодпиридазин в виде бесцветных листовидных кристаллов; ESI 241. 1.2. 705 г (3,39 моль) пинаколил 1-метил-1 Н-пиразол-4-бороната и 1,44 кг тригидрата трикалийфосфата прибавляли к раствору 815 г (3,39 моль) 3-хлор-6-йодпиридазина в 3,8 л 1,2-диметоксиэтана. Полученную суспензию нагревали до 80 С под азотом и при перемешивании и прибавляли 59,5 г (85 ммоль) бис-(трифенилфосфин)палладий(II) хлорида. Реакционную смесь перемешивали при 80 С в течение 3 ч. Смесь оставляли охлаждаться до комнатной температуры и прибавляли 9 л воды. Полученный осадок отфильтровывали с отсасыванием, промывали водой и сушили в вакууме: 3-хлор-6-(1-метил-1 Нпиразол-4-ил)пиридазин в виде коричневых кристаллов; ESI 195. 1.3. 4,86 мл (100 ммоль) гидроксида гидразина прибавляли к раствору 11,5 г (50,0 ммоль) метил 3 бромфенилацетата в 35 мл 1-бутанол и смесь нагревали при кипении в течение 90 мин. Реакционную смесь охлаждали до комнатной температуры. Полученный осадок отфильтровывали с отсасыванием,промывали петролейным эфиром и сушили в вакууме: (3-бромфенил)ацетогидразид в виде бесцветных тонких игл; ESI 229, 231. 1.4. Суспензию 3,89 г (20,0 ммоль) 3-хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазина и 4,58 г (20,0 ммоль) (3-бромфенил)ацетогидразида в 40 мл 1-бутанол нагревали при 130 С в течение 18 ч. Реакционную смесь охлаждали и разделяли между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток хроматографировали на колонке с силикагелем при помощи смеси дихлорметан/трет-бутил метиловый эфир/метанол как элюент: 3-(3-бромбензил)-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазин в виде бежевых кристаллов; ESI 369, 371. 1.5. 1,57 мг (16,1 ммоль) ацетата калия прибавляли к раствору 2,10 г (5.35 ммоль) 3-(3-бромбензил)6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина и 1,77 г (6.95 ммоль) бис-(пинаколато)дибора в 11 мл DMF и смесь нагревали до 80 С под азотом. Затем прибавляли 118 мг (0,16 ммоль) 1,1-бис(дифенилфосфино)ферроценпалладий(II) дихлорид и смесь перемешивали при 80 С в течение 3 ч. Реакционную смесь разделяли между водой и дихлорметаном. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток нагревали с трет-бутил метиловым эфиром, оставляли охлаждаться и отфильтровывали с отсасыванием, промывали трет-бутил метиловым эфиром и сушили в вакууме: 6-(1 метил-1 Н-пиразол-4-ил)-3-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил]-1,2,4-триазоло[4,3b]пиридазин в виде зеленых кристаллов; ESI 417. 1.6. Раствор 581 мг (5,48 ммоль) карбоната натрия в 2,7 мл воды прибавляли к суспензии 1,14 г(2,74 ммоль) 6-(1-метил-1 Н-пиразол-4-ил)-3-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензил]1,2,4-триазоло[4,3-b]пиридазина в 2,7 мл толуола и 5,4 мл этанола и смесь нагревали до 80 С под азотом. Затем прибавляли 780 мг (2,74 ммоль) 5-бром-2-йодпиримидина и 38,4 мг (0,06 ммоль) бис- 24019534(трифенилфосфин)палладий(II) хлорида и реакционную смесь перемешивали при 80 С под азотом в течение 18 ч. Реакционную смесь разделяли между водой и дихлорметаном. Органическую фазу выпаривали и остаток хроматографировали на колонке с силикагелем смесью петролейных эфир/дихлорметан/метанол как элюент: 3-[3-(5-бромпиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4 ил)-1,2,4-триазоло[4,3-b]пиридазин ("А 1") в виде бесцветных кристаллов; ESI 447/449; 1 Н-ЯМР (d6DMSO):[м.д.] 3,93 (s, 3 Н), 4,63 (s, 2 Н), 7,50 (t, J=7,8 Гц, 1 Н), 7,63 (dt, J1=7,5 Гц, J2=1,5 Гц, 1 Н), 7,66 (d,J=9,3 Гц, 1 Н), 8,20 (s, 1H), 8,23 (dt, J1=7,4 Гц, J2=1,3 Гц, 1 Н), 8,32 (d, J=9,6 Гц, 1 Н), 8,48 (t, J=1,5 Гц, 1 Н),8,51 (s, 1H), 9,06 (s, 2H). Пример 2. Получение 6-(1-метил-1 Н-пиразол-4-ил)-3-(3-5-[1-(2-пирролидин-1-илэтил)-1 Нпиразол-4-ил]пиримидин-2-илбензил)-1,2,4-триазоло[4,3-b]пиридазина ("А 2") осуществляли аналогично следующей схеме: 2.1. 17,5 г (101 ммоль) гидрохлорида N-(2-хлорэтил)пирролидина и 49,4 г (152 ммоль) карбоната цезия прибавляли к раствору 10,0 г (50,5 ммоль) пинаколил пиразол-4-бороната в 100 мл ацетонитрила. Полученную суспензию перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь фильтровали с отсасыванием и промывали ацетонитрилом. Фильтрат выпаривали и разделяли между этилацетатом и насыщенным раствором хлорида натрия. Органическую фазу сушили над сульфатом натрия и упаривали: 1-(2-пирролидин-1-илэтил)-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1 Нпиразол в виде бледно-оранжевого масла, которое постепенно кристаллизуется; 1 Н-ЯМР (d6-DMSO):(s, 1H). 2.2. Суспензию 112 мг (0,25 ммоль) 3-[3-(5-бромпиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4 ил)-1,2,4-триазоло[4,3-b]пиридазина, 100 мг (0,30 ммоль) 1-(2-пирролидин-1-илэтил)-4-(4,4,5,5 тетраметил-1,3,2-диоксаборолан-2-ил)-1 Н-пиразола и 106 мг (0,50 ммоль) тригидрата трикалийфосфата в 2 мл 1,2-диметоксиэтана нагревали до 80 С под азотом. Затем прибавляли 14 мг (20 мкмоль) бис(трифенилфосфин)палладий(II) хлорида и одну каплю триэтиламина и смесь перемешивали при 80 С в течение 6 ч. Реакционную смесь охлаждали и разделяли между водой и дихлорметаном. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток хроматографировали на колонке с силикагелем при помощи смеси дихлорметан/метанол как элюент: 6-(1-метил-1 Н-пиразол-4-ил)-3-(3-5-[1-(2 пирролидин-1-илэтил)-1 Н-пиразол-4-ил]пиримидин-2-илбензил)-1,2,4-триазоло[4,3-b]пиридазин ("А 2") в виде бесцветных кристаллов; ESI 532; 1 Н-ЯМР (d6-DMSO):[м.д.] 1,67 (m, 4 Н), 2,48 (m, 4 Н), 2,87 (t,J=6,6 Гц, 2 Н), 3,93 (s, 3 Н), 4,27 (t, J=6,6 Гц, 2 Н), 4,64 (s, 2 Н), 7,48 (t, J=8 Гц, 1 Н), 7,57 (d, J=8 Гц, 1 Н), 7,67(bs, 1H), 8,52 (s, 1H), 9,12 (s, 2H). Пример 3. Получение 3-[3-(5-бромпиримидин-2-ил)фенил]дифторметил-6-(1-метил-1 Н-пиразол 4-ил)-1,2,4-триазоло[4,3-b]пиридазина ("A3") осуществляли аналогично следующей схеме: 3.1. 12,3 мл (253 ммоль) гидроксида гидразина прибавляли к раствору 15,0 г (50,5 ммоль) этил (3- 25019534 бромфенил)дифторацетата (получен согласно WO 2007/014454) в 200 мл метанола и смесь перемешивали при 45 С в течение 10 мин. Реакционную смесь выпаривали. Остаток обрабатывали дихлорметаном и фильтровали. Остаток обрабатывали водой, фильтровали, промывали водой и сушили в вакууме: (3 бромфенил)дифторацетогидразид в виде слегка желтоватых кристаллов; ESI 265/267. 3.2. Суспензию 4,18 г (20,0 ммоль) 3-хлор-6-(1-метил-1 Н-пиразол-4-ил)пиридазина и 5,46 г (20,0 ммоль) (3-бромфенил)дифторацетогидразида в 87 мл 1-бутанола нагревали при 30 С в течение 18 ч. Реакционную смесь охлаждали и перемешивали при комнатной температуре в течение 4 дней. Полученный осадок отфильтровывали с отсасыванием и остаток хроматографировали на колонке с силикагелем при помощи смеси дихлорметан/метанол как элюент: 3-[(3-бромфенил)дифторметил]-6-(1-метил-1 Н-пиразол 4-ил)-1,2,4-триазоло[4,3-b]пиридазин в виде бесцветного порошка; ESI 405/407; 1 Н-ЯМР (d6-DMSO):[м.д.] 3,95 (s, 3 Н), 7,55 (t, J=7,8 Гц, 1 Н), 7,76 (d, J=8,4 Гц, 1 Н), 7,83 (d, J=8,4 Гц, 1 Н), 7,86 (d, J=9,5 Гц, 1 Н),7,97 (s, 1H), 8,09 (s, 1 Н), 8,49 (d, J=9,5 Гц, 1 Н), 8,51 (s, 1H). 3.3. 2,45 г (25,0 ммоль) ацетата калия прибавляли к раствору 3,38 г (8,33 ммоль) 3-[(3 бромфенил)дифторметил]-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина и 2,65 г (10,4 ммоль) бис-(пинаколато)дибора в 17 мл DMF, и смесь нагревали до 80 С под азотом. Затем прибавляли 175 мг (0,25 ммоль) бис-(трифенилфосфин)палладий(II) хлорида и смесь перемешивали при 80 С в течение 18 ч. Реакционную смесь разделяли между водой и дихлорметаном. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток нагревали с трет-бутилметиловым эфиром, оставляли охлаждаться, отфильтровывали с отсасыванием, промывали трет-бутилметиловым эфиром и сушили в вакууме: 3-дифтор[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил-6-(1-метил-1 Н-пиразол-4-ил)1,2,4-триазоло[4,3-b]пиридазин в виде бесцветных кристаллов; ESI 453. 3.4. Раствор 1,07 г (10,1 ммоль) карбоната натрия в 5 мл воды прибавляли к суспензии 2,31 г (5,06 ммоль) 3-дифтор-[3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина в 5 мл толуола и 10 мл этанола и смесь нагревали до 80 С под азотом. Затем прибавляли 1,44 г (5,06 ммоль) 5-бром-2-йодпиримидина и 71 мг (0,10 ммоль) бис(трифенилфосфин)палладий(II) хлорида и реакционную смесь перемешивали при 80 С под азотом в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, прибавляли воду и смесь фильтровали с отсасыванием. Остаток обрабатывали этанолом, перемешивали несколько минут и опять отфильтровывали с отсасыванием. Остаток сушили в вакууме: 3-[3-(5-бромпиримидин-2 ил)фенил]дифторметил-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазин в виде бежевого порошка; ESI 483,485; 1 Н-ЯМР (d6-DMSO):[м.д.] 3,92 (s, 3 Н), 7,76 (t, J=7,8 Гц, 1 Н), 7,83 (d, J=9,9 Гц,1 Н), 7,95 (d, J=7,8 Гц, 1 Н), 8,11 (s, 2H), 8,46 (s, 2H), 8,47 (d, J=9,8 Гц, 1 Н), 8,58 (d, J=7,5 Гц, 1 Н), 8,80 (bs,1H), 9,18 (s, 2H). Соединение 3-(3-[3-(5-бромпиримидин-2-ил)фенил]дифторметил-1,2,4-триазоло[4,3-b]пиридазин 6-ил)бензонитрил ("А 3 а")ESI 504/506, получен аналогично. Пример 4. Аналогично получению "А 1" соединение "А 4" получено исходя из метил 1-(3 бромфенил)циклопропанкарбоксилата Пример 5. Получение 3-3-[3-(5-бромпиримидин-2-ил)бензил]-1,2,4-триазоло[4,3-b]пиридазин-6 илбензонитрила ("А 5") осуществляли аналогично следующей схеме: 5.1. Раствор 10,6 г (100 ммоль) карбоната натрия в 50 мл воды прибавляли к раствору 7,34 г (50,0 моль) 3-цианобензолбороновой кислоты и 12,0 г (50,0 ммоль) 3-хлор-6-йодпиридазина в 100 мл этанола и 50 мл толуола и смесь нагревали до 80 С под азотом. Затем прибавляли 351 мг (0,50 ммоль) бис(трифенилфосфин)палладий(II) хлорида. Реакционную смесь перемешивали при 80 С в течение 18 ч. Смесь оставляли охлаждаться до комнатной температуры, полученный осадок отфильтровывали с отсасыванием и промывали водой. Остаток перекристаллизовывали из 2-пропанола: 3-(6-хлорпиридазин-3 ил)бензонитрил в виде коричневых кристаллов; ESI 216. 5.2. Суспензию 3,33 г (15,0 ммоль) 3-хлор-6-(3-цианофенил)пиридазина и 3,47 г (15,0 ммоль) (3 бромфенил)ацетогидразида в 30 мл 1-бутанола нагревали при 130 С в течение 18 ч. Реакционную смесь охлаждали, добавляли этилацетат и воду. Полученный осадок отфильтровывали с отсасыванием, хорошо промывали водой и сушили в вакууме: 3-[3-(3-бромбензил)-1,2,4-триазоло[4,3-b]пиридазин-6 ил]бензонитрил в виде коричневых кристаллов; ESI 390/392. 5.3. Далее, как в получении "A3". Получен 3-3-[3-(5-бромпиримидин-2-ил)бензил]-1,2,4-триазоло[4,3-b]пиридазин-6-илбензонитрил("А 5"), ESI 468/470. Пример 6. Аналогично получению "А 1" соединение "А 6" получено исходя из 1-хлор-4 метилпиридазина (получен согласно ЕР 1422218) Пример 7. Следующие соединения получены аналогично получению "А 2": Пример 8. Получение 6-(1-метил-1 Н-пиразол-4-ил)-3-[3-(5-морфолин-4-илпиримидин-2-ил)бензил]1,2,4-триазоло[4,3-b]пиридазин ("А 10") осуществляли аналогично следующей схеме: Пример 8 а. Получение соединения 3-3-[5-(4-метилпиперазин-1-ил)пиримидин-2-ил]бензил-6-(1 метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина ("А 11") осуществляли аналогично следующей схеме: Суспензию 546 мг (1,22 ммоль) 3-[3-(5-бромпиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)1,2,4-триазоло[4,3-b]пиридазина и 366 мг (2,44 ммоль) йодида натрия в 6 мл DMF нагревали до 80 С под азотом. Затем прибавляли 26 мг (0,18 ммоль) транс-N,N'-диметил-1,2-циклогександиамин, 18,6 мг (0,100 ммоль) йодида меди(I) и 6 мл диоксана и полученную суспензию перемешивали при температуре 95 С под азотом в течение 18 ч. Реакционную смесь разделяли между водой и дихлорметаном. Органическую фазу сушили над сульфатом натрия и упаривали. Остаток хроматографировали на колонке с силикагелем при помощи смеси дихлорметан/метанол как элюент: 3-[3-(5-йодпиримидин-2-ил)бензил]-6-(1-метил-1 Нпиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазин в виде коричневых кристаллов; ESI 495. Суспензию 288 мг (0,582 ммоль) 3-[3-(5-йодпиримидин-2-ил)бензил]-6-(1-метил-1 Н-пиразол-4-ил)1,2,4-триазоло[4,3-b]пиридазина в 1,5 мл толуола нагревали до 110 С под азотом и охлаждали до комнатной температуры. Затем прибавляли 178 мг (0,815 ммоль) трикалий фосфата, 97 мкл (0,874 ммоль) 1 метилпиперазина, 19,7 мг (0,047 ммоль) 2-дициклогексилфосфино-2',6'-диметоксибифенила и 10,7 ммоль(0,012 ммоль) трис-(дибензилиденацетон)дипалладия и полученную суспензию перемешивали при 110 С под азотом в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и прибавляли этилацетат. Полученный осадок отфильтровывали с отсасыванием и остаток хроматографировали на колонке с силикагелем при помощи смеси дихлорметан/метанол как элюент: 3-3-[5-(4-метилпиперазин-1 ил)пиримидин-2-ил]бензил-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазин в виде бежевых кристаллов; ESI 467; 1 Н-ЯМР (d6-DMSO):[м.д.] 2,31 (s, 3 Н), 2,58 (m, 4 Н), 3,34 (m, 4 Н), 3,94 (s, 3 Н),4,61 (s, 2 Н), 7,42 (t, J=7,7 Гц, 1 Н), 7,63 (d, J=7,3 Гц, 1 Н), 7,67 (d, J=9,8 Гц, 1 Н), 8,14 (d, J=7,4 Гц, 1 Н), 8,20(s, 1 Н), 8,32 (d, J=9,6 Гц, 1 Н), 8,39 (bs, 1H), 8,51 (s, 1 Н), 8,58 (s, 2H). Следующие соединения получены аналогично: Пример 9. Получение 3-(дифтор-3-[5-(2-морфолин-4-илэтокси)пиримидин-2-ил]фенилметил)-6(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина ("А 12") и 3-[дифтор-(3-пиримидин-2 илфенил)метил]-6-(1-метил-1 Н-пиразол-4-ил)-1,2,4-триазоло[4,3-b]пиридазина ("А 26") осуществляли аналогично следующей схеме:
МПК / Метки
МПК: A61P 35/02, C07D 487/04, A61K 31/5025
Метки: ингибиторов, качестве, 3-(3-пиримидин-2-илбензил)-1,2,4-триазоло[4,3-b]пиридазина, киназы, производные
Код ссылки
<a href="https://eas.patents.su/30-19534-proizvodnye-3-3-pirimidin-2-ilbenzil-124-triazolo43-bpiridazina-v-kachestve-ingibitorov-met-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-(3-пиримидин-2-илбензил)-1,2,4-триазоло[4,3-b]пиридазина в качестве ингибиторов met киназы</a>
Предыдущий патент: Композиция для местного применения для лечения актинического кератоза
Следующий патент: Способ борьбы с тлей на растениях
Случайный патент: Способ получения чистого циталопрама












