Замещенные производные триазоло-пиридазина в качестве лигандов рецепторов гамк
Номер патента: 2436
Опубликовано: 25.04.2002
Авторы: Мэдин Эндрю, Расселл Майкл Джеффри, Стрит Лесли Джозеф, Мур Кевин Вилльям, Карлинг Вилльям Роберт, Гиблин Александр Ричард, Кастро Пинейро Хосе Луис, Бротон Говард Барфф
Формула / Реферат
1. Соединение формулы I, его соль или пролекарство
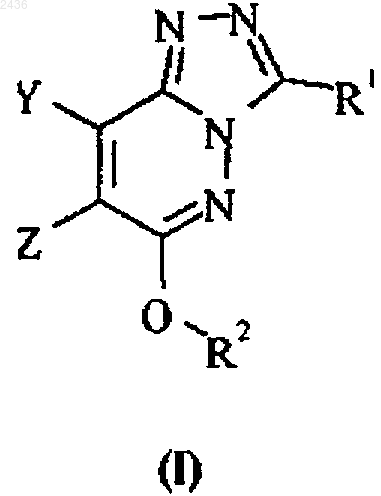
где Y означает водород или C1-6алкил; и
Z означает C1-6алкил, С3-7циклоалкил, С4-7циклоалкенил, арил, С3-7гетероциклоалкил, гетероарил или ди(C1-6)алкиламино, причем любая из групп может быть необязательно замещена; или
Y и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют кольцо, выбранное из С5-9циклоалкенила, С6-10бициклоалкенила, тетрагидропиридинила, пиридинила и фенила, причем любое из колец необязательно может быть бензо-конденсированным и/или замещенным;
R1 означает С3-7циклоалкил, фенил, фурил, тиенил или пиридинил, причем любая из групп может быть необязательно замещена; и
R2 означает циано(C1-6)алкил, гидрокси(C1-6)алкил, С3-7циклоалкил (C1-6)алкил, пропаргил, С3-7гетероциклоалкилкарбонил(C1-6)алкил, арил(C1-6)алкил или гетероарил(C1-6)алкил, причем любая из групп может быть необязательно замещена;
при этом необязательные заместители для групп Y, Z, R1 и R2 выбирают из группы, включающей C1-6алкил, арил(C1-6)алкил, пиридил(C1-6)алкил, галоген, гало(C1-6)алкил, циано, циано(C1-6)алкил, гидрокси, гидроксиметил, C1-6алкокси, С3-7циклоалкил(C1-6)алкокси, С3-7циклоалкокси, амино(C1-6)алкил, ди(C1-6)алкиламино(C1-6)алкил, ди(C1-6)алкиламинокарбонил(C1-6)алкил, N-(C1-6)алкилпиперидинил, пирролидинил(C1-6)алкил, пиперазинил(C1-6)алкил, морфолинил(C1-6)алкил, ди(C1-6)алкилморфолинил(C1-6)алкил и имидазолил(C1-6)алкил;
и при этом термин "арил" обозначает группы фенил и нафтил, предпочтительно фенил;
термин "гетероциклоалкил" обозначает группы азетидинил, пирролидинил, пиперидинил, пиперазинил, морфолинил и тиоморфолинил;
термин "гетероарил" обозначает группы пиридинил, хинолинил, изохинолинил, пиридазинил, пиримидинил, пиразинил, хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензтиенил, пирролил, индолил, пиразолил, индазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил и тетразолил;
при условии, что если Y и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют необязательно замещенное фенильное кольцо, то R2 не является гидрокси(C1-6)алкилом.
2. Соединение по п.1, где Y представляет собой водород.
3. Соединение по п.1 или 2, где Z означает метил, этил, изопропил, трет-бутил, 1,1-диметилпропил, метилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, циклобутенил, фенил, пирролидинил, метилпирролидинил, пиперидинил, морфолинил, тиоморфолинил, пиридинил, фурил, тиенил, хлортиенил и диэтиламино.
4. Соединение по любому из пп.1, 2 или 3, где R1 означает циклопропил, фенил, метилфенил, фторфенил, дифторфенил, метоксифенил, фурил, тиенил, метилтиенил и пиридинил.
5. Соединение по п.1, представленное формулой IIА, а также его соли и пролекарства
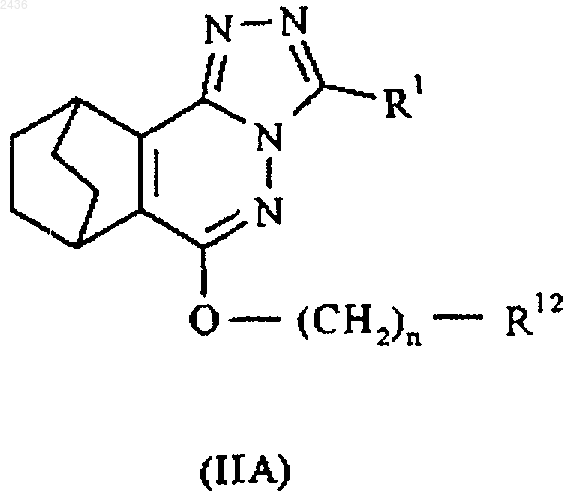
где R1 принимает значения, указанные в п.1;
R12 означает гидрокси; или С3-7циклоалкил, С3-7гетероциклоалкилкарбонил, арил или гетероарил, причем любая из групп может быть необязательно замещена.
6. Соединение по п.1, представленное формулой IIB, а также его соли и пролекарства
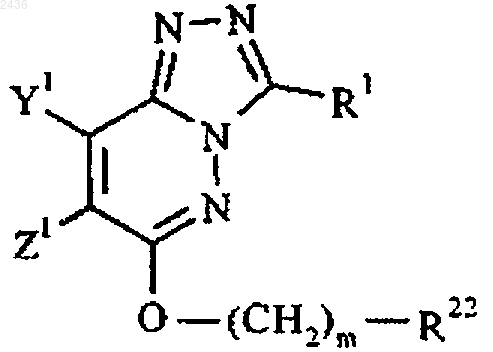
где Y1 означает водород или метил;
Z1 означает C1-6алкил, С3-7циклоалкил, С4-7циклоалкенил, арил, С3-7гетероциклоалкил, гетероарил или ди(C1-6)алкиламино, причем любая из групп может быть необязательно замещена;
R1 принимает указанные в п.1 значения;
m равно 1 или 2; и
R22 означает арил или гетероарил, причем любая из групп может быть необязательно замещена.
7. Соединение по п.6, где m равно 1.
8. Соединение по п.6, где R22 означает фенил, пиридинил, хинолинил, изохинолинил, пиридазинил, пиримидинил, пиразинил, хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензтиенил, пирролил, индолил, пиразолил, индазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил или тетразолил, причем любая из этих групп может быть необязательно замещена одним или несколькими заместителями, выбранными из группы, включающей метил, этил, н-пропил, бензил, пиридинилметил, хлоро, циано, цианометил, гидроксиметил, этокси, циклопропилметокси, диметиламинометил, аминоэтил, диметиламиноэтил, диметиламинокарбонилметил, N-метилпиперидинил, пирролидинилэтил, пиперазинилэтил и морфолинилметил.
9. Соединение по п.6, представленное формулой IIC, и его фармацевтически приемлемые соли
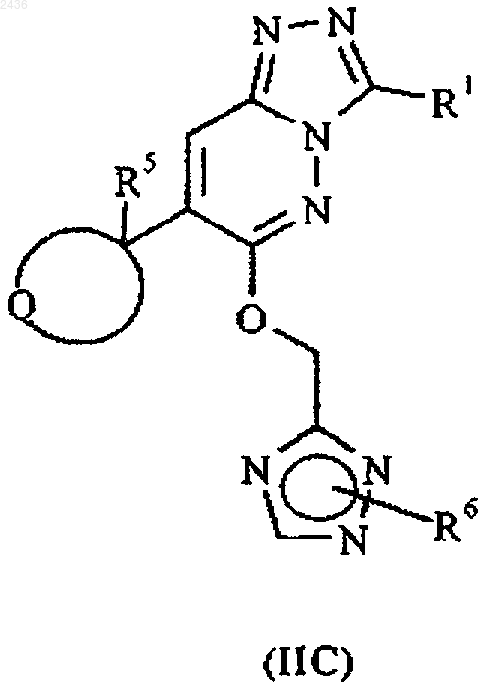
где R1 принимает указанные в п.1 значения;
Q означает остаток кольца циклопропила, циклобутила, циклопентила или циклогексила;
R5 означает водород или метил; и
R6 означает водород или метил.
10. Соединение, выбранное из группы, включающей
3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3,7-дифенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагадро-1,2,4-триазоло[3,4-а]фталазин;
7,8-диметил-3-фенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин;
7-метил-3-фенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин;
7-этил-3-фенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин;
7,8-бензо-3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а]фталазин;
8-метил-3,7-дифенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-метано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-5-(пиридин-2-илметокси)-1,2,3а,4,7-пентаазациклопента[a]нафталин;
3-фенил-5-(пиридин-2-илметокси)-1,2,3а,4,8-пентаазациклопента[a]нафталин;
8-метил-3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(2-пиридил)метилокси-(7,8-пентано)-1,2,4-триазоло[4,3-b]пиридазин;
8,8-диметил-3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-7-(пиперидин-1-ил)-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-7-(пиридин-4-ил)-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-5-(пиридин-2-илметокси)-6,7,8,9-тетрагидро-1,2,3а,4,8-пентаазациклопента[a]нафталин;
3-фенил-5-(пиридин-2-илметокси)-6,7,8,9-тетрагидро-1,2,3а,4,7-пентаазациклопента[a]нафталин;
7-метил-3-фенил-5-(пиридин-2-илметокси)-6,7,8,9-тетрагидро-1,2,3а,4,7-пентаазациклопента[a]нафталин;
3-фенил-6-(пиридин-2-илметокси)-7-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-6-(пиридин-2-илметокси)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-пропано)-1,2,4-триазоло[3,4-а]фталазин;
3-(4-метил)фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-(3-метокси)фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-(2-фтор)фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-(3-пиридил)-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-циклопропил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[(6-метил)-2-пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[(3-метил)-2-пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[(4-метил)-2-пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[(5-метил)-2-пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(3-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(4-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-[2-(1-метил)имидазолил]метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(3-цианофенил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[1-(3,5-диметил)пиразолил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[4-(2-метил)тиазолил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(2-хиноксалинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(3-пиридазинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(1-бензилимидазол-2-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(изохинолин-1-ил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(1-этилимидазол-2-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(1-пиразолил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(N-пирролидинилкарбонил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[4-(3-метил)пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(2-хинолинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(2-имидазолил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(2-тиазолил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[2-(5-метил)тиазолил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[2-(4-метил)тиазолил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[2-(3,5-диметил)пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(2-пиразинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[2-(4,6-диметил)пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(4-тиазолил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[2-(5,6-диметил)пиридил]метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(4-метилимидазол-2-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(4-пиримидинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-[4-(2-этил)тиазолил]метилокси-3-фенил-7,8,9,10-тетрагидро(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(6-хлорпиридазин-3-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(2-имидазолил)метилокси-3-(4-метилфенил)-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(4-гидроксиметилфенил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(4-гидроксибутил)окси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(4-гидроксиметилциклогексил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(3-гидроксиметилфенил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(1-метил-1,2,4-триазол-3-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
6-(2-метил-1,2,4-триазол-3-ил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(3-циклопропилметилокси-2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
3-фенил-6-(3-этокси-2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин;
и его соли и пролекарства.
11. Соединение, выбранное из
6-(6-метилпиридин-2-ил)метилокси-3-фенил-1,2,4-триазоло[3,4-а]фталазин, и его соли и пролекарства.
12. Соединение, выбранное из группы, включающей
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло-[4,3-b]пиридазин;
6-(2-метил-2H-тетразол-5-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(2-пропил-2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин ;
3,7-дифенил-6-(1-пропил-1Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-имидазол-4-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(3-метил-3H-имидазол-4-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(4-метил-4H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(5-метил-2H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(3-метил-3H-1,2,3-триазол-4-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3-(4-метоксифенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(3-метилпиридин-2-илметокси)-3-фенил-7-(пиперидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(морфолин-4-ил)-3-фенил-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-7-(пиридин-3-ил)-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
8-метил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-(морфолин-4-ил)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-(морфолин-4-ил)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклогексил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклогексил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
8-метил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-тpeт-бyтил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-этил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-трет-бутил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-этил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-метил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклобутил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-метил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-3-фенил-6-(2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(пиридин-2-илметокси)-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(2,4-дифторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-(пиридин-4-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(2-фторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(2-фторфенил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(2-фторфенил)-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(2,4-дифторфенил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-фенил-6-(пиридин-2-илметокси)-1,2,4-триазоло-[4,3-b]пиридазин;
7-циклопентил-8-метил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-фенил-6-(2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(4-метилфенил)-7-фенил-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(4-метилфенил)-6-(3-метилпиридин-2-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-этил-1H-имидазол-2-илметокси)-3-(4-метилфенил)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-6-(пиридин-2-илметокси)-7-(тиоморфолин-4-ил)-1,2,4-триазоло[4,3-b] пиридазин;
6-[2-(4-метилтиазол-5-ил)этокси]-3,7-дифенил-1,2,4-триазоло-[4,3-b]пиридазин;
(+)-7-(2-метилпирролидин-1-ил)-3-фенил-6-(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-7-(пиридин-4-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-изопропил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3-циклопропил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-3-(пиридин-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-7-фенил-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-7-фенил-3-(пиридин-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(фуран-3-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(5-метил-1,2,4-оксадиазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
7-фенил-3-(тиофен-2-ил)-6-(2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(фуран-2-ил)-6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-фенил-7-(тиофен-3-ил)-6-(2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-7-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-7-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(фуран-2-ил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(фуран-2-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(3-метил-1,2,4-оксадиазол-5-илметокси)-3,7-дифенил-1,2, 4-триазоло[4,3-b]пиридазин;
3-(4-фторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(2H-1,2,3-триазол-4-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(пиразин-2-илметокси)-1,2,4-триазоло[4,3-b]-пиридазин;
3-(4-метилфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(4-метилтиазол-2-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(5-метилтиазол-2-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(пиримидин-4-илметокси)-1,2,4-триазоло[4,3-b]-пиридазин;
3,7-дифенил-6-(пиридазин-3-илметокси)-1,2,4-триазоло[4,3-b]-пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-(морфолин-4-ил)-3-(тиофен-2-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(тиазол-4-илметокси)-1,2,4-триазоло[4,3-b]-пиридазин;
6-(5-метилизоксазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло-[4,3-b]пиридазин;
3-(3-фторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-(морфолин-4-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-(пиримидин-2-илметокси)-1,2,4-триазоло[4,3-b]-пиридазин;
6-(2-метил-2H-1,2,3-триазол-4-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклобутил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-изопропил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-трет-бутил-3-(2-фторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(4-метоксифенил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(фуран-2-ил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклопентил-3-(фуран-2-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин-6-илоксиметил)-1,2,4-триазол-1-илацетонитрил;
7-(1-метилциклопропил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопропил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
3-(3-фторфенил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(3-метилпиридин-2-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,3-триазол-4-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3-(5-метилтиофен-2-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-7-фенил-1,2,4-триазоло[4,3-b]пиридазин;
2-[3-(3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин-6-илоксиметил)-1,2,4-триазол-1-ил]-N,N-диметилацетамид;
3,7-дифенил-6-[1-(пиридин-2-илметил)-1H-1,2,4-триазол-3-илметокси]-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-бензил-1H-1,2,4-триазол-3-илметокси)-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
2-[5-(3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин-6-илоксиметил)-1,2,4-триазол-1-ил]ацетамид;
N-[2-[3-(3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин-6-илоксиметил)-1,2,4-триазол-1-ил]этил]-N,N-диметиламин;
3,7-дифенил-6-(пиримидин-5-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
6-[1-(2-(морфолин-4-ил)-этил)-1H-1,2,4-триазол-3-илметокси]-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(5-хлортиофен-2-ил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(5-хлортиофен-2-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1H-бензимидазол-2-илметокси)-3-(2,4-дифторфенил)-7-(1-метилциклопентил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(фуран-3-ил)-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а]фталачшэ;
7-циклобутил-3-фенил-6-(проп-2-инилокси)-1,2,4-триазоло[4,3-b]пиридазин;
(7-циклобутил-3-фенил-1,2,4-триазоло[4,3-b]пиридазин-6-илокси)ацетонитрил;
N-[4-(7-циклобутил-3-фенил-1,2,4-триазоло[4,3-b]пиридазин-6-илокси)бут-2-инил]-N,N-диметиламин;
и его соли и пролекарства.
13. Соединение, выбранное из группы, включающей
2-[3-(3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин-6-илоксиметил)-1,2,4-триазол-1-ил]этиламин;
3,7-дифенил-6-[1-(2-(пирролидин-1-ил)этил)-1Н-1,2,4-триазол-3-илметокси]-1,2,4-триазоло[4,3-b]пиридазин;
6-[1-(1-метилпиперидин-4-ил)-1H-1,2,4-триазол-3-илметокси]-3,7-дифенил-1,2,4-триазоло[4,3-b]пиридазин;
3,7-дифенил-6-[1-(2-(пиперазин-1-ил)этил)-1H-1,2,4-триазол-3-илметокси]-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-3-(2,4-дифторфенил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(циклобут-1-енил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(фуран-3-ил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
N,N-диэтил-N-[6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин-7-ил]амин;
7-(1-метилциклопентил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-(2,4-дифторфенил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(1,1-диметилпропил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-(4-фторфенил)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-(4-фторфенил)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-(2-фторфенил)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(1-метилциклобутил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
3-(2-фторфенил)-7-(1-метилциклобутил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-(2-фторфенил)-7-(тиофен-3-ил)-1,2,4-триазоло[4,3-b]пиридазин;
8-метил-7-(1-метилциклобутил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
8-метил-7-(1-метилциклобутил)-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
6-(1-метил-1Н-1,2,4-триазол-3-илметокси)-3-фенил-7-(пирролидин-1-ил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-8-метил-6-(2-метил-2H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-8-метил-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(2-метил-2Н-1,2,4-триазол-3-илметокси)-3-(2-фторфенил)-1,2,4-триазоло[4,3-b]пиридазин;
7-(1-метилциклопентил)-6-(1-метил-1H-1,2,4-триазол-3-илметокси)-3-(2-фторфенил)-1,2,4-триазоло[4,3-b]пиридазин;
7-циклобутил-6-[4-(2,6-диметилморфолин-4-ил)бут-2-инилокси]-3-фенил-1,2,4-триазоло[4,3-b]пиридазин;
и его соли и пролекарства.
14. Фармацевтическая композиция, отличающаяся тем, что включает соединение по п.1 формулы I или его фармацевтически приемлемую соль, или пролекарство, ассоциированное с фармацевтически приемлемым носителем.
15. Применение соединения по любому из пп.1-13 для изготовления медикамента, предназначенного для лечения и/или профилактики состояния беспокойства.
16. Применение соединения по любому из пп.1-13 для изготовления медикамента, предназначенного для лечения и/или предупреждения конвульсий.
17. Способ лечения и/или профилактики состояния беспокойства, отличающийся тем, что включает назначение нуждающемуся в таком лечении пациенту эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой соли, или пролекарства.
18. Способ лечения и/или предупреждения конвульсий, отличающийся тем, что включает назначение нуждающемуся в таком лечении пациенту эффективного количества соединения формулы I по п.1 или его фармацевтически приемлемой соли, или пролекарства.
19. Способ получения соединений по п.1, отличающийся тем, что
(А) проводят реакцию между соединением формулы III и соединением формулы IV


в которых Y, Z, R1 и R2 имеют указанные в п.1 значения, и L1 означает соответствующую отщепляемую группу; или
(Б) проводят реакцию между соединением формулы VII и соединением формулы VIII
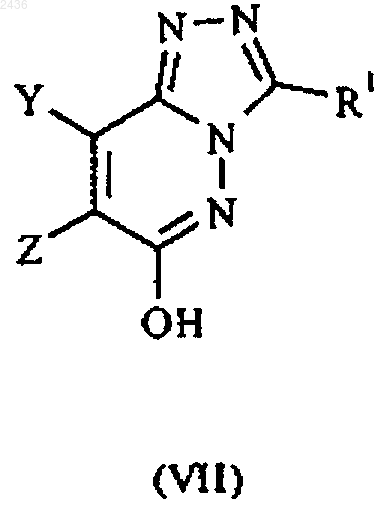

в которых Y, Z, R1 и R2 имеют указанные в п.1 значения и L3 означает соответствующую отщепляемую группу; или
(В) проводят реакцию между соединением формулы Z-CO2H и соединением формулы IX
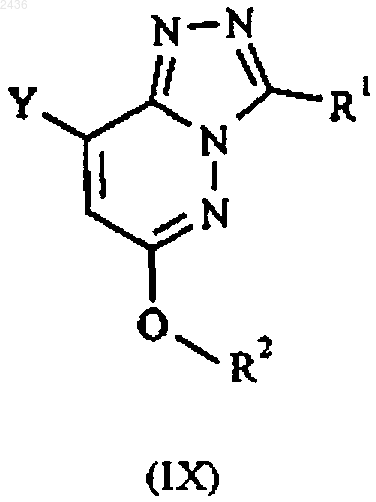
в которой Y, Z, R1 и R2 имеют указанные в п.1 значения; в присутствии нитрата серебра и персульфата аммония; или
(Г) проводят реакцию между соединением формулы Х и соединением формулы XI
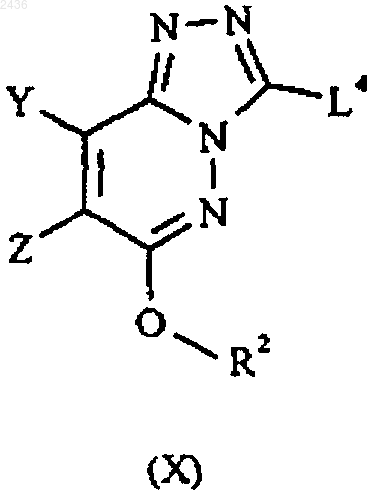
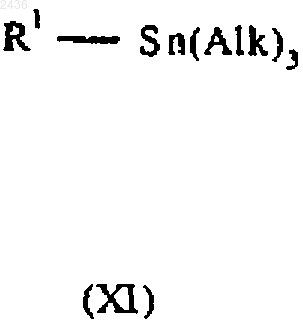
в которых Y, Z, R1 и R2 имеют указанные в п.1 значения, Alk означает C1-6алкил и L4 означает соответствующую отщепляемую группу, в присутствии металлического катализатора из группы переходных металлов; и
(Д) при желании, превращают первоначально полученное соединение формулы I в последующее соединение формулы I с помощью стандартных методов.
Текст
1 Настоящее изобретение относится к соединениям класса замещенных производных триазоло-пиридазина и их терапевтическому применению. Более конкретно, настоящее изобретение касается замещенных производных 1,2,4 триазоло[4,3-b]пиридазина, которые являются лигандами рецепторов ГАМКA и вследствие этого могут использоваться для лечения психических расстройств. Рецепторы основного медиатора торможения - гамма-аминомасляной кислоты (ГАМК),относят к двум основным классам: (1) рецепторы ГАМКA, являющиеся членами надсемейства лигандзависимых ионных каналов, и (2) рецепторы ГАМКB, которые могут быть членами надсемейства связанных с G-белком рецепторов. С тех пор как впервые было осуществлено клонирование кДНК, кодирующих отдельные субъединицы рецептора ГАМКA, число известных субъединиц рецептора ГАМКA млекопитающих достигло 13 (шесть -субъединиц, три субъединицы, три -субъединицы и одна субъединица). Возможно, существуют и еще не обнаруженные субъединицы, однако, вплоть до 1993 г. о них сообщений не было. Несмотря на то, что наши знания о многообразии семейства генов рецептора ГАМКA свидетельствуют об огромных шагах к пониманию этих лигандзависимых ионных каналов,проникновение в пределы разнообразия подтипов является лишь первым этапом. Следует отметить, что наличие -субъединицы, субъединицы и -субъединицы составляет минимальное требование для формирования полностью функционального рецептора ГАМКA при экспрессии кДНК в клетках. Как упоминалось выше, существуют также -субъединицы,присутствующие, однако, лишь в незначительной части популяции рецепторов ГАМКA. Исследование размеров рецепторов и визуализация с помощью электронного микроскопа показали, что, как и другие представители семейства лигандзависимых ионных каналов,нативные рецепторы ГАМКA существуют в пентамерной форме. При сочетании в составе пентамeров, по крайней мере, по одной -, - и субъединице из общего их числа 13, количество возможных комбинаций превышает 10000. Более того, эти расчеты не учитывают дополнительные пермутации, возможные при отсутствии жесткости расположения субъединиц вокруг ионного канала (т.е. для рецептора из пяти разных субъединиц возможны 120 вариантов). В составе существующих подтипов рецептора имеются, среди множества других, следующие сочетания: 122, 22/32, 32/3,21, 532/3, 62, 6 и 4. Подтипы, содержащие 1 в ансамбле субъединиц,присутствуют в большинстве областей головного мозга и предполагается, что у крыс число 2 рецепторов ГАМКA этого типа превышает 40%. Полагают, что среди рецепторов ГАМКA у крыс содержание подтипов с 2 и 3 в наборе субъединиц составляет, соответственно, около 25% и около 17%. Подтип с 5 в комплекте субъединиц встречается преимущественно в гиппокампе и коре головного мозга, составляя около 4% рецепторов ГАМКA у крыс. Характерное свойство всех известных рецепторов ГАМКA - наличие ряда точек модулирования, одна из которых представляет собой место присоединения бензодиазепина (БЗ). Место присоединения БЗ - наиболее исследованная точка модулирования рецептора ГАМКA, именно благодаря ей проявляется действие таких анксиолитических лекарств, как диазепам и темазепам. Перед клонированием семейства генов рецептора ГАМКA место присоединения БЗ исторически было разделено на два типа, БЗ 1 и БЗ 2, по данным присоединения радиолигандов. Было показано, что БЗ 1-тип фармакологически эквивалентен рецептору ГАМКА, содержащему 1 в комбинации с субъединицамии 2. Это наиболее распространенный подтип рецептора ГАМКA, возможно, представляющий почти половину всех рецепторов ГАМКA в коре головного мозга. Две другие основные популяции - подтипы 22 и 32/3, составляющие вместе еще 35% всего ассортимента рецепторов ГАМКA. По фармакологическим свойствам эти комбинации,видимо, эквивалентны БЗ 2-типу, определенному ранее по присоединению радиолигандов, хотя Б 32-тип может также включать в себя некоторые 5-содержащие подтипы. Физиологическая роль этих подтипов до сих пор неясна, поскольку не известны достаточно селективные агонисты или антагонисты. Можно ожидать, что агенты, действующие как БЗ-агонисты подтипов 12, 22 или 32, будут проявлять желательные анксиолитические свойства. Соединения, являющиеся модуляторами места присоединения бензодиазепина рецептора ГАМКA и действующие как БЗ-агонисты, ниже упоминаются как агонисты рецептора ГАМКA. Такие избирательные к 1 агонисты рецептора ГАМКA, как алпидем и золпидем, клинически назначаются как снотворные средства, наводя на мысль, что, по меньшей мере, некоторая часть седативного эффекта известных анксиолитических лекарств, влияющих на место присоединения БЗ 1, обусловлена посредством рецепторов ГАМКA, содержащих в наборе субъединиц 1. Соответственно, можно рассчитывать, что агонисты рецептора ГАМКA,активнее связывающиеся с субъединицами 2 и/или 3, чем с 1, будут эффективны в лечении патологических состояний беспокойства, оказывая при этом сниженное подавляющее действие. Причем агенты, являющиеся антагонистами или обратными агонистами к 1, могут применяться 3 для воздействия, противоположного седативному или гипнотическому действию, вызванному 1-агонистами. Соединения по настоящему изобретению являются селективными лигандами рецепторов ГАМКA, что обусловливает их применение для лечения и/или профилактики различных расстройств центральной нервной системы. Такие расстройства включают патологические состояния беспокойства, как панический страх с или без агорафобии, агорафобия без состояния паники в прошлом, боязнь животных и другие фобии (в том числе и социальные фобии), навязчивое расстройство, состояния стресса(включая посттравматический и острый стресс),генерализованное или вызванное лекарствами состояние тревоги; неврозы; судороги; мигрень; депрессивные или двуполюсные расстройства(например, единичное или рецидивное основное депрессивное расстройство, дистимия, двуполюсное I и двуполюсное II маниакальные расстройства, циклотимия). В заявке DE 2741763 и патентах US 4260755, 4260756 и 4654343 описаны различные классы производных 1,2,4-триазоло[4,3-b] пиридазина в качестве предполагаемых анксиолитических агентов. Соединения, описанные вDE 2741763 и в патентах US 4260755 и 4654343,содержат фенил в качестве заместителя в позиции 6 кольцевой системы триазолопиридазина. Соединения, описанные в патенте US 4260756,кроме того, содержат гетероарильную часть в позициях 6 или 8. Ни в одной из этих публикаций, однако, нет никаких заявок или намеков по поводу производных 1,2,4-триазоло[4,3-b] пиридазина, в которых заместитель в позиции 6 был бы присоединен через непосредственно связанный атом кислорода. Европейские заявки ЕР 0085840 и ЕР 0134946 описывают родственные серии производных 1,2,4-триазоло[3,4-а]фталазина, проявляющих способность подавления страха. Однако ни в одной из этих публикаций нет никаких заявок по поводу замены бензольной части кольцевой системы триазолофталазина какойлибо другой функциональной группой. Настоящее изобретение представляет класс производных триазоло-пиридазина, обладающих способностью взаимодействовать с различными подтипами рецептора ГАМКA. Соединения по настоящему изобретению в качестве лигандов проявляют высокое сродство к субъединицам 2 и/или 3 человеческого рецептора ГАМКA. Соединения по настоящему изобретению могут проявлять более эффективное присоединение к субъединицам 2 и/или 3, чем к 1. Полагают, что соединения по настоящему изобретению могут проявлять функциональную избирательность, выраженную в селективной активности по отношению к субъе 002436 4 диницам 2 и/или 3 в сравнении с субъединицей 1. У соединений по настоящему изобретению, являющихся лигандами подтипов рецептора ГАМКA, показатель сродства (Ki) к субъединицам 2 и/или 3 (значения которого определены представленным ниже методом) составляет 100 нМ или менее, в типичных случаях - 50 нМ или менее, и в идеальном случае - 10 нМ или менее. Соединения в соответствии с настоящим изобретением могут обладать, по меньшей мере, 2-кратным, соответственно, по крайней мере, 5-кратным, преимущественно, по крайней мере, 10-кратным селективным сродством к субъединицам 2 и/или 3 в сравнении с 1. Однако соединения, не проявляющие селективности по показателю сродства к субъединицам 2 и/или 3 в сравнении с 1, также включены в сферу данного изобретения: такие соединения могут проявлять функциональную избирательность за счет селективного влияния на субъединицы 2 и/или 3 в сравнении с 1. Настоящее изобретение охватывает соединения формулы I, их соли или пролекарства где Y означает водород или C1-6 алкил; иZ означает С 1-6 алкил, С 3-7 циклоалкил, C4-7 циклоалкенил, арил, С 3-7 гетероциклоалкил, гетероарил или ди(С 1-6)алкиламино, причем любая из групп может быть необязательно замещена; илиY и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют кольцо, выбранное из C5-9 циклоалкенилa, С 6-10 бициклоалкенилa, тетрагидропиридинилa, пиридинила и фенила, причем любое из колец необязательно может быть бензоконденсированным и/или замещенным;R1 означает С 3-7 циклоалкил, фенил, фурил,тиенил или пиридинил, причем любая из групп может быть необязательно замещена; и(С 1-6)алкил, С 3-7 циклоалкил(С 1-6)алкил, пропаргил, С 3-7 гетероциклоалкилкарбонил(С 1-6)алкил,арил(С 1-6)алкил или гетероарил(С 1-6)алкил, причем любая из групп может быть необязательно замещена; при условии, что если Y и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют необязательно замещенное фенильное кольцо, то R2 не является гидрокси(С 1-6)алкилом. 5 Кроме того, настоящее изобретение охватывает вышеуказанные соединения формулы I,их соли или пролекарства, в которыхY означает водород или C1-6 алкил; иZ означает C1-6 алкил, С 3-7 циклоалкил, арил,С 3-7 гетероциклоалкил или гетероарил, причем любая из групп может быть необязательно замещена; илиY и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют кольцо, выбранное из С 5-9 циклоалкенила, С 6-10 бициклоалкенила, тетрагидропиридинила, пиридинила и фенила, причем любое кольцо необязательно может быть бензоконденсированным и/или замещенным; иR1 и R2 определены выше; при условии, что если Y и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют необязательно замещенное фенильное кольцо, то R2 не является гидрокси(С 1-6)алкилом. Настоящее изобретение также охватывает вышеуказанные соединения формулы I, их соли или пролекарства, в которыхY означает водород или C1-6 алкил; иZ означает C1-6 алкил, С 3-7 циклоалкил, арил,С 3-7 гетероциклоалкил или гетероарил, причем любая из групп может быть необязательно замещена; илиY и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют кольцо, выбранное из С 5-9 циклоалкенила, С 6-10 бициклоалкенила, тетрагидропиридинила, пиридинила и фенила, причем любое из колец необязательно может быть бензоконденсированным и/или замещенным;R2 означает гидрокси(С 1-6)алкил, С 3-7 циклоалкил(С 1-6)алкил, С 3-7 гетероциклоалкилкарбонил(С 1-6)алкил,арил(С 1-6)алкил или гетероарил(С 1-6)алкил, причем любая из групп может быть необязательно замещена; при условии, что если Y и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют необязательно замещенное фенильное кольцо, то R2 не является гидрокси(С 1-6)алкилом. Настоящее изобретение также охватывает вышеуказанные соединения формулы I, их соли или пролекарства, в которыхY означает водород или C1-6 алкил; иZ означает C1-6 алкил, С 3-7 циклоалкил, арил,С 3-7 гетероциклоалкил или гетероарил, причем любая из групп может быть необязательно замещена; илиY и Z, взятые вместе с двумя расположенными между ними атомами углерода, образуют кольцо, выбранное из С 5-9 циклоалкенила, С 6-10 бициклоалкенила, гетрагидропиридинила и пиридинила, причем любое из колец необязатель 002436 6 но может быть бензоконденсированным и/или замещенным;R2 означает гидрокси(С 1-6)алкил, С 3-7 циклоалкил(С 1-6)алкил, С 3-7 гетероциклоалкилкарбонил(С 1-6)алкил, арил(С 1-6)алкил или гетероарил(С 1-6)алкил, причем любая из групп может быть необязательно замещена. В случае, когда Y и Z вместе с двумя расположенными между ними атомами углерода образуют кольцо, конечные соединения представленной выше формулы I включают в себя соответствующее циклоалкенильное, бициклоалкенильное, тетрагидропиридинильное, пиридинильное или фенильное кольцо, конденсированное с центральной кольцевой системой триазоло-пиридазина, как изображено формулой I. В случае, когда Y и Z вместе с двумя расположенными между ними атомами углерода образуют кольцо С 5-9 циклоалкенила, последнее может представлять собой циклопентенил, циклогексенил, циклогептенил, циклооктенил или циклононенил, предпочтительно - циклогексенил или циклогептенил. В случае, когда Y и Z вместе с двумя расположенными между ними атомами углерода образуют кольцо С 6-10 бициклоалкенила, последнее может представлять собой бицикло[2.1.1]гекс-2-енил, бицикло[2.2.1]гепт-2-енил,бицикло[2.2.2]окт-2-енил, бицикло[3.2.2]нон-6 енил или бицикло[3.3.2]дец-9-енил, предпочтительно - бицикло[2.2.1]гепт-2-енил, бицикло[2.2.2]окт-2-енил или бицикло[3.2.2]нон-6-енил и в особенности - бицикло[2.2.2]окт-2-енил. В случае, когда Y и Z вместе с двумя расположенными между ними атомами углерода образуют кольцо, это кольцо может быть необязательно бензоконденсированным. Для иллюстрации: если Y и Z вместе с двумя расположенными между ними атомами углерода составляют бензоконденсированное циклогексенильное кольцо, то конечная кольцевая система представляет собой дигидронафтил. Группы Y, Z, R1 и R2 могут быть незамещенными или замещенными одним или более заместителями, преимущественно моно- или двузамещенными. В общем случае группы Y, Z,R1 и R2 являются незамещенными или монозамещенными. Примеры необязательных заместителей в группах Y, Z, R1 и R2 включают C1-6 алкил, арил(С 1-6)алкил, пиридил(С 1-6)алкил, галоген, гало(С 1-6)алкил, циано, циано(С 1-6)алкил,гидрокси, гидроксиметил, C1-6 алкокси, С 3-7 циклоалкил(С 1-6)алкокси,С 3-7 циклоалкокси,амино(С 1-6)алкил,ди(С 1-6)алкиламино(С 1-6)алкил,ди(С 1-6)алкиламинокарбонил(С 1-6)алкил,N(С 1-6)алкилпиперидинил, пирролидинил(С 1-6) алкил, пиперазинил(С 1-6)алкил, морфолинил(С 1-6)алкил, ди(С 1-6)алкилморфолинил(С 1-6)алкил и имидазолил(С 1-6)алкил. Иллюстративные заместители включают C1-6 алкил, арил(С 1-6) алкил, пиридил(С 1-6)алкил, галоген, гало(С 1-6)(С 1-6)алкил и имидазолил(С 1-6)алкил. Типичные заместители включают C1-6 алкил, арил(С 1-6) алкил, галоген, циано, гидрокси, гидроксиметил,C1-6 алкокси и С 3-7 циклоалкил(С 1-6)алкокси. В дальнейшем выражение "C1-6 алкил" здесь означает группы метил и этил, а также группы пропил, бутил, пентил и гексил с прямой или разветвленной цепью. В частности, алкильные группы представляют собой метил,этил, н-пропил, изопропил, трет-бутил и 1,1 диметилпропил. Производные выражения, такие как "C1-6 алкокси", интерпретируются соответственно. Типичные представители группы С 3-7 циклоалкил включают циклопропил, циклобутил, циклопентил и циклогексил. Выражение "С 3-7 циклоалкил(С 1-6)алкил" в дальнейшем здесь означает циклопропилметил,циклобутилметил, циклопентилметил и циклогексилметил. Типичные представители C4-7 циклоалкенилгруппы включают циклобутенил, циклопентенил и циклогексенил. Типичные арильные группы включают фенил и нафтил, преимущественно фенил. Выражение "арил(С 1-6)алкил" здесь в дальнейшем включает бензил, фенилэтил, фенилпропил и нафтилметил. Предпочтительные гетероциклоалкилгруппы включают азетидинил, пирролидинил,пиперидинил, пиперазинил, морфолинил и тиоморфолинил. Предпочтительные гетероарилгруппы включают пиридинил, хинолинил, изохинолинил, пиридазинил, пиримидинил, пиразинил,хиноксалинил, фурил, бензофурил, дибензофурил, тиенил, бензтиенил, пирролил, индолил,пиразолил, индазолил, оксазолил, изоксазолил,тиазолил, изотиазолил, имидазолил, бензимидазолил, оксадиазолил, тиадиазолил, триазолил и тетразолил. Выражение "гетероарил(С 1-6)алкил" здесь в дальнейшем включает фурилметил, фурилэтил,тиенилметил, тиенилэтил, пиразолилметил, оксазолилметил, оксазолилэтил, изоксазолилметил, тиазолилметил, тиазолилэтил, имидазолилметил, имидазолилэтил, бензимидазолилметил,оксадиазолилметил, оксадиазолилэтил, тиадиазолилметил, тиадиазолилэтил, триазолилметил,триазолилэтил, тетразолилметил, тетразолилэтил, пиридинилметил, пиридинилэтил, пиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил. Выражение "галоген" здесь в дальнейшем означает фтор, хлор, бром и иод, особенно фтор и хлор. 8 В целях медицинского применения, соли соединений формулы I должны быть фармацевтически приемлемыми. Тем не менее, некоторые другие соли могут быть полезны при изготовлении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей. Пригодные фармацевтически приемлемые соли соединений по данному изобретению включают соли, образующиеся при добавлении кислоты, например, формирующиеся при смешивании раствора соединения по данному изобретению с раствором фармацевтически приемлемой кислоты - хлористо-водородной кислоты,серной кислоты, метансульфоновой кислоты,фумаровой кислоты, малеиновой кислоты, янтарной кислоты, уксусной кислоты, бензойной кислоты, щавелевой кислоты, лимонной кислоты, винной кислоты, угольной кислоты или фосфорной кислоты. Далее, в случае соединений по данному изобретению с кислотной составляющей, соответствующие фармацевтически приемлемые соли включают соли щелочных металлов, например натрия или калия; соли щелочно-земельных металлов, например кальция или магния; и соли, образованные с соответствующими органическими лигандами, например четвертичные соли аммония. Настоящее изобретение охватывает пролекарства вышеописанных соединений формулы I. В общем случае, такие пролекарства являются функциональными производными соединений формулы I, которые in vivo легко превращаются в требуемые соединения формулы I. Общепринятые процедуры подбора и изготовления желаемых производных пролекарств описаны, например, в Design of Prodrugs, ed.H.Bundgaard,Elsevier, 1985. При наличии хотя бы одного центра асимметрии соединения по настоящему изобретению могут существовать в виде энантиомеров. При наличии двух или большего числа центров асимметрии соединения по настоящему изобретению дополнительно могут существовать в виде диастереоизомеров. Имеется в виду, что все такие изомеры и их смеси в любых сочетаниях охватываются настоящим изобретением.Y преимущественно означает водород или метил, в особенности водород. Примеры соответствующих значений заместителей Z включают метил, этил, изопропил,трет-бутил,1,1-диметилпропил,метилциклопропил, циклобутил, метилциклобутил,циклопентил, метилциклопентил, циклогексил,циклобутенил, фенил, пирролидинил, метилпирролидинил, пиперидинил, морфолинил,тиоморфолинил, пиридинил, фурил, тиенил,хлортиенил и диэтиламино. Иллюстративные значения Z включают метил, этил, изопропил,трет-бутил, метилциклопропил, циклобутил,метилциклобутил, циклопентил, метилциклопентил, циклогексил, фенил, пирролидинил,метилпирролидинил, пиперидинил, морфоли 9 нил, тиоморфолинил, пиридинил, фурил, тиенил и хлортиенил. Типичные значения включают метил, этил, фенил, пиперидинил, пиридинил и тиенил. Конкретным примером заместителя Z является С 3-7 циклоалкил, как незамещенный, так и с замещением в виде C1-6 алкила, особенно метила. Z преимущественно означает циклобутил. В случае, когда Y и Z вместе с двумя расположенными между ними атомами углерода образуют кольцо, типичные соединения по настоящему изобретению включают вещества,структура которых отображена формулами отR4 означает водород или C1-6 алкил. Соответствующий R3 означает водород или C1-6 алкил, особенно водород или метил. Соответствующий R4 означает водород или метил. Преимущественные производные триазоло-пиридазина по настоящему изобретению включают соединения формулы IE, изображенной выше. Примеры типичных необязательных заместителей для группы R1 включают метил,фтор и метокси. Типичные значения R1 включают циклопропил, фенил, метилфенил, фторфенил, дифторфенил, метоксифенил, фурил, тиенил, метилтиенил и пиридинил. Внимания заслуживают циклопропил, фенил, метилфенил, фторфенил, метоксифенил и пиридинил. Конкретнее R1 представляет собой незамещенный или однозамещенный фенил. В частности R1 означает фенил. Соответствующие заместители R2 в соединениях по данному изобретению включают цианометил, гидроксибутил, циклогексилметил,пропаргил, пирролидинилкарбонилметил, бензил, пиразолилметил, изоксазолилметил, тиазолилметил, тиазолилэтил, имидазолилметил, бензимидазолилметил, оксадиазолилметил, триазолилметил, тетразолилметил, пиридинилметил,пиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил, причем любая из групп может быть необязательно замещена одним или большим числом заместителей. Типичные значения группы R2 включают гидроксибутил, циклогексилметил, пирролидинилкарбонилметил, бензил, пиразолилметил, тиазолилметил, имидазолилметил, триазолилметил, пиридинилметил, пиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил, причем любая из групп может быть необязательно за 11 мещена одним или большим числом заместителей. Примеры подходящих заместителей для группы R2 включают C1-6 алкил, apил(C1-6)алкил,пиридил(С 1-6)алкил, галоген, гало(С 1-6)алкил,циано, циано(С 1-6)алкил, гидроксиметил, C1-6 алкокси, С 3-7 циклоалкил(С 1-6)алкокси, амино ди(С 1-6)алкиламино(С 1-6)алкил,(С 1-6)алкил,ди(С 1-6)алкиламинокарбонил(С 1-6)алкил, N-(C1-6) алкилпиперидинил, пирролидинил(С 1-6)алкил,пиперазинил(С 1-6)алкил, морфолинил(С 1-6)алкил и ди(С 1-6)алкилморфолинил(С 1-6)алкил. Иллюстративные заместители включают C1-6 алкил,арил(С 1-6)алкил, пиридил(С 1-6)алкил, галоген,гало(С 1-6)алкил, циано, циано(С 1-6)алкил, гидроксиметил, C1-6 алкокси, С 3-7 циклоалкил(С 1-6) алкокси, ди(С 1-6)алкиламино(С 1-6)алкил, ди(С 1-6) алкиламинокарбонил(С 1-6)алкил и морфолинил(С 1-6)алкил. Типичные заместители включают C1-6 алкил, арил(С 1-6)алкил, галоген, циано,гидроксиметил, C1-6 алкокси и С 3-7 циклоалкил(С 1-6)-алкокси. Специальные примеры конкретных заместителей для группы R2 включают метил, этил, нпропил, бензил, пиридинилметил, хлор, хлорметил, циано, цианометил, гидроксиметил, этокси,циклопропилметокси,диметиламинометил,аминоэтил, диметиламиноэтил, диметиламинокарбонилметил, N-метилпиперидинил, пирролидинилэтил, пиперазинилэтил, морфолинилметил и диметилморфолинилметил. Более специфические примеры конкретных заместителей для группы R2 включают метил, этил, н-пропил, бензил, пиридинилметил,хлор, хлорметил, циано, цианометил, гидроксиметил, этокси, циклопропилметокси, диметиламинометил, диметиламиноэтил, диметиламинокарбонилметил и морфолинилметил. Значения R2 включают цианометил, гидроксибутил,гидроксиметилциклогексилметил,пропаргил, диметиламинометилпропаргил, диметилморфолинилметилпропаргил, пирролидинилкарбонилметил, цианобензил, гидроксиметилбензил,пиразолилметил,диметилпиразолилметил, метилизоксазолилметил, тиазолилметил,метилтиазолилметил,этилтиазолилметил, метилтиазолилэтил, имидазолилметил,метилимидазолилметил,этилимидазолилметил,бензилимидазолилметил,бензимидазолилметил, метилоксадиазолилметил, триазолилметил, метилтриазолилметил,пропилтриазолилметил, бензилтриазолилметил,пиридинилметилтриазолилметил, цианометилтриазолилметил,диметиламинометилтриазолилметил, аминоэтилтриазолилметил, диметиламиноэтил-триазолилметил,диметиламинокарбонилметил-триазолилметил, N-метилпиперидинил-триазолилметил, пирролидинилэтилтриазолилметил,пиперазинилэтилтриазолилметил, морфолинилэтилтриазолилметил, метилтетразолилметил,пиридинилметил,метилпиридинилметил,диметилпиридинилметил, 002436 12 этоксипиридинилметил, циклопропилметоксипиридинилметил, пиридазинилметил, хлорпиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил. Иллюстративные группы R2 включают цианометил, гидроксибутил, гидроксиметилциклогексилметил, пропаргил, диметиламинометилпропаргил, пирролидинилкарбонилметил,цианобензил, гидроксиметилбензил, пиразолилметил, диметилпиразолилметил, метилизоксазолилметил,тиазолилметил,метилтиазолилметил, этилтиазолилметил, метилтиазолилэтил,имидазолилметил,метилимидазолилметил, этилимидазолилметил, бензилимидазолилметил,бензимидазолилметил,метилоксадиазолилметил, триазолилметил, метилтриазолилметил,пропилтриазолилметил,бензилтриазолилметил, пиридинилметилтриазолилметил, цианометилтриазолилметил, диметиламинометилтриазолилметил,диметиламиноэтилтриазолилметил, диметиламинокарбонилметилтриазолилметил,морфолинилэтилтриазолилметил, метилтетразолилметил, пиридинилметил, метилпиридинилметил, диметилпиридинилметил, этоксипиридинилметил, циклопропилметоксипиридинилметил,пиридазинилметил, хлорпиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил,изохинолинилметил и хиноксалинилметил. Конкретные значения R2 включают гидроксибутил,гидроксиметилциклогексилметил,пирролидинилкарбонилметил,цианобензил,гидроксиметилбензил, пиразолилметил, диметилпиразолилметил, тиазолилметил, метилтиазолилметил, этилтиазолилметил, имидазолилметил, метилимидазолилметил, этилимидазолилметил, бензилимидазолилметил, метилтриазолилметил,пиридинилметил,метилпиридинилметил,диметилпиридинилметил,этоксипиридинилметил, циклопропилметоксипиридинилметил, пиридазинилметил, хлорпиридазинилметил, пиримидинилметил, пиразинилметил, хинолинилметил, изохинолинилметил и хиноксалинилметил. Предпочтительным значением R2 является метилтиазолилметил. Отдельный подкласс соединений по настоящему изобретению составляют соединения формулы IIА, а также их соли и пролекарстваR12 означает гидрокси; или С 3-7 циклоалкил,С 3-7 гетероциклоалкилкарбонил, арил или гете 13 роарил, причем любая из групп может быть необязательно замещена. Примеры подходящих необязательных заместителей группы R12 включают С 1-6 алкил,арил(С 1-6)алкил, галоген, циано, гидроксиметил,C1-6 алкокси и С 13-7 циклоалкил(С 1-6)алкокси. Типичные заместители включают метил, этил, бензил, хлоро, циано, гидроксиметил, этокси и циклопропилметокси. Конкретные значения R12 включают гидрокси, гидроксиметилциклогексил, пирролидинилкарбонил, цианофенил, гидроксиметилфенил, пиразолил, диметилпиразолил, тиазолил,метилтиазолил, этилтиазолил, имидазолил, метилимидазолил, этилимидазолил, бензилимидазолил, метилтриазолил, пиридинил, метилпиридинил, диметилпиридинил, этоксипиридинил,циклопропилметоксипиридинил, пиридазинил,хлорпиридазинил, пиримидинил, пиразинил,хинолинил, изохинолинил и хиноксалинил. Другой подкласс соединений по настоящему изобретению составляют соединения формулы IIВ, а также их соли и пролекарства где Y1 означает водород или метил;Z1 означает C1-6 алкил, С 3-7 циклоалкил, C4-7 циклоалкенил, арил, С 3-7 гетероциклоалкил, гетероарил или ди(С 1-6)алкиламино, причем любая из групп может быть необязательно замещена;R1 определяется ссылкой к представленной выше формуле I;R22 означает арил или гетероарил, причем любая из групп может быть необязательно замещена. Настоящее изобретение также охватывает вышеуказанные соединения формулы IIВ, их соли или пролекарства, в которыхZ1 означает C1-6 алкил, С 3-7 циклоалкил,арил, С 3-7 гетероциклоалкил или гетероарил,причем любая из групп может быть необязательно замещена; иY1, R1, m и R22 определены выше. Подходящим представителем Y1 является водород. Примеры типичных заместителей для группы Z1 включают C1-6 алкил и галоген, в особенности метил или хлор. Типичные значения группы Z1 включают метил, этил, изопропил, трет-бутил, 1,1 диметилпропил, метилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, циклобутенил, фенил, пирролидинил, метилпирролидинил, пиперидинил, морфолинил, тиоморфолинил, пири 002436 14 динил, фурил, тиeнил, хлортиенил и диэтиламино. Конкретные значения Z1 включают метил,этил, изопропил, трет-бутил, метилциклопропил, циклобутил, метилциклобутил, циклопентил, метилциклопентил, циклогексил, фенил,пирролидинил, метилпирролидинил, пиперидинил, морфолинил, тиоморфолинил, пиридинил,фурил, тиенил и хлортиенил. Предпочтительное значение Z1 - циклобутил. Примеры типичных заместителей группы(С 1-6)алкил и морфолинил(С 1-6)алкил. Типичные заместители включают C1-6 алкил, арил(С 1-6) алкил, пиридил(С 1-6)алкил, галоген, циано, циано(С 1-6)алкил, гидроксиметил, C1-6 алкокси, С 3-7 циклоалкил(С 1-6)алкокси,ди(С 1-6)алкиламино(С 1-6)алкил, ди(С 1-6)алкиламинокарбонил(С 1-6) алкил и морфолинил(С 1-6)алкил. Иллюстративные значения специфических заместителей в группах R22 включают метил,этил, н-пропил, бензил, пиридинилметил, хлоро,циано, цианометил, гидроксиметил, этокси,циклопропилметокси,диметиламинометил,аминоэтил, диметиламиноэтил, диметиламинокарбонилметил, N-метилпиперидинил, пирролидинилэтил, пиперазинилэтил и морфолинилметил. Типичные значения специфических заместителей в группах R22 включают метил, этил, нпропил, бензил, пиридинилметил, хлоро, циано,цианометил, гидроксиметил, этокси, циклопропилметокси, диметиламинометил, диметиламиноэтил, диметиламинокарбонилметил и морфолинилметил. Конкретные значения R22 включают цианофенил, гидроксиметилфенил, пиразолил, диметилпиразолил, метилизоксазолил, тиазолил,метилтиазолил, этилтиазолил, имидазолил, метилимидазолил, этилимидазолил, бензилимидазолил, бензимидазолил, метилоксадиазолил,триазолил, метилтриазолил, пропилтриазолил,бензилтриазолил,пиридинилметилтриазолил,цианометилтриазолил,диметиламинометилтриазолил, аминоэтилтриазолил, диметиламиноэтилтриазолил,диметиламинокарбонилметилтриазолил, N-метилпиперидинилтриазолил,пирролидинилэтилтриазолил, пиперазинилэтилтриазолил, морфолинилэтилтриазолил, метилтетразолил, пиридинил, метилпиридинил, диметилпиридинил, этоксипиридинил, циклопропилметоксипиридинил, пиридазинил, хлоропиридазинил, пиримидинил, пиразинил, хинолинил, изохинолинил и хиноксалинил. 15 Специфические значения R22 включают цианофенил, гидроксиметилфенил, пиразолил,диметилпиразолил, метилизоксазолил, тиазолил, метилтиазолил, этилтиазолил, имидазолил,метилимидазолил, этилимидазолил, бензилимидазолил, бензимидазолил, метилоксадиазолил, триазолил, метилтриазолил, пропилтриазолил, бензилтриазолил, пиридинилметилтриазолил, цианометилтриазолил, диметиламинометилтриазолил, диметиламиноэтилтриазолил,диметиламинокарбонилметилтриазолил,морфолинилэтилтриазолил,метилтетразолил,пиридинил, метилпиридинил, диметилпиридинил, этоксипиридинил, циклопропилметоксипиридинил, пиридазинил, хлорпиридазинил, пиримидинил, пиразинил, хинолинил, изохинолинил и хиноксалинил. Преимущественное значение R22 - метилтриазолил. Специальное подмножество соединений вышеуказанной формулы IIB представлено соединениями формулы IIС, а также их фармацевтически приемлемыми солями где R1 определено ссылкой к представленной выше формуле I;Q означает остаток кольца циклопропила,циклобутила, циклопентила или циклогексила;R5 означает водород или метил; иR6 означает водород или метил. Что касается вышеприведенной формулыIIC, подходящим значением R1 является фенил. Преимущественным воплощением значения Q является остаток кольца циклобутила. Наиболее соответствующим значением R5 является водород. Наиболее соответствующим значением R6 является метил. Специфические соединения, охватываемые настоящим изобретением, включают 3-фенил-6-(2-пиридил)метилокси-7,8,9,10 тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а] фталазин; 3,7-дифенил-6-(2-пиридил)метилокси 1,2,4-триазоло[4,3-b]пиридазин; 3-фенил-6-(2-пиридил)метилокси-7,8,9,10 тетрагидро-1,2,4-триазоло[3,4-а]фталазин; 7,8-диметил-3-фенил-6-(2-пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин; 7-метил-3-фенил-6-(2-пиридил)метилокси 1,2,4-триазоло[4,3-b]пиридазин;[4,3-b]пиридазин; и их соли и пролекарства. Настоящее изобретение охватывает также способ лечения и/или профилактики состояний беспокойства, включающий назначение больным, которым требуется такое лечение, эффективных количеств соединений представленной выше формулы I или их фармацевтически приемлемых солей либо пролекарств. Кроме того, настоящее изобретение касается способа лечения и/или профилактики конвульсий (например, у больных, страдающих эпилепсией или другими подобными расстройствами), включающего назначение больным,которым требуется такое лечение, эффективных количеств соединений представленной выше формулы I или их фармацевтически приемлемых солей либо их пролекарств. С другой стороны, настоящее изобретение относится к неподавляющим успокаивающим соединениям, которые являются модуляторами места присоединения бензодиазепина человеческого рецептора ГАМКA и проявляют сродство к 3 субъединице рецептора ГАМКA с показателем сродства Ki 10 нМ или менее, которые вызывают, по меньшей мере, 40% усиление ГАМК ЕС 20 отклика в стабильно трансфектированной рекомбинантной линии клеток с экспрессией 3 субъединицы человеческого рецептора ГАМКA и которые вызывают в лучшем случае 30% усиление ГАМК ЕС 20 отклика в стабильно трансфектированной рекомбинантной линии клеток с экспрессией 1 субъединицы человеческого рецептора ГАМКA. В этом аспекте показатель сродства (Кi) к 3 субъединице человеческого рецептора ГАМКA удобно измерять по описанной ниже методике. Показатель сродства (Кi) к 3 субъе 002436 26 динице человеческого рецептора ГАМКA соединений, соответствующих этому аспекту изобретения, составляет 10 нМ или менее, предпочтительно - 2 нМ или менее и наиболее предпочтительно - 1 нМ или менее. В этом аспекте изобретения, определение усиления ГАМК ЕС 20 отклика в стабильно трансфектированной рекомбинантной линии клеток с экспрессией 3 и 1 субъединиц человеческого рецептора ГАМКA удобно проводить с применением процедур, аналогичных описанным Wafford et al., Mol.Pharmacol., 1996, 50,670-678. Для проведения анализа используются культуры стабильно трансфектированных клеток эукариотов, обычно стабильно трансфектированных клеток мышиных фибробластов Ltk-. Под влиянием соединений, соответствующих этому аспекту изобретения, достигается как минимум 40%, предпочтительно - не менее 50% и наиболее предпочтительно - не менее 60% усиление ГАМК ЕС 20 отклика в стабильно трансфектированных рекомбинантных линиях клеток, экспрессирующих 3 субъединицу рецептора ГАМКA человека. Более того, под влиянием соединений, соответствующих этому аспекту изобретения, проявляется максимум 30%,предпочтительно - не более 20% и наиболее предпочтительно - не более 10% усиление ГАМК ЕС 20 отклика в стабильно трансфектированных рекомбинантных линиях клеток, экспрессирующих l субъединицу рецептора ГАМКA человека. Соединения, соответствующие этому аспекту изобретения, обладают анксиолитической активностью, о чем свидетельствуют положительные результаты тестирования в лабиринте и условного подавления в опытах с питьем поDawson et al., Psychopharmacology, 1995, 121,109-117. Более того, соответствующие этому аспекту изобретения соединения являются по существу неподавляющими, что подтверждается соответствующими результатами тестирования на чувствительность отклика по Bayley et al.,Psychopharmacology, 1996, 10, 206-213. Соединения, соответствующие этому аспекту изобретения, обладают противосудорожной активностью, что подтверждается их способностью блокировать индуцированный пентилентетразолом пароксизм у крыс и мышей в эксперименте, аналогичном описанному Bristowet al., J.Pharmacol. Exp.Ther., 1996, 279, 492-501. Для проявления поведенческого эффекта соединений, соответствующих этому аспекту изобретения, они должны проникать в головной мозг; иными словами, эти соединения должны обладать способностью преодолевать так называемый гематоэнцефалический барьер. Предпочтительно, чтобы соответствующие этому аспекту изобретения соединения проявляли свое благотворное лечебное воздействие при пероральном введении.[4,3-b]пиридазин. Еще одним аспектом настоящей заявки является способ скрининга неугнетающих успокаивающих соединений, включающий:(1) контактирование исследуемых соединений с (а) стабильно трансфектированной рекомбинантной линией клеток с экспрессией 3 субъединицы рецептора ГАМКA человека; и (б) стабильно трансфектированной рекомбинантной линией клеток с экспрессией 1 субъединицы рецептора ГАМКA человека.(2) определение усиления ГАМК ЕС 20 отклика под влиянием каждого из исследуемых соединений в каждой из стабильно трансфектированных линий клеток (а) и (б); и(3) отбор тех исследуемых соединений,под влиянием которых достигается как минимум 40% усиление ГАМК ЕС 30 отклика в линии клеток с экспрессией 3 субъединицы и проявляется максимум 30% усиление ГАМК ЕС 20 отклика в линии клеток с экспрессией 1 субъединицы. Настоящее изобретение также охватывает фармацевтические композиции, включающие одно или более соединений по данному изобретению в сочетании с фармацевтически приемлемыми носителями. Предпочтительно эти композиции представляют собой такие единичные формы дозирования как таблетки, пилюли, капсулы, порошки, гранулы, стерильные парентеральные растворы или суспензии, дозированные аэрозольные или жидкостные распылители, капли, ампулы, автоинъекционные устройства или суппозитории; для перорального, парентерального, интраназального, подъязычного или ректального введения, или для введения путем ингаляции или инсуффляции. Для приготовления твердых композиций, таких как таблетки, основной активный ингредиент смешивается с фармацевтическим носителем (например, из числа общепринятых таблетирующих ингредиентов, куда входят крахмал, лактоза, сахароза,сорбит, тальк, стеариновая кислота, стеарат магния, дикальций фосфат или камедь) и другими фармацевтическими разбавителями, например водой, для формирования твердой предкомпозиции, содержащей гомогенную смесь соединения по настоящему изобретению или его фармацевтически приемлемой соли. При ссылке на гомогенность этой предкомпозиции подразумевается, что активный ингредиент равномерно диспергирован во всем объеме субстанции таким образом, что композиция может быть легко подразделена на равные единицы форм дозирования, такие как таблетки, пилюли и капсулы. Такая твердая предкомпозиция подразделяется на единичные формы дозирования вышеопи 002436 28 санного типа с содержанием от 0,1 до 500 мг активного ингредиента по настоящему изобретению. Типичные формы дозирования содержат от 1 до 100 мг, к примеру, 1, 2, 5, 10, 25, 50 или 100 мг активного вещества. Таблетки или пилюли новой композиции могут быть с покрытием или же компаундированными для придания форме дозирования пролонгированного действия. Например, таблетка или пилюля может включать в себя внутренний и внешний компоненты дозирования, последний - в виде оболочки для первого. Оба компонента могут быть разделены прослойкой, которая служит защитой от дезинтеграции в желудке и способствует интактному проникновению внутреннего компонента в двенадцатиперстную кишку или задержке его высвобождения. Разнообразные вещества могут использоваться в качестве прослойки или покрытия, в том числе ряд полимерных кислот и смеси полимерных кислот с такими веществами, как щеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы новых композиций по настоящему изобретению, служащие для перорального или инъекционного применения,включают водные растворы, соответственно ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми растительными маслами (хлопковым, кунжутным, кокосовым, арахисовым), а также эликсиры и подобные фармацевтические средства. Для изготовления водных суспензий подходящими диспергирующими или суспендирующими агентами являются синтетические и натуральные камеди, такие как трагакантовая камедь, аравийская камедь, альгинат, декстран,натрий карбоксиметилцеллюлоза, метилцеллюлоза, поливинилпирролидон или желатин. Требующиеся дозы при лечении людей с состоянием патологического беспокойства составляют от 0,01 до 250 мг/кг в день, предпочтительно от 0,05 до 100 мг/кг в день и в особенности от 0,05 до 5 мг/кг в день. Режим введения соединений от 1 до 4 раз в день. Способ получения соединений представленной выше формулы I включает реакцию между соединением формулы III и соединением формулы IV в которых Y, Z, R1 и R2 описаны выше; и L1 означает соответствующую отщепляемую группу. Отщепляемая группа L1 обычно является атомом галогена, особенно хлора. Реакция между соединениями III и IV осуществляется с перемешиванием реагентов в подходящем растворителе, обычно это N,Nдиметилформамид, в присутствии сильного основания, такого как гидрид натрия или бис(триметилсилил)амид лития. Промежуточные соединения представленной выше формулы III могут быть получены реакцией взаимодействия соединения формулыV с по существу эквимолярным количеством производного гидразина формулы VI в которых Y, Z, R1 и L1 описаны выше и L2 означает соответствущую отщепляемую группу; при необходимости, с последующим разделением конечной смеси изомеров традиционным способом. Отщепляемая группа L2 обычно является атомом галогена, особенно хлора. Среди промежуточных соединений формулы V отщепляемые группы L1 и L2 могут быть одинаковыми или разными, но обычно - одинаковыми, предпочтительно обе представлены хлором. Реакцию между соединениями V и VI обычно осуществляют с нагреванием реагентов в присутствии основания, такого как триэтиламин, обычно при кипячении с обратным холодильником в инертном растворителе, таком как ксилол или 1,4-диоксан. Если Y и Z не одинаковы, реакция между соединениями V и VI, как указано выше, обычно приводит к образованию смеси изомерных продуктов в зависимости от того, которую из отщепляемых групп - L1 или L2 - замещает производное гидразина VI. Таким образом, вдобавок к требуемому продукту формулы III обычно обнаруживается некоторое количество изомер 002436 30 ных соединений с обратным расположением составляющих Y и Z. По этой причине обычно требуется проводить разделение конечной смеси изомеров соответствующими методами, такими как хроматография. Получить соединения представленной выше формулы I можно другим способом - с применением реакции между соединением формулы VII и соединением формулы VIII в которых Y, Z, R1 и R2 описаны выше; и L3 означает соответствующую отщепляемую группу. Отщепляемая группа L3 обычно является атомом галогена, в типичных случаях - хлора или брома. Реакцию между соединениями VII и VIII осуществляют с перемешиванием реагентов в подходящем растворителе, обычно это N,Nдиметилформамид, в присутствии сильного основания, такого как гидрид натрия. Промежуточные соединения представленной выше формулы VII могут быть получены взаимодействием соединения формулы III с гидроксидом щелочного металла, например, с гидроксидом натрия. Реакцию проводят в инертном растворителе, таком как водный 1,4 диоксан, в идеальном случае при флегмовой температуре растворителя. Может быть применен еще один способ получения соединений приведенной выше формулы I, который включает реакцию соединения формулы Z-СО 2 Н с соединением формулы IX в которой Y, Z, R1 и R2 описаны выше; в присутствии нитрата серебра и персульфата аммония. Реакцию проводят в кислотных условиях в подходящем растворителе, например, с использованием серной кислоты в воде или водном ацетонитриле, обычно при повышенной температуре. 31 Промежуточные соединения формулы IX соответствуют соединениям вышеприведенной формулы I, в которой Z означает водород,вследствие чего они могут быть получены аналогично вышеописанному способу получения соответствующих соединений формулы I. Кроме того, может применяться еще один способ получения соединений приведенной выше формулы I, который включает реакцию соединения формулы Х с соединением формулы в которых Y, Z, R1 и R2 описаны выше, Alk означает C1-6 алкил, обычно н-бутил, и L4 означает соответствующую отщепляемую группу; в присутствии катализатора группы переходного металла. Отщепляемая группа L4 обычно является атомом галогена, например, брома. Подходящим для применения в реакции взаимодействия между соединениями Х и XI катализатором группы переходных металлов является дихлорбис(трифенилфосфин)палладий(II). Реакцию между соединениями Х и XI осуществляют в инертном растворителе, таком как N,N-диметилформамид, обычно при повышенной температуре. Промежуточные соединения формулы Х могут быть получены реакцией взаимодействия соединения представленной выше формулы IV с соединением формулы XII в которых Y, Z, L1 и L4 описаны выше; в условиях, аналогичных вышеописанным для реакции между соединениями III и IV. При отсутствии в продаже коммерческих препаратов исходных веществ формул IV, V, VI,VIII, XI и XII, последние могут быть получены способами, аналогичными описанным в приведенных примерах, или стандартными широко известными способами. 32 Понятно, что любое соединение формулыI, первоначально полученное каким-либо из вышеописанных способов, затем может быть известным образом превращено в другое соединение формулы I. Например, соединения вышеописанных формул IJ или IK, в которых R3 представляет собой водород, можно подвергнуть каталитической гидрогенизации в стандартных условиях и получить соответствующие соединения формул, соответственно, IG или IH,в которых R4 означает водород. Более того, соединения вышеуказанных формул IG или IH, в которых R4 означает водород, могут быть превращены в соответствующие соединения, в которых R4 представляет собой C1-6 алкил, традиционным гидроалкилированием, например, под воздействием подходящего альдегида или кетона в присутствии восстанавливающего агента,такого как цианоборгидрид натрия. Подобным образом, первоначальное соединение формулыI, в котором R2 является незамещенным, может быть превращено в соответствующее соединение, в котором R2 содержит замещения, обычными методами алкилирования, например, воздействием галоалкильного производного в присутствии гидрида натрия и N,N-диметилформамида, или действием гидроксиалкильного производного в присутствии трифенилфосфина и диэтилазодикарбоксилата. Далее, первоначальное соединение формулы I, в котором R2 означает циано(С 1-6)алкил, может быть превращено в соответствующий 3-замещенный 1,2,4 триазол-5-ил(С 1-6)алкил аналог под действием подходящего производного ацилгидразина в присутствии основания, такого как метилат натрия. Подобным образом, первоначальное соединение формулы I, в котором R2 означает необязательно замещенный пропаргил, может быть превращено в соответствующий 1,2,3 триазолилметиланалог под действием аниона азида. Первоначальное соединение формулы I, в котором R2 замещен атомом галогена, например, хлора, может быть превращено в соответствующее соединение, в котором R2 замещен ди(С 1-6)алкиламино, под действием соответствующего ди(С 1-6)алкиламина, обычно при нагревании в растворителе, таком как 1,4-диоксан,в запаянном сосуде. В случае, когда вышеописанный способ получения соединений по настоящему изобретению приводит к образованию смесей стереоизомеров, последние могут быть разделены обычными методами, такими как препаративная хроматография. Новые соединения могут быть получены в рацемической форме, а индивидуальные энантиомеры могут быть получены путем энантиоспецифического синтеза либо с применением разделения. Новые соединения, к примеру, могут быть разделены на составляющие их энантиомеры с помощью таких стандартных методов, как препаративная высокоэффективная жидкостная хроматография (ВЭЖХ) 33 или формирование диастереомерных пар при образовании солей с оптически активными кислотами, такими как (-)-ди-p-толуоил-d-винная кислота и/или (+)-ди-p-толуоил-l-винная кислота, с последующей фракционирующей кристаллизацией и регенерацией свободного основания. Новые соединения могут также быть разделены методом формирования диастереомерных сложных эфиров или амидов с последующим хроматографическим разделением и удалением хиральных вспомогательных веществ. В любой из вышеприведенных последовательностей синтеза может быть необходимо и/или желательно защитить чувствительные или реактивные группы. Этого можно достичь посредством таких традиционных защитных групп, как описанные в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, PlenumSons, 1991. Защитные группы могут быть удалены на последующей стадии при помощи известных методов. Следующие примеры иллюстрируют получение соединений в соответствии с изобретением. Соединения в соответствии с настоящим изобретением эффективно ингибируют присоединение [3H]-флумазенила к месту присоединения бензодиазепина человеческого рецептора ГАМКA, содержащего 2 и 3 субъединицы,стабильно экспрессированные в Ltk- клетках. Реагенты.- буферный раствор для анализа: 10 мМ- [3H]-флумазенил (18 нМ для 132 клеток; 18 нМ для 232 клеток; 10 нМ для 332 клеток) в буферном растворе для анализа;- флунитразепам 100 мкМ в буферном растворе для анализа;- клетки, ресуспендированные в буферном растворе для анализа (1 поддон - в 10 мл). Подготовка клеток. Супернатант отделяют от клеток. Добавляют ФСБ (около 20 мл). Клетки соскабливают и помещают в 50 мл центрифужную пробирку. Операцию повторяют со следующей порцией 10 мл ФСБ для обеспечения наиболее полного удаления клеток. Осадок клеток собирают центрифугированием в течение 20 мин при 3000 об./мин в асептических условиях, после чего,при необходимости, клетки замораживают. Осажденные клетки ресуспендируют в количестве буфера из расчета 10 мл буфера на 1 поддон (25 см 25 см) клеток. 34 Анализ. Анализ может проводиться в глубоком 96 луночном планшете или в пробирках. В каждой пробирке содержится- 300 мкл буферного раствора для анализа;- 50 мкл [3H]-флумазенила (в конечной концентрации для 132 - 1,8 нМ; для 232 1,8 нМ; для 332 - 1,0 нМ);- 50 мкл буферного раствора или растворяющего носителя (например, 10% диметилсульфоксида), если соединения растворены в 10% диметилсульфоксиде; исследуемое соединение или флунитразепам (для оценки неспецифического присоединения), в конечной концентрации 10 мкМ;- 100 мкл клеток. Пробы инкубируют в течение 1 ч при температуре 40 С, затем фильтруют (с помощью соответствующего оборудования типа Tomtec или Brandel) через фильтр GF/B с последующей отмывкой ледяным буферным раствором для анализа 33 мл. Фильтры высушивают и подвергают анализу с помощью счетчика жидкой сцинтилляции. Ожидаемые значения для общего присоединения составляют 3000-4000 распадов в минуту по общему счету и менее чем 200 распадов в минуту по неспецифическому присоединению при использовании счетчика жидкой сцинтилляции, или 1500-2000 распадов в минуту по общему счету и менее чем 200 распадов в минуту по неспецифическому присоединению при оценке результатов с применением мелтилексного твердого сцинтиллятора. Методом нелинейного регрессивного анализа с применением наименьших квадратов определяются параметры присоединения, исходя из которых вычисляется константа ингибирования Ki для каждого тестируемого соединения. По результатам вышеописанного анализа в сопутствующих примерах соединения обладают значениями Ki вытеснения [3H]Ro 15-1788 из 2 и/или 3 субъединиц человеческого рецептора ГАМКA, составляющими 100 нМ или менее. Пример 1. 3-Фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4 триазоло[3,4-а]фталазин. а) 4,5-Диазатрицикло[6.2.2.2,7]додек-2(7)ен-3,6-дион. Ангидрид бицикло[2.2.2]окт-2-ен-2,3 дикарбоновой кислоты (полученный как описано в J. Org. Chem., 1993, 6740-6744) (60,8 г,0,342 моль) растворяют в 50% водной уксусной кислоте (1600 мл) с тригидратом ацетата натрия(55,5 г, 1,2 моль-экв.) и гидразингидрата (19,82 мл, 1,2 моль-экв.). Реакционную смесь нагревают с обратным холодильником в течение 16 ч,после чего дают остыть. Образовавшееся твердое вещество собирают фильтрованием и промывают водой и диэтиловым эфиром, затем высушивают в вакуумной печи при 80 С и получают целевой продукт (59,3 г, т. пл. = 214 С). 35 Н ЯМР (250 мГц, ДМСО)1.16 (4 Н, д, J = 7.1 Гц), 1.69 (4 Н, д, J = 7.1 Гц), 3.18 (2 Н, с),11.31 (2 Н, ш.с, NH); MS (ES+) m/e 193 [МН]+. б) 3,6-Дихлор-4,5-диазатрицикло[6.2.2.2,7] додека-2(7),3,5-триен. Продукт стадии а) по примеру 1 (59,2 г) растворяют в оксихлориде фосфора (300 мл) и 14 ч нагревают с обратным холодильником. Растворитель удаляют в вакууме и 2 х азеотропируют толуолом. Остаток растворяют в дихлорметане (200 мл) и быстро размешивают; раствор нейтрализуют добавляя (осторожно) твердый и водный гидрокарбонат натрия. После прекращения вспенивания органический слой отделяют, а водный слой экстрагируют дихлорметаном (2200 мл). Объединенные органические слои сушат (MgSO4), фильтруют, выпаривают и получают целевой продукт (59,5 г, т. пл.370 С). 1(ES+) m/e 229 [МН]+. в) 6-Хлор-3-фенил-7,8,9,10-тетрагидро(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин. Продукт стадии б) по примеру 1 (2,5 г,0,011 моль) суспендируют в ксилоле (50 мл) с бензоилгидразином (1,65 г, 1,1 моль-экв.) и триэтиламином (1,68 мл, 1,1 моль-экв.), и реакционную смесь нагревают с обратным холодильником в течение 6 дней. Растворитель удаляют в высоком вакууме, а остаток очищают хроматографией на силикагеле, используя 0-50% этилацетат в дихлорметане в качестве элюента; при последующей перекристаллизации из этилацетата/гексана получают целевой продукт (1,3 г, т. пл. = 186-188 С). 1 Н ЯМР (250 МГц, CDCl3)1.43-1.59 (4 Н,м), 1.91-2.05 (4 Н, м), 3.57 (1 Н, с), 4.07 (1 Н, с),7.58 (3 Н, м), 8.58 (2 Н, д.д., J = 7.8 и 1.5 Гц); MS[3,4-а]фталазин. К раствору 2-пиридилкарбинола (0,263 мл,0,0024 моль) в ДМФ (20 мл) добавляют гидрид натрия (0,113 г 60% суспензии в масле, 1,75 моль-экв.) и реакционную смесь перемешивают 15 мин при комнатной температуре. После этого добавляют продукт стадии в) по примеру 1 (0,5 г, 0,0016 моль) и реакционную смесь перемешивают в течение одного 1 ч при комнатной температуре. Добавляют воду, пока в растворе не появятся признаки помутнения, и после перемешивания дополнительно 15 мин твердое вещество собирают фильтрованием. Твердое вещество перекристаллизуют из этилацетата и получают целевой продукт (0,112 г, т. пл. = 196198 С). 1(ES+) m/e 384 [МН]+ Анал. установлено С, 71.76; Н, 5.54; N,18.03. C24H21N5O найдено С, 72.04; Н, 5.52; N,18.26%. Пример 2. 3,7-Дифенил-6-(2-пиридил) метилокси-1,2,4-триазоло[4,3-b]пиридазин. Соединение получают по методике примера 1, стадии а), б), в) и г), используя на стадии а) фенилмалеиновый ангидрид вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3-дикарбоновой кислоты. Хроматограмма получаемого на стадии в) 7-фенил-изомера сдвинута ниже, чем 8 фенил-изомера, и поэтому разделение региоизомеров осуществляют на этой стадии с помощью хроматографии на силикагеле, используя в качестве элюента 0-5% этилацетат в дихлорметане. Показатели целевого вещества: т. пл. = 203 С. 1 Н ЯМР (360 мГц, СDСl3)5.65 (2 Н, с),7.24 (1 Н, м), 7.34 (1 Н, д. J = 7.8 Гц), 7.53 (6 Н. м),7.69 (3 Н, м), 8.07 (1 Н, с), 8.41 (2 Н, д, J = 6.6 Гц),8.65 (1 Н, м); MS (ES+) m/e 380 [МН]+. Анал. установлено С, 72.59; Н, 4.47; N,18.04. C23H17N5O найдено С, 72.81; Н, 4.52; N,18.46%. Пример 3. 3-Фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а] фталазин. Соединение получают по методике примера 1, стадии а), б), в) и г), используя на стадии а) тетрагидрофталевый ангидрид вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3-дикарбоновой кислоты. Показатели целевого вещества: т. пл. = 194 С. 1 Н ЯМР (360 мГц, СDСl3)1.94 (4 Н, м),2.74 (2 Н, м), 3.14 (2 Н, м), 5.56 (2 Н, с), 7.27 (1 Н,м), 7.47 (4 Н, м), 7.73 (1 Н, м), 8.36 (2 Н, д, J= 6.6 Гц), 8.66 (1 Н, м); MS (ES+) m/e 358 [МН]+. Анал. установлено С, 70.50; Н, 5.25; N,19.27. C21H19N5O найдено С, 70.57; Н, 5.76; N,19.59%. Пример 4. 7,8-Диметил-3-фенил-6-(2 пиридил)метилокси-1,2,4-триазоло[4,3-b] пиридазин. Соединение получают по методике примера 1, стадии в) и г), используя на стадии в) 3,6 дихлор-4,5-диметилпиридазин вместо 3,6 дихлор-4,5-диазатрицикло[6.2.2.2,7]додека 2(7),3,5-триена. Показатели целевого соединения: т. пл. = 185 С. 1 Н ЯМР (360 мГц, CDCl3)2.35 (3 Н, с),2.69 (3 Н, с), 5.58 (2 Н, с), 7.27 (1 Н, м), 7.47 (4 Н,м), 7.75 (1 Н, д.д, J = 7.8, 7.8 и 1.8 Гц), 8.37 (2 Н,д. J = 7.6 Гц), 8.65 (1 Н, м); MS (ES+) m/e 332 37 Анал. установлено С, 68.38; Н, 4.82; N,20.64. С 19 Н 17N5 О найдено С, 68.87; Н, 5.17; N,21.13%. Пример 5. 7-Метил-3-фенил-6-(2-пиридил) метилокси-1,2,4-триазоло[4,3-b]пиридазин. Соединение получают по методике примера 1, стадии в) и г), используя на стадии в) 3,6 дихлор-4-метилпиридазин вместо 3,6-дихлор 4,5-диазатрицикло[6.2.2.2,7]додека-2(7),3,5 триена. Хроматограмма получаемого на стадии в) 7-метил-изомера сдвинута ниже, чем 8-метилизомера, поэтому разделение региоизомеров осуществляют на этой стадии с помощью хроматографии на силикагеле, используя в качестве элюента 0-10% этилацетат в дихлорметане. Показатели целевого вещества: т. пл. = 199 С. 1 Н ЯМР (360 МГц, СDСl3)2.42 (3 Н, с),5.59 (2 Н, с), 7.28 (1 Н, м), 7.49 (4 Н, м), 7.76 (1 Н,д.д.д, J = 7.8, 7.8 и 1.8 Гц), 7.83 (1 Н, с), 8.37 (2 Н,д, J = 7.6 Гц), 8.65 (1 Н, м); MS (ES+) m/e 318[4,3-b]пиридазина. Соединение получают по методике примера 1, стадии а), б), в) и г), используя на стадии а) этилмалеиновый ангидрид (Synth. Commun.,1990,2491) вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3-дикарбоновой кислоты. Хроматограмма получаемого на стадии в) 7 этил-изомера сдвинута ниже, чем 8-этилизомера, поэтому разделение региоизомеров осуществляют на этой стадии с помощью хроматографии на силикагеле, используя в качестве элюента 0-10% этилацетат в дихлорметане. Показатели целевого вещества: т. пл. = 193 С. 1N, 17.32%. Пример 7. 7,8-Бензо-3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике примера 1, стадии а), б), в) и г), используя на стадии а) 3,4-дигидро-1,2-нафталиндикарбоновый ангидрид вместо бицикло[2.2.2]окт-2-ен-2,3-дикарбоновой кислоты. Хроматограмма 7,8 бензоизомера, получаемого на стадии в) сдвинута ниже, чем 9,10-бензоизомера, поэтому разделение региоизомеров осуществляют на этой стадии с помощью хроматографии на силикагеле, используя в качестве элюента 0-30% этил 002436(4 Н, м), 7.51 (4 Н, м), 7.74 (1 Н, м), 8.37 (3 Н, м),8.71 (1 Н. м); MS (ES+) m/e 406 [МН]+. Анал. установлено С, 73.81; Н, 4.48; N,16.96. C25H19N5O найдено С, 74.06; Н, 4.72; N. 17.27%. Пример 8. 8-Метил-3,7-дифенил-6-(2 пиридил)метилокси-1,2,4-триазоло[4,3-b]пиридазин. Соединение получают по примеру 1, стадии а), б), в) и г), используя на стадии а) 3 метил-4-фенилмалеиновый ангидрид вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3-дикарбоксиловой кислоты. Хроматограмма получаемого на стадии в) 7-фенил-8-метил-изомера сдвинута ниже, чем 7-метил-8-фенил-изомера, поэтому разделение региоизомеров осуществляют на этой стадии с помощью хроматографии на силикагеле, используя в качестве элюента 0-15% этилацетат в дихлорметане. Показатели целевого вещества: т. пл. = 182 С. 1 Н ЯМР (360 МГц, ДМСО)2.45 (3 Н, с),5.50 (2 Н, с), 7.30 (2 Н, м), 7.54 (8 Н, м), 7.77 (1 Н,м), 8.25 (2 Н, д, J = 7.8 Гц), 8.58 (1 Н, м); MS (ES+)-3-Фенил-6-(2-пиридил) метилокси-7,8,9,10-тетрагидро-(7,10-метано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике примера 1, стадии а), б), в) и г), используя на стадии а) 2-норборнен-2,3-дикарбоновый ангидрид вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3 дикарбоновой кислоты. Показатели целевого вещества: т. пл. = 182 С. 1(2 Н, д, J = 7.8 Гц), 8.68 (1H, м); MS (ES+) m/e 370 [МН]+. Анал. установлено С, 71.53; Н, 5.18; N,18.96. C22H19N5O найдено С, 72.08; Н, 5.13; N,18.89%. Примеры 10 и 11. 0,25 Гидрат 3-фенил-5(пиридин-2-илметокси)-1,2,3 а,4,7-пентаазациклопента[]нафталина и 0,5 гидрат 3-фенил-5(пиридин-2-илметокси)-1,2,3 а,4,8-пентаазациклопента[]нафталина. а) 5-Хлор-3-фенил-1,2,3 а,4,7-пентаазациклопента[]нафталин и 5-хлор-3-фенил 1,2,3 а,4,8-пентаазациклопента[]нафталин. Такую смесь 1:1 хлоримидатов получают по методу примера 1, стадии а), б) и в), используя 3,4-пиридиндикарбоновый ангидрид вместо[МН]+. б) 0,25 Гидрат 3-фенил-5-(пиридин-2 илметокси)-1,2,3 а,4,7-пентаазациклопента[] нафталина и 0,5 гидрат 3-фенил-5-(пиридин-2 илметокси)-1,2,3 а,4,8-пентаазациклопента[] нафталина. К раствору 2-пиридилкарбинола (180 мл,1,9 ммоль) в сухом ДМФ (10 мл) при комнатной температуре в атмосфере азота добавляют гидрид натрия (76 мг 60% дисперсии в масле, 1,9 ммоль). Спустя 45 мин добавляют смесь хлоримидатов, полученных на стадии а) (380 мг, 1,35 ммоль). Выдержав еще 1 ч при комнатной температуре реакционную смесь разбавляют водой(200 мл) и экстрагируют дихлорметаном (400 мл и 2200 мл). Объединенные экстракты промывают рассолом (100 мл), высушивают (MgSO4),фильтруют и выпаривают. Остаток перекристаллизовывают из метанола и получают смесь фталазинов (136 мг) в виде смеси 1:1, неразделимой методами обычной хроматографии. Два изомера разделяют препаративной ВЭЖХ хроматографией (HPLC) при помощи 3,5 динитробензоил фенилглициновой колонки Пиркля, получая: Первое элюирование: 0,25 гидрат-3-фенил 5-(пиридин-2-илметокси)-1,2,3 а,4,7-пентаазациклопента[]нафталин: т. пл. 190 С; 1 Н ЯМР (360 мГц, СDСl3)5.79 (2 Н, с),7.34-7.37 (1 Н, м), 7.52-7.58 (3 Н, м), 7.61 (1 Н, д, J(500 мл) при -10 С добавляют N,N-диизопропилэтиламин (52 мл, 0,3 моль), после чего по каплям добавляют трифторметансульфонилхлорид (57 мл, 0,3 моль), поддерживая температуру в интервале от -5 до -10 С. Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 3 ч. Тонкослойная хроматография свидетельствует о 80% реакции; смесь охлаждают до -5 С и добавляют еще N,N-диизопропилэтиламина (14 мл, 0,1 моль), затем трифторметансульфонилхлорида (15,5 мл, 0,1 моль) и реакционную смесь перемешивают 15 ч при комнатной температуре. Смесь промывают холодной водой (2200 мл), холодным насыщенным бикарбонатом натрия (2200 мл) и рассолом (1200 мл). Органический слой высушивают (MgSO4),фильтруют и выпаривают; получают целевой продукт (85 г) в виде бесцветного масла. 1(3 Н, м), 4.25 (2 Н, м). б) 1-Этил-2-метил 4-метилциклогекс-1-ен 1,2-дикарбоксилат. К раствору продукта стадии а) примера 12(85 г, 0,27 моль) в ДМФ (500 мл) при -20 С добавляют ацетат палладия (II) (1,85 г, 0,0083 моль), бис(дифенилфосфино)ферроцен (9 г,0.0162 моль), метанол (250 мл) и триэтиламин(75.5 мл, 0.54 моль). В раствор в течение 15 мин подают газообразную моноокись углерода и потом реакционную смесь нагревают до 60 С и выдерживают в атмосфере моноокиси углерода 15 ч. Раствор оставляют охлаждаться и растворитель удаляют в высоком вакууме. Остаток растворяют в этилацетате, затем промывают водой (4200 мл) и рассолом (1200 мл). Органический слой высушивают (MgSO4), фильтруют и выпаривают; получают сырой продукт,который очищают при помощи хроматографии на силикагеле, используя 0-10% этилацетат в гексане для получения целевого продукта (27 г) в виде бледно-желтого масла. 1 Н ЯМР (250 мГц, CDCl3)1.12 (3 Н, д, J = 6.5 Гц), 1.33 (3 Н, м), 1.70-1-96 (4 Н, м), 2.35-2.61(3 Н, м), 3.73 (3 Н, с) 4.25 (2 Н, м). в) 4-Метилциклогекс-1-ен-1,2-дикарбоновая кислота. К раствору продукта стадии б) примера 12(33 г, 0,15 моль) в этаноле (200 мл) добавляют раствор гидроксида калия (32,7 г, 0,6 моль) в воде (20 мл) и нагревают с обратным холодильником в течение 15 ч. Раствор оставляют охлаждаться, растворитель удаляют в высоком вакууме, добавляют воду (200 мл), затем добавляют концентрированную соляную кислоту до рН 2. Водный слой экстрагируют дихлормета 41 ном (5200 мл), объединенные органические слои промывают рассолом (1200 мл), высушивают (MgSO4), фильтруют и выпаривают; получают целевой продукт в виде бледножелтого масла (16,7 г). 1 Н ЯМР (250 мГц, ДМСО)1.15 (3 Н, д, J = 6.5 Гц), 1.21 (1 Н, м), 1.86 (3 Н, м), 2.37 (3 Н, м),3.34 (2 Н, ш.с). г) Ангидрид 4-метил-(3,4,5,6-тетрагидро) фталевой кислоты. Продукт по стадии в) примера 12 (16,5 г,0,89 моль) нагревают с обратным холодильником в уксусном ангидриде (200 мл) в течение 15 ч. Уксусный ангидрид удаляют в высоком вакууме, остаток растворяют в толуоле и затем выпаривают для получения целевого продукта в виде масла (15,2 г). 1 Н ЯМР (250 мГц, ДМСО)1.03 (3 Н, д, J = 6.5 Гц), 1.24 (1 Н, м), 1.96 (3 Н, м), 2.23 (3 Н, м). д) 6-Метил-5,6,7,8-тетрагидрофталазин 1,4-дион. Соединение получают по методике стадии а) примера 1, используя ангидрид 4-метил(3,4,5,6-тетрагидро)фталевой кислоты вместо ангидрида бицикло[2.2.2]окт-2-ен-2,3-дикарбоновой кислоты. Показатели целевого соединения: 1[МН]+. е) 1,4-Дихлор-6-метил-5,6,7,8-тетрагидрофталазин. Соединение получают по методике стадии б) примера 1, используя 6-метил-5,6,7,8 тетрагидрофталазин-1,4-дион вместо 4,5 диазатрицикло[6.2.2.2,7]додек-2(7)-ен-3,6-диона. Показатели целевого соединения: 1 Н ЯМР (250 мГц, СDСl3)1.29 (3 Н, д, J = 7.0 Гц), 1.90 (4 Н, м), 2.54 (1 Н, м), 2.93 (1 Н, м),3.18 (1 Н, м); MS (ES+) m/e 217 + 219 [МН]+. ж)-6-Хлор-8-метил-3-фенил-7,8,9,10 тетрагидро-1,2,4-триазоло[3,4-а]фталазин и 6-хлор-9-метил-3-фенил-7,8,9,10-тетрагидро 1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадии в) примера 1, используя 1,4-дихлор-6-метил 5,6,7,8-тетрагидрофталазин вместо 3,6-дихлор 4,5-диазатрицикло[6.2.2.2,7]-додека-2(7),3,5 триена. В результате реакции получают смесь целевых соединений в приблизительном соотношении 1:1. На этой стадии соединения не разделяют. Показатели смеси целевых соединений: 1 42 Соединение получают по методике стадии г) примера 1, используя смесь, из стадии ж) примера 12 вместо 3-фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]-фталазина. Два продукта разделяют при помощи хроматографии на силикагеле, 0-8% метанол в дихлорметане. Продукт с более высоким Rf перекристаллизовывают из этилацетата/дихлорметана для получения целевого соединения. 1 Н ЯМР (250 мГц, ДМСО)1.23 (3 Н, д, J = 6.3 Гц), 2.05 (2 Н, м), 2.35 (1H, м), 3.00 (2 Н, м),3.24 (1H, м), 5.71 (2 Н, с), 7.58 (5 Н, м), 8.08 (1H,м), 8.36 (2 Н, м), 8.80 (1H, м); т. пл. 185-187 С;MS (ES+) m/e 372 [МH]+. Продукт с более низким Rf также выделяют; он оказывается -9-метил 1-3-фенил-6-(2 пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4 триазоло[3,4-a]фталазином. Показатели соединения даны для трифторуксусной соли; 1 Н ЯМР (250 мГц, ДМСО)1.13 (3 Н, д, J = 6.5 Гц), 1.24 (1H, м), 1.96 (2 Н, м), 2.80 (3 Н, м),3.16 (1H, м), 5.60 (2 Н, с), 7.70 (5 Н, м), 8.08 (1H,д, J = 7.8 Гц), 8.20 (2 Н, м), 8.65 (1H, м); т. пл. 152-154 С; MS (ES+) m/e 372 [МН]+. Структура доказана COSY и NOE экспериментами. Пример 13. 3-Фенил-6-(2-пиридил)метилокси-(7,8-пентано)-1,2,4-триазоло[4,3-b]пиридазин. Соединение получают по методике стадий а), б), в) и г) примера 1, используя на стадии а) ангидрид 1-циклогептен-1,2-дикарбоновой кислоты (Proc. Indian Acad. Sci., Sect. A, 1978, 87 А(ES+) m/e 372 [МН]+. Анал. установлено С, 70.52; Н, 5.25; N,18.44. C22H21N5O0.1 H2O найдено С, 70.80; Н,5.72; N, 18.76%. Пример 14. 8,8-Диметил-3-фенил-6-(2 пиридил)метилокси-7,8,9,10-тетрагидро-1,2,4 триазоло[3,4-а]фталазин. а) Диметил 4,4-(диметил)циклогексен-1,2 дикарбоксилат. Соединение получают с 62% выходом по методике, схожей с описанной для стадии а) примера 12, но с использованием 2 карбометокси-4,4-диметилциклогексанона (Liu,H.-J.; Browne, E. N. С.; Chew, S. Y., Can. J. 43 Смесь продукта по стадии а) примера 14(3,78 г, 16,7 ммоль) и гидроксида калия (3,50 г,66,9 ммоль) в этаноле (23 мл) и воде (28 мл) нагревают при 80 С в течение 23 ч. После охлаждения смесь концентрируют до 15 мл, вводят на ионообменную колонку Dowex 50WX8-200 и элюируют 0-20% МеОН/Н 2 О для получения 2,73 г (82%) нужного продукта в виде бледнокоричневого твердого вещества. 1 Н ЯМР (250 мГц, d6-ДМСО)1.09 (9 Н, с),1.61 (2 Н, т, J = 6.2 Гц), 2.26 (2 Н, т, J = 2.8 Гц),2.48 (2 Н, м). в) Ангидрид 4,4-(диметил)циклогексен 1,2-дикарбоновой кислоты. Соединение получают с 93% выходом по методике, схожей с описанной для стадии г) примера 12, но с использованием продукта по стадии в) примера 14. 1 Н ЯМР (250 мГц, d6-ДМСО)0.96 (6 Н, с),1.48 (2 Н, т, J = 6.2 Гц), 2.13 (2 Н, т, J = 2.8 Гц),2.35 (2 Н, м). г) 6,6-Диметил-5,6,7,8-тетрагидрофталазин-1,4-дион. Соединение получают с 92% выходом по методике, схожей с описанной для стадии а) примера 1, но с использованием продукта из стадии в) примера 14. 1 Н ЯМР (250 мГц, d6-ДМСО)0.92 (6 Н, с),1.43 (2 Н, т, J = 6.4 Гц), 2.16 (2 Н, с), 2.38 (2 Н, т, J= 6.4 Гц); MS (ES) m/e 195 [М+Н]+. д) 1,4-Дихлоро-5,6,7,8-тетрагидро-6,6 диметилфталазин. Соединение получают с 99% выходом по методике, схожей с описанной для стадии б) примера 1, но с использованием продукта по стадии г) примера 14. 1(2 Н, т, J = 6.6 Гц), 2.53 (2 Н, с), 2.78 (2 Н, т, J= 6.6 и 1.3 Гц); MS (ES) m/e 235/233/231 [М+Н]+. е) 6-Хлоро-7,8,9,10-тетрагидро-8,8-диметил-3-фенил-1,2,4-триазоло[3,4-а]фталазин. Смесь продукта по стадии д) примера 14(2,53 г, 10,9 ммоль), триэтиламина (1.83 мл, 13.1 ммоль) и бензоилгидразида (1,79 г, 13,1 ммоль) в ксилоле (50 мл) нагревают с обратным холодильником в течение 3 дней при наличии уловителя Dean-Stark. Растворитель удаляют в вакууме и к остатку добавляют дихлорметан (50 мл). Смесь перемешивают, отфильтовывают белый осадок, а фильтрат выпаривают в вакууме. Остаток очищают флеш-хроматографией (силикагель, 10-20% ЕtOАс/СН 2 Сl2) для получения 2,18 г (64%) частично разделенной смеси 9,9 диметилизомера и нужного продукта. 1 44 К перемешиваемой смеси гидрида натрия(60% дисперсия в масле, 40.4 мг, 1,01 ммоль) в безводном ДМФ (5 мл) в атмосфере азота добавляют 2-пиридилкарбинол (95 мл, 0,985 ммоль) и смесь перемешивают 1 ч при комнатной температуре. Через канюлю эту смесь добавляют к перемешиваемой смеси продукта по стадии е) примера 14 (0,205 г, 0,655 ммоль) в безводном ДМФ (5 мл) и смесь перемешивают еще 28 ч, дополнительно добавляя гидрид натрия (8,4 и 7 мг) спустя 18 и 25 ч. Смесь фракционируют между ЕtOАс (50 мл) и водой (50 мл), и водный слой далее экстрагируют ЕtOAс(250 мл). Объединенные органические экстракты высушивают (Na2SO4) и выпаривают в вакууме. Остаток очищают флешхроматографией (силикагель, 2% МеОН/СН 2 Сl2,затем глинозем, 80% EtOAc/CH2Cl2) для получения 71,4 мг (28%) нужного продукта; т. пл. 133-136 С (СН 2 Сl2-ЕtOАс-гексан); 1 Н ЯМР (360 мГц, d6-ДМСО) 1.10 (6 Н, с),1.71 (2 Н, т, J = 6.5 Гц), 2.53 (2 Н, м), 3.20 (2 Н, м),5.59 (2 Н, с), 7.31 (1 Н, м), 7.47-7.54 (4 Н, м), 7.80(1 Н, д.д, J = 7.8 и 1.7 Гц), 8.37 (2 Н, д.д, J = 8.0 и 1.3 Гц), 8.67 (1 Н, м); MS (ES) m/e 386 [M+H]+. Анал. установлено С, 71.41; Н, 6.12; N,17.99. C23H23N5O найдено С, 71.67; Н, 6.01; N,18.17%. Пример 15. 0,45 Гидрат 3-фенил-7(пиперидин-1-ил)-6-(пиридин-2-илметокси)1,2,4-триазоло[4,3-b]пиридазина. а) 4-Бром-1,2-дигидропиридазин-3,6-дион. Смесь броммалеинового ангидрида (50 г,283 ммоль) и ацетата натрия (76,5 г, 562 ммоль) в 40% уксусной кислоте/воде (750 мл) обрабатывают моногидратом гидразина (16,5 мл, 339 ммоль) в атмосфере азота при комнатной температуре. Коричневый раствор перемешивают и нагревают при 100 С в течение 18 ч. После охлаждения смесь выливают в воду (1 л) и экстрагируют этилацетатом (6500 мл). Объединенные экстракты высушивают (MgSO4), фильтруют и выпаривают для получения целевого соединения (20 г, 37%) в виде оранжевого твердого вещества. 1H ЯМР (250 мГц, d6-ДМСО)7.68 (1 Н,ш.с). MS (ES+) m/e 193 [МН]+, 191 [МН]+. Вещество используют без дальнейшей очистки. б) 4-Бромо-3,6-дихлоропиридазин. Раствор 4-бром-1,2-дигидропиридазин-3,6 диона (10 г, 52 ммоль) в оксихлориде фосфора(100 мл) перемешивают и нагревают при 100 С в атмосфере азота в течение 16 ч. После охлаждения избыток оксихлорида фосфора удаляют в вакууме. Остаток азеотропируют с помощью толуола (х 2), потом переносят в дихлорметан/воду. Смесь осторожно подщелачивают твердым гидрокарбонатом натрия. Для получения двух чистых слоев смеси необходимо дальнейшее разбавление. Два слоя разделяют, и водную фазу экстрагируют дихлорметаном (х 3).(Na2SO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя дихлорметаном для получения целевого соединения (5,0 г, 42%) в виде бесцветного твердого вещества. 1 Н ЯМР (250 мГц, CDCl3)7.68 (1 Н, ш.с).MS (ES+) m/e 230 [MH]+, 228 [МН]+. в) 3,6-Дихлор-4-(пиперидин-1-ил)пиридазин. Пиперидин (475 мл, 4,8 ммоль) добавляют и перемешивают раствор/суспензию 4-бром-3,6 дихлорпиридазина (1,0 г, 4,4 ммоль) и карбоната калия (1,2 г, 8,7 ммоль) в сухом ДМФ (40 мл) в атмосфере азота при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 16 ч, затем при 60 С в течение 3 ч. Реакционную смесь выливают в воду (250 мл). Водную фазу экстрагируют с помощью этилацетата (х 3). Объединенные экстракты высушивают (MgSO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя 0,5% метанол/дихлорметаном для получения целевого соединения (1.0 г, 98%) в виде бесцветного масла. 1 Н ЯМР (250 мГц, CDCl3)1.63-1.81 (6 Н,м), 3.24-3.29 (4 Н, м), 6.84 (1 Н, с). MS (ES+) m/e 234 [МН]+, 232 [MH]+. г) 6-Хлор-3-фенил-7-(пиперидин-1-ил)1,2,4-триазоло[4,3-b]пиридазин. Смесь 3,6-дихлор-4-(пиперидин-1-ил) пиридазина (0,55 г, 2,4 ммоль), бензоилгидразина (370 мг, 2,7 ммоль), триэтиламина (375 мл,2,7 ммоль) и моногидрата р-толуолсульфокислоты (510 мг, 2,7 ммоль) в ксилоле (смесь изомеров, 10 мл) перемешивают и нагревают с обратным холодильником в атмосфере азота в течение 24 ч. После охлаждения ксилол удаляют в вакууме, а остаток фракционируют между дихлорметаном и водой. Водную фазу далее экстрагируют дихлорметаном (х 3). Объединенные экстракты высушивают (Na2SO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя с 30% этилацетатом/дихлорметаном; получают побочный региоизомер (менее полярный) (177 мг, 23%) и целевое соединение (383 мг, 50%) (более полярное). Показатели целевого соединения: 1[4,3-b]пиридазина. К раствору 2-пиридилкарбинола (104 мг,0,96 ммоль) в сухом ДМФ (10 мл) при комнатной температуре в атмосфере азота добавляют гидрид натрия (60% дисперсия в масле, 39 мг,0,96 ммоль). Спустя 1 ч при комнатной температуре шприцем вводят раствор 6-хлор-3-фенил-7(пиперидин-1-ил)-1,2,4-триазоло[4,3-b]пирида 002436 46 зина (200 мг, 0,64 ммоль) в сухом ДМФ (10 мл). Смесь перемешивают при комнатной температуре в течение 16 ч. ДМФ затем удаляют в вакууме и остаток фракционируют между дихлорметаном и водой. Водную фазу в дальнейшем экстрагируют дихлорметаном (2100 мл). Объединенные экстракты высушивают(248 мг) очищают кристаллизацией из этилацетата/гексана (х 2); получают целевое соединение:(2 Н, м), 7.42-7.56 (4 Н, м), 7.76 (1 Н, т.д, J = 7.7,1.6 Гц), 8.31-8.35 (2 Н, м), 8.66 (1 Н, ш.с). (Радиохимия установлена по данным nOe). MS (ES+)(350 мг, 0,3 ммоль), и из реакционной смеси опять удаляют кислород с помощью повторных 3 циклов удаления/наполнения азотом. Потом смесь перемешивают и нагревают с обратным холодильником в атмосфере азота и защищая от попадания света в течение 16 ч. После охлаждения легкие фазы удаляют в вакууме. Остаток используют без дальнейшей очистки. Твердую фазу вышеупомянутого вещества переносят в оксихлорид фосфора (10 мл). Темную суспензию нагревают с обратным холодильником в течение 20 ч. После охлаждения легкие фазы удаляют в вакууме. Остаток азеотропируют толуолом (х 2), затем фракционируют между дихлорметаном и водой. Смесь осторожно подщелачивают твердым карбонатом натрия. Разделяют два слоя (образовавшийся осадок может быть удален фильтрованием через целит). Водную фазу в дальнейшем экстрагируют дихлорметаном (х 3). Объединенные экстракты высушивают (MgSO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя 3% метанол/дихлорметаном для получения целевого соединения (240 мг, более 38% после двух стадий) в виде бледно-желтого твердого вещества. 1 Н ЯМР (250 мГц, d6-ДМСО)7.77-7.79 47 б) 6-Хлор-3-фенил-7-(пиридин-4-ил)-1,2,4 триазоло[4,3-b]пиридазин. Смесь 3,6-дихлор-4-(пиридин-4-ил)пиридазина (390 мг, 1,7 ммоль), бензоилгидразина (260 мг, 1,9 ммоль), триэтиламина (270 мл, 1,9 ммоль) и р-толуолсульфокислоты (32 мг, 0,2 ммоль) в ксилоле (смесь изомеров) (5 мл) перемешивают и нагревают с обратным холодильником в атмосфере азота в течение 20 ч. Смесь фракционируют между дихлорметаном и насыщенным водным карбонатом калия. Водную фазу далее экстрагируют дихлорметаном (х 3). Объединенные экстракты высушивают (сульфат натрия), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя 3% метанол/дихлорметаном для получения целевого соединения (218 мг, 42%) в виде бледно-желтого твердого вещества. 1 Н ЯМР (360 мГц, d6-ДМСО)7.60-7.69(2 Н, м). MS (ES+) m/e 308 [МН]+, 310 [МН]+. в) 0,5 Гидрат 3-фенил-7-(пиридин-4-ил)-6(пиридин-2-илметокси)-1,2,4-триазоло[4,3-b] пиридазина. 2-Пиридилкарбинол (105 мл, 1,1 ммоль) добавляют в перемешиваемую суспензию гидрида натрия (60% дисперсия в масле, 40 мг, 1,0 ммоль) в сухом ДМФ (10 мл) при комнатной температуре в атмосфере азота. Спустя 1 ч добавляют раствор 6-хлор-3-фенил-7-(пиридин-4 ил)-1,2,4-триазоло[4,3-b]пиридазина (200 мг,0,65 ммоль) в сухом ДМФ (10 + 5 мл). Раствор перемешивают при комнатной температуре в течение 16 ч, затем выливают в воду (100 мл). Водную фазу экстрагируют этилацетатом (5100 мл). Объединенные экстракты высушивают(170 мг) перекристаллизовывают из горячего этилацетата; получают целевое соединение (120 мг, 49%) в виде бесцветного твердого вещества,т. пл. = 215 С dec. 1 48 Смесь 3-фенил-5-(пиридин-2-илметокси)1,2,3 а,4,7-пентаазациклопента[]нафталина и 3 фенил-5-(пиридин-2-илметокси)-1,2,3 а,4,8 пентаазациклопента[]нафталина (примеры 10 и 11), 2N НСl (1,0 мл, 2 ммоль) в метаноле (140 мл) гидрогенизируют над окисью платины (140 мг) при 30 psi в течении 45 мин при комнатной температуре. Катализатор удаляют, фильтруя через целит, промывая метанолом. Фильтрат выпаривают и остаток очищают хроматографией на силикагеле, элюируя дихлорметан/метанол/аммиаком - 80:8:1; получают целевые амины (465 мг, 65%) в виде желтого твердого вещества. Смесь неразделима при помощи флеш-хроматографии. Два изомера разделяют по методике нижеследующих стадий б), в) и г). б) Трет-бутиловый сложный эфир 3 фенил-5-(пиридин-2-илметокси)-6,9-дигидро 7H-1,2,3 а,4,8-пентаазациклопента[]нафталин 8-карбоновой кислоты и трет-бутиловый сложный эфир 3-фенил-5-(пиридин-2-илметокси)8,9-дигидро-6H-1,2,3 а,4,7-пентаазациклопента[]нафталин-7-карбоновой кислоты. Ди-трет-бутилдикарбонат (700 мг, 3,2 ммоль) добавляют в перемешиваемый раствор смеси 3-фенил-5-(пиридин-2-илметокси)-6,7,8,9 тетрагидро-1,2,3 а,4,8-пентаазациклопента[] нафталина и 3-фенил-5-(пиридин-2-илметокси)6,7,8,9-тетрагидро-1,2,3 а,4,7-пентаазациклопента[]нафталина (555 мг, 1,55 ммоль) с триэтиламином (550 мл, 3,9 ммоль) и 4 диметиламинопиридином (20 мг, 0,16 ммоль) в сухом дихлорметане при 0 С в атмосфере азота. Реакционной смеси дают более 1 ч чтобы дойти до комнатной температуры, затем перемешивают в течение 16 ч при такой температуре. Смесь фракционируют между дихлорметаном и насыщенным водным гидрокарбонатом натрия. Водную фазу далее экстрагируют дихлорметаном(Nа 2SO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле, элюируя 5% метанол/дихлорметаном; получают смесь целевых соединений (610 мг, 86%) в виде бесцветного твердого вещества. Два компонента могут быть разделены при помощи жидкостной хроматографии среднего давления на силикагеле; элюируя этилацетатом получают: менее полярный трет-бутиловый сложный эфир 3-фенил-5-(пиридин-2-илметокси)-6,9 дигидро-7H-1,2,3 а,4,8-пентаазациклопента[] нафталин-8-карбоновой кислоты (274 мг). Образец перекристаллизовывают из этилацетата/гексана: т. пл. = 170-173 С. 1 Н ЯМР (250 МГц, СDСl3)1.52 (9 Н, с),2.84-2.90 (2 Н, м), 3.81 (2 Н, т, J = 5.8 Гц), 5.00 49 Анал. установлено С, 61.83; Н, 5.60; N,17.52. C25H26N6O31,4 Н 2 О найдено С, 62.07; Н,6.00; N, 17.37%. Более полярный трет-бутиловый сложный эфир 3-фенил-5-(пиридин-2-илметокси)-8,9 дигидро-6H-1,2,3 а,4,7-пентаазациклопента[] нафталин-7-карбоновой кислоты (227 мг). Образец перекристаллизовывают из этилацетата/гексана: т. пл. = 166-168 С. 1 Н ЯМР (250 мГц, СDСl3)1.53 (9 Н, с),3.20-3.26 (2 Н, м), 3.82 (2 Н, т, J = 5.8 Гц), 4.62(ES+) m/e 459 [MH]+. Анал. установлено С, 65.76; Н, 5.81; N,18.25. C25H26N6O3 найдено С, 65.49; Н, 5.71; N,18.32%. в) 0,35 Гидрат 3-фенил-5-(пиридин-2 илметокси)-6,7,8,9-тетрагидро-1,2,3 а,4,8-пентаазациклопента[]нафталина. В раствор трет-бутилового сложного эфира 3-фенил-5-(пиридин-2-илметокси)-6,9-дигидро 7H-1,2,3 а,4,8-пентаазациклопента[]нафталин 8-карбоновой кислоты (255 мг, 0,56 ммоль) в сухом дихлорметане (3 мл), при 0 С в атмосфере азота добавляют трифторуксусную кислоту(3 мл). Спустя 1 ч легкие фазы удаляют в вакууме и остаток фракционируют между дихлорметаном и насыщенным водным карбонатом калия. Водную фазу далее экстрагируют дихлорметаном (х 2). Объединенные экстракты сушат (Na2SO4), фильтруют и выпаривают. Остаток очищают хроматографией на силикагеле,элюируя дихлорметан/метанол/аммиаком(60:8:150:8:1) и получают целевой амин (176 мг, 88%) в виде бесцветного твердого вещества,т. пл. = 175-178 С. 1[МН]+. Анал. установлено С, 66.14; Н, 4.98; N,22.71. С 20 Н 18N6 О 0,35 H2O найдено С, 65.86; Н,5.17; N, 23.04%. г) 0,75 Гидрат 3-фенил-5-(пиридин-2 илметокси)-6,7,8,9-тетрагидро-1,2,3 а,4,7-пентаазациклопента[]нафталина. В раствор трет-бутилового сложного эфира 3-фенил-5-(пиридин-2-илметокси)-8,9-дигидро 6H-1,2,3 а,4,7-пентаазациклопента[]нафталин 7-карбоновой кислоты (217 мг, 0,47 ммоль) в сухом дихлорметане (3 мл), при 0 С в атмосфере азота добавляют трифторуксусную кислоту(3 мл). Спустя 1 ч легкие фазы удаляют в вакууме и остаток фракционируют между дихлорметаном и насыщенным водным карбонатом калия. Водную фазу далее экстрагируют дихлорметаном (х 2). Объединенные экстракты 50 экстракты высушивают (Na2SO4), фильтруют и выпаривают. Осадок очищают хроматографией на силикагеле, элюируя дихлорметан/метанол/ аммиаком (60:8:1) и получают целевой амин(162 мг, 96%) в виде бесцветного твердого вещества, т. пл. = 157-159 С. 1 Н ЯМР (360 мГц, d6-ДМСО)2.92-2.96(100 мл, 1,75 ммоль) в сухом метаноле (10 мл) при комнатной температуре в атмосфере азота. Смесь охлаждают до 0 С и добавляют водный формальдегид (35 мл, 0,48 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин, затем при комнатной температуре в течение 5 ч. Реакцию прекращают насыщенным водным карбонатом калия (5 мл). Легкие фазы удаляют в вакууме, затем осадок фракционируют между дихлорметаном и водой. Водную фазу далее экстрагируют дихлорметаном (х 3). Объединенные экстракты сушат (Na2SO4), фильтруют и выпаривают. Осадок очищают хроматографией на силикагеле, элюируя дихлорметан/метанол/аммиаком (95:5:0,592:7:1) для получения целевого амина (130 мг, 100%) в виде бесцветного твердого вещества. Продукт перекристаллизовывают из этилацетата: т. пл. 186188 С. 1 Н ЯМР (360 мГц, СDСl3)2.57 (3 Н, с),2.84 (2 Н, т. J = 5.7 Гц), 3-27-3.31 (2 Н, м), 3.61(2 Н, ш.с), 5.59 (2 Н. с), 7.28 (1 Н, д.д, J = 6.7, 4.9 Гц), 7.45-7.52 (4 Н, м), 7.75 (1 Н, т.д, J = 7.8, 1.8 Гц), 8.35 (2 Н, д.д, J = 8.3, 1.8 Гц), 8.64-8.68 (1 Н,м). MS (ES+) m/e 373 [МН]+. Анал. установлено С, 67.95; Н, 5.57; N,22.43. C21H20N6O найдено С, 67.73; Н, 5.41; N. 22.57%. Пример 20. 0,45 Гидрат 3-фенил-6(пиридин-2-илметокси)-7-(тиофен-2-ил)-1,2,4 триазоло[4,3-b]пиридазина. Соединение получают, используя методику, описанную в стадиях а), б) и в) примера 16,только здесь используют 2-тиофенборную кислоту вместо дилитиевой соли 4-пиридилборной кислоты на стадии а) и на стадии б) вместо 0,1 эквивалента используют 1,1 эквивалента р 51 толуолсульфоновой кислоты. Показатели целевого соединения: 1 Н ЯМР (250 мГц, CDCl3)5.74 (2 Н, с),7.18 (1 Н, д.д, J = 5.2, 3.8 Гц), 7.28-7.34 (1 Н, м),7.50-7.58 (5 Н, м), 7.74-7.77 (2 Н, м), 8.28 (1 Н, с),8.38-8.42 (2 Н, м), 8.68-8.72 (1 Н, м). MS (ES+) m/e 386 [МН]+. Анал. установлено С, 64.46; Н, 4.16; N,17.63. C21H15N5OS0,45 Н 2O0,05 (С 4 Н 10 О) найдено С, 64.10; Н, 3.82; N, 17.35%. Пример 21. 0,2 Гидрат 3-фенил-6(пиридин-2-илметокси)-7-(тиофен-3-ил)-1,2,4 триазоло[4,3-b]пиридазина. Соединение получают по методике стадий а), б) и в) примера 16, за исключением того, что на стадии а) используют 3-тиофенборную кислоту вместо дилитиевой соли 4-пиридилборной кислоты, и 1,1 эквивалента р-толуенсульфоновой кислоты используют на стадии б) вместо 0,1 эквивалента. Показатели целевого соединения: 1(2 Н, м), 8.58 (1H, ш.с, J = 5.6 Гц). MS (ES+) m/e 386 [MH]+. Анал. установлено С, 64.83; Н, 4.11; N,17.78. C21H15N5OS0,2 Н 2O0,07 (С 4 Н 10 О) найдено С, 65.04; Н, 3.69; N, 17.38%. Пример 22. -3-Фенил-6-(2-пиридил) метилокси-7,8,9,10-тетрагидро-(7,10-пропано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии а) используют ангидрид бицикло[3.2.2]нон-6-ен-6,7 дикарбоновой кислоты (J. Chem. Soc., 2524,1970) вместо ангидрида бицикло[2.2.2]окт-2-ен 2,3-дикарбоновой кислоты. Показатели целевого соединения: т. пл. = 187 С. 1 Н ЯМР (360 мГц, CDCl3)1.42-2.19 (10 Н,м), 3.56 (1H, с), 3.98 (1H, с), 5.60 (2 Н, с), 7.28(1H, м), 7.48 (4 Н, м), 7.74 (1H, м), 8.38 (2 Н, д. J = 7.8 Гц), 8.66 (1H, м); MS (ES+) m/e 398 [МH]+. Анал. установлено С, 72.93; Н, 5.85; N,17.64. C24H23N5O найдено С, 72.52; Н, 5.83; N,17.62%. Пример 23. 3-(4-Метил)фенил-6-(2-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии в) 4 толуилгидразид используют вместо бензоилгидразина. Показатели целевого соединения: т. пл. = 167 С. 1 Н ЯМР (360 мГц, ДМСО)1.40 (4 Н, м),1.90 (4 Н, м), 2.40 (3 Н, с), 3.48 (1 Н, с), 3.74 (1 Н,с), 5.57 (2 Н. с), 7.36 (3 Н, м), 7.57 (1 Н, д, J = 7.8 Гц), 7.87 (1H, д.д, J = 7.8, 7.8 и 1.7 Гц), 8.14 (2 Н,д, J = 8.2 Гц), 8.68 (1H, м); MS (ES+) m/e 398 52 Анал. установлено С, 72.37; Н, 5.73; N,17.62. C24H23N5O найдено С, 72.52; Н, 5.83; N,17.62%. Пример 24. 3-(3-Метокси)фенил-6-(2 пиридил)метилокси-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии в) используют 3-метоксибензгидразид вместо бензоилгидразида. Показатели целевого соединения: т. пл. = 185 С. 1 Н ЯМР (360 мГц, ДМСО)1.40 (4 Н, м),1.91 (4 Н, м), 3.49 (1H, с), 3.76 (1H, с), 3.85 (3 Н,с), 5.59 (2 Н, с), 7.08 (1H. м), 7.37 (1H, м), 7.47(2 Н, м), 7.96 (1H, м), 8.64 (1H, м); MS (ES+) m/e 414 [МН]+. Анал. установлено С, 69.36; Н, 5.65; N,16.58. C24H23N5O2 найдено С, 69.72; Н, 5.61; N,16.94%. Пример 25. 3-(2-Фтор)фенил-6-(2-пиридил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии в) используют 2-фторобензгидразид вместо бензоилгидразина. Показатели целевого соединения: т. пл. = 159 С. 1(ES+) m/e 402 [МH]+. Анал. установлено С, 68.81; Н, 4.81; N,17.17. С 23 Н 20FN5O найдено С, 68.81; Н, 5.02; N,17.45%. Пример 26. 3-(3-Пиридил)-6-(2-пиридил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии в) используют гидразид никотиновой кислоты вместо бензоилгидразина. Показатели целевого соединения: т. пл. = 198 С. 1 Н ЯМР (360 мГц, CDCl3)1.49 (4 Н, м),1.96 (4 Н, м), 3.59 (1H, с), 3.99 (1 Н, с), 5.61 (2 Н,с), 7.28 (1 Н, м), 7.49 (2 Н, м), 7.78 (1 Н, м), 8.72(3 Н, м), 9.69 (1 Н, с); MS (ES+) m/e 385 [МН]+. Анал. установлено С, 67.56; Н, 5.66; N,19.51. C22H20N6O найдено С, 67.27; Н, 5.65; N,19.61%. Пример 27. 3-Циклопропил-6-(2-пиридил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии в) используют гидразид циклопропанкарбоновой кислоты вместо бензоилгидразина. Показатели целевого соединения: т. пл. = 160 С. 1 Н ЯМР (360 мГц, CDCl3)1.09 (2 Н, м),1.31 (2 Н, м), 1.44 (4 Н, м), 1.89 (4 Н, м), 2.38 (1 Н, 53 м), 3.52 (1H, с), 3.90 (1H, с), 5.57 (2 Н, с), 7.28(1H, м); MS (ES+) m/e 348 [МН]+. Анал. установлено С, 69.12; Н, 5.85; N,20.19. C20H21N5O найдено С, 69.14; Н, 6.09; N,20.16%. Пример 28. Гидрохлорид 6-6-метил)-2 пиридил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазина. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 6-метил-2-гидроксиметилпиридин вместо 2-пиридилкарбинола. Дополнительная стадия в конце синтеза состоит в том, что соединение растворяют в растворе хлорида водорода в метаноле перед выпариванием и перекристаллизацией. Показатели целевого соединения: т. пл. = 255 С. 1N, 14.89%. Пример 29. 6-3-Метил)-2-пиридил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только в стадии г) используют 3-метил-2-гидроксиметилпиридин вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 245 С. 1(1 Н, д, J = 7.1 Гц); MS (ES+) m/e 398 [МН]+. Анал. установлено С, 72.09; Н, 5.76; N,17.79. С 24H23N5O0,1 Н 2O найдено С, 72.20; Н,5.86; N, 17.54%. Пример 30. 6-4-Метил)-2-пиридил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 4-метил-2-гидроксиметилпиридин вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 190 С. 1 Н ЯМР (360 мГц, СDСl3)1.49 (4 Н, м),1.93 (4 Н, м), 2.39 (3 Н, с), 3.58 (1 Н, с), 3.99 (1 Н,с), 5.59 (2 Н, с), 7.13 (1 Н, д, J = 7.3 Гц), 7.35 (1 Н,с), 7.50 (3 Н, м), 8.41 (2 Н, д, J = 7.8 Гц), 8.51 (1 Н,д, J = 7.3 Гц); MS (ES+) m/e 398 [МН]+. Анал. установлено С, 72.91; Н, 5.78; N,17.32. C24H23N5O найдено С, 72.52; Н, 5.83; N,17.62%. Пример 31. 6-5-Метил)-2-пиридил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. 54 Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 5-метил-2-гидроксиметилпиридин вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 205 С. 1 Н ЯМР (360 мГц, CDCl3)1.48 (4 Н, м),1.92 (4 Н, м), 2.38 (3 Н, с), 3.56 (1 Н, с), 3.99 (1H,с), 5.58 (5 Н, с), 8.45 (3 Н, м); MS (ES+) m/e 398[МН]+. Анал. установлено С, 72.66; Н, 5.72; N,17.32. C24H23N5O найдено С, 72.52; Н, 5.83; N,17.62%. Пример 32. 3-Фенил-6-(3-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этанo)-1,2,4 триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 3-пиридилкарбинол вместо 2 пиридилкарбинола. Показатели целевого соединения: т. пл. = 202 С. 1 Н ЯМР (360 мГц, ДМСО)1.39 (4 Н, м),1.90 (4 Н, м), 3.40 (1H, с), 3.74 (1H, с), 5.58 (2 Н,с), 7.46 (1H, м), 7.56 (3 Н, м), 7.97 (1H, д, J = 7.8 Гц), 8.36 (2 Н, д, J = 7.9 Гц), 8.58 (1H, м), 8.77(1H, м); MS (ES+) m/e 384 [МН]+. Анал. установлено С, 72.70; Н, 5.49; N,18.19. C24H21N5O найдено С, 72.04; Н, 5.52; N,18.26%. Пример 33. 3-Фенил-6-(4-пиридил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4 триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 4-пиридилкарбинол вместо 2 пиридилкарбинола. Показатели целевого соединения: т. пл. = 205 С. 1 Н ЯМР (360 мГц, СDСl3)1.49 (4 Н, м),1.95 (4 Н, м), 3.55 (1H, с), 3.99 (1H, с), 5.49 (2 Н,с), 7.41 (2 Н, д, J = 6.0 Гц), 7.49 (3 Н, м), 8.32 (2 Н,д, J = 7.8 Гц), 8.69 (2 Н, д, J = 6.0 Гц); MS (ES+)m/e 384 [МН]+. Анал. установлено С, 71.29; Н, 5.16; N. 17.82. C24H21N5O0,1 H2O найдено С, 71.70; Н,5.54; N, 18.18%. Пример 34. 3-Фенил-6-(2-(1-метил)имидазолил)метилокси-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 1-метил-2-гидроксиметилимидазол вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 274 С. 1 55 Пример 35. 6-(3-Цианофенил)метилокси-3 фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4 триазоло[3,4-а]фталазин. а) 6-Гидрокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4-триазоло[3,4-а]фталазин. Продукт по стадии в) примера 1 (3,0 г, 9,6 ммоль) растворяют в 10% водном 1,4-диоксане(100 мл) с раствором гидроксида натрия (24 мл на 2N, 5 моляр. экв.), и реакционную смесь нагревают с обратным холодильником в течение 3 дней. Органический растворитель удаляют при помощи ротационного выпаривания и остаток фракционируют между водой (250 мл) и диэтиловым эфиром (250 мл). Водный слой отделяют и еще дважды промывают диэтиловым эфиром(100 мл), затем обрабатывают 5N соляной кислотой до достижения рН, равного 2. Выделившийся из раствора осадок собирают фильтрованием получая нужный продукт (2.7 г, т. пл.300 С, dec.). 1 Н ЯМР (250 мГц, СDСl3)1.35 (4 Н, м),2.00 (4 Н, м), 3.49 (1 Н, с), 3.84 (1 Н, с), 7.71 (3 Н,м), 8.54 (2 Н, д, J = 7.8 Гц); MS (ES+) m/e 293[3,4-а]фталазин. Продукт по стадии а) примера 35 (0,3 г,1,02 ммоль) растворяют в диметилформамиде(0,22 г, 1,1 мол. экв.) и продолжают нагревание еще 14 ч. Воду добавляют вплоть до помутнения раствора, и образовавшийся осадок собирают фильтрацией, затем очищают хроматографией на силикагеле, используя 0-30% этилацетат в дихлорметане в качестве элюента. Продукт перекристаллизовывают из этилацетата заданного соединения (0,22 г). Показатели целевого соединения: т. пл. = 216 С. 1m/e 408 [MH]+. Анал. установлено С, 64.54; Н, 4.98; N,17.79. C21H19N5OS найдено С, 64.76; Н, 4.92; N,17.98%. Пример 36. 6-(1-(3,5-Диметил)пиразолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) используют 1-гидроксиметил-3,5-диметилпиразол вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 210 С.(3 Н, м), 8.51 (2 Н, д, J = 7.8 Гц); MS (ES+) m/e 401 [MH]+. Анал. установлено С, 69.32; Н, 6.07; N,21.01. C23H24N6O найдено С, 68.98; Н, 6.04; N,20.99%. Пример 37. 6-(4-(2-Метил)тиазолил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют 4-хлорметил-2 метилтиазол. Показатели целевого соединения: т. пл. = 180 С. 1 Н ЯМР (360 мГц, CDCl3)1.47 (4 Н, м),1.91 (4 Н, м), 2.76 (3 Н, с), 3.53 (1 Н, с), 4.00 (1 Н,с), 5.55 (2 Н, с), 7.26 (1 Н, с), 7.52 (3 Н, м), 8.48(2 Н, д, J = 7.8 Гц); MS (ES+) m/e 404 [MH]+. Анал. установлено С, 65.82; Н, 5.17; N,17.25. C24H21N5OS найдено С, 65.49; Н, 5.25; N,17.36%. Пример 38. 3-Фенил-6-(2-хиноксалинил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют 2-хлорметилхиноксалин. Показатели целевого соединения: т. пл. = 250 С. 1(1 Н, с); MS (ES+) m/e 435 [МН]+. Анал. установлено С, 71.15; Н, 5.10; N, 18.66. C26H22N6O0,375 Н 2O найдено С, 70.77; Н, 5.20; N, 19.05%. Пример 39. 3-Фенил-6-(3-пиридазинил)метилокси-7,8,9,10-тетрагидро-(7,10-этано)-1,2,4 триазоло[3,4-а]фталазин. Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют 3-хлорметилпиридазин (полученный согласно Jeronim et al.,Chem. Веr., 1987, 120, 649-651). 3-Хлорметилпиридазин является нестабильным реагентом и склонен к полимеризации при нагревании,поэтому реакцию проводят сразу же после формирования алкилирующего агента. Показатели целевого соединения: т. пл. = 215 С. 1 Н ЯМР (360 МГц, CDCl3)1.49 (4 Н, м),1.91 (4 Н, м), 3.54 (1 Н, с), 4.01 (1 Н, с), 5.85 (2 Н,с), 7.54 (4 Н, м), 7.71 (1 Н, д.д, J = 8.5 и 1.7 Гц),8.36 (2 Н, д, J = 7.8 Гц), 9.22 (1 Н, д.д, J = 4.9 и 1.7 Гц); MS (ES+) m/e 385 [MH]+. Анал. установлено С, 68.60; Н, 5.31; N,21.65. C22H20N6O найдено С, 68.73; Н, 5.24; N,21.86%. Пример 40. 6-(1-Бензил-2-имидазолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. 1 57 Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) 1 бензил-2-(гидроксиметил)имидазол (полученный по методике Birker, Godefroi, Helder and[МН]+. Анал. установлено С, 71.49; Н, 5.62; N,17.82. C28H26N6O0,5 H2O найдено С, 71.32; Н,5.77; N, 17.82%. Пример 41. 3-Фенил-6-(изохинолин-1-ил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют 1-хлорметилизохинолин. Показатели целевого соединения: т. пл. = 230 С. 1 Н ЯМР (360 мГц, CDCl3)1.45 (4 Н, м),1.88 (4 Н, м), 3.45 (1 Н, с), 3.97 (1 Н, с), 6.09 (2 Н,с), 7.43 (3 Н, м), 7.71 (3 Н, м), 7.93 (1 Н, д, J = 8.2 Гц), 8.24 (1 Н, д, J = 8.4 Гц), 8.42 (2 Н, м), 8.58(1 Н, д, J = 6.2 Гц); MS (ES+) m/e 434 [MH]+. Анал. установлено С, 75.04; Н, 5.25; N,16.40. С 27 Н 23N5O найдено С, 74.81; Н, 5.35; N,16.16%. Пример 42. 6-(1-Этил-2-имидазолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) 1 этил-2-(гидроксиметил)имидазол (полученный по методике Tasaka, Teranishi, Matsushita, Tamura, Hayashi, Okanogi and Itoh, Chem. Pharm.H ЯМР (500 мГц, ДМСО)1.34 (3 Н, т, J = 7.2 Гц), 1.36 (4 Н, м), 1.87 (4 Н, м), 3.28 (1 Н, с),3.74 (1 Н, с), 5.58 (2 Н, кв, J = 7.2 Гц), 5.55 (2 Н, с),6.96 (1 Н, с), 7.33 (1 Н, с), 7.58 (3 Н, м), 8.50 (2 Н,м); MS (ES+) m/e 401 [МН]+. Анал. установлено С, 68.98; Н, 6.07; N,20.74. C23H24N6O найдено С, 68.98; Н, 6.04; N,20.99%. Пример 43. 3-Фенил-6-(1-пиразолил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) вместо 2-пиридилкарбинола используют 1(гидроксиметил)пиразол (полученный по методике Julia, Martinez-Martorell and Elguero, Heterocycles, 1986, 24, 2233). На конечной стадии необходимо добавить продукт по стадии в) од 002436 58 новременно с гидридом натрия, чтобы в результате получить заданный продукт. Показатели целевого соединения: т. пл. = 196 С. 1(2 Н, м); MS (ES+) m/e 373 [MH]+. Анал. установлено С, 67.73; Н, 5.42; N,22.48. C21H20N6O найдено С, 67.73; Н, 5.41; N,22.57%. Пример 44. 3-Фенил-6-(N-пирролидинилкарбонил)метилокси-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. а) N-Хлорметилкарбонилпирролидин. К раствору пирролидина (5 г, 0,07 моль) в дихлорметане (100 мл) при 0 С добавляют триэтиламин (11,8 мл, 0,084 моль), после чего добавляют по каплям хлорацетилхлорид (6,2 мл,0,077 моль) в дихлорметане (20 мл), перемешивают 2 ч, оставляют нагреваться до комнатной температуры. Реакционную смесь промывают водой (2100 мл), рассолом (1100 мл), органические слои высушивают (MgSO4), фильтруют и выпаривают для получения остаточного продукта (9,8 г), который используют без очистки. б) 3-Фенил-6-(N-пирролидинкарбонил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют(3 Н, м), 8.29 (2 Н, м); MS (ES+) m/e 404 [МН]+. Анал. установлено С, 68.12; Н, 6.23; N,17.03. C23H25N5O2 найдено С, 68.47; Н, 6.24; N,17.36%. Пример 45. 6-(4-(3-Метил)пиридил)метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают по методике стадий а), б), в) и г) примера 1, только на стадии г) вместо 2-пиридилкарбинола используют 4 гидроксиметил-3-метилпиридин. Показатели целевого соединения: т. пл. = 226 С. 1 59 Соединение получают по методике стадии б) примера 35, только вместо -бром-метатолуонитрила используют 2-хлорметилхинолин. Показатели целевого соединения: т. пл. = 203 С. 1 Н ЯМР (360 мГц, CDCl3)1.51 (4 Н, м),1.95 (4 Н, м), 3.61 (1 Н, с), 4.00 (1H, с), 5.80 (2 Н,с), 7.44 (3 Н, м), 7.53 (2 Н, м), 7.82 (2 Н, м), 8.30(30 мл) при 0 С, перемешивая, добавляют борогидрид натрия (0,42 г). При 0 С раствор перемешивают в течение 40 мин. Добавляют насыщенный раствор хлорида натрия (15 мл), и смесь перемешивают при комнатной температуре 15 мин. Метанол удаляют в вакууме и полученный водный раствор промывают этилацетатом (350 мл). Органические слои объединяют,высушивают (сульфатом натрия) и концентрируют в вакууме до получения масла, которое кристаллизуется при 0 С. Твердое вещество промывают и перекристаллизовывают из гексана, чтобы получить 1-2-(триметилсилил) этокси]метил]-2-(гидроксиметил)имидазол в виде бесцветных кристаллов (1,99 г). 1m/e 229 [МН]+. б) Гидрохлорид 6-(2-имидазолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазина. Соединение получают, используя методику стадий а), б), в) и г) примера 1, только на стадии г) вместо 2-пиридилкарбинола используют 1-2-(триметилсилил)этокси]метил]-2-(гидроксиметил)имидазол. Дополнительная стадия заключается в том, что продукт стадии г) перемешивают при 50 С в 5N соляной кислоте в течение 90 мин перед его выпариванием и перекристаллизацией из этилацетата/метанола. Показатели целевого соединения: т. пл. = 219 С (дец.). 1 Н ЯМР (360 мГц, ДМСО)1.42 (4 Н, м),1.91 (4 Н, м), 3.51 (1H, с), 3.78 (1H, с), 5.84 (2 Н,с), 7.59 (3 Н, м), 7.76 (2 Н, с), 8.23 (2 Н, м); MS 60 Пример 48. 3-Фенил-6-(2-тиазолил) метилокси-7,8,9,10-тетрагидро-(7,10-этано)1,2,4-триазоло[3,4-а]фталазин. Соединение получают, используя методику стадий а), б), в) и г) примера 1, только на стадии г) 2-гидроксиметилтиазол используют вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 183 С. 1 Н ЯМР (360 мГц, СDСl3)1.48 (4 Н, м),1.92 (4 Н, м), 3.51 (1H, с), 3.99 (1H, с), 5.49 (2 Н,с), 7.52 (4 Н, м), 7.69 (2 Н, м), 7.81 (1H, м), 8.35(2 Н, д, J = 7.8 Гц); MS (ES+) m/e 390 [МH]+. Анал. установлено С, 73.93; Н, 5.17; N,17.37. C25H21N5O найдено С, 73.68; Н, 5.19; N,17.19%. Пример 49. 6-(2-(5-Метил)тиазолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают, используя методику стадий а), б), в) и г) примера 1, только на стадии г) 2-гидроксиметил-5-метилтиазол используют вместо 2-пиридилкарбинола. Показатели целевого соединения: т. пл. = 228 С. 1 Н ЯМР (360 мГц, CDCl3)1.47 (4 Н, м),1.93 (4 Н, м), 2.50 (3 Н, с), 3.53 (1H, с), 3.99 (1H,с), 5.74 (2 Н, с), 6.95 (1H, с), 7.51 (3 Н, м), 8.45(2 Н, д, J = 7.8 Гц); MS (ES+) m/e 404 [МН]+. Анал. установлено С, 65.92; Н, 5.30; N,17.21. C22H21N5OS найдено С, 65.49; Н, 5.25; N,17.36%. Пример 50. 6-(2-(4-Мeтил)тиазолил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают, используя методику стадий а), б), в) и г) примера 1, только на стадии г) вместо 2-пиридилкарбинола используют 2-гидроксиметил-4-метилтиазол. Показатели целевого соединения: т. пл. = 165 С. 1 Н ЯМР (360 МГц, CDCl3)1.47 (4 Н, м),1.92 (4 Н, м), 2.49 (3 Н, с), 3.52 (1H, с), 3.98 (1H,с), 5.70 (2 Н, с), 7.49 (4 Н, м), 8.46 (2 Н, д, J = 7.9 Гц); MS (ES+) m/e 404 [MH]+.Aнaл. установлено С, 65.92; Н, 5.33; N,17.09. C22H21N5OS найдено С, 65.49; Н, 5.25; N,17.36%. Пример 51. 6-(2-(3,5-Диметил)пиридил) метилокси-3-фенил-7,8,9,10-тетрагидро-(7,10 этано)-1,2,4-триазоло[3,4-а]фталазин. Соединение получают используя методику стадий а), б), в) и г) примера 1, только на стадии г) 2-гидроксиметил-3,5-диметилпиридин (полученный по методике Boekelheide and Linn, J.Am. Chem. Soc., 1954, 76, 1286) используют вместо 2-пиридилкарбинола. Показатели целевого соединения : т. пл. = 199 С. 1
МПК / Метки
МПК: C07D 487/00, A61P 25/00, A61K 31/5025
Метки: рецепторов, замещенные, гамк, производные, триазоло-пиридазина, лигандов, качестве
Код ссылки
<a href="https://eas.patents.su/30-2436-zameshhennye-proizvodnye-triazolo-piridazina-v-kachestve-ligandov-receptorov-gamk.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные триазоло-пиридазина в качестве лигандов рецепторов гамк</a>
Предыдущий патент: Способ снижения уровня липопротеина (а) в сыворотке или в плазме крови млекопитающих
Следующий патент: Фармацевтические композиции, содержащие ламивудин и зидовудин.
Случайный патент: Каннабиноидная фармацевтическая композиция и способы ее получения и введения












