Гетероарилзамещенные пирроло[2,3-b]пиридины и пирроло[2,3-b]пиримидины в качестве ингибиторов янус-киназы
Номер патента: 19504
Опубликовано: 30.04.2014
Авторы: Вадди Кришна, Джаллури Рави Кумар, Рафальски Мария, Шепард Стейси, Мадускуи Томас П., Роджерс Джеймс Д., Арванитис Аргириос Г., Ван Хайшэн, Фридман Джордан С., Фалахатпишех Нику, Сторейс Льюис
Формула / Реферат
1. Соединение формулы
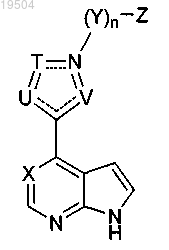
или его фармацевтически приемлемая соль, где
Т, U и V независимо выбирают из О, S, N, CR5 и NR6;
где 5-членное кольцо, образованное атомом углерода, атомом азота, U, Т и V, является ароматическим;
X представляет собой N или CR4;
n равно 0 или
n равно 1 и Y представляет собой C1-8 алкилен, С2-8 алкенилен, (CR11R12)pС(О)(CR11R12)q, (CR11R12)РС(О)NRC(CR11R12)q, (CR11R12)pC(O)O(CR11R12)q или (CR11R12)pOC(O)(CR11R12)q, где указанные С1-8 алкилен или С2-8 алкенилен необязательно замещены 1, 2 или 3 заместителями, выбранными из галогена, ОН, CN, амино, C1-4 алкиламино или С2-8 диалкиламино;
Z представляет собой арил, циклоалкил, гетероарил или гетероациклоалкил, каждый из которых необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С2-4 алкенила, С2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Су1, CN, NO2, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb и S(O)2NRcRd;
Су1 независимо выбирают из арила, гетероарила, циклоалкила и гетероциклоалкила, каждый из которых необязательно является замещенным 1, 2, 3, 4 или 5 заместителями, независимо выбранными из галогена, C1-4 алкила, С2-4 алкенила, С2-4 алкинила, C1-4 галогеналкила, CN, NO2, ORa", SRa", C(O)Rb", C(O)NRc"Rd", C(O)ORa", OC(O)Rb", OC(O)NRc"Rd", NRc"Rd", NRc"C(O)Rb", NRc"C(O)ORa", S(O)Rb", S(O)NRc"Rd", S(O)2Rb" и S(O)2NRc"Rd";
R4 независимо выбирают из Н;
R5 представляет собой Н, галоген, C1-4 алкил, С2-4 алкенил, С2-4 алкинил, C1-4 галогеналкил, CN, NO2, OR7, SR7, C(O)R8, C(O)NR9R10, C(O)OR7, OC(O)R8, OC(O)NR9R10, NR9R10, NR9C(O)R8, NR9C(O)OR7, S(O)R8, S(O)NR9R10, S(O)2R8, NR9S(O)2R8 и S(O)2NR9R10;
R6 представляет собой Н, C1-4 алкил, С2-4 алкенил, С2-4 алкинил, C1-4 галогеналкил, OR7, C(O)R8, C(O)NR9R10, С(O)OR7, S(O)R8, S(O)NR9R10, S(O)2R8 или S(O)2NR9R10;
R7 представляет собой Н, C1-6 алкил, C1-6 галогеналкил, С2-6 алкенил, С2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил;
R8 представляет собой Н, C1-6 алкил, C1-6 галогеналкил, С2-6 алкенил, С2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил;
R9 и R10 независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С2-6 алкенила, С2-6 алкинила, C1-6 алкилкарбонила, арилкарбонила, C1-6 алкилсульфонила, арилсульфонила, арила, гетероарила, циклоалкила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила;
или R9 и R10 вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу;
R11 и R12 независимо выбирают из Н, галогена, ОН, CN, H, C1-4 алкила, C1-4 галогеналкила, С2-4 алкенила, С2-4 алкинила, C1-4 гидроксиалкила, C1-4 цианоалкила, арила, гетероарила, циклоалкила и гетероциклоалкила;
Ra и Ra'' представляют собой Н, C1-6 алкил, C1-6 галогеналкил, С2-6 алкенил, С2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил и гетороциклоалкилалкил,
где указанный C1-6 алкил, C1-6 галогеналкил, С2-6 алкенил или С2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил и гетороциклоалкилалкил являются необязательно замещенными 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;
Rb и Rb" независимо выбирают из Н, C1-6 алкила, C1-6 галогеналкила, С2-6 алкенила, С2-6 алкинила, арила, циклоалкила, гетероарила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где указанный C1-6 алкил, C1-6 галогеналкил, С2-6 алкенил, С2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;
Rc и Rd независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С2-6 алкенила, С2-6 алкинила, где указанный C1-10 алкил, C1-6 галогеналкил, С2-6 алкенил или С2-6 алкинил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из Cy1, -(C1-6 алкил)-Cy1, ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 галогеналкила, арила, аралкила, гетероарила, гетероарилалкила, циклоалкила или гетероциклоалкила;
или Rc и Rd вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу, необязательно замещенную 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, арила, аралкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;
Rc" и Rd" независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С2-6 алкенила, С2-6 алкинила, арила, гетероарила, циклоалкила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где указанный C1-10 алкил, C1-6 галогеналкил, С2-6 алкенил, С2-6 алкинил, арил, гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, C1-6 галогеналкила, арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;
или Rc" и Rd" вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу, необязательно замещенную 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, С1-6 галогеналкила, C1-6 галогеналкила, арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;
р равно 0, 1, 2, 3, 4, 5 или 6; и
q равно 0, 1, 2, 3, 4, 5 или 6;
где "арил" относится к моноциклическим или полициклическим ароматическим углеводородам, которые содержат от 6 до примерно 20 атомов углерода;
"гетероарил" относится к моноциклическому или полициклическому ароматическому гетероциклу, имеющему от 1 до 4 гетероатомов в кольце, выбранных из серы, кислорода или азота, содержащему от 1 до примерно 20 атомов углерода;
"циклоалкил" относится к моно- или полициклическим неароматическим циклическим углеводородам, которые включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил, норборнил, норпинил, норкарнил или адамантил;
"гетероциклоалкил" относится к моноциклическим или полициклическим неароматическим гетероциклам, имеющим от 1 до 4 гетероатомов в кольце и включающим от 3 до 20 атомов углерода;
"арилалкил" относится к алкилу, замещенному арилом, при этом алкил содержит от 1 до 6 атомов углерода;
"циклоалкилалкил" относится к алкилу, замещенному циклоалкилом, при этом алкил содержит от 1 до 6 атомов углерода;
"гетероарилалкил" относится к алкилу, замещенному гетероарилом, имеющему от 1 до 4 гетероатомов в кольце, выбранных из серы, кислорода или азота, при этом алкил содержит от 1 до 6 атомов углерода; и
"гетероциклоалкилалкил" относится к алкилу, замещенному гетероциклоалкилом, при этом алкил содержит от 1 до 6 атомов углерода.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой N.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где X представляет собой CR4.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где 5-членное кольцо, образованное атомом углерода, атомом азота, U, Т и V, представляет собой пирролил, пиразолил или имидазолил.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 0.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 1.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 1 и Y представляет собой C1-8 алкилен, (CR11R12)pC(O)(CR11R12)q, (CR11R12)pC(O)NRc(CR11R12)q или (CR11R12)pC(О)О(CR11R12)q, где указанный C1-8 алкилен необязательно является замещенным 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С2-8 диалкиламино.
8. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 1 и Y представляет собой C1-8 алкилен, необязательно замещенный 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С2-8 диалкиламино.
9. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 1 и Y представляет собой ((CR11R12)pC(O)(CR11R12)q, (CR11R12)pC(O)NRc(CR11R12)q или ((CR11R12)pC(O)O(CR11R12)q.
10. Соединение по п.1 или его фармацевтически приемлемая соль, где р равно 0.
11. Соединение по п.1 или его фармацевтически приемлемая соль, где р равно 1.
12. Соединение по п.1 или его фармацевтически приемлемая соль, где р равно 2.
13. Соединение по п.1 или его фармацевтически приемлемая соль, где q равно 0.
14. Соединение по п.1 или его фармацевтически приемлемая соль, где q равно 1.
15. Соединение по п.1 или его фармацевтически приемлемая соль, где q равно 2.
16. Соединение по п.1 или его фармацевтически приемлемая соль, где один из р и q равен 0, а другой из р и q равен 1, 2 или 3.
17. Соединение по п.1 или его фармацевтически приемлемая соль, где Z представляет собой циклоалкил, который необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С2-4 алкенила, С2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Cy1, CN, NO2, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb и S(O)2NRcRd.
18. Соединение по п.17 или его фармацевтически приемлемая соль, где n равно 1.
19. Соединение по п.17 или его фармацевтически приемлемая соль, где n равно 0.
20. Соединение по п.1 или его фармацевтически приемлемая соль, где Z представляет собой гетероциклоалкил, который необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С2-4 алкенила, С2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Cy1, CN, NO2, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb и S(O)2NRcRd.
21. Соединение по п.20 или его фармацевтически приемлемая соль, где n равно 1.
22. Соединение по п.20 или его фармацевтически приемлемая соль, где n равно 0.
23. Соединение по п.1 или его фармацевтически приемлемая соль, где Z является замещенным по крайней мере одним заместителем, включающим по крайней мере одну CN группу.
24. Соединение по п.1 или его фармацевтически приемлемая соль, где R5 представляет собой Н, галоген, C1-4алкил, C1-4 галогеналкил, CN или NR9R10.
25. Соединение по п.1 или его фармацевтически приемлемая соль, где R5 представляет собой Н.
26. Соединение по п.1 или его фармацевтически приемлемая соль, где R6 представляет собой Н или C1-4 алкил.
27. Соединение по п.1 или его фармацевтически приемлемая соль, где R6 представляет собой Н.
28. Соединение по п.1 или его фармацевтически приемлемая соль, имеющее формулу
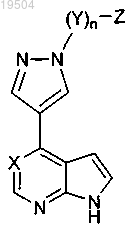
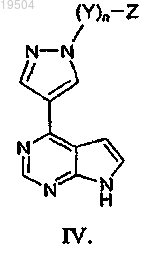
29. Соединение по п.1 или его фармацевтически приемлемая соль, имеющее формулу IV
30. Соединение по п.1, выбранное из
4-[1-(1-метил-3-пиразол-1-илпропил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(3-имидазол-1-ил-1-метилпропил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-циклопентил-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)пиразол-1-ил]бутиронитрила;
3-циклопентил-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-циклогексил-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-циклогексил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-циклопропил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутаннитрила;
3-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклопропилпропаннитрила;
1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклопропилацетонитрила;
4-1-[пирролидин-2-илметил]-1Н-пиразол-4-ил-7Н-пирроло[2,3-d]пиримидина;
4-(1-[1-(метилсульфонил)пирролидин-2-ил]метил-1Н-пиразол-4-2-ил)-7Н-пирроло[2,3-d]пиримидина;
3-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]акрилонитрила;
3-(2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил)циклопентанкарбонитрила;
3-[3-(гидроксиметил)циклопентил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-(1-бензил-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-[1-(2-нафтилметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-(1-фенил-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-{1-[1-метилбутил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-метил-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-[1-(3,5-диметоксибензил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(1-фенилэтил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(циклогексилметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
3-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}бензонитрила;
2-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}бензонитрила;
4-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}бензонитрила;
1-фенил-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]этанона;
4-{1-[(5-метилизоксазол-3-ил)метил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[1-(тетрагидро-2Н-пиран-2-илметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-(1-циклогекс-2-ен-1-ил-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-(1-циклогексил-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4'-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}бифенил-2-карбонитрила;
4-[1-(2-нитробензил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-{1-[2,6-дихлор-4-(трифторметил)фенил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[1-(3-нитробензил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2-бромбензил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
N-фенил-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропанамида;
4-{1-[3-(трифторметокси)бензил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-{1-[2-фтор-5-(трифторметил)бензил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-{1-[3-(трифторметил)бензил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[1-(пиридин-3-илметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-{1-[1-фенилбутил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
1-фенил-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропан-1-она;
4-[1-(2,6-дихлорбензил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2,6-диметилфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-5-(трифторметил)бензонитрила;
4-[1-(4-бром-3,5,6-трифторпиридин-2-ил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(циклопропилметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2,5-диметилфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2-метилфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2-метоксифенил)-1Н-пиразол-4-ил]-1Н-пирроло[2, 3-b]пиридина;
3-{1-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
3-хлор-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-[1-(1-циклогексилэтил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-фтор-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
2-фтор-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
3-фтор-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-(1-{1-[3-(трифторметил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-[1-(3,5-диметилфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
{4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]фенил}ацетонитрила;
4-[1-(1-фенилпропил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-(1-{1-[4-(метилсульфонил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-{1-[1-(3-фтор-4-метоксифенил)этил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина,
4-(1-{1-[2-(трифторметил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-(1-{1-[3,5-бис(трифторметил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-{1-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
4-{1-[4-нитро-2-(трифторметил)фенил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
3-метил-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-[1-(2-хлорфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
3-бром-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
этил 4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензоата;
4-{1-[2-хлор-6-нитро-4-(трифторметил)фенил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-(1-{1-[4-(трифторметил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-[1-(2,3-дигидро-1Н-инден-1-ил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(1,2,3,4-тетрагидронафталин-1-ил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-(1-{1-[2-хлор-5-(трифторметил)фенил]этил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
4-{1-[1-(2,4-дихлор-5-фторфенил)этил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[1-(1-циклопентилэтил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(1-метил-3-фенилпропил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(1-циклобутилэтил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
[2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-5-(трифторметил)фенил]ацетонитрила;
[5-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-2-(трифторметил)фенил]ацетонитрила;
4-{1-[4-фенилбут-3-ен-1-ил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
[3-хлор-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-5-(трифторметил)фенил]ацетонитрила;
5-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-2-(трифторметил)бензонитрила;
4-{1-[2-хлор-4-(трифторметил)фенил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-2-(трифторметил)бензонитрила;
2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
3-хлор-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-амино-5,6-дифтор-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]изофталонитрила;
1-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}циклопропанкарбонитрила;
5-бром-2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-4-(трифторметил)бензонитрила;
2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-3-(трифторметил)бензонитрила;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-4-(трифторметил)бензамида;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]циклогексанона;
2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]циклогексанола;
4-(1-{[1-(метилсульфонил)пиперидин-4-ил]метил}-1Н-пиразол-4-ил)-1Н-пирроло[2,3-b]пиридина;
2-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]циклогексанкарбонитрила;
4-{1-[2-(трифторметил)фенил]-1Н-пиразол-4-ил}-1Н-пирроло[2,3-b]пиридина;
4-[1-(2,6-дихлорфенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
(4-{[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]метил}циклогексил)метанола;
4-[1-(тетрагидрофуран-2-илметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(1-циклопентилпропил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(тетрагидрофуран-3-илметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
2-хлор-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-3-(1,3-тиазол-5-ил)пропаннитрила;
3-(1-метил-1Н-имидазол-5-ил)-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]-3-(3-тиенил)пропаннитрила;
{1-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]циклопентил}ацетонитрила;
4-хлор-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]фталонитрила;
3-метил-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]бензальдегида;
4-[1-(2-метил-4-нитрофенил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]циклопентанона;
4-[1-(3-фурилметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
4-[1-(2-фурилметил)-1Н-пиразол-4-ил]-1Н-пирроло[2,3-b]пиридина;
3-{2-циано-1-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
{3-метил-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]фенил}метанола;
3-(1-бензофуран-2-ил)-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-фурил)-3-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
{3-метил-4-[4-(1Н-пирроло[2,3-b]пиридин-4-ил)-1Н-пиразол-1-ил]фенил}ацетонитрила;
4-метил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
4-[1-(1-циклопентилпропил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклопентил}ацетонитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-(3-тиенил)пропаннитрила;
4-хлор-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бензонитрила;
3-(3-фурил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклопентил}пропаннитрила;
{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексил}ацетонитрила;
{3-метил-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]фенил}метанола;
или его фармацевтически приемлемая соль.
31. Соединение по п.1, выбранное из
3-пиридин-4-ил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-пиридин-3-ил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(метилтио)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-метоксифенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(4-метоксифенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
{3-метил-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]фенил}ацетонитрила;
3-[4-(метилсульфинил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(метилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(цианометокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(6-хлорпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}пиридин-2 карбонитрила;
3-(3,5-диметилизоксазол-4-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[6-(трифторметил)пиридин-3-ил]пропаннитрила;
3-(6-метоксипиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-пиридин-2-ил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(6-бромпиридин-2-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
6-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}пиридин-2-карбонитрила;
3-(5-бромпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}никотинонитрила;
3-(2-метоксипиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(цианометокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[2-(цианометокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3,5-дибромфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}изофталонитрила;
3-[6-(диметиламино)пиридин-2-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(4-бром-2-тиенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}тиофен-3-карбонитрила;
3-(5-бром-2-фторфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-нитрофенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(5-бром-2-метоксифенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-4-метоксибензонитрила;
3-(3-бромфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-4-фторбензонитрила;
3-[5-бром-2-(цианометокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(4-бром-2-фурил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-(цианометокси)-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
3-(4-бромпиридин-2-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
2-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}изоникотинонитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-3-фуронитрила;
3-[2-бром-5-(цианометокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-(цианометокси)-2-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
3-пиримидин-5-ил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(2-бромпиридин-4-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}пиридин-2-карбонитрила;
3-(5-метоксипиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-хлорфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[3-(трифторметил)фенил]пропаннитрила;
3-(3-феноксифенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[3-(трифторметокси)фенил]пропаннитрила;
метил 3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензоата;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензойной кислоты;
3-[3-(1Н-пиразол-4-ил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-аминофенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)ацетамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)метансульфонамида;
4-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}тиофен-2-карбонитрила;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}тиофен-2-карбонитрила;
3-[3-(морфолин-4-илкарбонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
N-(2-аминоэтил)-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
3-(5-формил-3-тиенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-метилбензамида;
2-циано-N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)ацетамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)никотинамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-N'-изопропилмочевины;
изопропил (3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)карбамата;
3-(5-фенилпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3,3'-бипиридин-5-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(5-пиримидин-5-илпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(1-метил-1Н-пиразол-4-ил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(5-этинилпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
или его фармацевтически приемлемая соль.
32. Соединение по п.1, выбранное из
3-[5-(фенилтио)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(2-бром-1,3-тиазол-5-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(5-морфолин-4-илпиридин-3-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(1-метил-1Н-пиразол-4-ил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-пиридин-3-илфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(фенилсульфинил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(фенилсульфонил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[5-(1,3-тиазол-2-илтио)пиридин-3-ил]пропаннитрила;
3-[5-(этилтио)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-{1-[1-метил-2-(1Н-1,2,4-триазол-1-ил)этил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
1-фенил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропан-1-она;
3-[5-(этилсульфинил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(этилсульфонил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(циклогексилтио)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
1-фенил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропан-1-ола;
3-[3-(этилтио)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(этилсульфинил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(этилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(циклогексилсульфонил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(циклогексилсульфинил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-[1-(1-метил-2-фенилэтил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
4-{1-[1-метил-2-(3-тиенил)этил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
3-{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензонитрила;
4-{1-[2-(1Н-имидазол-1-ил)-1-метилэтил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
4-{1-[1-метил-2-(3-метил-1,2,4-оксадиазол-5-ил)этил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
3-[3-(метилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-(3-пиридин-4-илфенил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(изопропилтио)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(изопропилсульфинил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[5-(изопропилсульфонил)пиридин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[5-(трифторметил)пиридин-3-ил]пропаннитрила;
2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-N-[3-(трифторметил)фенил]пропанамида;
N-2-нафтил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропанамида;
N-1-нафтил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропанамида,
N-(3-цианофенил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропанамида;
N-фенил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-(4-феноксифенил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-2-нафтил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-(3-цианофенил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-бифенил-4-ил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-(бифенил-4-илметил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-(бифенил-3-илметил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
N-(4-цианофенил)-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида,
N-1-нафтил-2-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутанамида;
5-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-фенилникотинамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-3-(трифторметил)бензамида;
N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)-3-(трифторметил)бензамида;
3-[3-(метилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)бензолсульфонамида;
3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}-N-[3-(трифторметил)фенил]бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N,N-диметилбензолсульфонамида;
N-бензил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензолсульфонамида;
N-бензил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-фенилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-[3-(трифторметил)фенил]бензамида;
N-(3-цианофенил)-3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}бензамида;
N-бензил-3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}бензамида;
N-1-нафтил-3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}бензамида;
N-2-нафтил-3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}бензамида;
N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)-2-нафтамида;
N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)-1-нафтамида;
2-фенил-N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)ацетамида;
3-хлор-N-(3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}фенил)бензамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-2-нафтамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-1-нафтамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-2-фенилацетамида;
3-циано-N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)бензамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)бензамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-4-(трифторметил)бензамида;
N-(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)-N'-фенилмочевины;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-[4-(трифторметил)фенил]бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(4-метилфенил)бензамида;
N-(4-цианофенил)-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-2-нафтилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-1-нафтилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N,N-диметилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-пиридин-3-илбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-метил-N-фенилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-циклогексилбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(4-феноксифенил)бензамида;
N-(3-цианофенил)-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
N-бифенил-4-ил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
N-(4-хлорфенил)-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(3,4-диметилфенил)бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(3-метоксифенил)бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(4-метоксифенил)бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-изоксазол-3-илбензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-метил-N-фенилбензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-пропил-бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-фенил-бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-2-нафтилбензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-циклопропилбензолсульфонамида;
3-[3-(пиперидин-1-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(морфолин-4-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(4-метилфенил)бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(3,4-диметилфенил)бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(3-метоксифенил)бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(4-метоксифенил)бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(3,5-диметоксифенил)бензамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-[4-(диметиламино)фенил]бензамида;
3-[3-(бензилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(бензилтио)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-{[(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)сульфонил]метил}бензонитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-метилбензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-1-нафтилбензолсульфонамида;
N-бифенил-4-ил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензолсульфонамида;
3-[3-(бензилокси)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-циклогексилбензолсульфонамида;
3-[3-(3,4-дигидроизохинолин-2(1Н)-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(2-метоксиэтил)бензолсульфонамида;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N,N-диэтилбензолсульфонамида;
3-{3-[(4-этилпиперазин-1-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
N-1,3-бензодиоксол-5-ил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}бензолсульфонамида;
3-{3-[(2,6-диметилмофролин-4-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{3-[(4-оксопиперидин-1-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(изопропилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{3-[(циклогексилметил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(октагидроизохинолин-2(1Н)-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(2-фенилэтил)бензолсульфонамида;
цис-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексилацетонитрила;
3-цис-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексилпропаннитрила;
цис-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексанкарбонитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексилацетонитрила;
5-({цис-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]циклогексил}тио)-1Н-1,2,4-триазол-3-амина;
[цис-4-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-1-(1Н-1,2,4-триазол-1-ил)циклогексил]ацетонитрила,
и его фармацевтически приемлемой соли.
33. Соединение по п.1, выбранное из
3-[3-(пиперазин-1-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-[3-(тиоморфолин-4-илсульфонил)фенил]пропаннитрила;
3-{3-[(4-гидроксипиперидин-1-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[3-(изобутилсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]-3-{3-[(тетрагидро-2Н-пиран-4-илметил)сульфонил]фенил}пропаннитрила;
3-{3-[(3-фурилметил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{3-[(1,1-диоксидотиоморфолин-4-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{3-[(пиридин-4-илметил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
3-{3-гидрокси-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропил}-N,N-диметилбензолсульфонамида;
3-{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бут-3-ен-1-ил}бензонитрила;
4-{1-[1-(3-бромфенил)бут-3-ен-1-ил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
3-{4,4-дифтор-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бут-3-ен-1-ил}бензонитрила;
4-(1-{4,4-дифтор-1-[3-(морфолин-4-илсульфонил)фенил]бут-3-ен-1-ил}-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
4-(1-{1-[3-(этилсульфонил)фенил]-4,4-дифторбут-3-ен-1-ил}-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
4-(1-{1-[3-(бензилокси)фенил]-4,4-дифторбут-3-ен-1-ил}-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
4-(1-{4,4-дифтор-1-[3-(метилсульфонил)фенил]бут-3-ен-1-ил}-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
3-{[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]метил}бензонитрила;
3-{1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бутил}бензонитрила;
4-(1-{1-[3-(этилсульфонил)фенил]-4,4-дифторбутил}-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
4-[1-(1-циклопентилбут-3-ен-1-ил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
4-[1-(1-циклопентилбутил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
4-[1-(1-циклопентил-4,4-дифторбут-3-ен-1-ил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
4-[1-[4,4-дифтор-1-(тетрагидрофуран-3-ил)бут-3-ен-1-ил]-1Н-пиразол]-4-ил-7Н-пирроло[2,3-d]пиримидина;
4-[1-(1-циклопропил-4,4-дифторбут-3-ен-1-ил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
4-[1-(1-циклопентил-4,4-дифторбутил)-1Н-пиразол-4-ил]-7Н-пирроло[2,3-d]пиримидина;
3-(1-метилциклопентил)-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
1-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}циклопропанкарбонитрила;
3-[1-(метилсульфонил)пирролидин-3-ил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрила;
4-{1-[2,2,2-трифтор-1-(1Н-имидазол-2-илметил)этил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидина;
4-(1-(1R)-2,2,2-трифтор-1-[(4-метил-1,3-тиазол-2-ил)метил]этил-1Н-пиразол-4-ил)-7Н-пирроло[2,3-d]пиримидина;
4-{1-[1-(5-бромпиридин-3-ил)-4,4-дифторбут-3-ен-1-ил]-1Н-пиразол-4-ил}-7Н-пирроло[2,3-d]пиримидин;
5-{4,4-дифтор-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]бут-3-ен-1-ил}никотинонитрил;
3-[3-(пирролидин-1-илсульфонил)фенил]-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил;
N-бензил-3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-метилбензолсульфонамид;
3-{[(3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}фенил)сульфонил]метил}бензонитрил;
3-{3-[(2-нафтилметил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил;
3-{3-[(1-фенилэтил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил;
3-{2-циано-1-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(2-морфолин-4-илэтил)бензолсульфонамид;
3-{2-циано-1-[4-(7Н-пирроло-[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-[(1S)-1-фенилэтил]бензолсульфонамид;
3-{2-циано-1-[4-(7Н-пирроло-[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-фенилбензамид;
3-{2-циано-1-[4-(7Н-пирроло-[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]этил}-N-(тетрагидрофуран-2-илметил)бензолсульфонамид;
3-{3-[(циклопропилметил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил;
3-{3-[(4-метилпиперазин-1-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил и
3-{3-[(1-оксидотиоморфолин-4-ил)сульфонил]фенил}-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил;
или его фармацевтически приемлемая соль.
34. Соединение, которое представляет собой 3-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил, или его фармацевтически приемлемая соль.
35. Соединение, которое представляет собой (R)-3-циклопентил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1Н-пиразол-1-ил]пропаннитрил, или его фармацевтически приемлемая соль.
36. Соединение, которое представляет собой 3-циклопропил-3-[4-(7Н-пирроло[2,3-d]пиримидин-4-ил)пиразол-1-ил]пропионитрил, или его фармацевтически приемлемая соль.
Текст
Изобретение относится к гетероарилзамещенным пирроло[2,3-b]пиридинам (I) и гетероарилзамещенным пирроло[2,3-b]пиримидинам, которые модулируют активность Янускиназы и могут использоваться для лечения заболеваний, связанных с активностью Янускиназы, включая, например, иммуносвязанные заболевания, заболевания кожи, миелоидные пролиферативные заболевания, рак и другие заболевания. Область изобретения Изобретение относится к гетероарилзамещенным пирроло[2,3-b]пиридинам и гетероарилзамещенным пирроло[2,3-b]пиримидинам, которые модулируют активность Янус-киназы и могут использоваться для лечения заболеваний, связанных с активностью Янус-киназ, включая, например, заболевания связанные с иммунной системой, кожные заболевания, миелоидные пролиферативные заболевания, рак и другие заболевания. Предпосылки создания изобретения Протеинкиназы (РК) представляют собой группу ферментов, которые регулируют различные важные биологические процессы, включая рост, выживание и дифференциацию клеток, образование и морфогенез органов, неоваскуляризацию, восстановление и регенерацию тканей наряду с прочим. Протеинкиназы проявляют свои физиологические функции, катализируя фосфорилирование белков (или субстратов) и таким образом модулируя клеточную активность субстратов в различном биологическом контексте. Помимо функций в нормальных тканях/органах, многие протеинкиназы также играют более специализированную роль в организме хозяина при заболеваниях человека, включая рак. Набор протеинкиназ(также упоминаемых как онкогенные протеинкиназы), когда нарушена их регуляция, может вызвать образование и рост опухоли и дополнительно вносить вклад в сохранение и прогрессирование опухоли(Blume-Jensen P et al, Nature 2001, 411(6835):355-365). До сих пор онкогенные протеинкиназы представляют собой наиболее большую и наиболее привлекательную группу белковых мишеней для вмешательства в раковые заболевания и разработку лекарственных средств. Протеинкиназы могут быть разделены на киназы рецепторного и нерецепторного типа. Рецепторные тирозинкиназы (RTK) имеют внеклеточную часть, трансмембранный домен, и внутриклеточную часть, тогда как нерецепторные тирозинкиназы являются полностью внеклеточными. RTKопосредованная сигнальная трансдукция обычно инициируется за счет внеклеточного взаимодействия с определенным фактором роста (лиганд), обычно с последующей димеризацией рецептора, стимуляцией активности собственного белка тирозинкиназы и трансфосфорилированием рецептора. Тем самым создаются сайты связывания для молекул внутриклеточной сигнальной трансдукции, и это приводит к образованию комплексов со спектром цитоплазматических сигнальных молекул, что облегчает подходящий клеточный ответ, такой как деление, дифференциация клетки, метаболические эффекты и изменения во внеклеточном микроокружении. В настоящее время идентифицировано по крайней мере девятнадцать (19) различных подсемействRTK. Одно из подсемейств RTK, обозначаемое HER, включает EGFR, HER2, HER3 и HER4 и связывает такие лиганды как эпителиальные факторы роста (EGF), TGF-, амфирегулин, HB-EGF, бетацеллюлин и герегулин. Второе семейство RTK, обозначаемое как подсемейство инсулина, включает INS-R, IGF-1R иFLK-II. Другое подсемейство RTK, упоминаемое как подсемейство FLK, охватывает рецептор со вставкой киназного домена фетальную киназу печени 1 (KDR/FLK-1), фетальную киназу печени 4 (FLK-4) иfms-подобную тирозинкиназу (flt-1). Два других подсемейства RTK были обозначены как FGF семейство рецепторов (FGFR1, FGFR2, FGFR3 и FGFR4) и подсемейство Met (c-Met, Ron и Sea). Подробное обсуждение протеинккиназ см., например, в публикациях Blume-Jensen, P. et al., Nature. 2001, 411 (6835): 355365, и Manning, G. et al., Science. 2002, 298 (5600): 1912-1934. Нерецепторный тип тирозинкиназ также состоит из множества подсемейств, включая Src, Btk, AbI,Fak и Jak. Каждое из этих подсемейств может быть дополнительно разделено на множество членов, которые часто связаны с онкогенезом. Семейство Src, например, является наибольшим и включает наряду с прочими Src, Fyn, Lck и Fgr. Подробное обсуждение данных киназ см. Bolen JB. Nonreceptor tyrosine protein kinases. Oncogene. 1993, 8(8):2025-31. Значительное число тирозинкиназ (как рецепторных, так и нерецепторных) связано с раком (см.Madhusudan S, Ganesan TS. Tyrosine kinase inhibitors in cancer therapy. Clin Biochem. 2004, 37 (7): 618-35). Клинические исследования дают возможность полагать, что сверхэкспрессия или нарушение функций тирозинкиназ также могут иметь прогнозируемое значение. Например, члены семейства HER ряда RTK связаны с неблагоприятным прогнозом при раке молочной железы, колоректальном раке, раке головы и шеи и раке легких. Мутация тирозинкиназы c-Kit связана с пониженной выживаемостью при стромальных опухолях желудочно-кишечного тракта. При острой миелогенной лейкемии, мутация Flt-3 предсказывает более короткую выживаемость без заболевания. Экспрессия VEGFR, которая является важной для ангиогенеза опухолей, связана с более низкой степенью выживания при раке легких. Экспрессия киназыTie-1 обратно пропорционально коррелирует с выживанием при раке желудка. Экспрессия BCR-Ab1 является важным фактором предсказания ответной реакции при хронической миелогенной лейкемии, а тирозинкиназа Src является индикатором неблагоприятного прогноза на всех стадиях колоректального рака. Иммунная система дает ответную реакцию на повреждение и угрозу патогенов. Цитокины представляют собой низкомолекулярные полипептиды или гликопротеины, которые стимулируют биологические ответные реакции виртуально во всех типах клеток. Например, цитокины регулируют множество путей, вовлеченных в воспалительную ответную реакцию хозяина на сепсис. Цитокины влияют на кле-1 019504 точную дифференциацию, пролиферацию и активацию, и они могут модулировать как провоспалительную, так и противовоспалительную ответную реакцию, давая возможность хозяину подходящим образом реагировать на патогены. Связывание цитокина с рецептором на поверхности клетки инициирует внутриклеточные сигнальные каскады, которые трансдуцируют межклеточный сигнал в ядро, в конечном счете, приводя к изменениям в экспрессии генов. Путь, включающий семейство Янус-киназ протеинтирозинкиназ (JAK) и сигнальных трансдукторов и активаторов транскрипции (STAT), занят в передаче сигнала для широкого ряда цитокинов. Обычно цитокиновые рецепторы не обладают собственной тирозинкиназной активностью и следовательно требуют рецепторсвязанных киназ для распространения каскада фосфорилирования. JAK выполняют эту функцию. Цитокины связываются с рецепторами, вызывая димеризацию рецепторов, и это дает возможность киназам JAK фосфорилировать друг друга, а также определенные тирозиновые мотивы в цитокиновых рецепторах. STAT, которые распознают данные мотивы фосфотирозина,привлекаются рецептором и затем сами активируются за счет JAK-зависимого фосфорилирования тирозина. После активации STAT диссоциируют от рецептора, димеризуются и направляются в ядро для связывания со специфическими сайтами ДНК и изменения транскрипции (Scott, M. J., С. J. Godshall, et al.(2002). "Jaks, STATs, Cytokines, and Sepsis." Clin Diagn Lab Immunol 9(6): 1153-9). Семейство JAK играет роль в цитокин-зависимом регулировании пролиферации и функции клеток,вовлеченных в иммунный ответ. В настоящее время имеется четыре известных члена семейства JAK млекопитающих: JAK1 (также известная как Янус-киназа-1), JAK2 (также известная как Янус-киназа-2),JAK3 (также известная как Янус-киназа лейкоцитов; JAKL; 1-JAK и Янус-киназа-3) и TYK2 (также известная как протеин-тирозинкиназа 2). Белки JAK колеблются в размере от 120 до 140 КДа и включают сеть консервативных гомологичных доменов JAK (JH), один из них представляет собой функциональный каталитический киназный домен, и другой представляет собой псевдокиназный домен, потенциально выполняющий регулирующую функцию и/или служащий в качестве стыковочного сайта для STATs(Scott, Godshall et al. 2002, см.выше). Тогда как JAK1, JAK2 и TYK2 экспрессируются повсеместно, сообщается, что JAK3 предпочтительно экспрессируется в природных киллерных (NK) клетках, а не в Т-клетках в состоянии покоя, что позволяет предположить ее роль в лимфоидной активации (Kawamura, М., D. W. McVicar, et al. (1994).He только цитокин-стимулированные иммунные и воспалительные ответные реакции действительно вносят свой вклад в защиту хозяина, но они также играют роль в патогенезе заболеваний: патологии,такие как тяжелый объединенный иммунодефицит (SCID) возникают из-за недостаточной активности и подавления иммунной системы, а гиперактивность и аномальная иммунная/воспалительная ответная реакция вносят вклад в патологию аутоиммунных заболеваний, таких как ревматоидный и псориатический артрит, астма и системная красная волчанка, воспалительное заболевание кишечника, рассеянный склероз, сахарный диабет типа I, бульбоспинальный паралич, тиреоидит, иммуноглобулиновые невропатии,миокардит, а также болезни, такие как склеродерма и остеоартрит (Ortmann, R. А., Т. Cheng, et al. (2000)."Janus kinases and signal transducers and activators of transcription: their roles in cytokine signaling, development and immunoregulation. " Arthritis Res 2(1): 16-32). Кроме того, абсолютно обычными являются синдромы со смешанным проявлением аутоиммунного и иммунодефицитного заболевания (Candotti, F., L.signaling pathways." J Clin Invest 109(10): 1261-9). Таким образом, терапевтические агенты обычно направлены на увеличение или подавление иммунных и воспалительных путей, соответственно. Дефицит в экспрессии членов семейства JAK связан с болезненными состояниями. Мыши Jakl -/являются мелкими при рождении, плохо выкармливаются и умирают в перинатальный период (Rodig,S.J., M.A.Meraz et al. (1998) "Disruption of the Jakl gene demonstrates obligatory and nonredundant roles of theJaks in cytokine-induced biologic responses." Cell 93(3): 373-83). Эмбрионы мышей Jak2 -/- страдают анемией и умирают примерно на 12,5 день после совокупления вследствие отсутствия фиксированного эритропоэза. JAK2-дефицитные фибробласты не дают ответной реакции на IFN гамма, хотя ответные реакции на IFN альфа/бета и IL-6 не затрагиваются.JAK2 функционирует при сигнальной трансдукции специфической группы цитокиновых рецепторов, необходимых для определяющего эритропоэза (Neubauer, H., A. Cumano, et al. (1998). Cell 93(3): 397409; Parganas, E., D. Wang, et al. (1998). Cell 93(3): 385-95). Оказалось, что JAK3 играет роль при нормальном развитии и функционировании В и Т лимфоцитов. Сообщалось, что мутации JAK3 являются ответственными за аутосоматический рецессивный тяжелый комбинированный иммунодефицит (SCID) у людей (Candotti, F., S. A. Oakes, et al. (1997). "Structural and functional basis for JAK3-deficient severe combined immunodeficiency." Blood 90(10): 3996-4003). Путь JAK/STAT и, в частности, всех четырех членов семейства JAK, как предполагается, играет роль в патогенезе астматической ответной реакции, при хроническом обструктивном заболевании легких, бронхите и других родственных воспалительных заболеваниях нижних дыхательных путей. Например, аномальные иммунные ответные реакции, которые характерны для астмы, сочетаются с наборомCD4+ Т хелперных клеток, определяемых как Т хелперные 2 (Th2) клетки. Передача сигнала посредством цитокинового рецептора IL-4 стимулирует JAK1 и JAK3 для активации STAT6, а передача сигнала посредством IL-12 стимулирует активацию JAK2 и TYK2 и последующее фосфорилирование STAT4.STAT4 и STAT6 контролируют множество аспектов дифференциации CD4+ Т хелперных клеток (Pernis,А. В. and Р. В. Rothman (2002). "JAK-STAT signaling in asthma." J Clin Invest 109(10): 1279-83). Кроме того, было установлено, что TYK2-дефицитные мыши имеют повышенную склонность к аллергическому воспалению дыхательных путей, опосредованному Th2-клетками (Seto, Y., H. Nakajima, et al. (2003). "Enhanced Th2 cell-mediated allergic inflammation in Tyk2-deficient mice." J Immunol 170(2): 1077-83). Более того, множество цитокинов, которые передают сигнал через киназы JAK, связаны с воспалительными заболеваниями или состояниями верхних дыхательных путей, такими как поражающие нос и носовые пазухи (например, ринит, синусит), независимо от того являются ли они классической аллергической реакцией или нет. Путь JAK/STAT также вовлечен в воспалительные заболевания/состояния глаз, включая, но не ограничиваясь указанным: воспаление радужной оболочки глаза, увеит, склерит, конъюнктивит, а также хронические аллергические ответные реакции. Следовательно, ингибирование киназ JAK может играть благоприятную роль при терапевтическом лечении данных заболеваний. Путь JAK/STAT и, в частности, JAK3, также играет роль при раке иммунной системы. При Тклеточной лейкемии/лимфоме взрослых (ATLL) CD4+Т клетки человека приобретают трансформированный фенотип, событие, которое коррелирует с приобретением конститутивного фосфорилированияJAK и STAT. Кроме того, связь между JAK3 и активацией STAT-1, STAT-3 и STAT-5 и развитием клеточного цикла была продемонстрирована путем как окрашивания с помощью иодида пропидия, так и внедрением бромдеоксиуридина в клетки четырех протестированных пациентов с ATLL. Данные результаты позволяют предположить, что активация JAK/STAT связана с репликацией лейкемических клеток, и что терапевтические подходы, направленные на ингибирование JAK/STAT могут рассматриваться, как останавливающие неопластический рост (Takemoto, S., J. С. Mulloy, et al. (1997). "Proliferation of adult TAcad Sci USA 94(25): 13897-902). Блокирование сигнальной трансдукции на уровне киназ JAK дает перспективу разработки подхода к лечению рака человека. Цитокины семейства интерлейкинов 6 (IL-6), которые активируют сигнальный трансдуктор др 130, являются основными факторами выживания и роста для клеток множественной миеломы человека (ММ). Предполагается, что сигнальная трансдукция др 130 вовлекает JAK1, JAK2 и Tyk2 и расположенные в прямом направлении (5'-3') эффекторы STAT3 и митоген-активированные протеинкиназные (МАРК) пути. В IL-6 зависимой ММ клеточных линиях, обработанных ингибитором JAK2 тирфостином AG490, ингибировались активность киназы JAK2 и фосфорилирование ERK2 и STAT3. Кроме того, подавлялась пролиферация клеток и индуцировался апоптоз. (De Vos, J., M. Jourdan, et al.(МАРК) and signal transducer and activator of transccription (STAT) pathways and induces apoptosis in myeloma cells." Br J Haematol 109(4): 823-8). Однако в некоторых случаях AG4 90 может индуцировать состояние бездействия опухолевых клеток в действительности затем защитить их от смерти. Активация JAK/STAT при раке может происходить по многочисленным механизмам, включая стимуляцию цитокина (например, IL-6 или GM-CSF) или за счет уменьшения эндогенных супрессоров передачи сигнала посредством JAK, таких как SOCS (супрессор или цитокиновая передача сигнала) илиPIAS (протеиновый ингибитор активированной STAT) (Boudny, V., and Kovarik, J., Neoplasm. 49:349-355,2002). Важным является то, что активация передачи сигнала посредством STAT, а также других путей в прямом направлении от JAK (например, Akt), коррелирует с неблагоприятным прогнозом для многих типов рака (Bowman, Т., et al. Oncogene 19:2474-2488, 2000). Кроме того, повышенные уровни циркулирующих цитокинов, которые передают сигнал посредством JAK/STAT, могут неблагоприятным образом влиять на состояние здоровья пациента, поскольку предполагается, что они играют эпизодическую роль при кахексии и/или хронической усталости. По существу, ингибирование JAK может иметь терапевтическое значение при лечении рака у пациентов по причинам, которые далеко расширяют потенциал противоопухолевой активности. Данные для кахексии могут привести к дополнительному выгрышу механистической поддержки от того факта, что фактор насыщения - лептин, предает сигналы посредством JAK. Янус-киназа 3 (JAK3) как фармакологическая цель успешно использовалась для контролирования отторжения аллотрансплантата и болезни "трансплантат-против-хозяина" (GVHD). В дополнение к ее вовлеченности в передачу сигнала цитокиновых рецепторов JAK3 также занята в сигнальном пути CD40 моноцитов периферической крови. Во время CD40-индуцированного созревания миелоидных дендритных клеток (DCs) индуцируется активность JAK3 и увеличивается совместно стимулированная молекулярная экспрессия, продуцирование IL-12, и наблюдается сильная аллогенная стимулирующая способность. Рационально разработанный ингибитор JAK3, WHI-P-154, предотвращает данные действия, останавливая DCs на не созревшем уровне, что позволяет предположить, что иммуносупрессорная терапия,имеющая целью тирозинкиназу JAK3, может также затрагивать функцию миелоидных клеток (Saemann,M. D., С. Diakos, et al. (2003). "Prevention of CD40-triggered dendritic cell maturation and induction of T-cellhyporeactivity by targeting of Janus kinase 3, " Am J Transplant 3(11): 1341-9). На системе мышиной модели также было показано, что JAK3 является важной молекулярной мишенью для лечения аутоиммунного инсулинзависимого сахарного диабета (типа I). Рационально разработанный ингибитор JAK3, JANEX-1 проявил сильную иммуномодулирующую активность и замедлял начало появления диабета на NODмышиной модели аутоиммунного диабета типа I (Cetkovic-Cvrlje, М., A. L. Dragt, et al. (2003). "TargetingJAK3 with JANEX-1 for prevention of autoimmune type 1 diabetes in NOD mice." Clin Immunol 106(3): 21325). Было предположено, что ингибирование тирозинкиназы JAK2 может быть благоприятным для пациентов с миелопролиферативными нарушениями (Levin, et al., Cancer Cell, vol. 7, 2005: 387-397). Миелопролиферативные нарушения (MPD) включают истинную полицитемию (PV), идиопатическую тромбоцитопению (ET), миелоидную метаплазию с миелофиброзом (МММ), хроническую миелогенную лейкемию (CML), хроническую миеломоноцитную лейкемию (CMML), гиперэозинофильный синдром(HES) и системное заболевание мастоцитов (SMCD). Хотя, как полагают, миелопролиферативные нарушения вызывает благоприобретенная соматическая мутация в гематопоэтических предшественниках,генетическая основа данных заболеваний неизвестна. Однако сообщалось, что гематопоэтические клетки большинства пациентов с PV и значительного числа пациентов с ЕТ и МММ обладают повторяющимися периодически соматическими активирующими мутациями в тирозинкиназе JAK2. Также сообщалось,что ингибирование киназы JAK2V617F небольшими молекулами ингибиторами приводит к ингибированию пролиферации гематопоэтических клеток, что позволяет предположить, что тирозинкиназа JAK2 является потенциальной мишенью для фармакологического ингибирования у пациентов с PV, ЕТ и МММ. Также предполагается, что ингибирование киназ JAK имеет терапевтическое преимущество для пациентов, страдающих от кожных иммунных нарушений, таких как псориаз и кожная аллергическая реакция. Общепринято, что при псориазе обыкновенном, наиболее распространенной форме псориаза, Тлимфоциты имеют важность для поддержания заболевания и связанными с ним псориатическими бляшками (Gottlieb, А. В., et al, Nat Rev Drug Disc, 4:19-34). Псориатические бляшки содержат существенный иммунный инфильтрат, включая лейкоциты и моноциты, а также многочисленные слои эпидермы с повышенной пролиферацией кератиноцита. Тогда как первоначальная активация иммунных клеток при псориазе происходит по зависящему от болезни механизму, предполагается что поддержание заболевания зависит от числа воспалительных цитокинов, в дополнение к различным хемокинам и факторам роста (JCI, 113:1664-1675). Многие из них, включая интерлейкины -2, -4, -6, -7, -12, -15, -18 и -23, а такжеGM-CSF и IFNg, передают сигнал посредством Янус-киназ (JAK) (Adv Pharmacol. 2000;47:1 13-74). По существу, блокирование сигнальной трансдукции на уровне киназ JAK может привести к терапевтическому выигрышу у пациентов, страдающих от псориаза или других иммунных нарушений кожного покрова. Известно, что некоторые лекарственные средства могут вызывать иммунные реакции, такие как кожная сыпь или диарея у некоторых пациентов. Например, применение некоторых новых направленных противораковых агентов, таких как Иресса, Эритукс и Тарцева индуцировало угревидную сыпь у некоторых пациентов. Другой пример относится к тому факту, что некоторые наружно применяемые лекарственные средства вызывают раздражение кожи, кожную сыпь, контактный дерматит или аллергическую контактную реакцию кожи. У некоторых пациентов данные иммунные реакции могут вызывать беспокойство, но для других иммунные реакции, такие как сыпь или диарея, могут привести к невозможности продолжать лечение. Хотя движущая сила таких иммунных реакций полностью не ясна к настоящему времени, данные иммунные реакции, вероятно, связаны с иммунным инфильтратом. Проводится широкий поиск ингибиторов Янус-киназы или родственных киназ, и в нескольких публикациях сообщается об эффективных классах соединений. Например, о некоторых ингибиторах сообщается в W0 99/65909, патенте США 2004/0198737; WO 2004/099204; WO 2004/099205 и WO 01/42246. О гетероарилзамещенных пирролах и других соединениях сообщается в WO 2004/72063 и WO 99/62908. Таким образом, постоянно необходимы новые или усовершенствованные агенты, которые ингибируют киназы, такие как Янус-киназы, которые действуют как иммуноподавляющие агенты при трансплантации органов, а также в качестве агентов для профилактики и лечения аутоиммунных заболеваний(например, рассеянный склероз, ревматоидный артрит, астма, диабет типа I, воспалительное заболевание кишечника, болезнь Крона, аутоиммунные нарушения щитовидной железы, болезнь Альцгеймера), заболеваний, которые включают гиперактивную воспалительную ответную реакцию (например, экзема), аллергий, рака (например, рак предстательной железы, лейкемия, множественная миелома) и некоторых иммунных реакций (например, кожная сыпь или контактный дерматит или диарея), вызванных другими лекарственными средствами, некоторые из которых упомянуты. Описанные здесь соединения, композиции и способы отвечают данной необходимости и другим целям. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулы I или их фармацевтически приемлемым солевым формам или пролекарственным формам, где составляющие определены в данном описании. Настоящее изобретение далее относится к композициям, содержащим соединение формулы I или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Настоящее изобретение далее относится к способам модулирования активности JAK, включающим контактирование JAK с соединением формулы I или его фармацевтически приемлемой солью. Настоящее изобретение далее относится к способам лечения заболевания у пациента, где заболевание связано с активностью JAK, включающим введение пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Настоящее изобретение далее относится к применению в терапии соединений формулы I. Настоящее изобретение далее относится к применению соединений формулы I для получения лекарственного средства для применения в терапии. Подробное описание изобретения Настоящее изобретение относится, между прочим, к соединениям, которые модулируют активность одной или нескольких из JAK и могут использоваться, например, для лечения заболеваний, связанных с экспрессией или активностью JAK. Соединения по изобретению имеют формулу I или его фармацевтически приемлемая соль, где Т, U и V независимо выбирают из О, S, N, CR5 и NR6; где 5-членное кольцо, образованное атомом углерода, атомом азота, U, Т и V, является ароматическим;C1-8 алкилен или C2-8 алкенилен необязательно замещены 1, 2 или 3 заместителями, выбранными из галогена, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино;Z представляет собой арил, циклоалкил, гетероарил или гетероациклоалкил, каждый из которых необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Су 1, CN, NO2, ORa, SRa,C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRcC(O)NRcRd, NRcC(O)ORa,S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb и S(O)2NRcRd;Cy1 независимо выбирают из арила, гетероарила, циклоалкила и гетероциклоалкила, каждый из которых необязательно является замещенным 1, 2, 3, 4 или 5 заместителями, независимо выбранными из галогена, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 галогеналкила, CN, NO2, ORa", SRa", C(O)Rb",C(O)NRc"Rd", C(O)ORa", OC(O)Rb", OC(O)NRc"Rd", NRc"Rd", NRc"C(O)Rb", NRc"C(O)ORa", S(O)Rb",S(O)NRc"Rd", S(O)2Rb" и S(O)2NRc"Rd";R4 независимо выбирают из Н;R9 и R10 независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С 2-6 алкенила, С 2-6 алкинила,C1-6 алкилкарбонила, арилкарбонила, C1-6 алкилсульфонила, арилсульфонила, арила, гетероарила, циклоалкила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила или R9 и R10 вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу;R11 и R12 независимо выбирают из Н, галогена, ОН, CN, Н, C1-4 алкила, C1-4 галогеналкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 гидроксиалкила, C1-4 цианоалкила, арила, гетероарила, циклоалкила и гетероциклоалкила;Ra и Ra представляет собой Н, C1-8 алкил, C1-6 галогеналкил, С 2-6 алкенил, С 2-6 алкинил, арил, циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил и гетороциклоалкилалкил, где указанный C1-6 алкил, C1-6 галогеналкил, С 2-6 алкенил или С 2-6 алкинил, арил, циклоалкил,гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил и гетороциклоалкилалкил являются необязательно замещенными 1, 2 или 3 заместителями, независимо выбранными из ОН, CN,амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, арила, арилалкила, гетероарила,гетероарилалкила, циклоалкила и гетероциклоалкила;Rb и Rb" независимо выбирают из Н, C1-6 алкила, C1-6 галогеналкила, С 2-8 алкенила, C2-6 алкинила,арила, циклоалкила, гетероарила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где указанный C1-6 алкил, C1-6 галогеналкил, С 2-6 алкенил, С 2-6 алкинил, арил,циклоалкил, гетероарил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, арила, арилалкила,гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;Rc и Rd независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С 2-6 алкенила, С 2-6 алкинила, где указанный C1-10 алкил, C1-6 галогеналкил, С 2-6 алкенил или С 2-6 алкинил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из Cy1, -(C1-6 алкил)-Су 1, ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 галогеналкила, арила, аралкила, гетероарила, гетероарилалкила,циклоалкила или гетероциклоалкила; или Rc и Rd вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу, необязательно замещенную 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, арила, аралкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила;Rc" и Rd" независимо выбирают из Н, C1-10 алкила, C1-6 галогеналкила, С 2-6 алкенила, С 2-6 алкинила,арила, гетероарила, циклоалкила, гетероциклоалкила, арилалкила, гетероарилалкила, циклоалкилалкила и гетероциклоалкилалкила, где указанный C1-10 алкил, C1-6 галогеналкил, С 2-6 алкенил, С 2-6 алкинил, арил,гетероарил, циклоалкил, гетероциклоалкил, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкилалкил необязательно является замещенным 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, галогенсульфанила, C1-6 галогеналкила,арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила; или Rc" и Rd" вместе с атомом N, к которому они присоединены, образуют 4-, 5-, 6- или 7-членную гетероциклоалкильную группу, необязательно замещенную 1, 2 или 3 заместителями, независимо выбранными из ОН, CN, амино, галогена, C1-6 алкила, C1-6 галогеналкила, C1-6 галогеналкила, арила, арилалкила, гетероарила, гетероарилалкила, циклоалкила и гетероциклоалкила; р равно 0, 1, 2, 3, 4, 5 или 6; иq равно 0, 1, 2, 3, 4, 5 или 6; где "арил" относится к моноциклическим или полициклическим ароматическим углеводородам, которые содержат от б до примерно 20 атомов углерода;"гетероарил" относится к моноциклическому или полициклическому ароматическому гетероциклу,имеющему от 1 до 4 гетероатомов в кольце, выбранных из серы, кислорода или азота, содержащему от 1 до примерно 20 атомов углерода;"циклоалкил" относится к моно или полициклическим неароматическим циклическим углеводородам, которые включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил, норборнил, норпинил, норкарнил, или адамантил;"гетероциклоалкил" относится к моноциклическим или полициклическим неароматическим гетероциклам, имеющим от 1 до 4 гетероатомов в кольце, и включающим от 3 до 20 атомов углерода;"арилалкил" относится к алкилу, замещенному арилом, при этом алкил содержит от 1 до 6 атомов углерода;"циклоалкилалкил" относится к алкилу, замещенному циклоалкилом, при этом алкил содержит от 1 до 6 атомов углерода; мов в кольце,выбранных из серы, кислорода или азота, при этом алкил содержит от 1 до 6 атомов углерода; и"гетероциклоалкилалкил" относится к алкилу, замещенному гетероциклоалкилом, при этом алкил содержит от 1 до 6 атомов углерода. В некоторых вариантах осуществления в том случае, когда X представляет собой N, n равно 1, и фрагмент, образованный U, Т, V и -(Y)n-Z, имеет формулу то Y не является (CR11R12)pС(О)NRC(CR11R12)q. В некоторых вариантах осуществления в том случае, когда X представляет собой СН, n равно 1, и фрагмент, образованный U, Т, V и -(Y)n-Z, имеет формулу то -(Y)n-Z отличается от СООН. В некоторых вариантах осуществления в случае, когда X представляет собой СН или С-галоген, n равно 1, и фрагмент, образованный U, Т, V и -(Y)n-Z, имеет формулу то Y отличается от (CR11R12)pС(О)NRC(CR11R12)q или (CR11R12)pC(O)(CR11R12)q. В некоторых вариантах осуществления в случае, когда X представляет собой СН или С-галоген, n равно 0, и фрагмент, образованный U, Т, V и -(Y)n-Z имеет формулу то Z отличается от CN, галогена или C1-4 алкила. В некоторых вариантах осуществления в случае, когда X представляет собой СН или С-галоген, и фрагмент, образованный U, Т, V и -(Y)n-Z имеет формулу то Y отличается от (CR11R12)pC(О)NRC(CRnR12)q или (CR11R12)pC(O)(CR11R12)q. В некоторых вариантах осуществления в случае, когда X представляет собой СН или С-галоген, n равно 1 и фрагмент, образованный U, Т, V и -(Y)n-Z, имеет формулу: то Y отличается от (CR11R12)pNRC(CR11R12)q. В некоторых вариантах осуществления X представляет собой N. В некоторых вариантах осуществления X представляет собой CR4. В некоторых вариантах осуществления по крайней мере один из U, Т и V представляет собой N. В некоторых вариантах осуществления 5-членное кольцо, образованное U, Т и V, представляет собой пирролил, пиразолил, имидазолил, оксазолил, тиазолил или оксадиазолил. В некоторых вариантах осуществления 5-членное кольцо, образованное U, Т и V, выбирают из где а обозначает место присоединения фрагмента -(Y)n-Z;b обозначает место присоединения фрагмента ядра: и с и с 1 обозначают два места присоединения конденсированного 4-20-членного арильного, циклоалкильного, гетероарильного или гетероциклоалкильного кольца. В некоторых вариантах осуществления 5-членное кольцо, образованное U, Т и V, выбирают из где а обозначает место присоединения фрагмента -(Y)n-Z;b обозначает место присоединения фрагмента ядра: и с и с' обозначают два места присоединения конденсированного 4-20-членного арильного, циклоалкильного, гетероарильного или гетероциклоалкильного кольца. В некоторых вариантах осуществления 5-членное кольцо, образованное U, Т и V, выбирают из где а обозначает место присоединения фрагмента -(Y)n-Z;b обозначает место присоединения фрагмента ядра: где а обозначает место присоединения фрагмента -(Y)n-Z;b обозначает место присоединения фрагмента ядра: В некоторых вариантах осуществления n равно 0. В некоторых вариантах осуществления n равно 1. В некоторых вариантах осуществления n равно 1 и Y представляет собой C1-8 алкилен, С 2-8 алкенилен, (CR11R12)pC(O) (CR11R12)q, (CR11R12)pC(O)NRc(CR11R12)q, (CR11R12)pC(O)O(CR11R12)q, (CR11R12)pOC(O)(CR11R12)q, где указанный C1-8 алкилен или С 2-8 алкенилен необязательно является замещенным 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1, и Y представляет собой C1-8 алкилен, CR11R12)PC(О)(CR11R12)q, (CR11R12)pC(O)NRc(CR11R12)q, CR11R12)РС(О)О(CR11R12)q, где указанный C1-8 алкилен необязательно является замещенным 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1 и Y представляет собой C1-8 алкилен, необязательно замещенный 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1 и Y представляет собой этилен, необязательно замещенный 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1 и Y представляет собой C1-8 алкилен, (CR11R12)PC(О) (CR11R12)q, (CR11R12)pC(O)NRc(CR11R12)q, или (CR11R12)PC (О)O(CR11R12)q, где указанный C1-8 алкилен необязательно является замещенным 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1 и Y представляет собой C1-8 алкилен, необязательно замещенный 1, 2 или 3 галогенами, ОН, CN, амино, C1-4 алкиламино или С 2-8 диалкиламино. В некоторых вариантах осуществления n равно 1, и Y представляет собой CR11R12)РС(О) 11 12(CR R )q, (CR11R12)pC(O)NRc(CR11R12)q или CR11R12) pC (O) О (CR11R12)q. В некоторых вариантах осуществления р равно 0. В некоторых вариантах осуществления р равно 1. В некоторых вариантах осуществления р равно 2. В некоторых вариантах осуществления q равно 0. В некоторых вариантах осуществления q равно 1. В некоторых вариантах осуществления q равно 2. В некоторых вариантах осуществления один из р и q равен 0, а другой из р и q равен 1, 2 или 3. В некоторых вариантах осуществления Z представляет собой циклоалкил, который необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Cy1, CN, NO2, ORa, SRa, C(O)Rb,C(O)NRcRd, C(O)ORa, OC(O)Rb, OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRCC (O) NRcRd, NRcC(O)ORa, S(O)Rb,S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb, и S(O)2NRcRd. В некоторых вариантах осуществления соединение по п.1 или его фармацевтически приемлемая соль, где Z представляет собой гетероциклоалкил, который необязательно замещен 1, 2, 3, 4, 5 или 6 заместителями, выбранными из галогена, C1-4 алкила, С 2-4 алкенила, С 2-4 алкинила, C1-4 галогеналкила, C1-4 гидроксиалкила, C1-4 цианоалкила, Cy1, CN, NO2, ORa, SRa, C(O)Rb, C(O)NRcRd, C(O)ORa, OC(O)Rb,OC(O)NRcRd, NRcRd, NRcC(O)Rb, NRCC (O) NRcRd, NRcC(O)ORa, S(O)Rb, S(O)NRcRd, S(O)2Rb, NRcS(O)2Rb,и S(O)2NRcRd. В некоторых вариантах осуществления, Z является замещенным по крайней мере одним заместителем, включающим по крайней мере одну CN группу. В некоторых вариантах осуществления R5 представляет собой Н, галоген, C1-4 алкил, C1-4 галогеналкил, CN или NR9R10. В некоторых вариантах осуществления R5 представляет собой Н.-9 019504 В некоторых вариантах осуществления R6 представляет собой Н или C1-4 алкил. В некоторых вариантах осуществления R6 представляет собой Н. В некоторых вариантах осуществления соединение имеет формулу: В некоторых вариантах осуществления соединение имеет формулу IV: В различных местах в настоящем описании заместители соединений по изобретению раскрываются в виде групп или в виде диапазонов. Преднамеренно подразумевается, что изобретение включает каждую и любую субкомбинацию членов таких групп и диапазонов. Например, термин "C1-6 алкил" специально предназначен для отдельного раскрытия метила, этила, С 3 алкила, С 4 алкила, С 5 алкила и С 6 алкила. Дополнительно следует понимать, что некоторые отличительные особенности изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, также могут быть обеспечены в сочетании с единственным вариантом осуществления. Наоборот, различные отличительные особенности изобретения, которые для краткости описаны в контексте единственного варианта осуществления также могут быть обеспечены по отдельности или в любой подходящей субкомбинации. В различных местах в настоящем описании описываются связывающие заместители. Специально подразумевается, что каждый связывающий заместитель включат как прямую, так и обратную форму связывающего заместителя. Например, -NR(CR'R")n- включает как NR(CR'R")n, так и -(CR'R")nNR-. Когда в структуре ясно требуется связывающая группа, в качестве связывающей группы следует понимать переменные Маркуша, перечисленные для такой группы. Например, если структура требует присутствия связывающей группы и определение группы Маркуша для данной переменной перечисляет "алкил" или"арил", то следует понимать, что "алкил" или "арил" представляют собой алкиленовую группу или ариленовую группу, соответственно. Термин "n-членный", где n представляет собой целое число, описывает число образующих кольцо атомов в фрагменте, где число образующих кольцо атомов равно n. Например, пиперидинил представляет собой пример 6-членного гетероциклоалкильного кольца и 1,2,3,4-тетрагидронафталин представляет собой пример 10-членной циклоалкильной группы. Для использования в данном описании, подразумевается, что термин "алкил" относится к насыщенным углеводородным группам, которые являются линейными или разветвленными. Примеры алкильных групп включают метил (Me), этил (Et), пропил (например, н-пропил и изопропил), бутил (например, нбутил, изобутил, трет-бутил), пентил (например, н-пентил, изопентил, неопентил), и тому подобные. Алкильная группа может содержать от 1 до примерно 20, от 2 до примерно 20, от 1 до примерно 10, от 1 до примерно 8, от 1 до примерно 6, от 1 до примерно 4, от 1 до примерно 3 атомов углерода. Связывающая алкильная группа упоминается в данном описании как "алкилен". Для использования в данном описании термин "алкенил" относится к алкильной группе, имеющей одну или более двойных углерод-углеродных связей. Примеры алкенильных групп включают этенил,пропенил, циклогексенил и тому подобные. Связывающая алкенильная группа упоминается в данном описании как "алкенилен". Для использования в данном описании, термин "алкинил" относится к алкильной группе, имеющей одну или более тройных углерод-углеродных связей. Примеры алкинильных групп включают этинил,пропинил, и тому подобные. Связывающая алкинильная группа упоминается в данном описании как "алкинилен". Для использования в данном описании, термин "галогеналкил" относится к алкильной группе, имеющей один или несколько галогеновых заместителей. Примеры галогеналкильных групп включают CF3,C2F5, CHF2, CCl3, CHCl2, C2Cl5 и тому подобные. Для использования в данном описании термин "галогенсульфанил" относится к серосодержащей группе, имеющей один или несколько галогеновых заместителей. Примеры галогенсульфанильных групп включают пентагалогенсульфанильные группы, такие как SF5. Для использования в данном описании, термин "арил" относится к моноциклическим или полициклическим (например, имеющим 2, 3 или 4 конденсированных кольца) ароматическим углеводородам,- 10019504 таким как, например, фенил, нафтил, антраценил, фенантренил, инданил, инденил и тому подобные. В некоторых вариантах осуществления, арильные группы содержат от 6 до примерно 20 атомов углерода. Связывающая арильная группа упоминается в данном описании как "арилен". Для использования в данном описании термин "циклоалкил" относится к неароматическим циклическим углеводородам, включая циклизованные алкильные, алкенильные и алкинильные группы. Циклоалкильные группы могут включать моно или полициклические (например, имеющие 2, 3 или 4 конденсированных кольца) группы и спироциклы. Образующие кольцо атомы углерода циклоалкильной группы необязательно могут быть замещенными оксо или сульфидо группой. Циклоалкильные группы также включают циклоалкилидены. Примеры циклоалкильных групп включают циклопропил, циклобутил,циклопентил, циклогексил, циклогептил, циклопентенил, циклогексенил, циклогексадиенил, циклогептатриенил, норборнил, норпинил, норкарнил, адамантил и тому подобные. Также в определение циклоалкила включены фрагменты, которые содержат одно или несколько конденсированных ароматических колец (т.е., имеющие общую связь) с циклоалкильным кольцом, например, бензо-или тиенильные производные пентана, пентена, гексана и тому подобные. Циклоалкильная группа, содержащая конденсированное ароматическое кольцо может быть присоединена через любой образующий кольцо атом, включая образующие кольцо атомы конденсированного ароматического кольца. Связывающая циклоалкильная группа упоминается в данном описании как "циклоалкилен". Для использования в данном описании термин "гетероарил" относится к ароматическому гетероциклу, имеющему по крайней мере один гетероатом в кольце, такой как сера, кислород или азот. Гетероарильные группы включают моноциклические и полициклические (например, имеющие 2, 3 или 4 конденсированных кольца) системы. Примеры гетероарильных групп включают без ограничения пиридил,пиримидинил, пиразинил, пиридазинил, триазинил, фурил, хинолил, изохинолил, тиенил, имидазолил,тиазолил, индолил, пиррил, оксазолил, бензофурил, бензотиенил, бензтиазолил, изоксазолил, пиразолил,триазолил, тетразолил, индазолил, 1,2,4-тиадиазолил, изотиазолил, бензотиенил, пуринил, карбазолил,бензимидазолил, индолинил, и тому подобные. В некоторых вариантах осуществления, гетероарильная группа содержит от 1 до примерно 20 атомов углерода и в следующих вариантах осуществления от примерно 3 до примерно 20 атомов углерода. В некоторых вариантах осуществления, гетероарильная группа содержит от 3 до примерно 14, от до примерно 14, от 3 до примерно 7 или 5-6 образующих кольцо атомов. В некоторых вариантах осуществления, гетероарильная группа содержит от 1 до примерно 14, от 1 до примерно 3 или 1-2 гетероатома. Связывающая гетероарильная группа упоминается в данном описании как "гетероарилен". Для использования в данном описании, термин "гетероциклоалкил" относится к неароматическим гетероциклам, включая циклические алкильные, алкенильные и алкинильные группы, где один или несколько из образующих кольцо атомов углерода заменен на гетероатом, такой как атом О, N или S. Гетероциклоалкильные группы включают моноциклические и полициклические (например, имеющие 2, 3 или 4 конденсированных кольца) системы, а также спироциклы. Пример "гетероциклоалкильных" групп включает морфолино, тиоморфолино, пиперазинил, тетрагидрофуранил, тетрагидротиенил, 2,3-дигидробензофурил, 1,3-бензодиоксол, бензо-1,4-диоксан, пиперидинил, пирролидинил, изоксазолидинил, изотиазолидинил, пиразолидинил, оксазолидинил, тиазолидинил, имидазолидинил и тому подобные. Образующие кольцо атомы углерода и гетероатомы гетероциклоалкильной группы необязательно могут быть замещенными оксо или сульфидо группой. Также в определение гетероциклоалкила включены фрагменты, которые содержат одно или несколько конденсированных ароматических колец (т.е., имеющие общую связь) с неароматическим гетероциклическим кольцом, например, фталимидил, нафталимидил и бензопроизводные гетероциклов. Гетероциклоалкильная группа может быть присоединена через образующий кольцо атом углерода или образующий кольцо гетероатом. Гетероциклоалкильная группа, содержащая конденсированное ароматическое кольцо, может быть присоединена через любой образующий кольцо атом, включая образующий кольцо атом конденсированного ароматического кольца. В некоторых вариантах осуществления, гетероциклоалкильная группа содержит от 1 до примерно 20 атомов углерода и в дополнительных вариантах осуществления от примерно 3 до примерно 20 атомов углерода. В некоторых вариантах осуществления гетероциклоалкильная группа содержит от 3 до примерно 14, от 4 до примерно 14, от 3 до примерно 7, или 5-6 образующих кольцо атомов. В некоторых вариантах осуществления гетероциклоалкильная группа содержит от 1 до примерно 4, от 1 до примерно 3 или 1-2 гетероатома. В некоторых вариантах осуществления гетероциклоалкильная группа содержит 0-3 двойных или тройных связи. В некоторых вариантах осуществления гетероциклоалкильная группа содержит 0-2 двойных или тройных связи. Связывающая гетероциклоалкильная группа упоминается в данном описании как "гетероциклоалкилен." Для использования в данном описании, "гало" или "галоген" включает фтор, хлор, бром и иод. Для использования в данном описании, термин "арилалкил" относится к алкилу, замещенному арилом, а термин "циклоалкилалкил" относится к алкилу, замещенному циклоалкилом. Примером арилалкильной группы является бензил. Для использования в данном описании, термин "гетероарилалкил" относится к алкилу, замещенному гетероарилом и "гетероциклоалкилалкил" относится к алкилу, замещенному гетероциклоалкилом. Для использования в данном описании, термин "амино" относится к NH2. Для использования в данном описании, термин "алкиламино" относится к аминогруппе, замещенной алкильной группой. Для использования в данном описании, термин "диалкиламино" относится к аминогруппе, замещенной двумя алкильными группами. Для использования в данном описании, термин "гидроксилалкил" относится к алкильной группе,замещенной гидроксилом. Для использования в данном описании, термин "цианоалкил" относится к алкильной группе, замещенной циано. Атом углерода цианогруппы обычно не входит в счет углеродов, предшествующих термину. Например, цианометил рассматривается в данном описании как C1 цианоалкильная группа. Описанные здесь соединения могут быть асимметрическими (например, содержащими одни или несколько стереоцентров). Все стереоизомеры, такие как энантиомеры и диастереомеры, включены в объем изобретения, если не указано другого. Соединения по настоящему изобретению, которые содержат асимметрически замещенные атомы углерода, могут быть выделены в оптически активной или рацемической формах. Известные из уровня техники способы получения оптически активных форм из оптически активных исходных веществ включают такие, как разделение рацемических смесей или стереоселективный синтез. Многие геометрические изомеры олефинов, соединений с C=N двойными связями и тому подобных также могут присутствовать в описанных здесь соединениях, и все такие стабильные изомеры также подразумеваются в настоящем изобретении. Описаны цис- и транс-геометрические изомеры соединений по настоящему изобретению и они могут быть выделены в виде смеси изомеров или в виде разделенных изомерных форм. Разделение на оптические изомеры рацемических смесей соединений может быть проведено с помощью любого из многочисленных способов, известных в данной области. Иллюстративный способ включает дробную кристаллизацию с использованием хиральной разделяющей кислоты, которая представляет собой оптически активную солеобразующую органическую кислоту. Подходящими разделяющими агентами для способов дробной кристаллизации являются, например, оптически активные кислоты, такие как D- и L-формы винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты, или различные оптически активные камфорсульфоновые кислоты, такие как -камфорсульфоновая кислота. Другие разделяющие агенты, пригодные для способов дробной кристаллизации, включают стереозомерно чистые формы -метилбензиламина(например, S- и R-формы или диастереомерно чистые формы), 2-фенилглицин, норэфедрин, эфедрин, Nметилэфедрин, циклогексилэтиламин, 1,2-диаминоциклогексан и тому подобные. Разделение на оптические изомеры рацемических смесей также может быть проведено путем элюирования на колонке, заполненной оптически активным разделяющим агентом (например, динитробензоилфенилглицин). Подходящая композиция растворителей для элюирования может быть определена специалистом в данной области. Соединения по изобретению также включают таутомерные формы. Таутомерные формы являются результатом замены простой связи со смежной двойной связью вместе с сопутствующей миграцией протона. Таутомерные формы включают прототропные таутомеры, которые представляют собой изомерные протонированные состояния, имеющие одну и ту же эмпирическую формулу и общий заряд. Примеры прототропных таутомеров включают пары кетоненол, пары амидимидиновая кислота, пары лактамлактим, пары амидимидиновая кислота, пары енаминимин и кольцеобразные формы, где протон может занимать два или более положений в гетероциклической системе, например, 1 Н- и 3 Н-имидазол, 1 Н-, 2 Ни 4 Н-1,2,4-триазол, 1 Н- и 2 Н-изоиндол и 1 Н-и 2 Н-пиразол. Таутомерные формы могут находиться в равновесии или же они стерически зафиксированы в одной форме за счет подходящего замещения. Соединения по изобретению дополнительно включают гидраты и сольваты, а также безводные и несольватированные формы. Соединения по изобретению также включают все изотопы атомов, существующих в промежуточных или конечных соединениях. Изотопы включают те атомы, которые имеют такой же атомный номер,но различные массовые числа. Например, изотопы водорода включают тритий и дейтерий. В некоторых вариантах осуществления, соединения по изобретению и их соли по существу являются выделенными. Под выражением "по существу выделенные" подразумевается, что соединения по крайней мере частично или, по существу, отделены от окружающей среды, в которой они образовались или были обнаружены. Частичное разделение может включать, например, композицию, обогащенную соединением по изобретению. Разделение, по существу, может включать композиции, содержащие по крайней мере примерно 50%, по крайней мере примерно 60%, по крайней мере примерно 70%, по крайней мере примерно 80%, по крайней мере примерно 90%, по крайней мере примерно 95%, по крайней мере примерно 97% или по крайней мере примерно 99% по весу соединения по изобретению или его соли. Способы выделения соединений и солей являются обычными для данной области. Выражения "температура окружающей среды" и "комнатная температура" как они использованы в данном описании, понятны в данной области и относятся обычно к температуре, например, к температу- 12019504 ре реакции, которая является близкой к температуре в комнате, где проводят реакцию, например, к температуре от примерно 20 С до примерно 30 С. Выражение "фармацевтически приемлемый" используется в данном описании для упоминания тех соединений, веществ, композиций и/или препаративных дозированных форм которые, в рамках значимого медицинского суждения, являются подходящими для применения в контакте с тканями организма человека и животных без избыточной токсичности, раздражения, аллергической ответной реакции или других проблем или осложнений, соразмерных с разумным соотношением преимущество/риск. Настоящее изобретение также включает фармацевтически приемлемые соли описанных здесь соединений. Для использования в данном описании, термин "фармацевтически приемлемые соли" относится к производным описанных соединений, в которых исходные соединения модифицированы путем преобразования существующего фрагмента кислоты или основания в его солевую форму. Примеры фармацевтически приемлемых солей включают, но не ограничиваются указанным, соли минеральных или органических кислот и основных остатков, таких как амины; щелочные или органические соли кислотных остатков, таких как карбоновые кислоты; и тому подобные. Фармацевтически приемлемые соли по настоящему изобретению включают обычные нетоксичные соли исходных соединений, образованные, например, нетоксичными неорганическими или органическими кислотами. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы из исходных соединений, которые содержат основный или кислотный фрагмент с помощью обычных химических методов. Обычно такие соли могут быть получены путем взаимодействия свободных кислотных или основных форм данных соединений со стехиометрическим количеством подходящего основания или кислоты в воде или в органическом растворителе, или в смеси этих двух растворителей; обычно неводные среды,такие как простой эфир, этилацетат, этанол, изопропанол или ацетонитрил (MeCN) являются предпочтительными. Перечень подходящих солей можно найти в публикациях Remington's Pharmaceutical Sciences,17th ed., Mack-Publishing Company, Easton, Pa., 1985, p. 1418 и Journal of Pharmaceutical Science, 66, 2(1977), каждая из которых включены в данное описание в качестве ссылки во всей своей полноте. Настоящее изобретение также включает пролекарства описанных здесь соединений. Для использования в данном описании, термин "пролекарства" относится к ковалентно связанным носителям, которые высвобождают активное исходное лекарственное средство при введении субъекту-млекопитающему. Пролекарства могут быть получены путем модификации функциональных групп, присутствующих в соединениях, таким образом, что модифицированные группы расщепляются либо при обычных манипуляциях, либо in vivo, приводя к исходным соединениям. Пролекарства включают соединения, в которых гидроксильная, амино, сульфгидрильная или карбоксильная группы связаны с любой группой которая,при введении субъекту-млекопитающему, расщепляется с образованием свободной гидроксильной, амино, сульфгидрильной или карбоксильной группы соответственно. Примеры пролекарств включают, но не ограничиваются указанным, ацетатные, формиатные и бензоатные производные спиртовой и аминной функциональных групп в соединениях по изобретению. Получение и применение пролекарств обсуждается в публикациях Т. Higuchi and V. Stella, "Pro-drugs as Novel Delivery Systems," Vol. 14 of the A. C. S.Association и Pergamon Press, 1987, обе из которых включены в данное описание в качестве ссылки во всей своей полноте. Синтез Соединения по данному изобретению, включая их соли, могут быть получены с использованием известных методов органического синтеза и могут быть синтезированы в соответствии с любым из возможных путей синтеза. Реакции получения соединений по изобретению могут быть проведены в подходящих растворителях, которые легко могут быть выбраны специалистом в области органического синтеза. Подходящие растворители по существу могут быть не реакционноспособными по отношению к исходным веществам (реагенты), промежуточным соединениям или продуктам при температурах, при которых проводят реакции, например, при температурах, которые могут колебаться от температуры замерзания растворителя до температуры кипения растворителя. Данную реакцию можно проводить в одном растворителе или смеси растворителей. В зависимости от конкретной стадии реакции подходящие растворители для конкретной стадии реакции могут быть выбраны квалифицированным специалистом. Получение соединение по изобретению может включать введение и удаление защиты различных химических групп. Необходимость во введении и удалении защитной группы и выбор подходящей защитной группы легко могут быть определены специалистом в данной области. Вопросы химии защитных групп можно найти в книге Т. W. Green and P. G. M. Wuts, Protective Groups in Organic Synthesis, 3rd.Ed., WileySons, Inc., New York (1999), которая включены в данное описание путем ссылки во всей своей полноте. Реакции можно контролировать с помощью любого подходящего способа, известного в данной области. Например, образование продукта можно контролировать спектроскопическими методами, такими как спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), инфракрасная спектроскопия,спектрофотометрия (например, в видимой и ультрафиолетовой областях света) или масс-спектрометрия или с помощью хроматографии, такой как высокоэффективная жидкостная хроматография (ВЭЖХ) или тонкослойная хроматография. Соединения по изобретению могут быть получены в соответствии с многочисленными путями синтеза, известными в литературе. Примеры методов синтеза для получения соединений по изобретению приведены ниже на схемах. Как показано на схеме 1, пиразолсодержащие центральные фрагменты 1-9 и 1-6 могут быть синтезированы, исходя из пирроло[2,3-b]пиридина или пирроло[2,3-b]пиримидина 1-1. Соединение 1-1 может быть преобразовано в активные производные, такие как аналог N-оксида (1-2) с использованием окислителя, такого как м-СРВА. N-оксид 1-2 можно галогенировать с использованием галогенирующего агента,такого как сочетание бромида тетраметиламмония и метансульфонового ангидрида, с образованием 4 галогензамещенного соединения 1-3, такого как 4-бромсодержащее соединение, при восстановлении в то же самое время N-оксида. Аминная группа в соединении 1-3 может быть защищена подходящей защитной группой амина с получением защищенного соединения 1-7, которое впоследствии подвергается кросс-сочетанию по Сузуки с борной кислотой 1-8, давая пиразолсодержащие центральные фрагменты 19 а, которые далее могут быть подвергнуты взаимодействию с реагентом L-(Y)n-Z (где L представляет собой уходящую группу), приводя к соединениям по изобретению 1. Альтернативно, N-оксид 1-2 можно галогенировать с использованием галогенирующего агента, такого как MeSO2Cl с образованием 4 галогензамещенного соединения 1-4, такого как 4-хлорсодержащее соединение, при восстановлении в то же самое время N-оксида. 4-Хлорсодержащее соединение 1-4 может быть конденсировано с бромзамещенным соединением пиразола 1-5 в подходящих условиях, таких как нагревание, с получением пиразолсодержащего центрального фрагмента 1-6, который может содержать некоторые функциональные группы, такие как бром или циано, подходящие для последующей химической модификации. Аналогично, имидазольный центральный фрагмент 1-11 может быть синтезирован конденсацией 4 галогензамещенного соединения 1-4 с имидазольным производным 1-10 в подходящих условиях, таких как нагревание, с получением имидазолсодержащего центрального фрагмента 1-11, который может содержать некоторые функциональные группы, такие как бром или циано, подходящие для последующей химической модификации. Схема 1 Как показано на схеме 2, пиразолсодержащие центральные фрагменты 2-3, 2-5 и 2-6 могут быть синтезированы, исходя из бромзамещенного производного пиразола 2-1 (соединение 1-6 на схеме 1, где один из R5 представляет собой Br). Бромзамещенное производное пиразола 2-1 может быть сконденсировано с борсодержащими ароматическими производными, такими как ароматические бороновые кислоты 2-2 с использованием кросс-сочетания Сузуки, где Ar представляет собой арил или гетероарил, каждый из которых может быть необязательно может быть замещенным одним или несколькими заместителями,такими как алкил, арил, CN, нитро, алкокси и.т.д. Альтернативно алкен- или алкинсодержащее соединение, такое как алкенсодержащее соединение 2-5, может быть получено путем конденсации бромзамещенного производного пиразола 2-1 с ненасыщенным соединение, такими как алкен 2-4 в присутствии металлического катализатора, такого как хлорид бис (трифенилфосфин)палладия (II), где t может быть равным 0, 1, 2 и тому подобному; и R может представлять собой заместитель, такой как алкил, арил, CN,- 14019504 нитро, алкокси и т.д. Алкеновая группа в соединении 2-5 может быть восстановлена путем гидрирования, с образованием соответствующего соединения 2-6. Схема 2 Как показано на схеме 3, имидазолсодержащие центральные фрагменты 3-7 могут быть синтезированы, исходя из N-защищенного 4-бромпирроло[2,3-b]пиридина или N-защищенного 4-бромпирроло[2,3b]пиримидина 3-1, где Р представляет собой подходящую защитную группу амина, такую как [2(триметилсилил)этокси]метил(SEM). Соединение 3-1 может быть подвергнуто взаимодействию с реактивом Гриньяра, таким как изопропилмагнийхлорид, для генерирования ароматического аниона путем ионного обмена. Последующее присоединение к аниону хлорацетилсодержащего соединения, такого как 2-хлор-N-метокси-N-метилацетамид 3-2, обычно будет приводить к хлорацетильному производному 3-3. Производное 3-3 может быть подвергнуто взаимодействию с солью органической кислоты, такой как цезиевая соль R5CO2Cs, с получением соединения 3-4. В присутствии подходящего источника аммиака,такого как ацетат аммония, соединение 3-4 может взаимодействовать с аммиаком в подходящих условиях, таких как высокая температура с образованием имидазольного кольца соединения 3-5. Азот свободного амина в имидазольном производном 3-5 может быть подвергнут последующей модификации, такой как взаимодействие с соединением X-(Y)n-Z, где X представляет собой уходящую группу, такую как хлор, бром или иод, таким образом, что образуется соединение 3-6. Защитная группа в соединении 3-6 может быть удалена с помощью подходящего способа в соответствии с природой защитной группы, приводя к соединению 3-7. Следует отметить, что если имеются функциональные группы, присутствующие в группе R, R5 и -(Y)n-Z, могут быть проведены дальнейшие модификации. Например, группа CN может быть гидролизована, с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир, который, в свою очередь, может быть восстановлен до спирта, который в свою очередь может быть модифицирован в дальнейшем. Специалисту в данной области будут понятны подходящие последующие модификации. Схема 3 Как показано на схеме 4, тиазолсодержащие центральные фрагменты 4-3 могут быть синтезированы, исходя из N-защищенного хлорацетильного производного 4-1, где Р представляет собой подходящую защитную группу амина, такую как SEM. Соединение 4-1 может реагировать с тиоамидом 4-2 с образованием тиазольного кольца с последующим удалением защитной группы у аминного атома азота в пиррольном кольце посредством удаления группы Р, с получением соединения 4-3. Различные тиомочевины 4-5 (эквиваленты соединению 4-2, где -(Y)n-Z представляет собой NR'R"; и R' и R представляют собой Н, алкил, арил или тому подобное; или R' и R' 'вместе с атомом N, к которому они присоединены образует гетероциклоалкил), которые можно использовать для получения тиазольных соединений 4-3, могут быть получены из вторичных аминов 4-4. Вторичный амин 4-4 может взаимодействовать с 1,1'тиокарбонилдиимидазолом, и полученное промежуточное соединение может далее взаимодействовать с аммиаком, давая тиомочевину 4-5. Как показано на схеме 5, тиазолсодержащие центральные фрагменты 5-5 могут быть синтезированы, исходя из тиазольного соединения 5-1. Соединение 5-1 может быть подвергнуто взаимодействию с алкилом металла, таким как н-бутиллитий, для генерирования ароматического аниона in situ посредством ионного обмена. Последующее присоединение триметилового эфира борной кислоты с последующим гидролизом обычно будет приводить к борной кислоте 5-2. Борная кислота 5-2 может вступать в кросссочетание по Сузуки с N-защищенным 4-бромпирроло[2,3-b]пиридином или N-защищенным 4-бромпирроло[2,3-b]пиримидином 5-3, где Р представляет собой подходящую защитную группу амина, такую какSEM. Защитная группа Р в продукте кросс-сочетания 5-4 может быть удалена с использованием подходящего способа в соответствии с природой защитной группы, приводя к соединению по изобретению 5-5. Схема 5 Как показано на схеме 6, пиразолсодержащие соединения 6-1 могут быть дополнительно модифицированы путем замещения пиразольной NH-группы подходящими реагентами. Например, соединение 6-1, в котором Р представляет собой подходящую защитную группу амина, такую как SEM, может быть подвергнуто взаимодействию с L-(Y)n-Z, где L представляет собой уходящую группу, такую как галоген,трифлат или тому подобные, с получением в основных условиях соединения 6-2. Если некоторые функциональные группы присутствуют в группах Y и/или Z, могут быть проведены дальнейшие модификации. Например, группа CN может быть гидролизована с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир, который в свою очередь может быть восстановлен до спирта. Специалисту в данной области будут понятны подходящие последующие модификации. Кроме того, соединение 6-1 может быть подвергнуто взаимодействию с алкеном 6-3 (где R' и R" могут представлять собой Н, алкил, циклоалкил и тому подобные; и Z' может представлять собой электроноакцепторную группу, такую как сложноэфирная группа или CN), приводя к получению соединения 6-4. Кроме того, можно провести замещение алкена 6-3 в альфа-положение (альфа относительно Z1) для образования замещенных производных продукта 6-4 (см., например, пример 68). В соединениях 6-2 и 6-4 могут быть удалены защитные группы с использованием подходящих способов в соответствии с природой использованной защитной группы, с получением из соответствующих незащищенных эквивалентов. Схема 6 Как показано на схеме 7, бромпиразол содержащие соединения 7-1 могут быть далее модифицированы путем металлирования такими реагентами, как бутиллитий, и взаимодействия с электрофилами,такими как альдегиды, с получением спиртосодержащих соединений 7-2, в которых может быть удалена защитная группа с получения соединений по изобретению, имеющих формулу 7-3. Специалисту в данной области будут понятны подходящие последующие модификации, где это является подходящим. Схема 7 Как показано на схеме 8, пиразолсодержащие соединения 8-4 и 8-5 могут быть получены взаимодействием N-защищенного бромидного соединения 8-1 с гидразином в подходящем растворителе, таком как N,N-диметилформамид (ДМФ), с получением гидразинового промежуточного соединения 8-2. Гидразиновое промежуточное соединение 8-2 подвергают взаимодействию с подходящим образом замещенным 1,3-бисальдегидом таким как 8-3 с получением пиразолсодержащего соединения 8-4. Если некоторые функциональные группы присутствуют в группах Y и/или Z, могут быть проведены дальнейшие модификации. Например, группа CN может быть гидролизована с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир, который в свою очередь может быть восстановлен до спирта. Специалисту в данной области будут понятны подходящие последующие модификации. Схема 8 Как показано на схеме 9, соединение 1,2,4-оксадиазола 9-6 может быть получено из N-защищенного бромидного соединения 9-1 при обработке его цианидом цинка в ДМФ в присутствии катализатора, такого как бис(трибутил)палладий, с получением N-защищенного циано-соединения 9-2. N-Гидроксикарбоксимидамидное соединение 9-3 может быть получено путем нагревания N-защищенного цианосоединения 9-2 с гидрохлоридом гидроксиламина в подходящем растворителе, таком как этанол, в присутствии основания, такого как карбонат калия, при температуре ниже температуры кипения растворителя. N-Защищенное соединение 1,2,4-оксадиазола может быть получено путем обработки Nгидроксикарбоксимидамидного соединения 9-3 подходящим образом замещенным хлорангидридом кислоты 9-4 в растворителе, таком как пиридин, при температуре, достаточной для завершения замыкания кольца. Если некоторые функциональные группы присутствуют в группах Y и/или Z, могут быть проведены дальнейшие модификации. Например, группа CN может быть гидролизована с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир, который в свою очередь может быть восстановлен до спирта. Специалисту в данной области будут понятны подходящие последующие модификации, где это является подходящим. Схема 9 Как показано на схеме 10, 3- и 4-арилпиразоло-соединения 10-9 могут быть получены путем взаимодействия соответствующего 3-арилпиразоло-соединения 10-4 или 4-арилпиразоло-соединения 10-7 с подходящим образом замещенным бромидным соединением 10-8, как описано ранее. 3-Арилпиразольное соединение 10-4 может быть получено путем взаимодействия замещенной подходящим образом арильной группы, содержащей галоген, такой как бром, или трифлат с N-защищенной бороновой кислотой или сложным эфиром бороновой кислоты соединения пиразола 10-2 в условиях типа условий Сузуки, известных в литературе. N-защитная группа в 10-3 может быть удалена в условиях, описанных ранее и известных в литературе для удаления группы, такой как SEM. 4-Арилпиразольные соединения 10-7 могут быть получены путем взаимодействия подходящим образом замещенного соединения ацетофенона 10-5 с ацеталем ДМФ при повышенной температуре, с получением диметиламино-соединения 10-6. 4-Арилпиразоло-соединения 10-7 могут быть получены путем обработки диметиламино-соединения 10-6 с гидразином в растворителе, таком как этанол. Схема 10 Как показано на схеме 11, замещенное соединение пиразола 11-5 может быть получено множеством способов, таких как удаление защитной группы, например, SEM, в соединении 11-4 в ранее описанных условиях. Например, замещенное N-защищенное соединение пиразола 11-4 может быть получено путем взаимодействия промежуточного N-защищенного соединения пиразола 11-3 с подходящим образом замещенным алкилгалогенидом, бензилгалогенидом, алкилсульфонатами, например, мезилатом или тозилатом или при других подходящих уходящих группах L, в подходящем растворителе, таком как MeCN,ДМФ или тетрагидрофуран (ТГФ), в присутствии основания, такого как гидрид натрия или карбонат цезия. N-Арилпиразол 11-4 (где Y является ароматической группой) может быть получен путем взаимодействия промежуточного пиразола 11-3 с подходящим образом замещенной арилбороновой кислотой в растворителе, таком как дихлорметан (ДХМ) в присутствии ацетата меди и пиридина. Альтернативно, Nарилпиразол 11-4 (где Y является ароматической группой) может быть получен путем взаимодействия промежуточного пиразола 11-3 с подходящим образом замещенным арилфторидом в растворителе, таком как ДМФ, при повышенной температуре. Или замещенные соединения пиразола 11-4 (где Z представляет собой группу, такую как нитрильная или сложноэфирная, и Y имеет по крайней мере два углерода) могут быть получены путем взаимодействия промежуточного пиразола 11-3 с подходящим образом замещенным акрилатом, акрилонитрилом или другими акцепторами типа Михаэля в растворителе,таком как ДМФ, в присутствии основания, такого как 1,8-диазабицикло[5,4,0]ундец-7-ен (ДБУ) или триэтиламин (TEA) и при температуре ниже температуры кипения растворителя. Если некоторые функциональные группы присутствуют в группах Y и/или Z, могут быть проведены дальнейшие модификации. Например, группа CN может быть гидролизована с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир, который в свою очередь может быть восстановлен до спирта. Специалисту в данной области будут понятны подходящие последующие модификации, где это является подходящим. Схема 11 Как показано на схеме 12, пиразол 12-1, где Р представляет собой подходящую защитную группу амина, такую как SEM, может быть подвергнут взаимодействию с алкинсодержащим сопряженным акцептором, таким как 12-2, где Z представляет собой электроноакцепторную группу (например, -CN) необязательно в присутствии основания (ДБУ или K2CO3 и тому подобные) в растворителе, таком как ДМФ или MeCN при различной продолжительности времени для получения олефинсодержащих аддуктов 12-3. В соединениях, представленных формулой 12-3, может быть удалена защитная группа с ис- 18019504 пользованием подходящих способов в соответствии с природой использованной защитной группы, с получением соединений по изобретению 12-4. Схема 12 Как показано на схеме 13, оксазол- или тиазолсодержащие соединения 13-6 могут быть получены,исходя из N-защищенного 4-хлор-пирроло[2,3-b]пиримидина 13-1, где Р представляет собой подходящую защитную группу амина, такую как SEM. Оксазол- или тиазолсодержащие продукты формулы 13-2 могут быть получены катализируемой палладием конденсацией 13-1 с оксазолом или тиазолом. Соединение 13-2 может быть подвергнуто взаимодействию с алкилом металла, таким как н-бутиллитий, для генерирования ароматического аниона in situ, к которому могут быть присоединены при низких температурах (предпочтительно между -78 С и 0 С) производные карбоновых кислот 13-3 (где W = N(Me)(OMe),когда X'=S; и W=Cl, когда Х'=O), в присутствии других вспомогательных добавок, таких как хлорид цинка или иодид меди (I), когда Х'=O, в подходящем растворителе, таком как ТГФ, для образования множества кетонов 13-4. Кетоны 13-4 могут быть подвергнуты взаимодействию со множеством реагентов, таких как диэтил(цианометил)фосфонат или триэтилфосфоноацетат в присутствии основания, такого как трет-бутоксид калия, с последующим восстановлением (включая гидрирование или медь-гидрид катализируемое восстановление) или с реагентами, такими как тозилметилизоцианид для получения продуктов формулы 13-5, где Z представляет собой электроноакцепторную группу, такую как сложноэфирная или -CN. Если некоторые функциональные группы присутствуют в группе R или они охватываютсяZ, могут быть проведены дальнейшие модификации, и такие подходящие дальнейшие модификации будут очевидны для специалиста в данной области. В соединениях 13-5 может быть удалена защитная группа с использованием подходящих способов в соответствии с природой использованной защитной группы, с получением соответствующих незащищенных эквивалентов 13-6. Схема 13 Как показано на схеме 14, аминотиазолсодержащие центральные фрагменты 14-5 могут быть синтезированы, исходя из тиазолсодержащего центрального фрагмента 14-1, где Р представляет собой подходящую защитную группу амина, такую как SEM. Соединение 14-1 может быть обработано алкилом металла, таким как н-бутиллитий, для генерирования ароматического аниона in situ, к которому может быть добавлен подходящий источник электрофильного галогена, такой как четырехбромистый углерод, с получением галогенированного производного 14-2. Защитная группа Р в 14-2 может быть удалена с использованием подходящего способа в соответствии с природой использованной защитной группы, с получением продукта 14-3. Соединение 14-3 может быть подвергнуто взаимодействию с аминами 14-4 при повышенной температуре в подходящем растворителе, таком как ДМФ, с получением соединения по изобретению 14-5. Как показано на схеме 15, пирролсодержащие центральные фрагменты 15-4 могут быть синтезированы, исходя из N-защищенного 4-хлор-пирроло[2,3-b]пиримидина 15-1, где Р представляет собой подходящую защитную группу амина, такую как DEM (диэтоксиметил). Соединение 15-1 может быть подвергнуто взаимодействию с 1-(триизопропилсилил)пиррол-3-бороновой кислотой в условия кросссочетания по Сузуки, с получением одновременно пиррольного центрального фрагмента с удаленной защитной группой 15-2. Пирролсодержащие соединения 15-2 могут быть подвергнуты взаимодействию с алкенами 15-3, содержащими электроноакцепторную группу Z (такую как -CN) в присутствии подходящего основания (такого как ДБУ) при различных температурах (например, между комнатной температурой и 40 С) с последующей in situ или отдельной стадией удаления защитной группы, которая является подходящей для выбранной защитной группы, с получением соединений по изобретению 15-4. Схема 15 Как показано на схеме 16, замещенное соединение пиразола, содержащее сульфоновую или сульфоксидную функциональную группу, как в 16-6, может быть получено множеством способов, например исходя из подходящим образом замещенного бромтиофенильного простого эфира 16-2. Простой тиоэфир 16-2 легко может быть получен алкилированием тиофенола 16-1 алкилгалогенидом, мезилатом или тому подобным с использованием основания, такого как ДБУ, карбоната калия или гидрид натрия. Циннамилнитрил 16-3 может быть получен реакцией Хека или подобным способом, с использованием ацетата палладия и трифенилфосфина в ДМФ при подходящей температуре с использованием акрилонитрила. SEMзащищенное промежуточное соединение 16-4 может быть получено способами, описанными ранее для осуществления присоединения по Михаэлю пиразольного центрального фрагмента к подходящим образом замещенному -ненасыщенному нитрилу, такому как 16-3. Сульфоксид 16-5, где n=1, и сульфон 16-5, где n=2, могут быть получены способами, хорошо известными в литературе для окисления простого тиоэфира 16-4, как например с использованием м-хлорпербензойной кислоты (МСРВА) в ДХМ. Конечные соединения 16-6, где n=0, 1 или 2, могут быть получены способами, описанными ранее для удаления защитной группы SEM. Альтернативно, окисление серы может быть проведено для соединений 16-2 или 16-3 в зависимости от совместимости замещения на схеме синтеза. Схема 16 Также, как показано на схеме 17, замещенные соединения пиразола, содержащие сульфонамидную функциональную группу, такие как 17-6, могут быть получены множеством способов. Например, можно исходить из подходящим образом замещенного бромфенилсульфонамида 17-2, где Rc и Rd являются подходящими заместителями. Соединение 17-2 легко может быть получено реакцией бромфенилсульфонилхлорида 17-1 и подходящим образом замещенного амина, такого как анилин или первичный или вторичный амин, в подходящем растворителе, таком как ДХМ, ТГФ или пиридин. Циннамилнитрил 17-3 может быть получен реакцией Хека или подобным способом, с использованием ацетата палладия и трифенилфосфина в ДМФ при подходящей температуре с использованием акрилонитрила. Конечные соединения 17-6, в которых Rc и Rd являются частью сульфонамидной функциональной группы, могут быть получены способами, аналогичными описанным для схемы 16, исходя из циннамилнитрила 17-3. Схема 17 Также, как показано на схеме 18, замещенные соединения пиразола, содержащие альфа-аллильную циклопентиметиленовую функциональную группу, такие как 18-8, могут быть получены, например, путем взаимодействия пиразола 18-3, где Р представляет собой подходящую защитную группу амина, такую как SEM, и X представляет собой N или С, с циклопентилакрилатным сложным эфиром 18-4 с образованием сложного эфира 18-5. Сложный эфир 18-5 затем может быть восстановлен в соответствующий альдегид, 18-6, например, с помощью двухстадийного способа, включающего восстановление до спирта и селективное окисление промежуточного спирта в альдегид, например, путем окисления по Сверну. Альдегид 18-6 может быть преобразован в соответствующий олефин, 18-7, например, реакцией с реагентом Виттига. В олефине 18-7 затем может быть удалена защитная группа, как описано ранее, с получением соединения формулы 18-7. Промежуточное соединение 18-4 может быть получено, например, как показано на схеме 18, исходя из циклопентилальдегида. Схема 18 Также, как показано на схеме 19, цианогуанидиновое производное 19-6 может быть получено, исходя из замещенных соединений пиразола, таких как пиразол 18-3, где Р представляет собой подходящую защитную группу, и X представляет собой N или С. Соединение 18-3 может, например, быть подвергнуто взаимодействию с олефином 19-1, полученным реакцией Хорнера-Вудсворта-Эммонса соответствующего Вос-защищенного пиперидона в присутствии подходящего основного катализатора в подходящем растворителе, образуя 19-2. В промежуточном соединении 19-2 удаляют защитную группу с использованием подходящей реакции для удаления защитной группы, получая соединение амина 19-3, ко- 21019504 торое затем реагирует селективно с цианоимидокарбонатным реагентом, таким как 19-4, в полярном растворителе при подходящей температуре, например примерно 20 С, давая цианоимидокарбамат, такой как 19-5, который затем может быть подвергнут взаимодействию с любым из множества аминов при повышенной температуре с получением продукта 19-6. Схема 19 Промежуточные соединения 20-5 и 20-6 могут быть получены с использованием множества способов, известных в литературе, например способами, представленными в общем виде на схеме 20. Промежуточное соединение 20-3 может быть получено реакцией соединения альдегида 20-1 с подходящим образом замещенным реагентом Виттига или реагентами Хорнера-Эммонса с образованием - незамещенного сложного эфира 20-3. Альтернативно, 20-3 может быть получен реакцией типа реакции Хека подходящим образом замещенного арилбромида 20-2 и акрилового сложного эфира в присутствии палладиевого реагента при повышенной температуре. Соединение 20-4 может быть получено способами,описанными ранее для присоединения типа присоединения Михаэля подходящим образом замещенного пиррола 18-3 к ненасыщенному сложному эфиру 20-3. Альдегидное соединение 20-5 может быть получено восстановлением сложноэфирного соединения 20-4 с использованием реагентов, таких как диизобутилалюминийгидрид при низкой температуре, такой как примерно -78 С в подходящем растворителе. Альдегидное соединение 20-5 может быть в дальнейшем восстановлено в соответствующее соединение спирта 20-6 с использованием реагентов, таких как боргидрид натрия в метаноле. Альтернативно,соединение спирта 20-6 может быть получено непосредственно восстановлением сложного эфира 20-4 с использованием реагентов, таких как литийалюминийгидрид в подходящем растворителе и при подходящей температуре. Схема 20 Соединения 21-1 и 21-3 могут быть получены с использованием множества способов, известных в литературе, например, способами, представленными в общем виде на схеме 21. Олефиновое соединение 21-1 может быть получено взаимодействием альдегида 20-5 с подходящим образом замещенным реагентом Виттига или реагентами Хорнера-Эммонса с использованием основания, такого как гидрид натрия или трет-бутоксид калия, в подходящем растворителе, при проведении при повышенной температуре. Олефиновое соединение 21-1 может быть восстановлено до насыщенного соединения 21-2, например, с использованием условий гидрирования, хорошо известных в литературе, например гидрирования в присутствии палладия на угле в таком растворителе как метанол. Ацетиленовое соединение 21-3 может быть получено способами, описанными ранее или реакцией альдегида 20-5 с реагентом Бестманна-Охира (Е.Quesada et al, Tetrahedron, 62 (2006) 6673-6680), как описано в литературе. Альтернативно, соединение спирта 20-6 на схеме 20 может быть окислено в альдегид 20-5 с использованием способов, хорошо известных в литературе, например, в условиях окисления Сверна, с последующей реакцией с реагентом Бестманна-Охира, где данная последовательность реакций может быть проведена в виде "one-pot" двухстадийной реакционной последовательности или в виде двух отдельных стадий реакции. Схема 21 Соединения 22-1 и 22-3 могут быть получены с использованием множества способов, известных в литературе, например, способами, представленными в общем виде на схеме 22. Кислород-замещенное соединение 22-1 может быть получено, например, взаимодействием с подходящим образом замещенным спиртом 20-6 (на схеме 20), где X представляет собой N или С, и Р представляет собой защитную группу,с основанием, таким как гидрид натрия, и подходящим агентом, таким как алкилиодид, карбонат или изоцианат, проведенным в подходящем растворителе и при подходящей температуре. Альтернативно,спиртовая группа в соединении 20-6 может быть преобразована в уходящую группу LG, как в соединении 22-2, где уходящая группа может представлять собой бромид или мезилат. Соединение 22-2 служит субстратом для последующей реакции с нуклеофилом, таким как например этоксид натрия (Nuc = этокси). Схема 22 Следует отметить, что на всех описанных схемах, если функциональные группы присутствуют в одной из групп заместителей, такой как Y, Z, R, R1, R2, R5 и т.д., могут быть проведены дальнейшие модификации, если это является подходящим и желательным. Например, группа CN может быть гидролизована с получением амидной группы, карбоновая кислота может быть преобразована в сложный эфир,который в свою очередь может быть восстановлен до спирта. В другом примере ОН-группа может быть преобразовано в лучшую уходящую группу, такую как мезилат, которая в свою очередь, являются пригодной для нуклеофильного замещения, например, группой CN. Такие последующие модификации будут очевидны для специалиста в данной области. Методы Соединения по изобретению могут модулировать активность одной или нескольких Янус-киназ(JAK). Подразумевается, что термин "модулировать" означает способность увеличивать или уменьшать активность одного или нескольких членов JAK семейства киназ. Соответственно, соединения по изобретению можно использовать в способах модулирования JAK посредством контактирования JAK с одним или несколькими описанными здесь соединениями или композициямии. В некоторых вариантах осуществления, соединения по изобретению могут действовать как ингибиторы одной или нескольких JAK. В некоторых вариантах осуществления, соединения по изобретению могут действовать, стимулируя активность одной или нескольких JAK. В следующих вариантах осуществления, соединения по изобретению можно использовать для модулирования активность JAK у индивидуума, нуждающегося в модулировании рецептора, путем введения модулирующего количества соединения формулы Ia, Ib или Ic. Киназы JAK, с которыми связываются и/или которые модулируют настоящие соединения, включают любой член семейства JAK. В некоторых вариантах осуществления, JAK представляет собой JAK1,JAK2, JAK3 или TYK2. В некоторых вариантах осуществления, JAK представляет собой JAK1 или JAK2. В некоторых вариантах осуществления, JAK представляет собой JAK2. В некоторых вариантах осуществления, JAK представляет собой JAK3. Соединения по изобретению могут быть селективными. Под термином "селективный" подразумевается, что соединение связывается или ингибирует JAK с большей аффинностью или эффективностью,соответственно, по сравнению по крайней мере с одной другой JAK. В некоторых вариантах осуществления, соединения по изобретению являются селективными ингибиторами JAK1 или JAK2 по сравнению с JAK3 и/или TYK2. В некоторых вариантах осуществления, соединения по изобретению являются селективными ингибиторами JAK2 (например, относительно JAK1, JAK3 и TYK2). Без связи с какой-либо теорией, поскольку ингибиторы JAK3 могут приводить к иммуноподавляющему действию, соединение,которое является селективным в отношении JAK2 по сравнению с JAK3, и которое используется для лечения рака (такого как множественная миелома, например) может давать дополнительное преимущество как имеющее меньшее иммуноподавляющее побочное действие. Селективность может быть по крайней мере примерно 5-кратной, 10-кратной, по крайней мере примерно 20-кратной, по крайней мере примерно 50-кратной, по крайней мере примерно 100-кратной, по крайней мере примерно 200-кратной, по крайней мере примерно 500-кратной или по крайней мере примерно 1000-кратной. Селективность может быть измерена способами, которые являются рутинными для данной области. В некоторых вариантах осуществления, селективность может быть протестирована для Km каждого фермента. В некоторых вариантах осуществления, селективность соединений по изобретению в отношении JAK2 по сравнению с JAK3 может быть определена с помощью клеточной концентрации АТФ. Другой аспект настоящего изобретения охватывает способы лечения JAK-связанного заболевания или нарушения у индивидуума (например, пациента) путем введения индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества или дозы соединения по настоящему изобретению или его фармацевтической композиции. JAK-связанное заболевание может включать любое заболевание, нарушение или состояние, которое непосредственно или косвенно связано с экспрессией или активностью JAK, включая сверхэкспрессию и/или аномальные уровни активности. JAK-связанное заболевание также может включать любое заболевание, нарушение или состояние, которое может быть предотвращено, уменьшено или излечено путем модулирования активности JAK. Примеры JAK-связанных заболеваний включают заболевания иммунной системы, включая, например, отторжение органа-трансплантата (например, отторжение аллотрансплантата или болезнь трансплантат-против-хозяина). Следующие примеры JAK-связанных заболеваний включают аутоиммунные заболевания, такие как рассеянный склероз, ревматоидный артрит, ювенильный артрит, диабет типа I, волчанка, псориаз, воспалительное заболевание кишечника, язвенный колит, болезнь Крона, бульбоспинальный паралич, иммуноглобулиновые невропатии, аутоиммунные нарушения щитовидной железы и тому подобные. В некоторых вариантах осуществления, аутоиммунное заболевание представляет собой аутоиммунное буллезное кожное заболевание, такое как обыкновенная пузырчатка (ОП) или буллезный пемфигоид (БП). Следующие примеры JAK-связанных заболеваний включают аллергические состояния, такие как астма, пищевые аллергии, атопический дерматит и ринит. Другие примеры JAK-связанных заболеваний включают вирусные заболевания, такие как вирус Эпштейна-Барра (EBV), гепатит В, гепатит С, HIV,HTLV 1, вирус варицелла-зостер (VZV) и вирус папилломы человека (HPV). Дополнительные примеры JAK-связанных заболеваний или состояний включают кожные заболевания, такие как псориаз (например, псориаз обыкновенный), атопический дерматит, кожная сыпь, раздражение кожи, повышенная аллергическая реакция кожи (например, контактный дерматит или аллергический контактный дерматит). Например, некоторые вещества, включая некоторые фармацевтические препараты, при наружном нанесении могут вызвать кожную реакцию. В некоторых вариантах осуществления, совместное введение или последовательное введение по крайней мере одного ингибитора JAK по изобретению вместе с агентом, вызывающим нежелательную аллергическую реакцию может быть полезно при лечении таких нежелательных аллергических реакций или дерматитов. В некоторых вариантах осуществления, кожное нарушение подвергают лечению путем наружного применения по крайней мере одного ингибитора JAK по изобретению. В следующих вариантах осуществления JAK-связанное заболевание представляет собой рак, включая характеризуемый твердыми опухолями (например, рак предстательной железы, рак почки, рак печени, рак поджелудочной железы, рак желудка, рак молочной железы, рак легкого, рак головы и шеи, рак щитовидной железы, глиобластома, саркома Капоши, болезнь Кастельмана, меланома и т.д.), гематологические виды рака (например, лимфома, лейкемия, такая как острая лимфобластозная лейкемия или множественная миелома) и рак кожи, такой как кожная Т-клеточная лимфома (CTCL) и кожная Вклеточная лимфома. Примеры кожных Т-клеточных лимфом включают синдром Сезария и грибовидный микоз.JAK-связанные заболевания могут дополнительно включать те, которые характеризуются экспрессией мутантной JAK2, таких как имеющие по крайней мере одну мутацию в псевдокиназном домене (например, AK2V617F).JAK-связанные заболевания могут дополнительно включать миелопролиферативные нарушения(MPDs), такие как болезнь Вакеза-Ослера (PV), идиопатическая тромбоцитопения (ЕТ), миелоидная метаплазия с миелофиброзом (МММ), хроническая миелогенная лейкемия (CML), хроническая миеломоноцитная лейкемия (CMML), гиперэозинофильный синдром (HES) или системное заболевание тучных клеток (SMCD) и тому подобные. Другие JAK-связанные заболевания включают воспаление и воспалительные заболевания. Примеры воспалительных заболеваний включают заболевания глаз (например, воспаление радужной оболочки глаза, увеит, склерит, конъюнктивит или родственное заболевание), воспалительные заболевания дыхательных путей (например, верхних дыхательных путей, включая нос и носовые пазухи, такие как ринит или синусит, или нижних дыхательных путей, включая бронхит, хроническое обструктивное заболевание легких и тому подобные), воспалительную миопатию, такую как миокардит, и другие воспалительные заболевания. Описанные здесь ингибиторы JAK кроме того можно использовать для лечения ишемических реперфузионных повреждений или заболевания или состояния, относящегося к воспалительному ишемическому случаю, такому как инсульт или остановка сердца. Описанные здесь ингибиторы JAK кроме того можно использовать для лечения анорексии, кахексии или утомляемости, такой как возникающая при раке или связанная с ним. Описанные здесь ингибиторы JAK кроме того можно использовать для лечения рестеноза, склеродермии или фиброза. Описанные здесь ингибиторы JAK кроме того можно использовать для лечения состояний, связанных с гипоксией или астроглиомой, такие как диабетическая ретинопатия, рак или нейродегенерация. См., например, Dudley, А.С. et al. Biochem. J. 2005, 390(Pt 2):427-Зб иSriram, К. et al. J. Biol. Chem. 2004, 279(19): 19936-47, Epub 2004 Mar 2. Для использования в данном описании термин "контактирование" относится к совместному появлению указанных фрагментов в системе in vitro или в системе in vivo. Например, "контактирование" JAK с соединением по изобретению включает введение соединения по настоящему изобретению индивидууму или пациенту, такому как человек, имеющему JAK, а также, например, введение соединения по изобретению в образец, содержащий клеточный или очищенный препарат, содержащий JAK. Для использования в данном описании термин "индивидуум" или "пациент", используемые взаимозаменяемо, относятся к любому животному, включая млекопитающих, предпочтительно, к мышам, крысам, другим грызунам, кроликам, собакам, кошкам, свиньям, крупному рогатому скоту, овцам, лошадям или приматам, и наиболее предпочтительно к человеку. Для использования в данном описании, выражение "терапевтически эффективное количество" относится к количеству активного соединения или фармацевтического агента, которое вызывает биологическую или медицинскую ответную реакцию ткани, системы, животного, индивидуума или человека,который рассматривается исследователем ветеринаром, лечащим доктором или другим клиницистом, что включает одно или несколько из следующего:(1) профилактику заболевания, например, предотвращение заболевания, состояния или нарушения у индивидуума, который может быть предрасположен к заболеванию, состоянию или нарушению, но который еще не подвержен или у которого еще не проявляется патология или симптоматика заболевания;(2) подавление заболевания, например, подавление заболевания, состояния или нарушения у индивидуума, который подвержен или у которого проявляется патология или симптоматика заболевания, состояния или нарушения (т.е. остановка дальнейшего развития патологии и/или симптоматики); и(3) облегчение протекания заболевания; например, облегчение протекания заболевания, состояния или нарушения у индивидуума, который подвержен или у которого проявляется патология или симптоматика заболевания, состояния или нарушения (т.е. обратное направление патологии и и/или симптоматики). Комбинированная терапия Один или несколько дополнительных фармацевтических агентов таких как, например, химиотерапевтические препараты, противовоспалительные агенты, стероиды, иммуносуппресанты, а также ингибиторы Bcr-Ab1, Flt-3, RAF и FAK киназ, такие как описанные в WO 2006/056399, или другие агенты могут использоваться в сочетании с соединения по настоящему изобретению для лечения JAK-связанных заболеваний, нарушений или состояний. Один или несколько дополнительных фармацевтических агентов можно вводить пациенту одновременно или последовательно. Примеры химиотерапевтических агентов включают протеосомные ингибиторы (например, бортезомид), талидомид, ревлимид, и ДНК-повреждающие агенты, такие как мелфалан, доксорубицин, цикло- 25019504 фосфамид, винкристин, этопозид, кармустин и тому подобные. Примеры стероидов включают кортикостероиды, такие как дексаметазон или преднизон. Примеры ингибиторов Bcr-Ab1 включают соединения и их фармацевтически приемлемые соли общего вида и разновидностей, описанные в патенте США 5521184, WO 04/005281, ЕР 2005/009967,ЕР 2005/010408 и патенте США сер. 60/578491. Примеры подходящих ингибиторов Flt-3 включают соединения и их фармацевтически приемлемые соли, такие как описано в WO 03/037347, WO 03/099771 и WO 04/046120. Примеры подходящих ингибиторов RAF включают соединения и их фармацевтически приемлемые соли, такие как описано в WO 00/09495 и WO 05/028444. Примеры подходящих ингибиторов FAK включают соединения и их фармацевтически приемлемые соли, такие как описано в WO 04/080980, WO 04/056786, WO 03/024967, WO 01/064655, WO 00/053595 иWO 01/014402. В некоторых вариантах осуществления ингибиторов JAK по изобретению можно использовать в сочетании с химиотерапией при лечении рака, такого как множественная миелома, и они могут улучшить ответную реакцию на лечение по сравнению с ответной реакцией на сам по себе химиотерапевтический агент, без эксцеребрация его токсического действия. Примеры дополнительных фармацевтических агентов, используемых при лечении множественной миеломы, например, могут включать, без ограничения,мелфалан, мелфалан плюс преднизон [МР], доксорубицин, дексаметазон и Велкад (бортезомиб). Другие дополнительные агенты, используемые для лечения множественной миеломы включают ингибиторыBcr-Abl, Flt-3, RAF и FAK киназы. Аддитивное или синергистическое действие являются желательным результатом комбинирования ингибитора JAK по настоящему изобретению с дополнительным агентом. Кроме того, резистентность клеток множественной миеломы к агентам, таким как дексаметазон, может быть обратимой при лечении с использованием ингибитора JAK по настоящему изобретению. Данные агенты можно комбинировать вместе с настоящими соединения в виде единой или постоянной препаративной формы или агенты можно вводить одновременно или последовательно в виде отдельных препаративных лекарственных форм. В некоторых вариантах осуществления кортикостероид, такой как дексаметазон, вводят пациенту в сочетании по крайней мере с одним ингибитором JAK, где дексаметазон вводят периодически в противоположность постоянному введению. В некоторых следующих вариантах осуществления комбинации одного или нескольких ингибиторов JAK по изобретению с другими терапевтическими агентами можно вводить пациенту до, во время и/или после трансплантации костного мозга или стволовых клеток. Фармацевтические препараты и дозированные лекарственные формы При использовании в качестве лекарственных средств соединения по изобретению можно применять в виде фармацевтических композиций. Данные композиции могут быть получены способом, хорошо известным в области фармацевтики и их можно вводить с помощью множества путей введения в зависимости от того, требуется ли местное или системное лечение и от области, подвергаемой лечению. Введение может быть наружным (включая чрескожное, эпидермическое, офтальмологическое и через слизистую оболочку, включая внутриназальную, влагалищную и ректальную доставку лекарственного средства), легочным (например, путем ингаляции или инсуфляции порошков или аэрозолей, включая использование небулайзера; внутритрахейное или внутриназальное), пероральное или парентеральное. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшинную, внутримышечную инъекцию или вливание; или внутричерепное, например, интратекальное или интравентикулярное, введение. Парентеральное введение может быть в виде единственной болюсной дозы, или может непрерывно подаваться перфузионным насосом. Фармацевтические композиции и препараты для наружного применения могут включать чрескожные пластыри, мази, лосьоны, кремы, гели, суппозитории, спреи, жидкости и порошки. Обычные фармацевтические носители, водные, порошкообразные или масляные основы, загустители и тому подобное могут оказаться необходимыми или желательными. Также можно использовать покрытые слоем презервативы, перчатки и тому подобное. Данное изобретение также включает фармацевтические композиции, которые содержат в качестве активного ингредиента, одно или несколько соединений по изобретению в сочетании с одним или несколькими фармацевтически приемлемыми носителями (эксципиентами). При получении композиций по изобретению активный ингредиент обычно смешивают с эксципиентом, разбавляют с помощью эксципиента или заключают в такой носитель в виде, например, капсулы, саше, бумаги или другого контейнера. Когда эксципиент выступает в качестве разбавителя, он может быть твердым, полужидким или жидким веществом, которое служит в качестве транспортного средства, носителя или среды для активного ингредиента. Таким образом, композиции могут быть в виде таблеток, пилюль, порошков, пастилок, саше, облаток, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в твердом виде или в жидкой среде), мазей, содержащих, например, до 10% по весу активного соединения, мягких или твердых желатиновых капсул, суппозиториев, стерильных растворов для инъекций и стерильных упакованных порошков. При получении препарата активное соединение может быть измельчено для получения частиц под- 26019504 ходящего размера перед объединением с другими ингредиентами. Если активное соединение является,по существу, нерастворимым, оно может быть измельчено до размера частиц менее 200 меш. Если активное соединение является, по существу, водорастворимым, размер частиц может быть отрегулирован путем измельчения, для получения, по существу, равномерного распределения в препарате, например,примерно до 40 меш. Некоторые примеры подходящих эксципиентов включают лактозу, декстрозу, сахарозу, сорбит,маннит, крахмалы, аравийскую камедь, фосфат кальция, альгинаты, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Препараты могут дополнительно включать: лубриканты, такие как тальк, стеарат магния и минеральное масло; смачивающие агенты; эмульгирующие и суспендирующие агенты; консерванты,такие как метил- и пропилгидроксибензоаты; подсластители и ароматизоторы. Композиции по изобретению могут быть составлены таким образом, чтобы обеспечивать быстрое, продолжительное или замедленное высвобождение активного ингредиента после введения пациенту, с помощью способов, известных в данной области. Композиции могут быть получены в виде единичных дозированных лекарственных форм, где каждая доза будет содержать от примерно 5 до примерно 1000 мг (1 г), более обычно примерно от 100 до примерно 500 мг активного ингредиента. Термин "единичная дозированная лекарственная форма" относится к физически дискретным единицам, походящим в качестве единичных доз для людей и других млекопитающих, при это каждая единица содержит заранее определенное количество активного вещества, рассчитанного для оказания желаемого терапевтического действия, в сочетании с подходящим фармацевтическим эксципиентом. Активное соединение может быть эффективным в широком диапазоне дозировки, и обычно его вводят в фармацевтически эффективном количестве. Следует понимать, что фактически вводимое количество соединения будет определяться лечащим врачом в соответствии со значимыми обстоятельствами,включая состояние, подвергаемое лечению, выбранный путь введения, реальное вводимое соединение,возраст, вес и ответную реакцию индивидуального пациента, тяжесть симптомов у пациента и тому подобное. Для получения твердых композиций, таких как таблетки, главный активный ингредиент смешивают с фармацевтическим эксципиентом с получением твердой предрецептурной композиции, содержащей гомогенную смесь соединения по настоящему изобертению. Когда данные предрецептурные композиции упоминаются как гомогенные, активный ингредиент обычно равномерно диспергируют в композиции таким образом, чтобы композиция могла быть разделена на равно эффективные единичные дозированные лекарственные формы, такие как таблетки, пилюли и капсулы. Данную предрецептурную композицию затем разделяют на единичные дозированные лекарственные формы вышеуказанного типа, содержащие, например, от примерно 0,1 до примерно 1000 мг активного ингредиента по настоящему изобретению. Таблетки или пилюли по настоящему изобретению могут быть покрыты оболочкой или составлены другим образом для получения дозированной лекарственной формы, дающей преимущество продолжительного действия. Например, таблетка или пилюля могут включать компонент внутренней дозы и компонент внешней дозы, где последний имеет вид конверта для первого. Два компонента могут быть разделены растворимым в кишечнике слоем, который служит для противодействия разрушению в желудке и дет возможность внутреннему компоненту проходить в двенадцатиперстную кишку или замедлять свое высвобождение. Жидкие формы, в которые соединения и композиции по настоящему изобретению могут быть введены для перорального введения или введения путем инъекции, включают водные растворы, подходящим образом ароматизированные сиропы, водные или масляные суспензии и ароматизированные эмульсии с пищевыми маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также эликсиры и аналогичные фармацевтические носители. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях, или их смесях и порошки. Жидкие или твердые композиции могут содержать фармацевтически приемлемые эксципиенты, как описано выше. В некоторых вариантах осуществления, композиции вводят через рот или носовой дыхательный путь для местного или системного действия. Композиции в металлическом контейнере можно распылять с помощью инертных газов. Распыляемые растворы можно вдыхать непосредственно из распыляющего устройства или распыляющее устройство может быть присоединено к маске для лица или дыхательной машине с переменным положительным давлением. Растворы, суспензии или порошкообразные композиции можно вводить перорально или назально из устройств, которые доставляют препарат подходящим образом. Количество вводимого пациенту соединения или композиции будет меняться в зависимости от того, что вводится, цели введения, такой как профилактика или терапия, состояния пациента, способа введения и тому подобного. В терапевтических применениях композиции можно вводить пациенту, уже страдающему от заболевания, в количестве, достаточном для излечения или по крайней мере частичной приостановки симптомов заболевания и его осложнений. Эффективные дозы будут зависеть от болез- 27019504 ненного состояния, подвергаемого лечению, а также от точки зрения лечащего врача в зависимости от факторов, таких как тяжесть заболевания, возраст, вес и общее состояние пациента и тому подобного. Композиции, вводимые пациенту, могут являться описанными выше композициями. Данные композиции могут быть стерилизованы обычными методами стерилизации или они могут быть стерилизованы фильтрованием. Водные растворы могут быть упакованы для применения в том виде, в котором они находятся, или лиофилизованы, и лиофилизованные препараты объединяют со стерильным водным носителем перед применением. РН препаратов соединений обычно будет составлять между 3 и 11, более предпочтительно от 5 до 9 и наиболее предпочтительно от 7 до 8. Следует понимать, что применение некоторых из вышеупомянутых эксципиентов, носителей или стабилизаторов будет приводить к образованию фармацевтических солей. Терапевтическая дозировка соединений по настоящему изобретению может меняться в соответствии, например, с конкретным применением, для которого проводится лечение, способом введения соединения, здоровьем и общим состоянием пациента и точкой зрения лечащего врача. Доля или концентрация соединения по изобретению в фармацевтической композиции может изменяться в зависимости от ряда факторов, включая дозировку, химические характеристики (например, гидрофобность) и путь введения. Например, соединения по изобретению могут быть обеспечены в водном физиологическом буферном растворе, содержащем примерно от 0.1 до примерно 10% вес./об. соединения для парентерального введения. Некоторые типичные интервалы дозировки составляют от примерно 1 мкг/кг до примерно 1 г/кг веса тела в сутки. В некоторых вариантах осуществления, диапазон дозировки составляет от примерно 0,011 мг/кг до примерно 100 мг/кг веса тела в сутки. Дозировка вероятно будет зависеть от таких переменных как тип и степень прогрессирования заболевания или нарушения, общее состояние здоровья конкретного пациента и относительной биологической эффективности выбранного соединения, рецептуры эксципиента и пути введения. Эффективные дозы могут быть экстраполированы из кривых доза-ответ в тест-системах in vitro или на животных моделях. Композиции по изобретению могут дополнительно включать одни или несколько дополнительных фармацевтических агентов, таких как химиотерапевтический агент, стероид, противовоспалительное соединение или иммуносупрессор, примеры которых перечислены выше в данном описании. Меченые соединения и методы анализа Другой аспект настоящего изобретения относится к меченым соединениям по изобретению (радиоактивно меченным, флуресцентно меченным и т.д.), которые могли бы быть полезными не только в способах визуализации, но также и в анализах, как in vitro, так и in vivo, для локализации и количественной оценки JAK в образцах тканей, включая ткани человека, и для идентификации лигандов JAK путем ингибирования связывания меченого соединения. Соответственно, настоящее изобретение включает анализы JAK, которые содержат такие меченые соединения. Настоящее изобретение дополнительно включает изотопно-меченные соединения по изобретению."Изотопно" или "радиоактивно" меченным соединением является соединение по изобретению, в котором один или несколько атомов заменено или замещено на атом, имеющий атомную массу или массовое число, отличное от атомной массы или массового числа, обычно обнаруживаемых в природе (т.е. природно существующие). Подходящие радионуклиды, которые могут быть введены в соединения по настоящему изобретению включают, но не ограничиваются указанным 2 Н (также пишется как D для дейтерия), 3 НI, I, I и 131I. Характер радионуклида, который вводят в настоящие радиоактивно меченные соединения, будет зависеть от конкретного применения такого радиоактивно меченного соединения. Например, для введения метки в металлопротеазы in vitro и конкурентных анализов наиболее полезными будут соединения, в которые введены 3 Н, 14 С, 82Br, 1251, 131I, 35S. Для применений в области радиоактивной визуализации наиболее полезными будут 11C, 18F, 125I, 123I, 124I, 131I, 75Br, 76Br или 77Br. Следует понимать, что "радиоактивно меченное" или "меченое соединение" представляет собой соединение, в которое введен по крайней мере один радионуклид. В некоторых вариантах осуществления,радионуклид выбирают из группы, состоящей из 3 Н, 14C, 125l, 35S и 82Br. Настоящее изобретение может дополнительно включать синтетические способы для введения радиоизотопов в соединения по изобретению. Синтетические способы для введения радиоизотопов в органические соединения хорошо известны в данной области и обычному специалисту будут очевидны способы, применимые для соединений по изобретению. Меченое соединение по изобретению можно использовать в скрининговых анализах для идентификации/оценки соединений. Например, может быть проведена оценка способности связывать JAK вновь синтезированных или идентифицированных соединений (т.е. тестируемых соединений), которые являются меченными путем мониторинга изменения их концентрации при контактировании с JAK посредством отслеживания метки. Например, может быть проведена оценка способности тестируемого соединения (меченое) уменьшать связывание другого соединения, для которого известно, что оно связывается сJAK (т.е. стандартное соединение). Соответственно способность тестируемого соединения конкурировать со стандартным соединением за связывание с JAK непосредственно коррелирует с его аффинностью связывания. Наоборот, в некоторых других скрининговых анализах стандартное соединение является меченным, а тестируемое соединение не является меченным. Соответственно контролируют концентрацию меченого стандартного соединения для оценки конкуренции между стандартным соединением и тестируемым соединение и таким образом определяют относительную аффиннность связывания тестируемого соединения. Наборы Настоящее изобретение также включает фармацевтические наборы, которые могут использоваться,например, для лечения или профилактики JAK-связанных заболеваний или нарушений, таких как рак,которые включают один или несколько контейнеров, содержащих фармацевтическую композицию,включающую терапевтически эффективное количество соединения по изобретению. Такие наборы могут дополнительно включать, при желании, один или несколько различных обычных компонентов фармацевтических наборов, таких как, например, контейнеры с одним или несколькими фармацевтически приемлемыми носителями, дополнительные контейнеры и т.д., что будет очевидно для специалиста в данной области. Инструкции, либо в виде вкладышей или этикеток, указывающие количества компонентов для введения, указания для введения и/или указания для смешивания компонентов также могут быть включены в набор. Изобретение будет более подробно описано с помощью конкретных примеров. Следующие примеры приведены в иллюстративных целях и не предназначены для ограничения изобретения каким-либо образом. Специалистам в данной области будет легко понятно множество некритических параметров,которые могут быть изменены или модифицированы с получением по существу таких же результатов. В соответствии по крайней мере с одним из описанных здесь анализов было установлено, что соединения по изобретению являются ингибиторами JAK. Примеры Пример 1. 3-[3-Метил-1-(1 Н-пирроло[2,3-b]пиридин-4-ил)-1 Н-пиразол-4-ил]бензонитрил Стадия 1. 1 Н-Пирроло[2,3-b]пиридин 7-оксид. К раствору 1 Н-пирроло[2,3-b]пиридина (4,90 г, 0,0415 моль) в этилацетате (41 мл, 0,42 моль) добавляли раствор мета-хлорбензойной кислоты (МСРВА; 9,3 г, 0,054 моль) в этилацетате (27 мл, 0,28 моль) при 0 С. Реакционную смесь затвердевала, когда добавляли 20 мл раствора МСРВА. Дополнительно добавляли 10 мл этилацетат к этой смеси так, чтобы образовывался раствор. Реакционную смесь оставляли нагреваться до комнатной температуры (к.т.) и перемешивали в течение ночи, затем охлаждали до 0 С, фильтровали и промывали этилацетатом три раза, получая 10,94 г влажного твердого вещества. Влажное твердое вещество (8,45 г) затем суспендировали в воде (35 мл), и к суспензии добавляли по каплям 13 мл насыщенного раствора Na2CO3, и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь затем охлаждали до 0 С, фильтровали и промывали водой (4), получая 3,55 г бледно-пурпурного твердого вещества, которое сушили при 40 С в течение ночи, получая целевой продукт (2,47 г, 44,4% выход). 1 Н ЯМР (400 МГц, CD3OD):8,2 (1 Н, д); 7,95 (1 Н, д); 7,5 (1 Н, д); 7,2 (1 Н, м); 6,65 (1 Н, д). Массспектр (М+Н)+: 136. Стадия 2. 4-Хлор-1 Н-пирроло[2,3-b]пиридин. К розовому раствору 1 Н-пирроло[2,3-b]пиридин 7-оксида (2,47 г, 0,0184 моль) в диметилформамиде (ДМФ) (13,3 мл, 0,172 моль) добавляли метансульфонилхлорид (4,0 мл, 0,052 моль) при 50 С, и розовая окраска изменялась на оранжевую. Реакционную смесь нагревали при 73 С в течение 2 ч, затем охлаждали до 40 С. Добавляли воду (35 мл) и полученную суспензию охлаждали при 0 С. NaOH добавляли для доведения рН смеси до примерно 7. Смесь фильтровали и промывали водой (3), получая 3,8 г влажного бледно-оранжевого твердого вещества, которое сушили при 40 С в течение ночи, получая продукт
МПК / Метки
МПК: C07D 487/04, A61P 37/00, A61P 17/00, A61P 35/00, C07D 471/04, A61K 31/395
Метки: пирроло[2,3-b]пиримидины, качестве, янус-киназы, ингибиторов, гетероарилзамещенные, пирроло[2,3-b]пиридины
Код ссылки
<a href="https://eas.patents.su/30-19504-geteroarilzameshhennye-pirrolo23-bpiridiny-i-pirrolo23-bpirimidiny-v-kachestve-ingibitorov-yanus-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероарилзамещенные пирроло[2,3-b]пиридины и пирроло[2,3-b]пиримидины в качестве ингибиторов янус-киназы</a>
Предыдущий патент: Электрод для выделения кислорода в промышленных электролитических процессах
Следующий патент: Способ получения иммортализованных клеток, секретирующих антитела, популяция иммортализованных клеток и ее применения
Случайный патент: Фенил-3-азабицикло[3.1.0]гекс-3-илметаноны и их применение в качестве лекарственного средства












