Пиридины и пиразины в качестве ингибиторов p13k (фосфатидилинозиткиназы-3)
Номер патента: 18065
Опубликовано: 30.05.2013
Авторы: Бадд Эмма, Хаушэм Кэтрин, Брюс Айан, Эдуардз Ли
Формула / Реферат
1. Соединение формулы I
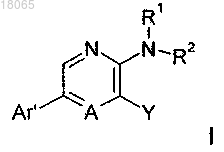
или его соль, в которой
R1 и R2, все независимо, выбраны из водорода и C1-С6-алкила;
Y выбран из группы, включающей -OC1-С6-алкил, -ОС3-С8-циклоалкил, -ОС1-С3-алкил-С3-С8-циклоалкил,
-О(СН2)a-арил, -О(СН2)b-гетероарил, -C(O)C1-С6-алкил, -С(О)С3-С8-циклоалкил, -С(О)С1-С3-алкил-С3-С8-циклоалкил, -С(О)арил и -С(О)гетероарил, где циклоалкильные, арильные и гетероарильные кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X;
а и b, все независимо, равны 0, 1, 2 или 3;
А обозначает N;
перечень X включает гидроксигруппу, галоген, цианогруппу, нитрогруппу, С1-С6-алкил, С3-С8-циклоалкил, С1-С3-алкил-С3-С8-циклоалкил, -OC1-С6-алкил, -ОС3-С8-циклоалкил, -ОС1-С3-алкил-С3-С8-циклоалкил, где каждая из алкильных групп необязательно содержит один или большее количество следующих заместителей: галоген, гидроксигруппу или цианогруппу;
Ar' обозначает группу
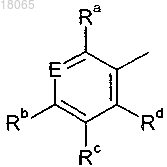
в которой Е обозначает N или CRe;
Ra выбран из группы, включающей Н, галоген, C1-С6-алкил, C1-С6-галогеналкил, ОС1-С6-алкил и -OC1-С6-галогеналкил;
Rb выбран из группы, включающей H, -MR40R41, галоген, C1-С6-алкил, C1-С6-галогеналкил, -OC1-С6-алкил и –ОН;
Rc обозначает S(O)2R45, где R45 обозначает -NHR43 или гетероциклил;
Rd выбран из группы, включающей Н, C1-C6-алкил и -OC1-C6-алкил;
Re выбран из группы, включающей Н, C1-C3-алкил, C1-C3-галогеналкил и галоген;
R40, R42 и R44, все независимо, выбраны из группы, включающей Н и C1-C6-алкил;
R41 и R43, все независимо, выбраны из группы, включающей H, C1-C6-алкил, С3-С6-циклоалкил, C1-C3-алкил-С3-С6-циклоалкил, С1-С3-алкиларил, С1-С3-алкилгетероциклил, арил, гетероциклил, С(O)С1-С6-алкил и C1-С3-алкил-ОС1-С3-алкил, где циклоалкильное кольцо необязательно содержит один или большее количество заместителей, выбранных из группы, включающей -ОН и -NH2;
арил означает 6-14-членную ароматическую карбоциклическую группу, содержащую от 1 до 3 колец;
гетероциклил представляет собой 5-7-членную азотсодержащую гетероциклическую группу, которая необязательно замещена одной или большим количеством групп, выбранных из группы, включающей -ОН, С1-С3-алкил, С3-С6-циклоалкил, С1-С3-алкил-C1-C6-циклоалкил и C1-C3-гидроксиалкил;
гетероарил означает ароматическую гетероциклическую группу, как определено выше.
2. Соединение по п.1, в котором Y выбран из группы, включающей -С(О)С1-С6-алкил, -С(О)С3-С8-циклоалкил, -С(О)С1-С3-алкил-С3-С8-циклоалкил, -С(О)арил и -С(О)гетероарил, где все кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X.
3. Соединение по п.2, в котором Y выбран из группы, включающей -С(О)арил и -С(О)гетероарил, где все кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X.
4. Соединение по п.3, в котором арил представляет собой фенил и гетероарил выбран из группы, включающей 5- и 6-членные азотсодержащие гетероароматические группы.
5. Соединение по п.1, выбранное из группы, включающей
{3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
N-{5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлорпиридин-3-ил}бензолсульфонамид,
{3-амино-6-[3-(пирролидин-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклопропилбензолсульфонамид,
{3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-4-метилфенил}амид циклопропансульфоновой кислоты,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-фенилбензолсульфонамид,
{3-амино-6-[4-метокси-3-(морфолин-4-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-бензил-4-метилбензолсульфонамид,
N-{3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]бензил}метансульфонамид,
{3-амино-5-метил-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}фенилметанон,
{3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}фенилметанон,
3-(5-амино-6-бензоилпиразин-2-ил)-N-циклопропилбензолсульфонамид,
{3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}-(3,5-дифторфенил)метанон,
{3-амино-6-[3-(морфолин-4-сульфонил)фенил]пиразин-2-ил}-(4-фторфенил)метанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-(2-метоксиэтил)бензолсульфонамид,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-(4-гидроксициклогексил)бензолсульфонамид,
{3-амино-6-[3-(морфолин-4-сульфонил)-4-трифторметилфенил]пиразин-2-ил}пиридин-3-илметанон,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклопропил-2,4-дифторбензолсульфонамид,
{3-амино-6-[3-(4-метилпиперазин-1-сульфонил)-5-трифторметилфенил]пиразин-2-ил}пиридин-3-илметанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-5-трифторметилбензолсульфонамид,
{3-амино-6-[5-(морфолин-4-сульфонил)пиридин-3-ил]пиразин-2-ил}пиридин-3-илметанон,
{3-амино-6-[2,4-дифтор-5-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
{3-амино-6-[4-хлор-3-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
{3-амино-6-[3-(4-циклопропилпиперазин-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
{3-амино-6-[3-(4-метил-[1,4]диазепан-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
{3-амино-6-[2,4-дифтор-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
(3-амино-6-{3-[4-(2-гидроксиэтил)пиперазин-1-сульфонил]фенил}пиразин-2-ил)пиридин-3-илметанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-[2-(4-метилпиперазин-1-ил)этил]бензолсульфонамид,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклобутилбензолсульфонамид,
{3-амино-6-[3-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-циклопропилбензолсульфонамид,
{3-амино-6-[4-хлор-3-(морфолин-4-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклопропилметилбензолсульфонамид,
{3-амино-6-[3-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил}-(4-хлорфенил)метанон,
{3-амино-6-[4-хлор-3-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил}-(4-хлорфенил)метанон,
{3-амино-6-[4-хлор-3-(4-изопропилпиперазин-1-сульфонил)фенил]пиразин-2-ил}-(4-хлорфенил)метанон,
3-[5-амино-6-(4-фторбензоил)пиразин-2-ил]-N-(2-метоксиэтил)бензолсульфонамид,
{3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил}циклопропилметанон,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклопропилметил-2,4-дифторбензолсульфонамид,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2,4-дифтор-N-(2-метоксиэтил)бензолсульфонамид,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-(2-метоксиэтил)-2-трифторметилбензолсульфонамид,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2,4-дифтор-N-(4-гидроксициклогексил)бензолсульфонамид,
5-(5-амино-6-циклопропанкарбонилпиразин-2-ил)-2,4-дифтор-N-(4-гидроксициклогексил)бензолсульфонамид,
3-(5-амино-6-циклопропанкарбонилпиразин-2-ил)-N-(2-метоксиэтил)бензолсульфонамид,
{3-амино-6-[3-(морфолин-4-сульфонил)фенил]пиразин-2-ил}пиридин-3-илметанон,
5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-(2-метоксиэтил)бензолсульфонамид и
N-{3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]фенил}метансульфонамид,
и его фармацевтически приемлемые соли.
6. Фармацевтическая композиция, содержащая соединение по любому из пп.1-5 и фармацевтически приемлемый инертный наполнитель.
7. Применение соединения по любому из пп.1-5 для приготовления лекарственного средства, предназначенного для лечения воспалительных или аллергических патологических состояний.
8. Применение по п.7, в котором патологические состояния выбраны из группы, включающей респираторные заболевания, аллергии, ревматоидный артрит, остеоартрит, ревматические нарушения, псориаз, язвенный колит, болезнь Крона, септический шок, пролиферативные нарушения, такие как рак, атеросклероз, отторжение аллотрансплантата после трансплантации, диабет, удар, ожирение и рестеноз.
Текст
В изобретении описаны соединение формулы (I) или его соль, предпочтительно фармацевтически приемлемая соль или сольват, в которой группыR1, R2, Ar', А и Y определены в описании, композиции и применение соединений для лечения воспалительных или аллергических патологических состояний. Настоящее изобретение относится к органическим соединениям, их получению и их применению в качестве лекарственных средств. Первым объектом настоящего изобретения являются соединения формулы IR1 и R2, все независимо, выбраны из водорода и C1-С 6-алкила;Y выбран из группы, включающей -OC1-С 6-алкил, -ОС 3-С 8-циклоалкил, -ОС 1-С 3-алкил-С 3-С 8 циклоалкил, -О(СН 2)a-арил, -О(СН 2)b-гетероарил, -C(O)C1-С 6-алкил, -С(О)С 3-С 8-циклоалкил, -С(О)С 1-С 3 алкил-С 3-С 8-циклоалкил, -С(О)арил и -С(О)гетероарил, где циклоалкильные, арильные и гетероарильные кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X; а и b, все независимо, равны 0, 1, 2 или 3; А обозначает N; перечень X включает гидроксигруппу, галоген, цианогруппу, нитрогруппу, C1-С 6-алкил, С 3-С 8 циклоалкил, С 1-С 3-алкил-С 3-С 8-циклоалкил, -OC1-С 6-алкил, -ОС 3-С 8-циклоалкил, -ОС 1-С 3-алкил-С 3-С 8 циклоалкил, где каждая из алкильных групп необязательно содержит один или большее количество следующих заместителей: галоген, гидроксигруппу или цианогруппу;R41 и R43, все независимо. выбраны из группы, включающей Н, C1-С 6-алкил, С 3-С 6-циклоалкил, C1 С 3-алкил-С 3-С 6-циклоалкил, C1-С 3-алкиларил, С 1-С 3-алкилгетероциклил, арил, гетероциклил, С(О)C1-С 6 алкил и С 1-С 3-алкил-ОС 1-С 3-алкил, где циклоалкильное кольцо необязательно содержит один или большее количество заместителей, выбранных из группы, включающей -ОН и -NH2; арил означает 6-14-членную ароматическую карбоциклическую группу, содержащую от 1 до 3 колец; гетероциклил представляет собой 5-7-членную азотсодержащую гетероциклическую группу, которая необязательно замещена одной или большим количеством групп, выбранных из группы, включающей -ОН, С 1-С 3-алкил, С 3-С 6-циклоалкил, C1-С 3-алкил-С 3-С 6-циклоалкил и С 1-С 3-гидроксиалкил; гетероарил означает ароматическую гетероциклическую группу, как определено выше. Алкильные, алкенильные, алкинильные, алкиленовые и алкоксигруппы, содержащие необходимое количество атомов углерода, могут быть линейными или разветвленными. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Примеры алкоксигруппы включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу. Примеры алкилена включают метилен, 1,1 этилен, 1,2-этилен, 1,1-пропилен, 1,2-пропилен, 1,3-пропилен и 2,2-пропилен. При отсутствии каких-либо указаний на иное "алкил" означает C1-С 6-алкил, "алкенил" означает С 2 С 6-алкенил, "алкинил" означает C2-С 6-алкинил и "циклоалкил" означает С 3-С 8-циклоалкил."Галоген" может означать фтор, хлор, бром или йод. Указание на необязательно замещенную группу означает, что произошло замещение связи С-Н на необходимую связь. Если заместителем является галоген, то образовавшуюся группу называют галогеналкильной группой. Например, если заместителем является фтор, то обычными галогеналкильными группами являются трифторалкильная, 2,2,2-трифторэтильная или 2,2,2,1,1-пентафторэтильная группы.C1-С 6-галогеналкил означает алкильную группу, содержащую в качестве заместителей до 7 атомов галогенов, предпочтительно фтора. Например, если заместителем является фтор, то обычными галогеналкильными группами являются трифторалкильная, 2,2,2-трифторэтильная или 2,2,2,1,1-пентафторэтильная группы."Аминогруппа" включает незамещенную группу -NH2, группу -N(H)C1-C6- и группу -N(C1-С 6)2. Это означает, что термин "аминогруппа" включает моноалкил- и диалкилзамещенные аминопроизводные."Циклоалкил" означает углеводородное кольцо, содержащее необходимое количество атомов углерода, например циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил."Карбоциклическая группа" означает насыщенное, частично насыщенное или ароматическое углеводородное кольцо, содержащее необходимое количество атомов углерода. Термин "арил" или "С 6-С 14-арил" означает ароматическую карбоциклическую группу, содержащую от 1 до 3 колец. Примеры включают фенил, нафтил, антрацил и фенантрил. Термин "гетероциклический", "гетероциклическая группа" или их производные означает 5-10 членное насыщенное, частично ненасыщенное или ароматическое кольцо, содержащее один или большее количество гетероатомов О, N или S. Конкретные примеры гетероциклильных групп включают[1,3]диоксолан, [1,4]диоксан, оксиранил, азиридинил, оксетанил, азетидинил, тетрагидрофуранил, пирролидинил, тетрагидропиранил, пиперидинил, морфолиновую группу, тиоморфолинил, пиперазинил,азепинил, оксапинил, оксазепинил, диазепинил и гетероарильные группы (см. ниже). Гетероциклические или гетероциклильные группы обычно присоединены через кольцевой атом углерода. Однако, если гетероциклическая или гетероциклильная группа содержит в качестве гетероатома атом азота, то группа в соответствующих случаях может быть присоединена через кольцевой атом углерода или через кольцевой атом азота. Например, пиперидиновая, пиперазиновая и морфолиновая группы могут быть присоединены через кольцевой атом углерода или через один из кольцевых атомов азота. Термин "гетероарил" или "гетероарильная группа" означает ароматическую гетероциклическую группу. Примеры моноциклических гетероарильных групп включают пиридил, тиенил, фуранил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил,тиадиазолил и тетразолил. Примеры бициклических гетероарильных групп включают индолил, бензофуранил, хинолил, изохинолил и индазолил. В настоящем описании и приведенной ниже формуле изобретения, если из контекста не следует иное, слово "включает" или его варианты, такие как "включающий", следует понимать, как включение указанного целого числа или стадии или группы целых чисел или стадий, но не исключение любого другого целого числа или стадии или группы целых чисел или стадий. Указанные ниже подходящие или предпочтительные характеристики соединения формулы (I) можно включить в определение формулы (I) и объединять любым образом. Так, специалист в данной области техники должен понимать, что в объем настоящего изобретения входят комбинации различных подходящих или необязательных признаков, указанных ниже в качестве вариантов осуществления настоящего изобретения. В одном варианте осуществления настоящего изобретения, определенном выше, Y выбран из группы, включающей -С(О)С 1-С 6-алкил, -С(О)С 3-С 8-циклоалкил, -С(О)С 1-С 3-алкил-С 3-С 8-циклоалкил,-С(О)арил и -С(О)гетероарил, где все кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X. В еще одном варианте осуществления настоящего изобретения Y выбран из группы, включающей-С(О)арил и -С(O)гетероарил, где все кольцевые системы необязательно содержат один или большее количество заместителей, выбранных из перечня X. Предпочтительно, если арильная группа представляет собой фенил и гетероарильная группа выбрана из группы, включающей 5- и 6-членные азотсодержащие гетероароматические группы. Подходящее отдельное соединение, предлагаемое в настоящем изобретении, выбрано из группы,включающей 3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3-илметанон,N-5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлорпиридин-3-илбензолсульфонамид,3-амино-6-[3-(пирролидин-1-сульфонил)фенил]пиразин-2-илпиридин 3-илметанон,3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-циклопропилбензолсульфонамид,3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-4-метилфениламид циклопропансульфоновой кислоты,5-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-фенилбензолсульфонамид,3-амино-6-[4-метокси-3-морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3-илметанон,3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]-N-бензил-4-метилбензолсульфонамид,N-3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]бензилметансульфонамид,3-амино-5-метил-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илфенилметанон,3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илфенилметанон,3-(5-амино-6-бензоилпиразин-2-ил)-N-циклопропилбензолсульфонамид,3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил-(3,5-дифторфенил)метанон,3-амино-6-[3-(морфолин-4-сульфонил)фенил]пиразин-2-ил-(4-фторфенил)метанон,-2 018065N-3-[5-амино-6-(пиридин-3-карбонил)пиразин-2-ил]фенилметансульфонамид,и его фармацевтически приемлемые соли. Соединения формулы I, которые содержат основной центр, могут образовывать соли присоединения с кислотами, предпочтительно фармацевтически приемлемые соли присоединения с кислотами. Фармацевтически приемлемые соли присоединения с кислотами соединения формулы I включают соли с неорганическими кислотами, например галогенводородными кислотами, такими как фтористоводородная кислота, хлористо-водородная кислота, бромисто-водородная кислота, йодисто-водородная кислота, азотной кислотой, серной кислотой, фосфорной кислотой; и органическими кислотами, например алифатическими монокарбоновыми кислотами, такими как муравьиная кислота, уксусная кислота,трифторуксусная кислота, пропионовая кислота и масляная кислота, каприловая кислота, дихлоруксусная кислота, гиппуровая кислота, алифатическими гидроксикислотами, такими как молочная кислота,лимонная кислота, винная кислота или яблочная кислота, глюконовая кислота, миндальная кислота, дикарбоновыми кислотами, такими как малеиновая кислота или янтарная кислота, адипиновая кислота,аспарагиновая кислота, фумаровая кислота, глутаминовая кислота, малоновая кислота, себациновая кислота, ароматическими карбоновыми кислотами, такими как бензойная кислота, п-хлорбензойная кислота, никотиновая кислота, дифенилуксусная кислота или трифенилуксусная кислота, ароматическими гидроксикислотами, такими как о-гидроксибензойная кислота, п-гидроксибензойная кислота, 1-3 018065 гидроксинафталин-2-карбоновая кислота или 3-гидроксинафталин-2-карбоновая кислота, и сульфоновыми кислотами, такими как метансульфоновая кислота или бензолсульфоновая кислота, этансульфоновая кислота, этан-1,2-дисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, (+)-камфор-10 сульфоновая кислота, нафталин-2-сульфоновая кислота, нафталин-1,5-дисульфоновая кислота или птолуолсульфоновая кислота. Эти соли можно получить из соединений формулы I по известным методикам получения солей. Фармацевтически приемлемые сольваты обычно представляют собой гидраты. Соединения формулы I, которые содержат кислотные, например карбоксигруппы, также могут образовывать соли с основаниями, предпочтительно с фармацевтически приемлемыми основаниями, такими как хорошо известные в данной области техники; такие подходящие соли включают соли металла,предпочтительно соли щелочного металла или щелочно-земельного металла, такие как соли натрия, калия, магния или кальция, или соли с аммиаком или фармацевтически приемлемыми органическими аминами или гетероциклическими основаниями, такими как этаноламины, бензиламины или пиридин, аргинин, бенетамин, бензатин, диэтаноламин, 4-(2-гидроксиэтил)морфолин, 1-(2-гидроксиэтил)пирролидин,N-метилглутамин, пиперазин, триэтаноламин или трометамин. Эти соли можно получить из соединений формулы I по известным методикам получения солей. Соединения формулы I, которые содержат кислотные, например карбоксигруппы, также могут существовать в виде цвиттерионов с четвертичным аммониевым центром. Фармацевтически приемлемые сольваты в контексте настоящего изобретения включают такие, в которых растворитель, использующийся для кристаллизации, может быть изотопно-замещенным например D2O, d6-ацетон или d6-ДМСО (диметилсульфоксид). Соединения формулы I, находящиеся в свободной форме, обычным образом можно превратить в соль и наоборот. Соединения, находящиеся в свободной форме или в форме соли, можно получить в виде гидратов или сольватов, содержащих растворитель, использовавшийся при кристаллизации. Соединения формулы I можно извлечь из реакционных смесей и очистить обычным образом. Изомеры, такие как энантиомеры, можно получить обычным образом, например с помощью фракционной кристаллизации или асимметрического синтеза из соответствующих асимметрично замещенных, например оптически активных исходных веществ. Некоторые соединения, предлагаемые в настоящем изобретении, содержат по меньшей мере один асимметрический атом углерода и поэтому они существуют в виде отдельных оптически активных изомерных форм или в виде их смесей, например в виде рацемических смесей. В случаях, когда содержатся дополнительные асимметрические центры, в объем настоящего изобретения входят отдельные оптические изомеры, а также их смеси, например смеси диастереоизомеров. В объем настоящего изобретения входят все такие формы, в частности чистые изомерные формы. Различные изомерные формы можно выделить или отделить друг от друга по обычным методикам, или любой данный изомер можно получить по обычным методикам синтеза или с помощью стереоспецифического или асимметрического синтеза. Поскольку соединения, предлагаемые в настоящем изобретении,предназначены для применения в фармацевтических композициях, нетрудно понять, что все они предпочтительно предоставляются в основном в чистом виде, например чистотой не менее 60%, более предпочтительно чистотой не менее 75% и еще более предпочтительно чистотой не менее 85%, еще более предпочтительно чистотой не менее 98% (выраженные в процентах значения являются массовыми). Неочищенные препараты соединений можно использовать для получения более чистых форм, использующихся в фармацевтических композициях; эти менее чистые препараты соединений должны содержать не менее 1%, предпочтительно не менее 5% и более предпочтительно от 10 до 59% соединения, предлагаемого в настоящем изобретении. В объем настоящего изобретения входят все фармацевтически приемлемые изотопно-меченые соединения формулы I, в которой один или большее количество атомов заменены на атомы, обладающие таким же атомным номером, но атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно обнаруживающихся в природе. Примеры изотопов, подходящих для включения в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, например 2 Н и 3 Н, углерода, например 11 С, 13C и 14 С, хлора, например 36Cl, фтора, например 18F, иода, например 123I и 125I, азота, например 13N и 15N, кислорода, например 15 О, 17 О и 18 О, и серы, например 35S. Некоторые изотопно-меченые соединения формулы I, например, содержащие радиоактивный изотоп, применимы для исследования распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий (3 Н) и углерод-14 (14 С) являются особенно подходящими вследствие легкости их включения и простых средств детектирования. Замещение более тяжелыми изотопами,такими как дейтерий (2 Н), может обеспечить некоторые терапевтические преимущества, обусловленные их более высокой метаболической стабильностью, например увеличенной длительностью полувыведенияin vivo или возможностью использования меньших доз, и поэтому при некоторых обстоятельствах они могут быть предпочтительными. Замещение изотопами, испускающими позитроны, такими как 11 С, 18F,15 О и 13N, может быть полезно для изучения занятости рецепторов с помощью позитронной эмиссионной томографии (ПЭТ). Изотопно-меченые соединения формулы I обычно можно получить по стандартным методикам, из-4 018065 вестным специалистам в данной области техники, или по методикам, аналогичным описанным в приведенных ниже примерах, с использованием подходящего изотопно-меченого реагента вместо использовавшегося ранее не содержащего изотоп реагента. Некоторые из соединений формулы I могут существовать в разных таутомерных формах. Таутометрия хорошо известна специалистам в данной области техники и специалист должен без труда определить, какие группы способны к таутометрии с образованием разных таутомерных форм. В объем настоящего изобретения входят все таутомерные формы соединений формулы I. Конкретные подходящие примеры соединений формулы I описаны ниже в настоящем изобретении в примерах. Другим объектом настоящего изобретения является способ получения соединения формулы (I). Например, соединения формулы (I) получают в соответствии со схемой 1. Схема 1 Реакцию соединения А 1 и соединения А 2 проводят с использованием подходящего палладиевого катализатора, такого как Pd(dppf)Cl2, в подходящем растворителе, таком как ДХМ (дихлорметан) или ДМФ (диметилформамид). Реакционная смесь обычно включает основание, такое как карбонат натрия или Et3N, и реакцию можно проводить при повышенных температурах, например при кипячении с обратным холодильником. Альтернативой реакции, представленной на приведенной выше схеме, является двухстадийная методика, по которой соединение А 1 можно ввести в реакцию с подходящим соединением бора в присутствии катализатора с получением производного бороновой кислоты/ангидрида бороновой кислоты А 1 и затем ввести его в реакцию с Ar'-Br (A3) с получением соединения формулы I. Альтернативная методика получения соединений формулы (I) приведена на схеме 2. Например, соединения формулы (I), в которой A, Ar', R1 и R2 являются такими, как определено выше, и Y обозначает кетогруппу, описывающуюся формулой C(O)Y', получают, как это показано на схеме. Схема 2 Если А обозначает N и Y обозначает C(O)Y', то соединения формулы A1 можно получить по методике, представленной на схеме 3. Если А обозначает СН и Y обозначает C(O)Y', то соединения формулы А 1 можно получить по методике, представленной на схеме 4. Схема 4 Если R1 и R2, оба, обозначают водород, то соединения формулы B1 можно получить по методике,представленной на схеме 5. Схема 5 Соединения формулы I и их фармацевтически приемлемые соли применимы в качестве лекарственных средств. В частности, они ингибируют ферменты фосфатидилинозит-3-киназы (PI 3-киназы), предпочтительно -изоформу (p110), которые обеспечивают образование фосфорилированных сигнальных продуктов. Таким образом, соединения, предлагаемые в настоящем изобретении, применимы для лечения нарушений, в которых участвует PI 3-киназа, в особенности -изоформа PI 3-киназы. Ингибирующую способность соединений формулы I можно продемонстрировать с помощью описанных ниже методик исследований. Бакуловирус, экспрессирующий различные фрагменты PI 3-K человека, слитого с глутатион-Sтрансферазой (GST), описан ранее в публикации Stoyanova, S., Bulgarelli-Leva, G., Kirsch, C., Hanck, Т.,Klinger, R., Wetzker, R., Wymann, M.P. (1997) Lipid- и protein kinase activities of G protein-coupled PI 3kinase g: structure-activity analysis и interactions with wortmannin. Biochem. J., 324:489. Остатки 38-1102 PI 3-K человека субклонируют в сайты BamHI и EcoRI вектора переноса pAcG2T (Pharmingen) и получаютGST-PI 3-K, в котором отсутствуют первые 37 остатков PI 3-K. Для экспрессирования рекомбинантного белка клетки насекомых Sf9 (Spodoptera frugiperda 9) при плотностях, равных от 3105 до 3106 клеток/мл, стандартным образом выдерживают в содержащей сыворотку среде TNMFH (Sigma). Клетки Sf9-6 018065 при плотности, равной 2106, в течение 72 ч инфицируют бакуловирусом человека GST-PI 3-K34 при множественности заражения (МН 3), равной 1. Инфицированные клетки собирают центрифугированием при 1400 g в течение 4 мин при 4 С и таблетки клеток замораживают при -80 С. Клетки Sf9 и Sf21 обладают одинаковыми характеристиками. Клетки Sf9 (1109) повторно суспендируют в 100 мл холодного(4 С) литического буфера (50 мМ Tris-HCl (Tris - трис(гидроксиметил)аминометан) рН 7,5, 1% Triton Х 100, 150 мМ NaCl, 1 мМ NaF, 2 мМ ДТТ (дитиотреитол) с прибавлением ингибиторов протеазы. Клетки инкубируют на льду в течение 30 мин и затем центрифугируют при 15000 g в течение 20 мин при 4 С. Очистку образца надосадочной жидкости проводят при 4 С с помощью афинной хроматографии с использованием гранул агарозного геля SEPHAROSE, связанных с глутатионом (выпускающихся фирмой Amersham Pharmacia Biotech). Используют отношение лизат клеток/смола GST, составляющее 50:1. Смолу GST сначала предварительно промывают для удаления консервирующего этанола и затем приводят в равновесие с литическим буфером. Добавляют лизат клеток (надосадочную жидкость) (обычно 50 мл лизата на 1 мл смолы GST в пробирках объемом 50 мл) и осторожно вращают в смесителе при 4 С в течение 2-3 ч. Поток несвязанного вещества, прошедший через образец, собирают центрифугированием при 1000 g в течение 5 мин при 4 С с помощью центрифуги DENLEY. 1 мл смолы GST, содержащей связанное вещество, переносят в пробирку для центрифуги FALCON объемом 15 мл для последующего проведения стадий промывки и элюирования. Сначала проводят серию из 3 циклов промывки (перемешивание путем осторожного переворачивания) с помощью 15 мл охлажденного льдом промывочного буфера А (50 мМ Tris-HCl рН 7,5, 1% Triton Х-100, 2 мМ ДТТ) с промежуточным центрифугированием при 1000 g в течение 5 мин при 4 С. Конечную однократную промывку проводят с помощью 15 мл охлажденного льдом промывочного буфера В (50 мМ Tris-HCl pH 7,5, 2 мМ ДТТ) и затем центрифугируют при 1000 g в течение 5 мин при 4 С. Промытую смолу GST подвергают заключительному элюированию с помощью 4 циклов посредством 1 мл охлажденного льдом буфера для элюирования (50 мМ Tris-HCl,pH 7,5, 10 мМ восстановленный глутатион, 2 мМ ДТТ, 150 мМ NaCl, 1 мМ NaF, 50% этиленгликоль и ингибиторы протеазы) с промежуточным центрифугированием при 1000 g в течение 5 мин при 4 С. Образцы разделяют на аликвоты и хранят при -20 С. Проведено исследование киназы in vitro, с помощью которого определяют перенос концевого фосфата аденозинтрифосфата к фосфатидилинозиту. Реакцию киназы проводят в белом 96-луночном микропланшете для титрования в рамках проксимально-сцинтилляционного анализа. Каждая лунка содержит 10 мкл исследуемого соединения в 5% диметилсульфоксиде и 20 мкл смеси для проведения анализа (40 мМ Tris, 200 мМ NaCl, 2 мМ этиленгликольаминоэтилтетрауксусная кислота (ЭГТК), 15 мкг/мл фосфатидилинозит, 12,5 мкМ аденозинтрифосфат (АТФ), 25 мМ MgCl2, 0,1 мкКи [33 Р]АТФ). Реакцию инициируют путем прибавления 20 мкл смеси ферментов (40 мМ Tris, 200 мМ NaCl, 2 мМ ЭГТК, содержащей рекомбинантную GST-p110). Планшет инкубируют при комнатной температуре в течение 60 мин и реакцию останавливают путем прибавления в каждую лунку по 150 мкл останавливающего раствора из гранул WGA (40 мМ Tris, 200 мМ NaCl, 2 мМ ЭГТК, 1,3 мМ этилендиаминтетрауксусная кислота(ЭДТК), 2,6 мкМ АТФ и 0,5 мг гранул полиакрилата натрия с агглютинином из зародышей пшеницы(Amersham Biosciences). Планшет герметизируют, инкубируют при комнатной температуре в течение 60 мин, центрифугируют при 1200 об/мин и затем исследуют в течение 1 мин с помощью сцинтилляционного счетчика. Полную активность определяют путем прибавления 10 мкл 5% диметилсульфоксида(ДМСО) и неспецифическую активность определяют путем прибавления 10 мкл 50 мМ ЭДТК вместо исследуемого соединения. По данным описанного выше анализа все приведенные в представленных ниже примерах соединения обладают значениями IC50, равными менее 1 мкМ. В частности, соединения примеров 1, 13, 28, 35,49, 51, 67, 74, 86 и 92 обладают значениями IC50 Для PI 3K , равными 0,033, 0,012, 0,373, 0,587, 0,362,0,393, 0,431, 0,125, 0,753 и 0,030 мкМ соответственно. В связи с их способностью ингибировать ферменты фосфатидилинозит-3-киназы соединения формулы I в свободной форме или в форме фармацевтически приемлемой соли ниже в настоящем изобретении также называющиеся "средствами, предлагаемыми в настоящем изобретении", применимы для лечения патологических состояний, которые опосредуются активацией ферментов PI 3-киназ, предпочтительно воспалительных или аллергических состояний. Лечение в контексте настоящего изобретения может быть симптоматическим или профилактическим. В соответствии с этим средства, предлагаемые в настоящем изобретении, применимы для лечения воспалительных или обструктивных заболеваний дыхательных путей и приводят, например, к уменьшению поражения тканей, воспаления дыхательных путей, бронхиальной гиперреактивности, ремоделирования или прогрессирования заболевания. Воспалительные или обструктивные патологические состояния и заболевания дыхательных путей, к которым применимо настоящее изобретение, включают астму любого типа или генеза, включая наследственную астму (неаллергическую) и приобретенную (аллергическую) астму, слабую, средней тяжести, тяжелую астму, бронхиальную астму, астму напряжения, профессиональную астму и астму, вызванную бактериальной инфекцией. Лечение астмы также следует понимать, как включающее лечение субъектов, например, в возрасте менее 4 или 5 лет, у которых наблю-7 018065 дается свистящее дыхание и которым поставлен или может быть поставлен диагноз "бронхит младенцев", установившаяся категория пациентов, вызывающих большую обеспокоенность медиков, которых в настоящее время часто называют страдающими от зарождающейся астмы или ранней стадии астмы. (Для удобства это конкретное астматические состояние часто называют "синдромом бронхита младенцев"). Профилактическая эффективность при лечении астмы проявляется в виде сниженной частоты или тяжести симптоматического приступа, например острого астматического или бронхосуживающего приступа, улучшении функции легких или улучшенной гиперреактивности дыхательных путей. Она также может проявляться в виде уменьшения потребности в другом, симптоматическом лечении, т.е. в лечении симптоматического приступа или предназначенном для ограничения или подавления симптоматического приступа, когда он происходит, например противовоспалительном (например, кортикостероидами) или бронхорасширяющем. Профилактическая эффективность при лечении астмы, в частности, может проявляться у субъектов, подверженных "утренним приступам". "Утренний приступ" является установленным астматическим синдромом, обычным для значительной доли страдающих астмой и характеризующимся приступом астмы, происходящим, например, примерно от 4 до 6 ч утра, т.е. в период времени, значительно удаленный от момента предыдущего введения симптоматического противоастматического средства. Другие воспалительные или обструктивные патологические состояния и заболевания дыхательных путей к которым применимо настоящее изобретение, включают острое поражение легких (ОПЛ), острый респираторный дистресс синдром взрослых (ОРСВ), хроническое обструктивное легочное заболевание,заболевание дыхательных путей или легких (ХОЛЗ, ХОЗД, ХОЗЛ), включая хронический бронхит или связанное с ним диспноэ, эмфизему, а также обострение гиперреактивности дыхательных путей, явившееся следствием лечения другим лекарственным средством, в частности другим средством ингаляционной терапии. Настоящее изобретение также относится к лечению бронхита любого типа или генеза,включая, например, острый, арахиновый, катаральный, крупозный, хронический или гнойный туберкулезный бронхит. Другие воспалительные или обструктивные заболевания дыхательных путей, к которым относится настоящее изобретение, включают пневмокониоз (воспалительное, обычно профессиональное,заболевание легких, часто сопровождающееся обструкцией дыхательных путей, хронической или острой,и вызываемое повторяющимся вдыханием пыли) любого типа или генеза, включая, например, алюминоз,антракоз, асбестоз, халикоз, птилоз, сидероз, силикоз, табакоз и биссиноз. Что касается их противовоспалительной активности, в особенности в отношении ингибирования активации эозинофилов, то средства, предлагаемые в настоящем изобретении, также применимы для лечения связанных с эозинофилами нарушений, например эозинофилии, в частности, связанных с эозинофилами нарушений дыхательных путей (например, включающих болезненную инфильтрацию эозинофилов тканей легких), включая гиперэозинофилию, поскольку она влияет на дыхательные пути и/или легкие, а также, например, связанных с эозинофилами нарушений дыхательных путей, следующих за синдромом Леффлера или одновременных с ним, эозинофильной пневмонии, заражения (в частности,многоклеточными) паразитами (включая тропическую эозинофилию), бронхолегочного аспергиллеза,нодозного полиартериита (включая синдром Черджа-Строса), эозинофильной гранулемы и связанных с эозинофилами нарушений, влияющих на дыхательные пути, вызванных реакцией на лекарственное средство. Средства, предлагаемые в настоящем изобретении, также применимы для лечения воспалительных или аллергических патологических состояний кожи, например псориаза, контактного дерматита, атопического дерматита, гнездной алопеции, многоформной эритемы, герпетриформного дерматита, склеродермы, витилиго, аллергического васкулита, уртикарии, буллезного пемфигоида, красной волчанки, пузырчатки, врожденного буллезного эпидермолиза и других воспалительных или аллергических патологических состояний кожи. Средства, предлагаемые в настоящем изобретении, также можно применять для лечения других заболеваний или патологических состояний, в частности заболеваний или патологических состояний,включающих воспалительный компонент, например для лечения заболеваний и патологических состояний глаз, таких как конъюнктивит, сухой кератоконъюнктивит и весенний конъюнктивит, заболеваний,влияющих на нос, включая аллергический ринит, и воспалительного заболевания с участием аутоиммунных реакций или обладающих аутоиммунным компонентом или этиологией, включая аутоиммунные заболевания крови (например, гемолитической анемии, апластической анемии, истинной эритроцитарной анемии и идиопатической тромбоцитопении), системной красной волчанки, полихондрии, склеродермы,гранулематоза Вегенера, дерматомиозита, хронического активного гепатита, злокачественной миастении,синдрома Стивенса - Джонсона, идиопатического спру, аутоиммунного воспалительного заболевания кишечника (например, язвенного колита и болезни Крона), эндокринной офтальмопатии, диффузного токсического зоба, саркоидоза; альвеолита, хронического гиперчувствительного пневмонита, рассеянного склероза, первичного биллиарного цирроза, увеита (переднего и заднего); сухого кератоконъюнктивита и весеннего конъюнктивита, интерстициального фиброза легких, псориатического артрита и гломерулонефрита (с нефротическим синдромом и без него, например включая идиопатический нефротический синдром или нефропатию с минимальными изменениями). Другие заболевания или патологические состояния, которые можно лечить средствами, предлагаемыми в настоящем изобретении, включают тромбоз, гипертензию, ишемическую болезнь сердца и панкреатит (Nature review Nov. 2006 Vol. 5), анемию, включая гемолитическую анемию, апластическую анемию и истинную эритроцитарную анемию (WO 2006/040318), септический шок, ревматоидный артрит,остеоартрит, пролиферативные заболевания, такие как рак, атеросклероз, отторжение аллотрансплантата после трансплантации, удар, ожирение, рестеноз, диабет, например сахарный диабет типа I (юношеский диабет) и сахарный диабет типа II, диарейные заболевания, ишемию/реперфузионные заболевания, ретинопатию, такую как диабетическая ретинопатия или гипербарическая вызванная кислородом ретинопатия, и патологические состояния, характеризующиеся повышенным внутриглазным давлением или секрецией внутриглазной жидкости, такие как глаукома. Средства, предлагаемые в настоящем изобретении, могут быть применимы для лечения или предупреждения сердечной недостаточности, такой как (острая и хроническая) застойная сердечная недостаточность, нарушения функции левого желудочка, включая нарушение сократительной способности сердца, гипертрофическую кардиомиопатию, диабетическую кардиомиопатию и другие типы вредной дисфункции сердца и ремоделирование. Другие заболевания или патологические состояния, которые можно лечить средствами, предлагаемыми в настоящем изобретении, включают септический шок, ревматоидный артрит, остеоартрит, пролиферативные заболевания, такие как рак, атеросклероз, отторжение аллотрансплантата после трансплантации, удар, ожирение, рестеноз, диабет, например сахарный диабет типа I (юношеский диабет) и сахарный диабет типа II, диарейные заболевания, ишемию/реперфузионные заболевания, ретинопатию,такую как диабетическая ретинопатия или гипербарическая вызванная кислородом ретинопатия, и патологические состояния, характеризующиеся повышенным внутриглазным давлением или секрецией внутриглазной жидкости, такие как глаукома. Средства, предлагаемые в настоящем изобретении, также могут быть применимы для лечения висцеральных нарушений, воспалительной болезни кишечника, воспалительного нарушения кишечника,цистита, например интерстициального цистита и недержания мочи, включая гиперрефлексию детрузора мочевого пузыря и гиперчувствительность мочевого пузыря. Эффективность средства, предлагаемого в настоящем изобретении, при подавлении воспалительных патологических состояний, например воспалительных заболеваний дыхательных путей, можно продемонстрировать на моделях животных, например модели мышей или крыс, предназначенных для исследования воспаления дыхательных путей или других воспалительных патологических состояний, например, как это описано в публикациях Szarka et al., J. Immunol. Methods (1997) 202:49-57; Renzi et al., Am.(1999) Am. J. Respir. Cell. Mol. Biol. 20:1-8. Средства, предлагаемые в настоящем изобретении, также применимы в качестве совместно применяющихся терапевтических средств, предназначенных для использования в комбинации с другими лекарственными веществами, такими как противовоспалительные, бронхорасширяющие или антигистаминные лекарственные вещества предпочтительно для лечения обструктивных или воспалительных заболеваний дыхательных путей, таких как указанные выше в настоящем изобретении, например, в качестве средств, усиливающих терапевтическую активность таких лекарственных средств, или в качестве средств, обеспечивающих снижение необходимой дозы или ослабление возможных побочных эффектов таких лекарственных средств. Средство, предлагаемое в настоящем изобретении, можно смешивать с другим лекарственным веществом в фиксированной фармацевтической композиции или можно вводить отдельно, до, одновременно или после другого лекарственного вещества. В соответствии с этим в объем настоящего изобретения входит комбинация средства, предлагаемого в настоящем изобретении, описанного выше в настоящем изобретении, с противовоспалительным, бронхорасширяющим или антигистаминным лекарственным веществом, указанное средство, предлагаемое в настоящем изобретении, и указанное лекарственное вещество находятся в одной или в разных фармацевтических композициях. Такие противовоспалительные лекарственные средства включают стероиды, в частности глюкокортикостероиды, такие как будезонид, бекламетазон дипропионат, флутиказон пропионат, циклезонид или мометазон фуроат, и соединения, описанные в WO 0200679, WO 0288167, WO 0212266 и WO 02100879, антагонисты LTB4, такие как описанные в US 5451700, антагонисты LTD4, такие как монтелукаст и зафирлукаст,агонисты допаминового рецептора, такие как каберголин, бромкриптин, ропинирол и 4-гидрокси-7-[22-3-(2-фенилэтокси)пропил]сульфонил]этил]амино]этил]-2(3 Н)-бензотиазолон и их фармацевтически приемлемые соли (гидрохлоридом является виозан - AstraZeneca), и ингибиторы PDE4, такие арифло(Schering-Plough), арофиллин (Almirall Prodesfarma), PD189659 (Parke-Davis), AWD-12-281 (Asta Medica),CDC-801 (Celgene) и KW-4490 (Kyowa Hakko Kogyo), а также описанные в WO 98/18796 и WO 03/39544. Такие бронхорасширяющие лекарственные средства включают антихолинергические или антимускариновые средства, в частности ипратропийбромид, окситропийбромид и соли тиотропия, а также средства,описанные в WO 01/04118, WO 02/51841, WO 02/53564, WO 03/00840, WO 03/87094, WO 04/05285, WO 02/00652, WO 03/53966, ЕР 424021, US 5171744, US 3714357 и WO 03/33495, и агонисты -2 адренорецептора, такие как салбутамол, тербуталин, салметерол и предпочтительно формотерол и их фармацевтически приемлемые соли и соединения (в свободной форме или в форме соли или сольвата) формулы I, указанные в РСТ International patent publication No. WO 00/75114, и этот документ включен в настоящее изобретение в качестве ссылки, предпочтительно соединения, указанные в приведенных в этой публикации примерах, предпочтительно 5-[(R)-2-(5,6-диэтилиндан-2-иламино)-1-гидроксиэтил]-8 гидрокси-1 Н-хинолин-2-он, и их фармацевтически приемлемые соли. Вводимые совместно антигистаминные лекарственные вещества включают цетиризингидрохлорид, ацетаминофен, клемастин фумарат,прометазин, лоратидин, деслоратидин, дифенгидрамин и фексофенадингидрохлорид. Комбинации средств, предлагаемых в настоящем изобретении, и стероидов, -2 агонистов, ингибиторов PDE4 или антагонистов LTD4 можно использовать, например, для лечения ХОЗЛ или предпочтительно астмы. Комбинации средств, предлагаемых в настоящем изобретении, и антихолинергических или антимускариновых средств, ингибиторов PDE4, агонистов допаминового рецептора или антагонистов LTB4 можно использовать, например, для лечения астмы или предпочтительно ХОЗЛ. Другими полезными комбинациями средств, предлагаемых в настоящем изобретении, с противовоспалительными лекарственными средствами являются комбинации с антагонистами хемокиновых рецепторов, например CCR-1, CCR-2, CCR-3, CCR-4, CCR-5, CCR-6, CCR-7, CCR-8, CCR-9 и CCR10,CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, в особенности с антагонистами CCR-5, такими как выпускающиеся фирмой Schering-Plough антагонисты SC-351125, SCH-55700 и SCH-D, выпускающиеся фирмой Takeda антагонисты, такие как N-4-6,7-дигидро-2-(4-метилфенил)-5 Н-бензоциклогептен-8 ил]карбонил]амино]фенил]метил]тетрагидро-N,N-диметил-2 Н-пиран-4-аминийхлорид (TAK-770), и антагонисты CCR-5, описанные в US 6166037 (в особенности в пп.18 и 19 формулы изобретения), WO 00/66558 (в особенности в п.8 формулы изобретения) и WO 00/66559 (в особенности в п.9 формулы изобретения). Ингибиторы киназы PI 3, например соединения, предлагаемые в настоящем изобретении, можно объединять с блокатором ангиотензинового рецептора, например валсартаном (блокатор ангиотензинового рецептора) и обеспечивать более значительный терапевтический эффект, чем при введении одного валсартана. Комбинированный режим также неожиданно уменьшает степень прогрессирования поражения органа-мишени - сердца, почек и головного мозга. Комбинация приводит к усиленным гипотензивным эффектам (при злокачественной, эссенциальной, реноваскулярной, диабетической, изолированной систолической и других типах вторичной гипертензии) и снижает пульсовое артериальное давление. Комбинация также эффективна для лечения наджелудочковой и желудочковой аритмии, фибрилляции предсердий, трепетания предсердий и вредного ремоделирования сосудов. Также можно показать, что комбинация эффективна для лечения и предупреждения инфаркта миокарда и его последствий и применима для лечения атеросклероза, стенокардии (стабильной и нестабильной) почечной недостаточности(диабетической и недиабетической), заболевания периферических сосудов, нарушения познавательной способности и удара. Кроме того, улучшение функции эндотелия при использовании комбинированной терапии благоприятно для заболеваний, при которых нарушена нормальная функция эндотелия, таких как сердечная недостаточность, стенокардия и диабет. Кроме того, комбинацию можно использовать для лечения или предупреждения первичной и вторичной легочной гипертензии, патологических состояний почек, таких как диабетическая нефропатия, гломерулонефрит, склеродермия, гломерулосклероз, протеинурия при первичном заболевании почек, а также артериальная почечно-сосудистая гипертензия,диабетическая ретинопатия, для лечения других сосудистых нарушений, таких как мигрень, заболевание периферических сосудов, болезнь Рейно, сужение просвета вследствие гиперплазии, нарушение познавательной способности (такое как болезнь Альцгеймера), глаукома и удар. Средства, предлагаемые в настоящем изобретении, также могут быть применимы для лечения заболеваний или нарушений, опосредуемых взаимодействиями с лимфоцитами, например, при трансплантации, таких как острое или хроническое отторжение алло- или ксеротрансплантатов клеток, тканей или органов или задержка функционирования трансплантата, реакция "трансплантант против хозяина", аутоиммунных заболеваний, например ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, злокачественной миастении, диабета типа I или II и связанных с ним нарушений, васкулита, пернициозной анемии, синдрома Шегрена, увеита, офтальмопатии Грейвса,гнездной алопеции и др., воспалительных заболеваний, необязательно обусловленных аберрантными реакциями, например, воспалительной болезни кишечника, болезни Крона или язвенного колита, наследственной бронхиальной астмы, воспалительной болезни легких, воспалительного поражения легких,воспалительного поражения почечных клубочков, атеросклероза, остеоартрита и также экзематозных дерматитов, себорейного дерматита, кожных проявлений иммунологически обусловленных нарушений,воспалительного заболевания глаз, кератоконъюнктивита, миокардита или гепатита, ишемии кишечника,травматического шока, рака, например рака молочной железы, Т-клеточных лимфом или Т-клеточных лейкозов, инфекционных заболеваний, например токсического шока (например, вызванного суперантигеном), септического шока, синдрома расстройства дыхания у взрослых или вирусных инфекций, напри- 10018065 мер СПИД (синдром приобретенного иммунодефицита), вирусного гепатита, хронической бактериальной инфекции или старческого слабоумия. Примеры трансплантатов клеток, тканей или цельных органов включают, например, островки Лангерганса, стволовые клетки, костный мозг, ткань роговицы, нейронную ткань, сердце, легкие, комбинированный сердце-легкие, почки, печень, кишечник, поджелудочную железу, трахею или пищевод. Средства, предлагаемые в настоящем изобретении, можно вводить вместе, например, с другими лекарственными средствами в качестве вспомогательных средств, например с иммунодепрессивными или иммуномодулирующими средствами или другими противовоспалительными средствами, например, для лечения или предупреждения острого или хронического отторжения алло- или ксеротрансплантата, или воспалительных или аутоиммунных нарушений. Например, соединения формулы I можно применять в комбинации с ингибитором кальциневрина, например циклоспорином А или FK 506, ингибиторомmTOR, например рапамицином, 40-О-(2-гидроксиэтил)рапамицином, CCI779, АВТ 578, АР 23573, биолимусом-7 или биолимусом-9, аскомицином, обладающим иммунодепрессивной способностью, например АВТ-281 или ASM981, кортикостероидами, циклофосфамидом, азатиопреном, метотрексатом, лефлуномидом, мизорибином, микофеноловой кислотой или ее солью, микофенолятом мотефилом, 15 дезоксиспергуалином или его иммунодепрессивным гомологом, аналогом или производным, ингибитором PKC, например, раскрытым в WO 02/38561 или WO 03/82859, например соединением примера 56 или 70, ингибитором киназы JAK3, например N-бензил-3,4-дигидроксибензилиденцианоацетамидом, циано-(3,4-дигидрокси)-N-бензилциннамамидом (тирфостин AG 490), продигиозином 25-С (PNU156804),[4-(4'-гидроксифенил)амино-6,7-диметоксихиназолином] (WHI-Р 131), [4-(3'-бром-4'-гидроксифенил) амино-6,7-диметоксихиназолином] (WHI-Р 154), [4-(3',5'-дибром-4'-гидроксифенил)амино-6,7-диметоксихиназолином] WHI-P97, KRX-211, 3-(3R,4R)-4-метил-3-[метил-(7 Н-пирроло[2,3-d]пиримидин-4-ил) амино]пиперидин-1-ил-3-оксопропионитрилом в свободной форме или в форме фармацевтически приемлемой соли, например моноцитратом (также обозначаемым, как СР-690.550), или соединением, раскрытым в WO 04/052359 или WO 05/066156, агонистом или модулятором рецептора S1P, напримерFTY720, необязательно фосфорилированным, или его аналогом, например 2-амино-2-[4-(3 бензилоксифенилтио)-2-хлорфенил]этил-1,3-пропандиолом, необязательно фосфорилированным, или 14-[1-(4-циклогексил-3-трифторметилбензилоксиимино)этил]-2-этилбензил-азетидин-3-карбоновой кислотой или ее фармацевтически приемлемыми солями, иммунодепрессивными моноклональными антителами, например моноклональными антителами к лейкоцитовым рецепторам, например MHC, CD2,CD3, CD4, CD7, CD8, CD25, CD28, CD40, CD45, CD52, CD58, CD80, CD86 или их лигандами, другими иммуномодулирующими соединениями, например рекомбинантной связывающей молекулой, содержащей по меньшей мере часть внеклеточного домена CTLA4 или его мутанта, по меньшей мере, внеклеточную часть CTLA4 или его мутанта, связанную с белковой последовательностью, не входящей вCTLA4, например CTLA4Ig (например, под обозначением АТСС 68629) или его мутанта, напримерLEA29Y, ингибиторами адгезионной молекулы, например антагонистами LFA-1, антагонистами ICAM-1 или -3, антагонистами VCAM-4 или антагонистами VLA-4. Средства, предлагаемые в настоящем изобретении, также могут быть применимы для лечения висцеральных нарушений, воспалительной болезни кишечника, воспалительного нарушения кишечника,цистита, например интерстициального цистита и недержания мочи, включая гиперрефлексию детрузора мочевого пузыря и гиперчувствительность мочевого пузыря. Средства, предлагаемые в настоящем изобретении, также могут быть применимы для лечения анемии в соответствии с WO 2006/040318. Средства, предлагаемые в настоящем изобретении, можно вводить любым подходящим путем, например перорально, например, в виде таблетки или капсулы; парентерально, например внутривенно; путем ингаляции, например, для лечения воспалительного или обструктивного заболевания дыхательных путей; назально, например, для лечения аллергического ринита; местно на кожу, например, для лечения атопического дерматита; или ректально, например, для лечения воспалительного заболевания кишечника. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы I в свободной форме или в форме фармацевтически приемлемой соли, необязательно совместно с фармацевтически приемлемым для нее разбавителем или носителем. Композиция может содержать совместно применяющееся терапевтическое средство, такое как противовоспалительное, бронхорасширяющее или антигистаминное лекарственное средство, как это описано выше в настоящем изобретении. Такие композиции можно приготовить с использованием обычных разбавителей и инертных наполнителей и методик, известных в области фармацевтики. Так, дозированные формы для перорального введения могут представлять собой таблетки или капсулы. Препараты для местного применения могут находиться в виде кремов, мазей, гелей или систем чрескожной доставки, например пластырей. Композиции для ингаляции могут представлять собой аэрозоль или другие распыляемые препараты или сухие порошкообразные препараты. Если композиция представляет собой аэрозольный препарат, то он предпочтительно содержит в качестве пропеллента, например, гидрофторалкан (HFA), такой как HFA134a, или HFA227, или их смесь, и может содержать один или большее количество сорастворителей, известных в данной области техники,- 11018065 таких как этанол (до 20 мас.%); и/или одно или большее количество поверхностно-активных веществ,таких как олеиновая кислота или сорбитантриолеат; и/или один или большее количество наполнителей,таких как лактоза. Если композиция представляет собой сухой порошкообразный препарат, то она предпочтительно содержит, например, соединение формулы I, обладающее частицами диаметром до 10 мкм,необязательно совместно с разбавителем или носителем, таким как лактоза, обладающим желательным распределением частиц по размерам, и соединение, которое способствует защите от ухудшения характеристик продукта вследствие влажности, например стеарат магния. Если композиция представляет собой препарат для распыления, то она предпочтительно содержит, например, соединение формулы I, растворенное или суспендированное в разбавителе, содержащем воду, сорастворитель, такой как этанол или пропиленгликоль, и стабилизатор, которым может являться поверхностно-активное вещество. Дозировки средств, предлагаемых в настоящем изобретении, использующиеся при практическом применении настоящего изобретения, разумеется, будут меняться в зависимости, например, от конкретного подвергающегося лечению патологического состояния, необходимого эффекта и пути введения. Обычно суточные дозы, подходящие для перорального введения, составляют примерно от 0,1 до 10 мг/кг. Другим объектом настоящего изобретения является соединение формулы I, определенное выше,предназначенное для применения в качестве лекарственного средства. Еще одним объектом настоящего изобретения является соединение формулы I, определенное выше,предназначенное для применения в качестве лекарственного средства для лечения воспалительных или аллергических патологических состояний, в частности воспалительных или аллергических патологических состояний, обсужденных выше в настоящем изобретении. Примеры Подходящие соединения, предлагаемые в настоящем изобретении, включают соединения формулы 1 а, приведенные ниже в табл. 1. Общие условия Масс-спектры снимают на приборах ЖХМС (жидкостная хроматография-масс-спектроскопия) с использованием ионизации электрораспылением. Этими приборами являются комбинации Agilent 1100 ВЭЖХ/масс-спектрометр Micromass Platform или Waters Acquity UPLC с масс-спектрометром SQD.[М+Н]+ и [M+Na]+ относятся к моноизотопным молекулярным массам. Спектры ядерного магнитного резонанса (ЯМР) снимают на спектрометрах общего пользованияBruker AVANCE 400 ЯМР с помощью ICON-ЯМР. Спектры снимают при 298 K и в качестве стандарта используют пик растворителя. Различные исходные вещества, промежуточные продукты и соединения, предлагаемые в предпочтительных вариантах осуществления, можно выделить и очистить, если это возможно, по обычным методикам, таким как осаждение, фильтрование, кристаллизация, выпаривание, перегонка и хроматография. Если не указано иное, то все исходные вещества приобретают у поставщиков и используют без дополнительной очистки. Соли можно получить из соединений по известным методикам получения солей. Кроме того, использовали различные имеющиеся в продаже реагенты и вещества. Такие реагенты и вещества включают Isolute (фирмы Biotage) и их можно приобрести у указанных поставщиков. Аббревиатуры. В экспериментальной части использовали приведенные ниже аббревиатуры: В приведенных ниже примерах соединения, предлагаемые в предпочтительных вариантах осуществления, синтезируют по методикам, описанным в настоящем изобретении, или по другим методикам,которые известны в данной области техники. Следует понимать, что настоящее изобретение не ограничивается вариантами осуществления, представленными в настоящем изобретении для иллюстрации, а включает все его формы, соответствующие объему приведенного выше описания. Получение конечных соединений Ссылочный пример 1.Na2CO3 (1 мл) добавляют ДМЭ (3 мл) и Pd(dppf)Cl2 ДХМ (0,027 г, 0,037 ммоль). Полученную красную суспензию нагревают при 120 С в течение 15 ч. Неочищенную реакционную смесь очищают с помощью хроматографии с обращенной фазой (Isolute С 18, 0-100% MeCN в воде - 0,1% ТФК) и получают искомое соединение в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)9,10 (1 Н, d), 9,02 (1 Н, s), 8,08 (1H, dd), 8,78 (1H, d), 8,36 (1H, dt),8,20 (1 Н, d), 8,02 (2 Н, br s), 7,61 (1 Н, ), 6,76 (2 Н, br s); MC m/z 362,0 [М+2 Н]+. Примеры 2-39. Эти соединения, а именно: 3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3-илметанон (пример 2),1 Н ЯМР (400 МГц, ДМСО-d6)9,14 (1 Н, m), 8,79 (1 Н, dd), 8,75 (1H, s), 8,30 (1H, dt), 8,18 (2 Н, s),7,78 (1H, d), 7,71 (1H, m), 7,66 (1 Н, m), 7,60 (1 Н, ddd), 3,70 (4 Н, t), 2,91 (4 Н, t), 2,51 (3 Н, s); MC m/z 440(1 Н, dt), 8,26 (1H, t), 8,17 (2 Н, s), 7,60 (1 Н, dd), 3,71-3,45 (6 Н, br d), 3,35 (2 Н, br ); MC m/z нет данных для массы иона [М+Н]+;MC m/z 380 [M+H]+; получают по методике, аналогичной методике получения соединения примера 1, путем замены 5(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина(промежуточный продукт K) на соответствующую бороновую кислоту или эфир бороновой кислоты. Соединения выделяют из реакционной смеси и очищают по стандартным методикам, таким как флэш-хроматография,фильтрование, перекристаллизация и растирание. Примеры 40-46. Эти соединения, а именно: 3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил-(4-хлорфенил)метанон (пример 40),1(1H, s), 8,01 (1H, d), 7,67 (1 Н, d), 7,58 (1 Н, t), 7,48 (1 Н, d), 3,83 (2 Н, m), 3,68 (4 Н, m), 3,62 (2 Н, t), 3,39 (3 Н,s), 2,94 (4 Н, m); МС m/z 484 [М+Н]+; получают по методике, аналогичной методике получения соединения примера 1, путем замены 5(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина(промежуточный продукт K) на соответствующую бороновую кислоту или эфир бороновой кислоты и (3-амино-6 бромпиразин-2-ил)пиридин-3-илметанона (промежуточный продукт АА) на соответствующий пиразинбромид. Пиразинбромиды получают, как это описано в разделе "Получение промежуточных продуктов". Ссылочный пример 47. [3-Амино-6-(1H-индол-5-ил)пиразин-2-ил]пиридин-3-илметанон. бис(Бензонитрил)палладий(II)хлорид (5,2 мг, 0,013 ммоль) и 1,4-бис(дифенилфосфино)бутан (6,7 мг, 0,015 ммоль) в толуоле (0,6 мл) перемешивают в течение 20 мин. Добавляют (3-амино-6 бромпиразин-2-ил)пиридин-3-илметанон (промежуточный продукт АА) (0,075 г, 0,27 ммоль), 5 индоилбороновую кислоту (0,056 г, 0,35 ммоль), этанол (0,36 мл) и 1 М раствор Na2CO3 (0,65 мл) и реакционную смесь нагревают с помощью микроволнового излучения при 140 С в течение 20 мин. Смесь разбавляют с помощью EtOAc и насыщенным водным раствором NaHCO3. Слои разделяют и водный слой экстрагируют с помощью EtOAc. Объединенные органические экстракты сушат (MgSO4) и очищают с помощью препаративной ВЭЖХ (0-100% MeCN в воде - 0,1% ТФК) и получают искомое соединение в виде оранжевого твердого вещества. 1(2 Н, br s), 7,90 (1H, s), 7,63-7,60 (3 Н, m), 7,39 (1 Н, t), 6,44 (1 Н, s); MC m/z 316 [М+Н]+; получают по методике, аналогичной методике получения соединения примера 47, путем замены 5 индоилбороновой кислоты на соответствующую бороновую кислоту. Соединения выделяют из реакционной смеси и очищают по стандартным методикам. Ссылочный пример 53.N-3-[5-(2-Метоксиэтиламино)-6-(пиридин-3-карбонил)пиразин-2 ил]фенилацетамид. Ацетат палладия(II) (2,83 мг, 0,006 ммоль) и 1,1-бис(дифенилфосфино)ферроцен (5,42 мг, 0,0095 ммоль) растворяют в ДМФ (2 мл) и смесь перемешивают при 50 С в течение 10 мин. Смесь охлаждают до комнатной температуры и добавляют 3-ацетамидобензолбороновую кислоту (25,5 мг, 0,14 ммоль), [6 бром-3-(2-метоксиэтиламино)пиразин-2-ил]пиридин-2-илметанон (промежуточный продукт АС) (40 мг,0,12 ммоль) в ДМФ (1,5 мл) и триэтиламин (24,9 мкл, 0,18 ммоль). После перемешивания при 80 С в течение 17 ч растворитель удаляют в вакууме. Очистка с помощью флэш-хроматографии при элюировании смесью CH2Cl2/MeOH, 98:2 дает искомое соединение. 1 Н ЯМР (ДМСО-d6)10,0 (1H, s) 9,4 (1H, d), 8,9 (1H, t), 8,77-8,73 (1H, m), 8,4 (1 Н, dt), 8,1 (1H, s),7,61-7,59 (1H, m), 7,54 (2 Н, t), 3,8-3,72 (2 Н, m), 3,62-3,56 (2 Н, m) 3,31 (3 Н, s) 2,02 (3 Н, s); MC m/z 376(ссылочный пример 57),1 Н ЯМР (ДМСО-d6)9,97 (1 Н, s), 9,16 (1H, d), 8,90 (1 Н, s), 8,66 (1H, d), 8,21 (1 Н, s), 8,11-8,08 (2 Н,m), 7,54 (1 Н, d), 7,47 (1 Н, d), 7,35 (1H, t), 2,03 (3 Н, s); MC m/z 424 [M+Na]+; получают по методике, аналогичной методике получения соединения ссылочного примера 53, путем замены 3-ацетамидобензолбороновой кислоты (25,5 мг, 0,14 ммоль) и [6-бром-3-(2 метоксиэтиламино)пиразин-2-ил]пиридин-2-илметанона (промежуточный продукт АС) на соответствующие бороновую кислоту и пиразинбромид. Пиразинбромиды получают, как это описано в разделе(0,05 г, 0,18 ммоль), бис(пинаколято)дибора (0,05 г, 0,19 ммоль), Pd(dppf)Cl2AXM (0,015 г, 0,018 ммоль) и ацетата калия (0,03 г, 0,27 ммоль) в ДМЭ (4 мл) кипятят с обратным холодильником в течение 4 ч. К суспензии добавляют Pd(dppf)Cl2 ДХМ (7 мг, 0,009 ммоль), 3-бром-N-(2-метоксиэтил)бензолсульфонамид (промежуточный продукт DD) (0,05 г, 0,18 ммоль), 2 М раствор Na2CO3 (1 мл) и ДМЭ (3 мл) и ее кипятят с обратным холодильником в течение еще 1 ч. После охлаждения реакционную смесь разбавляют с помощью EtOAc, промывают водой, сушат (MgSO4) и фильтруют через тонкий слой целита(фильтрующий материал). Растворитель удаляют в вакууме и остаток очищают с помощью колоночной флэш-хроматографии (SiO2, изогексан/EtOAc) и получают искомое соединение в виде желтого твердого вещества. 1H ЯМР (400 МГц, ДМСО-d6)9,01 (2 Н, m), 8,73 (1 Н, m), 8,29 (1H, dt), 8,22 (1 Н, m), 8,09 (3 Н, m),7,71 (1 Н, dt), 7,62 (1 Н, m), 7,51 (1 Н, ddd), 2,60 (2 Н, t), 0,72 (1 Н, m), 0,26 (2 Н, m), 0,01 (2 Н, m); MC m/z 410[M+H]+; получают по методике, аналогичной методике получения соединения примера 58, путем замены 3 бром-N-(2-метоксиэтил)бензолсульфонамида (промежуточный продукт DD) на соответствующее галогенированное соединение. Эти соединения имеются в продаже или их синтезируют, как это описано в разделе "Получение промежуточных продуктов". Примеры 82-85. Эти соединения, а именно: 3-амино-6-[3-(4-метилпиперазин-1-сульфонил)фенил]пиразин-2-ил-(4-хлорфенил)метанон (пример 82),1[М+Н]+; получают по методике, аналогичной методике получения соединения примера 58, с использованием соответствующих промежуточных арилбромида и пиразинбромида, которые получают, как это описано в разделе "Получение промежуточных продуктов". Соединения выделяют из реакционной смеси и очищают по стандартным методикам. Пример 86. [3-Амино-6-(3,4-дихлорфенил)пиразин-2-ил]-(4-пиперидин-1-илметилфенил)метанон. 0,25 М раствор [4-(1-пиперидинилметил)фенил]магнийбромида в ТГФ (5,51 мл, 1,37 ммоль) по каплям добавляют к раствору метоксиметиламида 3-амино-6-(3,4-дихлорфенил)пиразин-2-карбоновой кислоты (промежуточный продукт В) (0,09 г, 0,27 ммоль) в ТГФ (5 мл) и полученный раствор перемешивают в течение 2 ч. Раствор охлаждают до 0 С и добавляют 2 М раствор HCl (10 мл). Раствор промывают с помощью EtOAc (20 мл) и затем 2 М раствором NaOH значение рН доводят до 11. Экстракция с помощью EtOAc (50 мл), сушка (MgSO4) и удаление растворителя в вакууме дает желтое масло. Очистка с помощью флэш-хроматографии (SiO2, 50-100% EtOAc в изогексане) и последующее растирание с метанолом дают искомое соединение в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)9,04 (1H, s), 8,12 (1 Н, d), 7,97 (2 Н, bs), 7,93-7,88 (3 Н, m), 7,71 (1 Н,d), 7,47 (2 Н, d), 3,54 (2 Н, s), 2,36 (4 Н, bs), 1,52-1,51 (4 Н, m), 1,43-1,37 (2 Н, m); МС m/z 441, 443 [М+Н]+. Пример 87. 3-Амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илциклопропилметанон. 1M раствор циклопропилмагнийбромида в ТГФ (0,21 мл, 0,21 ммоль) в атмосфере N2 добавляют к раствору метоксиметиламида 3-амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-карбоновой кислоты (промежуточный продукт С) (0,058 мг, 0,14 ммоль) в безводном ТГФ (3 мл). Оранжевый раствор перемешивают при комнатной температуре в течение 2 ч, затем добавляют 1 М раствор циклопропилмагнийбромида в ТГФ (0,21 мл, 0,21 ммоль). Оранжевый раствор перемешивают при комнатной температуре в течение 1 ч. Добавляют 1 М раствор HCl (15 мл) и продукт экстрагируют с помощью(SiO2, 33-50% EtOAc в изогексане) дает искомое соединение в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)8,63 (1 Н, s), 7,92 (2 Н, bs), 7,79 (1H, s), 7,70-7,63 (2 Н, m), 3,64-3,62(4 Н, m), 3,49-3,43 (1 Н, m), 2,90 (4 Н, bs) 2,54 (3 Н, s), 1,09-1,01 (4 Н, m); МС m/z 403 [М+Н]+. Пример 88. 3-[6-Амино-5-(4-трет-бутилбензоил)пиридин-3-ил]-N-циклопропилбензолсульфонамид. Раствор 2-амино-5-(3-циклопропилсульфамоилфенил)-N-метокси-N-метилникотинамида (промежуточный продукт GA) (0,08 г, 0,21 ммоль) в ТГФ (3 мл) охлаждают до 0 С. По каплям добавляют 2 М раствор 4-трет-бутилфенилмагнийбромида в ТГФ (0,32 мл, 0,64 ммоль) и полученный раствор перемешивают и ему в течение ночи дают нагреться до комнатной температуры. Реакцию останавливают 2 М раствором HCl (5 мл). Растворитель удаляют в вакууме и остаток очищают с помощью колоночной хроматографии с обращенной фазой (Isolute C18, 0-100% MeCN в воде - 0,1% ТФК). Полученное твердое вещество растворяют в ДХМ, промывают 2 М раствором NaOH. Растворитель удаляют в вакууме и полученное твердое вещество сушат в вакууме при 40 С в течение ночи и получают искомое соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)8,69 (1H, d), 8,01 (1H, d), 7,97-7,89 (3 Н, m), 7,78 (1H, d), 7,72-7,67(5 Н, m), 7,64 (2 Н, d), 2,18-2,13 (1H, m), 1,38 (9 Н, s), 0,47-0,38 (4 Н, m); МС m/z 450 [М+Н]+. Пример 89. 3-(6-Амино-5-бензоилпиридин-3-ил)-N-циклопропилбензолсульфонамид. Это соединение получают по методике, аналогичной методике получения соединения примера 88, с использованием промежуточного продукта GA, полученного так, как это описано в разделе "Получение промежуточных продуктов", и реагента Гриньяра. Соединение выделяют из реакционной смеси и очищают по стандартным методикам. 1 Н ЯМР (400 МГц, ДМСО-d6)8,65 (1H, d), 7,94 (1 Н, d), 7,90 (1 Н, d), 7,88-7,86 (1H, m), 7,78 (2 Н, brs), 7,73-7,69 (3 Н, m), 7,64 (2 Н, t), 7,55 (2 Н, t), 7,13 (N14-H, t), 2,12-2,04 (1H, m), 0,44-0,33 (4 Н, m); МС m/z 394 [М+Н]+. Пример 90. [2-Амино-5-(3-хлор-5-метилфенил)пиридин-3-ил]фенилметанон. 1 М Раствор фенилмагнийбромида в ТГФ (0,79 мл, 0,79 ммоль) при 0 С по каплям добавляют к рас- 25018065GB) (0,08 г, 0,26 ммоль) в ТГФ (3 мл). Полученный раствор перемешивают при 0 С в течение 30 мин. По каплям добавляют 1 М раствор фенилмагнийбромида в ТГФ (0,79 мл, 0,79 ммоль) и раствор перемешивают при 0 С в течение еще 30 мин. Добавляют 2,5 М раствор HCl (10 мл) и продукт экстрагируют с помощью EtOAc и растворитель удаляют в вакууме. Очистка с помощью колоночной хроматографии с обращенной фазой (Isolute С 18, 0-100% MeCN в воде - 0,1% ТФК) дает искомое соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)8,28 (1H, dd), 7,77 (2 Н, br s), 7,66-7,59 (4 Н, m), 7,55-7,51 (2 Н, m),7,37 (1H, d), 7,29 (1H, dd), 7,23 (1H, d), 2,23 (3 Н, s); MC m/z 323 [М+Н]+. Пример 91. 2-Амино-5-[2-метил-5-(морфолин-4-сульфонил)фенил]пиридин-3-илпиридин-3 илметанон. Суспензию (2-амино-5-бромпиридин-3-ил)пиридин-3-илметанона (промежуточный продукт Н)(0,05 г, 0,18 ммоль), 3-N-морфолинилсульфонилфенилбороновой кислоты (0,055 г, 0,19 ммоль),Pd(dppf)Cl2 ДХМ (0,015 г, 0,018 ммоль) в 2 М растворе Na2CO3 (1 мл) и ДМЭ (3 мл) кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до комнатной температуры, адсорбируют на диоксиде кремния и очищают с помощью флэш-хроматографии (SiO2, 20-80% EtOAc в изогексане). Полученный продукт растирают с этанолом и сушат в вакууме при 45 С в течение ночи и получают искомое соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)8,83 (1H, d), 8,76 (1 Н, d), 8,39 (1 Н, d), 8,08 (1H, dt), 7,84 (2 Н, s), 7,67(0,05 г, 0,18 ммоль), бис(пинаколято)дибора (0,05 г, 0,19 ммоль), Pd(dppf)Cl2 ДХМ (0,015 г, 0,018 ммоль) и ацетата калия (0,026 г, 0,27 ммоль) в ДМЭ (4 мл) кипятят с обратным холодильником в течение 3 ч. Добавляют Pd(dppf)Cl2 ДХМ (0,015 г, 0,02 ммоль), 1-(3-бромбензолсульфонил)-4-метилпиперазин (промежуточный продукт DA) (0,05 г, 0,18 ммоль), 2 М раствор Na2CO3 (1 мл) и ДМЭ (1 мл) и реакционную смесь кипятят с обратным холодильником в течение ночи. Реакционную смесь непосредственно очищают с помощью колоночной хроматографии с обращенной фазой (Isolute С 18, 0-100% MeCN в воде 0,1% ТФК) и получают масло, которое растирают с изогексаном и сушат в вакууме при 45 С в течение ночи, и получают искомое соединение. 1(1H, d), 7,69 (1H, t), 7,58 (1 Н, ddd), 3,29-3,22 (1H, m), 3,01-2,92 (1 Н, m), 1,70-1,68 (2 Н, m), 1,59-1,56 (2 Н,m), 1,09-1,03 (2 Н, m); МС m/z 490 [М+Н]+; получают по методике, аналогичной методике получения соединения примера 58, путем замены 3 бром-N-(2-метоксиэтил)бензолсульфонамида (промежуточный продукт DD) на соответствующий галогенид. Галогениды имеются в продаже или их синтезируют, как это описано в разделе "Получение промежуточных продуктов". Пример 97. 3-Амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3 илметанон-О-метилоксим. 3-Амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3-илметанон (пример 2) (0,05 г, 0,11 ммоль), О-метилгидроксиламингидрохлорид (0,095 г, 1,14 ммоль), этанол (4 мл), воду(1 мл) и триэтиламин ( 0,07 г, 0,68 ммоль) нагревают в микроволновой печи при 120 С в течение 3,5 ч. Реакционную смесь очищают с помощью колоночной хроматографии с обращенной фазой (С 18, 0-100%MeCN в воде - 0,1% ТФК) и получают искомое соединение. 1 Н ЯМР (400 МГц, ДМСО-d6)8,56 (1H, dd), 8,48 (1 Н, d), 8,35 (1 Н, s), 7,75 (1 Н, dt), 7,70 (2 Н, bs),7,55-7,53 (2 Н, m), 7,48-7,43 (2 Н, m), 4,01 (3 Н, s), 3,61 (4 Н, t), 2,76 (4 Н, t) 2,19 (3 Н, s); МС m/z 469 [М+Н]+. Пример 98. 5-(5-Амино-6-циклопропанкарбонилпиразин-2-ил)-2,4-дифтор-N-(4-гидроксициклогексил)бензолсульфонамид. 1 М раствор циклопропилмагнийбромида в ТГФ (0,65 мл, 0,65 ммоль) в атмосфере N2 добавляют к раствору 2-амино-5-[2,4-дифтор-5-(4-гидроксициклогексилсульфамоил)фенил]-N-метокси-N-метилникотинамида (промежуточный продукт СА) (0,154 мг, 0,33 ммоль) в безводном ТГФ (5 мл). Оранжевый раствор перемешивают при комнатной температуре в течение 2 ч, затем добавляют 1 М раствор циклопропилмагнийбромида в ТГФ (0,65 мл, 0,65 ммоль). Оранжевый раствор перемешивают при комнатной температуре в течение 1 ч. Добавляют насыщенный рассол (10 мл) и продукт экстрагируют с помощьюEtOAc (2100 мл). Объединенные органические экстракты сушат (MgSO4) и концентрируют в вакууме. Очистка с помощью флэш-хроматографии (SiO2, 40-60% EtOAc в изогексане) дает искомое соединение в виде желтого твердого вещества. 1m/z 453 [М+Н]+. Пример 99. 3-(5-Амино-6-циклопропанкарбонилпиразин-2-ил)-N-(2-метоксиэтил)-бензолсульфонамид. 1 М раствор циклопропилмагнийбромида в ТГФ (1,3 мл, 1,3 ммоль) в атмосфере N2 добавляют к раствору метоксиметиламида 3-амино-6-[3-(2-метоксиэтилсульфамоил)фенил]пиразин-2-карбоновой кислоты (промежуточный продукт СВ) (0,49 г, 1,24 ммоль) в безводном ТГФ (15 мл). Оранжевый раствор перемешивают при комнатной температуре в течение 18 ч, затем добавляют 1 М раствор циклопропилмагнийбромида в ТГФ (1,3 мл, 1,3 ммоль). Оранжевый раствор перемешивают при комнатной температуре в течение 1 ч. Добавляют 1 М раствор HCl (45 мл) и продукт экстрагируют с помощью EtOAc (120 мл), сушат (MgSO4) и концентрируют в вакууме. Очистка с помощью флэш-хроматографии (SiO2, 50100% EtOAc в изогексане) дает искомое соединение в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)9,08 (1H, s), 8,51 (1 Н, m), 8,39 (1H, d), 8,22-7,90 (2 Н, br), 7,88 (2 Н,m), 7,76 (1 Н, t), 3,73 (1H, m) 3,37 (2 Н, t), 3,21 (3 Н, s), 3,02 (2 Н, q), 1,19 (2 Н, m), 1,14 (2 Н, m); МС m/z 377[М+Н]+. Пример 100. 3-Амино-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3 илметанон-О-(2-диметиламиноэтил)оксим. Это соединение получают по методике, аналогичной методике получения соединения примера 97,путем замены О-метилгидроксиламингидрохлорида на 2-(аминоокси)-N,N-диметилэтанаминдигидрохлорид. 1 Н ЯМР (400 МГц, CDCl3-d1)9,01 (1 Н, s), 8,71 (1 Н, d), 8,24 (1H, s), 8,22 (1H, dt), 7,85 (1H, d), 7,59(1H, s), 7,58 (1H, dd), 7,37 (1 Н, d), 4,74 (2H, t), 3,73 (4H, t), 3,51 (2H, t), 2,95 (4H, t), 2,84 (6H, s), 2,21 (3H,s); MC m/z 526 [M+H]+. Пример 101. 3-[5-Амино-6-(пиридин-3-илокси)пиразин-2-ил]-N-циклопропилбензолсульфонамид. Это соединение получают по методике, аналогичной методике получения соединения примера 1,путем замены 5-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина(промежуточный продукт K) на соответствующую бороновую кислоту и (3-амино-6-бромпиразин-2-ил) пиридин-3-илметанона (промежуточный продукт АА) на соответствующий пиразинбромид. Пиразинбромид получают, как это описано в разделе "Получение промежуточных продуктов". 1 Н ЯМР (400 МГц, ДМСО-d6)8,60 (1H, d), 8,47 (1H, dd), 8,35 (1H, s), 8,07-806 (1H, m), 7,95 (1H,dt), 7,83-7,80 (2 Н, m), 7,65 (1H, dt), 7,56 (1 Н, t), 7,54 (1H, dd), 6,99 (2 Н, s), 2,06 (1 Н, m), 0,42-0,36 (2 Н, m),0,34-0,30 (2 Н, m); MC m/z нет данных для массы иона [М+Н]+. Пример 102. 5-(5-Аминопиразин-2-ил)-2-хлор-N-(4-гидроксициклогексил)бензолсульфонамид(пример 102). Суспензию 5-бром-2-хлор-N-(4-гидроксициклогексил)бензолсульфонамида (промежуточный продукт DJ) (0,1 г, 0,27 ммоль), бис(пинаколято)дибора (0,07 г, 0,29 ммоль), Pd(dppf)Cl2 ДХМ (0,011 г, 0,014 ммоль) и ацетата калия (0,04 г, 0,40 ммоль) в ДМЭ (3 мл) кипятят с обратным холодильником в течение 1,5 ч. Добавляют Pd(dppf)Cl2 ДХМ (0,011 г, 0,014 ммоль), 2-амино-5-бромпиразин (0,05 г, 0,29 ммоль),2 М раствор Na2CO3 (1,5 мл) и ДМЭ (1 мл) и реакционную смесь кипятят с обратным холодильником в течение 1 ч. Реакционную смесь очищают с помощью колоночной хроматографии с обращенной фазойm/z 458 [М+Н]+; получают по методике, аналогичной методике получения соединения примера 102, путем замены 5 бром-2-хлор-N-(4-гидроксициклогексил)бензолсульфонамида (промежуточный продукт DJ) на соответствующий сульфонамид. Соединения выделяют из реакционных смесей и очищают с помощью колоночной хроматографии с обращенной фазой. Пример 105. 3-Амино-6-[3-(морфолин-4-сульфонил)фенил]пиразин-2-илпиридин-3-илметанон. Это соединение получают по методике, аналогичной методике получения соединения примера 1,путем замены 5-(4,4,5,5-тетраметил-[1,3,2]-диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина(промежуточный продукт K) на соответствующую бороновую кислоту. 1 Н ЯМР (400 МГц, ДМСО-d6)9,21 (1H, s), 9,18 (1H, d), 8,86 (1H, dd), 8,38 (2 Н, m), 8,24 (2 Н, s),8,22 (1H, m), 7,82 (2 Н, m), 7,65 (2 Н, dd), 3,72 (4 Н, t), 2,94 (4 Н, t); МС m/z 426 [М+Н]+. Пример 106. 5-[5-Амино-6-(пиридин-3-карбонил)пиразин-2-ил]-2-хлор-N-(2-метоксиэтил)бензолсульфонамид. Это соединение получают по методике, аналогичной методике получения соединения примера 58,путем замены 3-бром-N-(2-метоксиэтил)бензолсульфонамида (промежуточный продукт DD) на соответствующее галогенированное соединение. Это соединение имеется в продаже или его синтезируют, как это описано в разделе "Получение промежуточных продуктов". 1m/z 448 [М+Н]+. Пример 107. 3-(2-Метоксиэтиламино)-6-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-ил пиридин-3-илметанон (пример 107). Это соединение получают по методике, аналогичной методике получения соединения примера 53,путем замены 3-ацетамидобензолбороновой кислоты (25,5 мг, 0,14 ммоль) и [6-бром-3-(2 метоксиэтиламино)пиразин-2-ил]пиридин-2-илметанона (промежуточный продукт АС) на соответствующие бороновую кислоту и пиразинбромид. Пиразинбромиды получают, как это описано в разделе(3 Н, s); MC m/z 498 [М+Н]+. Пример 108. 5-[2-Метил-5-(морфолин-4-сульфонил)фенил]-N3-пиридин-3-илпиразин-2,3-диамин. Суспензию NaH (60% дисперсия в масле) (12 мг, 0,298 ммоль) перемешивают в ТГФ (3 мл). Добавляют пиридин-3-иламин (28 мг, 0,293 ммоль) и начинается выделение газа. После окончания выделения газа добавляют 3-хлор-5-[2-метил-5-(морфолин-4-сульфонил)фенил]пиразин-2-иламин (промежуточный продукт М) (100 мг, 0,271 ммоль) в ТГФ (3 мл). Реакционную смесь обрабатывают микроволновым излучением при 120 С в течение 10 мин. К реакционной смеси добавляют дополнительное количество NaH(60%) (33 мг, 0,813 ммоль) и образец обрабатывают микроволновым излучением при 120 С в течение 40 мин. Реакцию останавливают водой (100 мл) и смесь выпаривают в вакууме досуха. Коричневый остаток очищают с помощью колоночной хроматографии с обращенной фазой и получают искомое соединение в виде коричневого стеклообразного вещества. 1 Н ЯМР (400 МГц, ДМСО-d6)9,14 (1 Н, d), 8,99 (1H, s), 8,38-8,33 (3H, m), 7,81 (1H, s), 7,70 (1H, d),7,66-7,60 (5H, m), 3,64 (4H, t), 2,88 (4H, t), 2,54 (3H, s); MC m/z 427 [M+H]+. Пример 109. N-3-[5-Амино-6-(пиридин-3-карбонил)пиразин-2-ил]фенилметансульфонамид. Метансульфонилхлорид (24,6 мкл, 0,31 ммоль) в атмосфере N2 добавляют к раствору соединения примера 51 (68 мг, 0,21 ммоль) в пиридине (1 мл). Полученный раствор перемешивают при комнатной температуре в течение 1,5 ч. Растворитель удаляют в вакууме и остаток очищают с помощью флэшхроматографии (SiO2, 0-7,5% МеОН в ДХМ) и получают искомое соединение; MC m/z 370 [М+Н]+. Ссылочный пример 110. [3-Амино-6-(5-амино-2-метилфенил)пиразин-2-илметанон. Это соединение получают по методике, аналогичной методике получения соединения примера 47,путем замены 5-индоилбороновой кислоты на соответствующую бороновую кислоту. Соединение выделяют из реакционной смеси и очищают по стандартным методикам; MC m/z 306 [М+Н] . Ссылочный пример 111. N-3-[5-Амино-6-(пиридин-3-карбонил)пиразин-2-ил]-4-метилфенилацетамид. Уксусный ангидрид (19,7 мл, 0,21 ммоль) добавляют к раствору соединения примера 110 (48,5 мг,1 0,15 ммоль) в пиридине (1,5 мл) и полученный раствор перемешивают при комнатной температуре в течение 2 ч. Растворитель удаляют в вакууме и растирание с метанолом и диэтиловым эфиром дает искомое соединение в виде желтого твердого вещества; MC m/z 348 [М+Н]+. Получение промежуточных продуктов Следующие промежуточные продукты формулы (А) приведены ниже в табл. 2, методика их получения описана ниже в настоящем изобретении. Таблица 2 Промежуточный продукт АА. (3-Амино-6-бромпиразин-2-ил)пиридин-3-илметанон. Стадия 1. 2,2,6,6-Тетраметилпиперидин (1,97 мл, 11,6 ммоль) при -78 С по каплям добавляют к раствору нбутиллития (6,87 мл, 11,0 ммоль 1,6 М раствора в ТГФ) в ТГФ (40 мл) и полученный раствор перемешивают при этой же температуре в течение 5 мин. Реакционной смеси дают нагреться до 0 С и реакционную смесь перемешивают при этой же температуре в течение 35 мин. Реакционную смесь охлаждают до-78 С и по каплям добавляют 2-хлорпиразин (0,78 мл, 8,73 ммоль) и получают красный раствор, который перемешивают при -78 С в течение 40 мин. По каплям добавляют пиридин-3-карбальдегид (0,93 мл, 9,95
МПК / Метки
МПК: C07D 213/73, A61K 31/4427, A61P 37/08, C07D 241/20, C07D 401/06, A61P 37/06, A61K 31/4965, C07D 401/14, A61K 31/497
Метки: ингибиторов, пиридины, фосфатидилинозиткиназы-3, пиразины, качестве
Код ссылки
<a href="https://eas.patents.su/30-18065-piridiny-i-piraziny-v-kachestve-ingibitorov-p13k-fosfatidilinozitkinazy-3.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридины и пиразины в качестве ингибиторов p13k (фосфатидилинозиткиназы-3)</a>
Предыдущий патент: Способ лечения депрессии
Следующий патент: Агент, связывающийся с ядерными рецепторами
Случайный патент: Способ получения производных [1,4,5]-оксадиазепина












