Пиридо- и пиримидопиримидиновые производные в качестве антипролиферативных агентов
Номер патента: 13904
Опубликовано: 30.08.2010
Авторы: Эмбрехтс Вернер Констант Йохан, Понселе Виржини Софи, Фрейн Эдди Жан Эдгар, Бейнстерс Петер Якобус Йоханнес Антониус, Ван Эмелен Кристоф, Виллемс Марк, Сторк Пьер Анри, Перера Тимоти Пьетро Сурен
Формула / Реферат
1. Соединение, имеющее формулу
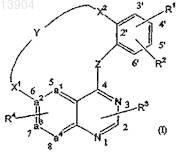
формы его N-оксидов, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,
где а1-а2=а3-а4представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH, N-CH=N-CH или CH-CH=N-CH,
Z представляет собой NH,
Y представляет собой -С3-9алкил-, -С1-5алкил-NR13-С1-5алкил-, -С1-5алкил-NR14-СО-С1-5алкил, С1-6алкил-NH-СО-,
X1 представляет собой NR11,
X2 представляет собой непосредственную связь, -O-, -N(R12-)С1-2алкил-, -N(R17)-С(О)-C1-2алкил-, -Het20-C1-2 алкил-,
R1 представляет собой водород или галоген,
R2 представляет собой водород или галоген,
R3 представляет собой водород,
R4 представляет собой водород,
R11 представляет собой водород,
R12 представляет собой водород или С1-4алкил,
R13 представляет собой водород,
R14 представляет собой водород,
R17 представляет собой водород,
Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила.
2. Соединение по п.1,
где Z представляет собой NH,
Y представляет собой -С3-9алкил-, -С1-5алкил-NR13-С1-5алкил-, -С1-5алкил-NR14-СО-С1-5алкил-, -С1-6алкил-NH-СО-,
X1 представляет собой NR11,
X2 представляет собой непосредственную связь, О, NR17-CO-C1-2алкил-, Нet20-С1-2алкил- или NR12-С1-2алкил-; в особом варианте осуществления X2 представляет собой непосредственную связь, NR17-CO-С1-2алкил-, Het20-С1-2алкил- или -О-,
R1 представляет собой водород или галоген, предпочтительно галоген,
R2 представляет собой водород или галоген,
R3 представляет собой водород,
R4 представляет собой водород,
R11 представляет собой водород,
R12 представляет собой водород или С1-4алкил,
R13 представляет собой водород,
R14 представляет собой водород,
R17 представляет собой водород,
Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила.
3. Соединение по п.1,
где Z представляет собой NH,
Y представляет собой -С3-9алкил-, -С1-5алкил-NR13-С1-5алкил-, -С1-5алкил-NR14-СО-С1-5алкил- или -С1-6алкил-NH-СО-,
X1 представляет собой -NR11-,
X2 представляет собой непосредственную связь, -C1-2алкил, -О-C1-2алкил-, -O-, -О-СН2- или Het20-С1-2алкил-,
R1 представляет собой водород или галоген,
R2 представляет собой водород или галоген,
R3 представляет собой водород,
R4 представляет собой водород,
R11 представляет собой водород,
R12 представляет собой водород или С1-4алкил,
R13 представляет собой водород,
Het20 представляет собой пирролидинил,
4. Соединение по п.1 или 2, где заместитель R1 находится в положении 4', заместитель R2 находится в положении 5', заместитель R3 находится в положении 3 и заместитель R4 находится в положении 7 структуры формулы (I).
5. Соединение по любому из пп.1-4, где а1-а2=а3-а4 представляет собой N-CH=CH-CH.
6. Соединение по любому из пп.1-4, где а1-а2=а3-а4 представляет собой N-CH=N-CH.
7. Соединение по любому из пп.1-4, где а1-а2=а3-а4 представляет собой CH-CH=N-CH.
8. Промежуточное соединение формулы

формы его N-оксидов, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,
где а1-а2=а3-а4представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH или N-CH=N-CH,
Y представляет собой -С3-9алкил-, -С1-5алкил-NR13-С1-5алкил- или -С1-6алкил-NH-CO-,
R1 представляет собой водород или галоген,
R2 представляет собой водород или галоген,
R4 представляет собой водород,
R11 представляет собой водород,
R13 представляет собой водород.
9. Применение соединений формулы (I) или формулы (XXXI) в качестве ингибитора киназы EGFR.
10. Применение соединения по любому из пп.1-7 в качестве лекарственного средства.
11. Применение соединения по любому из пп.1-7 для приготовления лекарственного средства для лечения нарушений, связанных с клеточной пролиферацией, таких как атеросклероз, рестеноз и рак.
12. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное для ингибирования киназы количество соединения, описанного в любом из пп.1-7.
13. Применение соединения по п.8 в качестве лекарственного средства.
14. Применение промежуточного соединения по п.8 для приготовления лекарственного средства для лечения нарушений, связанных с клеточной пролиферацией, таких как атеросклероз, рестеноз и рак.
15. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное для ингибирования киназы количество промежуточного соединения, описанного в п.8.
16. Способ получения соединения по любому из пп.1-7, включающий:
а) сочетание производного 2-ацетокси-8-хлорпиримидо[5,4-d]пиримидина (II) с подходящими замещенными анилинами (III) с получением промежуточных соединений формулы (IV) и снятие защиты с промежуточных соединений формулы (IV) с последующим замыканием кольца в подходящих условиях
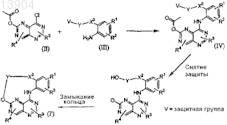
или
b) сочетание известного 8-хлор-2-(метилтио)пиримидо[5,4-d]пиримидина с производным 2-аминофенола формулы (XXI) с получением промежуточных соединений формулы (XXII), затем аминирование пиридо[3,2-d]пиримидина формулы (XXII) с использованием аминированного спирта (XXIII) в известных в данной области условиях с последующим замыканием кольца в условиях Мицунобу с получением требуемых соединений формулы (I")
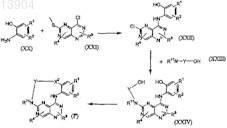
17. Способ лечения нарушения, связанного с клеточной пролиферацией, где указанный способ включает введение животному, нуждающемуся в подобном лечении, терапевтически эффективного количества соединения по любому из пп.1-7.
18. Способ лечения нарушения, связанного с клеточной пролиферацией, где указанный способ включает введение животному, нуждающемуся в подобном лечении, терапевтически эффективного количества промежуточного соединения по п.8.
Текст
Настоящее изобретение относится к соединениям формулы (I), формам их N-оксидов,фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где а 1 а 2=а 3-а 4 представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH, N-CH=N-CH или CH-CH=N-CH, Z представляет собой NH, Y представляет собой -C3-9 алкил-, -С 1-5 алкил-NR13 С 1-5 алкил-, -C1-5 алкил-NR14-СО-С 1-5 алкил, С 1-6 алкил-NH-СО-, X1 представляет собой NR11, X2 представляет собой непосредственную связь, -O-, -N(R12)С 1-2 алкил-, -N(R17)-С(О)-C1-2 алкил-,-Het20-C1-2 алкил-, R1 представляет собой водород или галоген, R2 представляет собой водород или галоген, R3 представляет собой водород, R4 представляет собой водород, R11 представляет собой водород, R12 представляет собой водород или С 1-4 алкил, R13 представляет собой водород, R14 представляет собой водород, R17 представляет собой водород, Het2 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила. Фрейн Эдди Жан Эдгар, Виллемс Марк(BE), Сторк Пьер Анри, Понселе Виржини Софи (FR), Ван Эмелен Кристоф, Бейнстерс Петер Якобус Йоханнес Антониус,Эмбрехтс Вернер Констант Йохан, Перера Тимоти Пьетро Сурен (BE) 013904 Данное изобретение относится к макроциклам на основе пиримидопиримидинов, которые, как было обнаружено, обладают антипролиферативной активностью, такой как противораковая активность и, соответственно, полезны в способах лечения организмов человека или животных, например, при получении лекарственных средств для применения при гиперпролиферативных нарушениях, таких как атеросклероз, рестеноз и рак. Изобретение относится также к способам получения указанных производных пиримидопиримидина, к содержащим их фармацевтическим композициям и их применению для производства лекарственных средств, используемых для получения антипролиферативного эффекта. В частности, было обнаружено, что соединения настоящего изобретения ингибируют тирозинкиназные ферменты, называемые также тирозинкиназами. Тирозинкиназы представляют собой класс ферментов, катализирующих перенос терминального фосфата аденозинтрифосфата к фенольной гидроксильной группе тирозинового остатка, находящегося в белке-мишени. Известно, что несколько онкогенов, участвующих в превращении клетки в клетку злокачественной опухоли, кодируют тирозинкиназные ферменты, включая некоторые рецепторы фактора роста, такие как EGF, FGF, IGF-1R, IR, PDGF и VEGF. Данное семейство рецепторных тирозинкиназ и, в частности, семейство EGF рецепторных тирозинкиназ часто присутствуют в обычных видах рака у человека, таких как рак груди, немелкоклеточный рак легких, включая аденокарциномы и рак сквамозных клеток легких, рак мочевого пузыря, рак пищевода, рак желудочно-кишечного тракта, такой как рак ободочной кишки, прямой кишки или желудка, рак предстательной железы, лейкемия и рак яичников, рак бронхов или поджелудочной железы, являющихся примерами нарушений, связанных с пролиферацией клеток. Соответственно, понятно, что селективное ингибирование тирозинкиназ будет полезно при лечении нарушений, связанных с пролиферацией клеток. Подтверждением этого мнения является разработка Herceptin (Trastuzumab) и Gleevec (мезилат иматиниба), первых примеров лекарственных препаратов против рака, направленных на мишень. Herceptin (Trastuzumab) направлен против Her2/neu, рецепторной тирозинкиназы, которая, как было обнаружено, увеличивается в 100 раз примерно у 30% пациентов с инвазивным раком груди. Клинические испытания Herceptin (Trastuzumab) показали, что он обладает противоопухолевой активностью против рака груди (Review by L.K. Shawer et al., "Smart Drugs: Tyrosinekinase inhibitors in cancer therapy", 2002, Cancer Cell Vol.1,117), и, соответственно, предоставили обоснование принципа терапии, направленной на рецепторные тирозинкиназы. Второй пример, Gleevec (мезилат иматиниба), направлен против Аbl тирозинкиназы (BcR-Abl), структурно активной цитоплазматической тирозинкиназы, присутствующей, фактически, у всех пациентов с хронической миелогенной лейкемией (CML) и у 15-30% взрослых пациентов с острой лимфобластической лейкемией. При клинических испытаниях Gleevec (мезилат иматиниба) показал впечатляющую эффективность при минимальных побочных эффектах, приводящую к улучшению в течение месяцев приема. Скорость прохождения данного агента через клинические испытания и регулятивную экспертизу стала примером быстрой разработки лекарственных средств (Drucker B.J.Lydon N., "Lessons learned from the development of an Abltyrosine kinase inhibitor for chronic myelogenous leukaemia.", 2000, J. Clininvest 105,3). Дополнительным доказательством является тот факт, что ингибиторы EGF рецепторной тирозинкиназы специфично ослабляют рост трансплантированной карциномы у бестимусных голых мышей, такой как карцинома молочной железы человека или карцинома сквамозных клеток человека (обзор T.R.Burke Jr,. Drugs of Future, 1992, 17, 119). В результате наблюдался значительный интерес к разработке лекарственных средств для лечения различных видов рака, мишенью для которых является EGFR рецептор. Например, несколько видов антител, связывающихся с внеклеточным доменом EGFR, находятся в процессе клинических испытаний, включая Ertibux (называемый также С 225, Cetuximab), который был разработан Imclone Systems и находится в III фазе клинических испытаний для лечения нескольких видов рака. Кроме того, несколько многообещающих перорально активных лекарственных средств, являющихся эффективными и относительно специфичными ингибиторами EGFR тирозинкиназы, в настоящее время значительно продвинулись в клинических испытаниях. Соединение ZD1839 AstrsZeneca, которое теперь называется IRESSA и принято для лечения развившегося немелкоклеточного рака легких, и соединение OSI-774 OSI/Genentech/Roche, которое теперь называется Tarceva (erlotinib), показали заметную эффективность против нескольких видов рака при клинических испытаниях на человеке (Morin M.J.,"From oncogene to drug: development of small molecule tyrosine kinase inhibitors as anti-tumour and antiangiogenic agents, 2000, Oncogene 19,6574). В дополнение к сказанному выше, было показано, что EFG рецепторные тирозинкиназы принимают участие в незлокачественных пролиферативных нарушениях, таких как псориаз (Elder et al,. Science,1989, 243; 811). Поэтому можно ожидать, что ингибиторы рецептора тирозинкиназы типа EFG окажутся полезными для лечения незлокачественных заболеваний, связанных с избыточной клеточной пролиферацией, таких как псориаз, доброкачественная гипертрофия предстательной железы, атеросклероз и рестеноз. В международной патентной заявке WO 96/07657 и WO 97/32880 описано, что пиримидопиримидины полезны в качестве ингибиторов тирозинкиназы и, в частности, рецепторной тирозинкиназы типаEFG. Неожиданно было обнаружено, что производные пиримидопиримидинов настоящей формулы (I),-1 013904 которые отличаются по своей структуре, обладают ингибирующей активностью по отношению к тирозинкиназе. Соответственно, целью настоящего изобретения является предоставление дополнительных ингибиторов тирозинкиназы, полезных для получения лекарственных средств для лечения нарушений, связанных с клеточной пролиферацией. Данное изобретение относится к соединениям формулы (I) формам их N-оксидов, фармацевтически приемлемым аддитивным солям и их стереохимически изомерным формам, где а 1-а 2=а 3-а 4 представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH, N-CH=N-CH или CH-CH=N-CH,Z представляет собой О, NH или S,Y представляет собой -С 3-9 алкил-, -С 3-9 алкенил-, -С 1-5 алкилокси-С 1-5 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил-, -С 1-5 алкил-СО-NR15-С 1-5 алкил-, -С 1-6 алкил-CO-NH-, -С 1-6 алкилNH-CO-, -СО-NH-СС 1-6 алкил-, -NH-СО-СС 1-6 алкил-, -CO-C1-7 алкил-, -С 1-7 алкил-CO-, C1-6 алкил-СО-С 1-6 алкил,X1 представляет собой непосредственную связь, О, -O-С 1-2 алкил-, СО, -СО-С 1-2 алкил-, NR11,11-NR C1-2 алкил-, NR16-CO-, NR16-СО-С 1-2 алкил-, -O-N=CH- или С 1-2 алкил,X2 представляет собой непосредственную связь, О, -O-С 1-2 алкил-, СО, -СО-С 1-2 алкил-, NR12, NR12 С 1-2 алкил-, NR17-CO-, NR17-СО-С 1-2 алкил-, Het20-C1-2 алкил-, -O-N=CH- или С 1-2 алкил,R1 представляет собой водород, циано, галоген, гидрокси, формил, С 1-6 алкилокси-, С 1-6 алкил-, С 1-6 алкилокси-, замещенный галогеном, С 1-6 алкил, замещенный одним или, где возможно, двумя или более заместителями, выбранными из гидрокси или галогена,R2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, Het16-карбонил-, С 1-4 алкилоксикарбонил-, С 1-4 алкилкарбонил-, аминокарбонил, моно- или ди(С 1-4 алкил)аминокарбонил-, Het1,формил, С 1-4 алкил-, С 2-6 алкинил-, С 3-6 циклоалкил-, С 3-6 циклоалкилокси-, С 1-6 алкилокси-, Ar5, Ar1-окси,дигидроксиборан, С 1-6 алкилокси-, замещенный галогеном,С 1-4 алкил, замещенный одним или, где возможно, двумя или более заместителями, выбранными из галогена, гидрокси или NR5R6,С 1-4 алкилкарбонил-, где указанный С 1-4 алкил необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси или С 1-4 алкилокси,R3 представляет собой водород, С 1-4 алкил, циано или С 1-4 алкил, замещенный одним или более заместителями, выбранными из галогена, С 1-4 алкилокси-, амино-, моно- или ди(С 1-4 алкил)амино-, С 1-4 алкилсульфонила- или фенила,R4 представляет собой водород, гидрокси, Аr3-окси, Аr4-С 1-4 алкилокси-, С 1-4 алкилокси-, С 1-4 алкенилокси-, необязательно замещенный Het12, или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси-, гидрокси,галогена, Het2-, -NR7R8, -карбонил-NR9R10 или Het3-карбонила-,R5 и R6, каждый независимо выбран из водорода или С 1-4 алкила,R7 и R8, каждый независимо выбран из водорода, С 1-4 алкила, Het8, аминосульфонила-, моно- или ди(С 1-4 алкил)аминосульфонила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила, гидроксикарбонил-С 1-4 алкила-, С 3-6 циклоалкила, Het9-карбонил-С 1-4 алкила-, Het10-карбонила-, полигидрокси-С 1-4 алкила, Het11 С 1-4 алкила- или Ar2-С 1-4 алкила-,R9 и R10, каждый независимо выбран из водорода, С 1-4 алкила, С 3-6 циклоалкила, Het4, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила-,R11 представляет собой водород, С 1-4 алкил, Het5, Het6-С 1-4 алкил-, С 2-4 алкенилкарбонил-, необязательно замещенный Het7-С 1-4 алкиламинокарбонилом-, С 2-4 алкенилсульфонил-, С 1-4 алкилокси-С 1-4 алкил или фенил, необязательно замещенный одним или, где возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или С 1-4 алкилокси-,R12 представляет собой водород, С 1-4 алкил, С 1-4 алкилоксикарбонил-, Het17, Het18-С 1-4 алкил-, С 2-4 алкенилкарбонил, необязательно замещенный Het19-C1-4 алкиламинокарбонилом-, С 2-4 алкенилсульфонил-,С 1-4 алкилокси-С 1-4 алкил или фенил, необязательно замещенный одним или, где возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или С 1-4 алкилокси-,-2 013904R13 представляет собой водород, С 1-4 алкил, Het13, Het14-С 1-4 алкил- или фенил, необязательно замещенный одним или, где возможно, двумя или более заместителями, выбранными из водорода, гидрокси,амино или С 1-4 алкилокси-,R14 и R15, каждый независимо выбран из водорода, С 1-4 алкила, Het15-С 1-4 алкила- или С 1-4 алкилоксиС 1-4 алкила-,R16 и R17, каждый независимо выбран из водорода, С 1-4 алкила, Het21-Cl-4 алкила- или С 1-4 алкилоксиС 1-4 алкила,Het1 представляет собой гетероцикл, выбранный из группы, включающей пиперидинил, морфолинил, пиперазинил, фуранил, пиразолил, диоксоланил, тиазолил, оксазолил, имидазолил, изоксазолил,оксадиазолил, пиридинил или пирролидинил, где указанный Het1 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из амино, С 1-4 алкила, гидрокси-С 1-4 алкила-, фенила, фенил-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила-, моно- или ди(С 1-4 алкил)амино- или аминокарбонила,Het2 представляет собой гетероцикл, выбранный из группы, включающей морфолинил, пиперазинил, пиперидинил, пирролидинил, тиоморфолинил или дитианил, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, галогена,амино, С 1-4 алкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила-, гидрокси-С 1-4 алкилокси, С 1-4 алкила-,моно- или ди(С 1-4 алкил)амино-, моно- или ди(С 1-4 алкил)амино-С 1-4 алкила-, амино-С 1-4 алкила-, моно- или ди(С 1-4 алкил)аминосульфонила-, аминосульфонила-,Het3, Het4 и Het8, каждый независимо представляет собой гетероцикл, выбранный из группы, включающей морфолинил, пиперазинил, пиперидинил, фуранил, пиразолил, диоксоланил, тиазолил, оксазолил, имидазолил, изоксазолил, оксадиазолил, пиридинил или пирролидинил, где указанный Het3, Het4 или Het8 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси-, амино-, С 1-4 алкила-, С 3-6 циклоалкил-С 1-4 алкила-, аминосульфонила-, моно- или ди(С 1-4 алкил)аминосульфонила- или амино-С 1-4 алкила-,Het5 представляет собой гетероцикл, выбранный из пирролидинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het6 и Het7, каждый независимо представляет собой гетероцикл, выбранный из группы, включающей морфолинил, пирролидинил, пиперазинил или пиперидинил, где указанный Het6 или Het7 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила,С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het9 и Het10, каждый независимо представляет собой гетероцикл, выбранный из группы, включающей фуранил, пиперидинил, морфолинил, пиперазинил, пиразолил, диоксоланил, тиазолил, оксазолил,имидазолил, изоксазолил, оксадиазолил, пиридинил или пирролидинил, где указанный Het9 или Het10 необязательно замещен С 1-4 алкилом, С 3-6 циклоалкил-С 1-4 алкилом или амино-С 1-4 алкилом-,Het11 представляет собой гетероцикл, выбранный из индолила илиHet12 представляет собой гетероцикл, выбранный из группы, включающей морфолинил, пиперазинил, пиперидинил, пирролидинил, тиоморфолинил или дитианил, где указанный Het12 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, галогена,амино, С 1-4 алкила-, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила, гидрокси-С 1-4 алкилокси-С 1-4 алкила,моно- или ди(С 1-4 алкил)амино- или моно- или ди(С 1-4 алкил)амино-С 1-4 алкила,Het13 представляет собой гетероцикл, выбранный из пирролидинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het14 представляет собой гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила-,Het15 и Het21, каждый независимо представляет собой гетероцикл, выбранный из группы, включающей морфолинил, пирролидинил, пиперазинил или пиперидинил или где указанные Het15 или Het21 необязательно замещены одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 диклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het16 представляет собой гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила,1,3,2-диоксаборолана или пиперидинила, где указанный гетероцикл необязательно замещен одним или более заместителями, выбранными из С 1-4 алкила,Het17 представляет собой гетероцикл, выбранный из пирролидинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, вы-3 013904 бранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het18 и Het19, каждый независимо представляет собой гетероцикл, выбранный из морфолинила,пирролидинила, пиперазинила или пиперидинила или где указанные Het18 и Het19 необязательно замещены одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-,Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила, пиперидинила, пиперазинила или пиразолидинила, где указанный гетероцикл необязательно замещен одним или,где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила-, иAr1, Ar2, Ar3, Ar4 и Ar5, каждый независимо представляет собой фенил, необязательно замещенный циано, С 1-4 алкилсульфонилом-, С 1-4 алкилсульфониламино-, аминосульфониламино-, гидрокси-С 1-4 алкилом-, аминосульфонилом-, гидрокси-, С 1-4 алкилокси- или С 1-4 алкилом. В предшествующих и последующих определениях галоген является общим определением для фтора, хлора, брома и йода,C1-4 алкил означает метил или этил,С 1-3 алкил означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 3 атомов углерода, например, такие как метил, этил, пропил и подобные,С 1-4 алкил означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 4 атомов углерода, например, такие как метил, этил, пропил, бутил, 1-метилэтил, 2-метилпропил,2,2-диметилэтил и подобные,С 1-5 алкил означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 5 атомов углерода, например, такие как метил, этил, пропил, бутил, пентил, 1-метилбутил, 2,2 диметилпропил, 2, 2-диметилэтил и подобные,подразумевается, что C1-6 алкил включает С 1-5 алкил и его высшие гомологи, содержащие 6 атомов углерода, например, такие как гексил, 1,2-диметилбутил, 2-метилпентил и подобные,подразумевается, что С 1-7 алкил включает С 1-6 алкил и его высшие гомологи, содержащие 7 атомов углерода, например, такие как 1,2,3-диметилбутил, 1,2-диметилпентил и подобные,С 3-9 алкил означает линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 3 до 9 атомов углерода, например, такие как пропил, бутил, пентил, гексил, гептил, октил, нонил и подобные,С 2-4 алкенил означает линейные и разветвленные углеводородные радикалы, содержащие одну двойную связь и содержащие от 2 до 4 атомов углерода, например, такие как винил, 2-пропенил, 3 бутенил, 2-бутенил и подобные,С 3-9 алкенил означает линейные и разветвленные углеводородные радикалы, содержащие одну двойную связь и содержащие от 3 до 9 атомов углерода, например, такие как 2-пропенил, 3-бутенил, 2 бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил и подобные,С 2-6 алкинил означает линейные и разветвленные углеводородные радикалы, содержащие одну тройную связь и содержащие от 2 до 6 атомов углерода, например такие как 2-пропинил, 3-бутинил, 2 бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил и подобные,С 3-6 циклоалкил является общим определением для циклопропила, циклобутила, циклопентила и циклогексила,С 1-4 алкилокси означает линейные и разветвленные насыщенные углеводородные радикалы, такие как метокси, этокси, пропокси, бутокси, 1-метилэтокси, 2-метилпропокси и подобные,подразумевается, что C1-6 алкилокси включает С 1-4 алкилокси и высшие гомологи, такие как метокси,этокси, пропокси, бутокси, 1-метилэтокси, 2-метилпропокси и подобные,полигидрокси-С 1-4 алкил является общим определением для определенного выше С 1-4 алкила, содержащего два, три или, где возможно, более гидроксизаместителей, например, таких как трифторметил. При использовании в предшествующих или последующих определениях термин формил относится к радикалу формулы -СН(=О). Когда X1 или X2 представляет собой двухвалентный радикал -O-N=CH-,указанный радикал связан через атом углерода с содержащим R3, R4 циклическим радикалом, соответственно, содержащим R1, R2 фенильным радикалом соединения формулы (I). Подразумевается, что указанные в предшествующих и последующих определениях гетероциклы включают все свои возможные изомерные формы, например, пирролил включает также 2 Н-пирролил,триазолил включает 1,2,4-триазолил и 1,3,4-триазолил, оксадиазолил включает 1,2,3-оксадиазолил, 1,2,4 оксадиазолил, 1,2,5-оксадиазолил и 1,3,4-оксадиазолил, тиадиазолил включает 1,2,3-тиадиазолил, 1,2,4 тиадиазолил, 1,2,5-тиадиазолил и 1,3,4-тиадиазолил, пиранил включает 2 Н-пиранил и 4 Н-пиранил. Кроме того, гетероциклы, указанные в предшествующих и последующих определениях, могут быть связаны с остатком молекулы формулы (I) через любой атом углерода кольца или подходящий гетероатом. Так, например, когда гетероцикл представляет собой имидазолил, он может представлять собой 1 имидазолил, 2-имидазолил, 3-имидазолил, 4-имидазолил и 5-имидазолил, когда он представляет собой тиазолил, он может представлять собой 2-тиазолил, 4-тиазолил и 5-тиазолил, когда он представляет со-4 013904 бой триазолил, он может представлять собой 1,2,4-триазол-1-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил,1,3,4-триазол-1-ил и 1,3,4-триазол-2-ил, когда он представляет собой бензотиазолил, он может представлять собой 2-бензотиазолил, 4-бензотиазолил, 5-бензотиазолил, 6-бензотиазолил и 7-бензотиазолил. Подразумевается, что фармацевтически приемлемые аддитивные соли включают формы терапевтически активных нетоксичных аддитивных солей кислот, которые способны образовывать соединения формулы (I). Последние могут быть удобно получены обработкой формы основания подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например, хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и подобные кислоты, или органические кислоты, например, такие как уксусная, пропионовая,гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть бутандикарбоновая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуосульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. Подразумевается, что указанные выше фармацевтически приемлемые аддитивные соли включают формы терапевтически активных нетоксичных аддитивных солей основания, которые способны образовывать соединения формулы (I). Примерами подобных форм аддитивных солей основания являются, например, соли натрия, калия, кальция, а также соли фармацевтически приемлемых аминов, например, таких как аммиак, алкиламины, бензатин, N-метил-D-глюкамин, гидрабамин, аминокислоты, например аргинин, лизин. Напротив, указанные солевые формы можно перевести в форму свободной кислоты или основания обработкой подходящим основанием или кислотой. Используемый выше термин аддитивная соль включает также сольваты, которые способны образовывать соединения формулы (I), а также их соли. Подобные сольваты представляют собой, например,гидраты, алкоголяты и подобные. Используемый выше термин стереохимически изомерные формы определяет возможные различные изомерные, а также конформационные формы, которыми могут обладать соединения формулы (I). Если не приведено или не указано иначе, химическое обозначение соединений указывает на смесь всех возможных стереохимически и конформационно изомерных форм, при этом указанные смеси содержат все диастереомеры, энантиомеры и/или конформеры основной молекулярной структуры. Подразумевается, что все стереохимически изомерные формы соединений формулы (I) как в чистом виде, так и в смеси друг с другом входят в объем настоящего изобретения. Некоторые соединения формулы (I) могут также существовать в виде своих таутомеров. Подразумевается, что хотя подобные формы особо не указаны в приведенных выше формулах, они входят в объем настоящего изобретения. Подразумевается, что формы N-оксидов соединений формулы (I) включают такие соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида. Предпочтительная группа соединений состоит из соединений формулы (I), для которых выполняется одно или более из следующих ограничений:Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 2-9 алкенил-, -С 1-5 алкилокси-С 1-5 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-6 алкил-NH-CO-, -CO-С 1-7 алкил-, -С 1-7 алкил-СО- или -С 1-6 алкил-СО-С 1-6 алкил-,X1 представляет собой О, -O-C1-2 алкил-, -O-N=CH-, NR11 или -NR11-С 1-2 алкил-; в конкретном варианте осуществления X1 представляет собой NR11, -О- или -О-СН 2-,X2 представляет собой непосредственную связь, О, -O-С 1-2 алкил-, -O-N=CH-, C1-2 алкил, NR12 или 12NR -С 1-2 алкил-; в конкретном варианте осуществления X2 представляет собой непосредственную связь,-O-N=CH-, С 1-2 алкил, -O-С 1-2 алкил-, -O-или -О-СН 2-,R1 представляет собой водород, циано, галоген или гидрокси, предпочтительно галоген,R2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, С 1-4 алкилоксикарбонил-, Het16-карбонил,С 1-4 алкил-, С 2-6 алкинил-, Ar5 или Het1; в дополнительном варианте осуществления R2 представляет собой водород, циано, галоген, гидрокси или Ar5,R3 представляет собой водород,R4 представляет собой водород, гидрокси, С 1-4 алкилокси-, Ar4-C1-4 алкилокси- или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси- или Het2-,R11 представляет собой водород, С 1-4 алкил- или С 1-4 алкилоксикарбонил-,R12 представляет собой водород, С 1-4 алкил- или С 1-4 алкилоксикарбонил-,R13 представляет собой Het14-С 1-4 алкил-, в частности морфолинил-С 1-4 алкил-,Het1 представляет собой тиазолил, необязательно замещенный амино, С 1-4 алкилом, гидрокси-С 1-4 алкилом-, фенилом, фенил-С 1-4 алкилом-, С 1-4 алкилокси-С 1-4 алкилом-, моно- или ди(С 1-4 алкил)амино- или аминокарбонилом-,-5 013904Het2 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила-; в дополнительном варианте осуществления Het2 представляет собой гетероцикл, выбранный из морфолинила или пиперидинила, необязательно замещенных С 1-4 алкилом-, предпочтительно метилом,Het14 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het14 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила;Het16 представляет собой гетероцикл, выбранный из пиперидинила, морфолинила или пирролидинила,Ar4 представляет собой фенил, необязательно замещенный циано, гидрокси, С 1-4 алкилокси- или С 1-4 алкилом,Ar5 представляет собой фенил, необязательно замещенный циано, гидрокси, С 1-4 алкилокси или С 1-4 алкилом. Следующая группа соединений состоит из таких соединений формулы (I), для которых выполняется одно или более из следующих ограничений:Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-6 алкил-NH-CO- или -CO-NH-C1-6 алкил-,X1 представляет собой -О- или -NR11-,X2 представляет собой непосредственную связь, -C1-2 алкил, -O-С 1-2 алкил-, -O- или -О-СН 2-,R1 представляет собой водород или галоген,R2 представляет собой водород, циано, галоген, гидроксикарбонил-, С 1-4 алкилоксикарбонил-, Het16 карбонил- или Ar5,R3 представляет собой водород,R4 представляет собой водород, гидрокси, С 1-4 алкилокси-, Ar4-С 1-4 алкилокси-, или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси- или Het2-,R11 представляет собой водород,R12 представляет собой водород, С 1-4 алкил- или С 1-4 алкилоксикарбонил-,R13 представляет собой Het14-С 1-4 алкил-, в частности морфолинил-С 1-4 алкил-,Het2 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила; в дополнительном варианте осуществления Het2 представляет собой гетероцикл, выбранный из морфолинила или пиперидинила, необязательно замещенных С 1-4 алкилом, предпочтительно метилом,Het14 представляет собой морфолинил,Het16 представляет собой гетероцикл, выбранный из морфолинила или пирролидинила,Ar4 представляет собой фенил,Ar5 представляет собой фенил, необязательно замещенный циано. Следующая группа соединений состоит из таких соединений формулы (I), для которых выполняется одно или более из следующих ограничений:Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 2-9 алкенил-, -С 1-5 алкилокси-С 1-5 алкил-, -С 1-5 алкил-NH13-С 1-5 алкил-, -С 1-5 алкил-NH14-СО-С 1-5 алкил-, -С 1-6 алкил-NH-CO-, -CO-С 1-7 алкил-, -С 1-7 алкил-CO- или С 1-6 алкилСО-С 1-6 алкил,X1 представляет собой О, -О-С 1-2 алкил-, -O-N=CH-, NR11 или -NR11-С 1-2 алкил-, в конкретном варианте осуществления X1 представляет собой непосредственную связь, С 1-2 алкил-, -O-C1-2 алкил-, NR11, -Оили -О-СН 2-,X2 представляет собой непосредственную связь, -O-, -O-С 1-2 алкил-, -O-N=CH-, NR17-CO-, NR17-СОС 1-2 алкил-, С 1-2 алкил-, Het20-C1-2 алкил-, NR12 или NR12-C1-2 алкил-; в конкретном варианте осуществленияX2 представляет собой непосредственную связь, C1-2 алкил-, -O-С 1-2 алкил-, NR17-CO-, NR17-CO-C1-2 алкил-,Het20-С 1-2 алкил-, -O- или -О-СН 2-,R1 представляет собой водород, циано, галоген или гидрокси, предпочтительно галоген,R2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, С 1-4 алкилоксикарбонил-, Het16-карбонил, С 1-4 алкил-, С 2-6 алкинил-, Ar5 или Het1; в дополнительном варианте осуществления R2 представляет собой водород, циано, галоген, гидрокси или Ar5, в более конкретном варианте осуществления R2 представляет собой водород или галоген,R3 представляет собой водород,R4 представляет собой водород, гидрокси, С 1-4 алкилокси-, Ar4-С 1-4 алкилокси- или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси- или Het2-,-6 013904R11 представляет собой водород, С 1-4 алкил- или С 1-4 алкилоксикарбонил-,R12 представляет собой водород, С 1-4 алкил- или С 1-4 алкилоксикарбонил-,R13 представляет собой водород или Het14-С 1-4 алкил-, в частности морфолинил-С 1-4 алкил-,R14 представляет собой водород или С 1-4 алкил,R17 представляет собой водород, С 1-4 алкил-, Het21-Cl-4 алкил или С 1-4 алкилокси-С 1-4 алкил, в частности R17 представляет собой водород или С 1-4 алкил,Het1 представляет собой тиазолил, необязательно замещенный амино, С 1-4 алкилом, гидрокси-С 1-4 алкилом, фенилом, фенил-С 1-4 алкилом, С 1-4 алкилокси-С 1-4 алкилом, моно- или ди(С 1-4 алкил)амино- или аминокарбонилом,Het2 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила-; в дополнительном варианте осуществления Het2 представляет собой гетероцикл, выбранный из морфолинила или пиперидинила, необязательно замещенных С 1-4 алкилом, предпочтительно метилом,Het14 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het14 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила,Het16 представляет собой гетероцикл, выбранный из пиперидинила, морфолинила или пирролидинила,Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила или пиперидинила,Het21 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het21 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила;Ar4 представляет собой фенил, необязательно замещенный циано, гидрокси, С 1-4 алкилокси или С 1-4 алкилом,Ar5 представляет собой фенил, необязательно замещенный циано, гидрокси, С 1-4 алкилокси или С 1-4 алкилом. Следующая группа соединений состоит из таких соединений формулы (I), для которых выполняется одно или более из следующих ограничений:Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил-, -С 16 алкил-NH-CO- или -CO-NH-C1-7 алкил-,X1 представляет собой непосредственную связь, С 1-2 алкил-, -O-С 1-2 алкил-, -O-, -О-СН 2- или -NR11-,X2 представляет собой -O-, -O-C1-2 алкил-, -O-С 1-2 алкил-, -NR12-, -NR12-С 1-2 алкил-, NR17-CO-, NR17 СО-С 1-2 алкил- или Het20-С 1-2 алкил-,R1 представляет собой водород или галоген,R2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, С 1-4 алкилоксикарбонил-, Het16-карбонил или Ar5; в частности, R2 представляет собой водород или галоген,R3 представляет собой водород,R4 представляет собой водород, гидрокси, С 1-4 алкилокси-, Ar4-С 1-4 алкилокси- или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси- или Het2-,R11 представляет собой водород,R12 представляет собой водород, С 1-4 алкил или С 1-4 алкилоксикарбонил,R13 представляет собой водород или Het14-С 1-4 алкил-, в частности, водород или морфолинил-С 1-4 алкил-,R14 представляет собой водород,R17 представляет собой водород,Het2 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила-; в дополнительном варианте осуществления Het2 представляет собой гетероцикл, выбранный из морфолинила или пиперидинила, необязательно замещенных С 1-4 алкилом, предпочтительно метилом,Het14 представляет собой морфолинил,Het16 представляет собой гетероцикл, выбранный из морфолинила или пирролидинила,Het20 представляет собой пирролидинил или пиперидинил,Ar4 представляет собой фенил,Ar5 представляет собой фенил, необязательно замещенный циано. Другую особую группу соединений составляют такие соединения формулы (I), где а 1-а 2=а 3-а 4 представляет собой N-CH=CH-CH,такие соединения формулы (I), где а 1-а 2=а 3-а 4 представляет собой N-CH=N-CH,-7 013904 такие соединения формулы (I), где а 1-а 2=а 3-а 4 представляет собой CH-CH=N-CH,такие соединения формулы (I), где -X1- представляет собой -O-,такие соединения формулы (I), где -X1- представляет собой -NR11-, в частности -NH-,такие соединения формулы (I), где -X2- представляет собой -NR17-СО-С 1-2 алкил, в частности -NHСО-С 1-2 алкил-,такие соединения формулы (I), где -X2- представляет собой -NR12-С 1-2 алкил, в частности -NH-С 1-2 алкил-,такие соединения формулы (I), где -Y- представляет собой -С 1-5 алкил-NR14-СО-С 1-5 алкил-, в частности -С 1-5 алкил-NH-CO-С 1-5 алкил-,такие соединения формулы (I), где R1 представляет собой фтор, хлор или бром,такие соединения формулы (I), где R2 представляет собой фтор, хлор или бром,такие соединения формулы (I), где R1 и R2 представляют собой галоген, в частности такие соединения формулы (I), где R1 представляет собой фтор, и R2 представляет собой хлор,такие соединения формулы (I), где R2 представляет собой Het1, в частности тиазолил, необязательно замещенный метилом,такие соединения формулы (I), где R2 представляет собой С 2-6 алкинил-, в частности этинил,такие соединения формулы (I), где R2 представляет собой Ar5, в частности фенил, необязательно замещенный циано,такие соединения формулы (I), где R3 представляет собой циано,такие соединения формулы (I), где R4 представляет собой метокси и где указанный метокси находится в 7 положении структуры формулы (I),такие соединения формулы (I), где R4 представляет собой С 1-4 алкилокси, замещенный одним заместителем, выбранным из C1-4 алкилокси- или Het2-, в частности пропокси, замещенный морфолинилом,такие соединения формулы (I), где R12 представляет собой водород или С 1-4 алкил, в частности, метил или где R12 представляет собой С 1-4 алкилоксикарбонил-, в частности трет-бутоксикарбонил-,такие соединения формулы (I), где Het2 представляет собой морфолинил, необязательно замещенный С 1-4 алкилом, предпочтительно, морфолинил, связанный по атому азота с остатком соединений формулы (I),такие соединения формулы (I), где Het3 представляет собой морфолинил, необязательно замещенный С 1-4 алкилом, предпочтительно морфолинил, связанный по атому азота с остатком соединений формулы (I),такие соединения формулы (I), где Het12 представляет собой морфолинил, необязательно замещенный С 1-4 алкилом, в частности, морфолинил, связанный по атому азота с остатком соединений формулы(I). В следующем варианте осуществления настоящего изобретения заместитель R1 находится в положении 4', заместитель R2 находится в положении 5', заместитель R3 находится в положении 2 и заместитель R4 находится в положении 6 структуры формулы (I). Особую группу соединений в соответствии с настоящим изобретением составляют такие соединения формулы (I), где анилиновый фрагмент содержит заместитель R2 в положении 5', и заместитель R1 в положении 4' и где указанный заместитель R1 представляет собой галоген, в частности фтор, и где указанный заместитель R2 выбран из группы, включающей галоген, С 1-4 алкилоксикарбонил-, Het12-карбонил-, гидроксикарбонил-, циано или Ar5, в частности,указанный R2 выбран из хлора, брома, метоксикарбонила, пирролидинокарбонила, морфолинокарбонила,гидроксикарбонила, циано или фенила. Соединения данного изобретения могут быть получены любым из нескольких стандартных способов синтеза, которые обычно используют специалисты в области органической химии, и которые описаны, например, в следующих ссылках: "Heterocyclic Compounds" Vol.24 (part4) p 261-304 Fused pyrimidines, Wiley-Interscienee; Chem. Pharm. Bull., vol 41 (2) 362-368 (1993); J. Chem. Soc, Perkin Trans. 1,2001,130-137. Кратко, для соединений формулы (I), где -X1- представляет собой -NH-, указанные соединения обычно получают по реакции 4-хлор-6-фторпиридопиримидинов или 4,6-дихлорпиридопиримидинов формулы (II) с соответствующим анилином (III), используя известные в данной области условия реакции, например, такие как применение основания, такого как триэтиламин, N-этил-N-(1-метилэтил)-2 пропанамин (DIPEA) и тому подобное, или неорганического основания, такого как Na2CO3, K2CO3 и тому подобное, в подходящем полярном растворителе, таком как пропан-2-ол, 1-бутанол, ацетонитрил и тому подобное, при повышенной температуре (60-90 С или температуре кипения с обратным холодильником). На следующей стадии полученные при этом анилинопиридопиримидины (IV) замещают соответствующим амином формулы (VII), получая промежуточное соединение формулы VIII. Вторую реакцию замещения проводят в известных условиях реакции, например, таких как перемешивание реагентов при повышенной температуре (70-100 С), необязательно, в подходящем растворителе, таком как пропан 2-ол, 1-бутанол или ДМСО в присутствии основания, например, такого как триэтиламин, N-этил-N-(1 метилэтил)-2-пропанамин (DIPEA) и тому подобное. В конечном итоге соединения в соответствии с настоящим изобретением получают после снятия защиты и замыкания кольца при использовании извест-8 013904 ных в данной области условий реакции. Замыкание кольца обычно осуществляют в присутствии агента сочетания, например, такого как 1,3-дициклогексилкарбодиимид (DCC), N,N'-карбонилдиимидазолP1 и Р 2, каждый независимо представляют собой необязательно защищенные функциональные группы, например, такие как первичный или вторичный амин, гидроксил, гидроксикарбонил или галоген(Cl, Br или I), которые в результате реакции дают вместе с заместителями Y1, соответственно, Y2, с которыми они связаны, двухвалентный радикал Y, который определен для приведенных выше соединений формулы (I). Определения X1, X2, R1, R2, R3 и R4 аналогичны приведенным выше для соединений формулы (I). Как приведено ниже в качестве примеров в экспериментальной части описания, группу соединений формулы (I), в которой -X1-представляет собой -O-, называемых далее соединениями формулы (I'),обычно получают по следующей схеме синтеза. Соединения данного изобретения можно получить сочетанием известного 4-хлор-6-хлорпиримидопиримидина (II) с подходящими замещенными анилинами(III), которые, в свою очередь, можно получить по схемам реакций 3-7, получая промежуточные соединения (IV). Замещение группы 6-хлор в известных в данной области условиях соответствующим алкоголятом, например, таким как бензилат, метилат, 2-тримитилсилилэтанол, приведет, после снятия защиты,соответственно, каталитического гидрирования, TMSCl, Na2S, TFA, к желаемому предшественнику Мицунобу формулы (VI) (схема 1). Затем в результате замыкания кольца в условиях Мицунобу получают желаемые соединения (I'). Схема 1V=водород или защитная группа, например, такая как метилкарбонильная, трет-бутильная, метильная, этильная, бензильная или триалкилсилильная группы, R представляет собой бензил или метил, и а 1 а 2=а 3-а 4, Y, X2, R1, R2, R3 и R4 аналогичны приведенным выше для соединений формулы (I). Соединения формулы (I'), где X2 представляет собой -O-, и а 1-а 2=а 3-а 4 представляет собой N-C=N-C,получают сочетанием известного 8-хлор-2-(метилтио)пиримидо[5,4-d]пиримидина (XXVII) с производными 2-аминофенола формулы (XXVIII), получая промежуточные соединения формулы (XXIX). Далее,-9 013904 после защиты фенола и окисления метилтио, пиримидопиримидин формулы (VIII) преобразовывают в промежуточное соединение формулы (IX) при использовании соответствующего алкоголята. Последующее снятие защиты, за которым следует замыкание кольца в условиях Мицунобу, будет приводить к требуемым соединениям формулы (I). Схема 2V=водород или защитная группа, например, такая как метилкарбонильная, трет-бутильная, метильная, этильная, бензильная или триалкилсилильная группы, и Y, X2, R1, R2, R3, и R4 аналогичны приведенным выше для соединений формулы (I). Альтернативно, соединения формулы (I'), где X2 представляет собой -O-, и а 1-а 2=а 3-а 4 представляет собой C-C=C-N, получают сочетанием известного 4-хлор-6-фторпиримидопиримидина (II) с производными 2-аминофенола формулы (XXVIII), получая промежуточные соединения формулы (VII). Далее,после защиты фенола, пиримидопиримидин формулы (VIII) преобразовывают в промежуточное соединение формулы (IX) при использовании соответствующего алкоголята. Последующее снятие защиты, за которым следует замыкание кольца в условиях Мицунобу, будет приводить к требуемым соединениям формулы (I). Схема 3V=водород или защитная группа, например, такая как метилкарбонил, трет-бутил, метильная,этильная, бензильная или триалкилсилильная группы, и Y, X2, R1, R2, R3 и R4 аналогичны приведенным выше для соединений формулы (I).- 10013904 Для соединений, где X2 представляет собой -O-, подходящие замещенные анилины формулы (IIIa),как правило, получают из коммерчески доступных нитрофенолов (X) и ,-защищенных галогензамещенных спиртов (XI) в щелочных условиях в нереакционноспособном растворителе, например, при использовании диметилацетамида (DMA) в присутствии K2CO3. Затем полученное нитрофенильное производное (XII) восстанавливают в стандартных условиях, например, при использовании железа/уксусной кислоты, получая замещенные анилины формулы (IIIa) (схема 4). Схема 4V представляет собой защитную группу, например, такую как метилкарбонильная. Для соединений, где X2 представляет собой -NR12- или -NR12-C1-2 алкил, подходящие замещенные анилины формулы (IIIb), как правило, получают из коммерчески доступных 2-нитробензальдегидов (XIII) и аминозамещенных спиртов (XIV) восстановительным аминированием в стандартных условиях, например, при использовании NaBH4 и изопропоксида титана(IV) в качестве восстанавливающих агентов в этаноле в качестве растворителя, получая на первой стадии нитробензиламины формулы (XV). Затем свободный первичный спирт защищают по известным в данной области методикам, например, при использовании реакции этерификации уксусным ангидридом в присутствии пиридина. Затем полученное в результате промежуточное соединение формулы (XVI) восстанавливают в стандартных условиях, например, при использовании железа/уксусной кислоты, получая замещенные анилины формулы (IIIb) (схема 5). Схема 5V представляет собой защитную группу, например, такую как метилкарбонильная, m=0 или 1, и n=1 или 2. Для соединений, где X2 представляет собой -O-N=CH-, подходящие замещенные анилины формулы(III ), как правило, получают по схеме реакции 5. На первой стадии известные 2-нитробензальдегиды(XIII) переводят в соответствующий оксим (XVII), например, при помощи известной в данной области реакции с гидроксиламином. Затем указанному оксиму формулы XVII дают прореагировать, например, с галогензамещенным алкилацетатом в щелочных условиях, например, при использовании K2CO3 в ДМСО или с более стойкой силильной защитной группой типа TBDMS или TBDPS и NaH в ТГФ в качестве условий реакции, с последующим восстановлением нитрогруппы, например, действием железа/уксусной кислоты, получая соответствующий замещенный анилин формулы (IIIc). Схема 6X представляет собой галоген, например, такой как Cl, Br и I. Для соединений, где X2 представляет собой непосредственную связь и Y представляет собой С 1-6- 11013904 алкил-NH-CO-, подходящие замещенные анилины формулы (IIId), как правило, получают по схеме реакции 7. На первой стадии известные 2-нитробензойные кислоты (XX) амидируют до промежуточных соединений формулы (XXII) в известных в данной области условиях, например, при использовании гидроксилированного амина формулы (XXI), который добавляют по каплям к смеси (XX) в CH2Cl2 в присутствии 1,1'-карбонилбис-1 Н-имидазола. Затем свободный первичный спирт защищают по известным в данной области методикам, например, при помощи этерификации уксусным ангидридом в присутствии пиридина. Затем полученное в результате промежуточное соединение формулы (XXIII) восстанавливают в стандартных условиях, например, при использовании железа/уксусной кислоты, получая замещенные анилины формулы (IIId). Схема 7V представляет собой защитную группу, например, такую как метилкарбонил. Для соединений, где X2 представляет собой непосредственную связь, подходящие замещенные анилины формулы (IIIе), как правило, получают по схеме реакции 8. На первой стадии известные 2-нитробензальдегиды (XIII) алкенилируют, получая промежуточные соединения формулы (XXV) в известных в данной области условиях, например, по реакции Виттига с соответствующей фосфониевой солью формулы (XXIV). После этерификации свободной карбоновой кислоты в стандартных условиях, например, при использовании этанола в кислых условиях, промежуточное соединение формулы (XXVI) восстанавливают,получая требуемые замещенные анилины формулы (IIIe). Схема 8Y1 представляет собой С 1-7 алкил. Как приведено ниже в качестве примеров в экспериментальной части описания, группу соединений формулы (I), где -X1-представляет собой -NR11- и а 1-а 2=а 3-а 4 представляет собой N-CH=N-CH, называемую далее соединениями формулы (I), как правило, получают по следующей схеме синтеза (схема 9). Указанные соединения можно получить сочетанием известного 8-хлор-2-(метилтио)пиримидо[5,4d]пиримидина с производными 2-аминофенола формулы (XXVIII), получая промежуточные соединения формулы (XXIX). Затем пиримидо[5,4-d]пиримидин формулы (XXIX) аминируют, используя аминирующий спирт(XXX), в известных в данной области условиях с последующим замыканием кольца в условиях Мицунобу, получая требуемые соединения формулы (I). Альтернативно, в случае соединений формулы (I), где -X1-представляет собой -NR11- и а 1-а 2=а 3-а 4 представляет собой N-СН=СН-СН, данные соединения получают сочетанием известных 4,6-дихлор(XXVII') с производными 2-аминофенола формулы (XXVIII), получая промежуточные соединения формулы (XXIX'). Затем пиридо[3,2-d]пиримидин формулы (XXIX') аминируют, используя аминирующий спирт(XXX), в известных в данной области условиях с последующим замыканием кольца в условиях Мицунобу, получая требуемые соединения формулы (I) (схема 10). Схема 10 При необходимости или желании можно осуществить одну или более следующих дополнительных стадий:(i) снятие любой оставшейся защитной группы(групп),(ii) превращение соединения формулы (I) или его защищенной формы в дополнительное соединение формулы (I) или его защищенную форму,(iii) превращение соединения формулы (I) или его защищенной формы в N-оксид, соль, четвертичный амин или сольват соединения формулы (I) или их защищенную форму,(iv) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в соединение формулы (I) или его защищенную форму,(v) превращение N-оксида, соли, четвертичного амина или сольвата соединения формулы (I) или его защищенной формы в другой N-оксид, фармацевтически приемлемую аддитивную соль, четвертичный амин или сольват соединения формулы (I) или его защищенную форму,(vi) в случае, когда соединение формулы (I) получают в виде смеси (R) и (S) энантиомеров, разделение данной смеси для получения требуемого энантиомера. Соединения формулы (I), их N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы можно перевести в другие соединения в соответствии с данным изобретением при помощи известных в данной области методик. Специалистам в данной области будет понятно, что в описанных выше способах для функциональных групп промежуточных соединений может потребоваться блокировка при помощи защитных групп. Функциональные группы, которые желательно защитить, включают гидрокси, амино и карбоновую кислоту. Подходящие защитные группы для гидроксила включают триалкилсилильные группы (например, трет-бутилдиметилсилильную, трет-бутилдифенилсилильную или триметилсилильную), бензильную и тетрагидропиранильную. Подходящие защитные группы для амино включают третбутоксикарбонильную или бензилоксикарбонильную. Подходящие защитные группы для карбоновой кислоты включают С(1-6)алкиловый или бензиловый эфиры.- 13013904 Защита или снятие защиты с функциональных групп можно проводить до или после стадии реакции. Кроме того, N-атомы в соединениях формулы (I) можно метилировать при помощи известных в данной области методов с использованием СН 3-I в подходящем растворителе, например, таком как 2 пропанон, тетрагидрофуран или диметилформамид. Соединения формулы (I) можно также превращать друг в друга по известным в данной области методикам преобразования функциональных групп, некоторые примеры которых упомянуты ниже. Соединения формулы (I) можно также переводить в формы соответствующих N-оксидов по известным в данной области методикам перевода трехвалентного атома азота в форму его N-оксида. Указанную реакцию N-окисления, как правило, можно осуществить взаимодействием исходного соединения формулы (I) с 3-фенил-2-(фенилсульфонил)оксазиридином или с соответствующим органическим или неорганическим пероксидом. Соответствующие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например пероксид натрия, пероксид калия; соответствующие органические пероксиды могут включать пероксикислоты, например,такие как надбензойная кислота или галогензамещенная надбензойная кислота, например, 3 хлорнадбензойная кислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например вода, низшие алкаиолы, например, этанол и тому подобное, углеводороды, например толуол, кетоны, например 2-бутанон, галогензамещенные углеводороды, например дихлорметан и смеси подобных растворителей. Стереохимически чистые изомерные формы соединений формулы (I) можно получить при помощи известных в данной области методов. Диастереомеры можно разделить физическими методами, такими как дробная кристаллизация, и хроматографическими методами, например противоточным распределением, жидкостной хроматографией и т.д. Некоторые соединения формулы (I) и некоторые промежуточные соединения настоящего изобретения могут содержать асимметрический атом углерода. Стереохимически чистые изомерные формы указанных соединений и указанных промежуточных соединений можно получить при применении известных в данной области методов. Например, диастереомеры можно разделить физическими методами, такими как дробная кристаллизация, и хроматографическими методами, например противоточным распределением, жидкостной хроматографией и подобными методами. Энантиомеры можно выделить из рацемических смесей, переводя сначала указанные рацемические смеси в смеси диастереомерных солей или соединений при помощи подходящих разделяющих агентов, например, таких как хиральные кислоты,затем физически разделяя указанные смеси диастереомерных солей или соединений, например, дробной кристаллизацией или хроматографическими методами, например противоточным распределением, жидкостной хроматографией и подобными методами, и, наконец, переводя указанные разделенные диастереомерные соли или соединения в соответствующие энантиомеры. Стереохимически чистые изомерные формы можно также получить из чистых стереохимически изомерных форм соответствующих промежуточных соединений и исходных веществ при условии, что промежуточные реакции протекают стереоспецифично. Альтернативный метод разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию, в частности жидкостную хроматографию с использованием хиральной неподвижной фазы. Некоторые промежуточные соединения и исходные соединения, используемые в приведенных выше методиках реакции, являются описанными соединениями и могут быть коммерчески доступны или их можно получить по известным в данной области методикам. Однако при синтезе соединений формулы(I) в настоящем изобретении предлагаются промежуточные соединения формулы (III) их фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеV представляет собой водород или защитную группу, предпочтительно выбранную из группы,включающей метилкарбонил, трет-бутил, метил, этил, бензил или триалкилсилил,Y представляет собой -С 3-9 алкил-, -С 3-9 алкенил-, -С 1-5 алкилокси-С 1-5 алкил, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил-, -С 1-5 алкил-СО-NR15-С 1-5 алкил, -С 1-6 алкил-CO-NH-, -С 1-6 алкил-NHCO-, -С 1-7 алкил-CO-, -С 1-6 алкил-СО-С 1-6 алкил-,X2 представляет собой непосредственную связь, -O-, -O-С 1-2 алкил-, СО, -CO-С 1-2 алкил-, NR12, -NR12 С 1-2 алкил-, -СН 2-, -O-N=CH- или C1-2 алкил,R1 представляет собой водород, циано, галоген, гидрокси, формил, C1-6 алкилокси-, C1-6 алкил-, С 1-6 алкилокси-, замещенную галогеном, С 1-6 алкил-, замещенный гидрокси или галогеном, иR2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, Het16-карбонил-, С 1-4 алкилоксикарбонил-,- 14013904 С 1-4 алкилкарбонил-, аминокарбонил-, моно- или ди(С 1-4 алкил)аминокарбонил-, Het1, формил, С 1-4 алкил-, С 2-6 алкинил-, С 3-6 циклоалкил-, С 3-6 циклоалкилокси-, С 1-6 алкилокси-, Ar5, Ar1-окси, дигидроксиборан, С 1-6 алкилокси-, замещенный галогеном,С 1-4 алкил-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из галогена, гидрокси или NR5R6,С 1-4 алкилкарбонил-, где указанный С 1-4 алкил необязательно замещен одним или, где возможно,двумя или более заместителями, выбранными из гидрокси или С 1-4 алкилокси-,R5 и R6, каждый независимо выбран из водорода или С 1-4 алкила,R12 представляет собой водород, С 1-4 алкил, С 1-4 алкилоксикарбонил, Het17, Het18-Cl-4 алкил-, С 2-4 алкенилкарбонил-, необязательно замещенный Het19-С 1-4 алкиламинокарбонилом-, С 2-4 алкенилсульфонил-, С 1-4 алкилокси-С 1-4 алкил- или фенил, необязательно замещенный одним или, где возможно, двумя или более заместителями, выбранными из водорода, гидрокси, амино или С 1-4 алкилокси-,R13 представляет собой водород, С 1-4 алкил-, Het13, Het14-С 1-4 алкил- или фенил, необязательно замещенный одним или, где возможно, двумя или более заместителями, выбранными из водорода, гидрокси,амино или С 1-4 алкилокси-,R14 и R15, каждый независимо выбраны из водорода, С 1-4 алкила, Het15-С 1-4 алкила- или С 1-4 алкилоксиС 1-4 алкила,Het1 представляет собой гетероцикл, выбранный из пиперидинила, морфолинила, пиперазинила,фуранила, пиразолила, диоксоланила, тиазолила, оксазолила, имидазолила, изоксазолила, оксадиазолила,пиридинила или пирролидинила, где указанный Het1 необязательно замещен амино, С 1-4 алкилом, гидрокси-С 1-4 алкилом-, фенилом, фенил-С 1-4 алкилом-, С 1-4 алкилокси-С 1-4 алкилом, моно- или ди(С 1-4 алкил)амино- или аминокарбонилом-,Het13 представляет собой гетероцикл, выбранный из пирролидинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила,Het14 представляет собой гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила,Het15 представляет собой гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила,Het16 представляет собой гетероцикл, выбранный из морфолинила, пирролидинила, пиперазинила,1,3,2-диоксаборолана или пиперидинила, где указанный гетероцикл необязательно замещен одним или,где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, иHet17 представляет собой гетероцикл, выбранный из пирролидинила или пиперидинила, где указанный гетероцикл необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила, гидрокси-С 1-4 алкила-, С 1-4 алкилокси-С 1-4 алкила или полигидрокси-С 1-4 алкила,Het18 и Het19, каждый независимо представляет собой гетероцикл, выбранный из морфолинила,пирролидинила, пиперазинила или пиперидинила, где указанные Het18 и Het19 необязательно замещены одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкила, С 3-6 циклоалкила,гидрокси-С 1-4 алкила-, С 1-4 алкилоксиС 1-4 алкила или полигидрокси-С 1-4 алкила,Ar1, Ar2, Ar3, Ar4 и Ar5, каждый независимо представляют собой фенил, необязательно замещенный циано, С 1-4 алкилсульфонил-, С 1-4 алкилсульфониламино-, аминосульфониламино-, гидрокси-С 1-4 алкилом,аминосульфонилом-, гидрокси-, С 1-4 алкилокси- или С 1-4 алкилом. В частности, промежуточные соединения формулы (III), для которых выполняется одно или более из следующих ограничений:i) Y представляет собой -С 3-9 алкил-, -С 1-5 алкилокси-С 1-5 алкил, -С 1-5 алкил-NR13-С 1-5 алкил-, -C1-6 алкил-NH-СО-,ii) X2 представляет собой непосредственную связь, О, -O-С 1-2 алкил-, NR12, -NR12-С 1-2 алкил-, -СН 2-,-O-N=CH- или С 1-2 алкил,iii) R1 представляет собой водород, циано, галоген или гидрокси, предпочтительно галоген,iv) R2 представляет собой водород, циано, галоген, гидрокси, гидроксикарбонил-, С 1-4 алкилоксикарбонил-, Hetl6-карбонил-, С 1-4 алкил-, С 2-6 алкинил-, Ar5 или Het1; в дополнительном варианте осуществления R2 представляет собой водород, циано, галоген, гидрокси или Ar5,v) R12 представляет собой водород, С 1-4 алкил или С 1-4 алкилоксикарбонил,vi) R13 представляет собой Het14-С 1-4 алкил-, в частности, морфолинил-С 1-4 алкил-,vii) Het1 представляет собой тиазолил, необязательно замещенный амино, С 1-4 алкилом, гидрокси-С 1-4 алкилом-, фенилом, фенил-С 1-4 алкилом-, С 1-4 алкилокси-С 1-4 алкилом, моно- или ди(С 1-4 алкил)амино- или ами- 15013904 нокарбонилом,viii) Het16 представляет собой гетероцикл, выбранный из пиперидинила или пирролидинила. Кроме того, целью настоящего изобретения является предоставление применения промежуточного соединения формулы (III) в синтезе макроциклического ингибитора киназы, например, такого как соединение формулы (I). Соединения формулы (I) и промежуточные соединения формулы (XXXI) настоящего изобретения полезны, поскольку они обладают фармакологическими свойствами. Следовательно, они могут быть использованы в качестве лекарственных средств. Соответственно, в следующем аспекте данное изобретение относится к промежуточным соединениям формулы (XXXI) формам их N-оксидов, фармацевтически приемлемым аддитивным солям и стереохимически изомерным формам, где а 1-а 2=а 3-а 4 представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH или N-CH=NCH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-6 алкил-NH-СО- или -CO-NH-C1-6 алкил-,R1 представляет собой водород или галоген,R2 представляет собой водород, циано, галоген, гидроксикарбонил, С 1-4 алкилоксикарбонил-, Het16 карбонил или Ar5,R4 представляет собой гидрокси, С 1-4 алкилокси-, Ar4-С 1-4 алкилокси- или R4 представляет собой С 1-4 алкилокси-, замещенный одним или, где возможно, двумя или более заместителями, выбранными из С 1-4 алкилокси- или Het2-,R11 представляет собой водород,R13 представляет собой Het14-С 1-4 алкил-, в частности, морфолинил-С 1-4 алкил-,Het2 представляет собой гетероцикл, выбранный из морфолинила, пиперазинила, пиперидинила или пирролидинила, где указанный Het2 необязательно замещен одним или, где возможно, двумя или более заместителями, выбранными из гидрокси, амино или С 1-4 алкила-; в следующем варианте осуществленияHet2 представляет собой гетероцикл, выбранный из морфолинила или пиперидинила, необязательно замещенных С 1-4 алкилом-, предпочтительно метилом,Het14 представляет собой морфолинил,Het16 представляет собой гетероцикл, выбранный из морфолинила или пирролидинила,Ar4 представляет собой фенил,Ar5 представляет собой фенил, необязательно замещенный циано, а также применение промежуточного соединения формулы (XXXI) при синтезе макроциклического ингибитора киназы, например,такого как соединения формулы (I). Как описано ниже в экспериментальной части, эффект ингибирования роста и противоопухолевая активность настоящих соединений и некоторых промежуточных соединений была показана in vitro при помощи ферментных анализов на рецепторной тирозинкиназе EGFR. В альтернативном анализе эффект ингибирования роста соединениями испытывали на клеточной линии карциномы яичников SKOV3 при помощи известных в данной области анализов на цитотоксичность, таких как LIVE/DEAD (MolecularProbes) или МТТ. Соответственно, в настоящем изобретении предлагаются соединения формулы (I) и промежуточные соединения формулы (XXXI) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы для применения в терапии. Более конкретно, для лечения или предупреждения заболеваний, опосредуемых пролиферацией клеток. Соединения формулы(I), промежуточные соединения формулы (XXXI) и их фармацевтически приемлемые N-оксиды, аддитивные соли, четвертичные амины и стереохимически изомерные формы можно в дальнейшем называть соединениями в соответствии с изобретением. Нарушения, при которых соединения в соответствии с изобретением особенно полезны, представляют собой атеросклероз, рестеноз, рак и осложнения при диабете, например ретинопатию. В свете применимости соединений в соответствии с изобретением предоставлен способ лечения нарушения, связанного с пролиферацией клеток, такого как атеросклероз, рестеноз и рак, при этом данный способ включает введение животному, нуждающемуся в подобном лечении, например млекопитающему,включая человека, страдающему заболеванием, связанным с пролиферацией клеток, терапевтически эффективного количества соединения в соответствии с настоящим изобретением. Указанный способ включает системное или местное введение эффективного количества соединения- 16013904 в соответствии с настоящим изобретением животному, включая человека. Специалисту в данной области будет понятно, что терапевтически эффективное количество ингибиторов EGFR настоящего изобретения представляет собой количество, достаточное для того, чтобы вызвать эффект ингибирования роста, и что данное количество изменяется, помимо прочего, в зависимости от размера, типа неоплазии, концентрации соединения в терапевтическом препарате и состояния пациента. Как правило, количество ингибитора EGFR, подлежащего введению в качестве терапевтического агента для лечения нарушения пролиферации клеток, такого как атеросклероз, рестеноз и рак, будет определяться от случаю к случаю лечащим врачом. Как правило, подходящей дозой является доза, которая приводит к концентрации ингибитора EGFR на участке лечения в интервале от 0,5 нМ до 200 мкМ и обычно от 5 до 10 мкМ. Для достижения данных лечебных концентраций пациенту, нуждающемуся в лечении, вероятно, будут вводить от 0,01 до 300 мг/кг массы тела, в частности от 10 до 100 мг/кг массы тела. Как указывалось выше, приведенные выше количества могут изменяться в зависимости от конкретного случая. В данных способах лечения из соединений в соответствии с изобретением предпочтительно готовят лекарственные препараты до введения. Как описано ниже, подходящие фармацевтические препараты изготавливают по известным методикам с использованием хорошо известных и легкодоступных ингредиентов. Благодаря высокой степени селективности в качестве ингибиторов EGFR, соединения формулы (I) и промежуточные соединения формулы (XXXI), определенные выше, также полезны при мечении или идентификации домена киназы в тирозинкиназных рецепторах. С этой целью в соединения настоящего изобретения можно ввести метку, в частности, заменяя, частично или полностью, один или более атомов в молекуле на их радиоактивные изотопы. Примерами представляющих интерес меченых соединений являются соединения, которые содержат по меньшей мере один атом галогена, являющийся радиоактивным изотопом йода, брома или фтора, или такие соединения, которые содержат по меньшей мере один атом 11 С или атом трития. Одну из особых групп составляют такие соединения формулы (I) и промежуточные соединения формулы (XXXI), где R1 является радиоактивным атомом галогена. В принципе, любое соединение в соответствии с изобретением, содержащее атом галогена, предрасположено к радиоактивному мечению путем замены атома галогена подходящим изотопом. Подходящими радиоизотопами галогена для этой цели являются радиоактивные атомы йода, например 122I, 123I, 125I, 131I, радиоактивные атомы брома, например 75Br, 76Br, 77Br и 82Br и радиоактивные атомы фтора, например 18F. Введение радиоактивного атома галогена можно осуществить при помощи подходящей реакции замещения или при использовании любой описанной выше методики получения галогенсодержащего производного формулы (I). Другой интересной формой введения радиоактивной метки является замена атома углерода атомом 11 С или замена атома водорода атомом трития. Следовательно, указанные меченные радиоактивными изотопами соединения в соответствии с настоящим изобретением можно использовать в способе специфичной маркировки сайтов рецепторов в биологическом материале. Указанный способ включает стадии (а) введения в соединение в соответствии с изобретением радиоактивной метки, (b) введения данного меченого соединения в биологический материал и затем (с) определения эмиссии от данного меченого соединения. Подразумевается, что термин биологический материал включает любой вид материала, имеющего биологическую природу. Более конкретно, данный термин относится к образцам тканей, плазме или жидкостям организма, но также к животным, особенно к теплокровным животным, или частям животных, таким как органы. При использовании в анализах in vivo, меченные радиоактивным изотопом соединения вводят животному в виде соответствующей композиции и определяют местоположение указанных радиоактивных соединений при помощи методов отображения, например, таких как компьютеризированная томография однопротонной эмиссии (SPECT) или томография позитронной эмиссии (PET) и подобные. При этом можно определить распределение сайтов конкретного рецептора внутри организма, и органы, содержащие сайты указанного рецептора, можно визуализировать при помощи приведенных выше методик отображения. Способ отображения органа при помощи введения меченного радиоактивным изотопом соединения формулы (I) и определения эмиссии от этого радиоактивного соединения также составляет часть настоящего изобретения. В еще одном аспекте настоящее изобретение предлагает применение соединений в соответствии с изобретением для получения лекарственного средства для лечения любого из указанных выше нарушений или показаний, связанных с пролиферацией клеток. Количество соединения в соответствии с настоящим изобретением, называемого в данном описании активным ингредиентом, необходимое для достижения терапевтического эффекта, несомненно будет изменяться в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента, и конкретного нарушения или заболевания, подлежащего лечению. Подходящая дневная доза может составлять от 0,01 до 300 мг/кг массы тела, в частности от 10 до 100 мг/кг массы тела. Способ лечения может также включать введение активного ингредиента в режиме от одного до четырех приемов за день. Несмотря на то, что активный ингредиент можно вводить сам по себе, предпочтительно предоста- 17013904 вить его в виде фармацевтической композиции. Соответственно, в настоящем изобретении предлагается также фармацевтическая композиция, содержащая соединение в соответствии с настоящим изобретением, наряду с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должны быть приемлемыми в смысле совместимости с прочими ингредиентами данной композиции и не причинять вреда их реципиенту. Фармацевтические композиции данного изобретения можно получить любым способом, хорошо известным в области фармацевтики, например при помощи таких способов, которые описаны у Gennaroet al. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см. в особенности Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически активное количество конкретного соединения в форме основания или аддитивные соли в качестве активного ингредиента соединяют путем тщательного смешивания с фармацевтически приемлемым носителем, который может принимать самые разнообразные формы в зависимости от формы препарата, желаемого для введения. Желательно, чтобы данные фармацевтические композиции имели вид единичных дозированных форм, предпочтительно для системного введения, такого как пероральное, подкожное или парентеральное введение, или местного введения, такого как путем ингаляции, назального спрея, глазных капель или при помощи крема, геля, шампуня и подобные. Например, при получении композиций в виде пероральной дозированной формы можно использовать любую из обычных фармацевтических сред, например, такую как вода, гликоли, масла, спирты и подобные в случае пероральных жидких композиций, таких как суспензии, сиропы, эликсиры и растворы или твердые носители,такие как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, разрыхляющие агенты и подобные в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения таблетки и капсулы представляют собой наиболее предпочтительную пероральную разовую дозированную форму, в случае которой, очевидно, используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, большей частью, хотя может содержать другие ингредиенты, например, для повышения растворимости. Например, можно приготовить растворы для инъекций, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Кроме того, можно приготовить растворы для инъекций, в которых могут быть использованы соответствующие жидкие носители, суспендирующие агенты и подобные. В случае композиций, подходящих для подкожного введения, носитель необязательно содержит агент, повышающий проникновение, и/или подходящий смачивающий агент, необязательно соединенный с подходящими добавками любой природы в незначительных пропорциях, при этом данные добавки не оказывают какого-либо значительного вредного влияния на кожу. Указанные добавки могут облегчать нанесение на кожу и/или могут оказаться полезными для приготовления желаемых композиций. Данные композиции можно вводить различными способами, например в виде трансдермального пластыря, в виде наносимого пятна или в виде мази. Особенно предпочтительно изготавливать препараты из указанных выше фармацевтических композиций в виде разовых дозированных форм для простоты введения и равномерности дозировки. Указанная в данном описании и формуле изобретения разовая дозированная форма относится к физически дискретным единицам, подходящим в качестве разовых доз, при этом каждая единица содержит заранее определенное количество активного ингредиента, рассчитанного таким образом, чтобы получить желаемый терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Примерами подобных разовых дозированных форм являются таблетки (включая таблетки с насечкой или с покрытием),капсулы, порошки в пакетиках, пастилки, растворы для инъекций или суспензии, чайные ложки лекарственного средства, столовые ложки лекарственного средства и подобные, и их отдельные множества. Экспериментальная часть Здесь и далее термин ADDP означает 1,1'-(азодикарбонил)биспиперидин, ДМФА означает N,Nдиметилформамид, ТГФ означает тетрагидрофуран, ДМСО означает диметилсульфоксид. А. Получение промежуточных соединений Пример 1 А.a) Получение 4-хлор-2-[(6-хлорпиридо[3,2-d]пиримидин-4-ил)амино]фенола (промежуточное соединение 1) Смесь 4,6-дихлорпиридо[3,2-d]пиримидина (0,00255 моль) и 4-хлор-2-аминофенола (0,00446 моль) в изопропаноле (30 мл) перемешивали при 50 С в течение 2 ч 30 мин, затем доводили до комнатной температуры и упаривали досуха. Остаток растворяли в эфире, фильтровали и сушили, получая 1 г (100%) промежуточного соединения 1.(промежуточное соединение 2) Смесь промежуточного соединения 1 (0,00255 моль) и 6-амино-1-гексанола (0,0255 моль) перемешивали при 100 С в течение 3 ч, затем доводили до комнатной температуры. Остаток очищали хроматографией на силикагеле (элюент: DCM/MeOH/NH4OH 97/3/0,1; 70-200 мкм), получая 0,71 г (72%) промежуточного соединения 2, температура плавления 260 С.- 18013904 Пример А 2. Получение 4-хлор-2-6-[(4-гидроксибутил)амино]пиридо[3,2-d]пиримидин-4 ил]амино]фенола (промежуточное соединение 3) Смесь промежуточного соединения 1 (0,0013 моль) и 4-амино-1-бутанола (0,026 моль) перемешивали при 100 С в течение 4 ч, затем доводили до комнатной температуры и гидролизовали насыщенным раствором хлорида натрия. Смесь экстрагировали DCM, декантировали, сушили над MgSO4, фильтровали и выпаривали растворитель досуха. Остаток (0,5 г) очищали колоночной хроматографией на силикагеле (элюент: DCM/MeOH/NH4OH 95/5/0,1; 70-200 мкм). Остаток (81 мг, 17%) кристаллизовали из ацетонитрила и диэтилового эфира. Осадок фильтровали и сушили, получая 69 мг (15%) промежуточного соединения 3, температура плавления 227 С. Пример A3. Получение 4-хлор-2-6-[(5-гидроксипентил)амино]пиридо[3,2-d]пиримидин-4 ил]амино]фенола (промежуточное соединение 4) Смесь промежуточного соединения 1 (0,0013 моль) и 5-амино-1-пентанола (0,0195 моль) перемешивали при 100 С в течение 4 ч, затем доводили до комнатной температуры и гидролизовали насыщенным раствором хлорида натрия. Смесь экстрагировали DCM, декантировали, сушили над MgSO4, фильтровали и выпаривали растворитель досуха. Остаток (0,45 г) очищали колоночной хроматографией на силикагеле (элюент: DCM/MeOH/NH4OH 95/5/0,1; 70-200 мкм). Остаток (66 мг, 14%) кристаллизовали из ацетонитрила и диэтилового эфира. Осадок фильтровали и сушили, получая 59 мг (12%) промежуточного соединения 4, температура плавления 240 С. Пример А 4.(0,0094 моль) в диоксане (5 мл) перемешивали при 80 С в течение 1 ч, затем охлаждали до комнатной температуры, осадок отфильтровывали, промывали водой, затем диэтиловым эфиром и сушили в вакууме, получая 1,2 г (80%) промежуточного соединения 5.b) Получение 4-хлор-2-6-[(6-гидроксигексил)амино]пиримидо[5,4-d]пиримидин-4-ил]амино]фенола (промежуточное соединение 6) Смесь промежуточного соединения 1 3,00172 моль) в 6-амино-1-гексаноле (0,0022 моль) расплавляли при 100 С в течение 8 ч. Остаток очищали колоночной хроматографией на силикагеле (элюент:(0,179 моль) добавляли ДМФА (3 капли). Реакционную смесь перемешивали и кипятили (при 80 С) в течение 90 мин. Растворитель выпаривали. Добавляли немного дихлорметана и выпаривали растворитель. Остаток растворяли в дихлорметане. Органический раствор промывали насыщенным водным раствором K2CO3, затем сушили (MgSO4), фильтровали и выпаривали растворитель, получая 0,49 мг (89%) промежуточного соединения (7) (ВЭЖХ: 85% ч).b) Получение этилового эфира 4-[2-(6-хлорпиридо[3,2-d]пиримидин-4-иламино)фенокси]масляной кислоты (промежуточное соединение 8) Промежуточное соединение (7) (0,00245 моль) растворяли в 2-пропаноле (20 мл) (не очень растворимо). Добавляли этиловый эфир 4-(2-аминофенокси)масляной кислоты (0,00416 моль), с последующим добавлением N,N-диэтилтанамина (0,00490 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и выпаривали растворитель. Остаток растворяли в диэтиловом эфире. Осадок отфильтровывали и сушили (насос), получая 1,48 г фракции (1) (зеленоватое твердое вещество, 92% ч по ВЭЖХ-МС, присутствует некоторое количество исходного соединения В). Данную фракцию (1) очищали, как описано ниже. Реакцию повторяли. Промежуточное соединение (7) (0,0055 моль) растворяли в 2-пропаноле (40 мл) (не очень растворимо). Добавляли этиловый эфир 4-(2-аминофенокси)масляной кислоты (0,00935 моль), с последующим добавлением N,N-диэтилэтанамина (0,0110 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и выпаривали растворитель. Остаток объединяли с фракцией (1) и подвергали колоночной флэшхроматографии на силикагеле (элюент: н-гексан/EtOAc 3/1). Фракции продукта собирали и выпаривали растворитель, получая 3,04 г промежуточного соединения (8) (зеленоватое твердое вещество с количественным выходом, используемое на следующей стадии реакции без дополнительной очистки). с) Получение этилового эфира 4-2-[6-(3-трет-бутоксикарбониламинопропиламино)пиридо[3,2d]пиримидин-4-иламино]феноксимасляной кислоты (промежуточное соединение 9) Промежуточное соединение (8) (0,00026 моль) и 1,1-диметилэтиловый эфир (3 аминопропил)карбаминовой кислоты (0,00288 моль) смешивали в течение 3 ч при 100 С в закрытом реакторе, получая фракцию (1) (57% ч по ВЭЖХ+35% амида).- 19013904 Фракцию (1) очищали, как описано ниже. Реакцию повторяли. Промежуточное соединение (8) (0,00026 моль) и 1,1-диметилэтиловый эфир (3 аминопропил)карбаминовой кислоты (0,00288 моль) перемешивали в течение 2,5 ч при 100 С в открытой реакционной колбе (не в закрытом реакторе, как описано выше). Смесь объединяли с фракцией (1). Очищали колоночной флэш-хроматографией на силикагеле (элюент: н-гексан/EtOAc 3/1). Фракции продукта собирали и выпаривали растворитель, получая промежуточное соединение (9) (ВЭЖХ: 92% ч).d) Получение этилового эфира 4-2-[6-(3-аминопропиламино)пиридо[3,2-d]пиримидин-4 иламино]феноксимасляной кислоты, трифторацетата (промежуточное соединение 10) Промежуточное соединение (9) (0,00019 моль) растворяли в дихлорметане (4,00 мл). Добавляли трифторуксусную кислоту (0,05192 моль) и перемешивали реакционную смесь в течение 2 ч при комнатной температуре. Растворитель и оставшуюся кислоту выпаривали на роторном испарителе. Полученный остаток (масло) сушили (высоковакуумный насос), получая промежуточное соединение (10) (ВЭЖХ: 93% ч; количественный выход; использовали на следующей стадии реакции без дополнительной очистки). е) Получение 4-2-[6-(3-аминопропиламино)пиридо[3,2-d]пиримидин-4-иламино]феноксимасляной кислоты (промежуточное соединение 11) Промежуточное соединение (10) (0,00019 моль, 1 экв.) растворяли в тетрагидрофуране (8,00 мл). Добавляли воду (1,00 мл). Добавляли моногидрат гидроксида лития (0,0019 моль) в виде твердого вещества. Добавляли еще моногидрат гидроксида лития до достижения щелочного рН (до этих пор он был кислым из-за остатков CF3COOH). Реакционную смесь перемешивали в течение 2 дней при 65 С. Растворитель выпаривали на роторном испарителе, получая промежуточное соединение (11) (ВЭЖХ: 78% ч; количественный выход; использовали на следующей стадии реакции без дополнительной очистки). Пример А 6.a) Получение 4-хлор-6-фторпиридо[3,4-d]пиримидина (промежуточное соединение 12) К смеси 6-фтор-3 Н-пиридо[3,4-d]пиримидин-4-она (0,00605 моль) и тионилхлорида (0,39 моль) добавляли ДМФА (3 капли). Реакционную смесь перемешивали и кипятили (при 80 С) в течение 7 дней. Растворитель выпаривали, получая 1,254 г промежуточного соединения (12) (количественный выход неочищенного продукта; использовали на следующей стадии реакции без дополнительной очистки).b) Получение этилового эфира 4-[2-(6-фторпиридо[3,4-d]пиримидин-4-иламино]фенокси]масляной кислоты (промежуточное соединение 13) Промежуточное соединение (12) (0,00605 моль) растворяли в 2-пропаноле (40 мл). Добавляли гидрохлорид этилового эфира 4-(2-аминофенокси)масляной кислоты [112290-16-1] (0,01028 моль), затем добавляли N,N-диэтилэнатамин (0,01210 моль). Реакционную смесь перемешивали и кипятили в течение ночи. Затем реакционную смесь охлаждали до комнатной температуры и выпаривали растворитель. Остаток очищали колоночной флэш-хроматографией на силикагеле (элюент: н-гексан/EtOAc 3/1). Фракции продукта собирали и выпаривали растворитель, получая 0,922 г промежуточного соединения (13) (выход 41% по двум стадиям; желтоватое твердое вещество; 97% ч по ВЭЖХ). с) Получение этилового эфира 4-2-[6-(3-трет-бутоксикарбониламинопропиламино)пиридо[3,4d]пиримидин-4-иламино]феноксимасляной кислоты (промежуточное соединение 14) Промежуточное соединение (13) (0,00027 моль) растворяли в ДМСО (по потребности) в реакторе. Добавляли 1,1-диметилэтиловый эфир (3-аминопропил)карбаминовой кислоты [75178-96-0] (0,07 мл),затем N-этил-N-(1-метилэтил)-2-пропанамин [7087-68-5] (0,10 мл). Реактор закрывали и нагревали реакционную смесь в течение 7 дней при 80 С. Реакционную смесь выливали в воду и трижды экстрагировали продукт дихлорметаном. Объединенные органические слои сушили (MgSO4), фильтровали и выпаривали растворитель, получая фракцию 1 промежуточного соединения (14). Две другие фракции промежуточного соединения 14 получали следующим образом. Промежуточное соединение (13) (0,00027 моль) и 1,1-диметилэтиловый эфир (3 аминопропил)карбаминовой кислоты [75178-96-0] (0,00299 моль) смешивали в (закрытом) реакторе и нагревали при 100 С в течение 3 ч, получая фракцию 2 промежуточного соединения (14). Промежуточное соединение (13) (0,00008 моль) и 1,1-диметилэтиловый эфир (3 аминопропил)карбаминовой кислоты [75178-96-0] (0,0009 моль) смешивали в открытой реакционной колбе и нагревали при 80 С в течение 3 дней, получая фракцию 3 промежуточного соединения (14). Фракции 1, 2 и 3 промежуточного соединения 14 объединяли и очищали колоночной флэшхроматографией на силикагеле. Промежуточное соединение 14 также получали следующим образом. Промежуточное соединение (13) (0,00027 моль) растворяли в ДМФА (3 мл). Добавляли 1,1 диметилэтиловый эфир (3-аминопропил)карбаминовой кислоты [75178-96-0] (0,00040 моль) и карбонат цезия (0,00135 моль) и перемешивали реакционную смесь в течение 4 ч при 100 С, затем в течение ночи при 115 С. Избыток карбоната цезия удаляли фильтрованием. Фильтрат упаривали, получая промежуточное соединение (14).d) Получение этилового эфира 4-2-[6-(3-аминопропиламино)пиридо[3,4-d]пиримидин-4 иламино]феноксимасляной кислоты (промежуточное соединение 15)- 20013904 Промежуточное соединение (14) (0,00055 моль) растворяли в дихлорметане (11,00 мл). Добавляли трифторуксусную кислоту (0,143 моль) и перемешивали реакционную смесь в течение 2 ч при комнатной температуре. Растворитель и оставшуюся кислоту выпаривали на роторном испарителе. Полученный остаток (масло) сушили (высоковакуумный насос), получая промежуточное соединение (15) (ВЭЖХ: 91% ч; количественный выход; использовали на следующей стадии реакции без дополнительной очистки).e) Получение 4-2-[6-(3-аминопропиламино)пиридо[3,4-d]пиримидин-4-иламино]феноксимасляной кислоты (промежуточное соединение 16) Промежуточное соединение (15) (0,00055 моль) растворяли в тетрагидрофуране (16,00 мл). Добавляли воду (2,00 мл). Добавляли моногидрат гидроксида лития (0,0055 моль) в виде твердого вещества. Добавляли еще моногидрат гидроксида лития до достижения щелочного рН (до этого он был кислым изза остатков CF3COOH). Реакционную смесь перемешивали в течение ночи при 65 С. Растворитель выпаривали на роторном испарителе, получая промежуточное соединение (16) (ВЭЖХ: 78% ч; количественный выход; использовали на следующей стадии реакции без дополнительной очистки). Пример А 7. а) Получение аллил(4-хлор-5-фтор-2-нитробензил)метиламина (промежуточное соединение 17) К раствору 4-хлор-5-фтор-2-нитробензальдегида (1 экв.) в 1,2-дихлорэтане (207 мл) добавляли Nметил-2-пропен-1-амин (1,1 экв.), затем добавляли MgSO4 (2 ложки) и перемешивали полученный раствор в течение 2 ч при комнатной температуре. Добавляли NaBH(ОАс)з (3 экв.) в виде 5 порций (одна порция в час) и промывали реакционную смесь K2CO3. После экстракции CH2Cl2 слои разделяли. Органический слой сушили над MgSO4, фильтровали и упаривали, получая промежуточное соединение 17.b) Получение 2-[(аллилметиламино)метил]-5-хлор-4-фторфенил]амина (промежуточное соединение 18) Раствор нитропроизводного промежуточного соединения (17) (1 экв.) в растворе Н 2 О (120 мл) иNH4Cl (5 экв.) при комнатной температуре растворяли в толуоле (120 мл), затем медленно добавляли порошок железа (5 экв.) и реакционную смесь перемешивали и кипятили с обратным холодильником при 105 С. Полученное неочищенное вещество очищали флэш-хроматографией. Фракции требуемого продукта собирали и выпаривали растворитель, получая 4,8 г промежуточного соединения (18).c) Получение 2-[(аллилметиламино)метил]-5-хлор-4-фторфенил-(6-хлорпиридо[3,2-d]пиримидин 4-ил)амина (промежуточное соединение 19) К раствору 4,6-дихлорпиридо[3,2-d]пиримидина (1 экв.) в ацетонитриле (сушили над Al2O3) (9 мл) добавляли триэтиламин (3 экв.). Выделялся HCl, и реакционную смесь продували N2 в течение от 10 до 15 мин. Добавляли промежуточное соединение (18) (1,7 экв.), затем реакционную смесь перемешивали и кипятили в течение 5 ч. После охлаждения до комнатной температуры из смеси выпадал светло-желтый осадок. Продукт собирали и сушили в высоком вакууме, получая желаемый продукт. К маточному слою добавляли EtOAc, и затем выпадало белое твердое вещество. После фильтрования фильтрат концентрировали и полученный концентрат очищали флэш-хроматографией на силикагеле (элюент: гексан/EtOAc 9/1). Требуемые фракции собирали и выпаривали растворитель, получая желаемый продукт. Собирали обе фракции требуемого продукта, получая 0,750 г промежуточного соединения (19).N6-аллил-N4-2-[(аллилметиламино)метил]-5-хлор-4-фторфенилпиридо[3,2d]пиримидин-4,6-диамина (промежуточное соединение 20) Раствор промежуточного соединения (19) (1 экв.) в 2-пропениламине (9,8 экв.) нагревали в течение ночи в запаянной трубке при 100 С, затем полученный раствор концентрировали и сушили в высоком вакууме, получая 0,487 г (115%) полутвердого вещества, которое повторно растворяли в CH2Cl2. Затем раствор фильтровали и фильтрат снова концентрировали, получая 0,412 г (100%) промежуточного соединения (20). е) Получение 9(Е)-16-хлор-15-фтор-7,8,11,12,13,18-гексагидро-12-метил-4,6-этандиилиденпиримидо[4,5-b][1,4,6,11]бензотетразациклотетрадецина (промежуточное соединение 21) Смесь промежуточного соединения (20) и катализатора Граббса второго поколения (0,2 экв.) вCH2Cl2 (7 мл) перемешивали и кипятили в течение 6 ч, затем реакционную смесь перемешивали 72 ч при комнатной температуре и снова кипятили с обратным холодильником. Добавляли дополнительное количество соединения В (20%), затем полученную смесь перемешивали и снова кипятили с обратным холодильником в течение 6 ч. Опять добавляли дополнительное количество соединения В (20%) и снова кипятили полученную смесь с обратным холодильником в течение ночи. После концентрирования полученный остаток очищали флэш-хроматографией на силикагеле (элюент: ацетат/гексан 1/1). Собирали желаемые фракции и выпаривали растворитель, получая 0,025 г (38%) чистого промежуточного соединения (21). В. Получение соединений Пример В 1. Получение 17-хлор-8,9,10,11,12,13-гексагидро-7 Н,19 Н-4,6-этандиилиденпиримидо[4,5b][13,1,4,6]бензоксатриазациклопентадецина (соединение 1) Из двух отдельных капельных воронок раствор трибутилфосфина (0,00268 моль) в ТГФ (20 мл) и раствор ADDP (0,00155 моль) в ТГФ (20 мл) одновременно медленно добавляли к раствору промежуточ- 21013904 ного соединения 2 (0,00103 моль) в ТГФ (20 мл) и ДМФА (2 мл), охлажденному до 0 С в атмосфере азота. Реакционную смесь перемешивали в течение 4 ч при комнатной температуре, выливали в 1N раствор водной хлористо-водородной кислоты и через 1 ч смесь разбавляли DCM. Осадок отфильтровывали, органическую фазу распределяли с 10%-ным водным раствором карбоната калия, сушили (MgSO4) и концентрировали в вакууме. Твердый остаток разрушали ультразвуком в горячем изопропаноле, отфильтровывали, промывали сухим эфиром и сушили в вакууме, получая 0,16 г (44%) соединения (1). Пример В 2. Получение 17-хлор-7,8,9,10,11,12,13,19-октагидро-6,4-(нитрилометено)пиримидо[4,5b][13,1,4,6]бензоксатриазациклопентадецина (соединение 2) Из двух отдельных капельных воронок раствор ADDP (0,00102 моль) в ТГФ (2 мл) и раствор трибутилфосфина (0,00177 моль) в ТГФ (2 мл) одновременно медленно добавляли к раствору промежуточного соединения 6 (0,000681 моль) в ТГФ (10 мл) и ДМФА (1,4 мл) и перемешивали при комнатной температуре в течение 18 ч. Затем раствор ADDP (0,000340 моль) в ТГФ (0,7 мл) и раствор трибутилфосфина(0,000592 моль) в ТГФ (0,7 мл) одновременно добавляли при комнатной температуре в течение 2 ч. Смесь гидролизовали и осадок отфильтровывали, промывали водой, затем изопропанолом и диэтиловым эфиром и сушили в вакууме, получая 0,124 г (49%) соединения (2), температура плавления 260 С. Пример В 3. Получение 8,9,10,11,14,15-гексагидро-7 Н,21 Н-4,6-этандиилиденпиримидо[4,5-b](0,00057 моль) растворяли в ДМФА (20 мл) и перемешивали при комнатной температуре. Промежуточное соединение (11) (0,00019 моль) растворяли в ДМФА (10 мл) и добавляли N-этил-N-(1-метилэтил)-2 пропанамин (0,00114 моль). Полученный раствор медленно добавляли в течение 2 ч к первому раствору. Светло-зеленый раствор перемешивали в течение ночи при комнатной температуре. Растворитель (ДМФА) выпаривали. Остаток очищали колоночной флэш-хроматографией, получая соединение (3).(0,00165 моль) растворяли в ДМФА (40 мл) и перемешивали при комнатной температуре. Промежуточное соединение (16) (0,00055 моль) растворяли в ДМФА (20 мл) и добавляли N-этил-N-(1-метилэтил)-2 пропанамин (0,0033 моль). Полученный раствор медленно добавляли в течение 2 ч к первому раствору. Светло-зеленый раствор перемешивали в течение ночи при комнатной температуре. Растворитель Все остальные соединения можно получить по данным методикам при условии, что соединения, гдеY представляет собой С 1-5 алкил, и Х 2/Х 1 NH, циклизуют в условиях метатезиса с замыканием кольца с использованием катализатора Граббса второго поколения для диенов (см. пример В 5 ниже.) Пример В 5. Получение 16-хлор-15-фтор-7,8,9,10,11,12,13,18-октагидро-12-метил-4,6-этандиилиденпиримидо[4,5-b][1,4,6,11]бензотетразациклотетрадецин (соединение 5) Промежуточное соединение (21) (1 экв.) растворяли в смеси метанол/диоксан (4/1), затем добавляли катализатор Pt/C (0,3 экв.) и перемешивали реакционную смесь в течение 4 ч в атмосфере Н 2. Полученную смесь фильтровали через тонкий слой целита и концентрировали фильтрат досуха. Полученный остаток сушили в высоком вакууме, получая 0,029 г (60%) чистого соединения (5). Идентификация соединений Соединения идентифицировали при помощи ЖХ/МС с использованием системы градиентного элюирования методом ВЭЖХ с обращенной фазой. Соединения идентифицировали по их специфическому времени удерживания и пику протонированного молекулярного иона МН+. Градиент ВЭЖХ поддерживали при помощи системы Waters Alliance HT 2790 с нагревателем колонки, установленным на 40 С. Поток из колонки разделяли на поток к детектору с фотодиодной матрицей (PDA) Waters 996 и масс-спектрометру Waters-Micromass ZQ с источником ионизации электрораспылением, работающим в режиме положительной и отрицательной ионизации. ВЭЖХ с обращенной фазой проводили на колонкеXterra MS C18 (3,5 мкм, 4,6100 мм) при объемном расходе 1,6 мл/мин. Использовали три подвижные фазы (подвижная фаза А 95% 25 мМ ацетата аммония+5% ацетонитрила; подвижная фаза В: ацетонитрил, подвижная фаза С: метанол) для установки условия градиента от 100% А до 50% В и 50% С за 6,5 мин, до 100% В за 1 мин, 100% В за 1 мин, и повторного установления равновесия с 100% А за 1,5 мин.- 23013904 Используемый объем введения составлял 10 мкл. Масс-спектры получали сканированием от 100 до 1000 за 1 с при времени пребывания 0,1 с. Электрическое напряжение капиллярной иглы составляло 3 кВ, и источник температуры устанавливали на 140 С. В качестве газа-распылителя использовали азот. Конусное напряжение составляло 10 В для режима положительной ионизации и 20 В для режима отрицательной ионизации. Сбор данных осуществляли при помощи информационной системы Waters-Micromass Mass-Lynx-Openlynx. Таблица. Время удерживания (RT в минутах) и молекулярная масса в виде МН+ С. Фармакологические примеры Пример С 1. Ингибирование EGFR in vitro Ингибирование EGFR in vitro определяли либо при помощи планшетной технологии, либо технологии стекловолоконного фильтра, описанной Davies, S.P. et al., Biochem J. (2000), 351; p. 95-105. Технология Flash Plate в общем виде описана В.A. Brown et al. in High Throughput Screening (1997), p.317-328.Editor(s): Devlin, John P. Publisher: Dekker, New York, N. Y. В анализе EGFR киназной реакции планшетным методом киназный субстрат, состоящий из биотинилированного поли(L-глутаминовая кислота-L-тирозин)(поли(GT)биотина), инкубируют с вышеуказанным белком в присутствии меченного (33 Р) АТФ. Затем определяют (33 Р) фосфорилирование субстрата в виде излучаемой световой энергии при помощи планшета, покрытого стрептавидином (PerkinElmer LifeSciences), путем захвата и количественного определения связывания меченого биотина и меченного радиоизотопом субстрата. Подробное описаниеEGFR киназную реакцию осуществляют при 30 С в течение 60 мин в 96-луночном микротитровочном планшете (PerkinElmer Life Sciences). Для каждого соединения проводили отклик на полную дозу от 1,10-6 М до 1,10-10 М. В качестве стандартных соединений использовали IRESSA и Tarceva (эрлотиниб). В 100 мкл реакционного объема содержится 54,5 мМ TrisHCl pH 8,0, 10 мМ MgCl2, 100 мкМNa3VO4, 5,0 мкМ немеченого АТФ, 1 мМ DTT, 0,009% BSA, 0,8 мКи АТ 33 Р, 0,35 мкг/лунка поли (GT) биотина и 0,5 мкг EGFR-киназного домена/лунка. Реакцию останавливают удалением реакционной смеси и промыванием планшета 3200 мкл промывного/стоп буфера (PBS+100 мМ EDTA). После стадии конечного промывания в каждую лунку добавляли 200 мкл промывного/стоп буфера и определяли количество фосфорилированного (33 Р) поли(GT)биотина, осуществляя подсчет (30 с/лунка) в микротитровочном сцинтилляционном счетчике. В случае анализа EGFR киназной реакции методом стекловолоконного фильтра киназный субстрат,состоящий из поли(L-глутаминовая кислота-L-тирозин)(поли(GT)биотина), инкубируют с указанным выше белком в присутствии меченного (33 Р) АТФ. Затем измеряют (33 Р) фосфорилирование в виде радиоактивности, связанной со стекловолоконным фильтром. Подробное описаниеEGFR киназную реакцию проводят при 25 С в течение 10 мин в 96-луночном микротитровочном планшете. Для каждого из тестируемых соединений проводили отклик на полную дозу от 1,10-6 М до 1,10-10 М. В качестве стандартных соединений использовали IRESSA и Tarceva (эрлотиниб). В 25 мкл реакционного объема содержится 60 мМ TrisHCl pH 7,5, 3 мМ MgCl2, 3 мМ MnCl2, 3 мкМ Na3VO4,50 мкг/мл ПЭГ 20000, 5,0 мкМ немеченного АТФ, 1 мМ DTT, 0,1 мКи АТ 33 Р, 62,5 мкг/лунка поли(СТ) и 0,5 мкг EGFR-киназного домена/лунка. Реакцию останавливают добавлением 3%-ного раствора фосфорной кислоты. Затем 10 мкл реакционной смеси наносят на фильтр Filtermat A (Wallac) и 3 раза промывают в течение 5 мин 75 мМ фосфорной кислоты и 1 раз в течение 5 мин метанолом перед высушиванием и количественным подсчетом при помощи Typhoon (Amersham) с использованием LE фосфоресцирующего экрана с длительным послесвечением. Пример С 2. Анализ пролиферации при недостатке сыворотки на клетках карциномы яичникаSKOV3. Клеточную линию карциномы яичника (SKOV3) использовали в анализе фактора роста эпидермиса,стимулированного клеточной пролиферацией, для оценки ингибирующего эффекта соединений на EGF в цельных клетках.- 24013904 На первой стадии клетки SKOV3 инкубировали в течение 24 ч в присутствии 10% сыворотки FCS. На второй стадии клетки SKOV3 инкубировали с соединениями, которые нужно было протестировать, в условиях отсутствия сыворотки (37 С и 5% (об/об) СО 2), и затем стимулировали в течение 72 ч EGF при конечной концентрации 100 нг/мл. Влияние соединений на стимулирование EGF окончательно оценивали при помощи стандартного анализа на жизнеспособность на МТТ клетках. В следующих таблицах приведены значения pIC50 соединений в соответствии с изобретением, полученные при помощи приведенных выше киназных анализов.D. Примеры композиций Следующие препараты являются типичными примерами фармацевтических композиций, пригодных для системного введения субъектам, представляющим собой животных и человека, в соответствии с настоящим изобретением. Активный ингредиент (А.И.), используемый в данных примерах, относится к соединению формулы (I), (XXXI) или их фармацевтически приемлемым аддитивным солям. Пример D.I. Таблетки с пленочным покрытием Получение ядра таблетки Смесь А.И. (100 г), лактозы (570 г) и крахмала (200 г) хорошо смешивали и затем увлажняли раствором додецилсульфата натрия (5 г) и поливинилпирролидона (10 г) примерно в 200 мл воды. Влажную порошкообразную смесь просеивали, сушили и снова просеивали. Затем добавляли микрокристаллическую целлюлозу (100 г) и гидрогенизированное растительное масло (15 г). Все это хорошо смешивали и прессовали в таблетки, получая 10000 таблеток, каждая из которых содержала 10 мг активного ингредиента. Покрытие К раствору метилцеллюлозы (10 г) в денатурированном этаноле (75 мл) добавляли раствор этилцеллюлозы (5 г) в CH2Cl2 (150 мл). Затем добавляли СН 2 С 12 (75 мл) и 1,2,3-пропантриол. Полиэтиленгликоль (10 г) расплавляли и растворяли в дихлорметане (75 мл). Последний раствор добавляли к первому и затем добавляли октадеканоат магния (2,5 г), поливинилпирролидон (5 г) и концентрированную суспензию красителя (30 мл) и все это гомогенизировали. Ядра таблеток покрывали полученной в результате смесью в аппарате для нанесения покрытий. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее формулу формы его N-оксидов, фармацевтически приемлемые аддитивные соли и стереохимически изомерные- 25013904 формы,где а 1-а 2=а 3-а 4 представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH, N-CH=N-CH илиCH-CH=N-CH,Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил, С 1-6 алкил-NHСО-,X1 представляет собой NR11,X2 представляет собой непосредственную связь, -O-, -N(R12-)С 1-2 алкил-, -N(R17)-С(О)-C1-2 алкил-,20-Het -C1-2 алкил-,R1 представляет собой водород или галоген,R2 представляет собой водород или галоген,R3 представляет собой водород,R4 представляет собой водород,R11 представляет собой водород,R12 представляет собой водород или С 1-4 алкил,R13 представляет собой водород,R14 представляет собой водород,R17 представляет собой водород,Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила. 2. Соединение по п.1,где Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил-, -С 1-6 алкилNH-СО-,X1 представляет собой NR11,X2 представляет собой непосредственную связь, О, NR17-CO-C1-2 алкил-, Het20-С 1-2 алкил- или NR12 С 1-2 алкил-; в особом варианте осуществления X2 представляет собой непосредственную связь, NR17-COС 1-2 алкил-, Het20-С 1-2 алкил- или -О-,R1 представляет собой водород или галоген, предпочтительно галоген,R2 представляет собой водород или галоген,R3 представляет собой водород,R4 представляет собой водород,R11 представляет собой водород,R12 представляет собой водород или С 1-4 алкил,R13 представляет собой водород,R14 представляет собой водород,R17 представляет собой водород,Het20 представляет собой гетероцикл, выбранный из пирролидинила, 2-пирролидинила. 3. Соединение по п.1,где Z представляет собой NH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил-, -С 1-5 алкил-NR14-СО-С 1-5 алкил-, или-С 1-6 алкил-NH-СО-,X1 представляет собой -NR11-,X2 представляет собой непосредственную связь, -C1-2 алкил, -О-C1-2 алкил-, -O-, -О-СН 2- или Het20 -С 12 алкил-,R1 представляет собой водород или галоген,R2 представляет собой водород или галоген,R3 представляет собой водород,R4 представляет собой водород,R11 представляет собой водород,R12 представляет собой водород или С 1-4 алкил,R13 представляет собой водород,Het20 представляет собой пирролидинил,4. Соединение по п.1 или 2, где заместитель R1 находится в положении 4', заместитель R2 находится в положении 5', заместитель R3 находится в положении 3 и заместитель R4 находится в положении 7 структуры формулы (I). 5. Соединение по любому из пп.1-4, где а 1-а 2=а 3-а 4 представляет собой N-CH=CH-CH. 6. Соединение по любому из пп.1-4, где а 1-а 2=а 3-а 4 представляет собой N-CH=N-CH. 7. Соединение по любому из пп.1-4, где а 1-а 2=а 3-а 4 представляет собой CH-CH=N-CH. 8. Промежуточное соединение формулы формы его N-оксидов, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы,где а 1-а 2=а 3-а 4 представляет собой двухвалентный радикал, выбранный из N-CH=CH-CH или NCH=N-CH,Y представляет собой -С 3-9 алкил-, -С 1-5 алкил-NR13-С 1-5 алкил- или -С 1-6 алкил-NH-CO-,R1 представляет собой водород или галоген,R2 представляет собой водород или галоген,R4 представляет собой водород,R11 представляет собой водород,R13 представляет собой водород. 9. Применение соединений формулы (I) или формулы (XXXI) в качестве ингибитора киназы EGFR. 10. Применение соединения по любому из пп.1-7 в качестве лекарственного средства. 11. Применение соединения по любому из пп.1-7 для приготовления лекарственного средства для лечения нарушений, связанных с клеточной пролиферацией, таких как атеросклероз, рестеноз и рак. 12. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное для ингибирования киназы количество соединения, описанного в любом из пп.1-7. 13. Применение соединения по п.8 в качестве лекарственного средства. 14. Применение промежуточного соединения по п.8 для приготовления лекарственного средства для лечения нарушений, связанных с клеточной пролиферацией, таких как атеросклероз, рестеноз и рак. 15. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента эффективное для ингибирования киназы количество промежуточного соединения, описанного в п.8. 16. Способ получения соединения по любому из пп.1-7, включающий: а) сочетание производного 2-ацетокси-8-хлорпиримидо[5,4-d]пиримидина (II) с подходящими замещенными анилинами (III) с получением промежуточных соединений формулы (IV) и снятие защиты с промежуточных соединений формулы (IV) с последующим замыканием кольца в подходящих условияхb) сочетание известного 8-хлор-2-(метилтио)пиримидо[5,4-d]пиримидина с производным 2 аминофенола формулы (XXI) с получением промежуточных соединений формулы (XXII), затем аминирование пиридо[3,2-d]пиримидина формулы (XXII) с использованием аминированного спирта (XXIII) в известных в данной области условиях с последующим замыканием кольца в условиях Мицунобу с получением требуемых соединений формулы (I") 17. Способ лечения нарушения, связанного с клеточной пролиферацией, где указанный способ включает введение животному, нуждающемуся в подобном лечении, терапевтически эффективного количества соединения по любому из пп.1-7. 18. Способ лечения нарушения, связанного с клеточной пролиферацией, где указанный способ включает введение животному, нуждающемуся в подобном лечении, терапевтически эффективного количества промежуточного соединения по п.8.
МПК / Метки
МПК: C07D 487/04, A61K 31/519, C07D 471/04, A61P 35/00, C07D 498/18, C07D 471/18
Метки: агентов, пиридо, антипролиферативных, пиримидопиримидиновые, качестве, производные
Код ссылки
<a href="https://eas.patents.su/29-13904-pirido-i-pirimidopirimidinovye-proizvodnye-v-kachestve-antiproliferativnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридо- и пиримидопиримидиновые производные в качестве антипролиферативных агентов</a>
Предыдущий патент: Способ регулирования положения отсечного золотника с динамической коррекцией положения “нуля”, применяемый в системе регулирования паровой турбины
Следующий патент: Производные изоксазола, их фармацевтические композиции и способ лечения невропатической боли
Случайный патент: Пылесос с емкостью для воды, не имеющий средств крепления указанной емкости












