Производные хинолина в качестве антибактериальных агентов
Номер патента: 10601
Опубликовано: 30.10.2008
Авторы: Андрис Кунрад Йозеф Лодевейк Марсель, Гийемон Жером Эмиль Жорж, Коул Анил, Паскье Элизабет Тереза Жанна
Формула / Реферат
1. Применение соединения для изготовления лекарственного средства для лечения бактериальной инфекции, причем соединение является соединением формулы
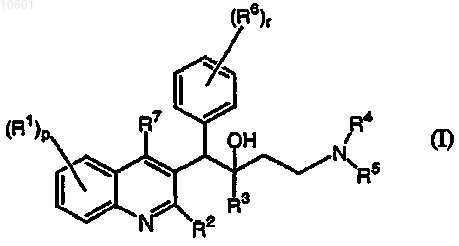
его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой, где
R1 представляет собой водород, галоген, полигалоC1-6алкил, C1-6алкил, Ar или Het;
р представляет собой целое число, равное 1 или 2;
R2 представляет собой C1-6алкилокси, C1-6алкилоксиC1-6алкилокси или C1-6алкилтио;
R3 представляет собой Ar, Het или Het1;
R4 и R5 представляют собой, каждый независимо, водород, C1-6алкил или бензил или
R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6алкилом, галогеном, полигалоC1-6алкилом, гидрокси, гидроксиC1-6алкилом, C1-6алкилокси, амино, моно- или ди(C1-6алкил)амино, C1-6алкилтио, C1-6алкилоксиC1-6алкилом, C1-6алкилтиоC1-6алкилом или пиримидинилом;
R6 представляет собой водород, галоген, полигалоC1-6алкил, C1-6алкил, C1-6алкилокси, C1-6алкилтио или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-;
r представляет собой целое число, равное 1 или 2;
R7 представляет собой водород, C1-6алкил, Ar, Het или Het1;
Ar представляет собой гомоциклический радикал, выбранный из группы фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоциклический радикал может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы гидрокси, галогена, циано, нитро, амино, моно- или ди(C1-6алкил)амино, C1-6алкила, полигалоC1-6алкила, гидроксиC1-6алкила, C1-6алкилокси, полигалоC1-6алкилокси, C1-6алкилоксиC1-6алкила, карбоксила, C1-6алкилоксикарбонила, аминокарбонила, морфолинила и моно- или ди(C1-6алкил)аминокарбонила;
Het представляет собой моноциклический гетероцикл, выбранный из группы N-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; каждый моноциклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6алкила, полигалоC1-6алкила, гидроксиC1-6алкила, C1-6алкилокси, C1-6алкилоксиC1-6алкила или Ar-C(=О)-;
Het1 представляет собой бициклический гетероцикл, выбранный из группы хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6алкила, полигалоC1-6алкила, гидроксиC1-6алкила, C1-6алкилокси, C1-6алкилоксиC1-6алкила или Ar-C(=О)-;
при условии, что бактериальная инфекция является другой, чем микобактериальная инфекция.
2. Применение по п.1, где соединение является другим, чем (aS,bR)-6-бром-a-[2-(диметиламино)этил]-2-метокси-a-1-нафталин-b-фенил-3-хинолинэтанол, его фармацевтически приемлемая кислотно- или основно-аддитивная соль или его N-оксидная форма.
3. Применение по п.1 или 2, где соединение формулы (I) является соединением, имеющим следующую формулу:
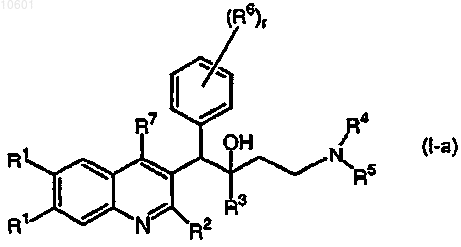
его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой.
4. Применение по любому из предыдущих пунктов, где соединение формулы (I) или (I-а) является соединением, имеющим следующую формулу:
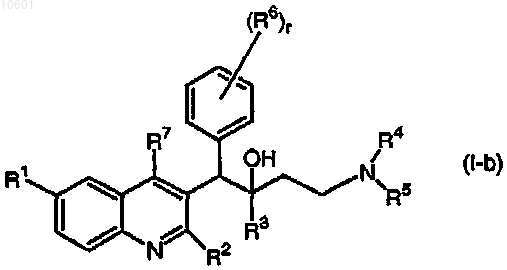
его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой.
5. Применение по любому из предыдущих пунктов, где R1 представляет собой водород, галоген, необязательно замещенный фенил или Het.
6. Применение по п.5, где R1 представляет собой водород, галоген или необязательно замещенный фенил.
7. Применение по п.6, где R1 представляет собой галоген.
8. Применение по любому из предыдущих пунктов, где R2 представляет собой C1-6алкилокси или C1-6алкилтио.
9. Применение по любому из предыдущих пунктов, где R3 представляет собой Ar или Het.
10. Применение по любому из пп.1-8, где R3 представляет собой Ar или Het1.
11. Применение по п.9 или 10, где R3 представляет собой Ar.
12. Применение по п.11, где R3 представляет собой необязательно замещенный фенил или необязательно замещенный нафтил.
13. Применение по любому из предыдущих пунктов, где R4 и R5 представляют собой, каждый независимо, водород, C1-6алкил или бензил.
14. Применение по п.13, где R4 и R5 представляют собой, каждый независимо, водород или C1-6алкил.
15. Применение по любому из пп.1-12, где R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6алкилом, галогеном, полигалоC1-6алкилом, гидрокси, гидроксиC1-6алкилом, C1-6алкилокси, амино, моно- или ди(C1-6алкил)амино, C1-6алкилтио, C1-6алкилоксиC1-6алкилом, C1-6алкилтиоC1-6алкилом или пиримидинилом.
16. Применение по п.15, где R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6алкилом, галогеном, полигалоC1-6алкилом, гидрокси, гидроксиC1-6алкилом, C1-6алкилокси, амино, моно- или ди(C1-6алкил)амино, C1-6алкилтио, C1-6алкилоксиC1-6алкилом, C1-6алкилтиоC1-6алкилом или пиримидинилом.
17. Применение по любому из предыдущих пунктов, где R6 представляет собой водород, галоген, полигалоC1-6алкил, C1-6алкил или два вицинальных радикала R6 взяты вместе с образованшхь двухвалентного радикала формулы -CH=CH-CH=CH-.
18. Применение по п.17, где R6 представляет собой водород или галоген.
19. Применение по любому из предыдущих пунктов, где R7 представляет собой водород.
20. Применение по любому из предыдущих пунктов, где r представляет собой целое число, равное 1.
21. Применение по любому из предыдущих пунктов, где p представляет собой целое число, равное 1.
22. Применение по п.1, при условии, что, когда один R1 представляет собой C1-6алкил, тогда p представляет собой целое число, равное 2, и другой заместитель R1 выбран из галогена, полигалоC1-6алкила, C1-6алкила, Ar или Het.
23. Применение по любому из предыдущих пунктов, где бактериальная инфекция является инфекцией, вызванной грамположительной бактерией.
24. Применение по п.1, где R1 представляет собой водород; C1-6алкил; галоген; фенил; фуранил, необязательно замещенный гидроксиC1-6алкилом; или пиридил; R2 представляет собой C1-6алкилокси; C1-6алкилтио или C1-6алкилоксиC1-6алкилокси; R3 представляет собой фенил, необязательно замещенный 1 или 2 атомами галогена; нафтил, необязательно замещенный 1 или 2 атомами галогена или C1-6алкилокси; тиенил; пиперидинил, замещенный Ar-C(=О)-; 2,3-дигидробензо[1,4]диоксинил; бензо[1,3]диоксолил или аценафтил; R4 и R5 представляют собой, каждый независимо, водород; C1-6алкил; бензил или R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из имидазолила; пиразинила, замещенного C1-6алкилом; пиперазинила, замещенного C1-6алкилом; пиперазинила, замещенного пиримидинилом; пиперидинила; тиоморфолинила; морфолинила; пирролидинила или триазолила; R6 представляет собой водород; галоген; C1-6алкил или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-; R7 представляет собой водород.
25. Применение по п.1, где соединение формулы (I) выбрано из
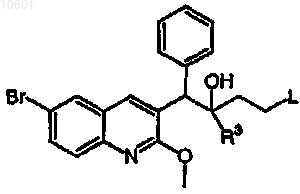
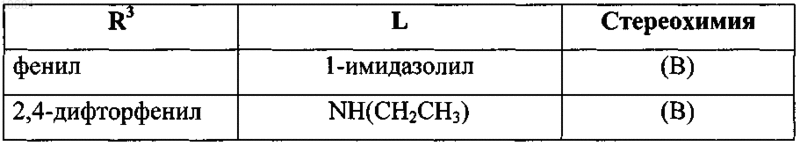
его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы.
26. Применение по п.1, где соединение формулы (I) выбрано из
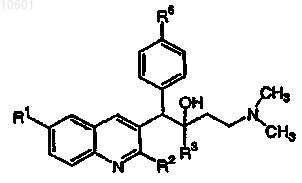
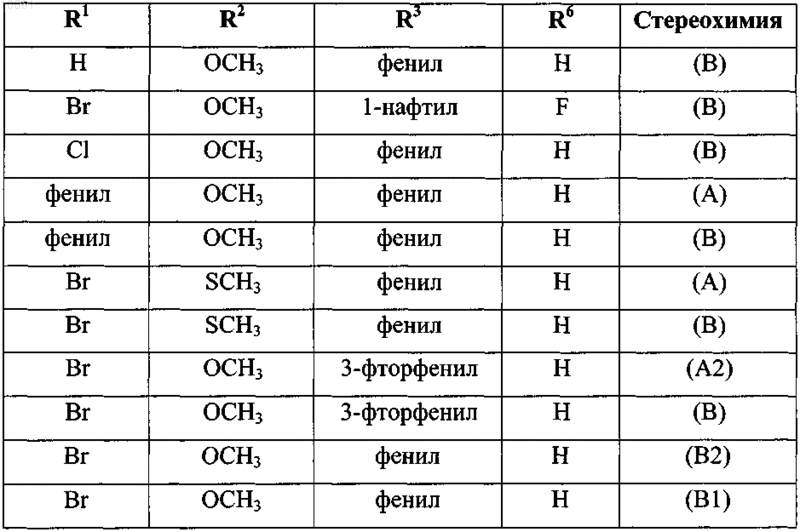
его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы.
27. Применение по п.1, где соединение формулы (I) выбрано из
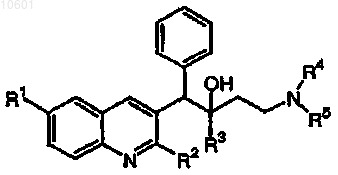
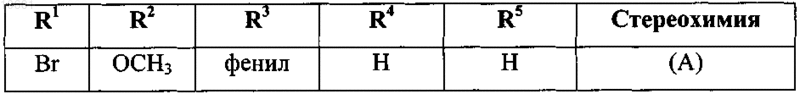
его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы.
28. Комбинация (a) соединения формулы (I) по любому из пп.1-27 и (b) одного или нескольких других антибактериальных агентов для лечения бактериальной инфекции при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты.
29. Фармацевтическая композиция для лечения бактериальной инфекции, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения формулы (I) по любому из пп.1-27 и (b) одного или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты.
30. Применение комбинации по п.28 для лечения бактериальной инфекции.
31. Применение фармацевтической композиции по п.29 для лечения бактериальной инфекции.
32. Продукт для лечения бактериальной инфекции, содержащий (а) соединение формулы (I) по любому из пп.1-27 и (b) один или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования при лечении бактериальной инфекции.
33. Соединение, выбранное из
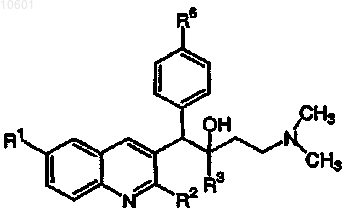
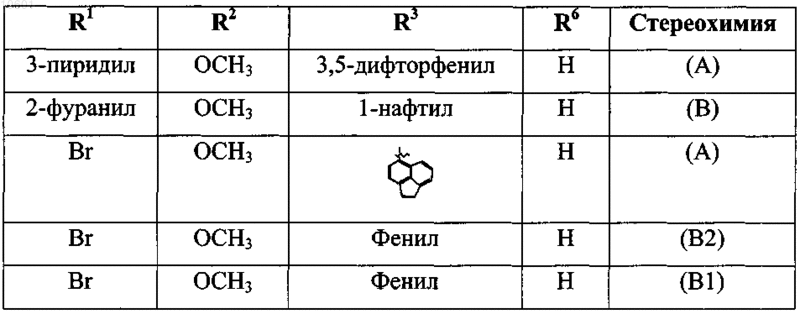
его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы.
34. Соединение, выбранное из
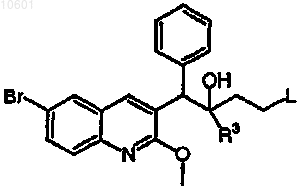
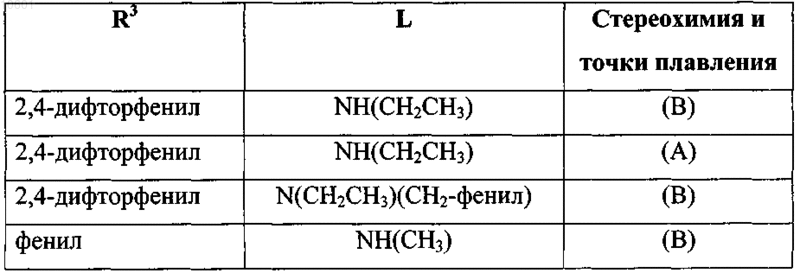
его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы.
35. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную со стафилококками, энтерококками или стрептококками.
36. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с резистентными к метициллину Staphylococcus aureus (MRSA), резистентными к метициллину, негативными по коагулазе стафилококкам (MRCNS), резистентными к пенициллину Streptococcus pneumoniae или резистентными ко многим лекарственным средствам Enterococcus faecium.
37. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с Staphylococcus aureus или Streptococcus pneumoniae.
38. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с Staphylococcus aureus.
Текст
010601 Настоящее изобретение относится к применению производных хинолина для изготовления лекарственного средства для лечения бактериальной инфекции. Возникающей в настоящее время проблемой является резистентность к антибиотическим агентам первой линии. Некоторые важные примеры включают в себя резистентный к пенициллину Streptococcusaureus, полирезистентные сальмонеллы. Резистентность к антибиотическим агентам является серьезной проблемой. Инфекции, вызванные резистентными микробами, не поддаются лечению, что приводит к продолжительному заболеванию и более высокому риску смерти. Неудачи в лечении приводят также к более длительным периодам инфективности, которая повышает число инфицированных людей, находящихся в обществе и, таким образом,подвергая общую популяцию риску получения инфекции резистентным штаммом. Больницы являются критическим компонентом проблемы антимикробной резистентности во всем мире. Комбинация очень восприимчивых пациентов, интенсивного и пролонгированного использования антимикробных средств и перекрестной инфекции приводила к инфицированиям очень резистентными бактериальными патогенами. Самолечение антимикробными средствами является другим основным фактором, способствующим резистентности. Самолечение антимикробными средствами может быть ненужным, часто является неадекватно дозированным или может не содержать адекватные количества активного лекарственного средства. Соблюдение пациентом рекомендованного лечения является другой основной проблемой. Пациенты забывают принимать лечение, прерывают свое лечение, когда они начинают чувствовать себя лучше,или могут быть не в состоянии позволить себе провести полный курс лечения, в результате чего создается идеальная окружающая среда для адаптации микробов, а не их уничтожения. Вследствие возникающей резистентности ко многим антибиотикам врачи противостоят инфекциям,для которых не имеется эффективной терапии. Заболеваемость, смертность и стоимостные аспекты таких инфекционных заболеваний вызывают повышение расходов для системы медико-санитарной помощи. Таким образом, существует большая потребность в новых соединениях для лечения бактериальных инфекций, особенно для лечения инфекций, вызванных резистентными штаммами. В WO 2004/011436 описаны замещенные производные хинолина, обладающие активностью против микобактерий, в частности против Mycobacterium tuberculosis. Одно конкретное соединение этих замещенных производных хинолина описано в Science (2005), 307, 223-227. Теперь обнаружено, что производные хинолина, описанные в WO 2004/011436, проявляют также активность против других бактерий, отличных от микобактерий. Таким образом, настоящее изобретение относится к применению соединения для изготовления лекарственного средства для лечения бактериальной инфекции, причем указанное соединение является соединением формулы его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой, гдеp представляет собой целое число, равное 1 или 2;R4 и R5 представляют собой, каждый независимо, водород, C1-6 алкил или бензил илиR4 и R5 вместе с атомом N, к которому они присоединены, могут образовать радикал, выбранный из группы пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила,пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом;R6 представляет собой водород, галоген, полигалоC1-6 алкил, C1-6 алкил, C1-6 алкилокси, C1-6 алкилтио или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1 или 2;Ar представляет собой гомоциклический радикал, выбранный из группы фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоциклический радикал может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы гидрокси, галогена, циано, нитро,амино, моно- или ди(C1-6 алкил)амино, C1-6 алкила, полигалоC1-6 алкила, гидроксиC1-6 алкила,C1-6 алкилокси, полигалоC1-6 алкилокси, C1-6 алкилоксиC1-6 алкила, карбоксила, C1-6 алкилоксикарбонила,аминокарбонила, морфолинила и моно- или ди(C1-6 алкил)аминокарбонила;Het представляет собой моноциклический гетероцикл,выбранный из группыN-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; каждый моноциклический гетероцикл может необязательно быть замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6 алкила, полигалоC1-6 алкила,гидроксиC1-6 алкила, C1-6 алкилокси, C1-6 алкилоксиC1-6 алкила или Ar-C(=O)-;Het1 представляет собой бициклический гетероцикл, выбранный из группы хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2, 3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями,каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6 алкила, полигалоC1-6 алкила,гидроксиC1-6 алкила, C1-6 алкилокси, C1-6 алкилоксиC1-6 алкила или Ar-C(=О)-; при условии, что бактериальная инфекция является другой, чем микобактериальная инфекция. Настоящее изобретение относится также к способу лечения бактериальной инфекции у млекопитающего, в частности теплокровного млекопитающего, более конкретно человека, включающего введение эффективного количества соединения изобретения млекопитающему. Используемый здесь до или здесь после термин C1-6 алкил в качестве группы или части группы означает насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как метил, этил, пропил, 1-метилэтил, бутил, пентил, гексил,2-метилбутил и т.п. Используемый здесь до или после термин (=O) образует карбонильную часть при присоединении к атому углерода. Термин галоген является общим для фтора, хлора, брома и йода. Используемый здесь до или после термин полигалоC1-6 алкил в качестве группы или части группы означает моно- или полигалогензамещенный C1-6 алкил, например метил с одним или несколькими атомами фтора, например дихлорметил или трифторметил, 1,1-дифторэтил и т.п. В случае, когда более чем один атом галогена присоединен к алкильной группе в определении полигалоC1-6 алкила, они могут быть одинаковыми или разными. Считается, что определение Het или Het1 или когда R4 и R5 взяты вместе, включает в себя все возможные изомерные формы гетероциклов, например пирролил содержит 1 Н-пирролил и 2 Н-пирролил.Ar, Het или Het1, перечисленные в определениях заместителей соединений формулы (I) (см., например, R3), указываемых здесь до или после, могут быть присоединены к остальной части молекулы формулы (I) через любой атом углерода или гетероатом, который подходит, если не оговорено особо. Так,например, когда Het представляет собой имидазолил, он может быть 1-имидазолилом, 2-имидазолилом,4-имидазолилом и т.п. Линии, проведенные от заместителей в системы колец, означают, что связь может быть присоединена к любому из подходящих атомов кольца. Когда два вицинальных радикала R6 взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-, это означает, что два вицинальных радикала R6 образуют вместе с кольцом фенила, к которому они присоединены, нафтил. Для терапевтического применения солями соединений формулы (I) являются соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, могут также найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, фармацевтически приемлемые они или нет, включены в пределы настоящего изобретения. Имеется в виду, что фармацевтически приемлемые аддитивные соли, указываемые здесь до или после, включают в себя терапевтически активные формы нетоксичных кислотно-аддитивных солей, которые способны образовывать соединения формулы (I). Последние могут быть удобно получены обработкой формы основания такими подходящими кислотами, как неорганические кислоты, например галогеноводородные кислоты, например хлористо-водородная кислота, бромисто-водородная кислота и т.п.; серная кислота; азотная кислота; фосфорная кислота и т.п. или органические кислоты, например уксусная, пропановая, гидроксиуксусная, 2-гидроксипропановая, 2-оксопропановая, щавелевая, малоновая,янтарная, малеиновая, фумаровая, яблочная, винная, 2-гидрокси-1,2,3-пропантрикарбоновая, метансульфоновая, этансульфоновая, бензолсульфоновая, 4-метилбензолсульфоновая, циклогексансульфаминовая,2-гидроксибензойная, 4-амино-2-гидроксибензойная и подобные кислоты. Наоборот, форма соли может-2 010601 быть превращена обработкой щелочью в форму свободного основания. Соединения формулы (I), содержащие кислотные протоны, могут быть превращены в их терапевтически активные формы нетоксичных солей металлов или аддитивных солей с аминами обработкой подходящими органическими и неорганическими основаниями. Подходящие формы солей оснований включают в себя, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и т.п.; соли с органическими основаниями, например соли с первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин и четыре изомера бутиламина, диметиламин, диэтиламин,диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин,триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин, бензатин,N-метил-D-глюкамин, 2-амино-2-(гидроксиметил)-1,3-пропандиол, гидрабамин; и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Наоборот, форма соли может быть превращена обработкой кислотой в форму свободной кислоты. Термин аддитивная соль включает в себя также гидраты и аддитивные формы с растворителем,которые способны образовывать соединения формулы (I). Примерами таких форм являются, например,гидраты, алкоголяты и т.п. Имеется в виду, что N-оксидные формы настоящих соединений включают в себя соединения формулы (I), у которых один или несколько третичных атомов азота окислены в так называемый N-оксид. Соединения формулы (I) могут быть превращены в соответствующие N-оксидные формы по известным в настоящей области процедурам превращения трехвалентного атома азота, в его N-оксидную форму. Указанную реакцию N-окисления обычно проводят взаимодействием материала формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают в себя, например, пероксид водорода, пероксиды щелочных или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать в себя пероксикислоты, такие как, например, бензолперкарбоновая кислота или галогензамещенная бензолперкарбоновая кислота, например 3-хлорбензолперкарбоновая кислота; пероксоалкановые кислоты,например пероксоуксусная кислота; алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода; низшие спирты, например этанол и т.п.; углеводороды, например толуол; кетоны, например 2-бутанон; галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Должно быть понятно, что некоторые соединения формулы (I) и их N-оксиды или аддитивные соли могут содержать один или несколько центров хиральности и могут существовать в виде стереохимически изомерных форм. Термин стереохимически изомерные формы, используемый здесь до или после, означает все возможные стереоизомерные формы, которыми могут обладать соединения формулы (I) и их N-оксиды, аддитивные соли или физиологически функциональные производные. Если не оговорено или указано особо, химическое название соединений означает смесь всех возможных стереохимически изомерных форм,причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. В частности, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо трансконфигурацию. Соединения, содержащие двойные связи, могут иметь стереохимию E (в противоположном направлении) или Z (в одном направлении) у указанной двойной связи. Термины цис, транс, R, S, Е и Z хорошо известны специалисту в данной области. Несомненно, подразумевается, что стереохимически изомерные формы соединений формулы (I) включаются в объем данного изобретения. По стандартам CAS-номенклатуры, когда в молекуле присутствуют два стереогенных центра известной абсолютной конфигурации, обозначение R или S предназначается (на основании правила последовательности Кана-Ингольца-Прелога) для хирального центра с самым низким числом, ссылочного центра. Конфигурация второго стереогенного центра обозначают с использованием относительных обозначений [R,R] или [R,S], где R всегда определяют как ссылочный центр и [R,R] означает центры с такой же самой хиральностью и [R,S] означает центры разной хиральности. Например, если хиральный центр с самым низким числом в молекуле имеет S-конфигурацию и второй центр является R, стереометрия должна быть указана как S-[R,S]. Если используют - и -положения, положение заместителя с наиболее высоким приоритетом на асимметричном атоме углерода в циклической системе, имеющем самое низкое число кольца, условно находится всегда в -положении средней плоскости, определяемой циклической системой. Положение заместителя с самим высоким приоритетом на другом асимметричном атоме углерода в циклической системе относительно положения заместителя с самым высоким приоритетом на ссылочном атоме обозначают , если он находится на той же самой стороне средней плоскости, определяемой циклической системой, или , если он находится на другой стороне средней плоскости, определяемой циклической системой. Когда указывается определенная стереоизомерная форма, это означает, что указанная форма является, по существу, свободной от другой формы, т.е. ассоциирована менее чем с 50%, предпочтительно-3 010601 менее чем с 20%, более предпочтительно менее чем с 10%, еще более предпочтительно менее, чем с 5%,далее предпочтительно менее чем с 2% и наиболее предпочтительно менее чем с 1% другого изомера(ов). Так, когда соединение формулы (I), например, указано как (S,R), это означает, что соединение,по существу, не содержит изомер (R,S). Соединения формулы (I) могут быть синтезированы в форме рацемических смесей энантиомеров,которые могут быть разделены друг от друга по известным в данной области процедурам разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие формы диастереомерных солей взаимодействием с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, селективной или фракционной кристаллизацией, и энантиомеры выделяют из них щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы(I) включает в себя жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов, при условии, что реакция протекает стереоспецифично. Предпочтительно, если желательным является определенный стереоизомер, указанное соединение может быть синтезировано стереоспецифическими способами получения. Эти способы должны подходящим образом использовать энантиомерно чистые исходные материалы. Изобретение включает в себя также производные (обычно называемые пролекарствами) фармакологически активных соединений по изобретению, которые расщепляются in vivo с образованием соединений по изобретению. Пролекарства обычно (но не всегда) имеют более низкую активность у целевого рецептора, чем соединения, в которые они превращаются. Пролекарства являются особенно применимыми, когда требуемое соединение имеет химические или физические свойства, которые делают его введение трудным или неэффективным. Например, требуемое соединение может быть только слабо растворимым, оно может плохо переноситься через слизистый эпителий или может иметь нежелательно короткий полупериод существования в плазме. Дальнейшее обсуждение пролекарств можно найти вStella, V.J. et al., "Prodrugs", Drug Delivery Systems, 1985, p.112-176, and Drugs, 1985, 29, p.455-473. Пролекарственные формы фармацевтически активных соединений по изобретению обычно являются производными любых из соединений формулы (I), их фармацевтически приемлемых кислотно- или основно-аддитивных солей, их стереохимически изомерных форм, их таутомерных и N-оксидных форм,имеющих кислотную группу, которая этерифицирована или амидирована. Такие этерифицированные кислотные группы включают в себя группы формулы -COORx, в которой Rx представляет собойC1-6 алкил, фенил, бензил или одну из следующих групп: Амидированные группы включают в себя группы формулы -CONRyRz, в которой Ry представляет собой Н, C1-6 алкил, фенил или бензил и Rz представляет собой -OH, H, C1-6 алкил, фенил или бензил. Соединения по изобретению, имеющие аминогруппу, могут быть превращены в производные взаимодействием с кетоном или альдегидом, таким как формальдегид, с образованием основания Манниха. Такое основание будет гидролизоваться по кинетике первого порядка в водном растворе. Имеется в виду, что всякий раз используемый здесь термин соединения формулы (I) включает в себя также их N-оксидные формы, их аддитивные соли или их стереохимически изомерные формы. Особенно интересными являются те соединения формулы (I), которые являются стереохимически чистыми. Первый, представляющий интерес вариант осуществления настоящего изобретения относится к соединению формулы (I-а) его фармацевтически приемлемой кислотно- или основно-аддитивной соли, его стереохимически изомерной или N-оксидной форме. Второй, представляющий интерес вариант осуществления настоящего изобретения относится к соединению формулы (I-b) его фармацевтически приемлемой кислотно- или основно-аддитивной соли, его стереохимически изомерной или N-оксидной форме. Третьим, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее в качестве представляющего интерес варианта осуществления, где R1 представляет собой водород, галоген, C1-6 алкил, Ar или Het; предпочтительно водород,галоген, необязательно замещенный фенил или Het; более предпочтительно водород, галоген, необязательно замещенный фенил, необязательно замещенный фуранил или пиридинил; еще более предпочтительно водород, галоген или необязательно замещенный фенил; наиболее предпочтительно галоген, такой как, например, бром или хлор, в частности бром. Четвертым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R1 представляет собой галоген, полигалоC1-6 алкил, Ar или Het; предпочтительно галоген,Ar или Het; более предпочтительно галоген, необязательно замещенный фенил или Het; еще более предпочтительно галоген, фенил, необязательно замещенный фуранил или пиридинил. Пятым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R2 представляет собой C1-6 алкилокси или C1-6 алкилтио, в частности метокси или метилтио; предпочтительно C1-6 алкилокси, более предпочтительно метокси. Шестым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R3 представляет собой Ar или Het, или где R3 представляет собой Ar или Het1; предпочтительно R3 представляет собой Ar; более предпочтительно необязательно замещенный фенил или необязательно замещенный нафтил; еще более предпочтительно фенил, необязательно замещенный галогеном или C1-6 алкилокси, или нафтил, необязательно замещенный галогеном или C1-6 алкилокси, наиболее предпочтительно фенил, необязательно замещенный 1 или 2 атомами галогена, в частности фтором, или нафтил, в частности 1-нафтил. Седьмым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R4 и R5 представляют собой, каждый независимо, водород или C1-6 алкил или R4 и R5 вместе с N-атомом, к которому они присоединены, могут образовать радикал, выбранный из пирролидинила,2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила,2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио,C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; более предпочтительно R4 представляет собой C1-6 алкил и R5 представляет собой водород или C1-6 алкил или R4 и R5 вместе сN-атомом, к которому они присоединены, могут образовывать радикал, выбранный из пирролидинила,2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила,2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио,C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; еще наиболее предпочтительноR4 представляет собой C1-6 алкил и R5 представляет собой водород или C1-6 алкил, или R4 и R5 вместе сN-атомом, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси,гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио,C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; наиболее предпочтительно R4 представляет собой C1-6 алкил, в частности метил или этил, более конкретно метил, и R5 представляет собой водород или C1-6 алкил, в частности метил или этил, более конкретно метил.-5 010601 Восьмым, представляющим интерес вариантом осуществления являются соединения формулы (I) или их любая подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R4 и R5 представляют собой, каждый независимо, водород, C1-6 алкил или бензил; предпочтительно R4 и R5 представляют собой, каждый независимо, водород или C1-6 алкил; более предпочтительно R4 представляет собой C1-6 алкил и R5 представляет собой водород или C1-6 алкил, наиболее предпочтительно R4 и R5 представляют собой C1-6 алкил, в частности метил или этил, более конкретно метил. Девятым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R4 и R5 вместе с N-атомом, к которому они присоединены, могут образовывать радикал,выбранный из пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила,пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом,галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; предпочтительно R4 и R5 вместе с N-атомом, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном,полигалоC1-6 алкилом,гидрокси,гидроксиC1-6 алкилом,C1-6 алкилокси,амино,моноили ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; более предпочтительно R4 и R5 вместе с N-атомом, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролила, имидазолила, пиразолила, триазолила, пиперидинила,пиперазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно,замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси,амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; еще более предпочтительно R4 и R5 вместе с N-атомом, к которому они присоединены, могут образовывать радикал, выбранный из группы имидазолила, триазолила, пиперидинила, пиперазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно,замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси,амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом; наиболее предпочтительно R4 и R5 вместе с N, к которому они присоединены, образуют имидазолил. Заместители на циклической системе, когда R4 и R5 взяты вместе, предпочтительно выбраны изC1-6 алкила, галогена, полигалоC1-6 алкила, гидрокси, C1-6 алкилокси, C1-6 алкилтио и пиримидинила; более предпочтительно заместители выбраны из C1-6 алкила или пиримидинила. Десятым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R6 представляет собой водород, галоген, полигалоC1-6 алкил, C1-6 алкил или два вицинальных радикала R6 взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-; предпочтительно R6 представляет собой водород, галоген, полигалоC1-6 алкил или C1-6 алкил; более предпочтительно R6 представляет собой водород, галоген или C1-6 алкил; еще более предпочтительно R6 представляет собой водород или галоген; наиболее предпочтительно R6 представляет собой водород. Одиннадцатым, представляющим интерес вариантом осуществления являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где R7 представляет собой водород. Двенадцатым, представляющим интерес вариантом осуществления являются соединения формулы(I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где r представляет собой целое число, равное 1. Тринадцатым, представляющим интерес вариантом осуществления, являются соединения формулы(I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где p представляет собой целое число, равное 1. Четырнадцатым, представляющим интерес вариантом осуществления, являются соединения формулы (I) или любая их подгруппа, как указано здесь ранее, при условии, что, когда один R1 представляет собой C1-6 алкил, тогда p равно целому числу, равному 2, и другой заместитель R1 выбран из галогена,полигалоC1-6 алкила, C1-6 алкила, Ar или Het. Пятнадцатым, представляющим интерес вариантом осуществления, являются соединения формулы(I) или любая их подгруппа, как указано здесь ранее, в качестве представляющего интерес варианта осуществления, где соединение не является (S,R)-6-бром[2-(диметиламино)этил]-2-метокси 1 нафталинилфенил-3-хинолинэтанолом, его фармацевтически приемлемой кислотно- или основноаддитивной солью или его N-оксидной формой.-6 010601 Шестнадцатым, представляющим интерес вариантом осуществления, является применение соединений формулы (I) или любой их подгруппы, как указано здесь ранее, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения инфекции, вызываемой грамположительной и/или грамотрицательной бактерией. Семнадцатым, представляющим интерес вариантом осуществления, является применение соединений формулы (I) или любой их подгруппы, как указано здесь ранее, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения инфекции, вызываемой грамположительной бактерией. Восемнадцатым, представляющим интерес вариантом осуществления является применение соединений формулы (I) или любой их подгруппы, как указано здесь ранее, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения инфекции, вызываемой грамотрицательной бактерией. Девятнадцатым, представляющим интерес вариантом осуществления является применение соединений формулы (I) или любой их подгруппы, как указано здесь ранее, в качестве представляющего интерес варианта осуществления для изготовления лекарственного средства для лечения бактериальной инфекции, где соединение формулы (I) имеет IC9015 мкл/мл против по меньшей мере одной бактерии, в частности грамположительной бактерии, предпочтительно IC9010 мкл/мл, более предпочтительноIC905 мкл/мл, причем величину IC90 определяют, как описано здесь ниже. Представляющими также интерес соединениями настоящего изобретения являются те соединения формулы (I), к которой применяют один или несколько, предпочтительно все из следующих определений:a) R1 представляет собой водород; C1-6 алкил; галоген, в частности бром или хлор; фенил; фуранил,необязательно замещенный гидроксиC1-6 алкилом; или пиридил;b) R2 представляет собой C1-6 алкилокси, в частности метокси или этокси; C1-6 алкилтио, в частности метилтио; или C1-6 алкилоксиC1-6 алкилокси;c) R3 представляет собой фенил, необязательно замещенный 1 или 2 атомами галогена, в частности фтора; нафтил, необязательно замещенный 1 или 2 атомами галогена или C1-6 алкилокси; тиенил; пиперидинил, замещенный Ar-C(=О); 2,3-дигидробензо[1,4]диоксинил; бензо[1,3]диоксолил или аценафтил;e) R6 представляет собой водород; галоген, в частности хлор или бром; C1-6 алкил; или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулыf) R7 представляет собой водород. Наиболее предпочтительными соединениями настоящего изобретения являются соединение 50, 206,31, 26, 27, 32, 33, 109, 39, 44, 41, соединения A, E и F, их фармацевтически приемлемые кислотно- или основно-аддитивные соли или их N-оксидные формы. Настоящее изобретение относится также к соединению, выбранному из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной форме.-7 010601 Настоящее изобретение относится также к соединению выбранному из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной форме. Соединения формулы (I) могут быть получены по способам, описанным в WO 2004/011436, которая включена здесь в качестве ссылки. В общем, соединения по изобретению могут быть получены последовательностью стадий, каждая из которых известна специалисту в данной области. В частности, соединения формулы (I) могут быть получены взаимодействием промежуточного соединения формулы (II) с промежуточным соединением формулы (III) по следующей схеме реакций (1): Схема 1 с использованием BuLi в смеси диизопропиламина и тетрагидрофурана,где все символы имеют значения, указанные как в формуле (I). Перемешивание может повысить скорость реакции. Реакция может быть удобно проведена при температуре, находящейся между -20 и -70C. Исходные материалы и промежуточные соединения формулы (II) и (III) представляют собой соединения, которые являются либо коммерчески доступными, либо могут быть получены по общепринятым процедурам реакций, обычно известных в данной области. Например, промежуточные соединения формулы (II-а) могут быть получены по следующей схеме реакций (2): Схема 2 где все символы имеют значения, указанные как в формуле (I). Схема реакций (2) содержит стадию (а), в которой подходящим образом замещенный анилин подвергают взаимодействию с подходящим ацилхлоридом, таким как 2-фенилпропионилхлорид,3-фторбензолпропионилхлорид или п-хлорбензолпропионилхлорид, в присутствии подходящего основания, такого как триэтиламин, и подходящего, инертного в условиях реакции растворителя, такого как метиленхлорид или этилендихлорид. Реакция может быть удобно проведена при температуре, находя-8 010601 щейся между комнатной температурой и температурой флегмы. В следующей стадии (b) аддукт, полученный в стадии (а), подвергают взаимодействию с фосфорилхлоридом (POCl3) в присутствииN,N-диметилформамида (формилирование по реакции Вильсмайера-Хаака с последующей циклизацией). Реакция может быть удобно проведена при температуре, находящейся между комнатной температурой и температурой флегмы. В следующей стадии (с) определенную R2-группу, где R2 представляет собой, например, C1-6 алкилокси или C1-6 алкилтиорадикал, вводят взаимодействием промежуточного соединения,полученного в стадии (b), с соединением Н-Х-C1-6 алкил, где X представляет собой S или О. Промежуточные соединения по формуле (II-b) могут быть получены по следующей схеме реакций(3), в которой в первой стадии (а) замещенный индол-2,3-дион подвергают взаимодействию с замещенным 3-фенилпропионовым альдегидом в присутствии подходящего основания, такого как гидроксид натрия (реакция Пфитцингера), после которого карбоновую кислоту в следующей стадии (b) декарбоксилируют при высокой температуре в присутствии подходящего, инертного в условиях реакции растворителя, такого как дифениловый эфир. Схема 3 Очевидно, что в вышеуказанных и последующих реакциях продукты реакции могут быть выделены из реакционной среды и, если необходимо, дополнительно очищены по методологиям, обычно известным в данной области, таких как экстракция, кристаллизация и хроматография. Далее очевидно, что продукты реакции, которые существуют в более чем одной энантиомерной форме, могут быть выделены из их реакционной смеси известными способами, в частности препаративной хроматографией, такой как препаративная ВЭЖХ. Соединения формулы (I) обычно могут быть разделены на их изомерные формы. Промежуточные соединения формулы (III) представляют собой соединения, которые либо являются коммерчески доступными, либо могут быть получены по общепринятым процедурам реакций, обычно известным в данной области. Например, промежуточные соединения формулы (III-а), в которой R3 представляет собой Ar, замещенный заместителями R10, где каждый R10 независимо выбран из группы гидрокси, галогена, циано, нитро, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкила, полигалоC1-6 алкила,C1-6 алкилокси, полигалоC1-6 алкилокси, карбоксила, C1-6 алкилоксикарбонила, аминокарбонила, морфолинила и моно- или ди(C1-6 алкил)аминокарбонила, и s представляет собой целое число, равное нулю, 1, 2 или 3, могут быть получены по следующей схеме реакций (4): Схема 4 Схема реакций (4) содержит стадию (а), в которой подходящим образом замещенный Ar, в частности подходящим образом замещенный фенил, подвергают взаимодействию по реакции Фриделя-Крафтса с подходящим ацилхлоридом, таким как 3-хлорпропионилхлорид или 4-хлорбутирилхлорид, в присутствии подходящей кислоты Льюиса, такой как, например, AlCl3, FeCl3, SnCl4, TiCl4 или ZnCl2, и подходящего, инертного в условиях реакции растворителя, такого как метиленхлорид или этилендихлорид. Реакцию можно удобно проводить при температуре, находящейся между комнатной температурой и температурой флегмы. На следующей стадии (b) аминогруппу (-NR4R5) вводят взаимодействием промежуточного соединения, полученного на стадии (а), с первичным или вторичным амином. В общем, бактериальные патогены могут быть классифицированы как либо грамположительные,либо грамотрицательные патогены. Антибиотические соединения с активностью против как грамположительных, так и грамотрицательных патогенов обычно рассматривают как имеющие широкий спектр активности. Соединения настоящего изобретения рассматривают как активные против грамположитель-9 010601 ных и/или грамотрицательных бактериальных патогенов. В частности, настоящие соединения являются активными против по меньшей мере одной грамположительной бактерии, предпочтительно против нескольких грамположительных бактерий, более предпочтительно против одной или нескольких грамположительных бактерий и/или одной или нескольких грамотрицательных бактерий. Настоящие соединения обладают бактерицидной или бактериостатической активностью. Примеры грамположительных и грамотрицательных аэробных и анаэробных бактерий включают в себя стафилококки, например S.aureus; энтерококки, например Е.faecalis; стрептококки, напримерS.pneumoniae, S.mutans, S.pyogens; бациллы, например Bacillus subtilis; Listeria, например Listeria monocytogenes; гемофильные бактерии, например Н.influenza; Moraxella, например М.catarrhalis; Pseudomonas,например Pseudomonas aeruginosa; и Escherichia, например Е.coli. Грамположительные патогены, например стафилококки, энтерококки и стрептококки, являются особенно важными вследствие развития резистентных штаммов, которые как трудно лечить, так и трудно ликвидировать, например, из окружающей среды больниц после их обнаружения. Примерами таких штаммов являются резистентные к метициллину Staphylococcus aureus (MRSA), резистентные к метициллину, негативные по коагулазе стафилококки(MRCNS), резистентные к пенициллину Streptococcus pneumoniae и резистентные ко многим лекарственным средствам Enterococcus faecium. Соединения настоящего изобретения проявляют также активность против резистентных бактериальных штаммов. Соединения настоящего изобретения являются особенно активными против Staphylococcus aureus,включая резистентные Staphylococcus aureus, такие как, например, резистентные к метициллину Staphylococcus aureus (MRSA) и Streptococcus pneumoniae. В частности, соединения настоящего изобретения являются активными в отношении тех бактерий,жизнеспособность которых зависит от правильной деятельности АТФ-синтазы F1F0. Без связи с какойлибо теорией считают, что активность настоящих соединений заключается в ингибировании АТФсинтазы F1F0, в частности ингибировании F0-комплекса АТФ-синтазы F1F0, более определенно ингибировании субъединицы с F0-комплекса АТФ-синтазы F1F0, приводящем к уничтожению бактерий посредством истощения клеточных уровней АТФ бактерий. Всякий раз, когда в тексте здесь до или после, указывается, что соединения могут лечить бактериальное инфекционное заболевание, это означает, что соединения могут лечить инфекционное заболевание с одним или несколькими бактериальными штаммами. Всякий раз, когда указывается здесь до или после, что бактериальная инфекция является другой,чем микобактериальная инфекция, это означает, что бактериальная инфекция является другой, чем инфекция с одним или несколькими микобактериями. Точная дозировка и частота введения настоящих соединений зависит от конкретного применяемого соединения формулы (I), конкретного подвергаемого лечению состояния, серьезности подвергаемого лечению состояния, возраста, массы, пола, питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другой лекарственной терапии, которую может принимать индивидуум, что хорошо известно специалисту в данной области. Кроме того, очевидно, что эффективное суточное количество может быть понижено или повышено в зависимости от ответной реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача, прописывающего соединения настоящего изобретения. Соединение настоящего изобретения может быть введено в фармацевтически приемлемой форме,необязательно в фармацевтически приемлемом носителе. Соединения и композиции, содержащие эти соединения, могут быть введены такими путями, как местные, локальные или системные пути введения. Системное применение включает в себя любой способ введения соединения в ткани тела, например, подоболочечное, эпидуральное, внутримышечное, чрескожное, внутривенное, внутрибрюшинное, подкожное, сублингвальное, ректальное и пероральное введение. Если необходимо, можно регулировать конкретную дозу антибактериального средства, которое нужно ввести, а также продолжительность лечения. Бактериальные инфекции, которые можно лечить настоящими соединениями, включают в себя, например, инфекции центральной нервной системы, инфекции наружного уха, инфекции среднего уха, такие как острое воспаление среднего уха, инфекции краниальных синусов, глазные инфекции, инфекции полости рта, такие как инфекции зубов, десен и слизистой оболочки, инфекции верхних дыхательных путей, инфекции нижних дыхательных путей, мочеполовые инфекции, желудочно-кишечные инфекции,гинекологические инфекции, сепсис, костные и хрящевые инфекции, инфекции кожи и кожной структуры, бактериальный эндокардит, ожоги, антибактериальная профилактика в хирургии и антибактериальная профилактика у иммунодепрессивных пациентов, таких как пациенты, получающие противораковую химиотерапию, или пациенты с трансплантацией органов. При наличии того факта, что соединения формулы (I) являются активными против грамположительных и/или грамотрицательных бактерий, настоящие соединения могут быть комбинированы с другими антибактериальными агентами, чтобы эффективно бороться с бактериальными инфекциями. Таким образом, настоящее изобретение относится также к комбинации (а) соединения формулы (I) и (b) одного или нескольких других антибактериальных агентов при условии, что один или несколько- 10010601 других антибактериальных агентов являются другими, чем антимикобактериальные агенты. Настоящее изобретение относится также к комбинации (а) соединения формулы (I) и (b) одного или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты, для использования в качестве лекарственного средства. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения формулы (I) и (b) одного или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты, также включена в настоящее изобретение. Настоящее изобретение относится также к применению комбинации или фармацевтической композиции, как указано выше, для лечения бактериальной инфекции. Настоящая фармацевтическая композиция может иметь различные фармацевтические формы для целей введения. В качестве подходящих композиций здесь могут быть названы все композиции, обычно используемые для вводимых системно лекарственных средств. Для получения фармацевтических композиций данного изобретения эффективное количество конкретных соединений, необязательно в форме аддитивной соли, в качестве активного ингредиента смешивают с образованием тесной смеси с фармацевтически приемлемым носителем, причем носитель может иметь различные формы в зависимости от формы препарата, требуемой для введения. Эти фармацевтические композиции являются желательными в единичной лекарственной форме, подходящей, в частности, для введения перорально или парентеральной инъекцией. Например, при получении композиции в пероральной лекарственной форме может быть использована любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла,спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения таблетки и капсулы представляют собой наиболее подходящие пероральные единичные лекарственные формы, в этом случае, несомненно, применяют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду по меньшей мере в большей части, хотя могут быть включены другие ингредиенты, например, для содействия растворимости. Например, могут быть получены инъецируемые растворы, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Могут быть получены также инъецируемые суспензии, в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и т.п. Включены также препараты в твердой форме, которые предназначаются для превращения, незадолго до использования, в препараты в жидкой форме. В зависимости от способа введения фармацевтическая композиция будет предпочтительно содержать от 0,05 до 99 мас.%, более предпочтительно от 0,1 до 70 мас.% активного ингредиента и от 1 до 99,95 мас.%, более предпочтительно от 30 до 99,9 мас.% фармацевтически приемлемого носителя, причем все проценты основаны на общей массе композиции. Отношение масса к массе (а) соединения формулы (I) и (b) другого антибактериального агента(ов),когда их дают в комбинации, может быть определено специалистом в данной области. Указанное отношение и точная дозировка и частота введения зависит от конкретного соединения формулы (I) и другого используемого антибактериального агента(ов), конкретного, подвергаемого лечению состояния, тяжести подвергаемого лечению состояния, возраста, массы, пола, питания, времени введения и общего физического состояния конкретного пациента, способа введения, а также другой лекарственной терапии, которую может принимать индивидуум, что хорошо известно специалисту в данной области. Кроме того,очевидно, что эффективное суточное количество может быть понижено или повышено в зависимости от ответной реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача, прописывающего соединения настоящего изобретения. Соединения формулы (I) и один или несколько других антибактериальных агентов могут быть скомбинированы в виде одного препарата или могут быть изготовлены в виде отдельных препаратов, так чтобы их можно было вводить одновременно, по отдельности или последовательно. Таким образом, настоящее изобретение относится также к продукту, содержащему (а) соединение формулы (I) и (b) один или несколько других антибактериальных агентов, при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты, в виде комбинированного препарата для одновременного, раздельного или последовательного применения при лечении бактериальной инфекции. Фармацевтическая композиция может дополнительно содержать различные другие ингредиенты,известные в данной области, например лубрикант, стабилизирующий агент, буферный агент, эмульгирующий агент, регулирующий вязкость агент, поверхностно-активное вещество, консервант, корригент или краситель. Особенно подходящим является изготовление вышеуказанных фармацевтических композиций в единичной дозированной форме для легкости введения и однородности дозы. Единичная дозированная- 11010601 форма, используемая здесь, относится к физически дискретным единицам, подходящим в качестве единичных доз, причем каждая единица содержит заданное количество активного ингредиента, определенное для того, чтобы вызвать требуемое терапевтическое действие в ассоциации с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (в том числе таблетки с насечками или покрытиями), капсулы, пилюли, пакетики с порошками, облатки, суппозитории, инъецируемые растворы или суспензии и т.п. и их сегрегированные многократные дозы. Суточная доза соединения по изобретению будет, конечно, изменяться в зависимости от применяемого соединения, способа введения, требуемого лечения и определенного бактериального заболевания. В данной области известными являются также другие антибактериальные агенты, которые могут быть скомбинированы с соединениями формулы (I). Другие антибактериальные агенты включают в себя антибиотики группы -лактамов, такие как природные пенициллины, полусинтетические пенициллины,природные цефалоспорины, полусинтетические цефалоспорины, цефамицины, 1-оксацефемы, клавулановые кислоты, пенемы, карбапенемы, нокардицины, монобактамы; тетрациклины, ангидротетрациклины, антрациклины; аминогликозиды; нуклеозиды, такие как N-нуклеозиды, C-нуклеозиды, карбоциклические нуклеозиды, бластицидин S; макролиды, такие как макролиды с 12-членным кольцом, макролиды с 14-членным кольцом, макролиды с 16-членным кольцом; ансамицины; пептиды, такие как блеомицин,грамицидины, полимиксины, бацитрацины, пептидные антибиотики с большим кольцом, содержащие лактонные связи, актиномицины, амфомицин, капреомицин, дистамицин, эндурацидины, микамицин,неокарциностатин, стендомицин, биомицин, виргиниамицин; циклогексимид; циклосерин; вариотин; саркомицин A; новобиоцин; гризеофульвин; хлорамфеникол; митомицины; фумагиллин; монензины; пирролнитрин; фосфомицин; фузидовая кислота; D-(п-гидроксифенил)глицин; D-фенилглицин; энедиины. Конкретными антибиотиками, которые могут быть скомбинированы с настоящими соединениями формулы (I), являются, например, бензилпенициллин (калий, прокаин, бензатин), феноксиметилпенициллин (калий), фенетициллин калий, пропициллин, карбенициллин (динатрий, фенилнатрий, инданилнатрий), сульбенициллин, тикарциллин динатрий, метициллин натрий, оксациллин натрий, клоксациллин натрий, диклоксациллин, флуклоксациллин, ампициллин, мезлоциллин, пиперациллин натрий, амоксициллин, циклациллин, гектациллин, сулбактам натрий, талампициллина гидрохлорид, бакампициллина гидрохлорид, пивмециллинам, цифалексин, цефаклор, цефалоглицин, цефадроксил, цефрадин, цефроксадин, цефапирин натрий, цефалотин натрий, цефацетрил натрий, цефсулодин натрий, цефалоридин, цефатризин, цефоперазон натрий, цефамандол, вефотиама гидрохлорид, цефазолин натрий, цефтризоксим натрий, цефотаксим натрий, цефменоксида гидрохлорид, цефуроксим, цефтриаксон натрий, цефтазидим,цефокситин, цефметазол, цефотетан, латамоксеф, клавулановая кислота, имипенем, аэтреонам, тетрациклин, хлортетрациклина гидрохлорид, диметилхлортетрациклин, окситетрациклин, метациклин, доксициклин, ролитетрациклин, миноциклин, даунорубицина гидрохлорид, доксорубицин, акларубицин, канамицина сульфат, беканамицин, тобрамицин, гентамицина сульфат, дибекацин, амикацин, микрономицин, рибостамицин, неомицина сульфат, паромомицина сульфат, стрептомицина сульфат, дигидрострептомицин, дестомицин A, гигромицин B, апрамицин, сизомицин, нетилмицина сульфат, спектиномицина гидрохлорид, астромицина сульфат, валидамицин, касугамицин, полиоксин, бластицидин S, эритромицин, эритромицина эстолат, олеандомицина фосфат, триацетилолеандомицин, китазамицин, жозамицин,спирамицин, тилозин, ивермектин, мидекамицин, блеомицина сульфат, пепломицина сульфат, грамицидин S, полимиксин B, бацитрацин, колистина сульфат, колистинметансульфонат натрия, энрамицин, микамицин, виргиниамицин, капреомицина сульфат, биомицин, энвиомицин, ванкомицин, актиномицин D,неокарциностатин, бестатин, пепстатин, монензин, лазалоцид, салиномицин, амфотерицин B, нистатин,натамицин, трихомицин, митрамицин, линкомицин, клиндамицин, клиндамицина пальмитат гидрохлорид, флавофосфолипол, циклосерин, пецилоцин, гризеофульвин, хлорамфеникол, хлорамфеникола пальмитат, митомицин C, пирролнитрин, фосфомицин, фузидовая кислота, бикозамицин, тиамулин, сикканин. В табл. 1-4 перечислены соединения формулы (I) по настоящему изобретению. Абсолютная стереохимическая конфигурация стереогенного атома углерода(ов) некоторых соединений экспериментально не была определена. В некоторых случаях стереохимически изомерную форму,которую выделили первой, обозначают как "A", а вторую как "B" без дополнительного отнесения к действительной стереохимической конфигурации. Однако указанные изомерные формы "A" и "B" могут быть однозначно охарактеризованы специалистом в данной области с использованием известных в данной области способов, например дифракцией рентгеновских лучей. В случае, когда "A" и "В" являются стереоизомерными смесями, их можно затем разделить, посредством чего выделенную соответствующую первую фракцию обозначают "А 1", соответственно "В 1", и вторую как "A2", соответственно "B2", без дополнительного отнесения к действительной стереохимической конфигурации. Однако указанные изомерные формы "A1, A2" и "B1, B2" могут быть однозначно охарактеризованы специалистом в данной области с использованием известных в данной области способов, например дифракцией рентгеновских лучей.- 12010601 Настоящие соединения пронумерованы в соответствии с соединениями WO 2004/011436 и могут быть получены по способам, описанным в WO 2004/011436. Номера примеров в нижеследующих таблицах относится к номерам примеров WO 2004/011436, которые соответственно указывают, какой процедурой соединения могут быть получены. Дополнительные соединения указаны при помощи букв. Соединения A, B и C получали по процедурам, описанным в WO 2004/011436. Схема, приведенная ниже, указывает путь синтеза соединения A, B и C. Номера примеров A8, A9, B12 и B13 соответствуют процедурам WO 2004/011436 Соединение C, которое является диастереоизомером (B), выделяли из смеси диастереоизомеров следующим образом. Остаток (5,4 г), полученный по процедуре B12, очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/циклогексан, 60/40). Собирали две фракции и растворитель выпаривали. Вторую фракцию кристаллизовали из диизопропилового эфира, получая при этом 0,83 г соединения C (диастереоизомер B) (выход: 13%). Соединение A, которое является диастереоизомером B, и соединение B, которое является диастереоизомером (А), выделяли из смеси диастереоизомеров следующим образом. Остаток (1,7 г), полученный по процедуре примера B13, очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH/NH4OH, 98/2/0,1). Собирали две фракции и растворитель выпаривали. Фракции кристаллизовали по отдельности из диизопропилового эфира, получая при этом 0,31 г соединения B (диастереоизомер A) (выход: 27%) и 0,52 г соединения A (диастереоизомер B) (выход: 45%). Соединение D получают по процедурам, описанным в WO 2004/011436. Схема ниже указывает путь синтеза соединения D. Номера примеров A9, B12 и B13 соответствуют процедурам WO 2004/011436 Соединение D, которое является диастереоизомером (В), выделяли из смеси диастереомеров следующим образом. Остаток (1,2 г), полученный по процедуре примера B13, очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 95/5/0,5). Собирали две фракции и растворитель выпаривали. Вторую фракцию кристаллизовали из диизопропилового эфира, получая при этом 0,08 г соединенияD (диастереоизомер B) (выход: 10%). Соединения E и F получали разделением соединения 4 (диастереоизомер B) WO 2004/011436 на его энантиомеры следующей процедурой.- 13010601 Конечное соединение 4 (2,5 г) разделяли на его энантиомеры колоночной хроматографией (элюент: гексан/этанол, 99,95/0,05; колонка: CHIRACEL OD). Собирали две чистые фракции и их растворители выпаривали. Выход: 0,5 г соединения E (энантиомер B1) (т.пл. 180C) и 0,12 г соединения F (энантиомер B2)(т.пл. 175C). Соединение G получают следующим образом. Смесь соединения 115 (получено в соответствии с B15 WO 2004/011436) (0,00028 моль), циклического эфира 1,3-пропандиола и пиридин-3-бороновой кислоты (0,00055 моль), Pd[P(Ph3)]4 (0,00003 моль) и 2 М Na2CO3 (0,0011 моль) в диметоксиэтане (4 мл) перемешивают при 90C в течение 1,5 ч, затем выливают в Н 2 О и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH, 95/5; 5 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 0,09 г соединения G (60%) (т.пл. 201C). Соединение H получают следующим образом. Смесь соединения 15 (получено по B7 WO 2004/011436) (0,0009 моль), 2-фуранбороновой кислоты(0,0018 моль), Pd[P(Ph3)]4 (0,00009 моль) и 2 М Na2CO3 (0,0036 моль) в диметоксиэтане (10 мл) перемешивают при 90C в течение 6 ч, затем выливают в Н 2 О и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток (0,57 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 99/1/0,1; 10 мкм). Чистые фракции собирают и растворитель выпаривают, получая при этом 0,23 г остатка. Эту фракцию кристаллизуют из смеси диизопропиловый эфир/ацетонитрил. Осадок отфильтровывают и сушат. Выход: 0,071 г соединения Н (15%) (т.пл. 215C). Соединения I получали по процедурам, описанным в WO 2004/011436. Приведенная ниже схема указывает путь синтеза соединения J. Номера примеров A10 и B1 соответствуют процедурам WO 2004/011436 Смесь коммерчески доступного 5-ацетил-1,2-дигидроаценафтилена (0,0407 моль) и гидрохлорида диметиламина (0,0858 моль) в параформальдегиде (37% в воде, 4 мл), HCl/iPrOH (1 мл) и этаноле(100 мл) перемешивают и кипятят с обратным холодильником в течение 48 ч. Растворитель выпаривают. Остаток растворяют в смеси H2O/3 н. HCl/CH2Cl2. Водный слой подщелачивают и экстрагируют CH2Cl2. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают. Остаток очищают колоночной хроматографией на силикагеле (элюент: CH2C12/CH3OH/NH4OH, 95/5/0,2; 15-40 мкм). Чистые фракции собирают и растворитель выпаривают. Выход: 4,9 г промежуточного соединения J (48%). 1,6 М H-BuLi (0,0102 моль) добавляют по каплям при -20C к раствору диизопропиламина(0,0091 моль) в тетрагидрофуране (15 мл) в потоке N2. Смесь перемешивают при -20C в течение 20 мин,затем охлаждают до -70C. По каплям добавляют раствор промежуточного соединения 3 (0,0091 моль) в тетрагидрофуране (10 мл). Смесь перемешивают при -70C в течение 2 ч. По каплям добавляют раствор промежуточного соединения J (0,01 моль) в тетрагидрофуране (20 мл). Смесь перемешивают при -70C в течение 3 ч, выливают в ледяную воду и экстрагируют EtOAc. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают. Остаток (6,5 г) очищают колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH/NH4OH, 99/1/0,2; 15-40 мкм). Собирают две фракции и растворитель выпаривают. Выход: 0,96 г F1, 0,72 г F2. F1 кристаллизуют из диэтилового эфира. Осадок фильтруют и сушат. Выход: 0,87 г соединения J (17%). Аналитические способы. Массу некоторых соединений регистрировали ЖХ-МС (жидкостная хроматография-массспектрометрия). Используемый способ описывается ниже. Данные собраны в табл. 5. Способ ЖХ-МС. Анализ ЖХ-МС проводили (ионизация электрораспылением положительных ионов, режим сканирования от 100 до 900 атомных единиц массы) на колонке Kromasil C18 (Interchim, Montlucon, FR; 5 мкм,4,6150 мм) со скоростью потока 1 мл/мин. Две подвижные фазы (подвижная фаза A: 30% 6,5 мМ ацетата аммония + 40% ацетонитрила + 30% муравьиной кислоты (2 мл/л); подвижная фаза B: 100% ацетонитрила) использовали для установления градиентного условия от 100% A в течение 1 мин до 100% B за 4 мин, 100% B в течение 5 мин до 100% A за 3 мин и снова установления равновесия со 100% A в течение 2 мин. Таблица 5 Молекулярный пик по ЖХ-МС Фармакологические примеры. Получение бактериальных суспензий для испытания на чувствительность. Бактерии, используемые в данном исследовании, выращивали на протяжении ночи в колбах, со- 18010601 держащих 100 мл бульона Mueller-Hinton (Becton Dickinson - каталожный 275730) в стерильной деионизированной воде, с встряхиванием при 37C. Исходные растворы (0,5 мл/пробирку) сохраняли при-70C перед использованием. Титрования бактерий проводили в титрационных микропланшетах для определения TCID50, где TCID50 представляет собой разведение, которое вызывает бактериальный рост в 50% инокулированных культур. В общем, уровень посевного разведения приблизительно 100 TCID50 использовали для испытаний на чувствительность. Испытание на антибактериальную чувствительность: определение IC90. Анализ в титрационных микропланшетах. Стерильные 96-луночные пластиковые микротитрационные планшеты с плоским дном заполняли 180 мкл стерильной деионизированной воды, дополненной 0,25% BSA. Затем исходные растворы(7,8 конечная концентрация испытания) соединений добавляли в объемах 45 мкл в столбец 2 планшета. Серийные пятикратные разведения (45 мкл в 180 мкл) проводили непосредственно в микротитрационных планшетах от столбца 2 до достижения столбца 11. Необработанные контрольные образцы с посевным материалом (столбец 1) и без него (столбец 12) включали в каждый микротитрационный планшет. В зависимости от типа бактерий приблизительно 10-60 CFU на лунку посевных бактерий (100 TCID50) в объеме 100 мкл в 2,8x среды бульона Mueller-Hinton добавляли в ряды от A до H, за исключением столбца 12. Такой же объем среды бульона без посевного материала добавляли к столбцу 12 в ряды от A до H. Культуры инкубировали при 37C в течение 24 ч при нормальной атмосфере (инкубатор с открытым для воздуха клапаном и непрерывной вентиляцией). В конце инкубации на следующий день после инокуляции рост бактерий количественно определяли флуорометрическим методом. Поэтому добавляли ресазурин (0,6 мг/мл) в объеме 20 мкл ко всем лункам через 3 ч после инокуляции и планшеты снова инкубировали на протяжении ночи. Изменение цвета от синего до розового указывает на рост бактерий. Флуоресценцию считывали в контролируемом компьютером флурометре (Cytofluor Biosearch) при длине волны возбуждения 530 нм и длине волны эмиссии 590 нм. Ингибирование роста в %, достигнутое соединениями, вычисляли по стандартным методам. IC90 (выражали в мкг/мл) определяли как 90% ингибиторную концентрацию для роста бактерий. Результаты показаны в табл. 6. Способ разведения в агаре. Величины MIC99 (минимальная концентрация для получения 99% ингибирования бактериального роста) могут быть определены проведением стандартного способа разведения в агаре по стандартамNCCLS, в которых используемая среда включает в себя агар Mueller-Hinton (Clinical laboratory standardinstitute. 2005). Методы для испытаний на антимикробную чувствительность при разведении для бактерий, которые растут в аэробных условиях: принятый стандарт шестое издание). Анализы на гибель в зависимости от времени. Бактерицидная или бактериостатическая активность соединений может быть определена по анализу на гибель в зависимости от времени с использованием способа микроразведения бульона (Zurenko, G.E.Agents Chemother. 40, 839-845 (1996. В анализе на гибель в зависимости от времени Staphylococcusaureus и резистентного к метициллину S.aureus (MRSA) исходными посевными дозами S.aureus и MRSA является 106 CFU/мл в бульоне Mueller Hinton. Антимикробные соединения используют при концентрации, от 0,1 до 10 раз превышающей MIC (т.е. IC90, определяемую анализом в микротитрационном планшете). Лунки, не получающие антибактериальный агент, образуют контроль роста культуры. Планшеты,содержащие микроорганизм и испытуемые соединения, инкубируют при 37C. После 0, 4, 24 и 48 ч инкубации образцы удаляют для определения содержания жизнеспособных микроорганизмов серийным разведением (от 10-1 до 10-6) в стерильной PBS и высеванием на агаре Mueller Hinton (200 мкл). Планшеты инкубируют при 37C в течение 24 ч и определяют число колоний. Кривые гибели можно построить нанесением log10CFU на мл в зависимости от времени. Бактерицидное действие обычно определяют как 3-1og10 уменьшение числа CFU на мл по сравнению с необработанным посевным материалом. Потенциальный эффект переноса лекарственных средств устраняют серийным разведением и подсчетом колоний при самом большом разведении, используемом для высевания. Определение уровней клеточного АТФ. Для определения изменения общей концентрации клеточного АТФ (с использованием ATP bioluminescence Kit, Roche) анализы проводят культивированием исходной культуры S.aureus (ATCC 29213) в 100 мл колбах Mueller Hinton и инкубированием в шейкер-инкубаторе в течение 24 ч при 37C(300 об/мин). Измеряют OD405 нм и вычисляют CFU/мл. Разводят культуры до 1106 CFU/мл (конечная концентрация для измерения АТФ: 1105 CFU/100 мкл на лунку), добавляют испытуемое соединение в количестве, составляющем 0,1-10 кратное количество MIC (т.е. IC90, определяемая в анализе на микротитрационном планшете). Эти пробирки инкубируют в течение 0, 30 и 60 мин при 300 об/мин при 37C. Используют 0,6 мл бактериальной суспензии из пробирок с защелкиваемыми крышками и добавляют к новым 2 мл пробиркам Эппендорфа. Добавляют 0,6 мл реагента для лизиса клеток (набор Roche), перемешивают с завихрением при максимальной скорости и инкубируют в течение 5 мин при комнатной температуре. Охлаждают на льду. Позволяют люминометру нагреться до 30C (Luminoskan Ascent Labsys- 19010601tems с инжектором). Заполняют один столбец (= 6 лунок) 100 мкл того же образца. Добавляют 100 мкл люциферазного реагента к каждой лунке с использованием системы инжектирования. Измеряют люминесценцию в течение 1 с. Таблица 6 Величины IC90 (мкг/мл), определенные по анализу в микротитрационном планшете(ATCC 25923); STA 29213 означает Staphylococcus aureus (ATCC 29213); STA RMETH означает резистентный к метициллину Staphylococcus aureus (MRSA) (клинический изолят из Университета Антверпена). ATCC означает Американскую коллекцию типовых культур.- 21010601 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения для изготовления лекарственного средства для лечения бактериальной инфекции, причем соединение является соединением формулы его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой, гдеR1 представляет собой водород, галоген, полигалоC1-6 алкил, C1-6 алкил, Ar или Het; р представляет собой целое число, равное 1 или 2;R4 и R5 представляют собой, каждый независимо, водород, C1-6 алкил или бензил илиR4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, 2-пирролинила, 3-пирролинила, пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила,пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом, галогеном,полигалоC1-6 алкилом,гидрокси,гидроксиC1-6 алкилом,C1-6 алкилокси,амино,моноили ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом;R6 представляет собой водород, галоген, полигалоC1-6 алкил, C1-6 алкил, C1-6 алкилокси, C1-6 алкилтио или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-;r представляет собой целое число, равное 1 или 2;Ar представляет собой гомоциклический радикал, выбранный из группы фенила, нафтила, аценафтила, тетрагидронафтила, каждый гомоциклический радикал может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы гидрокси, галогена, циано,нитро, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкила, полигалоC1-6 алкила, гидроксиC1-6 алкила,C1-6 алкилокси, полигалоC1-6 алкилокси, C1-6 алкилоксиC1-6 алкила, карбоксила, C1-6 алкилоксикарбонила,аминокарбонила, морфолинила и моно- или ди(C1-6 алкил)аминокарбонила;Het представляет собой моноциклический гетероцикл,выбранный из группыN-феноксипиперидинила, пиперидинила, пирролила, пиразолила, имидазолила, фуранила, тиенила, оксазолила, изоксазолила, тиазолила, изотиазолила, пиридинила, пиримидинила, пиразинила и пиридазинила; каждый моноциклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6 алкила, полигалоC1-6 алкила,гидроксиC1-6 алкила, C1-6 алкилокси, C1-6 алкилоксиC1-6 алкила или Ar-C(=О)-;Het1 представляет собой бициклический гетероцикл, выбранный из группы хинолинила, хиноксалинила, индолила, бензимидазолила, бензоксазолила, бензизоксазолила, бензотиазолила, бензизотиазолила, бензофуранила, бензотиенила, 2,3-дигидробензо[1,4]диоксинила или бензо[1,3]диоксолила; каждый бициклический гетероцикл может быть необязательно замещен 1, 2 или 3 заместителями, каждый заместитель независимо выбран из группы галогена, гидрокси, C1-6 алкила, полигалоC1-6 алкила,гидроксиC1-6 алкила, C1-6 алкилокси, C1-6 алкилоксиC1-6 алкила или Ar-C(=О)-; при условии, что бактериальная инфекция является другой, чем микобактериальная инфекция. 2. Применение по п.1, где соединение является другим, чем (S,R)-6-бром[2(диметиламино)этил]-2-метокси 1-нафталинфенил-3-хинолинэтанол, его фармацевтически приемлемая кислотно- или основно-аддитивная соль или его N-оксидная форма.- 22010601 3. Применение по п.1 или 2, где соединение формулы (I) является соединением, имеющим следующую формулу: его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой. 4. Применение по любому из предыдущих пунктов, где соединение формулы (I) или (I-а) является соединением, имеющим следующую формулу: его фармацевтически приемлемой кислотно- или основно-аддитивной солью, его стереохимически изомерной или N-оксидной формой. 5. Применение по любому из предыдущих пунктов, где R1 представляет собой водород, галоген, необязательно замещенный фенил или Het. 6. Применение по п.5, где R1 представляет собой водород, галоген или необязательно замещенный фенил. 7. Применение по п.6, где R1 представляет собой галоген. 8. Применение по любому из предыдущих пунктов, где R2 представляет собой C1-6 алкилокси илиC1-6 алкилтио. 9. Применение по любому из предыдущих пунктов, где R3 представляет собой Ar или Het. 10. Применение по любому из пп.1-8, где R3 представляет собой Ar или Het1. 11. Применение по п.9 или 10, где R3 представляет собой Ar. 12. Применение по п.11, где R3 представляет собой необязательно замещенный фенил или необязательно замещенный нафтил. 13. Применение по любому из предыдущих пунктов, где R4 и R5 представляют собой, каждый независимо, водород, C1-6 алкил или бензил. 14. Применение по п.13, где R4 и R5 представляют собой, каждый независимо, водород илиC1-6 алкил. 15. Применение по любому из пп.1-12, где R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролидинила, 2-пирролинила, 3-пирролинила,пирролила, имидазолидинила, пиразолидинила, 2-имидазолинила, 2-пиразолинила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила,триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно,замещено C1-6 алкилом, галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси,амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом. 16. Применение по п.15, где R4 и R5 вместе с атомом N, к которому они присоединены, могут образовывать радикал, выбранный из группы пирролила, имидазолила, пиразолила, триазолила, пиперидинила, пиридинила, пиперазинила, пиридазинила, пиримидинила, пиразинила, триазинила, морфолинила и тиоморфолинила, каждое из указанных колец может быть, необязательно, замещено C1-6 алкилом,галогеном, полигалоC1-6 алкилом, гидрокси, гидроксиC1-6 алкилом, C1-6 алкилокси, амино, моно- или ди(C1-6 алкил)амино, C1-6 алкилтио, C1-6 алкилоксиC1-6 алкилом, C1-6 алкилтиоC1-6 алкилом или пиримидинилом. 17. Применение по любому из предыдущих пунктов, где R6 представляет собой водород, галоген,полигалоC1-6 алкил, C1-6 алкил или два вицинальных радикала R6 взяты вместе с образованием двухвалентного радикала формулы -CH=CH-CH=CH-. 18. Применение по п.17, где R6 представляет собой водород или галоген.- 23010601 19. Применение по любому из предыдущих пунктов, где R7 представляет собой водород. 20. Применение по любому из предыдущих пунктов, где r представляет собой целое число, равное 1. 21. Применение по любому из предыдущих пунктов, где p представляет собой целое число, равное 1. 22. Применение по п.1, при условии, что, когда один R1 представляет собой C1-6 алкил, тогда p представляет собой целое число, равное 2, и другой заместитель R1 выбран из галогена, полигалоC1-6 алкила,C1-6 алкила, Ar или Het. 23. Применение по любому из предыдущих пунктов, где бактериальная инфекция является инфекцией, вызванной грамположительной бактерией. 24. Применение по п.1, где R1 представляет собой водород; C1-6 алкил; галоген; фенил; фуранил, необязательно замещенный гидроксиC1-6 алкилом; или пиридил; R2 представляет собой C1-6 алкилокси;C1-6 алкилом; пиперазинила, замещенного пиримидинилом; пиперидинила; тиоморфолинила; морфолинила; пирролидинила или триазолила; R6 представляет собой водород; галоген; C1-6 алкил или два вицинальных радикала R6 могут быть взяты вместе с образованием двухвалентного радикала формулы-CH=CH-CH=CH-; R7 представляет собой водород. 25. Применение по п.1, где соединение формулы (I) выбрано из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы. 26. Применение по п.1, где соединение формулы (I) выбрано из- 24010601 его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы. 27. Применение по п.1, где соединение формулы (I) выбрано из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы. 28. Комбинация (a) соединения формулы (I) по любому из пп.1-27 и (b) одного или нескольких других антибактериальных агентов для лечения бактериальной инфекции при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты. 29. Фармацевтическая композиция для лечения бактериальной инфекции, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество (а) соединения формулы (I) по любому из пп.1-27 и (b) одного или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты. 30. Применение комбинации по п.28 для лечения бактериальной инфекции. 31. Применение фармацевтической композиции по п.29 для лечения бактериальной инфекции. 32. Продукт для лечения бактериальной инфекции, содержащий (а) соединение формулы (I) по любому из пп.1-27 и (b) один или нескольких других антибактериальных агентов при условии, что один или несколько других антибактериальных агентов являются другими, чем антимикобактериальные агенты, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования при лечении бактериальной инфекции. 33. Соединение, выбранное из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы. 34. Соединение, выбранное из его фармацевтически приемлемой кислотно- или основно-аддитивной соли или его N-оксидной формы. 35. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную со стафилококками, энтерококками или стрептококками. 36. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с резистентными к метициллину Staphylococcus aureus (MRSA), резистентными к метициллину, негативными по коагулазе стафилококкам (MRCNS), резистентными к пенициллинуStreptococcus pneumoniae или резистентными ко многим лекарственным средствам Enterococcus faecium. 37. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с Staphylococcus aureus или Streptococcus pneumoniae. 38. Применение по любому из пп.1-27, 30 и 31, где бактериальная инфекция представляет собой инфекцию, связанную с Staphylococcus aureus.
МПК / Метки
МПК: C07D 405/06, C07D 413/06, A61K 31/4709, C07D 409/06, C07D 405/04, C07D 215/26, C07D 417/06, C07D 401/12, C07D 401/04, C07D 401/06, A61K 31/47
Метки: качестве, производные, антибактериальных, хинолина, агентов
Код ссылки
<a href="https://eas.patents.su/27-10601-proizvodnye-hinolina-v-kachestve-antibakterialnyh-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные хинолина в качестве антибактериальных агентов</a>
Предыдущий патент: Производство диоксида титана
Следующий патент: Система связи с функцией надзора, предназначенная для абонентов с ограниченной свободой совершения вызовов
Случайный патент: Комбинации для лечения заболеваний, связанных с клеточной пролиферацией, миграцией или апоптозом клеток миеломы или с ангиогенезом












