Соли и полиморфы сульфамидных ингибиторов ns3
Формула / Реферат
1. Гидрохлоридная соль (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного.
2. Полугидрохлоридная соль (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного.
3. Метансульфонатная соль (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного.
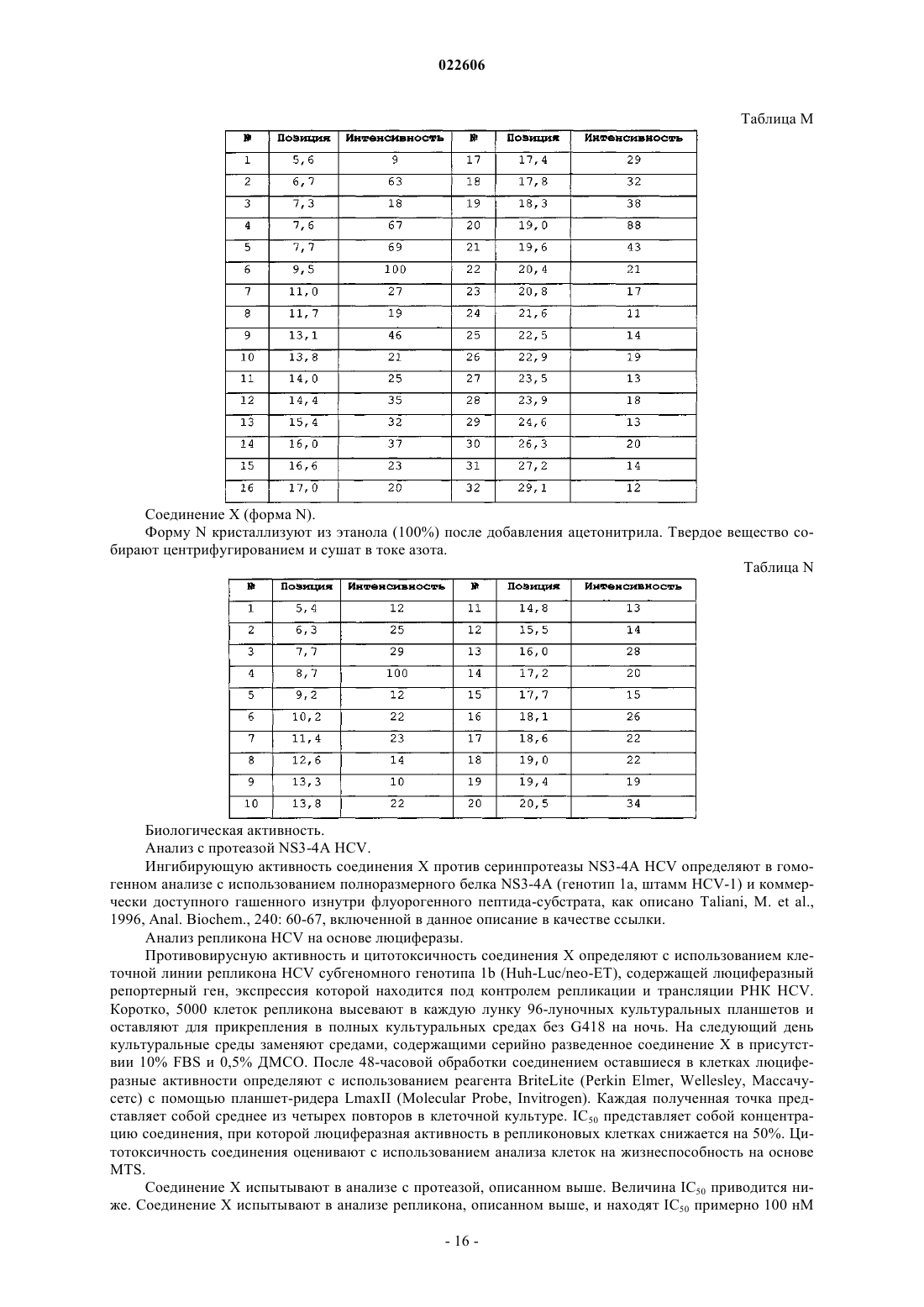
4. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма А), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 7,7, 8,9, 11,8, 15,5 и 18,0.
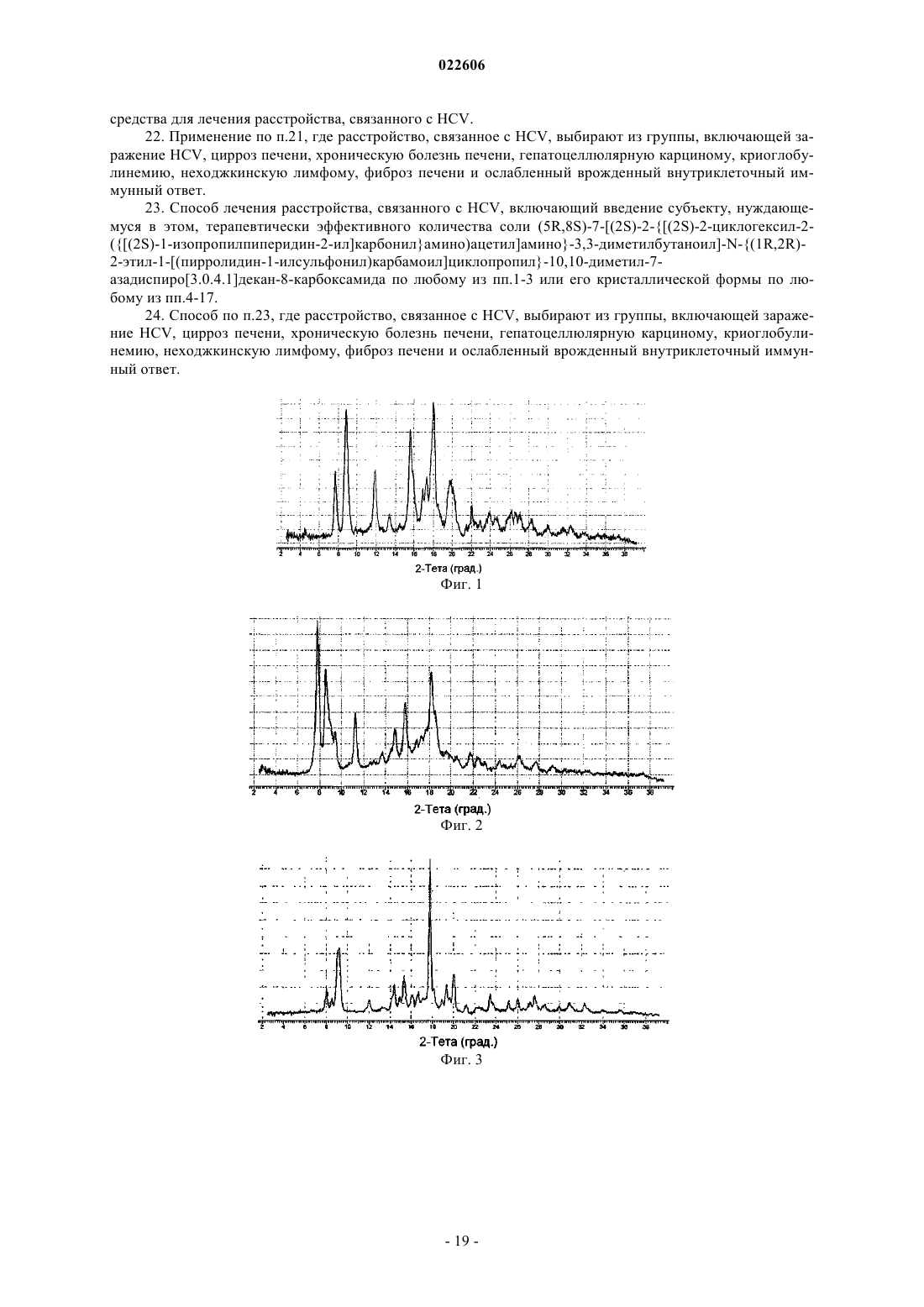
5. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма В), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 7,8, 8,6, 11,3, 15,8 и 18,2.
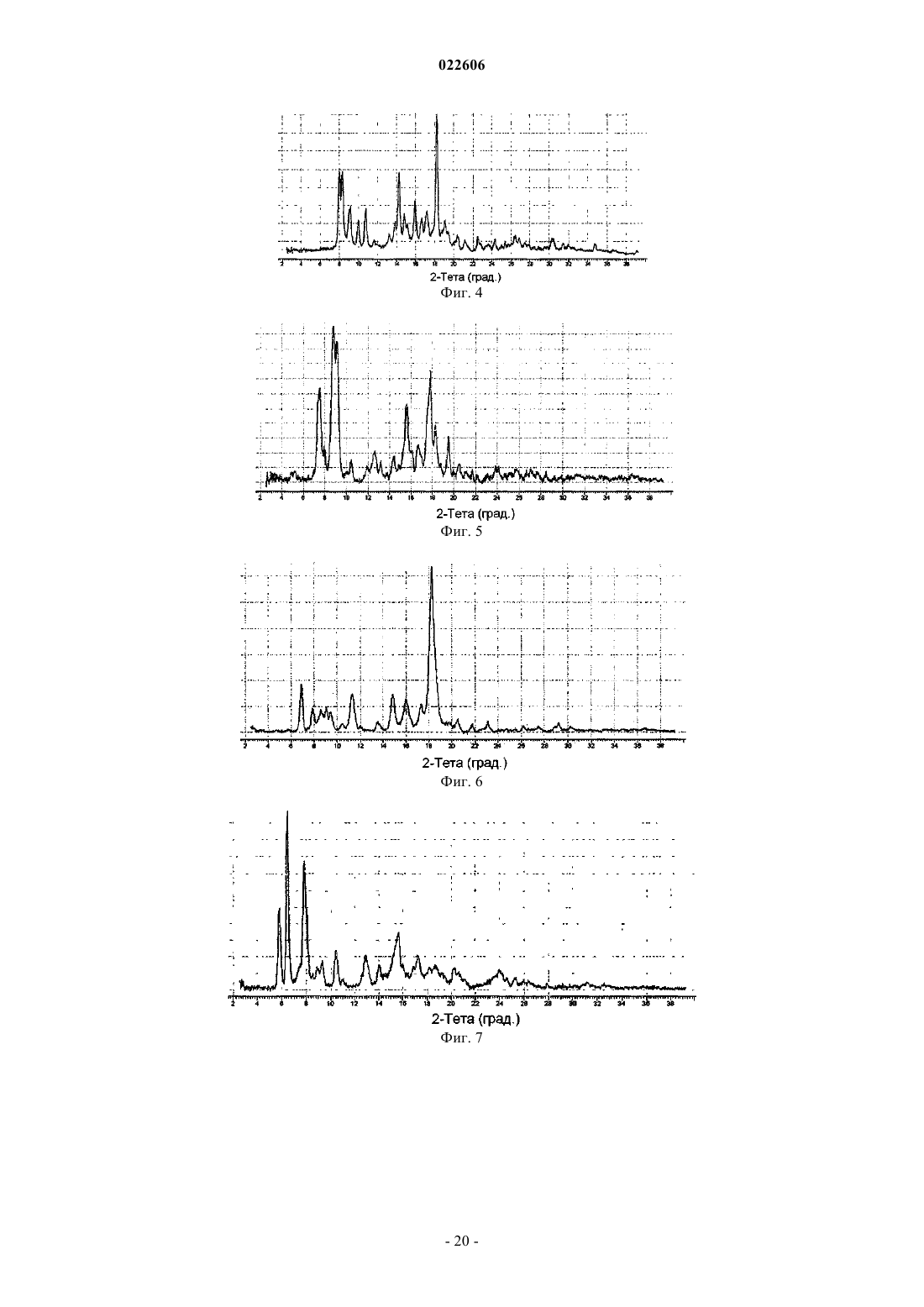
6. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма С), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 9,2, 14,4, 15,3, 17,7 и 20,0.
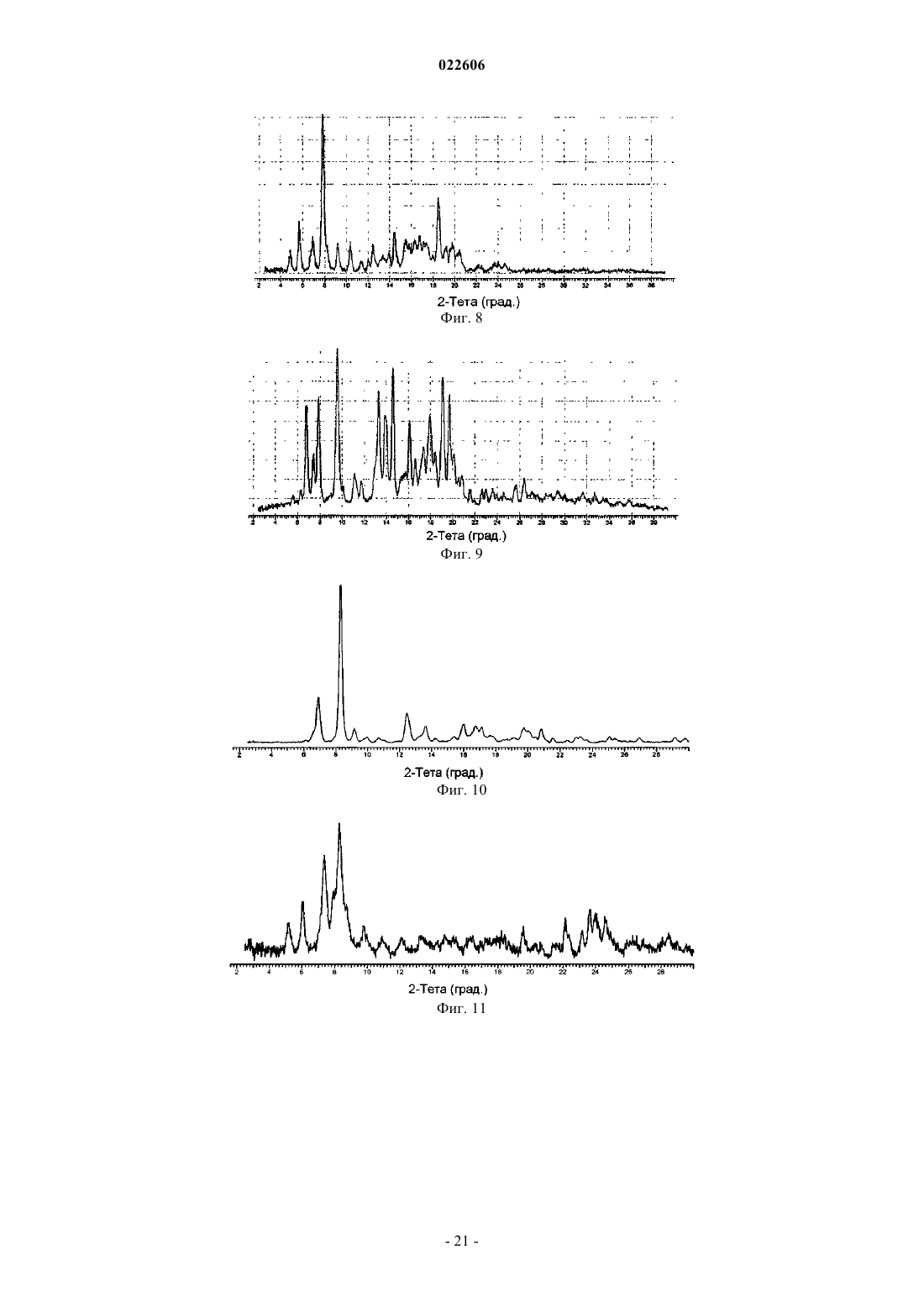
7. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма D), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 8,0, 8,3, 14,3, 15,9 и 18,2.
8. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма Е), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 7,5, 8,8, 9,2, 15,6 и 17,8.
9. Кристаллическая форма полугидрохлоридной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма F), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 6,9, 11,3, 14,8, 16,0 и 18,2.
10. Кристаллическая форма метансульфонатной соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма G), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 5,8, 6,5, 7,8, 10,4 и 15,7.
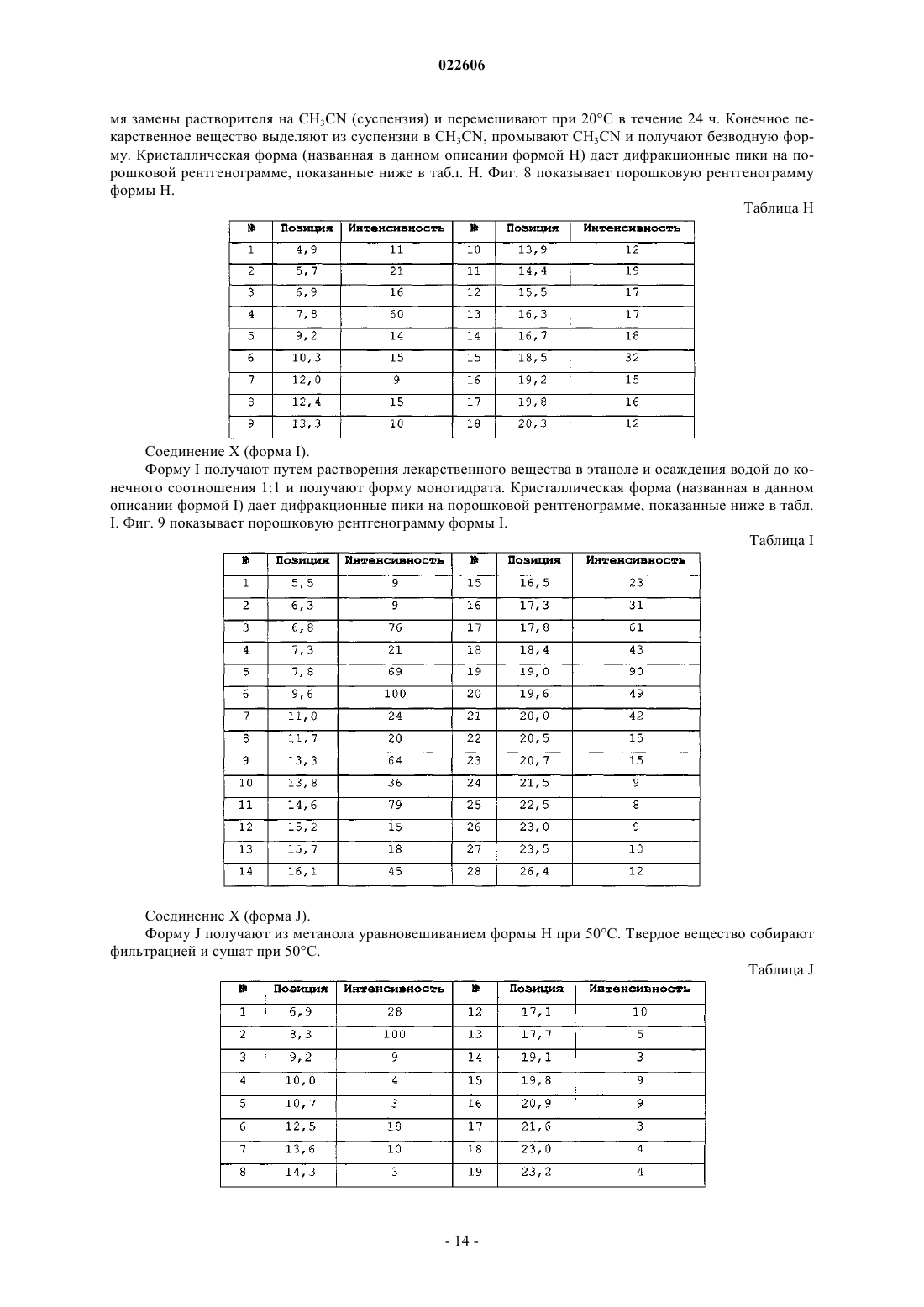
11. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма Н), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 5,7, 6,9, 7,8, 14,4 и 18,5.
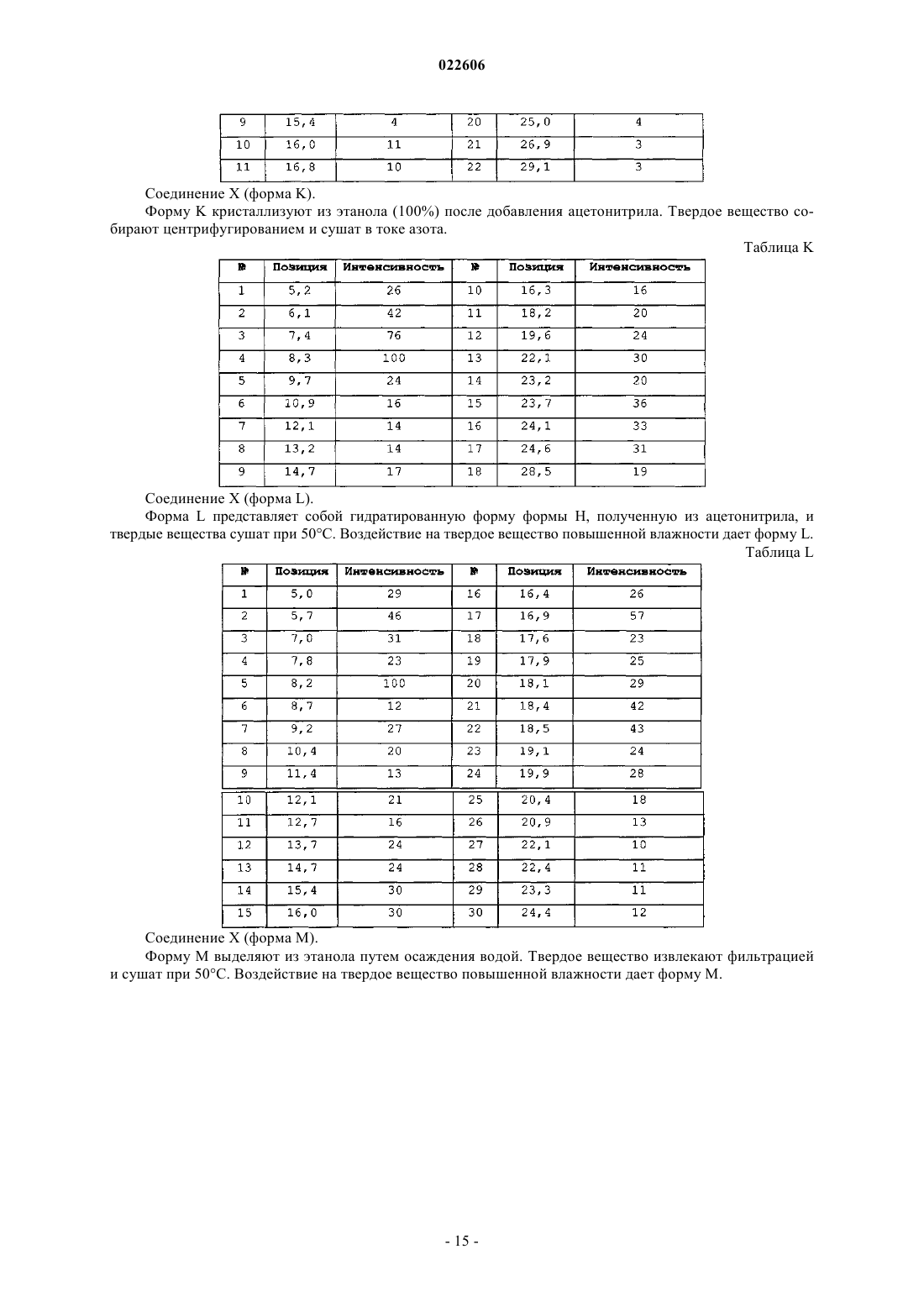
12. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма I), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 9,5, 13,3, 14,5, 19,0 и 19,7.
13. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма J), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 6,9, 8,3, 12,5, 13,6, 16,0, 16,8 и 17,1.
14. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма K), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 6,1, 7,4, 8,3, 22,1, 23,7, 24,1 и 24,6.
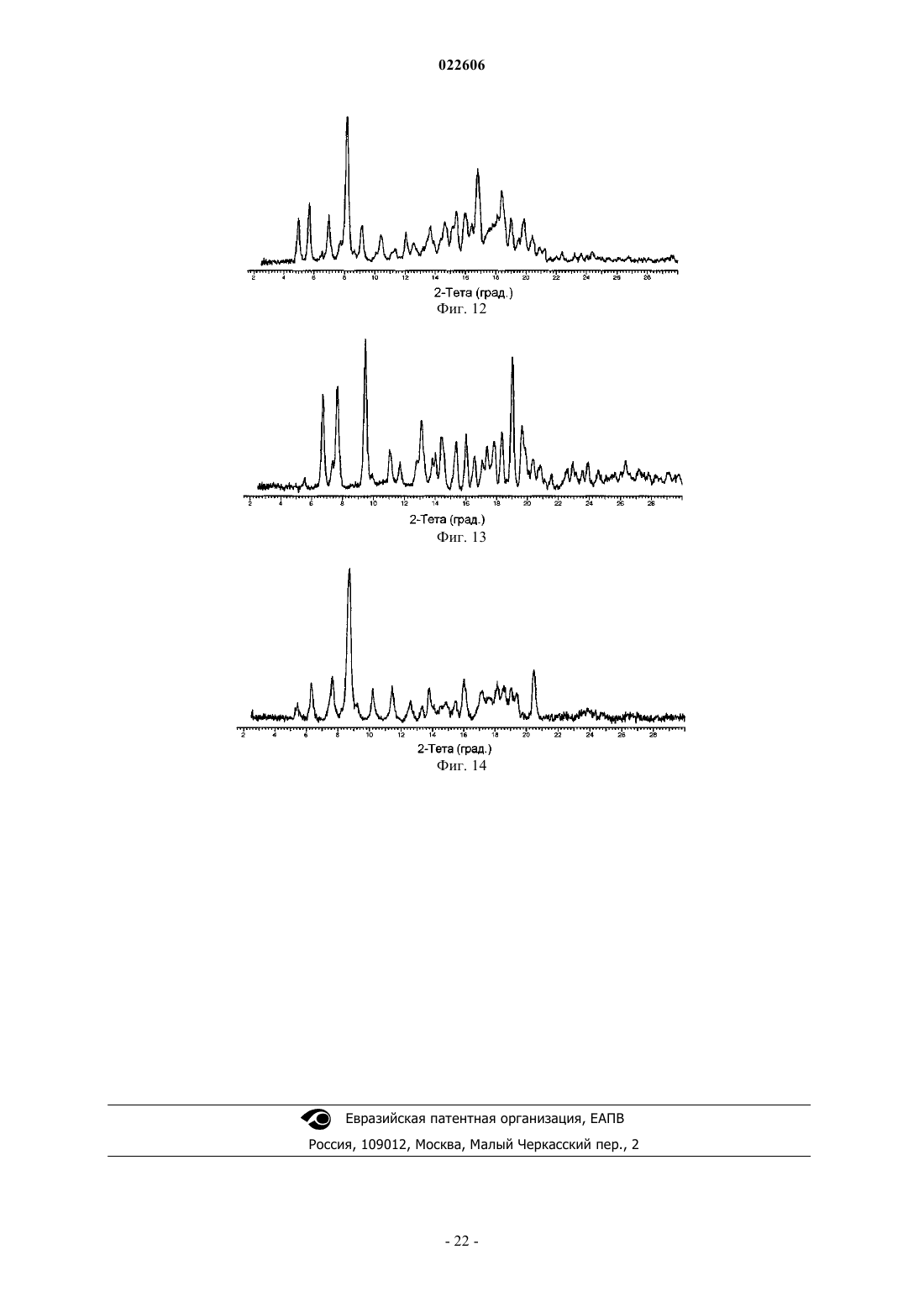
15. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма L), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 5,7, 8,2, 16,9, 18,4 и 18,5.
16. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма М), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 6,7, 7,6, 7,7, 9,5 и 19,0.
17. Кристаллическая форма (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма N), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2θ): 6,3, 7,7, 8,7, 16,0, 18,1 и 20,5.
18. Фармацевтическая композиция для лечения расстройства, связанного с HCV, включающая соль (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллическую форму по любому из пп.4-17 в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем.
19. Применение соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17 для лечения расстройства, связанного с HCV.
20. Применение по п.19, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ.
21. Применение соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17 для получения лекарственного средства для лечения расстройства, связанного с HCV.
22. Применение по п.21, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ.
23. Способ лечения расстройства, связанного с HCV, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соли (5R,8S)-7-[(2S)-2-{[(2S)-2-циклогексил-2-({[(2S)-1-изопропилпиперидин-2-ил]карбонил}амино)ацетил]амино}-3,3-диметилбутаноил]-N-{(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил}-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17.
24. Способ по п.23, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ.
Текст
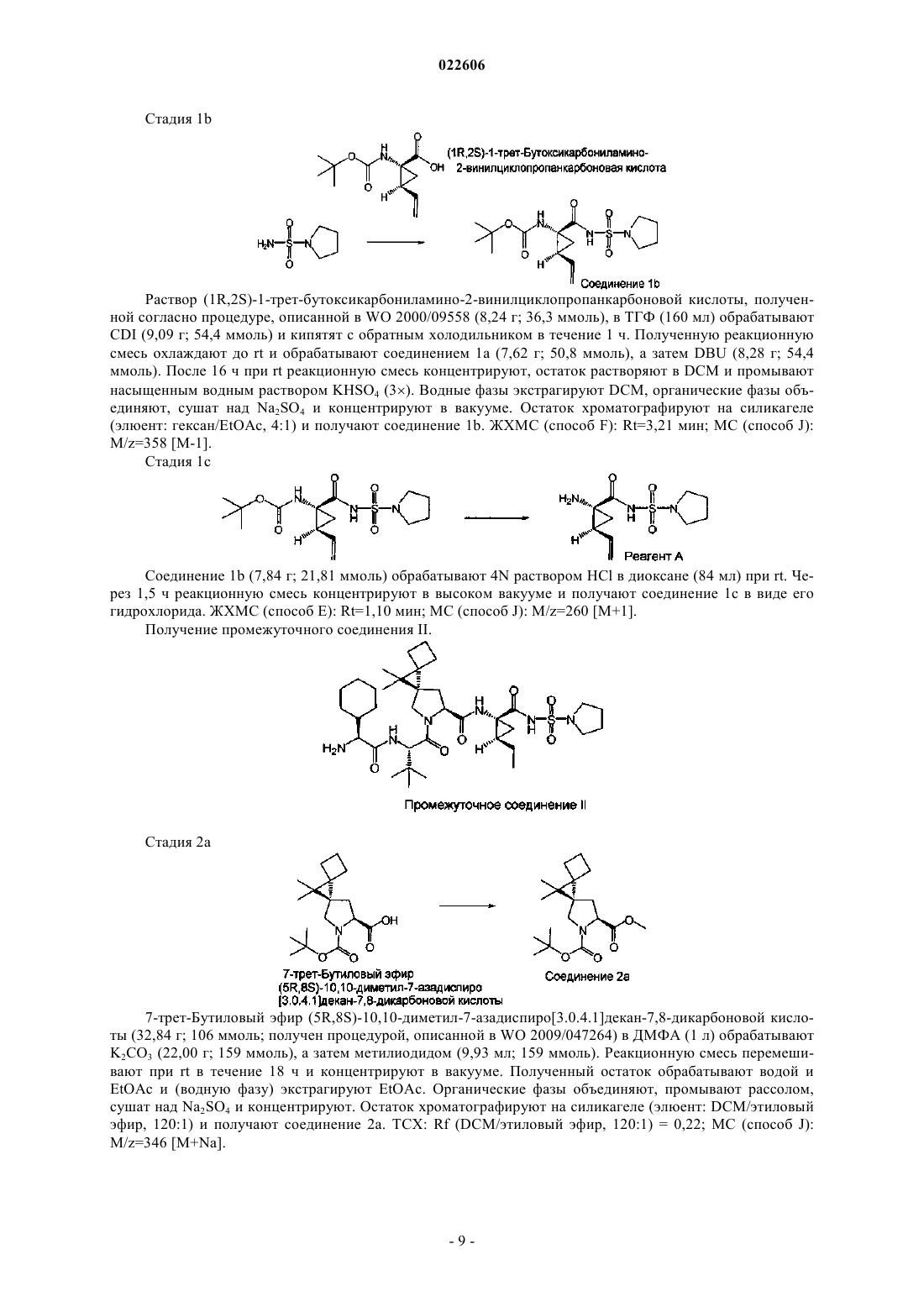
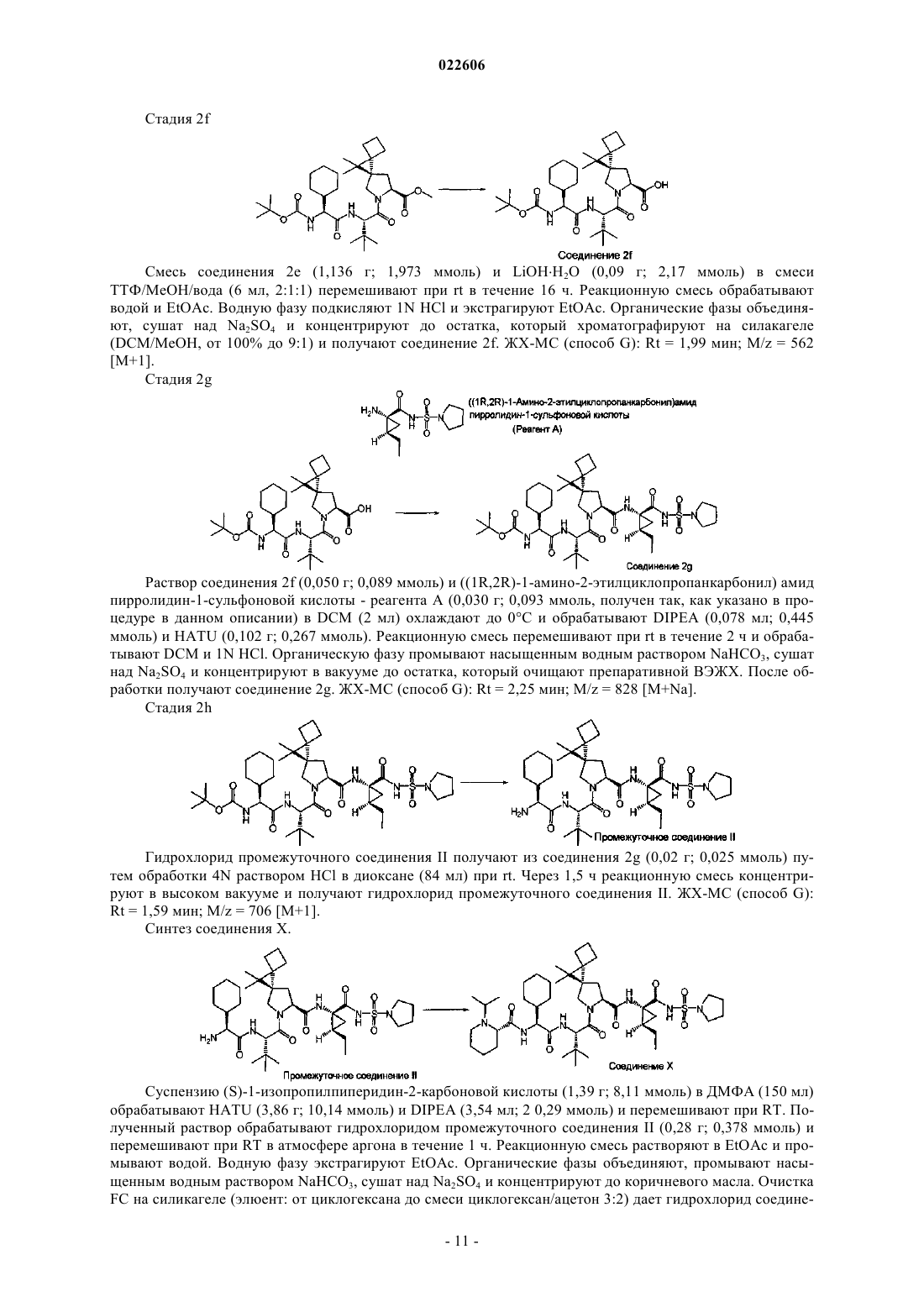
СОЛИ И ПОЛИМОРФЫ СУЛЬФАМИДНЫХ ИНГИБИТОРОВ NS3 Изобретение относится к новым солям и полиморфам 5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7 азадиспиро[3.0.4.1]декан-8-карбоксамида (называемого в изобретении соединением X),фармацевтическим композициям, содержащим их, и способам их получения и применения в терапии. Шах Липа, Саттон Пол Аллен (US),Чжан Лицзюнь (CN) Медведев В.Н. (RU) Настоящее изобретение относится к солям и полиморфам (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида, фармацевтическим композициям, содержащим их, и их применению в терапии. Уровень техники Хроническое заражение вирусом гепатита С (HCV) является основным бременем для здоровья в мире - по оценке в мире 170 млн инфицированных и 3-4 млн инфицируются каждый год (см., например,World Health Organization Fact Sheet164, October 2000). Хотя 25% новых заражений являются симптоматическими, у 60-80% больных будет развиваться хроническая болезнь печени, и, по оценке, у 20% из них будет развиваться до цирроза с ежегодным риском для 1-4% развития гепатоцеллюлярной карциномы (см., например, World Health Organization Guide on Hepatitis С 2002; Pawlotsky J.-M. (2006), Therapy ofHepatitis C: From Empiricism to Eradication. Hepatology, 43: S207-S220). В целом HCV ответственен за 5076% всех случаев рака печени и две трети всех пересадок печени в развитых странах (см., например,World Health Organization Guide on Viral Cancers, 2006). И в итоге 5-7% инфицированных пациентов будут умирать от последствий заражения HCV (см., например, World Health Organization Guide on HepatitisC. 2002). На сегодняшний день стандартной терапией в случае заражения HCV является пегилированный интерферон альфа (IFN-) в комбинации с рибавирином. Однако только до 50% больных с вирусом генотипа 1 можно успешно лечить такой терапией на основе интерферона. Более того, как интерферон, так и рибавирин могут вызывать существенные вредные эффекты, колеблющиеся от симптомов, подобных гриппу (жар и усталость), гематологических осложнений (лейкопения, тромбоцитопения), нейропсихиатрических проблем (депрессия, инсомния, раздражительность), потери массы и аутоиммунных дисфункций (гипотиреоз, диабет) от лечения интерфероном до существенной гемолитической анемии от лечения рибаварином. Следовательно, все еще весьма необходимы более эффективные и лучше переносимые лекарственные средства. Белок NS3 в приблизительно 70 кД имеет два различных домена: N-концевой серинпротеазный домен из 180 аминокислот (АА) и С-концевой хеликазный/NTP-азный домен (АА 181-631). Белок NS3 считается членом семейства химотрипсинов из-за схожести в последовательности белка, общей трехмерной структуры и механизма катализа. Серинпротеаза NS3 HCV ответственна за протеолитическое расщепление полипротеина в областях соединений NS3/NS4A, NS4A/NS4B, NS4B/NS5A и NS5A/NS5B (см., например, Bartenschlager, R.L. et al. (1993), J. Virol., 67: 3835-3844; Grakoui, A. et al. (1993), J. Virol., 67: 2832-2843; Tomei, L. et al. (1993), J. Virol., 67: 4017-4026). NS4A - белок в приблизительно 6 кД из 54 АА является кофактором для серинпротеазной активности NS3 (см., например, Failla, С. et al. (1994), J. Virol.,68: 3753-3760; Tanji, Y. et al. (1995), J. Virol., 69: 1575-1581). Ауторасщепление области соединенияNS3/NS4A серинпротеазой NS3/NS4A происходит внутримолекулярно (т.е. цис), в то время как другие сайты расщепления процессируются межмолекулярно (т.е. транс). Показано, что протеаза NS3 HCV необходима для репликации вируса и, таким образом, является привлекательной мишенью для противовирусной химиотерапии. Сохраняется потребность в новых способах лечения и терапиях против заражения HCV, а также расстройств, связанных с HCV. Также существует потребность в соединениях, применимых при лечении или предупреждении или уменьшении интенсивности одного или нескольких симптомов HCV, а также потребность в способах лечения или предупреждения или уменьшения интенсивности одного или нескольких симптомов HCV. Кроме того, существует потребность в новых соединениях, способных к модуляции активности серинпротеаз HCV, в частности серинпротеазы HCV NS3/NS4a, и использовании указанных соединений для лечения, предупреждения или уменьшения интенсивности заражения HCV. В неопубликованной заявке на патентPCT/IB 2010/000784 описывается новый класс соединений,применимых при лечении расстройств, связанных с HCV. Одним из таких соединений является (5R,8S)7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино 3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил 10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамид, имеющий структуру, показанную ниже. Данное соединение называется в данном описании соединением X При получении фармацевтических препаратов важно, чтобы активное соединение находилось в форме, с которой можно удобно обращаться и обрабатывать, для того, чтобы получить коммерчески жизнеспособный способ изготовления. Соответственно, важными факторами являются химическая доступность и физическая устойчивость активного соединения. Активные соединения и композиции, содержащие их, должны обеспечивать эффективное хранение в течение существенных периодов времени без проявления какого-либо существенного изменения физико-химических характеристик (например,химического состава, плотности, гигроскопичности и растворимости) активного соединения. Кроме того, если активное соединение должно быть включено в лекарственную форму для перорального введения, такую как таблетка, желательно, чтобы активное соединение легко измельчалось с образованием порошка с хорошими свойствами текучести, способствующими изготовлению. Вообще обнаружено, что существуют преимущества при изготовлении определенной формы твердого состояния фармацевтического ингредиента, и они описаны в "Handbook of Pharmaceutical Salts;Properties, Selection and Use", P. Heinrich Stahl, Camille, G. Wermuth (Eds.) (Verlag Helvetica Chimica Acta,Zurich). Способы получения форм твердого состояния также описаны в "Practical Process Research andDevelopment", Neal, G. Anderson (Academic Press, San Diego) и в "Polymorphism: In the Pharmaceutical Industry", Rolf Hilfiker (Ed) (Wiley VCH). Авторы настоящего изобретения обнаружили ряд солей и кристаллических полиморфов соединенияX. Соль и кристаллическое образование имеют потенциал улучшения выходов, так как полученная новая физическая форма может проявлять меньшую растворимость в органических растворителях. Это может привести к улучшенному процессу получения. Кроме того, выделение и очистка солей могут быть более легкими. Так, в одном аспекте изобретение относится к гидрохлоридной соли соединения X или ее фармацевтически приемлемым производным. В одном воплощении чистота соли составляет по меньшей мере 98%. В другом воплощении изобретение относится к полугидрохлориду соединения X или его фармацевтически приемлемым производным. В другом аспекте изобретение относится к соли метансульфоновой кислоты соединения X или ее фармацевтически приемлемым производным. В еще одном аспекте изобретение относится к соли янтарной кислоты соединения X или ее фармацевтически приемлемым производным. Кроме того, в соответствии с настоящим изобретением предлагается ряд кристаллических полиморфов соединения X и его солей. Таким образом, в одном аспекте изобретение относится к кристаллической форме гидрохлорида соединения X (форма А), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,7, 8,9, 11,8,15,5 и 18,0. В одном воплощении форма А характеризуется, по меньшей мере, следующими характеристическими пиками на порошковой рентгенограмме: 7,7, 8,9, 11,8, 15,5, 17,3, 18,0 и 19,9. В другом воплощении форма А характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. А. В еще одном воплощении форма А характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 1. В другом аспекте изобретение относится к кристаллической форме гидрохлорида соединения X(форма В), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,8, 8,6, 11,3, 15,8 и 18,2. В одном воплощении форма В характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 7,8, 8,6, 9,5, 11,3, 14,8, 15,8 и 18,2. В другом воплощении форма В характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанными в табл. В. В еще одном воплощении форма В характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 2. В другом аспекте изобретение относится к кристаллической форме гидрохлорида соединения X(форма С), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 9,2, 14,4, 15,3, 17,7 и 20,0. В одном воплощении форма С характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 8,0, 9,2, 14,4, 15,3, 17,7, 19,3 и 20,0. В другом воплощении форма С характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанными в табл. С. В еще одном воплощении форма С характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 3. В другом аспекте изобретение относится к кристаллической форме гидрохлорида соединения X(форма D), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 8,0, 8,3, 14,3, 15,9 и 18,2. В одном воплощении форма D характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 8,0, 8,3, 9,1, 10,0, 10,7, 14,3, 14,8, 15,9, 17,2 и 18,2. В другом воплощении форма D характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанными в табл. D. В еще одном воплощении форма D характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 4. В другом аспекте изобретение относится к кристаллической форме гидрохлорида соединения X ными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,5, 8,8, 9,2, 15,6 и 17,8. В одном воплощении форма Е характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 7,5, 8,8, 9,2, 15,6, 17,8, 18,2 и 19,5. В другом воплощении форма Е характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанными в табл. Е. В еще одном воплощении форма Е характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 5. В другом аспекте изобретение относится к кристаллической форме полугидрохлорида соединенияX (форма F), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,9, 11,3, 14,8, 16,0 и 18,2. В одном воплощении форма F характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 6,9, 7,8, 9,1, 11,3, 14,8, 16,0, 17,4 и 18,2. В другом воплощении форма F характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанными в табл. F. В еще одном воплощении форма F характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 6. В другом аспекте изобретение относится к кристаллической форме метансульфоната соединения X(форма G), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,8, 6,5, 7,8, 10,4 и 15,7. В одном воплощении форма G характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 5,8, 6,5, 7,8, 10,4, 12,9, 15,7 и 17,2. В другом воплощении форма G характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. G. В еще одном воплощении форма G характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 7. В другом аспекте изобретение относится к кристаллической форме соединения X (форма Н), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,7, 6,9, 7,8, 14,4 и 18,5. В одном воплощении форма Н характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 5,7, 6,9, 7,8, 9,2, 10,3, 12,4, 14,4, 15,5, 16,3, 16,7 и 18,5. В другом воплощении форма Н характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. Н. В еще одном воплощении форма Н характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 8. В другом аспекте изобретение относится к кристаллической форме соединения X (форма I), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 9,5, 13,3, 14,5, 19,0 и 19,7. В одном воплощении форма I характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 6,8, 7,4, 7,9, 9,5, 13,3, 14,0, 14,5, 16,1, 17,9, 19,0 и 19,7. В другом воплощении форма I характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. I. В еще одном воплощении форма I характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 9. В другом аспекте изобретение относится к кристаллической форме соединения X (форма J), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,9, 8,3, 12,5, 13,6, 16,0 и 17,1. В одном воплощении форма J характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 6,9, 8,3, 9,2, 12,5, 13,6, 16,0, 16,8, 17,1, 19,8 и 20,9. В другом воплощении форма J характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. J. В еще одном воплощении форма J характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 10. В другом аспекте изобретение относится к кристаллической форме соединения X (форма K), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,1, 7,4, 8,3, 22,1, 23,7, 24,1 и 24,6. В одном воплощении форма K характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 5,2, 6,1, 7,4, 8,3, 9,7, 18,2, 19,6, 22,1, 23,2, 23,7, 24,1 и 24,6. В другом воплощении форма K характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. K. В еще одном воплощении форма K характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 11. В другом аспекте изобретение относится к кристаллической форме соединения X (форма L), которая характеризуется по меньшей мере следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,7, 8,2, 16,9, 18,4 и 18,5. В одном воплощении форма L характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 5,7, 7,0, 8,2, 15,4, 16,0, 16,9, 18,4 и 18,5. В другом воплощении форма L характеризуется, по меньшей мере, характеристическими дифракционными пиками на порош-3 022606 ковой рентгенограмме, показанной в табл. L. В еще одном воплощении форма L характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 12. В другом аспекте изобретение относится к кристаллической форме соединения X (форма М), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,7, 7,6, 7,7, 9,5 и 19,0. В одном воплощении форма М характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 6,7, 7,6, 7,7, 9,5, 13,1, 14,4, 15,4, 16,0, 17,8, 18,3, 19,0 и 19,6. В другом воплощении форма М характеризуется, по меньшей мере, характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. М. В еще одном воплощении форма М характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 13. В другом аспекте изобретение относится к кристаллической форме соединения X (форма N), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,3, 7,7, 8,7, 16,0, 18,1 и 20,5. В одном воплощении форма N характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме: 6,3, 7,7, 8,7, 10,2, 11,4, 13,8, 16,0, 17,2, 18,1, 18,6, 19,0 и 20,5. В другом воплощении форма N характеризуется по меньшей мере характеристическими дифракционными пиками на порошковой рентгенограмме, показанной в табл. N. В еще одном воплощении формаN характеризуется порошковой рентгенограммой, по существу, такой же, какая показана на фиг. 14. В одном аспекте изобретения полиморфы по изобретению имеют кристаллические свойства и являются предпочтительно по меньшей мере на 50% кристаллическими, предпочтительнее по меньшей мере на 56% кристаллическими, еще предпочтительнее по меньшей мере на 70% кристаллическими и наиболее предпочтительно по меньшей мере на 80% кристаллическими. Кристалличность можно оценить методами рентгенографии или методами инфракрасной спектроскопии. В одном аспекте изобретения полиморфы по изобретению являются кристаллическими от 50, 60,70, 80 или 90% до 95, 96, 97, 98, 99 или 100%. В настоящем описании пики на порошковой рентгенограмме (выраженные в градусах 2) измеряют с использованием рентгеновского излучения меди с длиной волны 1,5406(1) и 1,5444(2). Кристаллические формы по настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах. Термин "сольват" используется в данном описании для описания молекулярного комплекса, включающего соединение по изобретению и определенное количество одного или нескольких фармацевтически приемлемых растворителей. Примеры фармацевтически приемлемых растворителей включают этанол и воду. Термин "гидрат" используется, когда растворителем является вода. В одном аспекте изобретение относится к соли или кристаллической форме, определенных в данном описании, для применения в терапии. В другом аспекте изобретение относится к способу лечения методом терапии, включающему введение субъекту, нуждающемуся в этом, фармацевтически приемлемого количества соли или кристаллической формы по изобретению. В одном аспекте изобретение относится к применению соли или кристаллической формы, определенных в данном описании, при получении лекарственного средства для применения в терапии. В одном воплощении терапия представляет собой лечение расстройства, связанного с HCV. В другом воплощении терапия представляет собой лечение заражения HCV. В другом воплощении терапия представляет собой лечение, ингибирование или предупреждение активности HCV. В другом воплощении терапия представляет собой ингибирование активности протеазы NS2, протеазы NS3, хеликазы NS3,белка NS5a и/или полимеразы NS5b. В другом воплощении терапия представляет собой разрушение взаимодействия между протеазой NS3 и кофактором NS4A. В другом воплощении терапия представляет собой предупреждение или уменьшение тяжести одного или нескольких соединений NS4A-NS4B, NS4BNS5A и NS5A-NS5B HCV. В другом воплощении терапия представляет собой ингибирование активности серинпротеазы. В другом воплощении терапия представляет собой снижение нагрузки РНК HCV у субъекта. В одном аспекте соли и кристаллические формы по изобретению проявляют активность протеазыHCV. В одном воплощении соли и кристаллические формы по изобретению представляют собой ингибиторы протеазы NS3-4A HCV. В одном аспекте изобретение относится к способу ингибирования репликации вируса гепатита С в клетке, включающему контактирование указанной клетки с солью или кристаллической формой по изобретению. В другом аспекте изобретение относится к лечению расстройства, связанного с HCV, упаковкой лекарственного средства, включающей соль или кристаллическую форму по изобретению, упакованные с инструкциями по применению эффективного количества соли или кристаллической формы для лечения расстройства, связанного с HCV. В некоторых воплощениях расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобу-4 022606 линемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ. В другом воплощении изобретение относится к способу лечения заражения HCV, цирроза печени,хронической болезни печени, гепатоцеллюлярной карциномы, криоглобулинемии, неходжкинской лимфомы, фиброза печени и/или ослабленного врожденного внутриклеточного иммунного ответа у субъекта, нуждающегося в этом, включающему введение субъекту фармацевтически приемлемого количества соли или кристаллической формы по изобретению. В одном воплощении HCV, от которого лечат, выбирают из любого генотипа HCV. В другом воплощении HCV выбирают из генотипа HCV 1, 2 и/или 3. Связанные с HCV состояния часто ассоциируются с серинпротеазой NS3 HCV, которая ответственна за некоторые стадии в процессинге полипротеина HCV в более мелкие функциональные белки. Протеаза NS3 образует гетеродимерный комплекс с белком NS4A - существенным кофактором, который усиливает ферментативную активность и, как полагают, способствует закреплению HCV на эндоплазматическом ретикулуме. NS3 сначала автокатализирует гидролиз соединения NS3-NS4A и затем расщепляет полипротеин HCV межмолекулярно в местах пересечения NS4A-NS4B, NS4B-NS5A и NS5A-NS5B. Такой процесс ассоциируется с репликацией HCV у субъекта. Ингибирование или модуляция активности одного или нескольких белков NS3, NS4A, NS4B, NS5A и NS5B будет ингибировать или модулировать репликацию HCV у субъекта, причем посредством этого предотвращается или лечится состояние, связанное с HCV. В частном воплощении состояние, связанное с HCV, ассоциируется с активностью протеазы NS3. В другом частном воплощении состояние, связанное с HCV, ассоциируется с активностью гетеродимерного комплекса NS3-NS4A. Изобретение также относится к способам получения кристаллических форм, описанных в данном описании. Так, в одном аспекте изобретение относится к способу получения любой из форм А, В, С, D,E, F, G, Н и I, включающему кристаллизацию формы из раствора соединения X. В контексте настоящего изобретения обращение в данном случае к "лечению" включает обращение к лечебному, паллиативному и профилактическому лечению, если не имеется конкретных указаний на иное. Термины "терапия", "терапевтический" и "терапевтически" должны истолковываться таким же путем. Соли и кристаллические формы по настоящему изобретению можно вводить одни или в комбинации с одним или несколькими другими лекарственными средствами. Как правило, их вводят в виде композиции в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Термин"эксципиент" используется в данном описании для описания любого соединения, иного, чем соединение(я) по изобретению, которое может придавать композициям или функциональные (т.е. регулирование скорости высвобождения лекарственного средства), и/или нефункциональные (т.е. способствование процессингу или разбавление) свойства. Выбор эксципиента будет в большой степени зависеть от таких факторов, как определенный способ введения, влияние эксципиента на растворимость и устойчивость и характер лекарственной формы. Фармацевтические композиции, подходящие для доставки солей и кристаллических форм по настоящему изобретению, и способы их получения будут вполне очевидны для специалистов в данной области техники. Такие композиции и способы их получения можно найти, например, в Remington's Pharmaceutical Sciences, 19th Edition (Mack Publishing Company, 1995). В случае введения пациентам-людям общая суточная доза соли или кристаллической формы типично находится в интервале 0,01-1000 мг, или от 0,1 до 250 мг, или от 1 до 50 мг, в зависимости, конечно,от способа введения. Общая суточная доза может вводиться в виде одной или раздельных доз и может по предписанию врача выходить за пределы типичного интервала, указанного в данном описании. Такие дозировки основаны в расчете на среднего человека с массой тела примерно 60-70 кг. Лечащий врач легко сможет определить дозы для субъектов, масса которых выпадает из указанного интервала, таких как дети и престарелые люди. Фармацевтические композиции можно вводить местно (например, на кожу или в легкие и/или дыхательные пути) в форме, например, кремов, растворов, суспензий, аэрозолей в гептафторалкане (HFA) и порошковых препаратов; или системно, например пероральным введением в форме таблеток, капсул,сиропов, порошков или гранул; или парентеральным введением в форме растворов или суспензий; или подкожным введением; или ректальным введением в форме суппозиториев; или трансдермально. В воплощении изобретения активный ингредиент вводят перорально. Пероральное введение может включать проглатывание, так что соединение поступает в желудочно-кишечный тракт, и/или буккальным, лингвальным или сублингвальным введением, при котором соединение поступает в кровоток непосредственно изо рта. Композиции, подходящие для перорального введения, включают твердые образования, твердые микрокапсулы, полутвердые вещества и жидкости (включая полифазные или дисперсные системы), такие как таблетки; мягкие или твердые капсулы, содержащие множество частиц или наночастицы, жидкости, эмульсии или порошки; лепешки (включая наполненные жидкостью); жевательные таблетки; гели; быстро распадающиеся лекарственные формы; пленки; вагинальные суппозитории; спреи и буккаль-5 022606 ные/мукоадгезивные пластыри. Композиции, подходящие для перорального введения, также могут быть созданы для доставки солей и кристаллических форм способом с немедленным высвобождением или с поддержанием определенной скорости высвобождения, при этом профиль высвобождения может быть с запозданием, импульсным, регулируемым, пролонгированным или отсроченным и пролонгированным или модифицированным таким образом, что оптимизируется терапевтическая эффективность активного средства. Средства для доставки соединений с поддержанием определенной скорости высвобождения известны в технике и включают полимеры, замедляющие высвобождение, которые можно ввести в композиции с указанными соединениями для регулирования их высвобождения. Примеры полимеров для поддержания скорости высвобождения включают разлагаемые и неразлагаемые полимеры, которые можно использовать для высвобождения указанных соединений путем диффузии или сочетания диффузии и разрушения полимера. Примеры полимеров для поддержания скорости высвобождения включают гидроксипропилметилцеллюлозу, гидроксипропилцеллюлозу, метилцеллюлозу, этилцеллюлозу, натрий-карбоксиметилцеллюлозу, поливиниловый спирт, поливинипирролидон,ксантановую камедь, полиметакрилаты, полиэтиленоксид и полиэтиленгликоль. Жидкие композиции (включая полифазные или дисперсные системы) включают эмульсии, суспензии,растворы, сиропы и эликсиры. Такие композиции могут быть представлены как наполнители в мягких или твердых капсулах (изготовленных, например, из желатина или гидроксипропилметилцеллюлозы) и типично включают носитель, например воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или несколько эмульгаторов и/или суспендирующих веществ. Жидкие композиции также можно получить путем восстановления твердого вещества, например, из саше. Соли и кристаллические формы по изобретению также можно использовать в быстро растворяющихся и быстро рассыпающихся лекарственных формах, таких как формы, описанные в Liang and Chen,Expert Opinion in Therapeutic Patents, 2001, 11(6), 981-986. Композиции таблеток обсуждаются в Pharmaceutical Dosage Forms: Tablets, Vol.1, H. Liebarman andL. Lachman (Marcel Dekker, New York, 1980). Краткое описание фигур С целью иллюстрации настоящего изобретения далее представлены неограничивающие его примеры. В примерах представлены фигуры, описанные далее. На фиг. 1 представлена порошковая рентгенограмма формы А, определенной в данном описании,на фиг. 2 - порошковая рентгенограмма формы В, определенной в данном описании,на фиг. 3 - порошковая рентгенограмма формы С, определенной в данном описании,на фиг. 4 - порошковая рентгенограмма формы D, определенной в данном описании,на фиг. 5 - порошковая рентгенограмма формы Е, определенной в данном описании,на фиг. 6 - порошковая рентгенограмма формы F, определенной в данном описании,на фиг. 7 - порошковая рентгенограмма формы G, определенной в данном описании,на фиг. 8 - порошковая рентгенограмма формы Н, определенной в данном описании,на фиг. 9 - порошковая рентгенограмма формы I, определенной в данном описании,на фиг. 10 - порошковая рентгенограмма формы J, определенной в данном описании,на фиг. 11 - порошковая рентгенограмма формы K, определенной в данном описании,на фиг. 12 - порошковая рентгенограмма формы L, определенной в данном описании,на фиг. 13 - порошковая рентгенограмма формы М, определенной в данном описании. на фиг. 14 - порошковая рентгенограмма формы N, определенной в данном описании. Общие экспериментальные подробности Список аббревиатур Порошковые рентгенограммы (XPRD) получают с использованием образцов в приблизительно 2-10 мг, которые осторожно спрессовывают на одном косо срезанном кремнеземном держателе образца дляXPRD с нулевым фоном. Затем образец загружают в Bruker GADDS и анализируют с использованием следующих условий эксперимента: Все исходные материалы, строительные блоки, реагенты, кислоты, основания, дегидратирующие агенты, растворители и катализаторы, используемые для синтеза соединений по настоящему изобретению, или коммерчески доступны, или могут быть получены методами органического синтеза, известными специалисту в данной области техники (Houben-Weyl, 4th ED., 1952, Methods of Organic Synthesis,Thieme, Volume 21). Кроме того, соединения по настоящему изобретению можно получить методами органического синтеза, известными специалисту в данной области техники, как показано в примерах,следующих далее. Способ В. ВЭЖХ. Прибор: система Agilent; колонка: Waters Symmetry C18, 3,5 мкм, 2,150 мм, поток 0,6 мл/мин; растворитель: CH3CN (0,1% CF3CO2H), H2O (0,1% CF3CO2H); градиент: 0-3,5 мин 20-95% CH3CN, 3,5-5 мин 95% CH3CN, 5,5-5,55 мин от 95 до 20% CH3CN. Способ G. ЖМСХ. Прибор: система Agilent; колонка: Halo C18, 2,7 мкм, 2,130 мм, поток 1,1 мл/мин; растворитель: CH3CN (0,1% НСО 2 Н), Н 2 О (0,1% НСО 2 Н); градиент: 0-2 мин 5-95% CH3CN, 2-2,6 мин 95% CH3CN, 2,6-2,65 мин от 95 до 5% CH3CN, 2,65-3 мин 5% CH3CN. Способ J. МС. Прибор: система Agilent; способ: поточная инжекция; детекция: API-ES, положительная/отрицательная. Соединение X. Ниже подробно описывается получение (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида, описанное в неопубликованной заявке на патентPCT/IB 2010/000784. Получение регента А. Стадия 1 а Суспензию в DCM (24 мл) N-(трет-бутоксикарбонил)-N-[4-(диметилазаниумилиден)-1,4 дигидропиридин-1-илсульфонил]азанида (3 г; 9,955 ммоль), полученного согласно процедуре Winum etal. (Organic Letters, 2001, 3, 2241), обрабатывают пирролидином (0,864 мл, 10,453 ммоль) и перемешивают при rt в течение 24 ч. Реакционную смесь хроматографируют FC на силикагеле (элюент:CH2Cl2/EtOAc, 100:1), и получают амид [N-(трет-бутоксикарбонил)]пирролидин-1-сульфоновой кислоты. ТСХ: Rf (DCM/EtOAc, 100:1) = 0,40. Раствор амида [N-(трет-бутоксикарбонил)]пирролидин-1 сульфоновой кислоты (57,09 г; 223 ммоль) в DCM (450 мл) обрабатывают ТФК (120 мл; 1,56 моль) и перемешивают в течение 7 ч. Реакционную смесь концентрируют в вакууме и оставшееся масло растирают в диизопропиловом эфире. Полученный порошок промывают диизопропиловым эфиром и сушат в высоком вакууме, получают соединение 1a. TCX: Rf (DCM/EtOAc, 50:1) = 0,10.CDI (9,09 г; 54,4 ммоль) и кипятят с обратным холодильником в течение 1 ч. Полученную реакционную смесь охлаждают до rt и обрабатывают соединением 1 а (7,62 г; 50,8 ммоль), а затем DBU (8,28 г; 54,4 ммоль). После 16 ч при rt реакционную смесь концентрируют, остаток растворяют в DCM и промывают насыщенным водным раствором KHSO4 (3). Водные фазы экстрагируют DCM, органические фазы объединяют, сушат над Na2SO4 и концентрируют в вакууме. Остаток хроматографируют на силикагеле Соединение 1b (7,84 г; 21,81 ммоль) обрабатывают 4N раствором HCl в диоксане (84 мл) при rt. Через 1,5 ч реакционную смесь концентрируют в высоком вакууме и получают соединение 1 с в виде его гидрохлорида. ЖХМС (способ Е): Rt=1,10 мин; МС (способ J): M/z=260 [M+1]. Получение промежуточного соединения II.K2CO3 (22,00 г; 159 ммоль), а затем метилиодидом (9,93 мл; 159 ммоль). Реакционную смесь перемешивают при rt в течение 18 ч и концентрируют в вакууме. Полученный остаток обрабатывают водой иEtOAc и (водную фазу) экстрагируют EtOAc. Органические фазы объединяют, промывают рассолом,сушат над Na2SO4 и концентрируют. Остаток хроматографируют на силикагеле (элюент: DCM/этиловый эфир, 120:1) и получают соединение 2 а. ТСХ: Rf (DCM/этиловый эфир, 120:1) = 0,22; МС (способ J): Гидрохлорид соединения 2b получают из соединения 2 а (6,3 г; 19,48 ммоль) путем обработки 4N раствором HCl в диоксане (84 мл) при rt. Через 1,5 ч реакционную смесь концентрируют в высоком вакууме и получают соединение 2b в виде его гидрохлорида. МС (способ J): M/z = 224 [М+1]. Стадия 2 с Соединение 2 с получают из раствора гидрохлорида соединения 2b (7,33 г; 27,93 ммоль) и BOC-Lтрет-лейцина (0,248 г; 1,072 ммоль) в DCM (15 мл), который охлаждают до 0 С и обрабатывают DIPEA(0,46 мл; 2,68 ммоль) и HATU (0,611 г; 1,608 ммоль). Реакционную смесь перемешивают при rt в течение 20 ч, концентрируют в вакууме и остаток очищают препаративной ВЭЖХ (способ K). После обработки(обработка 2 = фракции обрабатывают NaHCO3 и концентрируют; остаток обрабатывают водой и EtOAc,экстрагируют EtOAc; органические экстракты объединяют, сушат над Na2SO4 и концентрируют). ТСХ: Гидрохлорид соединения 2d получают из соединения 2 с (10,55 г; 24,16 ммоль) путем обработки 4N раствором HCl в диоксане (84 мл) при rt. Через 1,5 ч реакционную смесь концентрируют в высоком вакууме и получают гидрохлорид соединения 2d. TCX: Rf (DCM/MeOH, 95:5) = 0,39; МС (способ J): M/z = 337 [М+1]. Стадия 2 е Соединение 2 е получают из соединения 2d (0,2 г; 0,456 ммоль) и BOC-L-циклогексилглицина (1,582 г; 6,15 ммоль) в DCM (65 мл), которые охлаждают до 0 С и обрабатывают DIPEA (2,68 мл; 15,37 ммоль) и затем HATU (3,51 г; 9,22 ммоль). После 16 ч при rt реакционную смесь обрабатывают DCM и 1N HCl,органические фазы экстрагируют насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют. Очистка препаративной ВЭЖХ (способ K) с последующей обработкой (обработка 2) дает соединение 2 е. ЖХ-МС (способ G): Rt = 2,21 мин; M/z = 598 [M+Na]. Смесь соединения 2 е (1,136 г; 1,973 ммоль) и LiOHН 2 О (0,09 г; 2,17 ммоль) в смеси ТТФ/МеОН/вода (6 мл, 2:1:1) перемешивают при rt в течение 16 ч. Реакционную смесь обрабатывают водой и EtOAc. Водную фазу подкисляют 1N HCl и экстрагируют EtOAc. Органические фазы объединяют, сушат над Na2SO4 и концентрируют до остатка, который хроматографируют на силакагеле Раствор соединения 2f (0,050 г; 0,089 ммоль) и 1R,2R)-1-амино-2-этилциклопропанкарбонил) амид пирролидин-1-сульфоновой кислоты - реагента А (0,030 г; 0,093 ммоль, получен так, как указано в процедуре в данном описании) в DCM (2 мл) охлаждают до 0 С и обрабатывают DIPEA (0,078 мл; 0,445 ммоль) и HATU (0,102 г; 0,267 ммоль). Реакционную смесь перемешивают при rt в течение 2 ч и обрабатывают DCM и 1N HCl. Органическую фазу промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют в вакууме до остатка, который очищают препаративной ВЭЖХ. После обработки получают соединение 2g. ЖХ-МС (способ G): Rt = 2,25 мин; M/z = 828 [M+Na]. Стадия 2h Гидрохлорид промежуточного соединения II получают из соединения 2g (0,02 г; 0,025 ммоль) путем обработки 4N раствором HCl в диоксане (84 мл) при rt. Через 1,5 ч реакционную смесь концентрируют в высоком вакууме и получают гидрохлорид промежуточного соединения II. ЖХ-МС (способ G): Суспензию (S)-1-изопропилпиперидин-2-карбоновой кислоты (1,39 г; 8,11 ммоль) в ДМФА (150 мл) обрабатывают HATU (3,86 г; 10,14 ммоль) и DIPEA (3,54 мл; 2 0,29 ммоль) и перемешивают при RT. Полученный раствор обрабатывают гидрохлоридом промежуточного соединения II (0,28 г; 0,378 ммоль) и перемешивают при RT в атмосфере аргона в течение 1 ч. Реакционную смесь растворяют в EtOAc и промывают водой. Водную фазу экстрагируют EtOAc. Органические фазы объединяют, промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4 и концентрируют до коричневого масла. ОчисткаFC на силикагеле (элюент: от циклогексана до смеси циклогексан/ацетон 3:2) дает гидрохлорид соедине- 11022606H-ЯМР (400 МГц, метанол-d4):(м.д.) = 8,4 (д, 1 Н), 4,75 (д, 1 Н), 4,3 (д, 1 Н), 4,2 (т, 1 Н), 3,95 (уш.с,1 Н), 3,4-3,7 (м, 9 Н), 3,0 (м, 1 Н), 2,15 (м, 1 Н), 1,05-2,1 (м, 43 Н), 1,05 (с, 9 Н), 0,9 (с, 3H), 0,95 (с, 3H). Гидрохлорид соединения X (форма А). Растворяют свободное основание в IPA и добавляют 1 экв. HCl. IPA выпаривают, твердые вещества уравновешивают в ацетонитриле при комнатной температуре и получают форму дигидрата. Кристаллическая форма (названная в данном описании формой А) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. А. Фиг. 1 показывает порошковую рентгенограмму формы А. Таблица А Гидрохлорид соединения X (форма В). Растворяют 600 мг свободного основания в 3 мл смеси этилацетат/ацетонитрил (2:1) и добавляют 700 мкл 6N HCl. Раствор уравновешивают в течение 1 ч и затем упаривают. Твердые вещества ресуспендируют в ацетонитриле и суспендируют в течение 1 ч перед выделением, получают безводную форму. Кристаллическая форма (названная в данном описании формой В) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. В. Фиг. 2 показывает порошковую рентгенограмму формы В. Таблица В Гидрохлорид соединения X (форма С). Растворяют 2,54 г свободного основания в 3 мл ацетона. К раствору лекарственного вещества добавляют 1,075 мл 2,75N HCl. Полученный раствор уравновешивают в течение 2 ч, затем твердое вещество собирают фильтрацией и получают безводную форму. Кристаллическая форма (названная в данном описании формой С) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. С. Фиг. 3 показывает порошковую рентгенограмму формы С. Таблица С Гидрохлорид соединения X (форма D). Гидрохлорид (форма С) уравновешивают в этилацетате в течение 72 ч и получают форму дигидрата. Кристаллическая форма (названная в данном описании формой D) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. D. Фиг. 4 показывает порошковую рентгенограмму формы D. Гидрохлорид соединения X (форма Е). Гидрохлорид выделяют после уравновешивания формы В в воде в течение 72 ч и получают форму тригидрата. Кристаллическая форма (названная в данном описании формой Е) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. Е. Фиг. 5 показывает порошковую рентгенограмму формы Е. Таблица Е Полугидрохлорид соединения X (форма F). Растворяют 91 мг свободного основания в ТГФ и добавляют 53 мкл 6N HCl. Добавляют 2 мл ацетонитрила, систему уравновешивают в течение 4 ч перед сбором твердого вещества и получают дигидрат. Кристаллическая форма (названная в данном описании формой F) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. F. Фиг. 6 показывает порошковую рентгенограмму формы F. Таблица F Соль MeSO3H соединения X (форма G). Растворяют 50 мг свободного основания в метилизобутилкетоне, добавляют 1 экв. метансульфоновой кислоты и уравновешивают в течение 2 ч перед сбором твердых веществ. Кристаллическая форма(названная в данном описании формой G) дает дифракционные пики на порошковой рентгенограмме,показанные ниже в табл. G. Фиг. 7 показывает порошковую рентгенограмму формы G. Таблица G Соединение X - свободное основание (форма Н). Соединение X - свободное основание осаждают из изопропилацетата (прозрачный раствор) во вре- 13022606 мя замены растворителя на CH3CN (суспензия) и перемешивают при 20 С в течение 24 ч. Конечное лекарственное вещество выделяют из суспензии в CH3CN, промывают CH3CN и получают безводную форму. Кристаллическая форма (названная в данном описании формой Н) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл. Н. Фиг. 8 показывает порошковую рентгенограмму формы Н. Таблица Н Соединение X (форма I). Форму I получают путем растворения лекарственного вещества в этаноле и осаждения водой до конечного соотношения 1:1 и получают форму моногидрата. Кристаллическая форма (названная в данном описании формой I) дает дифракционные пики на порошковой рентгенограмме, показанные ниже в табл.I. Фиг. 9 показывает порошковую рентгенограмму формы I. Таблица I Соединение X (форма J). Форму J получают из метанола уравновешиванием формы Н при 50 С. Твердое вещество собирают фильтрацией и сушат при 50 С. Таблица J Соединение X (форма K). Форму K кристаллизуют из этанола (100%) после добавления ацетонитрила. Твердое вещество собирают центрифугированием и сушат в токе азота. Таблица K Соединение X (форма L). Форма L представляет собой гидратированную форму формы Н, полученную из ацетонитрила, и твердые вещества сушат при 50 С. Воздействие на твердое вещество повышенной влажности дает форму L. Таблица L Соединение X (форма М). Форму М выделяют из этанола путем осаждения водой. Твердое вещество извлекают фильтрацией и сушат при 50 С. Воздействие на твердое вещество повышенной влажности дает форму М. Соединение X (форма N). Форму N кристаллизуют из этанола (100%) после добавления ацетонитрила. Твердое вещество собирают центрифугированием и сушат в токе азота. Таблица N Биологическая активность. Анализ с протеазой NS3-4A HCV. Ингибирующую активность соединения X против серинпротеазы NS3-4A HCV определяют в гомогенном анализе с использованием полноразмерного белка NS3-4A (генотип 1 а, штамм HCV-1) и коммерчески доступного гашенного изнутри флуорогенного пептида-субстрата, как описано Taliani, M. et al.,1996, Anal. Biochem., 240: 60-67, включенной в данное описание в качестве ссылки. Анализ репликона HCV на основе люциферазы. Противовирусную активность и цитотоксичность соединения X определяют с использованием клеточной линии репликона HCV субгеномного генотипа 1b (Huh-Luc/neo-ET), содержащей люциферазный репортерный ген, экспрессия которой находится под контролем репликации и трансляции РНК HCV. Коротко, 5000 клеток репликона высевают в каждую лунку 96-луночных культуральных планшетов и оставляют для прикрепления в полных культуральных средах без G418 на ночь. На следующий день культуральные среды заменяют средами, содержащими серийно разведенное соединение X в присутствии 10% FBS и 0,5% ДМСО. После 48-часовой обработки соединением оставшиеся в клетках люциферазные активности определяют с использованием реагента BriteLite (Perkin Elmer, Wellesley, Массачусетс) с помощью планшет-ридера LmaxII (Molecular Probe, Invitrogen). Каждая полученная точка представляет собой среднее из четырех повторов в клеточной культуре. IC50 представляет собой концентрацию соединения, при которой люциферазная активность в репликоновых клетках снижается на 50%. Цитотоксичность соединения оценивают с использованием анализа клеток на жизнеспособность на основе ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Гидрохлоридная соль (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2 ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1 илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного. 2. Полугидрохлоридная соль(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного. 3. Метансульфонатная соль(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида или его фармацевтически приемлемого производного. 4. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма А), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,7, 8,9, 11,8,15,5 и 18,0. 5. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма В), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,8, 8,6, 11,3,15,8 и 18,2. 6. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма С), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 9,2, 14,4, 15,3,17,7 и 20,0. 7. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма D), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 8,0, 8,3, 14,3,15,9 и 18,2. 8. Кристаллическая форма гидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1 изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма Е), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 7,5, 8,8, 9,2,15,6 и 17,8. 9. Кристаллическая форма полугидрохлоридной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма F), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,9,11,3, 14,8, 16,0 и 18,2. 10. Кристаллическая форма метансульфонатной соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1] декан-8-карбоксамида (форма G), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,8,6,5, 7,8, 10,4 и 15,7.(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма Н), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,7, 6,9, 7,8, 14,4 и 18,5. 12. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма I), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 9,5, 13,3, 14,5, 19,0 и 19,7. 13. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма J), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,9, 8,3, 12,5, 13,6,16,0, 16,8 и 17,1. 14. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма K), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,1, 7,4, 8,3,22,1, 23,7, 24,1 и 24,6. 15. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма L), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 5,7, 8,2, 16,9, 18,4 и 18,5. 16. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида (форма М), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,7, 7,6, 7,7, 9,5 и 19,0. 17. Кристаллическая форма(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8 карбоксамида (форма N), которая характеризуется, по меньшей мере, следующими характеристическими дифракционными пиками на порошковой рентгенограмме (выраженными в градусах 2): 6,3, 7,7, 8,7,16,0, 18,1 и 20,5. 18. Фармацевтическая композиция для лечения расстройства, связанного с HCV, включающая соль(5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил] амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллическую форму по любому из пп.4-17 в сочетании с фармацевтически приемлемым адъювантом, разбавителем или носителем. 19. Применение соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2 ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17 для лечения расстройства, связанного сHCV. 20. Применение по п.19, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ. 21. Применение соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2-([(2S)-1-изопропилпиперидин-2 ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)-2-этил-1-[(пирролидин-1 илсульфонил)карбамоил]циклопропил-10,10-диметил-7-азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17 для получения лекарственного средства для лечения расстройства, связанного с HCV. 22. Применение по п.21, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ. 23. Способ лечения расстройства, связанного с HCV, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соли (5R,8S)-7-[(2S)-2-[(2S)-2-циклогексил-2([(2S)-1-изопропилпиперидин-2-ил]карбониламино)ацетил]амино-3,3-диметилбутаноил]-N-(1R,2R)2-этил-1-[(пирролидин-1-илсульфонил)карбамоил]циклопропил-10,10-диметил-7 азадиспиро[3.0.4.1]декан-8-карбоксамида по любому из пп.1-3 или его кристаллической формы по любому из пп.4-17. 24. Способ по п.23, где расстройство, связанное с HCV, выбирают из группы, включающей заражение HCV, цирроз печени, хроническую болезнь печени, гепатоцеллюлярную карциному, криоглобулинемию, неходжкинскую лимфому, фиброз печени и ослабленный врожденный внутриклеточный иммунный ответ.
МПК / Метки
МПК: A61K 31/497, C07D 209/96, A61K 38/13, C07D 401/12, A61K 31/437, A61K 38/20, A61K 31/7036, A61K 31/4439, A61K 31/4025, A61K 31/7056, C07D 403/14, A61K 38/21, A61P 31/22, A61K 31/496, A61P 31/20, C07D 403/12, C07K 5/08, A61K 31/5377, A61K 31/7105, A61K 31/713, C07D 401/14, A61K 31/403, A61K 31/7076, C07D 405/14, C07D 417/14
Метки: соли, сульфамидных, ингибиторов, полиморфы
Код ссылки
<a href="https://eas.patents.su/23-22606-soli-i-polimorfy-sulfamidnyh-ingibitorov-ns3.html" rel="bookmark" title="База патентов Евразийского Союза">Соли и полиморфы сульфамидных ингибиторов ns3</a>
Предыдущий патент: Система камер ячеистой структуры для хранения сжатого газа
Следующий патент: Триазолопиридины
Случайный патент: Очистка спиртов перед их применением в присутствии кислотного катализатора