Соли присоединения ингибиторов ангиотензин-i-превращающего фермента с no-донорными кислотами, способ их получения и содержащая их фармацевтическая композиция
Номер патента: 15092
Опубликовано: 30.06.2011
Авторы: Де Нантей Гийом, Вербёре Тони, Бенуа Ален, Курше Кристин, Глоанек Филипп, Симоне Серж, Портевен Бернар, Парментье Жан-Жилль, Рупэн Ален
Формула / Реферат
1. Соединения формулы (I)
(А)m×(В)n (I),
где А представляет собой соединение - ингибитор ангиотензинпревращающего фермента, обладающее формулой (II)
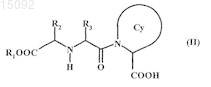
где R1представляет собой атом водорода или линейную либо разветвленную C1-С6алкильную группу,
R2 - линейную или разветвленную C1-С6алкильную группу или арил-(C1-С6)алкильную группу, где алкильная группа является линейной или разветвленной,
R3 - линейную или разветвленную C1-С6алкильную группу или амино-(C1-С6)алкильную группу, где алкильная группа является линейной или разветвленной,
![]() - моноциклическую или бициклическую азотсодержащую систему, содержащую от 3 до 12 атомов углерода, необязательно содержащую один или более дополнительных гетероатомов, выбранных из N, О и S, где указанная система необязательно замещена одной или более группами, выбранными из линейного или разветвленного C1-С6алкила, линейного или разветвленного C1-С6алкокси, оксо, карбокси, арила, С3-С8циклоалкила, гетероарила, карбокси-(C1-С6)алкила, где алкильная группа является линейной или разветвленной, и гидрокси,
- моноциклическую или бициклическую азотсодержащую систему, содержащую от 3 до 12 атомов углерода, необязательно содержащую один или более дополнительных гетероатомов, выбранных из N, О и S, где указанная система необязательно замещена одной или более группами, выбранными из линейного или разветвленного C1-С6алкила, линейного или разветвленного C1-С6алкокси, оксо, карбокси, арила, С3-С8циклоалкила, гетероарила, карбокси-(C1-С6)алкила, где алкильная группа является линейной или разветвленной, и гидрокси,
и которая в случае, если азотсодержащая система является бициклической, может быть конденсированной, спиро или мостиковой,
В обладает формулой (III)
![]()
где X представляет собой СО2Н, SO3H или Р(O)(ОН)2-группу,
Ak1 и Ak2, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную или ненасыщенную, линейную или разветвленную С1-С8алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота, или SO2-группой, где указанная алкиленовая группа необязательно замещена одной или более группами, выбранными из СО2Н, SO3H, гидрокси и амино,
х, у и z, которые могут быть одинаковыми или различными, каждый представляет собой 0 или 1,
Y представляет собой СО или CONH,
Z представляет собой NO-донорную группу, выбранную из следующих групп:
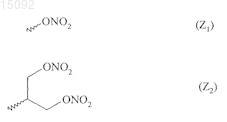
и его региоизомер

и его региоизомер

и его региоизомер
в данных формулах,
р представляет собой 0 или 1,
R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную C1-С6алкильную группу, или R5 и R6 вместе с несущим их атомом азота образуют азотсодержащий гетероцикл, содержащий от 3 до 7 кольцевых атомов, необязательно замещенный линейной или разветвленной C1-С6алкильной группой,
R7 представляет собой метильную или аминокарбонильную группу,
и R4 и R'4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или линейный либо разветвленный С1-С6алкил, трифторметильную или трифторметоксигруппу,
m представляет собой количество кислотных функций В, которые были превращены в соль, и
n представляет собой количество основных функций А, которые были превращены в соль, где связь или связи между А и В имеют ионную природу.
2. Соединения формулы (I) по п.1, где
![]() представляет собой пирролидиновый, пергидроиндольный, октагидроциклопента[b]пиррольный, имидазолиновый или тетрагидроизохинолиновый цикл.
представляет собой пирролидиновый, пергидроиндольный, октагидроциклопента[b]пиррольный, имидазолиновый или тетрагидроизохинолиновый цикл.
3. Соединения формулы (I) по п.1, где А представляет собой эналаприл, эналаприлат, лизиноприл, периндоприл, периндоприлат, рамиприл, спираприл, трандораприл, трандораприлат, имидаприл, моэксиприл, хинаприл или рамиприлат.
4. Соединения формулы (I) по п.1, выбранные из следующих соединений:
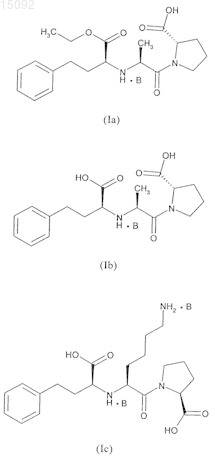
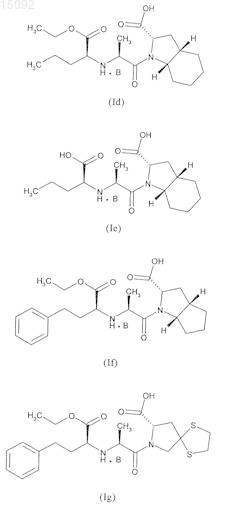
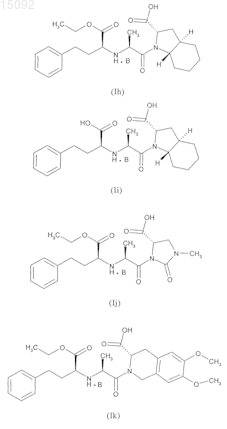
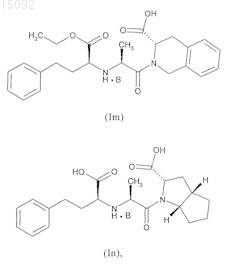
в данных формулах значение В такое, как определено в п.1.
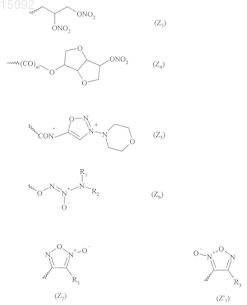
5. Соединения формулы (I) по п.1, где соединение формулы (III) выбирают из соединений следующих формул:
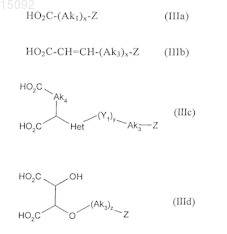
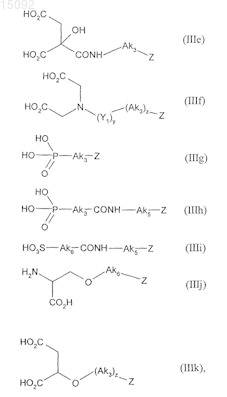
в данных формулах
Ak1, х, у, z и Z являются такими, как определено в п.1,
Ak3 и Ak5, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную линейную или разветвленную C1-С6алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота или SO2-группой,
Ak4 представляет собой насыщенную линейную или разветвленную C1-С3алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота или SO2-группой,
Ak6 представляет собой насыщенную линейную или разветвленную С2-С5алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота или SO2-группой,
Het представляет собой О или NH и
Y1 представляет собой карбонильную группу.
6. Соединения формулы (I) по любому из пп.1-5, где В выбирают из следующих соединений:
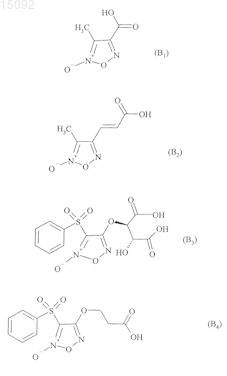
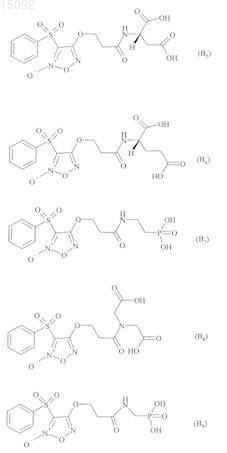
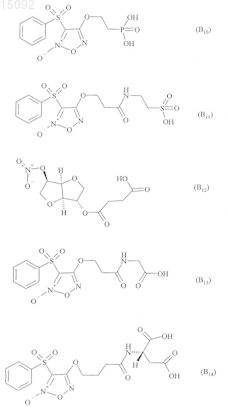
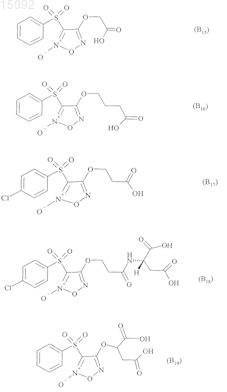
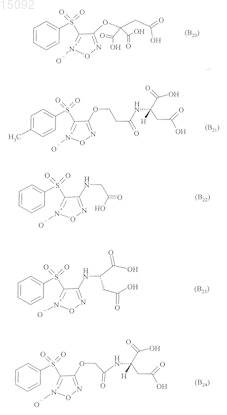
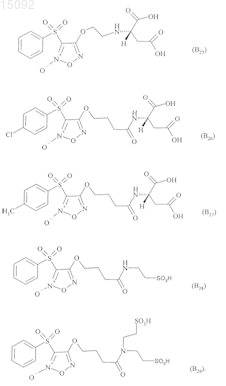
7. Соединения формулы (I) по п.1, выбранные из следующих соединений:
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1H-индоловая соль (2S)-2-[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)амино]янтарной кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1H-индоловая соль (2S)-2-[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)амино]глутаровой кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]октагидро-1H-индоловая соль 2-[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)амино]этансульфоновой кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль {[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)амино] метил}фосфоновой кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль 2,2'-[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)имино]диуксусной кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль {2-[(3-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}пропионил)амино]этил} фосфоновой кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1H-индоловая соль (2-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}этил)фосфоновой кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль (2S)-2-[(4-{[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси}бутаноил)амино]янтарной кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль (2S)-2-{[3-({4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-ил}окси)пропионил] амино}янтарной кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1Н-индоловая соль (2S)-2-{[3-({4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-ил}окси)пропионил] амино}янтарной кислоты;
(2S,3aS,7aS)-1-[(2S)-2-{[(1S)-1-(этоксикарбонил)бутил]амино}пропионил]-2-карбоксиоктагидро-1H-индоловая соль (2S)-2-{[3-({4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-ил}окси)бутаноил] амино}янтарной кислоты.
8. Соединения формулы (III)
![]()
где X представляет собой СО2Н, SO3H или Р(O)(ОН)2-группу,
Ak1 и Ak2, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную или ненасыщенную, линейную или разветвленную С1-С8алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота или SO2-группой, где указанная алкиленовая группа необязательно замещена одной или более группами, выбранными из карбокси, SO3H, гидрокси и амино,
х, у и z, которые могут быть одинаковыми или различными, каждый представляет собой 0 или 1,
Y представляет собой СО или CONH,
Z представляет собой группу Z9 или Z'9

где R4и R'4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или линейную либо разветвленную C1-С6алкильную, трифторметильную или трифторметоксигруппу.
9. Способ синтеза соединений формулы (I) по п.1, при котором проводят взаимодействие соединения А с соединением В в количестве, по крайней мере, равном (n/m) эквивалентов соединения А.
10. Фармацевтическая композиция, содержащая в качестве активного ингредиента соединение формулы (I) в соответствии с любым из пп.1-7 в сочетании с одним или более фармацевтически приемлемыми, инертными, нетоксичными эксципиентами или носителями.
11. Фармацевтическая композиция по п.10 для использования при лечении сердечно-сосудистых патологий.
12. Фармацевтическая композиция по п.11 для использования при лечении артериальной гипертензии и ее сосудистых и почечных последствий, систолической гипертензии, заболевания периферических сосудов, атеросклероза, рестеноза, сердечной недостаточности, тромбоза и тромбоэмболических явлений, стабильной или нестабильной стенокардии, цереброваскулярных явлений, коронарных явлений, инфаркта миокарда, сосудистого ремоделирования, диабета и его сосудистых и почечных последствий, осложнений, связанных с сердечно-сосудистыми хирургическими операциями, или эндотелиальной дисфункции.
13. Фармацевтическая композиция по п.10 для использования при лечении патологий, включая воспаление и оксидативный стресс.
Текст
СОЛИ ПРИСОЕДИНЕНИЯ ИНГИБИТОРОВ АНГИОТЕНЗИН-I-ПРЕВРАЩАЮЩЕГО ФЕРМЕНТА С NO-ДОНОРНЫМИ КИСЛОТАМИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ Соединения формулы (I) где А представляет собой соединение - ингибитор ангиотензинпревращающего фермента,обладающее формулой II содержащее по крайней мере одну солеобразующую основную функцию, где значения радикалов приведены в описании, В представляет собой соединение, содержащее по крайней мере одну солеобразующую кислотную функцию и по крайней мере одну NO-донорную группу, m представляет собой количество кислотных функций В, которые были превращены в соль, и n представляет собой количество основных функций А, которые были превращены в соль, где связь или связи между А и В имеют ионную природу. Способ получения соединений формулы (I) и содержащие их фармацевтические композиции.(71)(73) Заявитель и патентовладелец: ЛЕ ЛАБОРАТУАР СЕРВЬЕ (FR) 015092 Данное изобретение относится к солям присоединения ингибиторов ангиотензин-I-превращающего фермента с NO-донорными кислотами, способу их получения и фармацевтической композиции, которая их содержит. Данные соединения могут быть использованы в области заболеваний, связанных с повышенным давлением и сердечно-сосудистой системой. Повышенное давление связано с повышенным риском сосудистых заболеваний, в особенности на церебральном и коронарном уровне. Оно все чаше связано с другими патологиями, такими как атеросклероз, или с метаболическими расстройствами, такими как ожирение, диабет или почечная недостаточность, что существенно повышает риск возникновения спазмов или тромбоза. Начиная с открытия его воздействия на сердечно-сосудистую систему в 1980 г., монооксид азота(NO) был признан сосудорасширяющей и сосудоукрепляющей молекулой, способной предупреждать возникновение сосудистых спазмов, атеросклероз и тромбоз, таким образом, данный медиатор может потенциально защищать от сердечно-сосудистых заболеваний. NO, главным образом, производится в эндотелии. Считают, что NO, в общем, обладает сосудорасширяющим, антиадгезивным, антитромботическим, противовоспалительным и антиоксидантным действием. Такие ингибиторы ангиотензинконвертирующего фермента (АСЕ), как периндоприл (Ferrari et al.,2005, Am J. Hypertension, 18, 142S-154S), являются лечебными средствами известного кардиопротекторного действия; эти продукты понижают артериальное давление, риск возникновения инфаркта миокарда,сердечной недостаточности, дисфункции левого поджелудочка, инсульта и смертность, вызванную сердечно-сосудистыми заболеваниями. Такое благоприятное действие также наблюдалось для больных диабетом, с атеросклерозом или без него. Для периндоприла последние продемонстрировали антиатеромтозное и противовоспалительное действие и благоприятное воздействие на эндотелиальную дисфункцию(Ferrari et al., 2005). Путем блокирования конвертирующего фермента ингибиторы АСЕ (1) предупреждают образование ангиотензина II, мощного сосудосуживающего средства, задействованного в сердечнососудистых заболеваниях (Kon and Jabs, 2004, Current Opinion Nephrol Hypertens, 13, 291-297; Unger,2002, Am J. Cardiol, 89, 3A-10A; Ferrari et al., 2005) и (2) защищают от распада брадикинин, благоприятное воздействие брадикинина на сердечно-сосудистую систему (из-за его антиишемического действия) вызвано эндотелиальной выработкой NO (Unger 2002; Ferrari et al., 2005). Уже давно установлено, что при ряде патологических состояний, таких как атеросклероз, гипертония, диабет и др., выработка NO снижена или даже полностью отсутствует (Gewaltig and Kodja, 2002,Cardiovasc Res. 55, 250-260; Russo et al., 2002, Vase Pharmacol. 38, 259-269). В таком состоянии эндотелиальной дисфункции благоприятный эффект ингибиторов АСЕ в сочетании с ингибированием распада брадикинина будет менее выражен. Было установлено, что гибридные продукты, ингибиторы АСЕ и доноры NO могут быть полезными для таких различных патологических состояний, особенно для сердечно-сосудистых патологий. Донорные соединения NO, такие как нитроглицерин, дополнительно длительное время использовали для лечения инфаркта и сердечной недостаточности. Благоприятное воздействие данных продуктов связано с их способностью образовывать NO (самопроизвольно или метаболически). Их использование также привело к следующему наблюдению: в случае гипертонии эти доноры NO вызывают существенное уменьшение систолического артериального давления (Nesbitt, 2005, Hypertension, 45, 352-353). Неконтролируемое систолическое артериальное давление является значительным фактором риска для церебральных и сердечных заболеваний и часто не поддается лечению средствами от гипертонии. Действительно, несмотря на продемонстрированное противогипертоническое и вазопротекторное действие таких продуктов, как ингибиторы АСЕ и другие классы противогипертонических продуктов, артериальное давление, особенно систолическое артериальное давление, все еще тяжело контролировать, а заболеваемость и смертность у лиц, страдающих гипертонией, остается высокой. Таким образом, придание донорных свойств NO таким ингибиторам АСЕ, как периндоприл, является значительным шагом в борьбе с сердечно-сосудистыми заболеваниями. Действительно, обладание донорными свойствами NO может улучшить противогипертонические, кардиопротекторные и вазопротекторные свойства, поскольку NO является сосудорасширяющей, противотромбоцитной, антиадгезивной и антиоксидантной молекулой (Walford et al., 2003, J. Thromb. Haemost., 1, 2112-2118; Gewaltig andKodja, 2002, Cardiovasc Res. 55, 250-260). Соединения в соединении с данным изобретением проявляют такое двойное фармакологическое действие, что придает им ценные свойства, позволяющие применять их для лечения гипертонии и сердечно-сосудистых патологий. Более конкретно, данное изобретение относится к солям формулы (I) где А представляет собой соединение - ингибитор ангиотензинпревращающего фермента, содержащее по крайней мере одну солеобразующую основную функцию, В представляет собой соединение, содержащее по крайней мере одну солеобразующую кислотную функцию и по крайней мере одну NO донорную группу, m представляет собой количество кислотных функций В, которые были превращены в соль, и n представляет собой количество основных функций А, которые были превращены в соль, где связь или-1 015092 связи между А и В имеют ионную природу. Под "солеобразующей основной функцией" в данном описании подразумевают функцию, способную принимать протон. В качестве примера солеобразующей основной функции можно привести первичный, вторичный или третичный амин. Под "солеобразующей кислотной функцией" в данном описании подразумевают функцию, способную отдавать протон. В качестве примера солеобразующей кислотной функции можно привести -CO2H, -SO3H илиP(O)(OH)2-группу. Под NO-донорной группой в данном описании подразумевают группу, способную отдавать, высвобождать и/или переносить моноксид азота или его биологически активную форму и/или стимулироватьin vivo эндогенную выработку моноксида азота или его биологически активную форму. Преимущественно ингибитор ангиотензинпревращающего фермента А имеет следующую формулу где R1 представляет собой атом водорода или линейную либо разветвленную С 1-С 6 алкильную группу,R2 - линейную или разветвленную C1-С 6 алкильную группу или арил-(C1-С 6)алкильную группу, в которой алкильная группа является линейной или разветвленной,R3 - линейную или разветвленную C1-С 6 алкильную группу или амино-(С 1-С 6)алкильную группу, в которой алкильная группа является линейной или разветвленной,представляет собой моноциклическую или бициклическую азотсодержащую систему, содержащую от 3 до 12 атомов углерода, которая может дополнительно содержать один или более дополнительных гетероатомов, выбранных из N, О и S, указанная система необязательно замещена одной или более группами, выбранными из линейного или разветвленного C1-С 6 алкила, линейного или разветвленного C1-С 6 алкокси, оксо, карбокси, арила, С 3-С 8 циклоалкила, гетероарила, карбокси-(С 1-С 6)алкила, где алкильная группа является линейной или разветвленной, и гидрокси, которая, если азотсодержащая система является бициклической, может быть конденсированной, спиро или мостиковой. преимущественно представляет собой пирролидиновый, пергидроиндольный, октагидроциклопента[b]пиррольный, имидазолиновый или тетрагидроизохинолиновый цикл. Среди ингибиторов ангиотензин-I-превращающего фермента А можно привести в качестве примера эналаприл формулы (IIa),эналаприлат формулы (IIb), лизиноприл формулы (IIc), периндоприл формулы (IId), периндоприлат формулы (IIe), рамиприл формулы (IIf), спираприл формулы (IIg), трандораприл формулы (IIh), трандораприлат формулы (IIi), имидаприл формулы (IIj), моэксиприл формулы (IIk), хинаприл формулы (IIm) и рамиприлат формулы (IIn). Следующие соединения являются преимущественными соединениями формулы (I):-6 015092 Преимущественно соединение В имеет следующую формулу (III): где X представляет собой СО 2 Н, SO3H или Р(O)(ОН)2-группу,Ak1 и Ak2, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную или ненасыщенную, линейную или разветвленную С 1-С 8 алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота, или SO2-группой,указанная алкиленовая группа необязательно замещена одной или более группами, выбранными из СО 2 Н, SO3H, гидрокси и амино,х, у и z, которые могут быть одинаковыми или различными, каждый представляет собой 0 или 1,Y представляет собой СО или CONH,Z представляет собой n NO-донорную группу. Среди соединений формулы (III) можно привести соединения, имеющие одну из следующих формул:Ak1, х, у, z и Z являются такими, как определено выше,Ak3 и Ak5, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную линейную или разветвленную C1-С 6 алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота, или SO2-группой,-7 015092Ak4 представляет собой насыщенную линейную или разветвленную C1-С 3 алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота, или SO2 группой,Ak6 представляет собой насыщенную линейную или разветвленную С 2-С 5 алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота, или SO2 группой,Het представляет собой О или NH иY1 представляет собой карбонильную группу. Преимущественно Z выбирают из следующих групп: и его региостереомер,в данных формулах р представляет собой 0 или 1,R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную C1-С 6 алкильную группу, или R5 и R6 вместе с несущим их атомом азота образуют азотсодержащий гетероцикл, содержащий от 3 до 7 гетероатомов, необязательно замещенных линейной или разветвленной C1-С 6 алкильной группой,R7 представляет собой метильную или аминокарбонильную группу иR4 и R'4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена, или линейную либо разветвленную C1-С 6 алкил, трифторметильную или трифторметоксигруппу. Под азотсодержащим гетероциклом, содержащим от 3 до 7 гетероатомов, в данной заявке подразумевают насыщенную моноциклическую группу, содержащую от 3 до 7 гетероатомов, которая содержат один, два или три гетероатома, где один из этих гетероатомов представляет собой атом азота, а дополнительный гетероатом или атомы выбирают из атомов кислорода, азота и серы. Предпочтительным азотсодержащим гетероциклом, содержащим от 3 до 7 гетероатомов, является пирролидинильная группа. Следующие соединения В являются преимущественными- 11015092 Следующие соединения формулы (I) являются преимущественными:(2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Ниндоловая соль (2S)-2-[3-(4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)бутаноил]аминоянтарной кислоты. Данное изобретение относится также к способу синтеза соединений формулы (I), в котором соединение А реагирует с соединением В в количестве, как минимум, равном (n/m) эквивалентов соединения А. Соединения А формулы (IIa), (IIb), (IIc), (IId), (IIe), (IIf), (IIg), (IIh), (IIi), (IIj), (IIk), (IIm) и (IIn) известны. Соединения В могут быть получены в результате традиционных реакций, известных в органической химии. Например, соединения B1 и В 2 могут быть получены из кротонового альдегида, который превращается в 4-метил-1,2,5-оксадиазол 5-оксид-3-карбоксальдегид путем взаимодействия с нитратом натрия в уксусной кислоте. Полученный таким образом альдегид затем окисляют с получением соединения B1,или он взаимодействует с защищенным соединением трифенилфосфинометилиденкарбоновой кислоты с получением соединения В 2 после удаления защитной группы. Соединение B12 может быть получено путем сочетания изосорбида мононитрата с ангидридом янтарной кислоты. Соединение В формулы (III), где Z представляет собой группу Z9 или Z'9, может быть получено путем взаимодействия соединения формулы и спиртового соединения X-(Ak1)x-(Y)y-(Ak2)z-OH, в котором кислотные функции защищены, в присутствии основания после удаления защиты кислотных функций. Соединения В формулы (III), где Z представляет собой группу Z9 или Z'9, являются новыми продуктами для использования в качестве промежуточных веществ при синтезе в химической или фармацевтической промышленности, особенно в синтезе солей формулы (I), и как таковые являются неотъемлемой частью данного изобретения. С точки зрения фармакологических свойств, соединения в соответствии с данным изобретением- 12015092 показаны для лечения патологий, которые требуют лечения ингибитором АСЕ и/или донором NO, и их используют при лечении сердечно-сосудистых патологий, таких как артериальная гипертония (в ее различных формах) и ее сосудистые и почечные последствия, систолическая гипертония, заболевание периферических сосудов, атеросклероз, рестеноз, сердечная недостаточность, тромбоз и любые тромбоэмболические явления, стенокардия (стабильная или нестабильная), цереброваскулярные явления, коронарные явления, инфаркт миокарда, сосудистое ремоделирование, диабет и его сосудистые и почечные последствия, осложнения, связанные с хирургическими операциями, такими как сердечно-сосудистая терапия и эндотелиальная дисфункция. Поскольку NO имеет также противовоспалительные и антиоксидантные свойства, соединения в соответствии с данным изобретением находят использование для лечения патологий, включая воспаление и оксидативный стресс. Данное изобретение также относится к фармацевтическим композициям, содержащим соединение формулы (I) в качестве активного ингредиента, в одном или более фармацевтически приемлемом, инертном, нетоксичном эксципиенте или носителе. Среди фармацевтических композиций в соответствии с данным изобретением можно более конкретно упомянуть те из них, которые подходят для перорального, парентерального (внутривенного,внутримышечного или подкожного), чрезкожного, назального, ректального, подъязычного, глазного или респираторного введения, особенно таблетки или драже, сублингвальные таблетки, твердые желатиновые капсулы, капсулы, суппозитории, крема, мази, дермальные гели, препараты для введения или приема внутрь, аэрозоли, глазные капли или капли для носа и т.д. Кроме соединений формулы (I), фармацевтические композиции в соответствии с данным изобретением содержат один или более эксципиентов или носителей, таких как разбавители, любриканты, связующие вещества, агенты распада, абсорбенты, красители или подсластители. В качестве примеров эксципиентов можно привести в качестве разбавителей: лактоза, декстроза, сахароза, маннитол, сорбитол, целлюлоза, глицерин,в качестве любрикантов: кремнезем, талье, стеариновая кислота и ее магниевые и кальциевые соли,полиэтиленгликоль,в качестве связующих веществ: силикат магния и алюминия, крахмал, желатин, трагакантовая камедь, метилцеллюлоза, натрийкарбоксиметилцеллюлоза и поливинилпирролидон,в качестве агентов распада: агар, альгоновая кислота и ее натриевая соль, шипучие смеси. Процентное содержание активного ингредиента формулы (I) в фармацевтической композиции составляет преимущественно от 5 до 50 мас.%. Полезная дозировка варьируется в соответствии с возрастом и массой пациента, маршрутом введения, характером и тяжестью расстройства и проведением какого-либо связанного лечения и находится в диапазоне от 0,5 до 500 мг за одно или более введений в день. Данное изобретение проиллюстрировано следующими примерами. Структуры соединений, описанных в примерах, определяли в соответствии с обычными спектрофотометрическими методами (ИК-спектроскопия, ядерный магнитный резонанс, масс-спектрометрия). Сокращения: Пример 1. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]янтарной кислоты. Стадия А. трет-Бутил 3-[(5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил)окси]пропионат. Водный 50% раствор NaOH (6,4 г, 80 ммоль) добавляли в течение 15 мин к раствору, охлажденному до 15 С, 3,4-бис(фенилсульфонил)-1,2,5-оксадиазол-2-оксида (16 г, 44 ммоль) и трет-бутил 3 гидроксипропионата (10 г, 68 ммоль) в 200 мл безводного THF. После перемешивания в течение 2 ч раствор удаляли in vacuo, а осадок растворяли в 100 мл воды и 100 мл этилацетата. Органическую фазу декантировали, промывали насыщенным раствором NaCl, высушивали над сульфатом натрия и испаряли.- 13015092 Оставшееся масло очищали при помощи флэш-хроматографии, в качестве элюента использовали(98/2) смесь дихлорметан/этилацетат с получением желаемого продукта. Стадия В. 3-[(5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил)окси]пропионовая кислота (соединение В 4). 14 г Соединения, полученного на стадии А, растворяли в 100 мл дихлорметана под аргоном, добавляли 10 мл TFA, а затем перемешивали в течение 6 ч при температуре окружающей среды. Растворители удаляли in vacuo. Осадок кристаллизовали в диизопропиловом эфире с получением желаемого продукта. Точка плавления: 138 С. Стадия С. ди-трет-Бутил (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]сукцинат. Раствор соединения, полученного на предыдущей стадии (2,7 г, 8 ммоль), ди-трет-бутил L-аспартат гидрохлорида (2,25 г, 8 ммоль), EDCI (1,62 г, 8 ммоль), DIEA (1,32 г,8 ммоль) и НОВТ (1,1 г, 8 ммоль) в 100 мл безводного DMF перемешивали в течение 72 ч при температуре окружающей среды под аргоном.DMF удаляли путем отгонки, а затем осадок растворяли в 100 мл воды и 100 мл этилацетата. Затем органическую фазу промывали 5% раствором NaHCO3, сушили над Na2SO4 а затем испаряли до сухого остатка. Сырой реакционный продукт очищали при помощи флэш-хроматографии, в качестве элюента использовали (90:10) смесь дихлорметан/этилацетат. Стадия D. (2S)-2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]янтарная кислота (соединение В 5). Раствор соединения, полученного на предыдущей стадии (4 г, 7,3 ммоль), в 100 мл дихлорметана и 15 мл TFA перемешивали в течение 6 ч под аргоном. Растворители отгоняли до получения сухого остатка. Осадок растирали в порошок в диизопропиловом эфире в течение 2 ч до начала кристаллизации. Фильтровали и высушивали. Точка плавления: 130-131 С. Стадия Е. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]янтарной кислоты. Готовили раствор периндоприла или (2S,3aS,7aS)-l-[(2S)-2-[(1S)-l-(этоксикарбонил)бутил]амино пропионил]октагидро-1 Н-индол-2-карбоновой кислоты (368 г, 1 ммоль) и соединения, полученного на предыдущей стадии (429 г, 1 ммоль), в 50 мл воды и 50 мл ацетонитрила. Фильтровали через ватман и лиофилизовали. Элементный микроанализ: Пример 2. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 5-оксида 4-метил-1,2,5-оксадиазол-3-карбоновой кислоты. Стадия А. 4-Метил-1,2,5-оксадиазол 5-оксид-3-карбоксальдегид. Раствор кротонового альдегида (100 г, 1,42 моль) в 200 мл уксусной кислоты добавляли в течение 3 ч 30 мин к охлажденному до 0-5 С раствору нитрита натрия (340 г, 4,2 моль) в 400 мл воды. После перемешивания в течение 1 ч 150 мл воды добавляли и проводили экстракцию 6 раз, каждый раз используя 100 мл CH2Cl2. Соединенные органические фазы промывали 100 мл воды, сушили над Na2SO4 и испаряли до сухого остатка. Осадок очищали при помощи флэш-хроматографии, используя дихлорметан в качестве элюента. Точка плавления: 62 С. Стадия В. 4-Метил-1,2,5-оксадиазол 5-оксид-3-карбоновая кислота (соединение В 1). 14,2 г KMnO4 (90 ммоль) добавляли порциями в течение 1 ч 30 мин, сохраняя температуру 20 С, к раствору 7 г соединения, полученного на стадии А, в 400 мл воды. Затем добавляли 100 мл 1 М NaOH и фильтровали через 200 г цеолита. Затем фильтрат подкисляли 100 мл 1 М HCl и концентрировали до объема 100 мл при помощи роторного испарителя. После 8-кратной экстракции по 100 мл дихлорметана органические фракции высушивали над Na2SO4, а затем испаряли с получением желаемого соединения. Точка плавления: 92 С. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 5-оксида 4-метил-1,2,5-оксадиазол-3-карбоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 3. (2S,3aS,7aS)-1-[(2S)-2-[(lS)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2R,3R)-2-гидрокси-3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3 ил]оксиянтарной кислоты. Стадия А. ди-трет-Бутил (2R,3R)-2-гидрокси-3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3 ил]оксисукцинат. 50% раствор NaOH (1,2 г, 30 ммоль) добавляли в течение 1/2 ч к раствору 3,4 бис(фенилсульфонил)-1,2,5-оксадиазол 2-оксида (7 г, 19 ммоль) и ди-трет-бутил тартрата (5 г, 19 ммоль) в 100 мл безводного THF. После перемешивания в течение 5 ч растворитель испаряли до сухого остатка,а осадок растворяли в воде и этилацетате. Органическую фракцию высушивали над Na2SO4 и испаряли до сухого остатка, а затем очищали при помощи флэш-хроматографии, используя смесь (98:2) дихлорметан/этанол в качестве элюента, с получением желаемого продукта в виде бесцветного масла. Стадия В. (2R,3R)-2-Гидрокси-3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиянтарная кислота (соединение В 3). Соединение, полученное на предыдущей стадии, перемешивали в течение 4 ч в 50 мл дихлорметана и 10 мл TFA. Растворители удаляли in vacuo и осадок кристаллизовали в диизопропиловом эфире. Точка плавления: 198-200 С. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(lS)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2R,3R)-2-гидрокси-3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3 ил]оксиянтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 4. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]глутаровой кислоты. Стадия А. ди-трет-Бутил (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]глутарат. Раствор на основе соединения В 4, полученного на стадии В примера 1 (2,5 г, 8 ммоль), ди-третбутил гидрохлорид L-глутамата (2,36 г, 8 ммоль), EDCI (1,62 г, 8 ммоль), DIEA (1,32 мл, 8 ммоль) и НОВТ (1,1 г, 8 ммоль) в 100 мл безводного DMF перемешивали в течение 72 ч при температуре окружающей среды. DMF удаляли путем отгонки, а затем осадок растворяли в 100 мл воды и 100 мл этилацетата. Органическую фазу промывали 5% раствором NaHCO3, затем водой, высушивали над Na2SO4 и испаряли до сухого осадка. Очистку при помощи флэш-хроматографии проводили с использованием смеси(90:10) дихлорметан/этилацетат в качестве элюента с получением желаемого продукта в форме бесцветного масла. Стадия В. (2S)-2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]глутаровая кислота (соединение В 6). Раствор соединения, полученного на стадии А (3 г, 5,5 ммоль), в 100 мл дихлорметана и 15 мл TFA перемешивали в течение 6 ч под аргоном. Растворители отгоняли in vacuo. Осадок растирали в порошок в диизопропиловом эфире, фильтровали, а затем высушивали в вакууме in vacuo с получением желаемого продукта в виде белых кристаллов. Точка плавления: 157-158 С. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси пропионил)амино]глутаровой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 5. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2E)-3-(4-метил-5-оксидо-1,2,5-оксадиазол-3-ил)акриловой кислоты. Стадия А. трет-Бутил (2 Е)-3-(4-метил-5-оксидо-1,2,5-оксадиазол-3-ил)акрилат. Раствор соединения, полученного на стадии А примера 2 (3,9 г, 30 ммоль), и трет-бутилтрифенилфосфинометилиденкарбоксилата (13,1 г, 35 ммоль) в 100 мл безводного THF перемешивали в течение 1 ч при температуре окружающей среды. Раствор удаляли in vacuo, а затем осадок очищали при помощи флэш-хроматографии с использованием дихлорметана в качестве элюента с получением желаемого продукта в виде белых кристаллов. Точка плавления: 72-74 С. Стадия В. (2 Е)-3-(4-Метил-5-оксидо-1,2,5-оксадиазол-3-ил)акриловая кислота (соединение В 2). Раствор соединения, полученного на предыдущей стадии (6,2 г, 27 ммоль), в 100 мл дихлорметана и 10 мл TFA перемешивали в течение 8 ч при температуре окружающей среды. Растворители затем испаряли in vacuo, а осадок кристаллизовали в диэтиловом эфире, а затем фильтровали и высушивали с получением желаемого продукта в виде белых кристаллов. Точка плавления: 160 С. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2 Е)-3-(4-метил-5-оксидо-1,2,5-оксадиазол-3-ил)акриловой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 6. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]этансульфоновой кислоты. Стадия А. N-2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)окси]5-норборнен-2,3-дикарбоксимид. Раствор соединения В 4, полученного на стадии В примера 1 (2,5 г, 5,4 ммоль), N-гидрокси-5 норборнен-2,3-дикарбоксимида (1,03 г, 5,4 ммоль) и DCC (1,17 г, 5,4 ммоль) в 100 мл безводного THF перемешивали в течение 20 ч при температуре окружающей среды. Образующуюся дициклогексилмочевину удаляли путем фильтрования, a THF удаляли путем отгонки in vacuo. Сырой продукт растворяли в 80 мл этилацетата, снова фильтровали и испаряли до сухого осадка. Активированный эфир, полученный таким образом, использовали на стадии В без очистки. Стадия В. 2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино] этансульфоновая кислота (соединение В 11). Раствор активированного эфира, полученного на предыдущей стадии (2,56 г,5,4 ммоль), таурина(0,81 г, 6,5 ммоль) и NaHCO3 (0,54 г, 6,5 ммоль) в 80 мл воды перемешивали при температуре окружающей среды на протяжении 48 ч. Растворители удаляли путем отгонки in vacuo. Осадки растворяли в 100 мл воды и 100 мл этилацетата. После экстракции и декантирования водную фазу элюировали на препаративной ВЭЖХ колонке DOWEX 50WX8 с катионно-обменной смолой. Растворитель испаряли in vacuo. Осадок очищали на препаративной ВЭЖХ колонке DOWEX 50WX8 с катионно-обменной смолой, элюируя смесью (650:350:1) вода-ацетонитрил-TFA. Очищенные фракции лиофилизировали. Стадия С. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]этансульфоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е, пример 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ:- 16015092 Пример 7. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль [(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]метилфосфоновой кислоты. Стадия А. [(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]метилфосфоновая кислота (соединение В 9). Раствор соединения, полученного на стадии А примера 6 (2,14 г, 4,5 ммоль), аминометилфосфоновой кислоты (0,7 г, 6 ммоль) и NaHCO3 (1 г, 12 ммоль) в 50 мл диоксана и 50 мл воды перемешивали в течение 72 ч при температуре окружающей среды. Растворители затем испаряли до сухого остатка, осадок растворяли в 100 мл воды и 100 мл этилацетата и перемешивали в течение 1 ч. После декантирования водную фазу очищали на катионно-обменной колонке DOWEX 50WX8. Осадок, полученный после испарения воды, кристаллизовали в ацетонитриле, фильтровали и высушивали in vacuo с получением желаемого продукта. Точка плавления: 171-172 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль [(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]метилфосфоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 8. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2,2'-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)имино]диуксусной кислоты. Стадия А. ди-трет-Бутил 2,2'-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]диацетат. Раствор соединения, полученного на стадии В примера 1 (3,5 г, 11 ммоль), ди-трет-бутил иминодиацетата (2,74 г, 11 ммоль), НОВТ (1,5 г, 11 ммоль) и EDCI (2,4 г, 12 ммоль) в 100 мл безводного DMF перемешивали при температуре окружающей среды в течение 72 ч. DMF удаляли путем отгонки invacuo. Осадок растворяли в 100 мл воды и 100 мл этилацетата. Органическую фазу промывали водным 5% раствором NaHCO3, высушивали над Na2SO4 и испаряли до сухого осадка. Осадок очищали при помощи флэш-хроматографии, в качестве элюента использовали смесь (95:5) дихлорметан-этилацетат с получением желаемого продукта в форме бесцветного масла. Стадия В. 2,2'-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино] диуксусная кислота (соединение B8). Раствор соединения, полученного на предыдущей стадии (800 мг, 1,5 ммоль), в 50 мл дихлорметана и 5 мл TFA перемешивали в течение 6 ч при температуре окружающей среды. Растворители затем испаряли in vacuo. Осадок кристаллизовали в диизопропиловом эфире, отфильтровывали, а затем сушили в вакууме с получением желаемого продукта в виде белых кристаллов. Точка плавления: 154 С (разложения). Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2,2'-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)имино]диуксусной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 9. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]этилфосфоновой кислоты. Стадия А. [(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино] этилфосфоновая кислота (соединение В 7). Соединение получали в соответствии с процедурой, описанной на стадии А примера 7, с заменой аминометилфосфоновой кислоты на аминоэтилфосфоновую кислоту. Точка плавления: 162 С.- 17015092 Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксипропионил)амино]этилфосфоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ:(4,5 г, 31 ммоль) в 100 мл THF. После перемешивания в течение 1 ч раствор удаляли in vacuo, а осадок растворяли в воде (100 мл) и этилацетате (100 мл). Органические фазы высушивали над Na2SO4, а затем испаряли до сухого осадка. Осадок очищали при помощи флэш-хроматографии с использованием смеси(95/5) дихлорметан/этанол в качестве элюента с получением желаемого продукта в форме бесцветного масла. Стадия В. (2-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиэтил)фосфоновая кислота(соединение В 10). 2,9 мл триметилсилилбромида (4 экв.) добавляли к раствору соединения, полученного на предыдущей стадии (1,8 г, 4 ммоль), в 50 мл диоксана, а затем реакционную смесь нагревали в течение 4 ч при 60 С. Растворители выпаривали до сухого осадка. Осадок очищали на колонке Biogel с элюированием смеси (1/1) вода/ацетонитрил. Фракции, содержащие очищенный продукт, лиофилизовали. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиэтил)фосфоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 11. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль моно-(6-нитрооксигексагидрофуро[3,2-b]фуран-3-ил)янтарной кислоты. Стадия А. Моно-(6-нитрооксигексагидрофуро[3,2-b]фуран-3-ил)сукцинат (соединение В 12). Раствор изосорбид мононитрата (5,73 г, 30 ммоль), ангидрида янтарной кислоты (3,0 г, 30 ммоль) и 100 мг DMAP в 100 мл ацетонитрила кипятили с обратным холодильником в течение 20 ч. Затем растворитель удаляли путем испарения. Продукт очищали при помощи флэш-хроматографии с использованием смеси (98/2) дихлорметан/этанол в качестве элюента. Полученный продукт рекристаллизовали из диизопропилового эфира с получением желаемого продукта в виде белого твердого вещества. Точка плавления: 65 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль моно-(6-нитрооксигексагидрофуро[3,2-b]фуран-3-ил)янтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 12. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль N-(3-[5-оксидо-4-(фенилсульфонил-1,2,5-оксадиазол-3-ил]оксипропи- 18015092 онил)глициновой кислоты. Стадия А. трет-Бутил N-(3-[5-оксидо-4-(фенилсульфонил-1,2,5-оксадиазол-3-ил]оксипропионил) глицинат. Раствор соединения, полученного на стадии В примера 1 (1,5 г, 4 ммоль), трет-бутилглицината (0,6 г, 4 ммоль), EDCI (0,81 г, 4 ммоль) и НОВТ (0,57 г, 4 ммоль) в 100 мл безводного DMF перемешивали в течение 24 ч при температуре окружающей среды под аргоном. Затем DMF удаляли путем отгонки, а осадок растворяли в 100 мл воды и 100 мл этилацетата. Органическую фазу промывали 5% растворомNaHCO3 в воде, высушивали над Na2SO4, а затем испаряли до сухого осадка. Очистку при помощи флэшхроматографии проводили с использованием смеси (95/5) дихлорметан/этилацетат в качестве элюента с получением желаемого продукта в форме бесцветного масла. Стадия В. N-(3-[5-Оксидо-4-(фенилсульфонил-1,2,5-оксадиазол-3-ил)]оксипропионил)глициновая кислота (соединение В 13). Раствор соединения, полученного на предыдущей стадии (1,7 г, 4 ммоль), в 100 мл дихлорметана и 10 мл TFA перемешивали в течение 6 ч при температуре окружающей среды. Растворители затем удаляли in vacuo, а осадок растирали в порошок в диэтиловом эфире в течение 2 ч до начала кристаллизации. Фильтровали, высушивали в вакууме. Точка плавления: 177 С. Стадия С. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль N-(3-[5-оксидо-4-(фенилсульфонил-1,2,5-оксадиазол-3-ил)]оксипропионил)глициновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Пример 13. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(4-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси бутаноил)амино]янтарной кислоты. Стадия А. 4-[(5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил)окси]бутановая кислота (соединение В 16). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А и В примера 1, путем замещения трет-бутил-3-гидроксипропионата на трет-бутил-4-гидроксибутоната на стадии А. Точка плавления: 130-131 С. Стадия В. (2S)-2-[(4-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутаноил)амино] янтарная кислота (соединение В 14). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях С и D примера 1, исходя из соединения, полученного на предыдущей стадии. Стадия С. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(4-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси бутаноил)амино]янтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 14. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль [5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиуксусной кислоты. Стадия А. [5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиуксусная кислота (соединение B15). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А и В примера 1, путем замещения трет-бутил 3-гидроксипропионата на трет-бутил гидроксиацетат на стадии А. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль [5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиуксусной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 15. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль 3-[(5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил)окси]пропионовой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на стадии В примера 1. Пример 16. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1H-индоловая соль 4-[(5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил)окси]бутановой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на стадии А примера 13. Пример 17. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси) пропионовой кислоты. Стадия А. 3-(4-[(4-Хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)пропионовая кислота (соединение В 17). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А и В примера 1, путем замещения 3,4-бис(фенилсульфонил)-1,2,5-оксадиазол 2-оксида на 3,4-бис[(4-хлорфенил)сульфонил]-1,2,5-оксадиазол 2-оксид на стадии А. Стадия В. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси) пропионовой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Пример 18. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)пропионил]аминоянтарной кислоты. Стадия А. (2S)-2-[3-(4-[(4-Хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)пропионил]аминоянтарная кислота (соединение B18). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях С и D примера 1, исходя из соединения, полученного на стадии А примера 17. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)пропионил]аминоянтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 19. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси ацетил)амино]янтарной кислоты. Стадия А. (2S)-2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиацетил)амино] янтарная кислота (соединение B24). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А-D примера 1, путем замещения трет-бутил 3-гидроксипропионата на трет-бутил гидроксиацетат на стадии А. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси ацетил)амино]янтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ:(5,6 г, 40 ммоль) в 100 мл ацетонитрила кипятили с обратным холодильником в течение 16 ч. Минеральные соли отфильтровывали, а раствор удаляли путем отгонки in vacuo. Сырой продукт, полученный таким образом, очищали при помощи флэш-хроматографии на силикагеле с использованием смеси (95/5) дихлорметан/этанол в качестве элюента. Желаемый продукт получали в форме бесцветного масла. Стадия В. (2S)-2-[(2-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксиэтил)амино]янтарная кислота (соединение В 25). Соединение получали в соответствии с процедурой, описанной на стадиях А и В примера 1, путем замещения трет-бутил 3-гидроксипропионата на соединение, полученное на предыдущей стадии. Точка плавления: 160-161 С. Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[(2-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси этил)амино]янтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 21. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)пропионил]аминоянтарной кислоты. Стадия А. (2S)-2-[3-(4-[(4-Метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)пропионил]аминоянтарная кислота (соединение В 21). Соединение получали в соответствии с процедурой, описанной на стадиях А-D примера 1, путем замещения 3,4-бис(фенилсульфонил)-1,2,5-оксадиазол 2-оксида на 3,4-бис[(4-метилфенил)сульфонил]1,2,5-оксадиазол 2-оксид на стадии А. Точка плавления: 167-168 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)пропионил]аминоянтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 22. (2S,3aS,7aS)-l-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)бутаноил]аминоянтарной кислоты. Стадия А. (2S)-2-[3-(4-[(4-Хлорофенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)бутаноил]аминоянтарная кислота (соединение В 26). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А-D примера 1, путем замещения на стадии А трет-бутил 3-гидроксипропионата на трет-бутил 4-гидроксибутаноат и 3,4-бис(фенилсульфонил)-1,2,5-оксадиазол 2-оксида на 3,4-бис[(4-хлорфенил)сульфонил]-1,2,5 оксадиазол 2-оксид. Точка плавления: 145-146 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-хлорфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3- 21015092 илокси)бутаноил]амино]янтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 23. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)бутаноил]аминоянтарной кислоты. Стадия А. (2S)-2-[3-(4-[(4-Метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3-илокси)бутаноил]аминоянтарная кислота (соединение В 27). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А-D примера 1, путем замещения на стадии А трет-бутил 3-гидроксипропионата на трет-бутил 4-гидроксибутаноат и 3,4-бис(фенилсульфонил)-1,2,5-оксадиазол 2-оксида на 3,4-бис[(4-метилфенил)сульфонил]-1,2,5 оксадиазол 2-оксид. Точка плавления: 147-148 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль (2S)-2-[3-(4-[(4-метилфенил)сульфонил]-5-оксидо-1,2,5-оксадиазол-3 илокси)бутаноил]аминоянтарной кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ: Пример 24. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутаноил)амино]этансульфоновой кислоты. Стадия А. 2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутаноил)амино]этансулъфоновая кислота (соединение B28). Желаемое соединение получали в соответствии с процедурой, описанной на стадиях А и В примера 6, путем замещения на стадии А соединения В 4 на соединение B16, полученное на стадии А примера 13. Точка плавления: 131-132 С. Стадия В. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль 2-[(3-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутаноил)амино]этансульфоновой кислоты. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Элементный микроанализ:N,N-бис(2-сульфоэтил)-4-[5-оксидо-4-(фенилсульфонил)-1,2,5 оксадиазол-3-ил]оксибутанамида. Стадия А. N-2-[(3-[5-Оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутаноил)окси]-5 норборнен-2,3-дикарбоксимид. Желаемое соединение получали в соответствии с процедурой, описанной на стадии А примера 6,путем замещения соединения В 4 на соединение B16, полученное на стадии А примера 13. Стадия В. N,N-бис(2-Сульфоэтил)-4-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]окси бутанамид (соединение В 29). Желаемое соединение получали в соответствии с процедурой, описанной на стадии В примера 6,исходя из дитаурина (полученного в соответствии с DE 10033580) и соединения, полученного на предыдущей стадии.- 22015092 Стадия С. (2S,3aS,7aS)-1-[(2S)-2-[(1S)-1-(Этоксикарбонил)бутил]аминопропионил]-2-карбоксиоктагидро-1 Н-индоловая соль N,N-бuс(2-сульфоэтил)-4-[5-оксидо-4-(фенилсульфонил)-1,2,5-оксадиазол-3-ил]оксибутанамида. Соединение получали в соответствии с процедурой, описанной на стадии Е примера 1, исходя из периндоприла и соединения, полученного на предыдущей стадии. Фармакологическое исследование продуктов в соответствии с данным изобретением Пример 26. Донорная активность NO.In vitro. Использовали аортальные кольца без эндотелия. После первого сокращения, вызванного 60 мМ KCl для характеристики чувствительности кольца и промывания, стабильную концентрацию индуцировали норадреналином (0,1-0,3 мкМ) в присутствии или в отсутствие ингибитора гуанилатциклазы, ODQ (10 мкМ). Применяли серийные кумулятивные разведения, активность исследуемого продукта рассчитывали в соответствии с IC50 (доза, которая ингибирует максимальное действие на 50%). Результаты: соединения в соответствии с данным изобретением имели достаточно значимый расслабляющий эффект. Например, соединения примеров 1 и 7 имели значения IC50 0,048 и 0,047 мкМ соответственно. Пример 27. Ингибирование активности ангиотензин-I-превращающего фермента.In vivo. Крыс анестезировали пентобарбиталом и давали искусственное дыхание, а среднее артериальное давление измеряли катетером, помещенным в бедренную артерию и соединенным с датчиком давления. Блуждающий нерв разделили на секции и вводили мекамиламин (блокатор симпатического ганглия) i.v. в количестве 1,5 мг/кг. После стабилизации вводили ангиотензин I i.v. в количестве 1,5 мкг/кг. Максимальный гипертензивный отклик на ангиотензин I, измеренный у крыс за 60 мин до анестезии, получали орально путем введения сенегальской камеди отдельно (контрольная группа) или анализируемого соединения в сенегальской камеди. Ингибирующий эффект определяли как процентное содержание, полученное от отклика на ангиотензин I по сравнению с контрольной группой. Результаты: соединения в соответствии с данным изобретением имеют достаточно значимый ингибирующий эффект. Например, введение в дозах 0,1 мг/кг соединений примера 7 приводят к ингибированию ангиотензина I на 85 и 88% соответственно. Пример 28. Фармацевтическая композиция. Препаративный состав для 1000 таблеток, каждая из которых содержит дозу в 100 мг.(А)m(В)n (I),где А представляет собой соединение - ингибитор ангиотензинпревращающего фермента, обладающее формулой (II) где R1 представляет собой атом водорода или линейную либо разветвленную C1-С 6 алкильную группу,R2 - линейную или разветвленную C1-С 6 алкильную группу или арил-(C1-С 6)алкильную группу, где алкильная группа является линейной или разветвленной,R3 - линейную или разветвленную C1-С 6 алкильную группу или амино-(C1-С 6)алкильную группу, где алкильная группа является линейной или разветвленной,- моноциклическую или бициклическую азотсодержащую систему, содержащую от 3 до 12 атомов углерода, необязательно содержащую один или более дополнительных гетероатомов, выбранных- 23015092 из N, О и S, где указанная система необязательно замещена одной или более группами, выбранными из линейного или разветвленного C1-С 6 алкила, линейного или разветвленного C1-С 6 алкокси, оксо, карбокси,арила, С 3-С 8 циклоалкила, гетероарила, карбокси-(C1-С 6)алкила, где алкильная группа является линейной или разветвленной, и гидрокси,и которая в случае, если азотсодержащая система является бициклической, может быть конденсированной, спиро или мостиковой,В обладает формулой (III) где X представляет собой СО 2 Н, SO3H или Р(O)(ОН)2-группу,Ak1 и Ak2, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную или ненасыщенную, линейную или разветвленную С 1-С 8 алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота, или SO2-группой,где указанная алкиленовая группа необязательно замещена одной или более группами, выбранными из СО 2 Н, SO3H, гидрокси и амино,х, у и z, которые могут быть одинаковыми или различными, каждый представляет собой 0 или 1,Y представляет собой СО или CONH,Z представляет собой NO-донорную группу, выбранную из следующих групп: и его региоизомер в данных формулах,р представляет собой 0 или 1,R5 и R6, которые могут быть одинаковыми или различными, каждый представляет собой линейную или разветвленную C1-С 6 алкильную группу, или R5 и R6 вместе с несущим их атомом азота образуют азотсодержащий гетероцикл, содержащий от 3 до 7 кольцевых атомов, необязательно замещенный линейной или разветвленной C1-С 6 алкильной группой,R7 представляет собой метильную или аминокарбонильную группу,и R4 и R'4, которые могут быть одинаковыми или различными, каждый представляет собой атом водорода или галогена или линейный либо разветвленный С 1-С 6 алкил, трифторметильную или трифторметоксигруппу,m представляет собой количество кислотных функций В, которые были превращены в соль, иn представляет собой количество основных функций А, которые были превращены в соль, где связь или связи между А и В имеют ионную природу. 2. Соединения формулы (I) по п.1, где представляет собой пирролидиновый, пергидроиндольный, октагидроциклопента[b]пиррольный, имидазолиновый или тетрагидроизохинолиновый цикл. 3. Соединения формулы (I) по п.1, где А представляет собой эналаприл, эналаприлат, лизиноприл,периндоприл, периндоприлат, рамиприл, спираприл, трандораприл, трандораприлат, имидаприл, моэксиприл, хинаприл или рамиприлат. 4. Соединения формулы (I) по п.1, выбранные из следующих соединений: в данных формулах значение В такое, как определено в п.1. 5. Соединения формулы (I) по п.1, где соединение формулы (III) выбирают из соединений следующих формул:Ak1, х, у, z и Z являются такими, как определено в п.1,Ak3 и Ak5, которые могут быть одинаковыми или различными, каждый представляет собой насыщенную линейную или разветвленную C1-С 6 алкиленовую группу, в которой один или более атомов углерода могут быть замещены атомом кислорода, серы или азота или SO2-группой,Ak4 представляет собой насыщенную линейную или разветвленную C1-С 3 алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота или SO2 группой,Ak6 представляет собой насыщенную линейную или разветвленную С 2-С 5 алкиленовую группу, в которой один из атомов углерода может быть замещен атомом кислорода, серы или азота или SO2 группой,Het представляет собой О или NH иY1 представляет собой карбонильную группу. 6. Соединения формулы (I) по любому из пп.1-5, где В выбирают из следующих соединений:
МПК / Метки
МПК: A61P 9/00, C07D 413/02, A61K 31/4245, A61K 31/662, C07F 9/38, C07D 271/08, A61P 9/12, A61K 31/4725
Метки: композиция, получения, кислотами, соли, фермента, фармацевтическая, ангиотензин-i-превращающего, присоединения, ингибиторов, содержащая, no-донорными, способ
Код ссылки
<a href="https://eas.patents.su/30-15092-soli-prisoedineniya-ingibitorov-angiotenzin-i-prevrashhayushhego-fermenta-s-no-donornymi-kislotami-sposob-ih-polucheniya-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Соли присоединения ингибиторов ангиотензин-i-превращающего фермента с no-донорными кислотами, способ их получения и содержащая их фармацевтическая композиция</a>
Предыдущий патент: Способ получения полимерных конъюгатов доксорубицина с контролируемым ph высвобождением лекарственного средства
Следующий патент: Кремнийсодержащее соединение в качестве ингибитора коррозии в полиолефиновых композициях
Случайный патент: Связанные с матрицей пептидомиметики β-шпилечной структуры с активностью антагонистов cxcr4












