Производные 1-{4-(5-арил-[1,2,4]-оксадиазол-3-ил)бензил}пиперидин-4-илкарбоновой кислоты в качестве агонистов s1p1 рецепторов
Номер патента: 23638
Опубликовано: 30.06.2016
Авторы: Рана Диджикса Чандубхай, Тхеннати Раджаманнар, Патхак Сандееп Панкаджбхай, Капе Марк, Лёкомт Жанн -Мари, Панчал Бхавеш М., Десай Джапан Нитинкумар, Робер Филипп, Пал Ранджан Кумар, Шварц Жан -Шарль, Арадхие Джайрай Д., Саманта Бисваджит, Берреби-Бертран Изабэль, Пиллай Мутхукумаран Натараджан, Праджапати Каушик Дханджубхай
Формула / Реферат
1. Соединение формулы (I)
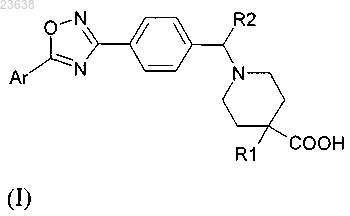
где Ar представляет собой фенильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из галогена, С1-С6 алкила, С3-С10 циклоалкила,
-О-С1-С6 алкила, фенила;
R1 представляет собой -X-(Y)n,
где -Х- выбирают из -С1-С6 алкила-, -С2-С15 алкенила-, фенила, -С1-С6 алкилфенила,
каждый из Y, идентичный остальным или отличный от них, выбирают из Н, ОН, галогена, -О-С1-С6 алкила, -О-С1-С6 алкилфенила-, -О-С1-С6 алкил-О-С1-С6 алкила, -О-фенила, 5-14-членного гетероарила, содержащего по меньшей мере один гетероатом, выбранный из N, О, S, -О-фенил(О-С1-С6 алкила), -О-С3-С10 циклоалкила, -С3-С10 циклоалкила, 3-14-членного гетероциклила, содержащего по меньшей мере один гетероатом, выбранный из N, О, S;
n равно 1-2;
R2 выбирают из Н;
или один из его изомеров или солей.
2. Соединение по п.1, где Ar представляет собой дизамещенную фенильную группу.
3. Соединение по п.1 или 2 формулы (II)
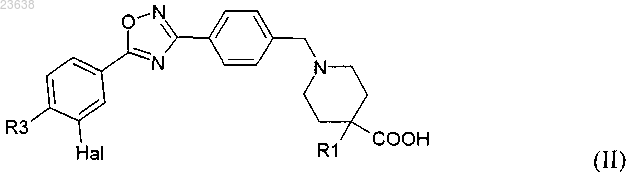
где R1 является таким, как определено в п.1;
R3 выбирают из галогена, фенила, С3-С10 циклоалкила, С1-С6 алкила и -О-С1-С6 алкила;
Hal представляет собой атом галогена.
4. Соединение по любому из предыдущих пунктов, где R1 выбирают из
метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторичного бутила, третичного бутила, н-пентила, изопентила, н-гексила, изогексила, гидроксиметила, гидроксиэтила, гидроксипропила, метоксиметила, этоксиметила, метоксиэтила, винила, аллила, метоксиэтоксиметила, этоксиэтоксиметила, этоксиэтоксиэтила, фенила, бензила, бензилоксиметила, бензилоксиэтила, -CH2-[Ph(o-F)], -CH2-[Ph(m-F)], -CH2-[Ph(p-F)], -СН2-[Ph(o-OMe)], -CH2-[Ph(m-OMe)] или -CH2-[Ph(p-OMe)], метоксибутила, метоксиэтоксиметила, метоксиэтоксиэтила, -CH2-[Ph(o,o-F2)], -CH2-[Ph(m-CF3)], -СН2-фурила, -СН2-пиридила, (2-метоксифенокси)этила, 4-метоксибензила, изопропоксиметила, циклопентилоксиметила, тиофен-2-илметила, циклопропилметила, 2-морфолин-4-ил-этила, 3-пиперидин-1-ил-пропила, 3-пирролидин-1-ил-пропила.
5. Соединение по любому из предыдущих пунктов, где R2 представляет собой Н.
6. Соединение по любому из предыдущих пунктов, где R3 выбирают из фенила, циклогексила, циклопентила, изобутила, изопропокси.
7. Соединение по любому из предыдущих пунктов, которое выбирают из
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклопентилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклопентилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
4-аллил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-пропилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-гидроксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
4-аллил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]-оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-пропилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
4-бензилоксиметил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
4-бензилоксиметил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-гидроксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-фенилпиперидин-4-карбоновой кислоты;
4-бензил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-фторбензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-фторбензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксибензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
1-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибутил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-феноксиэтил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2,6-дифторбензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изобутилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изопропилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(3-трифторметилбензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-фуран-2-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-[2-(2-метоксифенокси)этил]пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-3-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-4-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(4-трет-бутил-3-хлорфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-пропилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
4-аллил-1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-фторбензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибензил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
4-бензил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-пиридин-3-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-этоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изопропоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-циклопентилоксиметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-тиофен-2-илметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-циклопропилметилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-морфолин-4-ил-этил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(3-пиперидин-1-ил-пропил)пиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(3-пирролидин-1-ил-пропил)пиперидин-4-карбоновой кислоты
и их фармацевтически приемлемых солей.
8. Соединение по любому из предыдущих пунктов, которое выбирают из
1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли натрия и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли аргинина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли калия и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты,;
1-{4-[5-(3-хлор-4-циклопентилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и
1-{4-[5-(3-хлор-4-циклопентилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-аллил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пропилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-гидроксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-аллил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пропилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-бензилоксиметил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-бензилоксиметил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-гидроксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-фенилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-бензил-1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-фторбензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-фторбензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксибензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метокси-бутил)пиперидин-4-карбоновой кислоты;
соли калия и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-фенокси-этил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2,6-дифтор-бензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изобутил-пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изопропил-пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(3-трифторметилбензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-фуран-2-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-[2-(2-метоксифенокси)этил]пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-3-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-4-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(4-трет-бутил-3-хлорфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-пропилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-аллил-1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метокси-бензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-фтор-бензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(4-метоксибензил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-этилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 4-бензил-1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-2-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изопропоксифенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-метоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(2-хлорбифенил-4-ил)-[1,2,4]оксадиазол-3-ил]бензил}-4-пиридин-3-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-(2-этокси-этоксиметил)пиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-изопропоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-циклопентилоксиметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-тиофен-2-илметилпиперидин-4-карбоновой кислоты;
соли трет-бутиламина и 1-{4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]бензил}-4-циклопропилметилпиперидин-4-карбоновой кислоты
или одного из их изомеров.
9. Способ получения соединения по любому из предыдущих пунктов, включающий омыление соединения формулы (III)
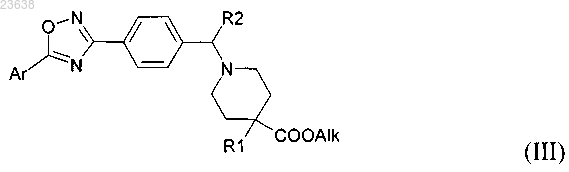
где Ar, R2, R1 являются такими, как определено в любом из предыдущих пунктов, и
Alk представляет собой С1-С6 алкильную группу, необязательно, с последующим образованием желаемой соли присоединения.
10. Способ по п.9, который дополнительно включает стадию получения соединения формулы (III) посредством сочетания соединения формулы (IV)
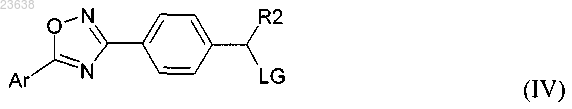
с соответствующим соединением формулы (V)

где Ar, R2, R1 являются такими, как определено в любом из пп.1-8,
Alk является таким, как определено в п.9, и
LG представляет собой уходящую группу.
11. Способ по п.10, дополнительно включающий стадию получения соединения формулы (IV), где LG представляет собой галогенид или мезилат, посредством преобразования соединения формулы (VI)

где Ar и R2 являются такими, как определено в любом из пп.1-8, в желаемый галогенид или мезилат.
12. Способ получения соединения по любому из пп.1-8, включающий взаимодействие соединения формулы (VII)

с соединением формулы (VIII)

где Ar, R2, R1 являются такими, как определено в любом из пп.1-8, и
R может представлять собой алкил в кислотной среде с последующим добавлением восстанавливающего агента, необязательно с последующим образованием желаемой соли присоединения.
13. Способ по п.12, дополнительно включающий стадию получения соединения формулы (VII) посредством окисления соединения формулы (VI)
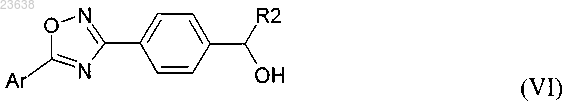
где Ar и R2 являются такими, как определено в любом из пп.1-8.
14. Способ по п.11 или 13, дополнительно включающий:
(а) получение соединения формулы (VI), где R2 представляет собой Н, посредством взаимодействия соединения формулы (IX)

где Ar является таким, как определено в любом из пп.1-8, с N-гидрокси-4-гидроксиметилбензамидином, необязательно в присутствии одного или нескольких активирующих агентов и/или агентов сочетания, с необязательным последующим
(b) окислением полученного соединения формулы (VI), где R2 представляет собой Н с последующим его взаимодействием с алкилмагнийгалогенидом.
15. Способ по любому из пп.9-14, дополнительно включающий стадию выделения полученного соединения.
16. Соединение формулы (VI)
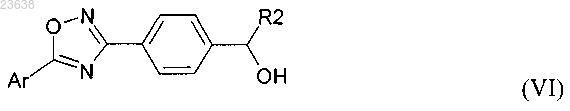
где R2 выбирают из Н, С1-С20 алкила и Ar представляет собой группу формулы

где Hal представляет собой Cl и R3 выбирают из галогена, С6-С14 арила, С3-С10 циклоалкила, С1-С20 алкила.
17. Применение соединения по любому из пп.1-8 при лечении и/или предотвращении отторжения транспланта, иммунных расстройств, аутоиммунных заболеваний, ишемии, воспалительных и хронических воспалительных состояний, которые включают ревматоидный артрит, астму, поллиноз, псориаз, болезнь Альцгеймера, миокардит, атопический дерматит, лимфоцитарные лейкозы, лимфомы, сепсис, множественный склероз, красную волчанку, воспалительные заболевания пищеварительного тракта, сахарный диабет, гломерулонефрит, атеросклероз, мультиорганную недостаточность, пневмонию, ишемическое реперфузионное повреждение, хроническое обструктивное пульмонарное заболевание, инфекцию, связанную с воспалением, вирусное воспаление, гепатит, хронический бронхит, гранулематозное заболевание, а также расстройства, связанные с ослаблением целостности сосудов, рак.
18. Применение по п.17, где отторжение транспланта представляет собой отторжение пересаженных гканей.
19. Применение по п.17, где аутоиммунное заболевание представляет собой аутоиммунный увеит.
20. Фармацевтическая композиция, содержащая комбинацию, содержащую соединение по любому из пп.1-8 с иммуносупрессантом, выбранным из адренокортикальных стероидов, циклоспорина, азатиоприна, метотрексата, ингибиторов кальцийнейрина, антител, блокирующих рецептор IL-2, антител, подавляющих Т-лимфоциты и другие иммунные клетки, анти-TNF, микофенолата, ингибиторов mTOR.
21. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8.
Текст
Настоящее изобретение относится к новым соединениям формулы (I) действующим в качестве агонистов S1P (сфингозин-1-фосфат) рецепторов, к композициям,содержащим эти соединения, к применениям этих соединений в медицине и к способу их получения.(71)(73) Заявитель и патентовладелец: БИОПРОЖЕ (FR); САН ФАРМА ЭДВАНСТ РИСЕРЧ КОМПАНИ ЛТД. Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям, действующим в качестве агонистов рецепторов S1P (сфингозин-1-фосфата), к композициям, содержащим эти соединения, к применению этих соединений в медицине и к способу их получения. Предшествующий уровень техникиS1P представляет собой биологически активный сфинголипидный метаболит, который непосредственно глубоко вовлечен в медиирование разнообразных иммунологических процессов посредством его воздействия на S1P рецепторы. S1P рецептор, исходно определяемый как рецептор гена дифференциации эндотелия (EDG), представляет собой семейство пяти родственных G-белок-сопряженных рецепторов, а именно S1P1/EDG1, S1P2/EDG5, S1P3/EDG3, S1P4/EDG6 и S1P5/EDG8. Эти рецепторы имеют широкое распространение в клетках и тканях и являются очень консервативными для человека и видов грызунов.S1P хранится в тромбоцитах и высвобождается из них при их активировании, но может также синтезироваться в разнообразных типах клеток в ответ на внеклеточные стимулы, подобные факторам роста и цитокинам. Он вовлечен в ряд клеточных функций, включая рост, дифференциацию, миграцию и апоптоз клеток, и таким образом, может играть важную роль при патофизиологических болезненных состояниях, таких как атеросклероз и рак. S1P оказывает эти разнообразные воздействия на клетки в зависимости от экспрессии конкретных субтипов S1P рецепторов и его связывания с этими рецепторами.EDG1 рецептор был первым идентифицированным S1P рецептором, который сначала выделили как орфанный GPCR (G-белок-сопряженный рецептор) в клетках эндотелия человека, и как было показано позднее, он кодирует S1P рецептор с высоким сродством. Экспрессия EDG1 является доминирующей,включая селезенку, головной мозг, сердце, легкие, адипозные ткани, печень, зобную железу, почки и скелетные мышцы. EDG5 впервые выделили как орфанный ген GPCR из сердечно-сосудистой и нервной системы крысы. Его экспрессирование является широко распространенным; он присутствует в сердце,легких, зобной железе, головном мозге, печени, почках, селезенке, адипозной ткани взрослых мышей и в легких, сердце, желудке, кишечнике и надпочечниках крыс. EDG3 выделяют в качестве орфанного генаGPCR посредством вырожденного клонирования на основе PCR из библиотеки геномной ДНК человека. Подобно EDG5, EDG3 представляет собой S1P рецептор с высоким сродством. Экспрессирование EDG3 является широко распространенным; он присутствует в селезенке, сердце, легких, зобной железе, почках,яичках, головном мозге и скелетных мышцах у взрослых мышей, и у людей, в сердце, плаценте, почках,печени, поджелудочной железе, скелетных мышцах, легких и головном мозге. В отличие от EDG1, EDG5 и EDG3 рецепторов, экспрессия EDG6 ограничена у людей и мышей лимфатическими узлами, селезенкой, легкими и зобной железой. Этот паттерн экспрессии говорит о потенциальной роли EDG6 в иммунной системе. Роли и функции EDG6 in vivo по-прежнему неизвестны. В мозгу крыс, EDG8 в основном экспрессируется в пучках белого вещества и в клетках последовательностей олигодендроцитов, что говорит об их потенциальной роли в созревании и миелинизации олигодендроцитов. Физиологическая рольEDG8 в опубликованных литературных источниках не обнаружена. Реакции, медиируемые EDG1 рецепторами, играют главную роль в модулировании направленной миграции клеток между лимфатической системой и кровью. Агонисты EDG1 рецепторов вызывают секвестрирование лимфоцитов во вторичных лимфоидных органах, которое связано с клинически полезной иммуносупрессией. Иммуносупрессия является желательной для предотвращения и/или лечения отторжения после трансплантации органа, ткани или клеток и при лечении аутоиммунных расстройств. Агенты, действующие в качестве иммуносупрессантов, как показано, являются полезными при различных аутоиммунных и воспалительных расстройствах, подобных отторжению транспланта, отторжению пересаженных тканей, иммунным расстройствам, аутоиммунным расстройствам, аутоиммунному увеиту,ишемии, ревматоидному артриту, поллинозу, множественному склерозу, сепсису, воспалительному заболеванию пищеварительного тракта, астме, сахарному диабету, атеросклерозу, красной волчанке, миокардиту, мультиорганной недостаточности, гломерулонефриту, атопическому дерматиту, лимфоцитарным лейкозам, лимфоме, болезни Альцгеймера, пневмонии, псориазу, а также расстройствам, связанным с ослабленной целостностью сосудов, раковым заболеваниям, дисрегуляторному ангиогенезу или избыточному неоангиогенезу. В последнее время FTY720 (Fingolimod), агонист EDG1 рецептора одобрен FDA для лечения пациентов с возобновляющейся формой множественного склероза. Однако имеются определенные исследования, которые сообщают, что FTY720 имеет отрицательное воздействие в виде бессимптомной брадикардии, которое, как сообщается, связано с неселективным агонизмом по отношению к EDG3 рецептору(Bioorg. Med. Chem. Lett., 2004, 14, 3501). Таким образом, все еще имеется интерес к разработке агонистов S1P рецепторов, показывающих селективность к рецептору, по отношению к EDG1 рецептору, конкретно, соединений, которые показывают низкую относительную активность по отношению к EDG3 рецептору, экспрессируемому в тканях сердца. (Hale et al, Bioorg. Med. Chem. Lett. 14, (2004), 3501-3505). Различные агонисты EDG1 описаны в литературных источниках. Например, WO2003105771, Merck описывает агонисты EDG1, которые представляют собой оксадиазольные соединения, замещенные арильной группой в 3- и 5-положениях. Все соединения, описанные в этой заявке, представляют собой либо азетидинил-, либо пирролидинилкарбо-1 023638 новые кислоты. WO 2007132307, Pfizer, описывает соединения агонисты EDG1 рецепторов, имеющие оксадиазольное кольцо, замещенное в 3- и 5-положении арильной группой. Все соединения, описанные в этой заявке, представляют собой аминоциклоалкилкарбоновые кислоты, более конкретно, аминоциклобутаны, замещенные группой карбоновой кислоты. WO 2008152149 относится к дикарбоновым кислотам в качестве агонистов EDG1. Сущность изобретения Настоящее изобретение относится к определенным новым пиперидинмонокарбоновым кислотам,которые являются эффективными в качестве агонистов для S1P1 рецепторов человека. Настоящее изобретение относится к соединению формулы (I)Ar представляет собой фенильную группу, необязательно замещенную одной или несколькими идентичными или различными группами, выбранными из галогена, С 1-С 6 алкила, С 3-С 10 циклоалкила,-О-С 1-С 6 алкила, фенила;-Х- выбирают из -С 1-С 6 алкила-, -С 2-С 15 алкенила-, фенила, -С 1-С 6 алкилфенила,каждый из Y, идентичный остальным или отличный от них, выбирают из Н, ОН, галогена, -О-С 1-С 6 алкила, -О-С 1-С 6 алкилфенила-, -О-С 1-С 6 алкил-О-С 1-С 6 алкила, -О-фенила, 5-14-членного гетероарила,содержащего по меньшей мере один гетероатом,выбранный из N, О, S, -О-фенил(О-С 1-С 6 алкила), -О-С 3-С 10 циклоалкила, -С 3-С 10 циклоалкила, 314-членного гетероциклила, содержащего по меньшей мере один гетероатом, выбранный из N, О, S;R2 выбирают из Н; или к одному из его изомеров или солей. В предпочтительном варианте осуществления, настоящее изобретение относится к соединению формулы (I), где Ar представляет собой дизамещенный фенил, где заместители являются такими, как определено выше для формулы (I). Если не указано иного, термины, используемые выше или ниже, имеют значения, приписанные им ниже:"Алкил" представляет собой алифатическую углеводородную группу, которая может быть прямой или разветвленной, имеющую 1-20 атомов углерода в цепи, если не указано иного. Предпочтительные алкильные группы имеют 1-12 атомов углерода, более предпочтительно имеют 1-8 атомов углерода в цепи, наиболее предпочтительно имеют 1-6 атомов углерода в цепи. В особенно предпочтительном варианте осуществления алкильная группа имеет 1-4 атома углерода в цепи. Иллюстративные алкильные группы включают метил, этил, н-пропил, изопропил, изобутил, н-бутил, трет-бутил, н-пентил, 3-пентил,октил, нонил, децил."Циклоалкил" относится к неароматической моно- или полициклической углеводородной кольцевой системе из 3-10 атомов углерода. Более предпочтительно циклоалкильная группа имеет 4-10 атомов углерода, более предпочтительно 4-8 атомов углерода, а наиболее предпочтительно она имеет 4-6 атомов углерода. Иллюстративный моноциклический циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, и тому подобное. Иллюстративный полициклический циклоалкил включает 1-декалин, норборнил, адамант-(1- или 2-)ил."Арил" относится к ароматической моноциклической, бициклической или трициклической углеводородной кольцевой системе из 6-14 атомов углерода. Более предпочтительно арил относится к нециклическому или бициклическому кольцу, содержащему 6-10 атомов углерода. Иллюстративные арильные группы включают фенил, нафтил, иденил, фенантрил, бифенил. Наиболее предпочтительно арильная группа представляет собой фенил."Алкенил" относится к алифатической углеводородной группе, которая содержит двойную связь углерод-углерод и которая может быть прямой или разветвленной, имеющей 2-15 атомов углерода в цепи, если не указано иного. Предпочтительные алкениловые группы имеют 2-12 атомов углерода в цепи; более предпочтительно примерно 2-8 атомов углерода в цепи, а наиболее предпочтительно имеют 2-4 атомов углерода в цепи. Иллюстративные алкениловые группы включают этенил, пропенил, н-бутенил,изобутенил, 3-метилбут-2-енил, н-пентенил, гептенил, октенил, ноненил, деценил."Алкинил" относится к алифатической углеводородной группе, которая содержит тройную связь углерод-углерод и которая может быть прямой или разветвленной, имеющей 2-15 атомов углерода в це-2 023638 пи, если не указано иного. Предпочтительные алкинильные группы имеют 2-12 атомов углерода в цепи; более предпочтительно имеют 2-8 атомов углерода в цепи, наиболее предпочтительно имеют 2-4 атомов углерода в цепи. Иллюстративные алкинильные группы включают этинил, пропинил, н-бутинил, 2 бутинил, 3-метил-1-бутинил, н-пентинил, 4,4-диметил-2-пентинил, гептинил, октинил и децинил."-О-арилалкил" относится к группе, где -О присоединен к алкильной группе, которая является замещенной арильной группой. Термины "алкил" и "арил" являются такими, как определено выше. Иллюстративные "О-арилалкильные" группы включают -О-СН 2-фенил. Термин "гетероарил" относится к 5-14-, предпочтительно 5-10-членному ароматическому моно-, биили полициклическому кольцу, где по меньшей мере один атом кольца представляет собой гетероатом,такой как N, О, S. Примеры включают пирролил, пиридил, пиразолил, тиенил, пиримидинил, пиразинил,тетразолил, индолил, хинолинил, пуринил, имидазолил, тиенил, тиазолил, бензотиазолил, фуранил, бензофуранил, 1,2,4-тиадиазолил, изотиазолил, триазоил, тетразолил, изохинолил, бензотиенил, изобензофурил, пиразолил, карбазолил, бензимидазолил, изоксазолил. Термины "гетероцикл", "гетероциклил" или "гетероциклический" относятся к насыщенным или частично ненасыщенным неароматическим стабильным 3-14-, предпочтительно 5-10-членным моно, биили полициклическим кольцам, где по меньшей мер, один атом кольца представляет собой гетероатом,такой как N, О, S. Как правило, гетероатомы включают, но, не ограничиваясь этим, атомы кислорода,азота, серы, селена и фосфора. Предпочтительные гетероатомы представляют собой атомы кислорода,азота и серы. Пригодные для использования гетероциклы описаны также в Handbook of Chemistry andPhysics, 76th Edition, CRC Press, Inc., 1995-1996, pages 2-25 to 2-26, описание которого тем самым включается в качестве ссылки. Предпочтительные неароматические гетероциклы включают, но, не ограничиваясь этим, оксетанил, тетрагидрофуранил, диоксоланил, тетрагидропиранил, диоксанил, пирролидинил,пиперидил, морфолинил, имидазолидинил, пиранил. Предпочтительные насыщенные гетероциклы выбирают из тетрагидрофуранила, диоксоланила, тетрагидропиранила, диоксанила, пирролидинила, пиперидила, морфолинила, имидазолидинила, более предпочтительно, из тетрагидрофуранила, диоксоланила,тетрагидропиранила."Алкил", "циклоалкил", "алкенил", "алкинил", "арил", и тому подобное, также относятся к соответствующему двухвалентному "алкилену", "циклоалкилену", "алкенилену", "алкинилену", "арилену", и тому подобное, которые образуются посредством удаления двух атомов водорода. Соединения по настоящему изобретению обладают кислотной группой и основной группой, которые могут образовывать соответствующие соли. Таким образом, настоящее изобретение включает соли соединений формулы (I). Соли могут предпочтительно представлять собой фармацевтически приемлемые соли. Кислотная группа может образовывать соли с основанием. Основание может представлять собой основание органического амина, например, триметиламин, трет-бутиламин, трометамин, меглумин, эполамин, и тому подобное. Кислотная группа может также образовывать соли с неорганическими основаниями, подобными гидроксиду натрия, гидроксиду калия, и тому подобное. Основная группа может образовывать соли с неорганическими кислотами, подобными хлористоводородной кислоте, серной кислоте, бромистоводородной кислоте, сульфаминовой кислоте, фосфорной кислоте, азотной кислоте, и тому подобное, и с органическими кислотами, подобными уксусной кислоте, пропионовой кислоте, янтарной кислоте, винной кислоте, лимонной кислоте, метансульфоновой кислоте, бензолсульфоновой кислоте, глюкороновой кислоте, глутаминовой кислоте, бензойной кислоте, салициловой кислоте, толуолсульфоновой кислоте, щавелевой кислоте, фумаровой кислоте, малеиновой кислоте, и тому подобное. Кроме того, соединения формулы (I) могут образовывать соли четвертичного аммония и соли с аминокислотами, такими как аргинин, лизин, и тому подобное. Списки пригодных для использования солей можно найти в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985,p. 1418 и P.H. Stahl, C.G. Wermuth, Handbook of Pharmaceutical salts -Properties, Selection and Use, WileyVCH, 2002, описание которых тем самым включается в качестве ссылки. Как используется в настоящем документе, термин "пациент" относится к теплокровному животному, такому как млекопитающее, предпочтительно человек или человеческое дитя, которое страдает от одного или нескольких заболеваний и состояний, описанных в настоящем документе, или может в принципе страдать от них. Как используется в настоящем документе, "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое является эффективным при уменьшении,устранении, лечении или контроле симптомов описанных в настоящем документе заболеваний и состояний. Термин "контроль" предназначен для упоминания всех процессов, которые могут представлять собой замедление, прерывание, приостановку или остановку развития заболеваний и состояний, описанных в настоящем документе, но не должен обязательно указывать на полное устранение всех симптомов заболевания и состояния, и предназначен для включения профилактического лечения и хронического использования. Как используется в настоящем документе, выражение "фармацевтически приемлемый" относится к тем соединениям, материалам, композициям или дозированным формам, которые являются в рамках значимого медицинского суждения пригодными для контакта с тканями человеческих существ и животных без избыточной токсичности, раздражения, аллергической реакции или других проблемных осложнений, совместимых с разумным соотношением выгода-риск. Предпочтительный вариант осуществления соединения формулы (I) представлен соединением формулы (II) или одним из его изомеров или солей,гдеR1 является таким, как определено для соединения формулы (I);Hal представляет собой атом галогена. Другой предпочтительный вариант осуществления настоящего изобретения относится к соединению формулы (II), где R1 выбирают из С 1-6 алкила, С 2-4 алкенила, С 2-4 алкинила, арила и арилалкила, которые, каждый, являются необязательно замещенными одной или несколькими группами из ОН, галогена, -О-алкила, -О-арилалкила, -О-алкил-О-алкила, О-арила, гетероарила, -О-арил(О-алкила), -Оциклоалкила, -циклоалкила, гетероциклила. Более предпочтительно R1 выбирают из метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторичного бутила, третичного бутила, н-пентила, изопентила, н-гексила, изогексила, гидроксиметила, гидроксиэтила, гидроксипропила, метоксиметила, этоксиметила, метоксиэтила, винила, аллила, метоксиэтоксиметила, этоксиэтоксиметила, этоксиэтоксиэтила, фенила, бензила, бензилоксиметила, бензилоксиэтила, -CH2-[Ph(o-F)], -CH2-[Ph(m-F)], -CH2-[Ph(p-F)], -CH2-[Ph(o-OMe)], -CH2-[Ph(m-OMe)], -CH2[Ph(p-OMe)], метоксибутила, метоксиэтоксиметила, -CH2-[Ph(o,o-F2)], -CH2-[Ph(m-CF3)], -СН 2-фурила,-СН 2-пиридила, (2-метоксифенокси)этила, 4-метокси-бензила, изопропоксиметила, циклопентилоксиметила, тиофен-2-илметила, циклопропилметила, 2-морфолин-4-ил-этила, 3-пиперидин-1-ил-пропила, 3 пирролидин-1-ил-пропила. Еще более предпочтительно R1 выбирают из метила, этила, н-пропила, гидроксиметила, метоксиметила, аллила, метоксиэтоксиметила, фенила, бензила, бензилоксиметила, -CH2-[Ph(o-F)], -CH2-[Ph(pF)], -CH2-[Ph(o-OMe)], -CH2-[Ph(p-OMe)], метоксибутила, метоксиэтоксиметила, -CH2-[Ph(o,o-F2)], -CH2[Ph(m-CF3)], -СН 2-фурила, -СН 2-пиридила, (2-метоксифенокси)этила, 4-метоксибензила, изопропоксиметила, циклопентилоксиметила, тиофен-2-илметила, циклопропилметила, 2-морфолин-4-ил-этила, 3 пиперидин-1-ил-пропила, 3-пирролидин-1-ил-пропила, где p-F, o-F, р-ОМе и о-ОМе обозначают парафтор, орто-фтор, пара-метокси и орто-метокси соответственно. Более предпочтительно настоящее изобретение относится к соединению формулы (I) или (II) выше,гдеR3 выбирают из фенила, циклогексила, циклопентила, изобутила, изопропокси; где p-F, o-F, р-ОМе и о-ОМе обозначают пара-фтор, орто-фтор, пара-метокси и орто-метокси соответственно. Еще более предпочтительно настоящее изобретение относится к соединению формулы (I) или (II),где когда R1 представляет собой -СН 3, -С 2 Н 5, -n-С 3 Н 7, -CH2-O-CH3, -СН 2-СН=СН 2, -СН 2-О-СН 2-СН 2 ОСН 3, -Ph, -CH2-O-CH2-Ph, -CH2-Ph, -CH2-[Ph(p-F)], -CH2-[Ph(o-F)], -CH2-[Ph(p-OMe)], -CH2-[Ph(o-OMe)],-CH2OH, метоксибутил, метоксиэтоксиметил, метоксиэтоксиэтил, изопропоксиметил, -CH2-CH2-O-Ph,-СН(СН 3)2 -CH2-[Ph(o,o-F2)], -CH2-[Ph(m-CF3)], -СН 2-фурил, -СН 2-пиридил, (2-метоксифенокси)этил, 4 метоксибензил, изопропоксиметил, циклопентилоксиметил, тиофен-2-илметил, циклопропилметил, 2 морфолин-4-ил-этил, 3-пиперидин-1-ил-пропил, 3-пирролидин-1-ил-пропил,тогда R3 представляет собой изобутил; когда R1 представляет собой -СН 3, -С 2 Н 5, -n-С 3 Н 7, -СН 2-О-СН 3, -СН 2-СН=СН 2, -СН 2-О-СН 2-СН 2 ОСН 3, -CH2-O-CH2-Ph, -СН 2-пиридил, CH2-[Ph(OMe)], -CH2-[Ph(F)], -CH2-Ph или -СН 2 ОН, тогда R3 представляет собой -Ph; когда R1 представляет собой -СН 3, -СН 2 СН 3, -СН 2-О-СН 3, CH2-[Ph(OMe)], тогда R3 представляет собой -циклогексил; когда R1 представляет собой -СН 3 или -СН 2-О-СН 3, тогда R3 представляет собой циклопентил; когда R1 представляет собой -СН 2-СН 3, -СН 2-СН=СН 2, -СН 2-О-СН 3 или -СН 2-О-СН 2-СН 2-О-СН 3,тогда R3 представляет собой изопропокси. Далее следуют примеры некоторых репрезентативных соединений по настоящему изобретению. Эти примеры предназначены только для целей иллюстрации и не должны рассматриваться как ограничивающие настоящее изобретение. или один из их изомеров. В соответствии с другой целью настоящее изобретение также относится к способу получения соединения формулы (I). Соединения и способы по настоящему изобретению могут быть получены с помощью ряда путей,хорошо известных специалистам в данной области. Соединения могут синтезироваться, например, посредством применения либо способов, описанных ниже, либо их вариантов, как ясно специалисту в данной области. Соответствующие модификации и замены будут очевидны и хорошо известны или могут быть легко получены из научной литературы специалистами в данной области. В частности, такие способы можно найти в R.C. Larock, Comprehensive Organic Transformations,VCH publishers, 1989. Будет очевидно, что соединения по настоящему изобретению могут содержать один или несколько асимметрично замещенных атомов углерода, и они могут быть выделены в оптически активной или рацемической форме. Таким образом, все хиральные, диастереомерные, рацемические формы и все геометрические изомерные формы структуры являются предполагаемыми, если только конкретно не указана конкретная стереохимия или изомерная форма. В данной области хорошо известно как приготовить и выделить такие оптически активные формы. Например, смеси стереоизомеров могут быть разделены посредством стандартных методик, включая, но, не ограничиваясь этим, разрешение рацемических форм, обычную хроматографию, хроматографию с обращенной фазой и хиральную хроматографию,предпочтительное образование соли, перекристаллизацию, и тому подобное, или либо посредством хирального синтеза из хиральных исходных материалов, либо посредством целенаправленного синтеза целевых хиральных центров. Соединения по настоящему изобретению могут быть получены посредством разнообразных путей синтеза. Реагенты и исходные материалы являются коммерчески доступными или легко синтезируются с помощью хорошо известных технологий, известных специалистам в данной области. Все заместители,если не указано иного, являются такими, как определено ранее. В реакциях, описанных ниже, может быть необходимой защита химически активных функциональных групп, например, гидрокси, амино, имино, тио или карбоксигрупп, когда они являются желательными в конечном продукте, чтобы избежать их нежелательного участия в реакциях. Обычные защитные группы могут использоваться в соответствии со стандартной практикой, относительно примеров см.McOmie in Protective Groups in Organic Chemistry, Plenum Press, 1973. Некоторые реакции могут осуществляться в присутствии основания. Нет конкретного ограничения на природу основания, которое должно использоваться в этой реакции, и здесь можно использовать с одинаковым успехом любое основание, обычно используемое в реакциях этого типа, при условии, что оно не имеет отрицательного воздействия на другие части молекулы. Примеры пригодных для использования оснований включают: гидроксид натрия, карбонат калия, триэтиламин, гидриды щелочных металлов, такие как гидрид натрия и гидрид калия; соединения алкиллития, такие как метиллитий и бутиллитий; и алкоксиды щелочных металлов, такие как метоксид натрия и этоксид натрия. Обычно, реакции осуществляют в соответствующем растворителе. Можно использовать разнообразные растворители, при условии, что они не имеют отрицательных воздействий на реакцию или на участвующие в ней реагенты. Примеры пригодных для использования растворителей включают: углеводороды, которые могут представлять собой ароматические, алифатические или циклоалифатические углеводороды, такие как гексан, циклогексан, бензол, толуол и ксилол; амиды, такие как диметилформамид; спирты, такие как этанол и метанол, и простые эфиры, такие как простой диэтиловый эфир и тетрагидрофуран. Реакции могут иметь место в широком диапазоне температур. В целом, авторы обнаружили, что удобно осуществлять реакции при температуре от 0 до 150 С (более предпочтительно, примерно от комнатной температуры до 100 С). Время, необходимое для осуществления реакции, может также изменяться в широких пределах, в зависимости от множества факторов, а именно, от температуры реакции и природы реагентов. Однако, при условии, что реакция осуществляется при предпочтительных условиях,приведенных выше, достаточным обычно будет период времени от 3 до 20 ч. Соединение, полученное таким образом, может извлекаться из реакционной смеси с помощью обычных средств. Например, соединения могут извлекаться посредством отгонки растворителя из реакционной смеси или, если это необходимо, после отгонки растворителя из реакционной смеси, выливания остатка в воду с последующим экстрагированием несмешиваемым с водой органическим растворителем и отгонки растворителя из экстракта. В дополнение к этому, продукт может, по желанию, дополнительно очищаться с помощью хорошо известных методик, таких как перекристаллизация, повторное осаждение,или с помощью разнообразных хроматографических методик, а именно, колоночной хроматографии или препаративной тонкослойной хроматографии. В частности, соединения по настоящему изобретению могут быть получены с помощью способов,описанных ниже. Промежуточные соединения, используемые в способах, либо являются коммерчески доступными, либо могут синтезироваться в лаборатории из хорошо известных исходных материалов и с помощью хорошо известных способов. Способ получения соединений по настоящему изобретению являются очевидными или легко получаются из литературных источников, например, WO 2003/105771,WO 2008152149. В соответствии с первым вариантом осуществления способ получения соединения формулы (I) включает омыление соединения формулы (III) где Ar, R2, R1 являются такими, как определено в формуле (I), и Alk представляет собой алкильную группу, с необязательным последующим образованием желаемой соли присоединения. Реакцию омыления, как правило, осуществляют в присутствии минерального основания, такого какNaOH, KOH, или их смесей, предпочтительно при температуре, находящейся в пределах между комнатной температурой и температурой дефлегмации реакционной смеси. Соль присоединения, как правило, получают посредством взаимодействия образующейся кислоты с основанием, соответствующим желаемой соли присоединения. Добавляемое основание может представлять собой органическое основание, включая амины, такие как трет-бутиламин, или неорганические основания, такие как NaOH, КОН, и тому подобное. После добавления основания, соединение формулы (I), как правило, находится в форме карбоксилатной соли, где противоион представляет собой катион, возникающий при добавлении протона к основанию. Кислотная форма соединения формулы (I) может извлекаться из его соли присоединения основания посредством подкисления указанной соли. Соединение формулы (III) может быть получено посредством сочетания соединения формулы (IV) с соответствующим соединением формулы (V) где Ar, R2, R1 являются такими, как определено в формуле (I), Alk является таким, как определено как в формуле (III), и LG представляет собой уходящую группу, такую как атом галогена, предпочтительно С 1, или мезилатную (O-SO2-CH3) группу. Эту реакцию, как правило, осуществляют в присутствии основания. Когда LG представляет собой атом галогена, основание может представлять собой карбонат калия для нейтрализации образующейся кислоты. Когда LG представляет собой мезилат, основание может представлять собой органическое основание, предпочтительно, N,N-диизопропилзтиламин, триэтиламин, или неорганическое основание, предпочтительно, карбонат калия, цезия или натрия. Предпочтительно, реакцию осуществляют при температуре, находящейся в пределах между комнатной температурой и температурой дефлегмации реакционной смеси. Соединение формулы (IV), где LG представляет собой галогенид или мезилат, может быть получено посредством преобразования соединения формулы (VI) где Ar и R2 являются такими, как определено в формуле (I), в желаемый галогенид или мезилат. Реакция замещения может осуществляться посредством взаимодействия указанного соединения формулы (VI) с обычными галогенирующими агентами, такими как тионил галогенид, гидрогалогенидная кислота Н-Hal, фосфор тригалогенид, и тому подобное, предпочтительно, с тионилхлоридом. Альтернативно, мезилатное производное может быть получено посредством взаимодействия указанного соединения (VI) с мезилхлоридом, в присутствии основания, такого как третичный амин, в частности триэтиламин, или неорганического основания, такого как карбонат, бикарбонат. В соответствии со вторым вариантом осуществления соединение формулы (I) может быть получено посредством взаимодействия соединения формулы (VII)R может представлять собой Н или алкил, с необязательным последующим образованием желаемой соли добавления. Эту реакцию, как правило, осуществляют в кислотной среде (например, в присутствии уксусной кислоты), с последующим добавлением восстанавливающего агента, такого как натрий цианоборгидрид. Если желательной является соль присоединения основания и соединения формулы (I), за этой реакцией может следовать добавление основания, как описано выше. Соединение формулы (VII) может быть получено посредством окисления соединения формулы (VI) где Ar и R2 являются такими, как определено в формуле (I). Эта реакция может осуществляться при известных условиях, как правило, используемых для окисления первичного или вторичного спирта, сообразно обстоятельствам. В частности, эта реакция может осуществляться в присутствии пиридиния хлорхромата (РСС). Соединение формулы (VI), используемое выше в обоих вариантах осуществления, может быть получено посредством:(а) взаимодействия соединения формулы (IX) где Ar является таким, как определено в формуле (I) с N-гидрокси-4-гидроксиметилбензамидином, необязательно, в присутствии одного или нескольких активирующих агентов и/или связывающих агентов, таких как N,N'-дициклогексилкарбодиимид (DCC) иN-гидроксибензотриазол моногидрат (HOBt), с тем, чтобы получить соединение формулы (VI), где R2 представляет собой Н, а когда желаемым является соединение (VI), где R2 представляет собой алкил, с необязательным последующим(b) окислением соединения формулы (VI) (где R2 представляет собой Н) с последующей его реакцией с алкилмагнием галогенидом. Способ по настоящему изобретению может также включать дополнительную стадию выделения полученных соединений. Соединения формулы (IX), (VII), (VIII), (V) и N-гидрокси-4-гидроксиметилбензамидин являются коммерчески доступными или могут синтезироваться посредством применения или адаптирования известных процедур. Соединения формулы (VI)Ar представляет собой группу формулы где Hal представляет собой атом Cl и R3 выбирают из галогена, арила, циклоалкила, алкила, являются новыми и представляют собой другую цель настоящего изобретения. В частности, в формуле (X) R3 выбирают из циклоалкила, такого как циклогексил или циклопентил; алкила, такого как изобутил; или арила, такого как фенил. Соли по настоящему изобретению могут синтезироваться из исходного соединения, которое содержит основной или кислотный остаток, с помощью обычных химических способов. Как правило, такие соли могут быть получены посредством взаимодействия свободных кислотных или основных форм этих соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, или в их смеси, и такие способы известны специалистам в данной области. Настоящее изобретение также относится к изомерам соединений формулы (I). Изомеры могут быть получены посредством разделения соответствующих рацемических соединений с помощью способов,хорошо известных в данной области. Настоящее изобретение также включает сложные эфиры соединения формулы (I). Они могут быть получены с помощью способов, хорошо известных специалистам в данной области. Например, сложные эфиры могут быть получены посредством реакции кислоты со спиртом, соответствующим желаемому сложному эфиру. Например, соединения формулы (I) с группой -СООН могут взаимодействовать с метанолом с образованием сложного метилового эфира соединения формулы (I). Подобным же образом могут быть получены сложные этиловые, пропиловые, изобутиловые и другие эфиры. Соединения по настоящему изобретению могут быть пригодными для лечения и/или предотвращения состояний, связанных с S1P1/EDG1 рецептором, или состояний, когда желательным является уменьшение количества лимфоцитов, циркулирующих в крови, они включают иммунно опосредуемые заболевания и состояния или воспалительные заболевания и состояния. Соединения по настоящему изобретению являются пригодными в качестве иммуносупрессорных/иммунодепрессивных агентов. Эти соединения являются пригодными для лечения и/или предотвращения отторжения транспланта, отторжения пересаженных тканей, иммунных расстройств, аутоиммунных заболеваний, аутоиммунного увеита, ишемии, воспалительных и хронических воспалительных состояний, которые включают ревматоидный артрит, астму, поллиноз, псориаз, болезнь Альцгеймера,миокардит, атопический дерматит, лимфоцитарные лейкозы, лимфомы, сепсис, множественный склероз,- 15023638 красную волчанку, воспалительные заболевания пищеварительного тракта, сахарный диабет, гломерулонефрит, атеросклероз, мультиорганную недостаточность, пневмонию, ишемическое реперфузионное повреждение, хроническое обструктивное пульмонарное заболевание, инфекцию, связанную с воспалением, вирусное воспаление, гепатит, хронический бронхит, гранулематозное заболевание, а также расстройства, связанные с ослаблением целостности сосудов, раком, или другие расстройства. Соединения по настоящему изобретению, как правило, представляют собой селективные агонисты EDG1 рецепторов с очень низким родством к EDG3 рецептору. Селективный агонизм по отношению к EDG1 по сравнению с EDG3 является желательным с учетом брадикардии, вызываемой неселективным агонизмом по отношению EDG3 рецептору. Также соединения по настоящему изобретению имеют низкое сродство к каналу hERG, благодаря чему они демонстрируют лучший профиль побочных воздействий. Соединения по настоящему изобретению могут использоваться в комбинации с другими иммуномодуляторами или иммуносупрессантами, включая адренокортикальные стероиды, циклоспорин, азатиоприн, метотрексат, ингибиторы кальцийнейрина, антитела, блокирующие рецепторы IL-2, антитела,подавляющие Т-лимфоциты, анти-TNF, микофенолат, ингибиторы mTOR. Указанные комбинации представляют собой другую цель настоящего изобретения. Типичный диапазон доз для использования в соответствии с настоящим изобретением может составлять от 1 мкг/кг до 0,1 г/кг массы тела в день; предпочтительный диапазон доз может составлять от 3 мкг/кг до 1 мг/кг массы тела в день. Наиболее сильнодействующие соединения могут даже вводиться только два - три раза в неделю при типичных дозах от 10 до 100 мкг/кг. Ежедневная доза для взрослых людей составляет от 0,1 до 10 мг, она может быть оптимизирована. Дозировка лекарственного средства, которое должно вводиться, зависит от таких параметров, как тип и степень развития заболевания или расстройства, общее состояние здоровья конкретного пациента,относительная биологическая эффективность выбранного соединения и препарат соединения, наполнители, и способ его введения. Соединения по настоящему изобретению могут быть приготовлены в виде фармацевтически приемлемого препарата при смешивании с носителем, наполнителем или разбавителем, в частности, для перорального или парентерального использования. Определенные предпочтительные соединения демонстрируют хорошую пероральную биологическую доступность и, таким образом, хорошо подходят для получения препаратов для перорального использования. Такие препараты могут находиться в форме таблеток, капсул или препаратов для парентерального введения. Твердый носитель может включать одно или несколько веществ, которые могут также действовать в качестве ароматизирующих агентов, смазывающих веществ, солюбилизаторов, суспендирующих агентов, наполнителей, агентов, обеспечивающих скольжение, добавок для облегчения прессования, связывающих веществ или агентов для разрыхления таблеток; он также может представлять собой инкапсулирующий материал. Жидкие носители могут включать воду, органический растворитель, их смесь или фармацевтически приемлемые масла и жиры. Композиции может быть удобным вводить в виде стандартной дозированной формы, и они могут быть получены с помощью любого из способов, хорошо известных в области фармации, например, как описано в Remington: The Science and Practice of Pharmacy, 20th ed.; Gennaro A. R., Ed.; Lippincott WilliamsWilkins: Philadelphia, PA, 2000. Фармацевтически совместимые связывающие агенты и/или вспомогательные материалы могут включаться как часть композиции. Таблетки, пилюли, порошки, капсулы, пастилки, и тому подобное, могут содержать один или несколько любых из следующих ингредиентов, или соединения сходной природы: связующее вещество,такое как микрокристаллическая целлюлоза или смола трагаканта; разбавитель, такой как крахмал или лактоза; разрыхлитель, такой как крахмал и производные целлюлозы; смазывающее вещество, такие как стеарат магния; агент, обеспечивающий скольжение, такой как коллоидный диоксид кремния; подслащивающий агент, такой как сахароза или сахарин; или ароматизирующий агент, такой как мята перечная или метилсалицилат. Капсулы могут находиться в форме твердой капсулы или мягкой капсулы, которые,как правило, изготавливают из желатиновых смесей, необязательно смешанных с пластификаторами, а также в форме крахмальной капсулы. В дополнение к этому, стандартные дозированные формы могут содержать разнообразные дополнительные материалы, которые модифицируют физическую форму стандартной единичной дозы, например, покрытия из сахара, шеллака или энтеральных агентов. Другие пероральные дозированные формы, сироп или эликсир могут содержать подслащивающие агенты, консерванты, красители, окрашивающие вещества и ароматизаторы. В дополнение к этому, активные соединения могут включаться в быстро растворимые, имеющие модифицированное высвобождение или замедленное высвобождение препараты и составы, и где такие препараты с замедленным высвобождением предпочтительно являются бимодальными. Предпочтительные препараты включают фармацевтические композиции, в которых соединение по настоящему изобретению приготавливают для перорального или парентерального введения, или более предпочтительно, композиции, в которых соединение по настоящему изобретению приготавливают в виде таблетки. Предпочтительные таблетки содержат лактозу, кукурузный крахмал, силикат магния, натрий кросскармелозу, повидон, стеарат магния или тальк в любом сочетании. Также одним из аспектов настоящего изобретения является то, что соединение по настоящему изобретению может включаться в пищевой продукт или жидкость. Жидкие препараты для введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Жидкие композиции могут также включать связывающие вещества, буферы, консерванты,хелатирующие агенты, подслащивающие, ароматизирующие и окрашивающие агенты, и тому подобное. Неводные растворители включают спирты, пропиленгликоль, полиэтиленгликоль, акрилатные сополимеры, растительные масла, такие как оливковое масло и сложные органические эфиры, такие как этилолеат. Водные носители включают смеси спиртов и воды, гидрогели, буферные среды и солевой раствор. В частности, биологически совместимый, биологически деградируемый лактидный полимер, сополимер лактид/гликолид или сополимеры полиоксиэтилена-полиоксипропилена могут представлять собой пригодные для использования наполнители для контроля высвобождения активных соединений. Внутривенные носители могут включать жидкость и питательные добавки, электролитные добавки, такие как добавки на основе декстрозы Рингера, и тому подобное. Другие потенциально пригодные для использования парентеральные системы доставки для этих активных соединений включают частицы сополимера этилена-винилацетата, осмотические насосы, имплантируемые инфузионные системы и липосомы. Альтернативные режимы введения включают препараты для ингаляций, которые включают такие средства как сухой порошок, аэрозоль или капли. Они могут представлять собой водные растворы, содержащие, например, простой полиоксиэтилен-9-лауриловый эфир, гликохолат и деоксихолат, или масляные растворы для введения в форме назальных капель или в виде геля, который должен наноситься интраназально. Препараты для буккального введения включают, например, лепешки или пастилки, и могут также содержать ароматизированную основу, такую как сахароза или смола акации, и другие наполнители, такие как гликохолат. Препараты, пригодные для ректального введения, предпочтительно представлены в виде однодозовых суппозиториев, с носителем на твердой основе, таким как масло какао, и могут включать салицилат. Препараты для местного нанесения на кожу предпочтительно принимают форму мази, крема, примочки, пасты, геля, спрея, аэрозоля или масла. Носители, которые можно использовать, включают вазелиновое масло, ланолин, полиэтиленгликоли, спирты или их сочетания. Препараты, пригодные для трансдермального введения, могут быть представлены в виде отдельных пластырей и могут представлять собой липофильные эмульсии или буферные, водные растворы, растворенные и/или диспергированные в полимере или адгезиве. Альтернативные способы введения включают также растворы, мази или другие препараты, приемлемые для офтальмологического введения. В соответствии с конкретным аспектом, соединение по настоящему изобретению может вводиться с помощью кожного, офтальмологического или дыхательного пути, как описано выше. Эти препараты являются особенно преимущественными, поскольку они обеспечивают локальное лечение, без связанной с этим лимфопении, которая может возникать при системных способах введения. Другие особенности настоящего изобретения станут очевидны в ходе следующего далее описания иллюстративных вариантов осуществления, которые приводятся для иллюстрации настоящего изобретения и не предназначаются для его ограничения. Рассмотренные выше особенности настоящего изобретения приводятся для иллюстрации настоящего изобретения и не предназначаются для его ограничения. Осуществление изобретения Получение промежуточных соединений Безводный хлорид алюминия (1,65 г, 0,012 моль) добавляют к раствору циклогексилбензола (1 г,0,006 моль) и ацетилхлорида (0,7 мл, 0,009 моль) в дихлорэтане (10 мл) при температуре -5-0 С. Реакционную смесь перемешивают при этой температуре в течение 30 мин, а затем обрабатывают 2 н хлористоводородной кислотой (7 мл). Ее экстрагируют дихлорметаном (220 мл) и объединенный экстракт сушат над сульфатом натрия. После удаления растворителя при пониженном давлении остаток очищают с помощью колоночной хроматографии (силикагель, 230-400 меш, этилацетат: н-гексан 7:93) с получением 1-(4-циклогексилфенил)этанона. Смесь концентрированной серной кислоты и азотной кислоты (68-72%) (1,7:6, 15 мл) добавляют по каплям в охлажденный раствор 1-(4-циклогексилфенил)этанона (6 г, 0,03 моль) в концентрированной серной кислоте (15 мл) при 0-5 С. Реакционной смеси позволяют перемешиваться при этой температуре в течение 30 мин, а затем выливают на измельченный лед. Затем ее экстрагируют этилацетатом (340 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (силикагель, 230-400 меш, этилацетат:н-гексан, 1:9) с получением 1-(4-циклогексил-3-нитрофенил)этанона. Хлорид дигидрат олова (15,8 г, 0,07 моль) добавляют к раствору 1-(4-циклогексил-3 нитрофенил)этанона (5,8 г, 0,0235 моль) в концентрированной хлористо-водородной кислоте (35 мл) при 0-5 С. Реакционную смесь медленно доводят до 60-65 С и перемешивают при этой температуре в течение 15 мин. После охлаждения до комнатной температуры реакционную смесь экстрагируют этилацетатом (3100 мл). рН доводят до 8,0-9,0 с использованием твердого бикарбоната натрия. После промывки водой (115 мл) органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением сырого продукта, который очищают с помощью колоночной хроматографии (230400 меш; этилацетат:н-гексан, 3:7) с получением 1-(3-амино-4-циклогексилфенил)этанона. Раствор нитрита натрия (1,2 г, 0,017 моль) в деминерализованной воде (7 мл) добавляют к раствору 1-(3-амино-4-циклогексилфенил)этанона (3,4 г, 0,016 моль) в концентрированной хлористоводородной кислоте (34 мл) при 0-5 С и позволяют перемешиваться в течение 15 мин при этой температуре. Затем его выливают в суспензию хлорида меди (CuCl) (3,1 г, 0,03 моль) в деминерализованной воде (10 мл) при 60-65 С и перемешивают в течение 30 мин. Реакционную смесь экстрагируют этилацетатом (230 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют с получением сырого продукта, который очищают с использованием колоночной хроматографии (230-400 меш; толуол:нгексан, 3: 2) с получением 1-(3-хлор-4-циклогексилфенил)этанона. Водный щелочной раствор перманганата калия (2,94 г, 0,0186 моль; в 22 мл 12% водного раствора гидроксида натрия) добавляют к раствору 1-(3-хлор-4-циклогексилфенил)этанона (2,2 г, 0,0093 моль) в диоксане (11 мл). Реакционную смесь перемешивают при температуре 80 С в течение 2 ч. Затем ее фильтруют, и фильтрат промывают простым диэтиловым эфиром (210 мл). рН водного слоя доводят до 1-2 посредством использования 6 н хлористоводородной кислоты. Ее экстрагируют этилацетатом (315 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют с получением сырого продукта, который очищают с использованием колоночной хроматографии (230-400 меш; этилацетат:нгексан, 1:3) с получением 3-хлор-4-циклогексилбензойной кислоты. Это соединение получают таким же путем, как рассмотрено для 3-хлор-4-циклогексилбензойной кислоты (I). 4-Изобутилбензальдегид (7 г, 0,0431 моль) добавляют по каплям к смеси концентрированной сер- 18023638 ной кислоты и азотной кислоты (68-72%) (9:1, 60 мл) при 0-5 С. Реакционной смеси позволяют перемешиваться при этой температуре в течение 2 ч, затем выливают на измельченный лед. Затем ее экстрагируют этилацетатом (340 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии (силикагель, 230-400 меш, этилацетат:н-гексан, 1:19) с получением 4-изобутил-3-нитробензальдегида. 4-Изобутил-3-нитробензальдегид (3,3 г, 0,0159 моль) добавляют к раствору хлорида олова (8,37 г,0,0441 моль) в концентрированной хлористо-водородной кислоте (23 мл) при 0-5 С. Реакционную смесь медленно доводят до 60-65 С и перемешивают при этой температуре в течение 30 мин. Реакционную смесь опять охлаждают до 0-5 С. Во время охлаждения наблюдают образование твердого продукта, который измельчают перед дальнейшей обработкой. Раствор нитрита натрия (1,36 г, 0,0188 моль) в деминерализованной воде (3 мл) добавляют к указанной выше реакционной смеси при 0-50 С, позволяя перемешиваться в течение 10 мин при этой температуре. Затем ее выливают в суспензию хлорида меди (3,6 г,0,0346 моль) в деминерализованной воде (5 мл) при 60-65 С и перемешивают в течение 20 мин. Реакционную смесь экстрагируют этилацетатом (230 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют с получением сырого продукта, который очищают с использованием колоночной хроматографии (230-400 меш; толуол:н-гексан, 3:7) с получением 3-хлор-4 изобутилбензальдегида. Смесь хлорита натрия (80%, согласно анализу, 1,06 г, 0,0094 моль) и натрия дигидрофосфата дигидрата (3,33 г, 0,0213 моль) в деминерализованной воде (10 мл) добавляют в виде двух одинаковых загрузок (с интервалом один час) к раствору 3-хлор-4-изобутилбензальдегида (0,7 г, 0,0036 моль) в третбутаноле (10 мл) при комнатной температуре. После завершения добавления, перемешивание при комнатной температуре продолжают в течение 4 часов. Затем ее экстрагируют этилацетатом (230 мл). Объединенный органический слой сушат над сульфатом натрия и концентрируют при пониженном давлении с получением 3-хлор-4-изобутилбензойной кислоты. Изобутил нитрит (121 г, 1,17 моль) и хлорид меди (II) (21,2 г, 0,16 моль) добавляют к раствору 4 бром-2-хлоранилина (200 г, 0,97 моль) в бензоле (500 мл) при температуре 60-65 С. Реакционную смесь нагревают с обратным холодильником в течение 2 ч. Реакционную смесь охлаждают до температуры 5055 С и добавляют к ней водный раствор серной кислоты (92 мл конц. серной кислоты в 453 мл деминерализованной воды). После нагрева с обратным холодильником в течение 1 ч реакционную смесь охлаждают до комнатной температуры, и органической слой отделяют. Его обрабатывают водным раствором мочевины (41 г в 127 мл воды) и нагревают с обратным холодильником в течение 1 ч. Органический слой отделяют, промывают деминерализованной водой (2200 мл) и сушат над сульфатом натрия. После удаления растворителя при пониженном давлении остаток фракционно отгоняют с получением 4-бром-2 хлорбифенила. Несколько кристаллов йода добавляют к тетрагидрофурану (200 мл), содержащему магниевую стружку (2,8 г, 0,117 моль). Смесь нагревают при 60-70 С. Раствор 4-бром-2-хлорбифенила (26 г, 0,097 моль) в тетрагидрофуране (50 мл) добавляют по каплям к реакционной смеси, и нагревают ее с обратным холодильником в течение 1 ч. Реакционную смесь доводят до комнатной температуры, а затем охлаждают до -20 С. Газообразный диоксид углерода пропускают через реакционную смесь в течение 45 мин. Реакционную смесь обрабатывают 3 н HCl (125 мл) и экстрагируют этилацетатом (2200 мл). Объединенный органический слой сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает твердый продукт, который промывают простым диэтиловым эфиром (2100 мл), а затем сушат с получением 2-хлорбифенил-4-карбоновой кислоты.V) Получение сложного этилового эфира 4-метилпиперидин-4-карбоновой кислотыn-Бутиллитий (15% раствор в н-гексане; 82 мл, 0,19 моль) добавляют к перемешиваемому раствору диизопропиламина (28,75 мл, 0,20 моль) в тетрагидрофуране (400 мл) при -70 С в атмосфере азота и перемешивают в течение 30 минут. Раствор сложного 4-этилового эфира сложного 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (30 г, 0,12 моль) в тетрагидрофуране (80 мл) вводят при -70 С. Добавляют гексаметил фосфорамид (45 мл), и реакционной смеси позволяют перемешиваться до тех пор,пока температура не достигнет -45 С. Реакционную смесь опять охлаждают до -70 С, добавляют метилйодид (39,3 мл, 0,60 моль) и перемешивают в течение 1 ч. В реакционную смесь медленно добавляют насыщенный водный раствор аммония хлорида (100 мл) при 0 С и перемешивают в течение 10 мин. Ее экстрагируют этилацетатом (3200 мл). Объединенный органический слой промывают насыщенным раствором соли (1100 мл) и сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает вязкую жидкость, которую очищают с помощью колоночной хроматографии (силикагель 230400, н-гексан:этилацетат, 9:1) с получением сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-метилпиперидин-1,4-дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 12,5 мл) в диоксане (25 мл) добавляют к сложному 4 этиловому эфиру сложного 1-трет-бутилового эфира 4-метилпиперидин-1,4-дикарбоновой кислоты (7,5 г, 0,028 моль) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают водным раствором бикарбоната натрия для доведения рН до 8-9. Ее опять концентрируют при пониженном давлении и остаток обрабатывают дихлорметаном. После сушки над сульфатом натрия растворитель удаляют с получением сырого остатка,который очищают с помощью колоночной хроматографии (силикагель 230-400 меш, метанол : дихлорметан : аммоний гидроксид, 14:85:1) с получением сложного этилового эфира 4-метилпиперидин-4 карбоновой кислоты. Следующие далее соединения VI - XIV (за исключением IX) могут быть получены, следуя способу,сходному с соединением V.VI) Сложный этиловый эфир 4-этилпиперидин-4-карбоновой кислотыVII) Сложный этиловый эфир 4-(2-метоксиэтоксиметил)пиперидин-4-карбоновой кислотыVIII) Сложный этиловый эфир 4-метоксиметилпиперидин-4-карбоновой кислотыIX) Сложный этиловый эфир 4-фенилпиперидин-4-карбоновой кислоты Этот материал является коммерчески доступным.X) Сложный этиловый эфир 4-бензилпиперидин-4-карбоновой кислотыXI) Сложный этиловый эфир 4-(4-фторбензил)пиперидин-4-карбоновой кислотыXII) Сложный этиловый эфир 4-(2-фторбензил)пиперидин-4-карбоновой кислотыXIII) Сложный этиловый эфир 4-(4-метоксибензил)пиперидин-4-карбоновой кислотыXIV) Сложный этиловый эфир 4-(2-метоксибензил)пиперидин-4-карбоновой кислотыXV) Получение сложного этилового эфира 4-аллилпиперидин-4-карбоновой кислоты н-Бутиллитий (15% раствор в н-гексане; 24,5 мл, 0,057 моль) добавляют к перемешиваемому раствору диизопропиламина (8,38 мл, 0,059 моль) в тетрагидрофуране (140 мл) при -70 С в атмосфере азота и перемешивают в течение 30 мин. Раствор сложного 4-этилового эфира сложного 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (8,0 г, 0,0311 моль) в тетрагидрофуране (20 мл) вводят при-70 С. Добавляют гексаметил фосфорамид (15 мл) и реакционной смеси позволяют перемешиваться до тех пор, пока температура не достигнет -45 С. Реакционную смесь опять охлаждают до -70 С, добавляют аллилбромид (13,5 мл, 0,155 моль) и перемешивают в течение 1 ч. В реакционную смесь медленно добавляют насыщенный водный раствор аммония хлорида (100 мл) при -30 С и перемешивают в течение 10 мин. Ее экстрагируют этилацетатом (360 мл). Объединенный органический слой промывают насыщенным раствором соли (130 мл) и сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает вязкую жидкость, которую очищают с помощью колоночной хроматографии (силикагель 230-400, н-гексан : этилацетат, 9:1) с получением сложного 4-этилового эфира сложного 1-третбутилового эфира 4-аллилпиперидин-1,4-дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 4 мл) в диоксане (6 мл) добавляют к сложному 4 этиловому эфиру сложного 1-трет-бутилового эфира 4-аллилпиперидин-1,4-дикарбоновой кислоты (2 г,0,006 моль) и перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают водным раствором бикарбоната натрия для доведения рН до 8-9. Ее опять концентрируют при пониженном давлении и остаток обрабатывают дихлорметаном. После сушки над сульфатом натрия растворитель удаляют с получением сложного этило- 21023638XVI) Получение сложного этилового эфира 4-пропилпиперидин-4-карбоновой кислоты 5% Pd/C (0,6 г, влажность 50%) добавляют к перемешиваемому раствору сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-аллилпиперидин-1,4-дикарбоновой кислоты (2,1 г, 0,007 моль) в этаноле (20 мл). Газообразный водород барботируют через реакционную смесь при комнатной температуре в течение 20 мин. Реакционную смесь фильтруют через слой целита и промывают метанолом (35 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением сложного 4-этилового эфира 1-трет-бутилового сложного эфира 4-пропилпиперидин-1,4-дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 4,2 мл) в диоксане (6,8 мл) добавляют к сложному 4 этиловому эфиру сложного 1-трет-бутилового эфира 4-пропилпиперидин-1,4-дикарбоновой кислоты (2,2 г, 0,0073 моль) и перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают водным раствором бикарбоната натрия для доведения рН до 8-9. Ее опять концентрируют при пониженном давлении и остаток обрабатывают дихлорметаном. После сушки над сульфатом натрия растворитель удаляют с получением сложного этилового эфира 4-пропилпиперидин-4-карбоновой кислоты.XVII) Получение сложного этилового эфира 4-бензилоксиметилпиперидин-4-карбоновой кислоты н-Бутиллитий (15% раствор в н-гексане; 9,5 мл, 0,022 моль) добавляют к перемешиваемому раствору диизопропиламина (3,1 мл, 0,022 моль) в тетрагидрофуране (15 мл) при -70 С в атмосфере азота и перемешивают в течение 30 мин. Раствор сложного 4-этилового эфира сложного 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (3 г, 0,012 моль) в тетрагидрофуране (10 мл) вводят при -70 С. Добавляют гексаметил фосфорамид (4,8 мл) и реакционной смеси позволяют перемешиваться до тех пор,пока температура не достигнет -45 С. Реакционную смесь опять охлаждают до -70 С, добавляют простой бензилхлорметиловый эфир (5 мл, 0,035 моль) и перемешивают в течение 1 ч. К реакционной смеси медленно добавляют насыщенный водный раствор аммония хлорида (30 мл) при -30 С и перемешивают в течение 10 мин. Ее экстрагируют этилацетатом (220 мл). Объединенный органический слой сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает вязкую жидкость, которую очищают с помощью колоночной хроматографии (силикагель 230-400, толуол:этилацетат, 23:2 с получением сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-бензилоксиметилпиперидин-1,4 дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 1,5 мл) в диоксане (7,5 мл) добавляют к 4-этиловому сложному эфиру сложному 1-трет-бутиловому эфиру 4-бензилоксиметилпиперидин-1,4-дикарбоновой кислоты (1,9 г, 0,005 моль) и перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают водным раствором бикарбоната натрия для доведения рН до 8-9. Ее опять концентрируют при пониженном давлении и остаток обрабатывают дихлорметаном. После сушки над сульфатом натрия растворитель удаляют с получением сложного этилового эфира 4-бензилоксиметилпиперидин-4-карбоновой кислоты.XVIII) Получение сложного этилового эфира 4-гидроксиметилпиперидин-4-карбоновой кислоты н-Бутиллитий (15% раствор в н-гексане; 9,5 мл, 0,022 моль) добавляют к перемешиваемому раствору диизопропиламина (3,1 мл, 0,022 моль) в тетрагидрофуране (15 мл) при -70 С в атмосфере азота и перемешивают в течение 30 мин. Раствор сложного 4-этилового эфира сложного 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (3 г, 0,012 моль) в тетрагидрофуране (10 мл) вводят при -70 С. Добавляют гексаметил фосфорамид (4,8 мл) и реакционной смеси позволяют перемешиваться до тех пор,пока температура не достигнет -45 С. Реакционную смесь опять охлаждают до -70 С, добавляют простой бензилхлорметиловый эфир (5 мл, 0,035 моль) и перемешивают в течение 1 ч. К реакционной смеси медленно добавляют насыщенный водный раствор аммония хлорида (30 мл) при -30 С и перемешивают в течение 10 мин. Ее экстрагируют этилацетатом (220 мл). Объединенный органический слой сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает вязкую жидкость, которую очищают с помощью колоночной хроматографии (силикагель 230-400, толуол:этилацетат, 23:2 с получением сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-бензилоксиметилпиперидин-1,4 дикарбоновой кислоты. 5% Pd/C (1,85 г, влажность 50%) добавляют к раствору сложного 4-этилового эфира сложного 1 трет-бутилового эфира 4-бензилоксиметилпиперидин-1,4-дикарбоновой кислоты (1,85 г, 0,0049 моль) в этаноле (20 мл). Реакционную смесь перемешивают при положительном давлении газообразного водорода в течение 16 ч при комнатной температуре. Реакционную смесь фильтруют через слой целита и промывают раствором метанола и дихлорметана (1:5, 100 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением 4-этилового сложного эфира сложного 1-трет-бутилового эфира 4 гидроксиметилпиперидин-1,4-дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 2,5 мл) в диоксане (4,5 мл) добавляют к сложному 4 этиловому эфиру 1-трет-бутилового сложного эфира 4-гидроксиметилпиперидин-1,4-дикарбоновой кислоты (1,35 г, 0,0047 моль) и перемешивают при комнатной температуре в течение 30 мин. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают водным раствором бикарбоната натрия для доведения рН до 8-9. Ее опять концентрируют при пониженном давлении и остаток обрабатывают дихлорметаном. После сушки над сульфатом натрия растворитель удаляют с получением сложного этилового эфира 4-гидроксиметилпиперидин-4-карбоновой кислоты. Следующие далее промежуточные соединения XIX-XXIX могут быть получены, следуя такой же процедуре, как для промежуточного соединения V.XIX) Сложный этиловый эфир 4-(4-метоксибутил)пиперидин-4-карбоновой кислотыXX) Сложный этиловый эфир 4-(2-феноксиэтил)пиперидин-4-карбоновой кислотыXXI) Сложный этиловый эфир 4-(2,6-дифторбензил)пиперидин-4-карбоновой кислотыXXII) Сложный этиловый эфир 4-пиридин-2-илметилпиперидин-4-карбоновой кислотыXXIII) Сложный этиловый эфир 4-[2-(2-метоксифенокси)этил]пиперидин-4-карбоновой кислотыXXIV) Сложный этиловый эфир 4-(4-метилбензил)пиперидин-4-карбоновой кислотыXXV) Сложный этиловый эфир 4-пиридин-3-илметилпиперидин-4-карбоновой кислотыXXVI) Сложный этиловый эфир 4-пиридин-4-илметилпиперидин-4-карбоновой кислотыXXVII) Сложный этиловый эфир 4-изопропоксиметилпиперидин-4-карбоновой кислотыXXVIII) Сложный этиловый эфир 4-циклопентилоксиметилпиперидин-4-карбоновой кислотыXXIX) Сложный этиловый эфир 4-(2-морфолин-4-ил-этил)пиперидин-4-карбоновой кислоты Это соединение получают, следуя такому же способу, как для сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-метилпиперидин-1,4-дикарбоновой кислоты [стадия (а) для промежуточного соединения V]. 5% Pd/C (0,3 г, влажность 50%) добавляют к раствору сложного 4-этилового эфира сложного 1 трет-бутилового эфира 4-(2-метилаллил)пиперидин-1,4-дикарбоновой кислоты (1,0 г, 0,0032 моль) в этаноле (10 мл). Реакционную смесь перемешивают при положительном давлении газообразного водорода в течение 1 ч при комнатной температуре. Реакционную смесь фильтруют через слой целита и промывают этанолом (15 мл). Объединенный фильтрат концентрируют при пониженном давлении с получением сложного 4- этилового эфира сложного 1-трет-бутилового эфира 4-изобутилпиперидин-1,4-дикарбоновой кислоты. Раствор гидроксида калия (85%, согласно анализу, 2,69 г, 0,041 моль) и гидроксида натрия (1,94 г,0,048 моль) в деминерализованной воде (8 мл) добавляют к раствору сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-изобутилпиперидин-1,4-дикарбоновой кислоты (0,95 г, 0,003 моль) в этаноле (15 мл). Реакционную смесь нагревают с обратным холодильником в течение 48 ч. Ее охлаждают до комнатной температуры, концентрируют при пониженном давлении, а затем обрабатывают деминерализованной водой (10 мл). рН доводят до 3-4 с использованием 2 н HCl (10 мл) и водный слой экстрагируют этилацетатом (215 мл). Объединенный экстракт сушат над сульфатом натрия. Удаление растворителя дает сырой остаток, который очищают с помощью колоночной хроматографии (230-400 меш, этилацетат:н-гексан, 1:3) с получением сложного монотрет-бутилового эфира 4-изобутилпиперидин-1,4 дикарбоновой кислоты. Раствор хлористо-водородной кислоты (12 н, 1,2 мл) в 1,4-диоксане (2,4 мл) добавляют к сложному монотрет-бутиловому эфиру 4-изобутилпиперидин-1,4-дикарбоновой кислоты (0,7 г, 0,0025 моль) и перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют при пониженном давлении и остаток обрабатывают насыщенным раствором бикарбоната натрия (0,5 мл) для доведения рН до 7. Ее опять концентрируют при пониженном давлении с получением сырой 4 изобутилпиперидин-4-карбоновой кислоты. Это соединение получают, следуя такой же процедуре, как для сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-метилпиперидин-1,4-дикарбоновой кислоты [стадия (а) для промежуточного соединения V]. Порошок гидроксида калия (85%, согласно анализу, 2,16 грамм, 0,0327 моль) и простой 18-краун-6 эфир (350 мг) добавляют к раствору сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4 циклопропилметилпиперидин-1,4-дикарбоновой кислоты (1,2 г, 0,0039 моль) в сухом толуоле (15 мл). Реакционную смесь нагревают с обратным холодильником в течение 30 мин. Затем ее обрабатывают деминерализованной водой (15 мл) при комнатной температуре, и рН доводят до 3-4 с использованием 2 нHCl (20 мл). Водный слой экстрагируют этилацетатом (215 мл) и объединенный экстракт сушат над сульфатом натрия. Удаление растворителя дает сложный монотрет-бутиловый эфир 4 циклопропилметилпиперидин-1,4-дикарбоновой кислоты. Это промежуточное соединение получают, следуя такой же процедуре, как изобутилпиперидин-4-карбоновой кислоты [стадия (d) для промежуточного соединения XXX]. 4 Это промежуточное соединение получают, следуя такой же процедуре, как циклопропилметил-пиперидин-4-карбоновой кислоты (XXXI).XXXIII) Сложный этиловый эфир 4-тиофен-2-илметилпиперидин-4-карбоновой кислоты 4 Метансульфонилхлорид (6,2 мл, 0,0797 моль) добавляют по каплям к раствору тиофен-2-метанола(7,0 г, 0,0613 моль) и триэтиламина (12,8 мл, 0,0920 моль) в дихлорметане (70 мл) при 0-5 С. Реакционной смеси позволяют перемешиваться при комнатной температуре в течение 30 мин. Деминерализованную воду (25 мл) добавляют к реакционной смеси, и органический слой отделяют. Водный слой экстрагируют дихлорметаном (125 мл). Объединенный органический слой сушат над безводным сульфатом натрия. Удаление растворителя при пониженном давлении дает сложный тиофен-2-илметиловый эфир метансульфоновой кислоты. н-Бутиллитий (15% раствор в н-гексане; 10 мл, 0,023 моль) добавляют к перемешиваемому раствору диизопропиламина (3,5 мл, 0,025 моль) в тетрагидрофуране (25 мл) при -70 С в атмосфере азота и перемешивают в течение 30 минут. Раствор сложного 4-этилового эфира сложного 1-трет-бутилового эфира пиперидин-1,4-дикарбоновой кислоты (3 г, 0,012 моль) в тетрагидрофуране (10 мл) вводят при -70 С. Добавляют гексаметилфосфарамид (4,8 мл), и реакционной смеси позволяют перемешиваться до тех пор,пока температура не достигнет -45 С. Реакционную смесь опять охлаждают до -70 С, добавляют сложный тиофен-2-илметиловый эфир метансульфоновой кислоты (5,8 г, 0,030 моль) в тетрагидрофуране (10 мл) и перемешивают в течение 45 мин. К реакционной смеси медленно добавляют деминерализованную воду (15 мл) при 0 С и перемешивают в течение 10 мин. Ее экстрагируют этилацетатом (215 мл). Объединенный органический слой сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает сырой остаток, который очищают с помощью колоночной хроматографии (230-400 меш,этилацетат:н-гексан, 15:85) с получением сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-тиофен-2-илметилпиперидин-1,4-дикарбоновой кислоты. Это промежуточное соединение получают, следуя такой же процедуре, как для сложного этилового эфира 4-метилпиперидин-4-карбоновой кислоты [стадия (b) для промежуточного соединения V].XXXIV) Сложный этиловый эфир 4-фуран-2-илметилпиперидин-4-карбоновой кислоты Это промежуточное соединение получают, следуя такой же процедуре, как для сложного этилового эфира 4-тиофен-2-илметилпиперидин-4-карбоновой кислоты (XXXIII).XXXV) Сложный этиловый эфир 4-(3-пиперидин-1-ил-пропил)пиперидин-4-карбоновой кислоты Это соединение получают, следуя такой же процедуре, как для сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-бензилоксиметилпиперидин-1,4-дикарбоновой кислоты [стадия (а) для промежуточного соединения (XVIII)]. Это соединение получают, следуя такой же процедуре, как для сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-гидроксиметилпиперидин-1,4-дикарбоновой кислоты [стадия (b) промежуточного соединения (XVIII)]. Четырехбромистый углерод (1,6 грамм, 0,0048 моль) добавляют к перемешиваемому раствору сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-(3-гидроксипропил)пиперидин-1,4 дикарбоновой кислоты (1,27 г, 0,0040 моль) и трифенилфосфина (1,6 г, 0,0060 моль) в дихлорметане (15 мл) при температуре 0-5 С. Реакционной смеси позволяют перемешиваться при комнатной температуре в течение 30 мин. Удаление растворителя дает сырой остаток, который очищают с помощью колоночной хроматографии (силикагель 230-400 меш, этилацетат:н-гексан 3:7) с получением сложного 4-этилового эфира сложного 1-трет-бутилового эфира 4-(3-бромпропил)пиперидин-1,4-дикарбоновой кислоты. трет-бутилового эфира 4-(3-бромпропил)пиперидин-1,4-дикарбоновой кислоты (0,1 г, 0,00026 моль) в тетрагидрофуране (5 мл). Реакционную смесь нагревают при 60-65 С в течение 3 ч. Затем ее охлаждают до комнатной температуры, обрабатывают деминерализованной водой (12 мл) и экстрагируют этилацетатом (220 мл). Объединенный экстракт сушат над сульфатом натрия и концентрируют при пониженном давлении с получением сырого остатка, который очищают с помощью колоночной хроматографии Это промежуточное соединение получают, следуя такой же процедуре, как для сложного этилового эфира 4-гидроксиметилпиперидин-4-карбоновой кислоты [стадия (с) для промежуточного соединенияXXXVI) Сложный этиловый эфир 4-(3-пирролидин-1-ил-пропил)пиперидин-4-карбоновой кислоты Это промежуточное соединение получают, следуя такой же процедуре, как для сложного этилового эфира 4-(3-пиперидин-1-ил-пропил)пиперидин-4-карбоновой кислоты (XXXV). Получение соединений по настоящему изобретению Способ получения некоторых репрезентативных соединений по настоящему изобретению рассматривается ниже в настоящем документе. Такие описания предназначаются только для иллюстративных целей и не должны рассматриваться как ограничивающие настоящее изобретение. Пример 1. 1-4-[5-(3-Хлор-4-циклогексилфенил)-[1,2,4]оксадиазол-3-ил]бензил-4-метилпиперидин-4-карбоновая кислотаN,N'-Дициклогексилкарбодиимид (0,615 г, 0,003 моль) добавляют к раствору 3-хлор-4 циклогексилбензойной кислоты (0,475 г, 0,002 моль), N-гидрокси-4-гидроксиметилбензамидина (0,45 г,0,003 моль) и N-гидроксибензотриазола моногидрата (0,457 г, 0,003 моль) в N,N-диметилформамиде (10 мл). Реакционную смесь перемешивают при 130-135 С в течение 2 ч. Затем ее охлаждают до 0-5 С,фильтруют и промывают дихлорметаном (220 мл). Фильтрат выпаривают при пониженном давлении, и остаток обрабатывают деминерализованной водой (20 мл). Ее экстрагируют этилацетатом (315 мл), и объединенный экстракт сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает сырой остаток, который очищают с помощью колоночной хроматографии (силикагель 230-400, этилацетат:толуол,15:85) с получением 4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]-оксадиазол-3 ил]фенилметанола. Тионилхлорид (0,27 мл, 0,0037 моль) и N,N-диметилформамид (0,1 мл) добавляют к перемешиваемому раствору 4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]-оксадиазол-3-ил]фенилметанола (0,45 г,0,0012 моль) в дихлорметане (10 мл) при 0 С. Реакционную смесь нагревают при 40-45 С и перемешивают при этой температуре в течение 1 ч. Затем ее охлаждают до температуры 0-5 С, обрабатывают деминерализованной водой (3 мл) и нейтрализуют 4 н раствором гидроксида натрия при 0-5 С с доведением до рН 8-9. Наконец, ее экстрагируют дихлорметаном (210 мл), и объединенный экстракт сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает 5-(3-хлор-4- 28023638 Карбонат калия (0,16 г, 0,0012 моль) и сложный этиловый эфир 4-метилпиперидин-4-карбоновой кислоты (0,21 г, 0,0012 моль) добавляют к раствору 5-(3-хлор-4-циклогексилфенил)-3-(4 хлорметилфенил)-[1,2,4]оксадиазола (0,3 г, 0,00077 моль) в N,N-диметилформамиде (15 мл). Реакционную смесь нагревают при 65-70 С в течение 2 ч. Удаление растворителя дает сырой остаток, который очищают с помощью колоночной хроматографии (силикагель 230-400 меш, этилацетат:толуол, 1:4) с получением сложного этилового эфира 4-метил-1-4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]оксадиазол 3-ил]бензилпиперидин-4-карбоновой кислоты. Раствор гидроксида натрия (0,1 г, 0,0023 моль) и гидроксида калия (85%, согласно анализу, 0,13 г,0,0020 моль) в деминерализованной воде (2 мл) добавляют к раствору сложного этилового эфира 4 метил-1-4-[5-(3-хлор-4-циклогексилфенил)-[1,2,4]-оксадиазол-3-ил]бензилпиперидин-4-карбоновой кислоты (0,3 г, 0,00057 моль) в тетрагидрофуране и этаноле (14 мл, 1:1). Реакционную смесь нагревают с обратным холодильником (80 С) в течение 2 ч. Затем ее концентрируют при пониженном давлении с получением сырого остатка, который растворяют в деминерализованной воде (10 мл) и подкисляют до рН 4-5 с помощью 20% водного раствора уксусной кислоты. Полученный твердый продукт фильтруют,сушат и промывают ацетоном (210 мл). Твердый продукт сушат в вакууме с получением 1-4-[5-(3 хлор-4-циклогексилфенил)-[1,2,4]-оксадиазол-3-ил]бензил 4-метилпиперидин-4-карбоновой кислоты. Пример 2. Соль трет-бутиламина и 1-4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]-оксадиазол-3-ил] бензил -4-метилпиперидин-4-карбоновой кислоты(15 мл). Реакционную смесь нагревают при 120-125 С в течение 2 ч. Затем ее охлаждают до 0-5 С, фильтруют и промывают дихлорметаном (220 мл). Фильтрат выпаривают при пониженном давлении, и остаток обрабатывают деминерализованной водой (20 мл). Его экстрагируют этилацетатом (230 мл), и объединенный экстракт сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает сырой остаток, который очищают с помощью колоночной хроматографии (силикагель 230-400, этилацетат:толуол, 15:85) с получением 4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]фенилметанола. Тионилхлорид (3,1 мл, 0,043 моль) и N,N-диметилформамид (0,2 мл) добавляют к перемешиваемому раствору 4-[5-(3-хлор-4-изобутилфенил)-[1,2,4]оксадиазол-3-ил]фенилметанола (4,9 г, 0,0143 моль) в дихлорметане (30 мл) при 0 С. Реакционную смесь нагревают при 40-45 С и перемешивают при этой температуре в течение 30 мин. Затем ее охлаждают до температуры 0-5 С, обрабатывают деминерализованной водой (3 мл) и нейтрализуют с помощью каустического щлока для доведения рН до 8-9. Наконец ее экстрагируют дихлорметаном (220 мл) и объединенный экстракт сушат над сульфатом натрия. Удаление растворителя при пониженном давлении дает 5-(3-хлор-4-изобутилфенил)-3-(4-хлорметилфенил)[1,2,4]-оксадиазол.
МПК / Метки
МПК: A61P 29/00, A61K 31/454, A61P 35/00, A61K 31/5377, C07D 413/14, A61P 9/10, C07D 413/10, A61P 37/06
Метки: кислоты, производные, рецепторов, 1-{4-(5-арил-[1,2,4]-оксадиазол-3-ил)бензил}пиперидин-4-илкарбоновой, агонистов, качестве
Код ссылки
<a href="https://eas.patents.su/30-23638-proizvodnye-1-4-5-aril-124-oksadiazol-3-ilbenzilpiperidin-4-ilkarbonovojj-kisloty-v-kachestve-agonistov-s1p1-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-{4-(5-арил-[1,2,4]-оксадиазол-3-ил)бензил}пиперидин-4-илкарбоновой кислоты в качестве агонистов s1p1 рецепторов</a>
Предыдущий патент: Система для маркировки участков железнодорожного пути и детектирования промаркированных указанной маркировкой участков пути в целях обслуживания железнодорожных путей
Следующий патент: Выделение диоксида углерода из процесса брожения при высоком давлении
Случайный патент: Машина для высаживания лент с семенами или рассадой












