Производные 3-ароилиндола и их применение в качестве агонистов рецепторов cb2
Номер патента: 5854
Опубликовано: 30.06.2005
Авторы: Ринальди Мирей, Васс Фабьенн, Конжи Кристиан, Барт Франсис, Гийомон Кароль, Верне Клод
Формула / Реферат
1. Соединение формулы
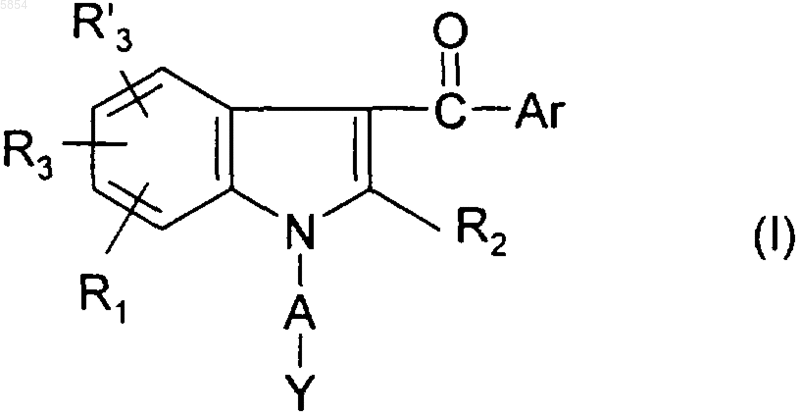
где Ar представляет собой
a) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена, (C1-C4)алкила, трифторметила, амино, нитро, гидроксила, (C1-C4)алкокси, (C1-C4)алкилсульфанила или (C1-C4)алкилсульфонила;
b) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (C1-C4)алкилом или трифторметилом;
A представляет собой C2-C6алкиленовый радикал;
Y представляет собой группу, выбранную из SR4, SOR4, SO2R4, SO2NR5R6, N(R7)SO2R4, OR4 или NR7SO2NR5R6;
R1, R3 и R'3, каждый независимо друг от друга, представляют собой водород, гидроксил, атом галогена, (C1-C4)алкил, трифторметил или (C1-C4)алкокси;
R2 представляет собой водород или (C1-C4)алкил;
R4 представляет собой (C1-C4)алкил или трифторметил;
R5 и R6, каждый независимо, представляют собой водород или (C1-C4)алкил;
R7 представляет собой водород или (C1-C4)алкил;
и его возможные соли и/или его сольваты.
2. Соединение по п.1 формулы
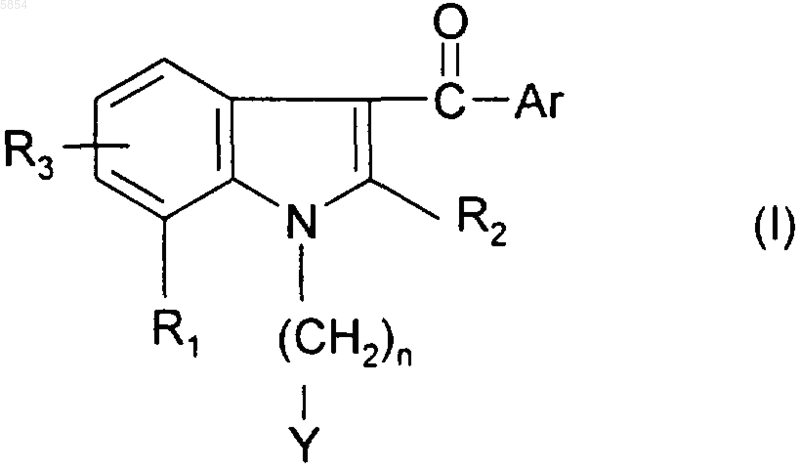
где Ar представляет собой
a) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена, (C1-C4)алкила, трифторметила, амино, нитро, (C1-C4)алкокси, (C1-C4)алкилсульфанила или (C1-C4)алкилсульфонила;
b) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (C1-C4)алкилом или трифторметилом;
n представляет собой 2, 3 или 4;
Y представляет собой группу, выбранную из SR4, SOR4, SO2R4, SO2NR5R6, N(R7)SO2R4 или OR4;
R1 представляет собой атом галогена, (C1-C4)алкил, трифторметил или (C1-C4)алкокси;
R2 представляет собой водород или (C1-C4)алкил;
R3 представляет собой водород, (C1-C4)алкил или галоген;
R4 представляет собой (C1-C4)алкил;
R5 и R6, каждый независимо, представляют собой водород или (C1-C4)алкил;
R7 представляет собой водород или (C1-C4)алкил;
и его возможные соли и/или его сольваты.
3. Соединение по п.1 формулы (I), где R1 находится в положении 7 индольного ядра и представляет собой метил или атом хлора или брома.
4. Соединение по п.1 формулы (I), где R2 представляет собой (C1-C4)алкил.
5. Соединение по п.1 формулы (I), где R3 представляет собой водород или R3 находится в положении 6 индольного ядра и представляет собой либо атом хлора, либо метил.
6. Соединение по п.1 формулы (I), где R'3 представляет собой водород.
7. Соединение по п.1 формулы (I), где Ar представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом.
8. Соединение по п.1 формулы (I), где Y представляет собой SO2R4 или NHSO2R4.
9. Соединение по п.1 формулы (I), где
Ar представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом;
A представляет собой группу (CH2)n;
n представляет собой 2, 3 или 4;
Y представляет собой SO2R4 или NHSO2R4;
R1 представляет собой метил или атом хлора или брома в положении 7 индольного ядра;
R2 представляет собой метил;
R3 представляет собой водород или R3 представляет собой либо атом хлора, либо метил в положении 6 индольного ядра;
R'3 представляет собой водород;
R4 представляет собой метил или этил;
и его возможные соли и/или его сольваты.
10. Способ получения соединения формулы (I) по п.1, его возможных солей и/или его сольватов, отличающийся тем, что
a) индол формулы
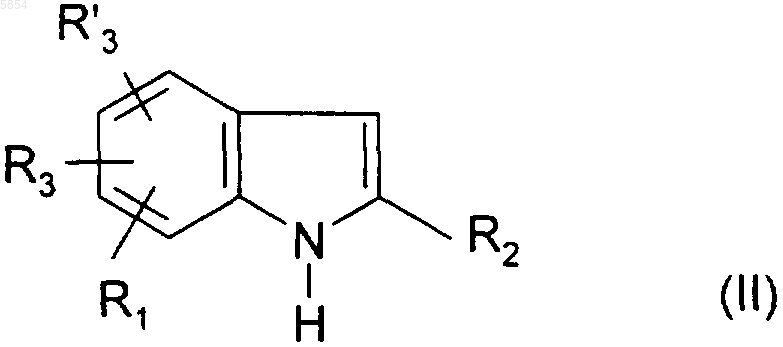
где R1, R2, R3 и R'3 являются такими, как определено в п.1 для соединения формулы (I), обрабатывают метилмагнийгалогенидом и галоидангидридом формулы ArCOHal (III), где Ar является таким, как определено для соединения формулы (I), и Hal представляет собой атом галогена;
b) полученное таким образом соединение формулы

обрабатывают галогенидом формулы Hal-A-Y (V), где -A- и Y являются такими, как определено для соединения формулы (I) в п.1, а Hal представляет собой атом галогена, в присутствии основания.
11. Способ по п.10, отличающийся тем, что стадию (b) модифицируют следующим образом:
b1) полученное на стадии (a) соединение формулы
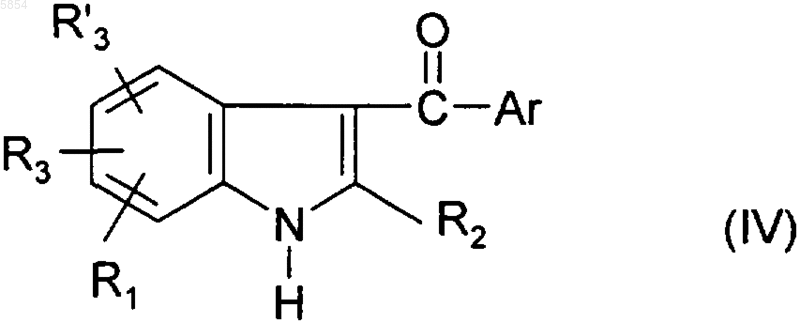
обрабатывают соединением формулы Z-A-Cl (VI), где Z представляет собой либо гидроксильную группу, либо атом галогена, а -A- является таким, как определено для (I) в п.1;
b2) возможно, полученное таким образом соединение формулы
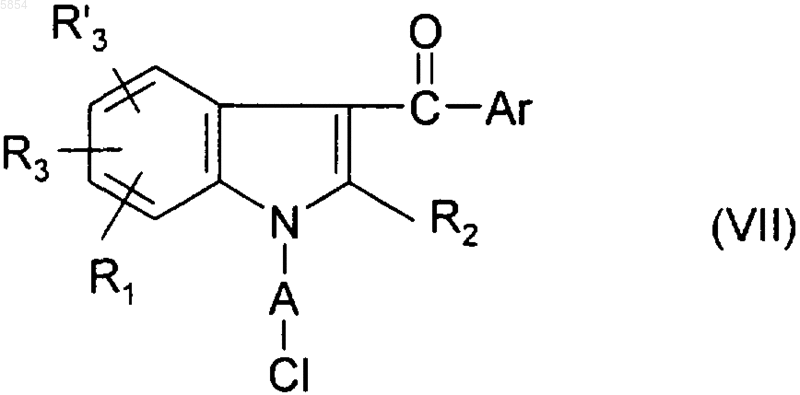
обрабатывают йодидом натрия;
b3) полученное таким образом на стадии (b1) соединение формулы (VII) или на стадии (b2) соединение формулы
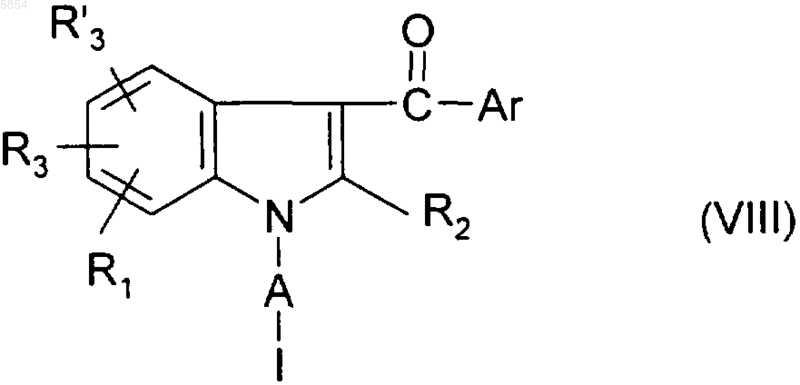
обрабатывают анионом Y(-), причем Y является таким, как определено для соединения формулы (I) в п.1.
12. Способ по п.10 получения соединения формулы (I), где Y представляет собой группу SOR4 или группу SO2R4, из соединения формулы (I), где Y представляет собой группу SR4, отличающийся тем, что проводят следующую дополнительную стадию:
c1) полученное соединение формулы
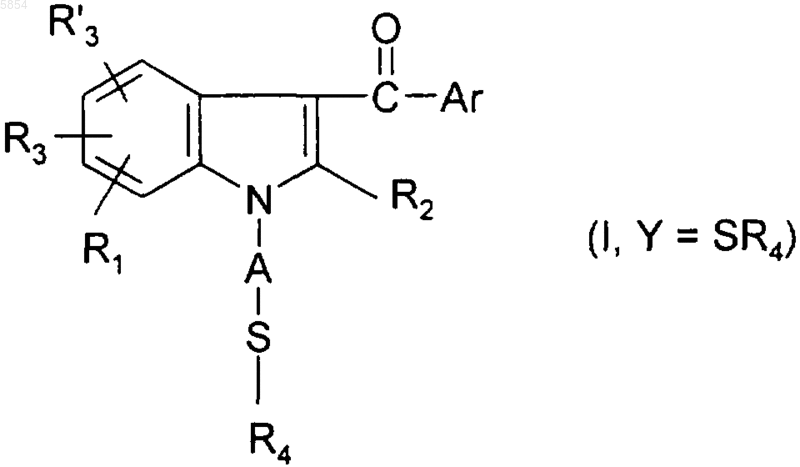
обрабатывают окислителем.
13. Способ по п.10 получения соединения формулы (I), где Y представляет собой группу N(R7)SO2R4, где R7 является иным, чем H, из соединения формулы (I), где Y представляет собой группу NHSO2R4, отличающийся тем, что проводят следующую дополнительную стадию:
c2) полученное соединение формулы
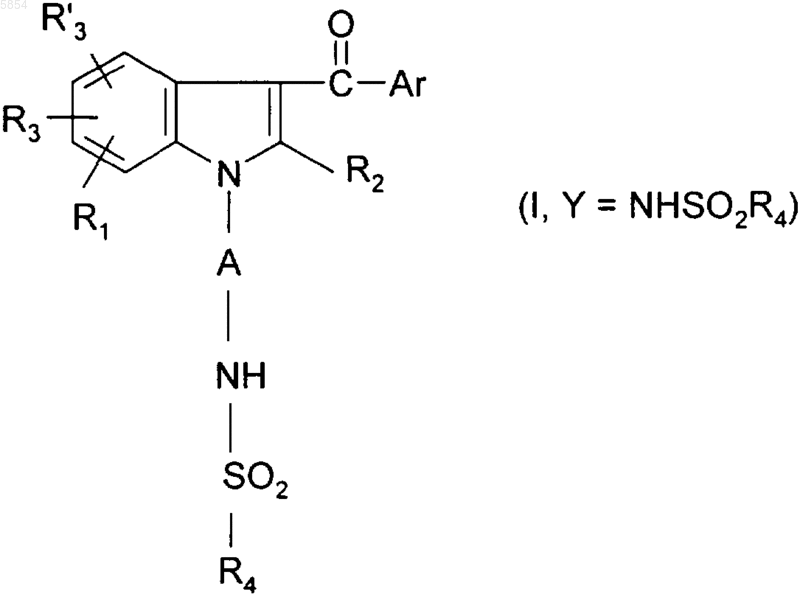
обрабатывают алкилирующим агентом в присутствии основания.
14. Способ по п.10 получения соединения формулы (I), где Y представляет собой группу SO2NR5R6, из соединения формулы (I), где Y представляет собой группу SO2NHR5, отличающийся тем, что проводят следующую дополнительную стадию:
c3) полученное соединение формулы
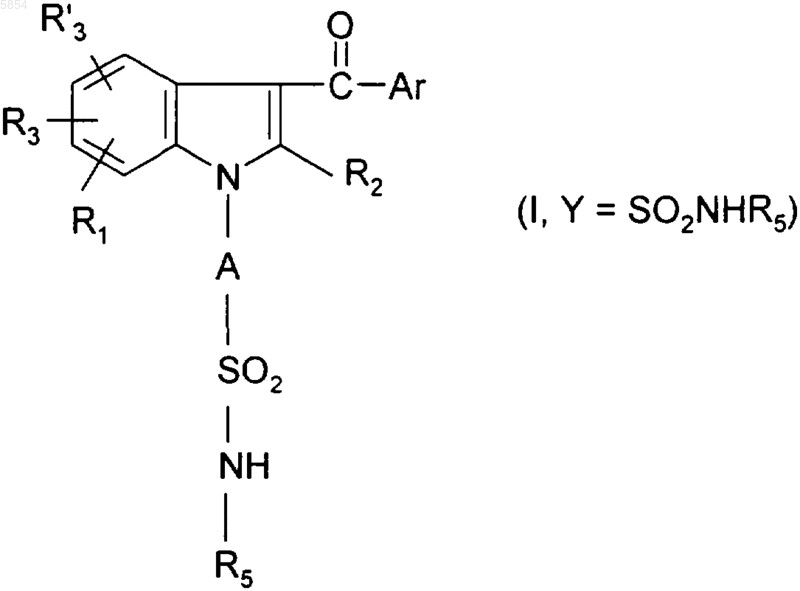
обрабатывают алкилирующим агентом в присутствии основания.
15. Способ по п.10 получения соединения формулы (I), где Y представляет собой NR7SO2R4 или груяяу NR7SO2NR5R6, отличающийся тем, что
b4) соединение формулы
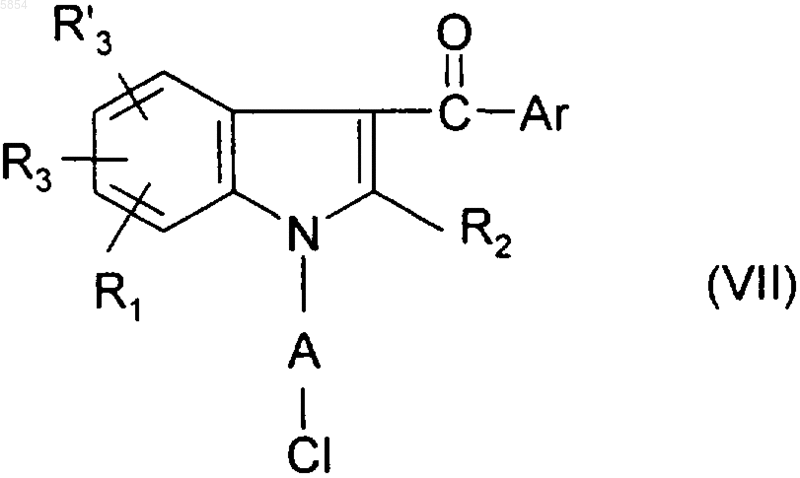
превращают в соединение формулы
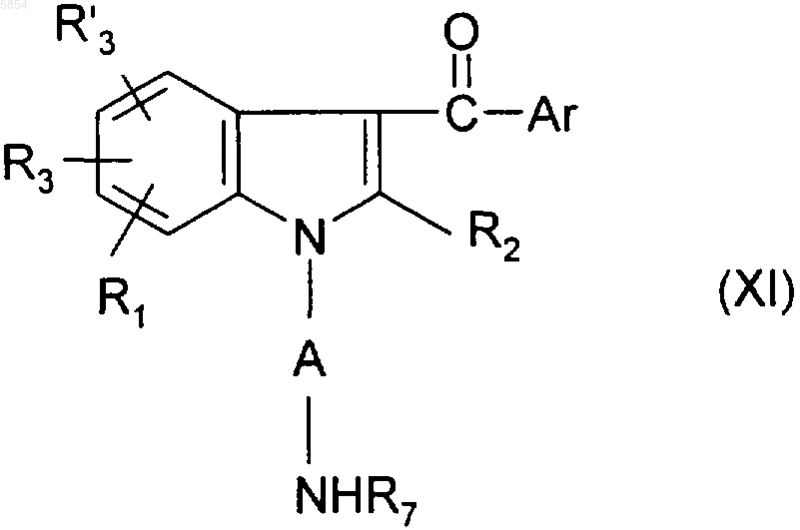
где R7 является таким, как определено для (I);
c4) проводят обработку галогенидом формулы HalSO2R4 или соответственно HalSO2NR5R6, где R4, R5 и R6 имеют значения, приведенные в п.1 для соединения формулы (I).
16. Способ получения соединения формулы (I) по п.1, его солей и/или сольватов, отличающийся тем, что
i) индол формулы
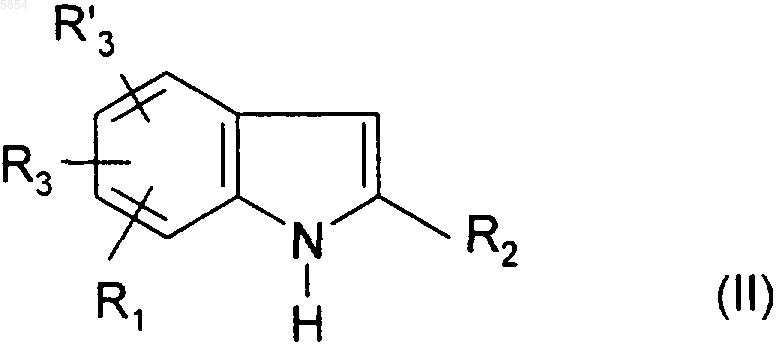
где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают галогенидом формулы Hal-A-Y (V), где -A- и Y являются такими, как определено для соединения формулы (I) в п.1, а Hal представляет собой атом галогена, предпочтительно брома, в присутствии основания;
ii) полученное таким образом соединение формулы
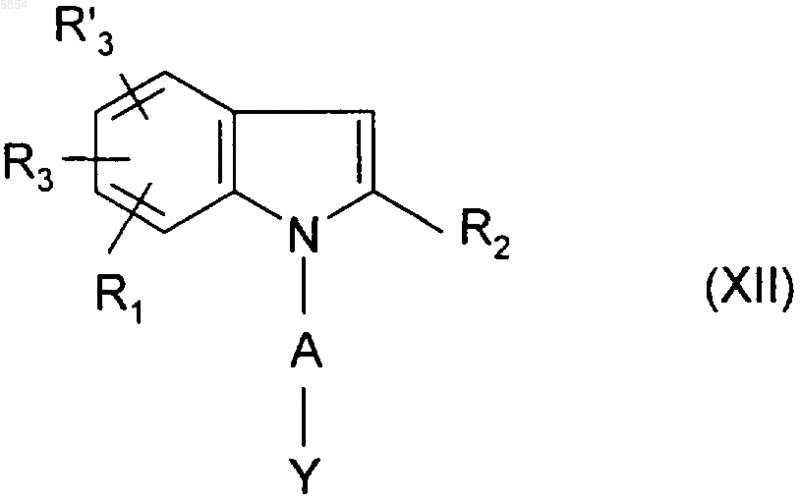
обрабатывают галоидангидридом формулы ArCOHal (III), где Ar является таким, как определено для соединения формулы (I) в п.1, а Hal представляет собой атом галогена.
17. Способ по п.16, отличающийся тем, что
i1) индол формулы
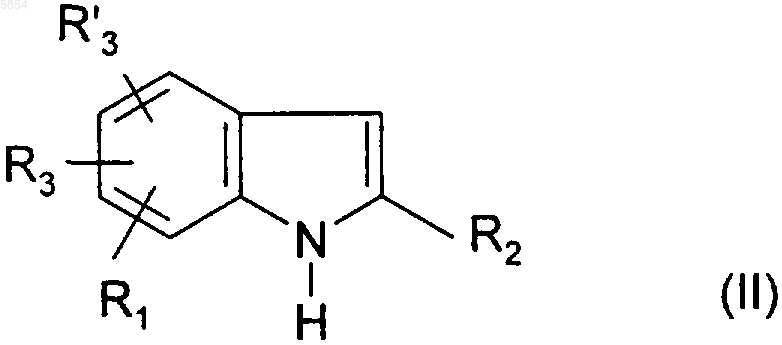
где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают соединением формулы Z-A-Cl (VI), где -A- является таким, как определено для соединения формулы (I) в п.1, а Z представляет собой гидроксильную группу или атом галогена;
i2) возможно, полученное таким образом соединение формулы

обрабатывают йодидом натрия;
i3) полученное таким образом на стадии (i1) или на стадии (i2) соединение формулы
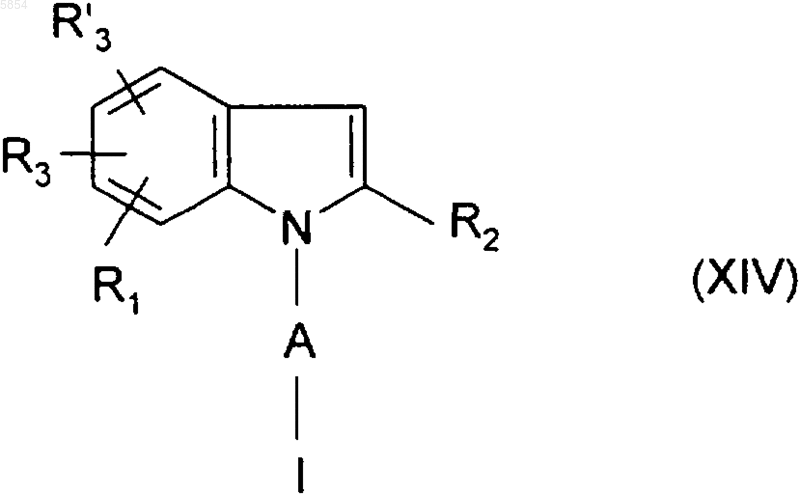
обрабатывают анионом формулы Y(-), причем Y является таким, как определено для соединения формулы (I) в п.1;
ii) полученное таким образом соединение формулы
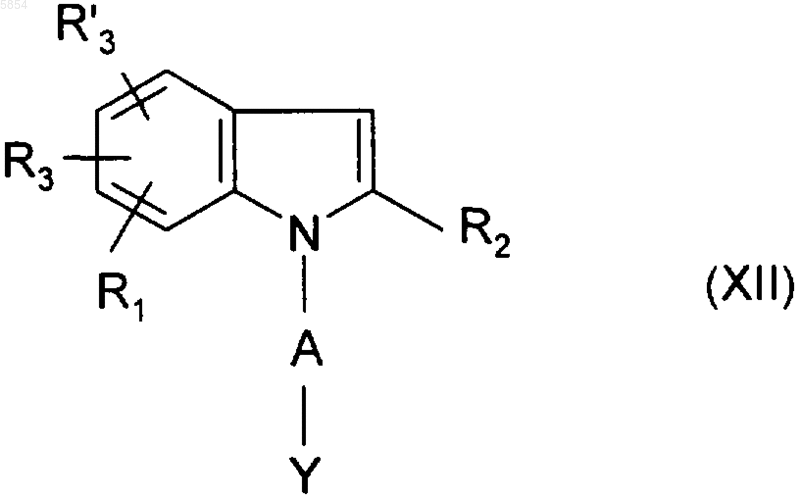
обрабатывают галоидангидридом формулы ArCOHal (III), где Ar является таким, как определено для соединения формулы (I) в п.1, а Hal представляет собой атом галогена.
18. Соединение формулы
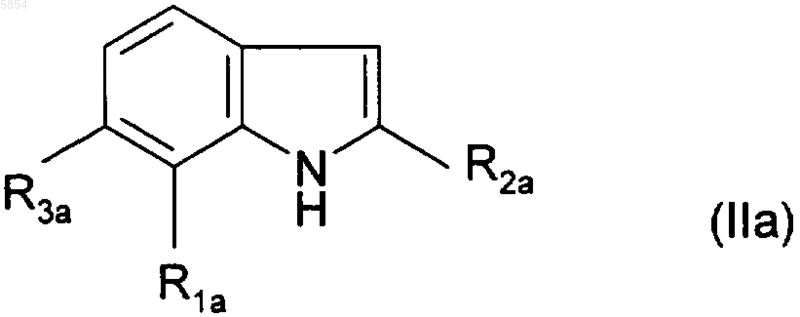
где R1a представляет собой атом хлора или брома или метил;
R2a представляет собой (C1-C4)алкил;
R3a представляет собой водород, атом хлора или брома или метил;
19. Соединение формулы

где R1a представляет собой атом хлора или брома или метил;
R2a представляет собой (C1-C4)алкил;
R3a представляет собой водород, атом хлора или брома или метил;
Ar является таким, как определено для соединений формулы (I).
20. Соединение формулы
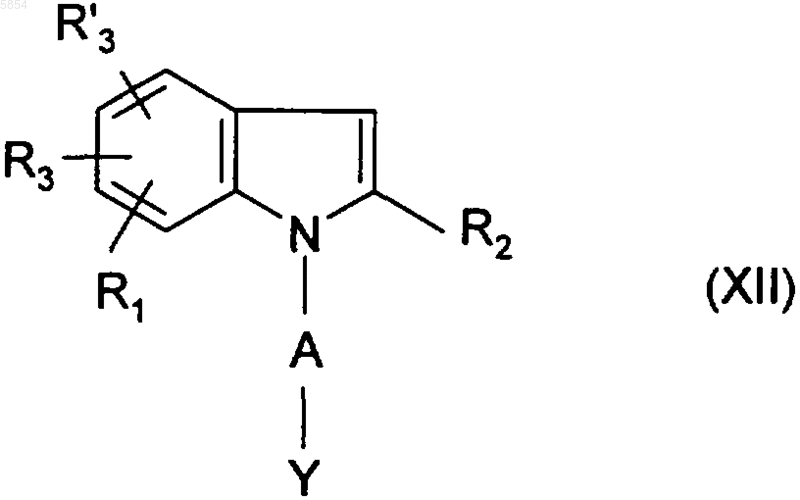
где R1, R2, R3, R'3 и Y являются такими, как определено для (I) по п.1.
21. Фармацевтическая композиция, содержащая в качестве активного начала соединение по любому из пп.1-9.
22. Фармацевтическая композиция по п.21, содержащая от 0,1 до 1000 мг активного начала в форме дозировочной единицы, в которой активное начало смешано по меньшей мере с одним фармацевтическим эксципиентом.
23. Применение соединения по любому из пп.1-9 в приготовлении лекарств, предназначенных для борьбы с любой патологией, в которую вовлечены каннабиноидные рецепторы CB2.
Текст
005854 Объектом настоящего изобретения являются новые соединения, производные 3-ароилиндола, которые являются агонистами каннабиноидных рецепторов СВ 2, способы их получения и содержащие их фармацевтические композиции. 9-Тетрагидроканнабинол (9-ТГК) представляет собой основной активный компонент, экстрагируемый из Cannabis sativa (Tuner, 1985; In Marijuana 1984, edited by Harvey, DY, IRL Press, Oxford). Во множестве статей были описаны не только психотропные эффекты каннабиноидов, но и влияние последних на иммунную функцию [HOLLISTER L.Е., J. Psychoact. Drugs, 24 (1992), 159-164]. Большинство in vitro исследований продемонстрировало иммунодепрессантные эффекты каннабиноидов: ингибирование пролиферативных реакций у Т-лимфоцитов и В-лимфоцитов, индуцированных митогенами [Luo,Y.D. et al., Int. J. Immunopharmacol., (1992) 14, 49-56, Schwartz, H. et al., J. Neuroimmunol., (1994) 55, 107115], ингибирование активности цитотоксических Т-клеток [Klein et al., J. Toxicol. Environ. Health, (1991) 32, 465-477], ингибирование микробицидной активности макрофагов и синтеза фактора некроза опухоли(TNF) [Arata, S. et al., Life Sci., (1991) 49, 473-479; Fisher-Stenger et al., J. Pharm. Exp. Ther., (1993) 267,1558-1565], ингибирование цитолитической активности и продукции TNF крупногранулярных лимфоцитов [Kusher et al., Cell. Immun., (1994) 154, 99-108]. В некоторых исследованиях наблюдались эффекты амплификации: увеличение биологической активности интерлейкина-1 резидентными макрофагами мышей или клеточными линиями дифференцированных макрофагов вследствие увеличения уровней TNF[Zhu et al., J. Pharm. Exp. Ther., (1994) 270, 1334-1339; Shivers, S.С. et al., Life Sci., (1994) 54, 1281-1289]. Эффекты каннабиноидов являются следствием взаимодействия со специфическими высокоаффинными рецепторами, связанными с G белками, присутствующими на центральном уровне (Devane et al., MolecularPharmacology (1988), 34, 605-613) и периферическом уровне (Nye et al., J. Pharmacol. and Exp. Ther. (1985),234, 784-791; Kaminski et al., Molecular Pharmacol. (1992), 42, 736-742; Munro et al., Nature (1993), 365, 61-65). Центральные эффекты каннабиноидов связаны с первым типом каннабиноидных рецепторов (CB1), который присутствует в основном в мозге, но также и на периферии. Кроме того, Munro et al. [Nature, (1993) 365, 61-65] клонировали второй тип каннабиноидных рецепторов, СВ 2, который присутствует на периферии и, более конкретно,на клетках иммунного происхождения. Присутствие каннабиноидных рецепторов СВ 2 на лимфоидных клетках может дать объяснение упомянутой выше иммуномодуляции, вызываемой агонистами каннабиноидных рецепторов. В предшествующем уровне техники было упомянуто, что некоторые производные индола демонстрируют аффинность к рецепторам СВ 2. Так, в патенте США 5532237 раскрыты соединения формулы где заместители имеют различные значения; а в eвропейской патентной заявке ЕР 833818 раскрыты соединения формулы где заместители имеют различные значения. Объектом настоящего изобретения являются соединения формулы где Аr представляет собой а) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена, (С 1-С 4)алкила, трифторметила, амино, нитро, гидроксила, (С 1-С 4)алкокси, (С 1-С 4)алкилсульфанила или (С 1-С 4)алкилсульфонила; б) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (С 1-С 4)алкилом или трифторметилом; А представляет собой С 2-С 6 алкиленовый радикал;R1, R3 и R'3, каждый независимо друг от друга, представляют собой водород, гидроксил, атом галогена, (С 1-С 4)алкил, трифторметил или (С 1-С 4)алкокси;R2 представляет собой водород или (С 1-С 4)алкил;R5 и R6, каждый независимо, представляет собой водород или (С 1-С 4)алкил;R7 представляет собой водород или (С 1-С 4)алкил; и их возможные соли и их сольваты. Подразумевается, что термин "галоген" означает атом хлора, брома, фтора или йода. Подразумевается, что термин "алкил" или "алкилиден" означает линейный или разветвленный радикал. Когда соединения формулы (I) включают в себя асимметрический атом серы или асимметрический атом углерода, все оптические изомеры и их смесь в любых пропорциях являются предметом данного изобретения. В общем случае, соли получают с фармацевтически приемлемыми кислотами, но соли других кислот,используемых при очистке или выделении соединений формулы (I), также составляют часть данного изобретения. Фармацевтически приемлемыми солями соединений формулы (I) являются, например, гидрохлорид, гидробромид, сульфат, гидросульфат, дигидрофосфат, метансульфонат, бензолсульфонат, нафталинсульфонат, паратолуолсульфонат, малеат, фумарат, сукцинат, цитрат, ацетат, глюконат или оксалат. В частности, объектом настоящего изобретения являются соединения формулы где Аr представляет собой а) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена,(С 1-С 4)алкила, трифторметила, амино, нитро, (С 1-С 4)алкокси, (С 1-С 4)алкилсульфанила или (С 1-С 4)алкилсульфонила; б) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (С 1-С 4)алкилом или трифторметилом;R1 представляет собой атом галогена, (С 1-С 4)алкил, трифторметил или (С 1-С 4)алкокси;R2 представляет собой водород или (С 1-С 4)алкил;R5 и R6, каждый независимо, представляет собой водород или (С 1-С 4)алкил;R7 представляет собой водород или (С 1-С 4)алкил; и их возможные соли и их сольваты. В соответствии с настоящим изобретением предпочтение отдается соединениям формулы (I), где R1 находится в положении 7 индольного ядра и представляет собой метил или атом хлора или брома, и соединениям формулы (I), где R2 представляет собой (С 1-С 4)алкил, в частности метил. Предпочтительными являются соединения формулы (I), где R3 представляет собой водород, или R3 находится в положении 6 индольного ядра и представляет собой атом хлора или метил. Предпочтительными являются соединения формулы (I), где R'3 представляет собой водород. Предпочтительными являются соединения формулы (I), где Аr представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом. Также предпочтительными являются соединения формулы (I), где Y представляет собой SO2R4 илиNНSO2R4, в частности, когда R4 представляет собой метил или этил. Таким образом, особое предпочтение отдается соединениям формулы (I), где Аr представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом; А представляет собой группу (СН 2)n;R1 представляет собой метил или атом хлора или брома в положении 7 индольного ядра;R3 представляет собой водород или R3 представляет собой либо атом хлора, либо метил в положении 6 индольного ядра;R4 представляет собой метил или этил;-2 005854 и их возможные соли и их сольваты. Еще одним объектом настоящего изобретения являются способы получения соединений формулы(I), их возможных солей и их сольватов. Один способ по данному изобретению, обозначенный как способ А, отличается тем, что а) индол формулы где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают метилмагнийгалогенидом и галоидангидридом формулы ArCOHal (III), где Аr является таким, как определено для соединения формулы (I), a Hal представляет собой атом галогена, предпочтительно хлора;b) полученное таким образом соединение формулы обрабатывают галогенидом формулы Hal-A-Y (V), где -А- и Y являются такими, как определено для соединения формулы (I), a Hal представляет собой атом галогена, предпочтительно брома, в присутствии основания. Если целесообразно, соединение формулы (I), полученное таким образом, превращают в одну из его солей или в один из его сольватов. На стадии (а) вышеупомянутого способа ацилирование проводят в инертном растворителе, таком как эфир. На стадии (b) реакцию проводят в присутствии основания, такого как карбонат натрия или карбонат калия, гидрид, такой как гидрид натрия, или гидроксид щелочного металла, такой как гидроксид калия, и в растворителе, таком как толуол, диметилсульфоксид (ДМСО) или N,N-диметилформамид (ДМФ), при температуре в пределах от температуры окружающей среды до температуры кипения растворителя. Конкретно, когда используемое основание представляет собой гидроксид щелочного металла, стадию (b) можно также проводить в присутствии трис[2-(2-метоксиэтокси)этил]амина (TDA-1), как описано в TetrahedronLett., 1987, 28, 2963, или четвертичной аммониевой соли, такой как гидросульфат тетрабутиламмония. Имеется альтернативная форма способа А, обозначенная как способ A1, отличающийся тем, что стадию (b) способа А модифицируют следующим образом:b1) полученное на стадии (а) соединение формулы обрабатывают соединением формулы Z-A-Cl (VI), где Z представляет собой либо гидроксильную группу,либо атом галогена, а -А- является таким, как определено для (I);b2) возможно, полученное таким образом соединение формулыb3) полученное таким образом на стадии (b1) соединение формулы (VII) или на стадии (b2) соединение формулы обрабатывают анионом Y, причем Y является таким, как определено для соединения формулы (I).-3 005854 Когда Z представляет собой атом галогена, стадию (b1) проводят в присутствии основания; когда Z представляет собой гидроксильную группу, стадию (b1) проводят в присутствии трифенилфосфина и диэтилазодикарбоксилата в растворителе, таком как дихлорметан. На стадии (b2), если ее проводят, используют растворитель, такой как ацетонитрил, ацетон или иной кетон. При проведении стадии (b3) используют анион, полученный при взаимодействии соединения формулы YH (IX) с NaH в растворителе, таком как ДМФ. Способ A1 предпочтителен, в частности для получения соединений формулы (I), где Y представляет собой SR4 или NHSO2R4. В соответствии еще c одной альтернативной формой способа А, обозначенной как способ А 2, соединение формулы (I), где Y представляет собой группу SOR4 или группу SO2R4, может быть получено из соединения формулы (I), где Y представляет собой группу SR4. Этот способ отличается тем, что после стадии (b) способа А или стадии (b2) или (b3) способа A1 проводят следующую дополнительную стадию: с 1) полученное соединение формулы обрабатывают окислителем. В качестве окислителя можно использовать водный раствор перекиси водорода или 3-хлорпербензойную кислоту; в зависимости от числа эквивалентов используемого окислителя и в зависимости от температуры реакции получают сульфоксид (I, Y=SOR4) или сульфон (I, Y=SO2R4). В соответствии еще c одной альтернативной формой способа А, обозначенной как способ А 3, соединение формулы (I), где Y представляет собой группу N(R7)SO2R4, где R7 является иным, чем Н, может быть получено из соединения формулы (I), где Y представляет собой группу NHSO2R4. Этот способ отличается тем, что после стадии (b) способа А или стадии (b2) или (b3) способа A1 проводят следующую дополнительную стадию: с 2) полученное соединение формулы обрабатывают алкилирующим агентом в присутствии основания. В качестве алкилирующего агента используют, например, диалкилсульфат формулы SO4(R7)2 или алкилгалогенид формулы R7Hal, где R7 является таким, как определено для соединений формулы (I), a Hal представляет собой атом галогена, предпочтительно йода, в присутствии основания, такого как, например, гидрид натрия. В соответствии еще c одной альтернативной формой способа А, обозначенной как способ A4, соединение формулы (I), где Y представляет собой группу SO2NR5R6, может быть получено из соединения формулы (I), где Y представляет собой группу SO2NHR5. Этот способ отличается тем, что после стадии(b) способа А или стадии (b2) или (b3) способа A1 проводят следующую дополнительную стадию: с 3) полученное соединение формулы-4 005854 обрабатывают алкилирующим агентом в присутствии основания. В качестве алкилирующего агента используют, например, диалкилсульфат формулы SO4(R6)2 или алкилгалогенид формулы R6Hal, где R6 является таким, как определено для соединений формулы (I), a Hal представляет собой атом галогена, предпочтительно йода, в присутствии основания, такого как гидрид натрия. Если требуется получить соединение по настоящему изобретению формулы (I), где Y представляет собой группу NR7SO2R4 или группу NR7SO2NR5R6, можно использовать альтернативную форму способа А, обозначенную как способ А 5. Этот способ отличается тем, что где R7 является таким, как определено для (I); с 4) проводят обработку галогенидом формулы HalSO2R4 или соответственно HalSO2NR5R6, где R4,R5 и R6 имеют значения, приведенные выше для (I). Стадию (b4) можно проводить различными способами, известными специалисту в данной области техники, например реакцией Делепина (Delepine) (Synthesis, 1979, р. 161-179), реакцией Габриеля (Gabriel)(Angew. Chem. Int. Ed. Engl., 1998, 7, 919-930) или реакцией Гебрарда (Hebrard) (Bull. Soc. Chim. Fr., 1970,1938). Стадию (с 4) можно проводить в присутствии основания, такого как триэтиламин. В соответствии со способом, альтернативным описанному выше способу А и его альтернативным формам, сначала можно проводить алкилирование атома азота индола, а затем ацилирование полученного таким образом соединения. Этот альтернативный способ, обозначенный как способ В, отличается тем, что где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают галогенидом формулы Hal-A-Y (V), где -А- и Y являются такими, как определено для соединения формулы (I),a Hal представляет собой атом галогена, предпочтительно брома, в присутствии основания;ii) полученное таким образом соединение формулы обрабатывают галоидангидридом формулы ArCOHal (III), где Аr является таким, как определено для соединения формулы (I), a Hal представляет собой атом галогена, предпочтительно хлора или брома. Если целесообразно, полученное таким образом соединение формулы (I) превращают в одну из его солей или один из его сольватов. Стадию (i) вышеупомянутого способа проводят в условиях, описанных для стадии (b) способа А. Стадию (ii) проводят в условиях Фиделя-Крафтса в присутствии кислоты Льюиса, такой как АlСl3 или дихлорид этилалюминия, в инертном растворителе, таком как дихлорметан или дихлорэтан, в соответствии со способом, описанным в J. Med. Chem., 1995, 38, 3094.-5 005854 Имеются различные альтернативные формы стадии (i) способа В. Эти альтернативные формы соответствуют тому, что было описано для способа А. Эти альтернативные формы также составляют предмет настоящего изобретения. Так, альтернативная форма B1 способа В отличается тем, что где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают соединением формулы Z-A-Cl (VI), где -А- является таким, как определено для соединения формулы (I), a Z представляет собой гидроксильную группу или атом галогена, предпочтительно брома;i2) возможно, полученное таким образом соединение формулыi3) полученное таким образом на стадии (i1) или на стадии (i2) соединение формулы обрабатывают анионом формулы Y, причем Y является таким, как определено для соединения формулыii) полученное таким образом соединение формулы обрабатывают галоидангидридом формулы ArCOHal (III), где Аr является таким, как определено для соединения формулы (I), a Hal представляет собой атом галогена, предпочтительно хлора. Если целесообразно, полученное таким образом соединение формулы (I) превращают в одну из его солей или в один из его сольватов. Конкретно, если требуется получить соединение формулы (I), где А представляет собой (CH2)2,можно использовать известные специалисту в данной области техники способы введения алкильной цепи соответствующей длины на одной из стадий либо способа А, либо способа В. Индолы формулы (II) известны или их получают известными способами, такими как способы, описанные в J. Am. Chem. Soc., 1974, 96, 5495 и 1974, 96, 5512, или в Tetrahedron Lett., 1989, 30, 2129. Индолы формулы где R1a представляет собой атом хлора или брома или метил;R3 а представляет собой водород, атом хлора или брома или метил;-6 005854 являются новыми и составляют объект настоящего изобретения. Соединения формулы ArCOCl (III) известны или их получают известными способами. Соединения формулы Hal(CH2)nY (V) известны или их получают известными способами. Например,-бромметилсульфанилалкил может быть получен из -гидроксиметилсульфанилалкила под действием РВr3. Промежуточные соединения формулы где R1a представляет собой атом хлора или брома или метил;R3 а представляет собой водород, атом хлора или брома или метил; Аr является таким, как определено для соединений формулы (I); являются новыми и составляют еще один объект настоящего изобретения. Промежуточные соединения формулы где R1, R2, R3, R'3, Y и А являются такими, как определено для (I), являются новыми и представляют собой еще один объект настоящего изобретения. Соединения по данному изобретению продемонстрировали хорошую in vitro аффинность к каннабиноидным рецепторам (СВ 2) и существенно более слабую in vitro аффинность к каннабиноидным рецепторам (CB1), будь то рецепторы человека или рецепторы грызунов. Анализы на аффинность связывания выполняли в соответствии с экспериментальными условиями, описанными Devane et al. (MolecularPharmacology, 1988, 34, 605-613), с использованием мембран из клеточной линии, в которой экспрессируются рецепторы CB1 (Matsuda et al., Nature, 1990, 346, 561-564) и рецепторы CB2 (Munro et al., Nature,1993, 365, 61-65). Для рецепторов человека in vitro аффинность к каннабиноидным рецепторам СВ 2, выраженная в виде Кi (константа ингибирования), имеет порядок нМ, и соотношение аффинность к рецепторам CB1/аффинность к рецепторам СВ 2 составляет по меньшей мере 100. Кроме того, соединения по данному изобретению in vitro ведут себя как агонисты, специфичные в отношении каннабиноидных рецепторов СВ 2 по сравнению с каннабиноидными рецепторами CB1; они уменьшают стимулированную форсколином продукцию цАМФ в клетках путем ингибирования аденилатциклазы. Тесты проводили в соответствии с экспериментальными условиями, описанными Matsuda et al., Nature, 1990, 346, 561-564. Соединения по данному изобретению обладают также in vivo аффинностью к каннабиноидным рецепторам, присутствующим в селезенке мыши, при их пероральном введении. Тесты проводили в соответствии с экспериментальными условиями, описанными Rinaldi-Carmona et al., J. Pharmacol. Exp. Ther., 1998, 284, 644-650. Так, соединения примеров 7, 44, 46, 72, 89, 106, 120, 130 и 132, для которых соотношение аффинность к рецепторам CB1/аффинность к рецепторам CB2 находится между 400 и 4000, активны перорально с ЭД 50, составляющей от 0,2 до 20 мг/кг. Соединения по настоящему изобретению являются, в частности, активными началами фармацевтических композиций, токсичность которых совместима с их применением в качестве лекарств. Согласно одному из аспектов настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли или сольвата в приготовлении лекарств, предназначенных для предупреждения или для лечения любой патологии, в которую вовлечены каннабиноидные рецепторы СВ 2. Можно упомянуть, например, следующие заболевания или состояния: расстройства иммунной системы, в частности аутоиммунные заболевания: псориаз, системная красная волчанка, заболевания соединительной ткани, синдром Шегрена, анкилозирующий спондилоартрит, ревматоидный артрит, реактивный артрит, недифференцированный спондилоартрит, болезнь Бехчета, аутоиммунные гемолитические анемии,рассеянный склероз, боковой амиотрофический склероз, амилозы, отторжение трансплантата или заболевания, поражающие линию клеток плазмы; аллергические заболевания: замедленная или немедленная гиперчувствительность, аллергический ринит, контактный дерматит или аллергический конъюктивит; инфекционные паразитические, вирусные или бактериальные заболевания: СПИД или менингит; воспалительные заболевания, в частности заболевания суставов: артрит, ревматоидный артрит, остеоартрит, спондилит, подагра, васкулит, болезнь Крона, воспалительное заболевание кишечника (ВЗК) или синдром раз-7 005854 драженного кишечника (СРК); остеопороз; боль: хроническая боль воспалительного типа, невропатическая боль или острая периферическая боль; глазные состояния: глазная гипертензия или глаукома; легочные состояния: заболевания дыхательных путей, астма, хронический бронхит, хроническая обструктивная пневмония (ХОП) или эмфизема; заболевания центральной нервной системы и нейродегенеративные заболевания: синдром Туретта, болезнь Паркинсона, болезнь Альцгеймера, старческая деменция, хорея, хорея Хантингтона, эпилепсия, психозы, депрессия или повреждения спинного мозга; мигрень, головокружение,рвота или тошнота, в частности рвота или тошнота в результате химиотерапии; сердечно-сосудистые заболевания, в частности гипертензия, атеросклероз, сердечный приступ или сердечная ишемия; почечная ишемия; онкологические заболевания: доброкачественные опухоли кожи, раковые опухоли и папилломы, опухоли предстательной железы или опухоли головного мозга (глиобластомы, медуллоэпителиомы, медуллобластомы, нейробластомы, опухоли эмбрионального происхождения, астроцитомы, астробластомы, эпендимомы, олигодендроглиомы, опухоли сплетений, нейроэпителиомы, опухоль эпифиза, эпендимобластомы,нейроэктодермальные опухоли, злокачественные менингиомы, саркоматозы, злокачественные меланомы или шванномы); заболевания желудочно-кишечного тракта; или ожирение. Применение соединений по данному изобретению для предупреждения и/или лечения вышеупомянутых заболеваний и для приготовлении лекарств, предназначенных для лечения этих заболеваний, составляет неотъемлемую часть данного изобретения. Соединения формулы (I), указанные выше, или их фармацевтически приемлемые соли или сольваты можно использовать в суточных дозах от 0,01 до 100 мг на килограмм массы тела млекопитающего,которого лечат, предпочтительно в суточных дозах от 0,1 до 50 мг/кг. У человека дозу предпочтительно можно варьировать от 0,1 до 4000 мг в сутки, более конкретно от 0,5 до 1000 мг, в зависимости от возраста субъекта, которого лечат, или от типа лечения, профилактического или куративного. При применении в качестве лекарств соединения формулы (I) обычно вводят в виде дозировочных единиц. Указанные дозировочные единицы готовят предпочтительно в виде фармацевтических композиций, в которых активное начало смешано с одним или более чем фармацевтическим эксципиентом. Таким образом, в соответствии еще c одним аспектом настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного начала соединение формулы (I) или его фармацевтически приемлемую соль или сольват. В фармацевтических композициях по настоящему изобретению для перорального, подъязычного,ингаляционного, подкожного, внутримышечного, внутривенного, черескожного, местного или ректального введения активные начала могут быть введены животным и людям в стандартных формах введения в виде смеси с традиционными фармацевтическими разбавителями. Подходящие стандартные формы введения включают формы для перорального ведения, такие как таблетки, желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, формы для подъязычного и трансбуккального введения, аэрозоли, формы для местного введения, имплантаты, формы для подкожного, внутримышечного, внутривенного, интраназального или внутриглазного введения и формы для ректального введения. Когда твердую композицию готовят в форме таблеток или желатиновых капсул, к микронизированному или немикронизированному активному началу добавляют смесь фармацевтических эксципиентов,которая может состоять из разбавителей, таких как, например, лактоза, маннит, микрокристаллическая целлюлоза, крахмал или гидрофосфат кальция, связывающих веществ, таких как, например, поливинилпирролидон или гидроксипропилметилцеллюлоза, разрыхлителей, таких как поперечно-сшитый поливинилпирролидон, поперечно-сшитая карбоксиметилцеллюлоза или натриевая кросскармеллоза, или агентов, придающих текучесть, таких как диоксид кремния или тальк, или смазывающих веществ, таких как стеарат магния, стеариновая кислота, глицерилтрибегенат или стеарилфумарат натрия. В препарат могут быть добавлены увлажняющие агенты или поверхностно-активные агенты, такие как лаурилсульфат натрия, полисорбат 80 или полоксамер 188. Таблетки могут быть приготовлены различными способами: прямое таблетирование, сухое гранулирование, влажное гранулирование или горячая плавка. Таблетки могут быть обыкновенными, или с покрытием из сахара (например, из сахарозы), или с покрытием из различных полимеров или других подходящих веществ. Таблетки могут быть изготовлены в форме, обеспечивающей немедленное, замедленное или длительное высвобождение активного начала, путем приготовления полимерных матриц или путем использования специфических полимеров в пленочном покрытии. Желатиновые капсулы могут быть мягкими или твердыми и могут иметь или не иметь пленочное покрытие, чтобы обладать немедленным, длительным или замедленным действием (например, посредством формы с кишечно-растворимым покрытием). Они могут содержать не только твердый препарат, приготовленный, как указано выше для таблеток, но и жидкости и полутвердые вещества. Препарат в форме сиропа или эликсира может содержать активное начало в сочетании с подсластителем, предпочтительно бескалорийным подсластителем, метилпарабеном и пропилпарабеном в качестве антисептического агента, усилителем вкуса и аромата и подходящим красителем.-8 005854 Диспергируемые в воде порошки или гранулы могут содержать активное начало в виде смеси с диспергирующими агентами, увлажняющими агентами или суспендирующими ангентами, такими как поливинилпирролидон, и с подсластителями или усилителями вкуса и аромата. Для ректального введения используют суппозитории, которые изготавливают с использованием связывающих веществ, которые плавятся при ректальной температуре, например с использованием масла какао или полиэтиленгликолей. Для парентерального, интраназального или внутриглазного введения используют водные суспензии, изотонические физиологические растворы или стерильные инъекционные растворы, которые содержат фармакологически совместимые диспергирующие агенты и/или солюбилизирующие агенты, например пропиленгликоль. Так, для приготовления водного раствора для внутривенной инъекции можно использовать сорастворитель, например спирт, такой как этанол, или гликоль, такой как полиэтиленгликоль или полипропиленгликоль, гидрофильное поверхностно-активное вещество, такое как полисорбат 80 или полоксамер 188. Для приготовления масляного раствора для внутримышечной инъекции активное начало можно растворять триглицеридом или глицериновым эфиром. Для местного введения могут быть использованы кремы, мази, гели, глазные примочки или спреи. Для черескожного введения могут быть использованы пластыри в многослойной форме или в форме резервуара, в котором активное начало может находиться в спиртовом растворе, или спреи. Для введения путем ингаляции используют аэрозоль, содержащий, например, сорбита триолеат или олеиновую кислоту, и трихлорфторметан, дихлорфторметан, дихлортетрафторэтан, заменители фреона или любой другой биологически совместимый газ-пропеллент; можно также использовать систему, содержащую активное начало одно или в комбинации с эксципиентом, в форме порошка. Активное начало может быть представлено также в форме комплекса с циклодекстрином, например-, - или -циклодекстрином или 2-гидроксипропилциклодекстрином. Можно также приготовить препарат активного начала в форме микрокапсул или микросфер, возможно с одним или более чем одним носителем или добавкой. В числе форм с длительным высвобождением активного начала в случае лечения хронических заболеваний можно использовать имплантаты. Они могут быть приготовлены в форме масляных суспензий или в форме суспензии микросфер в изотонической среде. В каждой дозировочной единице активное начало формулы (I) присутствует в количествах, подходящих для намеченных суточных доз. Как правило, каждая дозировочная единица подбирается в соответствии с дозировкой и предполагаемым типом введения, например таблетки, желатиновые капсулы и т.п., саше, виалы, сиропы и т.п., или капли, так чтобы дозировочная единица содержала от 0,1 до 1000 мг активного начала, предпочтительно от 0,5 до 250 мг, которые следует вводить от 1 до 4 раз в сутки. Хотя эти дозы являются примерами средних ситуаций, могут иметь место конкретные случаи, когда целесообразны более высокие или более низкие дозы; такие дозы также входят в объем данного изобретения. Согласно обычной практике дозу, подходящую для каждого пациента, определяет врач в соответствии со способом введения и возрастом, массой и ответной реакцией указанного пациента. Композиции по настоящему изобретению могут содержать, в дополнение к соединению формулы(I) или его фармацевтически приемлемой соли, сольвату и/или гидрату, другие активные начала, которые можно использовать при лечении расстройств или заболеваний, указанных выше. Таким образом, еще одним объектом настоящего изобретения являются фармацевтические композиции, содержащие несколько активных начал в комбинации, одно из которых представляет собой соединение по данному изобретению. Соединения по данному изобретению могут быть использованы также в приготовлении композиций для использования в ветеринарии. Кроме того, соединения по данному изобретению, сами по себе или в меченой форме, могут быть использованы в качестве фармакологических средств для человека или для животных или для обнаружения и мечения каннабиноидных рецепторов CB2. Следующие получения и примеры иллюстрируют данное изобретение, не ограничивая его объем. В получениях и примерах использованы следующие сокращения: эфир: диэтиловый эфир изоэфир: диизопропиловый эфир ДМФ: N,N-диметилформамид ТГФ: тетрагидрофуран ДХМ: дихлорметанTDA-1: трис[2-(2-метоксиэтокси)этил]амин хлороводородный эфир: насыщенный раствор соляной кислоты в диэтиловом эфире Тритон В: гидроксид N-бензилтриметиламмония т.пл.: температура плавления т.о.с.: температура окружающей среды т.кип.: температура кипения-9 005854 Спектры протонного магнитного резонанса (1 Н ЯМР) регистрировали при 200 МГц в d6-ДМСО(диметилсульфоксид), используя пик d6-ДМСО в качестве эталона. Химические сдвигивыражены в миллионных долях (млн-1). Наблюдаемые сигналы выражены следующим образом: s: синглет; bs: широкий синглет; d: дуплет; d.d: двойной дуплет; t: триплет; dt: двойной триплет; q: квартет; qt: квинтет; m: неразрешенный пик; mt: мультиплет; sp.: септет. Получение индолов формулы (II) Получение 1.1. 2-Метил-7-хлор-1 Н-индол. 42,1 г 2-хлорнитробензола помещают в 850 мл ТГФ в атмосфере азота. Смесь охлаждают до -40 С,а затем по каплям добавляют 1,6 л 0,5 М изопропенилмагнийбромида в ТГФ. После перемешивания при-40 С в течение 1 ч смесь гидролизуют 400 мл насыщенного раствора NH4Cl. Водную фазу дважды экстрагируют эфиром. Органическую фазу сушат, а затем выпаривают. Остаток подвергают хроматографии на диоксиде кремния, элюируя толуолом. Получают 20,3 г ожидаемого соединения. ЯМР:(млн-1): 2,4 : s : 3 Н; 6,2 : s : 1 Н; 6,9 : t : 1 Н; 7,1 : d : 1H; 7,4 : d : 1 Н; 11,2 :bs: 1H. Получение 1.2. 2-Метил-7-изопропил-1 Н-индол. Готовят 1570 мл 0,5 М раствора изопропенилмагнийбромида в ТГФ и охлаждают его до -45 С. Этот охлажденный раствор медленно вливают в раствор 43,3 г 2-изопропилнитробензола в 400 мл ТГФ, помещенного в атмосферу азота. Реакционную среду охлаждают до -40 С, затем перемешивают при этой температуре в течение 1,5 ч. Реакционную среду вливают в 1 л насыщенного раствора NН 4 Сl. Водную фазу дважды экстрагируют эфиром, а затем ДХМ. Проводят промывку насыщенным раствором NaCl. Органическую фазу сушат, а затем выпаривают. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (2/8, об./об.). Получают 23,7 г ожидаемого соединения. ЯМР:(млн-1): 1,1 : d : 6 Н; 2,4 : s : 3 Н; 3,3 : mt: 1H; 6 : s : 1H; 6,7 и 7,2 : 2 mt : 3H; 10,8 :bs: 1H. Получение 1.3. 7-Бром-2-этил-1 Н-индол. 2,4 г магния помещают в круглодонную колбу, и магний покрывают 10 мл ТГФ. Добавляют 1 г 2 бром-1-бутена, затем 10 мл ТГФ и затем снова 12,5 2-бром-1-бутена в 30 мл ТГФ. Наблюдается нагрев реакционной среды. После окончания реакции присоединения среду нагревают при 60 С в течение 30 мин. Смесь затем охлаждают до -20 С, добавляют 20 мл ТГФ, а затем добавляют при -20 С 6,7 г 2-бромнитробензола. Смеси дают возможность вернуться к т.о.с. Реакционную смесь вливают в 200 мл насыщенного раствора NaCl. Осуществляют экстрагирование эфиром, экстракты затем выпаривают и остаток переносят в ДХМ. Органическую фазу промывают водой, а затем насыщенным раствором NaCl. Ее сушат и выпаривают, а затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью циклогексан/AcOEt (9,5/0,5 об./об.). Получают 3,45 г ожидаемого соединения. ЯМР:(млн-1): 1,3 : t : 3 Н; 2,8 : q : 2 Н; 6,2 : s : 1H; 6,8 : t : 1 Н; 7,2 : d : 1H; 7,4 :d : 1H; 11 : bs : 1H. Получение 1.4. 2-Метил-7-этил-1 Н-индол. Раствор 36,5 г 2-этилнитробензола в 250 мл ТГФ по каплям добавляют при -20 С к 1,6 л изопропенилмагнийбромида в ТГФ. Реакционную среду поддерживают при -20 С при перемешивании в течение 2 ч,а затем вливают в 800 мл насыщенного раствора NaCl. Смеси дают возможность разделиться путем отстаивания, а затем осуществляют экстракцию эфиром. Эфирный экстракт сушат и выпаривают, после чего остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (1/9,об./об.). Получают 23,75 г ожидаемого соединения. ЯМР:(млн-1): 1,3 : t : 3 Н; 2,4 : s : 3 Н; 2,8 : q : 2 Н; 6,2 : s : 1H; 6,8 : m : 2 Н; 7,2 : d : 1H; 10,8 : bs : 1H. Получение 1.5. 7-Бром-2-метил-1 Н-индол. 27,0 г 2-бромнитробензола помещают в 400 мл ТГФ. Среду помещают в атмосферу азота и охлаждают до -55 С, а затем по каплям добавляют 800 мл 0,5 М изопропенилмагнийбромида в ТГФ. Среду перемешивают в течение 1 ч, а затем вливают в насыщенный раствор NH4Cl. Осуществляют экстракцию эфиром, экстракт выпаривают, а остаток переносят в ДХМ. Проводят промывку насыщенным растворомNaCl. Органический слой сушат и выпаривают, после чего остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (1/9, об./об.). Получают 10,7 г ожидаемого соединения. ЯМР:(млн-1): 2,4 : s : 3 Н; 6,2 : s : 1H; 6,9 : t : 1H; 7,2 : d : 1H; 7,4 : d : 1H; 11,2 :bs : 1H. Получение 1.6. 6,7-Дихлор-2-метил-1 Н-индол. 1600 мл 0,5 М изопропенилмагнийбромида в ТГФ помещают в атмосферу азота и охлаждают до-20 С, добавляют 51,2 г 2,3-дихлорнитробензола в 250 мл безводного ТГФ и эту смесь оставляют перемешиваться в течение 1 ч при -20 С. Реакционную среду вливают при -20 С в 1 л насыщенного раствораNH4Cl, смесь разбавляют Et2O, а затем водную фазу дважды промывают Et2O. Органические фазы объединяют и концентрируют досуха. Остаток экстрагируют ДХМ и органическую фазу дважды промывают водой, а затем насыщенным раствором NaCl. Ее сушат, а затем выпаривают, и остаток подвергают хроматографии на диоксиде кремния, элюируя смесью гексан/AcOEt (95/5, об./об.). Получают 24,27 г ожидаемого соединения, т.пл.=70-71 С. Были также получены производные индола, описанные в табл. 1 ниже.A) 1-Бром-3-метилсульфанилпропан. 24 г РВr3 смешивают при 0 С при перемешивании с 20 г 3-(метилсульфанил)-1-пропанола. Среде дают возможность вернуться к т.о.с., а затем ее нагревают при 100 С в течение 1 ч. Ей дают возможность охладиться до т.о.с., а затем ее охлаждают в ледяной бане. Среду переносят в бензол, а затем экстрагируют толуолом. Экстракт промывают 1% раствором Na2CO3, водой, а затем насыщенным раствором NaCl. Ее сушат над МgSO4 и концентрируют, а затем проводят перегонку с получением 3,6 г ожидаемого соединения.B) 7-Хлор-2-метил-1-(3-(метилсульфанил)пропил)-1H-индол. 1,5 г 7-хлор-2-метил-1H-индола смешивают при перемешивании с 1,1 г измельченного гидроксида калия и 0,2 г TDA-1. Смесь оставляют перемешиваться в течение 2 ч при т.о.с., затем по каплям добавляют 3,1 г 1-бром-3-метилсульфанилпропана и эту смесь нагревают с обратным холодильником в течение 24 ч. Снова добавляют измельченный гидроксид калия (0,5 г), TDA-1 (0,1 г) и 1,6 г 1-бром-3-метилсульфанилпропана. После нагревания с обратным холодильником в течение 9 ч снова добавляют 1-бром 3-метилсульфанилпропан и смесь нагревают с обратным холодильником в течение 24 ч. Смеси дают возможность вернуться к т.о.с., а затем экстрагируют толуолом. Органическую фазу промывают 10% раствором HCl, водой, а затем насыщенным раствором NaCl. Ее сушат и выпаривают, а затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью циклогексан/толуол (50/50, об./об.). Получают 1,87 г ожидаемого соединения. ЯМР:(млн-1): 1,9 : mt : 2 Н; 2,1 : s : 3 Н; 2,4 : s : 3 Н; 2,5 : mt : 2 Н; 4,5 : t : 2H; 6,3 : s : 1H; 6,9 : t: 1H; 7,1 : d : 1H; 7,4 : d : 1H.- 11005854 С) (7-Хлор-2-метил-1-(3-(метилсульфанил)пропил)-1H-индол-3-ил)-(2,3-дихлорфенил)метанон. При перемешивании в атмосфере азота смешивают 1,87 г соединения, полученного на предыдущей стадии, в 50 мл ДХМ и 2,06 г 2,3-дихлорбензоилхлорида. Температуру понижают до -5 С, а затем по каплям добавляют 9 мл 1,8 М дихлорэтилалюминия в толуоле. Смеси дают возможность вернуться к т.о.с. и поддерживают перемешивание в течение 24 ч. Среду экстрагируют ДХМ и органическую фазу промывают насыщенным раствором NH4Cl, водой, а затем насыщенным раствором NaCl. Ее сушат и выпаривают, а затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью циклогексан/толуол (50/50, об./об.). Полученный продукт кристаллизуется из смеси этанол/гептан. Получают 900 мг ожидаемого соединения, т.пл.=87 С. ЯМР:(млн-1): 2 : qt: 2H; 2,1 : s : 3 Н; 2,4 : s : 3 Н; 2,6 : t: 2H; 4,6 : mt : 2H; 7-7,9 : m : 6H. Пример 2 (Способ А 2). (7-Хлор-2-метил-1-(3-(метилсульфонил)пропил)-1 Н-индол-3-ил)-2,3-дихлорфенилметанон.I: R1=Cl, R2=Me, R3=R'3=Н, Ar=2,3-дихлорфенил, Y=SO2Me, А=(СН 2)n, n=3. 0,73 г соединения примера 1 помещают в 5 мл ДХМ. Температуру понижают до 0 С, затем по каплям добавляют 1,03 г 3-хлорпербензойной кислоты, разбавленной 10 мл ДХМ, и эту смесь оставляют перемешиваться в течение 24 ч при т.о.с. Среду экстрагируют ДХМ, затем экстракт промывают 5% раствором Nа 2 СО 3, водой, а затем насыщенным раствором NaCl. Ее сушат и выпаривают; полученный продукт кристаллизуется из смеси эфир/гексан. Получают 530 мг ожидаемого соединения, т.пл.=127 С. ЯМР:(млн-1): 2,2 : mt : 2H; 2,4 : s : 3 Н; 3,0 : s : 3 Н; 3,3 : mt : 3 Н; 4,7 : t : 2H; 7,1 : t: 1 Н; 7,2-7,6 : m : 4H; 7,8 : dd : 1 Н. Пример 3 (Способ B1). N-(3-(7-Хлор-3-(2-фтор-3-трифторметилфенил)-2-метил-1H-индол-1-ил)пропил)метансульфонамид.A) 7-Хлор-1-хлорпропил-2-метил-1 Н-индол. 40 г 7-хлор-2-метил-1H-индола помещают в 60 мл толуола с 2,8 г КОН в атмосфере азота. После перемешивания в течение 30 мин при т.о.с. добавляют 7,7 г 3-хлор-1-бромпропана, а затем смесь нагревают с обратным холодильником в течение 3 ч. Среду экстрагируют эфиром. Органическую фазу промывают водой, 10% раствором HCl, водой и насыщенным раствором NaCl. Ее сушат и выпаривают и получают 6,19 г ожидаемого соединения.B) N-(3-(7-Хлор-2-метил-1 Н-индол-1-ил)пропил)метансульфонамид. В атмосфере азота получают смесь, содержащую 2,2 г 60% NaH в масле и 170 мл ДМФ, и охлаждают ее до 0 С. Добавляют 4,0 г NН 2SО 2 СН 3, затем смеси дают возможность вернуться к т.о.с. и добавляют 5,0 г соединения, полученного на предыдущей стадии. Смесь нагревают при 130 С в течение 6 ч. Среду экстрагируют ДХМ и органическую фазу промывают водой, а затем насыщенным раствором NaCl. Ее сушат и выпаривают, а затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью циклогексан/AcOEt (30/70, об./об.). Получают 1,92 г ожидаемого соединения.C) N-(3-(7-Хлор-3-(2-фтор-3-трифторметилфенил)-2-метил-1 Н-индол-1-ил)пропил)метансульфонамид. Осуществляют смешивание в атмосфере азота 0,80 г соединения, полученного на предыдущей стадии, и 0,90 г 2-фтор-3-трифторметилбензоилхлорида в 60 мл ДХМ. Температуру понижают до 0 С, а затем добавляют 34 мл 1,8 М дихлорэтилалюминия в толуоле. Среде дают возможность вернуться к т.о.с., а затем перемешивают в течение 15 ч. Ее экстрагируют ДХМ. Органическую фазу промывают водой и насыщенным раствором NaCl, сушат и выпаривают. Продукт кристаллизуется из смеси ДХМ/эфир. Получают 550 мг ожидаемого соединения, т.пл.=168 С. ЯМР:(млн-1): 2 : mt : 2H; 2,4 : s : 3 Н; 3,0 : s : 3 Н; 3,2 : mt : 2 Н; 4,7 : mt : 2H; 7-7,5 : m : 3 Н; 7,7 : t: 1H; 8 : t : 1H ; 8,2 : t : 1H. Пример 4 (Способ А). (7-Изопропил-2-метил-1-2-этилсульфанил)этил)-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон.A) (7-Изопропил-2-метил-1 Н-индол-3-ил)-(2,3-дихлорфенил)метанон. 120 мл безводного ТГФ охлаждают до -5 С и добавляют 36 мл 3 М метилмагнийбромида в эфире. Смесь охлаждают до -30 С, а затем по каплям добавляют 15 г 7-изопропил-2-метил-1 Н-индола. Смесь оставляют перемешиваться в течение 1 ч при температуре между -20 и -30 С, а затем по каплям добавляют 30,9 г 2,3-дихлорбензоилхлорида, растворенного в 120 мл ТГФ. Среду оставляют стоять до достижения т.о.с., а затем вливают в 300 мл насыщенного раствора NH4Cl. Разделение осуществляют путем отстаивания, органический слой выпаривают, а остаток переносят в ДХМ. Органическую фазу промывают насыщенным раствором NaCl, а затем сушат и выпаривают. Остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (3/7, об./об.).B) (7-Изопропил-2-метил-1-2-этилсульфанил)этил)-1H-индол-3-ил)(2,3-дихлорфенил)метанон. Смешивают 0,7 г раздробленного гидроксида натрия, 1,5 г соединения, полученного на предыдущей стадии, 0,15 г гидросульфата тетрабутиламмония и 2,2 г 1-хлор-1-этилсульфанилэтана. Добавляют 60 мл толуола и 0,2 г воды и эту смесь нагревают с обратным холодильником в течение 3 дней. Среду охлаждают, а затем вливают в воду (200 мл). Осуществляют экстракцию 100 мл эфира, органическую- 12005854 фазу промывают водой, а затем насыщенным раствором NaCl. Органическую фазу сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексанA) (7-Бром-2-метил-1 Н-индол-3-ил)(2,3-дихлорфенилметанон). 10,7 г 7-бром-2-метил-1 Н-индола помещают в 100 мл ТГФ и эту смесь охлаждают до -10 С. При этой температуре добавляют 22 мл 3 М метилмагнийбромида в эфире. Смеси дают возможность вернуться к т.о.с., затем охлаждают до -5 С и по каплям добавляют 13,5 г 2,3-дихлорбензоилхлорида, растворенного в 80 мл ТГФ. Среде дают возможность вернуться к т.о.с., а затем ее вливают в насыщенный растворNH4 Сl. Осуществляют экстракцию эфиром и органическую фазу затем промывают 10% растворомNaOH, водой и насыщенным раствором NaCl. Ее сушат и выпаривают и остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (10/90, об./об.). Полученный продукт кристаллизуется из эфира, и получают 5 г ожидаемого соединения.B) (7-Бром-2-метил-1-(3-хлорпропил)-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон. 3 г соединения, полученного на предыдущей стадии, 0,3 г TDA-1 и 100 мл толуола добавляют к 1 г раздробленного гидроксида калия. Эту смесь затем нагревают с обратным холодильником в течение 30 мин и добавляют 5 г 1-бром-3-хлорпропана. Среде дают возможность охладиться до т.о.с., а затем ее вливают в 100 мл 10% раствора HCl. Среду экстрагируют толуолом, затем органическую фазу промывают водой,а затем насыщенным раствором NaCl. Ее сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя ДХМ. Получают 3,25 г ожидаемого соединения, т.пл.=139 С.C) (7-Бром-2-метил-1-(3-(метилсульфанил)пропил)-1 Н-индол-3-ил)(2,3-дихлорфенилметанон). 3 г соединения, полученного на предыдущей стадии, и 0,62 г MeSNa смешивают при т.о.с. в 40 мл этанола. Смесь нагревают с обратным холодильником в течение 2,5 ч, затем ей дают возможность остыть. Среду вливают в 10% раствор гидроксида натрия, экстрагируют эфиром, затем органическую фазу промывают насыщенным раствором NaCl. Получают 2 г ожидаемого соединения, т.пл.=119 С. ЯМР:(млн-1): 2 : mt : 2 Н; 2,1 : s : 3 Н; 2,4 : s : 3 Н; 2,6 : t : 2 Н; 4,6 : t : 2H; 7 : t : 1 Н; 7,4-7,6 : m : 4H; 7,8 : dd : 1 Н. Пример 6 (Способ А 2). (7-Бром-2-метил-1-(3-(метилсульфинил)пропил)-1H-индол-3-ил)(2,3-дихлорфенил)метанон.I: R1=Br, R2=Me, R3=R'3=Н, Ar=2,3-дихлорфенил, Y=-SOMe, A=(CH2)n, n=3. 2,5 г соединения предыдущего примера помещают в 50 мл уксусной кислоты и эту смесь охлаждают до 10 С. Добавляют 0,8 мл Н 2 О 2 при перемешивании, затем смеси дают возможность вернуться к т.о.с. и перемешивание продолжают в течение 1,5 ч. Среду выпаривают, а затем экстрагируют AcOEt. Органическую фазу промывают 10% раствором NaOH, водой и насыщенным раствором NaCl, выпаривают и полученный продукт перекристаллизовывают из смеси AcOEt/MeOH (9/1, об./об.). Получают 1,1 г ожидаемого соединения, т.пл.=137 С. ЯМР:(млн-1): 2,1 : qt : 2H; 2,4 и 2,6 : 2s : 6H; 2,8-3,2 : mt : 2H; 4,8 : t : 2H; 7,1 : t : 1H; 7,5 : m : 4H; 7,9 : d : 1H. Пример 7 (Способ А 2). (7-Бром-2-метил-1-(3-(метилсульфонил)пропил)-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон.I: R1=Cl, R2=Me, R3=R'3=Н, Ar=2,3-дихлорфенил, Y=SO2Me, A=(СН 2)n, n=3. 1,82 г 3-хлорпербензойной кислоты помещают в 40 мл ДХМ. Смесь охлаждают до 0 С, а затем по каплям при 0 С добавляют 1,5 г соединения примера 5, растворенного в 30 мл ДХМ. Смеси дают возможность вернуться к т.о.с., а затем перемешивание поддерживают в течение 2 ч. После стояния в течение 48 ч образовавшийся осадок (избыток кислоты) отфильтровывают, после чего фильтрат вливают в 30% раствор NaOH. Среду дважды экстрагируют Et2O. Органическую фазу промывают водой, а затем насыщенным раствором NaCl, сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя AcOEt. Получают 0,92 г ожидаемого соединения, т.пл.=90 С. ЯМР:(млн-1): 2,2 : mt : 2 Н; 2,4 : s : 3 Н; 3 : s : 3 Н; 3,3 : t: 2 Н; 4,7 : t : 2H; 6,9-8 : m : 6 Н. Пример 8 (Способ A1). N-(3-(7-Бром-3-(2,3-дихлорбензоил)-2-этил-1H-индол-1-ил)пропил)метансульфонамид.A) (7-Бром-2-этил-1H-индол-3-ил)-(2,3-дихлорфенил)метанон. 3,45 г 7-бром-2-этил-1H-индола помещают в атмосфере азота в 30 мл эфира и эту смесь охлаждают до +3 С. Добавляют 5,1 мл метилмагниййодида в 20 мл эфира, а затем 5,9 г дихлорбензоилхлорида в 30 мл эфира. Добавляют 10 мл ТГФ, смеси дают возможность вернуться к т.о.с. и ее перемешивают в течение 3 ч. Среду вливают в насыщенный раствор NH4Cl, а затем экстрагируют эфиром. Органическую фазу промывают 10% раствором HCl, 10% раствором NaOH, водой и раствором NaCl. Ее сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (3/7,об./об.). Получают 2,18 г ожидаемого соединения.B) (7-Бром-1-(3-хлорпропил)-2-этил-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон. 1,85 г соединения, полученного на предыдущей стадии, помещают в 100 мл толуола с 0,3 г TDA-1. Вводят 1 г раздробленного гидроксида калия, после чего смесь нагревают до температуры дефлегмации в атмосфере азота и добавляют 3,2 г 3-бром-1-хлорпропана, разбавленного 15 мл толуола. Смесь нагревают в течение ночи с обратным холодильником, а затем реакционную смесь быстро вливают в воду. Осуществляют экстракцию толуолом и экстракт промывают водой, а затем насыщенным раствором NaCl. Экстракт сушат и выпаривают, затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (3/7, об./об.). Получают 2 г ожидаемого соединения.C) (7-Бром-1-(3-йодпропил)-2-этил-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон. 2,0 г соединения, полученного на предыдущей стадии, и 4,4 г NaI смешивают в 120 мл СН 3 СN и эту реакционную смесь нагревают при 80 С в течение 5 дней. Образуется осадок NaCl. Реакционную среду вливают в воду, затем осуществляют экстракцию толуолом и экстракт промывают насыщенным раствором NaCl. Получают 2,4 г ожидаемого соединения.D) N-(3-(7-Бром-3-(2,3-дихлорбензоил)-2-этил-1H-индол-1-ил)пропил)метансульфонамид. 0,74 г 60% NaH в масле добавляют к 80 мл ДМФ и эту смесь охлаждают до +5 С. Добавляют 2 гMeSO2NH2 в 50 мл ДМФ и эту смесь перемешивают в течение 10 мин. Затем добавляют 2,4 г соединения, полученного на предыдущей стадии, в 40 мл ДМФ и смесь оставляют перемешиваться в течение 3 ч при +5 С. Реакционную среду быстро вливают в воду, а затем экстрагируют ДХМ. Экстракт промывают водой, затем концентрированным раствором NaCl. Его сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (1/1). Получают 1,1 г ожидаемого соединения. ЯМР:(млн-1): 1,05 : t : 3 Н; 1,9 : mt : 2 Н; 2,65-3,2 : m : 7H; 4,5 : mt : 2 Н; 6,7-7,8 : m : 6H. Пример 9 (Способ А 3). N-(3-(7-Бром-3-(2,3-дихлорбензоил)-2-этил-1H-индол-1-ил)пропил)-N-метилметансульфонамид.I: R1=Вr, R2=Et, R3=R'3=Н, Аr=2,3-дихлорфенил, Y=NMeSO2Me, А=(СН 2)n, n=3. 0,32 г NaH помещают в 20 мл безводного ДМФ и по каплям добавляют 0,86 г соединения предыдущего примера, растворенного в 20 мл ДМФ. Наблюдается выделение газа. По каплям добавляют 1,15 гMeI в 20 мл ДМФ и эту реакционную среду оставляют перемешиваться в течение 2 ч. Реакционную среду вливают в воду, затем осуществляют разделение путем отстаивания. Проводят экстракцию ДХМ, затем органическую фазу промывают насыщенным раствором NaCl. Ее сушат и выпаривают и остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (2/1, об./об.). Получают 0,5 г ожидаемого соединения, т.пл.=111 С. ЯМР:(млн-1): 1,1 : t : 3 Н; 1,95 : mt : 2 Н; 2,6-3 : m : 8 Н; 3,2 : t: 2 Н; 4,5 : mt : 2H; 6,8-7,9 : m : 6 Н. Пример 10 (Способ А). 3-(3-(2,3-Дихлорбензоил)-7-этил-2-метил-1H-индол-1-ил)-N,N-диметил-1 пропансульфонамид.A) 3-Хлор-N,N-диметил-1-пропансульфонамид. Продукт получают в соответствии с J. Am. Chem. Soc., 1951, 73, 3100. 10 г гидрохлорида диметиламина помещают в 60 мл воды, создают атмосферу азота и раствор охлаждают до температуры между 0 и -5 С, а затем по каплям добавляют 18 мл 3-хлор-1-пропансульфонилхлорида. Добавляют 10,6 г гидроксида натрия в 40 мл воды, поддерживая температуру -5 С, затем смеси дают возможность вернуться к т.о.с. и перемешивание продолжают в течение 1 ч. Добавляют 1 мл концентрированной HCl, а затем проводят экстракцию ДХМ. Органическую фазу промывают 10% раствором NaOH, а затем раствором NaCl. Получают 15,1 г ожидаемого соединения.B) (7-Этил-2-метил-1 Н-индол-3-ил)(2,3-дихлорфенил)метанон. 14,2 мл 3 М MeMgI в Et2O помещают в атмосферу аргона и по каплям добавляют 6,78 г 7-этил-2-метил 1 Н-индола в 40 мл Et2O. Через 30 мин по каплям добавляют 17,84 г 2,3-дихлорбензоилхлорида в 60 мл Et2O и реакционную среду перемешивают в течение 2 ч. Реакционную среду быстро вливают в насыщенный раствор NН 4 Сl. Осуществляют экстракцию диэтиловым эфиром (дважды), затем органическую фазу промывают 10% раствором NaOH, водой, а затем насыщенным раствором NaCl. Получают 5,5 г ожидаемого соединения.C) 3-(3-(2,3-Дихлорбензоил)-7-этил-2-метил-1 Н-индол-1-ил)-N,N-диметил-1-пропансульфонамид. Готовят смесь, содержащую 1,5 г соединения, полученного на предыдущей стадии, 3,34 г соединения, полученного на стадии А, и 0,15 г TDA-1. Добавляют 1,7 г раздробленного гидроксида натрия и эту смесь нагревают с обратным холодильником в течение 36 ч. Реакционную среду охлаждают, а затем вливают в воду. Осуществляют экстракцию толуолом, затем экстракт промывают водой, а затем насыщенным раствором NaCl. Экстракт сушат и выпаривают, затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (1/1, об./об.). Полученный продукт кристаллизуется из смеси AcOEt/циклогексан (3/7, об./об.). Получают 0,7 г ожидаемого соединения, т.пл.=118 С. ЯМР:(млн-1): 1,1 : t : 3 Н; 2 : mt : 2 Н; 2,4 : s : 3 Н; 2,8 : s : 6 Н; 2,9 : mt : 2H; 3,2 : mt: 2H; 4,4 : t : 2H; 6,8-7,2 : m : 3 Н; 7,3-7,6 : dd+t : 2H; 7,8 : dd : 1 Н. Промежуточные соединения формулы (IV), описанные ниже, получают с использованием способа А. Промежуточные соединения формулы (XII), описанные ниже, получены с использованием способа В или способа B1.- 16005854 Получение 3.17. ЯМР:(млн-1): 1,80 : qt : 2H; 2,40 : s : 3 Н; 2,70 : s : 3 Н; 2,90 : s : 3 Н; 3,00 : q : 2H; 4,30 : t : 2H; 6,20 : s : 1H; 7,00 : d : 1H; 7,10 : t : 1H; 7,25 : d : 1H. Получение 3.18. ЯМР:(млн-1): 1,80 : qt : 2H; 2,30 : s : 3 Н; 3,20 : t : 2H; 4,35 : t : 2H; 6,25 : s : 1H; 7,10 : d : 1H; 7,35 : d : 1H; 9,50 : bs : 1H. Получение 3.19. ЯМР:(млн-1): 1,85 : qt : 2H; 2,35 : s : 3 Н; 3,20 : t : 2H; 4,40 : t: 2H; 6,25 : s : 1H; 6,85 : t: 1H; 7,00 : d : 1H; 7,35 : d : 1H; 9,50 : bs : 1H. Получение 3.20. ЯМР:(млн-1): 1,20 : t : 3 Н; 1,80 : mt : 2 Н; 2,65 : q : 2H; 2,80 : s : 3 Н; 2,95 : mt : 2H; 4,40 : t : 2H; 6,20 : s : 1H; 6,80 : t : 1 Н; 7,00 : s : 1 Н; 7,20 : d : 1H;7,40 : d : 1H. Получение 3.21. ЯМР:(млн-1): 1,30 : t : 3 Н; 2,10 : mt : 2H; 2,60-3,40 : m : 10 Н; 4,50 : t : 2H; 6,30 : s : 1H; 6,90 : t : 1H; 7,20-7,60 : m : 2H. Получение 3.22. ЯМР:(млн-1): 1,85 : qt : 2H; 2,40 : s : 3 Н; 2,90 : s : 3 Н; 3,00 : q : 2H; 4,15 : t : 2H; 6,20 : s : 1H; 6,80-7,60 : m : 5H. Получение 3.23. ЯМР:(млн-1): 1,80 : qt : 2H; 2,35 : s : 3 Н; 2,60 : s : 6 Н; 2,90 : q : 2H; 4,40 : t : 2H; 6,25 : s : 1H; 6,80 : t : 1H; 7-7,50 : m : 4 Н. Соединения по данному изобретению, приведенные в таблице, представленной ниже, получены в соответствии с одним из описанных способов. Таблица 4I: R1=R3=Cl, R2=Me, R'3=Н, Ar=2-F-3-СF3-фенил, Y=-NHSO2Me, А=(CH2)n, n=3. А) 6,7-Дихлор-1-(3-хлорпропил)-2-метил-1H-индол. В атмосфере азота вводят 7,84 г раздробленного гидроксида натрия, 190 мл толуола, 7 г 6,7-дихлор 2-метил-1H-индола, 85 мл толуола и 0,7 г гидросульфата тетрабутиламмония. Смесь нагревают с обратным холодильником в течение 30 мин, затем добавляют 14 мл 1-бром-3-хлорпропана и нагревание с обратным холодильником продолжают в течение 2 ч. Реакционную среду вливают в воду и водную фазу промывают толуолом. Осуществляют экстракцию толуолом, а затем экстракт промывают водой и насыщенным раствором NaCl. Экстракт сушат и выпаривают с получением 11,3 г ожидаемого соединения.B) 6,7-Дихлор-1-(3-йодпропил)-2-метил-1 Н-индол. 11,3 г соединения, полученного на предыдущей стадии, помещают в 520 мл ацетонитрила и 43 гNaI, а затем смесь нагревают с обратным холодильником в течение 3 дней. Реакционную среду вливают в воду и разбавляют толуолом, а затем водную фазу дважды промывают толуолом. Органические фазы объединяют, промывают водой, а затем насыщенным раствором NaCl. Их сушат и концентрируют с получением 13,93 г ожидаемого соединения.C) N-[3-(6,7-Дихлор-2-метил-1 Н-индол-1-ил)пропил]метансульфонамид. 6,04 г 60% NaH вводят в атмосфере азота в 400 мл безводного ДМФ. Смесь охлаждают до 5 С, а затем добавляют 14,35 г метансульфонамида в 200 мл безводного ДМФ. После перемешивания в течение 10 мин при 5 С добавляют 13,9 г соединения, полученного на предыдущей стадии, в 200 мл безводного ДМФ, и смеси дают возможность вернуться к т.о.с. После перемешивания в течение 3 ч реакционную среду вливают в воду, а затем разбавляют ДХМ. Водную фазу 3 раза промывают ДХМ, а затем органические фазы объединяют. Их промывают водой и насыщенным раствором NaCl, сушат и концентрируют, а затем остаток подвергают хроматографии на диоксиде кремния, элюируя смесью циклогексан/AcOEtD) N-(3-(6,7-Дихлор-3-[2-фтор-3-(трифторметил)бензоил]-2-метил-1H-индол-1-ил)пропил)метансульфонамид. 1 г соединения, полученного на предыдущей стадии, и 1,35 г 2-фтор-3-(трифторметил)бензоилхлорида вводят в 120 мл ДХМ. Смесь охлаждают до температуры между -20 и -25 С и, используя шприц,добавляют дихлорэтилалюминий. Смеси дают возможность вернуться к температуре окружающей среды и перемешивание поддерживают в течение 3 ч. Реакционную среду вливают в воду, водную фазу 3 раза промывают ДХМ, а затем органические фазы объединяют и фильтруют через Celite. Объединенные органические фазы промывают 10% раствором NaOH, водой, 10% раствором HCl, а затем насыщенным раствором NaCl. Получают 0,94 г ожидаемого соединения, которое кристаллизуется из эфира, т.пл.=181 С. Пример 73 (Способ Б). N-(2-(7-Хлор-3-(2,3-дихлорбензоил)-2-метил-1 Н-индол-1-ил)этил)-N,Nдиметилсульфамид.A) 3-(7-Хлор-2-метил-1 Н-индол-1-ил)пропаннитрил. 20 г 7-хлор-2-метил-1 Н-индола смешивают в 100 мл диоксана с 3 г Тритона В (N-бензилтриметиламмония гидроксид), медленно добавляют 3 г акрилонитрила, снова добавляют 250 мл диоксана и после этого смесь нагревают при 60 С в течение 2 ч. Среду выпаривают; а остаток переносят в AcOEt. Образовавшийся осадок удаляют, полученный продукт как есть используют на следующей стадии.B) 3-(7-Хлор-2-метил-1H-индол-1-ил)пропановая кислота. Готовят раствор 35 г КОН в 350 мл воды и этот раствор добавляют к смеси, содержащей продукт,полученный на предыдущей стадии, в 175 мл этанола. Среду нагревают до 80 С, а затем вливают в 500 мл 10% водного раствора HCl. Осуществляют экстракцию ДХМ, а затем экстракт промывают насыщенным раствором NaCl. Получают 22,5 г ожидаемого соединения.C) 2-(7-Хлор-2-метил-1 Н-индол-1-ил)-1-этанамин. 22,5 г соединения, полученного на предыдущей стадии, 27,2 г дифенилфосфорилазида и 10 г триэтиламина смешивают в 400 мл трет-бутанола и эту смесь нагревают при 80 С в течение 3 ч. Реакционную среду вливают в 500 мл насыщенного раствора NаНСО 3, добавляют 500 мл AcOEt, а затем осуществляют разделение путем отстаивания. Органическую фазу выпаривают, остаток переносят в смесь 10 мл концентрированного HCl в 500 мл этанола и эту смесь нагревают до температуры дефлегмации в течение 6 ч. Смесь подщелачивают до рН 14 путем добавления 30% гидроксида натрия, а затем экстрагируютAcOEt и экстракт промывают насыщенным раствором NaCl. Получают 2,61 г ожидаемого соединения.D) N'-(2-(7-Хлор-2-метил-1 Н-индол-1-ил)этил)-N,N-диметилсульфамид. 2,63 г соединения, полученного на предыдущей стадии, суспендируют в 20 мл СН 3 СN и 2 мл триэтиламина в атмосфере азота. Готовят раствор 2 г диметилсульфамоилхлорида в 20 мл воды и этот раствор вливают в реакционную среду, охлажденную до -50 С. Реакционной среде дают возможность вернуться к т.о.с., а затем нагревают при 50 С в течение 3 ч. Реакционную среду быстро вливают в насы- 21005854 щенный раствор NH4Cl, а затем экстрагируют ацетонитрилом. Экстракт сушат и выпаривают и остаток затем подвергают хроматографии на диоксиде кремния, элюируя смесью AcOEt/циклогексан (1/1,об./об.). Получают 0,86 г ожидаемого соединения. ЯМР:(млн-1): 2,40 : s : 3 Н; 2,55 : s : 6 Н; 3,2 : q : 2 Н; 4,5 : t : 2H; 6,3 : s : 1H; 6,8-7,6 : m : 4H.E) N-(2-(7-Хлор-3-(2,3-дихлорбензоил)-2-метил-1H-индол-1-ил)этил)-N,N-диметилсульфамид. 0,86 г соединения, полученного на предыдущей стадии, и 0,75 г 2,3-дихлорбензоилхлорида вводят в атмосфере азота в 50 мл ДХМ. Смесь охлаждают до -50 С и при этой температуре добавляют 4,8 мл дихлорэтилалюминия в толуоле. Смеси дают возможность вернуться к т.о.с. и поддерживают перемешивание в течение 3 ч. Реакционную среду быстро вливают в NH4Cl, а затем экстрагируют ДХМ. Экстракт промывают 10% раствором HCl, 10% раствором NaOH, а затем насыщенным раствором NaCl. Экстракт сушат и выпаривают и остаток подвергают хроматографии на диоксиде кремния, элюируя смесьюa) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена, (С 1-С 4)алкила, трифторметила, амино, нитро, гидроксила, (С 1-С 4)алкокси, (С 1-С 4)алкилсульфанила или (С 1-С 4)алкилсульфонила;b) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (С 1-С 4)алкилом или трифторметилом; А представляет собой С 2-С 6 алкиленовый радикал;R1, R3 и R'3, каждый независимо друг от друга, представляют собой водород, гидроксил, атом галогена, (С 1-С 4)алкил, трифторметил или (С 1-С 4)алкокси;R2 представляет собой водород или (С 1-С 4)алкил;R5 и R6, каждый независимо, представляют собой водород или (С 1-С 4)алкил;R7 представляет собой водород или (С 1-С 4)алкил; и его возможные соли и/или его сольваты. 2. Соединение по п.1 формулыa) фенил, моно-, ди- или тризамещенный одной или более чем одной группой, выбранной из атома галогена, (С 1-С 4)алкила, трифторметила, амино, нитро, (С 1-С 4)алкокси, (С 1-С 4)алкилсульфанила или (С 1 С 4)алкилсульфонила;b) нафтил, который не замещен или замещен единожды или дважды атомом галогена, (С 1-С 4)алкилом или трифторметилом;R1 представляет собой атом галогена, (С 1-С 4)алкил, трифторметил или (С 1-С 4)алкокси;R2 представляет собой водород или (С 1-С 4)алкил;R5 и R6, каждый независимо, представляют собой водород или (С 1-С 4)алкил;R7 представляет собой водород или (С 1-С 4)алкил; и его возможные соли и/или его сольваты. 3. Соединение по п.1 формулы (I), где R1 находится в положении 7 индольного ядра и представляет собой метил или атом хлора или брома. 4. Соединение по п.1 формулы (I), где R2 представляет собой (С 1-С 4)алкил. 5. Соединение по п.1 формулы (I), где R3 представляет собой водород или R3 находится в положении 6 индольного ядра и представляет собой либо атом хлора, либо метил. 6. Соединение по п.1 формулы (I), где R'3 представляет собой водород. 7. Соединение по п.1 формулы (I), где Аr представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом.- 27005854 8. Соединение по п.1 формулы (I), где Y представляет собой SO2R4 или NHSO2R4. 9. Соединение по п.1 формулы (I), где Аr представляет собой фенил, моно- или дизамещенный атомом галогена, метилом, трифторметилом, метокси, метилсульфанилом или метилсульфонилом; А представляет собой группу (СН 2)n;R1 представляет собой метил или атом хлора или брома в положении 7 индольного ядра;R3 представляет собой водород или R3 представляет собой либо атом хлора, либо метил в положении 6 индольного ядра;R4 представляет собой метил или этил; и его возможные соли и/или его сольваты. 10. Способ получения соединения формулы (I) по п.1, его возможных солей и/или его сольватов,отличающийся тем, что а) индол формулы где R1, R2, R3 и R'3 являются такими, как определено в п.1 для соединения формулы (I), обрабатывают метилмагнийгалогенидом и галоидангидридом формулы ArCOHal (III), где Аr является таким, как определено для соединения формулы (I), и Hal представляет собой атом галогена;b) полученное таким образом соединение формулы обрабатывают галогенидом формулы Hal-A-Y (V), где -А- и Y являются такими, как определено для соединения формулы (I) в п.1, a Hal представляет собой атом галогена, в присутствии основания. 11. Способ по п.10, отличающийся тем, что стадию (b) модифицируют следующим образом:b1) полученное на стадии (а) соединение формулы обрабатывают соединением формулы Z-A-Cl (VI), где Z представляет собой либо гидроксильную группу,либо атом галогена, а -А- является таким, как определено для (I) в п.1;b2) возможно, полученное таким образом соединение формулыb3) полученное таким образом на стадии (b1) соединение формулы (VII) или на стадии (b2) соединение формулы обрабатывают анионом Y, причем Y является таким, как определено для соединения формулы (I) в п.1.- 28005854 12. Способ по п.10 получения соединения формулы (I), где Y представляет собой группу SOR4 или группу SO2R4, из соединения формулы (I), где Y представляет собой группу SR4, отличающийся тем, что проводят следующую дополнительную стадию: с 1) полученное соединение формулы обрабатывают окислителем. 13. Способ по п.10 получения соединения формулы (I), где Y представляет собой группуN(R7)SO2R4, где R7 является иным, чем Н, из соединения формулы (I), где Y представляет собой группуNHSO2R4, отличающийся тем, что проводят следующую дополнительную стадию: с 2) полученное соединение формулы обрабатывают алкилирующим агентом в присутствии основания. 14. Способ по п.10 получения соединения формулы (I), где Y представляет собой группу SO2NR5R6,из соединения формулы (I), где Y представляет собой группу SO2NHR5, отличающийся тем, что проводят следующую дополнительную стадию: с 3) полученное соединение формулы обрабатывают алкилирующим агентом в присутствии основания. 15. Способ по п.10 получения соединения формулы (I), где Y представляет собой NR7SO2R4 или группу NR7SO2NR5R6, отличающийся тем, что где R7 является таким, как определено для (I); с 4) проводят обработку галогенидом формулы HalSO2R4 или соответственно HalSO2NR5R6, где R4,R5 и R6 имеют значения, приведенные в п.1 для соединения формулы (I). 16. Способ получения соединения формулы (I) по п.1, его солей и/или сольватов, отличающийся тем, что где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают галогенидом формулы Hal-A-Y (V), где -А- и Y являются такими, как определено для соединения формулы (I) в п.1, a Hal представляет собой атом галогена, предпочтительно брома, в присутствии основания;ii) полученное таким образом соединение формулы обрабатывают галоидангидридом формулы ArCOHal (III), где Аr является таким, как определено для соединения формулы (I) в п.1, a Hal представляет собой атом галогена. 17. Способ по п.16, отличающийся тем, что где R1, R2, R3 и R'3 являются такими, как определено для соединения формулы (I), обрабатывают соединением формулы Z-A-Cl (VI), где -А- является таким, как определено для соединения формулы (I) в п.1, aZ представляет собой гидроксильную группу или атом галогена;i2) возможно, полученное таким образом соединение формулыi3) полученное таким образом на стадии (i1) или на стадии (i2) соединение формулы
МПК / Метки
МПК: C07D 209/12, A61P 43/00, A61K 31/404
Метки: агонистов, применение, рецепторов, 3-ароилиндола, производные, качестве
Код ссылки
<a href="https://eas.patents.su/30-5854-proizvodnye-3-aroilindola-i-ih-primenenie-v-kachestve-agonistov-receptorov-cb2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 3-ароилиндола и их применение в качестве агонистов рецепторов cb2</a>
Предыдущий патент: N-ацетилглюкозамин-6-фосфатдеацетилаза человека, взаимодействующая с каспазой-8, и способы ее применения
Следующий патент: Полиарилкарбоксамиды, применимые в качестве агентов, снижающих содержание липидов
Случайный патент: Устройство мобильной станции, способ управления состоянием линии радиосвязи и устройство для управления состоянием линии радиосвязи












