Производные индазола
Номер патента: 10165
Опубликовано: 30.06.2008
Авторы: Нара Синдзи, Кийои Хитоси, Канаи Фумихико, Андо Хироми, Умехара Хироси, Мияма Мотоки, Наое Томоки, Охта Йосихиса, Кавасима Кейко, Сиоцу Юкимаса, Канда Ютака
Формула / Реферат
1. Производное индазола, представленное формулой (I)
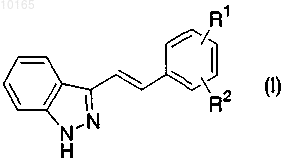
где R1 означает CONR1aR1b (где R1a и R1b могут быть одинаковыми или разными и каждый означает атом водорода, C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, арил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы В, аралкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы В, или гетероциклическую группу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы В, или R1a и R1b объединены вместе со смежным атомом азота с образованием гетероциклической группы, необязательно замещенной 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы В) или NR1cR1d (где R1c означает C1-10алкилсульфонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, или арилсульфонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы В, и R1d означает атом водорода или C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А) и
R2 означает атом водорода, галоген, C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, или C1-10алкоксигруппу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, где группа А включает
(А-1) гидрокси,
(А-2) оксо,
(А-3) карбокси,
(А-4) C1-10алкоксигруппу,
(А-5) C1-10алкоксикарбонил,
(А-6) арилсульфонил,
(А-7) гетероароил,
(А-8) арил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы а (где группа а включает карбокси, C1-10алкоксикарбонил, метилендиокси и этилендиокси),
(А-9) гетероциклическую группу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы b [где группа b включает C1-10алкил, C1-10алкоксигруппу и С1-8алканоил, и, когда замещенная гетероциклическая группа является замещенной гетероалициклической группой, заместителем может быть оксо],
(А-10) NR6aR6b [где R6a и R6b могут быть одинаковыми или разными, и каждый означает атом водорода, C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы с (где группа с включает галоген, гидрокси и C1-10алкоксигруппу), или
C1-8алканоил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы d (где группа d включает галоген, гидрокси, C1-10алкоксигруппу и арил), или R6a и R6b объединены вместе со смежным атомом азота с образованием гетероциклической группы],
(А-11) CONR7aR7b (где R7a и R7b имеют такие же значения, как R6a и R6b выше соответственно) и
(А-12) С1-10алкокси-C1-10алкоксигруппу, и
группа В включает
(В-1) галоген,
(В-2) гидрокси,
(В-3) нитро,
(В-4) циано,
(В-5) формил,
(В-6) карбокси,
(В-7) C1-10алкоксикарбонил,
(В-8) C1-10 алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А,
(В-9) C1-10алкоксигруппу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А,
(В-10) C1-8алканоил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А,
(В-11) C1-10алкилсульфонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А,
(В-12) ароил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е [где группа е включает галоген, гидрокси, нитро, циано, карбокси,
C1-8алканоил, C1-10алкоксикарбонил, аралкил, ароил, C1-10алкил, необязательно замещенный 1-3 гидроксигруппами, и C1-10алкоксигруппу, необязательно замещенную 1-3 гидроксигруппами),
(В-13) гетероароил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е,
(В-14) арил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е,
(В-15) гетероциклическую группу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы b,
(В-16) NR8aR8b [где R8a и R8b могут быть одинаковыми или разными, и каждый означает атом водорода, моно- или ди(C1-10алкил)аминокарбонил, C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, C1-8алканоил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А,
C1-10алкоксикарбонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А, арил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е, ароил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е, или гетероалициклический карбонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы f (где группа f включает галоген, гидрокси, оксо, амино, нитро, циано, карбокси, C1-8алканоил, C1-10алкоксикарбонил, аралкил, ароил, C1-10алкил, необязательно замещенный 1-3 гидроксигруппами, и C1-10алкоксигруппу, необязательно замещенную 1-3 гидроксигруппами) или R8a и R8b объединены вместе со смежным атомом азота с образованием гетероциклической группы, необязательно замещенной 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы g [где группа g включает галоген, гидрокси, оксо, амино, нитро, циано, карбокси, C1-8алканоил, C1-10алкоксикарбонил, аралкил, ароил, C1-10алкил, необязательно замещенный 1-3 гидроксигруппами, или C1-10алкоксигруппу необязательно замещенную 1-3 гидроксигруппами)],
(В-17) CONR9aR9b (где R9a и R9b имеют такие же значения, как указанные выше для R8a и R8b соответственно),
(В-18) арилсульфонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е,
(В-19) С4-8циклоалкенил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы h (где группа h включает амино, оксо, моно- или
ди(C1-10алкил)амино и гетероциклическую группу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы е) и
(В-20) гетероалициклический карбонил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы i (где группа i включает галоген, гидрокси, оксо, амино, нитро, циано, карбокси, C1-8алканоил, C1-10алкоксикарбонил, аралкил, ароил, C1-10алкил, необязательно замещенный 1-3 гидроксигруппами, и C1-10алкоксигруппу, необязательэю замещенную 1-3 гидроксигруппами), и заместителем(ями) в замещенной гетероалициклической группе, и заместителем(ями) в замещенной гетероциклической группе, образованной со смежным атомом азота, могут быть в дополнение к (В-1)-(В-20) следующие (В-21) или (В-22):
(В-21) оксо,
(В-22) -O(CR10aR10b)nO- (где R10a и R10b могут быть одинаковыми или разными, и каждый означает атом водорода или C1-10алкил, n означает 2 или 3, и два концевых атома кислорода объединены на одном и том же атоме углерода в замещенной гетероциклической группе, образованной со смежным атомом азота),
арил и остатки арила в ароиле, арилсульфониле и аралкиле выбраны из фенила, нафтила, инденила или антранила,
остаток алкилена в аралкиле имеет такое же значение, как группа, образованная удалением одного атома водорода из линейного или разветвленного C1-10алкила,
гетероциклическая группа означает гетероароматическую группу и гетероалициклическую группу, причем гетероароматическая группа выбрана из фурила, тиенила, пирролила, имидазолила, пиразолила, триазолила, тетразолила, оксазолила, оксадиазолила, тиазолила, пиридила, пиразинила, пиримидинила, пиридазинила, триазинила, индолила, индазолила, бензимидазолила, бензоксазолила, бензотиазолила, хинолила, изохинолила, фталазинила, нафтиридинила, хиноксалинила, хиназолинила, циннолинила, пуринила или кумаринила, и гетероалициклическая группа выбрана из пирролидинила, тиазолидинила, оксазолидинила, пиперидила, 1,2-дигидропиридила, пиперазинила, гомопиперазинила, морфолинила, тиоморфолинила, пиразолинила, оксазолинила, диоксоланила, тетрагидропиранила, тетрагидротиопиранила, тетрагидрофурила, тетрагидрохинолила, тетрагидроизохинолила, тетрагидрохиноксалинила, октагидрохинолила, индолинила и изоиндолинила,
остаток гетероарила в гетероароиле имеет такое же значение, как гетероароматическая группа, определенная выше,
гетероалициклический остаток в гетероалициклическом карбониле имеет такое же значение, как гетероалициклическая группа, определенная выше,
гетероциклическая группа, образованная вместе со смежным атомом азота, выбрана из пирролидинила, пирролидонила, пиперидино, пиперазинила, морфолино, тиоморфолино, гомопиперидино, гомопиперазинила, тетрагидропиридила, тетрагидрохинолила, тетрагидроизохинолила, индолила и изоиндолила,
или его фармацевтически приемлемая соль.
2. Производное индазола или его фармацевтически приемлемая соль по п.1, где R1 означает CONR1aR1b (где R1a и R1b имеют такие же значения, как указано выше соответственно) и R2 означает атом водорода или C1-10алкоксигруппу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А.
3. Производное индазола или его фармацевтически приемлемая соль по п.1, где R1 означает NR1cR1d (где R1c и R1d имеют такие же значения, как указано выше, соответственно) и R2 означает
C1-10алкоксигруппу, необязательно замещенную 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А.
4. Производное индазола или его фармацевтически приемлемая соль по п.1, где R1 означает CONR1aR1b (где R1a и R1b имеют такие же значения, как указано выше, соответственно) и R2 означает галоген или C1-10алкил, необязательно замещенный 1-3 заместителями, которые являются одинаковыми или разными и выбраны из группы А.
5. Производное индазола или его фармацевтически приемлемая соль по п.1, где R1 означает NR1cR1d (где R1c и R1d имеют такие же значения, как указано выше, соответственно) и R2 означает атом водорода.
6. Фармацевтическая композиция, включающая в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
7. Противоопухолевый агент, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
8. Терапевтический агент против гемопоэтической неоплазии, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
9. Терапевтический агент против лейкемии, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
10. Терапевтический агент против миеломы или лимфомы, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
11. Терапевтический агент против твердой карциномы, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
12. Терапевтический агент против рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких, рак ротовой полости и глотки, остеосаркома, меланома или опухоль головного мозга, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.1-5.
13. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения противоопухолевого агента.
14. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения терапевтического агента против гемопоэтической неоплазии.
15. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения терапевтического агента против лейкемии.
16. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения терапевтического агента против миеломы или лимфомы.
17. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения терапевтического агента против твердой карциномы.
18. Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5 для получения терапевтического агента против рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких, рак ротовой полости и глотки, остеосаркома, меланома или опухоль головного мозга.
19. Способ лечения опухоли, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
20. Способ лечения гемопоэтической неоплазии, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
21. Способ лечения лейкемии, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
22. Способ лечения миеломы или лимфомы, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
23. Способ лечения твердой карциномы, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
24. Способ лечения рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких, рак ротовой полости и глотки, остеосаркома, меланома или опухоль головного мозга, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.1-5.
Текст
010165 Область техники Данное изобретение относится к производным индазола или их фармацевтически приемлемым солям, которые обладают противоопухолевой или тому подобной активностью. Уровень техники В качестве производных индазола известны различные соединения [Японская выложенная патентная заявка (Kokai)32059/1990; WO 01/53268; WO 02/10137 и Khimiya Geterotsiklicheskikh Soedinenii,том 7, с. 957-959 (1978)]. В японской выложенной патентной заявке (Kokai)32059/1990 раскрыты соединения, представленные формулой (II) в которой R3A означает атом водорода, нитро, NR3A1R3A2, где R3A1 и R3A2 могут быть одинаковыми или разными и каждый означает атом водорода, замещенный или незамещенный низший алкил (число атомов углерода в низшем алкиле от 1 до 6), низший алканоил (число атомов углерода в низшем алканоиле от 1 до 6) или т.п.;R4A означает атом водорода или т.п.;Ar означает пиридил, замещенный или незамещенный 2-оксохроменил [2-оксохроменил своим бензольным кольцом связан с этенилом (-СН=СН-) и заместителем(ями) 2-оксохроменила является низший алкил, имеющий от 1 до 6 атомов углерода, или низшая алкоксигруппа, имеющая от 1 до 6 атомов углерода], или замещенный или незамещенный фенил [заместители Q5A1, Q5A2 и Q5A3 в замещенном фениле могут быть одинаковыми или разными и каждый означает атом водорода, галоген, нитро, нитрозо, гидрокси, карбокси, низший алкил, имеющий от 1 до 6 атомов углерода, низшую алкоксигруппу, имеющую от 1 до 6 атомов углерода, низший алкоксикарбонил, имеющий от 1 до 6 атомов углерода, NR5A1R5A2 (гдеR5A1 и R5A2 имеют такие же значения, которые указаны для R3A1 и R3A2 выше соответственно), или О(СН 2)ndNR5A3R5A4 (где nd означает целое число от 1 до 6 и R5A3 и R5A4 имеют такие же значения, которые указаны для R3A1 и R3A2 выше соответственно), или любые две из групп Q5A1-Q5A3 объединены вместе с образованием -О(CR5A5R5A6)О- (где два концевых атома кислорода связаны с фенилом у соседних атомов углерода в фениле и R5A5 и R5A6 могут быть одинаковыми или разными и каждый означает атом водорода или низший алкил, имеющий от 1 до 6 атомов углерода, или R5A5 и R5A6 объединены вместе с образованием алкилена, имеющего 4 или 5 атомов углерода) при условии, что Q5A1, Q5A2 и Q5A3, которые являются заместителями в замещенном фениле, не являются одновременно атомами водорода]. В WO 01/53268 раскрыты соединения, подавляющие дифференцировку клеток, представленные формулой (III) где R5B означает CH=CH-R5B1 (R5B1 означает замещенный или незамещенный алкил, замещенный или незамещенный арил, замещенную или незамещенную гетероциклическую группу или т.п.) и R3B означает алкил, арил, CH=CH-R5B2 (где R5B2 означает замещенный или незамещенный арил, замещенный или незамещенный гетероарил или т.п.). В WO 02/10137 раскрыты соединения, имеющие ингибирующую активность против c-jun где R5C означает CH=CH-R5C1 (где R5C1 означает замещенный или незамещенный арил, замещенный или незамещенный гетероарил или т.п.); где R1D означает метокси или нитро. Сущность изобретения Цель данного изобретения - предоставить производные индазола или их фармацевтически приемлемые соли, которые применимы в качестве противоопухолевого агента или т.п. Данное изобретение относится к следующим пунктам с (1) по (24). где R1 означает CONR1aR1b (R1a и R1b могут быть одинаковыми или разными и каждый означает атом водорода, замещенный или незамещенный низший алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил или замещенную или незамещенную гетероциклическую группу либоR1a и R1b объединены вместе со смежным атомом азота с образованием замещенной или незамещенной гетероциклической группы) или NR1cR1d (где R1c означает замещенный или незамещенный низший алкилсульфонил, или замещенный или незамещенный арилсульфонил и R1d означает атом водорода или замещенный или незамещенный низший алкил);R2 означает атом водорода, галоген, циано, нитро, гидрокси, карбокси, низший алкоксикарбонил,замещенный или незамещенный низший алкил, замещенную или незамещенную низшую алкоксигруппу,замещенный или незамещенный низший алканоил, CONR2aR2b (R2a и R2b могут быть одинаковыми или разными и каждый означает атом водорода, замещенный или незамещенный низший алкил, замещенный или незамещенный арил, замещенный или незамещенный аралкил или замещенную или незамещенную гетероциклическую группу, или R2a и R2b объединены вместе со смежным атомом азота с образованием замещенной или незамещенной гетероциклической группы) или NR2cR2d (R2c и R2d могут быть одинаковыми или разными и каждый означает атом водорода, замещенный или незамещенный низший алкил,замещенный или незамещенный низший алканоил, замещенный или незамещенный ароил, замещенный или незамещенный гетероароил, замещенный или незамещенный аралкил, замещенный или незамещенный низший алкилсульфонил или замещенный или незамещенный арилсульфонил),или его фармацевтически приемлемая соль.(2) Производное индазола или его фармацевтически приемлемая соль по (1), где R1 означаетCONR1aR1b (R1a и R1b имеют такие же значения, как указано выше, соответственно) и R2 означает атом водорода или замещенную или незамещенную низшую алкоксигруппу.(3) Производное индазола или его фармацевтически приемлемая соль по (1), где R1 означает 1c 1dNR R (R1c и R1d имеют такие же значения, как указано выше, соответственно) и R2 означает замещенную или незамещенную низшую алкоксигруппу.(4) Производное индазола или его фармацевтически приемлемая соль по (1), где R1 означаетCONR1aR1b (R1a и R1b имеют такие же значения, как указано выше, соответственно) и R2 означает галоген или замещенный или незамещенный низший алкил.(5) Производное индазола или его фармацевтически приемлемая соль по (1), где R1 означает 1c 1dNR R (R1c и R1d имеют такие же значения, как указано выше, соответственно) и R2 означает атом водорода.(6) Фармацевтическая композиция, включающая в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(7) Противоопухолевый агент, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(8) Терапевтический агент против гемопоэтической неоплазии, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(9) Терапевтический агент против лейкемии, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(10) Терапевтический агент против миеломы или лимфомы, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(11) Терапевтический агент против твердой карциномы, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(12) Терапевтический агент против рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких, рак ротовой полости и глотки, остеосаркома, меланома или опухоль головного мозга, включающий в качестве активного ингредиента производное индазола или его фармацевтически приемлемую соль по любому из пп.(1)-(5).(13) Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5) для получения противоопухолевого агента.(14) Применение производного индазола или его фармацевтически приемлемой солм по любому из пп.(1)-(5) для получения терапевтического агента против гемопоэтической неоплазии.(15) Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5) для получения терапевтического агента против лейкемии.(16) Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5) для получения терапевтического агента против миеломы или лимфомы.(17) Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5) для получения терапевтического агента против твердой карциномы.(18) Применение производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5) для производства терапевтического агента против рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких,рак ротовой полости и глотки, остеосаркома, меланома или опухоль головного мозга.(19) Способ лечения опухоли, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5).(20) Способ лечения гемопоэтической неоплазии, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5).(21) Способ лечения лейкемии, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5).(22) Способ лечения миеломы или лимфомы, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5).(23) Способ лечения твердой карцинома, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5).(24) Способ лечения рака, такого как рак молочной железы, рак матки, рак шейки матки, рак простаты, рак мочевого пузыря, рак почек, рак желудка, рак пищевода, рак печени, рак желчных путей, рак толстой кишки, ректальный рак, рак поджелудочной железы, рак легких, рак ротовой полости и глотки,остеосаркома, меланома или опухоль головного мозга, включающий стадию введения эффективного количества производного индазола или его фармацевтически приемлемой соли по любому из пп.(1)-(5). Соединения, представленные общей формулой (I), упоминаются здесь далее как соединение (I). То же относится к соединениям, представленным формулами с другими номерами. В определениях для каждой из групп в формуле (I):(i) Галоген включает атомы фтора, хлора, брома и йода.(ii) Примеры низшего алкила и остатков низшего алкила в низшей алкоксигруппе, низшем алкоксикарбониле и низшем алкилсульфониле включают, например, линейный, разветвленный или циклический алкил или алкил, содержащий такие алкилы в сочетании, имеющий от 1 до 10 атомов углерода. Более конкретные примеры их следующие:(ii-a) примеры линейного или разветвленного низшего алкила включают, например, метил, этил,н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, неопентил, н-гексил,н-гептил, н-октил, н-нонил и н-децил;(ii-b) примеры циклического низшего алкила включают, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, норадамантил, адамантил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[3.3.0]октил и бицикло[3.3.1]нонил и(ii-c) примеры низшего алкила, содержащего линейный или разветвленный алкил и циклический алкил, включают, например, циклопропилметил, циклопентилметил и циклооктилэтил.(iii) Остаток алкилена в аралкиле имеет такое же значение, как группа, образованная удалением одного атома водорода из линейного или разветвленного низшего алкила (ii-a) в определении низшего алкила, приведенном выше.(iv) Примеры арила и остатков арила в ароиле, арилсульфониле и аралкиле включают, например,моноциклические арилы или конденсированный арил, в котором два или более колец сконденсированы,и более конкретные примеры включают арил, имеющий от 6 до 14 атомов углерода в качестве образующих кольцо членов, такой как фенил, нафтил, инденил или антранил.(v) Примеры низшего алканоила включают, например, линейный, разветвленный или циклический низший алканоил или низший алканоил, содержащий такие низшие алканоилы в сочетании, имеющий от 1 до 8 атомов углерода, такой как формил, ацетил, пропионил, бутирил, изобутирил, валерил, изовале-3 010165 рил, пивалоил, гексаноил, гептаноил, октаноил, циклопропилкарбонил, циклобутилкарбонил, циклопропилметилкарбонил, циклопентилкарбонил, циклогексилкарбонил, 1-метилциклопропилкарбонил или циклогептилкарбонил.(vi) Примеры гетероциклической группы включают, например, гетероароматическую группу и гетероалициклическую группу. Примеры гетероароматической группы включают, например, моноциклическую ароматическую гетероциклическую группу или конденсированную гетероароматическую группу, в которой два или более колец сконденсированы. Тип и число гетероатомов, содержащихся в гетероароматической группе, конкретно не ограничено, и гетероароматическая группа может содержать,например, один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Более конкретные примеры включают гетероароматическую группу, имеющую от 5 до 14 атомов углерода в качестве образующих кольцо членов, такую как фурил, тиенил, пирролил,имидазолил, пиразолил, триазолил, тетразолил, оксазолил, оксадиазолил, тиазолил, пиридил, пиразинил,пиримидинил, пиридазинил, триазинил, индолил, индазолил, бензимидазолил, бензоксазолил, бензотиазолил, хинолил, изохинолил, фталазинил, нафтаридинил, хиноксалинил, хиназолинил, циннолинил,пуринил или кумаринил. Примеры гетероалициклической группы включают, например, моноциклическую гетероалициклическую группу или конденсированную гетероалициклическую группу, в которой два или более колец сконденсированы. Тип и число гетероатомов, содержащихся в гетероалициклических группах, конкретно не ограничены, и гетероалициклическая группа может содержать, например,один или несколько гетероатомов, выбранных из группы, состоящей из атома азота, атома серы и атома кислорода. Более конкретные примеры включают, например, пирролидинил, тиазолидинил, оксазолидинил, пиперидил, 1,2-дигидропиридил, пиперазинил, гомопиперазинил, морфолинил, тиоморфолинил,пиразолинил, оксазолинил, диоксоланил, тетрагидропиранил, тетрагидротиопиранил, тетрагидрофурил,тетрагидрохинолил, тетрагидроизохинолил, тетрагидрохиноксалинил, октагидрохинолил, индолинил и изоиндолинил.(vii) Примеры гетероциклической группы, образованной вместе со смежным атомом азота, включают 5- или 6-членную моноциклическую гетероалициклическую группу, содержащую по меньшей мере один атом азота (моноциклическая гетероалициклическая группа может дополнительно содержать какойлибо другой атом азота, атом кислорода и атом серы), и бициклическую или трициклическую конденсированную гетероциклическую группу, содержащую по меньшей мере один атом азота, в которой от 3- до 8-членные кольца сконденсированы (конденсированная гетероциклическая группа может дополнительно содержать какой-либо другой атом азота, атом кислорода и атом серы). Более конкретные примеры включают, например, пирролидинил, пирролидонил, пиперидино, пиперазинил, морфолино, тиоморфолино, гомопиперидино, гомопиперазинил, тетрагидропиридил, тетрагидрохинолил, тетрагидроизохинолил, индолил и изоиндолил.(viii) Остаток гетероарила в гетероароиле имеет такое же значение, как гетероароматическая группа в гетероциклической группе (vi) выше.(ix) Примеры заместителей в замещенном низшем алкиле, замещенной низшей алкоксигруппе, замещенном низшем алкилсульфониле и замещенном низшем алканоиле, которые могут быть одинаковыми или разными и в количестве от 1 до 3, включают:(ix-a) гидрокси,(ix-b) оксо,(ix-c) карбокси,(ix-d) низшую алкоксигруппу,(ix-e) низший алкоксикарбонил,(ix-f) арилсульфонил,(ix-g) гетероароил,(ix-h) замещенный или незамещенный арил (заместителем(ями) в замещенном ариле, которых может быть от 1 до 3, является, например, карбокси, низший алкоксикарбонил, метилендиокси и этилендиокси),(ix-i) замещенную или незамещенную гетероциклическую группу (заместителем(ми) (ix-ia) в замещенной гетероциклической группе, которых может быть от 1 до 3, является например, низший алкил,низшая алкоксигруппа и низший алканоил и, когда замещенная гетероциклическая группа является замещенной гетероалициклической группой, заместителем может быть оксо),(ix-j) NR6aR6b [где R6a и R6b могут быть одинаковыми или разными, и каждый означает атом водорода, замещенный или незамещенный низший алкил (заместителем(ями) в замещенном низшем алкиле,которых может быть от 1 до 3, является, например, галоген, гидрокси или низшая алкоксигруппа) или замещенный или незамещенный низший алканоил (заместителем(ями) в замещенном низшем алканоиле,которых может быть от 1 до 3, является, например, галоген, гидрокси, низшая алкоксигруппа или арил),или R6a и R6b объединены вместе со смежным атомом азота с образованием гетероциклической группы],(ix-k) CONR7aR7b (где R7a и R7b имеют такие же значения, как R6a и R6b выше, соответственно) и-4 010165 В определении заместителей (ix) в замещенном низшем алкиле, замещенной низшей алкоксигруппе,замещенном низшем алкилсульфониле и замещенном низшем алканоиле, галоген имеет такое же значение, как указанные в (i) выше; низший алкил и остаток низшего алкила в низшей алкоксигруппе, в низшем алкоксикарбониле и в низшей алкоксинизшей алкоксигруппе имеют такие же значения, как указанные в (ii) выше, соответственно; остаток алкилена в низшей алкоксинизшей алкоксигруппе имеет такое же значение, как группа, образованная удалением одного атома водорода из линейного или разветвленного низшего алкила (ii-a) в приведенном выше определении низшего алкила; арил и остаток арила в арилсульфониле имеют такие же значения, как указанные в (iv) выше, соответственно; низший алканоил имеет такие же значения, как указанные в (v) выше; гетероциклическая группа имеет такие же значения,как указанные в (vi) выше; гетероциклическая группа, образованная вместе со смежным атомом азота,имеет такие же значения, как указанные в (vii) выше; и гетероароил имеет такие же значения, как указанные в (viii) выше.(х) Примеры заместителей в замещенном ариле, замещенном ароиле, замещенном аралкиле, замещенном арилсульфониле, замещенном гетероароиле, замещенной гетероциклической группе и замещенной гетероциклической группе, образованной вместе со смежным атомом азота, которые могут быть одинаковыми или разными и в количестве от 1 до 3, включают:(х-а) галоген,(х-b) гидрокси,(х-с) нитро,(x-d) циано,(х-е) формил,(x-f) карбокси,(х-g) низший алкоксикарбонил,(x-h) замещенный или незамещенный низший алкил (заместитель(и) в замещенном низшем алкиле имеет такие же значения, как указанные в (ix) выше),(x-i) замещенную или незамещенную низшую алкоксигруппу (заместитель(и) в замещенной низшей алкоксигруппе имеют такие же значения, как указанные в (ix) выше),(x-j) замещенный или незамещенный низший алканоил (заместитель(и) в замещенном низшем алканоиле имеет такие же значения, как указанные в (ix) выше),(х-k) замещенный или незамещенный низший алкилсульфонил (заместитель(и) в замещенном низшем алкилсульфониле имеет такие же значения, как указанные в (ix) выше),(х-l) замещенный или незамещенный ароил (заместителем(ями) (х-la) в замещенном ароиле, которых может быть от 1 до 3, является, например, галоген, гидрокси, нитро, циано, карбокси, низший алканоил, низший алкоксикарбонил, аралкил, ароил), замещенный или незамещенный низший алкил (заместителем(ями) в замещенном низшем алкиле, которых может быть от 1 до 3, является, например, гидрокси) и замещенная или незамещенная низшая алкоксигруппа (заместителем(ями) в замещенной низшей алкоксигруппе, которых может быть от 1 до 3, является, например, гидрокси),(х-m) замещенный или незамещенный гетероароил (заместитель(и) в замещенном гетероароиле имеет такие же значения, как указанные в (х-la) выше),(х-n) замещенный или незамещенный арил (заместитель(и) в замещенном ариле имеет такие же значения, как указанные в (х-la) выше),(х-о) замещенную или незамещенную гетероциклическую группу (заместитель(и) в замещенной гетероциклической группе имеет такие же значения, как указанные в (ix-ia) выше),(х-р) NR8aR8b где R8a и R8b могут быть одинаковыми или разными и каждый означает атом водорода, моно- или ди(низший алкил)аминокарбонил, замещенный или незамещенный низший алкил [заместитель(и) в замещенном низшем алкиле имеет такие же значения, как указанные в (ix) выше], замещенный или незамещенный низший алканоил [заместитель(и) в замещенном низшем алканоиле имеет такие же значения, как указанные в (ix) выше], замещенный или незамещенный низший алкоксикарбонил [заместитель(и) в замещенном низшем алкоксикарбониле имеет такие же значения, как указанные в (ix) выше], замещенный или незамещенный арил [заместитель(и) в замещенном ариле имеет такие же значения, как указанные в (х-la) выше], замещенный или незамещенный ароил [заместитель(и) в замещенном ароиле имеет такие же значения, как указанные в (х-la) выше] или замещенный или незамещенный гетероалициклический карбонил [заместителем(ями) в замещенном гетероалициклическом карбониле, которых может быть от 1 до 3, является, например, галоген, гидрокси, оксо, амино, нитро, циано, карбокси,низший алканоил, низший алкоксикарбонил, аралкил, ароил, замещенный или незамещенный низший алкил (где заместителем(ями) в замещенном низшем алкиле, которых может быть от 1 до 3, является,например, гидрокси), замещенная или незамещенная низшая алкоксигруппа (заместителем(ями) в замещенной низшей алкоксигруппе, которых может быть от 1 до 3, является, например, гидрокси)] или R8a иR8b объединены вместе со смежным атомом азота с образованием замещенной или незамещенной гетероциклической группы [заместителем(ями) в замещенной гетероциклической группе, образованной со смежным атомом азота, которых может быть от 1 до 3, является, например, галоген, гидрокси, оксо, амино, нитро, циано, карбокси, низший алканоил, низший алкоксикарбонил, аралкил, ароил, замещенный-5 010165 или незамещенный низший алкил (заместителем(ями) в замещенном низшем алкиле, которых может быть от 1 до 3, является, например, гидрокси) или замещенная или незамещенная низшая алкоксигруппа(заместителем(ями) в замещенной низшей алкоксигруппе, которых может быть от 1 до 3, является, например, гидрокси)],(x-q) CONR9aR9b (где R9a и R9b имеют такие же значения, как указанные выше для R8a и R8b, соответственно),(х-r) замещенный или незамещенный арилсульфонил [заместитель(и) в замещенном арилсульфониле имеет такие же значения, как указанные в (х-la) выше],(x-s) замещенный или незамещенный низший циклоалкенил заместителем(ями) в замещенном низшем циклоалкениле, которых может быть от 1 до 3, является, например, амино, оксо, моно- или ди(низший алкил)амино или замещенная или незамещенная гетероциклическая группа [заместитель(и) в замещенной гетероциклической группе имеет такие же значения, как указанные в (х-la) выше] и(x-t) замещенный или незамещенный гетероалициклический карбонил [заместителем(ями) в замещенном гетероалициклическом карбониле, которых может быть от 1 до 3, является, например, галоген,гидрокси, оксо, амино, нитро, циано, карбокси, низший алканоил, низший алкоксикарбонил, аралкил,ароил, замещенный или незамещенный низший алкил (заместителем(ями) в замещенном низшем алкиле,которых может быть от 1 до 3, является, например, гидрокси) или замещенная или незамещенная низшая алкоксигруппа (заместителем(ями) в замещенной низшей алкоксигруппе, которых может быть от 1 до 3,является, например, гидрокси)]. Заместителем(ями) в замещенной гетероалициклической группе и заместителем(ями) в замещенной гетероциклической группе, образованной со смежным атомом азота, могут быть в дополнение к(х-u) оксо,(x-v) -O(CR10aR10b)nO- (R10a и R10b могут быть одинаковыми или разными, и каждый означает атом водорода, низший алкил или т.п., n означает 2 или 3, и два концевых атома кислорода объединены на одном и том же атоме углерода в замещенной гетероциклической группе, образованной со смежным атомом азота). В определении заместителей (х) в замещенном ариле, замещенном ароиле, замещенном аралкиле,замещенном арилсульфониле, замещенном гетероароиле, замещенной гетероциклической группе и замещенной гетероциклической группе, образованной со смежным атомом азота, галоген имеет такие же значения, как указанные в (i) выше; низший алкил и остаток низшего алкила в низшей алкоксигруппе,низшем алкоксикарбониле, низшем алкилсульфониле, моно- или ди(низший алкил)амино и моно- или ди(низший алкил)аминокарбониле имеют такие же значения, как указанные в (ii) выше, соответственно,и два остатка низшего алкила в ди(низший алкил)амино и ди(низший алкил)аминокарбониле могут быть одинаковыми или разными; остаток алкилена в аралкиле имеет такие же значения, как указанные в (iii) выше; арил и остаток арила в аралкиле, ароиле и арилсульфониле имеют такие же значения, как указанные в (iv) выше, соответственно; низший алканоил имеет такие же значения, как указанные в (v) выше; гетероциклическая группа имеет такие же значения, как указанные в (vi) выше; гетероциклическая группа, образованная со смежным атомом азота, имеет такие же значения, как указанные в (vii) выше; группа гетероарила в гетероароиле имеет такие же значения, как указанные в (viii) выше, и гетероалициклическая группа в гетероалициклическом карбониле имеет такие же значения, как гетероалициклическая группа в гетероциклической группе (vi) выше. Примеры низшего циклоалкенила включают, например,циклоалкенил, имеющий от 4 до 8 атомов углерода, такой как циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Примеры фармацевтически приемлемых солей соединения (I) включают, например, фармацевтически приемлемые аддитивные соли с кислотой, соли металлов, соли аммония, аддитивные соли с органическим амином и аддитивные соли с аминокислотами. Аддитивные соли с кислотами включают, например, соли неорганических кислот, такие как гидрохлориды, сульфаты и фосфаты; и соли органических кислот, такие как ацетат, малеат, фумарат, тартраты, цитраты, лактаты, аспартаты и глутаматы. Соли металлов включают, например, соли щелочных металлов, такие как соли натрия и соли калия; соли щелочно-земельных металлов, такие как соли магния и соли кальция; а также соли алюминия и соли цинка. Соли аммония включают, например, соли аммония и тетраметиламмония. Аддитивные соли с органическими аминами включают, например, соли морфолина и соли пиперидина. Аддитивные соли с аминокислотами включают, например, соли лизина, соли глицина и соли фенилаланина. Гемопоэтическая неоплазия относится к новообразованиям обычно в гемоцитах. Примерами патологического состояния на основе гемопоэтической неоплазии являются лейкемия, такая как хроническая миелоидная лейкемия и острая миелоидная лейкемия; миелома, такая как множественная миелома, и лимфома. Способы получения соединения (I) будут описаны ниже.Me, Et, Pr, iPr, iBu, tBu и Ph в следующих процессах реакции, структурных формулах и таблицах означают метил, этил, пропил, изопропил, изобутил, трет-бутил и фенил соответственно. Определения каждой из групп в следующих процессах реакции имеют такие же значения, как указано для каждой из-6 010165 групп выше, если не указано иначе. Когда определенная группа изменяется в условиях реакции или непригодна для осуществления процесса в следующих способах получения, можно получать целевое соединение, используя метод введения и удаления защитной группы, обычно используемый в химии органического синтеза (например,Protective groups in Organic Synthesis, third edition, T.W. Greene, John WileySons Inc. (1999. Если необходимо, порядок реакционных процессов, таких как введение заместителей, может быть изменен. Соединение (I) может быть получено согласно следующим реакционным процессам. Способ получения 1. Соединение (I) может быть получено с использованием соединения (А), полученного способом, подобным известному способу (например., J. Org. Chem., vol. 52, p. 19 (1987); Can. J. Chem., vol. 51, p. 792 где X означает любой из атомов хлора, брома или йода, и R1 и R2 имеют такие же значения, как указано выше, соответственно. Стадия 1. Соединение (I) может быть получено взаимодействием соединения (А) с соединением (В) в присутствии основания в растворителе, таком как метанол, этанол, тетрагидрофуран (ТГФ),N,N-диметилформамид (ДМФА) и смеси указанных растворителей. Карбонат калия, трет-бутоксид калия и гидрид натрия могут быть использованы в качестве основания. По отношению к соединению (А) используют от 1 до 10 экв. соединения (В) и основания соответственно. Реакцию обычно проводят при температурах между 0 и 100 С в течение от 1 до 72 ч. Способ получения 2. Из числа соединений (I) соединения (Ia), которые имеют специфическую функциональную группу вR1 или R2, также могут быть получены с использованием соединения (C), которое имеет другую функциональную группу в R1 или R2, полученного согласно способу получения 1 или другим известным способом (например, японская выложенная заявка (kokai)32059/1990) согласно следующему процессу. Хотя все соединения, упомянутые как соединение (Ia) и т.п. на следующих стадиях, не всегда охватываются общим понятием соединения (I), они обозначены, как, например, соединение (Ia), ради удобства. Более того, даже среди соединений, называемых здесь соединением (C) на следующих стадиях с 2-1 по 2-5, есть соединения, охватываемые общим понятием соединения (I) где R1e, R1f, R2e и R2f означают группы, определения которых даны на следующих стадиях с 2-1 по 2-5 соответственно, R1e и R1f имеют такие же значения, как R1 выше, соответственно и R2e и R2f имеют такие же значения, как R2 выше, соответственно, если не указано иначе на следующих стадиях с 2-1 по 2-5). Стадия 2-1. На стадии 2-1 по меньшей мере один из R1e и R2e означает низший алкоксикарбонил и по меньшей мере один из R1f и R2f означает карбокси. Соединение (Ia) может быть получено путем гидролиза соединения (C) в воде или в смешанном растворителе из воды и другого растворителя, такого как метанол, этанол или ТГФ, в присутствии основания, такого как гидроксид натрия, или кислоты, такой как хлороводородная кислота. По отношению к соединению (C) предпочтительно используют от 0,1 до 10 экв. кислоты или основания. Реакцию обычно проводят при температурах между 20 и 100 С в течение от 1 до 72 ч. Стадия 2-2. На стадии 2-2 по меньшей мере один из R1e и R2e означает нитро и по меньшей мере один из R1f и 2fR означает амино. Соединение (Ia) может быть получено обработкой соединения (C) восстановителем, таким как олово или железо, в присутствии кислоты, такой как концентрированная хлороводородная кислота или уксусная кислота, в растворителе, таком как вода, этанол или их смешанный растворитель, или в отсутствие растворителя, или восстановлением соединения (C) в присутствии катализатора, такого как палладий/углерод, диоксид платины или никель Ренея в атмосфере газообразного водорода или в присутствии донора водорода, такого как гидрат гидразина или формиат аммония, в растворителе, таком как-7 010165 вода, метанол, этанол, ТГФ, ДМФА или смешанный растворитель на их основе. По отношению к соединению (C) предпочтительно используют от 1 до 100 экв. кислоты, такой как концентрированная хлороводородная кислота или уксусная кислота и от 1 до 20 экв. восстановителя,такого как олово или железо. По отношению к соединению (C) предпочтительно используют от 0,5 до 100 мас.% катализатора и от 1 до 100 экв. донора водорода. Реакцию обычно проводят при температурах между 0 и 100 С в течение от 1 до 72 ч. Стадия 2-3. На стадии 2-3 по меньшей мере один из R1e и R2e означает карбокси и по меньшей мере один из R1f 2f и R означает CONR10R11 (R10 и R11 имеют такие же значения, как R1a и R1b выше, соответственно). Соединение (Ia) может быть получено взаимодействием соединения (C) с соединением (V), представленным формулой HNR10R11 (R10 и R11 имеют такие же значения, как указано выше, соответственно),в присутствии конденсирующего агента и активирующего агента в растворителе, таком как дихлорметан,ТГФ, 1,4-диоксан, ДМФА или N-метилпиперидон или смешанный растворитель на их основе. Примеры конденсирующего агента включают дициклогексилкарбодиимид, гидрохлорид 1-этил-3(3-диметиламинопропил)карбодиимида, связанный с полимером 1-этил-3-(3-диметиламинопропил)карбодиимид, трифенилфосфиноксидтрифторметансульфоновый ангидрид. Примеры активирующего агента включают 1-гидроксибензотриазол и N-гидроксисукцинимид. По отношению к соединению (C) предпочтительно используют от 1 до 20 экв. восстановителя, активирующего агента и соединения (V) соответственно. Реакцию обычно проводят при температурах между -20 и 80 С в течение от 30 мин до 72 ч. Некоторые из соединений (V) могут быть подвергнуты реакции в форме соли, образованной смешиванием с активирующим агентом. Стадия 2-4. На стадии 2-4 по меньшей мере один из R1e и R2e означает амино и по меньшей мере один из R1f и 2fR означает NHSO2R12 (R12 означает замещенный или незамещенный низший алкил или замещенный или незамещенный арил). В определении R12 низший алкил и арил имеют такие же значения, как указанные выше в (ii) и (iv),соответственно. Заместители в замещенном низшем алкиле и замещенном ариле имеют такие же значения, как указанные выше в (ix) и (х), соответственно. Соединение (Ia) может быть получено взаимодействием соединения (C) с соединением (VI),представленным формулой R12SO2Cl, где R12 имеет указанные выше значения, или соединением (VII),представленным формулой (R12SO2)2O, где R12 имеет указанные выше значения, в присутствии основания, такого как триэтиламин, пиридин, п-диметиламинопиридин, поливинилпиридин,4-морфолинометилполистирол или 4-пиперидинополистирол, в растворителе, таком как дихлорметан,ТГФ, 1,4-диоксан, ДМФА или N-метилпиперидон или смешанный растворитель на их основе. По отношению к соединению (C) предпочтительно используют от 1 до 20 экв. основания и соединения (VI) или соединения (VII) соответственно. Реакцию обычно проводят при температурах между-20 и 80 С в течение от 30 мин до 24 ч. Стадия 2-5. На стадии 2-5 по меньшей мере один из R1e и R2e означает заместитель, содержащий галоген, и по меньшей мере один из R1f и R2f означает заместитель, содержащий карбокси. Галоген имеет такие же значения, как указанные в (i) выше. Соединение (Ia) может быть получено обработкой соединения (C) сильным основанием, таким как гидрид натрия или н-бутиллитий в растворителе, таком как ТГФ, и взаимодействием полученного соединения с газообразным или твердым диоксидом углерода. По отношению к соединению (C) предпочтительно используют от 1 до 10 экв. сильного основания и 1 до 200 экв. диоксида углерода, соответственно. Реакцию обычно проводят при температурах между-80 и 30 С в течение от 1 до 24 ч. Преобразование функциональных групп, содержащихся в R1 или R2, в соединении (I) и в исходном веществе также может быть проведено известными методами (например, Comprehensive Organic Transformations, R. С. Larock, (1989 в дополнение к указанным процессам. Соединение (I), имеющее желательную функциональную группу в желательном положении, может быть получено проведением указанных процессов в каком-либо подходящем сочетании. Выделение и очистка продуктов указанных способов получения могут быть проведены подходящим сочетанием обычных методов, применяемых в органическом синтезе, таких как фильтрование, экстракция, промывание, сушка, концентрирование, кристаллизация и различные методы хроматографии. Промежуточные соединения могут быть также использованы на последующей стадии реакции без дополнительной очистки. Могут существовать изомеры соединения (I), такие как позиционные изомеры, геометрические изомеры или оптические изомеры. Все возможные изомеры, включая указанные изомеры и смеси изомеров в любом соотношении, могут быть использованы в данном изобретении или включены в данное изобретение.-8 010165 Когда желательно получить соль соединения (I), в случае, когда его получают в форме соли, оно может быть очищено, как таковое, когда его получают в свободной форме, его растворяют или суспендируют в подходящем растворителе с последующим добавлением к нему кислоты или основания для образования соли. Соединение (I) или его фармацевтически приемлемая соль может существовать в форме аддуктов с водой или растворителями. Указанные аддукты также включены в данное изобретение. Конкретные примеры соединения (I) показаны в табл. 1, что не означает ограничения объема данного изобретения. Таблица 1 Далее фармакологические активности соединения (I) будут проиллюстрированы со ссылкой на пример испытания.- 15010165 Пример испытания. Цитостатическое действие на линию клеток лейкемии и линию клеток твердой карциномы. Цитостатическую интенсивность воздействия испытуемого соединения на линии клеток острой миелоидной лейкемии человека MV-4-11 и ML-1 и линии клеток хронической миелоидной лейкемии человека K562 определяли следующим образом. Каждую линию клеток культивировали, используя Roswell Park Memorial Institute's Medium (RPMI) 1640 (Gibco, Catalog11875-093), содержащую 10% фетальной телячьей сыворотки (Gibco,Catalog10437-028) и 1% пенициллина/стрептомицина (1:1) (Gibco, Catalog15140-122). По 80 мкл бульона клеток MV-4-11, имеющего концентрацию 7,5104 клеток/мл (или бульона клеток ML-1 или клеток K562, имеющего концентрацию 2,5104 клеток/мл), инокулировали в лунки планшета ТС MICROWELL 96U (Nalge Nunc International, Catalog163320) и культивировали в инкубаторе с 5% газообразным диоксидом углерода при 37 С в течение 4 ч. В качестве пустого контроля только средуRPMI (80 мкл) добавляли в лунку. По 20 мкл раствора испытуемого соединения в диметилсульфоксиде(ДМСО), который готовили, чтобы получить конечную концентрацию 10 мкмоль/л, добавляли к клеткамMV-4-11, клеткам ML-1 и клеткам K562 соответственно. По 20 мкл ДМСО добавляли в контрольную лунку и в лунку пустого контроля до конечной концентрации 0,1%. После добавления испытуемого соединения клетки инкубировали в инкубаторе с 5% газообразным диоксидом углерода при 37 С в течение 72 ч. После добавления 20 мкл реагента WST-1 натриевая соль 4-[3-(4-иодфенил)-2-(4-нитрофенил)-2 Н 5-тетразолио]-1,3-бензолдисульфоната (Roche Diagnostics K.K., Catalog1644807), разбавленного до 50% средой RPMI, клетки дополнительно инкубировали при 37 С в течение 2 ч. Затем определяли оптические плотности при 450 нм (эталонная длина волны: 690 нм) на спектрофотометре SPECTRAmax 340PC для прочтения микропланшетов (Molecular Devices Corporation). Относительный рост (%) лунки, в которую было добавлено испытуемое соединение, определяли, принимая за 100% оптическую плотность лунки, в которую был добавлен только ДМСО без добавления испытуемого соединения, (контроль) и за 0% оптическую плотность лунки, содержащей только среду RPMI. Цитостатическую интенсивность (%) испытуемого соединения определяли вычитанием расчетного относительного роста из 100. Чем выше цитостатическая интенсивность, тем сильнее испытуемое соединение проявляет цитостатическое воздействие на клетку. Цитостатическую интенсивность воздействия испытуемого соединения на линию клеток рака толстой кишки человека Colo205 определяли следующим образом. Клетки культивировали, используя Roswell Park Memorial Institute's Medium (RPMI) 1640 (Gibco,Catalog11875-093), содержащую 10% фетальной телячьей сыворотки (Gibco, Catalog10437-028) и 1% пенициллина/стрептомицина (1:1) (Gibco, Catalog15140-122). По 80 мкл Colo205 с концентрацией 1,25104 клеток/мл инокулировали в лунки планшета ТС MICROWELL 96F (Nalge Nunc International,Catalog167008) и культивировали в инкубаторе с 5% газообразным диоксидом углерода при 37 С в течение 24 ч. В качестве пустого контроля только RPMI (80 мкл) добавляли в лунку. По 20 мкл раствора испытуемого соединения в ДМСО, который готовили, чтобы получить конечную концентрацию до 10 мкмоль/л, добавляли к клеткам Colo205. По 20 мкл ДМСО добавляли в контрольную лунку и в лунку пустого контроля до конечной концентрации 0,1%. После добавления испытуемого соединения клетки инкубировали в инкубаторе с 5% газообразным диоксидом углерода при 37 С в течение 72 ч. Цитостатическую интенсивность (%) определяли затем таким же образом, как для линий клеток лейкемии. Определенные цитостатические интенсивности (%) показаны в табл. 2. Таблица 2 Табл. 2 показывает, что соединение (I) проявляет цитостатическое воздействие на линии клеток острой миелоидной лейкемии человека MV-4-11 и ML-1, линию клеток хронической миелоидной лейкемии человека K562 и линию клеток рака толстой кишки человека Colo205. Соединение (I) или его фармацевтически приемлемая соль могут быть использованы как таковые или в различных фармацевтических формах в зависимости от фармакологического эффекта, цели введения и т.п. Фармацевтическая композиция по данному изобретению может быть приготовлена однородным смешиванием соединения (I) или его фармацевтически приемлемой соли в количестве, которое является эффективным, в качестве активного ингредиента с фармацевтически приемлемыми носителями. Эти носители могут иметь разные формы в широких пределах в соответствии с желательной лекарственной формой для введения. Предпочтительно, чтобы фармацевтическая композиция была в виде отдельной дозированной формы для перорального введения или парентерального введения, такой как инъекция. При производстве таблеток могут быть использованы наполнитель, такой как лактоза и маннит, дезинтегратор, такой как крахмал, смазывающий агент, такой как стеарат магния, связующее, такое как поливиниловый спирт и гидроксипропилцеллюлоза, и поверхностно-активное вещество, такое как сложные эфиры жирных кислот и сахарозы и сложные эфиры жирных кислот и сорбита, и т.п. в соответствии с обычной процедурой. Предпочтительны таблетки, содержащие от 1 до 200 мг активного ингредиента. При производстве препаратов для инъекций путем обычной процедуры могут быть использованы вода, физиологический раствор, растительное масло, такое как оливковое масло и арахисовое масло, растворитель, такой как этилолеат и пропиленгликоль, растворяющий агент, такой как бензоат натрия, салицилат натрия и уретан, агент для придания изотоничности, такой как хлорид натрия и глюкоза, консервант, такой как фенол, крезол, п-гидроксибензоат и хлорбутанол, и антиоксидант, такой как аскорбиновая кислота и пиросульфит натрия, и т.п. Соединение (I) или его фармацевтически приемлемая соль могут быть введены или перорально, или парентерально посредством раствора для инъекций и т.п. Эффективная доза и частота введения изменяются в зависимости от лекарственной формы, возраста, массы тела и симптома пациента и т.п. Как правило, соединение (I) или его фармацевтически приемлемая соль предпочтительно могут быть введены в количестве от 0,01 до 100 мг/кг в сутки. Наилучший способ осуществления изобретения Данное изобретение будет пояснено более подробно на примерах ниже, что не означает ограничения сущности данного изобретения. В спектре протонного ядерного магнитного резонанса (1 Н-ЯМР), используемого в примерах, обменный водород не удается ясно наблюдать в некоторых соединениях при некоторых условиях измерения. Что касается указания мультиплетных сигналов, здесь используется обычное изображение услов- 18010165 ными знаками, хотя br означает широкий сигнал, оцениваемый визуальным наблюдением. Пример 1. (Е)-N,N-Диметил-4-[2-(1H-индазол-3-ил)винил]бензамид (соединение 1). Стадия 1. 1 Н-Индазол-3-карбоновую кислоту (45,2 г, 279 ммоль) суспендируют в ТГФ (500 мл) и к суспензии добавляют диметиламмониевую соль 1-гидроксибензотриазола (55,7 г, 308 ммоль), полученную способом, подобным известному способу (например, Synthesis, page 285 (1992, и гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида (58,9 г, 307 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляют воду, экстрагируют этилацетатом и органический слой последовательно промывают насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток подвергают перекристаллизации из смешанного растворителя ацетон/вода, получая N,N-диметил-1 Н-индазол-3-карбоксамид (37,7 г, 71%). 1TOF-MC (m/z); 190 [М+1]+. Стадия 2. Алюмогидрид лития (13,7 г, 36,1 ммоль) суспендируют в ТГФ (500 мл) и к суспензии добавляют раствор N,N-диметил-1 Н-индазол-3-карбоксамида, полученного на стадии 1, (34,2 г, 181 ммоль) в ТГФ(250 мл) с последующим перемешиванием при комнатной температуре в потоке газообразного азота в течение 30 мин. Реакционную смесь смешивают с декагидратом сульфата натрия, перемешивают допонительно в течение 1 ч и фильтруют через Celite. Растворитель выпаривают при пониженном давлении,получая 3-диметиламинометил-1 Н-индазол (24,2 г, 76%). 1H-ЯМР (270 МГц, CDCl3)2,33 (с, 6 Н), 3,85 (с, 2 Н), 7,16 (ддд, J=1,3, 6,6, 7,9 Гц, 1 Н), 7,38 (ддд,J=1,0, 6,6, 8,3 Гц, 1 Н), 7,45 (д, J=8,3 Гц, 1 Н), 7,87 (дд, J=1,0, 7,9 Гц, 1H), 10,0 (ушир.с, 1 Н). Стадия 3. 3-Диметиламинометил-1 Н-индазол (25,6 г, 146 ммоль), полученный на стадии 2, растворяют в этилацетате (350 мл) и к раствору добавляют метилиодид (33,3 мл, 535 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. Полученный осадок выделяют фильтрованием, получая йодид (1 Н-индазол-3-илметил)триметиламмония (45,0 г, 97%). 1TOF-MC (m/z); 190 [М-127]+. Стадия 4. Йодид (1 Н-индазол-3-илметил)триметиламмония (45,0 г, 142 ммоль), полученный на стадии 3, растворяют в ДМФА (220 мл) и раствор смешивают с трифенилфосфином (44,7 г, 170 ммоль) с последующим кипячением с обратным холодильником в течение 2,5 ч. После охлаждения до комнатной температуры к реакционной смеси добавляют диэтиловый эфир и перемешивают в течение ночи. Полученный осадок выделяют фильтрованием, получая йодид (1 Н-индазол-3-илметил)трифенилфосфония (68,3 г,92%). 1TOF-MC (m/z); 393 [М-127]+. Стадия 5. Йодид (1 Н-индазол-3-илметил)трифенилфосфония (3,20 г, 6,15 ммоль), полученный на стадии 4,растворяют в метаноле (60 мл) и к раствору добавляют метил п-формилбензоат (1,00 г, 6,09 ммоль) и карбонат калия (2,55 г, 18,5 ммоль) с последующим перемешиванием при комнатной температуре в течение ночи. К реакционной смеси добавляют воду и экстрагируют этилацетатом, затем органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Остаток очищают тонкослойной хроматографией (хлороформ/метанол=15/1), допонительно растирают в смешанном растворителе этилацетат/диизопропиловый простой эфир, получая метил (Е)-4-[2-(1 Н-индазол-3-ил)винил]бензоат (0,87 г, 51%). 1TOF-MC (m/z); 279 [М+1]+. Стадия 6. Метил (Е)-4-[2-(1 Н-индазол-3-ил)винил]бензоат (0,71 г, 2,54 ммоль), полученный на стадии 5,растворяют в метаноле (2,6 мл) и к раствору добавляют водный раствор гидроксида натрия (1 моль/л,5,00 мл) с последующим кипячением с обратным холодильником в течение 1,5 ч. Метанол выпаривают при пониженном давлении, рН остатка доводят до 3 или ниже 6 моль/л хлороводородной кислотой при охлаждении льдом. Полученный осадок выделяют фильтрованием, получая (Е)-4-[2-(1 Н-индазол-3- 19010165 ил)винил]бензойную кислоту (0,70 г, количественный выход). 1TOF-MC (m/z); 265 [М+1]+. Стадия 7. Смесь раствора (Е)-4-[2-(1 Н-индазол-3-ил)винил]бензойной кислоты, полученной на стадии 6, в ТГФ (0,125 моль/л, 0,40 мл, 0,05 ммоль), раствора диметиламина в ТГФ (1 моль/л, 0,08 мл, 0,08 ммоль),раствора 1-гидроксибензотриазола в ТГФ (0,33 моль/л, 0,20 мл, 0,07 ммоль) и связанного с полимером 1-этил-3-(3-диметиламинопропил)карбодиимида (1 моль/г, 0,07 г, 0,07 ммоль) взбалтывают при комнатной температуре в течение ночи. Реакционную смесь фильтруют, растворитель выпаривают вдуванием воздуха в фильтрат и к остатку добавляют ТГФ (0,6 мл), поливинилпиридин (0,03 г, 0,29 ммоль) и 4-хлорформил-полистирол (3,5 моль/г, 0,03 г, 0,11 ммоль) с последующим взбалтыванием при комнатной температуре в течение ночи. Реакционную смесь фильтруют и растворитель выпаривают вдуванием воздуха в фильтрат. К остатку добавляют этанол (0,5 мл) и ионообменную смолу [Bio-Rad AG (зарегистрированный товарный знак) 1 Х-8 ОН форма, 0,15 г] с последующим взбалтыванием в течение 10 мин. Смесь фильтруют, смолу промывают этанолом и адсорбированное вещество элюируют 4 моль/л раствором хлороводорода в этилацетате. Растворитель выпаривают вдуванием воздуха в элюат, остаток очищают тонкослойной хроматографией (хлороформ/метанол=9/1), получая соединение 1 (0,4 мг, 3%).TOF-MC (m/z); 292 [М+1]+. Пример 2. (Е)-N-(3-Метилбутил)-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 2). Подобно стадии 7 примера 1 получают соединение 2 (1,2 мг, 7%), используя раствор (Е)-4-[2-(1 Ниндазол-3-ил)винил]бензойной кислоты, полученной на стадии 6 примера 1, в ТГФ (0,125 моль/л,0,40 мл, 0,05 ммоль) и раствор изоамиламина в ТГФ (1 моль/л, 0,08 мл, 0,08 ммоль).(Е)-4-[2-(1 Н-индазол-3-ил)винил]бензойной кислоты, полученной на стадии 6 примера 1, в ТГФ(Е)-4-[2-(1 Н-индазол-3-ил)винил]бензойной кислоты, полученной на стадии 6 примера 1, в ТГФ(Е)-4-[2-(1 Н-Индазол-3-ил)винил]бензойную кислоту (0,18 г, 0,67 ммоль), полученную на стадии 6 примера 1, растворяют в ТГФ (4 мл) и к раствору добавляют N-(2-метоксиэтил)метиламин(0,11 мл, 1,00 ммоль), моногидрат 1-гидроксибензотриазола (0,12 г, 0,85 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г, 0,92 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч. К реакционной смеси добавляют насыщенный водный раствор гидрокарбоната натрия, экстрагируют этилацетатом, органический слой последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния и растворитель выпаривают при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле (хлороформ/метанол=25/1), получая соединение 5 (0,22 г, 99%). 1 Н-ЯМР (270 МГц, ДМСО-d6)2,97 (с, 3 Н), 3,20 (ушир.м, 2 Н), 3,31 (с, 3 Н), 3,50 (ушир.м, 2 Н), 7,20TOF-MC (m/z); 336 [М+1]+. Пример 6. (Е)-N-(2-Диметиламиноэтил)-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 6). Подобно примеру 5 получают соединение 6 (0,06 г, 42%), используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,12 г, 0,40 ммоль), полученную на стадии 6 примера 1,N,N-диметилэтилендиамин (0,07 мл, 0,60 ммоль), моногидрат 1-гидроксибензотриазола (0,07 г,0,52 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,11 г, 0,57 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)2,18 (с, 6 Н), 2,40 (т, J=6,6 Гц, 2 Н), 3,31 (м, 2 Н), 7,21 (дд, J=7,3,7,9 Гц, 1 Н), 7,39 (дд, J=7,3, 7,9 Гц, 1 Н), 7,55 (д, J=7,9 Гц, 1 Н), 7,56 (д, J=16,8 Гц, 1 Н), 7,65 (д, J=16,8 Гц,1 Н), 7,79 (д, J=8,3 Гц, 2 Н), 7,85 (д, J=8,3 Гц, 2 Н), 8,20 (д, J=7,9 Гц, 1 Н), 8,38 (ушир.м, 1 Н), 13,2 (ушир.с,1 Н).(соединение 7). Стадия 1. К раствору 4-гидрокси-3-нитробензальдегида (6,37 г, 38,1 ммоль) в ДМФА (10,0 мл) добавляют карбонат калия (15,8 г, 114 ммоль) и гидрохлорид 2-(N-морфолино)этилхлорида (7,09 г, 38,1 ммоль) с последующим перемешиванием при 80 С в течение 7 ч. После охлаждения до комнатной температуры к реакционной смеси добавляют воду (40 мл), экстрагируют этилацетатом (100 мл X 4), органический слой сушат над безводным сульфатом натрия, обрабатывают 4 моль/л раствором хлороводорода в этилацетате, получая гидрохлорид 4-(2-морфолиноэтокси)-3-нитробензальдегида (6,07 г, 50%). 1 Н-ЯМР (270 МГц, ДМСО-d6)3,24-4,00 (м, 10 Н), 4,78 (т, J=4,7 Гц, 2 Н), 7,62 (д, J=8,8 Гц, 1 Н), 8,22APCI-MC (m/z); 281 [М+Н]+. Стадия 2. К раствору гидрохлорида 4-(2-морфолиноэтокси)-3-нитробензальдегида, полученного на стадии 1,(2,97 г, 9,38 ммоль) в дихлорметане (10,0 мл) добавляют триметилортоформиат (15,0 мл, 13,7 ммоль) и 10% раствор хлороводорода в метаноле (5,00 мл) с последующим перемешиванием при комнатной температуре в течение 4 ч. К реакционной смеси добавляют карбонат калия (10,0 г, 72,4 ммоль), затем перемешивают при комнатной температуре в течение 5 ч и растворитель выпаривают при пониженном давлении. К остатку добавляют воду (50 мл) и экстрагируют этилацетатом (50 мл X 3). После сушки над безводным сульфатом натрия растворитель выпаривают при пониженном давлении, получая 4-диметоксиметил-1-(2-морфолиноэтокси)-2-нитробензол (2,98 г, 97%). 1 Н-ЯМР (300 МГц, CDCl3)2,60 (ушир.т, J=4,7 Гц, 4 Н), 2,85 (т, J=5,6 Гц, 2 Н), 3,32 (с, 6 Н), 3,71ESI-MC (m/z); 327 [М+Н]+. Стадия 3. К раствору 4-диметоксиметил-1-(2-морфолиноэтокси)-2-нитробензола, полученного на стадии 2,(2,97 г, 9,10 ммоль) в этаноле (30,0 мл) добавляют оксид платины (0,02 г, 0,10 ммоль) с последующим перемешиванием при комнатной температуре в атмосфере водорода в течение 2 ч. Реакционную смесь фильтруют, растворитель из фильтрата выпаривают при пониженном давлении, полученный сырой продукт кристаллизуют из смешанного растворителя этилацетат/гексан (1/1), получая 5-диметоксиметил-2-(2-морфолиноэтокси)анилин (0,70 г, 26%). 1 Н-ЯМР (300 МГц, CDCl3)2,57 (ушир.т, J=4,7 Гц, 4 Н), 2,78 (т, J=5,7 Гц, 2 Н), 3,30 (с, 6 Н), 3,72ESI-MC (m/z); 297 [М+Н]+. Стадия 4. К раствору 5-диметоксиметил-2-(2-морфолиноэтокси)анилина, полученного на стадии 3, (0,27 г,0,91 ммоль) в дихлорметане (2,00 мл) добавляют метансульфонилхлорид (0,11 мл, 1,42 ммоль) и пиридин(0,50 мл, 6,18 ммоль) с последующим перемешиванием при комнатной температуре в течение 10 ч. В реакционную смесь добавляют хлороводородную кислоту (3 моль/л, 3,00 мл), перемешивают при комнатной температуре в течение 20 мин, нейтрализуют насыщенным водным раствором гидрокарбоната натрия (50 мл) и экстрагируют этилацетатом (50 мл X 3). Органический слой сушат над безводным сульфатом натрия, растворитель выпаривают при пониженном давлении. Сырой продукт очищают колоночной хроматографией на силикагеле (хлороформ, затем метанол/хлороформ=1/6), получая 3-метансульфониламино-4-(2-морфолиноэтокси)бензальдегид (0,28 г, 95%). 1 Н-ЯМР (300 МГц, CDCl3)2,56 (ушир.т, J=4,6 Гц, 4H), 2,70 (т, J=5,5 Гц, 2 Н), 2,99 (с, 3 Н), 3,80ESI-MC (m/z); 327 [М-Н]-. Стадия 5. К раствору 3-метансульфониламино-4-(2-морфолиноэтокси)бензальдегида, полученного на стадии 4, (0,27 г, 0,83 ммоль), в ДМФА (5,0 мл) добавляют йодид (1 Н-индазол-3-илметил)трифенилфосфония,полученный на стадии 4 примера 1, (0,40 г, 0,77 ммоль) и карбонат калия (0,23 г, 1,66 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч и дополнительным перемешиванием при 60 С в течение 11 ч. После охлаждения до комнатной температуры растворитель выпаривают при пониженном давлении, сырой продукт очищают хроматографией на силикагеле [аминомодифицированный химически связанный силикагель Chromatorex (зарегистрированный товарный знак)(4,30 мл, 83,5 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч. В реакционную смесь добавляют воду (100 мл) и растворитель из органического слоя выпаривают при пониженном давлении, получая 3-бром-4-гидроксибензальдегид в виде бледно-желтого твердого вещества(10,9 г, 49%), используя 3-бром-4-гидроксибензальдегид, полученный на стадии 1, (14,3 г, 71,0 ммоль),карбонат калия (20,0 г, 145 ммоль) и гидрохлорид 2-(N-морфолино)этилхлорида (13,5 г, 72,6 ммоль). 1 Н-ЯМР (270 МГц, CDCl3)2,65 (ушир.т, J=4,7 Гц, 4 Н), 2,91 (т, J=5,6 Гц, 2 Н), 3,73 (ушир.т,J=4,7 Гц, 4 Н), 4,26 (т, J=5,6 Гц, 2 Н), 7,00 (д, J=8,4 Гц, 1 Н), 7,80 (дд, J=2,0, 8,4 Гц, 1 Н), 8,08 (д, J=2,0 Гц,1 Н), 9,84 (с, 1 Н).(4,57 г, 98%), используя гидрохлорид 3-бром-4-(2-морфолиноэтокси)бензальдегида, полученный на стадии 2, (4,08 г, 13,0 ммоль), триметил ортоформиат (20,0 мл, 18,3 ммоль) и 10% раствор хлороводорода в метаноле (10 мл). 1 Н-ЯМР (300 МГц, CDCl3)2,60 (ушир.т, J=4,7 Гц, 4 Н), 2,85 (т, J=5,6 Гц, 2 Н), 3,32 (с, 6 Н), 3,71ESI-MC (m/z); 327 [М+Н]+. Стадия 4. Раствор 1-бром-5-диметоксиметил-2-(2-морфолиноэтокси)бензола (3,11 г, 8,63 ммоль), полученного на стадии 3, в ТГФ (40,0 мл) охлаждают до -78 С, к нему добавляют н-бутиллитий (1,60 моль/л, 20,0 мл,32,0 ммоль) по каплям в течение 3 мин с последующим перемешиванием при -78 С в течение 5 мин. В реакционную смесь добавляют сухой лед и перемешивают в течение 3 ч, пока она нагревается до комнатной температуры. Растворитель из реакционной смеси выпаривают при пониженном давлении. К остатку добавляют 1 моль/л водный раствор ацетата аммония (30 мл), очищают хроматографией на колонке НР-20 (вода, затем ацетонитрил/вода=2/1), затем кристаллизуют из смешанного растворителя этилацетат/гексан (1/1), получая 5-диметоксиметил-2-(2-морфолиноэтокси)бензойную кислоту (0,58 г, 21%). 1ESI-MC (m/z); 362 [М+Н]+. Стадия 5. К раствору 5-диметоксиметил-2-(2-морфолиноэтокси)бензойной кислоты (0,40 г, 1,23 ммоль), полученной на стадии 4, в ДМФА (5,00 мл) добавляют аммониевую соль 1-гидроксибензотриазола (0,30 г,1,97 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,35 г, 1,84 ммоль) с последующим перемешиванием при комнатной температуре в течение 35 ч. Растворитель из реакционной смеси выпаривают при пониженном давлении и к остатку добавляют хлороводородную кислоту (3 моль/л,3,00 мл) с последующим перемешиванием при комнатной температуре в течение 1 ч. Реакционную смесь нейтрализуют насыщенным водным раствором гидрокарбоната натрия (50 мл) и экстрагируют этилацетатом (50 мл X 3). После сушки над безводным сульфатом натрия растворитель выпаривают при пониженном давлении, получая 5-формил-2-(2-морфолиноэтокси)бензамид (0,25 г, 73%). 1 Н-ЯМР (300 МГц, CDCl3)2,55 (ушир.т, J=4,7 Гц, 4 Н), 2,87 (т, J=5,4 Гц, 2 Н), 3,71 (ушир.т,J=4,7 Гц, 4 Н), 4,32 (т, J=5,4 Гц, 2 Н), 5,80 (ушир.с, 1 Н), 7,10 (д, J=8,6 Гц, 1 Н), 8,04 (дд, J=2,2, 8,6 Гц, 1 Н),8,50 (ушир.с, 1 Н), 8,71 (д, J=2,2 Гц, 1 Н), 9,98 (с, 1 Н).ESI-MC (m/z); 279 [М+Н]+. Стадия 6. Подобно стадии 5 примера 7 соединение 8 (0,13 г, 46%) получают, используя 5-формил-2-(2-морфолиноэтокси)бензамид (0,20 г, 0,72 ммоль), полученный на стадии 5, йодид(1 Н-индазол-3-илметил)трифенилфосфония (0,38 г, 0,72 ммоль), полученный на стадии 4 примера 1, и карбонат калия (0,20 г, 1,45 ммоль).ESI-MC (m/z); 393 [М+Н]+. Пример 9. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоилморфолин (соединение 9). Подобно примеру 5 соединение 9 (2,65 г, 84%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (2,50 г, 9,47 ммоль), полученную на стадии 6 примера 1, морфолинESI-MC (m/z); 334 [М+Н]+. Пример 10. (Е)-N-(2-Морфолиноэтил)-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 10). Подобно примеру 5 соединение 10 (0,24 г, 55%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,30 г, 1,14 ммоль), полученную на стадии 6 примера 1,2-морфолиноэтиламин (0,22 мл, 1,71 ммоль), моногидрат 1-гидроксибензотриазола (0,20 г, 1,31 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,31 г, 1,62 ммоль). 1 Н-ЯМР (270 МГц, CDCl3)2,54 (ушир.т, J=4,6 Гц, 4 Н), 2,64 (т, J=6,0 Гц, 2 Н), 3,59 (кв., J=5,5 Гц,2 Н), 3,76 (ушир.т, J=4,8 Гц, 4 Н), 6,92 (ушир.м, 1 Н), 7,26 (т, J=6,6 Гц, 1 Н), 7,43 (т, J=7,3 Гц, 2 Н), 7,51 (д,J=8,4 Гц, 2 Н), 7,63 (д, J=8,4 Гц, 2 Н), 7,79 (д, J=8,4 Гц, 2 Н), 8,04 (д, J=8,1 Гц, 1 Н).ESI-MC (m/z); 377 [М+Н]+. Пример 11. (Е)-N-[2-(Ацетиламино)этил]-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 11). Подобно примеру 5 соединение 11 (0,30 г, 64%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,35 г, 1,33 ммоль), полученную на стадии 6 примера 1,N-ацетилэтилендиамин (0,41 мл, 4,01 ммоль), моногидрат 1-гидроксибензотриазола (0,23 г, 1,51 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,36 г, 1,62 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,81 (с, 3 Н), 3,19-3,31 (м, 4 Н), 7,21 (т, J=7,5 Гц, 1 Н), 7,39 (т,J=7,3 Гц, 1 Н), 7,52-7,88 (м, 4 Н), 7,98 (ушир.м, 1 Н), 8,20 (д, J=8,1 Гц, 1 Н), 8,51 (ушир.т, J=8,1 Гц, 1 Н), 13,3ESI-MC (m/z); 349 [M+H]+. Пример 12. (E)-N-Метил-5-[2-(1 Н-индазол-3-ил)винил]-2-(2-морфолиноэтокси)бензамид (соединение 12). Стадия 1. Подобно примеру 5 N-метил-5-диметоксиметил-2-(2-морфолиноэтил)бензамид (0,16 г, 94%) получают, используя 5-диметоксиметил-2-(2-морфолиноэтокси)бензойную кислоту (0,19 г, 0,59 ммоль), полученную на стадии 4 примера 8, гидрохлорид метиламина (0,08 г, 1,18 ммоль), моногидрат 1-гидроксибензотриазола (0,13 г, 0,85 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,18 г, 1,17 ммоль). 1 Н-ЯМР (300 МГц, CDCl3)2,56 (ушир.т, J=4,6 Гц, 4 Н), 2,88 (т, J=5,4 Гц, 2 Н), 3,05 (д, J=4,8 Гц, 3 Н),3,75 (ушир.т, J=4,6 Гц, 4 Н), 4,32 (т, J=5,4 Гц, 2 Н), 7,07 (д, J=8,6 Гц, 1 Н), 7,99 (дд, J=2,2, 8,6 Гц, 1 Н), 8,43N-метил-5-диметоксиметил-2-(2-морфолиноэтил)бензамид (0,16 г, 0,54 ммоль), полученный на стадии 1,йодид (1 Н-индазол-3-илметил)трифенилфосфония (0,13 г, 0,85 ммоль), полученный на стадии 4 примера 1, и карбонат калия (0,08 г, 1,18 ммоль). 1APCI-MC (m/z); 407 [М+Н]+. Пример 13. (Е)-4-Ацетил-1-4-[2-(1 Н-индазол-3-ил)винил]бензоилпиперазин (соединение 13). Подобно примеру 5 соединение 13 (0,69 г, 98%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,4-ацетилпиперазин (0,73 г, 5,67 ммоль), моногидрат 1-гидроксибензотриазола (0,33 г, 2,17 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,51 г, 2,66 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,81 (с, 3 Н), 3,42-3,63 (ушир.м, 8 Н), 7,22 (т, J=7,2 Гц, 1 Н), 7,41 (т,J=7,2 Гц, 1 Н), 7,45 (д, J=8,3 Гц, 2 Н), 7,52-7,68 (м, 3 Н), 7,80 (д, J=8,2 Гц, 2 Н), 8,21 (д, J=8,2 Гц, 1 Н), 13,2ESI-MC (m/z); 375 [М+Н]+. Пример 14. (Е)-N-Метил-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 14). Подобно примеру 5 соединение 14 (0,12 г, 55%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,20 г, 0,76 ммоль), полученную на стадии 6 примера 1, гидрохлорид метиламина (0,08 г, 1,19 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,20 г,1,06 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)2,79 (д, J=4,4 Гц, 3 Н), 7,21 (т, J=7,2 Гц, 1 Н), 7,40 (т, J=7,2 Гц, 1 Н),7,50-7,88 (м, 7 Н), 8,20 (д, J=8,1 Гц, 1 Н), 8,42 (ушир.м, 1 Н), 13,2 (ушир., 1 Н).ESI-MC (m/z); 278 [М+Н]+. Пример 15. Гидрохлорид (Е)-N,N-диэтил-4-[2-(1H-индазол-3-ил)винил]бензамида (соединение 15). Подобно примеру 5 свободное основание соединения 15 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1, диэтиламин(0,29 мл, 2,80 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,51 г,2,67 ммоль). Затем свободное основание соединения 15 растворяют в уксусной кислоте (5 мл) и добавляют 4 моль/л раствор хлороводорода в этилацетате (1,00 мл), сопровождая перемешиванием при комнатной температуре в течение 30 мин. Полученный осадок выделяют фильтрованием, получая соединение 15 (0,11 г, 18%). 1(соединение 16). Подобно примеру 5 свободное основание соединения 16 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,1,4-диокса-8-азаспиро[4,5]декан(0,36 мл,2,81 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,51 г, 2,67 ммоль) и затем свободное основание соединения 16 обрабатывают 4 моль/л раствором хлороводорода в этилацетате, получая соединение 16ESI-MC (m/z); 390 [М+Н]+. Пример 17. 1,1-Диметилэтиловый эфир (Е)-4-4-[2-(1 Н-индазол-3-ил)винил]бензоилпиперазин-1 карбоновой кислоты (соединение 17). Подобно примеру 5 соединение 17 (0,27 г, 33%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,4-(трет-бутоксикарбонил)пиперазин (0,53 г, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (0,33 г,2,17 ммоль) и гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (0,51 г, 2,66 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,41 (с, 9 Н), 3,23-3,57 (ушир.м, 8 Н), 7,20 (т, J=7,2 Гц, 1 Н), 7,39 (т,J=7,2 Гц, 1 Н), 7,42 (д, J=8,3 Гц, 2 Н), 7,53 (д, J=16,7 Гц, 1 Н), 7,55 (д, J=8,2 Гц, 1 Н), 7,63 (д, J=16,7 Гц, 1 Н),7,78 (д, J=8,2 Гц, 2 Н), 8,19 (д, J=8,2 Гц, 1 Н), 13,2 (ушир.с, 1 Н).ESI-MC (m/z); 431 [М-Н]Пример 18. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоилпиперазин (соединение 18). Стадия 1. К раствору соединения 17 (0,27 г, 0,62 ммоль) в метаноле (2 мл) добавляют 10% раствор хлороводорода в метаноле (2 мл) с последующим перемешиванием при 60 С в течение 30 мин. После охлаждения до комнатной температуры метанол выпаривают, получая дигидрохлорид соединения 18 (0,21 г,74%). Стадия 2. К дигидрохлориду соединения 18 (0,10 г), полученному на стадии 1, добавляют хлороформ (20 мл) и насыщенный водный раствор гидрокарбоната натрия (20 мл) с последующим перемешиванием при комнатной температуре в течение 1 ч, затем реакционную смесь экстрагируют хлороформом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Затем остаток подвергают перекристаллизации из этилацетата, полученные кристаллы промывают смешанным растворителем этилацетат/гексан (1:1), получая соединение 18 (0,022 г, 27%). 1 Н-ЯМР (270 МГц, CDCl3)2,78-3,02 (м, 4 Н), 3,32-3,89 (м, 4 Н), 7,20-7,52 (м, 7 Н), 7,60 (д, J=8,4 Гц,2 Н), 8,03 (д, J=8,1 Гц, 1 Н), 10,8 (ушир.с, 1 Н).ESI-MC (m/z); 361 [М+Н]+. Пример 20. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-метилпиперидин (соединение 20). Подобно примеру 5 соединение 20 (160 мг, 25%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1, 4-метилпиперидинESI-MC (m/z); 346 [М+Н]+. Пример 21. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-метилпиперазин (соединение 21). Подобно примеру 5 соединение 21 (230 мг, 35%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1, N-метилпиперазинESI-MC (m/z); 347 [М+Н]+. Пример 22. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(2-пиримидинил)пиперазин (соединение 22). Подобно примеру 5 соединение 22 (56,0 мг, 7%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,N-(2-пиримидинил)пиперазин (674 мг, 2,84 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и N-метилморфолин (0,41 мл, 3,73 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)3,45-3,56 (ушир.м, 4 Н), 3,75-3,84 (ушир.м, 4 Н), 6,66 (т, J=7,8 Гц,1 Н), 7,21 (дт, J=7,9, 0,8 Гц, 1 Н), 7,40 (дт, J=7,3, 0,8 Гц, 1 Н), 7,45-7,57 (м, 4 Н), 7,66 (д, J=16,7 Гц, 1 Н), 7,79ESI-MC (m/z); 411 [М+Н]+. Пример 23. (Е)-4-(2-Фуроил)-1-4-[2-(1 Н-индазол-3-ил)винил]бензоилпиперазин (соединение 23). Подобно примеру 5 соединение 23 (436 мг, 53%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,N-(2-фуроил)пиперазинESI-MC (m/z); 427 [М+Н]+. Пример 24. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-фенил-1,2,3,6-тетрагидропиридин (соединение 24). Подобно примеру 5 соединение 24 (98,9 мг, 12%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1, гидрохлорид 4 фенил-1,2,3,6-тетрагидропиридинаESI-MC (m/z); 406 [М+Н]+. Пример 25. (Е)-N-[2-(2-Пиридил)этил]-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 25). Подобно примеру 5 соединение 25 (238 мг, 34%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,8 9 ммоль), полученную на стадии 6 примера 1,2-(2-аминоэтил)пиридинESI-MC (m/z); 369 [М+Н]+. Пример 26. Гидрохлорид (Е)-4-[2-(1 Н-индазол-3-ил)винил]-N-[3-(2-оксопирролидин-1-ил)пропил]бензамида (соединение 26). Подобно примеру 5 свободное основание соединения 26 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,1-(3-аминопропил)-2-пирролидинон(0,27 мл,1,93 ммоль),гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и N-метилморфолин (0,42 мл, 3,82 ммоль), затем свободное основание соединения 26 растворяют в уксусной кислоте (5,00 мл) и добавляют 4 моль/л раствор хлороводорода в этилацетате (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 26 (124 мг, 15%). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,70 (quin, J=6,9 Гц, 2 Н), 1,93 (quin, J=7,6 Гц, 2 Н), 2,22 (т, J=8,1 Гц,2 Н), 3,23 (ушир.т, J=7,0 Гц, 4 Н), 3,35 (т, J=7,0 Гц, 2 Н), 7,21 (дт, J=7,9, 0,8 Гц, 1 Н), 7,39 (дт, J=8,2, 1,3 Гц,1 Н), 7,51-7,57 (м, 3 Н), 7,67 (д, J=16,7 Гц, 1H), 7,71-7,88 (м, 4H), 8,19 (д, J=8,1 Гц, 1 Н), 8,50 (ушир., 1 Н).APCI-MC (m/z); 314 [М+Н]+. Пример 28. Гидрохлорид (Е)-N-3-[2-(1H-индазол-3-ил)винил]фенилбензолсульфонамида (соединение 28). Подобно стадии 5 примера 1 свободное основание соединения 28 получают, используя йодид(500 мг, 1,91 ммоль) и карбонат калия (528 мг, 3,82 ммоль), и затем свободное основание соединения 28 обрабатывают 4 моль/л раствором хлороводорода в этилацетате, получая соединение 28 (85,3 мг, 12%) подобно примеру 15. 1APCI-MC (m/z); 376 [М+Н]+. Пример 29. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(этоксикарбонилметил)пиперазин (соединение 29). Подобно примеру 5 соединение 29 (86,7 мг, 11%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,1-(этоксикарбонилметил)пиперазин (490 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и(соединение 30). Подобно примеру 5 соединение 30 (363 мг, 42%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,1-(этоксикарбонилметил)пиперазин (606 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) иAPCI-MC (m/z); 460 [М+Н]+. Пример 31. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(бензо[1,3]диоксол-5-ил)метилпиперазин (соединение 31). Подобно примеру 5 соединение 31 (246 мг, 28%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,4-(бензо[1,3]диоксол-5-ил)метилпиперазин (626 мг, 2,85 ммоль), гидрохлорид 1-этил-3-(3- 26010165 диметиламинопропил)карбодиимида (510 мг, 2,66 ммоль) и N-метилморфолин (0,42 мл, 3,82 ммоль). 1 Н-ЯМР (270 МГц, ДМСО-d6)2,48-2,49 (м, 4 Н), 3,41 (ушир., 6 Н), 5,98 (с, 2 Н), 6,82-6,86 (м, 2 Н),7,22 (д, J=7,4 Гц, 1 Н), 7,36-7,41 (м, 4 Н), 7,54 (д, J=6,8 Гц, 1H), 7,56 (д, J=16,8 Гц, 1 Н), 7,62 (д, J=16,8 Гц,1 Н), 7,76 (д, J=8,4 Гц, 2 Н), 8,19 (д, J=7,4 Гц, 1 Н), 13,2 (ушир., 1 Н).APCI-MC (m/z); 467 [М+Н]+. Пример 32. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-этоксикарбонилпиперазин (соединение 32). Подобно примеру 5 соединение 32 (346 мг, 45%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль) полученную на стадии 6 примера 1, этиловый сложный эфир 1-пиперазинкарбоновой кислоты (0,42 мл, 2,84 ммоль), моногидрат 1-гидроксибензотриазолаESI-MC (m/z); 405 [М+Н]+. Пример 33. Гидрохлорид (Е)-1-4-[2-(1 Н-индазол-3-ил)винил]бензоил-4-метоксипиперидина (соединение 33). Подобно примеру 5 свободное основание соединения 33 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (0,30 г, 1,14 ммоль), полученную на стадии 6 примера 1,4-метоксипиперидин (200 мг, 1,71 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида(305 мг, 1,60 ммоль) и N-метилморфолин (0,3 мл, 32,28 ммоль), и затем свободное основание соединения 33 растворяют в этилацетате (5,00 мл) и добавляют 4 моль/л раствор хлороводорода в диоксане (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 33 (45,7 мг, 10%). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,43 (ушир., 2 Н), 1,83-1,90 (м, 2 Н), 3,26 (с, 3 Н), 3,40-3,47 (м, 1 Н),4,64 (ушир., 4 Н), 7,20 (д, J=8,1 Гц, 1 Н), 7,36-7,41 (м, 1 Н), 7,39 (д, J=8,1 Гц, 2 Н), 7,52 (д, J=16,6 Гц, 1 Н),7,57 (д, J=8,1 Гц, 1 Н), 7,62 (д, J=16,6 Гц, 1 Н), 7,76 (д, J=8,1 Гц, 2 Н), 8,19 (д, J=8,1 Гц, 1 Н).(Е)-1-4-[2-(1H-индазол-3-ил)винил]бензоил-4-метансульфонилпиперидина (соединение 34). Подобно примеру 5 свободное основание соединения 34 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (0,40 г, 1,52 ммоль), полученную на стадии 6 примера 1,4-метансульфонилпиперидин(469 мг,2,35 ммоль),гидрохлорид 1-этил-3-(3 диметиламинопропил)карбодиимида (410 мг, 2,13 ммоль) и N-метилморфолин (0,34 мл, 3,03 ммоль), и затем свободное основание соединения 34 растворяют в этилацетате (5,00 мл) и добавляют 4 моль/л раствор хлороводорода в этилацетате (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 34 (8,2 мг, 1,2%). 1 Н-ЯМР (270 МГц, ДМСО-d6)1,16 (ушир., 2 Н), 3,37 (ушир., 6 Н), 3,82 (с, 3 Н), 3,91 (ушир., 1 Н),7,22 (д, J=8,2 Гц, 1 Н), 7,31-7,43 (м, 1 Н), 7,33 (д, J=8,2 Гц, 2 Н), 7,57 (д, J=16,6 Гц, 1 Н), 7,71 (д, J=16,6 Гц,1 Н), 7,83 (д, J=8,2 Гц, 1 Н), 7,96 (д, J=8,2 Гц, 2 Н), 8,21 (д, J=8,2 Гц, 1 Н).(соединение 35). Подобно примеру 5 свободное основание соединения 35 получают, используя (Е)-4-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (0,50 г, 1,89 ммоль), полученную на стадии 6 примера 1,2-пиридилпиперазин (671 мг, 2,84 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида(510 мг, 2,67 ммоль) и N-метилморфолин (0,84 мл, 7,64 ммоль), и затем свободное основание соединения 35 растворяют в уксусной кислоте (5,00 мл) и добавляют 4 моль/л раствор хлороводорода в этилацетате(1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 35 (190 мг, 23%). 1APCI-MC (m/z); 410 [М+Н]+. Пример 36. Гидрохлорид (Е)-4-ацетил-1-3-[2-(1H-индазол-3-ил)винил]бензоилпиперазина (соединение 36). Подобно примеру 5 свободное основание соединения 36 получают, используя (Е)-3-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную подобно стадии 6 примера 1,N-ацетилпиперазин (490 мг, 3,82 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль),гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,66 ммоль) и N-метилморфолин(0,42 мл, 3,82 ммоль), и затем свободное основание соединения 36 растворяют в этилацетате (5,00 мл) и- 27010165 добавляют 4 моль/л раствор хлороводорода в этилацетате (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 36 (491 мг, 69%). 1 Н-ЯМР (270 МГц, ДМСО-d6)2,02 (с, 3 Н), 3,51-3,61 (ушир.м, 8 Н), 7,19 (т, 1 Н, J=7,9 Гц), 7,30APCI-MC (m/z); 375 [М+Н]+. Пример 37. Гидрохлорид (Е)-4-3-[2-(1H-индазол-3-ил)винил]бензоилморфолина (соединение 37). Подобно примеру 5 свободное основание соединения 37 получают, используя (Е)-3-[2-(1 Н-индазол 3-ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную подобно стадии 6 примера 1, морфолин (0,33 мл, 3,82 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,66 ммоль) и N-метилморфолин (0,42 мл,3,82 ммоль), и затем свободное основание соединения 37 растворяют в этилацетате (5,00 мл) и добавляют 4 моль/л раствор хлороводорода в этилацетате (1,00 мл) с последующим перемешиванием при комнатной температуре в течение 30 мин. Осадок в реакционной смеси фильтруют, получая соединение 37APCI-MC (m/z); 334 [М+Н]+. Пример 38. Гидрохлорид (Е)-N-[2-(ацетиламино)этил]-3-[2-(1 Н-индазол-3-ил)винил]бензамида (соединение 38). Подобно примеру 5 соединение 38 (240 мг, 36%) получают, используя (Е)-3-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную подобно стадии 6 примера 1,N-ацетилэтилендиамин (290 мг, 3,82 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль),гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,66 ммоль) и N-метилморфолинESI-MC (m/z); 349 [М+Н]+. Пример 39. (Е)-N-(1-Ацетилпиперидин-4-ил)-4-[2-(1 Н-индазол-3-ил)винил]бензамид (соединение 39). Подобно примеру 5 соединение 39 (156 мг, 21%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1, 4-амино-1 ацетилпиперидин (507 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль),гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и N-метилморфолинESI-MC (m/z); 389 [М+Н]+. Пример 40. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(пивалоил)пиперазин (соединение 40). Подобно примеру 5 соединение 40 (74,7 мг, 10%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,N-пивалоилпиперазин (587 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль),гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и N-метилморфолинESI-MC (m/z); 417 [М+Н]+. Пример 41. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(морфолинокарбонил)пиперазин (соединение 41). Подобно примеру 5 соединение 41 (491 мг, 58%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1, гидрохлорид(Е)-1-4-[2-(1 Н-индазол-3-ил)винил]бензоил-4-(трет-бутоксикарбониламино)пиперидин (соединение 42). Подобно примеру 5 соединение 42 (242 мг, 29%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,4-(трет-бутоксикарбониламино)пиперидин (538 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазолаESI-MC (m/z); 447 [М+Н]+. Пример 43. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(ацетиламино)пиперидин (соединение 43). Подобно примеру 5 соединение 43 (283 мг, 39%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1,4-(ацетиламино)пиперидин (404 мг, 2,84 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) иESI-MC (m/z); 389 [М+Н]+. Пример 44. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(изоникотиноил)пиперазин (соединение 44). Подобно примеру 5 соединение 44 (108 мг, 13%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (477 мг, 1,81 ммоль), полученную на стадии 6 примера 1, дигидрохлорид 4-(изоникотиноил)пиперазина (617 мг, 2,71 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) иESI-MC (m/z); 438 [M+H]+. Пример 45. (E)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(никотиноил)пиперазин (соединение 45). Подобно примеру 5 соединение 45 (58,6 мг, 7%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1, гидрохлорид 4-(никотиноил)пиперазина (617 мг, 2,71 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) иESI-MC (m/z); 438 [М+Н]+. Пример 46. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-бензоилпиперазин (соединение 46). Подобно примеру 5 соединение 46 (168 мг, 20%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1, гидрохлорид 4-бензоилпиперазина (643 мг, 2,71 ммоль), моногидрат 1-гидроксибензотриазола (332 мг, 2,46 ммоль),гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и N-метилморфолинESI-MC (m/z); 437 [М+Н]+. Пример 47. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(метансульфонил)пиперазин (соединение 47). Подобно примеру 5 соединение 47 (100 мг, 13%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (500 мг, 1,89 ммоль), полученную на стадии 6 примера 1, гидрохлорид 4-(метансульфонил)пиперазина (570 мг, 2,71 ммоль), моногидрат 1-гидроксибензотриазола (332 мг,2,46 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (510 мг, 2,67 ммоль) и(Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-[(1 Н-имидазол-1-ил)карбонил]пиперазин (соединение 48). К раствору дигидрохлорида соединения 18 (400 мг, 1,09 ммоль) в ТГФ (20 мл) добавляют этиламин(177 мг, 2,18 ммоль) и 1,1'-карбонилдиимидазол (352 мг, 2,18 ммоль) с последующим перемешиванием при комнатной температуре в течение 1,5 ч. Реакционную смесь разбавляют водой и экстрагируют этилацетатом. Органический слой промывают насыщенным раствором соли и сушат над безводным сульфатом магния. Растворитель выпаривают и остаток очищают препаративной тонкослойной хроматографиейESI-MC (m/z); 427 [М+Н]+. Пример 49. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-(этоксикарбонил)пиперидин (соединение 49). Подобно примеру 5 соединение 49 (3,04 г, 59%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (3,38 г, 12,8 ммоль), полученную на стадии 6 примера 1, этилизонипекотатESI-MC (m/z); 404 [М+Н]+. Пример 50. (Е)-1-4-[2-(1 Н-Индазол-3-ил)винил]бензоил-4-карбоксипиперидин (соединение 50). Соединение 49 (1,0 г, 2,80 ммоль) растворяют в этаноле (40 мл), затем к раствору добавляют 2 моль/л водный раствор гидроксида натрия (15,0 мл) при 0 С и нагревают до комнатной температуры. После перемешивания в течение 6 ч реакционную смесь нейтрализуют 2 моль/л хлороводородной кислотой и экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют. Остаток подвергают перекристаллизации из этилацетата и метанола, получая соединение 50ESI-MC (m/z); 445 [M+H]+. Пример 52. Метил (E)-4-[2-(1 Н-Индазол-3-ил)винил]бензоиламиноацетат (соединение 52). Подобно примеру 5 соединение 52 (1,65 г, 87%) получают, используя (Е)-4-[2-(1 Н-индазол-3 ил)винил]бензойную кислоту (1,50 г, 5,68 ммоль), полученную на стадии 6 примера 1, гидрохлорид метилового сложного эфира глицина (856 мг, 6,82 ммоль), моногидрат 1-гидроксибензотриазола (1,30 г,8,52 ммоль), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (1,63 г, 8,52 ммоль) иESI-MC (m/z); 336 [М+Н]+. Пример 53. (Е)-4-[2-(1 Н-Индазол-3-ил)винил]бензоиламиноуксусная кислота (соединение 53). Соединение 52 (1,65 г, 4,93 ммоль) растворяют в ТГФ (30 мл), затем к раствору добавляют 2 моль/л водный раствор гидроксида натрия (15,0 мл) при 0 С с последующим перемешиванием при 70 С в течение 1 ч. Реакционную смесь нейтрализуют 2 моль/л хлороводородной кислотой, затем экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют. Остаток подвергают перекристаллизации из этилацетата и метанола, получая соединение 53 (662 мг, 42%). 1
МПК / Метки
МПК: A61K 31/496, A61P 35/02, C07D 413/14, C07D 491/113, C07D 401/12, A61K 31/5377, A61K 31/416, C07D 413/12, A61K 31/438, C07D 401/14, C07D 231/56
Метки: производные, индазола
Код ссылки
<a href="https://eas.patents.su/30-10165-proizvodnye-indazola.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индазола</a>
Предыдущий патент: Фармацевтическая композиция, способ её получения и применение
Следующий патент: Полиморфные формы трет-бутилового эфира аторвастатина и их использование в качестве промежуточных соединений для получения аторвастатина
Случайный патент: Сложные эфиры фениламинобензгидроксамовых кислот












