Применение производных индазола для лечения невропатической боли
Номер патента: 8144
Опубликовано: 27.04.2007
Авторы: Ализи Алессандра, Каццолла Никола, Поленцани Лоренцо, Гильельмотти Анджело
Формула / Реферат
1. Применение соединения формулы I
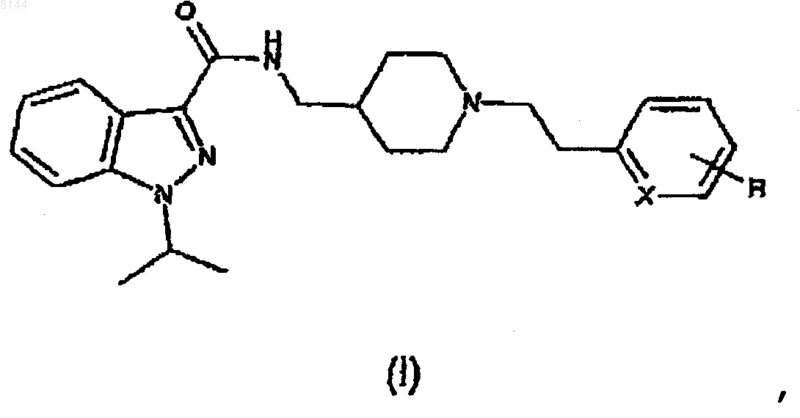
где X представляет собой СН или N, и
когда X представляет собой СН, R представляет собой Н, ОН, прямую или разветвленную алкильную цепь, имеющую от 1 до 3 атомов углерода, прямую или разветвленную алкоксицепь, имеющую от 1 до 3 атомов углерода, или атом галогена, и
когда X представляет собой N, R представляет собой Н,
или его кислотно-аддитивной соли с фармацевтически приемлемой органической или неорганической кислотой,
для получения фармацевтической композиции, активной при лечении невропатической боли.
2. Применение соединения формулы (I) по п.1, где X представляет собой СН и R представляет собой Н.
3. Применение соединения формулы (I) по п.1, где X представляет собой N и R представляет собой Н.
Текст
008144 Настоящее изобретение относится к применению соединений индазола для получения фармацевтической композиции, активной при лечении невропатической боли. Заявки на патент ЕР-А-0975623 и WO 93/03725 относятся к большому количеству соединений формулы IX представляет собой СН или N, и когда X представляет собой СН, R представляет собой Н, ОН, прямую или разветвленную алкильную цепь, имеющую от 1 до 3 атомов углерода, прямую или разветвленную алкокси-цепь, имеющую от 1 до 3 атомов углерода, или атом галогена, и когда X представляет собой N, R представляет собой Н. Далее соединения формулы (I), в которых R и X имеют указанные выше значения, будут для ясности упоминаться как соединение (I). В соответствии с указанными выше документами соединение (I) активно при лечении расстройств подвижности желудочно-кишечного тракта, недержания мочи, сердечной аритмии и расстройств центральной нервной системы, таких как расстройства памяти и тревожность. Неожиданно было обнаружено, что соединение (I) особенно активно в отношении невропатической боли. Известно, что в среднем примерно 10-20% взрослого населения страдает от хронической боли. Хроническая боль, как правило, ассоциируется с клиническими признаками, характеризуемыми хроническими и/или дегенеративными повреждениями. Типичные примеры патологических состояний, характеризуемых хронической болью, представляют собой ревматоидный артрит, остеоартрит, фибромиалгию, невропатию и т.п. [Ashburn M. А., Staats P.S., Management of chronic pain, Lancet 1999; 353: 1865-69]. Хроническая боль, в частности, невропатическая боль, часто является изнуряющей и является причиной потери работоспособности и плохого качества жизни. Как следствие, она также приводит к экономическим и социальным потерям. Анальгетические лекарственные средства, используемые в настоящее время при лечении невропатической боли, включают в себя нестероидные противовоспалительные средства (NSAID), антидепрессанты, опиодные анальгетики и антиконвульсанты [Woolf С. J., Mannion R. J. Neuropathic pain: aetiology,symptoms, mechanism, and management. Lancet 1999; 353:1959-1964]. Однако хроническая боль, и в частности, невропатическая боль, является, как известно, трудно поддающейся лечению с помощью лекарственных средств, доступных в настоящее время. Как следствие,разработка новых анальгетиков всегда являлась одной из главных целей фармацевтической промышленности. Более того, несмотря на усилия многих исследователей, направленные на идентификацию пригодных для использования анальгетических соединений, имеется значительное количество пациентов, у которых состояние боли по-прежнему удовлетворительно не лечится [Scholz J., Woolf С. J. Can we conquer pain Nat Neusci, 2002; 5: 1062-76]. Настоящее изобретение, таким образом, относится к применению соединения формулы (I) где X представляет собой СН или N, и когда X представляет собой СН, R представляет собой Н, ОН, прямую или разветвленную алкильную цепь, имеющую от 1 до 3 атомов углерода, прямую или разветвленную алкоксицепь, имеющую от 1 до 3 атомов углерода, или атом галогена, и когда X представляет собой N, R представляет собой Н,или к его кислотно-аддитивной соли с фармацевтически приемлемой органической или неорганической кислотой для получения фармацевтической композиции, активной при лечении невропатической-1 008144 боли. Типичные примеры фармацевтически приемлемых органических и неорганических кислот представляют собой щавелевую, малеиновую, метансульфоновую, паратолуолсульфоновую, янтарную, лимонную, винную, молочную, хлористоводородную, фосфорную и серную. Типичные примеры патологических состояний, характеризуемых невропатической болью, представляют собой диабет, рак, иммунодефицит, травмы, ишемию, множественный склероз, невралгию седалищного нерва, невралгию тройничного нерва и постгерпетические синдромы. Предпочтительно фармацевтические композиции согласно изобретению получают в форме соответствующих дозированных форм, содержащих эффективную дозу по меньшей мере одного соединения(I) или его кислотно-аддитивной соли с фармацевтически приемлемой органической или неорганической кислотой и по меньшей мере один фармацевтически приемлемый инертный ингредиент. Примеры подходящей дозированной формы представляют собой таблетки, капсулы, таблетки с покрытием, гранулы, растворы и сиропы для перорального введения; лекарственные пластыри, растворы,пасты, кремы и мази для трансдермального введения; суппозитории для ректального введения и стерильные растворы для введения посредством инъекций или с помощью аэрозолей. Другие подходящие дозированные формы представляют собой дозированные формы с замедленным высвобождением или дозированные формы на основе липосом для перорального введения или введения посредством инъекций. Дозированные формы могут также содержать другие обычные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества, буферы, соли для регуляции осмотического давления; эмульгаторы, подсластители, красители, ароматизаторы и т.п. Если требуется для конкретного терапевтического лечения, фармацевтическая композиция согласно изобретению может содержать другие фармакологически активные ингредиенты, одновременное введение которых является полезным. Количество соединения (I) или его кислотно-аддитивной соли с фармацевтически приемлемой кислотой в фармацевтической композиции согласно изобретению может изменяться в широких пределах, в зависимости от известных факторов, таких, например, как тип патологии, с которой ассоциируется невропатическая боль, которую нужно лечить, тяжесть заболевания, масса тела пациента, форма дозировки,выбранный способ введения, количество введений за день и эффективность выбранного соединения формулы (I). Однако оптимальное количество может определяться простым и рутинным способом специалистом в данной области. Как правило, количество соединения (I) или его кислотно-аддитивной соли с фармацевтически приемлемой кислотой в фармацевтической композиции согласно изобретению будет таким, чтобы обеспечить уровень введения от 0,001 до 100 мг/кг/день соединения (I) в качестве базового уровня. Предпочтительно уровень введения будет составлять от 0,05 до 50 мг/кг/день, а еще более предпочтительно - от 0,1 до 10 мг/кг/день. Дозированные формы фармацевтической композиции согласно изобретению будут получены с использованием технологий, хорошо известных специалисту в области фармацевтической химии, которые включают в себя смешивание, гранулирование, прессование, растворение, стерилизацию и т.п. Анальгетическую активность соединения (I) демонстрируют с помощью двух экспериментальных моделей на крысах: аллодинии, вызванной перевязыванием седалищного нерва, и механической гиперальгезии при диабетической невропатии, вызываемой стрептозотоцином. Как известно специалисту в данной области, указанные выше экспериментальные модели могут рассматриваться в качестве прогнозирующих для активности на человеке. Экспериментальная модель перевязывания седалищного нерва у крысы представляет собой невропатию, которая воспроизводит ряд реакций, подобных тем, которые наблюдаются у человека при многих травматических и патологических состояниях, ассоциируемых с невропатической болью. Перевязывание седалищного нерва на самом деле способно вызвать синдром, ассоциируемый с активированием специальных цепей, ответственных за контроль восприятия боли, и характеризуемый появлением аллодинии,гиперальгезии и спонтанной боли. Как хорошо известно, эта модель является эффективным инструментом для исследования лекарственных средств, для применения при лечении невропатической боли у человека и, в частности, при контроле таких состояний как аллодиния и гиперальгезия. В свою очередь, диабетическая невропатия, вызываемая стрептозотоцином у крыс, представляет собой инсулинозависимый синдром, характеризуемый одновременным уменьшением скорости прохождения сигнала в двигательных и сенсорных нервах и появлением ряда аномалий при восприятии боли. Как хорошо известно, эта модель является полезным инструментом при изучении лекарственных средств для применения при лечении невропатической боли у человека. В частности, модель представляет собой надежный пример большой группы типов невропатической боли, характеризуемых такими явлениями как гиперальгезия и аллодиния, вызванные первичными поражениями или дисфункциями нервной системы. Типичные примеры патологий человека, характеризуемых дисфункциями, описанными в двух экспериментальных моделях, цитируемых выше, и характеризуемых присутствием невропатической боли,-2 008144 представляют собой диабет, рак, иммунодефицит, травму, ишемию, множественный склероз, невралгию седалищного нерва, невралгию тройничного нерва и постгерпетический синдром. Исследования 1. Аллодиния, вызываемая перевязыванием седалищного нерва у крыс Используют самцов крыс CD весом 200-250 г при поступлении. Аллодиния вызывают перевязыванием под анестезией седалищного нерва левой задней лапы [Seltzer Z., Dubner R., Shir Y. A novel behavioral model of neuropathic pain disorders produced in rats by partial sciatic nerve injury. Pain 1990; 43: 205218; Bennett G. J., Xie Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation likethose seen in man. Pain 1998; 33: 87-107]. По меньшей мере через две недели после перевязывания седалищного нерва отбираются крысы, у которых порог чувствительности, зарегистрированный перед операцией, уменьшен по меньшей мере на 50%. Болевой порог измеряют посредством инструмента фон Фрея,который дает возможность при постепенном увеличении давления на плантарную зону левой задней лапы крысы регистрировать защитную реакцию, выраженную в граммах, в тот момент, когда животное высвобождает свою лапу. Через 30 мин, 1, 2 и 4 ч после лечения болевой порог, измеренный на контрольных животных, сравнивают с данными, измеренными на животных, которых лечат исследуемой гидрохлоридной солью соединения (I), где R = 4-ОН и X = СН. Контрольных животных лечат тем же носителем (водой), который используется для введения исследуемого продукта. Результаты представлены на фиг. 1. Схожие результаты получают для гидрохлоридных солей соединения (I), полученных в соответствии с примерами 2 (I, X = СН, R = Н) и 10 (I; X = N, R = Н) Европейского патента ЕР-А-0975623. 2. Механическая гиперальгезия у крыс с диабетом, вызываемым стрептозотоцином Используют самцов крыс CD весом 240-300 г при поступлении. Диабетический синдром вызывают посредством одной внутрибрюшинной (i.p.) инъекции 80 мг/кг стрептозотоцина, растворенного в стерильном физиологическом растворе [Courtsix С., Eschalier A.,Lavarenne J. Streptozotocin-induced diabetic rats: behavioral evidence for a model of chronic pain. Pain, 1993; 53: 81-88; Bannon A. W., Decker M. W., Kim Dj., Campbell J. E., Americ S. P. ABT-594, a novel cholinergicRes. 1998; 801: 158-63]. По меньшей мере через три недели после инъекции стрептозотоцина выбирают крыс с уровнем гликемии 300 мг/дл и порогом реакции 120 г на механический ноцицептивный стимул. Уровни гликемии измеряют с помощью рефлектометра, в котором используются реакционные полоски, пропитанные глюкозооксидазой. Болевой порог измеряют с помощью анальгезиметра. Это устройство дает возможность посредством приложения постепенно повышающегося давления на дорсальную зону левой задней лапы крысы регистрировать защитную реакцию, выраженную в граммах, в момент, когда животное высвобождает лапу. Через 30 мин, 1, 2 и 4 ч после лечения болевой порог, измеряемый у контрольных животных, сравнивают с данными, измеренными на животных, которых лечили исследуемой гидрохлоридной солью соединения (I), где R = 4-ОН и X = СН. Контрольных животных лечат таким же носителем (водой), который используется для введения исследуемой гидрохлоридной соли соединения (I). Результаты представлены на фиг. 2. Сходные результаты получают с гидрохлоридными солями соединений (I), полученных в соответствии с примерами 2 (I, X = СН, R = Н) и 10 (I, X = N, R = Н) Европейского патента ЕР-А-0975623. Примеры Пример 1. N-1-(2-(4-Гидроксифенил)этил)-4-пиперидинил)метил)-1-изопропил-1 Н-индазол-3 карбоксамида гидрохлорид (Соединение I; R = ОН, X = СН) Способ А) а) N-гексагидро-4-пиперидинилметил-N-фенилметилиденамин Бензальдегид (38,2 г, 0,36 моль) добавляют по каплям к раствору 4-аминометилпиперидина (41,1 г,0,36 моль) в толуоле (180 мл). Полученный таким образом раствор оставляют при комнатной температуре при перемешивании в течение 3 ч. Затем растворитель удаляют посредством выпаривания при пониженном давлении, и остаток дважды извлекают толуолом с получением желаемого продукта, который используют без дополнительной очистки.b) 1-(2-(4-гидроксифенил)этил)-4-пиперидинилметанамин Продукт, полученный на стадии 1 а) (63,2 г, 0,31 моль), растворяют в абсолютном этаноле (50 мл) и добавляют к суспензии 2-(4-гидроксифенил)этилбромида (получают, как описано в Acta Chem., Scand. 21(1) 53-62, 1967) (62,8 г, 0,31 моль) и безводного карбоната калия (64,7 г, 0,47 моль) в 150 мл абсолютного этанола. Полученную таким образом суспензию кипятят с обратным холодильником в течение 16 ч. Затем реакционной смеси дают возможность остыть до температуры окружающей среды и фильтруют. Фильтрат выпаривают при пониженном давлении. Полученный таким образом остаток суспендируют в 3N НСl (280 мл) и оставляют при температуре окружающей среды при перемешивании в течение 3 ч.-3 008144 Затем раствор переносят в разделительную воронку и кислую водную фазу промывают этилацетатом(4 х 200 мл); затем водную фазу подщелачивают, рН=12, добавляя 6N NaOH. Твердый продукт, который образуется, выделяют фильтрованием и кристаллизуют из абсолютного этанола с получением желаемого продукта (35 г). Т.пл.=166-168 С. 1 Н ЯМР (, ДМСО + D2O): 0,95-1,30 (м, 3 Н); 1,52-1,73 (м, 2 Н); 1,90 (т, J=11 Гц, 2 Н); 2,30-2,75 (м,6 Н); 2,80-2,95 (м, 2 Н); 6,65 (д, J=9 Гц, 2 Н); 6,98 (д, J=9 Гц, 2 Н).c) N-1-(2-(4-гидроксифенил)этил)-4-пиперидинил)метил)-1-изопропил-1 Н-индазол-3-карбоксамида гидрохлорид. Раствор продукта, полученного на стадии lb) (10,0 г, 0,043 моль), и триэтиламина (30 мл, 0,21 моль) в ДМФА (100 мл) добавляют по каплям к раствору хлорида 1-(1-метилэтил)-1 Н-индазол-3-карбоновой кислоты (9,5 г, 0,043 моль), полученного, как описано в Европейском патенте ЕР-А-0975623, в ДМФА(50 мл). После непрерывного перемешивания при комнатной температуре в течение 18 ч реакционную смесь переносят в разделительную воронку, добавляют H2O и экстрагируют этилацетатом (3 х 150 мл). Органическую фазу отделяют и сушат над Na2SO4. Растворитель удаляют посредством выпаривания при пониженном давлении. Полученный таким образом остаток извлекают абсолютным этанолом и преобразуют в соответствующую гидрохлоридную соль путем добавления этанольного раствора хлористого водорода. Раствор выпаривают при пониженном давлении, и остаток кристаллизуют из этанола с получением желаемого продукта (20 г). Способ В) 2-(4-Гидроксифенил)этилбромид (получают, как описано в Acta Chem. Scand. 21 (1) 53-62, 1967)(3,4 г, 0,017 моль) и безводный карбонат калия (4,6 г, 0,033 моль) в абсолютном этаноле (100 мл) добавляют к раствору N-(4-пиперидинилметил)-1-изопропил-1 Н-3-индазолкарбоксамида (4,2 г, 0,014 моль),полученного, как описано в Европейском патенте ЕР-А-0975623, в абсолютном этаноле (80 мл). Полученную таким образом суспензию непрерывно перемешивают при кипении с обратным холодильником в течение 16 ч. Суспензию фильтруют, и фильтрат выпаривают при пониженном давлении. Затем полученный таким образом остаток преобразуют в соответствующую гидрохлоридную соль путем растворения в этилацетате, добавления этанольного раствора хлористого водорода и перекристаллизации из абсолютного этанола с получением желаемого продукта (2,2 г). Т.пл.=218-220 С(д, J=8 Гц, 1 Н); 8,46 (м, 1 Н); 9,40 (с, 1 Н); 10,80 (ушир.с, 1 Н). Пример 2. Таблетка, содержащая, в качестве активного начала соединение (I) согласно изобретению, имеет следующий состав: Активное начало 50 мг Моногидрат лактозы 161 мг Дигидрат двухосновного фосфата кальция 161 мг Микрокристаллическая целлюлоза 95 мг Кукурузный крахмал 30 мг Натрийкарбоксиметилкрахмал 24 мг Повидон 11 мг Стеарат магния 3 мг Пример 3. Ампула, содержащая в качестве активного начала соединение (I) согласно изобретению, имеет следующий состав: Активное начало 25 мг Сорбит по потребности, для изоосмотического раствора Вода по потребности, до 100 мл Пример 4. Фармацевтическая композиция в гранулах, содержащая в качестве активного начала соединение (I) согласно изобретению, имеет следующий состав: Активное начало 50 мг Мальтит 1300 мг Маннит 2700 мг Сахароза 1000 мг Лимонная кислота 20 мг 1. Применение соединения формулы I где X представляет собой СН или N, и когда X представляет собой СН, R представляет собой Н, ОН, прямую или разветвленную алкильную цепь, имеющую от 1 до 3 атомов углерода, прямую или разветвленную алкоксицепь, имеющую от 1 до 3 атомов углерода, или атом галогена, и когда X представляет собой N, R представляет собой Н,или его кислотно-аддитивной соли с фармацевтически приемлемой органической или неорганической кислотой,для получения фармацевтической композиции, активной при лечении невропатической боли. 2. Применение соединения формулы (I) по п.1, где X представляет собой СН и R представляет собой Н. 3. Применение соединения формулы (I) по п.1, где X представляет собой N и R представляет собой Н. Фиг. 1 8 крыс/группу; среднеесреднеквадратичное отклонение; р 0,05 по сравнению с контролем, ANOVA с последующим тестом Дюнетта. Болевой порог нормальных животных такой же массы/возраста = 35,4 3,22 г Фиг. 2 8 крыс/группу; среднеесреднеквадратичное отклонение; р 0,05 по сравнению с контролем, ANOVA с последующим тестом Дюнетта. Болевой порог нормальных животных такой же массы/возраста = 252,56,20 г Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: A61P 25/02, A61P 29/00, A61K 31/454, A61K 31/4545
Метки: производных, лечения, применение, невропатической, боли, индазола
Код ссылки
<a href="https://eas.patents.su/6-8144-primenenie-proizvodnyh-indazola-dlya-lecheniya-nevropaticheskojj-boli.html" rel="bookmark" title="База патентов Евразийского Союза">Применение производных индазола для лечения невропатической боли</a>
Предыдущий патент: Иммуногенные композиции из вариабельных пептидных эпитопов и способ их получения
Следующий патент: Инъецируемая галеновая форма флупиртина
Случайный патент: Трициклические n-ацильные соединения










