Призводные замещенного индазола и их применение в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и фактора некроза опухоли (фно)
Формула / Реферат
1. Соединение формулы I
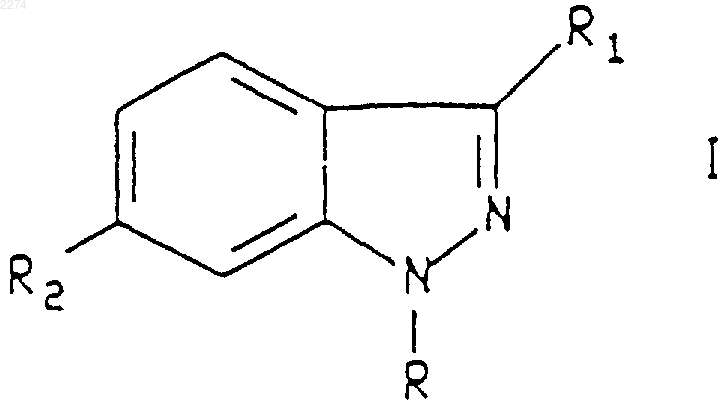
или его фармацевтически приемлемая соль,
где R представляет собой циклопентил или циклогексил;
R1 представляет собой С1-С2алкил; и
R2 представляет собой группировку, выбранную из группы, состоящей из группировок формул с (1.1) по (1.12):
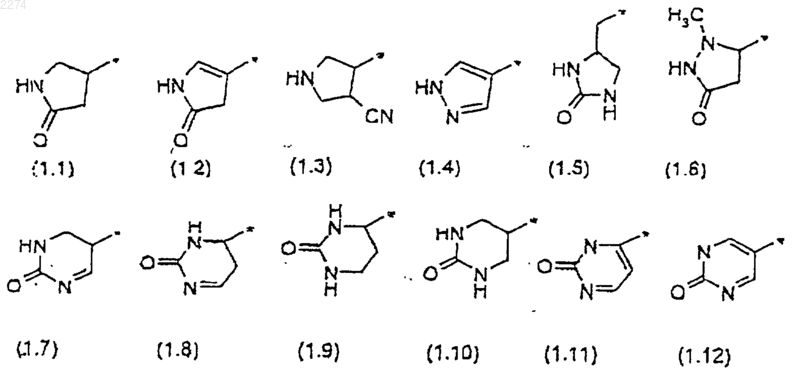
2. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.1).
3. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.10).
4. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.6).
5. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.5).
6. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.3).
7. Соединение по п.1, выбранное из группы, состоящей из
рацемического 4-(1-циклопентил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
(+)-4-(1-циклопентил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
(-)-4-(1-циклопентил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
и фармацевтически приемлемых солей указанных соединений.
8. Соединение по п.1, выбранное из группы, состоящей из
рацемического 4-(1-циклогексил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
(+)-4-(1-циклогексил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
(-)-4-(1-циклогексил-3-этил-1Н-индазол-6-ил)-пирролидин-2-она;
и фармацевтически приемлемых солей указанных соединений.
9. Соединение по п.1, в котором R представляет собой циклопентил.
10. Соединение по п.1, в котором R представляет собой циклогексил.
11. Соединение по п.1, в котором R1 представляет собой этил.
12. Фармацевтическая композиция для ингибирования фосфодиэстеразы (ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель.
13. Способ ингибирования фосфодиэстеразы (ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по п.1.
Текст
1 Изобретение относится к новым аналогам индазола. Соединения являются селективными ингибиторами фосфодиэстеразы (ФДЭ) типа IV и выработки фактора некроза опухоли (ФНО) и,как таковые, полезны при лечении астмы, артрита, бронхита, хронического обструктивного заболевания дыхательных путей, псориаза, аллергического ринита, дерматита и других воспалительных заболеваний, расстройств центральной нервной системы, таких как депрессия и мультиинфарктная деменция, СПИДа, септического шока и других заболеваний, заключающих в себе выработку ФНО. Изобретение также относится к способу применения таких соединений при лечении упомянутых выше заболеваний у млекопитающих, особенно людей, и к фармацевтическим композициям, содержащим такие соединения. С тех пор, как стало известно, что циклический аденозинфосфат (АМФ) является вторичным внутриклеточным переносчиком [E.W.Sutherland, and T.W. Rall, Pharmacol. Rev., 12,265, (1960)], ингибирование фосфодиэстераз являлось целью модулирования и, соответственно, терапевтического вмешательства в ряде патологических процессов. Недавно были определены отдельные классы ФДЭ [J.A. Beavo etal., Trends in Pharm. Sci. (TIPS), 11, 150, (1990)],и их селективное ингибирование привело к усовершенствованию лекарственной терапии [C.D.Nicholson, M.S. Hahid, TIPS. 12, 19, (1991)]. В частности, стало известно, что ингибирование ФДЭ типа IV может приводить к ингибированию высвобождения воспалительного медиатора [M.W. Verghese et al., J. Mol. Cell Cardiol., 12(Suppl. II), S 61, (1989)] и релаксации гладких мышц дыхательных путей [T.J. Torphy 'Directions for New Anti-Asthma Drugs', eds S.R.O'Donnell and C.G.A. Persson, 1988, 37 Birkhauser-Verlag]. Таким образом, соединения, которые ингибируют ФДЭ типа IV, но которые обладают низкой активностью по отношению к другим типам ФДЭ, будут ингибировать высвобождение воспалительных медиаторов и релаксировать гладкие мышцы дыхательных путей,не вызывая сердечно-сосудистых эффектов или антитромбоцитных эффектов. Было также обнаружено, что ингибиторы ФДЭ типа IV полезны при лечении несахарного диабета [Kidney Int. 37:362, 1990; Kidney Int. 35:494] и расстройств центральной нервной системы, таких как депрессия и мультиинфарктная деменция [РСТInternational Application WO 92/19594 (опубликована 12 ноября, 1992)]. Установлено, что ФНО вовлекается во многие инфекционные и аутоиммунные заболевания [W. Friers, Fed. of Euro. Bio. Soc. (FEBS)Letters, 285, 199, (1991)]. Кроме того, показано,что ФНО является первичным медиатором воспалительной реакции, наблюдаемой при сепсисе и септическом шоке [С.Е. Spooner et at., ClinicalImmunology and Immunopathology, 62, S11,(1992)]. Настоящее изобретение относится к соединениям формулы I или к его фармацевтически приемлемым солям,гдеR представляет собой Н, С 1-С 6 алкил,-(СН 2)m(С 3-С 7 циклоалкил), -(СН 2)m(С 3-С 9 гетероциклил), где m равно числу от 0 до 2, (С 1-С 6 алкокси)С 1-С 6 алкил, С 2-С 6 алкенил или -(Z1)b(Z2)c(С 6-С 10 арил), где b и с независимо равны 0 или 1, Z1 представляет собой С 1-С 6 алкилен или С 2 С 6 алкенилен, a Z2 представляет собой О, S, SO2 или NR10, и где указанные R группы возможно замещены одним или более чем одним заместителем, независимо выбранным из группы, состоящей из галогено, гидрокси, С 1-С 5 алкила, С 2 С 5 алкенила, С 1-С 5 алкокси, С 3-С 6 циклоалкокси,трифторметила, нитро, -CO2R10, -C(O)NR10R11,-NR10R11 и -SO2NR10R11;R1 представляет собой Н, С 1-С 7 алкил, С 2 С 3 алкенил, фенил, С 3-С 7 циклоалкил или (С 3 С 7 циклоалкил)С 1-С 2 алкил, где указанные алкил,алкенил и фенил группы R1 возможно замещены заместителями в количестве от 1 до 3, независимо выбранными из группы, состоящей из метила, этила, трифторметила и галогено;R2 представляет собой 2-оксо-4-пирролил,пиразолил, 2-оксо-3,4-дигидро-5-пиримидил, 2 оксо-3,4-дигидро-4-пиримидил,2-оксо-тетрагидро-4-пиримидил, 2-оксотетрагидро-5-пиримидил, 2-оксо-4-пиримидил или 2-оксо-5 пиримидил, где каждая из указанных групп R2 возможно замещена группами R6 в количестве от 1 до 4; или R2 представляет собой где, в указанных формулах (Ia)-(It), q равно 0 или 1 в формуле (Ib), n равно числу от 0 до 2 в формуле (Ic), а пунктирные линии в формулах(Ib), (Id), (Ig), (Ih), (li), (Ij) и (Io) представляют собой двойную связь или простую связь;X1 представляет собой О или S; Х 2, в формуле (Ik) и когда пунктирная линия в формуле (Ij) представляет собой двойную связь, представляет собой CR5, CR6, CR16 илиCOC(O)NR9R12 или, когда пунктирная линия в формуле (Ij) представляет собой простую связь,Х 2 представляет собой CR5R9, CR6R9 илиCR6R10; Х 4 представляет собой -(CH2)m-, где m равно числу от 0 до 2; Х 5 представляет собой связь или -СН 2-; Х 6 представляет собой -СН 2- или -С(O)-;R3 представляет собой Н, гидрокси, С 1-С 4 алкокси, -CHR7(O)q(CH2)mA, где q равно 0 или 1,а m равно числу от 0 до 2;R5 представляет собой Н, гидрокси,-(СН 2)mА, где m равно числу от 0 до 2, С 1-С 6 алкил или С 2-С 3 алканоил, где указанная алкильная группа возможно замещена заместителями в количестве от 1 до 3, независимо выбранными из галогено, нитро, -NR10R11, -CO2R10, -OR10,-OC(O)R10, -C(O)R10, циано, -C(=Y)NR10R11,-NR10C(=Y)NR10R11, -NR10C(=Y)R10,-NR10C(O)OR10, -C(NR10)NR10R11,-C(NCN)NR10R11, -C(NCN)SR10, -NR10SO2R10,-S(O)mR10, где m равно числу от 0 до 2,-NR10SO2 СF3, -NR10C(O)C(O)NR10R11,-NR10C(O)C(O)OR10, имидазолил и 1-(NНR10)-2 имидазолил; каждый R6 независимо выбран из группы,состоящей из Н, галогено, циано, R13, циклопропила, возможно замещенного R9, -OR10,-CH2OR10, -NR10R12, -CH2NR10R12, -C(O)OR10,-C(O)NR10R12, -CH=CR9R9, -CCR9 и -С(=Z3)Н;-OR10, -NR10R12 или R13; каждый R9 независимо представляет собой Н, галогено или С 1-С 4 алкил,возможно замещенный атомами фтора в количестве от 1 до 3; каждый из R10 и R11 независимо выбран из водорода и С 1-С 4 алкила; каждый R12 независимо представляет собой -ОR10 или R10;R13 представляет собой С 1-С 4 алкил; каждый R14 независимо выбран из группы,состоящей из галогено, нитро, циано, -NR10R16,-NR16R12, -C(=Z3)R8, -S(O)mR13, где m равно числу от 0 до 2, -OR12, -OC(O)NR10R12,-C(NR12)NR10R12, -C(NR10)SR13, -ОС(O)СН 3,-C(NCN)NR10R12, -C(S)NR10R12, -NR12C(O)R17,-C(O)R17, оксазолил, имидазолил, тиазолил, пиразолил, триазолил или тетразолил; каждый R15 независимо представляет собой водород или С 1-С 4 алкил, возможно замещенный атомами фтора в количестве от 1 до 3; каждый R16 независимо представляет собой Н,R13,-C(O)R13,-C(O)C(O)R8,-C(O)NR10R12, -S(O)mR13, где m равно числу от 0 5 до 2, -C(NCN)SR13, -C(NCN)R13, -C(NR12)R13,-C(NR12)SR13 или -C(NCN)NR10R12; каждый R17 независимо представляет собой R13, -C(O)R13, оксазолидинил, оксазолил,тиазолил, пиразолил, триазолил, тетразолил,имидазолил, имидазолидинил, тиазолидинил,изоксазолил, оксадиазолил, тиадиазолил, морфолинил, пиперидинил, пиперазинил или пирролил, где каждая из указанных R17 гетероциклических групп возможно замещена одной или двумя С 1-С 2 алкильными группами;R20 представляет собой Н, С 1-С 4 алкил, карбокси, аминокарбонил, С 1-С 6 алкил, возможно замещенный группой карбокси, -(СН 2)mС(O)(С 1 С 6 алкокси) или -(СН 2)m(С 6-С 10 арил), где m равно числу от 0 до 2;-(СН 2)nХ 7(пиридил), где n равно числу от 0 до 5,а Х 7 представляет собой связь или -СН=СН-, и где указанная пиридильная группировка возможно замещена галогеном;(пиридил), где n равно числу от 0 до 5, а Х 7 представляет собой связь или -СН=СН-, и где указанная пиридильная группировка возможно замещена галогеном;R10R11, -(СН 2)mРО 3 Н 2, -(CH2)mSO2NHC(O)R13 или -(СН 2)mSО 2NНС(O) (фенил), где m равно числу от 0 до 4;R31 и R32 каждый независимо представляет собой Н, циано, нитро, -CO2R10, -C(O)NR10R11,-CH2OH, -C(O)R10, -NHCO2R10 или -NHSO2R10; А представляет собой пиридил, морфолинил, пиперидинил, имидазолил, тиенил, пиримидил, тиазолил, фенил или нафтил, где каждая из указанных А групп возможно замещена одной или двумя группами R14 или одной группойY представляет собой О или S. Конкретные воплощения соединений формулы I включают в себя соединения, в которыхR представляет собой циклопентил или циклогексил, R1 представляет собой С 1-С 2 алкил, предпочтительно этил, R2 является заместителем формулы (Ia), где X1 представляет собой О, a R6 и R3 оба представляют собой Н. Другие конкретные воплощения соединений формулы I включают в себя соединения, в которых R представляет собой циклопентил или циклогексил, R1 представляет собой С 1-С 2 алкил,предпочтительно этил, R2 является заместителем формулы (Ib), где X1 представляет собой О,q равно 1, пунктирная линия указывает на простую связь, a R4 и R5 оба представляют собой Н. Другие конкретные воплощения соединений формулы I включают в себя соединения, в которых R представляет собой циклопентил или циклогексил, R1 представляет собой С 1-С 2 алкил,предпочтительно этил, R2 является заместителем формулы (Id), где пунктирная линия указывает на простую связь, R20 представляет собой метил и R21 представляет собой Н или-C(O)NR10R11. Другие конкретные воплощения соединений формулы I включают в себя соединения, в которых R представляет собой циклопентил или циклогексил, R1 представляет собой С 1-С 2 алкил,предпочтительно этил, R2 является группировкой формулы (Io), где пунктирная линия представляет собой простую связь, Х 6 представляет собой -CH2-, a R10 и R27 оба представляют собой Н. Другие конкретные воплощения соединений формулы I включают в себя соединения, в которых R представляет собой циклопентил или циклогексил, R1 представляет собой С 1-С 2 алкил,предпочтительно этил, R2 является группировкой формулы (Ip), где R31 и R32 оба представляют собой Н, R28 представляет собой -C(O)R10,-CO2R10, -С(O)(С 6-С 10 арил), циано, нитро,-C(O)NR10R11, -NR10C(O)R10 или -NR10SO2R10,R29 представляет собой R10 или -C(O)R10, R6 представляет собой Н и R30 представляет собой циано, -CO2R10 или -C(O)R10. Другие конкретные соединения в пределах этой группы вклю 7 чают в себя соединения, в которых R6, R31 и R32 представляют собой Н, R30 представляет собой-СО 2 СН 3, R28 представляет собой -С(O)СН 3 и R29 представляет собой -СН 3. Другие конкретные воплощения соединений формулы I включают в себя соединения, в которых R2 является заместителем формулы(Ic), (Ie), (If), (Ig), (Ih), (Ii), (Ij), (Ik), (Ii), (Im),(In), (Iq), (Ir), (Is) или (It). Конкретные предпочтительные соединения следующие: рацемический 4-(1-циклопентил-3-этил 1 Н-индазол-6-ил)-пирролидин-2-он;(-)-4-(1-циклопентил-3-этил-1 Н-индазол-6 ил)-пирролидин-2-он; и фармацевтически приемлемые соли указанных соединений. Другие конкретные предпочтительные соединения следующие: рацемический 4-(1-циклогексил-3-этил-1 Ниндазол-6-ил)-пирролидин-2-он;(-)-4-(1-циклогексил-3-этил-1 Н-индазол-6 ил)-пирролидин-2-он; и фармацевтически приемлемые соли указанных соединений. Далее, настоящее изобретение относится к фармацевтической композиции для ингибирования фосфодиэстеразы (ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. Далее, настоящее изобретение относится к способу ингибирования фосфодиэстеразы(ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по п.1. Далее, настоящее изобретение относится к фармацевтической композиции для предотвращения или лечения астмы, воспаления суставов,ревматоидного артрита, подагрического артрита, ревматоидного спондилита, остеоартрита и других артритических состояний; сепсиса, септического шока, эндотоксического шока, грамотрицательного сепсиса, токсического шока,острого респираторного дистресс-синдрома,церебральной малярии, хронического воспалительного заболевания легких, силикоза, легочного саркоидоза, заболеваний, сопровождающихся резорбцией костей, реперфузионного повреждения, реакции трансплантат против хозяина, отторжения аллотрансплантата, лихорадки и миалгии вследствие инфекции, кахексии, вторичной по отношению к инфекции или злокачественности, кахексии, вторичной по отношению к синдрому приобретенного иммуно 002274 8 дефицита человека (СПИД), СПИДа, ВИЧ,предСПИДа (СПИД-ассоциированного комплекса), келоидного образования, образования рубцовой ткани, болезни Крона, неспецифического язвенного колита, пиреза, рассеянного склероза, сахарного диабета типа 1, аутоиммунного диабета, несахарного диабета, системной красной волчанки, бронхита, хронического обструктивного заболевания дыхательных путей,псориаза, болезни Бехчета, анафилактоидного пурпурного нефрита, хронического гломерулонефрита, воспалительного заболевания кишечника, лейкоза, аллергического ринита, депрессии, мультиинфарктной деменции или дерматита у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. Далее, настоящее изобретение относится к способу лечения или предотвращения вышеуказанных конкретных заболеваний и состояний,при котором пациенту вводят терапевтически эффективное количество соединения по п.1, как оно определено выше, или его фармацевтически приемлемой соли. Термин галогено здесь, если не указано особо, означает фторо, хлоро, бромо или йодо. Предпочтительными галогеногруппами являются фторо, хлоро или бромо. Термин алкил здесь, если не указано особо, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие нормальные, циклические или разветвленные цепи. Термин алкокси здесь, если не указано особо, включает в себя -O-алкильные группы,где алкил такой, как определено выше. Термин алканоил здесь, если не указано особо, включает в себя -С(O)-алкильные группы, где алкил такой, как определено выше. Термин циклоалкил здесь, если не указано особо, включает в себя насыщенные одновалентные циклические углеводородные радикалы, включая циклобутил, циклопентил и циклогептил. Термин арил здесь, если не указано особо, включает в себя органические радикалы,образованные удалением одного атома водорода из ароматического углеводорода, такие как фенил или нафтил. Термин гетероциклил здесь, если не указано особо, включает в себя ароматические или неароматические гетероциклические группы,содержащие один или более чем один гетероатом, каждый из которых выбран из О, S и N. Гетероциклические группы включают в себя бензо-конденсированные кольцевые системы и кольцевые системы, замещенные по оксо группировке. Примером С 3 гетероциклической группы является тиазолил, а примером С 9 гетероциклической группы является хинолинил. Примерами неароматических гетероциклических групп являются пирролидинил, пиперидино, 9 морфолино, тиоморфолино и пиперазинил. Примерами ароматических гетероциклических групп являются пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, тетразолил, фурил, тиенил, озоксазолил и тиазолил. Гетероциклические группы, имеющие конденсированное бензольное кольцо включают в себя бензимидазолил. Термин гетероарил здесь, если не указано особо, включает в себя ароматические гетероциклические группы, где гетероциклическая группа является такой, как определено выше. Выражение фармацевтически приемлемая(ые) соль(и) здесь, если не указано особо,включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях формулы I. Некоторые соединения формулы I могут иметь асимметрические центры и, следовательно, могут существовать в различных энантиомерных формах. Это изобретение относится к применению всех оптических изомеров и стереоизомеров соединений формулы I и их смесей. Соединения формулы I также могут существовать в форме таутомеров. Это изобретение относится к применению всех таких таутомеров и их смесей. Следующие реакционные схемы 1-3 иллюстрируют получение соединений по настоящему изобретению. Если не указано особо, R и R1 на данных реакционных схемах являются такими,как определено выше. Схема 1 Получение соединений формулы I может осуществить любой квалифицированный специалист в соответствии с одним или более чем одним способом синтеза, приведенным на вышеуказанных схемах 1-3, и примерами, приведенными ниже. На стадии 1 схемы 1 карбоновую кислоту формулы II, которая является доступной из известных коммерческих источников или может быть получена в соответствии со способами, известными квалифицированным специалистам, нитруют в стандартных для нитрования условиях (НNО 3/Н 2SO4, 0 С), и полученное нитропроизводное формулы III гидри 11 руют на стадии 2 схемы 1, применяя стандартные способы гидрирования (H2-Pd/C, давление) при температуре окружающей среды (20-25 С) в течение нескольких часов (2-10 ч) с получением соединения формулы IV. На стадии 3 схемы 1,аминобензойную кислоту формулы IV подвергают взаимодействию с основанием, таким как карбонат натрия, в водных условиях и осторожно нагревают до тех пор, пока большая часть не растворится. Реакционную смесь охлаждают до более низкой температуры (около 0 С) и обрабатывают нитритом натрия в воде. Через приблизительно 15 мин, реакционную смесь медленно переносят в подходящий сосуд, в котором находятся куски льда и сильная кислота, такая как соляная кислота. Реакционную смесь перемешивают в течение 10-20 мин, а затем при температуре окружающей среды добавляют к раствору избытка трет-бутилтиола в протонном растворителе, таком как этанол. рН Реакционной смеси доводят до 4-5 добавлением неорганического основания, предпочтительно насыщенного водного Na2CO3, и реакционную смесь оставляют перемешиваться при температуре окружающей среды в течение 1-3 ч. Добавление к реакционной смеси рассола с последующей фильтрацией обеспечивает получение сульфида формулы V. На стадии 4 схемы 1, сульфид формулы V превращают в соответствующую индазолкарбоновую кислоту формулы VI взаимодействием сульфида формулы V с сильным основанием,предпочтительно трет-бутилатом натрия, в диметилсульфоксиде (ДМСО) при температуре окружающей среды. После перемешивания в течение нескольких часов (1-4 ч) реакционную смесь подкисляют сильной кислотой, такой как соляная или серная кислота, а затем экстрагируют, применяя традиционные способы. На стадии 5 схемы 1 индазолкарбоновую кислоту формулы VI превращают в соответствующий сложный эфир формулы VII традиционными способами, известными квалифицированным специалистам. На стадии 6 схемы 1 соединение формулы VIII получают алкилированием сложного эфира формулы VII в стандартных условиях алкилирования (сильное основание/ различные алкилирующие реагенты и, возможно, медный катализатор, такой как CuBr2) в полярном апротонном растворителе, таком как тетрагидрофуран (ТГФ), N-метилпирролидон или диметилформамид (ДМФА), при температуре окружающей среды или повышенной температуре(25-200 С) в течение приблизительно 6-24 ч,предпочтительно приблизительно 12 ч. На стадии 7 схемы 1 соединение формулы VIII превращают в соответствующий спирт формулы IX следующими известными специалистам традиционными способами восстановления эфиров до спиртов. Предпочтительно восстановление проводят с использованием в качестве восстановителя гидрида металла, такого как литийалюми 002274 12 нийгидрид, в полярном апротонном растворителе при низкой температуре (около 0 С). На стадии 8 схемы 1 спирт формулы IX окисляют до соответствующего альдегида формулы Х в соответствии с традиционными способами, известными квалифицированным специалистам. Например, окисление можно осуществлять с использованием каталитического количества перрутената тетрапропиламмония и избытка Nметилморфолин-N-оксида [J. Chem. Soc., Сhеm. Соmmun., 1625 (1987)] в безводном растворителе, предпочтительно метиленхлориде. На схеме 2 предложен альтернативный способ получения альдегида формулы X. На стадии 1 схемы 2 соединение формулы XI нитруют в стандартных для нитрования условиях(азотная и серная кислоты) с получением соединения формулы XII. На стадии 2 схемы 2 нитропроизводное формулы XII восстанавливают до соответствующего амина формулы XIII в соответствии с традиционными способами, известными квалифицированным специалистам. Предпочтительно соединение формулы XII восстанавливают до амина формулы XIII с использованием безводного хлорида олова (II) в безводном апротонном растворителе, таком как этанол. На стадии 3 схемы 2 амин формулы XIII превращают в соответствующий индазол формулы XIV получением соответствующих тетрафторборатов диазония [A. Roe, Organic Reactions. Vol. 5, Wiley, New York, 1949, pp.198-206],а затем циклизацией с использованием катализатора фазового переноса [R.A. Bartsch and I.W.(от -50 до 100 С (предпочтительно -78 С, затем гасят ДМФА при низкой температуре и нагревают до температуры окружающей среды с получением промежуточного альдегида формулы X. Схема 3 иллюстрирует получение соединений формулы I, где R и R1 являются такими,как определено выше, a R2 является заместителем формулы (Ia) и X1 представляет собой О. На стадии 1 схемы 3 промежуточный альдегид формулы Х подвергают взаимодействию в полярном безводном растворителе, таком как толуол, с диэтилмалонатом в присутствии органического основания, такого как пиперидин. Реакционную смесь нагревают с обратным холодильником, а воду, которая образуется во время реакции, собирают, используя ловушку Дина 13 Старка. Взаимодействие проводят в течение приблизительно 12-30 ч с получением промежуточного диэтилового эфира малоновой кислотыXVI. На стадии 2 схемы 3 промежуточный диэтиловый эфир малоновой кислоты XVI обрабатывают одним эквивалентом цианида натрия при температуре окружающей среды (20-25 С) в безводном полярном растворителе, таком как этанол, с получением, после подкисления, цианопромежуточного соединения XVII. На стадии 3 схемы 3 цианопромежуточное соединениеXVII подвергают циклизации до образования производного пирролидин-2-она XVIII, следуя четырехстадийной методике. На первой стадии цианопромежуточное соединение XVII гидрируют при высоком давлении 140-350 кПа (20-50 фунт/кв.дюйм) с использованием металлического катализатора, такого как платина, и кислотного растворителя, такого как уксусная кислота. На второй стадии промежуточное соединение с первой стадии нагревают с обратным холодильником в присутствии органического основания,такого как триэтиламин, в апротонном органическом растворителе, таком как толуол, в течение приблизительно 10-24 ч. На третьей стадии промежуточное соединение со второй стадии обрабатывают сильным основанием, таким как гидроксид натрия, в полярном протонном растворителе, таком как спирт, предпочтительно этанол, и нагревают с обратным холодильником в течение от приблизительно 30 мин до часа. На четвертой стадии промежуточное соединение с третьей стадии нагревают до высокой температуры, предпочтительно 150-200 С, в атмосфере инертного газа в течение 15-30 мин или до тех пор, пока полностью не прекратится выделение пузырьков. Неочищенный продукт может быть очищен с получением производного пирролидин-2-она XVIII с использованием стандартных хроматографических методов, известных квалифицированным специалистам. Производное пирролидин-2-она XVIII является рацематом и его можно разделить (или расщепить) на соответствующие индивидуальные энантиомеры, применяя методы разделения,известные квалифицированным специалистам. Такие методы описаны [J. March, Advanced Organic Chemistry, 4th Edition, J. WileySons,1992, pages 118-125]. На стадии 4 схемы 3 такое разделение осуществляют, применяя хиральную ВЭЖХ (высокоэффективная жидкостная хроматография) в качестве метода разделения, как описано в примере 2, приведенном ниже. Соединения формулы I также могут быть получены следуя одному или более чем одному способам синтеза, которые описаны в опубликованных патентных заявках или выданных патентах. В частности, соединения формулы I могут быть получены квалифицированными специалистами с использованием промежуточных соединений, описанных на схемах 1-3, рассмот 002274 14 ренных выше, в частности, промежуточных соединений формул VIII, X, XV и XVIII, способами синтеза, аналогичными способам, которые были описаны для соединений, в которых фенильное кольцо заменено на индазольное кольцо в соединениях формулы I. Такие аналогичные способы синтеза описаны в патенте США 5270206 (выдан 14 декабря 1993) и следующих опубликованных патентных заявках: ЕР 428313(опубликована 30 марта 1995); опубликованная заявка Японии 7215952 (опубликована 15 августа 1995), опубликованная заявка Японии 7017952 (опубликована 20 января 1995); WO 87/06576 (опубликована 5 ноября 1987); WO 91/07178 (опубликована 30 мая 1991); заявка РСТ 91/15451 (опубликована 17 октября, 1991);WO 92/07567 (опубликована 14 мая 1992); заявка РСТ 92/19594 (опубликована 12 ноября 1992); заявка РСТ 93/07111 (опубликована 15 апреля 1993); WO 93/07141 (опубликована 15 мая 1993); заявка РСТ 94/12461 (опубликована 9 июня 1994); WO 95/08534 (опубликована 30 марта 1995); WO 95/14680 (опубликована 1 июня 1995) и WO 95/14681 (опубликована 1 июня 1995). Упомянутые выше патент США и каждая из упомянутых выше опубликованных патентных заявок включены здесь ссылками во всей их полноте. В каждой из упомянутых выше опубликованных заявок РСТ указано ведомство США. В частности, соединения формулы I, где R2 представляет собой 2-оксо-4-пирролил, пиразолил, 2-оксо-3,4-дигидро-5-пиримидил, 2-оксо 3,4-дигидро-4-пиримидил,2-оксотетрагидро-4-пиримидил, 2-оксотетрагидро-5-пиримидил,2-оксо-4-пиримидил или 2-оксо-5 пиримидил, могут быть получены способами синтеза, аналогичными способам, описанным вWO 87/06576, который рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Iа), могут быть получены способами синтеза, аналогичными способам, описанным в WO 87/06576, WO 91/16303, WO 94/12461, WO 92/19594 или WO 93/07141, каждый из которых рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Ib), могут быть получены способами синтеза, аналогичными способам, описанными вWO 87/06576, патенте США 5270206, WO 94/12461, WO 92/17567, WO 91/07178 или ЕР 428313, каждый из которых рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Ic), могут быть получены способами синтеза, аналогичными способам,описанным в WO 87/06576, рассмотренном выше. Соединения формулы I, где R2 является заместителем формулы (Id), могут быть получены способами синтеза, аналогичными способам,описанным в ЕР 511865, рассмотренном выше. 15 Соединения формулы I, где R2 является заместителем формулы (Iе) или (If), могут быть получены способами синтеза, аналогичными способам, описанным в WO 87/06576 или WO 94/12461, каждый из которых рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Ig) или (Ih), могут быть получены способами синтеза, аналогичными способам, описанным в WO 87/06576, который рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Ii), могут быть получены способами синтеза, аналогичными способам, описанным в WO 91/15451 или WO 93/07141, каждый из которых рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Ij) или (Ik), могут быть получены способами синтеза, аналогичными способам, описанным в WO 93/07111, который рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (II), могут быть получены способами синтеза, аналогичными способам, описанным в WO 95/14680 или WO 95/14681, каждый из которых рассмотрен выше. Соединения формулы I, где R2 является заместителем формулы (Im) или (In), могут быть получены способами синтеза, аналогичными способам, описанным в опубликованной заявке Японии 7215952, которая рассмотрена выше. Соединения формулы I, где R2 является заместителем формулы (Io), могут быть получены способами синтеза, аналогичными способам,описанным в опубликованной заявке Японии 7017952, которая рассмотрена выше. Соединения формулы I, где R2 является заместителем формулы (Ip), могут быть получены способами синтеза, аналогичными способам, описанным вWO 95/08534 или ЕР 671389, каждый из которых рассмотрен выше. Соединения формулы I,где R2 является заместителем формулы (Iq), (Ir),(Is) или (It), могут быть получены способами синтеза, аналогичными способам, описанным вWO 87/06576, который рассмотрен выше. Соединения формулы I, которые имеют основный характер, способны образовывать широкий ряд различных солей со многими неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто желательно первоначально выделить соединение формулы I из реакционной смеси в виде фармацевтически неприемлемой соли, и затем просто превратить последнюю обратно в свободное основное соединение обработкой щелочным реагентом, а затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислоты основных соединений этого изобретения легко получают обработкой основного соединения, по существу, эквивалентным количеством выбранной неорганической или органической кислоты в водной среде, как растворителе, или в подходящем ор 002274 16 ганическом растворителе, таком как метанол или этанол. После выпаривания растворителя легко получают желаемую твердую соль. Желаемую соль присоединения кислоты также можно осадить из раствора свободного основания в органическом растворителе добавлением раствора соответствующей неорганической или органической кислоты. Катионные соли соединений формулы I получают подобным образом,за исключением реакции через карбоксигруппу,такую как когда R24 представляет собой карбокси, с соответствующим реагентом - катионной солью, такой как соль натрия, калия, кальция,магния, аммония, N,N'-дибензилэтилендиамин,N-метилглюкамин (меглюмин), этаноламин,трометамин или диэтаноламин. Для введения людям при лечении или профилактике воспалительных заболеваний пероральные дозировки соединения формулы I или его фармацевтически приемлемой соли (активных соединений) обычно находятся в пределах от 0,1 до 1000 мг ежедневно для среднего взрослого пациента (70 кг), в виде однократной или разделенных доз. Активные соединения можно вводить в виде однократной дозы или в виде разделенных доз. Отдельные таблетки или капсулы обычно должны содержать от 0,1 до 100 мг активного соединения в подходящем фармацевтически приемлемом наполнителе или носителе. Дозировки для внутривенного введения обычно находятся в пределах от 0,1 до 10 мг на однократную дозу, в зависимости от требования. Для ингаляционного введения или введения через нос дозу обычно приготавливают в виде от 0,1 до 1%-ного (мас./об.) раствора. На практике врач будет определять действительную дозу, которая будет наиболее подходящей для индивидуального пациента, и будет варьировать ее в зависимости от возраста, веса и реакции конкретного пациента. Упомянутые выше дозировки являются типичными для среднего пациента, но, конечно, могут существовать отдельные случаи, когда заслуживают внимания более высокий или более низкий пределы дозировок, и все такие дозировки находятся в пределах объема этого изобретения. Для введения людям для ингибирования ФНО можно использовать множество традиционных способов, в том числе пероральный, парентеральный, местный и ректальный (суппозитории). Обычно при лечении активное соединение будут вводить перорально или парентерально в дозировках между приблизительно 0,1 и 25 мг/кг веса тела субъекта, которого лечат, в день,предпочтительно от приблизительно 0,3 до 5 мг/кг, в виде однократной дозы или в виде разделенных доз. Однако в зависимости от состояния субъекта, которого лечат, обязательно будет происходить некоторое изменение дозировки. В любом случае, персона, ответственная за введение, будет определять соответствующую дозу для индивидуального субъекта. 17 Для применения у человека активные соединения по настоящему изобретению можно вводить сами по себе, однако, обычно их будут вводить в смеси с фармацевтическим разбавителем или носителем, выбранным с учетом назначенного способа введения и стандартной фармацевтической практики. Например, их можно вводить перорально в форме таблеток, содержащих такие эксципиенты, как крахмал или лактоза, или в капсулах либо сами по себе, либо в смеси с эксципиентами, или в форме эликсиров или суспензий, содержащих корригенты или красители. Их можно инъецировать парентерально, например внутривенно, внутримышечно или подкожно. Для парентерального введения лучше всего их применять в форме стерильного водного раствора, который может содержать другие вещества, например достаточно солей или глюкозы, чтобы сделать раствор изотоническим. Кроме того, активные соединения можно вводить местно при лечении воспалительных состояний кожи, и это можно делать с помощью кремов, желе, гелей, паст или мазей, в соответствии со стандартной фармацевтической практикой. Терапевтические соединения также можно вводить млекопитающим, иным чем человек. Дозировка для введения млекопитающему будет зависеть от вида животного и заболевания или расстройства, которые лечат. Терапевтические соединения можно вводить животным в форме капсулы, пилюли, таблетки или дозы жидкого лекарства. Терапевтические соединения также можно вводить животным инъецированием или в виде имплантата. Такие препараты получают традиционным способом в соответствии со стандартной ветеринарной практикой. В качестве альтернативного варианта терапевтические соединения можно вводить в корм животным и с этой целью можно готовить концентрированную пищевую добавку или премикс для смешивания с обычным кормом животных. Способность соединений формулы I или их фармацевтически приемлемых солей ингибировать ФДЭ IV можно определить при помощи следующего анализа. От 30 до 40 г ткани легкого человека помещают в 50 мл буфера Трис/ фенилметилсульфонилфторид (ФМСФ)/сахароза, рН 7,4, и гомогенизируют с использованием Tekmar Tissumizer (Tekmar Co., 7143 Kemper Road, Cincinnati, Ohio 45249) при максимальной скорости в течение 30 с. Гомогенат центрифугируют при 48000 х g в течение 70 мин при 4 С. Надосадочную жидкость дважды фильтруют через 0,22 мкм фильтр и вносят в колонку Mono-Q FPLCAvenue, Piscataway, New Jersey 08854), предварительно уравновешенную Трис/ФМСФ буфером, рН 7,4. Чтобы внести образец в колонку, 002274 18 используют объемную скорость потока 1 мл/мин, после чего для последующих промывки и элюирования используют скорость потока 2 мл/мин. Образец элюируют при постепенно возрастающей концентрацииNaCl в Трис/ФМСФ буфере, рН 7,4 (градиентное элюирование). Собирают 8 мл фракций. Фракции анализируют на специфическую ФДЭIV активность, определяемую [3 Н]цАМФ гидролизом (цАМФ - циклический аденозинмонофосфат) и способностью известного ФДЭIV ингибитора-20 С до использования. Соединения растворяют в диметилсульфоксиде (ДМСО) в концентрации 10 мМ и разбавляют в соотношении 1:25 водой (400 мкМ соединения, 4% ДМСО). Далее осуществляют серию разбавлений 4% ДМСО для достижения желаемых концентраций. Конечная концентрация ДМСО в пробирке для анализа составляет 1%. В стеклянную пробирку 12 х 75 мм, в двух экземплярах, по порядку добавляют следующее(все концентрации даны как конечные концентрации в пробирке для анализа): 1) 25 мкл соединения или ДМСО (1%, для контроля и "холостого" опыта); 2) 25 мкл Трис буфера, рН 7,5; 3) [3H]цАМФ (1 мкМ); 4) 25 мкл фермента ФДЭ IV (для "холостого" опыта, фермент предварительно инкубируют в кипящей воде в течение 5 мин). Реакционные пробирки встряхивают и помещают в водяную баню (37 С) на 20 мин, после чего реакцию останавливают, помещая пробирки в кипящую водяную баню на 4 мин. В каждую пробирку на ледяной бане добавляют промывочный буфер (0,5 мл, 0,1 М 4-(2 гидроксиэтил)-1-пиперазинэтансульфоновая кислота (HEPES)/0,1M naci, pH 8,5). Содержимым каждой пробирки наполняют колонку AFFGel 601 (Biorad Laboratories, P.O. Box 1229, 85AMarcus Drive, Melvile, New York 11747) (гель с аффинностью к боронату, объем слоя 1 мл),предварительно уравновешенную промывочным буфером. [3H]цАМФ промывают промывочным буфером 2 х 6 мл, и [3 Н]5'АМФ затем элюируют 4 мл 0,25 М уксусной кислоты. После встряхивания 1 мл элюата добавляют к 3 мл сцинтилляционной жидкости в подходящей ампуле,встряхивают и считают [3 Н]. ИК 50 является такой концентрацией соединения, которая ингибирует 50% специфического гидролиза [3H]цАМФ до [3 Н]5'АМФ. Способность соединений I или их фармацевтически приемлемых солей ингибировать 19 выработку ФНО и, следовательно, демонстрировать их эффективность для лечения заболевания, в которое вовлечена выработка ФНО, показана при помощи следующего анализа in vitro: Периферическую донорскую кровь человека (100 мл) собирают в этилендиаминтетрауксусную кислоту (EDTA). Одноядерные клетки выделяют с помощью FICOLL/Hypaque и промывают три раза в неполном HBSS (среде Хенка). Клетки повторно суспендируют до конечной концентрации 1 х 106 клеток на 1 мл в предварительно нагретом RPMI (содержащем 5%FCS (фетальной сыворотки теленка), глутамин,pen/step и нистатин). Моноциты высевают в количестве 1 х 106 клеток в 1,0 мл в 24-луночных планшетах. Клетки инкубируют при 37 С (5% диоксида углерода) и оставляют для адгезии с планшетами в течение 2 ч, после чего неадгезированные клетки удаляют осторожной промывкой. Затем к клеткам добавляют испытуемые соединения (10 мкл), каждое в 3-4 концентрациях, и инкубируют в течение 1 ч. В соответствующие лунки добавляют LPS (липополисахариды) (10 мкл). Планшеты инкубируют в течение ночи (18 ч) при 37 С. По окончании инкубирования ФНО анализируют методом "сэндвич"-ЕLISА(иммуноферментный анализ,ИФА) (RD Quantikine Kit). ИK50 определяют для каждого соединения на основе линейного регрессионного анализа. Следующие примеры иллюстрируют изобретение. Подготовительный пример 1. Метиловый эфир 1-циклопентил-3-этил-1 Н-индазол-6-карбоновой кислоты. А. 3-Нитро-4-пропилбензойная кислота. 9,44 г (57,5 ммоль, 1,0 экв.) 4-пропилбензойной кислоты частично растворяют в 50 мл концентрированной H2SO4 и охлаждают в ледяной бане. По каплям за 1-2 мин добавляют раствор 4,7 мл (74,7 ммоль, 1,3 экв.) концентрированной НNО 3 в 10 мл концентрированной H2SO4. После перемешивания в течение 1 ч при 0 С реакционную смесь вливают в 1-литровый химический стакан, наполовину заполненный льдом. После перемешивания в течение 10 мин образовавшееся белое твердое вещество фильтруют, промывают 1 хН 2 О и сушат с получением 12,01 г 20 Анализ: вычислено для С 10 Н 11NO41/4 Н 2O: С 56.20; Н 5.42; N 6.55; найдено: С 56.12; H 5.31; N 6.81. Б. 3-Амино-4-пpопилбензойная кислота. Смесь 11,96 г (57,2 ммоль) 3-нитро-4 пропил-бензойной кислоты и 1,5 г 10% Pd/C,50%-ной влажности, в 250 мл СН 3 ОН помещают в аппарат гидрирования Парра и встряхивают при 175 кПа (25 фунт/кв.дюйм) Н 2 при температуре окружающей среды (20-25 С). Через 1 ч реакционную смесь фильтруют через Celite, и фильтрат концентрируют и сушат с получением 9,80 г (96%) бледно-желтого кристаллического твердого вещества. Т.пл. 139,5-142,5 С. ИК (КВr) 3200-2400, 3369, 3298, 2969,2874, 2588, 1690, 1426, 1260, 916, 864 см-1; 1MC (Cl, NН 3) m/z 180 (М+Н+, основание). Анализ: вычислено для C10H13NО 21/3H2O: С 64.85; Н 7.89; N 7.56; найдено: С 64.69; Н 7.49; N 7.86. В. 3-Kapбокси-6-пропилбензолдиазо-тpeтбутилсульфид. Смесь 8,80 г (49,1 ммоль, 1,0 экв.) 3-амино-4-пропилбензойной кислоты и 2,34 г (22,1 ммоль, 0,45 экв.) карбоната натрия в 55 мл Н 2O осторожно нагревают феном до тех пор, пока большая часть не растворится. Реакционную смесь охлаждают на ледяной бане, и по каплям добавляют раствор 3,73 г (54,0 ммоль, 1,0 экв.) нитрита натрия в 27 мл Н 2 О. Через 15 мин реакционную смесь переносят в капельную воронку и за 10 мин добавляют в химический стакан, содержащий 55 г измельченного льда и 10,6 мл концентрированной HCl. После перемешивания в течение 10 мин содержимое химического стакана переносят в капельную воронку и за 5 мин при комнатной температуре добавляют к раствору 5,31 мл (47,1 ммоль, 0,96 экв.) трет-бутилтиола в 130 мл этанола. Доводят рН до 4-5 добавлением насыщенного водного раствора Nа 2 СО 3, и реакционную смесь оставляют перемешиваться в течение 1 ч при температуре окружающей среды (20-25 С). Добавляют 200 мл рассола и реакционную смесь фильтруют. Твердое вещество промывают 1 хН 2O и сушат в течение ночи с получением 12,25 г (89%) коричневого/цвета ржавчины порошка (осторожно - неприятный запах). Т.пл. 102 С (разл.). ИК (КВr) 3200-2400, 2962, 2872, 2550,1678, 1484, 1428, 1298, 1171 см-1. 1N 10.02. Г. 3-Этил-1 Н-индазол-6-карбоновая кислота. Раствор 12,0 г (42,8 ммоль, 1,0 экв.) 3 карбокси-6-пропилбензолдиазо-трет-бутилсульфида в 150 мл ДМСО добавляют по каплям за 15 мин к раствору 44,6 г (398 ммоль, 9,3 экв.) трет-бутилата калия в 200 мл диметилсульфоксида (ДМСО) при температуре окружающей среды. После перемешивания в течение 2 ч при температуре окружающей среды реакционную смесь вливают в 1,5 л 1 н. HCl при 0 С, перемешивают в течение 5 мин, затем экстрагируют 2 х 350 мл этилацетата. Этилацетатные экстракты(осторожно - неприятный запах) объединяют,промывают 2 х 250 мл Н 2O и сушат над MgSO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению желтоватокоричневого твердого вещества, которое перетирают с 1 л смеси Et2O/Гексаны (1:3) и сушат с получением 7,08 г (87%) желтовато-коричневого кристаллического порошка. Т.пл. 248251 С ИК (КВr) 3301, 3300-2400, 2973, 2504,1702, 1455, 1401, 1219 см-1; 1N 14.80. Д. Метиловый эфир 3-этил-1 Н-индазол-6 карбоновой кислоты. 8,78 г (45,8 ммоль, 1,1 экв.) гидрохлорида 1-(3-диметиламинопропил)3-этилкарбодиимида добавляют одной порцией к раствору 7,92 г (41,6 ммоль, 1,0 экв.) 3-этил 1 Н-индазолкарбоновой кислоты, 16,9 мл (416 ммоль, 10 экв.) метанола и 5,59 г (45,8 ммоль,1,1 экв.) диметиламинопиридина (ДМАП) в 250 мл CH2Cl2 при температуре окружающей среды. Через 18 ч при комнатной температуре реакционную смесь концентрируют до 150 мл, разбавляют 500 мл этилацетата, промывают 2 х 100 мл 1 н. HCl, 1 х 100 мл Н 2O, 1 х 100 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 7,8 г коричневого твердого вещества, которое очищают на колонке с силикагелем (градиент - от 30% до 50% этилацетат/гексан) с получением 6,41 г (75%) желтовато-коричневого твердого вещества. Т.пл. 107-108 С. ИК (КВr) 3100-2950, 1723, 1222 см-1. 1 Н ЯМР (300 МГц, CDCl3)8.19 (m, 1H),7.7-7.8 (m, 2 Н), 3.96 (s, 3H), 3.05 (q, 2H, J=7.7 Гц), 1.43 (t, 3H, J=7.7 Гц).N 13.96 Е. Метиловый эфир 1-циклопентил-3-этил 1 Н-индазол-6-карбоновой кислоты. 1,17 г (29,4 ммоль, 1,05 экв.) гидрида натрия, 60%-ная дисперсия в масле, добавляют одной порцией к раствору 5,7 г (27,9 ммоль, 1,0 экв.) метилового эфира 3-этил-1 Н-индазол-6-карбоновой кислоты в 125 мл безводного ДМФА при температуре окружающей среды. Через 20 мин по каплям добавляют 3,89 мл (36,6 ммоль, 1,3 экв.) циклопентилбромида, и реакционную смесь оставляют перемешиваться в течение ночи при комнатной температуре. Затем смесь вливают в 1 л Н 2O и экстрагируют 3 х 450 мл этилацетата. Органические экстракты объединяют, промывают 3 х 400 мл Н 2 О, 1 х 200 мл рассола и сушат надNa2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению масла янтарного цвета, которое очищают на колонке с силикагелем (10% этилацетат/гексаны, самотеком) с получением 5,48 г (72%) прозрачного масла. 1H ЯМР (300 МГц, CDCl3)8.16 (d, 1H,J=1.0 Гц), 7.7 (m, 2H), 5.00 (квинтет, 1H, J=7.5 Гц), 3.97 (s, 3H), 3.01 (q, 2H, J=7.6 Гц), 2.2 (m,4H), 2.0 (m, 2H), 1.8 (m, 2H), 1.39 (t, 3H, J=7.6 Гц). Вычислено по масс-спектру высокого разрешения (HRMS) для C16H20N2O2: 272,1526; найдено: 272,15078. Ж. (1-Циклопентил-3-этил-1 Н-индазол-6 ил)метанол. 7 мл (7,0 ммоль, 1,0 экв.) алюмогидрида лития, 1,0 М раствор в ТГФ, добавляют к раствору 1,02 г (7,05 ммоль, 1,0 экв.) метилового эфира 1-циклопентил-3-этил-1 Н-индазол-6 карбоновой кислоты в 50 мл безводного ТГФ при 0 С. Через 20 мин осторожно добавляют 1 мл метанола, затем реакционную смесь вливают в 500 мл 5% H2SO4 и экстрагируют 3 х 50 мл этилацетата. Органические экстракты объединяют, промывают 2 х 40 мл Н 2 О, 1 х 40 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 1,58 г прозрачного масла, которое очищают на колонке с силикагелем с получением 1,53 г 3. 1-Циклопентил-3-этил-1 Н-индазол-6 карбальдегид. 106 мг (0,301 ммоль, 0,05 экв.) тетрапропиламмония перрутената (VII) добавляют к суспензии 1,47 г (6,02 ммоль, 1,0 экв.) (1 циклопентил-3-этил-1 Н-индазол-6-ил)-метанола, 1,06 г (9,03 ммоль, 1,5 экв.) N-оксида Nметилморфолина и 3,01 г молекулярных сит 4 А в 12 мл безводного СН 2 Сl2 при комнатной температуре. Через 20 мин реакционную смесь фильтруют через небольшую колонку с силикагелем (элюируют СН 2 Сl2). Фракции, содержащие продукт, концентрируют, и остаток хроматографируют на колонке с силикагелем (15% этилацетат/гексаны, флэш) с получением 924 мг(628 ммоль, 1,0 экв.) 1-бром-4-пропилбензола добавляют одной порцией к раствору 600 мл конц. H2SO4 и 200 мл H2O при 10 С. При энергичном механическом перемешивании при температуре окружающей среды за 30 мин добавляют по каплям смесь 43,2 мл (691 ммоль, 1,1 экв.) конц. НNО 3 (69-71%, 16 М) в 150 мл конц.H2SO4 и 50 мл H2O. Ледяную баню оставляют нагреваться до температуры окружающей среды, и реакционную смесь перемешивают при комнатной температуре в течение 68 ч. Реакционную смесь вливают в 4-литровый химический стакан, неплотно заполненный измельченным льдом. После перемешивания в течение 1 ч смесь переносят в 4-литровую делительную воронку и экстрагируют 4 х 800 мл изопропилового эфира. Органические экстракты объединяют,промывают 3 х 800 мл H2O, 1 х 500 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 150 мл желтой жидкости, которую очищают хроматографией на силикагеле (2 колонки, 3 кг силикагеля в каждой, 2% этилацетат/гексан) с получением 63,9 г (42%) желтой жидкости. Целевой региоизомер менее полярен из двух, которые образуются в соотношении 1:1. Т.кип. 108 С, 2,0 мм. ИК (CDCl3) 3031, 2966, 2935, 2875, 1531,1352 см-1; 1(II) (безводного) добавляют одной порцией к раствору 51,9 г (213 ммоль, 1,0 экв.) 4-бром-2 нитро-1-пропилбензола в 1200 мл абсолютного этанола и 12 мл (6 экв.) Н 2 О при комнатной температуре. Через 24 ч при комнатной температуре большую часть этанола удаляют на роторном испарителе. Остаток вливают в 4 литровый химический стакан, заполненный на 3/4 измельченным льдом и Н 2 О. Порциями при перемешивании добавляют 150 г гранулированного NaOH до тех пор, пока рН не станет равным 10 и не растворится большая часть гидроксида олова (II). Смесь делят на две равные части, и каждую половину экстрагируют 2 х 750 мл этилацетата. Все четыре этилацетатных экстракта объединяют, промывают 1 х 500 мл 1 н. NaOH,1 х 500 мл Н 2 О, 1 х 500 мл рассола, затем сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению желтой жидкости, которую очищают на колонке с 1,2 кг силикагеля (1:12 этилацетат/гексаны) с получением 41,83 г (92%) бледно-желтой жидкости. ИК (СDСl3) 3490, 3404, 3008, 2962, 2933,2873, 1620, 1491 см-1 ; 1(GCMS) (El) m/z 215/213 (M+.), 186/184 (основание). Вычислено по масс-спектру высокого разрешения для C9H12NBr: С 50.49; Н 5.65; N 6.54; найдено: С 50.77; Н 5.70; N 6.50. В. 6-Бром-3-этил-1 Н-индазол. 49,22 г (230 ммоль, 1,0 экв.) 5-бром-2-пропил-фениламина помещают в 3-литровую колбу и охлаждают на ледяной бане. Добавляют раствор 57,5 мл (690 ммоль, 3,0 экв.) конц. HCl в 165 мл H2O при 0 С и полученную твердую массу измельчают до тех пор, пока не образуется тонко измельченная белая суспензия. Добавляют еще 100 мл Н 2 О,затем по каплям за 10 мин добавляют раствор 15,9 г (230 ммоль, 1,0 экв.) нитрита натрия в 75 мл H2O. Ледяную баню удаляют, и реакционную смесь оставляют перемешиваться при комнатной температуре в течение 30 мин. Затем реакционную смесь фильтруют через воронку со стеклянным фильтром, предварительно охлажденную до 0 С. Фильтрат охлаждают на ле 25 дяной бане, и при механическом перемешивании по каплям за 10 мин добавляют раствор/суспензию 32,8 г (313 ммоль, 1,36 экв.) тетрафторбората аммония в 110 мл Н 2 О при 0 С. Образовавшуюся густую белую суспензию(тетрафторборат арилдиазония) оставляют перемешиваться в течение 1,5 ч при 0 С. Затем смесь фильтруют, и твердое вещество промывают 1 х 200 мл 5% водн. NH4BF4 (охлажденного при 0 С), 1 х 150 мл СН 3 ОН (охлажденного до 0 С), затем 1 х 200 мл Et2O. Сушка при сильном разрежении и температуре окружающей среды в течение 1 ч приводит к получению 54,47 г (76%) соли диазония, не совсем белому твердому веществу. 1500 мл хлороформа, свободного от этанола, помещают в трехгорлую колбу, затем добавляют 34,16 г (348 ммоль, 2,0 экв.) ацетата калия(измельченного в порошок и высушенного) и 2,3 г (8,7 ммоль, 0,05 экв.) 18-краун-6. Через 10 мин одной порцией добавляют соль диазония, и реакционную смесь оставляют перемешиваться при комнатной температуре в атмосфере азота в течение 18 ч. Затем смесь фильтруют, твердое вещество промывают 2 раза СНСl3, и фильтрат концентрируют с получением 47 г неочищенного продукта (коричневых кристаллов). Хроматография на силикагеле (1,2 кг силикагеля, градиент 15%, 20%, 40% этилацетат/гексаны) приводит к получению 21,6 г (55% для второй стадии,общий выход 42%) желтовато-коричневатых кристаллов. Т.пл. 112-114 С. ИК (КВr) 3205, 3008, 2969, 2925, 1616,1340, 1037 см-1 ; 1(dd, 1H, J=1.5, 8.6 Гц), 2.99 (q, 2H, J=7.6 Гц),1.41 (t, 3 Н, J=7.6 Гц). МС (Cl, NН 3) m/z 227/225 (M+H+, основание). Анализ: вычислено для С 9 Н 9N2 Вr: С 48.02; Н 4.03; N 12.45; найдено: С 48.08; Н 3.87; N 12.45. Г. 6-Бром-1-циклопентил-3-этил-1 Н-индазол. 2,46 г (61,4 ммоль, 1,05 экв.) гидрида натрия, 60%-ная дисперсия в масле, добавляют порциями по 0,5 г к раствору 13,17 г (58,5 ммоль, 1,0 экв.) 6-бром-3-этил-1 Н-индазола в 500 мл безводного ДМФА при 10 С. Смесь перемешивают при температуре окружающей среды в течение 20 мин, затем по каплям добавляют раствор 8,8 мл (81,9 ммоль, 1,4 экв.) циклопентилбромида в 10 мл безводного ДМФА. Через 18 ч реакционную смесь вливают в 2 л Н 2O и экстрагируют 2 х 1 л этилацетата. Органические экстракты объединяют, промывают 2 х 750 мл Н 2O, 1 х 500 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 20,7 г неочищенного продукта, который очищают на колонке с силикагелем (1,1 кг силикагеля, 3% этилаце 002274(28,4 ммоль, 1,0 экв.) 6-бром-1-циклопетил-1 Ниндазола в 200 мл безводного ТГФ при -78 С. Через 30 мин при -78 С по каплям добавляют 8,8 мл (114 ммоль, 4,0 экв.) безводного ДМФА,и реакционную смесь оставляют перемешиваться в течение дополнительных 30 мин при -78 С. Смесь за 1 ч нагревают до комнатной температуры, затем добавляют 125 мл 1 н. HCl. После перемешивания в течение 10 мин большую часть ТГФ удаляют на роторном испарителе. Остаток разбавляют 500 мл Н 2 О и экстрагируют 2 х 250 мл этилацетата. Органические экстракты объединяют, промывают 1 х 100 мл Н 2O, 1 х 100 мл рассола и сушат над Na2SO4. Фильтрация,концентрирование фильтрата и сушка приводят к получению желтого масла, которое очищают на колонке с силикагелем (15% этилацетат/гексаны, самотек) с получением 4,70 г (68%) желтого кристаллического твердого вещества. 1H ЯМР (300 МГц, CDCl3) спектр идентичен спектру указанного в заглавии соединения подготовительного примера 1. Пример 1. Рацемический 4-(1-циклопентил-3-этил-1 Н-индазол-6-ил)-пирролидин-2-он. А. Диэтиловый эфир 2-(1-циклопентил-3 этил-1 Н-индазол-6-илметил)малоновой кислоты. Смесь 3,74 г (15,4 ммоль, 1,0 экв.) 1 циклопентил-3-этил-1 Н-индазол-6-карбальдегида, 2,33 мл (15,4 ммоль, 1,0 экв.) диэтилмалоната и 1,52 мл (15,4 ммоль, 1,0 экв.) пиперидина в 60 мл безводного толуола нагревают с обратным холодильником. Для завершения реакции применяют ловушку Дина-Старка. Через 24 ч реакционную смесь охлаждают до комнатной температуры и на роторном испарителе удаляют ацетон. Остаток разбавляют 500 мл этилацетата и промывают 2 х 150 мл насыщенного водногоNH4Cl, 1 х 150 мл H2O, 1 х 150 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 6,87 г неочищенного продукта, который очищают на колонке с силикагелем (10% этилацетат/ гекса 27 ны, флэш) с получением 3,01 г (51%) желтого масла. ИК (CDCl3) 2974, 2940, 2874, 1724, 1257 см-1 ; 1N 7.23 Б. Диэтиловый эфир 2-[циано-(1 циклопентил-3-этил-1 Н-индазол-6-ил)-метил]малоновой кислоты. 375 мг (7,65 ммоль, 1,0 экв.) цианида натрия добавляют одной порцией к раствору 2,94 г (7,65 ммоль, 1,0 экв.) диэтилового эфира 2-(1-циклопентил-3-этил-1 Ниндазол-6-илметилен)малоновой кислоты в 50 мл абсолютного этанола при комнатной температуре. Через 14 ч при комнатной температуре реакционную смесь концентрируют на роторном испарителе, и остаток разбавляют 500 мл этилацетата. Добавляют 200 мл Н 2O и смесь подкисляют 1 н. HCl до рН 3. Слои разделяют, и органический слой промывают 1 х 100 мл Н 2O,1 х 100 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению оранжевого масла, которое очищают на колонке с силикагелем (градиент 15-25% этилацетат/гексаны) с получением 2,84 гN 10.06. В. Рацемический 4-(1-циклопентил-3-этил 1 Н-индазол-6-ил)-пирролидин-2-он. 3,0 г оксида платины (IV) и 35 мл уксусной кислоты помещают в аппарат гидрирования Парра и встряхивают при 315 кПа (45 фунт/кв.дюйм) H2 при комнатной температуре в течение 1 ч. Добавляют 2,79 г (6,78 ммоль, 1,0 экв.) диэтилового эфира 2-[циано-(1-циклопентил-3-этил-1 Ниндазол-6-ил)метил]малоновой кислоты, растворяют в 40 мл уксусной кислоты, затем смесь встряхивают при 315 кПа (45 фунт/кв.дюйм) H2 при комнатной температуре в течение 3 ч. Реакционную смесь фильтруют через celite, и фильтрат концентрируют на роторном испарителе и 3 раза отгоняют азеотроп с толуолом. 28 Сушка при сильном разрежении и комнатной температуре приводит к получеию 3,37 г желтого масла. Это масло растворяют в 100 мл толуола, добавляют 10 мл триэтиламина, и смесь нагревают с обратным холодильником в атмосфере азота. Через 17 ч реакционную смесь охлаждают до комнатной температуры и на роторном испарителе удаляют толуол. Остаток растворяют в 250 мл этилацетата и промывают 3 х 50 мл 1 н. HCl, 1 х 50 мл H2O, 1 х 50 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 2,84 г масла янтарного цвета. Это второе масло растворяют в 60 мл этанола и добавляют 20 мл 1 н.NaOH. Через 30 мин нагревания с обратным холодильником реакционную смесь охлаждают до комнатной температуры и концентрируют на роторном испарителе. Остаток разбавляют 200 мл Н 2 О, подкисляют 1 н. HCl до рН 2 и экстрагируют 2 х 100 мл этилацетата. Органические экстракты объединяют, промывают 1 х 50 мл Н 2O, 1 х 50 мл рассола и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка рассола, и сушат над Na2SO4. Фильтрация, концентрирование фильтрата и сушка приводят к получению 2,45 г желтоватокоричневого аморфного твердого вещества. Это твердое вещество нагревают на масляной бане до 180 С (наружная температура) в атмосфере азота. Через 20 мин при 180 С прекращается выделение пузырьков газа, и полученную коричневую жидкость охлаждают до комнатной температуры. При охлаждении жидкость кристаллизуется до желтовато-коричневого твердого вещества. Хроматография на силикагеле (5% СН 3 ОН/СН 2 Сl2, флэш) приводит к получению 1,21 г (общий выход 60%) серебристо-белых хлопьев. Т.пл. 197-198 С. ИК (CDCl3) 3197, 3093, 2967, 2874, 2818,1705, 1682 см-1 ; 1N 14.33. Пример 2. (+)-4-(1-Циклопентил-3-этил 1 Н-индазол-6-ил)-пирролидин-2-он и (-)-4-(1 циклопентил-3-этил-1 Н-индазол-6-ил)пирролидин-2-он. 958 мг рацемического 4-(1-циклопентил-3 этил-1 Н-индазол-6-ил)-пирролидин-2-она разделяют хроматографическим методом на Chiracel OD колонке с внутренним диаметром 5 см и длиной 50 см. Подвижной фазой является смесь 88:12 гептан:изопропанол с 0,05% диэтиламина в качестве добавки. Загрузка для каждого цикла представляет собой 60 мг рацемата в 4 мл изопропанола. Объемная скорость потока составляет 70 мл/мин, и разделение наблюдают при 230 нм. На 50 и 55 мин элюированы два пика. Средние фракции 50 минутного пика объединяют и анализируют (96% ее). Эту фракцию(8 л) концентрируют, и остаток очищают на колонке с силикагелем (5% СН 3 ОН/СН 2 Сl2, флэш) с получением 371 мг белого твердого вещества,которое перекристаллизовывают из смеси этилацетат/гексаны с получением 295 мг серебристо-белых хлопьев. Т.пл. 132-135 С; ИК (СDСl3) 3204, 3097,2967, 2873, 1702 см-1. 1N 14.17; [а]D=-34,3 С (с=1.15, СНСl3). Средние фракции 55 минутного пика объединяют и анализируют (94% ее). Эту фракцию(13 л) концентрируют, и остаток очищают на колонке с силикагелем (5% СН 3 ОН/СН 2Cl2,флэш) с получением 400 мг белого твердого вещества, которое перекристаллизовывают из смеси этилацетат/гексаны с получением 256 мг белых кристаллов. Т.пл. 132,5-135,5 С; ИК (СDСl3) 3203, 3097, 2967, 2872, 1703 см-1; 1 или его фармацевтически приемлемая соль,где R представляет собой циклопентил или циклогексил;R2 представляет собой группировку, выбранную из группы, состоящей из группировок формул с (1.1) по (1.12): 2. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.1). 3. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.10). 4. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.6). 5. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.5). 6. Соединение по п.1, в котором R2 представляет собой группировку формулы (1.3). 7. Соединение по п.1, выбранное из группы, состоящей из рацемического 4-(1-циклопентил-3-этил 1 Н-индазол-6-ил)пирролидин-2-она;(-)-4-(1-циклопентил-3-этил-1 Н-индазол-6 ил)пирролидин-2-она; и фармацевтически приемлемых солей указанных соединений. 8. Соединение по п.1, выбранное из группы, состоящей из рацемического 4-(1-циклогексил-3-этил 1 Н-индазол-6-ил)пирролидин-2-она;(-)-4-(1-циклогексил-3-этил-1 Н-индазол-6 ил)пирролидин-2-она; и фармацевтически приемлемых солей указанных соединений. 9. Соединение по п.1, в котором R представляет собой циклопентил. 10. Соединение по п.1, в котором R представляет собой циклогексил. 11. Соединение по п.1, в котором R1 представляет собой этил. 12. Фармацевтическая композиция для ингибирования фосфодиэстеразы (ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, содержащая терапевтически эффективное количество соединения по п.1 и фармацевтически приемлемый носитель. 13. Способ ингибирования фосфодиэстеразы (ФДЭ) типа IV или выработки фактора некроза опухоли (ФНО) у млекопитающего, при котором указанному млекопитающему вводят терапевтически эффективное количество соединения по п.1.
МПК / Метки
МПК: A61K 31/416, C07D 403/04, A61P 37/00
Метки: применение, типа, фосфодиэстеразы, опухоли, замещенного, фдэ, фактора, качестве, некроза, индазола, фно, призводные, ингибиторов
Код ссылки
<a href="https://eas.patents.su/16-2274-prizvodnye-zameshhennogo-indazola-i-ih-primenenie-v-kachestve-ingibitorov-fosfodiesterazy-fde-tipa-iv-i-faktora-nekroza-opuholi-fno.html" rel="bookmark" title="База патентов Евразийского Союза">Призводные замещенного индазола и их применение в качестве ингибиторов фосфодиэстеразы (фдэ) типа iv и фактора некроза опухоли (фно)</a>












