Полиморфные формы трет-бутилового эфира аторвастатина и их использование в качестве промежуточных соединений для получения аторвастатина
Номер патента: 10166
Опубликовано: 30.06.2008
Авторы: Зупет Рок, Яксе Рената, Стимац Антон, Грцман Мария, Смрколь Матей
Формула / Реферат
1. Кристаллическая форма 1 трет-бутилового эфира аторвастатина формулы (II)
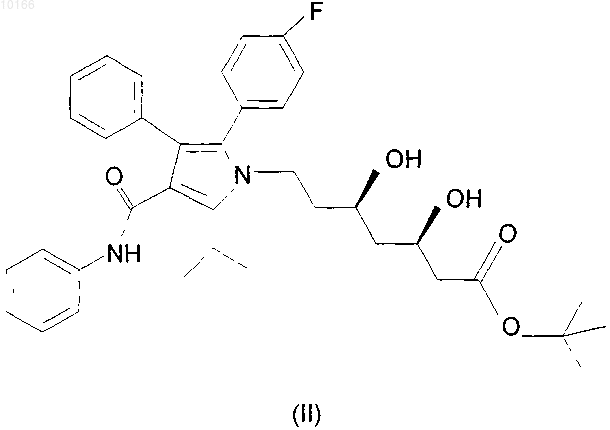
отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,10, 6,83, 10,77, 17,01 + 0,1ш.
2. Кристаллическая форма 1 по п.1, отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,10, 6,83, 10,77, 12,18, 16,20, 17,01, 17,65, 19,07, 19,80, 21,25, 21,64, 23,70, 27,60 +0,1ш.
3. Кристаллическая форма 1 трет-бутилового эфира аторвастатина (II), отличающаяся тем, что имеет кривую дифференциальной сканирующей калориметрии (ДСК), изображенную на фиг. 3, с начальной температурой около 97шС.
4. Способ получения кристаллической формы 1 по любому из пп. 1-3, включающий
растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина формулы (I)
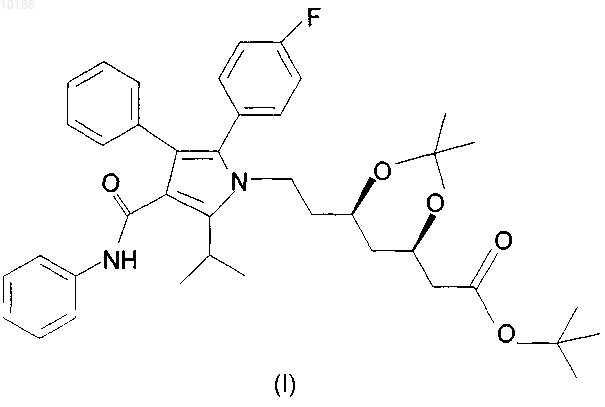
в смешивающемся с водой растворителе и
добавление водного раствора кислоты, предпочтительно HCl, при температуре 10-50шС, предпочтительно при 10-40шС, наиболее предпочтительно при комнатной температуре.
5. Способ по п.4, дополнительно включающий проведение реакции взаимодействия диметилкеталя трет-бутилового эфира аторвастатина (I) с кислотой в течение 3-24 ч при той же температуре до завершения реакции.
6. Способ по п.5, дополнительно включающий добавление воды к реакционной смеси после завершения реакции для осаждения трет-бутилового эфира аторвастатина (II).
7. Способ по п.6, где объем воды, добавляемой к реакционной смеси, больше, чем объем смешивающегося с водой растворителя.
8. Способ по п.6 или 7, где объем воды, добавляемой к реакционной смеси, больше, чем объем реакционной смеси.
9. Способ по любому из пп.4-8, где смешивающийся с водой растворитель и водный раствор кислоты используются в соотношении 10:1, предпочтительно 6:1 и наиболее предпочтительно 4:1 (по объему).
10. Способ по любому из пп.4-9, где смешивающимся с водой растворителем является ацетонитрил.
11. Кристаллическая форма 2 трет-бутилового эфира аторвастатина формулы (II)
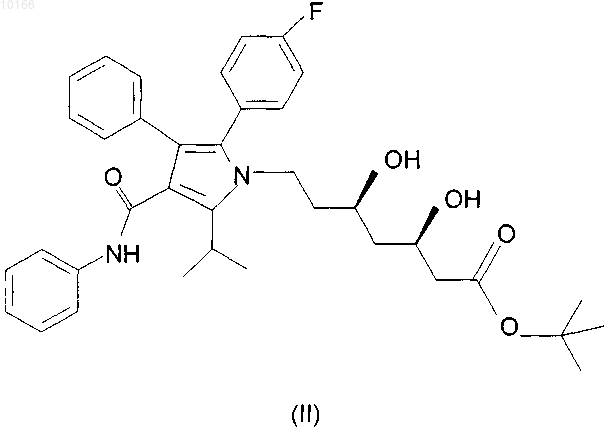
отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,48, 12,15, 17,21, 18,34, 20,18, 20,47, 24,45 +0,1ш.
12. Кристаллическая форма 2 по п.11, отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,48, 7,59, 10,97, 12,15, 15,02, 17,21, 18,34, 20,18ш, 20,47, 21,59, 24,45, 26,07, 29,41 + 0,1ш.
13. Кристаллическая форма 2 трет-бутилового эфира аторвастатина формулы (II), отличающаяся тем, что имеет кривую ДСК, изображенную на фиг. 4, с начальной температурой около 144шС.
14. Способ получения кристаллической формы 2 трет-бутилового эфира аторвастатина по любому из пп.11-13, включающий
растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина формулы (I) в смешивающемся с водой растворителе,
добавление водного раствора кислоты, предпочтительно HCl и
нагревание смеси до 50-100шС, предпочтительно до температуры кипения смеси.
15. Способ по п.14, дополнительно включающий проведение реакции взаимодействия диметилкеталя трет-бутилового эфира аторвастатина (I) с кислотой в течение 3-24 ч при той же температуре до завершения реакции.
16. Способ по п.15, дополнительно включающий добавление воды к реакционной смеси после завершения реакции для осаждения трет-бутилового эфира аторвастатина (II).
17. Способ по п.16, где объем воды, добавляемой к реакционной смеси, больше, чем объем смешивающегося с водой растворителя.
18. Способ по пп.16, 17, где объем воды, добавляемой к реакционной смеси, больше, чем объем реакционной смеси.
19. Способ по любому из пп.14-18, где смешивающимся с водой растворителем является ацетонитрил.
20. Способ по любому из пп.14-19, где смешивающийся с водой растворитель и водный раствор кислоты используются в отношении 10 к 1, предпочтительно 6 к 1, наиболее предпочтительно 4 к 1 (по объему).
21. Применение кристаллической формы 1 по любому из пп.1-3 для получения гемикальциевой соли аторвастатина в аморфной или кристаллической форме или их смеси.
22. Применение кристаллической формы 2 по любому из пп.11-13 для получения гемикальциевой соли аторвастатина в аморфной или кристаллической форме или их смеси.
23. Способ получения гемикальциевой соли аторвастатина с использованием кристаллической формы 1 по любому из пп.1-3 или кристаллической формы 2 по любому из пп.11-13, включающий
осуществление взаимодействия кристаллической формы 1 или кристаллической формы 2 с основанием в растворителе,
добавление соли кальция для образования гемикальциевой соли аторвастатина и
проведение осаждения гемикальциевой соли аторвастатина.
24. Способ по п.23, где растворитель представляет собой смесь трет-бутилметилового эфира, метанола и воды, где объем воды больше объема трет-бутилметилового эфира, и где осаждение геми-кальциевой соли аторвастатина проводят, добавляя воду к реакционной смеси.
Текст
010166 Область изобретения Настоящее изобретение относится к новым кристаллическим формам 1 и 2 третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]1 Н-пиррол-1-гептановой кислоты формулы (II), далее называемый трет-бутиловым эфиром аторвастатина (II). Изобретение также относится к способу получения этих кристаллических форм, для которого в качестве исходного материала используется третичный бутиловый эфир (4R-цис)-6-2-[2-(4-фторфенил)-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]пиррол-1-ил]этил-2,2-диметил-1,3-диоксан-4-уксусной кислоты формулы (I), далее называемый диметилкеталь трет-бутилового эфира аторвастатина (I). Более точно, изобретение относится к использованию этих новых полиморфных форм в качестве промежуточных соединений для получения фармацевтически приемлемых солей аторвастатина. Предшествующий уровень техники Трет-бутиловый эфир аторвастатина (II), известный и важный предшественник для получения ингибитора HMG-CoA (3-гидрокси-3-метилглутарилкоэнзим А) редуктазы аторвастатина ([R-(R,R)]-2-(4 фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты) и его солей, а также фармацевтически приемлемых эфиров. Эти вещества относятся к классу лекарств, называемых статинами. Статины подавляют биосинтез холестерина посредством конкурентного ингибирования 3-гидрокси 3-метилглутарил-коэнзима А редуктазы, катализирующей превращение HMG-CoA в мевалонат, которое является скорость-определяющей стадией в биосинтезе холестерина. В настоящее время они являются наиболее терапевтически эффективными лекарствами, пригодными для лечения гиперлипидемии и гиперхолестеринемии, являющимися факторами риска для артериосклероза и коронарной болезни сердца. Способы получения аторвастатина и ключевых промежуточных соединений раскрыты, например, в патентах США : 5003080; 5097045; 5103024; 5124482; 5149837; 5155251; 5216174; 5245047; 5248793; 5280126; 5342952; 5397792; 4681893; 5273995 и 5298627. Кроме того, К.Л. Бауман с соавторами описали получение диметилкеталя трет-бутилового эфира аторвастатина (I) путем синтеза Пааля-Кнорра пирролов с использованием смеси трех растворителей толуол-гептан-тетрагидрофуран (1:4:1), катализируемого триметилуксусной кислотой, и превращение (I) в геми-кальциевую соль аторвастатина без выделения каких-либо промежуточных продуктов (Tetrahedron Lett. 1992, 33, 2283-2284). Аналогичную процедуру описали Петер В.К. с соавторами в J. Label.Compd. Radiopharm., 1999, vol. 42, part II, 135-145 и B.C. Чен с соавторами в J. Label. Compd. Radiopharm.,2000, vol. 43, part III, 261-270. Также в WO 02/059087 описано прямое превращение диметилкеталя трет-бутилового эфира аторвастатина (I) в некристаллическую гемикальциевую соль аторвастатина или лактон аторвастатина без выделения промежуточных продуктов. Х.Т. Ли с соавторами описали в J. Label. Compd. Radiopharm., 1999, vol. 42, part II, 129-133 получение трет-бутилового эфира аторвастатина (II) восстановлением соответствующего -кетоэфира.-1 010166 В WO 02/083637 и WO 02/083638 раскрыто, что обработка диметилкеталя трет-бутилового эфира аторвастатина (I) в метаноле водным раствором соляной кислоты дает сложную смесь, содержащую 5 промежуточных продуктов, как показано с помощью ВЭЖХ (высокоэффективной жидкостной хроматографии). Процентное содержание и распределение обнаруженных соединений в реакционной смеси различается в зависимости от условий реакции. Однако ни один из промежуточных продуктов, включая трет-бутиловый эфир аторвастатина (II) не был выделен, а реакционный раствор был далее обработан разбавленным водным раствором гидроксида натрия. Более того, в WO 02/43667 и WO 03/016317 также описаны трудности в процессе получения гмикальциевой соли аторвастатина, в частности на стадии превращения диметилкеталя трет-бутилового эфира аторвастатина (I), используя кислотный катализатор, в трет-бутиловый эфир аторвастатина (II). Продукт, как показано, содержащий другие соединения, такие как лактон аторвастатина и аторвастатин в виде свободной кислоты, был выделен, например, в виде масла, что указывает на загрязненность третбутилового эфира аторвастатина (II), полученного таким способом. Таким образом, эти способы не обеспечивают получение трет-бутилового эфира аторвастатина (II) в виде четко установленной кристаллической формы с высокой степенью чистоты. Изложенное выше показывает, что способы, известные из предшествующего уровня техники, не обеспечивают получение трет-бутилового эфира аторвастатина (II) в кристаллической форме, а следовательно, и с высокой степенью чистоты. Более того, эти способы, известные из предшествующего уровня техники, не приводят к образованию геми-кальциевой соли аторвастатина с фильтруемостью и чистотой, приемлемой для получения фармацевтических составов, поскольку присутствующие примеси сложно удалить. Следовательно, до сих пор существует потребность в способе получения аторвастатина, в частности в виде его геми-кальциевой соли с хорошей фильтруемостью и высокой чистотой, что делает его приемлемым для приготовления фармацевтических составов. Кроме того, существует необходимость в предшественниках, позволяющих просто получать полиморфные формы аторвастатина и его фармацевтически приемлемых солей или превращать в другие формы аторвастатина и его фармацевтичеси приемлемых солей. Перечисленные проблемы решаются настоящим изобретением. Подробное описание изобретения Во-первых, изобретение относится к двум хорошо охарактеризованным полиморфным формам трет-бутилового эфира аторвастатина (II), обозначенным как кристаллическая форма 1 и форма 2, являющимся превосходными промежуточными соединениями для получения аторвастатина и его производных, в частности для получения аморфной геми-кальциевой соли аторвастатина. Эти две полиморфные формы были охарактеризованы рентгенографией и дифференциальной сканирующей калориметрией(ДСК). Порошковая рентгенография была выполнена с помощью дифрактометра Phillips PW 3040/60 X'PertPRO, используя излучение CuK 1,541874. ДСК проводили с помощью сканирующего калориметра PerkinElmer DSC 7. Образцы массой около 3 мг сканировали в нагревательном режиме 10 С/мин в атмосфере азота в открытых алюминиевых кюветах для ДСК. Кристаллическая форма 1 трет-бутилового эфира аторвастатина (II) по изобретению характеризуется рентгенодифрактограммой с пиками при значениях угла 2-тета: 6,10, 6,83, 10,77, 17,010,1. Предпочтительно, чтобы на рентгенодифрактограмме имелись пики при значениях угла 2-тета: 6,10, 6,83, 10,77, 12,18, 16,20, 17,01, 17,65, 19,07, 19,80, 21,25, 21,64, 23,70, 27,60 0,1. Характерная рентгенодифрактограмма образца кристаллической формы 1 приводится в табл. 1 посредством перечисления градусов 2-тета вместе с соответствующими интенсивностями. В табл. "s" означает высокую относительную интенсивность (от 30 до 100%), а m означает среднюю относительную интенсивность (от 10 до 30%). Кроме того, кристаллическая форма 1 трет-бутилового эфира аторвастатина (II) по изобретению охарактеризована кривой ДСК, приведенной на фиг. 3, с начальной температурой около 97 С. Кристаллическая форма 2 трет-бутилового эфира аторвастатина (II) по изобретению охарактеризована методом порошковой рентгенографии и имеет рентгенодифрактограмму с пиками при значениях угла 2-тета: 6,48, 12,15, 17,21, 18,34, 20,18, 20,47, 24,450,1. Предпочтительно, чтобы на рентгенодифрактограмме имелись пики при значениях угла 2-тета: 6,48, 7,59, 10,97, 12,15, 15,02, 17,21, 18,34, 20,18, 20,47, 21,59, 24,45, 26,07, 29,41 0,1. Характерная рентгенодифрактограмма образца кристаллической формы 2 приводится в табл. 2 посредством перечисления градусов 2-тета вместе с соответствующими интенсивностями. В табл. s означает высокую относительную интенсивность (от 30 до 100%), а m означает среднюю относительную интенсивность (от 10 до 30%). Таблица 2 Кроме того, кристаллическая форма 2 трет-бутилового эфира аторвастатина (II) по изобретению охарактеризована кривой ДСК, приведенной на фиг. 4, с начальной температурой около 144 С. Фиг. 1 иллюстрирует порошковую рентгенодифрактограмму формы 1 трет-бутилового эфира аторвастатина (II). Фиг. 2 иллюстрирует порошковую рентгенодифрактограмму формы 2 трет-бутилового эфира аторвастатина (II). Фиг. 3 иллюстрирует кривую ДСК формы 1 трет-бутилового эфира аторвастатина (II). Фиг. 4 иллюстрирует кривую ДСК формы 2 трет-бутилового эфира аторвастатина (II). Кристаллическую форму 1 трет-бутилового эфира аторвастатина (II) по изобретению получают способом, включающим растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина(I) в смешивающимся с водой растворителе и добавление водного раствора кислоты при температуре от 10 до 50 С, предпочтительно при температуре от 10 до 40 С и наиболее предпочтительно при комнатной температуре. Кристаллическую форму 2 трет-бутилового эфира аторвастатина (II) по изобретению, получают способом, включающим растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина(I) в смешивающимся с водой растворителе и добавление водного раствора кислоты при температуре от 50 до 100 С, предпочтительно при кипячении смеси с обратным холодильником. В способе получения формы 1 и формы 2 диметилкеталь трет-бутилового эфира аторвастатина (I),использующийся в качестве исходного материала, может находиться в любой форме, например, присутствовать в реакционном растворе, в фильтрате, в любой неочищенной, полиморфной, безводной, сольватированной или гидратной форме или их смесях, полученных согласно любому способу, известному специалисту, или описанному на предшествующем уровне техники. Смешивающимися с водой растворителями являются предпочтительно органические растворители,в частности ацетонитрил, 1,2-диметоксиэтан, тетрагидрофуран, низшие спирты, такие как метанол, этанол, пропанол, изопропанол и бутанол, или этилацетат. Наиболее предпочтительным растворителем является ацетонитрил. Кроме того, наиболее предпочтительной кислотой является соляная кислота. Также предпочтительно, чтобы при получении форм 1 и 2 трет-бутилового эфира аторвастатина(II), смешивающийся с водой растворитель и водный раствор кислоты использовали в соотношении 10 к 1, предпочтительнее 6 к 1 и наиболее предпочтительно 4 к 1 (по объему). Более того, эффективно проводить взаимодействие диметилкеталя трет-бутилового эфира аторвастатина (II) с кислотой при установленной температуре в течение 3-24 ч. Этого времени реакции достаточно для завершения реакции. Наконец, эффективным является добавление воды к смеси после завершения реакции для того, чтобы осадить трет-бутиловый эфир аторвастатина. Предпочтительно, чтобы вода добавлялась в большем объеме по сравнению со смешивающимся с водой растворителем и более предпочтительно в объеме большем, чем общий объем реакционной смеси. Неожиданно подобная специфическая процедура осаждения приводит к продукту, который можно выделить с высоким выходом и высокой чистотой. Это является существенным преимуществом по сравнению со способами, известными из предшествующего уровня техники и приводящим к сложным реакционным смесям. Согласно способу по изобретению возможно в значительной мере уменьшить содержание устойчивых примесей. Так, чистота полученного трет-бутилового эфира аторвастатина (II) обычно составляет более 98%, предпочтительно более 99%. В другом предпочтительном воплощении, возможно также получить кристаллическую форму 2 трет-бутилового эфира аторвастатина (II) кристаллизацией трет-бутилового эфира аторвастатина (II) из конкретного растворителя, выбранного из этилацетата, метанола, этанола, ацетонитрила и изопропанола. Предпочтительным растворителем является ацетонитрил или изопропанол. Кристаллические формы 1 и 2 по изобретению идеально подходят в качестве промежуточных соединений для получения любой формы аторвастатина, например, аторвастатина в виде свободной кислоты, лактона аторвастатина или соли аторвастатина, либо производных аторвастатина. Предпочтительно кристаллические формы 1 и 2 использовать для получения любой формы соли аторвастатина в аморфной или любой полиморфной форме, а наиболее предпочтительно для получения аморфной гемикальциевой соли аторвастатина. Таким образом, изобретение также относится к способу получения любых форм аторвастатина,предпочтительно гемикальциевой соли аторвастатина, с использованием для этого кристаллической формы 1 или кристаллической формы 2. Способ предпочтительно включает взаимодействие кристаллической формы 1 или кристаллической формы 2 с основанием в смеси трет-бутилметилового эфира, метанола и воды, где объем воды больше, чем объем трет-бутилметилового эфира. добавление соли кальция для образования гемикальциевой соли аторвастатина и добавление воды к реакционной смеси для осаждения гемикальциевой соли аторвастатина. Основанием может являться, в частности, NaOH, а солью кальция могут являться, в частности, хлорид кальция или ацетат кальция. Неожиданно оказалось, что способ по изобретению лишен недостатков, присущих известным способам, и обеспечивает простой, воспроизводимый и рентабельный способ получения однородно аморфной геми-кальциевой соли аторвастатина с высокой степенью чистоты. Более того, способ обеспечивает получение продукта с чрезвычайно хорошей фильтруемостью вследствие большого размера частиц. Это существенно облегчает отделение продукта, что может быть важно для высокого выхода и чистоты продукта. Таким образом, настоящее изобретение обеспечивает превращение диметилкеталя трет-бутилового эфира аторвастатина (I) в трет-бутиловый эфир аторвастатина (II) с высокой степенью чистоты, а также-4 010166 превращение последнего в геми-кальциевую соль аторвастатина с высокой степенью чистоты в некристаллической, в частности аморфной, форме. Кроме того, настоящее изобретение также предлагает способ для получения фармацевтического состава, содержащего геми-кальциевую соль аторвастатина с высокой степенью чистоты, которая была получена из кристаллической формы 1 и 2 трет-бутилового эфира аторвастатина (II) по изобретению, в некристаллической, в частности аморфной, форме. Изобретение далее иллюстрируется примерами. Примеры Получение формы 1 третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) конденсацией 4 фтор[2-метил-1-оксопропил]оксо-N,-дифенилбензенбутанамида и третичного бутилового эфира(4R-цис)-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан-4-уксусной кислоты. Пример 1. К раствору 1,32 г третичного бутилового эфира (4R-цис)-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан 4-уксусной кислоты (4,8 ммоль, 1,2 эквив.) в смеси 9:1 гептана и толуола (30 мл) последовательно добавили 0,49 г 2-метилмасляной кислоты (0,52 мл, 4,8 ммоль, 1,2 эквив.) и 1,66 г 4-фтор[2-метил-1 оксопропил]оксо-N,-дифенилбензенбутанамида (4,0 ммоль). Гетерогенную смесь перемешивали при кипячении с обратным холодильником в атмосфере аргона в течение 22 ч. Образовавшийся желтый раствор оставляли охлаждаться при комнатной температуре, разбавляли 30 мл трет-бутилметилового эфира и промывали последовательно 50 мл 1 М NaOH, 30 мл 1 М HCl и, наконец, солевым раствором. После выпаривания растворителей образовывался вязкий светло-коричневый осадок, который растворяли в 12 мл ацетонитрила, 2,2 мл воды и 0,6 мл 1 М HCl. Полученный прозрачный раствор перемешивали ночь, в течение этого времени произошло образование осадка. Добавили 10 мл воды, а затем 20 мл ацетонитрила, который предпочтительно использовать для того, чтобы перевести полутвердый осадок в фильтруемую форму. Перемешивание продолжали в течение по меньшей мере 1 ч. Твердое вещество отфильтровывали, высушенный на воздухе материал дважды перекристаллизовывали из ацетонитрила и продукт сушили в вакууме при 20-25 С до постоянной массы. Получали 0,70 г, 28,5% кристаллизованного третичного бутилового эфира [R-(R,R)]-2-(4 фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) с температурой плавления в диапазоне 60-90 С. Чистота полученного продукта составила около 96%. Пример 2. К раствору 1,32 г третичного бутилового эфира (4R-цис)-6-(2-аминоэтил)-2,2-диметил-1,3-диоксан 4-уксусной кислоты (4,8 ммоль) в смеси 9:1 гептана и толуола (30 мл) добавили последовательно 0,245 г 2-метилмасляной кислоты (0,26 мл, 2,4 ммоль) и 1,66 г 4-фтор[2-метил-1-оксопропил]оксо-N,дифенилбензенбутанамида (4,0 ммоль). Гетерогенную смесь перемешивали при кипячении с обратным холодильником в атмосфере аргона в течение 48 ч. Полученный желтый раствор оставляли охлаждаться при комнатной температуре, разбавляли 30 мл трет-бутилметилового эфира и промывали последовательно 50 мл 1 М NaOH, 30 мл 1 М HCl и, наконец, солевым раствором. После выпаривания растворителей образовывался вязкий остаток оранжевого цвета, который растворяли в 12 мл ацетонитрила, 2,2 мл воды и 0,6 мл 1 М HCl. Полученную смесь нагревали при 45-49 С с перемешиванием в течение 5,5 ч до полного превращения промежуточного вещества формулы (I) согласно ВЭЖХ анализу. Смесь оставляли охлаждаться и продолжали перемешивание при 20-25 С 2 ч, в течение этого периода началось выпадение осадка. Добавили 10 мл воды, а затем 10 мл ацетонитрила, последний предпочтительно использовать для превращения полутвердого осадка в фильтруемую суспензию, после чего продолжали перемешивание в течение 1 ч. Твердое вещество отфильтровали, отфильтрованный осадок промывали 4 мл 50%-ного (объем/объем) водным раствором ацетонитрила, а затем продукт сушили в вакууме при 20-25 С до постоянной массы (0,754 г). Оставшийся фильтрат перемешивали при комнатной температуре в течение ночи. Вторую порцию осадка отфильтровывали, промывали 4 мл 50%-ного (объем/объем) водного раствора ацетонитрила, а затем продукт сушили в вакууме при 20-25 С до постоянной массы (0,373 г). Этот продукт согласно ВЭЖХ анализу является идентичным продукту, полученному из первой порции. Получали 1,127 г, 45,8%-ного кристаллизованного третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) с температурой плавления 84-91 С. Чистота полученного продукта оказалась выше 98%. Получение формы I третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) Пример 3. 3 г, 4,58 ммоль третичного бутилового эфира (4R-цис)-6-2-[2-(4-фторфенил)-5-(1-метилэтил)-3 фенил-4-[(фениламино)карбонил]пиррол-1-ил]этил-2,2-диметил-1,3-диоксан-4-уксусной кислоты (I) поместили в 50 мл колбу и суспендировали в 13,5 мл ацетонитрила, 2,6 мл воды и 0,72 мл 1 М HCl. Реакционную смесь перемешивали не менее 12 ч, после чего добавляли 30 мл воды и перемешивание про-5 010166 должали не менее 1 ч. Твердое вещество отфильтровали и отфильтрованный осадок промывали 1 мл воды. Влажный осадок сушили при 20-25 С в течение 3 ч и при 45-50 С в течение 6 ч, пока ПВС (потеря веса при сушке) не составила 0,5%. Получали 185,8 мг, 98,9% третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II)с температурой плавления в диапазоне 100-102 С. Чистота полученного продукта составила более 99%. Получение формы II третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II). Пример 4. 10 г, 15,3 ммоль третичного бутилового эфира (4R-цис)-6-2-[2-(4-фторфенил)-5-(1-метилэтил)-3 фенил-4-[(фениламино)карбонил]пиррол-1-ил]этил-2,2-диметил-1,3-диоксан-4-уксусной кислоты (I) добавили в 500 мл колбу и суспендировали в 45 мл ацетонитрила, 18,8 мл воды и 2,4 мл 1 М HCl. Реакционную смесь нагревали до 45 С до полного растворения исходного материала, ход реакции контролировали ВЭЖХ. После 4 ч реакционную смесь охлаждали до комнатной температуры и добавляли 100 мл воды. Твердый осадок отфильтровывали и осадок промывали 50 мл смеси растворителей, содержащей ацетонитрил и воду (1:1, объем:объем). Влажный осадок сушили при 20-25 С на воздухе до постоянной массы. Получили 8,45 г, 89,9% третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси 5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) с температурой плавления 142-145 С. Чистота полученного продукта составила более 99%. Пример 5. 1 г, 1,5 ммоль третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1 метилэтил)-3-фенил-4-[(фениламино) карбонил]-1 Н-пиррол-1 -гептановой кислоты (II) растворяли в 5 мл ацетонитрила и нагревали с обратным холодильником до кипения. Кристаллизующуюся смесь медленно охлаждали до комнатной температуры, после чего образовались кристаллы. Густую суспензию охлаждали до 0-5 С и кристаллы отфильтровали. Продукт сушили на воздухе при 20-25 С до постоянной массы. Получали 0,915 г, 91,5% кристаллического третичного бутилового эфира [R-(R,R)]-2-(4 фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) с температурой плавления 146-148 С. Чистота полученного продукта составляет более 99%. Пример 6. 1 г, 1,5 ммоль третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1 метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) растворяли в 10 мл 2-пропанола при температуре кипения растворителя. Кристаллизующуюся смесь медленно охлаждали до комнатной температуры, а затем до 0-5 С. Образовавшиеся кристаллы отфильтровывали. Продукт сушили при 20-25 С на воздухе до постоянной массы. Получали 0,626 г, 62,6% кристаллизованного продукта с температурой плавления 141-143 С. Чистота полученного продукта составила более 99%. Получение аморфной гемикальциевой соли аторвастатина. Пример 7. К раствору 1 г третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1 метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) (1,62 ммоль) в 3,4 мл метанола и 2,8 мл трет-бутилметилового эфира, добавляли 68,4 мг NaOH (1,7 ммоль, 1,05 эквив.) и 5,8 мл воды. Реакционную смесь продували потоком азота в течение 5 мин и нагревали с обратным холодильником до кипения в течение 2-4 ч, пока концентрация исходного третичного бутилового эфира [R(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) не стала меньше 0,5%, что определяли ВЭЖХ. Реакционную смесь оставляли охлаждаться до 20-25 С, добавляли активный уголь и реакционную смесь перемешивали еще в течение 30 мин. Реакционную смесь фильтровали и рН фильтрата доводили до 8,0-8,2 добавлением HCl. Реакционную смесь промывали три раза по 2,9 мл трет-бутилметиловым эфиром и водную фазу фильтровали. Реакционную смесь продували потоком азота в течение 5 мин, а затем добавляли 0,179 г СаС 12 (0,82 ммоль CaCl26H2O) и 6,8 мл воды в течение 15-20 мин при 20-25 С. После окончания добавления CaCl2 реакционную смесь перемешивали еще в течение 15-30 мин. Затем в реакционную смесь медленно добавляли 6 мл воды для начала кристаллизации вязкой эмульсиоподобной смеси. Гемикальциевая соль аторвастатина образовывалась в виде частиц с размером до нескольких мм, что давало лучшую фильтруемость. Осадок отфильтровывали через 30 мин. Влажный осадок промывали водой. Собранный твердый материал сушили на воздухе с получением сухой твердой гемикальциевой соли аторвастатина. Пример 8. К раствору 9,22 г третичного бутилового эфира [R-(R,R)]-2-(4-фторфенил)-,-дигидрокси-5-(1 метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) (15 ммопь) в 61 мл-6 010166 метанола и 52 мл трет-бутилметилового эфира добавили 0,63 г NaOH (15,7 ммоль, 1,05 эквив.) и 104 мл воды. Реакционную смесь продували потоком азота в течение 5 мин и кипятили с обратным холодильником в течение 2-4 ч, пока концентрация исходного третичного бутилового эфира [R-(R,R)]-2-(4 фторфенил)-,-дигидрокси-5-(1-метилэтил)-3-фенил-4-[(фениламино)карбонил]-1 Н-пиррол-1-гептановой кислоты (II) не составила менее 0,5%, что определяли ВЭЖХ. Реакционную смесь оставляли охлаждаться до 20-25 С, рН доводили до 8,0-8,2 добавлением HCl. Реакционную смесь трижды промывали трет-бутилметиловым эфиром по 26 мл и водную фазу фильтровали. Реакционную смесь продували потоком азота в течение 5 мин, затем добавляли 1,80 г CaCl2 (8,2 ммоль CaCl26 Н 2 О) и 64 мл воды в течение 15-25 мин при температуре 20-25 С. После окончания добавления CaCl2 реакционную смесь перемешивали еще в течение 15-30 мин, затем в реакционную смесь медленно добавляли 270 мл воды для начала кристаллизации вязкой эмульсиоподобной смеси. Гемикальциевая соль аторвастатина образовывалась в виде гранул с улучшенной фильтруемостью. Осадок отфильтровывали и влажный осадок промывали смесью воды и метанола, а в конце водой. Собранный твердый осадок сушили на воздухе с получением сухой твердой гемикальциевой соли аторвастатина. Сухую гемикальциевую соль аторвастатина можно, по желанию, размолоть в сухой крупошлифовальной машине. Пример 9. К раствору 5,47 г третичного эфира (4R-цис)-6-2-[2-(4-фторфенил)-5-(1-метилэтил)-3-фенил-4[(фениламино)карбонил]пиррол-1-ил]этил-2,2-диметил-1,3-диоксан-4-уксусной кислоты (20 ммоль, 1 эквив.) в смеси 9:1 гептана и толуола (150 мл) последовательно добавляли 2,04 г триметилуксусной кислоты (2,30 мл, 20 ммоль, 1,0 эквив.) и 8,30 г 4-фтор[2-метил-1-оксопропил]оксо-N,дифенилбензенбутанамида (20 ммоль). Гетерогенную смесь перемешивали при кипячении с обратным холодильником в атмосфере аргона в течение 25 ч. Полученный желтый раствор оставляли охлаждаться до комнатной температуры, разбавляли 150 мл трет-бутилметилового эфира и промывали последовательно 150 мл 1 М NaOH, дважды по 150 мл 1 М HCl и, наконец, солевым раствором. После выпаривания растворителей образовывалась ярко-желтая пена, которую растворяли в 60 мл ацетонитрила, 11 мл воды и 3,0 мл 1 М HCl. Полученную смесь нагревали при 45-50 С с перемешиванием в течение 6,5 ч до полного превращения промежуточного соединения формулы (I) согласно анализу ВЭЖХ. Смесь оставляли охлаждаться, добавляли 50 мл воды и перемешивали при 20-25 С 2 ч, в течение этого времени начиналось выпадение осадка. Затем добавляли 50 мл ацетонитрила для перевода полутвердого осадка в фильтруемую суспензию и продолжали перемешивание в течение 1 ч. Твердое вещество отфильтровывали,промывали его 20 мл 50%-ного (объем/объем) водного раствора ацетонитрила и сушили в вакууме при 20-25 С до постоянной массы. Получали 4,77 г (39%) соединения формулы (II) с температурой плавления 90-95 С и чистотой более 98%. К раствору 4,75 г эфира (II) (7,73 ммоль) в 16,5 мл метанола и 14 мл трет-бутилметилового эфира добавляли 0,325 г NaOH (8,1 ммоль, 1,05 эквив.) и 29 мл воды. Реакционную смесь продували потоком азота в течение 5 мин, нагревали до кипения с обратным холодильником в течение 4 ч и охлаждали до комнатной температуры. рН раствора доводили до 11 добавлением 2 М NaOH и кипятили с обратным холодильником в течение 3 ч. Реакционную смесь оставляли охлаждаться до 20-25 С, рН доводили до 8,0-8,2 добавлением HCl. Смесь трижды промывали по 15 мл трет-бутилметиловым эфиром и водную фазу фильтровали. Реакционную смесь продували потоком азота в течение 5 мин, добавляли 0,836 гCaCl26H2O (3,82 ммоль, 0,99 эквив.) в 19 мл воды в течение 15-20 мин при 20-25 С. После завершения добавления CaCl2 реакционную смесь перемешивали еще в течение 15-30 мин и к реакционной смеси медленно добавляли 80 мл воды для начала кристаллизации вязкой эмульсиоподобной смеси. Гемикальциевая соль аторвастатина образовалась в виде гранул с улучшенной фильтруемостью. Твердое вещество отфильтровывали через 2 ч. Влажный осадок промывали смесью воды и метанола, а затем водой. Собранный осадок сушили на воздухе с получением 3,817 г (33% от 4-фтор[2-метил-1-оксопропил]-оксо-N,-дифенилбензенбутанамида) сухой твердой гемикальциевой соли аторвастатина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическая форма 1 трет-бутилового эфира аторвастатина формулы (II) отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,10,-7 010166 6,83, 10,77, 17,010,1. 2. Кристаллическая форма 1 по п.1, отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,10, 6,83, 10,77, 12,18, 16,20, 17,01, 17,65, 19,07, 19,80, 21,25, 21,64,23,70, 27,60 0,1. 3. Кристаллическая форма 1 трет-бутилового эфира аторвастатина (II), отличающаяся тем, что имеет кривую дифференциальной сканирующей калориметрии (ДСК), изображенную на фиг. 3, с начальной температурой около 97 С. 4. Способ получения кристаллической формы 1 по любому из пп. 1-3, включающий растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина формулы (I) в смешивающемся с водой растворителе и добавление водного раствора кислоты, предпочтительно HCl, при температуре 10-50 С, предпочтительно при 10-40 С, наиболее предпочтительно при комнатной температуре. 5. Способ по п.4, дополнительно включающий проведение реакции взаимодействия диметилкеталя трет-бутилового эфира аторвастатина (I) с кислотой в течение 3-24 ч при той же температуре до завершения реакции. 6. Способ по п.5, дополнительно включающий добавление воды к реакционной смеси после завершения реакции для осаждения трет-бутилового эфира аторвастатина (II). 7. Способ по п.6, где объем воды, добавляемой к реакционной смеси, больше, чем объем смешивающегося с водой растворителя. 8. Способ по п.6 или 7, где объем воды, добавляемой к реакционной смеси, больше, чем объем реакционной смеси. 9. Способ по любому из пп.4-8, где смешивающийся с водой растворитель и водный раствор кислоты используются в соотношении 10:1, предпочтительно 6:1 и наиболее предпочтительно 4:1 (по объему). 10. Способ по любому из пп.4-9, где смешивающимся с водой растворителем является ацетонитрил. 11. Кристаллическая форма 2 трет-бутилового эфира аторвастатина формулы (II) отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,48, 12,15, 17,21, 18,34, 20,18, 20,47, 24,45 0,1. 12. Кристаллическая форма 2 по п.11, отличающаяся наличием в порошковой рентгенодифрактограмме пиков при значениях угла 2-тета: 6,48, 7,59, 10,97, 12,15, 15,02, 17,21, 18,34, 20,18, 20,47, 21,59,24,45, 26,07, 29,410,1. 13. Кристаллическая форма 2 трет-бутилового эфира аторвастатина формулы (II), отличающаяся тем, что имеет кривую ДСК, изображенную на фиг. 4, с начальной температурой около 144 С. 14. Способ получения кристаллической формы 2 трет-бутилового эфира аторвастатина по любому из пп.11-13, включающий растворение любой формы диметилкеталя трет-бутилового эфира аторвастатина формулы (I) в смешивающемся с водой растворителе,добавление водного раствора кислоты, предпочтительно HCl и нагревание смеси до 50-100 С, предпочтительно до температуры кипения смеси. 15. Способ по п.14, дополнительно включающий проведение реакции взаимодействия диметилкеталя трет-бутилового эфира аторвастатина (I) с кислотой в течение 3-24 ч при той же температуре до за-8 010166 вершения реакции. 16. Способ по п.15, дополнительно включающий добавление воды к реакционной смеси после завершения реакции для осаждения трет-бутилового эфира аторвастатина (II). 17. Способ по п.16, где объем воды, добавляемой к реакционной смеси, больше, чем объем смешивающегося с водой растворителя. 18. Способ по пп.16, 17, где объем воды, добавляемой к реакционной смеси, больше, чем объем реакционной смеси. 19. Способ по любому из пп.14-18, где смешивающимся с водой растворителем является ацетонитрил. 20. Способ по любому из пп.14-19, где смешивающийся с водой растворитель и водный раствор кислоты используются в отношении 10 к 1, предпочтительно 6 к 1, наиболее предпочтительно 4 к 1 (по объему). 21. Применение кристаллической формы 1 по любому из пп.1-3 для получения гемикальциевой соли аторвастатина в аморфной или кристаллической форме или их смеси. 22. Применение кристаллической формы 2 по любому из пп.11-13 для получения гемикальциевой соли аторвастатина в аморфной или кристаллической форме или их смеси. 23. Способ получения гемикальциевой соли аторвастатина с использованием кристаллической формы 1 по любому из пп.1-3 или кристаллической формы 2 по любому из пп.11-13, включающий осуществление взаимодействия кристаллической формы 1 или кристаллической формы 2 с основанием в растворителе,добавление соли кальция для образования гемикальциевой соли аторвастатина и проведение осаждения гемикальциевой соли аторвастатина. 24. Способ по п.23, где растворитель представляет собой смесь трет-бутилметилового эфира, метанола и воды, где объем воды больше объема трет-бутилметилового эфира, и где осаждение гемикальциевой соли аторвастатина проводят, добавляя воду к реакционной смеси.
МПК / Метки
МПК: C07D 207/34
Метки: использование, трет-бутилового, качестве, формы, получения, соединений, промежуточных, полиморфные, аторвастатина, эфира
Код ссылки
<a href="https://eas.patents.su/11-10166-polimorfnye-formy-tret-butilovogo-efira-atorvastatina-i-ih-ispolzovanie-v-kachestve-promezhutochnyh-soedinenijj-dlya-polucheniya-atorvastatina.html" rel="bookmark" title="База патентов Евразийского Союза">Полиморфные формы трет-бутилового эфира аторвастатина и их использование в качестве промежуточных соединений для получения аторвастатина</a>












