Кристаллическое соединение 7-[(3r)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-a]пиразина
Формула / Реферат
1. Кристаллическое соединение 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1
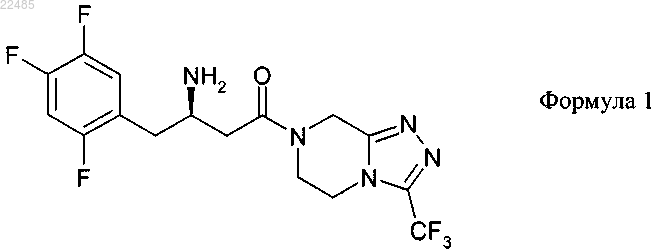
с фумаровой кислотой или его гидрат, при этом молярное соотношение между соединением формулы 1 и фумаровой кислотой составляет от 1:0,95 до 1:1,05, при том, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d (Å), составляющие 12,9 (w), 10,3 (w), 5,15 (m) и 4,30 (vs), и обозначается далее как форма А.
2. Кристаллическое соединение по п.1, отличающееся тем, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d (Å), составляющие 12,9 (w), 10,3 (w), 5,15 (m), 4,69 (m), 4,30 (vs), 3,50 (s) и 3,22 (s).
3. Кристаллическое соединение по одному из пп.1 или 2 для лечения диабета.
4. Медикамент, предназначенный для лечения диабета, содержащий кристаллическое соединение по одному из предыдущих пунктов.
5. Применение кристаллического соединения по одному из пп.1-3 для приготовления медикамента, предназначенного для лечения диабета.
6. Способ получения соединения по одному из пп.1-3, заключающийся в том, что
а) приготавливают раствор 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1,
б) к приготовленному на стадии а) раствору добавляют фумаровую кислоту,
в) полученный на стадии б) состав при необходимости концентрируют и/или при необходимости добавляют к нему приемлемый нерастворитель для снижения растворимости кристаллического соединения и
г) полученное твердое вещество отделяют,
при этом молярное соотношение между растворенным соединением формулы 1 со стадии а) и фумаровой кислотой, используемой на стадии б), составляет от 1:0,95 до 1:1,05.
7. Способ по п.6, отличающийся тем, что фумаровую кислоту добавляют на стадии б) к приготовленному на стадии а) раствору в виде твердого вещества или фумаровую кислоту добавляют на стадии б) к приготовленному на стадии а) раствору в виде раствора в пригодном для этого растворителе.
8. Способ получения формы А путем перемешивания кристаллического соединения формулы 1 (ситаглиптина) и фумаровой кислоты в 2-бутаноне (метилэтилкетоне) или ацетонитриле при молярном соотношении между ситаглиптином и фумаровой кислотой предпочтительно 1:1±0,1.
Текст
В изобретении описано кристаллическое соединение 7-[(3R)-3-амино-1-оксо-4-(2,4,5 трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы (1) с фумаровой кислотой или его гидрат, при этом молярное соотношение между соединением формулы (1) и фумаровой кислотой составляет от 1:0,95 до 1:1,05, при том, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d ,составляющие 12,9 (w), 10,3 (w), 5,15 (m) и 4,30 (vs), а также описан способ получения такого соединения. Настоящее изобретение относится к кристаллическому соединению 7-[(3R)-3-амино-1-оксо-4-(2,4,5 трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (международное непатентованное название (МНН): ситаглиптин) с фумаровой кислотой или его гидрату, при этом молярное соотношение между указанным соединением и фумаровой кислотой составляет от 1:0,95 до 1:1,05, при том, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9 (w), 10,3 (w), 5,15 (m) и 4,30 (vs). Настоящее изобретение относится также к способу получения такого соединения. Диабет представляет заболевание, возникновение которого обусловлено несколькими причинными факторами и которое характеризуется повышенным уровнем глюкозы в плазме крови или гипергликемией в состоянии натощак либо после введения глюкозы в организм при оральном тесте на толерантность к глюкозе. Стойкая или неизлечимая гипергликемия сопряжена с повышенной и преждевременной заболеваемостью и смертностью. Часто ненормальный гомеостаз глюкозы напрямую, а также косвенно связан с изменениями липидного, липопротеинового и аполипопротеинового обмена и с иными метаболическими и гемодинамическими заболеваниями. Поэтому у больных сахарным диабетом 2-го типа существует особо высокий риск развития макроваскулярных и микроваскулярных осложнений, включая ишемическую болезнь сердца, апоплексию, заболевание периферических сосудов, гипертензию, нефропатию, невропатию и ретинопатию. В соответствии с этим терапия ненормального гомеостаза глюкозы, нарушения липидного обмена и гипертензии имеет решающее значение для управления клинической картиной сахарного диабета и его лечения. В настоящее время существует две общепризнанные формы диабета. Организм больных диабетом 1-го типа или инсулинозависимым сахарным диабетом (ИЗСД) вырабатывает инсулин, представляющий собой гормон, регулирующий утилизацию глюкозы в организме, в малых количествах или не вырабатывает его вовсе. У больных же диабетом 2-го типа или инсулиннезависимым сахарным диабетом (ИНЗСД) уровень инсулина в плазме крови часто соответствует таковому у недиабетиков или даже превышает его. Однако у подобных больных развилась резистентность к инсулиностимулирующему действию на глюкозный и липидный обмен в крупных чувствительных к инсулину тканях, таких как мышечная, печеночная и жировая ткани, а концентрации инсулина в плазме крови несмотря на его повышенный уровень не достаточно для преодоления выраженной резистентности к инсулину. Резистентность к инсулину является в первую очередь не следствием сниженного количества инсулиновых рецепторов, а следствием нарушения механизма связывания инсулина на пострецепторном уровне, причина какового нарушения еще не выяснена. Такая резистентность к чувствительности к инсулину приводит к недостаточной активации инсулином процесса поглощения, окисления и накопления глюкозы в мышечной ткани и к недостаточному подавлению инсулином липолиза в жировой ткани и вырабатывания и секреции глюкозы в печени. В настоящее время существует множество классов соединений, которые могут использоваться для лечения диабета. Особо при этом следует упомянуть ингибиторы дипептидилпептидазы IV ("ингибиторы ДПП-IV"), которые пригодны для лечения или предупреждения заболеваний, в которых участвует дипептидилпептидаза IV, таких, например, как диабет и прежде всего диабет 2-го типа. В WO 03/004498 А 1 в качестве подобных ингибиторов ДПП-IV предложены вещества с пиразиновой структурой, среди которых упоминается также 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразин (МНН: ситаглиптин). В указанной публикации прежде всего описан также гидрохлорид ситаглиптина. Такой гидрохлорид является гигроскопичным. В WO 2005/003135 описана дигидрофосфатная соль ситаглиптина, которая явно была получена в виде гидрата, но при температуре 40C и выше проявляет нестабильность фазового состояния. Отсюда следует, что получение такого соединения в больших количествах в промышленном масштабе сопряжено с трудно контролируемым процессом сушки. В WO 2005/072530 А 1 описаны другие соли ситаглиптина. Такие соединения также используются в качестве ингибиторов ДПП-IV для лечения диабета. Однако ни в WO 03/004498 А 1, ни в WO 2005/072530 А 1 не описаны соединения, содержащие ситаглиптин и фумаровую кислоту. У Kim и др., J. Med. Chem, 48, 2005, cc. 141-151, описано исследование принимаемых внутрь ингибиторов ДПП-IV для лечения диабета 2-го типа. Согласно этой публикации ситаглиптин для его исследования in vivo, помимо прочего, подвергают взаимодействию с фумаровой кислотой. При этом получают твердое вещество с соотношением между ситаглиптином и фумаровой кислотой 1:0,5. Характеристики такого соединения определяют лишь путем ЯМР-спектроскопии и масс-спектрометрии высокого разрешения. В этой публикации не указывается, является ли полученное твердое вещество кристаллическим. В уровне техники существует потребность в содержащих ситаглиптин соединениях со свойствами,позволяющими улучшить их введение в организм. При этом прежде всего существует потребность в форме применения ситаглиптина, которая удовлетворяла бы требованиям, предъявляемым к фармакокинетике действующего вещества, и которую, кроме того, можно было бы использовать в качестве пероральной формы применения (лекарственной формы). Задача изобретения состояла в первую очередь в получении соединения, которое обладало бы оптимизированным низким водопоглощением при хранении. Положенная в основу настоящего изобретения техническая задача решается с помощью кристаллического соединения 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1 с фумаровой кислотой или его гидрата, при этом молярное соотношение между соединением формулы 1 и фумаровой кислотой составляет от 1:0,95 до 1:1,05, при том, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9 (w), 10,3 (w), 5,15(m) и 4,30 (vs), и обозначается далее как форма А. При создании изобретения неожиданно было установлено, что фумаровая кислота и ситаглиптин образуют кристаллическое соединение с указанным выше молярным соотношением между ситаглиптином и фумаровой кислотой. Подобный результат является непредвидимым для специалиста с учетом существующего уровня техники, поскольку специалист должен был бы исходить из того, что ситаглиптин и фумаровая кислота не образуют кристаллические соединения. Для аморфных форм при их анализе порошковой дифрактометрией обычно характерно отсутствие четких дифракционных максимумов (рефлексов). На порошковой дифрактограмме аморфных форм присутствует лишь значительно увеличенный фоновый сигнал в интервале угла 2 от примерно 10 до 30. Для мезоморфных форм при их анализе порошковой дифрактометрией обычно характерно наличие только небольшого количества, часто лишь одного или двух четких дифракционных максимумов или даже полное отсутствие таковых. Смеси аморфных и кристаллических фаз при их анализе порошковой дифрактометрией характеризуются лишь очень слабыми дифракционными максимумами главным образом в том случае, когда доля аморфной фазы очень высока, например составляет 50% или более. Рентгеновская порошковая дифрактометрия является широкораспространенным и признанным методом идентификации и характеризации молекулярных твердых тел. Описание этого метода можно найти в европейской фармакопее, а также в фармакопее США как "Methode Nr. 941 "X-Ray Diffraction", либо в "Polymorphism - In the Pharmaceutical Industry", гл. 6, Rolf Hilfiker, изд-во Wiley-VCH Verlag, Weinheim,Deutschland, 2006. Обычно анализ рентгеновской порошковой дифрактометрией проводят с использованием K-излучения меди, которое использовали и в данном случае. Значения межплоскостного расстояния d вможно пересчитывать в значения угла 2 в угловых градусах и наоборот по уравнению Брэгга следующим образом: n = 2dsin, где n обозначает целое число, аобозначает длину волны используемого рентгеновского излучения в . Получаемые в результате порошковой дифрактометрии данные представляют собой значения интенсивности сигнала (в виде количества импульсов) в зависимости от угла 2. Помимо этого следует учитывать, что измерения можно проводить по схеме с регистрацией отраженного излучения (дифрактометрия на отражение) или по схеме с регистрацией прошедшего излучения (дифрактометрия на пропускание). Представленные в настоящем описании измерения проводили путем дифрактометрии на отражение. В отличие от положения линий в угловых градусах, которое не зависит от схемы регистрации излучения - на отражение или на пропускание, - относительная интенсивность может, однако, изменяться в зависимости от схемы регистрации излучения, а также в зависимости от свойств анализируемого образца и особенностей его подготовки. Поэтому указанные в настоящем описания значения интенсивности являются лишь качественным показателем. При измерениях подобного рода их погрешность обычно составляет 0,1 угла 2. Тогда как погрешность измерений в градусах угла 2 по всему диапазону измерений изменяется лишь незначительно или не изменяется вовсе, погрешность при определении значений d с учетом вышеуказанного уравнения Брэгга зависит от этого угла. Однако угол 2 и значения d эквиваленты, и поэтому для значений d погрешность измерений не вычисляли, несмотря на ее фактическое наличие. Особым объектом настоящего изобретения являются кристаллические соединения ситаглиптина с фумаровой кислотой, которые отличаются высокой кристаллической чистотой. Подтверждается это тем,что на рентгеновских порошковых дифрактограммах этих соединений присутствует по меньшей мере четыре пика, у каждого из которых отношение сигнал/шум преимущественно составляет по меньшей мере 4. Более предпочтительно отношение сигнал/шум по меньшей мере 8 или выше, при этом анализ рентгеновской порошковой дифрактометрией должен проводиться в представленных в настоящем описании или эквивалентных условиях проведения измерений. В сравнении с известным уровнем техники на порошковой дифрактограмме предлагаемого в изобретении кристаллического соединения преимущественно имеется в сопоставлении с соединениями, со-2 022485 держащими фумаровую кислоту, большое количество четких дифракционных максимумов. Другим высоконадежным методом идентификации и характеризации различных форм молекулярных твердых тел является рамановская спектроскопия (спектроскопия комбинационного рассеяния). Детальное описание применения рамановской спектроскопии с указаннойцелью можно найти, например, в"Polymorphism - In the Pharmaceutical Industry", гл. 5, Rolf Hilfiker, изд-во Wiley-VCH Verlag, Weinheim,Deutschland, 2006. При измерениях подобного рода их погрешность обычно составляет 1 см-1. Указанное кристаллическое соединение по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9 (w), 10,3 (w), 5,15 (m) и 4,30 (vs), и обозначается ниже как форма А. В еще одном предпочтительном варианте соединение (форма А) по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9(w), 10,3 (w), 5,15 (m), 4,69 (m), 4,30 (vs), 3,50 (s), 3,22 (s). Порошковая дифрактограмма формы А приведена на фиг. 1. Молярное соотношение между соединением формулы 1 и фумаровой кислотой составляет от 1:0,95 до 1:1,05 и относится к форме А. В предпочтительном варианте форма А имеет характеристические линии в спектре комбинационного рассеяния при 3083, 3034, 3019, 2940, 1707, 1655, 1516, 1479, 1439, 1389, 1338, 1260, 979, 899, 807, 756,748, 697, 537, 453, 396, 288, 213, 104 и 85 см-1 (волновые числа). Линии большей интенсивности в спектре комбинационного рассеяния у формы А обнаруживаются преимущественно при 3034, 2940, 1655, 1516,756 и 104 см-1 (волновые числа). Аморфные или мезоморфные формы того или иного соединения могут проявлять гораздо более высокую склонность к поглощению влаги, чем его кристаллические формы. Представленные в настоящем описании соединения в виде фумарата ситаглиптина отличаются тем, что они обладают хорошими гигроскопическими свойствами, т.е. при высокой относительной влажности (ОВ) поглощают малое количество воды (влаги). Об этом свидетельствуют данные, приведенные ниже в табл. 1, в которой между собой сравниваются влажность кристаллического фумарата (форма А) и влажность кристаллического гидрохлорида при 50%-ной и 90%-ной относительной влажности. Приведенные в указанной таблице данные были получены при измерениях динамической адсорбции водяного пара. Измерение сорбции водяного пара представляет собой метод, пригодный для исследования гигроскопических свойств твердых веществ. Измерения сорбции водяного пара можно проводить различными путями. В общем же случае при этом небольшой образец массой примерно 10-30 мг в пригодном держателе помещают на микроаналитические весы. Затем образец подвергают в соответствии с заданной программой воздействию атмосферы с различной относительной влажностью, одновременно регистрируя при этом изменение массы образца во времени. В результате таким путем можно получить сведения о гигроскопических свойствах вещества. Этим методом исследовали кристаллический моногидрат гидрохлорида ситаглиптина и предлагаемые в изобретении кристаллические соединения и при этом установили, что гидрохлорид при одинаковых условиях проведения измерений адсорбирует значительно большее количество воды и поэтому более гигроскопичен. По результатам подобных измерений было установлено, что, например, кристаллический фумарат в форме А при 50%-ной относительной влажности содержит воду в количестве лишь около 0,3%, а по истечении четырех часов выдержки при 96%-ной относительной влажности поглощает лишь на примерно 1% больше воды, чем при 50%-ной относительной влажности, которая в среднем соответствует нормальной влажности в Центральной Европе. Таблица 1 Результаты измерений сорбции водяного пара Подобный результат является для специалиста неожиданным и непредвидимым с учетом существующего уровня техники. Поэтому предлагаемые в изобретении кристаллические соединения обладают предпочтительным для применения в медикаментах комплексом свойств. Следующим объектом настоящего изобретения является медикамент для лечения диабета, содержащий предлагаемое в изобретении кристаллическое соединение. Следующим объектом настоящего изобретения является способ получения предлагаемого в изобретении кристаллического соединения. Такой способ заключается в том, что а) приготавливают раствор 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8 тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1,-3 022485 б) к приготовленному на стадии а) раствору добавляют фумаровую кислоту,в) полученный на стадии б) состав при необходимости концентрируют и/или при необходимости добавляют к нему приемлемый нерастворитель для снижения растворимости кристаллического соединения и г) полученное твердое вещество отделяют и затем, при необходимости, сушат, при этом молярное соотношение между растворенным соединением формулы 1 со стадии а) и фумаровой кислотой, используемой на стадии б), составляет от 1:0,95 до 1:1,05. В предпочтительном варианте фумаровую кислоту можно добавлять на стадии б) к приготовленному на стадии а) раствору в виде твердого вещества. В другом варианте фумаровую кислоту можно добавлять на стадии б) к приготовленному на стадии а) раствору в виде раствора в пригодном для этой цели растворителе. В еще одном предпочтительном варианте можно также изменить порядок выполнения стадий а) и б), т.е. приготовленный на стадии а) раствор, содержащий ситаглиптин, можно добавлять к фумаровой кислоте на стадии б). В качестве растворителя на стадии а) и/или необязательного растворителя на стадии б) предпочтительно использовать органический или неорганический растворитель. На стадии а) и/или стадии б) предпочтительно далее использовать низкомолекулярные и физиологически совместимые растворители и/или физиологически совместимые спирты, такие, например, как этанол, изопропанол, 1-пропанол, н-бутанол, низкомолекулярные кетоны, такие, например, как ацетон, 2 бутанон, метилизобутилкетон, ацетаты, например, этилформиат, этилацетат, бутилацетат или изопропилацетат, или простые эфиры, например, трет-бутилметиловый эфир, диэтиловый эфир, диизопропиловый эфир, либо любые смеси таких растворителей. На стадии а) и/или стадии б) особенно предпочтительно использовать физиологически совместимые растворители, в которых фумаровая кислота растворима в достаточной степени. Предпочтительны в этом отношении этанол, 1-пропанол, 2-пропанол, тетрагидрофуран, ацетон, этилметилкетон, вода и их смеси. Для применения на стадии а) наиболее пригодны этанол, 2-пропанол, этилацетат, изопропилацетат, ацетон и этилметилкетон, а для применения на стадии б) - этанол, 2-пропанол, ацетон, этилметилкетон и вода. Выражение "физиологически совместимый" означает, что такие растворители соответствуют директиве Q3C ICH (от англ. "International Commission for Harmonization", Международная комиссия по гармонизации), класс 3. Последовательность выполнения стадий а) и б) можно изменить на обратную. На стадиях а) и б) оба компонента можно растворять в одинаковых или же в разных растворителях,а также в одинаковых или же в разных концентрациях. Помимо этого на стадии а) и/или стадии б) можно также использовать смеси двух или более растворителей. В другом варианте предпочтительно использовать соединение 7-[(3R)-3-амино-1-оксо-4-(2,4,5 трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1 с фумаровой кислотой или его гидрат в качестве исходного материала для кристаллизации. На стадии в) в предпочтительном варианте можно добавлять затравочные кристаллы требуемой формы. На стадии в) предпочтительно далее перемешивать полученную суспензию при приемлемой температуре. В предпочтительном варианте такая температура составляет от 5 до 50C. Помимо этого на стадиях а) и б) температуру кристаллизации, соответственно момент достижения насыщения требуемой солью можно регулировать путем выбора различных комбинаций растворителей и концентраций таким образом, чтобы получать требуемую соль с высоким выходом и с высокой степенью чистоты. Для получения формы А ситаглиптин и фумаровую кислоту предпочтительно перемешивать в 2 бутаноне (метилэтилкетоне) или ацетонитриле. Ситаглиптин и фумаровую кислоту предпочтительно при этом использовать в молярном соотношении между ними 1:10,1. Такую смесь предпочтительно перемешивать в течение по меньшей мере одного дня, предпочтительно при комнатной температуре. В еще одном предпочтительном варианте растворитель, по меньшей мере частично, выпаривают в процессе перемешивания. Форму А можно получать с высокой степенью чистоты. Примеры Рентгеновская порошковая дифрактометрия. Для регистрации порошковых дифрактограмм использовали порошковый дифрактометр Bruker D8Advance с гониометром радиусом 217,5 мм, применяя K-излучение меди. Такой прибор работает по схеме Брэгга-Брентано с регистрацией отраженного излучения при напряжении на аноде 40 кВ и при силе тока 40 мА, при этом использовали щелевой экран с варьируемым углом расхождения. ПриборBruker D8 Advance оснащен детектором LynxEye, при этом ширину активного окна для наблюдения устанавливали на 3. Величина шага составляла 0,02, а эквивалентное время накопления составляло 37 с на один шаг. Анализируемые образцы без дополнительной обработки подготавливали на круговых держателях из монокристалла кремния, имевших глубину 0,1 мм и диаметр 12 мм. В процессе измерений образцы вращали со скоростью 0,5 об/с. Погрешность измерений составляет порядка 0,1 угла 2. Рамановская спектроскопия. Для анализа рамановской спектроскопией с фурье-преобразованием использовали спектрометрBruker RFS100, который для возбуждения оснащен лазером на алюмоиттриевом гранате, легированном неодимом, с длиной волны излучения 1064 нм. Используемая мощность лазерного излучения составляла 300 мВт. Применяемый прибор оснащен германиевым детектором с охлаждением жидким азотом. Анализируемый образец массой около 3 мг вдавливают в небольшой алюминиевый держатель и помещают его в измерительную камеру спектрометра. Спектры регистрировали, выполняя 64 циклов измерений с накоплением при разрешении 2,0 см-1 в интервале волновых чисел от 100 до 3500 см-1. Погрешность измерений составляет порядка 1 см-1. Измерения адсорбции водяного пара. Для проведения измерений динамической адсорбции водяного пара использовали прибор SPS11100n фирмы "Projekt Messtechnik", Ульм, Германия. Для этого образец массой около 20 мг на алюминиевом держателе помещали в измерительную камеру прибора. Затем образец подвергали в соответствии с заданной программой воздействию атмосферы с предварительно выбранными показателями относительной влажности, определяя при этом изменение массы образца во времени. При проведении измерений относительную влажность (ОВ) изменяли по следующей схеме: выдержка при постоянной 50%-ной ОВ в течение 2 ч, затем изменение относительной влажности до 0%-ной, после чего изменение относительной влажности до 96%-ной, выдержка при постоянной 96%-ной ОВ в течение 4 ч, затем изменение относительной влажности до 50%-ной и после этого выдержка при постоянной 50%-ной ОВ в течение 1 ч. Скорость изменения относительной влажности в каждом случае устанавливали на 5% в час. 1 Н-ЯМР-Спектроскопия. Для 1 Н-ЯМР-спектроскопии использовали прибор Bruker DPX300. Измерения на образцах фумарата ситаглиптина обычно проводили в ДМСО-d6. Получение кристаллических соединений в виде фумарата ситаглиптина. Пример 1. 500,7 мг (1,23 ммоль) ситаглиптина в виде свободного основания и 142,8 мг (1,23 ммоль) фумаровой кислоты перемешивали в 50 мл этилметилкетона при комнатной температуре. Через 1 ч полученный прозрачный раствор нагревали ручным теплоэлектровентилятором и охлаждали в ультразвуковой бане. При концентрировании раствора до объема примерно 40 мл потоком N2 происходило выпадение осадка,который отфильтровывали. К маточному раствору добавляли затравочные кристаллы, образовавшиеся при их первом выпадении в осадок, и раствор выдерживали при комнатной температуре. Образовавшуюся суспензию фильтровали и белое твердое вещество сушили в течение 30 мин при давлении примерно 3 мбара. При анализе этого твердого вещества рентгеновской порошковой дифрактометрией была получена типичная для формы А порошковая дифрактограмма, которая представлена на фиг. 1. Наиболее важные дифракционные максимумы приведены ниже в табл. 2. Результаты анализа этого же образца 1 НЯМР-спектроскопией свидетельствуют о присутствии ситаглиптина и фумаровой кислоты в молярном соотношении между ними 1:1. Таблица 2 Данные анализа формы А рентгеновской порошковой дифрактометрией В приведенной выше таблице w означает "слабый", m означает "средний", s означает "сильный", avs означает "очень сильный". При анализе полученного продукта рамановской спектроскопией был получен характеристический для формы А рамановский спектр, который представлен на фиг. 4. Наиболее важные пики указаны ниже в табл. 3. Таблица 3 Рамановский спектр формы А В приведенной выше таблице w означает "слабый", m означает "средний", s означает "сильный", avs означает "очень сильный". Пример 2. 2,0 г (4,91 ммоль) ситаглиптина в виде свободного основания и 571 мг (4,92 ммоль) фумаровой кислоты в течение 1 ч перемешивали в 150 мл этилметилкетона при комнатной температуре. После добавления еще 60 мл этилметилкетона мутный раствор нагревали ручным теплоэлектровентилятором. После охлаждения до комнатной температуры к ставшему теперь прозрачным раствору добавляли затравочные кристаллы фумарата ситаглиптина и раствор выдерживали при комнатной температуре в темноте. Через три дня образовавшуюся суспензию фильтровали и белое твердое вещество сушили в течение 2 ч при давлении примерно 3 мбара (выход: 1,35 г). Полученный материал анализировали путем рамановской спектроскопии, 1 Н-ЯМР-спектроскопии, элементарного анализа и термогравиметрии в сочетании с инфракрасной спектроскопией, а также измерением динамической сорбции водяного пара. Результаты анализа термогравиметрией в сочетании с инфракрасной спектроскопией с фурье-преобразованием свидетельствуют о том, что подвергнутый минимальной сушке образец содержит воду в количестве лишь около 0,5%, а также в малом количестве содержит этилметилкетон. По данным анализа 1 Н-ЯМРспектроскопией соотношение между ситаглиптином и фумаровой кислотой составляет 1:1. С учетом малого содержания воды и остаточного растворителя такое соотношение соответствует результату элементарного анализа, при котором были получены следующие значения: С = 45,5%, Н = 3,5%, N = 13,2%, O = 15,6% и F = 21,6%. При анализе рамановской спектроскопией был получен типичный для формы А рамановский спектр. Результаты измерений динамической сорбции водяного пара свидетельствуют о том,что форма А даже при высокой относительной влажности поглощает лишь малое количество воды. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллическое соединение 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8 тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1 с фумаровой кислотой или его гидрат, при этом молярное соотношение между соединением формулы 1 и фумаровой кислотой составляет от 1:0,95 до 1:1,05, при том, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9 (w), 10,3 (w), 5,15(m) и 4,30 (vs), и обозначается далее как форма А. 2. Кристаллическое соединение по п.1, отличающееся тем, что оно по данным его анализа рентгеновской порошковой дифрактометрией (РПД) имеет значения d , составляющие 12,9 (w), 10,3 (w),5,15 (m), 4,69 (m), 4,30 (vs), 3,50 (S) и 3,22 (s). 3. Кристаллическое соединение по одному из пп.1 или 2 для лечения диабета. 4. Медикамент, предназначенный для лечения диабета, содержащий кристаллическое соединение по одному из предыдущих пунктов. 5. Применение кристаллического соединения по одному из пп.1-3 для приготовления медикамента,предназначенного для лечения диабета. 6. Способ получения соединения по одному из пп.1-3, заключающийся в том, что а) приготавливают раствор 7-[(3R)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8 тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-а]пиразина (МНН: ситаглиптин) формулы 1,б) к приготовленному на стадии а) раствору добавляют фумаровую кислоту,в) полученный на стадии б) состав при необходимости концентрируют и/или при необходимости добавляют к нему приемлемый нерастворитель для снижения растворимости кристаллического соединения и г) полученное твердое вещество отделяют,при этом молярное соотношение между растворенным соединением формулы 1 со стадии а) и фумаровой кислотой, используемой на стадии б), составляет от 1:0,95 до 1:1,05. 7. Способ по п.6, отличающийся тем, что фумаровую кислоту добавляют на стадии б) к приготовленному на стадии а) раствору в виде твердого вещества или фумаровую кислоту добавляют на стадии б) к приготовленному на стадии а) раствору в виде раствора в пригодном для этого растворителе. 8. Способ получения формы А путем перемешивания кристаллического соединения формулы 1 (ситаглиптина) и фумаровой кислоты в 2-бутаноне (метилэтилкетоне) или ацетонитриле при молярном соотношении между ситаглиптином и фумаровой кислотой предпочтительно 1:10,1.
МПК / Метки
МПК: C07D 487/04
Метки: кристаллическое, 7-[(3r)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-a]пиразина, соединение
Код ссылки
<a href="https://eas.patents.su/9-22485-kristallicheskoe-soedinenie-7-3r-3-amino-1-okso-4-245-triftorfenilbutil-5678-tetragidro-3-triftormetil-124-triazolo43-apirazina.html" rel="bookmark" title="База патентов Евразийского Союза">Кристаллическое соединение 7-[(3r)-3-амино-1-оксо-4-(2,4,5-трифторфенил)бутил]-5,6,7,8-тетрагидро-3-(трифторметил)-1,2,4-триазоло[4,3-a]пиразина</a>
Предыдущий патент: Инструментальное хирургическое оборудование для минимально инвазивного хирургического вмешательства
Следующий патент: Устройство для выведения трубы с большим сечением через крышу
Случайный патент: Производные индолин-2-она, их получение и их применение в качестве лигандов рецепторов окситоцина












