Производные индолин-2-она, их получение и их применение в качестве лигандов рецепторов окситоцина
Номер патента: 5093
Опубликовано: 28.10.2004
Авторы: Серрадейль-Ле Галь Клодин, Гарсия Жорж, Валетт Жерар, Фулон Луак
Формула / Реферат
1. Соединения в форме чистого энантиомера или смеси энантиомеров формулы

в которой
R0 представляет собой группу, выбранную из
1)
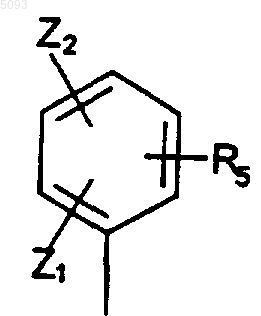
в которой
Z1 представляет собой атом хлора, брома, йода или фтора или (C1-C4)алкильную, (C1-C4)алкокси или трифторметильную группу;
Z2 представляет собой атом водорода, хлора, брома, йода или фтора или (C1-C4)алкильную, (C3-C5)циклоалкильную, (C1-C4)алкокси, (C3-C5)циклоалкокси или полифтор(C1-C4)алкильную группу;
R5 представляет собой T1W, где T1 представляет собой -(CH2)m-, где m может быть равно 0 или 1, а W представляет собой атом водорода или гидроксикарбонильную (или карбоксильную), (C1-C4)алкоксикарбонильную, 1,3-диоксолан-2-ильную или 1,3-диоксан-2-ильную группу,
или иначе W представляет собой группу -NR6R7, в которой R6 и R7 представляют собой независимо друг от друга атом водорода, (C1-C4)алкильную группу, (C1-C4)алкил-
сульфонильную группу или фенилсульфонильную группу, в которой фенильная группа может быть моно-, ди- или тризамещенной заместителем Z5; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, морфолинильную группу, возможно замещенную (C1-C4)алкильной группой или оксо; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, пиперазинильную группу, возможно замещенную в положении 4 заместителем Z3; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная и пиперидильная группы возможно замещены заместителем Z4;
или иначе W представляет собой группу -NR8COR9, в которой R8 представляет собой атом водорода или (C1-C4)алкильную группу, а R9 представляет собой атом водорода или (C1-C4)алкильную, бензильную, пиридильную или фенильную группу, причем указанная фенильная группа может быть моно-, ди- или тризамещенной заместителем Z5; или иначе R9 представляет собой группу -NR10R11, в которой R10 и R11 представляют собой независимо друг от друга атом водорода или (C1-C4)алкильную группу, или иначе R10 и R11 образуют с атомом азота, с которым они связаны, пирролидинильную, пиперидильную или морфолинильную группу, возможно замещенную (C1-C4)алкильной группой; или иначе R9 представляет собой пирролидин-2-ильную или -3-ильную группу или пиперид-2-ильную, -3-ильную или -4-ильную группу, причем указанные пирролидинильные и пиперидильные группы возможно замещены заместителем Z7; или иначе R9 представляет собой группу -T2-R12 или -T2-COR12, в которых T2 представляет собой -(CH2)n-, где n может быть равно 1, 2, 3 и 4, а R12 представляет собой (C1-C4)алкоксигруппу или группу -NR10R11, где R10 и R11 такие, как определено выше;
или иначе W представляет собой группу -CONR13R14, в которой R13 представляет собой атом водорода или (C1-C4)алкильную, (C3-C7)циклоалкильную, монофтор(C1-C4)алкильную или полифтор(C1-C4)алкильную группу, а R14 представляет собой атом водорода, (C1-C4)алкильную группу, фенильную группу, возможно замещенную заместителем Z5, группу -T4-R15, в которой T4 представляет собой -(CH2)q-, где q равно 1, 2, 3 или 4, а R15 представляет собой гидроксильную группу, (C1-C4)алкоксигруппу, (C1-C4)алкоксикарбонильную группу, (C1-C4)алкоксикарбониламиногруппу, фенильную группу, возможно моно- или дизамещенную заместителем Z5, пирид-2-ильную, -3-ильную или -4-ильную группу или группу -NR16R17, в которой R16 и R17 представляют собой независимо друг от друга атом водорода или (C1-C4)алкильную группу, или иначе R16 и R17 образуют с атомом азота, с которым они связаны, морфолинильную группу, возможно моно- или дизамещенную (C1-C4)алкильной группой, или иначе R16 и R17 образуют с атомом азота, с которым они связаны, пиперазинильную группу, возможно замещенную в положении 4 заместителем Z3, или иначе R16 и R17 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная или пиперидильная группы возможно замещены заместителем Z5, и подразумевается, что когда q равно 1, R15 является иным, чем гидроксил, (C1-C4)алкокси, (C1-C4)алкоксикарбониламино или -NR16R17; или иначе R13 и R14 образуют с атомом азота, с которым они связаны, морфолинильную группу, возможно моно- или дизамещенную (C1-C4)алкильной группой или пиперазинильной группой, возможно замещенной в положении 4 заместителем Z3; или иначе R13 и R14 образуют с атомом азота, с которым они связаны, азетидинильную, пирролидинильную, пиперидильную или гексагидроазепинильную группу, причем указанные пирролидинильная, пиперидильная и гексагидроазепинильная группы возможно моно- или дизамещены заместителем Z8;
или иначе W представляет собой группу OR18, в которой R18 представляет собой атом водорода или (C1-C4алкильную групппу, (C1-C4)алкокси(C1-C4)алкильную группу или группу -T3-R19, в которой T3 представляет собой -(CH2)p-, где p может быть равно 2 или 3, а R19 выбран из гидроксильной группы, трифенилметоксигруппы или группы -NR20R21, в которой R20 представляет собой атом водорода или (C1-C4)алкильную группу, а R21 представляет собой атом водорода или (C1-C4)алкильную, тетрагидрофуранилметильную или тетрагидропиранилметильную группу, или иначе R20 и R21 образуют с атомом азота, с которым они связаны, морфолинильную группу, возможно моно- или дизамещенную (C1-C4)алкильной группой, или пиперазинильную группу, возможно замещенную в положении 4 заместителем Z3, или иначе R20 и R21 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная и пиперидильная группы возможно замещены заместителем Z5;
Z3 представляет собой (C1-C4)алкильную, пиридильную, фенильную, (C1-C4)алкилкарбонильную или (C1-C4)алкоксикарбонильную группу;
Z4 представляет собой оксо, атом фтора, гидроксил, (C1-C4)алкил, бензил, амино, (C1-C4)алкиламино, ди(C1-C4)алкиламино, (C1-C4)алкокси, (C1-C4)алкоксикарбонил или (C1-C4)алкоксикарбониламино;
Z5 представляет собой атом хлора, брома, йода или фтора, гидроксильную группу, (C1-C4)алкильную группу или (C1-C4)алкоксигруппу;
Z7 представляет собой атом фтора, гидроксильную группу, гидрокси(C1-C4)алкильную группу, (C1-C4)алкильную группу, (C1-C4)алкоксигруппу или (C1-C4)алкилкарбонильную группу;
Z8 представляет собой атом фтора или гидроксильную, (C1-C4)алкильную, (C3-C6)циклоалкильную, бензильную, амино, (C1-C4)алкиламино, ди(C1-C4)алкиламино, (C1-C4)алкоксикарбонильную, (C1-C4)алкоксикарбониламино, (C3-C6)циклоалкокси, гидроксикарбонильную, гидрокси(C1-C4)алкильную, (C1-C4)алкокси(C1-C4)алкильную, (C1-C4)алкоксигруппу или группу -CONR23R24, в которой R23 и R24 представляют собой независимо друг от друга атом водорода, (C1-C4)алкил, монофтор(C1-C4)алкил или полифтор(C1-C4)алкил, или иначе R23 и R24 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная или пиперидильная группы возможно замещены заместителем Z3 или дифторметилиденом;
2)
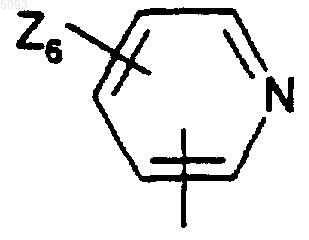
где Z6 представляет собой атом хлора или (C1-C4)алкильную или (C1-C4)алкоксигруппу;
R1 представляет собой (C1-C4)алкильную группу, возможно содержащую двойную или тройную связь, (C1-C4)алкоксикарбонильную группу, фенилоксикарбонильную группу или группу T1-R22, в которой T1 такой, как определено выше, а R22 представляет собой гидроксильную или (C1-C4)алкоксигруппу;
R2 и R4 представляют собой независимо друг от друга атом водорода, хлора или фтора или (C1-C4)алкильную, или (C1-C4)алкоксигруппу;
R3 представляет собой атом хлора или фтора или гидрокси, (C1-C4)алкил, (C1-C4)алкокси, (C1-C4)карбамоил, (C1-C4)алкилкарбониламино, нитро, циано, трифторметил, амино, (C3-C6)циклоалкиламино, (C1-C4)алкиламино, ди(C1-C4)алкиламино, три(C1-C4)алкиламмоний A-, где A- является анионом, пирролидин-1-ильную, пиперид-1-ильную, пиперазин-1-ильную, морфолин-4-ильную или гексагидроазепин-1-ильную группу;
X и Y представляют собой независимо друг от друга атом водорода, хлора, брома, йода или фтора, или (C1-C4)алкокси, или трифторметоксигруппу;
и их фармацевтически приемлемые соли, их сольваты и их гидраты.
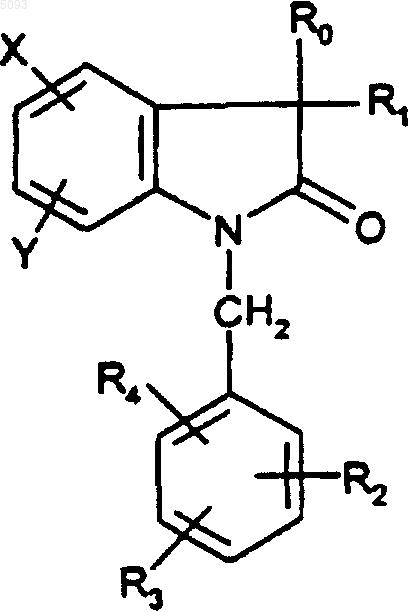
2. Соединения по п.1 в форме чистого энантиомера или смеси энантиомеров формулы
(I)
в которой
Ro представляет собой
1)
где Z1, Z2, R1, R2, R3, R4, R5, Y и X являются такими, как определено для (I), и их фармацевтически приемлемые соли, их сольваты и их гидраты.
3. Соединения по п.2 формулы
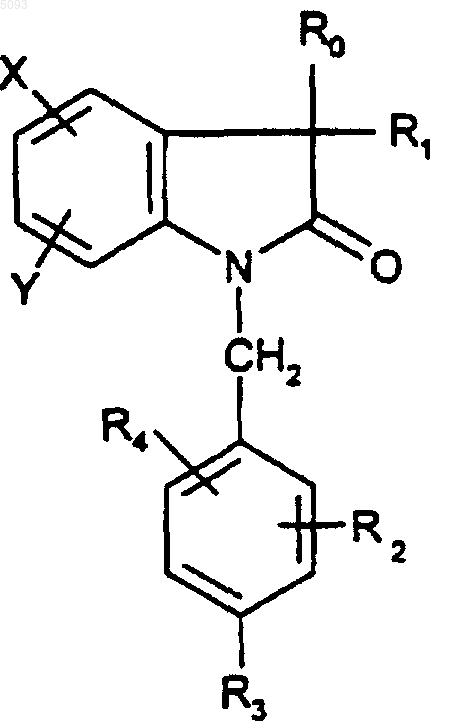
(Ia)
в которой R1 представляет собой метильную или гидроксильную группу, а R0, R2, R3, R4, X и Y являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров и их фармацевтически приемлемые соли, их сольваты и их гидраты.
4. Соединения по п.3 формулы
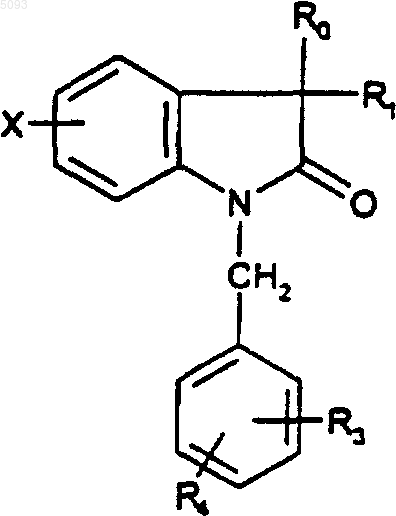
(Ib)
в которой R1 представляет собой метильную или гидроксильную группу, а R0, R3, R4, и X являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров и их фармацевтически приемлемые соли, их сольваты и их гидраты.
5. Соединения по п.4 формулы
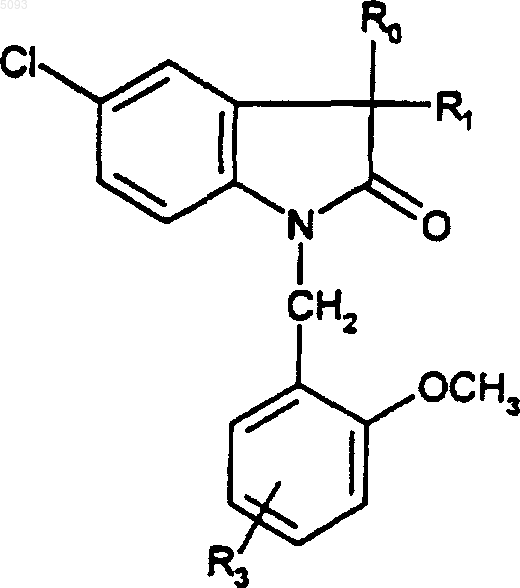
(Ic)
в которой R1 представляет собой метильную или гидроксильную группу, а R0 и R3 являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров и их фармацевтически приемлемые соли, их сольваты и их гидраты.
6. Соединения по п.5 формулы
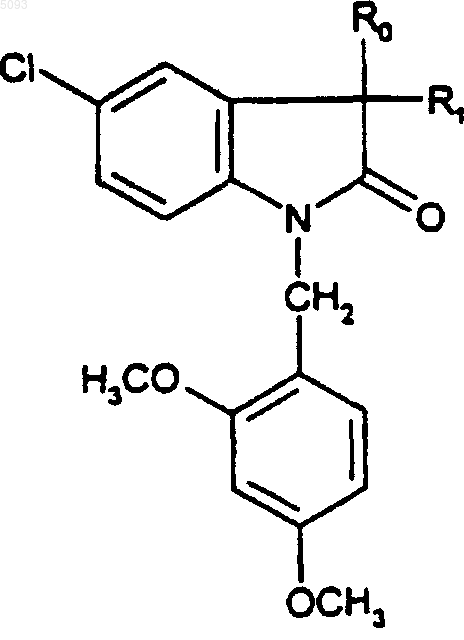
(Id)
в которой R1 представляет собой метильную или гидроксильную группу, а R0 является таким, как определено для (I), в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемые соли, их сольваты и их гидраты.
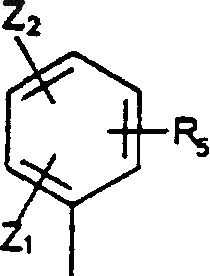
7. Соединения по любому из пп.1-6, где R0 представляет собой группу

в которой Z1, Z2 и R5 являются такими, как определено для (I).
8. Соединения по п.7, где R0 представляет собой группу
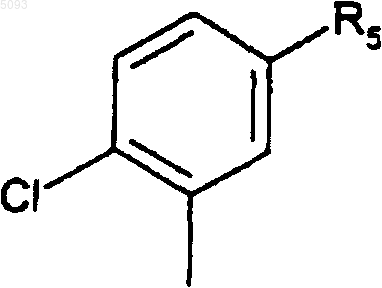
в которой R5 является таким, как определено для (I).
9. Соединения по любому из пп.1-8, где R1 представляет собой метильную группу.
10. Соединения по п.1, выбранные из
5-хлор-3-(2-хлорфенил)-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
5-хлор-3-(2-хлорфенил)-1-[4-(изопропиламино)-2-метоксибензил]-3-метилиндолин-2-она,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}ацетамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}-3-метилбутанамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}бензамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}никотинамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}-2-метоксиацетамида,
метил-3-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]анилино}-3-оксопропаноата,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}-3-метоксипропанамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}-N-метилацетамида,
N-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил}-N-метилметансульфонамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N,N-диэтилбензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N,N-диметилбензамида,
5-хлор-3-[2-хлор-5-(1-пиперидилкарбонил)фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этилбензамида,
5-хлор-3-[2-хлор-5-{[2-(метоксиметил)-1-пирролидинил]карбонил}фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
5-хлор-3-{2-хлор-5-[(2-метил-1-пиперидил)карбонил]фенил}-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-метилбензамида,
метил-1-{4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил}-2-пиперидинкарбоксилата,
5-хлор-3-{2-хлор-5-[(4-гидрокси-1-пиперидил)карбонил]фенил}-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
5-хлор-3-{2-хлор-5-[(2-метоксиэтокси)метил]фенил}-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
5-хлор-3-[2-хлор-5-(4-морфолинилметил)фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
5-хлор-3-(2-хлор-5-{[2-(4-морфолинил)этокси]метил}фенил)-1-(2,4-диметоксибензил)-3-метилиндолин-2-она,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-3-гидроксипиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R)-3-гидроксипиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-4-метоксипиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил-4-этоксипиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R,S)-2,6-диметилпиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R)-2-этоксикарбонилпиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R)-2-N,N-диметиламинокарбонилпиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R)-2-(N-метил-N-2,2,2-трифторэтиламинокарбонил)пиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(R)-2-пирролидинокарбонилпиперидина,
1-[4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензоил]-(S)-2-метилпиперидина,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-фенилэтил)бензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(4-пиридилметил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(3-пиридилметил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-пиридилметил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-метоксиэтил)бензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-диметиламиноэтил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-морфолиноэтил)бензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-пирролидиноэтил)бензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-пиперидиноэтил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-гидроксиэтил)бензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-[2-(пирид-4-ил)этил]бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2,2,2-трифторэтил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-метил-N-(2,2,2-трифторэтил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-изопропилбензамида,
гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-(2-диметиламиноэтил)-N-(2,2,2-трифторэтил)бензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-циклогексилбензамида,
4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]-N-этил-N-[3-(пирид-4-ил)пропил]бензамида,
в форме чистого энантиомера или смеси энантиомеров и их фармацевтически приемлемых солей, их сольватов и их гидратов.
11. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы
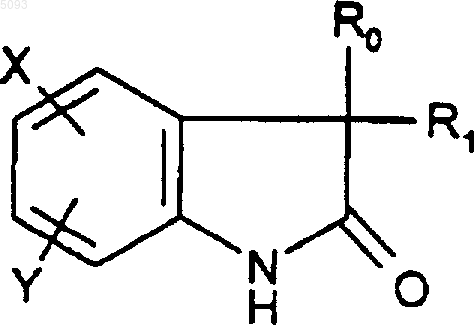
(II)
в которой X, Y, R0 и R1 такие, как определено для (I), подвергают взаимодействию в присутствии основания с галогенидом формулы
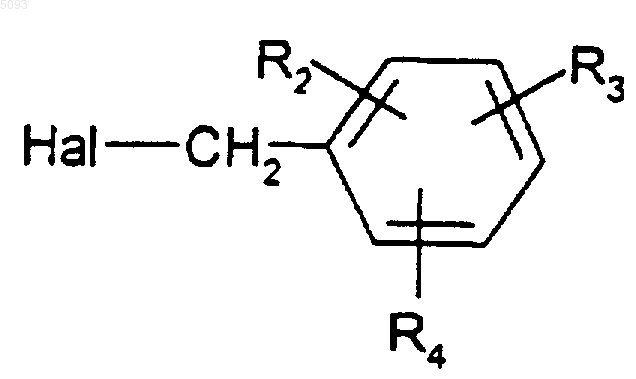
(1)
где Hal представляет собой атом галогена, и R2, R3, R4 такие, как определено для (I).
12. Способ получения соединений формулы (I) по п.1, когда R1 представляет собой электрофильную группу, отличающийся тем, что осуществляют превращение соединения формулы
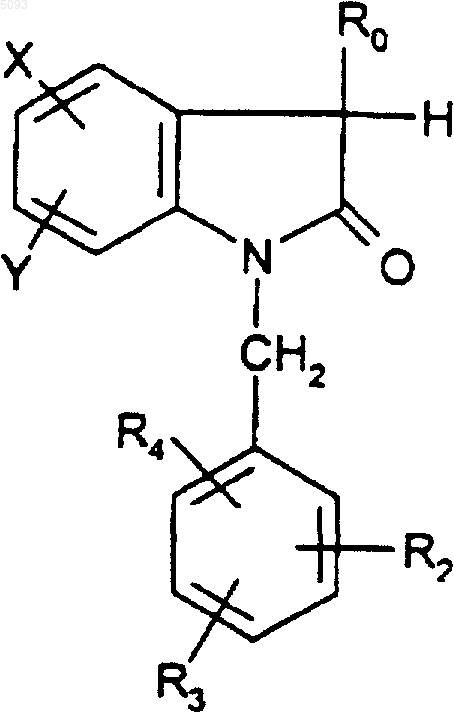
(III)
в которой R0, R2, R3, R4, X и Y такие, как определено для (I), действуя производным R1-Z, где Z представляет собой уходящую группу, в присутствии основания.
13. Способ получения соединений формулы (I) по п.1, когда R1 представляет собой OH, отличающийся тем, что производное изатина формулы
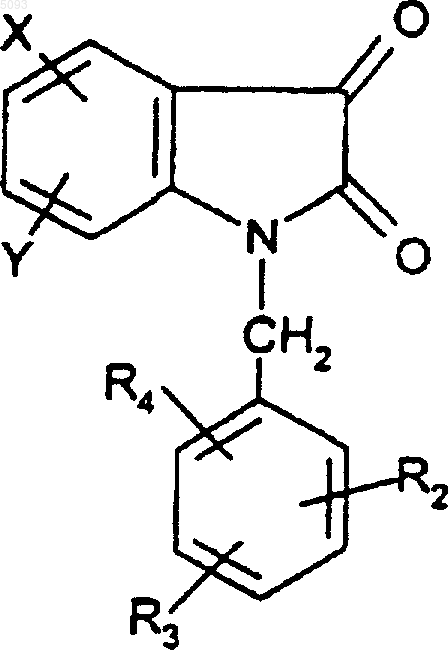
(IV)
в которой R2, R3, R4, X и Y такие, как определено для (I), подвергают взаимодействию с металлоорганическим производным R0-M или R0MgHal, где R0 такой, как определено для (I), M представляет собой атом металла и Hal представляет собой атом брома или йода.
14. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы
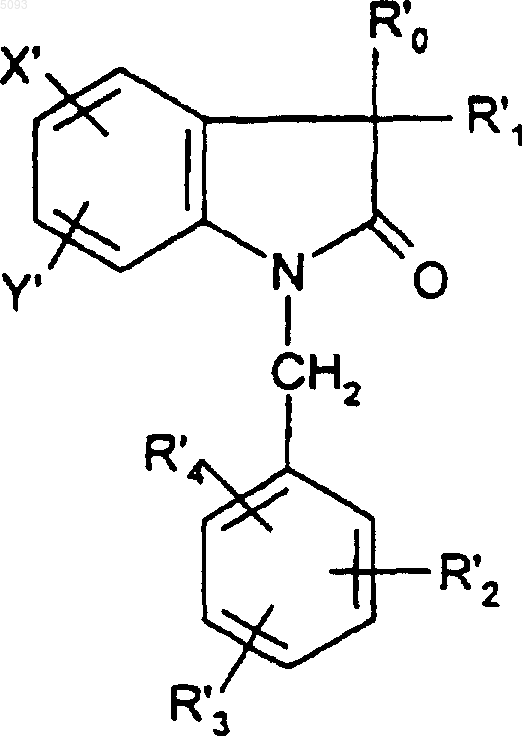
(Ip)
в которой R'0, R'1, R'2, R'3, R'4, X' и Y' представляют собой соответственно либо R0, R1, R2, R3, R4, X и Y, как они определены для (I), либо группу-предшественник для R0, R1, R2, R3, R4, X и Y, подвергают последующей обработке с превращением любой из групп R'0, R'1, R'2, R'3, R'4, X' и Y' в соответственно R0, R1, R2, R3, R4, X и Y, как они определены для (I).
15. Фармацевтическая композиция, отличающаяся тем, что в качестве активного начала она содержит соединение по любому из пп.1-10.
16. Фармацевтическая композиция по п.15, отличающаяся тем, что она содержит антагонист рецепторов окситоцина по любому из пп.1-10 в комбинации с антагонистом рецепторов вазопрессина V1a.
17. Применение соединения по любому из пп.1-10 в изготовлении лекарства, предназначенного для лечения окситоцинзависимых расстройств.
18. Применение соединения по любому из пп.1-10 в изготовлении вызывающего релаксацию матки или токолитического лекарства.
19. Применение соединения по любому из пп.1-10 в изготовлении лекарств, предназначенных для содействия рубцеванию, для лечения аналгезии, анксиолиза, депрессии, шизофрении, аутизма или обсессивно-компульсивного синдрома, для улучшения материнского и социального поведения, для облегчения узнавания и принятия матери ребенком, для лечения нарушений памяти, для регулирования приема пищи и питья, зависимости от лекарственных средств, отнятия ребенка от груди и половой мотивации, для лечения расстройств мочеполовой сферы в акушерской и гинекологической областях, для контроля сокращений матки до разрешения беременности в срок, для контроля пренатальной родовой деятельности, для лечения дисменореи, для контроля подготовительной родовой деятельности в целях родоразрешения путем кесарева сечения, для решения проблем стерильности или фертильности, для контроля родов, для контроля эструса, прекращения кормления грудью, отнятия от груди или пересадки и имплантации эмбрионов, для лечения эндометриоза, мочевой напряженности или безотлагательного недержания, доброкачественной гипертрофии простаты, эректильных дисфункций, гипертензии, гипонатриемии, сердечной недостаточности, атеросклероза или ангиогенеза, для регулирования накопления жира жировой клеткой и для лечения рака молочной железы или простаты.
20. Лекарство, отличающееся тем, что оно содержит соединение по любому из пп.1-10.
21. Продукт, содержащий антагонист рецепторов окситоцина яю любому из пп.1-10 и антагонист рецепторов вазопрессина V1a, для одновременного, раздельного или последовательного использования в лечении окситоцинзависимых расстройств.
22. Продукт по п.21 для лечения дисменореи или эндометриоза, для контроля преждевременных родов или для контроля подготовительной родовой деятельности в целях родоразрешения путем кесарева сечения.
Текст
1 Объектом настоящего изобретения являются новые производные индолин-2-она, способ их получения и содержащие их фармацевтические композиции. Эти новые производные являются сильнодействующими и селективными лигандами рецепторов окситоцина и, следовательно, их можно использовать в качестве активного начала в фармацевтических композициях, в частности в акушерской и гинекологической области. Окситоцин (ОТ) представляет собой экскретируемый нейрогипофизом гормон,имеющий циклическую нонапептидную структуру, подобную структуре аргинин-вазопрессина (AVP). Рецепторы окситоцина в основном находятся в гладкой мышце матки и на миоэпителиальных клетках молочных желез. Следовательно окситоцин играет важную роль при родах, так как он вовлечен в сокращение мышцы матки и в лактацию. Кроме того, рецепторы окситоцина также локализованы в других периферических тканях и в центральной нервной системе. Следовательно, окситоцин оказывает воздействие на сердечно-сосудистую, почечную,эндокринную или поведенческую сферы. Производные индолин-2-она были раскрыты в некоторых патентных заявках как лиганды рецепторов вазопрессина и возможно рецепторов окситоцина; можно упомянуть патентные заявки WO 93/15051, ЕР 636608, ЕР 636609, WO 95/18105, WO 97/15556 и WO 98/25901. До сих пор производные индолин-2-она не были раскрыты как сильнодействующие и селективные лиганды рецепторов окситоцина. Теперь обнаружено, что некоторые производные индолин-2-она являются сильнодействующими и селективными лигандами рецепторов окситоцина. Таким образом, согласно одному из своих аспектов настоящее изобретение относится к новым производным индолин-2-она в форме чистого энантиомера или смеси энантиомеров формулы в которой Z1 представляет собой атом хлора,брома, йода или фтора или (С 1-С 4)алкильную,(С 1-С 4)алкокси или трифторметильную группу;Z2 представляет собой атом водорода, хлора, брома, йода или фтора или (С 1-С 4) алкильную, (С 3-С 5)циклоалкильную, (С 1-С 4)алкокси,(С 3-С 5)циклоалкокси или полифтор(С 1-С 4)алкильную группу;R5 представляет собой T1W, где T1 представляет собой -(СН 2)m-, где m может быть равно 0 или 1, a W представляет собой атом водорода или гидроксикарбонильную (или карбоксильную), (С 1-С 4)алкоксикарбонильную, 1,3-диоксолан-2-ильную или 1,3-диоксан-2-ильную группу,или иначе W представляет собой группу-NR6R7, в которой R6 и R7 представляют собой,независимо друг от друга, атом водорода, (С 1 С 4)алкильную группу, (С 1-С 4)алкилсульфонильную группу или фенилсульфонильную группу, в которой фенильная группа может быть моно-,ди- или тризамещенной заместителем Z5; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, морфолинильную группу,возможно замещенную (С 1-С 4)алкильной группой или оксо; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, пиперазинильную группу, возможно замещенную в положении 4 заместителем Z3; или иначе R6 и R7 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная и пиперидильная группы возможно замещены заместителем Z4; или иначе W представляет собой группу-NR8COR9, в которой R8 представляет собой атом водорода или (С 1-С 4)алкильную группу, aR9 представляет собой атом водорода или (С 1 С 4)алкильную, бензильную, пиридильную или фенильную группу, причем указанная фенильная группа может быть моно-, ди- или тризамещенной заместителем Z5; или иначе R9 представляет собой группу -NR10R11, в которой R10 иR11 представляют собой, независимо друг от друга, атом водорода или (С 1-С 4)алкильную группу, или иначе R10 и R11 образуют с атомом азота, с которым они связаны, пирролидинильную, пиперидильную или морфолинильную группу, возможно замещенную (С 1-С 4)алкильной группой; или иначе R9 представляет собой пирролидин-2-ильную или -3-ильную группу или пиперид-2-ильную, -3-ильную или -4 ильную группу, причем указанные пирролидинильные и пиперидильные группы возможно замещены заместителем Z7; или иначе R9 представляет собой группу -T2-R12 или -T2-COR12, в которых Т 2 представляет собой -(СН 2)n-, где n может быть равно 1, 2, 3 и 4, a R12 представляет собой (С 1-С 4)алкоксигруппу или группу-CONR13R14, в которой R13 представляет собой атом водорода или (С 1-С 4)алкильную, (С 3-С 7) циклоалкильную, монофтор(С 1-С 4)алкильную 3 или полифтор(С 1-С 4)алкильную группу, a R14 представляет собой атом водорода, (С 1-С 4)алкильную группу, фенильную группу, возможно замещенную заместителем Z5, группу -T4-R15, в которой Т 4 представляет собой -(CH2)q-, где q равно 1, 2, 3 или 4, a R15 представляет собой гидроксильную группу, (С 1-С 4)алкоксигруппу,(С 1-С 4)алкоксикарбонильную группу, (С 1-С 4) алкоксикарбониламиногруппу,фенильную группу, возможно моно- или дизамещенную заместителем Z5, пирид-2-ильную, -3-ильную или -4-ильную группу или группу -NR16R17, в которой R16 и R17 представляют собой, независимо друг от друга, атом водорода или (С 1 С 4)алкильную группу, или иначе R16 и R17 образуют с атомом азота, с которым они связаны,морфолинильную группу, возможно моно- или дизамещенную (С 1-С 4)алкильной группой, или иначе R16 и R17 образуют с атомом азота, с которым они связаны, пиперазинильную группу,возможно замещенную в положении 4 заместителем Z3, или иначе R16 и R17 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролидинильная или пиперидильная группы возможно замещены заместителем Z5, и подразумевается, что когда q равно 1, R15 является иным, чем гидроксил, (С 1-С 4)алкокси, (С 1 С 4)алкоксикарбониламино или -NR16R17; или иначе R13 и R14 образуют с атомом азота, с которым они связаны, морфолинильную группу,возможно моно- или дизамещенную (С 1-С 4) алкильной группой или пиперазинильной группой, возможно замещенной в положении 4 заместителем Z3; или иначе R13 и R14 образуют с атомом азота, с которым они связаны, азетидинильную, пирролидинильную, пиперидильную или гексагидроазепинильную группу, причем указанные пирролидинильная, пиперидильная и гексагидроазепинильная группы возможно моно- или дизамещены заместителем Z8,или иначе W представляет собой группуOR18, в которой R18 представляет собой атом водорода или (С 1-С 4)алкильную групппу, (С 1 С 4)алкокси(С 1-С 4)алкильную группу или группу-(СН 2)Р-, где р может быть равно 2 или 3, a R19 выбран из гидроксильной группы, трифенилметоксигруппы или группы -NR20R21 в которой R20 представляет собой атом водорода или (С 1 С 4)алкильную группу, a R21 представляет собой атом водорода или (С 1-С 4)алкильную, тетрагидрофуранилметильную или тетрагидропиранилметильную группу, или иначе R20 и R21 образуют с атомом азота, с которым они связаны,морфолинильную группу, возможно моно- или дизамещенную (С 1-С 4)алкильной группой, или пиперазинильную группу, возможно замещенную в положении 4 заместителем Z3, или иначеR20 и R21 образуют с атомом азота, с которым они связаны, пирролидинильную или пиперидильную группу, причем указанные пирролиди 005093 4 нильная и пиперидильная группы возможно замещены заместителем Z5;Z5 представляет собой атом хлора, брома,йода или фтора, гидроксильную фуппу, (С 1-С 4) алкильную группу или (С 1-С 4)алкоксигруппу;Z7 представляет собой атом фтора, гидроксильную группу, гидрокси(С 1-С 4)алкильную группу, (С 1-С 4)алкильную группу, (С 1-С 4)алкоксигруппу или (С 1-С 4)алкилкарбонильную группу;Z8 представляет собой атом фтора или гидроксильную, (С 1-С 4)алкильную, (С 3-С 6)циклоалкильную, бензильную, амино, (С 1-С 4)алкиламино, ди(С 1-С 4)алкиламино, (С 1-С 4)алкоксикарбонильную, (С 1-С 4)алкоксикарбониламино,(С 3-С 6)циклоалкокси, гидроксикарбонильную,гидрокси(С 1-С 4)алкильную, (С 1-С 4)алкокси(С 1 С 4)алкильную, (С 1-С 4)алкоксигруппу или группу -CONR23R24, в которой R23 и R24 представляют собой, независимо друг от друга, атом водорода, (С 1-С 4)алкил, монофтор(С 1-С 4)алкил или полифтор(С 1-С 4)алкил, или иначе, R23 и R24 образуют с атомом азота, с которым они связаны,пирролидинильную или пиперидильную группу,причем указанные пирролидинильная или пиперидильная группы возможно замещены заместителем Z3 или дифторметилиденом; 2) где Z6 представляет собой атом хлора или (С 1 С 4)алкильную или (С 1-С 4)алкоксигруппу;R1 представляет собой (С 1-С 4)алкильную группу, возможно содержащую двойную или тройную связь, (С 1-С 4)алкоксикарбонильную группу, фенилоксикарбонильную группу или группу T1-R22, в которой T1 такой, как определено выше, a R22 представляет собой гидроксильную или (С 1-С 4)алкоксигруппу;R2 и R4 представляют собой, независимо друг от друга, атом водорода, хлора или фтора,или (С 1-С 4)алкильную или (С 1-С 4)алкоксигруппу;R3 представляет собой атом хлора или фтора или гидрокси, (С 1-С 4)алкил, (С 1-С 4)алкокси, (С 1-С 4)карбамоил, (С 1-С 4)алкилкарбониламино, нитро, циано, трифторметил, амино,(С 3-С 6)циклоалкиламино,(С 1-С 4)алкиламино,ди(С 1-С 4)алкиламино, три(С 1-С 4)алкиламмоний А-, где А- является анионом, пирролидин-1 ильную, пиперид-1-ильную, пиперазин-1-иль 5 ную, морфолин-4-ильную или гексагидроазепин-1-ильную группу;X и Y представляют собой, независимо друг от друга, атом водорода, хлора, брома,йода или фтора или (С 1-С 4)алкокси или трифторметоксигруппу; и их фармацевтически приемлемым солям,их сольватам и их гидратам. Термин алкил означает насыщенный,линейный или разветвленный одновалентный углеводородный радикал. Термин (С 1-С 4)алкил означает алкильный радикал, имеющий от 1 до 4 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втop-бутил и третбутил. Термин алкилен означает насыщенный,линейный или разветвленный двухвалентный углеводородный радикал. Термин алкокси означает О-алкильный радикал. Термин анион А- означает, например, Сl-,- Вr , I , CH3SO4-. Термин ди(С 1-С 4)алкиламино означает радикал амино, замещенный двумя алкильными радикалами, которые могут быть одинаковыми или разными. Таким же образом, для три(С 1 С 4)аммония алкильные радикалы могут быть одинаковыми или разными. Соли соединений по изобретению получают способами, которые хорошо известны специалисту в данной области. Соли соединений формулы (I) по данному изобретению включают соли с неорганическими или органическими кислотами, которые делают возможным соответствующее выделение или кристаллизацию соединений формулы (I) и фармацевтически приемлемых солей. В качестве подходящих кислот можно упомянуть пикриновую кислоту,щавелевую кислоту или оптически активную кислоту, например винную кислоту, дибензоилвинную кислоту, миндальную кислоту или камфорсульфоновую кислоту, и кислоты, которые образуют физиологически приемлемые соли,такие как гидрохлорид, гидробромид, сульфат,гидросульфат, дигидрофосфат, малеат, фумарат,2-нафталинсульфонат или паратолуолсульфонат, причем предпочтительным является гидрохлорид. Если соединение по изобретению имеет один или более чем один асимметрический атом углерода, оптические изомеры этого соединения составляют неотъемлемую часть изобретения. Если соединение по изобретению проявляет стереоизомерию,например аксиальноэкваториальную или типа Z-E, изобретение охватывает все стереоизомеры этого соединения. Данное изобретение охватывает соединения формулы (I) в форме чистых изомеров, а также в форме смеси изомеров в любом соотношении. 6 Соединения (I) выделяют в форме чистых изомеров общепринятыми способами разделения. Например, можно применять фракционные перекристаллизации соли рацемата с использованием оптически активной кислоты или основания, которые общеизвестны, или общепринятые методы хроматографии на хиральной или нехиральной фазе. Вышеуказанные соединения формулы (I) также включают соединения, в которых один или более чем один атом водорода, углерода или галогена, в частности йода, хлора или фтора, заменен их радиоактивным изотопом, например тритием или углеродом-14. Такие меченые соединения находят применение в научноисследовательской работе, в метаболических или фармакокинетических исследованиях или в биохимических анализах в качестве рецепторных лигандов. Функциональные группы, возможно присутствующие в молекуле соединений формулы(I) и в реакционных промежуточных соединениях, могут быть защищены либо постоянно, либо временно защитными группами, которые обеспечивают определенный синтез ожидаемых соединений. Реакции введения защиты и снятия защиты проводят по методикам, хорошо известным специалистам в данной области. Термин временные защитные группы для аминов или спиртов подразумевает защитные группы, такие как группы, описанные в "Protective GroupsGroups", Kocienski P.J., 1994, Georg Thieme Verlag. Например, можно упомянуть следующие временные защитные группы для аминов: бензилы, карбаматы (такие как трет-бутилоксикарбонил, который может отщепляться в кислой среде, или бензилоксикарбонил, который может отщепляться в результате гидрогенолиза); для карбоновых кислот: алкиловые эфиры (такие как метиловый, этиловый или трет-бутиловый эфиры, которые могут гидролизоваться в основной или кислой среде) и бензиловые эфиры,которые могут подвергаться гидрогенолизу; для спиртов или для фенолов: такие как тетрагидропираниловый, метилоксиметиловый, метилэтоксиметиловый, трет-бутиловый и бензиловый эфиры; или для карбонильных производных: такие как линейные или циклические ацетали,подобные, например, 1,3-диоксан-2-илу или 1,3 диоксолан-2-илу. Ссылку можно сделать на общеизвестные основные способы, описанные в упомянутом выше источнике информации"Protective Groups". Специалист в данной области будет стоять перед выбором подходящих защитных групп. Соединения формулы (I) могут содержать группы-предшественники, которые впоследствии преобразуют на одной или более чем одной другой стадии. 7 Одно семейство соединений по изобретению состоит из производных индолин-2-она в форме чистого энантиомера или смеси энантиомеров формулы 8 Другое подсемейство соединений по изобретению состоит из соединений формулы(Iс) в которой R1 представляет собой метильную или гидроксильную группу, a R0 и R3 являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемых солей, их сольватов и их гидратов. Еще одно подсемейство соединений по изобретению состоит из соединений формулы где Z1, Z2, R1, R2, R3, R4, R5, Y и X такие, как определено для (I), и их фармацевтически приемлемых солей, их сольватов и их гидратов. В соответствии с другим своим аспектом изобретение относится к соединениям формулы(Iа) в которой R1 представляет собой метильную или гидроксильную группу, a R0, R2, R3, R4, X и Y являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемым солям,их сольватам и их гидратам. Подсемейство соединений по изобретению состоит из соединений формулы(Ib) в которой R0 представляет собой метильную или гидроксильную группу, a R0, R3, R4 и X являются такими, как определено для (I), в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемых солей, их сольватов и их гидратов.(Id) в которой R1 представляет собой метильную или гидроксильную группу, a R0 является таким, как определено для (I), в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемых солей, их сольватов и их гидратов. Среди этих соединений формул (I), (Ia),(Ib), (Iс) и (Id) соединения, в которых R0 представляет собой группу в которой R5 является таким, как определено для (I), составляют еще один аспект изобретения. Среди этих последних соединений соединения, в которых R1 представляет собой метильную группу, составляют еще один аспект изобретения. Согласно еще одному из своих аспектов данное изобретение относится к соединениям,выбранным из 5-хлор-3-(2-хлорфенил)-1-(2,4-диметоксибензил)-3-метилиндолин-2-она (пример 1), 9 5-хлор-3-(2-хлорфенил)-1-[4-(изопропиламино)-2-метоксибензил]-3-индолин-2-она(пример 177),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-морфолиноэтил)бензамида (пример 178), 11 гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]N-этил-N-(2-пирролидиноэтил)бензамида (пример 182),гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]N-этил-N-(2-пиперидиноэтил)бензамида (пример 183),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2-гидроксиэтил)бензамида (пример 198),гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]N-этил-N-[2-(пирид-4-ил)этил]бензамида (пример 179),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-этил-N-(2,2,2 трифторэтил)бензамида (пример 180),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-метил-N-(2,2,2 трифторэтил)бензамида (пример 171),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-этил-N-изопропилбензамида (пример 187),гидрохлорида 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]N-(2-диметиламиноэтил)-N-(2,2,2-трифторэтил) бензамида (пример 202),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-циклогексилбензамида (пример 192),4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)3-метил-2-оксоиндолин-3-ил]-N-этил-N-[3-(пирид-4-ил)пропил]бензамида (пример 204),в форме чистого энантиомера или смеси энантиомеров, и их фармацевтически приемлемых солей, их сольватов и их гидратов. Соединения формулы (I) могут быть получены согласно следующей схеме 1 Схема 1 12 ственно либо R0, R1, R2, R3, R4, X и Y, как они определены для(I),либо группупредшественник для R0, R1, R2, R3, R4, R5, X и Y,и подразумевается, что R1 является иным, чем атом водорода. Другим объектом настоящего изобретения является способ получения соединений формулы (I), отличающийся тем, что а) соединение формулы в которой X, Y, R0 и R1 такие, как определено для (I), подвергают взаимодействию в присутствии основания с галогенидом формулы где Hal представляет собой атом галогена, a R2,R3 R4 такие, как определено для (I); б) или иначе, когда R1 представляет собой электрофильную группу, осуществляют превращение соединения формулы(III) в которой R0, R2, R3, R4, X и Y такие, как определено для (I), действуя производным R1-Z, гдеZ представляет собой уходящую группу, в присутствии основания; в) или иначе, когда R1 представляет собой(IV) в которой R2, R3, R4, X и Y такие, как определено для (I), подвергают взаимодействию с металлоорганическим производным R0-M илиR0MgHal, где R0 такой, как определено для (I),M представляет собой атом металла, и Hal представляет собой атом брома или йода; г) или иначе соединение формулы На этой схеме R0, R1, R2, R3, R4, R5, X и Y такие, как определено для (I), a для (Ip) R'0, R'1,R'2, R'3, R'4, X' и Y' представляют собой соответ 13(Ip) в которой R'0, R'1, R'2, R'3, R'4, X' и Y' представляют собой соответственно либо R0, R1, R2, R3, R4, X иY, как они определены для (I), либо группупредшественник для R0, R1, R2, R3, R4, X и Y, подвергают последующей обработке с превращением любой из групп R'0, R'1, R'2, R'3, R'4, X' и Y' в соответственно R0, R1, R2, R3, R4, X и Y, как они определены для (I), согласно реакциям, хорошо известным специалисту в данной области. Взаимодействие, описанное в (а), предпочтительно проводят с соединением (1), в которомHal представляет собой атом хлора или брома, с использованием в качестве основания гидрида металла, такого как гидрид натрия, или алкоксида щелочного металла, такого как третбутоксид калия, в безводном растворителе, таком как диметилформамид или тетрагидрофуран. Во взаимодействии, описанном в (б), термин уходящая группа означает, например,атом галогена, такого как хлор, бром или йод,или, альтернативно, сульфоновую эфирную группу, такую как паратолуолсульфонат. Предпочтительно, соединение (III) подвергают взаимодействию с галогенидом R1-Hal, где R1 является таким, как определено для (I), и Hal представляет собой атом галогена, предпочтительно атом йода, в присутствии основания. Например,это взаимодействие проводят в присутствии такого основания, как алкоксид щелочного металла, например трет-бутоксид калия, в эфирном растворителе, таком как тетрагидрофуран,или, альтернативно, в присутствии карбоната,такого как карбонат натрия, карбонат калия или карбонат цезия, в растворителе, таком как диметилформамид или ацетонитрил. Преимущественно, при взаимодействии,описанном в (в), соединение формулы (IV) подвергают взаимодействию с магниевым производным R0Mg-Hal, где R0 такой, как определено для (I) или (Ip), и Hal представляет собой атом брома или предпочтительно атом йода, или,альтернативно, соединение (IV) подвергают взаимодействию с производным R0M, где М предпочтительно представляет собой атом лития. Производное R0Li получают либо прямым литиированием, например действуя бутиллитием или диизопропиламидом лития в соответствии с Heterocycles, 1993, 35(1), 151-169, либо реакцией обмена с галоген-литием в соответствии с Organolithium Methods, Pergamon Press,New York, 1988, или J. Am. Chem. Soc, 1956, 005093 14 2217. Эти реакции предпочтительно проводят в безводном растворителе, таком как диэтиловый эфир или тетрагидрофуран. Превращение соединения (Ip), предшественника соединения (I), описанное в (г), проводят по общепринятым методикам. Кроме того, соединения формулы (I) могут быть получены из другого соединения (I) путем превращения одного из заместителей R0, R1, R2,R3, R4, X или Y в конкретные заместители R0, R1 или R3. Например: соединения (I), в которых R3 представляет собой -NH2, могут быть получены восстановлением соответствующих соединений формулы(I), в которых R3 представляет собой -NO2, например под действием хлороводородной кислоты в присутствии олова в спирте, таком как этанол; соединения (I), в которых R3 представляет собой (С 1-С 4)алкиламиногруппу или ди(С 1 С 4)алкиламиногруппу, могут быть получены из соответствующих соединений (I), в которых R3 представляет собой -NH2, реакцией восстановительного аминирования. Ссылаясь на J. Org.Soc, 1974, 96(25), 7812, можно проводить реакцию, действуя (С 1-С 4)алкилкислотой в присутствии боргидрида натрия. Можно также использовать общепринятые реакции N-алкилирования, например взаимодействием аминогруппы с (С 1-С 4)алкилгалогенидом в присутствии диметилформамида и карбоната калия; соединения (I), в которых R3 представляет собой (С 1-С 4)алкоксигруппу, могут быть получены из соответствующих соединений (Ip), в которых R'3 представляет собой -ОН, общепринятой реакцией О-алкилирования, например под действием (С 1-С 4)алкилгалогенида в присутствии диметилформамида и карбоната цезия или калия; соединения (I), в которых R3 представляет собой (С 1-С 4)алкилкарбониламиногруппу, могут быть получены из соответствующих соединений(I), в которых R3 представляет собой -NH2, общепринятым ацилированием, например под действием хлорангидрида (С 1-С 4)алкилкислоты в присутствии основания, такого как триэтиламин, в растворителе, таком как дихлорметан; соединения (I), в которых R3 представляет собой циклический амин или морфолин-4-ил,могут быть получены из соответствующих соединений (I), в которых R3 представляет собой могут быть получены из соответствующих соединений формулы (I) путем превращения группы R5 общепринятыми способами, например алкилированием, ацилированием, окислением, восстановлением или аминированием,которые хорошо известными специалисту в данной области. Соединения (III) получают дегалогенированием соединений формулы(I) в которой R0, R2, R3, R4, X и Y такие, как определено для (I), и Hal представляет собой атом хлора, брома или йода, например под действием затрудненного диалкиламида лития, такого как диизопропиламид лития (LDA), по аналогии со способом, описанным N. Newcom et al. в J. Am.Chem. Soc, 1990, 5186-5193. Соединение формулы (I) получают, например, превращением соответствующего соединения (I), в котором R1 представляет собой-ОН, под действием галогенированного производного, например типа галогенангидрида кислоты. В качестве хлорированного производного можно упомянуть SOCl2. Соединение (IV) обычно получают путем взаимодействия соединения (1) с производным изатина формулы(2) где X и Y такие, как определено для (I), в тех же условиях, что и условия, описанные выше для получения соединения (I) из соединения (II). Производные изатина (2) являются коммерчески доступными соединениями, или их получают способами, описанными в Tetrahedron Letters,1998, 39, 7679-7682; Tetrahedron Letters, 1994,35, 7303-7306; J. Org. Chem., 1977, 42, 13441348; и Advances in Heterocyclic Chemistry, A.R.York, 1975, 18, 2-58. Соединения (II) можно синтезировать различными способами, в частности способами,раскрытыми в патентных заявках ЕР 526348 иWO 95/18105. Некоторые пути производства соединений(II) показаны на схеме 2. Термин нуклеофильный R1 означает (С 1 С 4)алкоксигруппу. Соединения (II), в которых R1 представляет собой электрофильную группу, например (С 1 С 4)алкильную группу, могут быть получены из соединений формулы(I), путем взаимодействия с производным R1-Z,где Z представляет собой уходящую группу, в тех же условиях, что и условия, описанные выше для преобразования соединения (III) в соединение (I). Соединение (V) обычно синтезируют либо дегидроксилированием соответствующего соединения (II), в котором R1 представляет собой ОН, под действием хлорида олова в кислой среде, согласно способу, описанному вTetrahedron, 1996, 52(20), 7003-7012, или под действием триэтилсилана, согласно Bioorganic andMedicinal Letters, 1997, 7(10), 1255-1260; либо реакцией циклизации в среде сильной кислоты, такой как, например, серная кислота,соединения формулы(I), причем само это соединение (VII) получают реакцией конденсации производного -гидроксиуксусной кислоты формулы(VIII) где R0 является таким, как определено для (I), и аминобензола формулы(I). Соединения (3) коммерчески доступны,или их синтезируют стандартными способами. Соединения формулы (VIII) коммерчески доступны, или их синтезируют способами, хорошо известными специалисту в данной области. В частности, можно сделать ссылку на J.Med. Chem., 1987, 30(8), 1447. Другие реакции также могут приводить к получению соединений (V). Можно упомянуть реакцию Бруннера (Brunner), описанную в 18 чения соединений (I), в которых R1 представляет собой ОН, из соединений (IV). Когда R1 не представляет собой гидроксильную группу, соединения (II) могут быть получены по нижеследующей схеме 3 Схема 3 (R1 не представляет собой ОН) согласно Tetrahedron, 1996, 52(20), 70037012. Соединения (II), в которых R1 представляет собой (С 1-С 4)алкоксигруппу, получают из соединений формулы(I), a Hal представляет собой атом галогена, например атом хлора, действуя соответствующим спиртом R1H. Соединение (VI) получают из соответствующего соединения (II), в котором R1 представляет собой ОН, путем взаимодействия с тионилхлоридом в присутствии пиридина в дихлорметане. Соединения (II), в которых R1 представляет собой ОН, обычно получают из соответствующего изатина формулы в которой X и Y такие, как определено для (I),согласно способу, описанному выше для полу На этой схеме 3 R0, R1, X и Y являются такими, как определено для (I), R1 не представляет собой гидроксильную группу, а М представляет собой, например, атом лития или MgHal, где Hal представляет собой атом галогена. Превращение соединения (X) в соединениеChem. Soc., 1957, 1928. Бензилгалогениды (1) известны, или их получают известными способами. Например,можно упомянуть J. V. Rajanbabu, J. Org. Chem.,1986, 51, 1704-1712, и публикации, процитированные в ЕР 636609. В общем, производные галогенометилбензола (1) получают действием N-галогеносукцинимидов на соответствующие производные метилбензола и в соответствии с ЕР 229566. Взаимодействие проводят в растворителе, таком как тетрахлорид углерода, в присутствии дибензоилпероксида. Производное галогенометилбензола могут быть получены также из соответствующего производного гидроксиметилбензола путем взаимодействия с трибромидом фосфора в диэтиловом эфире или путем взаимодействия с тионилхлоридом. На любой стадии этого способа могут образовываться промежуточные соединения типа(IIр), (IIIр) или (IVp), в которых по меньшей мере один из заместителей заменен одной из его групп-предшественников. Эти соединения (IIр),(IIIр) и (IVp) превращают стандартными реакциями в (II), (III) и (IV) соответственно. Специалист в данной области способен будет адаптировать вышеупомянутые реакции к соединениям (IIр), (IIIр) и (IVp). 19 Соединения по изобретению стали объектом биохимических и фармакологических исследований. Сродство соединений по изобретению к рецепторам окситоцина определяли в invitro тесте на связывание с использованием метода, описанного J. Elands et al. в Eur.Pharmacol., 1987,147, 192-207. Этот метод представляет собой исследование in vitro вытеснения меченного радиоактивным йодом аналога окситоцина на рецепторах окситоцина в мембранном препарате рецепторов окситоцина человеческой матки. В этом тесте значения IC50 (концентрация, которая ингибирует 50% связывания меченного радиоактивным йодом аналога окситоцина с его рецепторами) низкие и варьируются в пределах от 10-10 до 10-6 М. Были проведены также исследования на сродство соединений по изобретению к рецепторам вазопрессина V1 а человека (метод, описанный М. Thiobonnier et al. в J. Biol. Chem.,1994, 269, 3304-3310), к рецепторам V1b (метод,описанный Т. Sugimoto et al. в J. Biol. Chem.,1994, 269, 27088-27092) и к рецепторам V2 (метод, описанный М. Birnbaueret al. в Nature(Lond.), 1992, 357, 333-335). Исследованные соединения либо имеют незначительное сродство к рецепторам V1 а, V1b и V2, либо не имеют сродства к рецепторам V1 а, V1b и V2. В качестве доказательства, соединение примера 1 демонстрирует IC50 менее 50 нМ, причем в отношении рецепторов V1 а, V1b и V2 значения IC50 составляют более 1 мкМ. Агонистическую или антагонистическую природу соединений определяют в условиях invitro в тесте на измерение внутриклеточного кальция в отношении клеток, экспрессирующих рецепторы окситоцина человека, согласно общей методике, описанной в Am. J. Physiol., 268(Heart Circ. Physiol., 37), 1995, H404-H410. Когда соединения по изобретению ведут себя как антагонисты, их значение IC50 составляет преимущественно от 0,5 мкМ до 0,5 нМ. К примеру, правовращающий энантиомер соединения примера 1 является антагонистом со значением IC50 3,21,9 нМ. Соединения по изобретению, сильнодействующие и селективные лиганды рецепторов окситоцина, особенно благотворны в предупреждении и/или лечении окситоцинзависимых расстройств. Соединения по настоящему изобретению могут либо имитировать, либо ингибировать эффекты окситоцина. Они особенно благотворны при рубцевании, при аналгезии и анксиолизе (предупреждение боли и тревоги), депрессии, шизофрении,аутизме, обсессивно-компульсивном синдроме,при расстройствах материнского поведения (облегчение узнавания и принятия мать - ребенок) и социального поведения, при нарушениях памяти, для регулировании приема пищи и питья,при зависимости от лекарственных средств, при отнятии ребенка от груди и половой мотивации. 20 Их можно успешно применять при лечении расстройств мочеполовой сферы, в частности в акушерской и гинекологической областях, в частности в качестве вызывающего расслабление матки или токолитического агента, или для контроля сокращений матки до разрешения беременности в срок, для контроля пренатальной родовой деятельности или для контроля подготовительной родовой деятельности в целях родоразрешения путем кесарева сечения, для решения проблем стерильности или фертильности, для контроля родов (в частности, при использовании в ветеринарии), для контроля эструса, прекращения кормления грудью, отнятия от груди или пересадки и имплантации эмбрионов, для лечения эндометриоза, дисменореи и мочевой напряженности или безотлагательного недержания, доброкачественной гипертрофии простаты и эректильных дисфункций, гипертензии, гипонатриемии, сердечной недостаточности, атеросклероза или ангиогенеза, и для регулирования накопления жира жировой клеткой. Кроме того, принимая во внимание роль окситоцина в контроле лютеинизирующего гормона (J.J. Evans, J. Endocrin., 1996, 151, 169174), соединения по изобретению можно применять для предупреждения беременности. Кроме того, соединения по изобретению,благодаря их противоопухолевому действию,можно применять при окситоцинсекретирующих опухолях, в частности при раке молочной железы или простаты. Применение соединений по изобретению для предупреждения и/или лечения вышеупомянутых состояний и для изготовления лекарств, предназначенных для лечения этих состояний, составляет неотъемлемую часть данного изобретения. Таким образом, другим объектом настоящего изобретения является фармацевтическая композиция, содержащая соединение по изобретению или его фармацевтически приемлемую соль, сольват или гидрат и подходящие эксципиенты. Указанные эксципиенты выбирают в соответствии с желаемыми фармацевтической формой и способом введения: пероральными,сублингвальными, подкожными, внутримышечными, внутривенными, местными, внутритрахеальными, интраназальными, трансдермальными, ректальными или интраокулярными. Фармацевтические композиции готовят способами, известными специалисту в данной области. Для получения желаемого профилактического или терапевтического эффекта каждая стандартная доза содержит от 0,5 до 1000 мг,предпочтительно от 1 до 500 мг активных ингредиентов в комбинации с фармацевтическим носителем. Эту стандартную дозу можно вводить от 1 до 5 раз в сутки так, чтобы суточная дозировка составляла от 0,5 до 5000 мг, предпочтительно от 1 до 2500 мг. 21 Соединения по изобретению также можно применять в изготовлении композиций для ветеринарного применения для регулирования родов. Соединения по изобретению можно также применять в изготовлении косметических композиций. Эти препараты можно предоставлять в форме крема для местного применения, и они должны предназначаться для контроля липолиза. Композиции по настоящему изобретению могут содержать, в дополнение к продуктам формулы (I) выше или их фармацевтически приемлемым солям, сольватам и гидратам, например, активные начала, которые можно применять в лечении расстройств или состояний,указанных выше. Таким образом, еще одним объектом настоящего изобретения является фармацевтическая композиция, содержащая несколько активных начал в комбинации, одно из которых представляет собой соединение по изобретению. В частности, настоящее изобретение относится к фармацевтическим композициям, содержащим соединение по изобретению,антагонист рецепторов окситоцина, вместе с соединением-антагонистом V1 а. Этот тип композиции особенно полезен для лечения дисменореи или эндометриоза или для контроля преждевременных родов и для контроля подготовительной родовой деятельности в целях родоразрешения путем кесарева сечения. Еще одним объектом данного изобретения является, таким образом, продукт, содержащий антагонист рецепторов окситоцина по изобретению и антагонист рецепторов вазопрессина V1 а для одновременного, раздельного или последовательного применения в лечении окситоцинзависимых расстройств, в частности для лечения дисменореи или эндометриоза, для контроля преждевременных родов или для контроля подготовительной родовой деятельности в целях родоразрешения путем кесарева сечения. Следующие ниже разделы ПОДГОТОВИТЕЛЬНЫЕ ПРИМЕРЫ и ПРИМЕРЫ иллюстрируют изобретение, но не ограничивают его. Спектры ядерного магнитного резонанса регистрировали в дейтерированном хлороформе, если не указано иное, при 200 МГц, и химические сдвиги выражены в млн-1. Использованы следующие сокращения: s - синглет, m - мультиплет, d - дублет, t - триплет, q - квинтет. Все соединения по изобретению были подвергнуты органическому элементному анализу,который проводили методом сжигания при 1000 С в присутствии кислорода с использованием весов типа Supermicro S4 Sartorius и элементного анализатора типа ЕА 1108. Анализ полученного процентного состава элементов углерод, водород, азот и сера соответствует ожидаемым теоретическим расчетам. 22 ПОДГОТОВИТЕЛЬНЫЕ ПРИМЕРЫ Подготовительный пример 1. N-(4-Хлорфенил)-2-оксопропионамид, соединение XI.1. 26,3 г 4-хлорфениламина в 150 мл дихлорметана и 35 мл триэтиламина при -60 С добавляют к 22 г 2-оксопропионилхлорида (полученного согласно Synthesis, 1975, 163-164 из 2 оксопропионовой кислоты и 1,1-дихлорметилового эфира) в 350 мл дихлорметана. Реакционную смесь перемешивают при -60 С в течение 2 ч, а затем при -30 С добавляют 200 мл водного 0,15 н. раствора хлороводородной кислоты и 500 мл дихлорметана. Органическую фазу экстрагируют, промывают 0,25 н. водным раствором хлороводородной кислоты и сушат над сульфатом натрия. Растворители выпаривают при пониженном давлении, и полученный остаток кристаллизуют из дихлорметана; Т.пл. = 151 С. Подготовительный пример 2. 2-(2-Хлор-4 фторфенил)-N-(4-хлорфенил)-2-гидроксипропионамид, соединение IX.1. 0,18 г магния и 2,57 г 2-хлор-4-фтор-1 йодбензола перемешивают при нагревании с обратным холодильником в 30 мл диэтилового эфира. Полученную таким образом смесь добавляют при -60 С к 0,99 г соединения XI.1 в 9 мл тетрагидрофурана. Реакционную смесь перемешивают при 20 С в течение 2 ч, а затем добавляют насыщенный водный раствор NH4Cl. Проводят экстракцию этилацетатом, органическую фазу сушат над Na2SO4 и растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/дихлорметан 1/1(об./об.), а затем смесью дихлорметан/метанол 99/1 (об./об.). Выделенное таким образом твердое вещество кристаллизуют из диизопропилового эфира; Т.пл. = 167 С. Таким же способом получены следующие соединения= 171 С. Подготовительный пример 3. (2-Хлорфенил)-N-(4-хлорфенил)гидроксиацетамид, соединение VII.1 Смесь 60 г (2-хлорфенил)-гидроксиуксусной кислоты и 41 г 4-хлорфениламина в 300 мл 1,2-дихлорбензола нагревают до 200 С. Установка включает в себя аппарат Дина-Старка, и поэтому во время реакции образующаяся вода 23 удаляется. Отгоняют приблизительно 150 мл растворителя, и целевое соединение кристаллизуют при 20 С. Твердое вещество промывают диизопропиловым эфиром; Т.пл. = 120 С. Таким же способом из 4-метоксифениламина получен (2-хлорфенил)-N-(4-метоксифенил)гидроксиацетамид, соединение VII.2; Т.пл.= 130 С. Таким же способом из (2-хлор-4-фторфенил)гидроксиуксусной кислоты (синтезированной согласно J. Med. Chem., 1987, 30(8),1447, из 2-хлор-4-фторбензальдегида и бромоформа) получен (2-хлор-4-фторфенил)-N-(4 хлорфенил)гидроксиацетамид,соединение При 10 С готовят раствор 263 мл 95% серной кислоты и 100 мл 20% олеума. Этот раствор перемешивают с 74 г соединения VII.1 в течение 2 ч при 40 С. Потом реакционную смесь охлаждают, а затем выливают на смесь ледвода. Полученный осадок отфильтровывают, а затем промывают 1000 мл воды. Твердое вещество растворяют в дихлорметане и полученный таким образом раствор последовательно промывают насыщенным водным раствором гидрокарбоната натрия и водой, а затем сушат надNa2SO4. Растворители выпаривают при пониженном давлении, а затем полученное твердое вещество промывают диэтиловым эфиром; Т.пл.= 201 С. Соединение V.2, приведенное ниже, получено таким же способом: 5-хлор-3-(2-хлор-4 фторфенил)индолин-2-он, соединение V.2 Т.пл. = 221 С. Подготовительный пример 5. 5-Метокси-3(2-хлорфенил)индолин-2-он, соединение V.3. 20,1 г 2-(2-хлорфенил)-N-(4-метоксифенил)-2-гидроксиацетамида, соединения VII.2,добавляют к смеси фосфорной кислоты, полученной из 65 мл 85% фосфорной кислоты и 130 г пентоксида фосфора при температуре 50 С, и затем смесь выдерживают при этой температуре в течение 6 ч. После охлаждения проводят обработку водным раствором гидрокарбоната натрия до получения рН 5. Проводят экстракцию этилацетатом. Органическую фазу промывают водой, а затем сушат над безводным сульфатом натрия. Растворитель частично выпаривают при пониженном давлении и отфильтровывают целевой продукт; Т.пл. = 179 С. 18,2 г трет-бутоксида калия добавляют к раствору 15 г соединения V.1 в тетрагидрофуране при -40 С. Реакционную смесь в течение 5 мин перемешивают при 0 С, а затем добавляют раствор 3,7 мл метилйодида в 80 мл тетрагидрофурана при -60 С. Как только температура реакционной смеси достигнет 0 С, добавляют 100 мл насыщенного водного раствора хлорида аммония и проводят экстракцию этилацетатом. Органическую фазу промывают водой, а затем сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Полученное твердое вещество очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью этилацетат/циклогексан 1/9 (об./об.). Полученное твердое вещество кристаллизуют из н-пентана; Т.пл.= 185 С. Таким же способом получают приведенные ниже соединения с II.2 по II.6. 5-Метокси-3-(2-хлорфенил)-3-метилиндолин-2-он, соединение II.7, получено по такой же методике из 5-метокси-3-(2-хлорфенил)индолин 2-она; Т.пл. = 176 С. Подготовительный пример 7. 5-Хлор-3-(2 хлор-4-фторфенил)-3-метилиндолин-2-он,соединение II.6. 25 Описанное выше соединение II.6 можно получить также следующим образом: 0,3 г соединения IX.1 и заранее приготовленный раствор 5,3 г пентоксида фосфора в 3 мл 85% водного раствора фосфорной кислоты нагревают до 150 С в течение 5 ч. Реакционную смесь выливают на лед, добавляют насыщенный водный раствор карбоната калия и проводят экстракцию этилацетатом. Полученную таким образом органическую фазу сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Полученное твердое вещество кристаллизуют из н-пентана; Т.пл. = 189 С. 5-Хлор-3-(2,5-диметоксифенил)-3-метилиндолин-2-он, соединение II.8 получено таким же способом; Т.пл. = 163 С. Подготовительный пример 8. 5-Хлор-3-[2 хлор-4-(4-метил-1-пиперазинил)фенил]-3-метилиндол-2-он, соединение II.9 Смесь, состоящую из 0,5 г соединения II.6,2,5 мл диметилсульфоксида, 3,6 мл N-метилпиперазина, 1 г карбоната натрия и 0,1 г йодида меди греют в при 120 С течение 24 ч. После того, как температура снова станет комнатной температурой, соли отфильтровывают через тальк, и осадок промывают диметилсульфоксидом, а затем 60 мл этилацетата. Фильтрат промывают 40 мл воды и органическую фазу сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят дихлорметаном. После переноса твердого остатка в диизопропиловый эфир и последующего фильтрования выделяют целевой продукт; Т.пл. =155 С. Подготовительный пример 9. 5-Хлор-3-(2 хлор-4-фторфенил)-3-гидроксииндолин-2-он,соединение II.10 26 водный раствор хлорида аммония. Проводят экстракцию этилацетатом, органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят дихлорметаном, а затем смесью дихлорметан/метанол 95/5 (об./об.). Полученное твердое вещество кристаллизуют из нпентана; Т.пл. = 239 С. Таким же способом из 1-бром-2,5-диметоксибензола получают 5-хлор-3-(2,5-диметоксифенил)-3-гидроксииндолин-2-он, соединение 0,8 мл тионилхлорида добавляют при температуре ниже 20 С к 3 г соединения II.11 в присутствии 1,2 мл пиридина в 50 мл дихлорметана и затем реакционную смесь перемешивают в течение 1 ч. Реакционную смесь промывают водой и сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении, после чего остаток хроматографируют на колонке с силикагелем, причем элюирование проводят дихлорметаном. Т.пл. = 157 С. Таким же способом получены следующие соединения: 3,5-дихлор-3-(2-хлорфенил)индолин-2-он,соединение VI.2 Т.пл. = 190 С. 3,5-Дихлор-3-(2-хлорфенил)индолин-2-он,соединение VI.3 0,44 г 60% дисперсии гидрида натрия в масле добавляют при -40 С к охлажденной суспензии 2 г 5-хлориндолин-2,3-диона в 60 мл тетрагидрофурана, и эту реакционную смесь перемешивают при 0 С в течение 15 мин. 0,45 г магния и 4,23 г 2-хлор-4-фтор-1-йодбензола в 18 мл диэтилового эфира перемешивают при нагревании с обратным холодильником в течение 3 ч. Полученный таким образом раствор медленно добавляют при -60 С к реакционной смеси. Реакционную смесь перемешивают в течение 30 мин при 20 С и добавляют насыщенный 27 0,4 г соединения VI.1 в присутствии 25 мл метанола в 50 мл тетрагидрофурана поддерживают при нагревании с обратным холодильником в течение 3 ч. Растворители выпаривают при пониженном давлении. Т.пл. = 180 С. Таким же способом получают следующие соединения: 5-хлор-3-(2-хлорфенил)-3-метоксииндолин-2-он, соединение II.12X = 5-Cl; Y = Н а) 0,25 мл трибромида фосфора добавляют при -50 С к суспензии 1,45 г 2,4-диметоксифенилметанола в 25 мл диэтилового эфира. Полученный таким образом раствор оставляют стоять до достижения температуры 0 С; б) 2 г трет-бутоксида калия добавляют при-60 С к суспензии 1,3 г 5-хлориндолин-2,3-диона в 50 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 5 мин при 0 С, а затем при -60 С добавляют раствор, приготовленный на стадии а). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч, затем растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/дихлорметан при соотношении,изменяющемся от 8:2 до 2:8 (об./об.). Полученное твердое вещество кристаллизуют из толуола; Т.пл. = 175 С. Таким же способом получают следующие соединения: 5-хлор-1-(4-хлор-2-метоксибензил)индолин-2,3-дион, соединение IV.2, T.nл. = 136 С; 5,7-дихлор-1-(2,4-диметоксибензил)индолин-2,3-дион, соединение VI.3, Т.пл. = 171 С; 5-фтор-1-(2,4-диметоксибензил)индолин 2,3-дион, соединение IV.4, Т.пл. = 163 С; 1-(2,4-диметоксибензил)индолин-2,3-дион,соединение IV.5, Т.пл. = 142 С. Пример 1. 5-хлор-3-(2-хлорфенил)-1-(2,4 диметоксибензил)-3-метилиндолин-2-он 28 а) 0,48 мл трибромида фосфора при -50 С добавляют к суспензии 2,6 г 2,4-диметоксифенилметанола в 45 мл диэтилового эфира. Полученный таким образом раствор оставляют стоять до достижения температуры 0 С. б) 1,2 г трет-бутоксида калия добавляют при -40 С 3 г соединения II.1 в растворе в 90 мл тетрагидрофурана, затем реакционную смесь перемешивают до тех пор, пока температура вновь не достигнет 0 С. Реакционную смесь затем охлаждают до -60 С и добавляют раствор,полученный на стадии (а). Реакционную смесь перемешивают в течение 2 ч при 20 С, добавляют 50 мл воды и проводят экстракцию этилацетатом. Органическую фазу сушат над сульфатом натрия и растворители выпаривают при пониженном давлении. Полученное твердое вещество кристаллизуют из диизопропилового эфира; Т.пл. = 179 С. Это соединение в рацемической форме разделяют хроматографией на колонкеChiralpak AD от Daicel, причем элюирование проводят смесью 2-метилпентан/этанол 98/2(об./об.). Таким образом выделяют правовращающий изомер; Т.пл. = 92 С; Соединение примера 2 получают по такой же методике из 5-метокси-3-(2-хлорфенил)индолин-2-она, соединения II.7; Т.пл. = 133 С. Пример 3. 5-Хлор-3-(2-хлорфенил)-1-[4(1,1-диметилэтокси)-2-метоксибензил]-3-метилиндолин-2-он а) Получение [4-(1,1-диметилэтокси)-2 метокси]фенилметанола Получение метил-[4-(1,1-диметилэтокси)2-метоксибензоата согласно J. Org. Chem., 1986,51, 111-113 0,25 мл трифторметансульфоновой кислоты добавляют при -70 С к 6,2 г метил-4-гидрокси-2-метоксибензоата (согласно J. Med.Chem., 1985, 28, 717-727, из коммерческого метил-2,4-дигидроксибензоата) в 60 мл дихлорметана, а затем с помощью погруженной в реакционную смесь трубки добавляют 25 мл 2-метилпропена, предварительно конденсированного при -20 С и дегазированного в результате есте 29 ственного подогрева. После перемешивания в течение 24 ч при температуре между -30 и-70 С к этой реакционной смеси добавляют 0,5 мл триэтиламина. Растворители выпаривают при пониженном давлении и остаток переносят в этилацетат и промывают разбавленным раствором бикарбоната натрия. Отделенную органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Целевой продукт выделяют,при этом очистку проводят хроматографией на колонке с силикагелем, элюируя циклогексаном. 1 Н ЯМР: 7.75 (d, 1H), 6.62-6.53 (m, 2H),3.85 (s, 3H), 3.84 (s, 3H), 1.40 (s, 9H); согласно J. Chem. Soc. Perkin Trans., 1991,3291-3294 15,90 мл 2 М раствора LiBH4 в тетрагидрофуране добавляют к упомянутому выше соединению, полученному на стадии (а), в 25 мл толуола. Реакционную смесь нагревают при 100 С в течение 45 мин. При примерно 20 С реакционную смесь выливают на смесь вода/лед, и водную фазу экстрагируют этилацетатом. После разделения отстаиванием водную фазу экстрагируют этилацетатом. Органические фазы соединяют, сушат над безводным сульфатом натрия и затем растворители выпаривают при пониженном давлении. 1 Н ЯМР: 7.10 (d, 1H), 6.59-6.50 (m, 2H),4.61 (d, 2H), 3.81 (s, 3H), 2.20 (t, 1H), 1.34 (s, 9H). б) Соединение примера 3 получают по такой же методике, как для соединения примера 1; Т.пл. = 131 С. Пример 4. 5-Хлор-3-(2-хлорфенил)-1-[4-(1 метилэтокси)-2-метоксибензил]-3-метилиндолин-2-он а) Получение [4-(1-метилэтокси)-2-метокси]фенилметанола. Получение метил-4-(1-метилэтокси)-2 метоксибензоата согласно Synthesis, 1988, 712. 2,86 г карбоната цезия и затем 1,28 мл 2 йодпропана добавляют при 0 С к 0,8 г метил-4 гидрокси-2-метоксибензоата в 20 мл диметилформамида. Реакционную смесь перемешивают при 20 С в течение 2 ч, затем добавляют 50 мл воды и проводят экстракцию этилацетатом. Органическую фазу промывают водой, а затем сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. 1 Н ЯМР: 7.81 (d, 1 Н), 6.47-6.42 (m, 2 Н),4.69-4.51(m, 1 Н), 3.85 (s, 3H), 1.33 (d, 6 Н). Это соединение может быть получено из соединения II.10 по такой же методике, как методика, описанная в примере 1, или же согласно приведенному ниже способу: 0,87 мл 2-хлор-4-фтор-1-иодбензола и 0,09 г магния в 15 мл диэтилового эфира перемешивают при нагревании с обратным холодильником в течение 1 ч. Добавляют при температуре-40 С 0,75 г соединения IV.1 в парциальном растворе в 15 мл тетрагидрофурана. Эту реакционную смесь перемешивают в течение 2 ч при 20 С, а затем добавляют насыщенный водный 32 раствор хлорида аммония. Проводят экстракцию этилацетатом, органическую фазу сушат над безводным сульфатом натрия и после этого растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/ дихлорметан 1/1 (об./об.). Полученное твердое вещество кристаллизуют из циклогексана; Т.пл. = 177 С. Это соединение в рацемической форме разделяют хроматографией на колонкеChiralpak AD от Daicel, причем элюирование проводят смесью 2-метилпентан/этанол 9/1(об./об.). Таким образом выделяют правовращающий энантиомер: []D20,5= +63 (с=1, СН 3 ОН) и его антипод. Пример 19. 5-Хлор-3-(2-хлор-5-метоксиметоксиметилфенил)-1-(2,4-диметоксибензил)-3 гидроксииндолин-2-он а) Получение 2-хлор-1-йод-5-гидроксиметилбензола согласно J. Org. Chem., 1991, 56,5964-5965, из соответствующей коммерческой бензойной кислоты. К 25 г 4-хлор-3-йодбензойной кислоты в растворе в 200 мл тетрагидрофурана при 0 С очень медленно порциями добавляют 5,02 г боргидрида натрия, а затем 14,5 г йода в растворе в 50 мл тетрагидрофурана. Эту реакционную смесь перемешивают в течение 2 ч при комнатной температуре, а затем при 35 С в течение 30 мин. Проводят гидролиз при 10 С раствором 0,5 н хлороводородной кислоты и экстракцию этилацетатом. Органическую фазу отделяют отстаиванием и после этого обрабатывают водным раствором бисульфита натрия, а затем водой. Органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Целевое соединение получают дистилляцией; Т.кип. = 108 С при 3 Па. б) Получение 2-хлор-1-йод-5-метоксиметоксиметилбензола согласно Synthesis, 1985, 74. 1,5 мл моногидрата паратолуолсульфоновой кислоты и 1,4 г бромида лития добавляют к 24,45 г упомянутого выше соединения в 100 мл диметоксиметана. Эту реакционную смесь перемешивают при 35 С в течение 4 ч, а затем в течение 2 ч при нагревании с обратным холодильником. Проводят гидролиз при комнатной температуре с использованием разбавленного водного раствора бикарбоната натрия и проводят экстракцию диэтиловым эфиром. Органическую фазу промывают водой, сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Целе 33 вой продукт получают дистилляцией; Т.кип. = 108 С при 1,9 Па. в) Соединение примера 19 получают по методике, описанной в примере 18; Т.пл. = 142 С. Пример 20. Метил-4-хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-гидрокси-2-оксоиндолин-3 ил]бензоат 45,2 мл 1,6 М раствора н-бутиллития в гексане, разведенного в 200 мл тетрагидрофурана и охлажденного до -90 С, медленно добавляют к 10,72 г метил-4-хлор-3-йодбензоата (полученного этерификацией соответствующей коммерческой кислоты; Т.пл. = 56 С) в 200 мл тетрагидрофурана, охлажденного до -100 С. Реакционную смесь перемешивают при -95 С в течение 20 мин и после этого добавляют охлажденный до -70 С раствор 10 г соединения IV.1 в 600 мл тетрагидрофурана. После того, как температура достигнет комнатной температуры, проводят гидролиз с использованием 200 мл насыщенного раствора хлорида аммония, растворители частично выпаривают при пониженном давлении, проводят экстракцию этилацетатом, органическую фазу сушат над безводным сульфатом натрия и после этого растворители выпаривают при пониженном давлении. Полученный остаток промывают диэтиловым эфиром, отфильтровывают, а затем сушат при 50 С при пониженном давлении; Т.пл. =236 С. Пример 21. 3-(5-Амино-2-хлорфенил)-5 хлор-1-(2,4-диметоксибензил)-3-гидроксииндолин-2-онLetters, 1984, 25 (12), 1253-1254, и 0,03 г йодида цинка нагревают при 140 С в токе аргона в течение 5 ч. Целевой продукт дистиллируют; Т.кип. = 105 С при 37 Па. б) Соединение примера 21 получают по методике, которая описана в примере 20, при этом очистку проводят хроматографией на колонке с силикагелем, элюируя смесью дихлорметан/метанол 99/1 (об./об.); Т.пл. = 133 С. Соединения приведенных ниже примеров 22-31 получают таким же способом, как и способ, описанный в примере 18. 35 Смесь, состоящую из 5 г 3-бромпараанизальдегида, 5 мл этиленгликоля, 0,088 г паратолуолсульфоновой кислоты и 125 мл толуола нагревают с обратным холодильником в течение 1 ч 30 мин в реакторе, оснащенном аппаратом Дина-Старка. Реакционную смесь вливают при комнатной температуре в 50 мл воды, проводят экстракцию диэтиловым эфиром и органическую фазу сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Полученное масло очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 8/2 (об./об.). Целевой продукт получают после дистилляции при пониженном давлении; Т.кип. = 128 С при 5 Па. б) Соединение примера 32 получают из предыдущего соединения по методике, описанной в примере 18; Т.пл. = 140 С. Пример 33. 5-Хлор-1-(2,4-диметоксибензил)-3-5-[(диметиламино)метил]-2-метоксифенил-3-гидроксииндолин-2-он а) 3-[5-Хлор-1-(2,4-диметоксибензил)-3 гидрокси-2-оксоиндолин-3-ил]-4-метоксибензальдегид, полученный снятием защиты с соединения примера 32 в кислой среде согласно J.Chem. Soc., Сhem. Commun., 1987,1351. Смесь, состоящую из 0,55 г соединения примера 32, 5 мл ацетона, 2,5 мл воды и 0,22 мл 1 н хлороводородной кислоты доводят до температуры 30 С в течение 2 ч при перемешивании. Реакционную смесь нейтрализуют при комнатной температуре водным раствором бикарбоната натрия и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия, растворители выпаривают при пониженном давлении и в результате фильтрации остатка после выпаривания, перенесенного в диэтиловый эфир, получают целевое соединение; Т.пл. = 189 С. б) Восстановительное аминирование согласно J. Org. Chem., 1996, 61(11), 3849-3862. К 0,113 мл упомянутого выше соединения,полученного на стадии (а), в суспензии в 3 мл 1,2-дихлорэтана добавляют 0,015 г диметиламина в растворе в 1 мл 1,2-дихлорэтана, а затем 0,72 г триацетоксиборгидрида натрия. После перемешивания в течение 15 ч при комнатной температуре проводят гидролиз с использованием 10 мл воды и проводят экстракцию этилацетатом. Органическую фазу сушат над сульфатом натрия, растворители выпаривают при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью дихлорметан/метанол 95/5 (об./об.). Целевой продукт получают после кристаллизации из изопропилового эфира; Т.пл. = 162 С (0,4 Н 2 О). К раствору 2,88 мл 1,5 М диизопропиламида лития в циклогексане, разведенному в 7 мл тетрагидрофурана и охлажденному до -75 С, по каплям добавляют раствор 0,414 мл 3-хлорпиридина в 5 мл тетрагидрофурана. После добавления реакционную смесь перемешивают в течение 20 мин при -75 С, а затем добавляют 1,2 г соединения IV.1 в 15 мл тетрагидрофурана. Температуре реакционной смеси дают возможность медленно подняться до 0 С, а затем проводят гидролиз с использованием 30 мл водного раствора хлорида аммония. Проводят экстракцию этилацетатом, и органическую фазу сушат над сульфатом натрия. Растворители выпаривают при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 75/25 (об./об.). Полученное твердое вещество затем кристаллизуют из этилацетата; Т.пл. = 215 С. Указанные ниже соединения примеров 35 и 36 получают таким же способом. Таблица 6. а) 3,5-Дихлор-3-(2-хлорфенил)-1-(2,4-диметоксибензил)индолин-2-он, соединение I'.1. 0,98 мл тионилхлорида добавляют при-20 С к раствору 2 г соединения примера 30 и 1,4 мл пиридина в 24 мл дихлорметана. Реакционную смесь перемешивают в течение 1 ч 30 мин при комнатной температуре и охлаждают до 0 С, а затем добавляют 50 мл воды и 50 мл 37 дихлорметана. Проводят разделение отстаиванием, органическую фазу промывают водным раствором NаНСО 3 и сушат над безводным сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный остаток сушат при пониженном давлении в течение 2 ч и выделяют соединение I'.1 в виде смолы,которую непосредственно используют на следующей стадии. б) Соединение III.1. 6,53 мл 1,5 М раствора диизопропиламида лития в циклогексане, повторно разбавленного 15 мл тетрагидрофурана, добавляют при -68 С к раствору полученного выше соединения I'.1 в 24 мл тетрагидрофурана. Реакционную смесь перемешивают в течение 45 мин при -68 С, а затем медленно добавляют 5 мл метанола. При приблизительно 0 С добавляют воду и проводят экстракцию этилацетатом. Органическую фазу промывают раствором хлорида натрия и сушат над сульфатом натрия. Растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 85/15 (об./об.). Целевой продукт выделяют после кристаллизации из изопропилового эфира; Т.пл. = 151 С (0,2 Н 2 О). Соединения III.2 - III.8, указанные ниже,получают таким же способом. Таблица 7. 0,34 г трет-бутоксида калия при -40 С добавляют к раствору 1,14 г соединения III.4 в 20 мл тетрагидрофурана. Реакционную смесь перемешивают при 0 С в течение 5 мин, а затем добавляют 32 мл метилйодида при -40 С. Реакционную смесь перемешивают в течение 2 ч при комнатной температуре, затем добавляют 10 мл насыщенного водного раствора хлорида аммония и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и после этого растворители выпаривают при пониженном давлении. Полученный остаток кристаллизуют из диизопропилового эфира; Т.пл. = 166 С. Соединения примеров 38-44, приведенных ниже, получают таким же способом и возможно очищают хроматографией на диоксиде кремния: Таблица 8. Рацемическое соединение примера 41 подвергают хроматографии на хиральной колонке в условиях примера 1, причем элюирование проводят смесью 2-метилпентан/2-пропанол 90/10 0,082 г трет-бутоксида калия добавляют к 0,26 г соединения III.1 в 7 мл тетрагидрофурана,охлажденного до -40 С. Реакционную смесь перемешивают в течение 15 мин при 0 С, а затем медленно добавляют 0,86 мл этилхлорформиата при -65 С. После перемешивания в течение 30 мин при 20 С реакционную смесь гидролизуют 20 мл 5%-ного раствора хлорида аммония и проводят экстракцию этилацетатом. Органическую фазу сушат над сульфатом натрия и после этого растворители выпаривают при пониженном давлении. Целевой продукт выделяют после кристаллизации из изопропанола; Т.пл. = 112 С (0,3 Н 2 О). Пример 46. Фениловый эфир 5-хлор-3-(2 хлорфенил)-1-(2,4-диметоксибензил)-2-оксоиндолин-3-илкарбоновой кислоты Соединение примера 46 получают с использованием фенилхлорформиата согласно той же методике, описанной в примере 45; Т.пл. = 126 С. Пример 47. 5-Хлор-3-(2-хлорфенил)-1-(2,4 диметоксибензил)-3-гидроксиметилиндолин-2 он-40 С к 0,3 г соединения III.1 в 5 мл тетрагидрофурана. 0,3 г параформальдегида, который медленно деполимеризуется нагреванием, барботируют в реакционную смесь при 0 С. Реакционную смесь перемешивают в течение 1 ч при 40 комнатной температуре, а затем гидролизуют 5% водным раствором NH4Cl. Проводят экстракцию этилацетатом, и органическую фазу сушат над сульфатом натрия. Растворители выпаривают при пониженном давлении и полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью н-пентан/этилацетат 90/10 К 5,19 г соединения примера 5 в 64 мл этанола добавляют 2,83 г олова в виде порошка, а затем 5,6 мл концентрированной хлороводородной кислоты. Реакционную смесь нагревают при 50 С в течение 3 ч. Реакционную смесь фильтруют при комнатной температуре через целит,растворитель частично выпаривают при пониженном давлении, остаток переносят в этилацетат, после чего раствор обрабатывают водным раствором бикарбоната натрия. Органическую фазу сушат над безводным сульфатом натрия и после этого растворители выпаривают при пониженном давлении. Полученный остаток переносят в диизопропиловый эфир, отфильтровывают и сушат при пониженном давлении; Т.пл. 0,4 г порошка бикарбоната натрия и 0,14 мл 1,4-дибромбутана добавляют к 0,5 г соединения примера 48 в 50 мл гексаметилфосфорамида. Реакционную смесь нагревают при 115 С в течение 10 ч. Реакционную смесь гидролизуют при комнатной температуре и экстрагируют этилацетатом. Органическую фазу несколько раз промывают водой и сушат над безводным сульфатом натрия, а затем растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 95/5 (об./об.). Полученное масло обрабатывают хлороводородной кислотой в диэтиловом эфире; Т.пл. = 198 С (HCl0,4 Н 2 О). Соединения примеров 50-52, приведенных ниже, получают таким же способом. 150 мл метилиодида добавляют к 238 мг соединения примера 48 в 4 мл метанола и 1 мл диметилформамида и к 100 мг карбоната калия и после этого реакционную смесь нагревают до 45 С в течение 24 ч. Добавляют 10 мл воды при комнатной температуре и проводят экстракцию этилацетатом. Органическую фазу дважды промывают водой и сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 90/10 (об./об.). Полученный остаток кристаллизуют из н-пентана, отфильтровывают и сушат при пониженном давлении в течение 4 ч; Т.пл. = 135 С. Пример 54. 5-Хлор-3-(2-хлорфенил)-1-(2 метокси-4-метиламинобензил)-3-метилиндолин 2-он 42 Получают восстановительным аминированием согласно в J. Org. Chem., 1996, 61(11),3849-3862. 347 мг Триацетоксиборгидрида натрия добавляют при 20 С к 0,25 г соединения примера 48 в 6 мл 1,2-дихлорэтана, 167 мкл уксусной кислоты и 105 мкл изобутиральдегида. После перемешивания в течение 1 ч при комнатной температуре реакционную смесь гидролизуют 20 мл воды и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и затем растворители выпаривают при пониженном давлении. Остаток подвергают хроматографии на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 97/3 (об./об.). Полученное масло переносят в раствор хлороводородной кислоты в диэтиловом эфире, проводят фильтрацию и растворители выпаривают при пониженном давлении. Полученное твердое вещество сушат в течение 5 ч при 45 С при пониженном давлении; Т.пл. = 153 С (HCl0,5 Н 2 О). Пример 56. 5-Хлор-3-(2-хлорфенил)-1-(4 изопропиламино-2-метоксибензил)-3-метилиндолин-2-он Получают восстановительным аминированием согласно J. Org. Chem., 1996, 61(11), 38493862. 0,26 мл уксусной кислоты, 0,14 мл ацетона и затем 0,56 г триацетоксиборгидрида натрия добавляют к 0,40 г соединения примера 48 в 10 мл 1,2-дихлорэтана при комнатной температуре. После перемешивания в течение 2 ч при комнатной температуре реакционную смесь гидролизуют водным раствором гидрокарбоната натрия и экстрагируют этилацетатом. Органическую фазу промывают водой и сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Целевой продукт получают фильтрацией кристаллизованного остатка после выпаривания, перенесенного в н-пентан; Т.пл. = 154 С. Это соединение,в рацемической форме, подвергают разделению хроматографией на колонке с хиральным наполнителем в условиях примера 1. Таким образом выделяют правовращающий энантиомер: Т.пл. = 2137 С; []D20 = +34,6 (с=1, СН 3 ОН), и его антипод. Пример 57. 5-Хлор-3-(2-хлорфенил)-1-[4(изопропилметиламино)-2-метоксибензил]-3-метилиндолин-2-он Соединение примера 56 обрабатывают водным формальдегидом и боргидридом натрия. 43 Полученное соединение превращают в соль путем обработки раствором хлороводородной кислоты в диэтиловом эфире. Гидрохлорид затем выделяют после фильтрации и сушки при 45 С при пониженном давлении; Т. пл. = 156 С (HCl1,5 Н 2 О). Пример 58. Йодид 4-[5-хлор-3-(2-хлорфенил)-3-метил-2-оксоиндолин-1-илметил]-3-метоксифенилизопропилдиметиламмония 0,56 г карбоната цезия и затем 0,27 мл метилйодида добавляют к 0,4 г соединения примера 56 в 10 мл диметилформамида. Реакционную смесь нагревают при 40 С при перемешивании в течение 48 ч. Затем эту реакционную смесь обрабатывают при комнатной температуре 40 мл воды и дважды экстрагируют диэтиловым эфиром, затем 3 раза дихлорметаном. Органические фазы с хлорированными растворителями сушат над безводным сульфатом натрия и выпаривают при пониженном давлении. Полученный таким образом остаток переносят в диэтиловый эфир,отфильтровывают и сушат при 50 С при пониженном давлении; Т.пл. = 146 С (1 Н 2 О). Пример 59. 5-Хлор-3-(2-хлорфенил)-1-[4(циклопропиламино)-2-метоксибензил]-3-метилиндолин-2-он Получают из соединения примера 48 согласно T.L., 1995, 36(41), 7399-7402. 0,54 мл уксусной кислоты, 0,4 г молекулярного сита 3 и 0,207 мл (1-этоксициклопропил)окситриметилсилана добавляют к 0,4 г соединения примера 48 в растворе в 10 мл метанола. После перемешивания в течение 30 мин при комнатной температуре добавляют 0,265 г цианборгидрида натрия, после чего смесь нагревают с обратным холодильником в течение 10 ч. После охлаждения проводят гидролиз 20 мл 2 н раствора гидроксида натрия, проводят фильтрацию через целит и этот целит промывают этилацетатом. Органическую фазу промывают 10% водным раствором хлорида натрия, сушат над сульфатом натрия и растворители выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/дихлорметан 50/50 (об./об.). Целевой продукт выделяют в результате кристаллизации из н-пентана; Т.пл. = 185 С(0,5 Н 2 О). Пример 60. 5-Хлор-3-(2-хлорфенил)-1-[4 диэтиламино-2-метоксибензил]-3-метилиндолин-2-онChem. Soc. 1974, 96(25), 7812. 0,45 г боргидрида натрия добавляют к 0,5 г соединения примера 48 в 7 мл уксусной кислоты. Реакционную смесь нагревают до 60 С при перемешивании в течение 4 ч, растворители частично выпаривают, реакционную смесь гидролизуют водным раствором гидрокарбоната натрия и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученное масло обрабатывают раствором хлороводородной кислоты в диэтиловом эфире; Т.пл. = 198 С(НСl). Пример 61. 5-Хлор-3-(2-хлорфенил)-1-[4 этиламино-2-метоксибензил]-3-метилиндолин 2-он Соединение примера 61 получают по такой же методике, как методика, описанная в примере 60; Т.пл. = 167 С. Пример 62. N-4-[5-Хлор-3-(2-хлорфенил)3-метил-2-оксоиндолин-1-ил]-3-метоксифенил ацетамид 0,10 мл ацетилхлорида при 0 С медленно добавляют к 0,5 г соединения примера 48 в 10 мл дихлорметана и 0,5 мл триэтиламина. Реакционную смесь гидролизуют при комнатной температуре, добавляют 20 мл дихлорметана,органическую фазу сушат над Na2SO4 и растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 50/50 а) 5-Хлор-3-(2-хлорфенил)-1-(4-гидрокси 2-метоксибензил)-3-метилиндолин-2-он. 3 мл трифторуксусной кислоты добавляют при 0 С к 1,14 г соединения примера 3 в 20 мл дихлорметана и 1 мл метилфенилсульфида. По 45 сле перемешивания в течение 2 ч при комнатной температуре реакционную смесь гидролизуют и проводят экстракцию этилацетатом. Органическую фазу промывают водным раствором бикарбоната натрия и сушат над безводным сульфатом натрия, после чего растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 80/20 (об./об.); Т.пл. = 200 С. б) 0,23 г карбоната цезия и затем при 0 С 0,112 мл йодэтана добавляют к 0,2 г соединения,полученного на стадии (а) в 5 мл диметилформамида. После перемешивания в течение 1 ч при 28 С реакционную смесь гидролизуют и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Полученное масло переносят в нпентан и полученный осадок отфильтровывают и сушат в течение 5 ч при 50 С при пониженном давлении; Т.пл. = 124 С. Пример 64. 5-Хлор-3-(2-хлорфенил)-1-(2,4 диметоксибензил)-3-метоксиметилиндолин-2-он К раствору 70 мг соединения, полученного по примеру 47, в 1 мл дихлорметана добавляют при -20 С 0,1 мл метилтрифторметансульфоната и затем 0,07 мл 2,6-ди(трет-бутил)пиридина и эту реакционную смесь выдерживают при +5 С в течение одной недели. Растворитель выпаривают при пониженном давлении, добавляют 5 мл 0,1 н хлороводородной кислоты и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и растворитель выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 95/5 (об./об.). Полученную смолу переносят в н-пентан. Полученное твердое вещество отфильтровывают и сушат в течение 5 ч при 50 С; Т.пл. = 125 С (0,4 Н 2 О). Пример 65. 5-Хлор-3-(2-хлор-5-гидроксиметилфенил)-1-(2,4-диметоксибензил)-3-гидроксииндолин-2-он Смесь 0,307 г соединения примера 19, 15 мл метанола и 1 мл 10 н хлороводородной кислоты нагревают при 50 С в течение 2 ч. Растворители выпаривают при пониженном давлении и полученный остаток переносят в дихлор 005093 46 метан и воду. Органическую фазу дважды промывают водой, а затем сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Целевой продукт выделяют после затвердевания в циклогексане,фильтрования и сушки при 30 С при пониженном давлении в течение 6 ч; Т.пл. = 107 С. Пример 66. 5-Хлор-3-[2-хлор-5-(диметиламино)фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-он Получают из соединения примера 43 по методике, описанной в примере 53. Целевой продукт выделяют после кристаллизации из изопропилового эфира; Т.пл. = 149 С (0,7 Н 2 О). Пример 67. 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенилформамид. Согласно T.L., 1982, 23(33), 3315. 0,216 мл муравьиной кислоты добавляют к 0,44 мл уксусного ангидрида, охлажденного до 0 С, и затем эту реакционную смесь нагревают при 58 С в течение 1 ч 30 мин. После охлаждения до 10 С добавляют 0,8 мл тетрагидрофурана, а затем 0,80 г соединения примера 43 в растворе в 4 мл тетрагидрофурана. После перемешивания в течение 2 ч при 20 С растворители выпаривают при пониженном давлении. Полученный остаток переносят в н-пентан и отфильтровывают; Т.пл. = 190 С. Пример 68. 5-Хлор-3-[2-хлор-5-(метиламино)фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-он Получают согласно T.L. 1982, 23(33), 3315. 0,56 мл 2 М раствора борандиметилсульфида в тетрагидрофуране добавляют к охлажденному до 0 С раствору 0,4 г соединения примера 67 в 1 мл тетрагидрофурана. После выдерживания в течение 1 ч при 58 С и последующего охлаждения до 0 С к этой реакционной смеси добавляют 0,2 мл 10 н хлороводородной кислоты и 1 мл метанола. Смесь нагревают в течение 1 ч при 60 С и охлаждают и растворители выпаривают при пониженном давлении. Твердый остаток обрабатывают 1 мл насыщенного раствора карбоната калия и несколько раз проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом на 47 трия и растворители выпаривают при пониженном давлении. Проводят очистку хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 85/15 (об./об.). Целевой продукт выделяют в форме гидрохлорида путем обработки полученного остатка диэтиловым эфиром, содержащим хлороводород, и затем проводят фильтрацию; Т.пл. = 121 С (0,5 Н 2 О 1 HCl). Пример 69. 5-Хлор-3-2-хлор-5-[этил(метил)амино]фенил-1-(2,4-диметоксибензил)-3 метилиндолин-2-он Получают из соединения примера 68 по такой же методике, как в примере 60; Т.пл. = 145 С. Пример 70. N-4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенилацетамид Это соединение получают по той же методике, по которой получают соединение примера 62, из соединения примера 43; Т.пл. = 117 С. Соединения следующих ниже примеров 71-80 получают таким же способом. 0,068 мл 3-метоксипропионовой кислоты и 320 мг гексафторфосфата бензотриазолил-Nокситрисдиметиламинофосфония добавляют к 0,3 г соединения примера 43 в 10 мл диметилформамида. После охлаждения до 0 С добавляют 0,23 мл триэтиламина. Реакционную смесь перемешивают в течение 16 ч при комнатной температуре. Добавляют 40 мл воды и проводят экстракцию с использованием 30 мл этилацетата. Органическую фазу обрабатывают 20 мл водного раствора бикарбоната натрия, эту фазу отделяют отстаиванием и сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят дихлорметаном. Целевой продукт получают после кристаллизации из н-пентана; Т.пл. =168 С (0,3 Н 2 О). Соединения следующих ниже примеров 82-86 получают таким же способом. Получают из соединения примера 68 по той же методике, которая описана в примере 62; Т.пл. = 84 С. Соединения следующих ниже примеров 88-90 получают таким же способом. 0,14 г N,N-диметилглицина, 0,40 мл триэтиламина и 0,34 г хлорида N,N-бис[2-оксо-3 оксазолидинил]фосфордиамида добавляют при 0 С к 0,32 г соединения примера 68 в 5 мл дихлорметана. Реакционную смесь перемешивают в течение 24 ч при комнатной температуре, добавляют 20 мл водного раствора бикарбоната натрия и проводят экстракцию с использованием 30 мл этилацетата. Органическую фазу снова промывают 20 мл водного раствора бикарбоната натрия, а затем сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Проводят очистку хроматографией на колонке с силикагелем, причем элюирование проводят смесью дихлорметан/метанол 97/3 (об/об). Целевой продукт выделяют кристаллизацией из н-пентана; Т.пл. = 104 С. Пример 92. 1-Ацетил-N-4-хлор-3-[5-хлор 1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]фенил-N-метилпирролидинкарбоксамид Получают по той же методике, которая описана в примере 91; Т.пл. = 74 С (2 Н 2 О). Пример 93. N-4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенилмочевина а) Образование фенил 4-хлор-3-[5-хлор-1(2,4-диметоксибензил)-3-метил-2-оксоиндолин 3-ил]фенилкарбамата. 0,30 мл 30% раствора гидроксида натрия добавляют к 0,4 г соединения примера 43 в 20 мл тетрагидрофурана. После охлаждения до-5 С к этой реакционной смеси добавляют 0,33 мл фенилкарбоната. После перемешивания в течение 4 ч при комнатной температуре добавляют 30 мл воды и проводят экстракцию с использованием 50 мл этилацетата. Органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Полученное масло используют на следующей стадии. б) Получение соединения примера 93. Соединение, полученное на стадии (а), переносят в 30 мл дихлорметана в присутствии 1 мл жидкого аммиака. После перемешивания в течение 48 ч при комнатной температуре растворитель частично выпаривают и остаток переносят в диэтиловый эфир. Продукт отфильтровывают и промывают диэтиловым эфиром; Т.пл. = 254 С (1,5 Н 2 О). Пример 94. N-4-Хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенил-N',N'-диметилмочевина Получают по той же методике, которая описана в примере 93; Т.пл. = 182 С(0,4 Н 2 О). Пример 95. N-4-Хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенилметансульфонамид 0,23 мл триэтиламина добавляют к 0,3 г соединения примера 43 в 10 мл дихлорметана, а затем, после охлаждения до -10 С, добавляют 56 мкл метансульфонилхлорида. После перемешивания в течение 24 ч при комнатной температуре добавляют 10 мл водного раствора карбоната натрия и 30 мл этилацетата. Органическую фазу отделяют и сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем,причем элюирование проводят дихлорметаном. Целевой продукт получают после кристаллизации из н-пентана; Т.пл. = 210 С (0,25 Н 2 О). Пример 96. N-4-Хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-метил-2-оксоиндолин-3 ил]фенил-N-(метилсульфонил)метансульфонамид Получают согласно способу примера 95 с использованием двух эквивалентов метансульфонилхлорида; Т.пл. = 159 С. Пример 97. N-4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенил-N-метилметансульфониламид Получают по методике примера 95 из соединения примера 68; Т.пл. = 76 С (0,8 Н 2 О). Пример 98. N-4-Хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-метил-2-оксоиндолин-3-ил] фенил-N-метилфенилсульфонамид Получают по той же методике, которая описана в примере 97; Т.пл. =73 С (0,8 Н 2 О). Пример 99. 5-Хлор-3-[2-хлор-5-(4-морфолинил)фенил]-1-(2,4-диметоксибензил)-3-метилиндолин-2-он Получают по той же методике, которая описана в примере 52, из соединения примера 43; Т.пл. = 168 С. Пример 100. 3-Хлор-3-[2-хлор-4-(4-метил 1-пиперазинил)фенил]-1-(2,4-диметоксибензил)3-метилиндолин-2-он Получают по той же методике, которая описана в примере 1, из соединения II.9; Т.пл. = 140 С (2HCl0,3 Н 2 О). Пример 101. 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]бензойная кислота 11 мл 2 н водного раствора гидроксида натрия добавляют к 3,46 г рацемического соединения примера 41 в 300 мл раствора, содержащего метанол/диоксан (об./об.) и эту реакционную смесь оставляют перемешиваться в течение 5 ч при 65 С. После охлаждения до комнатной температуры растворители частично выпаривают при пониженном давлении и проводят экс 53 тракцию этилацетатом. Водную фазу подкисляют при 10 С 1 н хлороводородной кислотой и кислоту экстрагируют дихлорметаном. Последнюю органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Целевой продукт получают кристаллизацией масла из изопропилового эфира; Т.пл. = 186 С. Правовращающий энантиомер: []D20 =+101 (с=1, СН 3 ОН), Т.пл. = 114 С, и его антипод выделяют хиральной хроматографией в условиях примера 1, причем элюирование проводят смесью 2-метилпентан/2-пропанол 90/10 и 0,1% трифторуксусной кислотой. Пример 102. 4-Хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил]N,N-диэтилбензамид 0,46 г гексафторфосфата бензотриазолилN-окситрисдиметиламинофосфония, 0,20 мл диэтиламина и 0,28 мл триэтиламина добавляют при 0 С к 0,48 г соединения примера 101 в 10 мл диметилформамида. После перемешивания в течение 15 ч при 20 С реакционную смесь гидролизуют 70 мл 0,1 н хлороводородной кислоты и проводят экстракцию этилацетатом. Органическую фазу обрабатывают 70 мл водного раствора гидрокарбоната натрия и сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. Целевой продукт получают кристаллизацией из нпентана; Т.пл. = 88 С. Соединение примера 102 в рацемической форме очищают хроматографией на колонкеChiralpak AD от Daicel, причем элюирование проводят смесью 2-метилпентан/2-пропанол 90/10 (об./об.). Таким образом выделяют правовращающий энантиомер: Т.пл. = 86 С; []D20 =+100,3 (с=1, СН 3 СО 2 С 2 Н 5), и его антипод. Амиды из табл. 13 получают таким же способом, как способ получения рацемической смеси. Рацемическое соединение примера 119 подвергают хроматографии на хиральной колонке в условиях примера 102. Получают правовращающий энантиомер и его антипод; Т.пл.= 86 С; []D20= +129 (с=1, этилацетат). То же самое из соединения примера 134. Получают правовращающий энантиомер и его антипод; Т.пл. = 174 С (Н 2 О); []D20= +107(с=1, этилацетат). То же самое из соединения примера 131. Получают правовращающий энантиомер и его антипод; Т.пл. = 91 С; []D20= +129 (с=1, этилацетат). То же самое из соединения примера 112. Получают правовращающий энантиомер и его антипод; Т.пл. = 273 С (Н 2 О); []D20= +88,3 16,5 мл раствора гидрида диизобутилалюминия (DIBAL) добавляют к 3,3 г рацемического соединения примера 41 в 130 мл дихлорметана при -68 С. Реакционную смесь обрабатывают при -30 С 10 мл метанола, затем водным раствором хлорида аммония и экстрагируют дихлорметаном. Проводят фильтрацию через целит, органическую фазу промывают водой и сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. После кристаллизации из смеси циклогексан/гептан получают целевой продукт; Т.пл. = 97 С. Этот продукт также можно получить путем снятия защиты с соединения примера 40 в кислой среде в условиях примера 65. 0,08 г метилйодида, а затем при 0 С 0,02 г гидрида натрия в виде 60% суспензии в масле добавляют к 0,2 г соединения примера 140 в 2 мл тетрагидрофурана. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь гидролизуют 5%-ным водным раствором хлорида аммония и проводят экстракцию этилацетатом. Органическую фазу промывают водой и сушат над безводным сульфатом натрия. Растворители выпаривают при пониженном давлении. После кристаллизации из н-пентана получают продукт; Т.пл. = 122 С. Соединения следующих ниже примеров 142-144 получают таким же способом. 58 Целевой продукт кристаллизуют из пентана; Т.пл. = 134 С. б) Соединение примера 145 получают восстановительным аминированием соединения,полученного на стадии (а) по методике, описанной в примере 33; Т.пл. = 125 С (0,6 Н 2 О). Таким же способом получают соединения следующих ниже примеров 146-149. Таблица 14. Рацемическое соединение примера 148 подвергают хроматографии на хиральной колонке в условиях, аналогичных условиям примера 102. Получают правовращающий энантиомер, превращенный в соль под действием хлороводородной кислоты в этиловом эфире, и его антипод; Т.пл. = 139 С. Пример 150. N-4-Хлор-3-[5-хлор-1-(2,4 диметоксибензил)-3-метил-2-оксоиндолин-3 ил]бензил-N-метилацетамид Пример 145. 5-Хлор-3-2-хлор-5-[(диметиламино)метил]фенил-1-(2,4-диметоксибензил)-3-метилиндолин-2-он а) Получение 4-хлор-3-[5-хлор-1-(2,4-диметоксибензил)-3-метил-2-оксоиндолин-3-ил] бензальдегида. 1 г соединения примера 140 добавляют к 0,69 г хлорхромиата пиридиния в 10 мл дихлорметана. После перемешивания в течение 1 ч при 10 С эту смесь фильтруют через целит, растворители выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 90/10 (об./об.). Получают по той же методике, которая описана для соединения примера 62, из соединения примера 146; Т.пл. = 81 С (0,6 Н 2 О). Пример 151. 5-Хлор-3-2-хлор-5-[(2-гидроксиэтокси)метил]фенил-1-(2,4-диметоксибензил)-3-метилиндолин-2-он а) Получение 5-хлор-3-[2-хлор-5-(1,3-диоксолан-2-ил)-фенил]-1-(2,4-диметоксибензил)-3 метилиндолин-2-она. 1 мл этиленгликоля и 16 мг п-толуолсульфоновой кислоты добавляют к 2,044 г со 59 единения, полученного на стадии (а) примера 145 в растворе в 22 мл толуола. Реакционную смесь нагревают с обратным холодильником в течение 16 ч реакторе, оснащенном аппаратом Дина-Старка для удаления воды, образующейся в процессе реакции. После охлаждения до комнатной температуры добавляют 30 мл воды и проводят экстракцию этилацетатом. Органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении с получением целевого продукта,который непосредственно используют на следующей стадии. б) 0,29 М раствор боргидрида цинка в диэтиловом эфире (приготовленного согласно способу, описанному в Chem. Farm. Bull., 1984,32(4), 1411-1415), а затем 1,2 мл триметилсилилхлорида добавляют к 2,20 г соединения, полученного на стадии (а), в растворе в 14 мл дихлорметана при 6 С. После перемешивания в течение 2 ч 30 мин при комнатной температуре реакционную смесь подвергают гидролизу 30 мл 1 н хлороводородной кислоты и проводят экстракцию этилацетатом. Органическую фазу промывают водой и сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении. Полученный остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью дихлорметан/метанол 99/1 (об./об.). Конечный продукт получают после кристаллизации из нпентана; Т.пл. = 53 С. Этот продукт может быть получен также путем снятия защиты с соединения примера 143 в кислой среде согласно T.L., 1977, 3473 или любым другим способом, описанным в Protective Groups in O.S., T.W. Green et al., Wileylnterscience (3rd Edition, 1999). Пример 152. 5-Хлор-3-(2-хлор-5-[2-(4 морфолинил)этокси]метилфенил)-1-(2,4-диметоксибензил)-3-метилиндолин-2-он 60 получением целевого продукта в виде пасты и этот продукт используют на следующей стадии. б) 0,12 г карбоната натрия и затем 0,20 мл морфолина добавляют к 0,75 г соединения, полученного на стадии (а) в растворе в 2 мл ацетонитрила. После перемешивания в течение 2 ч при 75 С реакционную смесь охлаждают до комнатной температуры, проводят гидролиз 20 мл воды и проводят экстракцию этилацетатом. Органическую фазу промывают еще раз водой и сушат над безводным сульфатом натрия, растворители выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, причем элюирование проводят смесью циклогексан/этилацетат 80/20(об./об.). Целевой продукт получают после гидрохлорирования раствором хлороводородной кислоты в диэтиловом эфире, выпаривания и кристаллизации остатка из н-пентана; Т.пл. = 81 С (0,7 Н 2 ОHCl). Энантиомеры соединения примера 152 получают таким же способом, как в примере 102, и эти энантиомеры превращают в соль под действием фумаровой кислоты в ацетоне. Фумараты выделяют после выпаривания ацетона и кристаллизации в диэтиловом эфире: правовращающий энантиомер: Т.пл. = +112 С, []D20 =+76,7 (с=1, СН 3 ОН), и его антипод. Рацемические соединения следующих ниже примеров 153-157 получают таким же способом Таблица 16. а) Получение производного 5-хлор-3-[2 хлор-5-(2-[(4-метилфенил)сульфонилокси] этоксиметил)фенил]-1-(2,4-диметоксибензил)3-метилиндолин-2-она. 0,39 мл триэтиламина и затем 0,27 г птолуолсульфонилхлорида добавляют к 0,48 г соединения примера 151 в 1,5 мл тетрагидрофурана при 0 С. После перемешивания в течение 16 ч при комнатной температуре реакционную смесь гидролизуют 10 мл воды и проводят экстракцию этилацетатом. Органическую фазу промывают водным раствором гидрокарбоната натрия и затем водой. Органическую фазу сушат над безводным сульфатом натрия и растворители выпаривают при пониженном давлении с Соединения приведенных ниже примеров 158-162 получают по методике, описанной в примере 18
МПК / Метки
МПК: A61P 5/10, A61K 31/404, C07D 209/34
Метки: индолин-2-она, получение, окситоцина, производные, применение, рецепторов, лигандов, качестве
Код ссылки
<a href="https://eas.patents.su/30-5093-proizvodnye-indolin-2-ona-ih-poluchenie-i-ih-primenenie-v-kachestve-ligandov-receptorov-oksitocina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные индолин-2-она, их получение и их применение в качестве лигандов рецепторов окситоцина</a>
Предыдущий патент: Новый сцинтилляционный анализ близкого расстояния для изучения связывающих аминогликозид молекул (abm)
Следующий патент: Способ получения циталопрама
Случайный патент: Определение насыщенности углеводородами с использованием скоростей распространения акустических волн, измеряемых через обсадную колонну












