Фармацевтически приемлемые соли метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата и их применение в терапии
Формула / Реферат
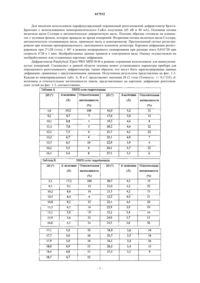
1. Соль метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли.
2. Моногидрохлорид метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9Н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата.
3. Моногидробромид метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9Н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата.
4. Дималеат метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата.
5. Фармацевтическая композиция, содержащая соль метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.
6. Фармацевтическая композиция по п.5 в форме сухой порошкообразной композиции для применения в ингаляционной терапии.
7. Сухой порошковый ингалятор, содержащий фармацевтическую композицию по п.6.
8. Способ изготовления фармацевтической композиции по п.5, включающий смешивание соли метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9Н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли с фармацевтически приемлемым адъювантом, разбавителем или носителем.
9. Применение соли по любому из пп.1-4 в ингаляционной терапии.
10. Применение соли по любому из пп.1-4 в изготовлении лекарственного средства для лечения астмы, ХОБЛ (хронической обструктивной болезни легких), аллергического ринита, аллергического конъюнктивита, атопического дерматита, рака, гепатита В, гепатита С, HIV (вируса иммунодефицита), HPV (папилломавируса человека), бактериальных инфекций или дерматоза.
11. Способ лечения обратимого обструктивного заболевания дыхательных путей у пациента, страдающего от указанного заболевания или имеющего риск его возникновения, включающий введение пациенту терапевтически эффективного количества соли метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли.
Текст
ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ МЕТИЛ-(3-3-(6-АМИНО-2 БУТОКСИ-8-ОКСО-7,8-ДИГИДРО-9 Н-ПУРИН-9-ИЛ)ПРОПИЛ](3-МОРФОЛИН-4 ИЛПРОПИЛ)АМИНО]МЕТИЛФЕНИЛ)АЦЕТАТА И ИХ ПРИМЕНЕНИЕ В ТЕРАПИИ Настоящее изобретение относится к солям метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой и малеиновой кислотой, содержащим их композициям и их применению в терапии.(71)(73) Заявитель и патентовладелец: АСТРАЗЕНЕКА АБ (SE); ДАЙНИППОН СУМИТОМО ФАРМА КО., ЛТД. (JP) 017532 Настоящее изобретение относится к солям 8-оксоаденинового производного, содержащим их фармацевтическим композициям и их применению в терапии. Метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетат конкретно раскрыт в примере 2-37 опубликованной Международной заявки на патентWO 2005/092893 в качестве иммуномодулирующего соединения, которое действует через Toll-подобный рецептор 7 (TLR7). При изготовлении лекарственных веществ важно, чтобы лекарственное вещество (активное соединение) находилось в форме, в которой с ним можно удобно обращаться и в которой его можно удобно обрабатывать. Последнее важно не только с точки зрения обеспечения пригодного для коммерческого использования способа изготовления самого лекарственного вещества, а также с точки зрения последующего изготовления фармацевтических препаратов, содержащих активное соединение и подходящие эксципиенты. В этой связи химическая и физическая стабильность активного соединения представляют собой важные факторы. Активное соединение и содержащие его препараты должны быть способны эффективно храниться в течение значительных периодов времени, не демонстрируя какого-либо значительного изменения физико-химических свойств (например, химической композиции, плотности, гигроскопичности и растворимости) активного соединения. Кроме того, если активное соединение должно быть включено в композицию для легочного введения, например при помощи сухого порошкового ингалятора, такого как устройство Turbuhaler, тогда желательно, чтобы активное соединение могло быть легко микронизировано с получением порошка, обладающего хорошими свойствами и содержащего высокую фракцию мелких частиц (т.е. фракцию, в которой частицы активного соединения имеют масс-медианный диаметр (MMD) меньше чем или равный 10 мкм (микрометров. Такая фракция способна проникать глубоко в легкие для ускорения и увеличения абсорбции активного соединения. Специалисту в данной области техники понятно, что типично, если лекарственное вещество может быть легко получено в стабильной форме, такой как стабильная кристаллическая форма, тогда преимущества могут быть обеспечены с точки зрения легкости обработки, легкости получения и длительного периода полувыведения подходящих фармацевтических препаратов, и более достоверного профиля растворимости. Неожиданно обнаружили, что можно получать некоторые соли метил-(3-3-(6-амино-2-бутокси-8 оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата,обладающие улучшенными физико-химическими свойствами по сравнению со свободным основанием, которые могут быть изготовлены в виде сухой порошковой композиции для легочного введения. Структура метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3 морфолин-4-илпропил)амино]метилфенил)ацетата изображена ниже Таким образом, в соответствии с настоящим изобретением предложена соль метил-(3-3-(6 амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой (далее названная как "соль гидрохлорид, гидробромид или малеат"). В еще одном аспекте изобретения предложена соль метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой, которая демонстрирует характеристические пики порошковой дифракции рентгеновских лучей (выраженные в градусах 2), представленные соответственно в табл. А, В или С (см. Пример 4 далее). В изобретении также предложены сольваты (включая гидраты), соли гидрохлорида, гидробромида или малеата. Тем не менее, соль гидрохлорид, гидробромид или малеат предпочтительно является безводной и предпочтительно находится в несольватированной форме. В одном воплощении изобретения соль гидрохлорид, гидробромид или малеат или его сольват обладает кристаллическими свойствами и предпочтительно по меньшей мере 50% кристалличностью, более предпочтительно по меньшей мере 60% кристалличностью, еще более предпочтительно по меньшей мере 70% кристалличностью и наиболее предпочтительно по меньшей мере 80% кристалличностью. Кристалличность может быть оценена при помощи обычных способов рентгеновской дифрактометрии. В еще одном воплощении изобретения соль гидрохлорид, гидробромид или малеат или его сольват обладает от 50, 60, 70, 80 или 90 до 95, 96, 97, 98, 99 или 100% кристалличностью.-1 017532 Получение метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата описано в опубликованной Международной заявке на патентWO 2005/092893. Соли гидрохлорид, гидробромид и малеат (включающие сольватированные формы) этого соединения могут быть получены в соответствии с известными способами. Тем не менее,специалисту в данной области техники понятно, что существуют другие возможные пути получения этого соединения и его солей. Соли (включая сольватированные формы) по изобретению полезны в качестве модуляторов активности TLR7 и таким образом могут быть введены млекопитающему, включая человека, для лечения следующих состояний или заболеваний: 1) респираторного тракта: обструктивных заболеваний дыхательных путей, включая астму, включая бронхиальную, аллергическую, врожденную, приобретенную, вызванную физической нагрузкой, вызванную лекарством (включая аспирин и вызванную NSAID (нестероидные противовоспалительные средства и вызванную пылью астму, перемежающуюся и персистирующую, и всех степеней тяжести, и другие случаи гиперчувствительности дыхательных путей; хронической обструктивной болезни легких(ХОБЛ); бронхита, включая инфекционный и эозинофильный бронхит; эмфиземы; бронхоэктаза; муковисцидоза; саркоидоза; аллергического альвеолита у сельскохозяйственных рабочих и родственных заболеваний; гиперчувствительного пневмонита; фиброза легкого, включая криптогенный фиброзирующий альвеолит, идиопатических интерстициальных пневмоний, фиброза, осложняющего противоопухолевую терапию, и хроническую инфекцию, включая туберкулез и аспергиллез и другие грибковые инфекции; осложнений трансплантаций легких; васкулитных и тромбозных расстройств легочной сосудистой сети и легочной гипертензии; противокашлевой активности, включающей лечение хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, и ятрогенного кашля; острого и хронического ринита, включая медикаментозный ринит, и вазомоторного ринита; круглогодичного и сезонного аллергического ринита, включая нейровегетативный ринит (сенную лихорадку); назального полипоза; острой вирусной инфекции, включая обычную простуду, и инфекции вследствие респираторного синцитиального вируса, вируса гриппа, коронавируса (включающего SARS(острую респираторную вирусную инфекцию и аденовируса; 2) кожи: псориаза, атопического дерматита, контактного дерматита или других экзематозных дерматозов, и реакций гиперчувствительности замедленного типа; фито- и фотодерматита; себоррейного дерматита, герпетиформного дерматита, красного плоского лишая, склеротического атрофического лишая, гангренозной пиодермии, кожного саркоидоза, дисковидной системной красной волчанки, пузырчатки, пемфигоида, буллезного эпидемоза, крапивницы, ангиодемы, васкулитов, токсических эритем,кожных эозинофиллий, очагового облысения, облысения по мужскому типу, синдрома Свита, синдрома Вебера-Кристиана, экссудативной эритемы; целлюлита, инфекционного и неинфекционного; панникулита; кожных лимфом, немеланомного рака кожи и других диспластических поражений; вызванных лекарствами расстройств, включая стойкие лекарственные эритемы; 3) глаз: блефарита; конъюнктивита, включающего круглогодичный и весенний аллергический конъюнктивит; ирита; переднего и заднего увеита; хориоидита; аутоиммунных, дегенеративных или воспалительных расстройств, поражающих сетчатку; офтальмита, включая симпатический офтальмит; саркоидоза; инфекций, включая вирусные, грибковые и бактериальные; 4) мочеполового тракта: нефрита, включая интерстициальный и гломерулонефрит; нефротического синдрома; цистита, включая острый и хронический (интерстициальный) цистит и язвы Ханнера; острого и хронического уретрита, простатита, эпидидимита, оофорита и сальпингита; вульвовагинита; болезни Пейрони; эректильной дисфункции (у мужчин и женщин); 5) отторжения трансплантата: острого и хронического после, например, трансплантации почки,сердца, печени, легкого, костного мозга, кожи или роговицы, или после переливания крови; или болезни трансплантат против хозяина; 6) других аутоиммунных и аллергических расстройств, включая ревматоидный артрит, синдром раздраженного кишечника, системную красную волчанку, рассеянный склероз, тиреоидит Хашимото,диффузный токсический зоб, Аддисонову болезнь, сахарный диабет, идиопатическую тромбоцитопеническую пурпуру, эозинофильный фасциит, гипер-IgE синдром, антифосфолипидный синдром и синдром Сезари; 7) онкологии: лечение обычных форм рака, включая рак предстательной железы, молочной железы,легкого, яичников, предстательной железы, кишечника и толстой кишки, желудка, опухолей и злокачественных образований кожи и головного мозга, поражающих костный мозг (включая лейкемии) и лимфопролиферативные системы, таких как ходжкинская и неходжкинская лимфома; включая профилактику и лечение метастазов и рецидивов опухолей, и паранеопластических синдромов; и 8) инфекционных заболеваний: вирусных заболеваний, таких как остроконечные кондиломы, обыкновенные бородавки, подошвенные бородавки, гепатита В, гепатита С, вируса простого герпеса, контагиозного моллюска, оспы, вируса иммунодефицита человека (HIV), вируса папилломы человека (HPV),цитомегаловируса (CMV), вируса ветряной оспы (VZV), риновируса, аденовируса, коронавируса, вируса гриппа, вируса парагриппа; бактериальных заболеваний, таких как туберкулез и mycobacterium avium,-2 017532 лепра; других инфекционных заболеваний, таких как грибковые заболевания, хламидии, candida, aspergillus, криптококковый менингит, плазмоклеточная пневмония, криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомная инфекция и лейшманиоз. Таким образом, в настоящем изобретении предложена соль метил-(3-3-(6-амино-2-бутокси-8 оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли для применения в терапии. В еще одном аспекте настоящего изобретения предложено применение соли метил-(3-3-(6 амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли в изготовлении лекарственного средства для применения в терапии. В контексте настоящего описания, если конкретно не указано иное, то термин "терапия" также включает "профилактику". Термины "терапевтический" и "терапевтически" следует рассматривать аналогичным образом. Ожидают, что профилактика особенно подходит для лечения лиц, страдающих от предшествующего эпизода, или иным образом имеющего увеличенный риск интересующего заболевания или состояния. Лица, имеющие риск развития конкретного заболевания или состояния, как правило, включают лица,имеющие семейный анамнез заболевания или состояния, или лица, которые, как идентифицировано путем генетического тестирования или отбора, особенно чувствительны к развитию заболевания или состояния. В частности, соли (включая сольватированные формы) по изобретению могут быть применены в лечении астмы, ХОБЛ, аллергического ринита, аллергического конъюнктивита, атопического дерматита,рака, гепатита В, гепатита С, HIV, HPV, бактериальных инфекций и дерматоза. Таким образом в изобретении предложен способ лечения воспалительного заболевания у пациента,страдающего указанным заболеванием или имеющим риск его возникновения, включающий введение пациенту терапевтически эффективного количества соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли. В изобретении также предложен способ лечения заболевания дыхательных путей, например, обратимого обструктивного заболевания дыхательных путей, такого как астма, у пациента, страдающего указанным заболеванием или имеющего риск его возникновения, включающий введение пациенту терапевтически эффективного количества соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин 9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромистоводородной кислотой или малеиновой кислотой или сольвата этой соли. В изобретении также предложен способ лечения или уменьшения риска заболевания или состояния,включающего или возникающего в результате аномального клеточного роста (например, рака), включающий введение пациенту, нуждающемуся в таком введении, терапевтически эффективного количества соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли. Для вышеупомянутых терапевтических применений вводимая доза безусловно будет варьировать в зависимости от используемой соли, способа введения, желаемого лечения и показанного расстройства. Например, суточная доза (сольватированной) соли гидрохлорида, гидробромида или малеата при введении путем ингаляции может находиться в диапазоне от 0,05 мкг на килограмм массы организма (мкг/кг) до 100 мкг на килограмм массы организма (мкг/кг). Альтернативно, если (сольватированная) соль гидрохлорид, гидробромид или малеат вводят перорально, тогда суточная доза может находиться в диапазоне от 0,01 мг на килограмм массы организма (мкг/кг) до 100 мг на килограмм массы организма (мг/кг). Соль гидрохлорид, гидробромид или малеат или ее сольват по изобретению могут быть применены самостоятельно, но, как правило, их вводят в форме фармацевтической композиции, в которой соль гидрохлорид, гидробромид или малеат или ее сольват (активный ингредиент) находится вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. Обычные способы отбора и изготовления подходящих фармацевтических препаратов описаны, например в "Pharmaceuticals - The Science ofDosage Form Designs", M. E. Aulton, Churchill Livingstone, 1988. В зависимости от способа введения фармацевтическая композиция может содержать от 0,05 до 99 мас.% (процент по массе), более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.%, и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, где все процентные содержания по массе основаны на массе всей композиции. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соль метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.-3 017532 В изобретении также предложен способ изготовления фармацевтической композиции по изобретению, включающий смешивание соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромистоводородной кислотой или малеиновой кислотой или сольвата этой соли с фармацевтически приемлемым адъювантом, разбавителем или носителем. Фармацевтические композиции могут быть введены местно (например, в кожу или в легкое и/или дыхательные пути) в форме, например, кремов, растворов, суспензий, гептафторалкановых (HFA) аэрозолей и сухих порошковых препаратов, например препаратов в ингаляторе, известном как Turbuhaler; или системно, например путем перорального введения в форме таблеток, капсул, сиропов, порошков или гранул; или путем парентерального введения в форме растворов или суспензий; или путем подкожного введения; или путем ректального введения в форме суппозиториев; или трансдермально. В воплощении изобретения фармацевтическую композицию вводят путем ингаляции (пероральной или назальной). В еще одном воплощении фармацевтическую композицию вводят при помощи сухого порошкового ингалятора (DPI).DPI может быть "пассивным" или приводиться в действие дыханием, или "активным", где порошок диспергируется при помощи некоторого механизма, отличающегося от ингаляции пациентом, например внутренний источник воздуха под давлением. В настоящее время имеется три типа пассивных сухих порошковых ингалятора: однодозовые, содержащие множество стандартных доз, или мультидозовые (резервуар) ингаляторы. В однодозовых устройствах индивидуальные дозы представлены обычно в капсулах и должны быть загружены в ингалятор перед применением, примеры которых включают устройстваEclipse (Aventis). Ингаляторы, содержащие множество стандартных доз, содержат множество индивидуально упакованных доз в виде множества желатиновых капсул или в блистерах, примеры которых включают устройства Diskhaler (GlaxoSmithKline), Diskus (GlaxoSmithKline), Aerohaler (Boehringer) иHandihaler (Boehringer). В мультидозовых устройствах лекарство хранят в объемном порошковом резервуаре, из которого отмеряются индивидуальные дозы, примеры которого включают устройства Turbuhaler (AstraZeneca), Easyhaler (Orion), Novolizer (ASTA Medica), Clickhaler (Innovata Biomed) иPulvinal (Chiesi). Ингалируемая фармацевтическая композиция или сухая порошковая композиция для применения вDPI может быть изготовлена путем смешивания тонко измельченного активного ингредиента (имеющего масс-медианный диаметр, как правило, равный или меньше чем 10 мкм, предпочтительно равный или меньше чем 5 мкм) с веществом-носителем, например моно-, ди- или полисахаридом, сахарным спиртом или другим полиолом. Подходящие носители представляют собой сахара, например лактозу, глюкозу,раффинозу, мелезитозу, лактит, мальтит, трегалозу, сахарозу, маннит и крахмал. Порошковую смесь затем при необходимости можно распределять в твердые желатиновые капсулы, каждая из которых содержит желаемую дозу активного ингредиента. Альтернативно, ингалируемая фармацевтическая композиция может быть изготовлена путем обработки тонко измельченного порошка (например, состоящего из тонко измельченного активного ингредиента и тонко измельченных частиц носителя) в сферы, которые разрушаются во время процедуры ингаляции. Этим сферонизированным порошком заполняют резервуар для лекарства мультидозового ингалятора, например известного как Turbuhaler, в котором дозирующий блок отмеряет желаемую дозу, которая затем вдыхается пациентом. Соответственно, в настоящем изобретении также предложен сухой порошковый ингалятор, в частности сухой порошковый ингалятор, содержащий множество доз, содержащий ингалируемую фармацевтическую композицию по изобретению. Соль гидрохлорид, гидробромид или малеат или ее сольват по изобретению также могут быть введены в сочетании с другими соединениями, используемыми для лечения вышеприведенных состояний. Таким образом, изобретение также относится к способам комбинированной терапии, при которых соль гидрохлорид, гидробромид или малеат, или ее сольват по изобретению, или фармацевтическую композицию, содержащую соль гидрохлорид, гидробромид или малеат, или ее сольват по изобретению вводят одновременно или последовательно, или в виде комбинированного препарата с другим терапевтическим агентом или агентами для лечения одного или более чем одного из перечисленных состояний. Фиг. 1 демонстрирует картину порошковой дифракции рентгеновских лучей для моногидрохлорида метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетата. Фиг. 2 демонстрирует картину порошковой дифракции рентгеновских лучей для моногидробромида метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетата. Фиг. 3 демонстрирует картину порошковой дифракции рентгеновских лучей для дималеата метил(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)ами-4 017532 но]метилфенил)ацетата. Настоящее изобретение далее дополнительно будет объяснено путем ссылки на следующие иллюстративные примеры. Общие способы Спектры 1 Н ЯМР (ядерный магнитный резонанс) регистрировали при 298 К на приборе Varian UnityPFG). Центральные пики для ацетона-d6 или диметилсульфоксида (DMSO)-d6 использовали в качестве внутренних стандартов. Следующий способ использовали для анализа путем LC/MS (жидкостной хроматографии/массспектрометрии): Прибор для MS: Agilent 1100, оборудованный интерфейсом APCI (химическая ионизация при атмосферном давлении). Прибор для LC: Agilent 1100, оборудованный UV(ультрафиолетовым)-детектором VWD, автосэмплером ALS, двойным насосом и дегазатором. Колонка для LC: Chromolith Speed ROD, RP-C18,4,650 мм. Элюент: Растворитель А: вода + 0,1% трифторуксусная кислота (TFA); Растворитель В: ацетонитрил + 0,1% TFA. Условия LC: поток 2,5 мл/мин; от 5 до 95% В в градиенте; время анализа 3,6 мин; UV 220 нм.(а) Метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетат (40 мг, 0,07 ммоль) растворяли в этилацетате (5 мл) и добавляли 3,28 М раствор HCl/этанол (21 мкл, 0,07 ммоль). Растворитель удаляли путем упаривания и остаток сушили в вакууме с получением моногидрохлорида метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро 9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата в качестве конечного продукта.(б) 80 мМ раствор соляной кислоты в метаноле (65,0 мкл, 5,2 мкмоль) при комнатной температуре добавляли к метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетату (3,0 мг, 5,3 мкмоль), растворенному в метаноле (1,5 мл). Раствор встряхивали при 60C в течение одного часа, затем охлаждали до 5C. Через 30 мин растворитель оставляли медленно выпариваться при 5C с получением моногидрохлорида метил-(3-3-(6-амино-2-бутокси-8-оксо 7,8-дигидро-9 Н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата в качестве конечного продукта. Дополнительные количества соли моногидрохлорида получали при помощи следующего способа:(в) Стехиометрическое количество раствора соляной кислоты в метаноле (массовое отношение 2,4, WR) добавляли к суспензии метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3 морфолин-4-илпропил)амино]метилфенил)ацетата в метаноле (4,0 WR) при 5C. После перемешивания в течение 10 мин белую суспензию растворяли с получением прозрачного раствора. По каплям к раствору добавляли трет-бутилметиловый эфир (5,1 WR) и после добавления затравочного кристалла моногидрохлорида метил-(33-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата, полученного, как описано на стадии (а) выше, образовывался белый осадок. После перемешивания в течение 5 мин добавляли трет-бутилметиловый эфир (11,2 WR) и суспензию перемешивали в течение 1 ч при 5C. Осадок фильтровали и промывали трет-бутилметиловым эфиром (3,7 WR) с получением моногидрохлорида метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата в виде твердого вещества (выход 90%). Элементный анализ Стехиометрию, основание к кислоте, равную 1:1, подтверждали при помощи ЯМР. Пример 2. Получение соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с бромисто-водородной кислотой (соль 1:1)(0,9 мл) при комнатной температуре. Прозрачный раствор оставляли при -10C на неделю, после чего осаждалось кристаллическое вещество. Кристаллическое вещество моногидробромид метил-(3-3-(6 амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата фильтровали и сушили. Дополнительные количества соли моногидробромида получали при помощи следующего способа:(б) Стехиометрическое количество раствора бромисто-водородной кислоты (водн., 48%) в метаноле(0,8 WR) добавляли к суспензии метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата в метаноле (11,9 WR) при комнатной температуре. После перемешивания в течение 10 мин белую суспензию растворяли с получением прозрачного раствора. Добавляли затравочный кристалл моногидробромида метил-(3-3-(6-амино-2 бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата, полученного, как описано в (а) выше. трет-Бутилметиловый эфир (11,3 WR) затем по каплям добавляли к раствору с получением белого осадка. Суспензию охлаждали до 3C и перемешивали в течение 1 ч. Осадок фильтровали и промывали трет-бутилметиловым эфиром (3,7 WR) с получением моногидробромида метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетата в виде твердого вещества (выход 87,7-89,4%). Стехиометрию, основание к кислоте, равную 1:1, подтверждали при помощи ЯМР. Пример 3. Получение соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с малеиновой кислотой (соль 1:2)(а) 27 мМ раствор малеиновой кислоты в 1,4-диоксане (0,5 мл, 13,5 мкмоль) при комнатной температуре добавляли к раствору метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата (4 мг, 7 мкмоль) в 1,4-диоксане (0,75 мл) и смесь оставляли на ночь. На следующие сутки раствор нагревали до 40C и встряхивали в течение одного часа, и после этого оставляли охлаждаться до комнатной температуры. Растворитель выпаривали при комнатной температуре с получением дималеата метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9 Н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата в качестве конечного продукта. Дополнительные количества соли дималеата получали при помощи следующего способа:(б) Малеиновую кислоту (0,9 г, 7,8 ммоль) добавляли к смеси метил-(3-3-(6-амино-2-бутокси-8 оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата (2,2 г,3,9 ммоль) в метаноле (20 мл) и изопропилового спирта (20 мл) и смесь нагревали до 50C до получения прозрачного раствора. Раствор оставляли охлаждаться до комнатной температуры и затем вводили затравку кристалла дималеата метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата, полученного, как описано на стадии(а) выше. Через 16 ч твердое вещество фильтровали и сушили при 50C в высоком вакууме в течение 72 ч. Выход 2,96 г, 95%. 1 Н ЯМР (DMSO-D6)9,88 (s, 1H), 7,32-7,22 (m, 4H), 6,43 (s, 2H), 6,11 (s, 4H), 4,12 (t, 2 Н), 3,95 (s,2 Н), 3,71 (brs, 6 Н), 3,68 (s, 2 Н), 3,60 (s, 3H), 2,94-2,75 (m, 10 Н), 1,99-1,94 (m, 2 Н), 1,90-1,80 (m, 2 Н), 1,651,58 (m, 2 Н), 1,41-1,32 (m, 2 Н), 0,90 (t, 3H). Стехиометрию, основание к кислоте, равную 1:2, подтверждали при помощи ЯМР. Пример 4. Анализы порошковой дифракции рентгеновских лучей Общие способы. Анализы порошковой дифракции рентгеновских лучей (XRPD) могут быть осуществлены на образцах, приготовленных в соответствии со стандартными способами (см., например Giacovazzo et al., eds.,Fundamentals of Crystallography, Oxford University Press (1992); JenkinsSnyder, eds., Introduction to XRay Powder Diffractometry, John WileySons, New York (1996); Bunn, ed., Chemical Crystallography, Clarendon Press, London (1948) и KlugAlexander eds., X-ray Diffraction Procedures, John WileySons, NewYork (1974. Картины порошковой дифракции рентгеновских лучей для солей, описанных в примерах 1-3 выше-6 017532 Для анализов использовали парафокусирующий порошковый рентгеновский дифрактометр БрэггаБрентано с использованием монохроматического CuK излучения (45 кВ и 40 мА). Основная оптика включала щели Соллера и автоматическую дивергентную щель. Плоские образцы готовили на планшетах с нулевым фоном, которые вращали во время измерений. Вторичная оптика включала щели Соллера,автоматическую отсеивающую щель, приемную щель и монохроматор. Преломленный сигнал регистрировали при помощи пропорционального, заполненного ксеноном детектора. Картины дифракции регистрировали при 22 (тэта)40 в режиме непрерывного сканирования при размере шага 0,0162 при скорости 42 в 1 мин. Необработанные данные хранили в электронном виде. Оценку осуществляли на необработанных или сглаженных картинах дифракции. Дифрактометр Panalytical X'pert PRO MPD - в режиме отражения использовали для вышеупомянутых измерений. Специалист в данной области техники может устанавливать параметры прибора для порошкового рентгеновского дифрактометра, таким образом, что могут быть зарегистрированы данные дифракции, сравнимые с представленными данными. Полученные результаты представлены на фиг. 1-3. Каждая из нижеприведенных табл. А, В и С представляет значения 2 (2 тэта) (Точность: +/- 0,12), dвеличины и относительные интенсивности пиков, представленных на картинах дифракции рентгеновских лучей на фиг. 1-3, соответственно. Пример 5. Дифференциальная сканирующая калориметрия (DSC) С использованием стандартных способов, например, описанных в Hhne, G. W. H. et al (1996), Differential Scanning Calorimetry, Springer, Berlin, калориметрический ответ тестируемого образца на увеличение температуры исследовали с использованием дифференциального сканирующего калориметра с модуляцией температуры (MTDSC) ТА Instruments Q1000 с использованием модуляции 0,50C в интервалах 40 с и изменением температуры 5C в 1 мин. Приблизительно от 1 до 5 мг тестируемого образца помещали в алюминиевые стаканы с крышками (без обжатия) в атмосфере азота. Хорошо известно, что начало DSC и максимальные температуры могут варьировать вследствие чистоты образца и параметров прибора, особенно скорости сканирования температуры. Специалист в данной области техники может использовать стандартную оптимизацию/калибровку для установки параметров прибора для дифференциального сканирующего калориметра таким образом, что могут быть собраны данные, сравнимые с представленными здесь данными. Найдено, что температура плавления для типичного образца безводной соли моногидрохлорида,полученной в примере 1(с), составляет 144C3C (начало). Найдено, что температура плавления для типичного образца безводной соли моногидробромида,полученной в примере 2(b), составляет 150C3C (начало). Найдено, что температура плавления для типичного образца безводной соли дималеата, полученной в примере 3(b), составляет 150C3C (начало). Пример 6. Уменьшение размера частиц Уменьшение размера частиц с использованием 2" спиральной струйной мельницы (SJM) осуществляли со следующими тремя тестируемыми веществами: соль моногидрохлорид в соответствии с примером 1 (соль по изобретению), соль дималеат в соответствии с примером 3 (соль по изобретению) и соединение метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетат в виде свободного основания (соединение для сравнения). Просеянную партию тестируемого вещества загружали в камеру струйной мельницы через систему подачи Вентури при помощи вибрационного загрузчика. Микронизации достигали путем столкновений частиц под действием газа под давлением (азота), вдуваемого через располагающиеся под углом форсунки в камеру струйной мельницы. Частицы, имеющие отличающиеся размеры, развивают различные скорости и импульс, и по мере уменьшения размера частиц последние по спирали движутся в центр струйной мельницы и выбрасываются в корзину для сбора. Параметры способа, которые контролируют размер частиц, дополнительно к собственным свойствам микронизированного соединения представляют собой скорость загрузки, давление в измельчителе и давление в трубке Вентури и обобщены в следующей табл. Вследствие накопления соединения для сравнения в выбрасываемом материале мельница забивалась. Уменьшение давления в измельчителе/трубке Вентури с 2/5 бар (2/5105 Па) до 1/4 бар (1/4105 Па) не оказывало значительного благоприятного действия в этом отношении. Таким образом, уменьшение размера частиц соединения для сравнения останавливалось после загрузки только 1,7 г из предполагаемых 7 г. Наоборот, соли моногидрохлорид и дималеат легкомикронизировались, и отсутствовало существенное забивание или блокирование мельницы во время работы. Пример 7. Измерение фракции мелких частиц (FPF). Способ. Измерение FPF, начиная с полученного вещества, осуществляли в соответствии со следующими сериями стадий: 1. Уменьшение размера частиц (микронизация) полученного вещества. 2. Измерение размера частиц (после уменьшения размера) с использованием прибора для лазерной дифракции. 3. Ручная загрузка образца. 4. Деагрегация порошка и сбор аэрозоля в каскадном импакторе. 5. Количественная оценка с использованием жидкостной хроматографии высокого давления(HPLC) и расчет FPF. Тестировали три вещества: соль моногидрохлорид в соответствии с примером 1 (соль по изобретению), соль моногидробромид в соответствии с примером 2 (соль по изобретению) и соединение метил(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетат в виде свободного основания (соединение для сравнения). Уменьшение размера частиц Уменьшение размера частиц (микронизацию) осуществляли в струйной мельнице, в которой газ под давлением использовали для столкновения частиц вещества при высокой скорости для осуществления уменьшения размера частиц. Измерение размера частиц Измерения размера частиц осуществляли при помощи лазерной дифракции с использованием прибора Malvern Scirocco. Полученные результаты представлены в следующей табл. 1. Таблица 1 Загрузка образца Дозы 1-2 мг отвешивали вручную (без соскребания) в отверстия прототипа ингалятора (см. ниже). Осуществляли по два измерения для каждого тестируемого образца и в каждом эксперименте использовали по две дозы и, таким образом, в общем, в экспериментах использовали по четыре дозы каждого тестируемого вещества. Образцы сушили в атмосфере газообразного азота в течение ночи, а затем осуществляли эксперименты. Постановка эксперимента и деагрегация образца Мелкие частицы оценивали с использованием импактора Next Generation Impactor, NGI. Этот каскадный импактор описан в фармакопее, такой как USP (Фармакопея США) (general chapter 601 AERSOLS, NASAL SPRAYS, METERED-DOSE INHALERS, DRY POWDER INHALERS, apparatus 5) и Европейская Фармакопея (5.8 section 2.9.18 PREPARATIONS FOR INHALATION: AERODYNAMIC ASSESSMENT OF FINE PARTICLES, apparatus E), в которой имеется подробное описание того, как собирать, использовать и калибровать импактор для применения с различными скоростями потока. Использовали два импактора NGI, по одному на эксперимент. Использовали простой прототип ингалятора, состоящий из имеющего форму L цилиндрического канала, содержащего вертикальный компонент и горизонтальный компонент. Прототип ингалятора при-9 017532 крепляли через USP-вход к NGI импактору. Микронизированный порошок переносили через вертикальный канал в изгиб прототипа ингалятора (т.е. изгиб канала, имеющего форму L). Каждую дозу 1-2 мг порошка захватывали потока воздуха 60 л/мин в течение 2 с (измеренные на входе индукционного порта), захватывая порошок, находящийся в изгибе, и аэрозоль затем переносился через горизонтальный компонент канала через спиральный мундштук и в импактор NGI. Порошки лекарств собирали в индукционном порту и в восемь стаканчиков (смотри приведенные выше ссылки). Отбор и сбор порошков лекарств осуществляли в изолирующей камере (с перчатками) при уровне относительной влажности меньше 2%. Анализ HPLC Порошковое лекарственное содержимое индукционного порта и в восьми стаканах затем количественно оценивали с использованием способа жидкостной хроматографии высокого давления, описанной в табл. 2. Таблица 2 Расчет Ключевые данные, используемые для расчетов FPF, полученные в результате анализов HPLC, представлены в табл. 3. Рассчитывали FPF, определенную в вышеприведенных ссылках на фармакопею. Таблица 3 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соль метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3-морфолин 4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли. 2. Моногидрохлорид метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9 Н-пурин-9 ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата. метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9 Н-пурин-93. Моногидробромид ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата. 4. Дималеат метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9H-пурин-9-ил)пропил](3 морфолин-4-илпропил)амино]метилфенил)ацетата. 5. Фармацевтическая композиция, содержащая соль метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольват этой соли вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. 6. Фармацевтическая композиция по п.5 в форме сухой порошкообразной композиции для применения в ингаляционной терапии. 7. Сухой порошковый ингалятор, содержащий фармацевтическую композицию по п.6. 8. Способ изготовления фармацевтической композиции по п.5, включающий смешивание соли ме- 10017532 тил-(3-3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9 Н-пурин-9-ил)пропил](3-морфолин-4 илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли с фармацевтически приемлемым адъювантом, разбавителем или носителем. 9. Применение соли по любому из пп.1-4 в ингаляционной терапии. 10. Применение соли по любому из пп.1-4 в изготовлении лекарственного средства для лечения астмы, ХОБЛ (хронической обструктивной болезни легких), аллергического ринита, аллергического конъюнктивита, атопического дерматита, рака, гепатита В, гепатита С, HIV (вируса иммунодефицита), HPV(папилломавируса человека), бактериальных инфекций или дерматоза. 11. Способ лечения обратимого обструктивного заболевания дыхательных путей у пациента, страдающего от указанного заболевания или имеющего риск его возникновения, включающий введение пациенту терапевтически эффективного количества соли метил-(3-3-(6-амино-2-бутокси-8-оксо-7,8 дигидро-9H-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метилфенил)ацетата с соляной кислотой, бромисто-водородной кислотой или малеиновой кислотой или сольвата этой соли.
МПК / Метки
МПК: A61K 31/5377, A61P 31/18, A61P 11/00, A61P 31/12, A61P 37/08, C07D 473/18, A61P 17/00, A61P 37/02, A61P 35/00, A61P 11/06
Метки: метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата, соли, приемлемые, применение, фармацевтически, терапии
Код ссылки
<a href="https://eas.patents.su/13-17532-farmacevticheski-priemlemye-soli-metil-3-3-6-amino-2-butoksi-8-okso-78-digidro-9n-purin-9-ilpropil3-morfolin-4-ilpropilaminometilfenilacetata-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтически приемлемые соли метил-(3-{[[3-(6-амино-2-бутокси-8-оксо-7,8-дигидро-9н-пурин-9-ил)пропил](3-морфолин-4-илпропил)амино]метил}фенил)ацетата и их применение в терапии</a>