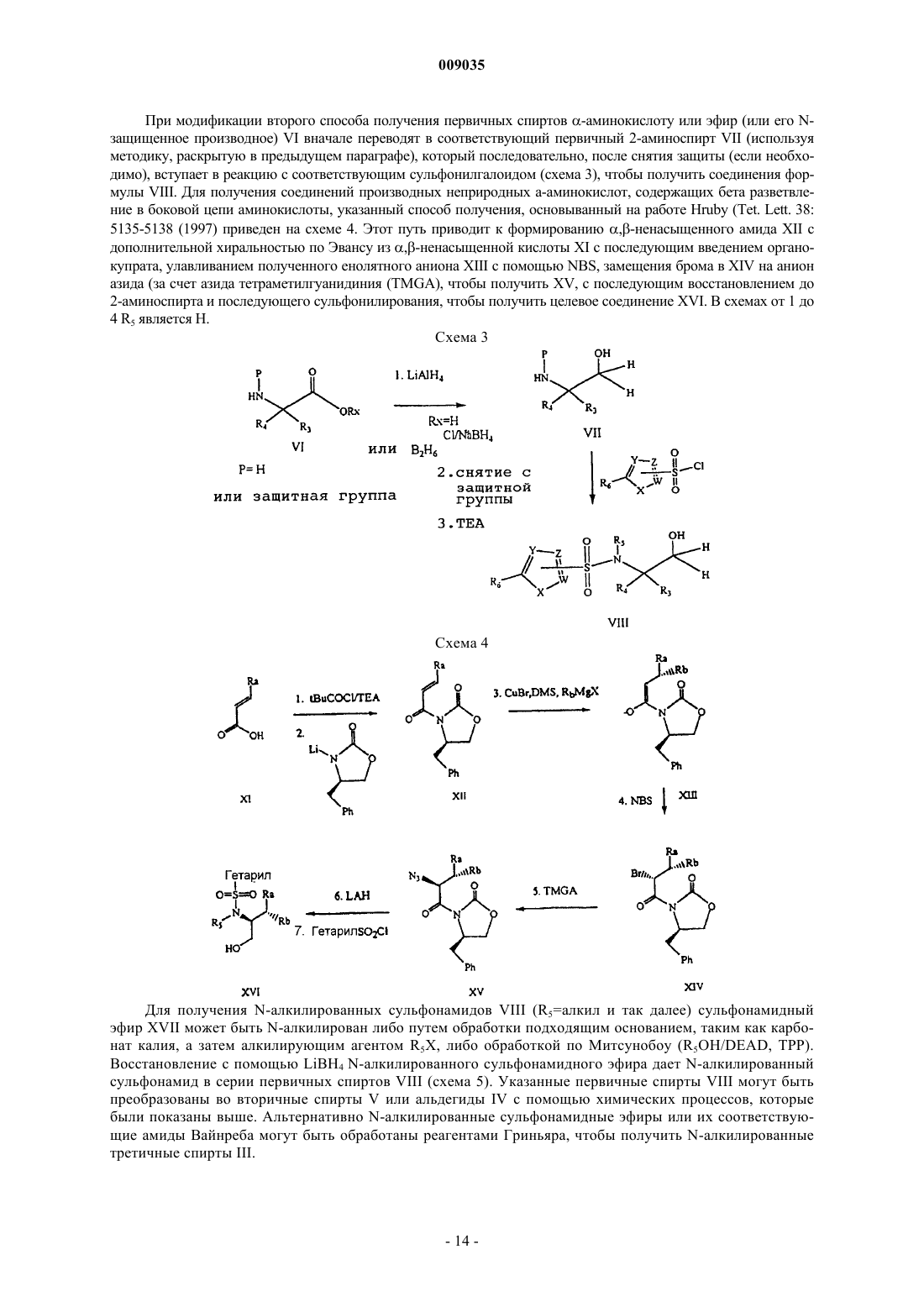
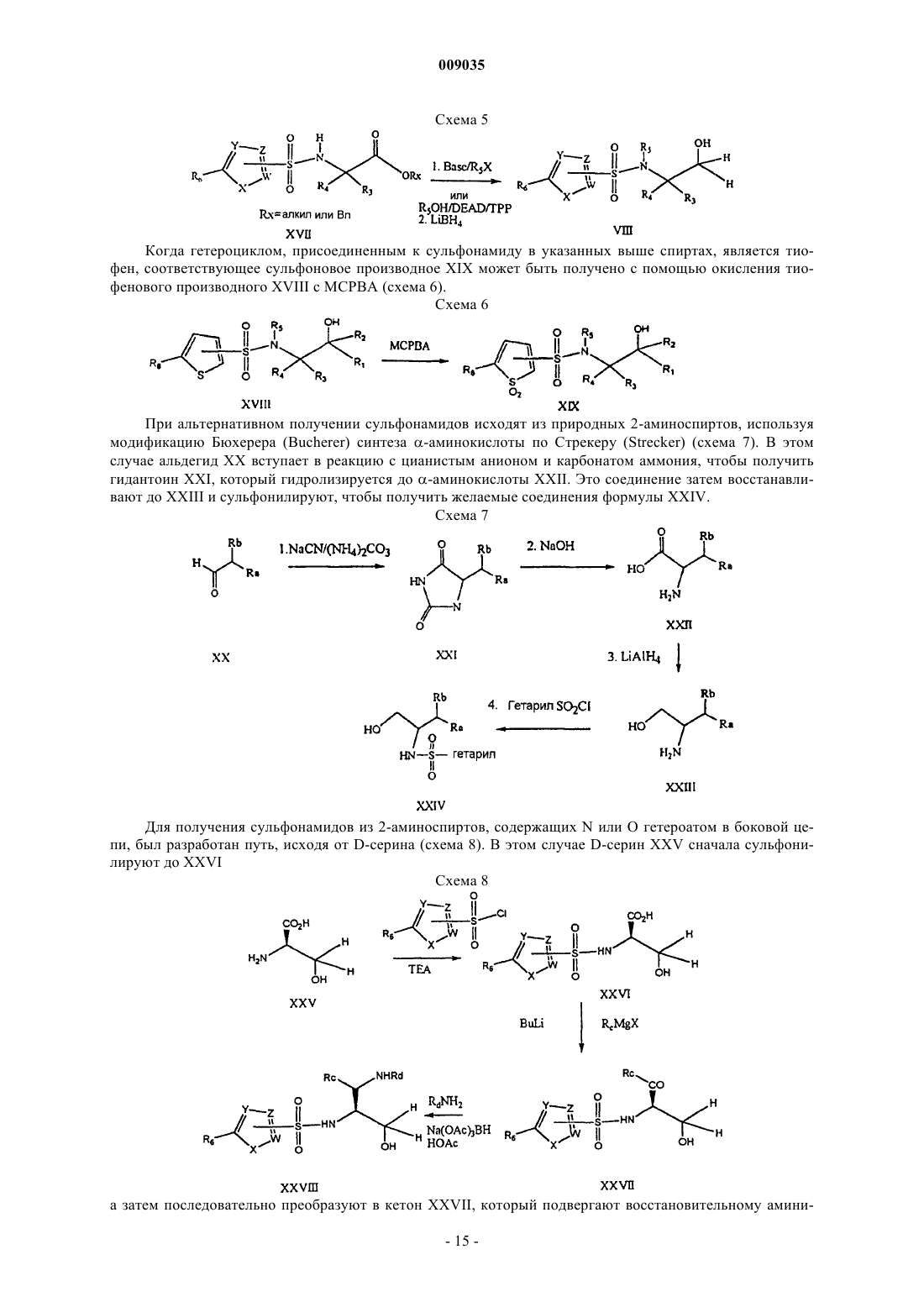
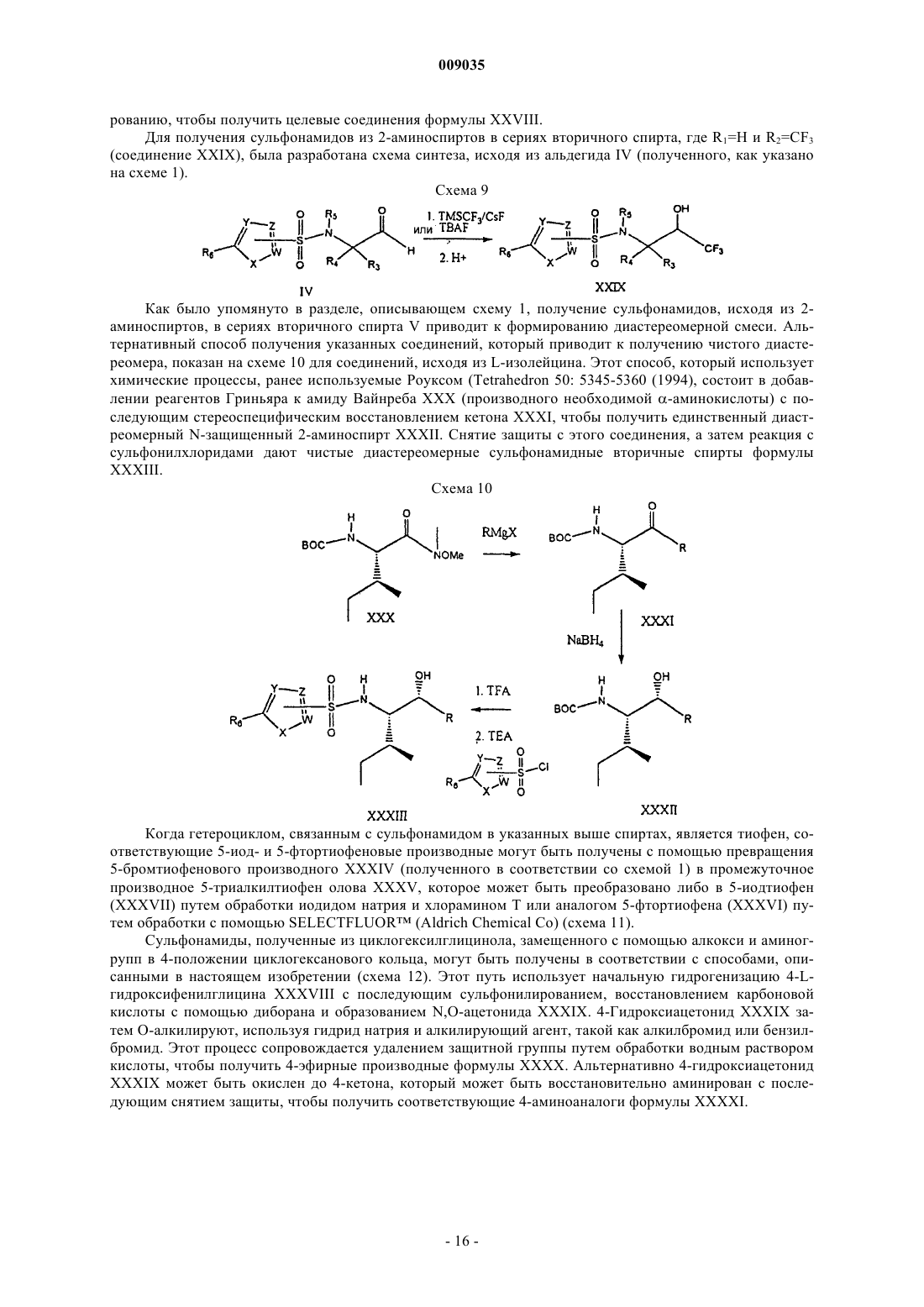
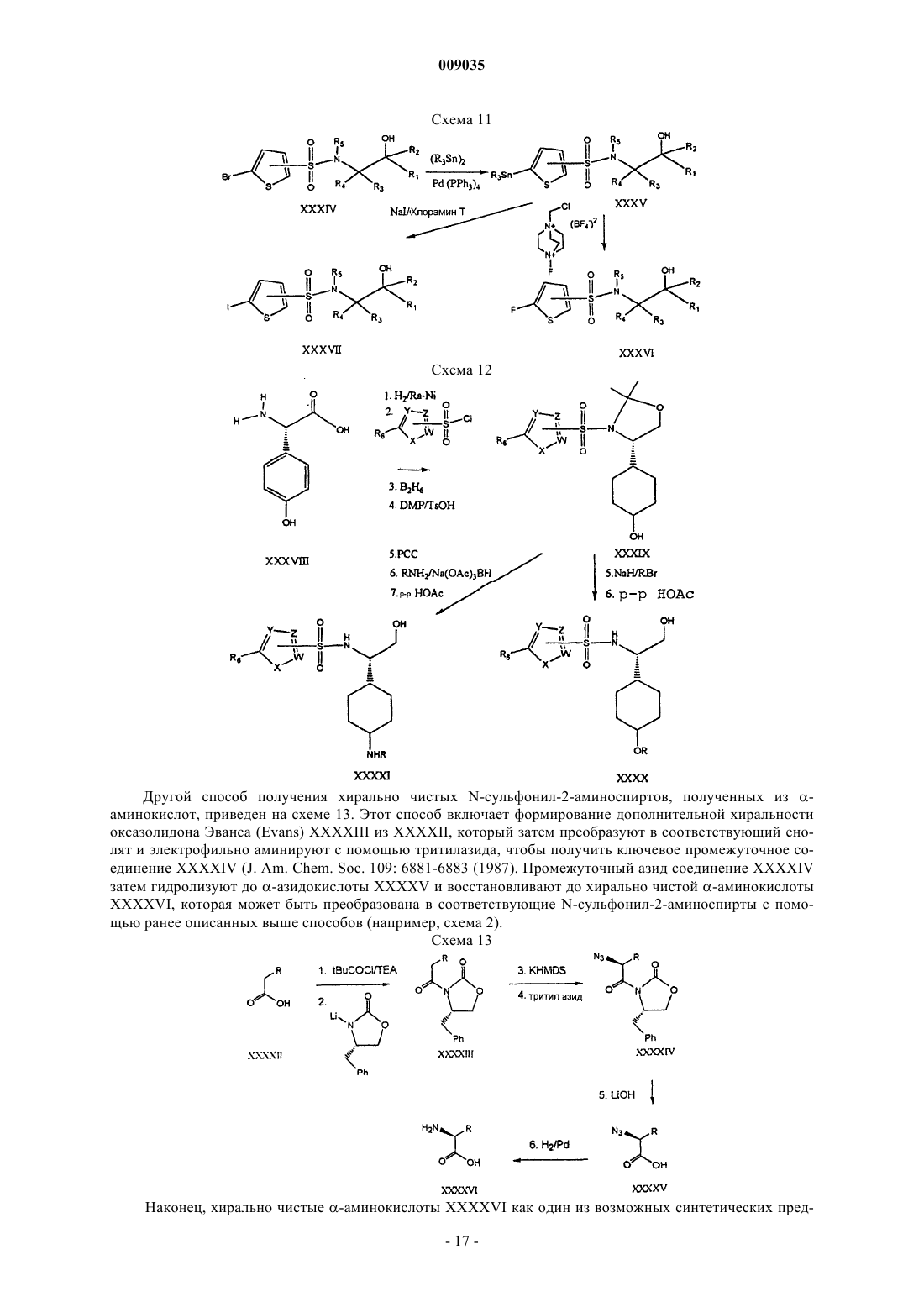
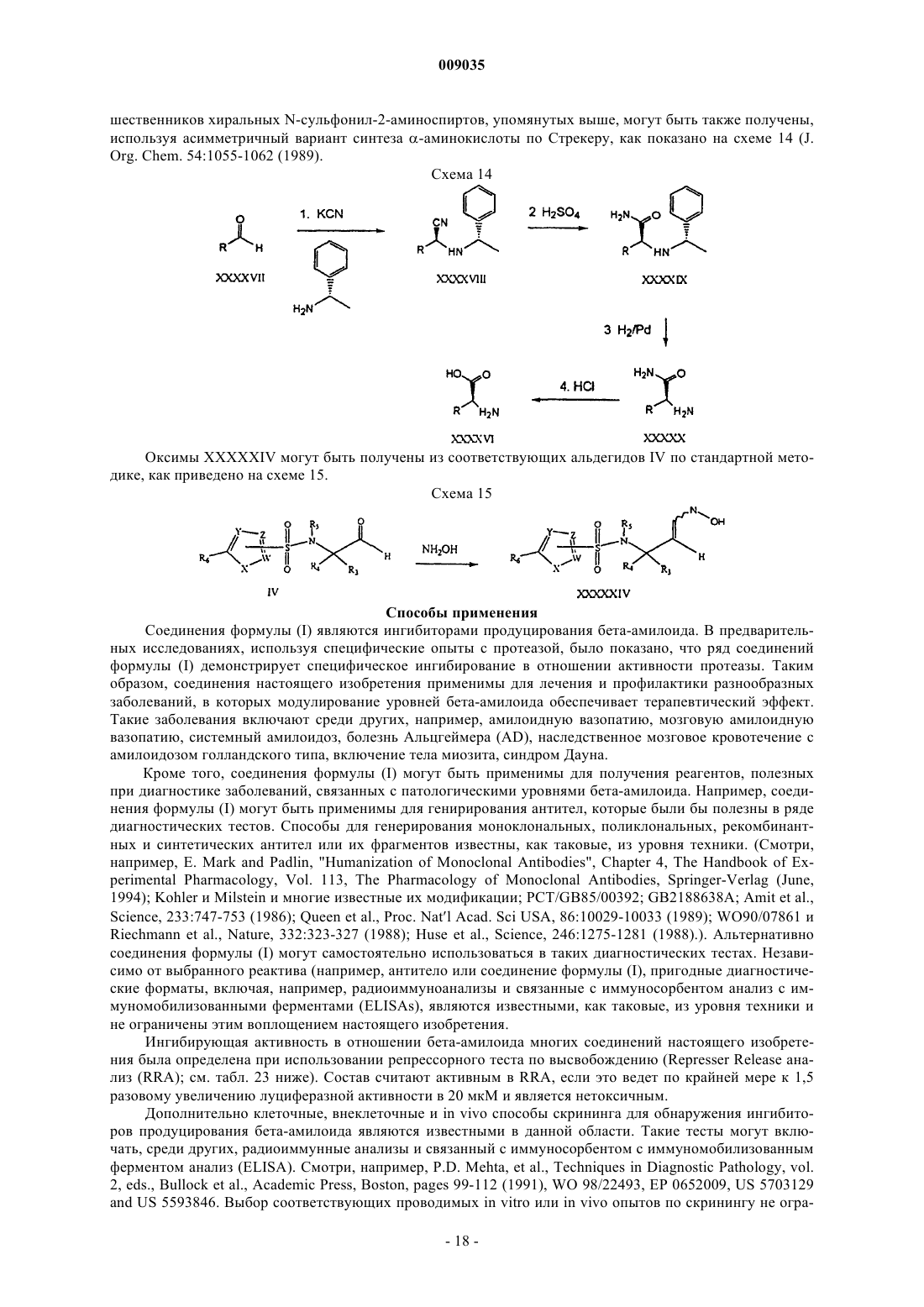
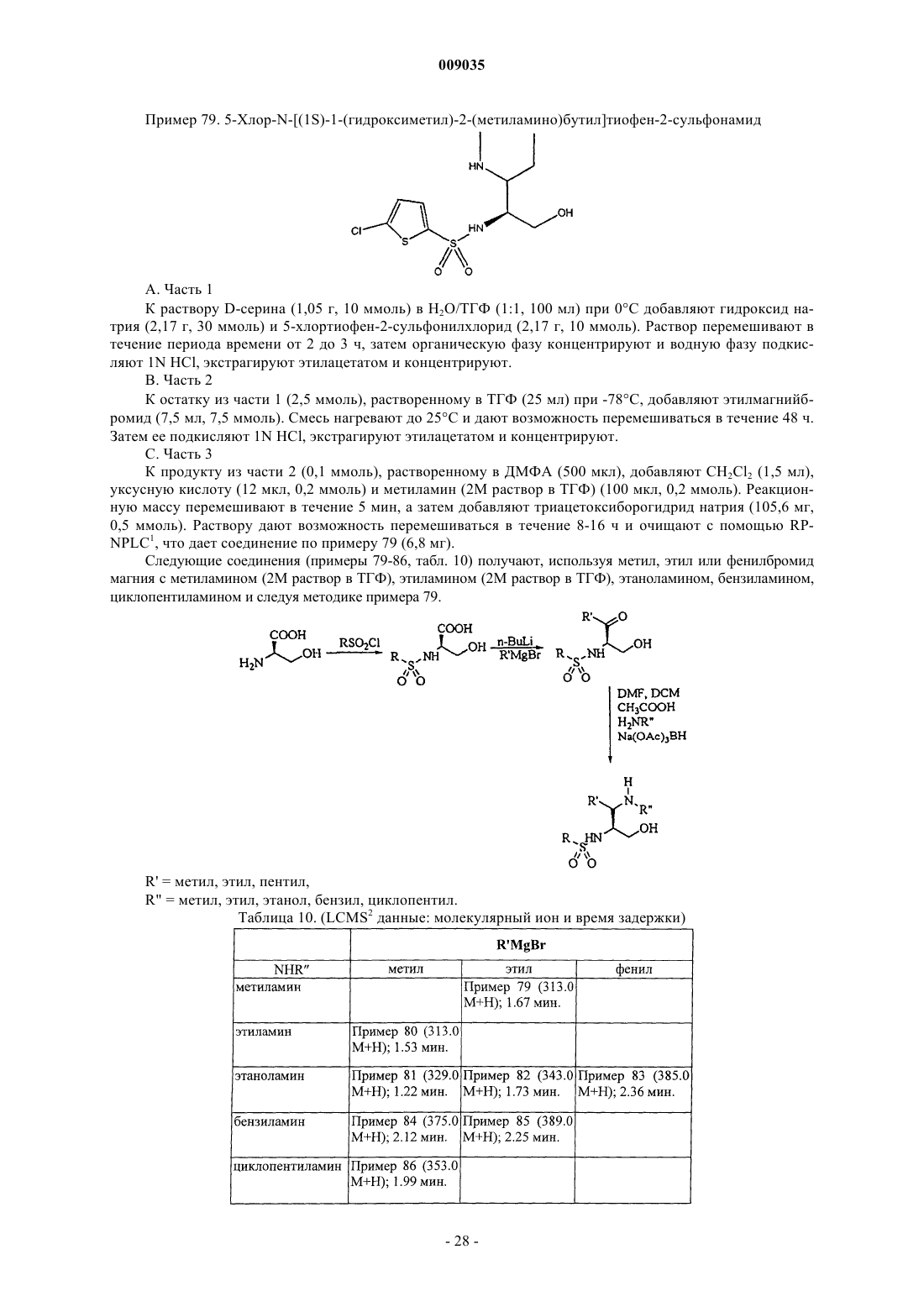
Получение гетероциклических сульфонамидных ингибиторов бета-амилоида
Номер патента: 9035
Опубликовано: 26.10.2007
Авторы: Мор Уильям Джей, Коул Дерек Сесил, Кербрак Деннис Майкл, Каттерер Кристина Марта, Стоск Джозеф Раймонд, Кейсбьер Дейвид Скотт, Уоллер Кевин Роджер, Крефт Энтони Франк, Диаманитис Джордж
Формула / Реферат
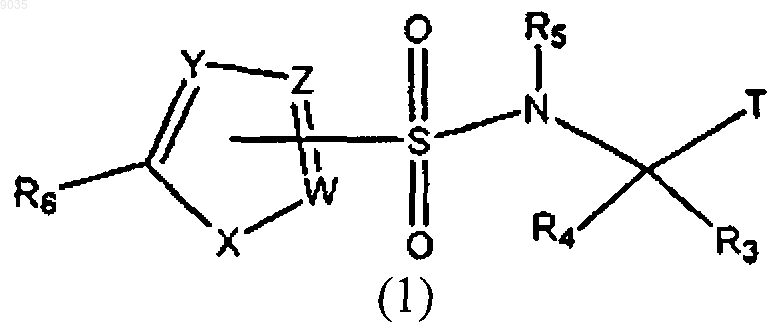
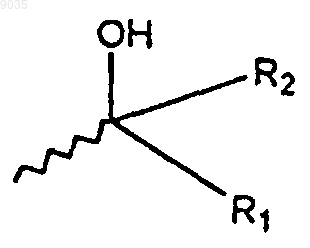
1. Соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру
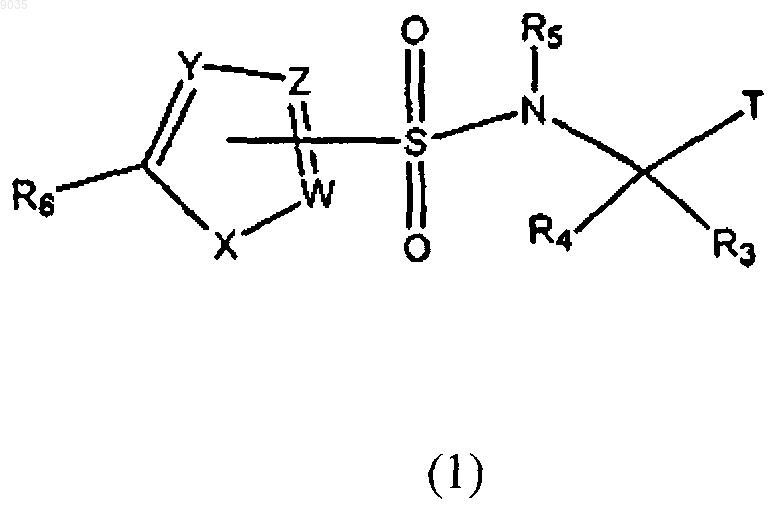
где R1 и R2 независимо выбирают из группы, состоящей из водорода; C1-C10алкила; CF3; C2-С8алкенила; C2-С8алкенила, замещенного фенилом или C1-С8алкилом; C2-С8алкинила; С4-C10циклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С8алкилом, N(С1-С8алкилом) или SCH3; нафтанила; циклогексенила и (СН2)n(1,3)диоксана, где n имеет значение от 2 до 5;
R3 выбирают из группы, состоящей из водорода и C1-C10алкила;
R4 выбирают из группы, состоящей из водорода; C1-C10алкила; C1-C10алкила, замещенного фенилом, фенилом, замещенным метокси, бифенилом, гидроксилом и фенилом, замещенным NO2, фенилом, замещенным группой ОСН2(фенил), SCH2(фенил), SCH2(фенил, замещенный С1-С8алкилом), ОCH2(фенил) или S(С1-С8алкил); С1-C10алкил(С4-C10)циклоалкила; C1-C10алкилОН; C1-C10алкилпиридила; C1-C10алкилфуранила; СН(ОН)фенила, замещенного нитро; С4-C10циклоалкила; С4-C10циклоалкила, замещенного группой ОН, O(С1-С8алкил), O(С2-С8алкенил), ОСН2(фенил), ОСН2(пиридил), NНСH2(фенил), NH(C1-C8алкил), NH(C2-С8алкенилом), морфолина, NН(C1-С8алкил)(пиридин), или NНС(O)O(С1-С8алкил); N-замещенного пиперидинила, замещенного С(O)O(С1-С8алкилом); пиперидинила; тетрагидротиопиранила; 2-инденила; фенила; C1-C10алкилNНR7; циклогексенила; циклогексенила, замещенного С1-С8алкилом;
при условии, что R3 и R4 оба не являются водородом;
R7 является C1-C10алкилом, С4-C10циклоалкилом, бензилом или C1-C10алкилОН;
или R3 и R4 могут быть объединены с образованием С4-С10 циклоалкила, норборнанила, инденила или пиперидинила, замещенного С(O)(С1-С6алкилом);
R5 выбирают из группы, состоящей из водорода, C1-С6алкила, замещенного О(фенилом) и бензила, замещенного галогензамещенным фенилом;
R6 выбирают из группы, состоящей из водорода и галогена;
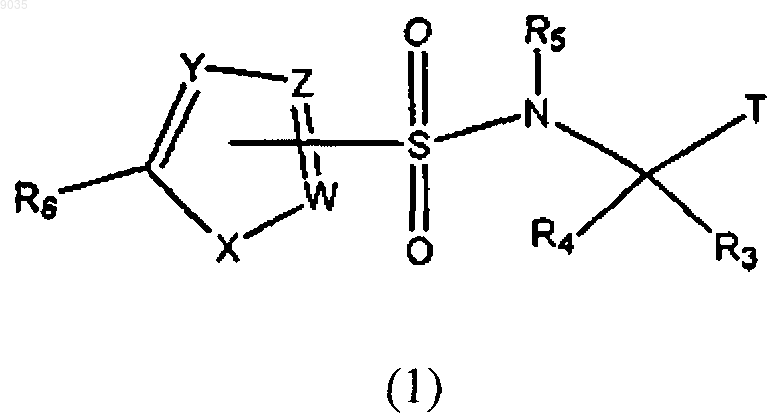
Т выбирают из группы, состоящей из
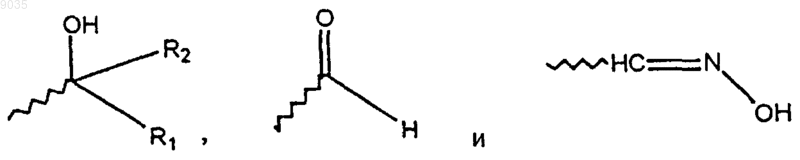
W, Y и Z независимо выбирают из группы, состоящей из С и CR10;
R10 выбирают из группы, состоящей из водорода и галогена, при условии, что по крайней мере один из W, Y и Z должен быть С;
X выбирают из группы, состоящей из О, S и SO2;
при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим.
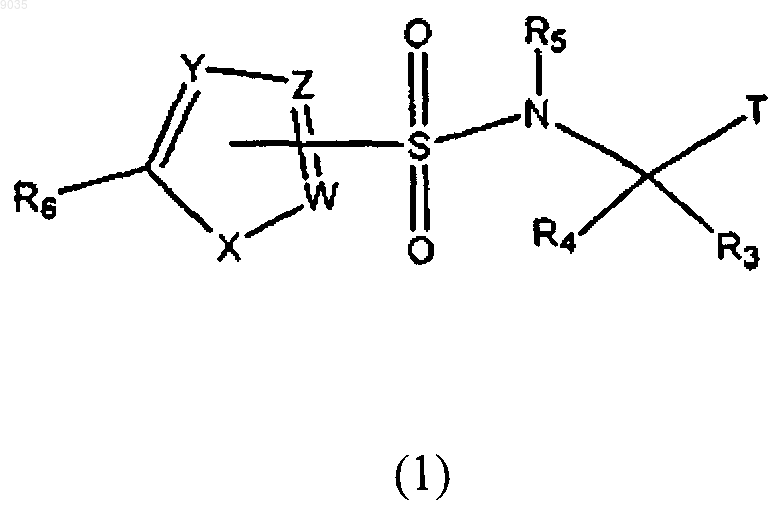
2. Соединение формулы (1) или его фармацевтически приемлемая соль, в котором формула (1) имеет структуру
где R1 и R2 независимо выбирают из группы, состоящей из водорода; C1-C10алкила; CF3; C2-С8алкенила, С2-С8алкенила, замещенного фенилом или C1-С8алкилом; C2-С8алкинила; С4-C10циклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С8алкилом, N(С1-С8алкилом) или SCH3; нафтанила; циклогексенила; и (СН2)n(1,3)диоксана, где n имеет значение от 2 до 5;
R3 выбирают из группы, состоящей из водорода и C1-C10алкила;
R4 выбирают из группы, состоящей из водорода; С1-C10алкила; C1-C10алкила, замещенного фенилом, фенилом, замещенным метокси, бифенилом, гидроксилом и фенилом, замещенным NO2, фенилом, замещенным группой ОCH2(фенил), SCH2(фенил); SСН2(фенил, замещенный С1-С8алкилом), ОСН2(фенил) или S(С1-С8алкил); C1-C10алкил(С4-C10циклоалкил); C1-C10алкилОН; C1-C10алкилпиридила; C1-C10алкилфуранила; СН(ОН)фенила, замещенного нитро; С4-C10циклоалкила; С4-C10циклоалкила, замещенного группой ОН, O(C1-С8алкил), O(С2-С8алкенил), ОСН2(фенил), ОСН2(пиридил), NНСН2(фенил), NH(C1-C8алкил), NH(С2-С8алкенил), морфолина, NН(С1-С8алкил)(пиридин) или NНС(O)O(C1-С8алкил); N-замещенного пиперидинила, замещенного С(O)O(C1-С8алкилом); пиперидинила; тетрагидротиопиранила; 2-инденила; фенила; C1-C10алкилNHR7; циклогексенила; циклогексенила, замещенного С1-С8алкилом;
при условии, что R3 и R4 оба не являются водородом;
R7 является C1-C10алкилом, С4-C10циклоалкилом, бензилом или C1-C10алкилОН,
или R3 и R4 могут быть объединены с образованием С4-C10циклоалкила, норборнанила, инденила или пиперидинила, замещенного С(O)(С1-С6алкилом);
R5 выбирают из группы, состоящей из водорода, C1-С6алкила, замещенного О(фенилом) и бензила, замещенного галогензамещенным фенилом;
R6 выбирают из группы, состоящей из водорода и галогена;
Т является
W является С, где W обеспечивает положение присоединения к SO2 группе;
X является S;
Y и Z независимо являются С или CR10;
R10 выбирают из группы, состоящей из водорода и галогена;
при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим.
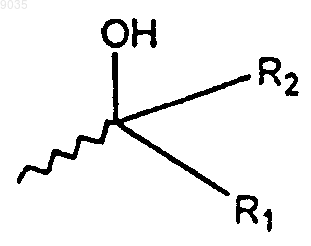
3. Соединение формулы (1) или его фармацевтически приемлемая соль, в котором формула (1) имеет структуру
где R1 и R2 независимо выбирают из группы, состоящей из водорода; С1-C10алкила; CF3; С2-С8алкенила; C2-С8алкенила, замещенного фенилом или C1-С8алкилом; C2-С8алкинила; С4-C10циклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С8алкилом, N(C1-С8алкилом) или SCH3; нафтанила; циклогексенила; и (СН2)n(1,3)диоксана, где n имеет значение от 2 до 5;
R3 выбирают из группы, состоящей из водорода и C1-C10алкила;
R4 выбирают из группы, состоящей из водорода; C1-C10алкила; C1-C10алкила, замещенного метокси, бифенилом, гидроксилом и фенилом, замещенным NO2, фенилюь, замещенным группой ОCH2(фенил), SСН2(фенил), SCH2(фенил, замещенный С1-С8алкилом), ОСН2(фенил) или S(C1-C8алкил); C1-C10алкил(C4-C10циклоалкил); C1-C10алкилОН; C1-C10алкилпиридила; C1-C10алкилфуранила; СН(ОН)фенила, замещенного нитро; С4-C10циклоалкила; С4-C10циклоалкила, замещенного группой ОН, O(С1-С8алкил), O(С2-С8алкенил), ОСН2(фенил), ОСН2(пиридил), NНСН2(фенил), NH(C1-С8алкил), NH(C2-С8алкенил), морфолина, NH(C1-С8алкил)(пиридин) или NHС(O)O(С1-С8алкил); N-замещенного пиперидинила, замещенного С(O)O(С1-С8алкилом); пиперидинила; тетрагидротиопиранила; 2-инденила; фенила; C1-C10алкилNНR7; циклогексенила; циклогексенила, замещенного С1-С8алкилом;
при условии, что R3 и R4 оба не являются водородом;
R7 является С1-C10алкилом, С4-C10циклоалкилом, бензилом или, C1-C10алкилОН;
или R3 и R4 могут быть объединены с образованием С4-С10циклоалкила, норборнанила, инденила или пиперидинила, замещенного С(O)(С1-С6алкилом);
R5 выбирают из группы, состоящей из водорода, С1-С6алкила, замещенного О(фенилом) и бензила, замещенного галогензамещенным финилом;
R6 является галогеном;
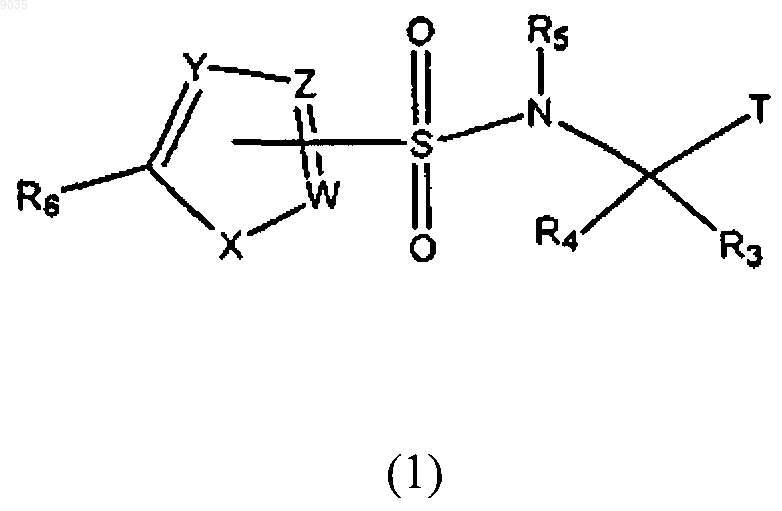
Т представляет собой
W является С, где W обеспечивает положение присоединения к SO2 группе;
X является S;
Y и Z независимо являются С или CR10;
R10 выбирают из группы, состоящей из водорода и галогена;
при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим.
4. Соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру
где R1 и R2 являются водородом;
R3 является водородом;
R4 является S-стереохимическим C1-С6алкилом;
R5 является водородом;
R6 является галогеном;
Т является
X является S;
W, Y и Z являются С, где W обеспечивает положение присоединения к SO2 группе.
5. Соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру
где R1 и R2 являются водородом;
R3 является водородом;
R4 является S-стереохимическим C1-С6алкилом;
R5 является водородом;
R6 является водородом или галогеном;
Т является
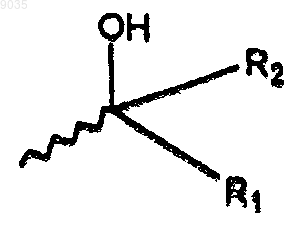
X является О;
W, Y и Z являются С, W обеспечивает положение присоединения к SO2 группе.
6. Соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру
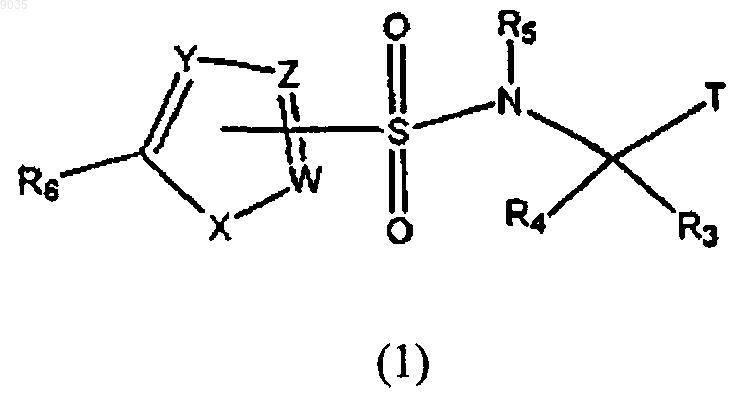
где R3 выбирают из группы, состоящей из водорода и С1-С8алкила;
R4 выбирают из группы, состоящей из водорода и С1-С8алкила;
при условии, что R3 и R4 оба не являются водородом;
R5 представляет собой водород;
R6 представляет собой галоген;
Т является
W, Y и Z независимо выбирают из группы, состоящей из С и CR10;
R10 представляет собой водород, при условии, что по крайней мере один из W, Y и Z должен быть С;
X представляет собой S;
при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим.
7. Соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру
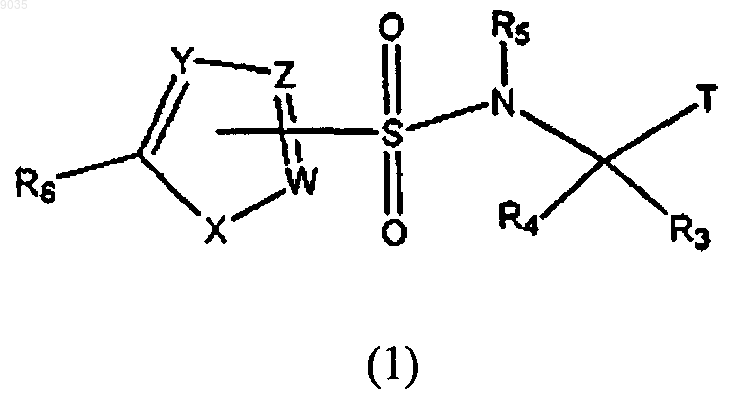
где R3 выбирают из группы, состоящей из водорода и С1-С8алкила;
R4 выбирают из группы, состоящей из водорода и С1-С8алкила;
при условии, что R3 и R4 оба не являются водородом;
R5 представляет собой водород;
R6 представляет собой галоген;
Т является
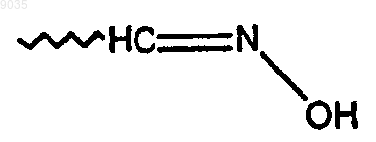
W, Y и Z независимо выбирают из группы, состоящей из С и CR10;
R10 представляет собой водород, при условии, что по крайней мере один из W, Y и Z должен быть С;
X представляет собой S;
при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим.
8. Соединение по любому из пп.1, 2 или 5, где R6 является галогеном.
9. Соединение по любому из пп.1-8, где R6 является хлором или бромом.
10. Соединение по любому из пп.1-3, где Т является C(OH)R1R2, и R1 и R2 каждый является водородом.
11. Соединение по любому из пп.1-7, где оба W и Z являются C.
12. Соединение по любому из пп.1-3, 6 или 7, где R4 является S-стереохимическим C1-С6алкилом.
13. Соединение по любому из пп.1-3, где X является S, W является С, Z является С, R6 является галогеном, R4 является S-стереохимическим C1-С6алкилом, R3 является водородом, R5 является водородом и R1 и R2 каждый является водородом.
14. Соединение по любому из пп.1-3, где R3CR4 является циклогексилом.
15. Соединение по любому из пп.1-3, где R3CR4 является пиперидином, замещенным С(O)(C1-С6алкилом).
16. Соединение по п.1, где X является S.
17. Соединение в соответствии с п.1, которое выбирают из группы, состоящей из
3-бром-5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
4-бром-5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
2,5-дихлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-3-сульфонамид;
4,5-дихлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(1S)-1-(гидроксиметил)-2-метилпропил]тиофен-2-сульфонамид;
5-бром-N-[(1S)-1-(гидроксиметил)-2-метилпропил]тиофен-2-сульфонамид;
5-бром-N-[(1R)-(гидроксиметил)-2-метилпропил]тиофен-2-еульфонамид;
4,5-дибром-N-[(1S)-1-(гидроксиметил)-2-метилпропил]тиофен-2-сульфонамид;
5-хлор-N-[(1S)-1-циклогексил-2-гидроксиэтил]тиофен-2-сульфонамид;
5-бром-N-[(lS)-1-циклогексил-2-гидроксиэтил]тиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)-2-фенилпропил]тиофен-2-сульфонамид;
5-бром-N-[1-(гидроксиметил)-2-фенилпропил]тиофен-2-сульфонамид;
5-xлop-N-[(1S,2R)-1-(гидpoкcимeтил)-2-мeтилбyтил]тиoфeн-2-cyльфoнaмид;
5-бpoм-N-[(1S,2R)-1-(гидpoкcимeтил)-2-мeтилбyтил]тиoфeн-2-cyльфoнaмид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид-1,1-диоксид;
5-хлор-N-[1-(гидроксиметил)-2,3-диметилфенил]тиофен-2-сульфонамид;
5-xлop-N-[1-(гидроксиметил)-2-метилфенил]тиофен-2-сульфонамид;
5-хлор-N-[2-этил-1-(гидроксиметил)гексил]тиофен-2-сульфонамид;
5-хлор-N-[2-гидрокси-1-(2,4,6-триметилциклогекс-3-ен-1-ил)этил]тиофен-2-сульфонамид;
5-хлор-N-(1-циклогекс-3-ен-1-ил-2-гидроксиэтил)тиофен-2-сульфонамид;
5-хлор-N-(1-циклопентил-2-гидроксиэтил)тиофен-2-сульфонамид;
5-бром-N-[(1S)-1-(гидроксиметил)-1,2-диметилпропил]тиофен-2-сульфонамид;
5-хлор-N-[(1S)-1-(гидроксиметил)-1,2-диметилпропил]тиофен-2-сульфонамид;
5-xлop-N-[(1S,2R)-1-(гидроксиметил)-2,4-диметилпентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-1-(гидроксиметил)-2-(4-метоксифенил)пропил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-1-(гидроксиметил)-2-метилоктил]тиофен-2-сульфонамид;
5-хлор-N-[(1S)-2-этил-1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
5-хлор-N-(1S,2R)-2-этил-1-(гидроксиметил)-4-метилпентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-1-(гидроксиметил)-2-(4-метоксипентил)бутил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилпентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-2-этил-1-(гидроксиметил)пентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-1-(гидроксиметил)-4-метил-2-пропилпентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-1-(гидроксиметил)-2-(4-метоксифенил)пентил]тиофен-2-сульфонамид;
5-хлоp-N-[(1S,2R)-1-(гидроксиметил)-2-пропилоктил]тиофен-2-сульфонамид;
5-xлop-N-[(1S,2R)-l-(гидpoкcимeтил)-2-фeнилпeнтил]тиoфeн-2-cyльфoнaмид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилгептил]тиофен-2-сульфонамид;
5-хлop-N-[(1S)-2-пропил-1-(гидроксиметил)пентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-2-этил-1-(гидроксиметил)гептил]тиофен-2-сульфонамид;
5-xлop-N-[(1S,2R)-1-(гидpoкcимeтил)-2-изoбyтилгeптил]тиoфeн-2-cyльфoнaмид;
5-xлop-N-[(1S,2R)-l-(гидpoкcимeтил)-2-(4-мeтoкcифeнил)гeптил]тиoфeн-2-сульфонамид;
5-xлop-N-[(1S,2R)-l-(гидpoкcимeтил)-2-пeнтилoктил]тиoфeн-2-сyльфoнaмид;
5-xлop-N-[(1S,2R)-l-(гидpoкcимeтил)-2-фeнилгeптил]тиoфeн-2-cyльфoнaмид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-фенилпропил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-4-метил-2-фенилпентил]тиофен-2-сульфонамид;
5-xлop-N-[(1S,2R)-2-(2-фypил)-1-(гидpoкcимeтил)пpoпил]тиoфeн-2-cyльфoнaмид;
5-хлор-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)бутил]тиофен-2-сулъфонамид;
5-хлор-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)-4-метилпентил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-изопропилоктил]тиофен-2-сульфонамид;
N-[(1S,2S)-2-[1,1'-бифенил]-4-ил-1-(гидроксиметил)пропил]-5-хлортиофен-2-сульфонамид;
N-[(1S,2S)-2-[1,1'-бифенил]-4-ил-1-(гидроксиметил)бутил]-5-хлортиофен-2-сульфонамид;
N-[(1S,2S)-2-[1,1'-бифенил]-4-ил-1-(гидроксиметил)-4-метилпентил]-5-хпортиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-2,4-диметилпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-2-метилоктил]тиофен-2-сульфонамид;
5-бром-N-[(1S)-2-этил-1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-этил-1-(гидроксиметил)-4-метилпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-2-этил-1-(гидроксиметил)пентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-4-метил-2-пропилпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-2-этил-1-(гидроксиметил)гептил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-2-изобутилгептил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-2-(4-метоксифенил)гептил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-1-(гидроксиметил)-2-пентилоктил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-фенилпропил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-фенилбутил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-4-метил-2-фенилпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-4-метил-2-пиридин-3-илпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)пропил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)-4-метилпентил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-(2-фурил)-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-2-этил-1-(гидроксиметил)-3-метилбутил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-изопропил-4-метилпентил]тиофен-2-сульфонамид;
N-[(1S,2S)-2-[1,1'-бифенил]-4-ил-1-(гидроксиметил)бутил]-5-бромтиофен-2-сульфонамид;
5-хлор-N-[(1S,2R)-2-этил-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-хлор-N-[(1S,2S)-2-этил-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2R)-2-этил-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-бром-N-[(1S,2S)-2-этил-1-(гидроксиметил)октил]тиофен-2-сульфонамид;
5-хлор-N-[(1S)-1-(гидроксиметил)-2-(метиламино)бутил]-2-тиофенсульфонамид;
5-хлор-N-[(1S)-2-(этиламино)-2-(гидроксиметил)пропил]-2-тиофенсульфонамид;
5-хлop-N-[(1S)-2-[(2-гидроксиэтил)амино]-1-(гидроксиметил)пропил)-2-тиофенсульфонамид;
5-хлор-N-[(1S)-2-[(2-гидроксиэтил)амино]-1-(гидроксиметил)бутил]-2-тиофенсульфонамид;
5-хлор-N-[(1S)-2-[(2-гидроксиэтил)амино]-1-(гидроксиметил)гептил]-2-тиофенсульфонамид;
N-[(1S)-2-(бензиламино)-1-(гидроксиметил)пропил]-5-хлор-2-тиофенсульфонамид;
N-[(1S)-2-(бензиламино)-1-(гидроксиметил)бутил]-5-хлор-2-тиофенсульфонамид;
5-хлор-N-[(1S)-2-(циклопентиламино)-1-(гидроксиметил)пропил]-2-тиофенсульфонамид;
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-N-(2-феноксиэтил)тиофен-2-сульфонамид;
5-хлор-N-(3-хлорбензил)-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-фенилэтил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-1-(гидроксиметил)-3-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)фенил]тиофен-2-сульфонамид;
5-хлор-N-(2-гидрокси-1,1-диметилэтил)тиофен-2-сульфонамид;
N-[1,1-бис(гидроксиметил)пропил]-5-хлортиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)циклопентил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-циклогексил-1-(гидроксиметил)этил]тиофен-2-сульфонамид;
N-[(S)-1-бензил-2-гидроксиэтил]-5-хлортиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-1-(гидроксиметил)-2,2-диметилпропил]тиофен-2-сульфонамид;
5-хлор-N-[(R,R)-2-гидрокси-1-(гидроксиметил)-2-(4-нитрофенил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-1-(гидроксиметил)пропил]тиофен-2-сульфонамид;
N-[N-2-(бензилтио)-1-(гидроксиметил)этил]-5-хлортиофен-2-сульфонамид;
N-[(R,S)-2-(бензилокси)-1-(гидроксиметил)пропил]-5-хлортиофен-2-сульфонамид;
5-хлор-N-[(R,R)-2-гидрокси-1-(гидроксиметил)пропил]тиофен-2-сульфонамид;
5-бром-N-[(S)-2-гидрокси-1-фенилэтил]тиофен-2-сульфонамид;
5-бром-N-[(S)-1-(гидроксиметил)-3-метилбутил]тиофен-2-сульфонамид;
5-бром-N-[1S)(гидроксиметил)пентил]тиофен-2-сульфонамид;
5-бром-N-(2-гидрокси-1,1-диметилэтил)тиофен-2-сульфонамид;
N-[1,1-бис(гидроксиметил)пропил]-5-бромтиофен-2-сульфонамид;
5-бром-N-[1-(гидроксиметил)циклопентил]тиофен-2-сульфонамид;
5-бром-N-[(S)-2-циклогексил-1-(гидроксиметил)этил]тиофен-2-сульфонамид;
5-бром-N-[(S)-1-(гидроксиметил)-3-(метилтио)пропил]тиофен-2-сульфонамид;
5-бром-N-[1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
5-бром-N-[(S)-1-(гидроксиметил)-2,2-диметилпропил]тиофен-2-сульфонамид;
N-[R-2-(бензилтио)-1-(гидроксиметил)этил]-5-бромтиофен-2-сульфонамид;
5-бром-N-(R-2-гидрокси-1-{[(3-метилбензил)тио]метил}этил)тиофен-2-сульфонамид;
N-{(S)-1-[4-(бензилокси)бензил]-2-гидроксиэтил}-5-бромтиофен-2-сульфонамид;
5-бром-N-[(R,R)-2-гидрокси-1-(гидроксиметил)пропил]тиофен-2-сульфонамид;
5-хлор-N-[(S,S)-1-формил-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(S,S)-1-(1-гидроксиэтил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[циклопентил(гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]октил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гептил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гексил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-3-метил-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-3,3-диметил-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-4-метил-1-[(S)-1-метилпропил]пентил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]бут-3-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[(4-фторфенил)(гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[(4-хлорпентил)(гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-4-метил-1-[(S)-1-метилпропил]пент-3-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-3-метил-1-[(S)-1-метилпропил]бут-3-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[гидрокси(4-метоксифенил)метил]-2-метилбутил)тиофен-2-сульфонамид;
5-хлор-N-{(S,Е)-2-гидрокси-3-метил-1-[(S)-1-метилпропил]пент-3-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-4-(1,3-диоксан-2-ил)-2-гидрокси-1-[(S)-1метилпропил]бутил}тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гекс-5-енил}тиофен-2-сульфонамид;
5-хлор-N-((S,S)-1-{гидрокси[4-(метилтио)фенил]метил}-2-метилбутил)тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[[4-(диметиламино)фенил](гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
N-{(S,S)-1-[циклопентил(гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]октил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гептил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гексил}тиофен-2-сульфонамид;
N-{(S,S)-1-[гидрокси(2-метилфенил)метил]-2-метилбутил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-3,3-диметил-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]бут-3-енил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
N-{(S,S)-1-[гидрокси(4-метоксифенил)метил]-2-метилбутил}тиофен-2-сульфонамид;
N-{(S)-4-(1,3-диоксан-2-ил)-2-гидрокси-1-[(S)-1-метилпропил] бутил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]гекс-5-енил}тиофен-2-сульфонамид;
N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]пент-3-енил}тиофен-2-сульфонамид;
N-((S,S)-1-{гидрокси[4-(метилтио)фенил]метил}-2-метилбутил)тиофен-2-сульфонамид;
N-{(S,S)-1-[[4-(диметиламино)фенил](гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
3-хлор-N-{(S,S)-1-[(S)-циклогекс-2-ен-1-ил(гидрокси)метил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S,Е)-2-гидрокси-1-[(S)-1-метилпропил]гекс-4-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S,R,Е)-2-гидрокси-1-[(S)-1-метилпропил]гекс-4-енил}тиофея-2-сульфонамид;
5-хлор-N-{(S,R,Е)-2-гидрокси-1-[(S)-1-метилпропил]гепт-4-енил}тиофен-2-сульфоиамид;
5-хлop-N-{(S,S)-2-гидрокси-4-метил-1-[(S)-1-метилпропил]пвнт-4-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S,R)-2-гидрокси-4-метил-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S,Е)-2-гидрокси-1-[(S)-1-метилпропил]-5-фенилпент-4-енил}тиофен-2-сульфонамид;
5-хлор-N-[(S,S)-1-(1-гидрокси-1-метилэтил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-1-[(S)-1-метилпропил]-2-пентилгептил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[гидрокси(дифенил)метил]-2-метилбутил}тиофен-2-сульфонамид;
N-{(S)-2-аллил-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}-5-хлортиофен-2-сульфонамид;
5-хлор-N-{(S)-2-этил-2-гидрокси-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
N-{(S,S)-1-[бис(4-хлорфенил)(гидрокси)метил]-2-метилбутил}-5-хлортиофен-2-сульфонамид;
5-хлор-N-{(S)-2-гидрокси-2-изопропенил-3-метил-1-[(S)-1-метилпропил]6ут-3-енил}тиофен-2-сульфонамид;
5-хлор-N-((S,S)-1-{гидрокси[бис(4-метоксифенил)]метил}-2-метилбутил)тиофен-2-сульфонамид;
5-хлор-N-{(S,Е)-2-гидрокси-3-метил-2-[(Е)-1-метилпроп-1-енил]-1-[(S)-]-метилпропил]пент-3-енил}тиофен-2-сульфонамид;
N-{(S)-2-бут-3-енил-2-гидрокси-1-[(S)-1-метилпропил]гекс-5-енил}-5-хлортиофен-2-сульфонамид;
5-хлор-N-((S,S)-1-{гидрокси[ди(1-нафтил)]метил}-2-метилбутил)тиофен-2-сульфонамид;
5-бром-N-{(S)-2-этил-2-гидрокси-1-[(S)-1-метилпропил]бутил}тиофен-2-сульфонамид;
5-бром-N-{(S)-2-гидрокси-2-изопропенил-3-метил-1-[(S)-1-метилпропил]бут-3-енил}тиофен-2-сульфонамид;
5-бром-N-{(S,Е)-2-гидрокси-3-метил-2-[(Е)-1-метилпроп-1-енил]-1-[(S)-1-метилпропил]пент-3-енил}тиофен-2-сульфонамид;
5-бром-N-{(S)-2-бут-3-енил-2-гидрокси-1-[(S)-1-метилпропил]гекс-5-енил}тиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)циклогексил]тиофен-2-сульфонамид;
5-хлор-N-[2-(гидроксиметил)бицикло[2.2.1]гепт-2-ил]тиофен-2-сульфонамид;
5-хлор-N-[1-(гидроксиметил)-2,3-дигидро-H-инден-1-ил]тиофен-2-сульфонамид;
5-хлор-N-[2-(гидроксиметил)-2,3-дигидро-H-инден-2-ил]тиофен-2-сульфонамид;
5-бром-N-[1-(гидроксиметил)циклогексил]тиофен-2-сульфонамид;
5-бром-N-[2-(гидроксиметил)бицикло[2,2.1]гепт-2-ил]тиофен-2-сульфонамид;
5-бром-N-[2-(гидроксиметил)-2,3-дигидро-H-инден-2-ил]тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[(S)-1-гидроксиэтил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[R-1-гидроксиэтил]-2-метилбутил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-2-гидрокси-1-[(S)-1-метилпропил]пентил}тиофен-2-сульфонамид;
5-хлор-N-{(S,R)-2-гидрокси-1-[(S)-1-метилпропил]пентил}тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-хлор-N-{(S,R)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-бром-N-{(S,S)-1-[(S)-1-гидроксиэтил]-2-метилбутил}тиофен-2-сульфонамид ;
5-бром-N-((S,S)-1-[R-1-гидроксиэтил]-2-метилбутил}тиофен-2-сульфонамид;
5-бром-N-{(S,S)-2-гидрокси-1-[(S)-1-метилпропил]пентил)тиофен-2-сульфонамид;
5-бром-N-{(S,R)-2-гидрокси-1-[(S)-1-метилпропил]пентил}тиофен-2-сульфонамид;
5-бром-N-{(S,S)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-бром-N-{(S,R)-2-гидрокси-1-[(S)-1-метилпропил]пент-4-енил}тиофен-2-сульфонамид;
5-хлор-N-[(S,S)-2-метил-1-(2,2,2-трифтор-1-гидроксиэтил)бутил]тиофен-2-сульфонамид;
5-хлор-N-[1-(1-гидроксибут-3-енил)циклогексил]тиофен-2-сульфонамид;
5-хлор-N-[1-(1-гидрокси-3-метилбут-3-енил)циклогексил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-метоксициклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-пропоксициклогексил)этил]тиофен-2-сулъфонамид;
N-{(S)-1-[4-(аллилокси)циклогексил]-2-гидроксиэтил}-5-хлортиофен-2-сульфонамид;
N-{(S)-1-[4-(бензилокси)циклогекеил]-2-гидроксиэтил}-5-хлортиофен-2-сульфонамид;
N-[1-ацетил-4-(гидроксиметил)пиперидин-4-ил]-5-хлортиофен-2-сульфонамид;
N-[(1S)-2-бутил-1-(гидроксиметил)гексил]-5-хлор-2-тиофенсульфонамид;
N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-5-иод-2-тиофенсульфонамид;
5-фтор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-2-тиофенсульфонамид;
N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-бензиламиноциклогексил)этил)тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-метиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-этиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-н-пропиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-аллиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-(3-пиридил)метиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-морфолинциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-(4-пиридил)метиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-(2-пиридил)метиламиноциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-(карбоэтоксиметил)аминоциклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-(4-гидроксициклогексил)этил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-этил-1-формилбутил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-этил-1-(1-гидроксиэтил)бутил]тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-этил-1-(1-гидрокси-1-метилэтил)бутил]тиофен-2-сульфонамид;
5-хлор-N-(2-гидрокси-1-тетрагидро-N-тиопиран-4-илэтил)тиофен-2-сульфонамид;
5-хлор-N-[(S)-2-гидрокси-1-пиперидин-4-илэтил]тиофен-2-сульфонамид;
N-[(S)-2-этил-1-(гидроксиметил)бутил]тиофен-2-сульфонамид;
N-[(S)-2-этил-1-(гидроксиметил)бутил]-S-фтортиофен-2-сульфонамид;
5-хлор-N-[(S)-1-(2,3-дигидро-H-инден-2-ил)-2-гидроксиэтил]тиофен-2-сульфонамид;
5-хлор-N-{(S,S)-1-[(Z)-(гидроксимино)метил]-2-метилбутил}тиофен-2-сульфонамид и
5-хлор-N-(S, S)-1-[(E)-(гидроксимино)метил]-2-метилбутил}тиофен-2-сульфонамид.
18. Соединение по п.1, которое является 5-хлор-N-[(1S)-2-этил-1-(гидроксиметил)бутил]тиофен-2-сульфонамидом.
19. Соединение по п.1, где X является О и W, Y и Z являются независимо выбранными из С и СR10.
20. Соединение по п.19, где R6 является галогеном, R4 является S-стереохимическим C1-С6алкилом, R3 является водородом, R5 является водородом и R4 и R2 каждый является водородом.
21. Соединение по п.1, в котором соединение выбирают из группы, состоящей из
N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-2-фурансульфонамида и
5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-2-фурансульфонамида.
22. Соединение по п.1, которое является трет-бутиловым эфиром 4-[1-(5-хлортиофен-2-сульфониламино)-2-гидроксиэтил]пиперидин-1-карбоновой кислоты.
23. Соединение по любому из пп.1-22, в котором фармацевтически приемлемая соль выбрана из группы, состоящей из солей уксусной кислоты, молочной кислоты, лимонной кислоты, винной кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, малоновой кислоты, миндальной кислоты, яблочной кислоты, соляной кислоты, бромисто-водородной кислоты, фосфорной кислоты, азотной кислоты, серной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты и солей оснований и их смесей.
24. Фармацевтическая композиция, полезная для ингибирования процесса продуцирования бета-амилоида, содержащая соединение в соответствии с любым из пп.1-23 и физиологически совместимый носитель.
25. Применение соединения по любому из пп.1-23 или его приемлемой соли для получения лекарственного средства.
26. Применение соединения по любому из пп.1-23 или его приемлемой соли для получения лекарственного средства, полезного для введения млекопитающему для ингибирования процесса продуцирования бета-амилоида.
27. Применение по п.29, где указанное соединение вводят орально или с помощью инъекции.
28. Применение соединения по любому из пп.1-23 или его приемлемой соли при получении лекарственных средств, полезных для введения млекопитающим, при лечении заболевания, выбранного из группы, включающей болезнь Альцгеймера, амилоидоз кровеносных или лимфатических сосудов, церебральный амилоидоз кровеносных или лимфатических сосудов, систематический амилоидоз, наследственное мозговое кровотечение с амилоидозом голландского типа, включая тело миозита и синдром Дауна, где указанное соединение вводят в количестве, достаточном чтобы облегчить симптомы или развитие указанного заболевания.
Текст
009035 Уровень техники Настоящее изобретение относится к получению ингибиторов бета-амилоида, которые полезны при лечении болезни Альцгеймера. Болезнь Альцгеймера (AD) является наиболее общей формой слабоумия (потеря памяти) в пожилом возрасте. Главные патологические нарушения при AD, обнаруженные в головном мозге, включают внеклеточные отложения бета-амилоидного протеина в форме бляшек и агиопатическких и внутриклеточных нейрофибриллярных клубков, сгрупированного в гиперфосфорилированный тау протеин. Недавние исследования показали, что повышенные уровни бета-амилоида в головном мозге не только предшествуют тау патологии, но также связаны с проявляющимся ухудшением здоровья. Кроме того, предполагая причинную роль для бета-амилоида при AD, недавние исследования показали, что агрегированный бетаамилоид токсичен для нейронов в клеточной культуре. Бета-амилоидный протеин состоит в основном из 39-42 аминокислотных пептидов и образуется из предшественника протеина, названного предшественником амилоидного протеина (АРР), с помощью последовательного действия протеазы бета и гамма секретазы. Хотя редко, но случаи раннего начала AD приписывают генетическим мутациям в АРР, что приводит к перепроизводству либо общего количества бета-амилоидного протеина, либо его большей агрегации - изоформы из 42 аминокислот. Кроме того,люди с синдромом Дауна обладают дополнительной хромосомой, содержащей ген, который кодирует АРР и, таким образом, повышает уровни бета-амилоида и неизменно развивает AD позже в процессе старения. Исходя из этого, продолжает существовать непроходящая потребность в композициях, полезных для ингибирования продуцирования бета-амилоида и для эффективного лечения болезни Альцгеймера(AD). Сущность изобретения Настоящее изобретение обеспечивает гетероциклические сульфонамидные производные 2-амино-1 спиртов и соответствующих гомологов, которые, как было обнаружено, специфически ингибируют продуцирование бета-амилоидного протеина из АРР и способны проходить через гематоэнцефалический барьер. Эти соединения применимы для лечения заболеваний, в которых уровни бета-амилоида являются повышенными (например, AD, синдром Дауна). Систематическое введение указанных соединений субъектам, находящимся в группе риска или страдающим от этих заболеваний, снижает уровни бетаамилоидного протеина с последующим снижением токсичных бета-амилоидных агрегатов в головном мозге этих пациентов. В одном аспекте настоящее изобретение обеспечивает соединение формулы (1), как оно определено в описании, его фармацевтически приемлемые соли, его гидраты или его пролекарства. В одном из воплощений соединения формулы (1) являются тиофенсульфонамидами. В другом воплощении соединения формулы (1) являются фурансульфонамидами. Особенно желательными соединениями являются те, которые имеют атом галогена в 5-положении гетероцикла (например, 5-галоген тиофенсульфонамиды) и(-ответвления в боковой цепи первичного спирта. В другом аспекте изобретение обеспечивает фармацевтическую композицию, содержащую одно или более соединений формулы (1) и физиологически приемлемый носитель. В еще другом аспекте изобретение обеспечивает способ ингибирования процесса продуцирования бета-амилоида у субъекта с помощью доставки соединения формулы (1). В следующем аспекте изобретение обеспечивает способ лечения болезни Альцгеймера (AD) у субъекта путем введения соединения формулы (1) в количестве, достаточном для того, чтобы облегчить симптомы или развитие AD. Наиболее предпочтительными соединениями в соответствии с предлагаемым изобретением являются соединения формулы (1) или их фармацевтически приемлемые соли, где формула (1) имеет структуру где R1 и R2 независимо выбирают из группы, состоящей из водорода; C1-С 10 алкила; CF3; С 2-С 8 алкенила; С 2-С 8 алкенила, замещенного фенилом или С 1-С 8 алкилом; C2-С 8 алкинила; С 4-С 10 циклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С 8 алкилом, N(C1-C8 алкилом) или SCH3; нафтанила; циклогексенила и (СН 2)n(1,3)диоксана, где n имеет значение от 2 до 5;R3 выбирают из группы, состоящей из водорода и C1-С 10 алкила;C1-С 10 алкилфуранила; СН(ОН)фенила, замещенного нитро; С 4-С 10 циклоалкила; С 4-С 10 циклоалкила, замещенного группой ОН, O(С 1-С 8 алкил), O(C2-C8 алкенил), OCH2(фенил), OCH2(пиридил), NHCH2(фенил),NH(C1-C8 алкил), NH(C2-C8 алкенилом), морфолина, NH(С 1-С 8 алкил)(пиридин), или NHC(O)O(С 1 С 8 алкил); N-замещенного пиперидинила, замещенного С(O)O(С 1-С 8 алкилом); пиперидинила; тетрагидротиопиранила; 2-инденила; фенила; C1-C10 алкилNHR7; циклогексенила; циклогексенила, замещенного С 1-С 8 алкилом; при условии, что R3 и R4 оба не являются водородом;R7 является C1-С 10 алкилом, С 4-С 10 циклоалкилом, бензилом или C1-С 10 алкилОН; или R3 и R4 могут быть объединены с образованием С 4-С 10 циклоалкила, норборнанила, инденила или пиперидинила, замещенного С(O)(С 1-С 6 алкилом);R6 выбирают из группы, состоящей из водорода и галогенаZ независимо выбирают из группы, состоящей из С, и CR10;R10 выбирают из группы, состоящей из водорода и галогена, при условии, что по крайней мере один из W, Y и Z должен быть С;X выбирают из группы, состоящей из О, S и SO2; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим. Более предпочтительны соединения формулы (1) или их фармацевтически приемлемые соли, в которых формула (1) имеет структуру где R1 и R2 независимо выбирают из группы, состоящей из водорода; C1-C10 алкила; CF3; С 2-С 8 алкенила,С 2-С 8 алкенила, замещенного фенилом или С 1-С 8 алкилом; С 2-С 8 алкинила; С 4-С 10 циклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С 8 алкилом, N(C1-C8 алкилом) или SCH3; нафтанила; циклогексенила; и (СН 2)n(1,3)диоксана, где п имеет значение от 2 до 5;R3 выбирают из группы, состоящей из водорода и C1-C10 алкила;N-замещенного пиперидинила, замещенного С(O)O(С 1-С 8 алкилом); пиперидинила; тетрагидротиопиранила; 2-инденила; фенила; C1-С 10 алкилNHR7; циклогексенила; циклогексенила, замещенного C1 С 8 алкилом; при условии, что R3 и R4 оба не являются водородом;R7 является C1-C10 алкилом, С 4-C10 циклоалкилом, бензилом или С 1-C10 алкилОН,или R3 и R4 могут быть объединены с образованием С 4-C10 циклоалкила, норборнанила, инденила или пиперидинила, замещенного С(O)(С 1-С 6 алкилом);R6 выбирают из группы, состоящей из водорода и галогена; Т являетсяW является С, где W обеспечивает положение присоединения к SO2 группе;R10 выбирают из группы, состоящей из водорода и галогена; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим. Еще более предпочтительны соединения формулы (1) или их фармацевтически приемлемые соли, в которых формула (1) имеет структуру где R1 и R2 независимо выбирают из группы, состоящей из водорода; C1-C10 алкила; CF3; C2-C8 алкенила; С 2-С 8 алкенила, замещенного фенилом или С 1-С 8 алкилом; С 2-С 8 алкинила; С 4-C10 пиклоалкила; фенила; фенила, замещенного галогеном, OCH3, C1-С 8 алкилом, N(C1-C8 алкилом) или SCH3; нафтанила; циклогексенила; и (СН 2)n(1,3)диоксана, где n имеет значение от 2 до 5;R3 выбирают из группы, состоящей из водорода и C1-C10 алкила;R4 выбирают из группы, состоящей из водорода; C1-C10 алкила; C1-C10 алкила, замещенного метокси, бифенилом, гидроксилом и фенилом, замещенным NO2, фенилом, замещенным группой ОСН 2(фенил), SСН 2(фенил),SСН 2(фенил, замещенный C1-С 8 алкилом), ОСН 2(фенил) или S(С 1-С 8 алкил); C1-C10 алкил(C4-C10 циклоалкил); C1C10 алкилОН; C1-C10 алкилпиридила; C1-C10 алкилфуранила; СН(ОН)фенила, замещенного нитро; С 4C10 циклоалкила; С 4-C10 циклоалкила, замещенного группой ОН, O(С 1-С 8 алкил), O(С 2-С 8 алкенил), ОСН 2(фенил),ОСН 2(пиридил), NНСН 2(фенил), NH(C1-C8 алкил), NH(C2-С 8 алкенил), морфолина, NН(С 1-С 8 алкил)(пиридин) илиC1-С 8 алкилом; при условии, что R3 и R4 оба не являются водородом;R7 является C1-C10 алкилом, С 4-C10 циклоалкилом, бензилом или, C1-C10 глкилОН; или R3 и R4 могут быть объединены с образованием С 4-С 10 циклоалкила, норборнанила, инденила или пиперидинила, замещенного C(O)(C1-С 6 алкилом);W является С, где W обеспечивает положение присоединения к SO2 группе;R10 выбирают из группы, состоящей из водорода и галогена; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим. Одним из аспектов изобретения является соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуруW, Y и Z являются С, где W обеспечивает положение присоединения к SO2 группе. Еще одним из аспектов изобретения является соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуруR6 является водородом или галогеном; Т являетсяW, Y и Z являются С, W обеспечивает положение присоединения к SO2 группе. Следующим аспектом изобретения является соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуру где R3 выбирают из группы, состоящей из водорода и C1-С 8 алкила;R4 выбирают из группы, состоящей из водорода и C1-С 8 алкила; при условии, что R3 и R4 оба не являются водородом;W, Y и Z независимо выбирают из группы, состоящей из С и CR10;R10 представляет собой водород, при условии, что по крайней мере один из W, Y и Z должен бытьX представляет собой S; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим. Еще одним аспектом изобретения является соединение формулы (1) или его фармацевтически приемлемая соль, где формула (1) имеет структуруR3 выбирают из группы, состоящей из водорода и C1-С 8 алкила;R4 выбирают из группы, состоящей из водорода и C1-С 8 алкила; при условии, что R3 и R4 оба не являются водородом;W, Y и Z независимо выбирают из группы, состоящей из С и CR10;R10 представляет собой водород, при условии, что по крайней мере один из W, Y и Z должен бытьX представляет собой S; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере,один из хиральных центров должен быть S-стереохимическим. Предпочтительно соединение по изобретению, в котором R6 является галогеном. Более предпочтительно соединение, в котором R6 является хлором или бромом. Предпочтительно соединение, в котором Т является C(OH)R1R2, и R1 и R2 каждый является водородом, а оба W и Z являются С. Предпочтительно соединение, в котором R4 является S-стереохимическим С 1-С 6 алкилом. Также предпочтительно соединение, в котором X является S, W является С, Z является С, R6 является галогеном, R4 является S-стереохимическим С 1-С 6 алкилом, R3 является водородом, R5 является водородом и R1 и R2 каждый является водородом. Предпочтительно соединение, в котором R3CR4 является циклогексилом или пиперидином, замещенным С(O)(С 1-С 6 алкилом), а X является S. Наиболее предпочтительными являются соединения, выбираемые из группы, состоящей из 3-бром-5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид; 5-бром-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид; 4-бром-5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид; 5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид; 2,5-дихлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-3-сульфонамид; 4,5-дихлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид;N-[(S)-2-этил-1-(гидроксиметил)бутил]-S-фтортиофен-2-сульфонамид; 5-хлор-N-[(S)-1-(2,3-дигидро-H-инден-2-ил)-2-гидроксиэтил]тиофен-2-сульфонамид; 5-хлор-N-(S,S)-1-[(Z)-(гидроксимино)метил]-2-метилбутилтиофен-2-сульфонамид и 5-хлор-N-(S,S)-1-[(E)-(гидроксимино)метил]-2-метилбутилтиофен-2-сульфонамид. Предпочтительным соединением по изобретению является 5-хлор-N-[(1S)-2-этил-1(гидроксиметил)бутил]тиофен-2-сульфонамидом. И наконец, предпочтительно соединение по изобретению, в котором X является О и W, Y и Z являются независимо выбранными из С и CR10, a R6 является галогеном, R4 является S-стереохимическим C1 С 6 алкилом, R3 является водородом, R5 является водородом и R1 и R2 каждый является водородом. Кроме того, полезными соединениями по изобретению, являются соединения, которые выбирают из группы, состоящей из N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-2-фурансульфонамида и 5-хлор-N[(1S,2S)-1-(гидроксиметил)-2-метилбутил]-2-фурансульфонамида, трет-бутилового эфира 4-[1-(5 хлортиофен-2-сульфониламино)-2-гидроксиэтил]пиперидин-1-карбоновой кислоты. Предпочтительными фармацевтически приемлемыми солями являются фармацевтически приемлемые соли, выбранные из группы, состоящей из солей уксусной кислоты, молочной кислоты, лимонной кислоты, винной кислоты, янтарной кислоты, фумаровой кислоты, малеиновой кислоты, малоновой кислоты, миндальной кислоты, яблочной кислоты, соляной кислоты, бромисто-водородной кислоты, фосфорной кислоты, азотной кислоты, серной кислоты, метансульфоновой кислоты, толуолсульфоновой кислоты и солей оснований и их смесей. Еще одним объект изобретения является фармацевтическая композиция, полезная для ингибирования процесса продуцирования бета-амилоида, содержащая соединение по изобретению и физиологически совместимый носитель. Следующим объектом изобретения является применение соединения по изобретению или его приемлемой соли для получения лекарственного средства. Кроме того, объектом изобретения является применение соединения по по изобретению или его приемлемой соли для получения лекарственного средства, полезного для введения млекопитающему для ингибирования процесса продуцирования бета-амилоида, где указанное введение осуществляют орально или с помощью инъекции. Еще одним объектом изобретения является применение соединения по изобретению или его приемлемой соли при получении лекарственных средств, полезных для введения млекопитающим, при лечении заболевания, выбранного из группы, включающей болезнь Альцгеймера, амилоидоз кровеносных или лимфатических сосудов, церебральный амилоидоз кровеносных или лимфатических сосудов, систематический амилоидоз, наследственное мозговое кровотечение с амилоидозом голландского типа, включая тело миозита и синдром Дауна, где указанное соединение вводят в количестве, достаточном чтобы облегчить симптомы или развитие указанного заболевания. Эти и другие аспекты настоящего изобретения станут очевидными для специалиста в данной области знаний при чтении следующего детального описания изобретения. Детальное описание изобретения Изобретение относится к соединениям формулы (I), их фармацевтическим композициям и их применению для модулирования продуцирования бета-амилоида у субъектов, находящихся в группе риска или страдающих от AD или других заболеваний, вызванных повышением уровней бета-амилоидного протеина в головном мозге. Соединения формулы (I) включают фармацевтически приемлемые соли и/или гидраты, или их пролекарства, гдеR1 и R2 являются независимо выбранными из группы, состоящей из водорода, алкила, замещенного алкила, CF3, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, фенила, замещенного фенила и (СН 2)n(1,3)диоксана, где n имеет значение от 2 до 5;R4 выбирают из группы, состоящей из водорода, алкила, замещенного алкила, алкилциклоалкила,замещенного алкилциклоалкила, фенил(замещенного)алкила, алкилОН, замещенного алкилОН,алкилOBn, замещенного алкилOBn, алкилпиридила, замещенного алкилпиридила, алкилфуранила, замещенного алкилфуранила, СН(ОН)фенила, СН(ОН)замещенного фенила, алкенила, замещенного алкенила, циклоалкила, замещенного циклоалкила, N-замещенного пиперидинила, пиперидинила, замещенного пиперидинила, тетрагидротиопирана, замещенного тетрагидротиопирана, 2-индана, замещенного 2 индана, фенила, замещенного фенила, алкилNHR7 и замещенного aлкилNHR7; при условии, что R3 и R4 не являются оба водородом;R7 является алкилом, замещенным алкилом, циклоалкилом, замещенным циклоалкилом, бензилом,замещенным бензилом, алкилОН, замещенным алкилОН, алкилSR8 или замещенным алкил SR8;R8 является алкилом, замещенным алкилом, бензилом или замещенным бензилом; или R3 и R4 могут быть объединены с образованием кольца;R9 является низшим алкилом, замещенным низшим алкилом, фенилом или замещенным фенилом;W, Y и Z являются независимо выбранными из группы, состоящей из С, CR10 и N;R10 выбирают из группы, состоящей из водорода и галогена, при условии, что по крайней мере один из W, Y и Z должен быть С;R11 выбирают из группы, состоящей из водорода, низшего алкила, замещенного низшего алкила,бензила, замещенного бензила, фенила и замещенного фенила; при условии, что когда соединение содержит один или более хиральных центров, по крайней мере один из хиральных центров должен быть S-стереохимическим. Точка присоединения W-X-Y-Z-C гетероциклического кольца к SO2 группе не является ограничением настоящего изобретения. Однако в одном из предпочтительных воплощений кольцо присоединяется к SO2 группе через атом углерода. Тем не менее, кольцо может быть присоединено через О, S или N гетероатомы. Соединения в соответствии с изобретением могут содержать один или более асимметричных атомов углерода, и некоторые из соединений могут содержать один или более асимметричных (хиральных) центров и, таким образом, могут приводить к появлению оптических изомеров и диастреомеров. Как показано без учета стереохимии в формуле (I), когда соединения формулы (I) содержат один или более хиральных центров по крайней мере один из хиральных центров имеет S-стереохимию. Наиболее предпочтительно, чтобы атом углерода, к которому присоединяют N, T, R3 и R4, имел S-стереохимию. Таким образом, изобретение включает определенные оптические изомеры и диастреомеры, а также рацемические и разделенные, энантиомерно чистые стереоизомеры, а также другие смеси R и S стереоизомеров и их фармацевтически приемлемые соли, гидраты и пролекарства. Термин "алкил", как его используют в настоящем изобретении, относится к обеим как нормальным,так и разветвленным цепям насыщенных алифатических углеводродных групп, имеющих от одного до десяти атомов углерода, предпочтительно от одного до восьми атомов углерода и, наиболее предпочтительно, от одного до шести атомов углерода; использование здесь термина "низший алкил" относится к нормальной и разветвленной цепи насыщенных алифатических углеводородных групп, имеющих от одного до шести атомов углерода; "алкенил", как предполагается, включает и нормальную, и разветвленную цепь алкильных групп по крайней мере с одной углерод-углеродной двойной связью и содержащей- 10009035 от двух до восьми атомов углерода, предпочтительно от двух до шести атомов углерода; "алкинильная" группа, как предполагается, охватывает и нормальную, и разветвленную цепь алкильных групп по крайней мере с одной углерод-углеродной тройной связью и содержащей от двух до восьми атомов углерода,предпочтительно от двух до шести атомов углерода. Термины "замещенный алкил", "замещенный алкенил" и "замещенный алкинил" относятся к алкилу, алкенилу и алкинилу, как это только что было описано, имеющим от одного до трех заместителей,выбранных из группы, включающей галоген, CN, ОН, NO2, амино, арил, гетероцикл, замещенный арил,замещенный гетероцикл, алкокси, замещенный алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино, арилтио. Указанные заместители могут быть присоединены к любому атому углерода алкильной, алкенильной или алкинильной групп при условии, что присоединение приводит к появлению устойчивой химической молекулы. Термин "арил", используемый в настоящем изобретении, относится к карбоциклической ароматической системе, которая может представлять собой одно кольцо или множество ароматических колец, конденсированных или связанных вместе так, что по крайней мере одна часть конденсированных или связанных колец образует сопряженную ароматическую систему. Арильные группы включают, но не ограничиваются, фенилом, нафтинилом, бифенилом, антрилом, тетрагидронафтилом, фенантрилом и инданом Термин "замещенный арил" относится к арилу, как это уже описано, имеющему от одного до четырех заместителей из группы, включающей галоген, CN, ОН, NO2, амин, алкил, циклоалкил, алкенил, алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил, алкилкарбокси, алкиламино и арилтио. Термин "замещенный бензил" относится к бензильной группе, имеющей заместители в бензольном кольце, от одного до пяти заместителей, выбранных из группы, включающей галоген, CN, ОН, NO2, амино, алкил, циклоалкил, алкенил, алкинил, алкокси, арилокси, замещенный алкилокси, алкилкарбонил,алкилкарбокси, алкиламино и арилтио. Термин "гетероцикл", используемый в настоящем изобретении, относится к устойчивому от 4 до 7 членному моноциклическому или устойчивому полициклическому гетероциклическому кольцу, которое является насыщенным, частично ненасыщенным или ненасыщенным и которое состоит из атомов углерода и от одного до четырех гетероатомов, выбранных из группы, включающей N, О, и S атомы. АтомыN и S могут быть окислены. Гетероциклическое кольцо также включает любое полициклическое кольцо,в котором любое из описанных выше гетероциклических колец сконденсировано с ароматическим кольцом. Гетероциклическое кольцо может быть присоединено к любому гетероатому или атому углерода при условии, что получают химически устойчивую структуру. Такие гетероциклические группы включают, например, тетрагидрофуран, пиперидинил, пиперазинил, 2-оксопиперидинил, азепинил, пирролидинил, имидазолил, пиридил, пиразинил, пиримидинил, пиридазинил, оксазолил, изоксазолил, морфолинил, индолил, хинолинил, тиенил, фурил, бензофуранил, бензотиенил, тиаморфолинил, сульфоксид тиаморфолинила, изохинолинил и тетрагидротиопиран. Термин "замещенный гетероцикл", используемый в настоящем изобретении, относится к гетероциклу, как это уже описано, имеющему от одного до четырех заместителей, выбранных из группы,включающей галоген, CN, ОН, NO2, амино, алкил, замещенный алкил, циклоалкил, замещенный циклоалкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, алкокси, замещенный алкокси,арилокси, замещенный арилокси, алкилокси, замещенный алкилокси, алкилкарбонил, замещенный алкилкарбонил, алкилкарбокси, замещенный алкилкарбокси, алкиламин, замещенный алкиламин, арилтио или замещенный арилтио. Термин "замещенный циклоалкил", используемый в настоящем изобретении, относится к углеродсодержащему кольцу, содержащему более, чем 3 атома углерода, которые образуют устойчивое кольцо и имеют от одного до пяти заместителей, выбранных из группы, состоящей из галогена, CN, ОН, NO2,амино, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, алкокси, арилокси, замещенного алкилокси, алкилкарбонила, алкилкарбокси, алкиламино, замещенного алкиламино, арилтио,гетероцикла, замещенного гетероцикла, аминоалкила и замещенного аминоалкила. Там, где приведены термины "замещенный алкилциклоалкил", "замещенный алкилOBn", "замещенный алкилпиридил", "замещенный алкилфуранил", "замещенный алкилNHR7, "замещенный алкилОН" и "замещенный алкилSR8", замещение может быть проведено по алкильной группе или на соответствующем основном соединении. Как используется при определении R4 группы, N-замещенная пиперидинильная группа может быть определена как замещенные гетероциклические группы. Среди особенно желательных заместителей находятся N-алкил-, N-арил-, N-ацил- и N-сульфонилпиперидинильные группы. Одной из особенно подходящих N-ацилпиперидинильных групп является N-трет-бутоксикарбонил (ВОС)пиперидин. Однако другие подходящие заместители могут быть легко подобраны средним специалистом в данной области. Термин "алкокси", используемый в настоящем изобретении, относится к группе OR, где R является алкилом или замещенным алкилом. Термин "арилокси", используемый в настоящем изобретении, относится к группе OR, где R является арилом или замещенным арилом. Термин "алкилкарбонил", исполь- 11009035 зуемый в настоящем изобретении, относится к группе RCO, где R является алкилом или замещенным алкилом. Термин "алкилкарбокси", используемый в настоящем изобретении, относится к группе COOR,где R является алкилом или замещенным алкилом. Термин "аминоалкил" относится к обоим вторичному и третичному аминам, где алкильная или замещенная алкильная группы, содержащие от одного до восьми атомов углерода, могут быть одинаковыми или различными, и точка присоединения находится на атоме азота. Термин "галоген" относится к Cl, Br, F, или I. Термин "кольцевая" структура, например, когда R3 и R4 могут образовывать кольцевую структуру,включает моноциклическую структуру, мостиковую циклическую структуру и конденсированные циклические структуры, если тип кольцевой структуры не является иначе определенным. Соединения настоящего изобретения могут быть использованы в форме солей, полученных из фармацевтически или физиологически приемлемых кислот или оснований. Указанные соли включают, но не ограничиваются, солями с органическими и неорганическими кислотами, такими как уксусная, молочная, лимонная, винная, янтарная, фумаровая, малеиновая, малоновая, миндальная, яблочная, соляная,бромистоводородная, фосфорная, азотная, серная, метансульфоновая, толуолсульфоновая и подобными известными приемлемыми кислотами и их смесями. Другие соли включают соли со щелочными металлами или щелочно-земельными металлами, такими как натрий (например, гидроксид натрия), калий (например, гидроксид калия), кальций или магниий. Указанные соли, также как другие соединения изобретения, могут быть в форме эфиров, карбаматов и других обычных "пролекарственных" формах, которые,когда их вводят в такой форме, превращаются в активное начало in vivo. В особенно предпочтительном воплощении изобретения пролекарствами являются эфиры. См., например, В. Testa and J. Caldwell, "Prodrugs Revisited: The "Ad Hoc" Approach as a Complement to Ligand Design", Medicinal Research Reviews,16(3):233-241, ed., John Wiley Sons (1996). В одном особенно желательном воплощении изобретения соединениями формулы (I) являются тиофенсульфонамиды и, более желательно, 5-галогентиофенсульфонамиды и, наиболее желательно, 5 галогентиофенсульфонамиды с -ответвлениями в боковой цепи первичного спирта. Исходя из формулы(I), соединения по изобретению желательно имеют структуру, в которой X является S, W является С (илиCR10), Y является С (или CR10) и Z является С (или CR10), а сульфонамид присоединен к C2 тиофенового кольца. Более желательно, когда X является S, W является С (или CR10), Y является С (или CR10), Z является С (или CR10) и R6 является галогеном. Наиболее желательно, когда X является S, X является С, W является С, Y является С, Z является С, R6 является галогеном и Т является C(OH)R1R2, где R1 и R2 являются водородом, R3 является Н, R4 является низшим S-стереохимическим алкилом и R5 является Н. В предварительно проведенных анализах скрининга in vitro и in vivo были найдены соединения указанных структур, которые имеют неожиданно хорошую бета-амилоидную ингибирующую активность и, в большинстве случаев, более высокую активность, чем активность соединений формулы (I), имеющих другие гетероциклы (например, фураны, где X является О). Тем не менее, другие такие соединения формулы (I) также являются полезными для целей, описанных здесь. Например, в другом воплощении изобретения соединения формулы (I) являются фурансульфонамидами, в которых X является О, W является С, Y является С и Z является С. В одном особенно желательном воплощении фурансульфонамиды формулы (I), кроме того, характеризуются наличием ответвлений в боковой цепи первичного спирта. Так, исходя из формулы (I), в этих соединениях Т является C(OH)R1R2, где R1 и R2 являются водородом, R3 является Н, R4 является низшим Sстереохимическим алкилом, R5 является Н и R6 является галогеном. В еще одном воплощении изобретения соединения формулы (I) характеризуются тем, что они являются сульфонамидами формулы (I), которые имеют -ответвления в боковой цепи первичной спиртовой группы. Так, исходя из формулы (I), в этих соединениях Т является C(OH)R1R2, R1 и R2 являются водородом, R3 является Н, R4 является низшим S-стереохимическим алкилом и R5 является Н. Эти и другие соединения изобретения могут быть получены в соответствии со следующими нижеприведенными схемами. Синтез Соединения настоящего изобретение могут быть получены различными путями, хорошо известными специалистам в области органического синтеза. Соединения настоящего изобретения могут быть получены, используя способы, описанные ниже, вместе со способами синтеза, известными в области органичекого синтеза, или их модификациями, известными в данной области. (См., вообще, ComprehensiveCompounds", ed. J.F. Stoddard, Pergamon Press, New York (1979. Предпочтительные способы включают,но не ограничиваются тем, что показано ниже. Первый способ получения включает взаимодействие 2-аминоспирта II с соответствующим сульфонилгалоидом в присутствии основания, такого как триэтиламин (TEA), и в подходящем растворителе с образованием соединения формулы III. Для соединений, где R2 и R2 являются водородом, окисление N- 12009035 сульфонильного первичного спирта с помощью хлорхромата пиридиния (РСС) или в условиях Сверна(Swern) затем приводит к альдегиду IV, который может вступить в реакцию с реактивами Гриньяра(RMgX, где R является органическим радикалом и X является галогеном), чтобы получить вторичные спирты V в виде смеси диастреомеров, которые могут быть разделены с помощью высокоэффективной жидкостной хроматографии (HPLC) (схема 1). Схема 1 Второй способ получения включает взаимодействие -аминокислоты или эфира IX с подходящим сульфонилгалоидом в присутствии основания, такого как триэтиламин, и в подходящем растворителе,чтобы получить соединения формулы X (схема 2). Промежуточная N-сульфонильная кислота X (Rx=H) может быть переведена в соответствующий первичный спирт VIII (R1=R2=H), используя стандартную методику, такую как использующую LiAlH4, B2H6 или цианурхлорид/NaВН 4. Промежуточный Nсульфонильный эфир X (Rx=алкил, Bn) может также быть восстановлен до соответствующего первичного спирта VIII (R1=R2=H), используя стандартную методику, такую как использующую LiAlH4. Альтернативно промежуточный N-сульфонильный эфир X (Rx=алкил, Bn) может быть превращен в альдегид IV с помощью DiBAL. Наконец, промежуточный N-сульфонильный эфир X (Rx=алкил, Bn) может вступить в реакцию с 2 эквивалентами реактива Гриньяра, чтобы получить третичные спирты III с R1=R2. Альтернативно для третичных спиртов III с R1, не являющимся одинаковым с R2, соответствующий амид Вайнреба (Weinreb) (см. схему 10) N-сульфонильной кислоты может быть получен и последовательно обработан R1MgX и R2MgX. Для соединений формулы X (Rx=H), которые имеют асимметричный центр на атоме углерода -аминокислоты, чистые энантиомеры могут быть получены с помощью стандартных способов разделения, включающих перекристаллизацию солей, образованных с различными хиральными основаниями. Схема 2- 13009035 При модификации второго способа получения первичных спиртов -аминокислоту или эфир (или его Nзащищенное производное) VI вначале переводят в соответствующий первичный 2-аминоспирт VII (используя методику, раскрытую в предыдущем параграфе), который последовательно, после снятия защиты (если необходимо), вступает в реакцию с соответствующим сульфонилгалоидом (схема 3), чтобы получить соединения формулы VIII. Для получения соединений производных неприродных а-аминокислот, содержащих бета разветвление в боковой цепи аминокислоты, указанный способ получения, основыванный на работе Hruby (Tet. Lett. 38: 5135-5138 (1997) приведен на схеме 4. Этот путь приводит к формированию ,-ненасыщенного амида XII с дополнительной хиральностью по Эвансу из ,-ненасыщенной кислоты XI с последующим введением органокупрата, улавливанием полученного енолятного аниона XIII с помощью NBS, замещения брома в XIV на анион азида (за счет азида тетраметилгуанидиния (TMGA), чтобы получить XV, с последующим восстановлением до 2-аминоспирта и последующего сульфонилирования, чтобы получить целевое соединение XVI. В схемах от 1 до 4 R5 является Н. Схема 3 Для получения N-алкилированных сульфонамидов VIII (R5=алкил и так далее) сульфонамидный эфир XVII может быть N-алкилирован либо путем обработки подходящим основанием, таким как карбонат калия, а затем алкилирующим агентом R5X, либо обработкой по Митсунобоу (R5OH/DEAD, TPP). Восстановление с помощью LiBH4 N-алкилированного сульфонамидного эфира дает N-алкилированный сульфонамид в серии первичных спиртов VIII (схема 5). Указанные первичные спирты VIII могут быть преобразованы во вторичные спирты V или альдегиды IV с помощью химических процессов, которые были показаны выше. Альтернативно N-алкилированные сульфонамидные эфиры или их соответствующие амиды Вайнреба могут быть обработаны реагентами Гриньяра, чтобы получить N-алкилированные третичные спирты III. Когда гетероциклом, присоединенным к сульфонамиду в указанных выше спиртах, является тиофен, соответствующее сульфоновое производное XIX может быть получено с помощью окисления тиофенового производного XVIII с МСРВА (схема 6). Схема 6 При альтернативном получении сульфонамидов исходят из природных 2-аминоспиртов, используя модификацию Бюхерера (Bucherer) синтеза -аминокислоты по Стрекеру (Strecker) (схема 7). В этом случае альдегид XX вступает в реакцию с цианистым анионом и карбонатом аммония, чтобы получить гидантоин XXI, который гидролизируется до -аминокислоты XXII. Это соединение затем восстанавливают до XXIII и сульфонилируют, чтобы получить желаемые соединения формулы XXIV. Схема 7 Для получения сульфонамидов из 2-аминоспиртов, содержащих N или О гетероатом в боковой цепи, был разработан путь, исходя от D-серина (схема 8). В этом случае D-серин XXV сначала сульфонилируют до XXVI Схема 8 а затем последовательно преобразуют в кетон XXVII, который подвергают восстановительному амини- 15009035 рованию, чтобы получить целевые соединения формулы XXVIII. Для получения сульфонамидов из 2-аминоспиртов в сериях вторичного спирта, где R1=H и R2=CF3(соединение XXIX), была разработана схема синтеза, исходя из альдегида IV (полученного, как указано на схеме 1). Схема 9 Как было упомянуто в разделе, описывающем схему 1, получение сульфонамидов, исходя из 2 аминоспиртов, в сериях вторичного спирта V приводит к формированию диастереомерной смеси. Альтернативный способ получения указанных соединений, который приводит к получению чистого диастереомера, показан на схеме 10 для соединений, исходя из L-изолейцина. Этот способ, который использует химические процессы, ранее используемые Роуксом (Tetrahedron 50: 5345-5360 (1994), состоит в добавлении реагентов Гриньяра к амиду Вайнреба XXX (производного необходимой -аминокислоты) с последующим стереоспецифическим восстановлением кетона XXXI, чтобы получить единственный диастреомерный N-защищенный 2-аминоспирт XXXII. Снятие защиты с этого соединения, а затем реакция с сульфонилхлоридами дают чистые диастереомерные сульфонамидные вторичные спирты формулы Когда гетероциклом, связанным с сульфонамидом в указанных выше спиртах, является тиофен, соответствующие 5-иод- и 5-фтортиофеновые производные могут быть получены с помощью превращения 5-бромтиофенового производного XXXIV (полученного в соответствии со схемой 1) в промежуточное производное 5-триалкилтиофен олова XXXV, которое может быть преобразовано либо в 5-иодтиофен(XXXVII) путем обработки иодидом натрия и хлорамином Т или аналогом 5-фтортиофена (XXXVI) путем обработки с помощью SELECTFLUOR (Aldrich Chemical Со) (схема 11). Сульфонамиды, полученные из циклогексилглицинола, замещенного с помощью алкокси и аминогрупп в 4-положении циклогексанового кольца, могут быть получены в соответствии с способами, описанными в настоящем изобретении (схема 12). Этот путь использует начальную гидрогенизацию 4-Lгидроксифенилглицина XXXVIII с последующим сульфонилированием, восстановлением карбоновой кислоты с помощью диборана и образованием N,O-ацетонида XXXIX. 4-Гидроксиацетонид XXXIX затем O-алкилируют, используя гидрид натрия и алкилирующий агент, такой как алкилбромид или бензилбромид. Этот процесс сопровождается удалением защитной группы путем обработки водным раствором кислоты, чтобы получить 4-эфирные производные формулы ХХХХ. Альтернативно 4-гидроксиацетонидXXXIX может быть окислен до 4-кетона, который может быть восстановительно аминирован с последующим снятием защиты, чтобы получить соответствующие 4-аминоаналоги формулы XXXXI. Другой способ получения хирально чистых N-сульфонил-2-аминоспиртов, полученных из аминокислот, приведен на схеме 13. Этот способ включает формирование дополнительной хиральности оксазолидона Эванса (Evans) XXXXIII из ХХХХII, который затем преобразуют в соответствующий енолят и электрофильно аминируют с помощью тритилазида, чтобы получить ключевое промежуточное соединение XXXXIV (J. Am. Chem. Soc. 109: 6881-6883 (1987). Промежуточный азид соединение XXXXIV затем гидролизуют до -азидокислоты XXXXV и восстановливают до хирально чистой -аминокислотыXXXXVI, которая может быть преобразована в соответствующие N-сульфонил-2-аминоспирты с помощью ранее описанных выше способов (например, схема 2). Схема 13 Наконец, хирально чистые -аминокислоты XXXXVI как один из возможных синтетических пред- 17009035 шественников хиральных N-сульфонил-2-аминоспиртов, упомянутых выше, могут быть также получены,используя асимметричный вариант синтеза -аминокислоты по Стрекеру, как показано на схеме 14 (J. Оксимы XXXXXIV могут быть получены из соответствующих альдегидов IV по стандартной методике, как приведено на схеме 15. Схема 15 Способы применения Соединения формулы (I) являются ингибиторами продуцирования бета-амилоида. В предварительных исследованиях, используя специфические опыты с протеазой, было показано, что ряд соединений формулы (I) демонстрирует специфическое ингибирование в отношении активности протеазы. Таким образом, соединения настоящего изобретения применимы для лечения и профилактики разнообразных заболеваний, в которых модулирование уровней бета-амилоида обеспечивает терапевтический эффект. Такие заболевания включают среди других, например, амилоидную вазопатию, мозговую амилоидную вазопатию, системный амилоидоз, болезнь Альцгеймера (AD), наследственное мозговое кровотечение с амилоидозом голландского типа, включение тела миозита, синдром Дауна. Кроме того, соединения формулы (I) могут быть применимы для получения реагентов, полезных при диагностике заболеваний, связанных с патологическими уровнями бета-амилоида. Например, соединения формулы (I) могут быть применимы для генирирования антител, которые были бы полезны в ряде диагностических тестов. Способы для генерирования моноклональных, поликлональных, рекомбинантных и синтетических антител или их фрагментов известны, как таковые, из уровня техники. (Смотри,например, Е. Mark and Padlin, "Humanization of Monoclonal Antibodies", Chapter 4, The Handbook of Experimental Pharmacology, Vol. 113, The Pharmacology of Monoclonal Antibodies, Springer-Verlag (June,1994); Kohler и Milstein и многие известные их модификации; PCT/GB85/00392; GB2188638A; Amit et al.,Science, 233:747-753 (1986); Queen et al., Proc. Natl Acad. Sci USA, 86:10029-10033 (1989); WO90/07861 иRiechmann et al., Nature, 332:323-327 (1988); Huse et al., Science, 246:1275-1281 (1988).). Альтернативно соединения формулы (I) могут самостоятельно использоваться в таких диагностических тестах. Независимо от выбранного реактива (например, антитело или соединение формулы (I), пригодные диагностические форматы, включая, например, радиоиммуноанализы и связанные с иммуносорбентом анализ с иммуномобилизованными ферментами (ELISAs), являются известными, как таковые, из уровня техники и не ограничены этим воплощением настоящего изобретения. Ингибирующая активность в отношении бета-амилоида многих соединений настоящего изобретения была определена при использовании репрессорного теста по высвобождению (Represser Release анализ (RRA); см. табл. 23 ниже). Состав считают активным в RRA, если это ведет по крайней мере к 1,5 разовому увеличению луциферазной активности в 20 мкМ и является нетоксичным. Дополнительно клеточные, внеклеточные и in vivo способы скрининга для обнаружения ингибиторов продуцирования бета-амилоида являются известными в данной области. Такие тесты могут включать, среди других, радиоиммунные анализы и связанный с иммуносорбентом с иммуномобилизованным ферментом анализ (ELISA). Смотри, например, P.D. Mehta, et al., Techniques in Diagnostic Pathology, vol. 2, eds., Bullock et al., Academic Press, Boston, pages 99-112 (1991), WO 98/22493, EP 0652009, US 5703129and US 5593846. Выбор соответствующих проводимых in vitro или in vivo опытов по скринингу не огра- 18009035 ничивает настоящее изобретение. Фармацевтические составы Соединения настоящего изобретения могут быть введены субъекту любым желательным путем,учитывая специфическое состояние, для которого оно было отобрано. В качестве субъекта подразумевается любое подходящее млекопитающее, включая людей, домашних животных (например, собак и кошек) и крупный рогатый скот, которые были определены в качестве группы риска одного или более заболеваний, для которых модулирование уровней бета-амилоида является желательным. Таким образом,соединения настоящего изобретения применимы для лечения и/или профилактики ряда заболеваний человека и животных. Как подразумевается здесь, "профилактика" охватывает профилактику симптомов у субъекта, который был идентифицирован как находящийся в группе риска, но еще не был тождественно диагностирован и/или у которого еще не присутствуют никакие симптомы заболеваний. Эти соединения могут быть доставлены или введены с помощью любого подходящего способа доставки, например, среди других, орально, внутривенно, подкожно, внутримышечно, подъязычно, внутричерепно, эпидурально, эндотрахеально, ректально, влагалищно. Максимально желательно, чтобы соединения были введены орально или с помощью подходящего парентерального пути. Соединения могут быть сформированы в составы с обычными фармацевтическими носителями, которые являются физиологически совместимыми. Необязательно, чтобы одно или более соединений по изобретению были смешаны с другими активными агентами. Подходящие физиологически совместимые носители могут быть легко выбраны специалистом в данной области. Например, пригодные твердые носители включают, среди других, одно или более веществ, которые могут также вести себя как смазки, солюбилизаторы, суспендирующие агенты, наполнители, разжижители, компрессионные средства, связующие компоненты или разрыхлители или инкапсулирующий материал. В порошках носитель является мелко раздробленным твердым веществом, которое находится в смеси с мелко раздробленным активным компонентом. В таблетках активный ингредиент смешан с носителем, имеющим необходимые компрессионные свойства в подходящих пропорциях и сформирован в желаемые форму и размер. Порошки и таблетки предпочтительно содержат вплоть до 99% активного ингредиента. Подходящие твердые носители включают, например, крахмал, сахар (включая, например, лактозу и сахарозу), дикальций фосфат, целлюлозу (включая, например, микрокристаллическую целлюлозу, метилцеллюлозу, натрий карбоксиметилцеллюлозу) и каолин. Жидкие носители могут быть использованы для приготовления растворов, суспензий, эмульсий,сиропов и эликсиров. Активный ингредиент по настоящему изобретению может быть растворен или суспендирован в фармацевтически приемлемом жидком носителе, таком как вода, органический растворитель, их смеси или в фармацевтически приемлемых маслах или жире. Жидкий носитель может содержать другие подходящие фармацевтические добавки, такие как солюбилизаторы, эмульгаторы, буферы, суспендирующие агенты, уплотняющие агенты, регуляторы вязкости, стабилизаторы или осморегуляторы. Подходящие примеры жидких носителей для орального и парентерального введения включают воду(особенно, содержащую добавки, указанные выше, например, производные целлюлозы, предпочтительно раствор карбоксиметилцеллюлозы натрия), спирты (включая одноатомные спирты и многоатомные спирты, например, гликоли) и их производные и масла (например, перегнанное кокосовое масло, арахисовое масло, зерновое масло, масло земляного ореха и кунжутное масло). Для парентерального введения носитель может также быть масляным эфиром, таким как этилолеат и изопропилмиристат. Стерильными жидкими носителями являются применяемые в стерильной жидкой форме составы для парентерального введения. Необязательно добавки, обычно используемые при приготовлении фармацевтических составов, могут быть включены в композиции по изобретению. Такие добавки включают, например, подслащивающие вещества или другие придающие вкус агенты, пигменты, консервирующие средства и антиоксиданты, например, витамин Е, аскорбиновую кислоту, ВНТ и ВНА. Жидкие фармацевтические композиции, которые являются стерильными растворами или суспензиями, могут использоваться, например, внутримышечно, интраперитонеально или через подкожную инъекцию. Стерильные растворы могут также применяться внутривенно. Оральное введение может быть в виде любой жидкой или твердой композиции. Предпочтительно фармацевтическая композиция находится в форме дозированной единицы, например, таблетки или капсулы. В такой форме композиция разделена на унифицированные дозы, содержащие адекватные количества активного ингредиента; дозированной единицей могут быть упакованные составы, например, упакованные порошки, пузырьки, ампулы, шприцы с наполнителем или пакетики,содержащие жидкости. Формой дозированной единицы может быть, например, непосредственно капсула или таблетка или это может быть адекватное количество любых таких упакованных форм. Как описано в настоящем изобретении, терапевтически или профилактически полезным количеством соединения по изобретению является такое количество соединения, которое облегчает симптомы болезни, например, AD или которое предотвращает появление симптомов или проявление более тяжелых симптомов. Вообще, индивидуальная доза (то есть, в единице, например, в таблетке) соединения по изобретению может находиться в области приблизительно от 1 мкг/кг до приблизительно 10 г/кг, более- 19009035 предпочтительно от 10 мг/кг до приблизительно 5 г/кг и наиболее предпочтительно от приблизительно 1 мг/кг до приблизительно 200 мг/кг. При желании эти количества обеспечиваются при ежедневной дозировке. Однако дозировка, которая используется при лечении или профилактике специфического когнитивного дефицита или другого заболевания, может быть субъективно определена лечащим врачом. Используемое варьирование основано на специфичности когнитивного дефицита, а также размере, возрасте и восприимчивости пациента. Например, основываясь на профиле активности и потенции соединений настоящего изобретения, первоначальная доза составляет приблизительно 10 мг в сутки с постепенным увеличением суточной дозы до приблизительно 200 мг в сутки, может обеспечить желательный уровень дозировки для человека. Альтернативно может быть желательным применение устройств по постоянному высвобождению средств доставки, чтобы избежать необходимости для пациента принимать медикаменты ежедневно."Пролонгированная доставка" определена как замедление доставки активного агента, то есть соединения по изобретению, даже после окончания помещения в среду доставки с последующей пролонгированной доставкой агента в более позднее время. Средние специалисты в данной области знают соответствующие устойчивые средства доставки. Примеры пригодных пролонгированных средств доставки включают,среди других, например, гидрогели (см., например, US Patent Nos. 5266325; 4959217; и 5292515), осмотический насос, такой как описан у Alza (US 4295987 и US 5273752) или Merck (EP 314206); гидрофобные мембранные материалы, такие как этиленметакрилат (ЕМА) и этиленвинилацетат (EVA); биорассасывающиеся полимерные системы (см., например, WO 98/44964, Bioxid and Cellomeda; US 5756127 and US 5854388); другие биорассасывающиеся имплантируемые средства были описаны как входящие в состав,например полиэфиры, полиангидриды или сополимеры молочной и гликолевой кислот (см., например,US 5817343 (Alkermes Inc.). При использовании таких пролонгированных средств доставки соединения по изобретению могут быть сформированы в составы, как описано в настоящем изобретении. Примеры Следующие примеры приведены, чтобы продемонстрировать получение и активность представленных соединений по изобретению и привести результаты их скрининга. Квалифицированный специалист в данной области оценит, что, хотя приведены в последующих примерах конкретные реагенты и условия,эти реагенты и условия не ограничивают настоящее изобретение. Пример 1. 3-Бром-5-хлор-N-[(1S,2S)-1-(гидроксиметил)-2-метилбутил]тиофен-2-сульфонамид К раствору (S)-+-изолейцинола (23 мг, 0,2 ммоль) в ТГФ (3 мл) добавляют триэтиламин (46 мкл,0,24 ммоль) и 3-бром-5-хлортиофен-2-сульфонилхлорид (59,2 мг, 0,2 ммоль). Раствор перемешивают в течение 8-16 ч, затем концентрируют. Остаток растворяют в МеОН (1,5 мл) и очищают с помощью полупрепаративной жидкостной хроматографии высокого разрешения (RP-NPLC1), что дает соединение по примеру 1 (20,3 мг). Следующие соединения (примеры 1-7, табл. 1) получают, используя 3-бром-5-хлортиофен-2 сульфонилхлорид, 5-бромтиофен-2-сульфонилхлорид, 3-бром-2-хлортиофен-5-сульфонилхлорид, 5 хлортиофен-2-сульфонилхлорид,2,5-дихлортиофен-3-сульфонилхлорид,2,3-дихлортиофен-5 сульфонилхлорид и 2-тиофенсульфонилхлорид и следуя методике, приведенной в примере 1. К раствору L-валинола (25,8 мг, 0,25 ммоль) в ТГФ (3 мл) добавляют триэтиламин (58 мкл, 0,3 ммоль) и 5-хлортиофен-2-сульфонилхлорид (54 мг, 0,25 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, затем концентрируют. Остаток растворяют в МеОН (1,5 мл) и очищают с помощью RP-NPLC1, что дает соединение по примеру 8 (19,5 мг). Следующие соединения (примеры 8-10, табл. 2) получают, используя 5-тиофен-2-сульфонилхлорид и 5-бромтиофенсульфонилхлорид с L-валинолом и D-валинолом и следуя методике, приведенной в примере 8. К раствору (S)-(+)-2-амино-3-метил-1-бутанола (20,6 мг, 0,2 ммоль) в ТГФ (3 мл) добавляют триэтиламин (46 мкл, 0,24 ммоль) и 4,5-дибромтиофен-2-сульфонилхлорид (68 мг, 0,2 ммоль). Раствор пе- 21009035 ремешивают в течение периода времени от 8 до 16 ч, растворитель удаляют и остаток очищают с помощью RP-NPLC1, что дает соединение по примеру 11 (49,6 мг).A. Часть 1 К раствору L-циклогексилглиципа (48,5 мг, 0,25 ммоль) в ТГФ (2 мл) добавляют алюмогидрид лития (1 М раствор в ТГФ) (0,8 мл, 0,8 ммоль) и раствор нагревают при 60 С в течение 4 ч. Раствор перемешивают при температуре 25 С в течение периода времени от 8 до 16 ч. Реакционную массу захолаживают путем добавления воды (45 мкл), 15% водного раствора гидроксида натрия (45 мкл) и воды (105 мкл) при энергичном перемешивании между каждым добавлением. Затем смесь фильтруют и концентрируют.B. Часть 2 К раствору остатка из части 1 в ТГФ (3 мл) добавляют триэтиламин (69 мкл, 0,50 ммоль) и 5 хлортиофен-2-сульфонилхлорид (54,3 мг, 0,25 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, растворитель удаляют и остаток очищают с помощью RP-NPLC1, что дает соединение по примеру 12 (25,9 мг). Следующие соединения (примеры 12-17, табл. 4) получают, используя 5-хлортиофен-2 сульфонилхлорид и 5-бромтиофен-2-сульфонилхлорид с L-циклогексилглицином, -метил-DLфенилаланином и L-аллоизолейцином и следуя методике примера 12.(210 мкл, 1,5 ммоль) и 5-бромтиофен-2-сульфонилхлорид (130,8 мг, 0,5 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, затем концентрируют.B. Часть 2. Остаток из части 2 (0,5 ммоль) растворяют в дихлорметане (3 мл) и добавляют метахлорпербензойную кислоту (2,5 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч,растворитель удаляют и остаток очищают с помощью RP-NPLC, что дает соединение по примеру 18 (4,3 мг). LCMS2 данные: молекулярный ион и время задержки, 375,9 М+Н; 3,37 мин. Пример 19. 5-Хлор-N-[1-(гидроксиметил)-2,3-диметилпентил]тиофен-2-сульфонамид А. Часть 1 К раствору цианида натрия (735,15 мг, 15 ммоль) и карбоната аммония (1,92 г, 20 ммоль) вEtOH/Н 2 О (1:1, 35 мл) добавляют 2,3 диметилпентанал (570,95 мг, 5 ммоль). Раствор нагревают при 50 С в течение 20 ч, затем концентрируют.B. Часть 2 Остаток из части 1 (5 ммоль) растворяют в 35 мл водного раствора 3N гидроксида натрия и нагревают при 95 С в течение 22 ч. Перемешивание продолжают в течение дополнительного периода времени от 8 до 16 ч, затем растворитель удаляютC. Часть 3 К остатку из части 2 (2,5 ммоль) в ТГФ (10 мл) добавляют алюмогидрид лития (1 М раствор в ТГФ)(5 мл, 5 ммоль) и раствор нагревают при 60 С в течение 4 ч. Раствор перемешивают при температуре 25 С в течение периода времени от 8 до 16 ч. Реакционную массу захолаживают путем добавления воды(285 мкл), 15% водного раствора гидроксида натрия (285 мкл) и воды (665 мкл) при энергичном перемешивании между каждым добавлением. Затем смесь фильтруют и концентрируют.D. Часть 4 К остатку из части 3 (0,5 ммоль) в ТГФ (5 мл) добавляют триэтиламин (83,7 мл, 0,6 ммоль) и 5 хлортиофен-2-сульфонилхлорид (108,54 мг, 0,5 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, растворитель удаляют и остаток очищают с помощью RP-NPLC1, что дает соединение по примеру 19 (46,1 мг). Следующие соединения (примеры 19-24, табл. 5) получают, используя 2,3 диметилпентаналь, 2 метилвалеральдегид,2-этилгексаналь,2,4,6-триметил-3-циклогексен-1-карбоксальдегид,1,2,3,6 тетрагидробензальдегид, циклопентилметанал и и следуя методике примера 19.A. Часть 1 К раствору (S)метилвалина (131 мг, 1 ммоль) в ТГФ (5 мл) добавляют алюмогидрид лития (1 М раствор в ТГФ) (2 мл, 2 ммоль) и раствор нагревают при 60 С в течение 4 ч. Раствор перемешивают при температуре 25 С в течение периода времени от 8 до 16 ч. Реакционную массу захолаживают путем добавления воды (114 мкл), 15% водного раствора гидроксида натрия (114 мкл) и воды (266 мкл) при энергичном перемешивании между каждым добавлением. Затем смесь фильтруют и концентрируют.B. Часть 2 К остатку из части 1 (0,5 ммоль) в ТГФ (2 мл) добавляют триэтиламин (83,7 мкл, 0,6 ммоль) и 5 бромтиофен-2-сульфонилхлорид (130,8 мг, 0,5 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, растворитель удаляют и остаток очищают с помощью RP-NPLC1, что дает соединение по примеру 25 (50,8 мг). Следующие соединения (примеры 25-26, табл. 6) получают, используя 5-бромтиофен-2 сульфонилхлорид и 5-хлортиофен-2-сульфонилхлорид и следуя методике примера 25. А. Часть 1 Раствор 4-метил-2-пентеновой кислоты (7,6 мл, 40 ммоль) в ТГФ (100 мл) охлаждают до температуры -78 С. Затем добавляют с помощью шприца триэтиламин (5,85 мл, 42 ммоль) и триметилацетилхлорид (пивалоилхлорид) (5,17 мл, 42 ммоль) в указанной последовательности. Баню с сухим льдом заменяют на баню со льдом и реакционную массу перемешивают при температуре 0 С в течение 1 ч, затем реакционную массу повторно охлаждают до температуры -78 С. В отдельной колбе (R)-(+)-4-бензил-2-оксазолидинон (7,0 г, 40 ммоль) растворяют в ТГФ (100 мл) и охлаждают до температуры -78 С, затем добавляют с помощью шприца н-бутиллитий (1,6 М, 25 мл). Смесь перемешивают в течение 20 мин, затем указанную выше реакционную смесь добавляют, удаляя перегородку, и быстро переливают из одной колбы в другую (примечание: попытки перенести реакционную смесь через канюлю потерпели неудачу из-за суспедированного хлорида триметиламмония в смеси). Полученную смесь перемешивают при температуре -78 С в течение 30 мин, затем ей дают возможность нагреться до температуры 25 С в течение от 1 до 2 ч перед гашением насыщенным водным раствором NH4Cl (100 мл). Летучие вещества удаляют на роторном испарителе и водную взвесь разбавляют водой (200 мл) и экстрагируют этилацетатом (2 х 200 мл). Объединенную органическую фазу сушат над безводным MgSO4, фильтруют и концентрируют. Продукт может кристаллизоваться из раствора и иметь высокую чистоту. Если требуется очистка сырого продукта, она может быть осуществлена с помощью флеш хроматографии, используя 20-30% раствор этилацетата в гексане.B. Часть 2 К комплексу бромид меди (I)/диметилсульфид (246 мг, 1,2 ммоль) в смеси ТГФ/диметилсульфоксид(2:1, 15 мл), охлажденному до температуры -40 С, добавляют метилмагнийбромид (2,4 мл, 1 М раствор в ТГФ, 2.4 ммоль). Раствору дают возможность перемешиваться в течение 10 мин, пока происходит нагревание до температуры -15 С. Смесь повторно охлаждают до температуры -40 С и добавляют продукт из части 1 (245 мг, 1 ммоль) в ТГФ (6 мл). Раствор перемешивают при температуре 25 С в течение периода времени от 8 до 16 ч. Затем раствор повторно охлаждают до температуры -78 С и добавляют Nбромсукцинимид (NBS) (356 мг, 2 ммоль) в ТГФ (2 мл). Раствору дают возможность нагреться до температуры 0 С и встряхивают при температуре 0 С в течение 3 ч. Реакционную массу захолаживают 1:1 раствором из насыщенного карбоната аммония и 0,5N гидросульфата калия (5 мл). Органическую фазу отфильтровывают и концентрируют.C. Часть 3 К продукту из части 3, растворенному в ацетонитриле (5 мл), добавляют азид тетраметилгуанидиния (0,6 мл, 4 ммоль). Раствор перемешивают в течение периода времени от 72 до 120 ч. Затем его концентрируют досуха, повторно растворяют в CH2 Сl2 и добавляют 1N HCl (2 мл). Слои разделяют и органический слой фильтруют через подушку из силикагеля, промывают CH2Cl2 (5 мл) и концентрируют.D. Часть 4 К продукту из части 3 (131 мг, 1 ммоль) в ТГФ (5 мл) при 0 С добавляют алюмогидрид лития (1 М раствор в ТГФ) (2 мл, 2 ммоль), и раствор перемешивают при температуре 25 С в течение 4 ч. Реакционную массу захолаживают путем добавления воды (114 мкл), 15% водного раствора гидроксида натрия(114 мкл) и воды (266 мкл) при энергичном перемешивании между каждым добавлением. Затем смесь фильтруют и концентрируют.E. Часть 5 К остатку из части 4 (0.5 ммоль) в ТГФ (2 мл) добавляют триэтиламин (83,7 мкл, 0.6 ммоль) и 5 хлортиофен-2-сульфонилхлорид (108 мг, 0,5 ммоль). Раствор перемешивают в течение периода времени от 8 до 16 ч, растворитель удаляют и остаток очищают, как описано для примера 1, что дает 50,8 мг.R= Me, Et н-Pr, изо-Pr, гексил, фенилбифенил, 3-пиридил, 2-фурил,R MgX= Me, Et, изо-Bu, гексил, фенил, 4-MeOPh. Следующие соединения (примеры 27-55, табл. 7) получают, используя 5-хлортиофен-2 сульфонилхлорид с кротоновой кислотой, 2-пентеновой кислотой, 2-гексеновой кислотой, 2-октеновой кислотой, коричной кислотой, фурилакриловой кислотой, 4-метил-2-пентеновой кислотой, 4 фенилкоричной кислотой и метил-, этил-, изобутил-, 4-метоксифенилом, гексилом и фенилмагнийбромидом и следуя методике примера 27. Следующие соединения (примеры 56-76, табл. 8) получают, используя 5-бромтиофен-2 сульфонилхлорид с кротоновой кислотой, 2-пентеновой кислотой, 2-гексеновой кислотой, 2-октеновой кислотой, коричной кислотой, -(3-пиридил)акриловой кислотой, фурилакриловой кислотой, 4-метил-2 пентеновой кислотой, 4-фенилкоричной кислотой и метил-, этил-, изобутил-, 4-метоксифенилом, гексилом и фенилмагнийбромидом и следуя методике примера 27. Следуя процессу по примеру 27 (части 1 и 2), 2-пентеновую кислоту конденсируют с 4R-4-бензил 2-оксазолидиноном, чтобы получить R-3-(2'-пентенил)-4-бензил-2-оксазолидинон. Добавляют гексилмагнийбромид после улавливания N-бромсукцинимидом. После обработки флеш-хроматографии на силикагеле с использованием 5% раствора эфира в гексане получают приблизительно смесь 2:1 (1R-2R)-:(1R-2S)-3-(2'-бром-3'этилнонанил)-4-бензил-2-оксазолидинона. Каждый изомер преобразуют в соответствующий сульфонилированный аминоспирт, следуя методике примера 27, (стадии 3-5). А. Часть 1 К раствору D-серина (1,05 г, 10 ммоль) в Н 2 О/ТГФ (1:1, 100 мл) при 0 С добавляют гидроксид натрия (2,17 г, 30 ммоль) и 5-хлортиофен-2-сульфонилхлорид (2,17 г, 10 ммоль). Раствор перемешивают в течение периода времени от 2 до 3 ч, затем органическую фазу концентрируют и водную фазу подкисляют 1N HCl, экстрагируют этилацетатом и концентрируют.B. Часть 2 К остатку из части 1 (2,5 ммоль), растворенному в ТГФ (25 мл) при -78 С, добавляют этилмагнийбромид (7,5 мл, 7,5 ммоль). Смесь нагревают до 25 С и дают возможность перемешиваться в течение 48 ч. Затем ее подкисляют 1N HCl, экстрагируют этилацетатом и концентрируют.C. Часть 3 К продукту из части 2 (0,1 ммоль), растворенному в ДМФА (500 мкл), добавляют CH2Cl2 (1,5 мл),уксусную кислоту (12 мкл, 0,2 ммоль) и метиламин (2 М раствор в ТГФ) (100 мкл, 0,2 ммоль). Реакционную массу перемешивают в течение 5 мин, а затем добавляют триацетоксиборогидрид натрия (105,6 мг,0,5 ммоль). Раствору дают возможность перемешиваться в течение 8-16 ч и очищают с помощью RPNPLC1, что дает соединение по примеру 79 (6,8 мг). Следующие соединения (примеры 79-86, табл. 10) получают, используя метил, этил или фенилбромид магния с метиламином (2 М раствор в ТГФ), этиламином (2 М раствор в ТГФ), этаноламином, бензиламином,циклопентиламином и следуя методике примера 79.A. Часть 1 К раствору гидрохлорида L-изолейцинметилового эфира (1,82 г, 10 ммоль) и 5-хлортиофен-2 сульфонилхлорида (1,82 г, 10 ммоль) добавляют триэтиламин (4,18 мл, 30 ммоль). Смесь перемешивают при температуре 60 С в течение ночи, затем фильтруют и концентрируют. Сырой продукт очищают с помощью флеш-хроматографии на силикагеле, используя 10% раствор этилацетата в гексане, что дает 5 хлортиофен-2-сульфонилизолейцинметиловый эфир 2,53 г.B. Часть 2 К раствору 5-хлортиофен-2-сульфонилизолейцинметилового эфира (103 мг, 0,25 ммоль) в ДМФА (1 мл) добавляют -бромфенетол (55 мг, 0,5 ммоль) и карбонат калия (103 мг, 0,75 ммоль). Реакционную массу встряхивают при 25 С в течение ночи, затем концентрируют. С. Часть 3 Остаток из части 2 растворяют в 5% растворе метанола в ТГФ (1 мл) и затем добавляют боргидрид лития (11 мг, 0,5 ммоль). Реакционную массу встряхивают при 25 С в течение 2 дней, затем захолаживают путем добавления воды (1 мл) и экстрагируют в этилацетате (3,5 мл). Органическую фазу упаривают и остаток очищают с помощью RP-HPLC1, что дает соединение по примеру 87 (48 мг). Следующие соединения (примеры 87-88, табл. 11) получают, используя -бромфенетол, 3 хлорбензилбромид и следуя методике примера 87.(200 мкл). Пробирку закрывают и встряхивают в течение периода времени от 8 до 12 ч при 40 С. Растворитель удаляют в вакууме, и остаток растворяют в 1,6 мл ДМСО (0,03 М). Следующие соединения (примеры 89-117, табл. 12) получают, используя 5-хлортиофен-2- 29009035 сульфонилхлорид и 5-бромтиофен-2-сульфонилхлорид с (S)-(+)-2-фенилглицинолом, L-лейцинолом, DL2-амино-1-гексанолом, 2-амино-2-метил-1-пропанолом, 2-амино-2-этил-1,3-пропандиолом, циклолейцино лом, (S)-циклогексилаланинолом, L-фенилаланинолом, L-метионинолом, DL-2-амино-1-пентанолом,L-трет-лейцинолом, хлорамфениколом, (S)-(+)-2-амино-1-бутанолом, (S)-бензил-1-цистеинолом, бензилL-треонинолом, 4-метилбензил-N-цистеинолом, бензил-N-тирозинолом и L-треонинолом, следуя методике примера 89.
МПК / Метки
МПК: A61P 25/28, A61K 31/341, C07D 333/34, A61K 31/4535, C07D 409/12, C07D 307/64, A61K 31/381
Метки: сульфонамидных, бета-амилоида, получение, гетероциклических, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-9035-poluchenie-geterociklicheskih-sulfonamidnyh-ingibitorov-beta-amiloida.html" rel="bookmark" title="База патентов Евразийского Союза">Получение гетероциклических сульфонамидных ингибиторов бета-амилоида</a>