Бензо[с]хинолизиновые производные, их получение и использование в качестве ингибиторов 5&alpha-редуктаз
Формула / Реферат
1. Бензо[с]-хинолизиновые соединения формулы (I)
 (I)
(I)
в которой R1, R2, R3, R4, R6 одинаковые или различные выбирают из группы, состоящей из Н, C1-8-алкила, С2-8-алкенила, C2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, галогена, CN, азида, NRR', C1-8-алкиламино, ариламино, C1-8-алкилокси, арилокси, COOR, CONRR', где R и R' одинаковые или различные выбирают из группы, состоящей из Н, C1-8-алкила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, арил-С1-8-алкила;
R5 выбирают из группы, состоящей из Н, C1-8-алкила, COOR, CN, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N;
X выбирают из группы, состоящей из О, C(=O)R, COOR, NO2, CONR'R, в которой R и R' являются такими, как определено выше;
Q выбирают из группы, состоящей из простой связи, C1-8-алкила, С2-8-алкенила, С2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, СО, CONR, NR, где R является таким, как определено выше;
W выбирают из группы, состоящей из Н, C1-8-алкила, С2-8-алкенила, С2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, трифторметила, C1-8-алкокси, С1-8-алкокси-С1-8-алкила, арил-С1-8-алкила, фенила, нафтила, арилокси, ариламино, C1-8-алкилкарбонила, арилкарбонила, галогена, CN, NRR', C1-8-алкиламино, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, причем группы алкила, алкенила, алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, могут быть замещенными галогеном, OR, фенилом, NRR', CN, COOR, CONRR', C1-8-алкилом (где R и R' являются такими, как определено выше);
n является целым числом в интервале от 1 до 4;
символ ----- означает, что соответствующие связи а, b, с, d, e, f и g могут быть простыми или двойными связями;
при условии, что когда b или f являются двойными связями, то группа R5 отсутствует; и при условии, что из формулы изобретения исключены следующие два соединения: 4-карбонитрил-2,3-дигидро-(1Н)-бензо[с]хиноли-
зин-3-он и 3,4-дигидро-1-фенил-4аН-бензо[с]хинолизин-3-он;
их фармацевтически приемлемые соли или эфиры.
2. Бензо[с]-хинолизиновые соединения формулы (I) по п.1, в которой
R5 = Н, насыщенный или ароматический гетероцикл, содержащий один или более атомов N;
Х = 0;
Q = простые связи, СО, CONR, NR (где R является таким, как определено выше);
W = Н, F, Cl, Br, Me, трет-бутил, C1-8-алкокси, 2,5-диметилгексил, трифторметил, 2,5-(ди-трифторметил)-фенил, 4-метоксифенил, 4-фторфенил-, фенил, фенил-С1-8-алкил, C1-8-алкилкарбонил, фенилкарбонил;
n = 1 или 2;
R1, R2, R3, R4, R5, R6=H, Me, CN, фенил, COOR, CONRR' (где R и R' являются такими, как определено выше).
3. Бензо[с]-хинолизиновые соединения по п.1 следующей формулы:
1,2,4,4а,5,6-гексагидро-(11Н)-бензо[с]хинолизин-3-он;
8-хлор-1,2,4,4а,5,6-гексагидро-(11Н)-бензо[с]хинолизин-3-он;
1,2,4,4а,5,6-гексагидро-8-метил-(11H)-бензо[с]хинолизин-3-он;
1,2,4,4а,5,6-гексагидро-4-метил-(11H)-бензо[с]хинолизин-3-он;
1,2,4,4а,5,6-гексагидро-1-метил-(11H)-бензо[с]хинолизин-3-он;
1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он,
8-хлор-1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
8-метил-1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
4-метил-1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
1-метил-1,2,4,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
5,6-дигидро-(11H)-бензо[с]хинолизин-3-он;
8-хлор-4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
8-хлор-1-метил-4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
8-метил-4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
4-метил-4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он (цис) и (транс);
8-хлор-4-метил-1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
4,8-диметил-1,2,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он;
4,8-диметил-4,4а,5,6-тетрагидро-(11H)-бензо[с]хинолизин-3-он (цис) и (транс);
8-хлор-4-метил-4,4а,5,6-тетрагидро-(11H)-бензо(с]хинолизин-3-он (цис) и (транс).
4. Способ получения соединений по п.1, в котором амидную группу соединения формулы (2)
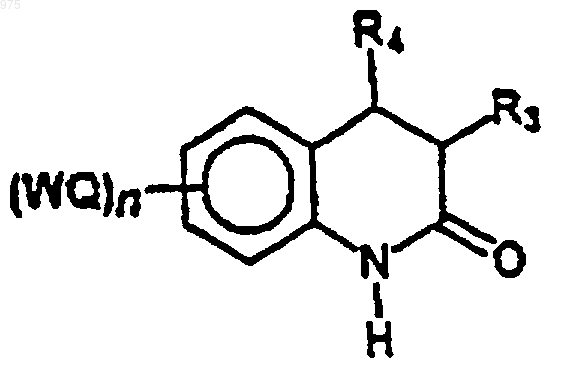
(2)
защищают защитной группой Z с образованием соединения (3)
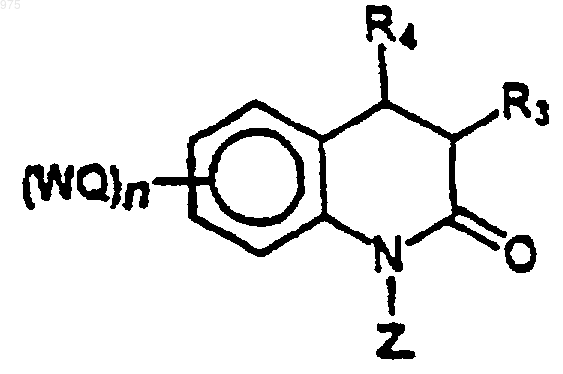
(3)
вышеуказанное соединение (3) восстанавливают до соединения (4), например, боргидридом натрия в этаноле (рН 3)
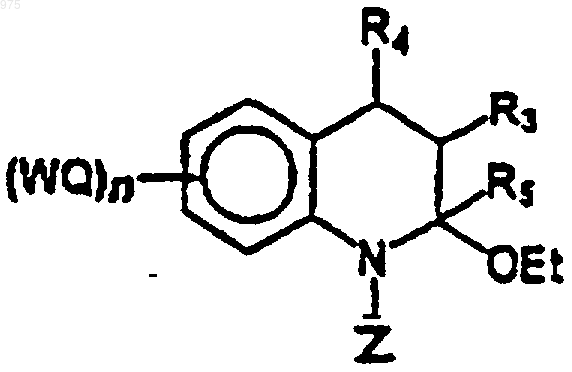
(4)
и соединение (4) вводят в реакцию с силиловым эфиром (6)
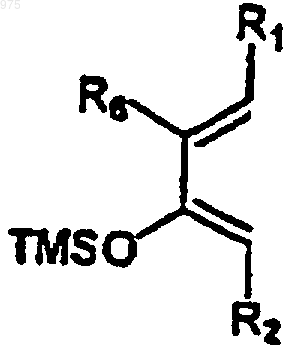
(6)
получаемым "in situ" посредством взаимодействия винил-кетона (5)
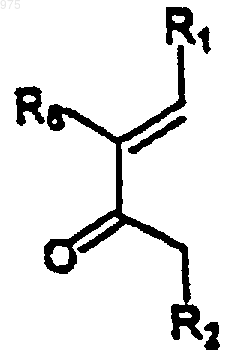
(5)
(в котором R1, R2, R6 являются такими, как определено выше) с таким силилирующим реагентом, как ангидрид триметилсилилтрифторметансульфоновой кислоты (TMSOTf), и, наконец, гидролизуют, например, гидрокарбонатом натрия с образованием конечного соединения формулы (I), в которой Х=0.
5. Способ по п.4, в котором возможное введение двойных связей в положения а или b осуществляют посредством реакции дихлордицианохинона (ДДХ) с соответствующими силиловыми эфирами енолов или посредством окисления ацетатом ртути насыщенного соединения, полученного, как заявлено выше, а возможное превращение группы Х осуществляют через соответствующие енолтрифлаты и последующее карбонилирование в присутствии диацетата палладия, трифенилфосфина и подходящего нуклеофильного реагента.
6. Соединение формулы (4)
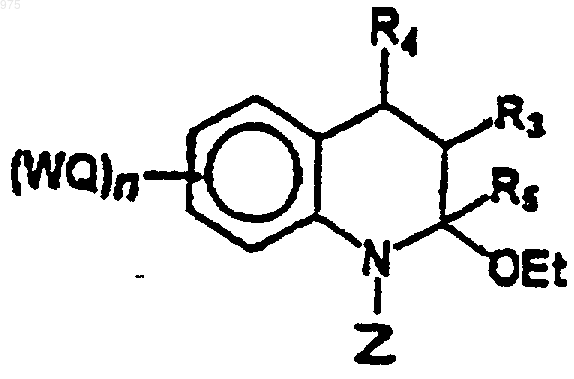
(4)
в котором W, Q, n, R3, R4, R5 являются такими, как определено в п.1, и Z представляет защитную группу для амидогруппы, при условии, что когда R3=R4=R5=(WQ)n=Н, то Z не является этоксикарбонильной группой.
7. Фармацевтическая композиция, в которой действующим началом является соединение формулы (I)
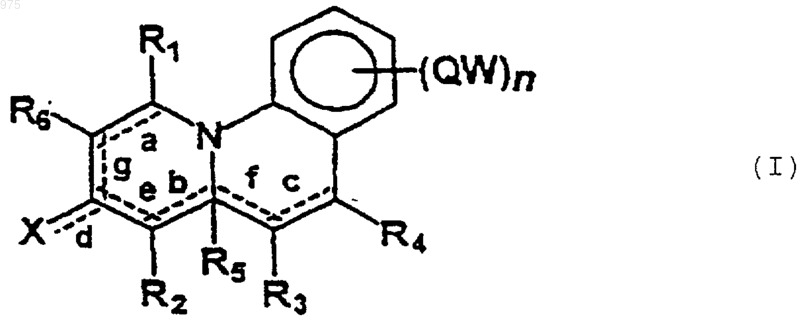
в которой R1, R2, R3, R4, R6 одинаковые или различные выбирают из группы, состоящей из Н, C1-8-алкила, С2-8-алкенила, C2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, галогена, CN, азида, NRR', C1-8-алкиламино, ариламино, C1-8-алкилокёш, арилокси, COOR, CONRR', где R и R', одинаковые или различные, выбирают из группы, состоящей из Н, C1-8-алкила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, арил-С1-8-алкила;
R5 выбирают из группы, состоящей из Н, C1-8-алкила, COOR, CN, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N;
Х выбирают из группы, состоящей из О, C(=O)R, COOR, NO2, CONR'R, в которой R и R' являются такими, как определено выше;
Q выбирают из группы, состоящей из простой связи, С1-8-алкила, С2-8-алкенила, С2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, СО, CONR, NR, где R является таким, как определено выше;
W выбирают из группы, состоящей из Н, C1-8-алкила, С2-8-алкенила, С2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, трифторметила, C1-8-алкокси, С1-8-алкокси-С1-8-алкила, арил-С1-8-алкила, фенила, нафтила, арилокси, ариламино, C1-8-алкилкарбонила, арилкарбонила, галогена, CN, NRR', C1-8-алкиламино, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, причем группы алкила, алкенила, алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, могут быть замещенными галогеном, OR, фенилом, NRR', CN, COOR, CONRR1 , C1-8-алкилом (где R и R' являются такими, как определено выше);
n является целым числом в интервале от 1 до 4;
символ ----- означает, что соответствующие связи а, b, с, d, e, f и g могут быть простыми или двойными связями;
при условии, что когда b или f являются двойными связями, то группа R5 отсутствует;
их фармацевтически приемлемые соли или эфиры
или их смеси в комбинации с подходящими фармацевтически приемлемыми эксципиентами.
8. Фармацевтическая композиция по п.7 для использования для ингибирования 5-a R-I и/или 5-a R-II изоферментов.
9. Фармацевтическая композиция по пп.7 и 8 в форме, пригодной для местного использования.
10. Применение соединения формулы (I) по п.7 в качестве лекарственного средства.
11. Применение соединения формулы (I) по п.7 для получения фармацевтической композиции, предназначенной для лечения угревой сыпи, алопеции, рака предстательной железы и гипертрофии предстательной железы у мужчин и гирсутизма у женщин.
12. Способ лечения патологий, связанных с 5a -редуктазными ферментами, посредством введения пациенту фармацевтически активного количества фармацевтической композиции по п.7.
13. Способ лечения угревой сыпи, алопеции, рака предстательной железы и гипертрофии предстательной железы у мужчин и гирсутизма у женщин посредством введения фармацевтически активного количества фармацевтической композиции по п.7.
Текст
1 Область изобретения Настоящее изобретение относится к бензо[с]хинолизиновым производным общей формулы (I)Q выбирают из группы, состоящей из простой связи, C1-8-алкила, С 2-8-алкенила, С 2-8 алкинила, циклоалкила, СО, CONR, NR, где R является таким, как указано выше;n является целым числом в интервале от 1 до 4; символозначает, что соответствующие связи а, b, с, d, e, f и g могут быть простой или двойной связью; при условии, что когда b или f являются двойными связями, то группа R5 отсутствует; и при условии, что исключены следующие два соединения: 4-карбонитрил-2,3-дигидро-(1 Н)бензо[с]хинолизин-3-он и 3,4-дигидро-1-фенил 4 аН-бензо[с]хинолизин-3-он; их фармацевтически приемлемым солям или эфирам, способам их получения и их использованию в качестве ингибиторов стероидных 5-редуктаз (далее обозначаемых как 5 редуктазы). Также изобретение относится к соединениям формулы (4) 2 в которой W, Q, n, R3, R4, R5 являются такими,как определено выше, и Z представляет защитную группу для амидной группы, при условии,что когда R3=R4=R5= (WQ)n =Н, то Z не является этоксикарбонильной группой. Уровень развития техники Фермент, известный как стероидная 5 альфа-редуктаза, представляет собой систему,образованную двумя изоферментами (тип I и тип II или 5R-I и 5R-II, соответственно), которая превращает тестостерон в дигидротестостерон, наиболее сильный андроген, находящийся в теле человека. Изофермент типа I (5R-I) присутствует,главным образом, в печени и коже, в то время как изофермент типа II (5R-II) в основном присутствует в тканях простаты и в мужских половых органах, и его активность существенна при развитии плода для дифференцировки внешних половых органов. Продуцирование дигидротестостерона связывают с некоторыми патологиями, которые широко представлены, как, например, доброкачественная гипертрофия простаты, рак простаты, алопеция (облысение) и угревая сыпь у мужчин и гирсутизм (избыточный рост волос по мужскому типу) у женщин. Более конкретно,изофермент-I играет роль в патологиях, относящихся к коже, тогда как изофермент-II связан с патологиями простаты. В последние годы группы исследователей во всем мире предпринимали попытки выделить новые соединения, способные ингибировать фермент 5-редуктазы, для того, чтобы лечить вышеуказанные патологии, особенно, если возможно, воздействовать селективно на только один из двух ферментов. Ингибиторы 5-редуктазы и также изоферментов 5R-I и 5R-II уже были описаны,например, финастерид, с успехом используемый при лечении доброкачественной гипертрофии простаты [см., например, J. Med.Chem., 36,4313-15 (1993), J. Med.Chem., 37, 3871-74(1994)]. Следовательно, остается необходимость создания новых соединений, способных ингибировать действие фермента 5-редуктазы и,особенно, способных воздействовать селективно на изофермент 5R-I, который, как указано,является ответственным за широко распространенные патологии, имеющие высокое значение,такие как облысение у мужчин и гирсутизм у женщин. Подробное описание изобретения Настоящее изобретение относится к новым соединениям, способным ингибировать фермент 5-редуктазы, или селективно в отношении 5R-I и 5R-II, или оба этих изофермента, полезным при лечении патологий, вызываемых этим ферментом. Продукты согласно изобретению имеют общую формулу (I) в которой заместители R1, R2, R3, R4, R5, R6, X,Q, W, n и символявляются такими, как определено выше. Согласно настоящему изобретению в качестве групп C1-8-алкил, С 2-8-алкенил, С 2-8-алкинил указываются линейные или разветвленные алкильные радикалы, как, например, метил, этил,пропил, изопропил, бутил, пентил, гексил, гептил, октил, этилен, пропен, бутен, изобутен,ацетилен, пропин, бутин и т.д. В качестве циклоалкилов указываются циклопропан, циклобутан, циклопентан, циклогексан, циклогептан, циклооктан, норборнан,канфан, адамантан. В качестве арилов указаны фенил и нафтил. Гетероцикл, в частности, означает насыщенные или ароматические гетероциклы, содержащие один или более атомов N, более конкретно, пиридин, имидазол, пиррол, индол,триазолы, пирролидин, пиперидин. Галоген означает фтор, хлор, бром, иод. Заместителями вышеуказанной группы W,предпочтительно, являются галоген, OR, фенил,NRR', CN, COOR, CONRR', C1-8-алкил (где R иR' являются такими, как определено выше). В частности, согласно настоящему изобретению соединения формулы (I) являются предпочтительными в том случае, когдаR1, R2, R3, R4, R6 = Н, Me, CN, фенил,COOR, CONRR' (в котором R и R' являются такими, как определено выше). Среди фармацевтически приемлемых эфиров и солей согласно настоящему изобретению могут быть отмечены следующие: гидрохлорид,сульфат, цитрат, формиат, фосфат. Предпочтительными соединениями согласно настоящему изобретению являются 1,2,4,4 а,5,6-гексагидро-(11 Н)-бензо[с] хинолизин-3-он; 8-хлор-1,2,4,4 а,5,6-гексагидро-(11 Н)-бензо[с]хинолизин-3-он(цис) и (транс); 8-хлор-4-метил-I,2,5,6-тетрагидро-(11 Н)бензо[с]хинолизин-3-он; 4,8-диметил-1,2,5,6-тетрагидро-(11 Н)бензо[с]хинолизин-3-он; 4,8-диметил-4,4 а,5,6-тетрагидро-(11 Н)бензо[с]хинолизин-3-он(цис) и (транс); 8-хлор-4-метил-4,4 а,5,6-тетрагидро-(11 Н)бензо[с]хинолизин-3-он(цис) и (транс). Соединения согласно настоящему изобретению могут быть получены, например, исходя из соединений формулы 2(2) где R3, R4, W, Q и n такие, как определено выше,по описываемой далее схеме реакции. Соединения 2 коммерчески доступны или могут быть получены известными способами. Как можно видеть на схеме, получение соединений согласно изобретению включает защиту амидогруппы в соединении 2 защитной группой Z, например, трет-бутоксикарбонил (tBoc), с образованием соединения 3; соединение 3 восстанавливают до соединения 4, например,(когда R5 представляет Н) боргидридом натрия в этаноле (рН 3), которое вводят в реакцию с силиловым эфиром 6, получаемым in situ, исходя из реакции винилкетонов 5 (в которых R1, R2 и R6 являются такими, как определено выше) с силилирующим агентом, таким как ангидрид триметилсилилтрифторметансульфоновой кислоты (TMSOTf), а затем гидролизуют, например, в гидрокарбонате натрия, с образованием соединений формулы (I), в которых Х=0. Возможное введение двойных связей и превраще 5 ние группы Х в одну из других отмеченных выше групп легко может быть осуществлено согласно известным способам, исходя из соответствующих соединений формулы (I), полученных, как указано выше. Например, введение двойных связей в позиции а или b может быть осуществлено посредством реакции дихлордицианохинона (ДДХ) с соответствующими силиловыми эфирами енолов или посредством окисления ацетатом ртути соответствующих насыщенных соединений, полученных, как описано выше. Превращение группы Х может быть осуществлено через соответствующие енолтрифлаты и их карбонилирование в присутствии диацетата палладия, трифенилфосфина и подходящего нуклеофильного реагента (спирт, амин, нитрогруппа). Пример 1. Получение N-(трет-бутоксикарбонил)-3,4-дигидрохинолин-2(1 Н)-она [соединение 3, в котором (QW)n=H, R3=R4=Н]. 5 г (34 ммоля) 3,4-дигидрохинолин-2(1 Н)она [соединение 2, в котором (QW)2=H,R3=R4=Н] и 111 мл CH2Cl2 загружают в атмосфере азота в круглодонную колбу на 250 мл,оборудованную магнитной мешалкой. К вышеуказанной смеси добавляют 4,7 мл(34 ммоля) триэтиламина (перегнанного над КОН), 8,9 г (40,8 ммоля) дитретбутилкарбоната и 1 г (8,2 ммоля) 4-диметиламинопиридина. Смесь перемешивают при кипячении с обратным холодильником в течение 5 ч, затем одну ночь при комнатной температуре, после этого растворитель удаляют и добавляют 200 мл воды. Водную фазу экстрагируют диэтиловым эфиром и органическую фазу нейтрализуют водным раствором KHSO4 (1 M). Органическую фазу промывают насыщенным раствором NaCl и сушат над Na2SO4. После фильтрации и удаления растворителя получают 8,23 г требуемого соединения (белые кристаллы). Т. пл. 68-69 С. Выход 98%. Пример 2. Получение N-(трет-бутоксикарбонил)-2-этокси-1,2,3,4-тетрагидрохинолина(QW)n=H,R3=R4=R5=H]. 4,35 г (17,6 ммоля) соединения, полученного в примере 1 и 136 мл абсолютного этанола загружают в 500-мл круглодонную колбу, оборудованную магнитной мешалкой. Раствор охлаждают до -25 С и добавляют к смеси в течение 1 ч 2,66 г (70,4 ммоля) NaBH4(разделенного на 6 порций). Через 4 ч к смеси добавляют раствор 2 ННСl в абсолютном этаноле, до рН 3 и смесь перемешивают при 0 С в течение 1,5 ч. Добавляют 100 мл воды, водную фазу экстрагируют метиленхлоридом, органическую фазу промывают насыщенным растворомNаНСО 3 и насыщенным раствором NaCl и смесь сушат над Na2SО 4. После фильтрации растворитель удаляют и получают 4,74 г ожидаемого продукта (густая желтая жидкость); выход 96%. 6 Аналогично указанному выше получают другие соединения 4, в которых заместители не восстанавливаются NaBH4; если в соединении присутствуют заместители, которые могут восстанавливаться NaBH4, то они должны быть предварительно защищены. Пример 3. Получение 1,2,4,4 а,5,6 гексагидро-(11 Н)-бензо[с]хинолизин-3-она [соединение формулы (I), в котором Х=0;(1,22 ммоля) триэтиламина (перегнанного над КОН) и 209 мкл (1,08 ммоля) триметилсилилтрифторметансульфоната (TMDOTf). При этих условиях образуетсяsitu 2(триметилсилокси)-1,3-бутадиен [соединение 6,в котором R1=R2=R6=H]. Смесь перемешивают в течение 45 мин, а затем к ней по каплям добавляют раствор 100 мг (0,36 ммоля) продукта из примера 2 в 2 мл безводного СН 2 Сl2 вместе с 69 мкл (0,36 ммоля) TMSOTf. Смесь доводят до комнатной температуры и через 30 мин добавляют 4 мл насыщенного раствора NаНСО 3 и смесь интенсивно перемешивают в течение 36 ч. К смеси прибавляют 4 мл воды и водную фазу экстрагируют хлористым метиленом, органическую фазу промывают насыщенным раствором NаНСО 3, водой, насыщенным растворомNaCl и сушат над Na2SO4. После фильтрации растворитель удаляют и получают 59 мг сырого продукта. Продукт очищают флэшхроматографией на колонке с силикагелем(ФХК), элюируя хлористым метиленом и триэтиламином 1%. Получают 18 мг требуемого продукта (кристаллы). Т. пл. 53-54 С. Выход 25%. Используя различные винилкетоны 5 или используя непосредственно различные силиловые эфиры енолов 6, когда они доступны, возможно получить соответствующие производные формулы (I). Конкретно, при использовании 1-метокси 3-(триметилсилилокси)-1-3-бутадиена (соединение 6, в котором R1=MeO, R2=H, R6=H) был непосредственно получен согласно синтезу, описанному в следующем примере 4,4,4 а,5,6 тетрагидро-(11 Н)-бензо[с]хинолизин-3-он (соединение I, в котором Х=0, (QW)n= H; R1=R2 = 7 К перемешиваемому раствору соединения 4 [(QW)n=H, R3=R4=H] (4 г, 14,42 ммоля) из примера 3 в 75 мл безводного СН 2 Сl2 под аргоном при -10 С добавляют по каплям в течение 7 мин 28,84 мл 1 М раствора TiCl4 в СН 2 Сl2, поддерживая температуру ниже -5 С. Затем добавляют из шприца 1-метокси-3-(триметилсилилокси)-1-3-бутадиен(соединение 6,R1=MeO, R2=H, R6=Н) (3,29 мл, 17,3 ммоля) при 0 С, и реакцию оставляют при комнатной температуре на 1 ч. К реакционной смеси осторожно добавляют 100 мл насыщенного раствораNaHCO3 и затем перемешивают в течение 30 мин. Органический слой отделяют, промывают водой, фильтруют через целиты и сушат надNa2SO4. После удаления растворителя сырой продукт очищают колоночной флэшхроматографией (элюент легкий петролейный эфир/этил ацетат 1:4), получая 0,72 г (25% выход) ожидаемого продукта (белые кристаллы, т. пл. 135-137 С). Пример 5. Получение 4-метил-4,4 а,5,6 тетрагидро-(11 Н)-бензо[с]хинолизин-3-она [соединение формулы I, в котором Х=0, (QW)n= H;H; R1=R3=R4=R5=R6=H; R2=Me; a, b, c, e, f, g ординарные связи, полученное согласно примеру 3 реакцией соединения 4 (в котором (QW)n=H; R3=R4=R5=H) по примеру 2 и этилвинилкетона (соединение 5, в котором R1=R6=H; R2=Me] и 120 мл 5% раствора (объем/объем) ледяной уксусной кислоты в воде загружают в атмосфере азота в двухгорлую круглодонную колбу, снабженную магнитной мешалкой, холодильником и капельной воронкой. При интенсивном перемешивании добавляют 7,27 г (18,56 ммоль) тетранатриевой соли ЭДТА и 5,92 г (18,56 ммоля)(СН 3 СO2)2 Нg и реакционную смесь нагревают при 90 С в течение 2 ч. После охлаждения до комнатной температуры к реакционной смеси добавляют 120 мл волы и экстрагируют хлористым метиленом (470 мл). Отделенную органическую фазу промывают насыщенным раствором NаНСО 3, насыщенным раствором NaCl,затем сушат над Na2SО 4. После удаления растворителя сырой продукт очищают флэшхроматографией на силикагеле, элюируя этилацетатом/легким петролейным эфиром 2:1, получая 83 мг (10%) (смолообразное твердое вещество) цис-4-метил-4,4 а,5,6-тетрагидро-(11 Н) 000975R6= H; R2=Me; a = двойная связь; b, c, e, f, g = ординарные связи]. 350 мг (40%) (кристаллы, т. пл. 148-150 С) 4-метил-1,2,5,6-тетрагидро-(11 Н)-бензо[с]хинолизин-3-она [соединение формулы (I), в котором Х=0, (QW)n= H; R1=R3=R4=R6=Н; R2=Me; b = двойная связь; a, c, e, f, g = ординарные связи] и 107 мг (12%) (смолообразное твердое вещество) 4-метил-5,6-дигидро-(11 Н)-бензо[с]хинолизин 3-она [соединение формулы I, в котором Х=0,(QW)2= H; R1=R3=R4=R6=H; R2=Me; a, b = двойные связи; c, e, f, g = ординарные связи]. Испытание активности Ингибирующая способность полученных соединений в отношении изоферментов 1 и 2 5-редуктазы была определена с использованием образцов ткани (например ткань простаты человека) или клеточных систем человека (например клетки DU 145), выражающих изоферменты 2 и 1, соответственно. Образцы инкубировали в присутствии тестостерона, меченного тритием, и после этого измеряли количество меченного дигидротестостерона, образующегося в отсутствии и в присутствии ингибитора. Соединения продемонстрировали высокую ингибирующую активность в отношении фермента-5-редуктазы (в особенности изофермента 1) с ингибированием выше 50% при концентрации 10-100 нМ. Для терапевтического введения соединения согласно изобретению готовили в форме фармацевтических композиций, содержащих действующее начало и органические или неорганические эксципиенты, подходящие для перорального, парэнтерального или местного введения композиций. Фармацевтические композиции могут быть, таким образом, в твердой форме (драже, суппозитории, кремы, мази), жидкой форме (растворы, суспензии, эмульсии) и могут,возможно, содержать стабилизаторы, консерванты, увлажнители, эмульгаторы, буферы или соли, используемые для поддержания равновесия осмотического давления, которые обычно используются в данной области техники. Обычно введение соединений осуществляют в соответствии с модальностью и количествами, используемыми для известных агентов,применяемых в тех же целях, принимая во внимание возраст и состояние пациентов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Бензо[с]-хинолизиновые формулы (I)R1, R2, R3, R4, R6 одинаковые или различные выбирают из группы, состоящей из Н, C1-8 алкила, С 2-8-алкенила, C2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана,циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, галогена, CN, азида,NRR',C1-8-алкиламино, ариламино, C1-8 алкилокси, арилокси, COOR, CONRR', где R иR' одинаковые или различные выбирают из группы, состоящей из Н, C1-8-алкила, циклопропана, циклобутана, циклопентана, циклогексана,циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, арил-С 1-8-алкила;R5 выбирают из группы, состоящей из Н,C1-8-алкила, COOR, CN, фенила, нафтила, насыщенного или ароматического гетероцикла,содержащего один или более атомов N;Q выбирают из группы, состоящей из простой связи, C1-8-алкила, С 2-8-алкенила, С 2-8 алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, СО,CONR, NR, где R является таким, как определено выше;W выбирают из группы, состоящей из Н,C1-8-алкила, С 2-8-алкенила, С 2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, трифторметила, C1-8 алкокси, С 1-8-алкокси-С 1-8-алкила, арил-С 1-8 алкила, фенила, нафтила, арилокси, ариламино,C1-8-алкилкарбонила, арилкарбонила, галогена,CN, NRR', C1-8-алкиламино, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, причем группы алкила,алкенила, алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана,циклооктана, норборнана, канфана, адамантана,фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, могут быть замещенными галогеном,OR, фенилом, NRR', CN, COOR, CONRR', C1-8 алкилом (где R и R' являются такими, как определено выше);n является целым числом в интервале от 1 до 4; 10 символозначает, что соответствующие связи а, b, с, d, e, f и g могут быть простыми или двойными связями; при условии, что когда b или f являются двойными связями, то группа R5 отсутствует; и при условии, что из формулы изобретения исключены следующие два соединения: 4 карбонитрил-2,3-дигидро-(1 Н)-бензо[с]хинолизин-3-он и 3,4-дигидро-1-фенил-4 аН-бензо[с] хинолизин-3-он; их фармацевтически приемлемые соли или эфиры. 2. Бензо[с]-хинолизиновые соединения формулы (I) по п.1, в которойR5 = Н, насыщенный или ароматический гетероцикл, содержащий один или более атомов 11 4-метил-4,4 а,5,6-тетрагидро-(11H)-бензо[с] хинолизин-3-он (цис) и (транс); 8-хлор-4-метил-1,2,5,6-тетрагидро-(11H)бензо[с]хинолизин-3-он; 4,8-диметил-1,2,5,6-тетрагидро-(11H)бензо[с]хинолизин-3-он; 4,8-диметил-4,4 а,5,6-тетрагидро-(11H)бензо[с]хинолизин-3-он (цис) и (транс); 8-хлор-4-метил-4,4 а,5,6-тетрагидро-(11H)бензо(с]хинолизин-3-он (цис) и (транс). 4. Способ получения соединений по п.1, в котором амидную группу соединения формулы(2) защищают защитной группой Z с образованием соединения (3) 12 осуществляют посредством реакции дихлордицианохинона (ДДХ) с соответствующими силиловыми эфирами енолов или посредством окисления ацетатом ртути насыщенного соединения,полученного, как заявлено выше, а возможное превращение группы Х осуществляют через соответствующие енолтрифлаты и последующее карбонилирование в присутствии диацетата палладия, трифенилфосфина и подходящего нуклеофильного реагента. 6. Соединение формулы (4)(4) в котором W, Q, n, R3, R4, R5 являются такими,как определено в п.1, и Z представляет защитную группу для амидогруппы, при условии, что когда R3=R4=R5=(WQ)n=Н, то Z не является этоксикарбонильной группой. 7. Фармацевтическая композиция, в которой действующим началом является соединение формулы (I)(3) вышеуказанное соединение (3) восстанавливают до соединения (4), например, боргидридом натрия в этаноле (рН 3)(в котором R1, R2, R6 являются такими, как определено выше) с таким силилирующим реагентом, как ангидрид триметилсилилтрифторметансульфоновой кислоты (TMSOTf), и, наконец,гидролизуют, например, гидрокарбонатом натрия с образованием конечного соединения формулы (I), в которой Х=0. 5. Способ по п.4, в котором возможное введение двойных связей в положения а или bR1, R2, R3, R4, R6 одинаковые или различные выбирают из группы, состоящей из Н, C1-8 алкила, С 2-8-алкенила, C2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана,циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, галогена, CN, азида,NRR',C1-8-алкиламино, ариламино, C1-8 алкилокси, арилокси, COOR, CONRR', где R иR', одинаковые или различные, выбирают из группы, состоящей из Н, C1-8-алкила, циклопропана, циклобутана, циклопентана, циклогексана,циклогептана, циклооктана, норборнана, канфана, адамантана, фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, арил-С 1-8-алкила;R5 выбирают из группы, состоящей из Н,C1-8-алкила, COOR, CN, фенила, нафтила, насыщенного или ароматического гетероцикла,содержащего один или более атомов N; Х выбирают из группы, состоящей из О,C(=O)R, COOR, NO2, CONR'R, в которой R и R' являются такими, как определено выше;Q выбирают из группы, состоящей из простой связи, С 1-8-алкила, С 2-8-алкенила, С 2-8 алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, СО, 13W выбирают из группы, состоящей из Н,C1-8-алкила, С 2-8-алкенила, С 2-8-алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана, циклооктана, норборнана, канфана, адамантана, трифторметила, C1-8 алкокси, С 1-8-алкокси-С 1-8-алкила, арил-С 1-8 алкила, фенила, нафтила, арилокси, ариламино,C1-8-алкилкарбонила, арилкарбонила, галогена,CN, NRR', C1-8-алкиламино, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, причем группы алкила,алкенила, алкинила, циклопропана, циклобутана, циклопентана, циклогексана, циклогептана,циклооктана, норборнана, канфана, адамантана,фенила, нафтила, насыщенного или ароматического гетероцикла, содержащего один или более атомов N, могут быть замещенными галогеном,OR, фенилом, NRR', CN, COOR, CONRR1, C1-8 алкилом (где R и R' являются такими, как определено выше);n является целым числом в интервале от 1 до 4; символозначает, что соответствующие связи а, b, с, d, e, f и g могут быть простыми или двойными связями; при условии, что когда b или f являются двойными связями, то группа R5 отсутствует; их фармацевтически приемлемые соли или эфиры 14 или их смеси в комбинации с подходящими фармацевтически приемлемыми эксципиентами. 8. Фармацевтическая композиция по п.7 для использования для ингибирования 5-R-I и/или 5-R-II изоферментов. 9. Фармацевтическая композиция по пп.7 и 8 в форме, пригодной для местного использования. 10. Применение соединения формулы (I) по п.7 в качестве лекарственного средства. 11. Применение соединения формулы (I) по п.7 для получения фармацевтической композиции, предназначенной для лечения угревой сыпи, алопеции, рака предстательной железы и гипертрофии предстательной железы у мужчин и гирсутизма у женщин. 12. Способ лечения патологий, связанных с 5-редуктазными ферментами, посредством введения пациенту фармацевтически активного количества фармацевтической композиции по п.7. 13. Способ лечения угревой сыпи, алопеции, рака предстательной железы и гипертрофии предстательной железы у мужчин и гирсутизма у женщин посредством введения фармацевтически активного количества фармацевтической композиции по п.7.
МПК / Метки
МПК: A61K 31/435, C07D 455/04, A61P 13/08
Метки: производные, ингибиторов, бензо[с]хинолизиновые, 5&alpha-редуктаз, использование, получение, качестве
Код ссылки
<a href="https://eas.patents.su/8-975-benzoshinolizinovye-proizvodnye-ih-poluchenie-i-ispolzovanie-v-kachestve-ingibitorov-5alpha-reduktaz.html" rel="bookmark" title="База патентов Евразийского Союза">Бензо[с]хинолизиновые производные, их получение и использование в качестве ингибиторов 5&alpha-редуктаз</a>
Следующий патент: Композиция для снятия боли и способ снятия боли
Случайный патент: Способ лечения оппозиционного расстройства












