Гетеробициклические производные в качестве ингибиторов hcv
Номер патента: 23642
Опубликовано: 30.06.2016
Авторы: Вандик Коэн, Рабуассон Пьер Жан-Мари Бернар, Версхюэрен Вим Гастон
Формула / Реферат
1. Соединение формулы I
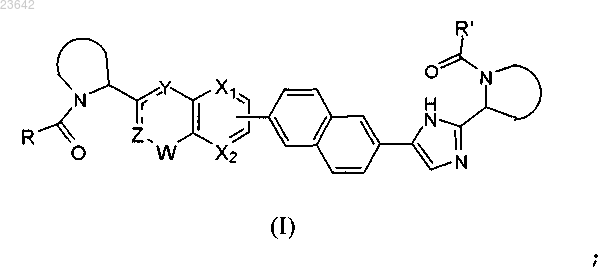
или его стереоизомер, в которых
каждый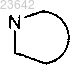 независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил, пиперидин-2-ил, 2-аза-бицикло[2.2.1]гептан-2-ил или октагидро-1Н-индол-2-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомами галогена;
независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил, пиперидин-2-ил, 2-аза-бицикло[2.2.1]гептан-2-ил или октагидро-1Н-индол-2-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомами галогена;
обозначает CR4=C-NH, NH-C=CH или NH-C=N;
X1 обозначает CH и Х2 обозначает CH; или
X1 обозначает CH и Х2 обозначает N; или
X1 обозначает N и Х2 обозначает CH;
W обозначает карбонил, сульфонил или CR5R6;
R и R' независимо выбраны из -CR1R2R3, причем
R1 выбран из C1-4алкила, возможно замещенного метокси, гидроксилом или диметиламино; C3-6
циклоалкила; тетрагидропиранила; фенила, возможно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4алкокси, трифторметокси, или 2 заместителя на смежных кольцевых атомах образуют 1,3-диоксолановую группу; бензила, возможно замещенного галогеном или метокси;
R2 выбран из амино, C1-4алкилоксикарбониламино; и
R3 обозначает водород или C1-4алкил, или
CR2R3 вместе образуют карбонил; или
CR1R3 образует циклопропильную группу;
R4 обозначает водород, C1-4алкил или циано;
R5 и R6, каждый независимо, обозначают C1-4алкил или
CR5R6 вместе образуют C3-7циклоалкил, оксетан, тетрагидрофуран;
или его фармацевтически приемлемые соли или сольват.
2. Соединение формулы I по п.1, в котором каждый 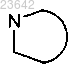 независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил или пиперидин-2-ил.
независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил или пиперидин-2-ил.
3. Соединение формулы I по п.1, в котором каждый 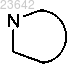 независимо обозначает пирролидин-2-ил или 2-аза-бицикло[3.1.0]гексан-3-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомов галогена.
независимо обозначает пирролидин-2-ил или 2-аза-бицикло[3.1.0]гексан-3-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомов галогена.
4. Соединение формулы I по любому из пп.1-3, в котором![]() обозначает CH=C-NH.
обозначает CH=C-NH.
5. Соединение по любому из пп.1-3, в котором R и R' являются одинаковыми.
6. Соединение по любому из пп.1-3, в котором R2 обозначает C1-4алкилоксикарбониламино и R3 обозначает водород.
7. Соединение по любому из пп.1-3, в котором R1 выбран из C1-4алкила; C2-4алкила, замещенного метокси или гидроксилом; и фенила, возможно замещенного 1 или 2 заместителями, независимо выбранными из галогена.
8. Соединение по любому из пп.1-3 формулы Ia
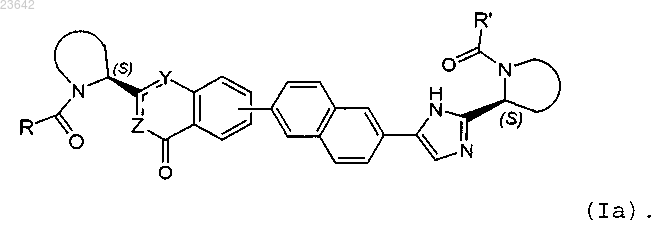
9. Применение соединения по по любому из пп.1-8 для профилактики или лечения инфекции HCV у млекопитающего.
10. Фармацевтическая композиция для профилактики или лечения инфекции HCV у млекопитающего, включающая соединение по любому из пп.1-8 и фармацевтически приемлемый носитель.
11. Применение фармацевтической композиции по п.9 для профилактики или лечения инфекции HCV у млекопитающего.
12. Продукт, содержащий (а) соединение формулы I, как определено в любом из пп.1-8, и (b) другой ингибитор HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении инфекций HCV.
Текст
(71)(73) Заявитель и патентовладелец: ЯНССЕН САЙЕНСИЗ АЙРЛЭНД ЮCИ (IE) В изобретении представлены ингибиторы репликации HCV формулы I включая стереохимически изомерные формы, и их соли, гидраты, сольваты, в которой R и R' имеют значения, определенные здесь. Изобретение также относится к способам получения указанных соединений, к содержащим их фармацевтическим композициям и к их применению индивидуально или в комбинации с другими ингибиторами HCV, в терапии HCV. Техническая область Это изобретение относится к гетеробициклическим производным, в частности производным хинолинона, которые являются ингибиторами вируса гепатита С (HCV), к их синтезу и к их применению индивидуально или в комбинации с другими ингибиторами HCV, в лечении или профилактике HCV. Уровень техникиHCV представляет собой одноцепочечный вирус с позитивным РНК-геномом, принадлежащий к семейству вирусов Flaviviridae рода hepacivirus. Вирусный геном транслируется в единственную открытую рамку считывания, которая кодирует множество структурных и неструктурных белков. После начальной острой инфекции у большинства инфицированных людей развивается хронический гепатит, потому что HCV реплицируется преимущественно в гепатоцитах, но не является непосредственно цитопатическим. В частности, недостаток мощного Т-лимфоцитарного ответа и высокая способность вируса к мутациям, по-видимому, промотируют высокую степень хронической инфекции. Хронический гепатит может развиваться в фиброз печени, приводя к циррозу, заболеванию печени терминальной стадии, и HCC (гепатоцеллюлярный рак), делая это ведущей причиной трансплантаций печени. Существует шесть главных генотипов HCV и более 50 подтипов, которые по-разному распределены географически. Генотип HCV 1 является преобладающим генотипом в Европе и в США. Обширная генетическая гетерогенность HCV имеет важные диагностические и клинические проявления, возможно объясняя трудности в разработке вакцин и отсутствие реакции на существующие виды терапии. Передача HCV может происходить через контакт с загрязненной кровью или продуктами крови,например после переливания крови или внутривенного использования лекарственного средства. Введение диагностических тестов, используемых в скрининге крови, привело к снижению случаев посттрансфузионной инфекции HCV. Однако, учитывая медленную прогрессию к заболеванию печени терминальной стадии, существующие инфекции продолжают представлять собой серьезное медицинское и экономическое бремя в течение многих десятилетий. Текущие терапии HCV основаны на (ПЭГилированном) альфа-интерфероне (IFN-) в комбинации с рибавирином. Эта комбинированная терапия приводит к замедлению вирусологического ответа у 40% пациентов, инфицированных генотипом 1 HCV, и приблизительно 80% инфицированных генотипами 2 и 3. Помимо ограниченной эффективности в отношении генотипа HCV 1, эта комбинированная терапия имеет значительные побочные эффекты, включая гриппоподобные симптомы, гематологические патологии и психоневрологические симптомы. Следовательно, существует потребность в более эффективных,более удобных и лучше переносимых видах лечения. Опыт использования ВИЧ-препаратов, в частности ингибиторов ВИЧ-протеазы, позволил установить, что субоптимальные фармакокинетики и сложные режимы введения быстро приводят к уменьшению комплаенса. Это, в свою очередь, означает, что концентрация в течение 24 ч (минимальная плазменная концентрация) для соответствующих лекарственных средств в ВИЧ режимах часто падает ниже порога IC90 или ED90 в течение большей части дня. Предполагается, что уровень в течение 24 ч по меньшей мере IC50, и более реалистично IC90 или ED90, является существенным для замедления развития мутантов,"ускользнувших" от лекарственного средства. Достижение фармакокинетики и скорости метаболизма лекарственных средств, необходимых для обеспечения таких уровней, представляет собой серьезную задачу для разработки лекарственных средств. Белок NS5A HCV расположен ниже белка NS4B и выше белка NS5B. После посттрансляционного расщепления вирусной серинпротеазой NS3/4A, NS5A вызревает в цинксодержащий фосфопротеин с тремя доменами, который существует либо в форме гипофосфорилированных (56-kDa, р 56), либо гиперфосфорилированных разновидностей (58-kDa, p58). NS5A HCV участвует во множестве аспектов жизненного цикла вируса, включая репликацию вируса и сборку инфекционных частиц, а также модуляцию среды клетки-хозяина. Хотя этому белку не было приписано ферментативных функций, он, как сообщается, взаимодействует с многочисленными вирусными и клеточными факторами. Во множестве патентов и заявок на патент раскрыты соединения с ингибирующей активностью в отношении HCV, в частности, мишенью которых является NS5A. В WO 2006/133326 раскрыты производные стильбена, в то время как в WO 2008/021927 и WO 2008/021928 раскрыты производные дифенила, имеющие NS5A HCV ингибирующую активность. В WO 2008/048589 раскрыты производные 4(фенилэтинил)-1H-пиразола и их противовирусное применение. В WO 2008/070447 раскрыт широкий диапазон HCV ингибирующих соединений, включающих бензимидазольную группу. В WO 2010/017401 и WO 2010/065681 раскрыты бис-имидазольные ингибиторы HCV NS5A. Существует потребность в ингибиторах HCV, которые могут преодолеть недостатки текущей терапии HCV, такие как побочные эффекты, ограниченная эффективность, развитие резистентности и снижение комплаенса, а также улучшить замедленный ответ вирусной нагрузки. Настоящее изобретение относится к группе HCV ингибирующих гетеробициклических производных, в частности производных хинолинона, с полезными свойствами в отношении одного или более следующих параметров: противовирусная эффективность, благоприятный профиль развития резистентности, сниженная или отсутствующая токсичность и генотоксичность, благоприятные фармакокинетические и фармакодинамические свойства, легкость составления и введения и ограниченное или отсутст-1 023642 вующее межлекарственное взаимодействие, в частности, с другими анти-HCV средствами. Соединения по изобретению могут также быть привлекательными вследствие того, что они не проявляют активности против других вирусов, в частности против ВИЧ. ВИЧ-инфицированные пациенты часто страдают со-инфекциями, такими как HCV. Лечение таких пациентов ингибитором HCV, который также ингибирует ВИЧ, может привести к появлению резистентных штаммов ВИЧ. Описание изобретения В одном аспекте настоящее изобретение относится к соединениям, которые могут быть представлены формулой I включая любые их возможные стереоизомеры, в которой каждый независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил, пиперидин 2-ил, 2-аза-бицикло[2.2.1]гептан-2-ил или октагидро-1 Н-индол-2-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомами галогена; обозначает CR4=C-NH, NH-C=CH или NH-C=N; Х 1 обозначает CH, и Х 2 обозначает CH; илиR и R' независимо выбраны из -CR1R2R3, причемR1 выбран из C1-4 алкила, возможно замещенного метокси, гидроксилом или диметиламино; C3-6 циклоалкила; тетрагидропиранила; фенила, возможно замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4 алкокси, трифторметокси, или 2 заместителя на смежных кольцевых атомах образуют 1,3-диоксолановую группу; бензила, возможно замещенного галогеном или метокси;R3 обозначает водород или C1-4 алкил, илиR5 и R6 каждый независимо обозначают C1-4 алкил; илиCR5R6 вместе образуют C3-7 циклоалкил, оксетан, тетрагидрофуран; или к их фармацевтически приемлемым солям или сольвату. В другом аспекте изобретение относится к применению соединений формулы I или их подгрупп,как определено здесь, для ингибирования HCV. В первом варианте осуществления настоящего изобретения каждый независимо обозначает пирролидин-2-ил, 2-аза-бицикло[3.1.0]гексан-3-ил или пиперидин-2-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомами галогена. Во втором варианте осуществления настоящего изобретения каждый независимо обозначает пирролидин-2-ил или 2-аза-бицикло[3.1.0]гексан-3-ил, причем каждый из указанных гетероциклов может быть замещен одним или более атомов галогена. В третьем варианте осуществления настоящего изобретения обозначает CH=C-NH. В другом варианте осуществления R и R' являются одинаковыми. В другом варианте осуществления R2 обозначает C1-4 алкилоксикарбониламино, и R3 обозначает водород. В другом варианте осуществления R1 выбран из C1-4 алкила; C2-4 алкила, замещенного метокси или гидроксилом; и фенила, в случае необходимости замещенного 1 или 2 заместителями, независимо выбранными из галогена. В другом аспекте изобретение относится к применению соединения формулы I или его фармацевтически приемлемой соли, гидрата или сольвата в лечении или профилактике инфекции HCV. Репрезентативные генотипы HCV в контексте лечения или профилактики в соответствии с изобретением включают, но не ограничены ими, генотип 1b (распространенный в Европе) и 1 а (распространенный в Северной Америке). Изобретение также относится к способу лечения или профилактики инфекцииHCV, в частности генотипа 1 а или 1b, включающему введение пациенту терапевтически эффективного количества соединения, как определено выше. Чистые стереоизомерные формы соединений и промежуточных соединений, как указано здесь, определяют как изомеры, в основном не содержащие других энантиомерных или диастереомерных форм той же самой основной молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистые" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от по меньшей мере 80% (то есть минимум 90% одного изомера и максимум 10% других возможных изомеров) до стереоизомерного избытка 100% (то есть 100% одного изомера и ни одного другого), в частности к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от 90 до 100%, более предпочтительно имеющим стереоизомерный избыток от 94 до 100% и наиболее предпочтительно имеющим стереоизомерный избыток от 97 до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" должны пониматься подобным образом, но в отношении энантиомерного избытка и диастереомерного избытка соответственно рассматриваемой смеси. Чистые стереоизомерные формы или стереоизомеры соединений и промежуточных соединений по изобретению могут быть получены с применением процедур, известных из уровня техники. Например,энантиомеры могут быть отделены друг от друга селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Примерами этого являются винная кислота,дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфоновая кислота. Альтернативно,энантиомеры могут быть разделены хроматографическими методиками с использованием хиральных стационарных фаз. Указанные стереохимически чистые изомерные формы могут также быть получены из соответствующих чистых стереоизомерных форм подходящих исходных материалов, при условии, что реакция происходит стереоспецифически. Предпочтительно, если желателен определенный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах предпочтительно используют энантиомерно чистые исходные материалы. Диастереомерные рацематы соединений формулы I могут быть получены отдельно обычными способами. Подходящими физическими методами разделения, которые могут использоваться, являются,например, селективная кристаллизация и хроматография, например хроматография на колонках или надкритическая жидкостная хроматография. Соединения формулы I и подгруппы соединений формулы I, как определено выше, имеют несколько центров хиральности. Интерес представляют стереогенные центры кольца пирролидина по атому 2 углерода. Конфигурация в этом положении может быть той, которая соответствуя L-пролину, то есть Особенный интерес представляют соединения формулы I или их подгруппы, как определено здесь,которые отвечают формуле Ia в частности. Также интерес представляет конфигурация группы -CR1R2R3: когда R1 выбран из C1-4 алкила, в случае необходимости замещенного метокси, гидроксилом или диметиламино; C3-6 циклоалкила и тетрагидропиранила, тогда S-конфигурация является предпочтительной; когда R1 выбран из фенила, в случае необходимости замещенного 1, 2 или 3 заместителями, независимо выбранными из галогена, C1-4 алкокси,трифторметокси, или 2 заместителя на смежных кольцевых атомах образуют 1,3-диоксолановую группу; и гетероарила; тогда R-конфигурация является предпочтительной. Фармацевтически приемлемые соли присоединения включают формы соли присоединения с терапевтически активной нетоксичной кислотой и основанием соединений формулы (I) или их подгрупп. Интерес представляют свободные, то есть несолевые формы соединений формулы I, или любой подгруппы соединений формулы I, определенной здесь. Фармацевтически приемлемые соли присоединения с кислотой могут быть получены обработкой формы основания такой подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородная или бромистоводородная кислота, серная, азотная, фосфорная и т.п. кислоты; или органические кислоты, такие как,например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то есть этановая дикислота), малоновая, янтарная (то есть бутановая дикислота), малеиновая, фумаровая, яблочная (то есть гидроксибутановая дикислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и т.п. кислоты. Наоборот, указанные формы соли могут быть преобразованы обработкой подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, могут также быть преобразованы в их соли присоединения с основанием, в частности формах соли присоединения с металлом или амином, обработкой подходящими органическими и неорганическими основаниями. Подходящие формы соли с основанием включают, например, соли аммония, соли щелочного и щелочно-земельного металла, например соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. Термин "сольваты" охватывает любые фармацевтически приемлемые сольваты, которые соединения формулы I, а также их соли, могут образовывать. Такими сольватами являются, например гидраты,алкоголяты, например этанолаты, пропанолаты и т.п. Некоторые из соединений формулы I могут также существовать в таутомерных формах. Например,таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-C(O)=N-). Таутомерные формы, хотя они явно не обозначены в структурных формулах, представленных здесь, включены в рамки настоящего изобретения. В рамках изобретения "C1-4 алкил", как группа или часть группы, определяет насыщенные углеводородные группы с прямой или разветвленной цепью, включающие от 1 до 4 атомов углерода, такие как,например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. В рамках настоящего изобретения интерес среди C1-4 алкилов представляет C3-4 алкил, то есть углеводородные группы с прямой или разветвленной цепью, имеющие 3 или 4 атома углерода, такие как 1-пропил, 2 пропил, 1-бутил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Особенный интерес может представлять разветвленный C3-4 алкил, такой как 2-пропил, 2-бутил, 2-метил-1-пропил, 2-метил-2-пропил. Термин "C3-6 циклоалкил", как группа или ее часть, определяет насыщенную циклическую углеводородную группу, включающую от 3 до 6 атомов углерода, которые вместе образуют циклическую структуру. Примеры C3-6 циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил."C1-4 алкокси", как группа или часть группы, означает группу формулы -O-C1-4 алкил, в которой C1-4 алкил имеет значение, определенное выше. Примерами C1-4 алкокси являются метокси, этокси, нпропокси, изопропокси. Термин "галоген" является родовым по отношению к фтору, хлору, брому и йоду. В рамках изобретения термин "(=O)" или "оксо" образует карбонильную группу, когда он присоединен к атому углерода. Следует отметить, что атом может быть замещен оксогруппой, только когда валентность этого атома это допускает. В рамках изобретения определение "арила", как группы или части этого, означает ароматическую кольцевую структуру, в случае необходимости включающую один или два гетероатома, выбранных из N,О и S, в частности из N и О. Указанная ароматическая кольцевая структура может иметь 5 или 6 кольцевых атомов. В рамках изобретения приставка "гетеро" в определении группы означает, что группа включает по меньшей мере 1 гетероатом, выбранный из N, О и S, в частности N и О. Например, термин "гетероарил" означает ароматическую кольцевую структуру, как определено для термина "арил", включающую по меньшей мере 1 гетероатом, выбранный из N, О и S, в частности из N и О, например фуранил, оксазолил,пиридинил. Альтернативно, термин "гетероС 3-6 циклоалкил" означает насыщенные циклические углеводородные группы, определенные для "C3-6 циклоалкила", дополнительно включающие по меньшей мере 1 гетероатом, выбранный из N, О и S, в частности из N и О, например тетрагидрофуранил, тетрагидропиранил, пиперидинил. Если положение группы в молекуле не определено (например, заместитель на фениле) или представлено плавающей связью, такая группа может быть позиционирована на любом атоме такой молекулы, при условии, что получившаяся структура химически стабильна. Когда любая переменная присутствует в молекуле более одного раза, каждое определение является независимым. Всякий раз, когда здесь используется термин "соединения формулы I" или "соединение по изобретению" или подобные термины, они включают соединения формулы I, включая возможные стереоизомерные формы, и их фармацевтически приемлемые соли и сольваты. Общие способы синтеза. Схема 1 Строительные блоки, использованные в синтезе соединений формулы I, описаны в схеме 1. Аминокетон IIa (схема 1, A=NH2), где X обозначает галоген, в частности бром или йод, вводят в реакцию сочетания с соответственно защищенным производным III, в котором PG' обозначает защитную группу на азоте, предпочтительно трет-бутоксикарбонил, в присутствии реагента сочетания для ацилирования аминогруппы, предпочтительно HATU, в присутствии основания, такого как DIPEA. Таким образом образованное промежуточное соединение циклизуют в соединение имидазола общей формулы IV обработкой ацетатом аммония, предпочтительно при температуре, составляющей от 0 до 150C. Альтернативно, промежуточный имидазол IV может быть получен сочетанием -галогенкетона IIb,в котором X и А каждый независимо обозначают атом галогена, X предпочтительно выбран из йода или брома и А предпочтительно выбран из хлора, брома или йода, с соответственно защищенным соединением III, в котором PG' является защитной группой на азоте, предпочтительно трет-бутоксикарбонилом, в присутствии подходящего основания, например DIPEA, с последующей циклизацией до промежуточного соединения имидазола IV, как описано выше. Это промежуточное соединение IV может быть преобразовано в эфир бороновой кислоты формулы V в условиях, катализируемых Pd, например в присутствииPd(dppf)Cl2, бис(пинаколято)диборона и основания, например ацетата калия. Другие строительные блоки описаны в схемах 2 а, 2b, 2 с и 3 а, 3b, 3 с, 3d. Схема 2 а В схеме 2 а кислотное производное VI превращают в -кетоэфир VII способами, известными в литературе, например активацией карбоновой кислоты с использованием DCC или CDI, с последующей, например, реакцией с кислотой и последующим декарбоксилированием Мелдрама в присутствии спирта,или, в качестве альтернативы, как описано в примерах, конденсацией с моноалкилмалонатной солью магния с последующим декарбоксилированием. -Кетоэфир VII (Ralk относится к C1-4 алкилу) затем конденсируют с VIII или X с последующей циклизацией в IXa и IXb соответственно (X' обозначает галоген,выбранный из йода или брома, предпочтительно бром). Эта конденсация может быть осуществлена в толуоле в присутствии уксусной кислоты. Циклизация в соединения формулы IXa и IXb может быть осуществлена термически нагреванием с обратным холодильником в Dowtherm А (смесь дифенилоксида и бифенила). Предпочтительным примером PGA защитной группы является бензилоксикарбонил Альтернативно, соединения общей формулы IXc могут быть получены катализируемой Pd последовательностью реакций карбонилирование Sonogashira/циклизация, как описано в схеме 2b. Исходя из Соединения общей формулы IXd, где R4 обозначает Н или C1-4 алкил, могут быть получены, как показано в схеме 2 с. Соединение VIII (X' является галогеном, выбранным из йода или брома, предпочтительно бромом) может быть преобразовано в соединение А.IV, например, обработкой VIII с использованием BCl3 в растворителе, таком как бензол, при температуре ниже, чем комнатная температура, например при охлаждении льдом, с последующей обработкой AlCl3 и нитрилом A.III (R4 обозначает Н или C14 алкил), например при нагревании с обратным холодильником в бензоле. После гидролиза может быть получено соединение А.IV. Формирование амидной связи исходя из А.IV и VI приводит к формированию соединения A.V. Эта реакция может быть осуществлена путем превращения соединения VI в галогенангидрид кислоты, например фторангидрид кислоты или хлорангидрид кислоты, с последующей реакцией с А.IV в присутствии основания. Другим примером является формирование A.V из VI и А.IV при помощи реагента сочетания 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида гидрата Синтез соединений формулы XIII описан в схеме 3 а. Формирование амидной связи исходя из XI (X' является галогеном, выбранным из йода или брома, предпочтительно бромом) и VI приводит к формированию соединения XII. Эта реакция может быть осуществлена путем превращения соединения VI в галогенангидрид кислоты, например фторангидрид кислоты или хлорангидрид кислоты, с последующей реакцией с XI в присутствии основания. Другим примером является формирование XII из VI и XI при помощи реагента сочетания 4-(4,6-диметокси[1.3.5]триазин-2-ил)-4-метилморфолиния хлорида гидрата(DMTMM). Соединения XII затем превращают в соединения общей формулы XIII в основных условиях,например KOH в этаноле. Схема 3b Соединение общей формулы А.XI (X' является галогеном, выбранным из йода или брома, предпочтительно бромом) может быть получено, как показано в схеме 3b. Используя способы, описанные в литературе (WO 2007039578; Tet. Lett. 2001, 42, 33, 5601-5603), фторид А.VI может быть превращен в А.IX. Последний подвергают реакции сочетания с галогенангидридом кислоты А.Х (где X" обозначает хлор или фтор) в присутствии основания, например триэтиламина, с последующей циклизацией в соединение А.XI в основных условиях, таких как, например, 2 н. водный раствор K2CO3 при нагревании с обратным холодильником. Схема 3 с Соединение общей формулы А.XVI может быть получено, как показано в схеме 3 с. Диалкирование сложного эфира А.XII подходящим алкилгалогенидом, например MeI в случае R5=R6=Метил, в присутствии основания, например NaH, приводит к соединению А.XIII. Этот сложный эфир может быть превращен в соединение А. XIV с последующим гидролизом, формированием ацилазида (например, обработкой соответствующей кислоты А.XIII дифенилфосфорилазидом) и реакцией Curtius. После восстановления соединения А.XIV в А.XV последнее соединение превращают в соединение А.XVI реакцией сочетания с кислотой VI, например обработкой с HATU и основанием, таким как триэтиламин, и последующей циклизацией в соединение А.XVI в кислых условиях, например в уксусной кислоте, при 50C. Схема 3d Альтернативная процедура синтеза соединения А.XIV (например, в случае, если R5 и R6 вместе с углеродом, к которому они присоединены, образуют оксетан) изображена в схеме 3d. Анион, полученный реакцией замещения металла в металлоорганическом соединении, например бутиллитии, и соединение А.XVII при низкой температуре, например при -78C, может быть введен в реакцию с сульфинамидом А.XVIII. После удаления защитной группы от сформированного сульфинамида в кислых условиях получают соединение А.XIV, которое может быть далее преобразовано в А.XVI, как описано в схеме 3 с. Схема 4 Строительные блоки А.XIX, полученные способами, подобными описанным в схемах 2 (а, b, с) и схемах 3 (а, b, с и d) и V (схема 1), могут быть превращены в структуру XIV с использованием условий Синтез соединений общей формулы XIVa описан в схеме 5. Сочетание Suzuki-Miyaura между галогенидом XV и эфиром бороновой кислоты V приводит к промежуточному соединению XVI, которое может быть преобразовано в XIVa обработкой основанием, например бутиллитием, и реакцией с XVII. Схема 6 структуры XIV подпадают под определение соединений формулы I. В этом случае схемы 4 и 5 описывают синтез соединений формулы I. Альтернативно, XIV может быть подвергнуто удалению защитной группы, как описано в схеме 6. Например, обработкой кислотой (например, HCl в iPrOH), когда PG или PG' обозначают третбутилоксикарбонил (Boc). Соединение XX может быть преобразовано в соединение формулы Ib, в которой R и R' являются одинаковыми, обычным формированием амида между кислотой R-(C=O)OH и бисамином XX, как описано в схеме 7. Предпочтительным способом является использование HATU в присутствии основания, такого как DIPEA. Схема 7 Если PG' отличается от PG, возможно селективное удаление защитной группы, как описано в схеме 6, приводящее к соединениям XVIII или XIX исходя из XIV. Например, в случае, если PG' обозначает трет-бутилоксикарбонил (Boc) и PG обозначает бензилоксикарбонил (Cbz), селективное удаление защитной группы может быть осуществлено путем удаления защитной группы Boc в кислых условиях, таких как HCl в iPrOH, при комнатной температуре или путем удаления CBz-защитной группы в восстанавливающих условиях, таких как водород в присутствии катализатора, например Pd(OH)2. Когда PG' обозначает R' (C=O)- или PG обозначает R(C=O)-, синтез соединений XIV, как описано в схеме 1-5, приводит к соединениям формулы XXI (схема 8) или XXIII (схема 9) соответственно. Соединения XXI и XXIII могут быть получены из соединения XIX и R'(C=O)OH или XVIII и R(C=O)OH соответственно в типичных условиях формирования амида. Эти соединения могут затем быть преобразованы в соединения формулы I. Селективное удаление защитной группы XXI с получением XXII с последующим формированием амидной связи между XXII и R(C=O)-OH приводит к соединениям формулы I. Аналогичная последовательность реакций может затем быть использована для трансформации XXIII в В другом аспекте настоящее изобретение относится к фармацевтической композиции, включающей терапевтически эффективное количество соединения формулы I, как определено здесь, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в этом контексте означает количество, достаточное, для того чтобы стабилизировать или уменьшить инфекцию HCV у инфицированных пациентов, или количество, достаточное, для того чтобы предотвратить инфекцию HCV у пациентов с риском инфицирования. В другом аспекте это изобретение относится к способу получения фармацевтической композиции, как определено здесь, который включает тесное смешение фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы I, как определено здесь. Поэтому соединения согласно настоящему изобретению или любая их подгруппа могут быть составлены в различные фармацевтические формы для введения. В качестве подходящих композиций могут быть названы все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по изобретению эффективное количество конкретного соединения, в случае необходимости в форме соли присоединения или комплекса с металлом, в качестве активного ингредиента объединяют в тесной смеси с фармацевтически приемлемым носителем,причем этот носитель может принимать разнообразные формы в зависимости от формы препарата, же-8 023642 лаемой для введения. Эти фармацевтические композиции желательны в подходящей стандартной лекарственной форме, особенно для перорального, ректального, чрескожного введения или введения парентеральной инъекцией. Например, для получения композиций в пероральной лекарственной форме может использоваться любая обычная фармацевтическая среда, такая как, например, вода, гликоли, масла,спирты и т.п. в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие,дезинтеграторы и т.п. в случае порошков, пилюль, капсул и таблеток. Из-за легкости их введения таблетки и капсулы представляют собой самые предпочтительные пероральные стандартные лекарственные формы, когда очевидно используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерилизованную воду, по меньшей мере, в значительной степени, хотя могут быть включены другие ингредиенты, например, облегчающие растворимость. Например, могут быть получены инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь раствора глюкозы и солевого раствора. Могут также быть получены инъецируемые суспензии, когда могут использоваться подходящие жидкие носители, суспендирующие агенты и т.п. Также в рамки изобретения включены твердые формы препаратов, предназначенные для превращения незадолго до использования в жидкие формы препаратов. В композициях, подходящих для чрескожного введения, носитель в случае необходимости включает средство, усиливающее проникновение,и/или подходящее смачивающее вещество, в случае необходимости комбинированное с подходящими добавками любой природы в незначительных соотношениях, причем эти добавки не оказывают значительного вредного эффекта на кожу. Соединения согласно настоящему изобретению могут также вводиться через пероральную ингаляцию или вдувание в форме раствора, суспензии или сухого порошка с использованием любой известной из уровня техники системы доставки. Особенно предпочтительно составлять указанные фармацевтические композиции в стандартной лекарственной форме для простоты введения и однородности дозировки. Стандартная лекарственная форма в рамках изобретения относится к физически дискретным единицам, подходящим в качестве разовых доз, причем каждая единица содержит предопределенное количество активного ингредиента, вычисленное таким образом, чтобы произвести желаемый терапевтический эффект, в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки(включая таблетки с насечкой или таблетки, покрытые оболочкой), капсулы, пилюли, суппозитории, пакетики с порошком, пастилки, инъецируемые растворы или суспензии и т.п. и их разделенные однотипные наборы. Соединения формулы I показывают активность против HCV и могут использоваться в лечении и профилактике инфекции HCV или заболеваний, связанных с HCV. Последние включают прогрессивный фиброз печени, воспаление и некроз, приводящие к циррозу, заболевание печени терминальной стадии и гепатоцеллюлярный рак. Множество соединений по изобретению, кроме того, как известно, являются активными против мутантных штаммов HCV. Дополнительно, соединения по изобретению могут иметь привлекательные свойства в отношении биодоступности, демонстрировать благоприятный фармакокинетический профиль, включая приемлемый период полужизни, AUC (область под кривой), пиковые и промежуточные значения и отсутствие неблагоприятных явлений, таких как недостаточно быстрое начало действия или задержка в ткани. Противовирусная активность соединений формулы I in vitro против HCV может быть проверена в клеточной системе репликона HCV, основанной на Lohmann et al. (1999) Science 285:110-113, с дальнейшими модификациями, описанными Krieger et al. (2001) Journal of Virology 75:4614-4624 (включенном в настоящее описание путем ссылки), что далее иллюстрируется в разделе примеров. Эта модель, хотя она не является полной моделью инфекции для HCV, широко используется в качестве самой надежной и эффективной из доступных в настоящее время моделей автономной репликации РНК HCV. Следует отметить, что важно отличать соединения, которые специфически противодействуют функциями HCV, от тех, которые демонстрируют цитотоксические или цитостатические эффекты в модели репликона HCV и как следствие вызывают уменьшение концентрации РНК HCV или связанного репортерного фермента. В области оценки клеточной цитотоксичности известны тесты, основанные, например, на активности митохондриальных ферментов, с использованием флуорогенного окислительно-восстановительного потенциала красителя, такого как диазорезорцин. Кроме того, существуют способы контрскрининга клеток для оценки неселективного ингибирования связанной активности репортерного гена, такого как люцифераза светляка. Подходящие типы клеток могут быть оборудованы стабильной трансфекцией репортерным геном люциферазы, экспрессия которого зависит от конститутивно активного гена-промотора, и такие клетки могут использоваться в качестве контрскрининга для исключения неселективных ингибиторов. Вследствие их анти-HCV свойств соединения формулы I или их подгруппы, как определено здесь,могут быть использованы в ингибировании репликации HCV, в частности в лечении теплокровных животных, в частности человека, инфицированных HCV, и для профилактики инфекций HCV у теплокровных животных, в частности человека. Настоящее изобретение, кроме того, относится к способу лечения теплокровного животного, в частности человека, инфицированного HCV или подвергающегося риску инфекции HCV, причем указанный способ включает введение терапевтически или профилактически эф-9 023642 фективного количества соединения формулы I, как определено выше. Соединения формулы I, как определено здесь, могут поэтому использоваться в качестве лекарственного средства, в частности в качестве лекарственного средства против HCV. Указанное использование в качестве лекарственного средства или способ лечения включает системное введение инфицированным HCV пациентам или пациентам, склонным к инфекции HCV, количества, эффективного для уменьшения или предотвращения симптомов и состояний, связанных с инфекцией HCV. Настоящее изобретение также относится к применению соединений по изобретению в получении лекарственного средства для лечения или профилактики инфекции HCV. В целом считается, что эффективное противовирусное суточное количество составляет от приблизительно 0,01 до приблизительно 50 мг/кг или от приблизительно 0,02 до приблизительно 30 мг/кг массы тела. Может быть предпочтительным введение необходимой дозы в форме двух, трех, четырех или больше поддоз через подходящие интервалы времени в течение дня. Указанные поддозы могут быть составлены как стандартные лекарственные формы, например содержащие от приблизительно 1 до приблизительно 500 мг, или от приблизительно 1 до приблизительно 300 мг, или от приблизительно 1 до приблизительно 100 мг, или от приблизительно 2 до приблизительно 50 мг активного ингредиента на стандартную лекарственную форму. Комбинированная терапия. Изобретение также относится к комбинации соединения формулы I, его фармацевтически приемлемой соли или сольвата и другого противовирусного соединения, в частности другого соединения противHCV. Термин "комбинация" относится к продукту, содержащему (а) соединение формулы I, как определено выше, и (b) другой анти-HCV ингибитор в качестве комбинированного препарата для одновременного, раздельного или последовательного использования в лечении инфекций HCV. Комбинации согласно настоящему изобретению могут использоваться в качестве лекарственных средств. Соответственно настоящее изобретение относится к применению соединения формулы (I) или любой их подгруппы, как определено выше, для получения лекарственного средства, пригодного для ингибирования активности HCV у млекопитающего, инфицированного вирусами HCV, причем указанное лекарственное средство используют в комбинированной терапии, причем указанная комбинированная терапия, в частности, включает соединение формулы (I) и по меньшей мере одно другое средство против HCV, например IFN-, ПЭГилированный IFN-, рибавирин, албуферон, тарибавирин, нитазоксанид Debio025 или их комбинацию. Другие средства, которые могут быть комбинированы с соединениями согласно настоящему изобретению, включают, например нуклеозидные и ненуклеозидные ингибиторы полимеразы HCV, ингибиторы протеазы, ингибиторы геликазы, ингибиторы NS4B и средства, которые функционально ингибируют внутренний сайт связывания рибосомы (IRES), и другие средства, которые ингибируют прикреплениеHCV к клетке или проникновение вируса, трансляцию РНК HCV, транскрипцию РНК HCV, репликацию или созревание HCV, сборку или высвобождение вируса. Специфические соединения в этих классах включают ингибиторы протеазы HCV, такие как телапревир (VX-950), боцепревир (SCH-503034), нарлапревир (SCH-900518), ITMN-191 (R-7227), ТМС-435350 (ТМС-435), МК-7009, BI-201335, BI-2061 (цилупревир), BMS-650032, ACH-1625, ACH-1095, GS 9256, VX-985, IDX-375, VX-500, VX-813, РНХ-1766,РНХ 2054, IDX-136, IDX-316, АВТ-450, ЕР-013420 (и родственные соединения) и VBY-376; нуклеозидные ингибиторы полимеразы HCV, пригодные для использования в изобретении, включают ТМС 649128,R7128, PSI-7851, PSI-7977, IDX-189, IDX-184, IDX-102, R1479, UNX-08189, PSI-6130, PSI-938 и PSI-879 и различные другие нуклеозиды и аналоги нуклеотидов и ингибиторы HCV, включая полученные как 2'С-метил-модифицированные нуклеозиды, 4'-аза-модифицированные нуклеозиды и 7'-деазамодифицированные нуклеозиды. Ненуклеозидные ингибиторы полимеразы HCV, пригодные для использования в изобретении, включают HCV-796, HCV-371, VCH-759, VCH-916, VCH-222, ANA-598, МК 3281, АВТ-333, АВТ-072, PF-00868554, BI-207127, GS-9190, А-837093, JKT-109, GL-59728, GL-60667,АВТ-072, AZD-2795 и ТМС 647055. Следующие примеры предназначены для иллюстрации изобретения и не должны рассматриваться как ограничение его объема. Экспериментальная часть. Способы LCMS. Способ А. Общий: мобильная фаза А: H2O (0,1% TFA); В: CH3CN (0,05% TFA), время остановки: 2 мин; время градиента (мин) [% А/% В] 0,01 [90/10]-0,9 [20/80]-1,5 [20/80]-1,51 [90/10]; поток: 1,2 мл/мин; темп. колонки: 50C Способ A1. Shimadzu LCMS 2010, XR-ODS Shim-pack, 330 мм Способ А 2. Xtimate C18 2,130 мм, 3 мкм Способ A3. SHIMADZU Shim pack 230 Способ А 4. Welch Xtimate C18 2,130 мм, 3 мкм Способ В. Agilent 1100, YMC-PACK ODS-AQ, 502,0 мм 5 мкм мобильная фаза А: H2O (0,1% TFA; В:CH3CN (время остановки 0,05% TFA: 10 мин; время градиента (мин) [% А/% В] 0 [100/0]-1 [100/0]-5[40/60]-7,5 [40/60]-8 [100/0]; поток: 0,8 мл/мин; темп. колонки: 50C Способ С. Agilent 1100, YMC-PACK ODS-AQ, 502,0 мм 5 мкм мобильная фаза А: H2O (0,1% TFA; В: CH3CN (0,05% TFA); время остановки: 10 мин; время градиента (мин) [% А/% В] 0 [90/10]-0,8 [90/10]4,5 [20/80]-7,5 [20/80]-8 [90/10]; поток: 0,8 мл/мин; темп. колонки: 50C Способ D. Shimadzu LCMS 2010, Shim-pack XR-ODS, 330 мм, мобильная фаза А: H2O (0,1% TFA; В: CH3CN (0,05% TFA), время остановки: 2 мин; время градиента (мин) [% А/% В] 0,01 [100/0]-0,9 1 н. NaOH в воде (1250 мл) добавляли к L-валину (150 г, 1280 ммоль) в 3-л круглодонную колбу,оборудованную магнитной мешалкой. К этому раствору добавляли Na2CO3 (67,8 г, 640 ммоль) и реакционную смесь охлаждали до 0C в ванне с водой со льдом. Метилхлорформиат (107 мл, 1390 ммоль) добавляли по каплям, и реакционной смеси давали нагреться до комнатной температуры. Реакционную смесь перемешивали в течение 15 ч. Реакционную смесь промывали этилацетатом (3400 мл). Водный слой охлаждали в ванне с водой со льдом и подкисляли концентрированной HCl (водный раствор) до pH 2. Реакционную смесь экстрагировали CH2Cl2 (31000 мл). Объединенные органические слои высушивали над Na2SO4, и растворитель концентрировали, получая сырой продукт. Сырой продукт нагревали с обратным холодильником с 150 мл этанола и 150 мл воды в течение 2 ч. Затем смесь охлаждали до комнатной температуры, и кристаллические твердые частицы отфильтровывали, получая (S)-2(метоксикарбониламино)-3-метилбутановую кислоту (146 г, 65% выход).MgCl2 (153 г, 1640 ммоль) добавляли в одной части к раствору малоната этилкалия (354,9 г, 2085 ммоль) в THF (2500 мл). Реакционную смесь перемешивали в течение 7 ч при 65-70C и затем при 30C в течение ночи. Раствор Cbz-L-пролина (400 г) в THF (1000 мл) медленно добавляли к смеси CDI (312,1 г,1924,8 ммоль) в THF (1500 мл) и перемешивали при 30C в течение 2 ч. Раствор добавляли к смеси этилмалоната за 20 мин при 20-30C и перемешивали в течение ночи при 30C. Смесь охлаждали до 20C и нейтрализовали разбавленной HCl (4 н., 1800 мл). Раствор концентрировали, и продукт растворяли в этилацетате и промывали 5%-ным водным раствором бикарбоната натрия. Органический слой концентрировали, и остаток очищали флэш-хроматографией на колонке (элюент:петролейный эфир:этилацетат=от 20:1 до 3:1), получая чистый (S)-бензил-2-(3-этокси-3-оксопропаноил)пирролидин-1-карбоксилат (460 г,90% выход). Способ А 4 Rt: 1,23 мин, m/z: 341,9 (M+Na)+, точная масса: 319,1.(S)-бензил-2-(3-этокси-3 оксопропаноил)пирролидин-1-карбоксилата (100 г, 313 ммоль) в толуоле (800 мл), содержащей уксусную кислоту (16,7 мл, 313 ммоль), и нагревали с обратным холодильником в течение 6 ч, используя аппарат Дина-Старка, чтобы удалить реакционную воду. Растворитель удаляли, и остаток, содержащий конденсат промежуточного соединения 1, растворяли в Dowtherm A (260 мл). Смесь перемешивали при 235C в течение 1,5 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли простой эфир 3-Броманилин (186 г, 1080 ммоль) добавляли к смеси (S)-бензил-2-(3-этокси-3 оксопропаноил)пирролидин-1-карбоксилата (460 г, 1440 ммоль) в толуоле, содержащей уксусную кислоту (86,4 г, 1440 ммоль), и нагревали с обратным холодильником в течение 8 ч, используя аппарат ДинаСтарка, чтобы удалить реакционную воду. Смесь концентрировали при пониженном давлении и высушивали под вакуумом. Сырой продукт использовали на следующей стадии без дальнейшей очистки (662 г). Колбу, оснащенную мешалкой, дистилляционной головкой и капельной воронкой, продували азотом. Добавляли Dowtherm A (90 мл) и затем нагревали до 240C. Раствор конденсата промежуточного соединения 3 (662 г) в Dowtherm A (900 мл) добавляли за 10 мин, в то время как температуру поддерживали в диапазоне 230-245C. Смесь нагревали еще 1 ч при 240C и затем охлаждали до комнатной температуры. Добавляли петролейный эфир (2000 мл) и гептан (2400 мл). Образовывался масляный остаток, и растворитель декантировали. Собранный масляный остаток очищали флэш-хроматографией на колонке(6000 мл) и алюминия хлорида (642,2 г, 4818 ммоль) перемешивали в течение 4 ч при 100C. Смесь лили на воду со льдом, полученную суспензию фильтровали, и органическую фазу отделяли от фильтрата. Органическую фазу промывали водой (2000 мл), высушивали над Na2SO4 и фильтровали. Растворитель удаляли дистилляцией. Остаток перекристаллизовывали из раствора гексан:этилацетат (10:1), получая 1-(6-бромнафталин-2-ил)этанон (480 г, 42% выход).TMSOTf (13,4 г, 60,2 ммоль) добавляли к перемешиваемому раствору 1-(6-бромнафталин-2 ил)этанона (300 г, 1204 ммоль) и NBS (235,8 г, 1324 ммоль) в CH3CN (6000 мл). Смесь перемешивали в течение 24 ч при 30C. Реакционную смесь разбавляли простым эфиром, промывали H2O, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток сырого 2-бром-1-(6 бромнафталин-2-ил)этанона (526 г) использовали на следующей стадии без дальнейшей очистки. 2-Бром-1-(6-бромнафталин-2-ил)этанон (526,5 г, 1204 ммоль) растворяли в CH3CN (6000 мл). К раствору добавляли BOC-L-пролин (284 г, 1325 ммоль), и реакционную смесь перемешивали в течение 20 мин при комнатной температуре. К раствору по каплям добавляли Et3N (480 мл, 3612 ммоль). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре. Растворитель удаляли под вакуумом, и сырой продукт 5 (794 г) использовали на следующей стадии без дальнейшей очистки. Способ A1; 5 (794 г, 1204 ммоль) растворяли в толуоле (6000 мл) и к раствору добавляли ацетат аммония (1855 г, 24096 ммоль). Смесь перемешивали в течение 12 ч при 100C. Раствор разбавляли этилацетатом (1000 мл) и промывали водой (2500 мл). Неорганический слой экстрагировали этилацетатом (2500 мл). Объединенные органические слои концентрировали под вакуумом. Остаток растирали в CH3CN (300 мл) в К раствору соединения 6 (75 г, 170 ммоль) при комнатной температуре добавляли диоксан/HCl (750 мл) и смесь перемешивали в течение 1 ч. Смесь фильтровали, получая соединение 6 а (73 г).(1200 мл) при комнатной температуре добавляли HOBt (36,4 г, 270 ммоль) и EDC.HCl (51,6 г, 270 ммоль). Смесь перемешивали в течение 30 мин при комнатной температуре и добавляли 6 а (73 г). Раствор затем охлаждали до 0C, добавляли диизопропилэтиламин (75 г, 578 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли CH2Cl2 (1500 мл) и промывали водным раствором NaOH (0,5 н., 1000 мл). Органический слой промывали солевым раствором. Объединенный органический слой высушивали и концентрировали. Полученный сырой продукт промывали CH3CN,получая соединение 6b (80 г, от 6: 94%).Pd(PPh3)4 (11/6 г, 15,8 ммоль) добавляли к смеси соединения 6 (140 г, 316,5 ммоль),бис(пинаколято)диборона (160,7 г, 633 ммоль), KOAc (62 г, 633 ммоль) и толуола (4000 мл) в атмосфере азота. Реакционную смесь перемешивали в течение 15 ч при 85C. После охлаждения добавляли CH2Cl2 и смесь промывали Na2CO3, затем солевым раствором. Воду экстрагировали CH2Cl2 (3900 мл). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали под вакуумом. Остаток перекристаллизовывали в смешанном растворителе гексан/i-Pr2O (3/2, 2150 мл), получая соединение 7 (105 г, 63% выход). Способ A3; Rt: 1,35 мин, m/z: 490,1 (M+H)+, точная масса: 489,3.Pd(dppf)Cl2 (5 г, 6,9 ммоль) под N2 при комнатной температуре. Реакционную смесь перемешивали при 80C в течение ночи. После охлаждения добавляли этилацетат (1000 мл) и смесь промывали насыщенным NaHCO3 (1500 мл) и солевым раствором. Водный слой экстрагировали этилацетатом. Органический слой высушивали над Na2SO4 и после фильтрации концентрировали в вакууме. Сырой продукт очищали хроматографией на колонках, приводящей к соединению 7 а (52 г, 68% выход). Способ С, Rt: 4,01 мин,m/z: 547,3 (M+H)+, точная масса: 546,3 Смесь перемешивали в течение 10 ч при 90C. Реакционную смесь фильтровали и промывали метанолом(500 мл). Фильтрат концентрировали под вакуумом. Остаток экстрагировали CH2Cl2 (3300 мл). Объединенные органические слои концентрировали досуха под вакуумом. Остаток растворяли в CH3CN и очищали препаративной высокоэффективной хроматографией (элюент: CH3CN/H2O=от 40/60 до 65/35, 0,1%CF3COOH). Желаемую фракцию собирали, и pH раствора доводили до pH 8-9 насыщенным NaHCO3(водный раствор). CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2(3150 мл). Органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, и чистый продукт 8 высушивали под вакуумом (12,7 г, 19% выход). Способ С; Rt: 3,91 мин, m/z: 710,5 (M+H)+,точная масса: 709,3.(38 г, 88,9 ммоль), Na2CO3/H2O (18,8 g/300 мл), толуола (650 мл) и этанола (350 мл) в атмосфере азота. Смесь перемешивали в течение 10 ч при 90C. Реакционную смесь фильтровали и промывали метанолом(500 мл). Фильтрат концентрировали под вакуумом. Остаток экстрагировали CH2Cl2 (2500 мл). Объединенные органические слои концентрировали досуха под вакуумом. Остаток растирали в CH3CN, получая продукт 9 (25 г, 40% выход). Способ A1; Rt: 1,22 мин, m/z: 710,3 (M+H)+, точная масса: 709,3. 4 н. HCl/диоксан (4,2 мл, 17 ммоль) добавляли к раствору 9 (6 г, 8,5 ммоль) в CH2Cl2 (40 мл) при 0C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 10 мин. Осадок фильтровали и промывали простым метил-трет-бутиловым эфиром, получая соединение 10 (5,2 г, 87% выход). Способ A; Rt: 1,14 мин, m/z: 610,4 (M+H)+, точная масса: 609,3. К раствору соединения (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (3,6 г, 20,4 ммоль) в CH3CN (100 мл) добавляли EDC.HCl (3,9 г, 20,4 ммоль) и НОВТ (2,75 г, 20,4 ммоль). Смесь перемешивали при 20C в течение 1 ч. Затем добавляли 10 (5,2 г, 7,6 ммоль). Суспензию охлаждали до 0C и добавляли DIPEA (4,4 г, 30,4 ммоль). Смесь перемешивали при комнатной температуре в течение 15 ч. Смесь концентрировали, и остаток разбавляли 150 мл CH2Cl2 и 75 мл 0,5 н. NaOH (водный раствор). Органический слой отделяли и промывали солевым раствором (375 мл), высушивали и концентрировали,получая сырой продукт. Сырой продукт 11 использовали на следующей стадии без дальнейшей очисткиPd(OH)2/C (20%, 3 г, сухие) добавляли к раствору 11 (4,9 г, 6,4 ммоль) в метаноле (40 мл). Смесь гидрировали под H2 (345 кПа) при 40C. Через 18 ч смесь фильтровали через диатомовую землю и концентрировали. Сырое соединение 12 использовали на следующей стадии без дальнейшей очистки (4,0 г,75% выход). Способ A; Rt: 1,04 мин, m/z: 633,3 (M+H)+, точная масса: 632,3. К раствору соединения (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (2,6 г, 15,1 ммоль) в CH3CN (40 мл) добавляли EDC.HCl (2,8 г, 15,1 ммоль) и НОВТ (2,0 г, 15,1 ммоль). Смесь перемешивали при 20C в течение 1 ч. Затем добавляли 12 (4,0 г, 6,3 ммоль). Суспензию охлаждали до 0C и добавляли DIPEA (3,2 г, 25,2 ммоль). Смесь перемешивали при комнатной температуре в течение 15 ч. Смесь концентрировали и разбавляли CH2Cl2 (120 мл) и водным 0,5 н. раствором NaOH (50 мл). Органический слой отделяли и промывали солевым раствором (350 мл), высушивали и концентрировали, получая сырой продукт. Сырой продукт очищали препаративной высокоэффективной хроматографией(элюент: CH3CN/H2O=от 30/70 до 60/40, 0,1% CF3COOH). Желаемую фракцию собирали, и значение pH раствора доводили до pH приблизительно 6 с помощью 0,5 н. лимонной кислоты (водный раствор).CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2 (3150 мл). Органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, и соединение 13 высушивали под вакуумом (2 г, 40% выход). 1 г диастереомерной смеси 13 разделяли с помощью SFC. Две желаемые фракции собирали, и растворитель упаривали при пониженном давлении. Чистый продукт высушивали под вакуумом. Получали 335 мг 13 а и 310 мг 13b. SFC:колонка: OD-3 1504,6 мм; 3 мкм; поток: 2,5 мл/мин, мобильная фаза: 40% EtOH (0,05% диэтиламина) в CO2. 13 а: Rt: 4,9 мин; 13b: Rt: 7,8 мин; изомер 13b: Способ С. Rt: 3,63 мин, m/z: 790,5 (M+H)+, точная масса: 789,4; изомер 13 а: Способ С. Rt: 3,69 мин,m/z: 790,4 (M+H)+, точная масса: 789,4. К (2S,3R)-3-метокси-2-(метоксикарбониламино)бутановой кислоте (63,5 мг, 0,332 ммоль), растворенной в дихлорметане (100 мл) в круглодонной колбе на 250 мл, добавляли триэтиламин (0,13 мл, 0,95 ммоль), сопровождаемый COMU (142 мг, 0,33 ммоль). Смесь перемешивали при комнатной температуре. Через 10 мин добавляли соединение 12 (2 00 мг, 0,32 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. К реакционной смеси добавляли 5-6 н. HCl в iPrOH (10 мл), и затем смесь промывали насыщенным водным раствором Na2CO3 (2200 мл). Органический слой высушивали на MgSCO4, и после фильтрации фильтрат упаривали досуха, получая коричневый порошок. Полученный порошок очищали хроматографией на силикагеле с элюированием от 0 до 8%-ного МеОН (7 н. NH3) в EtOAc. После сбора релевантных фракций и упаривания летучих компонентов соединение 13-А 1 получали в форме желто-белого порошка (105 мг, 0,130 ммоль, 41%). Способ Е; Rt: 5,01 мин, m/z: 806,3 Соединение 13-А 2 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием (S)2-(метоксикарбониламино)бутановой кислоты вместо (2S,3R)-3-метокси-2-(метоксикарбониламино)бутановой кислоты. Способ Е; Rt: 5,0 (два пика) мин, m/z: 776,4 (M+H)+, точная масса: 775,4. Соединение 13-А 3 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием Соединение 13-А 4 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием 2(метоксикарбониламино)-2-(тетрагидро-2 Н-пиран-4-ил)уксусной кислоты вместо (2S,3R)-3-метокси-2(метоксикарбониламино)бутановой кислоты. Способ Е; Rt: 4,94 мин, m/z: 832,4 (M+H)+, точная масса: 831,4. Соединение 13-А 5 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием Соединение 13-А 6 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием (S)4-метокси-2-(метоксикарбониламино)бутановой кислоты вместо Соединение 13-А 7 синтезировали по аналогии с тем, что описано для 13-А 1, с использованием дициклогексиламинной соли (S)-2-(трет-бутоксикарбониламино)-3-метоксипропановой кислоты вместо Соединение 13-А 8 синтезировалось исходя из соединения 13-А 7. 13-А 7 (135 мг, 0,162 ммоль) перемешивали в MeOH (9 мл) и добавляли 6 М HCl в iPrOH (2,9 мл),смесь перемешивали при комнатной температуре в течение 3 ч, и летучие компоненты удаляли. Полученный порошок (130 мг) перемешивали в ацетонитриле (10 мл) и обрабатывали метилхлорформиатом иN-метилимидазолом, пока исходный продукт не был израсходован. Летучие компоненты удаляли, растворяли в MeOH (5 мл), обрабатывали 6 М HCl в iPrOH (5 мл), и смесь нагревали с обратным холодильником в течение 2 ч, летучие компоненты удаляли, и соединение очищали препаративной ВЭЖХ (RPVydac Denali C18 - 10 мкм, 250 г, 5 см). Мобильная фаза (0,25% раствор NH4HCO3 в воде, CH3CN, желаемые фракции собирали, упаривали, растворяли в MeOH и упаривали снова. После высушивания в вакууме получали соединение 13-А 8 (32 мг). Способ Е; Rt: 4,88 мин, m/z: 792,4 (M+H)+, точная масса: 791,4. Оксалилхлорид (50 мл, 581,5 ммоль) добавляли по каплям при комнатной температуре к раствору 14 (50 г, 232,5 ммоль) в CH2Cl2 (750 мл) и DMF (1 мл, 11,6 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при комнатной температуре. Реакционную смесь концентрировали под вакуумом, и остаток использовали без дальнейшей очистки. Получали полные 65 г сырого 15.NaOH в воде (465 мл, 465 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь экстрагировали этилацетатом (310 мл). Органические слои объединяли, высушивали и концентрировали под вакуумом. Остаток очищали хроматографией на колонках (гексан:этилацетат=10:1), получая продукт 16 (36 г, 57% выход, 2 шага). Способ A3; Rt: 1,39 мин, m/z: 269,9Pd(PPh3)4 (4,3 г, 3,7 ммоль) добавляли в одной части в атмосфере азота к смеси 7 (18,1 г, 37 ммоль) и 16 (10 г, 37 ммоль), Na2CO3 (8 г, 74 ммоль), воды (160 мл), толуола (320 мл) и этанола (160 мл). Смесь перемешивали в течение 10 ч при 90C. Реакционную смесь экстрагировали CH2Cl2 (дважды 300 мл). Объединенные органические слои концентрировали под вакуумом. Остаток растворяли в этилацетате(100 мл) и затем к смеси добавляли петролейный эфир (200 мл). Прозрачный раствор верхнего слоя декантировали, и черное масло удаляли. К полученному раствору добавляли дополнительное количество петролейного эфира (800 мл). Полученное твердое вещество собирали фильтрацией и затем высушивали,получая продукт 17 (14,7 г, 72% выход). Способ A3; Rt: 1,28 мин, m/z: 553,2 (M+H)+, точная масса: 552,3.n-BuLi (26,7 мл, 71,6 ммоль) медленно добавляли к раствору соединения 17 (9 г, 16,3 ммоль) в сухом THF (300 мл) в атмосфере азота при -20C, в то время как температуру реакции поддерживали ниже 0C. После добавления реакционную смесь перемешивали в течение часа при той же самой температуре. 1-N-ВОС-2-циано-пирролидин (полученный согласно процедурам, описанным в J. Med. Chem., 2002, 45,- 17023642 4581-4584) (3,5 г, 17,9 ммоль) в THF (10 мл) добавляли к полученному раствору при -50C, и смесь перемешивали в течение дополнительных 20 мин при той же самой температуре. Реакционную смесь гасили,медленно добавляя воду (15 мл). Смесь экстрагировали этилацетатом (3150 мл). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали под вакуумом, получая сырой продукт 18. Сырой продукт очищали препаративной высокоэффективной хроматографией (элюент:CH3CN/H2O=от 45/55 до 60/40, 0,1% CF3COOH). Желаемую фракцию собирали, и раствор подщелачивали до приблизительно pH 8 насыщенным NaHCO3 (водный раствор). CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2 (3150 мл). Органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, и чистый продукт высушивали под вакуумом (5 г, 45% выход). Способ В; Rt: 5,67 мин, m/z: 676,3 (M+H)+, точная масса: 675,3; SFC: колонки: ChiralpakOD-H 2504,6 мм; 5 мкм; поток: 2,35 мл/мин; мобильная фаза: А: CO2, В: метанол (0,05% диэтиламина); 40% В в А. Изомер 18 а: Rt: 5,51 мин, изомер 18b: Rt: 6,71 мин. Соединение 18 (1,8 г, 2,7 ммоль) растворяли в CH2Cl2 (10 мл), и 4 н. HCl в 1,4-диоксане (2 мл, 8,1 ммоль) добавляли по каплям при 0-5C. Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, фильтровали, и твердое вещество промывали простым трет-бутилметиловым эфиром (20 мл), получая продукт 19 (1,4 г). Способ D; Rt: 1,52 мин, m/z: 476,3 (M+H)+, точная масса: 475,2. К раствору соединения (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (1,01 г, 5,8 ммоль) в CH3CN (20 мл) добавляли НОВТ (0,8 г, 5,8 ммоль) и EDC.HCl (1,08 г, 5,8 ммоль). Смесь перемешивали при 20C в течение 1 ч. Затем добавляли соединение 19 (1,14 г). Полученную суспензию охлаждали до 0C и добавляли DIPEA (1,3 г, 8,4 ммоль). Смесь перемешивали при 20C в течение 15 ч. Смесь концентрировали и разбавляли 30 мл CH2Cl2 и 15 мл 0,5 н. NaOH (водный раствор). Органический слой отделяли и промывали солевым раствором (315 мл). Органический слой высушивали и концентрировали, получая сырой продукт. Сырой продукт очищали препаративной высокоэффективной хроматографией (элюент:CH3CN/H2O=от 35/65 до 70/30, 0,1% CF3COOH). Желаемую фракцию собирали, и раствор подщелачивали до приблизительно pH 8 насыщенным NaHCO3 (водный раствор). CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2 (3200 мл). Органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, получая соединение 20 (0,893 г). Способ В; Rt: 5,14 мин, m/z: 790,4 (M+H)+, точная масса: 789,4; SFC: колонка: Chiralpak AS-H 2504,6 мм; 5 мкм; поток: 2,35 мл/мин, мобильная фаза: 40% MeOH (0,05% диэтиламин) в CO2; 20 а: Rt: 4,5 мин; 20b: Rt: 8,0 мин. Соединение 8 (1500 мг, 2,11 ммоль, 1,00 экв.) растворяли в 5-6 н. HCl в изопропаноле (150 мл, 900 ммоль, 426 экв.) в круглодонной колбе на 250 мл, и реакционную смесь перемешивали в течение 20 ч при 100C под атмосферой азота и давали охладиться до комнатной температуры. К суспензии добавлялиtBuOMe (100 мл). Твердые частицы отфильтровывали и промывали tBuOMe (250 мл) и немедленно высушивали под вакуумом, получая 1,23 г соединения 21 в форме желтого порошка, который использовали также в следующих стадиях.(150 мл) в круглодонной колбе на 500 мл добавляли триэтиламин (0,713 мл, 5,13 ммоль), затем 2-(3H[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (682 мг, 1,80 ммоль). Смесь обрабатывали ультразвуком в течение 10 мин. Затем добавляли 21 (500 мг, 0,86 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли HCl в iPrOH (5-6 н., 10 мл), и полученный раствор последовательно промывали насыщенным водным раствором Na2CO3 (2200 мл) и солевым раствором (100 мл). После высушивания на сульфате магния и фильтрации фильтрат упаривали досуха, получая белый порошок. Порошок очищали, используя хроматографию на колонках (NH3 (7 н. в MeOH)/CH2Cl2 0-6,5%), получая соединение 22 в форме белого порошка (диастереомерная смесь, 636 мг; 93%). Часть диастереомерной смеси (586 мг) перекристаллизовывали из смеси метанол/ацетонитрил/ДМСО 5/2/2 (9 мл). Твердые частицы отфильтровывали,промывали метанолом (22 мл) и высушивали в вакуумном сушильном шкафу при 40C в течение выходных, получая изомер 22b (122 мг, 92% de) SFC: колонка: (AS) 500 4,6 мм; поток: 3 мл/мин; мобильная фаза: 35% MeOH (содержащий 0,2% iPrNH2) в течение 15 мин; температура: 50C; Rt (6,38 мин) УФ: 4,0% изомера 22 а; УФ: 96,0% изомера 22b. LC-MS (22b). Способ Е; Rt: 4,81 мин, m/z: 790,3 (M+H)+, точная масса: 789,4. Фильтрат охлаждали до 4C в течение выходных, и полученный осадок фильтровали, промывали метанолом и высушивали в вакуумном сушильном шкафу при 40C в течение ночи, получая изомер 22 а К (2S,3R)-3-метокси-2-(метоксикарбониламино)бутановой кислоте (251 мг, 1,31 ммоль), растворенной в дихлорметане (150 мл) в круглодонной колбе на 250 мл, добавляли триэтиламин (0,694 мл, 4,99 ммоль), затем 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоуроний гексафторфосфат(V) (498 мг, 1,31 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли соединение 21 (365 мг, 0,624 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси затем добавляли HCl в iPrOH (5-6 н., 10 мл), и полученный раствор последовательно промывали насыщенным водным раствором Na2CO3 (2200 мл) и солевым раствором (100 мл). Органический слой высушивали на сульфате магния, фильтровали, и фильтрат концентрировали в вакууме, получая коричневый порошок. Порошок очищали, используя хроматографию на колонках (NH3 (7 н. в MeOH)/DCM 0-8%), получая соединение 23 (390 мг; 75%) в форме белого порошка. Способ D; Rt: 4,40 и 4,52 мин, m/z: 822,3 (M+H)+, точная масса: 821,4; 340 мг диастереомерной смеси перекристаллизовывали из метанола (8 мл). Твердые частицы отфильтровывали, промывали метанолом (22 мл) и высушивали в вакуумном сушильном шкафу при 40C в течение ночи, получая соединение 23b (73 мг, 14%, 93% de) в форме белого порошка. SFC: колонка:(3,58 мин, 23 а) УФ: 3,4%; Rt (4,49 мин, 23b) УФ: 96,6%. Способ D; Rt: 4,39 мин, m/z: 822,3 (M+H)+, точная масса: 821,4. Фильтрат очищали препаративной SFC на Chiralpak Diacel OD 20250 мм. Мобильная фаза (CO2,- 19023642 метанол с 0,2% iPrNH2). Желаемые фракции собирали, упаривали, растворяли в метаноле и упаривали снова, получая соединение 23 а (114 мг) в форме белого порошка (22%, 100% de) SFC: колонка: (OD)-Н 500 4,6 мм; поток: 3 мл/мин; мобильная фаза: 40% MeOH (содержащего 0,2% iPrNH2) выдержка 19,50 мин, 40-50% MeOH (содержащего 0,2% iPrNH2) выдержка 4,10 мин; Температура: 50C; Rt (6,5 мин, 23 а) УФ: 100,00%; Rt (7,5 мин, 23b) УФ: 0,00%. LC-MS: Способ Е; Rt: 4,44 мин, m/z: 822,5 (M+H)+, точная масса: 821,4; и соединение 23b (41 мг) в форме белого порошка (7%, 94% диастереомерный избыток К (2S,3S)-2-(метоксикарбониламино)-3-метилпентановой кислоте (248 мг, 1,31 ммоль), растворенной в дихлорметане (150 мл) в круглодонной колбе на 250 мл, добавляли триэтиламин (0,694 мл, 4,99 ммоль), затем 2-(3H-[1,2,3]триазоло[4,5-b]пиридин-3-ил)-1,1,3,3-тетраметилизоурония гексафторфосфат(V) (498 мг, 1,31 ммоль). Смесь перемешивали при комнатной температуре в течение 10 мин. Добавляли соединение 21 (365 мг, 0,624 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. К реакционной смеси добавляли HCl в iPrOH (5-6 н., 10 мл), и полученный раствор промывали насыщенным водным раствором Na2CO3 (2200 мл) и высушивали на сульфате магния. После фильтрации растворитель упаривали в вакууме, получая коричневый порошок. Порошок очищали,используя хроматографию на колонках (NH3 (7 н. в MeOH)/DCM 0-6,5%), получая диастереомерную смесь 24 (395 мг) в форме белого порошка. LC-MS: Способ Е; Rt: 5,5 и 5,7 мин, m/z: 818,4 (M+H)+, точная масса: 817,4. 345 мг диастереомерной смеси перекристаллизовывали из метанола (5 мл). Твердые частицы отфильтровывали, промывали метанолом (22 мл) и высушивали в вакуумном сушильном шкафу при 40C в течение ночи, получая соединение 24 а (78 мг, 14%, 93% de) в форме белого порошка. LC-MS: Способ Е; Rt: 5,7 мин, m/z: 818,4 (M+H)+, точная масса: 817,4;SFC: колонка: (OD)-Н 2504,6 мм; поток: 3,5 мл/мин; мобильная фаза: 40% MeOH 10,00 мин. Температура: 30C; Rt (3,29 мин, 24 а) УФ: 97,7%; Rt (4,55 мин, 24b) УФ: 2,3%. Фильтрат очищали препаративной SFC (Chiralpak Diacel OD 20250 мм; мобильная фаза (CO2, метанол с 0,2% iPrNH2) ). Желаемые фракции собирали и упаривали, получая соединение 24 а (54 мг, 10%,100% диастереомерный избыток) в форме белого порошка. LC-MS: Способ Е; Rt: 5,7 мин, m/z: 818,4MeOH (содержащий 0,2% iPrNH2) выдержка 19,50 мин, 40-50% MeOH (содержащий 0,2% iPrNH2) выдержка 4,10 мин; Температура: 50C; Rt (6,8 мин, 24 а) УФ: 100,00; Rt (8,0 мин, 24b) УФ: 0,00%; и 24b в форме белого порошка (130 мг 25%, 100% диастереомерный избыток). LC-MS: Способ Е; Rt: 5,5 мин,m/z: 818,4 (M+H)+, точная масса: 817,4; колонка: (OD)-Н 500 4,6 мм; поток: 3 мл/мин; мобильная фаза: 40% MeOH (содержащий 0,2% iPrNH2) выдержка 19,50 мин, 40-50% MeOH (содержащий 0,2% iPrNH2) выдержка 4,10 мин; температура: 50C; Rt (6,8 мин); УФ: 0,0%; Rt (8,0 мин, 24b) УФ: 100,0%.(60 мл) и THF (180 мл). Реакционную смесь перемешивали в течение 12 ч при комнатной температуре. Органический растворитель удаляли в вакууме. Смесь затем экстрагировали этилацетатом (2100 мл). Водный слой нейтрализовали 1 н. HCl (до pH 4) и экстрагировали этилацетатом (3100 мл). Объединенные органические слои концентрировали под вакуумом, получая соединение 26 (9,1 г, 97% выход). Соединение 26 (9,1 г, 42,1 ммоль), НОВТ (13,6 г, 101,1 ммоль) и EDC.HCl (19,4 г, 101,1 ммоль) растворяли в DMF (60 мл) и NH3. Медленно добавляли H2O (30 мл). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре. Растворитель затем удаляли в вакууме. Остаток растворяли вDMF (1,5 мл). Добавляли по каплям при комнатной температуре оксалил хлорид (13,5 мл, 157,5 ммоль). Реакционную смесь перемешивали в течение 0,5 ч при комнатной температуре. Реакционную смесь концентрировали под вакуумом, и остаток (22 г) использовали непосредственно без дальнейшей очистки. К раствору соединения 29 (22 г, сырая смесь) в сухом THF (250 мл) добавляли соединение 27 (7,6 г,35,3 ммоль) и 1 н. NaOH (водный раствор, 85 мл, 85 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь затем экстрагировали этилацетатом (3100 мл). Объединенные органические слои промывали 1 н. NaOH в воде (15 мл), солевым раствором, высушивали над Na2SO4 и концентрировали под вакуумом, получая соединение 30. Способ A1; Rt: 1,36 мин. m/z=446,1 (M+H)+,точная масса: 445,1. Соединение 30 (17 г, 38,1 ммоль) в CH3CH2OH (200 мл) и 10% KOH (34 мл) нагревали до 80C в течение 3 ч. Реакционную смесь охлаждали до 0C и нейтрализовали до pH 7, аккуратно добавляя концентрированную HCl. Полученный осадок собирали фильтрацией и промывали смесью этилацетат/гексанPd(PPh3)4 (3,0 г, 2,6 ммоль) добавляли к смеси соединения 31 (11 г, 25,7 ммоль), соединения 7 (12,5 г, 25,7 ммоль), Na2CO3 (5,4 г, 51,4 ммоль), воды (110 мл), CH3CH2OH (110 мл) и толуола (220 мл) в одной части в атмосфере азота. Смесь перемешивали в течение 10 ч при 80C. Органический растворитель удаляли под вакуумом, и водный слой экстрагировали этилацетатом (3200 мл). Объединенные органические слои промывали солевым раствором и затем высушивали над Na2SO4 и концентрировали досуха. Остаток очищали хроматографией на колонках (петролейный эфир/этилацетат=от 2/1 до 1/2). Полученный продукт далее очищали препаративной высокоэффективной хроматографией (элюент:CH3CN/H2O=от 20/80 до 70/30, 0,1% CF3COOH). Желаемую фракцию собирали, и значение pH раствора доводили до приблизительно 8, добавляя K2CO3. Затем органический растворитель удаляли при пониженном давлении. Водный слой экстрагировали этилацетатом (3300 мл). Органические слои объединя- 21023642 К раствору соединения 32 (3,2 г, 4,5 ммоль) в CH2Cl2 (20 мл) добавляли по каплям 4 н. HCl в диоксане (5,6 мл) при 0C. Когда исходный материал полностью потреблялся, растворитель удаляли под вакуумом. Остаток промывали простым трет-бутилметиловым эфиром (210 мл), получая соединение 33 К раствору соединения 33 (2,47 г, 3,82 ммоль) в CH3OH в атмосфере азота добавляли Pd(O)2/C (0,3 г, 0,43 ммоль). Полученную смесь гидрировали при 40C под H2 (50 psi) в течение 14 ч. Смесь фильтровали на целите и концентрировали. Остаток (1,2 г, соединение 34) использовали непосредственно на следующей стадии без дальнейшей очистки. К раствору (S)-2-(метоксикарбониламино)-3-метилбутановой кислоты (1,05 г, 6 ммоль) в CH3CN (20 мл) добавляли НОВТ (0,81 г, 6 ммоль) и EDC.HCl (1,14 г, 6 ммоль). Смесь перемешивали при 20C в течение 1 ч. Затем добавляли соединение 34 (1,2 г). Суспензию охлаждали до 0C и добавляли диизопропилэтиламин (1,6 г). Смесь перемешивали при 20C в течение 15 ч. Смесь концентрировали и разбавлялиCH2Cl2 (30 мл) и водным 0,5 н. раствором NaOH (15 мл). Органический слой отделяли и промывали солевым раствором (315 мл). Объединенные органические слои высушивали над Na2SO4 и концентрировали, получая сырой продукт. Сырой продукт очищали препаративной высокоэффективной хроматографией (элюент: CH3OH/H2O=от 40/60 до 70/30, 0,1% CF3COOH). Желаемую фракцию собирали, и значениеpH раствора доводили до приблизительно pH 8 с помощью K2CO3. Затем CH3OH удаляли под сниженным давлением, и водный слой экстрагировали этилацетатом (3300 мл). Органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, получая соединение 35 (1,0 г). 1 Н ЯМР (400 МГц, ДМСО-d6, описан основной изомер)ч./млн 11,79-12,44 (м, 2 Н, два общих синглета при 11,84 и 12,34), 7,82-8,49 (м, 8H), 7,56-7,68 (м, 2H), 7,23-7,33 (м, 2H), 5,09-5,17 (м, 1H), 4,78-4,87(40 мл) и THF (120 мл). Реакционную смесь перемешивали в течение 3 ч при 50C. Органический растворитель затем удаляли под вакуумом. Остаток экстрагировали этилацетатом (350 мл). Водный слой подкисляли конц. HCl до pH 2 и экстрагировали этилацетатом (3100 мл). Объединенные органические слои концентрировали под вакуумом, получая продукт 37 (9,3 г, 98% выход). Соединение 37 (9,3 г, 43,1 ммоль), НОВТ (13,4 г, 99 ммоль) и EDC.HCl (19 г, 99 ммоль) растворяли в DMF (40 мл). Раствор перемешивали при 20C в течение 30 мин. К раствору медленно добавлялиNH3H2O (20 мл). Реакционную смесь перемешивали в течение 15 ч при комнатной температуре. Растворитель удаляли в вакууме. Остаток растворяли в этилацетате (100 мл). Смесь промывали насыщеннымNaHCO3 и водным раствором NH4Cl. Органический слой высушивали над Na2SO4 и концентрировали под вакуумом, получая соединение 38 (6,2 г, 67% выход). К раствору соединения 29 (7,0 г, 26,1 ммоль) в сухом THF (100 мл) добавляли соединение 38 (5,6 г,26,1 ммоль) и 1 н. NaOH (водный раствор. 52 мл, 52,2 ммоль). Смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали 1 н. NaOH в воде (50 мл), солевым раствором, высушивали над Na2SO4 и концентрировали под вакуумом, получая соединение 39 (8,3 г, 71% выход). Способ A1; Rt: 1,37 мин,m/z=468,1 (M+Na)+, точная масса: 445,1. Раствор соединения 39 (8,3 г, 18,6 ммоль) в CH3CH2OH и 10% KOH (на 100 мл) (17 мл) нагревали до 80C в течение 3 ч. Реакционную смесь охлаждали до 0C и нейтрализовали до pH 7 с помощью 10 н. водного раствора HCl. Смесь фильтровали, и фильтрат концентрировали. Остаток растворяли в CH2Cl2(80 мл) и промывали солевым раствором. Органический слой высушивали над Na2SO4 и концентрировали под вакуумом. Остаток очищали флэш-хроматографией на колонке (элюент:петролейный эфир/этилацетат=от 10/1 до 1/3), получая соединение 40 (1,8 г, 21% выход). Способ A; Rt: 1,42 мин,m/z=428,1 (M+H)+, точная масса: 427,1. части в атмосфере азота. Смесь перемешивали в течение 10 ч при 90C. Органический растворитель удаляли под вакуумом. Остаток очищали на колонке (элюент:петролейный эфир/этилацетат=от 10/1 до 1/3). Полученное соединение 41 снова очищали препаративной жидкостной высокоэффективной хроматографией (элюент:CH3CN/H2O=ОТ 30/70 до 60/40, 0,1% CF3COOH). Желаемую фракцию собирали, и раствор подщелачивали до приблизительно pH 10 с помощью K2CO3. Затем CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2 (315 мл), и органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, и остаток высушивали под вакуумом, получая соединение 41 (0,58 г,35% выход). Способ С; Rt: 4,11 мин, m/z=711,3 (M+H)+, точная масса: 710,3. К раствору соединения 41 (0,58 г, 0,82 ммоль) в CH2Cl2 (5 мл) добавляли по каплям при 0C 4 н. HCl в диоксане (0,35 мл). После полного превращения в соединение 42 растворитель удаляли в вакууме. Остаток промывали простым трет-бутилметиловым эфиром (23 мл), получая соединение 42 (0,5 г). Способ К раствору соединения 42 (0,5 г) в CH3OH в атмосфере азота добавляли Pd(O)2/C (0,15 г, 0,22 ммоль). Полученную смесь гидрировали при 40C под давлением 50 psi в течение 18 ч. Смесь фильтровали на целите и концентрировали. Остаток использовали непосредственно на следующей стадии без дальнейшей очистки (0,38 г). Способ A; Rt: 1,02 мин, m/z=477,3 (M+H)+, точная масса: 476,2.(10 мл) добавляли НОВТ (0,43 г, 3,2 ммоль) и EDC.HCl (0,63 г, 3,2 ммоль). Смесь перемешивали при 20C в течение 1 ч. Затем добавляли соединение 43 (0,38 г). Суспензию охлаждали до 0C и добавляли диизопропилэтиламин (0,51 г, 4,0 ммоль). Смесь перемешивали при 20C в течение 15 ч. Смесь концентрировали и разбавляли CH2Cl2 (50 мл) и 0,5 н. NaOH (20 мл; водный раствор). Органический слой отделяли и промывали солевым раствором (310 мл). После выпаривания летучих компонентов сырой продукт очищали препаративной высокоэффективной жидкостной хроматографией (элюент:CH3CN/H2O=от 30/70 до 60/40, 0,1% CF3COOH). Желаемую фракцию собирали, и раствор подкисляли до приблизительноpH 6 с помощью 0,5 н. лимонной кислоты. Затем CH3CN удаляли при пониженном давлении. Водный слой экстрагировали CH2Cl2 (350 мл), и органические слои объединяли и высушивали над Na2SO4. Раствор упаривали, и остаток высушивали под вакуумом, получая соединение 44 (181 мг). Способ С; Rt: 3,86 мин, m/z=791,5 (M+H)+, точная масса: 790,4; SFC: колонки: Chiralpak OD-H 504,6 мм; 3 мкм; поток: 4 мл/мин; мобильная фаза: А: CO2, В: MeOH (0,05% диэтиламина); 40% В в А, температура 40C: Rt: 1,42 мин.[]58920=-228, 0 (мг/мл CH2Cl2, 1 мг/мл) 1 Н ЯМР (400 МГц, ДМСО-d6, описан основной изомер)ч./млн 11,67-12,44 (2H, м, два общих синглета при 11,82 и 12,26), 7,61-8,36 (10H, м), 7,23 (2H, д, J=8,3 Гц), 5,08-5,16 (1H, м), 4,82 (1H, дд, J=4,9,7,7 Гц), 4,06-4,17 (2H, м), 3,70-3,98 (4 Н, м), 3,55 (3H, с), 3,54 (3H, с), 1,85-2,35 (10H, м), 0,8-1,05 (12H, м).EDC.HCl (0,63 г, 3,3 ммоль) и HOBt (0,45 г, 3,3 ммоль) добавляли к раствору (S)-2(метоксикарбониламино)-3-метилбутановой кислоты (0,58 г, 3,3 ммоль) в ацетонитриле (45 мл). Смесь перемешивали при 10C в течение 1 ч и затем добавляли соединение 42 (0,9 г). Смесь охлаждали до 0C,и после добавления диизопропилэтиламина (0,72 г, 5,6 ммоль) смесь перемешивали при 10C в течение 48 ч. После фильтрации реакционной смеси фильтрат концентрировали в вакууме, и полученный остаток разбавляли CH2Cl2 (20 мл) и 1 н. HCl (15 мл). Твердое вещество фильтровали, промывали простым третбутилметиловым эфиром (5 мл) и высушивали под высоким вакуумом, получая соединение 42 а (0,4 г). Органический слой отделяли и промывали насыщенным водным раствором NaHCO3 (15 мл) и солевым раствором и высушивали на Na2SO4. После фильтрации растворитель удаляли в вакууме. Остаток промывали простым бутилметиловым эфиром (10 мл) и высушивали под высоким вакуумом, получая дополнительное количество соединения 42 а (0,3 г). Способ А 2; Rt: 0,84 мин, m/z=767,8 (M+H)+, точная масса: 767,3. Смесь соединения 42 а (0,56 г), (Вос)20 (0,34 г, 1,54 ммоль, 2 экв.), триэтиламин (0,33 мл, 2,31 ммоль) и сухой 20% Pd(O)2/С (0,5 г) в метаноле (5 мл) перемешивали в атмосфере водорода при 10C в течение 3 ч. Смесь фильтровали, и фильтрат упаривали в вакууме. Полученный остаток растворяли вCH2Cl2 (10 мл) и промывали H2O (5 мл). Органический слой высушивали на Na2SO4, и после фильтрации фильтрат концентрировали в вакууме. Полученный остаток промывали простым трет-бутилметиловым эфиром (3 мл). Твердое вещество (0,47 г) фильтровали и высушивали под высоким вакуумом. Способ А 2;Rt: 1,00 мин, m/z=734,4 (M+H)+, точная масса: 733,4. Твердое вещество растворяли в CH2Cl2 (5 мл), и 4 н.HCl/диоксан (3 мл, 12 ммоль) добавляли по каплям при 0C. Смесь перемешивали при 10C в течение 1 ч. Растворитель удаляли в вакууме, и остаток отверждали простым трет-бутилметиловым эфиром (2 мл). Твердое вещество фильтровали и высушивали под высоким вакуумом, получая соединение 42b (0,36 г). Способ А 2; Rt: 0,82 мин, m/z=634,1 (M+H)+, точная масса: 633,3. Смесь соединения 42b (0,3 г), (R)-2-(трет-бутоксикарбониламино)-2-фенилуксусной кислоты (0,25 г, 0,99 ммоль), циклического ангидрида пропилфосфоновой кислоты (0,9 мл, 1,69 ммоль), диизопропилэтиламина (0,6 мл, 2,7 ммоль, 6 экв.) и DMF (6 мл) перемешивали при 10C в течение 1 ч. ДобавлялиCH2Cl2 (5 мл) и насыщенный раствор NaHCO3 (3 мл). Органический слой промывали солевым раствором(23 мл) и высушивали на Na2SO4. После фильтрации растворитель удаляли в вакууме. Полученный остаток промывали простым трет-бутилметиловым эфиром (3 мл). Твердое вещество фильтровали и высушивали под высоким вакуумом. Остаток очищали высокоэффективной жидкостной хроматографией (колонка: Grace Vydac 25020 мм, 5 мкм; мобильная фаза А: вода (содержащая 0,075% TFA, об./об.), мобильная фаза В: ацетонитрил (содержащий 0,025% TFA, об./об.), объемная скорость потока: 30 мл/мин,градиент: 35-50% (об./об.) В в А от 0 до 11 мин). Чистые фракции собирали и подщелачивали с помощьюNaHCO3 до pH 8. Летучие компоненты удаляли в вакууме. Остаток экстрагировали CH2Cl2 (220 мл). Органический слой промывали солевым раствором (10 мл) и высушивали на Na2SO4. После фильтрации растворитель удаляли в вакууме, получая соединение 44-1 (0,11 г). Способ С; Rt: 4,10 мин, m/z=867,5 Соединение 44-1 (1,8 г, сырое) растворяли в CH2Cl2 (20 мл), и HCl/диоксан (6 мл, 24 ммоль) добавляли по каплям при 0C. Смесь перемешивали при 0C в течение 2 ч. Растворитель удаляли в вакууме. Остаток промывали простым диэтиловым эфиром (3 мл) и CH2Cl2 (5 мл). Твердое вещество высушивали под высоким вакуумом, получая соединение 44-1 а (0,82 г). Способ А 2; Rt: 0,85 мин, m/z=767,3 (M+H)+,точная масса: 766,4. Метилхлорформиат (0,33 г, 3,49 ммоль) при 0C добавляли к смеси соединения 44-1 а в H2O (10 мл) и простом трет-бутилметиловом эфире (10 мл). Добавляли NaOH (0,12 г, 3,1 ммоль). Смесь перемешивали при 0C в течение 1 ч и затем добавляли CH2Cl2 (10 мл). Органический слой промывали H2O (10 мл) и высушивали (Na2SO4). После фильтрации растворитель упаривали в вакууме. Остаток очищали высокоэффективной жидкостной хроматографией (колонка: Grace Vydac 25020 мм 5 мкм, мобильная фаза А: вода (содержащая 0,075% TFA, об./об.), мобильная фаза В: ацетонитрил (содержащий 0,025% TFA,об./об.), скорость потока: 30 мл/мин, градиент: 35-50% В (об./об.) в А от 0 до 11 мин). Чистые фракции собирали и подщелачивали насыщенным раствором NaHCO3 до pH 8. Летучие фракции удаляли в вакууме. Остаток экстрагировали CH2Cl2 (215 мл). Органический слой промывали солевым раствором (10 мл) и высушивали на Na2SO4. После фильтрации растворитель удаляли в вакууме. Полученный остаток дополнительно высушивали в вакууме, получая соединение 44-2 (45 мг) в форме белого порошка. Способ В; Rt: 5,05 мин, m/z=825,5 (M+H)+, точная масса: 824,4. Циклопентилхлорформиат (0,44 г, 3 ммоль) добавляли при 0C к смеси соединения 44-1 а (0,2 г),H2O (5 мл) и МТВЕ (5 мл). Добавляли NaOH (0,1 г, 2,5 ммоль) в H2O (0,5 мл). Смесь перемешивали при 0C в течение 1 ч. 1 н. HCl добавляли до достижения pH 3 с последующим добавлением CH2Cl2 (10 мл). Органический слой промывали H2O (10 мл). Растворитель удаляли в вакууме, и полученный остаток очищали высокоэффективной жидкостной хроматографией (колонка: Grace Vydac 25020 мм 5 мкм,мобильная фаза А: вода (содержащая 0,075% TFA, об./об.), мобильная фаза В: ацетонитрил (содержащий 0,025% TFA, об./об.), скорость потока: 30 мл/мин, градиент: 35-50% В (об./об.) в А от 0 до 11 мин). Чистые фракции собирали и подщелачивали насыщенным раствором NaHCO3 до pH 8. Летучие фракции удаляли в вакууме. Остаток экстрагировали CH2Cl2 (215 мл). Органический слой промывали солевым раствором (10 мл) и высушивали на Na2SO4. После фильтрации растворитель удаляли в вакууме. Полученный остаток лиофилизировали, получая соединение 44-3 (34 мг). Способ В; Rt: 5,35 мин, m/z=879,6 Циклобутанол (2 г, 27,7 ммоль) и N,N-диметиланилин (3,69 г, 30,5 ммоль) медленно добавляли к смеси трифосгена (8,22 г, 27,7 ммоль, 1 экв.) в сухом THF (20 мл) при 0C. Через 10 мин реакционную смесь нагревали до 10C и перемешивали в течение 12 ч. Добавляли сухой CH2Cl2 (20 мл) и смесь медленно лили в раствор N-гидроксисукцинимида (4,14 г, 36 ммоль) в сухом CH2Cl2 (20 мл) при 0C. Смесь перемешивали при 10C в течение 10 ч. Добавляли H2O (20 мл) и смесь перемешивали в течение 3 ч. Смесь экстрагировали этилацетатом (230 мл). Органический слой промывали солевым раствором (20 мл) и высушивали над Na2SO4. Растворитель удаляли под вакуумом, получая 2,5-диоксопирролидин-1-ил К 44-1a (0,1 г) в THF (5 мл) добавляли по каплям насыщенный раствор NaHCO3 (1,25 мл). Затем добавляли по каплям 2,5-диоксопирролидин-1-ил циклобутил карбонат (0,03 г) в THF (2 мл). Смесь перемешивали при 10C в течение 1 ч и добавляли 10%-ный водный раствор лимонной кислоты (3 мл). Смесь экстрагировали этилацетатом (25 мл). Объединенные органические слои промывали солевым раствором(2 мл) и высушивали над Na2SO4. Растворитель удаляли под вакуумом. Остаток очищали высокоэффективной жидкостной хроматографией (колонка: Grace Vydac 25020 мм 5 мкм, мобильная фаза А: вода(содержащая 0,075% TFA, % об./об.), мобильная фаза В: ацетонитрил (содержащий 0,025% TFA, % об./об.), объемная скорость потока: 30 мл/мин; градиент: 35-50% В (об./об.) в А от 0 до 11 мин). Чистые фракции объединяли и подщелачивали насыщенным NaHCO3 до pH 8. Летучие компоненты удаляли в вакууме. Полученную смесь экстрагировали CH2Cl2 (215 мл). Органические слои объединяли, промывали солевым раствором (10 мл) и высушивали над Na2SO4. Растворитель удаляли в вакууме, получая соединение 44-4 (0,023 г). Способ В; Rt: 5,16 мин, m/z=865,3 (M+H)+, точная масса: 864,4. Соединение 45 (4 г, 15,9 ммоль) и 38 (3,8 г, 17,7 ммоль) растворяли в сухом THF (250 мл). Смесь нагревали до 80C и перемешивали в течение 1 ч. Затем добавляли 4-(4,6-диметокси[1.3.5]триазин-2-ил)4-метилморфолиния хлорида гидрат (DMTMM, 1,2 экв.), и смесь перемешивали при 80C в течение ночи. Смесь концентрировали, добавляли воду (60 мл) и затем экстрагировали CH2Cl2 (3150 мл). Органическую фазу отделяли, высушивали над Na2SO4, фильтровали, и растворитель удаляли под вакуумом. Сырой продукт очищали препаративной высокоэффективной жидкостной хроматографией (колонка: С 18,элюент: CH3CN/H2O от 47/53 до 77/23, 0,1% CF3COOH). Желаемую фракцию собирали и подщелачивали насыщенным NaHCO3 (водный раствор). Смесь концентрировали и экстрагировали CH2Cl2 (2200 мл). Органический слой высушивали над Na2SO4, и растворитель упаривали под вакуумом. Чистый продукт высушивали под вакуумом (4,2 г, 59%). Способ F; Rt: 1,63 мин, m/z=470,0 (M+Na)+, точная масса: 447,1.(120 мл) перемешивали при 20C в течение ночи. Смесь концентрировали и добавляли воду (40 мл). Смесь экстрагировали CH2Cl2 (3120 мл), и объединенные органические слои отделяли. Органические слои высушивали над Na2SO4, и растворитель удаляли под вакуумом. Соединение 47 высушивали в вакууме (3,2 г, 79%). Способ С; Rt: 4,31 мин, m/z=430,0 (M+H)+, точная масса: 429,1.Pd(PPh3)4 (0,2 экв.) добавляли частями к смеси соединения 47 (2 г, 4,6 ммоль), соединения 7 (2,4 г,1,1 экв.) и Na2CO3 (2,0 экв.) в смеси H2O/толуол/CH3CH2OH (1/2/1) (32 мл, 16 мл/загрузка) в атмосфере азота. Смесь перемешивали при 100C в микроволновом реакторе в течение 2 ч. Смесь концентрировали и добавляли воду (30 мл). Смесь экстрагировали CH2Cl2 (380 мл). Объединенные органические слои отделяли, высушивали над Na2SO4, и растворитель удаляли под вакуумом. Сырой продукт очищали препаративной высокоэффективной жидкостной хроматографией (колонка: С 18, элюент: CH3CN/H2O от 35/65 до 60/40, 0,1% CF3COOH). Желаемую фракцию собирали и подщелачивали насыщенным NaHCO3(водный раствор). Смесь концентрировали и экстрагировали CH2Cl2 (3100 мл). Органический слой отделяли, высушивали над Na2SO4, и растворитель удаляли под вакуумом. Соединение 48 высушивали в вакууме (1,9 г, 58%). Способ F; Rt: 1,55 мин, m/z=713,5 (M+H)+, точная масса: 712,3.(4 н., 10 мл) добавляли по каплям при 0-5C, и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь затем фильтровали, и твердое вещество промывали простым третбутилметиловым эфиром (20 мл). Остаток (1,8 г) использовали непосредственно на следующей стадии. Способ F; Rt: 1,14 мин, m/z=513,1 (M+H)+, точная масса: 512,2.(50 мл) добавляли EDC.HCl (7,0 ммоль) и HOBt (7,0 ммоль). Смесь перемешивали при 0C в течение 1 ч и затем добавляли соединение 49 (1,7 г). Суспензию затем охлаждали до 0C, и добавляли DIPEA (1,5 г). Смесь перемешивали при 20C в течение 15 ч. Смесь концентрировали и разбавляли CH2Cl2 (30 мл) и 0,5 н. NaOH (водный раствор) (15 мл). Органический слой отделяли и промывали солевым раствором(315 мл). Объединенный органический слой высушивали над Na2SO4 и концентрировали, получая сырой продукт. Сырой продукт очищали препаративной высокоэффективной жидкостной хроматографией(колонка: С 18, элюент: CH3CN/H2O от 35/65 до 50/50, 0,1% CF3COOH). Желаемую фракцию собирали и подщелачивали насыщенным NaHCO3 (водный раствор) до pH8. Смесь концентрировали и экстрагировали CH2Cl2 (2100 мл). Органический слой высушивали над Na2SO4, и растворитель удаляли под вакуумом. Чистый продукт затем дополнительно очищали жидкостной хроматографией (колонка: ChiralpakAS 25025 мм I.D., 20 мкм, мобильная фаза: А: CO2, В: метанол (0,5% DEA); В в А от 5 до 40%, поток: 50 мл/мин). Растворитель удаляли под вакуумом, и соединение 50 получали после лиофилизации (640 мг). Способ С; Rt: 3,84 мин,. m/z=827,3 (M+H)+, точная масса: 826,4.[]58920=-232, 8 (CH2Cl2, 2,5 мг/мл). 1 Н ЯМР (400 МГц, ДМСО-d6, описан основной изомер)ч./млн 11,79-12,44 (м, 2H, два общих синглета при 11,86 и 12,33), 8,12-8,34 (м, 3H), 7,83-8,05 (м, 6H), 7,63-7,69 (м, 1H), 7,49 (д, 1 Н; J=8,0 Гц), 7,31NaH (60%, 3,13 г, 78 ммоль, 2 экв.) добавляли к ДМСО (100 мл) с последующим добавлением по каплям диэтилмалоната (12,54 г, 78 ммоль, 2 экв.). Реакционную смесь нагревали до 100C в течение 40 мин. Смесь охлаждали до комнатной температуры, добавляли 1,4-дибром-2-нитробензол (10 г, 35,6 ммоль), перемешивание продолжали в течение 30 мин при комнатной температуре и затем нагревали до 100C в течение 1 ч. Реакционную смесь гасили насыщ. водным раствором NH4Cl (50 мл). Затем добавляли EtOAc (150 мл), и органический слой отделяли и промывали водой (50 мл) и солевым раствором (50 мл). Органический слой высушивали, фильтровали и затем концентрировали, получая соединение 51 (15 г), которое использовали без дальнейшей очистки на следующей стадии.(0,64 г, 35,6 ммоль) и реакционную смесь нагревали до 100C в течение 3 ч. Реакционную смесь охлаждали и вливали в EtOAc (200 мл) и солевой раствор (200 мл). Фазы отделяли, и органическую фазу промывали солевым раствором, высушивали над Na2SO4, и фильтрат концентрировали. Полученный остаток очищали хроматографией на силикагеле (элюент:петролейный эфир/этилацетат=50/1), получая продукт 52 (9,0 г).NaH (60%, 3,75 г, 93 ммоль) добавляли к перемешиваемой суспензии соединения 52 (8,0 г, 27,8 ммоль) в DMF (90 мл) при комнатной температуре. Через 15 мин добавляли MeI (22,2 г, 156 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Смесь лили в воду со льдом(200 мл) и EtOAc (200 мл). Органический слой промывали водой (3200 мл), солевым раствором, высушивали и концентрировали. Остаток очищали хроматографией на силикагеле (элюент:петролейный эфир/этилацетат=200:1), получая соединение 53 (7,0 г, 80% выход).(2 М, 80 мл, 160 ммоль, 2,7 экв.). Реакционную смесь нагревали до 80C в течение 5 ч и затем концентрировали в вакууме. Остаток разбавляли водой (50 мл) и промывали простым метил-трет-бутиловым эфиром (50 мл). Водный слой подкисляли до pH 2 добавлением 6 М HCl и затем экстрагировали EtOAc (350 мл). Органический слой промывали солевым раствором, высушивали и концентрировали, получая соединение 54 (5,0 г, 79%). Соединение 54 (8,8 г, 30,5 ммоль) растворяли в CH2Cl2 (200 мл) под N2. После добавления триэтиламина (4,01 г, 39,6 ммоль.) смесь перемешивали при комнатной температуре в течение 15 мин. Добавляли дифенилфосфорилазид (DPPA) (11 г, 40,0 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. После удаления летучих компонентов в вакууме полученный остаток разбавляли толуолом (200 мл), и смесь нагревали с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры и добавляли HCl (6 М, 100 мл). Полученный раствор нагревали с обратным холодильником в течение 3 ч. Сырую смесь концентрировали в вакууме, разбавляли водой со льдом и подщелачивали водным раствором NaOH (5M), экстрагировали EtOAc (500 мл), промывали солевым раствором и высушивали над NaSO4, затем концентрировали в вакууме. Остаток очищали хроматографией (петролейный эфир:этилацетат=10:1), получая соединение 55 (7,1 г, 89%).(S)-1-(трет-Бутоксикарбонил)пирролидин-2-карбоновую кислоту (6,42 г, 29,8 ммоль) растворяли в дихлорметане (150 мл), добавляли HATU (20,6 г, 54,2 ммоль) и триэтиламин (8,22 г, 81,4 ммоль). Полученный раствор перемешивали при комнатной температуре в течение 15 мин, затем добавляли соединение 55 (7,1 г, 2 7,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и затем добавляли воду (150 мл). Органический слой отделяли, промывали солевым раствором, высушивали и после фильтрации концентрировали в вакууме. Полученный остаток очищали хроматографией на колонках с силикагелем (петролейный эфир:этилацетат=20:1), получая соединение 56 (8,9 г, 72%). Спо- 29
МПК / Метки
МПК: C07D 403/14, C07D 471/04, A61K 31/47, C07D 491/10, A61K 31/4704, A61P 31/12, C07D 401/14, C07D 417/14
Метки: качестве, гетеробициклические, ингибиторов, производные
Код ссылки
<a href="https://eas.patents.su/30-23642-geterobiciklicheskie-proizvodnye-v-kachestve-ingibitorov-hcv.html" rel="bookmark" title="База патентов Евразийского Союза">Гетеробициклические производные в качестве ингибиторов hcv</a>
Предыдущий патент: Способ легирования полупроводникового материала
Следующий патент: Автомобильное оконное стекло с антенной
Случайный патент: Панель остекления












