Производные 2,5-пиперазиндиона в качестве ингибиторов apaf-1
Номер патента: 21838
Опубликовано: 30.09.2015
Авторы: Моуре Фернандес Алехандра, Гарсиа Виллар Нативидад, Гонсалес Пиначо Даниэль, Перес Пая Энрике, Монльео Мас Эстер, Масип Масип Исабель, Мессегуер Пейроч Анхель, Катена Руис Хуанло
Формула / Реферат
1. Соединение формулы (I)

и его фармацевтически приемлемые соли, в которой
R1 выбран из -(СН2)0-3-арила и -(СН2)0-3-гетероарила,
R2 выбран из -(СН2)0-3-арила, -(СН2)0-3-гетероарила и -(СН2)1-2-СН(арила)2,
R3 выбран из -C1-5-алкила, -(СН2)1-3-гетероциклила, -(СН2)1-3-арила и -(СН2)1-3-гетероарила,
R4 выбран из -Н, -(CHR7)1-3-CO-NR5R6, -(CHR7)1-3-CO-OR5 и -(CH2)1-3-CO[NCHR7CO]mNH2,
n представляет собой 1;
m представляет собой 1;
R5 и R6 независимо выбраны из -Н, -С1-5-алкила и -(СН2)0-3-арила,
R7 выбран из -Н и -С1-5-алкила, где
арил представляет собой фенил или нафтил;
гетероарил представляет собой 5-10-членную ароматическую кольцевую систему, содержащую по меньшей мере один кольцевой гетероатом, выбранный из О, S и N;
гетероциклил представляет собой насыщенную или частично ненасыщенную 5-10-членную кольцевую систему, содержащую по меньшей мере один гетероатом в кольце, выбранный из О, S и N; где
C1-5 алкильная и гетероциклическая группы могут быть необязательно замещены одним или несколькими OR5,
где арильная и гетероарильная группы могут быть необязательно замещены одним или несколькими заместителями, выбранными независимо из галогена, CF3, OR5 и NO2,
при условии, что, когда R2 представляет собой 2-(4-фторфенил)этил, R4 представляет собой -(CH2)-CO-NH2 и n является 1, тогда
если R1 представляет собой 2-(4-фторфенил)этил, R3 не является 2-(4-метоксифенил)этилом, 2-(2-пиридил)этилом или 2-(2,4-дихлорфенил)этилом, и
если R1 представляет собой 2-(2,4-дихлорфенил)этил, R3 не является 2-(4-метоксифенил)этилом или 2-(2-пиридил)этилом.
2. Соединение по п.1, в котором R1 представляет собой -(СН2)0-3-арил.
3. Соединение по п.1, в котором R5 представляет собой -Н или -C1-5-алкил.
4. Соединение по п.1, в котором R6 представляет собой -Н.
5. Соединение по п.1, которое представляет собой
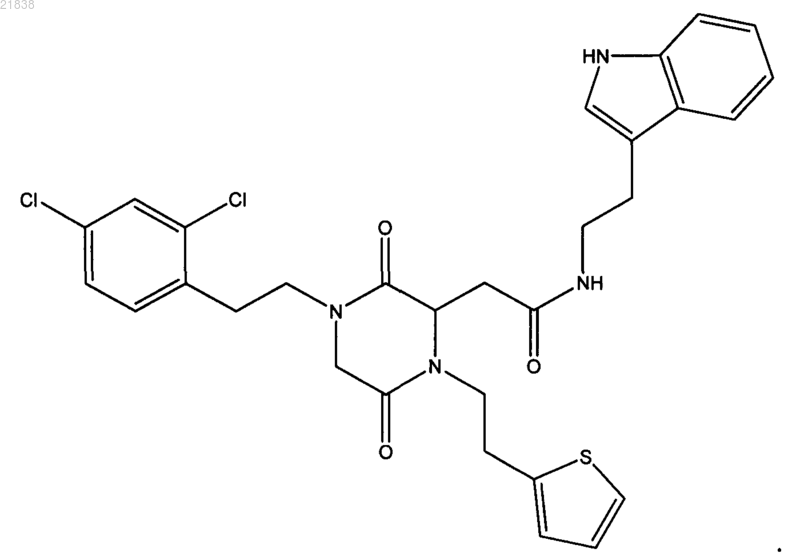
6. Соединение по п.1, которое представляет собой
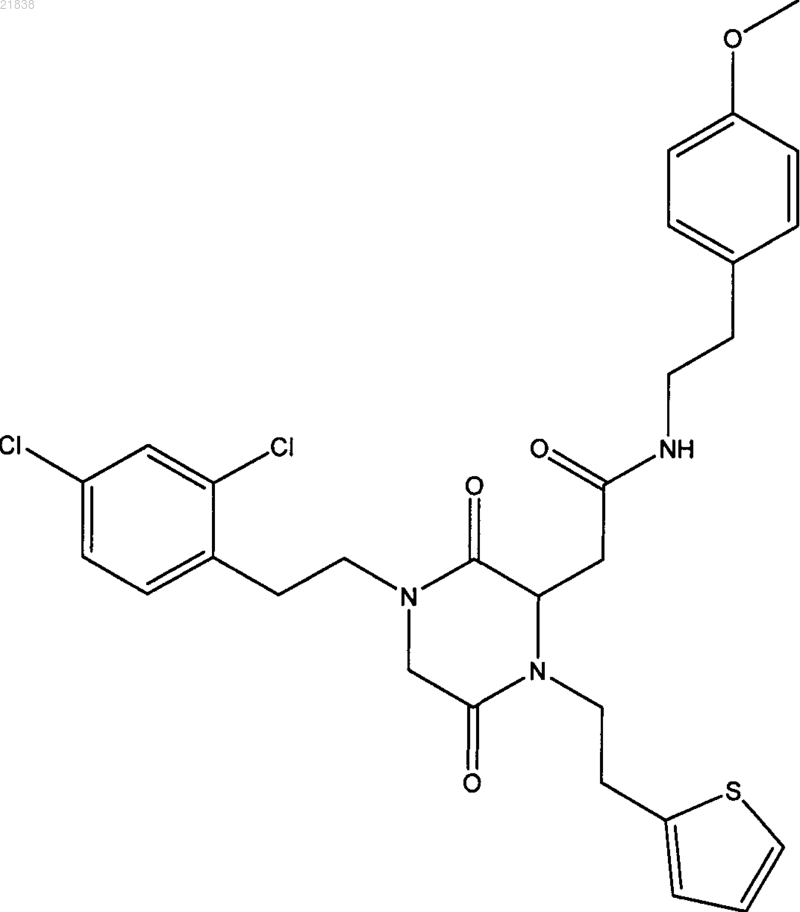
7. Соединение по п.1, которое выбрано из группы, состоящей из
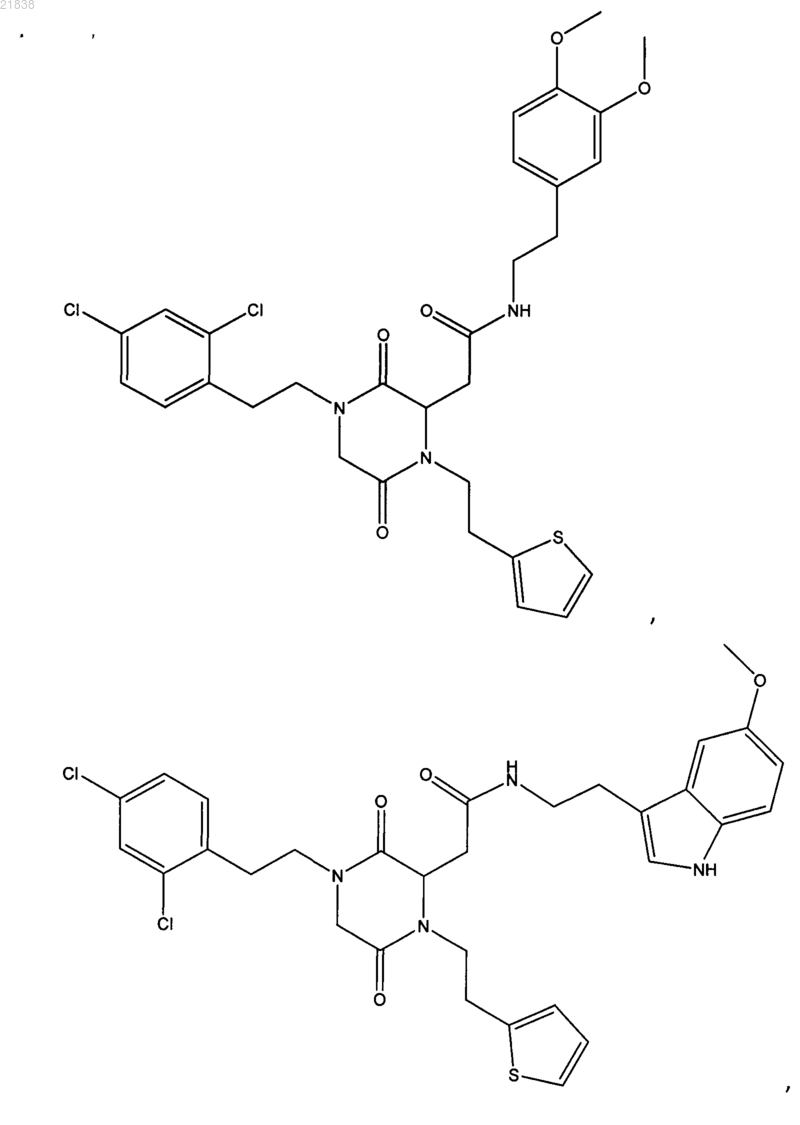
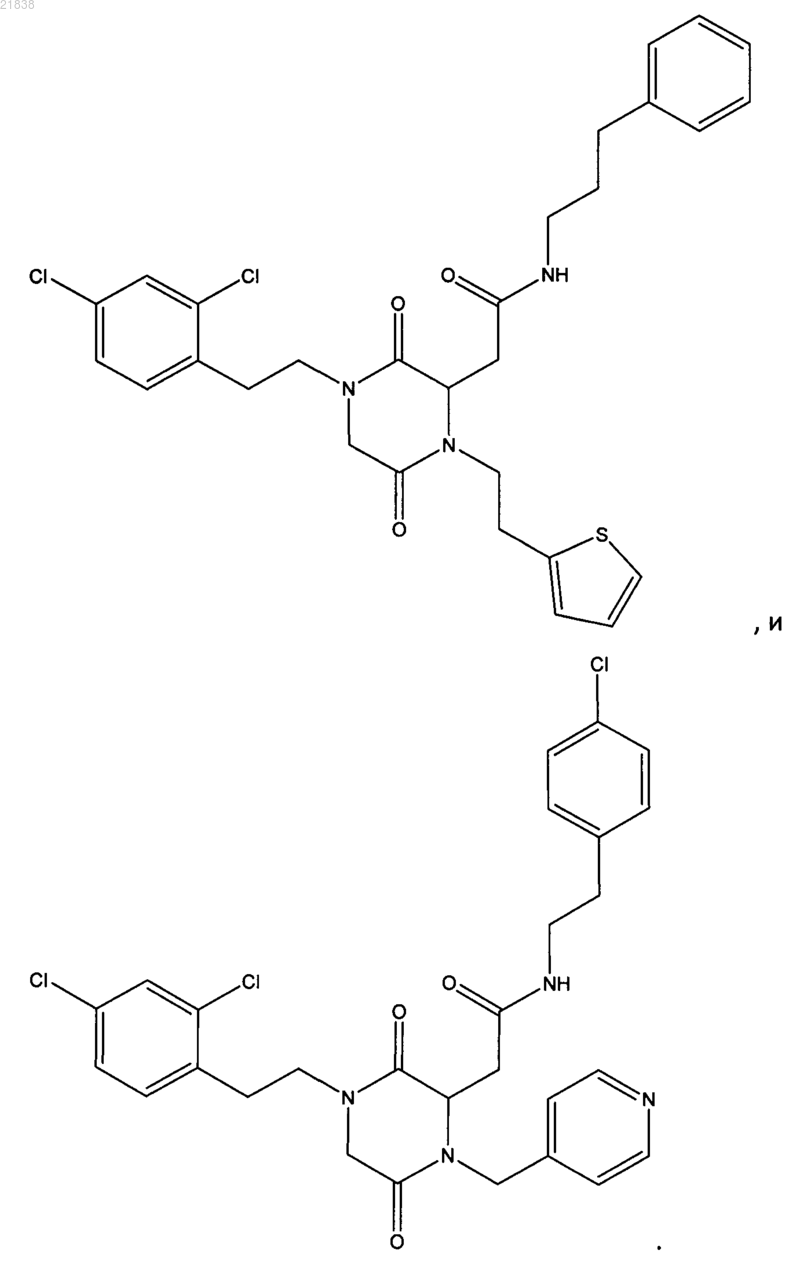
8. Применение соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли в профилактике и/или лечении патологического и/или физиологического состояния, связанного с увеличением апоптоза, выбранного из предотвращения цитотоксичности, патологий вследствие условий гипоксии; глазных патологий; нейродегенеративных заболеваний; диабета; остеоартрита; артрита; воспаления и иммунодефицита.
9. Применение по п.8, где глазные патологии выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой.
10. Применение соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли для консервирования органов или клеток.
11. Применение соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли для производства лекарственного средства, предназначенного для профилактики и/или лечения патологического и/или физиологического состояния, связанного с увеличением апоптоза, выбранного из предотвращения цитотоксичности; патологий вследствие условий гипоксии; глазных патологий; нейродегенеративных заболеваний; диабета; остеоартрита; артрита; воспаления и иммунодефицита.
12. Применение по п.11, где глазные патологии выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой.
13. Применение соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли для производства препарата, предназначенного для консервирования органов или клеток.
14. Способ профилактики и/или лечения индивидуума или органа, страдающего или восприимчивого к страданию от патологического и/или физиологического состояния, ассоциируемого с увеличением апоптоза, выбранного из предотвращения цитотоксичности, патологий вследствие условий гипоксии; глазных патологий; нейродегенеративных заболеваний; диабета; остеоартрита; артрита; воспаления и иммунодефицита, включающий введение терапевтически эффективного количества соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли указанному индивидууму или органу вместе с достаточными количествами фармацевтически приемлемых эксципиентов.
15. Способ по п.14, где глазные патологии выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой.
16. Способ консервирования органов или клеток, включающий введение терапевтически эффективного количества соединения, определенного в любом из пп.1-7, или его фармацевтически приемлемой соли в указанный орган или клетку вместе с достаточными количествами фармацевтически приемлемых эксципиентов.
Текст
Производные 2,5-пиперазиндиона формулы (I) являются ингибиторами фактора 1 (Apaf-1),активирующего апоптотическую пептидазу, поэтому они являются полезными в качестве активных фармацевтических ингредиентов для профилактики и/или лечения патологического и/ или физиологического состояния, связанного с увеличением апоптоза. Мессегуер Пейроч Анхель, Моуре Фернандес Алехандра, Гонсалес Пиначо Даниэль, Масип Масип Исабель, Перес Пая Энрике, Гарсиа Виллар Нативидад, Монльео Мас Эстер, Катена Руис Хуанло (ES) Медведев В.Н. (RU) Настоящее изобретение относится к соединениям для профилактики и/или лечения расстройств,вызываемых гибелью апоптотических клеток, или для профилактики дегенеративных процессов, вызываемых гибелью апоптотических клеток. Состояние уровня техники Апоптоз или программируемая гибель клеток является сложным физиологическим явлением, вовлекаемым в поддержание гомеостаза клеток. Апоптоз регулируется различными клеточными контрольными механизмами вследствие их ключевой роли в поддержании здоровья. Многие патологии основаны на апоптозной дисфункции. Следовательно, избыточная гибель апоптотических клеток может оказывать отрицательное влияние на функциональность ткани (например, гибель кардиомиоцитов в случаях инфаркта миокарда), тогда как избыточно ингибируемый апоптоз влечет за собой нерегулируемое выживание клеток (например, неопластические процессы). Клеточные компоненты, регулирующие апоптоз, находятся в постоянном динамическом равновесии в здоровых клетках. Для апоптотического каспазного каскада имеются по крайней мере два пути вполне характеризуемого активирования. Один из них, внешний путь, активируется внеклеточной сигнализацией и требует участия специфических мембранных рецепторов. Свойственный путь соответствует клеточному стрессу, токсическим агентам, радиации, окисляющим агентам, Са 2+ перегрузке, ДНК повреждению; он активируется в ответ на онкогенез и вовлекает митохондриальную дестабилизацию. В некоторых патофизиологических состояниях (например, при аноксии в клетках трансплантируемых органов, лечении токсическими веществами), апоптоз увеличивает и избыточное число смертей клеток, нанося вред функциональности пораженной ткани и подвергая риску ее выживание в некоторых случаях. Механизмы индукции молекулярного апоптоза влекут за собой активирование белков с активностью протеазы, называемых каспазами, которые известны также как эффекторы апоптоза. Образование молекулярного комплекса, называемого апоптосомой, необходимо для обеспечения возможности активирования каспаз. Апоптосома образуется цитохромом с, про-каспазой-9 и фактором 1 активирования апоптотической пептидазы (Apaf-1). Было продемонстрировано, что ингибирование Apaf-1 ингибирует образование апоптосомного комплекса и что оно вызывает ингибирование апоптоза (измеряемое по активации каспазы 3). В анализах клеток, при которых апоптоз вызывается с помощью гипоксии (снижение концентрации кислорода в воздухе) или с помощью химических соединений, наблюдается увеличение выживания клеток, когда последние предварительно обрабатывались ингибиторами апоптоза. Аналогичным образом, во время процесса удаления и трансплантации органа клетки подвергаются состоянию гипоксии, которое ведет к гибели клеток, подвергая риску жизнеспособность и функционирование органа. Поэтому, например, только 70% всех роговиц, предоставляемых для трансплантации, являются подходящими для имплантации. Это является следствием того, что во время хранения роговицы происходит гибель апоптотических клеток. Аналогичная ситуация имеет место с трансплантантами почек и сердца. На рынке в продаже имеются растворы для трансплантации органов, обеспечивающие исключительно буферные и стерильные условия окружающей среды, но они не содержат каких-либо активных молекул, которые предотвращают гибель апоптотических клеток. Исследование механизмов, вовлекаемых в апоптоз, позволило идентификацию различных потенциальных фармакологических мишеней. Поэтому были спроектированы ингибиторы, действующие на различных уровнях апоптотического каскада, такие как факторы транскрипции, киназы, регуляторы обеспечения проницаемости митохондриальной мембраны и ингибиторы семейства каспаз. Поскольку образование апоптосомы является ключевой стадией в апоптотическом каскаде и последующей активации каспаз, ингибирование активации Apaf-1 может оказывать большее воздействие на ингибирование апоптоза, чем другие исследуемые фармакологические мишени. В научной литературе имеются указания на терапевтическую роль ингибирования Apaf-1. Поэтому негативная трансдукцияApaf-1 доминанты с помощью аденовируса на животной модели Паркинсона была более эффективной,чем негативная трансдукция доминанты каспазы-1 с помощью аденовируса. Документ WO 2007060524 описывает производные [1,4]диазепан-2,5-диона следующей ниже формулы в качестве ингибиторов апоптоза Документ WO 2008009758 описывает соединения следующей ниже формулы в качестве ингибиторов UBC13-UEV взаимодействия, которые могут использоваться в приготовлении фармацевтических композиций для противоопухолевой терапии или для лечения и/или профилактики заболеваний, ассоциируемых с метаболическими путями, вовлекающими фермент UBC13, метаболическими путями, вовлекающими фактор NF-kB транскрипции, или путями, вовлекающими PCNA или RAD6. Хотя они считаются структурно аналогичными соединениям настоящего изобретения, они имеют иное применение. Поэтому желательно создание новых соединений, которые являются ингибиторами Apaf-1. Описание изобретения Настоящее изобретение предоставляет новые соединения, производные 2,5-пиперазиндиона, формулы (I), обладающие Apaf-1 ингибирующей активностью. Следовательно, первый аспект изобретения относится к соединениям формулы (I) и их фармацевтически приемлемым солям, в которойR5 и R6 независимо выбраны из -Н, -C1-5-алкила и -(СН 2)0-3-арила,R7 выбран из -Н и -C1-5-алкила, где арил представляет собой фенил или нафтил; гетероарил представляет собой 5-10-членную ароматическую кольцевую систему, содержащую по меньшей мере один кольцевой гетероатом, выбранный из О, S и N; гетероциклил представляет собой насыщенную или частично ненасыщенную 5-10-членную кольцевую систему, содержащую по меньшей мере один гетероатом в кольце, выбранный из О, S и N; где C1-5 алкильная и гетероциклическая группы могут быть необязательно замещены одним или несколькимиOR5,где арильная и гетероарильная группы могут быть необязательно замещены одним или несколькими заместителями, выбранными независимо из галогена, CF3, OR5 и NO2,при условии, что, когда R2 представляет собой 2-(4-фторфенил)этил, R4 представляет собой -(СН 2)CO-NH2 и n является 1, тогда если R1 представляет собой 2-(4-фторфенил)этил, R3 не является 2-(4-метоксифенил)этилом, 2-(2 пиридил)этилом или 2-(2,4-дихлорфенил)этилом, и если R1 представляет собой 2-(2,4-дихлорфенил)этил, R3 не является 2-(4-метоксифенил)этилом или 2-(2-пиридил)этилом. В конкретном воплощении изобретения R1 представляет собой -(СН 2)0-3-арил. В еще одном конкретном воплощении изобретения R5 представляет собой -Н или -C1-5-алкил. В еще одном конкретном воплощении изобретения R6 представляет собой -Н. В еще одном конкретном воплощении изобретения соединение формулы (I) представляет собой соединение следующей структуры: В еще одном конкретном воплощении изобретения соединение формулы (I) представляет собой соединение следующей структуры: В еще одном конкретном воплощении изобретения соединение формулы (I) выбирают из группы,состоящей из следующих соединений: Еще один аспект настоящего изобретения относится к применению соединения формулы (I) или его фармацевтически приемлемой соли в профилактике и/или лечении патологического и/или физиологического состояния, связанного с увеличением апоптоза, где патологическое и/или физиологическое состояние, связанное с увеличением апоптоза, выбрано из предотвращения цитотоксичности, патологий вследствие условий гипоксии; глазных патологий; нейродегенеративных заболеваний; диабета; остеоартрита; артрита; воспаления и иммунодефицита. Причем глазные патологии выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой. Еще один аспект настоящего изобретения относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для производства лекарственного средства, предназначенного для профилактики и/или лечения патологического и/или физиологического состояния, связанного с увеличением апоптоза, в частности, одного из упомянутых выше состояний. Причем глазные патологи выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой. Еще один аспект настоящего изобретения относится к способу профилактики и/или лечения индивидуума или органа, страдающего или восприимчивого к страданию от патологического и/или физиологического состояния, ассоциируемого с увеличением апоптоза, особенно одного из упомянутых выше состояний, включающему введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли указанному индивидууму или органу вместе с достаточными количествами фармацевтически приемлемых эксципиентов. Причем глазные патологи выбраны из группы, состоящей из повреждений, вызываемых глазной хирургией, возрастной макулярной дегенерацией, диабетической ретинопатией, пигментозного ретинита или глаукомы, или где цитотоксичность опосредуема химическими веществами, радиацией или акустической травмой. Настоящее изобретение также относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для консервирования органов или клеток. В другом аспекте изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для производства лекарственного средства, предназначенного для консервирования органов или клеток. В еще одном аспекте изобретение относится к способу консервирования органов или клеток, включающему введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли в указанный орган или клетку вместе с достаточными количествами фармацевтически приемлемых эксципиентов. Предпочтительными являются соединения формулы (I) и их фармацевтически приемлемые соли,особенно соединения формулы (I), описанные в качестве примеров или в качестве промежуточных соединений. Соединения настоящего изобретения могут использоваться по одному или в сочетании с одним или более соединениями, которые полезны для профилактики и/или леченияпатологического и/или физиологического состояния, связанного с увеличением апоптоза, особенно такого, как предотвращения цитотоксичности, особенно цитотоксичности, опосредуемой химическими веществами, физическими агента-3 021838 ми, такими как радиация, акустическая травма, ожоги, или биологическими агентами, такими как вирусная инфекция гепатита; патологий вследствие условий гипоксии, таких как сердечный приступ или церебральный инфаркт; глазных патологий, таких как повреждения, вызываемые глазной хирургией, возрастная макулярная дегенерация, диабетическая ретинопатия, пигментозный ретинит или глаукома; нейродегенеративных заболеваний, таких как болезни Альцгеймера, Хантингтона, Паркинсона или амиотрофический рассеянный склероз; диабета, особенно консервирование островков Лангеранса, или ассоциируемой с диабетом цитотоксичности, такой как, например, нефротоксичности; остеоартрита; артрита; воспаления или иммунодефицита, такого как ассоциируемое со СПИДом истощение CD4+ T лимфоцитов. Термин "C1-5 алкил", один или в сочетании, обозначает алкильную группу с прямой или разветвленной цепью, имеющую 1-5 атомов углерода. Термин "гетероциклил", один или в сочетании, обозначает насыщенный или частично ненасыщенный гетероцикл из 5-10 связей, содержащий один или более гетероатомов, выбранных из азота, кислорода и серы. Для целей данного изобретения гетероцикл может быть моноциклической или бициклической кольцевой системой, которая может включать конденсированные кольцевые системы. Примерами гетероциклических групп являются тетрагидрофуранил (ТГФ), дигидрофуранил, диоксанил, морфолил, пиперазинил, пиперидинил, 1,3-диоксоланил, имидазолидинил, имидазолинил, пирролидил, пирролидинил,тетрагидропиранил, дигидропиранил и аналогичные. Термин "арил", один или в сочетании, относится к моно- или полициклической ароматической кольцевой системе, содержащей кольцевые углеродные атомы. Предпочтительными арилами являются моноциклические или бициклические ароматические кольцевые системы из 5-10 членов, такие как фенил или нафтил, имеющие необязательно один или несколько заместителей, предпочтительно от одного до трех, выбранных независимо из галогена, CF3, ОН, OR5, OCF3, SH, SR5, NH2, NHCOR5, NO2, CN, COR5,COOR5, OCOR5, CONR5R6, -(CH2)0-3-NR5R6, SO2NH2, NHSO2CH3, С 1-5-алкила, арила и гетероарила. Термин "гетероарил", один или в сочетании, относится к ароматическому или частично ароматическому гетероциклу, содержащему по меньшей мере один кольцевой гетероатом, выбранный из О, S и N. Гетероарилы, таким образом, включают гетероарилы, сконденсированные с другими классами колец,таких как арилы, циклоалкилы и гетероциклы, которые являются неароматическими. Примеры гетероарильных групп включают пирролил, изоксазолил, изотиазолил, пиразолил, пиридил, оксазолил, тиазолил, имидазолил, триазолил, фурил, тиенил, пиримидил, бензизоксазолил, бензоксазолил, бензотиазолил,дигидробензофуранил, индолинил, пиридазинил, индазолил, изоиндолил, дигидробензотиенил, индолизинил, хиназолинил, нафтиридинил, изобензилфуранил, бензимидазолил, бензофуранил, бензотиенил,хинолил, индолил, изохинолил, дибензофуранил, бензотиофенил, тетрагидробензотиофенил и аналогичные. Выражение "необязательно замещен(ный) одним или несколькими заместителями" обозначает, что группа может быть незамещенной или замещенной одним или несколькими заместителями, предпочтительно 1, 2, 3 или 4 заместителями, при условии, что указанная группа имеет 1, 2, 3 или 4 положения,восприимчивых к замещению. Термин "фармацевтически приемлемые соли" обозначает те соли, которые сохраняют эффективность и биологические свойства свободных оснований или свободных кислот и которые не вызывают дискомфорта в биологических ощущениях или в каких-либо других ощущениях. Согласно изобретению соединения формулы (I) и их фармацевтически приемлемые соли полезны для профилактики и/или лечения патологического и/или физиологического состояния, связанного с увеличением апоптоза, за счет их APAF-1 ингибирующей активности. Если не указано иное, все технические и научные термины, используемые здесь, имеют те же значения, что и значения, обычно понятные специалистам в области изобретения. В практике настоящего изобретения могут использоваться методы или способы и материалы, которые аналогичны или эквивалентны тем, что приведены в описании. В описании и пунктах формулы изобретения слово "включает" и его варианты не имеют целью исключить другие технические признаки, добавки, компоненты, стадии или стереоизомеры соединений, о которых идет речь.Специалисты в данной области техники, очевидно,сделают выводы о других объектах, преимуществах и признаках изобретения на основании частично описания и частично практического осуществления изобретения. Соединения формулы (I) могут быть получены с помощью следующих различных методов, известных специалисту в области органического синтеза, в частности с помощью общих процессов, показанных на следующих схемах. Исходные материалы для способов получения являются промышленно доступными или они могут быть получены известными из литературы способами. Если не указано иное,значения групп R1, R2, R3, R4, R5, R6 и R7 являются значениями, описанными в общей формуле (I). Соединения формулы (I) могут быть получены согласно способам и схемам, описанным ниже. Согласно способу А, когда с флуоренметилоксикарбонильной группы снята защита, амин II, связанный с твердым носителем или подложкой, ацилируется ацилирующим агентом III, в котором X представляет уходящую группу, например галоген, и Y представляет собой ОН или галоген. Когда Y представляет галоген, например хлорацетилхлорид, реакция может проводиться в присутствии основания,такого как триэтиламин. Когда Y представляет -ОН, например бромуксусную кислоту, реакция может осуществляться в присутствии подходящего агента сочетания, например N,N'-диизопропилкарбодиимида. В обоих случаях реакция может проводиться в инертном растворителе, в котором смола способна набухать, таком как N,N-диметилформамид или метиленхлорид, и при комнатной температуре или при микроволновом облучении для минимизации времени реакции. Затем амин IVa подвергается сочетанию с использованием третичного амина в качестве основания. Реакция может осуществляться при комнатной температуре или при микроволновом облучении. Карбоновая кислота VI, в которой PG представляет защитную группу, такую как аллил, вводится в реакцию с амином V с получением амида VII, с использованием агента сочетания, такого как, например,смесь N,N'-диизопропилкарбодиимида и 1-гидроксибензотриазола. Затем добавляется амин IVb с помощью реакции Михаэля с использованием основания и растворителя, такого как N,N-диметилформамид или диметилсульфоксид, с получением промежуточного соединения VIII после отщепления от смолы с использованием смеси трифторуксусной кислоты, дихлорметана и воды. Промежуточное соединениеVIII циклизуется (промежуточное соединение IX), и защита снимается в основной среде, давая промежуточную кислоту X. Промежуточное соединение X альтернативно может быть получено в твердой фазе согласно схеме 2, где амин V может быть получен из амина IVa или с помощью реакции восстановительного аминирования глиоксилатом в THF-AcOH с использованием восстановительного агента, такого как NaBH3CN,или альтернативно с помощью алкилирования бромацетатом или бромацетамидом с использованием третичного амина в качестве основания. Впоследствии осуществляется сочетание с кислотой VI с получением амида VII'. Затем добавляется амин IVb, и с помощью реакции Михаэля и последующей циклизации in situ получается промежуточный сложный эфир IX, который с помощью обработки основанием дает соединение X. Схема 2 Схема 3. Получение соединения формулы (I) Соединение формулы Ia может быть получено из промежуточного соединения X с помощью сочетания с амином, связанным с твердым носителем Va или Va', полученным в соответствии с методикой,указанной выше, в присутствии агента сочетания, такого как, например, комбинация HATU и НОВТ. Соединение формулы Ib может быть получено согласно способу, сходному с синтезом соединения Ia, за исключением того, что в случае твердой фазы, в которой исходный твердый носитель (IIb) имеет галогеновую группу вместо аминогруппы, такой как, например, хлортритильная смола, после отщепления от смолы получается кислота. Сложный эфир Ic может синтезироваться с помощью сложной этерификации соответствующей кислоты Ib с помощью обычных в органическом синтезе методов сложной этерификации, таких как, например, с использованием метанола в кислотной среде, такой как серная кислота. В случае Ib соединение может быть получено с помощью омыления сложного эфира Ic. Соединения формулы Id могут быть получены по реакции промежуточного соединения X с первичным амином IVc. Альтернативный способ получения соединений формулы I может осуществляться с помощью ацилирования амина II аминокислотой формулы XI (способ В). Способ В Как вполне очевидно специалистам в области изобретения, для получения соединения формулы I можно комбинировать некоторые из стадий способа А с некоторыми из стадий способа В. Альтернативно, соединения формулы Ie и If можно получать, как показано на схеме, описанной ниже. Схема 3 Пептид XIII и псевдопептид XIV, которые связываются с кислотой X, могут быть получены с по-6 021838 мощью стандартных реакций пептидного синтеза. Следовательно, амин IIa (Z=NH2) или хлоридная IIb(Z=Cl) смола может вводиться в реакцию с подходящим образом защищенной аминокислотой (XII), с использованием подходящего агента сочетания. Процесс необязательно может впоследствии повторяться, предварительно со снятием защиты с амина, с получением пептида XIII. Карбоновая кислота X затем реагирует с соединением XIII с получением соединения Ie. При комбинировании аминокислотных звеньев XIII с глициновым звеном (следуя способу А или В) получается псевдопептид XIV, который ведет к получению соединения If согласно способу, сходному со способом, описанным выше. Используемые первичные амины IVa, IVb и IVc являются промышленно доступными или могут быть получены с помощью известных способов (March, Advanced Organic Chemistry, 1991, Ed. John WileySons) или с помощью использования, например, схем, описанных ниже. Схема 4 Амин может быть получен с помощью реакции Мицунобу, исходя из спирта и фталимида калия в присутствии, например, диэтилазодикарбоксилата (DEAD) и трифенилфосфина в тетрагидрофуране в качестве растворителя и последующего высвобождения гидразингидратом (Mitsunobu, J. Am. Chem. Soc. 1972, 94, 679-680).N-замещенные глицины V и XI могут быть синтезированы с помощью нескольких из способов, показанных ниже, таких как, например, восстановительное аминирование соответствующего глицина подходящим альдегидом (схема 5) с использованием восстанавливающих агентов, таких как NaBH4,NaBH3CN или NaBH(AcO)3, или с помощью нуклеофильного замещения сложного эфира амином R-NH2 Следующие примеры служат для лучшей иллюстрации изобретения, но они не должны рассматриваться как ограничивающие его. Номенклатура, используемая в настоящем документе, основана на CFWCHEMICALNAME function в Chemdraw для Excel version 12. Общие данные Соединения синтезировались с использованием полистирольной AM RAM смолы, приобретаемой у фирмы Rapp Polymere GmbH (Германия). В реакциях использовались полистирольные шприцы с полиэтиленовым диском с использованием HS501 digital IKA Labortechnic мешалки. В реакциях, осуществляемых с помощью микроволн, использовалась СЕМ Discover модель с 10-мл стеклянными реакторами. Продукты анализировали с помощью способ А - с помощью RP-HPLC с использованием оборудования Hewlett Packard Series 1100 (УФ детектор 1315 А) с использованием колонки с обращенной фазой X-Terra C18 (150,46 см, 5 мкм). Длина волны, используемая для УФ детекции, была 210 нм. В качестве подвижной фазы использовались смесиCH3CN-H2O с 0,1% TFA 1 мл/мин. Анализы проводили с градиентом от 20 до 70% CH3CN (10 мин) и от 70 до 100% (8 мин); способ В - продукты анализировали с использованием оборудования Agilent 1100 HPLC, снабженного УФ детектором с изменчивой длиной волны и масс-спектрометром модели 1100 VL. Используемая для УФ детекции длина волны была 210 нм, в то время как MS детектор эксплуатировали по способу положительной электро-распылительной ионизации и проводили 100-1300 m/z сканирование. Что касается хроматографического разделения, используемой колонкой была Kromasil 100 С 18 (4,040 нм, 3,5 мкм), устанавливаемая при 50 С, и инъецировали 5 мкл. Для элюирования придерживались одного из двух градиентов растворителей, описываемых ниже: 5-100% В 7 мин, 5% В 7-8,5 мин. Скорость потока подвижной фазы составляет 1,4 мл/мин. Растворитель А состоит из 0,2% муравьиной кислоты в воде,тогда как В представляет 0,2% муравьиную кислоту в ацетонитриле; способ С - используют оборудование Waters HPLC-UV-MS, снабженное детектором, имеющим последовательно диоды, и масс-спектрометром модели EMD1000. Используемая для УФ детекции длина волны была 210 нм, в то время как MS детектор эксплуатировали по способу положительной электрораспылительной ионизации и проводили 100-1000 m/z сканирование. Что касается хроматографического разделения, используемой колонкой была Kromasil C18 (2,150 мм, 3,5 мкм), устанавливаемая при 50 С,и инъецировали 2 мкл. Для элюирования придерживались следующего градиента: 5-100% В, 0-5 мин,100% В, 5-6,5 мин, 5% В, 6,5-8 мин. Скорость потока подвижной фазы составляет 0,5 мл/мин. Масс-спектрометрию высокого разрешения осуществляли с помощью UPLC-HRMS с использованием Waters Acquity UPLC оборудования, соединенного с масс-спектрометром Waters ортогонального времени ускорения полета модели LCT Premier XE. Хроматографическое разделение проводили с помощью Waters Acquity С 18 колонки (102,1 мм, 1,7 мкм). В качестве подвижной фазы использовали смеси CH3CN-H2O с 20 мМ муравьиной кислотой при 0,3 мл/мин. Анализы проводили с градиентом от 50 до 100% CH3CN, 6 мин. Промежуточное соединение VIVI. Аллиловый эфир (Z)-2-бутендиовой кислоты 1,8 мл Аллилового спирта (26 ммоль, 1,3 экв.) добавляли к 2 г раствору малеинового ангидрида (20 ммоль) в хлороформе. Реакционную смесь перемешивали при нагревании с обратным холодильником в течение 5 ч. Получающийся раствор обрабатывали 1 н. HCl и экстрагировали хлороформом. Органические экстракты промывали насыщенным раствором хлорида натрия, сушили безводным сульфатом магния и фильтровали. Растворитель выпаривали при пониженном давлении и полученный остаток идентифицировали как промежуточное соединение VI в форме масла (95% чистота, 85% выход). Промежуточные соединения X Смесь 2 г Fmoc-Rink амид AM полистирольной смолы (0,61 ммоль/г смолы, 1,22 ммоль) и 12 мл 20% пиперидина в DMF перемешивали в микроволновом реакторе в течение 2 мин при 35 С. Смолу отфильтровывали и промывали DMF (315 мл), изопропиловым спиртом (315 мл) и DCM (315 мл). Смолу обрабатывали раствором бромуксусной кислоты (III, 840 мг, 5 экв.) и N,N'-диизопропилкарбодиимидом (1,15 мл, 5 экв.) в DMF (12 мл). Реакционную смесь перемешивали в течение 2 мин при 60 С в микроволновом реакторе. Смолу отфильтровывали и промывали DMF (315 мл), изопропиловым спиртом (315 мл) и DCM (315 мл). К смоле добавляли раствор 2,4-дихлорфенэтиламина (IVa, 1,035 мл, 5 экв.) и триэтиламина (0,85 мл, 5 экв.) в 12 мл DMF и суспензию перемешивали в течение 2 мин при 90 С при активировании микроволнами. Супернатант удаляли и реакцию повторяли в тех же условиях. Полученную смолу V фильтровали и промывали DMF (315 мл), изопропиловым спиртом (315 мл) и DCM (315 мл). Затем смолу обрабатывали раствором аллилового эфира (Z)-2-бутендиовой кислоты (VI, 957 мг, 5 экв.), НОВТ (825 мг, 5 экв.) и DIC(770 мкл, 5 экв.) в DCM:DMF 2:1, 123 мл. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин и фильтровали. Смолу сушили и промывали DMF (315 мл), изопропиловым спиртом(315 мл) и DCM (315 мл). Затем к смоле добавляли раствор 3,3-дифенилпропиламина (IVb, 1,29 г, 5 экв.) и триэтиламина (0,85 мл, 5 экв.) в 12 мл DMF и суспензию перемешивали в течение 3 ч при комнатной температуре. Смолу отфильтровывали и реакцию повторяли в течение 16 ч при той же температуре. Супернатант удаляли и смолу сушили и промывали DMF (315 мл), изопропиловым спиртом (315 мл) иDCM (315 мл). Отщепление от твердой фазы выполняли с помощью обработки смесью 60:40:2TFA/DCM/вода (20 мл) в течение 30 мин при комнатной температуре. Реакционную смесь фильтровали и растворители выпаривали при пониженном давлении. Затем выполняли циклизацию с помощью обработки полученного остатка 20 мл диоксана в течение 1,5 ч при нагревании с обратным холодильником(мониторинг реакции с помощью HPLC). Затем добавляли 1:2 раствор (9 мл) 4 н. гидроксида натрия и аллилового спирта и смесь перемешивали в течение 45 мин при нагревании с обратным холодильником. Сырой продукт реакции подкисляли 1 н. соляной кислотой и растворитель упаривали. Получающийся в результате раствор экстрагировали этилацетатом (350 мл) и органические экстракты промывали насыщенным раствором NaCl (2100 мл); их сушили безводным MgSO4 и выпаривали при пониженном давлении, получая 450 мг желаемого продукта (X, 70% чистота, 95% выход при 210 нм). HRMS (М+Н)+ вычислено для C29H29Cl2N2O4, 539,1504, экспериментальное, 539,1514. Следующие соединения получали,следуя методу, сходному со способом, описанным в примере выше, но с использованием различных аминов Стадия 1. Промежуточное соединение V' 7,55 мл Et3N и 2,50 г (27 ммоль) Бромацетамида добавляли к раствору 5 г (41 ммоль) 2-(2-пиридил)этиламина в 300 мл диоксана. Получающуюся в результате смесь кипятили с обратным холодильником на протяжении ночи. Раствор выпаривали досуха и очищали на силикагеле, используя смесь AcOEt:MeOH:NH3 (10:1:0,01) в качестве элюента, получая 2,39 г промежуточного соединения V. Способ В: tr: 0,261, m/z: 180. Стадия 2. Промежуточное соединение VII' 4,90 мл Et3N, 3,24 г (24 ммоль) НОВТ, 4,60 г (24 ммоль) EDC и продукт стадии 1 добавляют к раствору, состоящему из 2,31 г (16,0 ммоль) моноэтилового эфира малеиновой кислоты в 100 мл DMF. Образовавшуюся суспензию хранят при перемешивании при к.т. в течение 18 ч. Затем ее обрабатывают водой и добавляют AcOEt, органическую фазу отделяют, а водную фазу экстрагируют еще один раз этилацетатом. Органические фазы сливают вместе и последовательно промывают насыщенным растворомNaHCO3 и солевым раствором. Затем их сушат безводным сульфатом натрия, растворитель отфильтровывают и выпаривают при пониженном давлении. Получают 1,5 г соединения, идентифицируемого как соединение примера VII'.13. Способ В: tr: 1,094, m/z: 306. Стадия 3. Промежуточное соединение IX 0,8 мл (5,89 ммоль) Et3N и 1,5 г Промежуточного соединения VII'.13 (4,91 ммоль) добавляли к раствору 2-тиофенилэтиламина (0,63 мл, 5,4 ммоль) в 40 мл диоксана и получающийся раствор перемешивали в течение 18 ч при нагревании с обратным холодильником. Раствор выпаривали досуха и очищали с помощью хроматографии на колонке с силикагелем, используя (10:1:0,01) смесь AcOEt:МеОН:NH3 в качестве элюента, получая 510 мг масла, идентифицируемого как промежуточное соединение, IX.13 этил(2-(3,6-диоксо-4-(2-(пиридин-2-ил)этил)-1-(2-тиофен-2-ил)этил)пиперазин-2-ил)ацетат. Способ A: tr: 2,289, m/z: 416. Следующие промежуточные соединения получали с помощью способа, сходного с получением промежуточного соединения IX.13IX.13 в 15 мл смеси МеОН:ТГФ (1:3) и оставляли перемешиваться при комнатной температуре в течение ночи. Затем смесь разбавляли AcOEt и промывали водой, водную фазу подкисляли 1 н. раствором HCl до рН 7 и экстрагировали AcOEt. В заключение органические фазы объединяли, сушили на безводномNa2SO4, фильтровали и растворитель выпаривали при пониженном давлении. Получалось 330 мг бесцветного масла, идентифицируемого как промежуточное соединение X.13. Способ В: tr: 1,768, m/z: 388. Следующие промежуточные соединения получали таким же способом, как для промежуточного соединения Х.13 Кислоту Х.1 (100 мг, 1,1 экв.), HOBt (40 мг, 1,5 экв.), HATU (105 мг, 1,5 экв.) и DIPEA (95 мкл, 3 экв.) добавляли к суспензии смолы Va (0,61 ммоль/г смолы, 0,17 ммоль) с подходящим амином и предварительно подвергнутой разбуханию, с помощью раствора 2:1 DCM:DMF (дихлорметан:диметилформамид) (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смолу сушили и промывали DMF (33 мл), изопропиловым спиртом (33 мл) и DCM (33 мл) и затем обрабатывали смесью 60:40:2 TFA/DCM/вода (5 мл) в течение 30 мин при комнатной температуре. Смолу фильтровали и фильтрат выпаривали при пониженном давлении, получая 73 мг желаемого соединения Кислоту Х.2 (100 мг, 1 экв.) добавляли к раствору 2-(4-фторбензиламино)ацетамида (IVc, 28 мкл, 1 экв.), DIC (85 мкл, 3 экв.) и триэтиламина (80 мкл, 3 экв.) в 2 мл DCM и реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Сырой неочищенный продукт реакции нейтрализовали с помощью NaOH и экстрагировали DCM. Органические экстракты промывали насыщенным раствором хлорида натрия, сушили на безводном MgSO4 и выпаривали при пониженном давлении, получая 96 мг желаемого соединения Ia.2.1. Способ A: tr: 13,239, m/z: 681. Следующие промежуточные соединения получали таким же способом, как для соединения Ia.2.1: Раствор бромуксусной кислоты (275 мг, 5 экв.) и DIPEA (345 мкл, 5 экв.) в DMF (3 мл) добавляли к 200 мг 2-хлортритилхлоридной смолы (1,6 ммоль/г Cl/г смолы, 0,17 ммоль) и суспензию перемешивали при комнатной температуре в течение 1 ч. Смолу фильтровали и промывали DMF (33 мл), изопропиловым спиртом (33 мл) и DCM (33 мл). Смолу затем обрабатывали метанолом (3 мл) в течение 10 мин для удаления непрореагировавших атомов хлора. Супернатант удаляли, и остаток промывали DCM (33 мл), изопропиловым спиртом (33 мл) и DMF (33 мл). Затем к смоле добавляли раствор 2,4-дихлорфенэтиламина (IVa, 340 мкл, 5 экв.) и триэтиламина (280 мкл, 5 экв.) в 3 мл DMF и суспензию перемешивали при комнатной температуре в течение 3 ч. После фильтрования и промывки с помощью DMF(33 мл), изопропиловым спиртом (33 мл) и DCM (33 мл) в смолу добавляли кислоту X (100 мг, 1,1 экв.) в присутствии НОВТ (40 мг, 1,5 экв.), HATU (105 мг, 1,5 экв.) и DIPEA (95 мкл, 3 экв.) в смеси 2:1DCM:DMF (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч и фильтровали. Смолу сушили и промывали DMF (33 мл), изопропиловым спиртом (33 мл) и DCM (33 мл). Наконец, смолу обрабатывали смесью 5:95 TFA:DCM (5 мл) в течение 30 мин при комнатной температуре, получая сырой неочищенный продукт реакции, который фильтровали. Растворитель фильтрата удаляли при пониженном давлении, получая 60 мг желаемого соединения (Ib.I.2, 42% выход, 91% чистоты). Смесь кислоты Ib.1.2 (30 мг, 1 экв.), метанола (7,5 мл) и H2SO4 (20 мкл, 1 экв.) подвергали реакции в течение 15 ч при комнатной температуре. Сырой неочищенный продукт реакции нейтрализовали с помощью NaOH и экстрагировали DCM. Органические экстракты промывали насыщенным раствором хлорида натрия, сушили на безводном MgSO4 и выпаривали при пониженном давлении, получая 22 мг же- 20021838 лаемого соединения Ic.1.2 (72% выход, 86% чистоты). HRMS (М+Н)+ вычислено для C40H39Cl4N3O5,782,1722, экспериментальное, 782,1216.
МПК / Метки
МПК: A61K 31/495, C07D 241/06
Метки: качестве, производные, 2,5-пиперазиндиона, apaf-1, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-21838-proizvodnye-25-piperazindiona-v-kachestve-ingibitorov-apaf-1.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2,5-пиперазиндиона в качестве ингибиторов apaf-1</a>
Предыдущий патент: Способ противопожарного устройства полосных лесных культур сосны
Следующий патент: Тыльная покровная композиция и зеркало
Случайный патент: Агрохимические композиции












