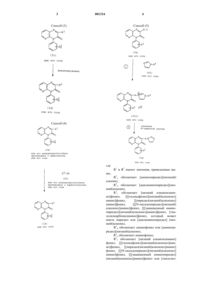
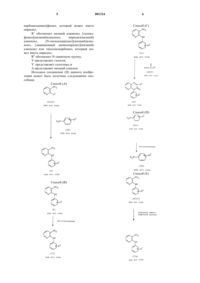
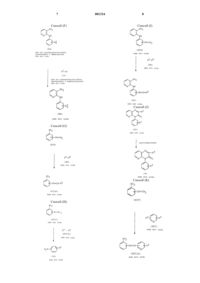
Гетеробициклические производные
Номер патента: 1324
Опубликовано: 26.02.2001
Авторы: Ватанабе Синя, Савада Акихико, Симазаки Норихико
Формула / Реферат
1. Соединение формулы
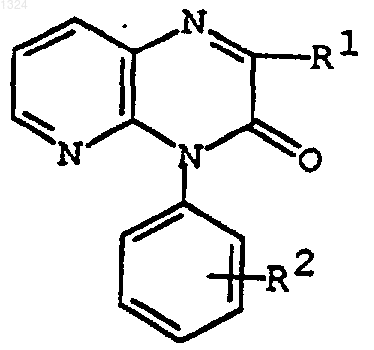
где R1 представляет пиридил(С1-6)алкил, N-оксидопиридил(C1-6)алкил или имидазолил(С1-6)алкил,
R2 представляет аминофенил, [защищенный амино]фенил,
[[[галоидфенил](С2-6)алкеноил]амино]фенил,
[[пиридил(С2-6)алкеноил]амино]фенил,
[[[N-оксидопиридил](С2-6)алкеноил]амино]фенил,
[[[защищенный аминопиридил](С2-6)алкеноил]амино]фенил,
[тиазолилкарбониламино]фенил, который может иметь пиридил, нафтил, имеющий C1-6алкокси и галоген, [дигалоидфенил](С2-6)алкенил,
[N-оксидопиридил](С2-6)алкенил,
[аминопиридил](С2-6)алкенил,
[защищенный аминопиридил](С2-6)алкенил,
[карбоксипиридил](С2-6)алкенил,
[защищенный карбоксипиридил](С2-6)алкенил,
[[пиридил(С2-6)алкенил]пиридил](С2-6)алкенил,
[[карбокси(С2-6)алкенил]пиридил](С2-6)алкенил,
[[защищенный карбокси(С2-6)алкенил]пиридил](С2-6)алкенил, [пиридил(С2-6)алкенил]пиридил, C1-6алкилбензотиазолил или [галоидпиридилкарбонил]амино, при условии, что если R2 представляет [[4-пиридил(С2-6)алкеноил]амино]фенил, аминофенил, [C1-6алканоиламино]фенил или [дигалоидфенил](С2-6)алкенил, то
R1 обозначает N-оксидопиридил(С1-6)алкил или имидазолил(C1-6)алкил,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, в котором
R2 представляет аминофенил, [C1-6алканоиламино]фенил,
[[[галоидфенил](С2-6алкеноил]амино]фенил,
[[пиридил(С2-6алкеноил]амино]фенил,
[[[N-оксидопиридил(С2-6алкеноил]амино]фенил,
[[[ациламинопиридил(С2-6алкеноил]амино]фенил,
[[пиридилтиазолил]карбониламино]фенил, нафтил, имеющий C1-6алкокси и галоген,
[дигалоидфенил](С2-6)алкенил, [N-оксидопиридил](С2-6)алкенил,
[аминопиридил](С2-6)алкенил, [[ациламино]пиридил](С2-6)алкенил,
[карбоксипиридил](С2-6)алкенил,
[сложноэтерифицированный карбоксипиридил](С2-6)алкенил,
[[пиридил(С2-6)алкенил]пиридил](С2-6)алкенил,
[[карбокси(С2-6)алкенил]пиридил](С2-6)алкенил,
[[сложноэтерифицированный карбокси(С2-6)алкенил]пиридил](С2-6)алкенил,
[пиридил(С2-6)алкенил]пиридил, C1-6алкилбензотиазолил или галоидпиридилкарбониламино,
при условии, что если R2 представляет [[4-пиридил(С2-6)aлкеноил]амино]фенил, аминофенил, [C1-6алканоиламино]фенил или [дигалоидфенил](С2-6)алкенил, то
R1 обозначает N-оксидопиридил(С1-6)алкил или имидазолил(C1-6)алкил.
3. Соединение по п.2, в котором
R2 представляет аминофенил, [C1-6алканоиламино]фенил,
[[[галоидфенил](С2-6)алкеноил]амино]фенил,
[[пиридил(C2-6)алкеноил]амино]фенил,
[[[N-оксидопиридил](С2-6)алкеноил]амино]фенил,
[[[C1-6алканоиламино]пиридил](С2-6)алкеноил]амино]фенил,
[[пиридилтиазолил]карбониламино]фенил, нафтил, имеющий С1-6алкокси и галоген,
[дигалоидфенил](С2-6)алкенил,
[N-оксидопиридил](C2-6)алкенил,
[аминопиридил](C2-6)алкенил, (C1-6)
[[C1-6алканоиламино]пиридил](С2-6)алкенил, [[моно(или ди, или три)галоид(C1-6)алканоиламино]пиридил](С2-6)алкенил, [карбоксипиридил](С2-6)алкенил, [C1-6алкоксикарбонилпиридил](С2-6)алкенил, [[пиридил(C2-6)алкенил]пиридил](С2-6)алкенил, [[карбокси(С2-6)алкенил]пиридил](С2-6)алкенил, [[C1-6алкоксикарбонил(С2-6)алкенил]пиридил](С2-6)алкенил, [пиридил(С2-6)алкенил]пиридил, C1-6алкилбензотиазолил или галоидпиридилкарбониламино,
при условии, что если R2 представляет [[4-пиридил(С2-6)алкеноил]амино]фенил, аминофенил, [C1-6алканоиламино]фенил или [дигалоидфенил](С2-6)алкенил, то
R1 обозначает N-оксидопиридил(С1-6)алкил или имидазолил(C1-6)алкил.
4. Соединение по п.3, в котором
R2 представляет аминофенил, [C1-6алканоиламино]фенил,
[[[галоидфенил](С2-6)алкеноил]амино]фенил,
[[пиридил(С2-6)алкеноил]амино]фенил,
[[[N-оксидопиридил](С2-6)алкеноил]амино]фенил,
[[[[C1-6алканоиламино]пиридил](С2-6)алкеноил]амино]фенил,
[[пиридилтиазолил]карбониламино]фенил, нафтил, имеющий C1-6алкокси и галоген,
[дигалоидфенил](С2-6)алкенил,
[N-оксидопиридил](С2-6)алкенил,
[аминопиридил](С2-6)алкенил, [[алканоиламино]пиридил](С2-6)алкенил, [[тригалоид(C1-6)алканоиламино]пиридил](С2-6)алкенил), [карбоксипиридил](С2-6)алкенил,
[алкоксикарбонилпиридил](С2-6)алкенил,
[[пиридил(С2-6)алкенил]пиридил](C2-6)алкенил,
[[карбокси(С2-6)алкенил]пиридил](С2-6)алкенил,
[[C1-6алкоксикарбонил(С2-6)алкенил]пиридил](С2-6)алкенил,
[пиридил(С2-6)алкенил]пиридил, C1-6алкилбензотиазолил или галоидпиридилкарбониламино, при условии, что если R2 представляет [[4-пиридил(С2-6)алкеноил]амино]фенил, аминофенил, [C1-6алканоиламино]фенил или [дигалоидфенил](С2-6)алкенил, то
R1 обозначает N-оксидопиридил(С1-6)алкил или имидазолил(C1-6)алкил.
5. Соединение по п.4, в котором R1 представляет пиридил(С1-6)алкил, и
R2 представляет [[2-пиридил(С2-6)алкеноил]амино]фенил,
[[3-пиридил(С2-6)алкеноил]амино]фенил,
[[пиридилтиазолил]карбониламино]фенил,
[аминопиридил](С2-6)алкенил,
[[C1-6алканоиламино]пиридил](С2-6)алкенил,
[[тригалоид(C1-6)алканоиламино]пиридил](С2-6)алкенил),
[C1-6алкоксикарбонилпиридил](С2-6)алкенил),
[[пиридил(С2-6)алкенил]пиридил](С2-6)алкенил или C1-6алкилбензотиазолил.
6. Соединение по п.4, в котором
R1 представляет имидазолил(C1-6)алкил, и
R2 представляет нафтил, имеющий С1-6алкокси и галоген.
7. Способ получения соединения формулы
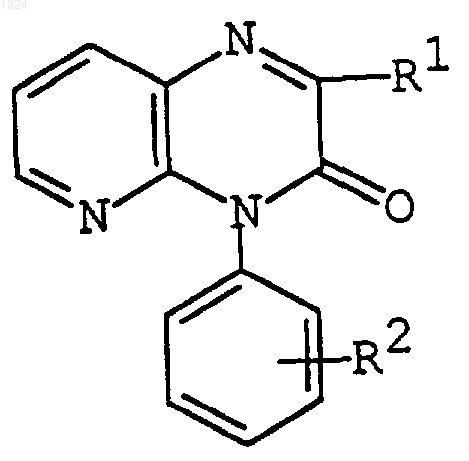
где R1 и R2 каждый, как определено в п.1,
или его соль, который содержит
(1) взаимодействие соединения формулы
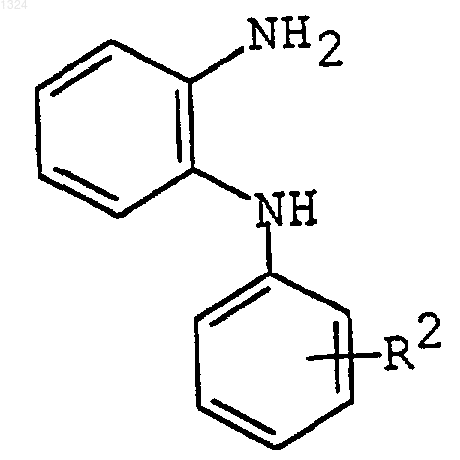
где R2 имеет значения, приведенные выше, или его соли с соединением формулы
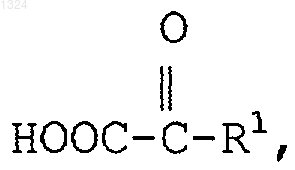
где R1 имеет значения, указанные выше, или его солью с получением соединения формулы

где R1 и R2 каждый имеет значения, указанные выше, или его соли, или
(2) ацилирование соединения формулы
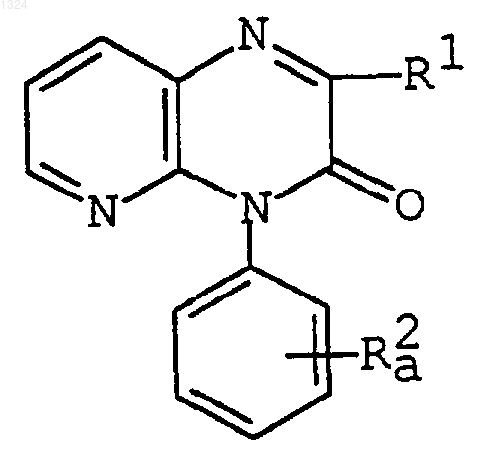
где R1 имеет значения, указанные выше, и
R2a представляет [аминопиридил](С2-6)алкенил или его реакционноспособное производное у аминогруппы,
или его соли с получением соединения формулы
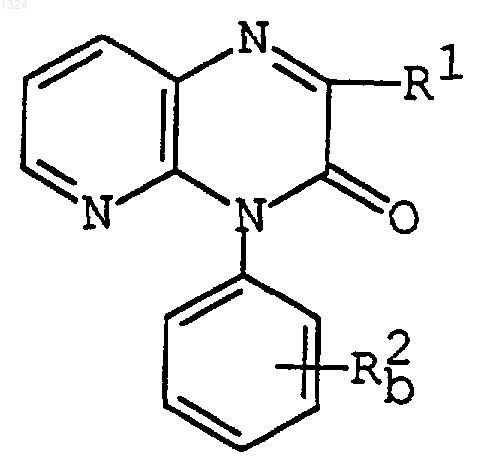
где R1 имеет значения, указанные выше, и
R2b представляет [ациламинопиридил](C2-6)алкенил, или его соли, или
(3) деацилирование соединения формулы
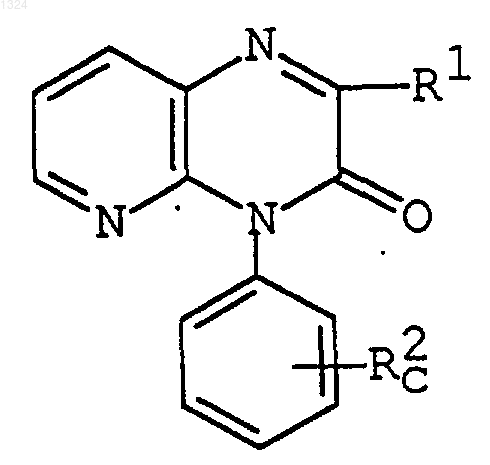
где R1 имеет значения, указанные выше,
R2c представляет [C1-6алканоиламино]фенил,
[[[галоидфенил](С2-6)алкеноил]амино]фенил,
[[пиридил(C2-6)алкеноил]амино]фенил,
[[[N-оксидопиридил](С2-6)алкеноил]амино]фенил,
[[[защищенный аминопиридил](С2-6)алкеноил]амино]фенил,
[тиазолилкарбониламино]фенил, который может иметь пиридил, или
[ациламинопиридил](С2-6)алкенил,
или его соли с получением соединения формулы
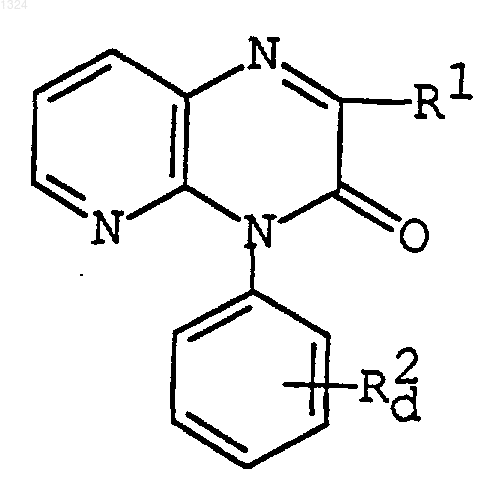
где R1 имеет значения, указанные выше, и
R2d представляет аминофенил или [аминопиридил](С2-6)алкенил,
или его соли, или
(4) взаимодействие соединения формулы
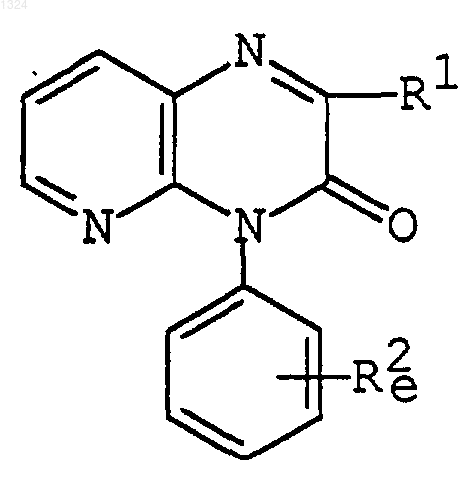
где R1 имеет значения, указанные выше, и
R2e представляет аминофенил,
или его реакционноспособного производного у аминогруппы, или его соли с соединением формулы
R3-OH,
где R3 представляет C1-6алканоил, [галоидфенил](C2-6)алкеноил, пиридил(С2-6)алкеноил, [ N-оксидопиридил](C2-6)алкеноил, [защищенный аминопиридил](C2-6)алкеноил или тиазолилкарбонил, который может иметь пиридил,
или его реакционноспособным производным у карбоксильной группы, или его солью с получением соединения формулы
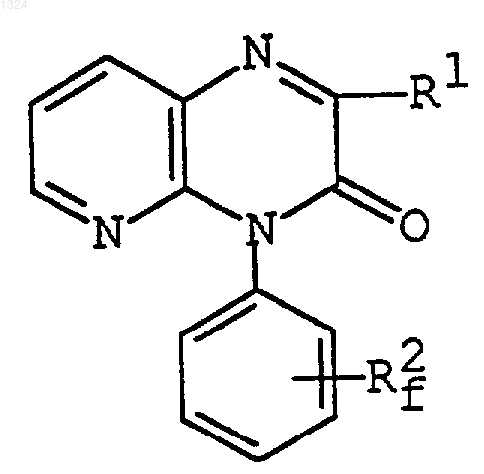
где R1 имеет значения, указанные выше,
R2f представляет [[ C1-6алканоиламино]амино]фенил,
[[[галоидфенил](С2-6)алкеноил]амино]фенил,
[[пиридил(С2-6)алкеноил]амино]фенил,
[[[N-оксидопиридил](С2-6)алкеноил]амино]фенил,
[[[защищенный аминопиридил](C2-6)алкеноил]амино]фенил, или
[тиазолилкарбониламино]фенил, который может иметь пиридил, или
(5) удаление N-защитной группы у соединения формулы
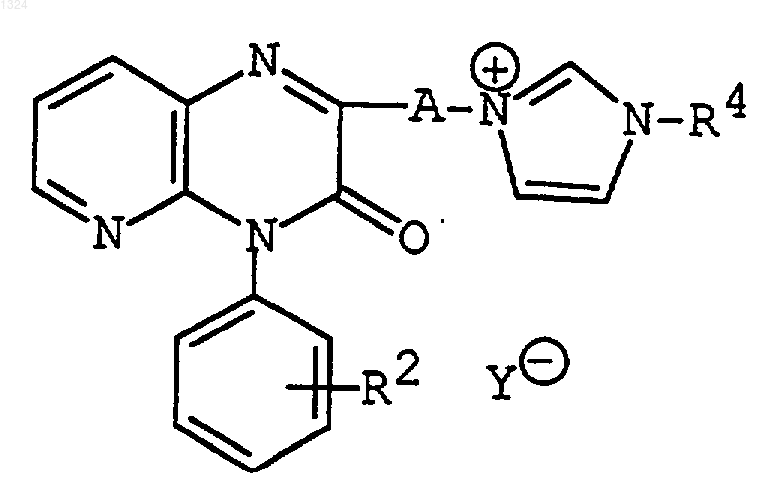
где R2 имеет значения, указанные выше,
R4 представляет N-защищенную группу,
А представляет C1-6алкилен и
Y- является галогенидом,
или его соли с получением соединения формулы
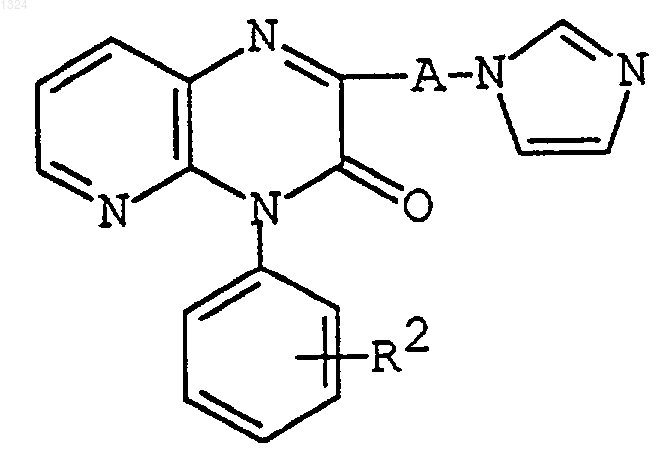
где R2 и А имеют значения, указанные выше,
или его соли.
8. Фармацевтическая композиция, которая содержит в качестве активного ингредиента соединение по п.1 или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемыми носителями.
9. Применение соединения по п.1 или его фармацевтически приемлемой соли в качестве ингибитора образования фосфодиэстеразы IV (PDE-IV) и ингибитора образования фактора некроза опухоли (TNF).
10. Способ профилактики или терапевтического лечения переносимых фосфодиэстеразой IV (PDE-IV) или фактором некроза опухоли (TNF) заболеваний, который включает введение соединения по п.1 или его фармацевтически приемлемой соли человеку или животному.
11. Способ получения фармацевтической композиции, который включает смешивание соединения по п.1 или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем.
Текст
1 Область техники Изобретение относится к новым гетеробициклическим производным. Целью данного изобретения является создание новых и полезных производных пиридопиразина и его фармацевтически приемлемых солей, которые обладают сильной активностью ингибирования фосфодиэстеразы IV (PDE IV) и сильной ингибирующей активностью по отношению к образованию фактора некроза опухоли(TNF). Другой целью данного изобретения является создание способа получения производных пиридопиразина и его солей. Следующей целью данного изобретения является создание фармацевтической композиции, содержащей указанные производные пиридопиразина или его фармацевтически приемлемые соли. Еще одной целью изобретения является предложение применения указанных производных пиридопиразина или его фармацевтически приемлемых солей в качестве лечебного средства для профилактики и терапевтического лечения переносимых фосфодиэстеразой IV и фактором некроза опухоли заболеваний, как например, хронических воспалительных заболеваний,специфических аутоиммунных заболеваний,вызванных сепсисом повреждений органов и т.п. заболеваний человека и животных. Раскрытие изобретения Производные пиридопиразина, составляющие предмет данного изобретения, являются новыми и могут быть представлены следующей общей формулой (I)(низший)алкенил]пиридил](низший)алкенил,[пиридил(низший)алкенил]пиридил,низший алкилбензотиазолил или [галоидпиридилкарбонил]амино, при условии, что если R2 представляет 4-пиридил(низший)алкеноил]амино]фенил, аминофенил, [низший алканоиламино]фенил или [дигалоидфенил](низший)алкенил, то R1 обозначает N-оксидопиридил (низший)алкил или имидазолил(низший)алкил. Соединение (I), являющееся предметом данного изобретения, может быть получено следующими способами. Способ (1) или его соль Способ (2) где(низший)алкеноил]амино]фенил,защищенный аминопиридил](низший)алкеноил]амино] фенил, [тиазолилкарбониламино]фенил, который может иметь пиридил, нафтил, имеющий низший алкокси и галоген, [дигалоидфенил]R2 а обозначает [аминопиридил](низший) алкенил,R2b обозначает [ациламинопиридил](низший)алкенил,R2c обозначает [низший алканоиламино]фенил,галоидфенил](низший)алкеноил] амино]фенил,пиридил(низший)алкеноил] амино]фенил,N-оксидопиридил](низший) алкеноил]амино]фенил, защищенный аминопиридил](низший)алкеноил]амино]фенил, [тиазолилкарбониламино]фенил, который может иметь пиридил или [ациламинопиридил] (низший)алкенил,R2d обозначает аминофенил или [аминопиридил](низший)алкенил,R2e обозначает аминофенил,R2f обозначает [низший алканоиламино] фенил, галоидфенил](низший)алкеноил]амино]фенил, пиридил(низший)алкеноил]амино] фенил, N-оксидопиридил](низший)алкеноил] амино]фенил, защищенный аминопиридил](низший)алкеноил]амино]фенил или [тиазолил 5 карбониламино]фенил, который может иметь пиридил,R3 обозначает низший алканоил, [галоидфенил](низший)алкеноил,пиридил(низший) алкеноил,[N-оксидопиридил](низший)алкеноил, [защищенный аминопиридил](низший) алкеноил или тиазолилкарбонил, который может иметь пиридил,R4 обозначает N-защитную группу,Y представляет галоген,Y- представляет галогенид и А представляет низший алкилен. Исходное соединение (II) данного изобретения может быть получено следующими способами. Способ (А)R2, R2e, R2f и R3 имеют значения, указанные выше,R5 представляет низший алкил,R6 представляет защищенный аминофенил,R7 представляет аминофенил,R8 представляет дигалоидфенил, Nоксидопиридил, аминопиридил, защищенный аминопиридил, карбоксипиридил, защищенный карбоксипиридил, [пиридил(низший)алкенил] пиридил, [карбокси(низший)алкенил]пиридил или [защищенный карбокси(низший)алкенил] пиридил,R9 обозначает галоид(низший)алкил,X1, X2, X3, X4 и X5 каждый является удаляемой группой иQ проставляет низший алкенилен. Пригодными фармацевтически приемлемыми солями соединения (I) являются обычные не токсичные соли, и они могут включать соль с основанием или аддитивную соль кислоты, такую как соль с неорганическим основанием,например, соль щелочного металла (например,соль натрия, соль калия и т.д.), соль щелочноземельного металла (например, соль кальция,соль магния и т.д.), соль аммония; соль с органическим основанием, например, органическая соль амина (например, соль триэтиламина, соль пиридина, соль пиколина, соль этаноламина,соль триэтаноламина, соль дициклогексиламина, соль N,N'-дибензилэтилендиамина и т.д.); 10 аддитивную соль неорганической кислоты(например, гидрохлорид, гидробромид, сульфат,фосфат и т.д.); аддитивную соль органической карбоновой или сульфоновой кислоты (например, формиат, ацетат, трифторацетат, малеат, тартрат,фумарат, метансульфонат, бензолсульфонат,толуолсульфонат и т.д); соль с основной или кисло аминокислотой (например, аргинин, аспарагиновая кислота, глутаминовая кислота и т.д). Приведенные в предшествующей и последующей частях настоящего изобретения подходящие примеры и иллюстрации различных терминов, которые входят в объем настоящего изобретения, поясняются подробно ниже. Термин "низший" используется для обозначения группы, имеющей 1-6, предпочтительно, 1-4 атомов углерода, если не указано иначе. Термин "высший" используется для обозначения группы, имеющей 7-20 атомов углерода, если не указано иначе. Подходящие "низший алкил" и "низшая алкильная часть" в терминах "пиридил(низший) алкил","N-оксидопиридил(низший)алкил","имидазолил(низший)алкил", "низший алкилбензотиазолил" и "галоид(низший)алкил" могут быть линейными или разветвленными с 1-6 атомами углерода, такими как метил, этил, пропил,изо-пропил, бутил, изобутил, втор-бутил, третбутил, пентил, трет-пентил, гексил и т.п., из которых более предпочтительным примером может быть C1-C4 алкил и наиболее предпочтительным метил. Подходящие "низший алкенил" и "низшая алкенильная часть" в терминах "[дигалоидфенил](низший)алкенил","[N-оксидопиридил](низший)алкенил", "[защищенный карбоксипиридил](низший)алкенил","пиридил(низший) алкенил]пиридил](низший)алкенил", "карбокси(низший)алкенил]пиридил](низший)алкенил","защищенный карбокси(низший)алкенил] пиридил](низший)алкенил" и "[пиридил(низший) алкенил]пиридил" могут включать винил, 1(или 2-)пропенил, 1-(или 2-, или 3-)бутенил, 1(или 2-, или 3-, или 4-)пентенил, 1-(или 2-, или 3-, или 4-, или 5-)гексенил, метилвинил, этилвинил, 1-(или 2-, или 3-)метил-1-(или 2-)пропенил,1-(или 2-, или 3-)этил-1-(или 2-)пропенил, 1(или 2-, или 3-, или 4-) метил-1-(или 2-, или 3-) бутенил и т.п., из которых более предпочтительным примером может быть C2-C4 алкенил и наиболее предпочтительным винил. Подходящий "низший алкинил" может включать этинил, 1-пропинил, пропаргил, 1 метилпропаргил, 1 или 2, или 3-бутинил, 1 или 2, или 3, или 4-пентинил, 1 или 2, или 3, или 4,или 5-гексинил и т.п. Подходящий "низший алкокси" может включать метокси, этокси, пропокси, изопро 11 покси, бутокси, изобутокси, трет-бутокси, пентилокси, трет-пентилокси, гексилокси и т.п. Подходящий "низший алкилен" может включать линейный или разветвленный алкилен, такой как метилен, этилен, триметилен,тетраметилен, пентаметилен, гексаметилен, метилметилен, этилэтилен, пропилен и т.п., из которых более предпочтительным примером может быть C1-C4 алкилен и наиболее предпочтительным метилен. Подходящий "низший алкенилен" может включать линейный или разветвленный алкенилен с 2-6 атомами углерода, такой как винилен,пропенилен, 1-(или 2-)бутенилен, 1-(или 2-, или 3-)пентенилен, 1-(или 2-, или 3-)гексенилен,метилвинилен, этилвинилен, 1-(или 1-, или 3-) метилпропенилен, 1-(или 2-, или 3-) этилпропенилен, 1-(или 2-, или 3-, или 4-)метил-1-(или 2-) бутенилен и т.п. Подходящий "цикло(низший)алкил" может включать циклопентил, циклогексил и т.п. Подходящий"[галоидпиридилкарбонил]амино" могут включать фтор, бром, хлор и иод. Подходящая "удаляемая группа" может включать кислотный остаток, низший алкокси,определенный выше, и т.п. Подходящий "кислотный остаток" может включать галоген, определенный выше, ацилокси и т.п. Подходящий "галогенид" может включать фторид, бромид, хлорид и т.п. Подходящие "защищенный карбокси" и"[защищенный карбоксипиридил](низший) алкенил и защищенный карбокси(низший) алкенил]пиридил](низший)алкенил" могут включать сложноэтерифицированный карбокси и т.п. Подходящим примером указанного сложного эфира может быть, такой как сложный низший алкиловый эфир (например, сложный метиловый эфир, сложный этиловый эфир, сложный пропиловый эфир, сложный изопропиловый эфир, сложный бутиловый эфир, сложный изобутиловый эфир, сложный трет-бутиловый эфир, сложный пентиловый эфир, сложный трет-пентиловый эфир, сложный гексиловый эфир и т.д); сложный низший алкениловый эфир(например, сложный виниловый эфир, сложный аллиловый эфир и т.д.) ; сложный низший алкиниловый эфир (например, сложный этиниловый эфир, сложный пропиниловый эфир и т.д.); сложный низший алкокси(низший)алкиловый эфир (например, 001324 12 сложный метоксиметиловый эфир, сложный этоксиметиловый эфир,сложный изопропоксиметиловый эфир, сложный 1-метоксиэтиловый эфир, сложный 1-этоксиэтиловый эфир и т.д.); сложный низший алкилтио(низший) алкиловый эфир (например, сложный метилтиометиловый эфир, сложный этилтиометиловый эфир, сложный этилтиоэтиловый эфир, сложный изопропокситиометиловый эфир и т.д.); сложный моно(или ди, или три)галоид(низший)алкиловый эфир (например, сложный мезилметиловый эфир,сложный 2 мезилэтиловый эфир и т.д.) ; сложный низший алкоксикарбонилокси(низший)алкиловый эфир (например, сложный метоксикарбонилоксиметиловый эфир,сложный этоксикарбонилоксиметиловый эфир,сложный пропоксикарбонилоксиметиловый эфир, сложный трет-бутоксикарбонилоксиметиловый эфир, сложный 1-(или 2-)метоксикарбонилоксиэтиловый эфир, сложный 1-(или 2-) этоксикарбонилоксиэтиловый эфир, сложный 1(или 2-)изопропоксикарбонилоксиэтиловый эфир и т.д.); сложный фталидилиден(низший)алкиловый эфир; сложный (5-низший алкил-2-оксо-1,3 диоксол-4-ил)(низший)алкиловый эфир [например, сложный (5-метил-2-оксо-1,3-диоксол-4 ил)метиловый эфир, сложный (5-этил-2-оксо 1,3-диоксол-4-ил)метиловый эфир, сложный (5 пропил-2-оксо-1,3-диоксол-4-ил)этиловый эфир и т.д.]; сложный моно(или ди, или три) алкил(низший)алкиловый эфир, например, сложный моно(или ди, или три)фенил (низ 13 ший)алкиловый эфир, который может иметь один или несколько подходящих заместителей(например, сложный бензиловый эфир, сложный 4-метоксибензиловый эфир, сложный 4 нитробензиловый эфир, сложный фенетиловый эфир, сложный тритиловый эфир, сложный бензгидриловый эфир, сложный бис(метоксифенил)метиловый эфир, сложный 3,4 диметоксибензиловый эфир, сложный 4 гидрокси-3,5-ди-трет-бутилбензиловый эфир и т.д.); сложный ариловый эфир, который может иметь один или несколько подходящих заместителей, такой как замещенный или незамещенный сложный фениловый эфир (например,сложный фениловый эфир, сложный толиловый эфир, сложный трет-бутилфениловый эфир,сложный ксилиловый эфир, сложный мезитиловый эфир, сложный кумениловый эфир, сложный 4-хлорфениловый эфир, сложный 4 метоксифениловый эфир и т.д); сложный три(низший)алкилсилиловый эфир; сложный низший алкил-тиоэфир (например, сложный метилтиоэфир, сложный этилтиоэфир и т.д.) и т.п., из которых более предпочтительным примером может быть C1-C4 алкоксикарбонил и наиболее предпочтительным метоксикарбонил. Подходящая "гидрокси защитная группа" в термине "защищенный гидрокси" может включать ацил, моно(или ди, или три)фенил (низший)алкил, который может иметь один или более подходящих заместителей (например, бензил, 4-метоксибензил, тритил и т.д.), тризамещенный силил [например, три(низший) алкилсилил(например,триметилсилил,третбутилдиметилсилил и т.д.) и т.д.], тетрагидропиранил и т.п. Подходящая "N-защитная группа" может включать ацил или обычную защитную группу,такую как моно(или ди, или три)арил(низший) алкил, например, моно(или ди, или три)фенил"защищенная аминная часть" в терминах "[защищенный амино]фенил", "защищенный аминопиридил](низший)алкеноил]амино] фенил" и "[защищенный аминопиридил](низший) алкенил" могут включать ациламино или аминогруппу, замещенную обычной защитной группой, такой как моно(или ди, или три)арил(низший)алкил, например, моно(или ди, или три)фенил(низший)алкил (например, бензил,тритил и т.д.) или т.п. Подходящие "ацил" и "ацильная часть" в терминах "ациламино" и "ацилокси" могут включать карбамоил, тиокарбамоил, алифатическую ацильную группу или ацильную группу,содержащую ароматическое кольцо, которая определена как ароматический ацил, или гете 001324 14 роциклическое кольцо, которая определена как гетероциклический ацил. Подходящий пример указанного ацила может быть проиллюстрирован следующим образом: карбамоил; тиокарбамоил; алифатический ацил, такой как низший или высший алканоил (например, формил, ацетил, пропаноил, бутаноил, 2-метил-пропаноил,пентаноил, 2,2-диметилпропаноил, гексаноил,гептаноил, октаноил, нонаноил, деканоил, ундеканоил, додеканоил, тридеканоил, тетрадеканоил, пентадеканоил, гексадеканоил, гептадеканоил, октадеканоил, нонадеканоил, икозаноил и т.д.); низший или высший алкеноил (например,акрилоил, 2-(или 3-)бу-теноил, 2-(или 3-, или 4-) пентеноил, 2-(или 3-, или 4-, или 5-)гексеноил и т.д.); низший или высший алкоксикарбонил (например, метоксикарбонил, этоксикарбонил,изопропоксикарбонил, трет-бутоксикарбонил,трет-пентилоксикарбонил, гептилоксикарбонил и т.д.); низший или высший алкилсульфонил (например, метилсульфонил, этилсульфонил и т.д.); низший или высший алкоксисульфонил(например, циклопентилоксикарбонил, циклогексилоксикарбонил и т.д.); низший алкилглиоксилоил (например, метилглиоксилоил, этилглиоксилоил, пропилглиоксилоил и т.д.); низший алкоксиглиоксилоил (например,метоксиглиоксилоил, этоксиглиоксилоил, пропоксиглиоксилоил и т.д.); или т.п.; ароматический ацил, такой как ароил (например, бензоил, толуоил, нафтоил и т.д.); ар(низший)алканоил [например, фенил(например,феноксиацетил, феноксипропионил и т.д.); арилглиоксилоил (например, фенилглиоксилоил, нафтилглиоксилоил и т.д.); арилсульфонил (например, фенилсульфонил, п-толилсульфонил и т.д.); ар(низший) алкилсульфонил [например, фенил(низший) алкилсульфонил (например, бензилсульфонил,фенилэтилсульфонил и т.д.), нафтил(низший) алкилсульфонил (например, нафтилметилсульфонил, нафтилэтилсульфонил и т.д.) и т.д.]; и т.п.; Гетероциклический ацил, такой как гетероциклический карбонил; гетероциклический(низший)алканоил (например, гетероциклический ацетил, гетероциклический пропаноил, гетероциклический бутаноил, гетероциклический пентаноил, гетероциклический гексаноил и т.д.); гетероциклический(низший)алкеноил (например, гетероциклический пропеноил, гетероциклический бутеноил, гетероциклический пентеноил, гетероциклический гексеноил и т.д.); гетероциклический глиоксилоил; гетероциклический оксикарбонил; или т.п.,в которых "гетероциклическая часть" в терминах "гетероциклический карбонил", "гетероциклический(низший)алканоил", "гетероциклический(низший)алкеноил","гетероциклический оксикарбонил" и "гетероциклический глиоксилоил", как более детально указывалось выше,обозначают насыщенную или ненасыщенную,моноциклическую или полициклическую гетероциклическую группу, содержащую, по меньшей мере, один гетероатом, такой как атом кислорода, серы, азота и т.п. И особенно предпочтительной гетероциклической группой может быть гетероциклическая группа, такая как ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-4 атома азота,такая как пирролил, пирролинил, имидазолил,пиразолил, пиридил, дигидропиридил, пиримидинил, пиразинил, пиридазинил, триазолил (например, 1 Н-1,2,4-триазолил, 4 Н-1,2,4-триазолил,-1 Н-1,2,3-триазолил, 2 Н-1,2,3-триазолил и т.д.), тетразолил (например, 1H-тетразолил, 2 Нтетразолил и т.д.) и т.д.; насыщенная 3-8 членная (более предпочтительно, 5- или 6-членная) гетеромоноциклическая группа, содержащая 1-4 атома азота, например, пирролидинил, имидазолидинил, пиперидил, пиперазинил и т.д.; 16 ненасыщенная конденсированная гетероциклическая группа, содержащая 1-4 атома азота, такая как индолил, изоиндолил, индолинил,индолизинил, бензимидазолил, хинолил, тетрагидрохинолил (например, 1,2,3,4-тетрагидрохинолил, и т.д.), изохинолил, индазолил, бензотриазолил, бензопиримидинил (например,бензо[b]пиримидинил и т.д.) и т.д.; ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, такая как оксазолил,изоксазолил, оксадиазолил (например, 1,2,4 оксадиазолил, 1,3,4-оксадиазолил, 1,2,5-оксадиазолил и т.д.), и т.д.; насыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например, морфолинил, сиднонил и т.д.; ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода и 1-3 атома азота, например, бензоксазолил, бензоксадиазолил и т.д.; ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота, такая как тиазолил, изотиазолил, тиадиазолил (например, 1,2,3-тиадиазолил,1,2,4-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5 тиадиазолил и т.д.), дигидротиазинил и т.д.; насыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота, например, тиазолидинил и т.д.; ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1-2 атома серы,например, тиенил, дигидродитиинил, дигидродитионил и т.д.; ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома серы и 1-3 атома азота, например, бензотиазолил,бензотиадиазолил и т.д.; ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1 атом кислорода,например, фурил и т.д.; ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома кислорода, такая как бензодиоксолил(например, метилендиоксифенил и т.д.),бензофурил и т.д.; ненасыщенная 3-8-членная (более предпочтительно, 5 или 6-членная) гетеромоноциклическая группа, содержащая 1 атом кислорода и 1-2 атома серы, например, дигидрооксатиинил и т.д.; ненасыщенная конденсированная гетероциклическая группа, содержащая 1-2 атома се 17 ры, такая как бензотиенил (например, бензо[b]тиенил и т.д.); бензодитиинил и т.д.; ненасыщенная конденсированная гетероциклическая группа, содержащая 1 атом кислорода и 1-2 атома серы, например, бензоксатиинил и т.д.; и т.п. Как указано выше, ацильная часть может содержать от 1 до 10, одинаковых или различных подходящих заместителей, таких как низший алкил, определенный выше, низший алкокси, определенный выше, низший алкилтио, в котором часть низшего алкила определена выше, цикло(низший)алкил, определенный выше,цикло(низший)алкенил, определенный выше,цикло(низший)алкилокси, в котором цикло(низший)алкильная часть определена выше,галоген, определенный выше, амино, защищенный амино, определенные выше, гидрокси, защищенный гидрокси, определенные выше, циано, нитро, карбокси, защищенный карбокси,определенные выше, сульфо, сульфамоил, имино, оксо, амино(низший)алкил, где часть низшего алкила определена выше, карбамоилокси,моно(или ди, или три)галоид(низший)алкил, где галогенная часть и часть низшего алкила определены выше, гидрокси(низший)алкил, где часть низшего алкила определена выше, гетероциклическая группа, определенная выше, гетероциклический окси, где гетероциклическая часть определена выше, гетероциклический амино, который может иметь нитро, где гетероциклическая часть определена выше, арил, который может иметь подходящие заместители,где арильная часть определена выше, арилсульфонил, где арильная часть определена выше,ар(низший) алкил, где арильная часть и часть низшего алкила определены выше, защищенный карбокси(низший)алкенил, где часть защищенного карбокси и часть низшего алкенила определены выше, ацил, определенный выше, ациламино, где ацильная часть определена выше,или т.п. Предпочтительно, чтобы определенный таким образом ацил был алифатическим ацилом, таким как низший алканоил (например,ацетил и т.д.) и наиболее предпочтительно, ацетилом. Подходящая "часть низшего алканоила" в термине "[низший алканоиламино]фенил" определена выше. Подходящая "часть низшего алкеноила" в терминах "галоидфенил](низший)алкеноил] амино]фенил","пиридил(низший)алкеноил] амино]фенил", "N-оксидопиридил](низший) алкеноил]амино]фенил" и "защищенный аминопиридил](низший)алкеноил]амино]фенил" соответствует приведенным выше определениям. Способы получения соединений по изобретению и исходных соединений поясняются подробнее ниже. Способ (1). 18 Соединение (I) или его соль может быть получено взаимодействием соединения (II) или его соли с соединением (III) или его солью. Это взаимодействие осуществляют в растворителе, таком как вода, спирт (например,метанол, этанол и т.д.), бензол, N,Nдиметилформамид, тетрагидрофуран, толуол,метиленхлорид, этилендихлорид, хлороформ,диэтиловый эфир или другой растворитель, который не оказывает отрицательного влияния на ход реакции. Температура реакции не является критической, и реакцию обычно проводят от подогрева до нагревания. Способ (2). Соединение (Ib) или его соль может быть получено реакцией ацилирования соединения(Iа) или его реакционноспособного производного у аминогруппы или его соли. Подходящий ацилирующий агент, который можно использовать в данной реакции ацилирования, может включать соединение формулы(где R является ацилом) или его реакционноспособное производное или его соль. Подходящее реакционноспособное производное соединения (Iа) у аминогруппы может включать основания Шиффа имино типа или его изомер типа таутомерного энамина, полученное путем взаимодействия соединения (Iа) с карбонильным соединением, таким как альдегид, кетон или т.п.; силильное производное, полученное взаимодействием соединения (Iа) с силильным соединением, таким как N,O-бис (триметилсилил)ацетамид, N-триметилсилил-ацетамид или т.п.; производное, полученное взаимодействием соединения (Iа) с трихлоридом фосфора или фосгеном или т.п. Подходящее реакционноспособное производное соединения (XXV) может включать ангидрид кислоты, активированный сложный эфир, изоцианат и т.п. Подходящим примером может быть хлорангидрид кислоты, азид кислоты, смешанный ангидрид кислоты с кислотой,такой как замещенная фосфорная кислота (например, диалкилфосфорная кислота, фенилфосфорная кислота, дифенилфосфорная кислота,дибензилфосфорная кислота, галогенированная фосфорная кислота и т.д.), диалкилфосфористая кислота, сернистая кислота, тиосерная кислота,алкансерная кислота (например, метансульфокислота, этансульфокислота и т.д.), серная кислота, алкилугольная кислота, алифатическая карбоновая кислота (например, пиваловая кислота, пентановая кислота, изопентановая кислота, 2-этилмасляная кислота, трихлоруксусная кислота и т.д.); ароматическая карбоновая кислота (например, бензойная кислота и т.д.); симметричный ангидрид кислоты; 19 амид, активированный имидазолом, 4 замещенным имидазолом, диметилпиразолом,триазолом или тетразолом; активированный сложный эфир (например, сложный цианометиловый эфир, сложный метоксиметиловый эфир,сложный диметилиминометиловый [(СН 3)2N+=CH-] эфир, сложный виниловый эфир, сложный пропаргиловый эфир, сложный п-нитрофениловый эфир, сложный 2,4-динитрофениловый эфир, сложный трихлорфениловый эфир, сложный пентахлорфениловый эфир, сложный мезилфениловый эфир, сложный фенилазофениловый эфир, сложный фенилтиоэфир, сложный п-нитрофениловый тиоэфир, сложный пкрезиловый тиоэфир, сложный карбоксиметиловый тиоэфир, сложный пираниловый эфир,сложный пиридиловый эфир, сложный пиперидиловый эфир, сложный 8-хинолиловый тиоэфир и т.д.); сложный эфир N-гидроксильного соединения (например, N,N-диметилгидроксиламин, 1 гидрокси-2-(1 Н)-пиридон, N-гидроксисукцинимид, N-гидроксибензотриазол, N-гидроксифталимид, 1-гидрокси-6-хлор-1H-бензотриазол и т.д.); замещенный или незамещенный арилизоцианат; замещенный или незамещенный арилизотиоцианат и т.п. Эти реакционноспособные производные могут быть выбраны в соответствии с видом используемого соединения (XXV). Взаимодействие осуществляют в общепринятом растворителе, таком как вода, ацетон,диоксан, ацетонитрил, хлороформ, метиленхлорид, этиленхлорид, тетрагидрофуран,этилацетат, N,N-диметилформамид, пиридин или другой органический растворитель, который не оказывает отрицательного влияния на ход реакции. Эти обычные растворители можно использовать также в смеси с водой. Когда соединение (XXV) используют в виде свободной кислоты или его соли, реакцию проводят, предпочтительно, в присутствии обычного конденсирующего агента, такого какN,N-карбонил-бис(2-метилимидазол); пентаметиленкетен-N-циклогексилимин; дифенилкетен-N-циклогексилимин; этоксиацетилен; 1-алкокси-1-хлорэтилен; триалкилфосфит; изопропилполифосфат; оксихлорид фосфора (фосфорилхлорид); трихлорид фосфора; тионилхлорид; оксалилхлорид; трифенилфосфит; соль 2-этил-7 гидроксибензизоксазолия; гидроксидная межмолекулярная соль 2-этил-5-(м-сульфофенил) изоксазолия; 1-(п-хлор-бензолсульфонилокси)6-хлор-1 Н-бензотриазол; так называемый реа 001324 20 гент Вилсмайера, получаемый реакцией N,Nдиметилформамида с тионилхлоридом, фосгеном, оксихлоридом фосфора и т.д.; или т.п. Взаимодействие можно проводить также в присутствии органического или неорганического основания, такого как бикарбонат щелочного металла, три(низший)алкиламин, пиридин, N(низший)алкилморфорин, N,N-ди(низший) алкилбензиламин или т.п. Температура реакции не является критической и реакцию обычно проводят от охлаждения до нагревания. Способ (3). Соединение (Id) или его соль может быть получено реакцией деацилирования соединения(Iс) или его соли. Подходящим для этой реакции деацилирования может быть обычный способ, такой как гидролиз, восстановление и т.п.(i) Для гидролиза. Гидролиз проводят, предпочтительно, в присутствии основания или кислоты, включая кислоту Льюиса. Подходящее основание может включать неорганическое основание и органическое основание, такое как щелочной металл (например,натрий, калий и т.д.), щелочно-земельный металл (например, магния, кальций и т.д.), их гидроксид или карбонат, или гидрокарбонат, триалкиламин (например, триметиламин, триэтиламин и т.д.), пиколин, 1,5-диазабицикло[4.3.0]нон-5-ен или т.п. Подходящая кислота может включать органическую кислоту (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифторуксусная кислота и т.д.) и неорганическую кислоту (например, соляная кислота, бромистоводородная кислота, серная кислота, хлороводород, бромоводород и т.д.). Удаление (отщепление) с использованием кислоты Льюиса, такой как тригалоидуксусная кислота (например, трихлоруксусная кислота,трифторуксусная кислота и т.д.), или т.п. проводят, предпочтительно, в присутствии улавливающих катионы агентов (например, анизол,фенол и т.д.). Реакцию обычно осуществляют в общепринятом растворителе, таком как вода, спирт(например, метанол, этанол, изопропиловый спирт и т.д.), тетрагидрофуран, диоксан, толуол,метиленхлорид, этилендихлорид, хлороформ,N,N-диметилформамид, N,N-диметилацетамид или другие органические растворители, которые не оказывают отрицательного воздействия на ход реакции, или их смеси. Температура реакции не является критической, и реакцию обычно проводят от охлаждения до нагревания. 21 Восстановление проводят обычным образом, включая химическое восстановление и каталитическое восстановление. Подходящим восстанавливающим реагентом для использования в химическом восстановлении являются гидриды (например, иодид водорода, сероводород, литийалюминий гидрид,боргидрид натрия, цианборгидрид натрия и т.д.) или комбинация металла (например, олово,цинк, железо и т.д.) или соединения металла(например, хлорид хрома, ацетат хрома и т.д.) и органической кислоты или неорганической кислоты (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трифторуксусная кислота, п-толуолсульфокислота, соляная кислота, бромистоводородная кислота и т.д.). Подходящими катализаторами для использования в каталитических реакциях являются обычные катализаторы, такие как платиновые катализаторы (например, платиновая пластина,пористая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.д.), палладиевые катализаторы (например, пористый палладий, палладиевая чернь,оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.д.), никелевые катализаторы (например, восстановленный никель,оксид никеля, никель Ренея и т.д.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т.д.), железные катализаторы (например, восстановленное железо, железо Ренея, железо Ульмана и т.д.) и т.п. Восстановление обычно осуществляют в общепринятом растворителе, таком как вода,спирт (например, метанол, этанол, изопропиловый спирт и т.д.), тетрагидрофуран, диоксан,толуол, метиленхлорид, этилендихлорид, хлороформ,N,N-диметилформамид,N,Nдиметилацетамид или другие органические растворители, которые не оказывают отрицательного воздействия на ход реакции, или их смеси. Кроме того, если указанные выше кислоты, используемые в химическом восстановлении, являются жидкостями, их можно использовать в качестве растворителя. Температура реакции при таком восстановлении не является критической и реакцию обычно проводят от охлаждения до нагревания. Способ (4). Соединение (If) или его соль может быть получено путем взаимодействия соединения (Iе) или его реакционноспособного производного у аминогруппы или его соли с соединением (IV) или его реакционноспособным производным у карбоксильной группы или его солью. Это взаимодействие можно проводить аналогично приведенному выше способу 2, и поэтому условия реакции (например, растворитель, температура реакции) соответствуют условиям реакции способа 2. 22 Способ (5)-1. Соединение (VII) или его соль может быть получено путем взаимодействия соединения(Va) или его соли с соединением (VI) или его солью. Обычно это взаимодействие осуществляют в общепринятом растворителе, таком как вода,спирт (например, метанол, этанол и т.д.), бензол, N,N-диметилформамид, тетрагидрофуран,толуол, метиленхлорид, этилендихлорид, хлороформ, диоксан, диэтиловый эфир или другие растворители, которые не оказывают отрицательного воздействия на ход реакции, или их смеси. Температура реакции не является критической и реакцию обычно проводят от охлаждения до нагревания. Обычно реакцию проводят в присутствии кислоты, включая кислоту Льюиса. Подходящая кислота может включать органическую кислоту (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трихлоруксусная кислота, трифторуксусная кислота и т.д.) и неорганическую кислоту [например, соляная кислота, бромистоводородная кислота, серная кислота, хлороводород, бромоводород, галогенид цинка (например, хлорид цинка, бромид цинка и т.д.), и т.д.] и т.п. Реакцию можно также осуществлять в присутствии неорганического или органического основания, такого как щелочной металл (например, натрия, калий и т.д.), гидроксид щелочного металла (например, гидроксид натрия, гидроксид калия и т.д.), гидрокарбонат щелочного металла (например, гидрокарбонат натрия, гидрокарбонат калия и т.д.), карбонат щелочного металла (например, карбонат натрия, карбонат калия и т.д.), три(низший)алкиламин (например,триметиламин,триэтиламин,диизопропилэтиламин и т.д.), гидрид щелочного металла (например, гидрид натрия и т.д.), (низший)алкоксид щелочного металла (например,метоксид натрия, этоксид натрия и т.д.), пиридин, лутидин, пиколин, диметиламинопиридин,N-(низший)алкилморфолин,N,N-ди(низший) алкилбензиламин, N,N-ди(низший)алкиланилин и т.п. Когда основание, кислота и/или исходное соединение представляют собой жидкость, они могут быть использованы также и в качестве растворителя. Способ (5)-2). Соединение (Ig) или его соль может быть получено путем удаления N-защитной группы соединения (VII) или его соли. Эту реакцию можно проводить аналогично реакции приведенного выше способа (3), и поэтому используемые реагенты и условия реакции (например, растворитель, температура реакции) соответствуют реагентам и условиям реакции способа (3). 23 Способ (А). Соединение (X) или его соль может быть получено взаимодействием соединения (VIII) или его соли с соединением (IX) или его солью. Обычно это взаимодействие осуществляют в растворителе, таком как вода, спирт (например, метанол, этанол и т.д.), бензол, N,Nдиметилформамид, тетрагидрофуран, толуол,метиленхлорид, этилендихлорид, хлороформ,диэтиловый эфир или другие растворители, которые не оказывают отрицательного воздействия на ход реакции. Температура реакции не является критической и взаимодействие обычно осуществляют от подогрева до нагревания. Если исходное соединение является жидкостью, то его можно использовать в качестве растворителя. Способ (В). Соединение (II) или его соль может быть получено восстановлением соединения (X) или его соли. Восстановление проводят обычным образом, включая химическое восстановление и каталитическое восстановление. Подходящим восстанавливающим реагентом для использования в химическом восстановлении являются гидриды (например, иодоводород, сероводород, литийалюминий гидрид,боргидрид натрия, цианборгидрид натрия и т.д.) или комбинация металла (например, олово,цинк, железо и т.д.) или соединения металла(например, хлорид хрома, ацетат хрома и т.д.) и органической кислоты или неорганической кислоты (например, муравьиная кислота, уксусная кислота, пропионовая кислота, трифторуксусная кислота, п-толуолсульфокислота, соляная кислота, бромистоводородная кислота и т.д.). Подходящими катализаторами для использования в каталитических реакциях являются обычные катализаторы, такие как платиновые катализаторы (например, платиновая пластина,пористая платина, платиновая чернь, коллоидная платина, оксид платины, платиновая проволока и т.д.), палладиевые катализаторы (например, пористый палладий, палладиевая чернь,оксид палладия, палладий на угле, коллоидный палладий, палладий на сульфате бария, палладий на карбонате бария и т.д.), никелевые катализаторы (например, восстановленный никель,оксид никеля, никель Ренея и т.д.), кобальтовые катализаторы (например, восстановленный кобальт, кобальт Ренея и т.д.), железные катализаторы (например, восстановленное железо, железо Ренея, и т.д.), медные катализаторы (например, восстановленная медь, медь Ренея, медь Ульмана и т.д.) и т.п. Обычно восстановление проводят в общепринятом растворителе, который не оказывает отрицательного воздействия на ход реакции,таком как вода, спирт (например, метанол, эта 001324 24 нол, пропанол и т.д.), тетрагидрофуран, диоксан, N,N-диметилформамид, или их смеси. Температура реакции при таком восстановлении не является критической и реакцию обычно проводят от охлаждения до нагревания. Способ (С). Соединение (XI) или его соль может быть получено взаимодействием соединения (II) или его соли с соединением (XXIV) или его солью. Это взаимодействие можно проводить аналогично приведенному выше способу (1), и поэтому используемые реагенты и условия реакции (например, растворитель, температура реакции) соответствуют реагентам и условиям реакции способа (1). Способ (D). Соединение (IX) или его соль может быть получено восстановлением соединения (XII) или его соли. Эту реакцию можно проводить аналогично приведенному выше способу (В), и поэтому используемые реагенты и условия реакции (например, растворитель, температура реакции) соответствуют реагентам и условиям реакции способа (В). Способ (Е). Соединение (IIа) или его соль может быть получено реакцией удаления амино-защитной группы соединения (XIII) или его соли. Эту реакцию можно проводить способом,раскрытым в Получении 5 или 6, или аналогичным образом. Способ (F). Соединение (Хb) или его соль может быть получено взаимодействием соединения (Ха) или его реакционноспособного производного у аминогруппы или его соли с соединением (IV) или его реакционноспособным производным у карбоксильной группы или с его солью. Эту реакцию можно проводить способом,раскрытым в получении 16, или аналогичным образом. Способ (G). Соединение (ХIIа) или его соль может быть получено взаимодействием соединения(XIV) с соединением (XV) или его солью. Эту реакцию можно проводить способом,раскрытым в получении 1, или аналогичным образом. Способ (Н). Соединение (IX) или его соль может быть получено взаимодействием соединения (XVII) или его соли с соединением (XVIII) или его солью. Эту реакцию можно проводить способом,раскрытым в получении 3, или аналогичным образом. Способ (I). Соединение (Хс) или его соль может быть получено взаимодействием соединения (XIX) или его соли с соединением (XX). 25 Эту реакцию можно проводить способом,раскрытым в получении 10, или аналогичным образом. Способ (J). Соединение (V) или его соль может быть получено реакцией галогенирования соединения(XI) или его соли. Эту реакцию можно проводить способом,раскрытым в получении 25, или аналогичным образом. Способ (К). Соединение (XXIIа) или его соль может быть получено взаимодействием соединения(XIV) с соединением (XXI) или его солью. Эту реакцию можно проводить способом,раскрытым в получении 2, или аналогичным образом. Способ (L). Соединение (XIIb) или его соль может быть получено взаимодействием соединения(XXII) или его соли с соединением (XXIII) или его солью. Эту реакцию можно проводить способом,раскрытым в получении 12, или аналогичным образом. В качестве солей соединений по изобретению или исходных соединений в способах (1)(5) и (A)-(L) могут быть использованы соли,приведенные в качестве примеров для соединения (I). Новые производные (I) пиридопиразина и их фармацевтически приемлемые соли вряд ли имеют сильную ингибирующую активность против фосфодиэстеразы III (PDE III), однако,обладают сильной ингибирующей активностью против фосфодиэстеразы IV (PDE IV) и сильной ингибирующей активностью по отношению к фактору некроза опухоли (TNF). Таким образом, производные (I) пиридопиразина и их фармацевтически приемлемые соли являются селективными ингибиторами фосфодиэстеразы IV (PDE IV) и ингибиторами образования фактора некроза опухоли (TNF). В соответствии с этим, новые производные(I) пиридопиразина и их фармацевтически приемлемые соли могут использоваться для профилактики и терапевтического лечения заболеваний, переносимых фосфодиэстеразой IV (PDEIV) и фактором некроза печени (TNF), таких как хронические воспалительные заболевания (например, ревматоидный артрит, остеоартрит,эмфизема, хронический бронхиолит и т.д.), остеопороз, отторжение при трансплантации, астма, эозинофилия, кистозный фиброз, гепатит,панкреатит, нефрит, эндотоксиновый шок, специфические аутоиммунные заболевания [например, анкилозирующий спонделит, аутоиммунные гематологические расстройства (например, гемолитическая анемия, апластическая анемия, чистая эритроцитная анемия, идиопатическая тромбоцитопения и т.д.], системная красная волчанка, полихондрит, склеродермия, 001324 26 гранулематоз Вегенера, дерматомиозит, хронический активный гепатит, тяжелая миастения,атопический дерматит, псориаз, идиопатический спру, аутоиммунное воспалительное кишечное заболевание (например, язвенный колит, болезнь Крона и т.д.), эндокринная офтальмопатия, болезнь Грейва, саркоидоз, рассеянный склероз, первичный желчный (biliary) цирроз, диабет [например, ювенильный диабет (сахарный диабет типа I) и т.д.], синдром Райтера,не инфекционный увеит, аутоиммунный кератит(например, кератоконъюнктивит сухой, весенний конъюнктивит и т.д.), интерстициальный легочный фиброз, псориатический артрит и т.д.), раковая кахексия, СПИД-кахексия, тромбоз и т.п. Для демонстрации полезности производных (I) пиридопиразина и его фармацевтически приемлемых солей согласно настоящему изобретению ниже приведены данные фармакологических испытаний типичного соединения производных (I) пиридопиразина.IV (PDE IV). 1. Метод испытаний. Собранный U937 замораживают до -80 С и разбрасывают для разрушения оболочки клетки. Шарик разрушенной клетки промывают забуференным фосфатом солевым раствором (PBS). Промытый клеточный шарик гомогенизируют с помощью гомогенизатора Доунса (20 ходов) в гомогенизирующем буфере (0,5% деоксихолата [DOC], 5 ммоль 2-меркаптоэтанола, 1 мкмоль леу-пептина, 100 мкмоль PMSF, 20 мкмоль п-тозил-L-лизин-хлорметилкетона[TLCK] в PBS). Гомогенат центрифугируют при 100000 х g в течение 90 мин (при 4 С) и надосадочную жидкость (супернатант), содержащую активность фосфодиэстеразы IV, подвергают диализу на диализном буфере, который представляет собой тот же компонент, что и гомогенизирующий буфер без деоксихолата (DOC). Диализированную надосадочную жидкость гомогената помещают в морозильник (-80 С) в качестве препарата фермента фосфодиэстеразыIV. Препарат фермента разбавляют в испытательном буфере (10 мкмоль TRIS-HCl, 5 ммольMgCl2, 1 ммоль 2-меркаптоэтанола [рН 8,0]. Степень разбавления выбирают заранее для каждой новой порции гомогенизированного препарата. Для контроля часть препарата фермента кипятят в течение 10 мин. Испытуемые соединения растворяют в диметилсульфоксиде (DMSO) при концентрации 4 х 10(-2) [М] (конечная концентрация 1 х 10 (-5) М), затем последовательно разбавляют диметилсульфоксидом для получения желаемых концентраций. Разбавленные соединения каждой концентрации далее разбавляют в соотношении 1:500 в испытательном буфере (0,2% диметилсульфоксид). Конечная концентрация 27 диметилсульфоксида в испытательной пробирке составляла 0,025%. В качестве дубликата в стеклянную пробирку последовательно при 0 С добавляют следующие вещества (все концентрации даны как конечные концентрации в испытательной пробирке): 50 мкл соединения или испытательного буфера для контроля или слепой опыт,50 мкл 8 х 10 (-5) [М] CI-930 (окончательно 10 мкмоль) :(CI-930 является ингибитором фосфодиэстеразы III),200 мкл препарата фермента или прокипяченного препарата фермента для контрольной пробы. Реакционную пробирку предварительно инкубируют в водяной ванне (30 С) в течение 5 мин, затем в нее добавляют 100 мкл [3H]-cAMP(37,0 MBq/ml [3H]-cAMP : 4 мкмоль холодного сАМР = 1:800). Спустя 15 мин в реакционную смесь добавляют 2,5 единиц/мл щелочной фосфатазы и реакцию продолжают в течение 15 мин. В реакционную смесь добавляют 1 х 8 геля Довекс и хорошо перемешивают встряхиванием. Смесь центрифугируют при 1000 об/мин, в течение 5 мин и затем добавляют 500 мкл надосадочной жидкости в 10 мл сцинтилляционной жидкости в соответствующей склянке, смешивают встряхиванием и производят подсчет [3H]. Ингибирующую активность вычисляют по формуле:(b) Ингибирование образования TNF- в моноядерных клетках человека Берут пробы крови от здоровых добровольцев с гепарином. Фракцию одноядерных клеток (МNС) получают градиентным центрифугированием (1800 об/мин., 15 мин), разбавляют тем же объемом культуральной средыBiotechnology). Одноядерные клетки дважды промывают в RPMI-1640. Затем одноядерные клетки ресуспендируют в культуральной средеRPMI-1640, в которую добавлено 2 ммоль Lглутамина и 1% эмбриональной бычьей сыворотки. Одноядерные клетки инкубируют при 37 С в течение 16 ч на планшете для микрокультуры с 96 ячейками при концентрации 3 х 105 клеток/ячейка без или с 1 мкг/мл липополисахарида (LPS) (из Е. coli) и различными количествами испытуемого соединения. В конце 28 инкубации получают надосадочную жидкость и измеряют ее активность TNF- с помощью ферментно-соединенной иммуносорбентной пробы (ELISA). Ферментно-соединенную иммуносорбентную пробу подготавливают с помощью набора(а) 2,4 х 10-8 Для терапевтического применения соединение (I) согласно настоящему изобретению и его фармацевтически приемлемые соли используются в виде обычных фармацевтических препаратов в смеси с обычным фармацевтически приемлемым носителем, таким как органический или неорганический, твердый или жидкий эксципиент, пригодный для перорального, парентерального или внешнего применения. Фармацевтический препарат может быть изготовлен в твердом виде, например, в виде гранул, капсул, таблеток, драже или свеч, или в жидком виде, например, в виде раствора, суспензии или эмульсии для инъекций, приема внутрь, глазных капель и т.д. При необходимости, в указанные выше препараты могут быть включены дополнительные вещества, такие как стабилизатор,смачивающий или эмульгирующий агент, буфер или другие обычно применяемые добавки. Эффективный ингредиент можно обычно применять в единичной дозе от 0,001 мг/кг до 500 мг/кг, предпочтительно, от 0,01 мг/кг до 10 мг/кг, от 1 до 4 раз в день. Однако указанная выше дозировка может быть увеличена или уменьшена в зависимости от возраста, веса и самочувствия пациента или способа применения. Предпочтительные варианты соединения(I) согласно изобретению указаны ниже.(низший)алкеноил]амино] фенил, ациламинопиридил](низший) алкеноил]амино]фенил (более предпочтительно, низший алканоиламино]пиридил](низший) алкеноил]амино]фенил),пиридилтиазолил] карбониламино]фенил,нафтил, имеющий низший алкокси и галоген,[дигалоидфенил](низший)алкенил,[пиридил(низший)алкенил] пиридил, низший алкилбензотиазолил или галоидпиридилкарбониламино, при условии, что если R2 представляет 4-пиридил(низший) алкеноил]амино]фенил, аминофенил, [низший алканоиламино]фенил или [дигалоидфенил](низший)алкенил, то R1 представляет Nоксидопиридил(низший)алкил или имидазолил(низший)алкил. Ниже приводятся получения и примеры для более детальной иллюстрации данного изобретения. Получение 1. Смесь 3-нитростирола (7,0 г), 2-ацетамидо 5-бромпиридина (10,1 г), тетра-н-бутиламмонийхлорида (13,1 г), ацетата палладия (II)(0,08 г) и бикарбоната натрия (9,87 г) в N,Nдиметилформамиде (70 мл) перемешивают при 110 С в течение 6 ч. Реакционную смесь выливают в ледяную воду и собирают выпавшие в осадок кристаллы, промывают водой и сушат,получая 3-[(Е)-2-(6-ацетамидо-3-пиридил) винил]нитробензол (12,0 г). ЯМР (DMSO-d6, ): 2,11 (3 Н, s), 7,44 (1H,d, J=16 Гц), 7,50 (1H, d, J=16 Гц), 7,68 (1H, dd,J=8, 8 Гц), 8,04 (1H, d, J=8 Гц), 8,11 (3 Н, m), 8,43(259 мг), тетра-н-бутил-аммонийхлорида (10,7 г) и бикарбоната натрия (8,07 г) в N,Nдиметилформамиде (50 мл) перемешивают при 120 С в течение 4 ч. Смесь выливают в раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Объединенный органический раствор промывают раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Получившееся твердое вещество промывают диизопропиловым эфиром, получая 3-бром-5-[(Е)-2-(3-нитрофенил)винил] пиридин (5,74 г). ЯМР (CDCl3, ): 7,1-7,3 (2 Н, m), 7,59 (1H, t,J=8 Гц), 7,82 (1H, d, J=8 Гц), 8,02 (1H, t, J=2 Гц), 001324(1,06 г) и 2 М водного раствора бикарбоната натрия (42 мл) в толуоле (85 мл) и этаноле (21 мл) перемешивают при 80 С в течение 4,5 ч. Смесь выливают в раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Объединенный органический раствор промывают раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Осадок хроматографируют на колонке с силикагелем(4% метанол в хлороформе), получая 3-(3 аминофенил)-5-бромпиридин (4,31 г). ЯМР (DMSO-d6, ): 5,24 (2 Н, s), 6,64 (1 Н,m), 6,8-6,9 (2 Н, m), 7,14 (1 Н, t, J=8 Гц), 8,19 (1H,t, J=2 Гц), 8,66 (1H, d, J=2 Гц), 8,78 (1H, d, J=2 Гц). Получение 4. Следующее соединение получают по методике получения 3.(1,48 г), хлорида аммония (0,57 г), этанола (30 мл) и воды (9 мл) перемешивают при температуре кипения с обратным холодильником в течение 5 ч. Реакционную смесь фильтруют, концентрируют и экстрагируют хлороформом. Экстракт хроматографируют на силикагеле (20 г,хлороформ : метанол в соотношении 100:1 в качестве элюента) с получением масла. Кристаллизацией из метанола получают 3-[(Е)-2-(6 ацетамидо-3-пиридил)винил]анилин (2,4 г). ЯМР (DMSO-d6, ): 2,10 (3 Н, s), 5,10 (2 Н,s), 6,50 (1H, m), 6,73 (2H, m), 7,05 (3 Н, m), 8,05(2 Н, m), 8,48 (1H, m). Получение 6. Смесь 3-бром-5-[(Е)-2-(3-нитрофенил) винил]пиридина (5, 55 г), железного порошка (3,05 г) и формиата аммония (5,73 г) в этаноле (90 мл) и воде (30 мл) перемешивают при 90 С в течение 0,5 ч. Смесь фильтруют в горячем состоянии. Фильтрат добавляют в раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Объединенный органический раствор промывают раствором бикарбоната натрия и рассолом, 31 сушат над сульфатом магния и концентрируют,получая 3-[(Е)-2-(3-аминофенил)винил]-5-бромпиридин (3,57 г). ЯМР (DMSO-d6, ): 5,13 (2H, s), 6,54 (1H,d, J=8 Гц), 6,79 (2H, m), 7,0-7,1 (2H, m), 7,37 (1H,d, J=16 Гц), 8,35 (1H, d, J=2 Гц), 8,56 (1H, d, J=2 Гц), 8,74 (1H, s) Получение 7. Смесь 3-виниланилина (8,0 г), 2-хлор-3 нитропиридина (10,7 г) и карбоната калия (18,6 г) в диоксане (80 мл) перемешивают при температуре кипения с обратным холодильником в течение 5 дней. Реакционную смесь экстрагируют хлороформом, промывают водой, сушат над сульфатом магния и упаривают. После упаривания растворителя сырой осадок кристаллизуют из метанола,получая 2-(3 винилфениламино)-3-нитропиридин (12,9 г) в виде оранжевых кристаллов. ЯМР (CDCl3, ): 5,30 (1 Н, d, J=12 Гц), 5,79(30 мл) перемешивают при температуре кипения с обратным холодильником в течение 22 ч. Смесь фильтруют и фильтрат концентрируют. Получившееся твердое вещество промывают этанолом, получая 2-[3-[(Е)-2-(5-бромпиридин 3-ил)винил]фениламино]-3-нитропиридин (1,63 г). ЯМР (CDCl3, ): 6,89 (1H, dd, J=5, 8 Гц),7,03 (1H, d, J=16 Гц), 7,20 (1H, d, J=16 Гц), 7,37,5 (2 Н, m), 7,60 (1H, d, J=8 Гц), 7,87 (1H, s),8,00 (1H, s), 8,5-8,6 (2 Н, m), 8,63 (1H, s) Получение 9. Следующие соединения получают по методике получения 7 или 8.(25 мл) и ацетонитрила (150 мл) перемешивают при температуре кипения с обратным холодильником в атмосфере азота в течение ночи. После удаления растворителей сырой остаток хроматографируют на силикагеле (450 г, хлороформ в качестве элюента), получая 2-[3-[(Е)-2-(3 пиридил)винил]фениламино]-3-нитропиридин в виде красновато-оранжевых кристаллов (11,5 г). ЯМР (DMSO-d6, ): 7,02 (1H, dd, J=8, 5 Гц),7,30 (1H, d, J=16 Гц), 7,40 (4 Н, m), 7,65 (1H, m),7,88 (1H, m), 8,05 (1H, d, J=8 Гц), 8,46 (1H, m),8,55 (2H, m), 8,80 (1H, m). Получение 11. Следующее соединение получают по методике получения 10. 2-[3-[(Е)-2-(5-Метоксикарбонилпиридин-3 ил)винил]фениламино]-3-нитропиридин. ЯМР (DMSO-d6, ): 3,92 (3 Н, s), 7,02 (1H,dd, J=8,5 Гц), 7,42 (3 Н, m), 7,56 (1H, d, J=16 Гц),7,68 (1H, m), 7,93 (1H, m), 8,55 (3 Н, m), 8,95 (1H,br s), 9,05 (1H, br s). Получение 12. Смесь 2-[3-[(Е)-2-(5-бромпиридин-3-ил) винил]фениламино]-3-нитропиридина (800 мг) ,4-винилпиридина (233 мг), ацетата палладия (II)(27 мг) , тетра-н-бутиламмонийхлорида (616 мг) и бикарбоната натрия (432 мг) в N,Nдиметилформамиде (4 мл) перемешивают при 120 С в течение 4 ч. Смесь выливают в раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Объединенный органический раствор промывают водным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Осадок кристаллизуют из этанола, получая 2-[3-[(Е)-2-[5-[(Е)-2-(4 пиридил)винил]пиридин-3-ил]винил]фениламино]-3-нитропиридин (346 мг). 33 ЯМР (СDСl3, ): 6,89 (1H, dd, J=5, 8 Гц),7,1-7,5 (8 Н, m), 7,62 (1H, d, J=8 Гц), 7,87 (1H, s),8,00 (1H, s), 8,5-8,7 (6 Н, m). Получение 13. Следующие соединения получают по методике получения 12.(1H, t, J=2 Гц), 8,06 (1H, t, J=2 Гц), 8,5-8,7 (4 Н,m), 8,76 (1H, d, J=2 Гц), 8,82 (1H, d, J=2 Гц),10,25 (1H, s). Получение 14. Смесь 2-[3-(6-метокси-2-нафтил)фениламино]-3-нитропиридина (5,2 г), N-бромсукцинимида (3,24 г) и бензоилпероксида (678 мг) в хлороформе (30 мл) перемешивают при температуре кипения с обратным холодильником в течение 3 ч. Смесь концентрируют в вакууме и очищают колоночной хроматографией (на силикагеле),получая 2-[3-(5-бром-6-метокси-2 нафтил)фениламино]-3-нитропиридин (3,3 г). ЯМР (CDCl3, ): 4,05 (3 Н, s), 6,87 (1H, dd,J=8,6 Гц), 7,31 (1H, d, J=8 Гц), 7,48-7,53 (2 Н, m),7,65-7,73 (1H, m), 7,83-7,90 (2 Н, m), 7,95 (1H, s),8,00 (1H, s), 8,29 (1H, d, J=8 Гц), 8,45-8,56 (2 Н,m) Получение 15. Раствор 2-[3-(3-ацетамидофенил)фениламино]-3-нитропиридина (10 г) в 3N хлористоводородной кислоте (100 мл) перемешивают при температуре кипения с обратным холодильником в течение 2 ч. Холодный реакционный раствор доводят до рН 8 насыщенным раствором бикарбоната натрия и собирают выпавшие в осадок красноватые кристаллы, промывают водой и сушат, получая 2-[3-(3-аминофенил) фениламино]-3-нитропиридин (9,53 г). ЯМР (DMSO-d6, ): 6,89 (1H, m), 7,01 (1 Н,dd, J=8, 5 Гц), 7,17 (2 Н, m), 7,30 (1H, m), 7,36(1H, m), 7,45 (1H, dd, J=8, 8 Гц), 7,68 (1H, m),7,88 (1H, m), 8,55 (2 Н, m). Получение 16. В охлажденную льдом суспензию 3-(2 пиридил)акриловой кислоты (1,07 г) в сухом метиленхлориде (80 мл) добавляют триэтиламин (1,46 г) и пивалоилхлорид (0,87 г) и смесь перемешивают в течение 2 ч. После получения прозрачной реакционной смеси в нее добавляют 2-[3-(3-аминофенил)фениламино]-3 001324 34 нитропиридин (2,0 г) и перемешивают при температуре кипения с обратным холодильником в течение ночи. Продукт реакции хроматографируют на силикагеле (хлороформ : метанол, 50:1 в качестве элюента), получая 2-[3-[3-[(Е)-3-(2 пиридил)акрилоил-амино]фенил]фениламино]3-нитропиридин в виде оранжевых кристаллов(2,85 г). ЯМР (DMSO-d6, ): 7,02 (1H, dd, J=8, 5 Гц),7,35 (1H, d, J=16 Гц), 7,42 (4 Н, m), 7,50 (1H, m),7,65 (2 Н, m), 7,71 (2 Н, m), 7,88 (1H, m), 7,94 (1H,s), 8,08 (1H, s), 8,55 (2H, m), 8,66 (1H, m). Получение 17. Следующие соединения получают по методике получения 16.(2) 2-[3-[3-[(Е)-3-(4-Пиридил)акрилоиламино]фенил]фениламино]-3-нитропиридин. ЯМР (DMSO-d6, ): 7,02 (1H, dd, J=8, 5 Гц),7,05 (1H, d, J=15 Гц), 7,45 (4 Н, m), 7,60 (3 Н, m),7,72 (2 Н, m), 7,93 (1H, m), 8,05 (1H, m), 8,55 (2 Н,m), 8,65 (2 Н, m). Получение 18. К раствору 3-нитро-2-[3-[(Е)-2-(3-пиридил) винил]фениламино]пиридина (2,22 г) в дихлорметане (70 мл) добавляют м-хлорпербензойную кислоту (1,81 г). Смесь перемешивают при комнатной температуре в течение 1 ч, затем выливают в водный раствор бикарбоната натрия и экстрагируют хлороформом. Объединенный органический раствор промывают водным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Осадок хроматографируют на колонке с силикагелем (8% метанол в хлороформе), получая 3 нитро-2-[3-[(Е)-2-(1-оксидо-3 пиридил)винил]фениламино]пиридин (1,51 г). ЯМР (CDCl3, ): 6,85-7,0 (2 Н, m), 7,15-7,5(1H, d, J=5 Гц), 8,38 (1H, s), 8,5-8,6 (2 Н, m). Получение 19. Следующие соединения получают по методике получения 18.(0,26 г), этанола (20 мл) и воды (6 мл) перемешивают при температуре кипения с обратным холодильником в течение 1 ч. Смесь фильтруют, концентрируют и экстрагируют хлороформом. Экстракт промывают насыщенным раствором бикарбоната натрия, сушат и упаривают,получая 2-[3-[(Е)-2-(6-ацетамидо-3 пиридил)винил]фениламино]-3-аминопиридин в виде темно-пурпурных кристаллов (1,59 г). ЯМР (DMSO-d6, ): 2,10 (3 Н, s), 5,08 (2 Н,s), 6,64 (1H, dd, J=8, 5 Гц), 6,90 (1H, d, J=8 Гц),7,11 (2H, m), 7,23 (2H, m), 7,55 (2 Н, m), 7,77 (2 Н,m), 8,07 (2H, s), 8,50 (1H, s). Получение 21. Смесь 2- [3-[(Е)-2-[5-[(Е)-2-(4-пиридил) винил]пиридин-3-ил]винил]фениламино]-3 нитропиридина (331 мг), железного порошка(6 мл) и воде (2 мл) перемешивают при 90 С в течение 30 мин. Смесь фильтруют в горячем состоянии. Фильтрат добавляют в водный раствор бикарбоната натрия и дважды экстрагируют этилацетатом. Объединенный органический раствор промывают раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Оставшееся твердое вещество промывают диизопропиловым эфиром, получая 3-амино-2-[3-[(Е)-2-[5-[(Е)-2-(4-пиридил)винил] пиридин-3-ил]винил]фениламино]пиридин (270 мг). ЯМР (DMSO-d6, ): 5,10 (2H, s), 6,67 (1H,dd, J=5,8 Гц), 6,92 (1H, d, J=8 Гц), 7,1-7,3 (3 Н,m), 7,4-7,7 (7 Н, m), 7,81 (1H, s), 7,90 (1H, s), 8,42(1H, s). Получение 22. Следующие соединения получают по методике получения 20 или 21.MASS (m/z) : 420(M+1), 422. Получение 23. Смесь 2-[3-(6-метокси-2-нафтил)фениламино]-3-аминопиридина (60 г) и пировиноградной кислоты (18,6 г) в метаноле перемешивают при температуре кипения с обратным холодильником в течение 5 ч. Смесь охлаждают и кристаллизуют. С помощью отсасывания собирают 2-метил-4-[3-(6-метокси-2-нафтил)фенил]3-оксо-3,4-дигидропиридо[2,3-b]пиридин (12,6 г). ЯМР (DMSO-d6, ): 2,51 (3 Н, s), 3,88 (3 Н,s), 7,20 (1 Н, m), 7,35 (2 Н, m), 7,40 (1 Н, dd, J=8, 5 Гц), 7,66 (1 Н, dd, J=8, 8 Гц), 7,81 (2 Н, m), 7,90(3 Н, m), 8,19 (1 Н, s), 8,23 (1H, m), 8,40 (1H, m). Получение 24. Следующее соединение получают по методике получения 23. 4-[3-(3-Ацетамидофенил)фенил]-2-(3-пиридилметил)-3-оксо-3,4-дигидропиридо[2,3-b] пиразин. Т.пл. 190-193 С. ЯМР (CDCl3, ): 2,13 (3 Н, s), 4,32 (2 Н, s),7,2-7,35 (5 Н, m), 7,45 (2 Н, m), 7,55 (1H, s), 7,62(1H, dd, J=8, 8 Гц), 7,70 (2 Н, m), 7,82 (1H, m),8,18 (1H, d, J=8 Гц), 8,41 (1H, m), 8,49 (1H, d,J=5 Гц), 8,73 (1H, s). Получение 25. Смесь 2-метил-4-[3-(6-метокси-2-нафтил) фенил]-3-оксо-3,4-дигидропиридо[2,3-b]пиразина (3,4 г), N-бромсукцинимида (3,08 г) и бензоилпероксида (837 мг) в хлороформе (30 мл) перемешивают при температуре кипения с обратным холодильником в течение 3 ч. Смесь концентрируют в вакууме и очищают колоночной хроматографией (силикагель), получая 2 бромметил-4-[3-(6-метокси-5-бром-2-нафтил) фенил]-3-оксо-3,4-дигидропиридо[2,3-b]пиразинMASS (m/z): 550 (M+1), 552, 554. Получение 26. Следующее соединение получают по методике получения 15.(260 мг) и 3-пиридилпировиноградной кислоты (121 мг) в этаноле (5 мл) перемешивают при температуре кипения с обратным холодильником в течение 5 ч. После удаления растворителя остаток хроматографируют на колонке с силикагелем (хлороформметанол, 9:1) и кристаллизуют из метанола, получая 2-(3-пиридилметил)-3-оксо-4-[3-[(Е)-2-[5[(Е)-2-(4-пиридил)винил]пиридин-3-ил]винил] фенил]-3,4-дигидропиридо[2,3-b]пиразин (208 мг). ЯМР (CDCl3, ): 4,33 (2 Н, s), 7,1-7,35 (7 Н,m), 7,40 (2 Н, d, J=5 Гц), 7,47 (1H, s), 7,55-7,7(0,79 г) в этаноле (30 мл) перемешивают при температуре кипения с обратным холодильником в течение 8 ч. Холодную реакционную смесь фильтруют и промывают этанолом, получая 2-(3-пиридилметил)-3-оксо-4-[3-[(Е)-2-(6 ацетамидо-3-пиридил)винил]фенил]-3,4 дигидропиридо[2,3-b]пиразин в виде бесцветных кристаллов (1,76 г). Т.пл. 260-261 С. ЯМР (DMSO-d6, ): 2,10 (3 Н, s), 4,25 (2 Н,s), 7,27 (3 Н, m), 7,39 (2 Н, m), 7,58 (2 Н, m), 7,68(1H, m), 7,78 (1H, m), 8,05 (2 Н, m), 8,22 (1H, m),8,40 (1H, m), 8,45 (2 Н, m), 8,59 (1H, m). Пример 3. Следующие соединения получают по методике примера 1 или 2.(20 мл) добавляют м-хлорпербензойную кислоту (232 мг). Смесь перемешивают на ледяной бане в течение 1 ч, затем выливают в водный раствор бикарбоната натрия и экстрагируют хлороформом. Объединенный органический раствор промывают водным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Осадок хроматографируют на колонке с силикагелем (метанолхлороформ, 9:1), получая 2-[(1-оксидо-3 пиридил)метил]-4-[3-[(Е)-2-(1-оксидо-3 пиридил)винил]фенил]-3-оксо-3,4 дигидропиридо[2,3-b]пиразин (43 мг). ЯМР (CDCl3, ): 4,29 (2 Н, s), 6,92 (1 Н, d,J=16 Гц), 7,15-7,45 (8 Н, m), 7,6-7,7 (2 Н, m), 8,13(10 мл) добавляют мхлорпербензойную кислоту (181 мг). Смесь перемешивают при комнатной температуре в течение 1 ч, затем выливают в водный раствор бикарбоната натрия и экстрагируют хлороформом. Органический раствор промывают водным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Полученное твердое вещество промывают дии 41 зопропиловым эфиром, получая 4-[3-[(Е)-2-(3,5 дихлорфенил)винил]фенил]-2-[(1-оксидо-3 пиридил)метил]-3-оксо-3,4-дигидропиридо[2,3b]пиразин (167 мг). ЯМР (CDCl3, ): 4,28 (2 Н, s), 6,97 (1H, d,J=16 Гц), 7,1-7,45 (9 Н, m), 7,55-7,7 (2 Н, m), 8,12(1H, d, J=5 Гц), 8,20 (1H, d, J=8 Гц), 8,36 (1H, s),8,47 (1H, m). Пример 6. Следующие соединения получают по методике примера 4 или 5.(2) 2-[(1-Оксидо-3-пиридил)метил]-4-[3[(Е)-2-(1-оксидо-4-пиридил)винил]фенил]-3 оксо-3,4-дигидропиридо[2,3-b]пиразин. Т.пл. 168-180 С. ЯМР (CDCl3, ): 4,28 (2 Н, s), 6,99 (1H, d,J=16 Гц), 7,15-7,45 (8 Н, m), 7,55-7,7 (2 Н, m), 8,18,25 (4 Н, m), 8,37 (1H, s), 8,47 (1H, m). Пример 7. Раствор 4-[3-[(Е)-2-(6-ацетамидо-3-пиридил)винил]фенил]-2-(3-пиридилметил)-3-оксо 3,4-дигидропиридо[2,3-b]пиразина (1,56 г) в 4N хлористоводородной кислоте (30 мл) кипятят с обратным холодильником в течение 1 ч. Холодную реакционную смесь разбавляют водой и собирают выпавшие в осадок вещества, промывают водой и сушат, получая 4-[3-[(Е)-2-(6 амино-3-пиридил)винил]фенил]-2-(3 пиридилметил)-3-оксо-3,4-дигидропиридо[2,3b]пиразиндигидрохлорид (1,65 г). Т.пл. 215-222 С. ЯМР (DMSO-d6, ): 4,48 (2 Н, s), 7,08 (1H,d, J=8 Гц), 7,20 (1H, d, J=16 Гц), 7,28 (2 Н, m),7,40 (1H, dd, J=8, 5 Гц), 7,52 (1H, s), 7,58 (1H, dd,J=8, 8 Гц), 7,66 (1H, d, J=8 Гц), 8,02 (1H, dd,J=8,5 Гц), 8,06 (1H, s), 8,18 (1H, d, J=8 Гц), 8,33(3 Н, m), 8,42 (1H, d, J=5 Гц), 8,52 (1H, d, J=8 Гц),8,83 (1H, d, J=5 Гц), 8,92 (1H, s). Пример 8. Следующее соединение получают по методике примера 7. 4-[3-(3-Аминофенил)фенил]-2-[(1-оксидо 3-пиридил)метил]-3-оксо-3,4-дигидропиридо(0,17 г) и бис(трифторацетил)ангидрид (0,14 г). Полученную смесь перемешивают еще в течение 2 ч и собирают выпавшие в осадок бесцветные кристаллы, промывают метиленхлоридом и сушат, получая 4-[3-[(Е)-2-(6-трифторацетиламино-3-пиридил)винил]фенил]-2-(3-пиридилметил)-3-оксо-3,4-дигидропиридо[2,3-b] пиразин (0,28 г). Т.пл. 155-163 С. ЯМР (DMSO-d6, ): 4,40 (2 Н, s), 7,02 (1H,d, J=8 Гц), 7,18 (1H, d, J=16 Гц), 7,28 (2 Н, m),7,41 (1 Н, dd, J=8, 5 Гц), 7,53 (1 Н, s), 7,60 (1H, s),7,68 (1H, m), 7,79 (1H, dd, J=8, 5 Гц), 8,05 (1H,s), 8,20-8,35 (4 Н, m), 8,42 (1H, m), 8,71 (1H, m),8,80 (1H, s). Пример 10. К раствору 4-(3-аминофенил)-2-(3-пиридилметил)-3-оксо-3,4-дигидропиридо[2,3-b] пиразина (300 мг) и триэтиламина (0,33 мл) в 1,4 диоксане (10 мл) добавляют 5-бром-3 пиридилкарбонил-хлоридгидрохлорид (304 мг). Смесь перемешивают при комнатной температуре в течение 15 мин, затем выливают в водный раствор бикарбоната натрия и экстрагируют этилацетатом. Органический раствор промывают водным раствором бикарбоната натрия и рассолом, сушат над сульфатом магния и концентрируют. Остаток кристаллизуют из метанола, получая 4-[3-[5-бром-3-пиридил) карбониламино]фенил]-2-(3-пиридилметил)-3-оксо-3,4 дигидропиридо[2,3-b]пиразин (256 мг). Т.пл. 223-226 С. ЯМР (СDСl3, ): 4,32 (2 Н, s), 6,78 (1H, d,J=8 Гц), 7,12 (1H, dd, J=5, 8 Гц), 7,3-7,45 (2 Н, m),7,56 (1H, s), 7,7-7,8 (2 Н, m), 8,2-8,3 (2 Н, m), 8,32(1H, m), 8,43 (1H, m), 8,65 (1H, s), 8,74 (1H, d,J=2 Гц), 8,88 (1H, s), 8,91 (1H, s). Пример 11. Следующие соединения получают по методике примера 10.MASS (m/z): 553 (M+1). Пример 12. К перемешиваемой суспензии 2-(3 пиридил)тиазол-4-карбоновой кислоты (0,56 г) и триэтиламина (0,55 г) в метиленхлориде (25 мл) добавляют пивалоилхлорид (0, 33 г) в метиленхлориде (5 мл) и смесь перемешивают в течение 2 ч. После того как реакционная смесь стала прозрачной,в нее добавляют 4-[3-(3 аминофенил)фенил]-2-(3-пиридилметил)-3 оксо-3,4-дигидропиридо[2,3-b]пиразин (1,0 г) и смесь перемешивают при температуре кипения с обратным холодильником в течение 2 ч. Реакционную смесь промывают раствором бикарбоната натрия и водой, сушат над сульфатом магния и концентрируют. Сырой остаток хроматографируют на силикагеле (70 г, хлороформметанол, 100:1 в качестве элюента), получая 4[3-[3-[2-(3-пиридил)тиазол-4-илкарбониламино]фенил]фенил]-2-(3-пиридилметил)3-оксо-3,4-дигидропиридо[2,3-b]пиразин в виде прозрачных кристаллов (0,48 г). Т.пл. 199-200 С. ЯМР (DMSO-d6, ): 4,28 (2 Н, s), 7,38 (3 Н,m), 7,50 (2 Н, m), 7,60 (1 Н, dd, J=8, 5 Гц), 7,70N,N-диметилформамиде (40 мл) перемешивают при температуре 70 С в течение 5 ч. В смесь добавляют насыщенный карбонат натрия (40 мл) и хлороформ (40 мл). Смесь перемешивают в течение 30 мин. Смесь экстрагируют хлороформом (2 х 40 мл). Органический слой упаривают под вакуумом. Сырой продукт очищаютR1 обозначает N-оксидопиридил(С 1-6)алкил или имидазолил(C1-6)алкил,или его фармацевтически приемлемая соль. 2. Соединение по п.1, в которомR2 представляет нафтил, имеющий С 1-6 алкокси и галоген. 7. Способ получения соединения формулы[тиазолилкарбониламино]фенил, который может иметь пиридил, или где R2 имеет значения, приведенные выше, или его соли с соединением формулы где R1 имеет значения, указанные выше, или его солью с получением соединения формулыR2a представляет [аминопиридил](С 2-6) алкенил или его реакционноспособное производное у аминогруппы,или его соли с получением соединения формулыR2d представляет аминофенил или [аминопиридил](С 2-6)алкенил,или его соли, илиR2e представляет аминофенил,или его реакционноспособного производного у аминогруппы, или его соли с соединением формулыR3-OH,3 где R представляет C1-6 алканоил, [галоидфенил](C2-6)алкеноил, пиридил(С 2-6)алкеноил, [Nоксидопиридил](C2-6)алкеноил,[защищенный аминопиридил](C2-6)алкеноил или тиазолилкарбонил, который может иметь пиридил,или его реакционноспособным производным у карбоксильной группы, или его солью с получением соединения формулы[тиазолилкарбониламино]фенил, который может иметь пиридил, или 50 соединение по п.1 или его фармацевтически приемлемую соль в смеси с фармацевтически приемлемыми носителями. 9. Применение соединения по п.1 или его фармацевтически приемлемой соли в качестве ингибитора образования фосфодиэстеразы IV(PDE-IV) и ингибитора образования фактора некроза опухоли (TNF). 10. Способ профилактики или терапевтического лечения переносимых фосфодиэстеразой IV (PDE-IV) или фактором некроза опухоли(TNF) заболеваний, который включает введение соединения по п.1 или его фармацевтически приемлемой соли человеку или животному. 11. Способ получения фармацевтической композиции, который включает смешивание соединения по п.1 или его фармацевтически приемлемой соли с фармацевтически приемлемым носителем.
МПК / Метки
МПК: A61P 7/06, A61K 31/4985, C07D 471/04
Метки: гетеробициклические, производные
Код ссылки
<a href="https://eas.patents.su/26-1324-geterobiciklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Гетеробициклические производные</a>
Предыдущий патент: 4-замещенные аналоги пиперидина и их использование в качестве подтип-селективных антагонистов рецепторов nmda.
Следующий патент: Способы лечения и профилактики интерстициального цистита
Случайный патент: Фармацевтические композиции и способы лечения инсулином