1,2,5-оксадиазолы в качестве ингибиторов индоламин-2,3-диоксигеназы
Номер патента: 22669
Опубликовано: 29.02.2016
Авторы: Вен Линкай, Лю Пинли, Комбс Эндрю П., Юэ Эдди В., Лин Циянь, Чжу Вэньюй, Чжоу Цзячэн, Юэ Тай-Юйэнь, Спаркс Ричард Б.
Формула / Реферат
1. Соединение формулы I
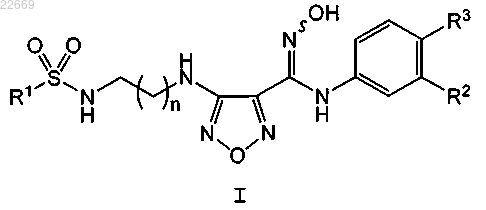
или его фармацевтически приемлемая соль,
где R1 представляет собой NH2 или CH3;
R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой NH2.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 представляет собой CH3.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой Cl.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой Br.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой CF3.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой CH3.
8. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой CN.
9. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 представляет собой Н.
10. Соединение по п.1 или его фармацевтически приемлемая соль, где R3 представляет собой F.
11. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 1.
12. Соединение по п.1 или его фармацевтически приемлемая соль, где n равно 2.
13. Соединение по п.1, выбранное из
4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-(3-бром-4-фторфенил)-N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({3-[(аминосульфонил)амино]пропил}амино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-(3-бром-4-фторфенил)-N'-гидрокси-4-({3-[(метилсульфонил)амино]пропил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-хлор-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-(3-хлор-4-фторфенил)-N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({3-[(аминосульфонил)амино]пропил}амино)-N-(3-хлор-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-(3-хлор-4-фторфенил)-N'-гидрокси-4-({3-[(метилсульфонил)амино]пропил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({2-[(аминосульфонил)амино]этил}амино)-N-[4-фтор-3-(трифторметил)фенил]-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-[4-фтор-3-(трифторметил)фенил]-N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({3-[(аминосульфонил)амино]пропил}амино)-N-[4-фтор-3-(трифторметил)фенил]-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида;
N-[4-фтор-3-(трифторметил)фенил]-N'-гидрокси-4-({3-[(метилсульфонил)амино]пропил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({2-[(аминосульфонил)амино]этил}амино)-N'-гидрокси-N-[3-(трифторметил)фенил]-1,2,5-оксадиазол-3-карбоксимидамида;
N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-N-[3-(трифторметил)фенил]-1,2,5-оксадиазол-3-карбоксимидамида;
4-({3-[(аминосульфонил)амино]пропил}амино)-N'-гидрокси-N-[3-(трифторметил)фенил]-1,2,5-оксадиазол-3-карбоксимидамида;
N'-гидрокси-4-({3-[(метилсульфонил)амино]пропил}амино)-N-[3-(трифторметил)фенил]-1,2,5-оксадиазол-3-карбоксимидамида;
N-(4-фтор-3-метилфенил)-N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-1,2,5-оксадиазол-3-карбоксимидамида;
4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-циано-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида и
N-(3-циано-4-фторфенил)-N'-гидрокси-4-({2-[(метилсульфонил)амино]этил}амино)-1,2,5-оксадиазол-3-карбоксимидамида,
или его фармацевтически приемлемая соль.
14. Соединение, которое представляет собой 4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамид, или его фармацевтически приемлемая соль.
15. Соединение, которое представляет собой 4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамид.
16. Соединение по п.15 в виде кристаллического вещества.
17. Соединение по п.15 в виде твердого вещества с температурой плавления от приблизительно 162 до приблизительно 166°C.
18. Соединение по п.15 в виде твердого вещества, которое демонстрирует термограмму DSC такую, как показано на фиг. 2.
19. Соединение по п.15 в виде твердого вещества, которое демонстрирует на дифрактограмме рентгеноструктурного анализа порошка по меньшей мере один пик в единицах 2-тета, выбранный из приблизительно 18,4, приблизительно 18,9, приблизительно 21,8, приблизительно 23,9, приблизительно 29,2 и приблизительно 38,7°.
20. Соединение по п.15 в виде твердого вещества, которое демонстрирует на дифрактограмме рентгеноструктурного анализа порошка по меньшей мере два пика в единицах 2-тета, выбранных из приблизительно 18,4, приблизительно 18,9, приблизительно 21,8, приблизительно 23,9, приблизительно 29,2 и приблизительно 38,7°.
21. Соединение по п.15 в виде твердого вещества, которое демонстрирует на дифрактограмме рентгеноструктурного анализа порошка по меньшей мере три пика в единицах 2-тета, выбранных из приблизительно 18,4, приблизительно 18,9, приблизительно 21,8, приблизительно 23,9, приблизительно 29,2 и приблизительно 38,7°.
22. Соединение по п.15 в виде твердого вещества, которое демонстрирует дифрактограмму рентгеноструктурного анализа порошка такую, как показано на фиг. 1.
23. Соединение формулы F28

или его фармацевтически приемлемая соль,
где R4 представляет собой F, Cl, Br или I и
n равно 1 или 2.
24. Соединение, которое представляет собой 4-({2-[(аминосульфонил)амино]этил}амино)-N-[(4-бром-2-фурил)метил]-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамид, или его фармацевтически приемлемая соль.
25. Соединение, которое представляет собой 4-({2-[(аминосульфонил)амино]этил}амино)-N-[(4-хлор-2-фурил)метил]-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамид, или его фармацевтически приемлемая соль.
26. Фармацевтическая композиция, содержащая соединение формулы I по любому из пп.1-15 и 23-25 или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель.
27. Способ ингибирования активности индоламин-2,3-диоксигеназы, отличающийся тем, что включает контакт указанной индоламин-2,3-диоксигеназы с соединением по пп.1-15 и 23-25 или его фармацевтически приемлемой солью.
28. Способ лечения рака у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения по пп.1-15, 23-25 или его фармацевтически приемлемой соли.
29. Способ по п.28, где указанный рак выбирают из рака яичника, рака молочной железы, меланомы, рака прямой кишки, рака поджелудочной железы, рака предстательной железы, рака легкого, рака шейки матки, рака яичка, рака почки, рака головы и шеи, лимфомы и лейкоза.
30. Способ по п.29, дополнительно включающий введение указанному пациенту противоопухолевой вакцины, анти-CTL-4 антитела, анти-PD-1 антитела, противовирусного средства, химиотерапевтического средства, иммуносупрессанта, радиационное облучение, введение противоопухолевой вакцины, противовирусной вакцины, терапию цитокином или ингибитором тирозикиназы.
31. Способ по п.30, где указанная терапия цитокинов включает IL2.
32. Способ по п.30, где химиотерапевтическое средство представляет собой цитотоксическое средство.
33. Способ лечения рака, выбранного из рака яичника, рака молочной железы и меланомы, у пациента, включающий введение указанному пациенту терапевтически эффективного количества 4-({2-[(аминосульфонил)амино]этил}амино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида или его фармацевтически приемлемой соли.
34. Способ по п.33, где рак представляет собой рак яичника.
35. Способ по п.33, где рак представляет собой рак молочной железы.
36. Способ по п.33, где рак представляет собой меланому.
37. Способ по любому из пп.33-36, дополнительно включающий введение указанному пациенту анти-CTL-4 антитела или анти-PD-1 антитела.
38. Способ лечения рака, выбранного из рака яичника, рака молочной железы и меланомы, у пациента, включающий введение указанному пациенту терапевтически эффективного количества 4-({2-[(аминосульфонил)амино]этил}амино)-N-[(4-бром-2-фурил)метил]-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида или его фармацевтически приемлемой соли.
39. Способ по п.38, где рак представляет собой рак яичника.
40. Способ по п.38, где рак представляет собой рак молочной железы.
41. Способ по п.38, где рак представляет собой меланому.
42. Способ по любому из пп.38-41, дополнительно включающий введение указанному пациенту анти-CTL-4 антитела или анти-PD-1 антитела.
43. Способ получения соединения формулы F15
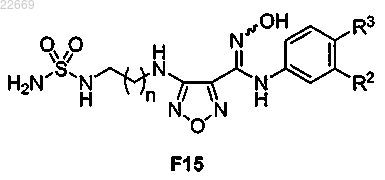
или его соли,
где R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2,
отличающийся тем, что включает:
а) реакцию соединения формулы F13

или его соли, где Pg1 представляет собой защитную группу для защиты аминогруппы, с агентом для удаления защитной группы с аминогруппы с получением соединения формулы F14
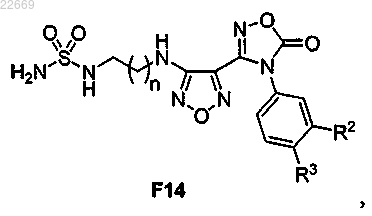
или его соли;
б) реакцию указанного соединения формулы F14 с основанием с получением указанного соединения формулы F15.
44. Способ по п.43, отличающийся тем, что R2 представляет собой Br; R3 представляет собой F и n равно 2.
45. Способ по п.43, отличающийся тем, что указанный алкоксикарбонил представляет собой трет-бутоксикарбонил.
46. Способ по п.43, отличающийся тем, что указанный агент для удаления защитной группы с аминогруппы представляет собой трифторуксусную кислоту.
47. Способ по п.43, отличающийся тем, что указанный агент для удаления защитной группы с аминогруппы представляет собой хлористо-водородную кислоту.
48. Способ по п.43, отличающийся тем, что указанное основание представляет собой натрия гидроксид.
49. Способ по п.43, отличающийся тем, что указанное соединение формулы F13 получают обработкой соединения формулы F12
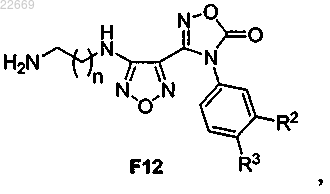
или его соли Pg1-NH-сульфонилхлоридом с последующей обработкой органическим основанием с получением указанного соединения формулы F13.
50. Способ по п.49, отличающийся тем, что указанный Pg1 представляет собой трет-бутоксикарбонил.
51. Способ по п.49, отличающийся тем, что указанное органическое основание представляет собой триэтиламин.
52. Способ по п.49, отличающийся тем, что указанное соединение формулы F12 получают восстановлением соединения формулы F11
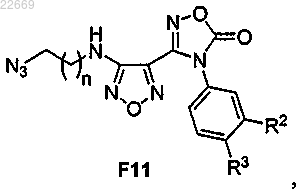
или его соли.
53. Способ получения соединения формулы F15
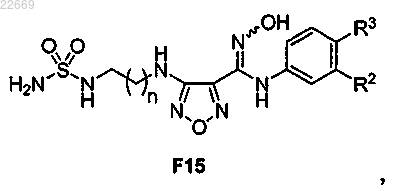
или его соли,
где R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2,
который включает:
а) реакцию соединения формулы F12

или его соли с сульфамидом и органическим основанием с получением соединения формулы F14
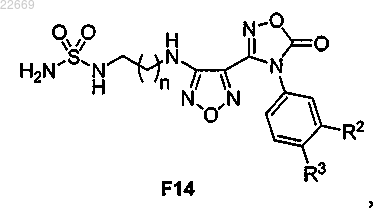
или его соли;
b) реакцию указанного соединения формулы F14 или его соли с основанием с получением указанного соединения формулы F15.
54. Способ по п.53, отличающийся тем, что указанное органическое основание представляет собой пиридин.
55. Способ по п.53, отличающийся тем, что реакция соединения формулы F12 дополнительно включает нагревание реакционной смеси.
56. Способ по п.55, отличающийся тем, что указанное нагревание осуществляется с использованием микроволнового излучения.
57. Соединение формулы F9
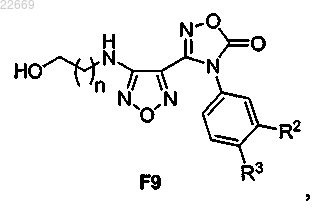
или его соль,
где R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2.
58. Соединение по п.57,
где R2 представляет собой Br;
R3 представляет собой F и
n равно 2.
59. Соединение формулы F12
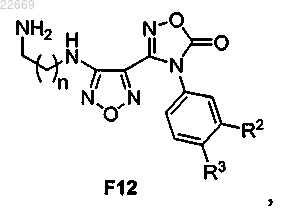
или его соль,
где R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2.
60. Соединение по п.59,
где R2 представляет собой Br;
R3 представляет собой F и
n равно 2.
61. Соединение формулы F14
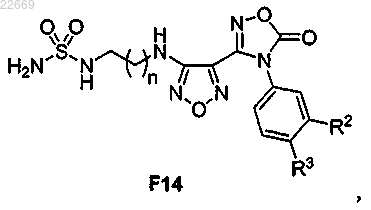
или его соль,
где R2 представляет собой Cl, Br, CF3, CH3 или CN;
R3 представляет собой Н или F и
n равно 1 или 2.
62. Соединение по п.61,
где R2 представляет собой Br;
R3 представляет собой F и
n равно 2.
Текст
Изобретение направлено на производные 1,2,5-оксадиазола и их композиции, которые являются ингибиторами индоламин-2,3-диоксигеназы и полезны в лечении рака и других расстройств, а также способы и промежуточные соединения для получения таких производных 1,2,5-оксадиазола.(71)(73) Заявитель и патентовладелец: ИНСАЙТ ХОЛДИНГС КОРПОРЕЙШН (US) Область изобретения Данное изобретение относится к производным 1,2,5-оксадиазола, которые являются ингибиторами индоламин-2,3-диоксигеназы и пригодны для лечения рака и других расстройств, и к способам и промежуточным соединениям для их получения. Уровень техники Триптофан (Trp) представляет собой неотъемлемую аминокислоту, необходимую для биосинтеза белков, ниацина и нейромедиатора 5-гидрокситриптамина (серотонин). Фермент индоламин-2,3 диоксигеназа (также известный как INDO или IDO) катализирует первую, ограничивающую скорость стадию разложения L-триптофана до N-формил-кинуренина. В человеческих клетках истощение Trp в результате действия IDO - это очевидный противомикробный эффекторный механизм, индуцируемый гамма-интерфероном (IFN-). Стимуляция IFN- индуцирует активацию IDO, что ведет к истощению Trp,таким образом останавливая рост Trp-зависимых внутриклеточных патогенов, таких как Toxoplasmagondii и Chlamydia trachomatis. Активность IDO также включает антипролиферативное действие на многочисленные опухолевые клетки, и индукция IDO наблюдается in vivo в ходе отторжения аллогенных опухолей, указывая на возможную роль данного фермента в процессе отторжения опухоли (Daubener, et(PBLs), приобретают ингибирующий иммунитет фенотип путем регуляции активности IDO. Считается,что уменьшение пролиферации PBL при обработке интерлейкином-2 (IL2) является результатом высвобождения IDO клетками опухоли в ответ на секрецию IFNG PBL. Данный эффект изменяли обработкой 1-метилтриптофаном (1 МТ) - специфическим ингибитором IDO. Допускается, что активность IDO в клетках опухоли может служить цели ослабления противоопухолевых реакций (Logan, et al., 2002, Immunology, 105: 478-87). В последнее время больше внимания уделяется иммунорегулирующей роли истощения Trp. Несколько линий доказательств свидетельствуют, что IDO вовлечен в индукцию иммунной толерантности. Исследования беременности, резистентности опухоли, хронических инфекций и аутоиммунных заболеваний у млекопитающих показали, что клетки, которые экспрессируют IDO, могут подавлять реакции Тклеток и способствовать толерантности. Ускоренный катаболизм наблюдается при заболеваниях и расстройствах, связанных с иммунной активацией клеток, например инфекция, злокачественное новообразование, аутоиммунные заболевания и СПИД, а также в ходе беременности. Например, повышенные уровни интерферонов и повышенные уровни метаболитов Trp в моче наблюдаются при аутоиммунных заболеваниях; был выдвинут постулат, что системное или местное истощение Trp, которое возникает при аутоиммунных заболеваниях, возможно, связано с дегенерацией и симптомами истощения при этих заболеваниях. В подтверждение данной гипотезы, высокие уровни IDO наблюдались в клетках, выделенных из синовия артритных суставов. Уровни интерферонов также повышаются у людей, инфицированных вирусом иммунодефицита (ВИЧ), и повышение уровней интерферона связано с прогнозом ухудшения. Таким образом, допускается, что IDO индуцируется хронической ВИЧ-инфекцией и, кроме того, его содержание увеличивается при оппортунистических инфекциях и что хроническая потеря Trp инициирует механизмы, ответственные за кахексию, слабоумие, понос и, возможно, иммуносупрессию у больных СПИДом (Brown, et al., 1991, Adv. Exp. Med. Biol., 294: 425-35). С этой точки зрения недавно было продемонстрировано, что ингибирование IDO может увеличивать уровни специфических по отношению к вирусу Т-клеток и одновременно уменьшать количество инфицированных вирусом макрофагов на модели ВИЧ у мышей (Portula et al., 2005, Blood, 106: 2382-90). Считается, что IDO играет роль в процессах угнетения иммунитета, которые предупреждают отторжение эмбриона в матке. Более 40 лет назад наблюдали, что в ходе беременности генетически незрелое оплодотворенное яйцо млекопитающих выживает, невзирая на прогноз иммунологии пересадки ткани (Medawar, 1953, Symp. Soc. Exp. Biol., 7: 320-38). Анатомический отсек матери и утробного плода и антигенная незрелость утробного плода не могут полностью объяснять выживания аллотрансплантированного эмбриона. В последнее время внимание сосредоточено на иммунологической толерантности матери. Поскольку IDO экспрессируется человеческими синцитиотрофобластными клетками, и системная концентрация триптофана снижается на протяжении нормальной беременности, выдвинута гипотеза,что экспрессия IDO в материнско-эмбрионном интерфейсе необходима для предупреждения иммунологического отторжения эмбрионного аллотрансплантата. Чтобы проверить данную гипотезу, беременных мышей (с сингенными или аллогенными утробными плодами) подвергали действию 1 МТ, и наблюдалось быстрое, индуцируемое Т-клетками отторжение всех аллогенных оплодотворенных яиц. Таким образом,по-видимому, путем катаболизма триптофана оплодотворенное яйцо млекопитающих подавляет активность Т-клеток и защищает себя от отторжения, а блокирование катаболизма триптофана в ходе мышиной беременности позволяет материнским Т-клеткам провоцировать отторжение аллотрансплантированного эмбриона (Munn, et al., 1998, Science, 281: 1191-3). Последующие доказательства механизма иммунорезистентности опухолей, основанной на разложении триптофана под действием IDO, полученные в результате наблюдения, что большинство человеческих опухолей конститутивно экспрессируют IDO и что экспрессия IDO клетками иммуногенной опухо-1 022669 ли мыши предупреждает их отторжение предварительно иммунизированными мышами. Такое влияние сопровождается отсутствием аккумуляции специфических Т-клеток в месте опухоли и может быть частично обращено системным лечением мышей ингибитором IDO при отсутствии заметной токсичности. Таким образом, это наводит на мысль, что эффективность терапевтической вакцинации больных раком может быть повышена сопутствующим введением ингибитора IDO (Uyttenhove et al., 2003, Nature Med.,9: 1269-74). Также продемонстрировано, что ингибитор IDO, 1-МТ, может осуществлять синергетическое действие с химиотерапевтическими средствами с целью уменьшения роста опухолей у мышей, указывая на то, что ингибирование IDO также может усиливать противоопухолевую активность обычной цитотоксической терапии (Muller et al., 2005, Nature Med., 11: 312-9). Один из механизмов, который способствует отсутствию иммунологической реакции против опухолей, может заключаться в презентации антигенов опухоли толерогенными хозяина APCs. Также описано подмножество экспрессирующих IDO человеческих антиген-презентующих клеток (APCs), соэкспрессирующих CD123 (IL3RA) и CCR6 и подавляющих пролиферацию Т-клеток. Как зрелые, так и незрелыеCD123-положительные дендритные клетки подавляли активность Т-клеток, и такая подавляющая IDO активность блокировалась 1 МТ (Munn, et al., 2002, Science, 297: 1867-70). Также продемонстрировано,что дренирующие опухоль лимфатические узлы у мышей (TDLNs) содержат подмножество плазмацитоидных дендритных клеток (pDC), которые конститутивно экспрессируют иммуносупресивные уровниIDO. Несмотря на содержание только 0,5% клеток лимфатического узла, in vitro эти pDC мощно подавляют реакции Т-клеток на антигены, презентованные непосредственно pDC, а также доминирующим образом подавляют реакции Т-клеток на антигены третьей стороны, презентованные несупрессорнымиAPCs. В пределах популяции pDC большая часть опосредствованной функциональным IDO супрессорной активности отделена с новым подмножеством pDC, соэкспрессирующих маркер В-выстилки CD19. Таким образом, выдвинута гипотеза, что опосредствованное IDO угнетение pDCs в TDLNs создает местное микроокружение, которое мощно подавляет противоопухолевые реакции Т-клеток хозяина (Munn, etIDO разлагает индольный фрагмент триптофана, серотонина и мелатонина и инициирует выработку нейроактивных и иммунорегулирующих метаболитов, коллективно известных как кинуренины. Путем локального истощения триптофана и увеличения проапоптотических кинуренинов IDO, экспрессирующийся дендритными клетками (DCs), может существенно поражать пролиферацию и выживание Тклеток. Индукция IDO в DCs может быть распространенным механизмом делеционной толерантности,которой управляют регуляторные Т-клетки. Поскольку можно ожидать, что такие толерогенные реакции действуют при разнообразных физиопатологических состояниях, метаболизм триптофана и продуцирование кинуренина могут представлять критический интерфейс между иммунной и нервной системами(Grohmann, et al., 2003, Trends Immunol., 24: 242-8). При состояниях постоянной иммунной активации доступность свободного Trp в сыворотке уменьшается и как результат сниженной выработки серотонина серотонинергические функции также могут быть нарушены (Wirleitner, et al., 2003, Curr. Med. Chem., 10: 1581-91). Интересно, что при введении интерферона- наблюдалась индукция нейропсихиатрических побочных эффектов, таких как депрессивные симптомы и изменения когнитивной функции. Прямое влияние на серотонинергическую нейромедиацию, возможно, способствует таким побочным эффектам. Кроме того, поскольку активация IDO приводит к снижению уровней триптофана, прекурсора серотонина (5 НТ), IDO может играть роль в развитии таких нейропсихиатрических побочных эффектов, уменьшая центральный синтез 5-НТ. К тому же, метаболиты кинуренинов, например 3-гидроксикинуренин (3-OHKYN) и хинолиновая кислота (QUIN) оказывают токсичное действие на функции мозга. 3-OH-KYN может вызывать окислительный стресс, увеличивая выработку реакционноспособных форм кислорода(ROS), и QUIN может вызывать избыточную стимуляцию рецепторов N-метил-O-аспартата (NMDA) в гиппокампе, что приводит к апоптозу и атрофии гиппокампа. Как избыточная выработка ROS, так и атрофия гиппокампа, вызванная избыточной стимуляцией NMDA, связаны с депрессией (Wichers and Maes,2004, J. Psychiatry Neurosci., 29: 11-17). Таким образом, активность IDO может играть роль в механизме депрессии. Созданы низкомолекулярные ингибиторы IDO для лечения или предупреждения связанных с IDO заболеваний, таких как описанные выше. Например, оксадиазол и другие гетероциклические ингибиторыIDO раскрыты в патенте США 2006/0258719 и патенте США 2007/0185165. В публикации РСТ WO 99/29310 раскрыты способы изменения опосредствованного Т-клетками иммунитета, включающие изменение местных внеклеточных концентраций триптофана и метаболитов триптофана, с применением ингибитора IDO, такого как 1-метил-DL-триптофан, п-(3-бензофуранил)-DL-аланин, п-[3-бензо(b) тиенил]DL-аланин и 6-нитро-L-триптофан) (Munn, 1999). В WO 03/087347, также опубликованной как Европейский Патент 1501918, раскрыты способы получения антиген-презентующих клеток для увеличения или уменьшения толерантности Т-клеток (Munn, 2003). Соединения, которые обладают ингибирующей индоламин-2,3-диоксигеназу (IDO) активностью, дополнительно раскрыты в WO 2004/094409; и публикация патентной заявки США 2004/0234623 направлена на способы лечения субъекта с раком или инфекцией путем введения ингибитора индоламин-2,3-диоксигеназы в комбинации с другими схемами лечения. В свете экспериментальных данных, которые указывают на роль IDO в угнетении иммунитета, резистентности и/или отторжении опухоли, хронических инфекциях, ВИЧ-инфекции, СПИДе (в частности,его проявлениях, таких как кахексия, слабоумие и понос), аутоиммунных заболеваниях или расстройствах (таких как ревматоидный артрит) и иммунологической толерантности и предотвращении отторжения эмбриона in utero, желательными являются терапевтические средства, направленные на угнетение разложения триптофана путем ингибирования активности IDO. Ингибиторы IDO могут применяться для активации Т-клеток и, таким образом, усиления активации Т-клеток, когда Т-клетки угнетены беременностью, злокачественным новообразованием или вирусом, например ВИЧ. Ингибирование IDO может также быть важной стратегией лечения для пациентов с неврологическими или нейропсихиатрическими заболеваниями или расстройствами, такими как депрессия. Соединения, композиции и способы в данном описании помогают удовлетворить существующую потребность в модуляторах IDO. Сущность изобретения В данном изобретении предлагаются, в частности, ингибиторы IDO формулы I или их фармацевтически приемлемые соли, где переменные определены в данном описании. В данном изобретении дополнительно предлагается фармацевтическая композиция, содержащая соединение формулы I и по меньшей мере один фармацевтически приемлемый носитель. В данном изобретении дополнительно предлагается способ ингибирования активности индоламин 2,3-диоксигеназы, включающий контакт индоламин-2,3-диоксигеназы (IDO) с соединением формулы I или его фармацевтически приемлемой солью. В данном изобретении дополнительно предлагается способ угнетения иммуносупрессии у пациента, который включает введение указанному пациенту эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В данном изобретении дополнительно предлагается способ лечения рака, вирусной инфекции, депрессии, нейродегенеративного расстройства, травмы, возрастной катаракты, отторжения пересаженного органа или аутоиммунного заболевания у пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В данном изобретении дополнительно предлагается способ лечения меланомы у пациента, который включает введение указанному пациенту терапевтически эффективного количества соединения формулыI или его фармацевтически приемлемой соли. В данном изобретении дополнительно предлагается соединение формулы I или его фармацевтически приемлемая соль для применения в терапии. В данном изобретении дополнительно предлагается применение соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства с целью применения в терапии. В данном изобретении дополнительно предлагаются промежуточные соединения, способы их получения и содержащие их композиции, пригодные для получения соединения формулы F15 В данном изобретении дополнительно предлагаются промежуточные соединения, способы их получения и содержащие их композиции, пригодные для получения соединения формулы F28 Краткое описание фигур Фиг. 1 демонстрирует пример рентгеноструктурной дифрактограммы, характерной для соединения по изобретению, полученного в примере 1; фиг. 2 демонстрирует термограмму DSC, характерную для соединения по изобретению, полученного в примере 1; фиг. 3 демонстрирует характеристику данных ТГА соединения по изобретению, полученного в примере 1. Подробное описание изобретения В данном изобретении предлагаются, среди прочего, ингибиторы IDO формулы I или их фармацевтически приемлемые соли,где R1 представляет собой NH2 или CH3;n равно 1 или 2. В некоторых вариантах R1 представляет собой NH2. В некоторых вариантах R1 представляет собой CH3. В некоторых вариантах R2 представляет собой Cl. В некоторых вариантах R2 представляет собой Br. В некоторых вариантах R2 представляет собой CF3. В некоторых вариантах R2 представляет собой CH3. В некоторых вариантах R2 представляет собой CN. В некоторых вариантах R3 представляет собой Н. В некоторых вариантах R3 представляет собой F. В некоторых вариантах n равно 1. В некоторых вариантах n равно 2. Соединения по данному изобретению могут существовать в различных твердых формах. В данном описании "твердая форма" обозначает твердое вещество, которое характеризуется одним или больше свойствами, например температурой плавления, растворимостью, стабильностью, кристалличностью,гигроскопичностью, содержанием воды, показателями ТГА, показателями DSC, показателями ДСВ, показателями РГАДП и т.п. Формы твердых веществ, например, могут быть аморфными, кристаллическими, или могут быть смесями указанных компонентов. Различным кристаллическим твердым формам обычно свойственные разные кристаллические решетки (например, единичные ячейки) и, обычно в результате этого, разные физические свойства. В некоторых случаях разные кристаллические твердые формы содержат разное количество воды или растворителя. Разные кристаллические решетки могут быть идентифицированы методами описания твердого состояния, такими как рентгеноструктурный анализ дифракции порошка (РГАДП). Другие способы описания, такие как дифференциальная сканирующая калориметрия (DSC), термогравиметрический анализ(ТГА), динамическая сорбция паров (ДСВ) и подобные дополнительно помогают идентифицировать твердую форму, а также помогают определить стабильность и содержание растворителя/воды. В одном из аспектов данного изобретения предлагаются различные твердые формы 4-(2[(аминосульфонил)амино]этиламино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида (см. пример 1). В некоторых вариантах твердая форма представляет собой кристаллическое твердое вещество. В некоторых вариантах твердая форма является в существенной мере безводной (например, содержит менее чем приблизительно 1% воды, менее чем приблизительно 0,5% воды, менее чем приблизительно 1,5% воды, менее чем приблизительно 2% воды). В некоторых вариантах твердая форма характеризуется температурой плавления или эндотермой DSC, центрированной в интервале от приблизительно 162 до приблизительно 166C. В некоторых вариантах твердая форма характеризуется температурой плавления или эндотермой DSC, центрированной при приблизительно 164C. В некоторых вариантах твердая форма демонстрирует в существенной мере такую же термограмму DSC, как показано на фиг. 2. В других вариантах на РГАДП твердой формы присутствуют по меньшей мере один, два или три пика в единицах 2-тета, выбранных из приблизительно 18,4, приблизительно 18,9, приблизительно 21,8, приблизительно 23,9, приблизительно 29,2 и приблизительно 38,7. В других вариантах твердая форма демонстрирует в существенной мере такой же характер РГАДП, как показано на фиг. 1. В данном изобретении дополнительно предлагается композиция, содержащая твердую форму 4-(2[(аминосульфонил)амино]этиламино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида (см. пример 1). Композиция может содержать по меньшей мере приблизительно 50, по меньшей мере приблизительно 75, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95 или по меньшей мере приблизительно 99 мас.% твердой формы. Композиция может также содержать фармацевтически приемлемое вспомогательное вещество. В некоторых вариантах твердая форма является в существенной мере очищенной. Характер РГАДП отображения (пики) обычно считается "отпечатком пальцев" конкретной кристаллической формы. Хорошо известно, что относительная интенсивность пиков РГАДП может широко варьировать в зависимости от, среди прочего, техники изготовления образца, распределения размера кристаллов, различных применяемых фильтров, методики монтажа образца и конкретного использованного прибора. В некоторых случаях могут наблюдаться новые пики или существующие пики могут исчезать в зависимости от вида прибора или установленных параметров. В данном описании термин "пик" обозначает отображение с относительной высотой/интенсивностью по меньшей мере приблизительно 4% от максимальной высоты/интенсивности пика. Кроме того, инструментальная вариация и другие факторы могут влиять на значение 2-тета. Поэтому отнесения пиков, например, приведенные в данном описании, могут варьировать в пределах приблизительно 0,2 (2-тета), и термин "в существенной мере" в контексте РГАДП в данном описании предназначен охватывать вышеприведенные вариации. Таким же образом, значения температуры в связи с DSC, ТГА или другими термическими экспериментами могут варьировать в пределах приблизительно 3C в зависимости от прибора, конкретных параметров прибора, способа подготовки образцов и т.п. Соответственно, если кристаллическая форма,приведенная в данном описании, демонстрирует термограмму DSC, "в существенной мере такую же",как показано на любом из чертежей, это предусматривает включение данной вариации. В разных местах данного описания заместители соединений по изобретению могут быть раскрыты в группах или в интервалах. Конкретно предусматривается, что изобретение включает каждую и любую индивидуальную подкомбинацию членов таких групп и интервалов. Предусматривается, что соединения по изобретению являются стабильными. В данном описании"стабильный" обозначает соединение, которое является достаточно устойчивым, чтобы выдержать выделение до пригодной степени чистоты из реакционной смеси, и предпочтительно пригодное к введению в рецептуру эффективного терапевтического средства. Дополнительно предусматривается, что некоторые признаки изобретения, которые с целью ясности описаны в контексте отдельных вариантов, могут также быть приведены в комбинации в одном и том же варианте. С другой стороны, различные признаки изобретения, которые с целью краткости описаны в контексте одного и того же варианта, могут также быть приведены отдельно или в какой-либо подходящей подкомбинации. Дополнительно предусматривается, что соединения по изобретению включают все возможные геометрические изомеры. цис-и транс-Геометрические изомеры соединений по данному изобретению описаны и могут быть выделены как смесь изомеров или как отделенные изомерные формы. Предусматривается, что связь, представленная в структурной формуле волнистой линией "", показывает, что структура представляет цис- или транс-изомер, либо смесь цис- и транс-изомеров в любом соотношении. Соединения по изобретению также включают таутомерные формы. Таутомерные формы образуются в результате миграции одинарной связи и смежной двойной связи с сопутствующей миграцией протона. Соединения по изобретению могут также включать все изотопы атомов, присутствующих в промежуточных соединениях или конечных соединениях. Изотопы включают атомы с таким же атомным числом, но разной массой. Например, изотопы водорода включают тритий и дейтерий. В некоторых вариантах соединения по изобретению и их соли являются в существенной мере выделенными. "В существенной мере выделенный" означает, что соединение, по меньшей мере, частично или в существенной мере выделено из окружения, в котором оно было образовано или найдено. Частичное выделение может включать, например, композицию, обогащенную соединением по изобретению. Существенное выделение может включать композиции, содержащие по меньшей мере приблизительно 50, по меньшей мере приблизительно 60, по меньшей мере приблизительно 70, по меньшей мере приблизительно 80, по меньшей мере приблизительно 90, по меньшей мере приблизительно 95, по меньшей мере приблизительно 97 или по меньшей мере приблизительно 99 мас.% соединения по изобретению или его соли. Способы выделения соединений и их солей шаблонно описаны в уровне техники. Данное изобретение также включает соли соединений, описанных в данном описании. В данном описании "соли" обозначают производные раскрытых соединений, где начальное соединение модифицировано путем превращения существующего кислотного или основного фрагмента в его солевую форму. Примеры солей включают, не ограничиваясь ими, соли минеральных кислот (например, HCl, HBr,H2SO4) или органических кислот (например, уксусная кислота, бензойная кислота, трифторуксусная кислота) и основных остатков, таких как амины; соли щелочного металла (например, Li, Na, K, Mg, Ca) или органического основания (например, триалкиламмоний) и кислотных остатков, таких как карбоновые кислоты; и т.п. Соли по данному изобретению могут быть синтезированы из начального соединения, которое содержит основной или кислотный фрагмент, традиционными химическими способами. В целом,такие соли могут быть получены реакцией свободной кислоты или основания указанных соединений со стехиометрическим количеством соответствующего основания или кислоты в воде или в органическом растворителе, или в смеси двух растворителей; в целом неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил (ACN), являются предпочтительными."Фармацевтически приемлемые соли" по данному изобретению включают подмножество "солей",описанных выше, которые представляют собой традиционные нетоксичные соли начального соединения,образованные, например, с нетоксичными неорганическими или органическими кислотами. Перечни пригодных солей можно найти у Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company,Easton, Pa., 1985, p. 1418 и Journal of Pharmaceutical Science, 66, 2 (1977), каждая из которых включена в данное описание путем ссылки во всей ее полноте. Фраза "фармацевтически приемлемый" используется в данном описании для обозначения таких соединений, материалов, композиций и/или лекарственных форм, которые являются, в пределах контекста звукового медицинского диагноза, пригодными для применения в контакте с тканями человеческого существа и животных без избыточной токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, с рациональным соотношением пользы/риска. Методы синтеза. Соединения по данному изобретению могут быть получены различными путями, известными специалисту в области органического синтеза. Соединения по данному изобретению могут быть синтезированы с применением описанных ниже способов, вместе с синтетическими методами, известными из уровня техники в области синтетической органической химии или их вариаций, как будет понятно специалистам в данной области. Соединения по данному изобретению могут быть получены из легкодоступных начальных материалов, с использованием следующих общих способов и методик. Следует понимать, что в случае указания типичных или предпочтительных условий (т.е. температура реакции, длительность реакции, молярное соотношение реагентов, растворители, давление и т.п.) способа получения, могут также быть использованы другие условия процесса, если не указано противоположное. Оптимальные условия реакции могут варьировать для конкретных используемых реагентов или растворителей, но такие условия могут быть определены специалистом в данной области шаблонными методами оптимизации. Контроль процессов, описанных в данном описании, может быть осуществлен в соответствии с любым пригодным способом, известным из уровня техники. Например, образование продукта может контролироваться спектроскопическими средствами, например спектроскопия ядерного магнитного резонанса (например, 1 Н или 13 С), спектроскопия в инфракрасной области, спектрофотомерия (например, в видимой или УФ-области) или масс-спектрометрия; или хроматографическими методами, например высокоэффективная жидкостная хроматография (ВЕРХ) или тонкослойная хроматография. Соединения,полученные в ходе реакций, могут быть очищены любым пригодным способом, известным из уровня техники. Например, хроматография ВЭЖХ (среднее давление) на подходящем адсорбенте (например,силикагель, кремния диоксид и т.п.), или препаративная тонкослойная хроматография; дистилляция/сублимация, растирание или перекристаллизация. Получение соединений может включать введение и удаление защитных групп для различных химических групп. Потребность во введении и удалении защитной группы, а также выбор соответствующих защитных групп может быть легко осуществлен специалистом в данной области. Химия защитных групп описана, например, в Wuts and Greene, Greene's Protective Groups in Organic Synthesis, 4th Ed., John WileySons: New York, 2006, которая включена в данное описание путем ссылки во всей ее полноте. Реакции способов, описанных в данном описании, могут осуществляться в подходящих растворителях, которые могут быть легко выбраны специалистом в области органического синтеза. Подходящие растворители могут в существенной мере не реагировать с начальными материалами (реагентами), промежуточными соединениями или продуктами при температурах, при которых осуществляются реакции,т.е. температурах, которые могут варьировать от температуры замерзания растворителя до температуры кипения растворителя. Реакция получения может быть осуществлена в растворителе или смеси более чем одного растворителя. В зависимости от стадии реакции может быть выбран подходящий растворитель(и) для конкретной указанной стадии реакции. Подходящие растворители включают воду, алканы (например, пентан, гексан, гептан, циклогексан и т.п. или смесь указанных растворителей), ароматические растворители (например, бензол, толуол, ксилен и т.п.), спирты (например, метанол, этанол, изопропанол и т.п.), эфиры (например, диалкиловые эфиры, трет-бутилметиловый эфир (МТБЭ), тетрагидрофуран(ГМФА) и N-метилпирролидон (NMP). Такие растворители могут применяться в водных или безводных формах. Разделение рацемических смесей соединений может быть осуществлено любым из многочисленных способов, известных из уровня техники. Пример способа включает фракционную перекристаллизацию с использованием "хиральной разделяющей кислоты", которая представляет собой оптически активную органическую кислоту, образующую соль. Подходящие разделяющие агенты для способов фракционной перекристаллизации представляют собой, например, оптически активные кислоты, например формы D- иL-винной кислоты, диацетилвинной кислоты, дибензоилвинной кислоты, миндальной кислоты, яблочной кислоты, молочной кислоты или различных оптически активных сульфокамфорных кислот. Разделение рацемических смесей может также быть осуществлено элюацией на колонке, заполненной оптически активным разделяющим агентом (например, динитробензоилфенилглицином). Подходящий состав смеси растворителей для элюации может быть определен специалистом в данной области. Соединения по изобретению могут быть получены, например, с использованием реакционных путей и способов, описанных ниже. Способы и промежуточные соединения по данному изобретению пригодны для получения ингибиторов IDO. Общая схема получения соединений F15 по изобретению показана на схеме 1. Схема 1 Обращаясь к схеме 1, в изобретении предлагается способ получения соединений формулы F15 или их солей, где R2 представляет собой Cl, Br, CF3, CH3 или CN; R3 представляет собой Н или F и n равно 1 или 2, путем реакции соединения формулы F13 или ее солей, где Pg1 представляет собой защитную группу для аминогруппы, с реагентом для удаления защитной группы с аминогруппы (стадия М), с получением соединения формулы F14 или его соли; и реакции соединения формулы F14 с основанием (стадияN), с получением соединения формулы F15. Соединение формулы F15 может быть очищено растиранием или перекристаллизацией с использованием таких растворителей, как, например, вода, этанол, МТБЭ или их комбинация. В некоторых вариантах R2 представляет собой Br, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой Br, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой Cl, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой Cl, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой Н и n равно 1. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой Н и n равно 2. В некоторых вариантах R2 представляет собой CN, R3 представляет собой F и n равно 1. Защитные группы для аминогруппы регулярно применяются в органическом синтезе для предупреждения нежелательных реакций аминогруппы при осуществлении целевого превращения. Защитные группы для аминогруппы позволяют легко осуществить ковалентное присоединение к атому азота, а также селективное отщепление от атома азота. Разнообразные защитные группы для аминогруппы, широко классифицированные как алкоксикарбонил (например, этоксикарбонил, трет-бутоксикарбонил(Boc), бензилоксикарбонил (Cbz), 9-флуоренилметилоксикарбонил (Fmoc) и т.п.), ацил (например, ацетил (Ас), бензоил (Bz) и т.п.), сульфонил (например, метансульфонил, трифторметансульфонил и т.п.),арилалкил (например, бензил, дифенилметил, трифенилметил (тритил и т.п.), алкенилалкил (например,аллил, пренил и т.п.), диарилметиленил (например, (C6H5)2C=N и т.п.) и силил (например, третбутилдиметилсилил, триизопропилсилил и т.п.), известные специалисту в данной области. Химия защитных групп для аминогруппы описана в Wuts and Greene, Greene's Protective Groups in Organic Synthesis,4th Ed., p. 696-926, John WileySons: New York, 2006. В некоторых вариантах Pg1 может представлять собой алкоксикарбонил (например, трет-бутоксикарбонил). Защитные группы для аминогруппы, описанные выше, могут быть подходящим образом удалены с использованием многочисленных доступных реагентов для удаления защитной группы с аминогруппы,которые являются специфическими для разных групп, упомянутых выше, без воздействия на другие целевые фрагменты соединения. Группа трет-бутоксикарбонил может быть отщеплена (например, гидролизом) от атома азота, например, обработкой кислотой (например, трифторуксусной кислотой, толуолсульфоновой кислотой, хлористо-водородной кислотой и т.п.); комбинацией реагентов (например, смесь хлорангидрида уксусной кислоты и метанолы), которая, как известно, образует кислоту; или кислотой Льюиса (например, BF3Et2O). Группа бензилоксикарбонил может быть отщеплена (например, гидрогенолизом) от атома азота, например, обработкой водородом и катализатором (например, палладий-на-угле). В некоторых вариантах реагент для удаления защитной группы с аминогруппы может быть трифторуксусной кислотой. В некоторых вариантах реагент для удаления защитной группы с аминогруппы содержит трифторуксусную кислоту и 0,5 об.% воды, например 1,0 об.% воды, 1,5 об.% воды, 2,0 об.% воды,от приблизительно 2 до приблизительно 10 об.% воды, от приблизительно 10 до приблизительно 20 об.% воды или от приблизительно 20 до приблизительно 50 об.% воды. В некоторых вариантах реагент для удаления защитной группы с аминогруппы может быть смесью трифторуксусной кислоты и воды в объемном соотношении приблизительно 98:2. В некоторых вариантах реагент для удаления защитной группы с аминогруппы может быть хлористо-водородной кислотой, необязательно в растворителе (например,вода, ТГФ или диоксан). В таких вариантах хлористо-водородная кислота может быть прибавлена в концентрации приблизительно 4 н., например приблизительно 1, приблизительно 2, приблизительно 3, приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9 или приблизительно 10 н. В некоторых вариантах удаление защитной группы можно осуществлять в спирте (например,изопропанол). В некоторых вариантах стадию М (схема 1) можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Основание может использоваться для превращения (например, гидролизом) оксадиазолонового кольца в F14, чтобы открыть амидоксим в F15, необязательно в растворителе (стадия N, схема 1). Защита амидоксима в форме оксадиазолона может быть подходящей для предупреждения побочных реакций гидроксильной группы или амидоксима в целом. Основание может быть или органическим основанием,например ациклическим амином (например, триэтиламин, диизопропилэтиламин (ДИПЭА) и т.п.), или циклическим амином (например, пирролидин, пиперидин и т.п.); или неорганическим основанием, например щелочью (например, NaOH, LiOH, KOH, Mg(OH)2 и т.п.). Основание может быть сделано доступным в форме смолы (например, Amberlite и т.п.). В некоторых других вариантах основание может присутствовать в форме раствора в воде, например приблизительно 2 н. раствора (например, приблизительно 0,5 н. раствора, приблизительно 1 н. раствора, приблизительно 1,5 н. раствора, приблизительно 2,5 н. раствора, от приблизительно 3 до приблизительно 5 н. раствора, от приблизительно 5 до приблизительно 10 н. раствора). В некоторых вариантах основание представляет собой гидроксид щелочного металла (например, гидроксид натрия). В некоторых вариантах основание может представлять собой 2 н. раствор NaOH в воде. В некоторых вариантах растворитель может быть метанолом или тетрагидрофураном (ТГФ). В некоторых вариантах стадию N (схема 1) можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. На стадии L (схема 1) соединение формулы F13 может быть получено путем обработки соединения формулы F12 или его соли Pg1-NH-сульфонилхлоридом, необязательно в растворителе, с последующей обработкой полученной смеси органическим основанием, с получением соединения формулы F13. В ходе указанной стадии L (схема 1) первичный амин F12 превращается в сульфонилмочевину F13 с использованием защищенного амино-сульфонилхлорида(Pg1-NH-SO2Cl). Защищенный аминосульфонилхлорид может быть получен и немедленно использован в реакции с F12. Защитная группа может быть выбрана как любая из защитных групп, известных из уровня техники для защиты аминов или сульфонамидов (выше). В некоторых вариантах Pg1 может быть алкоксикарбонильной группой (например, трет-бутоксикарбонил). В таких вариантах алкоксикарбонил NH-сульфонилхлорид может быть получен реакцией спирта (например, этанол, трет-бутиловый спирт и т.п.) с хлорсульфонилизоцианатом(ClS(О)2NCO). Подходящие растворители для этой реакции включают, не ограничиваясь ими, галогенированные растворители, например дихлорметан и т.п. Органическое основание может быть любым основанием, которое служит для нейтрализации HCl, образованного в ходе реакции первичного амина, например F12, и защищенного аминосульфонилхлорида. Органическое основание может включать ациклические третичные амины, например три(C1-6)алкиламин (например, триэтиламин, диизопропилэтиламин(ДИПЭА) и т.п.), циклические третичные амины (например, N-метилпиперидин, 1,4 диазабицикло[2.2.2]октан (ДАБЦО) и т.п.). В некоторых вариантах органическим основанием может быть триэтиламин. В некоторых вариантах данную стадию можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C,от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Органические соединения могут быть восстановлены до низшей степени окисления с использованием восстанавливающих агентов. Восстановление обычно включает добавление атомов водорода или удаление атомов кислорода из группы. Органические азиды, например F11, могут быть восстановлены до аминов, например F12 (стадия K, схема 1), добавлением водорода, в форме элементарного водорода или с использованием гидридного реагента (например, NaBH4, LiAlH4 и т.п.); с использованием трифенилфосфина; или с использованием комбинации натрия йодида, хлортриметилсилана и метанола. В некоторых вариантах соединение формулы F12 может быть получено восстановлением соединения формулыF11 или его соли. В некоторых вариантах восстановление можно осуществлять в присутствии йодида натрия, хлортриметилсилана и метанола. В некоторых вариантах молярное соотношение йодида натрия и хлортриметилсилана может составлять приблизительно 1,0, например приблизительно 0,9, приблизительно 0,95, приблизительно 1,0, приблизительно 1,05 или приблизительно 1,1. В некоторых вариантах хлортриметилсилан может быть прибавлен к смеси F11, йодида натрия и метанола как раствор в метано-8 022669 ле. В некоторых вариантах стадию K (схема 1) можно осуществлять при приблизительно комнатной температуре, например от приблизительно 10 до приблизительно 50C, от приблизительно 15 до приблизительно 40C, от приблизительно 20 до приблизительно 30C или от приблизительно 25 до приблизительно 30C. Аминные соединения F12 в некоторых случаях может быть сложно получить в существенной мере чистой форме по данным ВЭЖХ или ЯМР-спектроскопии и т.п. Без намерения связываться с теорией,считается, что некоторые из указанных аминов, возможно, сложно очищать хроматографией на силикагеле из-за увеличения высокого сродства по отношению к силикагелю или из-за нежелательного разложения в ходе очистки. В таких вариантах обращаясь к схеме 2, соединение формулы F12 может быть очищено путем реакции соединения формулы F12 с защитным агентом для аминогруппы, с получением соединения формулы F12' или его соли, где Pg2N представляет собой защищенный амин. За введением защиты (стадия K') может следовать очистка соединения формулы F12' с получением очищенного соединения формулы F12', и реакция очищенного соединения формулы F12' с агентом для удаления защитной группы с аминогруппы (стадия K"), с получением очищенного соединения формулы F12. Защитные агенты для аминогруппы и агенты для удаления защитной группы с аминогруппы известны специалисту в данной области, например, из Wuts и Greene (там же). В некоторых вариантах защитный агент для аминогруппы представляет собой ди-трет-бутилдикарбонат (Boc2O). В таких вариантах Pg2N представляет собой трет-бутоксикарбонил-NH. В таких вариантах реагент для удаления защитной группы с аминогруппы представляет собой реагент, пригодный для удаления защитной группы Boc (выше). В таких вариантах реагент для удаления защитной группы с аминогруппы представляет собой кислоту (например,хлористо-водородная кислота, трифторуксусная кислота т.п.), необязательно в растворителе (например,вода, ТГФ или диоксан). В некоторых вариантах хлористо-водородная кислота может быть прибавлена в концентрации приблизительно 4 н., например приблизительно 1, приблизительно 2, приблизительно 3,приблизительно 5, приблизительно 6, приблизительно 7, приблизительно 8, приблизительно 9 или приблизительно 10 н. В некоторых вариантах снятия защиты можно осуществлять в спирте (например, изопропанол). В некоторых вариантах стадию K' или K" можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Подходящие способы очистки известны специалисту в данной области и могут включать хроматографию, кристаллизацию, сублимацию и т.п. В некоторых вариантах очистку можно осуществлять хроматографией на силикагеле. В целом чистоту соединений определяют физическими способами, например измерением температуры плавления (в случае твердого вещества), получения ЯМР-спектра или разделения методом ВЭЖХ. Если температура плавления снижается, если нежелательные сигналы в ЯМР-спектре уменьшены или если внешние пики на хроматограмму ВЭЖХ удалены, соединение можно назвать очищенным. В некоторых вариантах соединения являются в существенной мере очищенными. Схема 2 В некоторых вариантах соединение формулы F11 (схема 1) может быть получено путем обработки соединения формулы F10 или его соли, где L1 может быть выбран из алкилсульфонила (например, метансульфонил), галогеналкилсульфонила (например, трифторметансульфонил), арилсульфонила (например, толуолсульфонил) и т.п.; с азидным реагентом, с получением соединения формулы F11 (стадия J). В некоторых вариантах L1 представляет собой алкилсульфонил. Азидные реагенты включают любой реагент, способный к продуцированию нуклеофильного иона азида. Примеры азидных реагентов включают азиды щелочных металлов (например, азид натрия, азид калия и т.п.). В некоторых необязательных вариантах азидный реагент, например азид натрия, может использоваться в комбинации с йодидом натрия. Пригодными растворителями для такого превращения являются полярные растворители, в том числе ДМФА, ДМСО, NMP и т.п. В некоторых вариантах стадию J можно осуществлять в ДМФА. Стадию J можно осуществлять при повышенной температуре, например от приблизительно 40 до приблизительно 100C, от приблизительно 50 до приблизительно 90C или от приблизительно 60 до приблизительно 80C. В некоторых вариантах стадию J можно осуществлять приблизительно при 50C. В некоторых вариантах стадию J можно осуществлять приблизительно при 85C. Соединение формулы F10 или его соль может быть получено в результате последовательности стадий, показанных на схеме 3. Получение промежуточного соединения, 4-амино-N'-гидрокси-1,2,5 оксадиазол-3-карбоксимидамида F2 описано в J. Heterocycl. Chem. (1965), 2, 253, которая включена в данное описание путем ссылки во всей ее полноте, и его превращение в хлороксим F3 описано в Synth.Commun. (1988), 18, 1427, которая включена в данное описание путем ссылки во всей ее полноте. Амины(например, первичные или вторичные амины, в том числе амины, которые содержат защищенную функциональную группу, например этиламин, 2-метоксиэтиламин или диметиламин) могут сочетаться с хлороксимом F3, необязательно в растворителе (например, этилацетате), со следующим добавлением органического основания (например, триэтиламина или ДИПЭА, для гашения HCl, образующегося в ходе реакции), с получением амидоксима соединения F4. Реорганизация таких соединений, как F4, с целью перемещения аминогруппы на кольцевой атом углерода и аминогруппы на атом углерода оксима, с получением соединений F5, может быть осуществлена обработкой F4 основанием (например, KOH, NaOH,LiOH, Mg(OH)2, Al(OH)3 и т.п.), необязательно в растворителе (например, вода, этанол, этиленгликоль и т.п.), и кипячением реакционной смеси с обратным холодильником при повышенной температуре, например приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130, приблизительно 140, приблизительно 150, приблизительно 160, приблизительно 170, приблизительно 180, приблизительно 190 или приблизительно 200C. Амидоксим F5 может быть активирован снова как хлороксим F6 добавлением F5 к кислой водной смеси,содержащей хлористо-водородную кислоту и, необязательно, уксусную кислоту. В этом способе превращения F5 на F6, кислая смесь F5 может быть нагрета до температуры приблизительно 45C, например приблизительно 30, приблизительно 40, приблизительно 50 или приблизительно 60C, для растворения. Хлорид натрия может быть прибавлен к полученному раствору, а затем обработан нитритным реагентом,который может необязательно присутствовать как водный раствор, при температуре ниже приблизительно 0C, например ниже приблизительно -10, ниже приблизительно -5, ниже приблизительно 5 или ниже приблизительно 10C. Нитритный реагент способен образовывать нитрит-анион. Нитритные реагенты включают нитрит щелочного металла (например, нитрит натрия, нитрит калия и т.п.) и органический нитрит (например, тетраэтиламмония нитрит), который включает органический катион. В некоторых вариантах этилацетат, ТГФ или диоксан может использоваться как сорастворитель. Хлороксим F6 может сочетаться с ароматическими аминами, например производными анилина, необязательно в полярном растворителе (например, метанол, вода, этанол и т.п.) при повышенной температуре, например приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90, приблизительно 100, приблизительно 110 или приблизительно 120C, необязательно в присутствии неорганического основания (например, KHCO3, NaHCO3), с получением ариламидоксима F7. В некоторых вариантах неорганическое основание может присутствовать в форме водного раствора. В некоторых вариантах неорганическое основание может быть прибавлено к реакционной смеси при повышенной температуре. Функциональная группа амидоксим F7 далее может быть защищена как оксадиазолон с использованием 1,1'-карбонилдиимидазолов (КДИ) в растворителе (например, этилацетат, диоксан, ТГФ и т.п.) при повышенной температуре, например приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90 или приблизительно 100C. Метоксигруппа F8 далее может быть преобразована в гидроксильную группу в F9 с использованием агента для удаления защитной группы с метоксигруппы, известного специалисту в данной области, например, см. Wuts and Greene, Greene's ProtectiveGroups in Organic Synthesis, 4th Ed., p. 24-30, John WileySons: New York, 2006. Например, добавлением трибромида бора к холодному (например, от приблизительно -78 до приблизительно 25C, например от приблизительно -78 до приблизительно 10C, от приблизительно -78 до приблизительно 0C, от приблизительно -78 до приблизительно -10C, от приблизительно 0 до приблизительно 25C или от приблизительно 0 до приблизительно 10C) раствору F8, необязательно в растворителе, например галогенированном растворителе (например, ДХМ, хлороформ и т.п.) или этилацетате. Первичная гидроксильная группа в F9 далее может быть активирована как группа L1O- (см. F10), которая уходит последовательной обработкой L1C1, необязательно в растворителе (например, этилацетат или ДХМ), и органическим основанием, чтобы нейтрализовать образованный HCl (например, триэтиламин или ДИПЭА). L1, например, может быть выбран из алкилсульфонила (например, метансульфонил), галогеналкилсульфонила (например,трифторметансульфонил), арилсульфонила (например, толуолсульфонил) и т.п. Соединение F10 далее может быть обработано каким-либо нуклеофилом для вытеснения (например, по механизму SN2) группы Альтернативно, соединение формулы F12 может быть получено в результате последовательности стадий, изображенных на схеме 4. Схема 4 Обращаясь к схеме 4, в некоторых вариантах соединение формулы F12 может быть получено путем реакции соединения формулы F24 или его соли, где Pg3N представляет собой защищенный амин (например, (С 6 Н 5)3 С-NH, (C6H5)2C=N и т.п.); с агентом для удаления защитной группы с аминогруппы, с получением соединения формулы F12. Обработка соединения F24 с целью замены Pg3N на NH2 (стадия Q) может быть осуществлена способами удаления защитной группы с конкретного амина, известными специалисту в данной области, например, описанными в Wuts and Greene, Greene's Protective Groups in Organic Synthesis, 4th Ed., p. 696-926, John WileySons: New York, 2006. В некоторых вариантах если Pg3N представляет собой (C6H5)2C=N, агент для удаления защитной группы может представлять собой кислоту, например органическую кислоту (например, трифторуксусная кислота, метансульфоновая кислота и т.п.) или неорганическую кислоту (например, хлористо-водородная кислота); водород и палладий; или кислотный гидроксиламин (NH2OH). В некоторых вариантах если Pg3N представляет собой -(С 6 Н 5)3 СNH, агент для удаления защитной группы может включать органическую кислоту (например, метансульфоновая кислота, трифторуксусная кислота и т.п.) и необязательно органическое соединение силана; водород и палладий; или натрий в нашатырном спирте. Органические соединения силана представляют собой соединения, которые содержат по меньшей мере одну связь Si-H, и остальные группы, присоединенные к кремнию, представляют собой алкил, арил или их комбинацию. Примеры органических соединений силана включают триалкилсилан (например, три(изопропил)силан, триарилсилан (например,трифенилсилан) или дифенилметилсилан. Стадию Q можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Соединения F24, которые представляют собой защищенные вторичные амины, могут быть получены реакцией Мицунобу спиртов F25 с защищенными первичными аминами F22 в присутствии реагента сочетания (стадия Р). Реагент сочетания может быть комбинацией третичного фосфина, такого как триарилфосфин (например, трифенилфосфин), или триалкилфосфина (например, трибутилфосфин) и диалкилазодикарбоксилата. Диалкилазодикарбоксилаты имеют общую структуру ROOC-N=N-COOR, где R может быть алкильной группой (например, диизопропилазодикарбоксилат, диэтилазодикарбоксилат или ди-п-хлорбензилазодикарбоксилат). Без намерения связываться с теорией, считается, что защита аминогруппы с помощью трифторацетильного фрагмента (например, в F22) предупреждает побочные реакции и улучшает выход вторичного амина F24. Гидроксильная группа спиртов, например F25, может быть активирована в присутствии реагента сочетания. Аминный нуклеофил может вытеснять активированную гидроксильную группу с образованием вторичного амина. Реакцию Мицунобу можно осуществлять в растворителе, например эфире, таком как ТГФ, диоксан, диалкиловый эфир и т.п.; галогенированных растворителях, например дихлорметане, хлороформе и т.п.; неполярных растворителях, например бензоле, толуоле и т.п.; полярных апротонных растворителях, например ДМФА, ГМФА и т.п. В некоторых вариантах соединение формулы F24 может быть получено путем обработки соединения формулы F22 или его соли соединением формулы F25 или его солью и реагентом сочетания с получением соединения формулы F24. В некоторых вариантах эту стадию можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Соединения F22 могут быть получены в ходе двухстадийного способа (стадии G' и О) из соединений F21. Соединения F21 могут быть обработаны 1,1'-карбонилдиимидазолом (КДИ), необязательно в растворителе (например, этилацетате или ТГФ), при повышенной температуре, например приблизительно 50C, например приблизительно 60, приблизительно 65, приблизительно 70, приблизительно 80 или приблизительно 90C, для превращения амидоксима в соединениях F21 в оксадиазолон, присутствующий в соединениях F26. Указанные соединения F26, в свою очередь, могут быть обработаны ангидридом трифторуксусной кислоты, необязательно в растворителе (например, ДХМ, ТГФ, диоксане или этилацетате) в присутствии органического основания (например, пиридин, триэтиламин, ДИПЭА и т.п.), с получением соединений F22. В некоторых вариантах соединение формулы F22 может быть получено путем обработки соединения формулы F21 или его соли карбонилдиимидазолом (КДИ) с образованием соединения формулы F26 или его соли, с последующей обработкой соединения формулы F26 ангидридом трифторуксусной кислоты, с получением соединения формулы F22. Схема 5 Обращаясь к схеме 5 (стадия Р') и базируясь на упомянутом выше описании реакции Мицунобу, в другом аспекте изобретения предлагается способ получения соединений формулы F8 или их солей, гдеR2, R3 и n определены в данном описании, который включает реакцию соединения формулы F22 или его соли и соединения формулы F25' или его соли с реагентом сочетания, необязательно в растворителе (например, ТГФ, диалкиловый эфир или дихлорметан) с образованием соединения формулы F8. В некоторых вариантах эту стадию можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Схема 6 На схеме 6 показан альтернативный путь введения сульфонамидной группы в аминное соединениеF12. Обработка F12 сульфамидом в присутствии основания (стадия R), например органического основания, которое может представлять собой гетероциклическое основание (например, пиридин) или триалкиламин (например, триэтиламин, ДИПЭА и т.п.), каждое из которого необязательно может использоваться как растворитель для данного превращения, может давать сульфонилмочевину, например F14. Указанную реакцию можно осуществлять при повышенной температуре, например приблизительно 130C, например приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130 или приблизительно 140C. Такое нагревание может быть с успехом применено с использованием облучения микроволнами. Облучение микроволнами можно осуществлять в коммерческой микроволновой печи (например, Initiator 3 от Biotage) с одним режимом работы. Из соединений F14, которые содержат оксадиазолоновое кольцо, может быть удалена защитная группа (например, гидролизом) с образованием целевых амидоксимов F15 в присутствии основания (стадия N'). Основание может быть или органическим осно- 12022669 ванием, например ациклическим амином (например, триэтиламин, диизопропилэтиламин (ДИПЭА) и т.п.) или циклическим амином (например, пирролидин, пиперидин и т.п.); или неорганическим основанием, например щелочью (например, NaOH, LiOH, KOH, Mg(OH)2 и т.п.). Основание может быть сделано доступным в форме смолы (например, Amberlite и т.п.). В некоторых других вариантах основание может присутствовать в форме раствора в воде, например приблизительно 2 н. раствора (например, приблизительно 0,5 н. раствора, приблизительно 1 н. раствора, приблизительно 1,5 н. раствора, приблизительно 2,5 н. раствора, от приблизительно 3 до приблизительно 5 н. раствора, от приблизительно 5 до приблизительно 10 н. раствора). В некоторых вариантах основание может быть гидроксидом щелочного металла(например, гидроксидом натрия). В некоторых вариантах основание может быть 2 н. раствором NaOH в воде. В некоторых вариантах растворитель может быть метанолом или тетрагидрофураном (ТГФ). В некоторых вариантах удаление защитной группы можно осуществлять при температуре от приблизительно-10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Таким образом, в данном аспекте изобретения предлагается способ получения соединений формулы F15 или их солей, где R2, R3 и n являются такими, как определено в данном описании, который включает реакцию соединения формулы F12 или его соли с сульфамидом и органическим основанием с образованием соединения формулы F14 или его соли, и реакцию соединения формулы F14 или его соли с основанием с получением соединения формулы F15. В данном изобретении дополнительно предлагается соединение формулы F9, F12 и F14 или его соль, где R2 представляет собой Cl, Br, CF3, CH3 или CN; R3 представляет собой Н или F и n равно 1 или 2. В некоторых вариантах R2 представляет собой Br, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой Br, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой Cl, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой Cl, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой F и n равно 2. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой Н и n равно 1. В некоторых вариантах R2 представляет собой CF3, R3 представляет собой Н и n равно 2. В некоторых вариантах R2 представляет собой CH3, R3 представляет собой F и n равно 1. В некоторых вариантах R2 представляет собой CN, R3 представляет собой F и n равно 1. Схема 9 Соединение F28 может быть получено, как описано на схеме 9. Хлороксим F6 (схема 1, выше) может сочетаться с гетероциклическими аминами (например, соединение формулы F38), необязательно в полярном растворителе (например, метанол, вода, этанол и т.п.), в присутствии основания, например неорганического основания или органического основания (например, Et3N, пиридин или ДИПЭА), с получением ариламидоксима F36 (стадия F"). В некоторых вариантах превращение F6 в F36 можно осуществлять при таких температурах, как, например, приблизительно 10, приблизительно 20, приблизительно 30, приблизительно 40, приблизительно 50, приблизительно 60 или приблизительно 90C. В некоторых вариантах неорганическое основание может присутствовать в форме водного раствора. В некоторых вариантах неорганическое основание может быть прибавлено к реакционной смеси при повышенной температуре. Амидоксимовая функциональная группа F36 далее может быть защищена как оксадиазолон с использованием 1,1'-карбонилдиимидазолов (КДИ) в растворителе (например, этилацетате, диоксане,- 13022669 ТГФ и т.п.) при повышенной температуре, например приблизительно 50, приблизительно 60, приблизительно 70, приблизительно 80, приблизительно 90 или приблизительно 100C (стадия G"). Метоксигруппа F35 далее может быть преобразована в гидроксильную группу в F34 способами, известными специалисту в данной области для удаления защитной группы с метоксигруппы (стадия Н'), например, как описано в Wuts and Greene, Greene's Protective Groups in Organic Synthesis, 4th Ed., p. 24-30, John WileySons: New York, 2006. Например, добавлением трибромида бора к холодному (например, от приблизительно -78 до приблизительно 25C, например от приблизительно -78 до приблизительно 10C, от приблизительно -78 до приблизительно 0C, от приблизительно -78 до приблизительно -10C, от приблизительно 0 до приблизительно 25C или от приблизительно 0 до приблизительно 10C) раствору F35, необязательно в растворителе, например галогенированном растворителе (например, ДХМ, хлороформ и т.п.) или этилацетате. Первичная гидроксильная группа в F34 далее может быть активирована как группаL1O- (см. стадию I', F32), которая уходит, последовательной обработкой L1Cl, необязательно в растворителе (например, этилацетат или ДХМ), и органическом основании для нейтрализации образующегосяHCl (например, триэтиламин или ДИПЭА). В соединениях F32, L1 может быть выбран из алкилсульфонила (например, метансульфонил), галогеналкилсульфонила (например, трифторметансульфонил), арилсульфонила (например, толуолсульфонил) и т.п. Соединение F32 далее может быть обработано какимлибо нуклеофилом для вытеснения SN2 группы L1O, которая уходит. В некоторых вариантах эту стадию можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Если нуклеофил представляет собой ион азида, F32 дает F31 (стадия J'). Азидные реагенты включают любой реагент, способный к продуцированию нуклеофильного иона азида. Примеры азидных реагентов включают азиды щелочных металлов (например, азид натрия, азид калия). В некоторых необязательных вариантах азидный реагент, например азид натрия, может использоваться в комбинации с йодидом натрия. Подходящими растворителями для такого превращения являются полярные растворители, в том числе ДМФА, ДМСО, NMP и т.п. В некоторых вариантах эту стадию можно осуществлять в ДМФА. В некоторых вариантах эту стадию можно осуществлять при повышенной температуре, например, от приблизительно 40 до приблизительно 100C, от приблизительно 50 до приблизительно 90C или от приблизительно 60 до приблизительно 80C. В некоторых вариантах эту стадию можно осуществлять при 50C. В некоторых вариантах эту стадию можно осуществлять при 85C. Органические азиды, напримерF31, могут быть восстановлены до органических аминов, таких как F29, добавлением водорода, в форме элементарного водорода; с использованием гидридного реагента (например, NaBH4, LiAlH4 и т.п.); с использованием трифенилфосфина; или с использованием комбинации йодида натрия, хлортриметилсилана и метанола (стадия K"'). В некоторых вариантах восстановление можно осуществлять в присутствии йодида натрия, хлортриметилсилана и метанола. В некоторых вариантах восстановление можно осуществлять приблизительно при комнатной температуре, например от приблизительно 10 до приблизительно 50C, от приблизительно 15 до приблизительно 40C, от приблизительно 20 до приблизительно 30C или от приблизительно 25 до приблизительно 30C. В некоторых вариантах молярное соотношение йодида натрия и хлортриметилсилана может составлять приблизительно 1,0, например приблизительно 0,9, приблизительно 0,95, приблизительно 1,0, приблизительно 1,05 или приблизительно 1,1. В некоторых вариантах хлортриметилсилан может быть прибавлен к смеси F31, йодида натрия и метанола в виде раствора в метаноле. Обработка F29 сульфамидом в присутствии основания, например органического основания, которое может быть гетероциклическим основанием (например, пиридин) или триалкиламином (например, триэтиламин, ДИПЭА и т.п.), каждое из которых может необязательно использоваться как растворитель для данного превращения, дает сульфонилмочевину, такую как F30 (стадия R'). Указанную реакцию можно осуществлять при повышенной температуре, например приблизительно 130C, например приблизительно 100, приблизительно 110, приблизительно 120, приблизительно 130 или приблизительно 140C. Такое нагревание может быть соответствующим образом осуществлено с использованием облучения микроволнами. Облучение микроволнами можно осуществлять в коммерческой микроволновой печи (например, Initiator 3 от Biotage), которая работает в одном режиме. Из соединений F30, которые содержат оксадиазолоновое кольцо, может быть удалена защитная группа (например, гидролизом) с образованием целевых амидоксимов F28 в присутствии основания (стадия N"'). Основание может быть или органическим основанием, таким как ациклические амины (например, триэтиламин, диизопропилэтиламин (ДИПЭА) и т.п.) или циклические амины (например, пирролидин, пиперидин и т.п.); или неорганическим основанием, таким как щелочь (например, NaOH, LiOH, KOH, Mg(OH)2 и т.п.). Основание может быть сделано доступным в форме смолы (например, Amberlite и т.п.). В некоторых других вариантах основание может присутствовать в форме раствора в воде (водное основание), например приблизительно 2 н. раствора (например, приблизительно 0,5 н. раствора, приблизительно 1 н. раствора, приблизительно 1,5 н. раствора, приблизительно 2,5 н. раствора, от приблизительно 3 до приблизительно 5 н. раствора, от приблизительно 5 до приблизительно 10 н. раствора). В некоторых вариантах основание может быть гидроксидом щелочного металла (например, гидроксид натрия). В некоторых вариантах основание может быть 2 н. раствором NaOH в воде. В некоторых вариантах растворитель может быть метанолом или тетрагидрофураном (ТГФ). В некоторых вариантах удаление защитной группы можно осуществлять при температуре от приблизительно -10 до приблизительно 60C, например от приблизительно -10 до приблизительно 0C, от приблизительно 0 до приблизительно 25C, от приблизительно 25 до приблизительно 45C или от приблизительно 45 до приблизительно 60C. Соответственно в другом аспекте изобретения предлагается способ получения соединений формулы F28 или их солей, где R4 представляет собой F, Cl, Br или I и n равно 1 или 2, который включает реакцию соединения формулы F29 или его соли с сульфамидом и органическим основанием, с образованием соединения формулы F30 или его соли, и реакцию соединения формулы F30 с основанием, с получением соединения формулы F28. В некоторых вариантах R4 представляет собой Cl и n равно 1. В некоторых вариантах R4 представляет собой Br и n равно 1. В некоторых вариантах реакция соединения формулы F29 дополнительно включает нагревание реакционной смеси (например, с использованием облучения микроволнами). В другом аспекте изобретения предлагается способ получения соединения формулы F29 восстановлением соединения формулы F31 или его соли. В некоторых вариантах восстановление можно осуществлять с использованием комбинации йодида натрия, хлортриметилсилана и метанола. В другом аспекте изобретения соединение формулы F31 может быть получено путем обработки соединения формулы F32 или его соли, где L1 выбран из алкилсульфонила, галогеналкилсульфонила и арилсульфонила; азидным реагентом, с получением соединения формулы F31. В данном описании термин "алкил", при использовании отдельно или вместе с дополнительными терминами, которые обозначают фрагменты, обозначает насыщенную углеводородную, линейную или разветвленную группу, содержащую от 1 до 6 атомов углерода, от 1 до 4 атомов углерода или от 1 до 3 атомов углерода. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и т.п. В данном описании термин "алкенил" обозначает алкильную группу, содержащую одну или больше двойных углерод-углеродных связей. Примеры алкенильных групп включают этенил (винил), пропенил и т.п. В данном описании термин "арил" обозначает ароматическую углеводородную группу, которая может быть моно- или полициклической и содержит от 6 до 14 атомов углерода. Примеры арильной группы включают фенил, нафтил, антраценил, фенантренил, инданил, инденил и т.п. В данном описании термин "галогеналкил" при использовании отдельно или вместе с дополнительным фрагментом обозначает алкильную группу, замещенную одним или больше атомами галогена, независимо выбранными из F, Cl, Br и I. Примеры галогеналкильных групп включают CF3, CHF2, CH2CF3 и т.п. В данном описании термин "алкокси" обозначает группу -O-алкил. Примеры алкоксильных групп включают метокси, этокси, пропокси (например, н-пропокси и изопропокси), трет-бутокси и т.п. В данном описании "алкиламин" обозначает аминогруппу (NH2), замещенную алкильной группой. Примеры алкиламинных групп включают метиламин, гексиламин и т.п. В данном описании "триалкиламин" обозначает атом азота, замещенный тремя алкильными группами. Примеры триалкиламинных групп включают триметиламин, триэтиламин и т.п. В данном описании термин "алкоксикарбонил" обозначает СО, замещенный алкоксильной группой:-С(О)-O-алкил. Примеры алкоксикарбонильных групп включают этоксикарбонил, трет-бутоксикарбонил(Boc), бензилоксикарбонил (Cbz), 9-флуоренилметилоксикарбонил (Fmoc) и т.п. В данном описании термин "алкилсульфонил" обозначает сульфонильную группу, замещенную алкильной группой: алкил-S(O)2-. Примеры алкилсульфонильных групп включают метансульфонил, этансульфонил и т.п. В данном описании термин "галогеналкилсульфонил" обозначает сульфонильную группу, замещенную галогеналкильной группой. Примеры галогеналкилсульфонильных групп включают трифторметансульфонил, 1,1,1-трифторетансульфонил и т.п. В данном описании термин "арилсульфонил" обозначает сульфонильную группу, замещенную арильной группой или замещенной арильной группой, где заместители в арильной группе выбраны из галогена, нитро, C1-4 алкила и C1-4 галогеналкила. В данном описании термин "гетероциклическое основание" обозначает 4-14-членный, необязательно замещенный гетероцикл, где по меньшей мере один атом кольца представляет собой атом азота. Гетероциклическое основание может быть ароматическим или неароматическим. Примеры гетероциклических оснований включают пиридин, пирролидин, пиперидин, морфолин и т.п. Примеры заместителей в гетероцикле включают F, Cl, Br, C1-4 алкил и C1-4 галогеналкил. Способы применения Соединения по изобретению могут ингибировать активность фермента индоламин-2,3 диоксигеназы (IDO). Например, соединения по изобретению могут быть применены для ингибирования активности IDO в клетке или в организме индивидуума, который нуждается в модуляции фермента, пу- 15022669 тем введения ингибирующего количества соединения по изобретению. В данном изобретении дополнительно предлагаются способы ингибирования разложения триптофана в системе, содержащей клетки, которые экспрессируют IDO, например, в ткани, живом организме или культуре клеток. В некоторых вариантах данного изобретения предлагаются способы изменения(например, увеличения) внеклеточных уровней триптофана у млекопитающего путем введения эффективного количества соединения или композиции, предложенной в данном описании. Способы измерения уровней триптофана и разложения триптофана шаблонно известные из уровня техники. В данном изобретении дополнительно предлагаются способы ингибирования иммуносупрессии,например опосредствованной IDO иммуносупрессии, у больного путем введения больному эффективного количества соединения или композиции, заявленной в данном изобретении. Опосредствованная IDO иммуносупрессия связана, например, с различными видами рака, ростом опухоли, метастазом, вирусной инфекцией, репликацией вируса и т.п. В данном изобретении дополнительно предлагаются способы лечения заболеваний, связанных с активностью или экспрессией, в том числе аномальной активностью и/или избыточной экспрессией IDO у индивидуума (например, больного) путем введения индивидууму, который нуждается в таком лечении,терапевтически эффективного количества или дозы соединения по данному изобретению или его фармацевтической композиции. Примеры заболеваний могут включать любое заболевание, расстройство или состояние, которое прямо или косвенно связано с экспрессией или активностью фермента IDO, например избыточной экспрессией или аномальной активностью. Связанное с IDO заболевание может также включать какое-либо заболевание, расстройство или состояние, которое может быть предупреждено, облегчено или излечено путем модуляции активности фермента. Примеры связанных с IDO заболеваний включают рак, вирусную инфекцию, например ВИЧ-инфекцию, инфекцию вирусом гепатита С, депрессию,нейродегенеративные расстройства, например болезнь Альцгеймера и болезнь Хантингтона, травму, возрастную катаракту, пересадку органа (например, отторжение пересаженного органа) и аутоиммунные заболевания, в том числе астму, ревматоидный артрит, рассеянный склероз, аллергическое воспаление,воспалительное заболевание кишечника, псориаз и красную системную волчанку. Примеры разных видов рака, которые поддаются лечению способами по данному изобретению, включают рак ободочной и прямой кишки, поджелудочной железы, молочной железы, предстательной железы, легкого, мозга, яичника, шейки матки, яичка, почки, головы и шеи, лимфому, лейкоз, меланому и т.п. Соединения по изобретению могут также быть пригодными для лечения ожирения и ишемии. В данном описании термин "клетка" обозначает клетку, которая находится in vitro, ex vivo или invivo. В некоторых вариантах клетка ex vivo может быть частью образца ткани, полученного из организма, например, млекопитающего. В некоторых вариантах клетка in vivo может быть клеткой в культуре клеток. В некоторых вариантах клетка in vivo представляет собой клетку, живущую в организме, например, млекопитающего. В данном описании термин "обеспечение контакта" ("контакт") обозначает сочетание указанных фрагментов в системе in vitro или в системе in vivo. Например, "контакт" фермента IDO с соединением по изобретению включает введение соединения по данному изобретению индивидууму или больному,например человеку, организм которого содержит IDO, а также, например, введение соединения по изобретению в образец, содержащий клеточный или очищенный препарат, который содержит фермент IDO. В данном описании термины "индивидуум" или "больной" ("пациент") употребляются равнозначным образом и обозначают любое животное, в том числе млекопитающих, предпочтительно мышей,крыс, других грызунов, кроликов, собак, котов, свиней, крупный рогатый скот, овец, коней или приматов, и наиболее предпочтительно человека. В данном описании фраза "терапевтически эффективное количество" обозначает количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский ответ в ткани, системе, организме животного, индивидууму или человека, предусмотренный исследователем, ветеринаром, врачом или другим клиническим специалистом. В данном описании термин "лечение" обозначает 1) профилактику заболевания; например профилактику заболевания, состояния или расстройства у индивидуума, который может быть склонным к заболеванию, состоянию или расстройству, но еще не испытывает или у которого не проявляется патология или симптомы заболевания; 2) подавление заболевания; например подавление заболевания, состояния или расстройства у индивидуума, который испытывает или у которого проявляется патология или симптомы заболевания, состояния или расстройства (т.е. остановка последующего развития патологии и/или симптомов заболевания); или 3) улучшение состояния при заболевании; например облегчение заболевания, состояния или расстройства у индивидуума, который испытывает или у которого проявляется патология или симптомы заболевания, состояния или расстройства (т.е. обращение патологии и/или симптомов). Фармацевтические композиции и лекарственные формы. При применении в качестве фармацевтических средств соединения по изобретению можно вводить в форме фармацевтических композиций, которые представляют собой комбинацию соединения по изобретению и фармацевтически приемлемого носителя. Указанные композиции в известной степени могут быть получены хорошо известными в фармацевтической области способами и могут быть введены различными способами в зависимости от предусмотренного местного или системного лечения, и от участка,который подлежит лечению. Введение может быть местным нанесением (в том числе в глаза и на слизистые оболочки, в том числе интраназальное, вагинальное и ректальное введение), легочным (например,ингаляцией или инсуффляцией порошков или аэрозолей, в том числе с помощью небулайзера; интратрахеальным, интраназальным, эпидермальным и трансдермальным), глазным, пероральным или парентеральным введением. Способы введения в глаза могут включать местное нанесение (глазные капли), субконъюнктивальную, периокулярную или интравитреальную инъекцию или введение с помощью баллонного катетера или глазных вставок, хирургически размещенных в конъюнктивальном мешочке. Парентеральное введение включает внутривенную, внутриартериальную, подкожную, внутрибрюшную или внутримышечную инъекцию или инфузию; или интракраниальное, например интратекальное или интравентрикулярное введение. Парентеральное введение может осуществляться в форме однодозового большого болюса или может осуществляться, например, насосом для непрерывной перфузии. Фармацевтические композиции и препараты для местного применения могут включать трансдермальные пластыри,мази, лосьоны, кремы, гели, капли, суппозитории, спреи, жидкости и порошки. Традиционные фармацевтические носители, водные, порошкообразные или масляные основы, загустители и т.п. могут быть необходимыми или желательными. Данное изобретение также включает фармацевтические композиции, содержащие в качестве активного ингредиента одно или больше соединений по изобретению, описанных выше, в комбинации с одним или больше фармацевтически приемлемых носителей. При изготовлении композиций по изобретению активный ингредиент обычно смешивают со вспомогательным веществом, разбавляют вспомогательным веществом или помещают в пределы такого носителя в форме, например, капсулы, саше, бумажной или другой емкости. Если вспомогательное вещество служит разбавителем, она может быть твердым, полутвердым или жидким материалом, который действует как растворитель, носитель или среда для активного ингредиента. Таким образом, композиции могут приобретать форму таблеток, пилюль,порошков, леденцов, саше, каше, эликсиров, суспензий, эмульсий, растворов, сиропов, аэрозолей (в виде твердого вещества или в жидкой среде), мазей с содержанием, например, до 10 мас.% активного соединения, мягких и твердых желатиновых капсул, суппозиториев, стерильных инъекционных растворов и стерильных расфасованных порошков. В ходе изготовления препарата активное соединение может быть смолото для получения соответствующего размера частиц перед объединением с другими ингредиентами. Если активное соединение является в существенной мере нерастворимым, оно может быть смолото до размера частиц меньше 200 меш. Если активное соединение является в существенной мере растворимым в воде, размер частиц может быть скорректирован путем помола, для получения в существенной мере однородного распределения в препарате, например, приблизительно 40 меш. Некоторые примеры подходящих вспомогательных веществ включают лактозу, глюкозу, сахарозу,сорбит, маннит, различные виды крахмала, акациевую камедь, фосфат кальция, альгинат, трагакантовую камедь, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп и метилцеллюлозу. Рецептуры могут дополнительно включать смазывающие средства,например тальк, стеарат магния и минеральное масло; увлажняющие средства; эмульгирующие и суспендирующие средства; консерванты, например метил- и пропилгидроксибензоаты; подсластители и вкусовые добавки. Композиции по изобретению могут быть разработаны таким образом, чтобы обеспечивать быстрое, пролонгированное или замедленное высвобождение активного ингредиента после введения больному, с применением методик, известных из уровня техники. Композиции могут быть разработаны в дозированной лекарственной форме, где каждая единица дозированной формы содержит от приблизительно 5 до приблизительно 100 мг, чаще от приблизительно 10 до приблизительно 30 мг активного ингредиента. Термин "дозированная лекарственная форма" обозначает подходящие физически дискретные единицы как единицы дозированной лекарственной формы для субъекта-человека и других млекопитающих, где каждая единица содержит предварительно определенное количество активного материала, вычисленное таким образом, чтобы осуществлять целевое терапевтическое воздействие, в сочетании с подходящим фармацевтическим вспомогательным веществом. Активное соединение может быть эффективным в широком интервале доз, и, в общем, вводится в фармацевтически эффективном количестве. Однако следует понимать, что количество соединения, которое фактически вводят, обычно будет определяться врачом в соответствии с существующими обстоятельствами, в том числе состояния, которое подлежит лечению, выбранного способа введения, конкретного соединения, которое вводят, возраста, массы тела и ответа конкретного больного, тяжести симптомов у больного и т.п. Для получения твердых композиций, например таблеток, основной активный ингредиент смешивают с фармацевтическим вспомогательным веществом для образования твердой композиции премикса,содержащей гомогенную смесь соединения по данному изобретению. Если считать указанные композиции премикса гомогенными, активный ингредиент обычно диспергирован равномерно в композиции таким образом, что композиция может быть легко разделена на одинаково эффективные единицы лекарст- 17022669 венной формы, например таблетки, пилюли и капсулы. Такой твердый премикс далее разделяют на единицы лекарственной формы описанного выше типа, содержащие, например, от 0,1 до приблизительно 500 мг активного ингредиента по данному изобретению. Таблетки или пилюли по данному изобретению могут быть покрыты покрытиями или изготовлены таким образом, чтобы получить лекарственную форму, обеспечивающую преимущество пролонгированного действия. Например, таблетка или пилюля может включать внутреннюю дозу и внешний компонент дозы, где последний присутствует в форме оболочки над первым. Два компонента могут быть разделены кишечнорастворимым слоем, который служит для защиты от разложения в желудке и позволяет прохождение внутреннего компонента в неповрежденном виде в двенадцатиперстную кишку или его замедленное высвобождение. Различные материалы могут применяться для такого кишечнорастворимого слоя или покрытия, среди таких материалов целый ряд полимерных кислот и смесей полимерных кислот с такими материалами как шеллак, цетиловый спирт и ацетат целлюлозы. Жидкие формы, в которые соединения и композиции по данному изобретению могут быть введены с целью введения путем приема внутрь или инъекции, включают водные растворы, сиропы с подходящими вкусовыми добавками, водные или масляные суспензии и ароматизированные эмульсии со съедобными маслами, такими как хлопковое масло, кунжутное масло, кокосовое масло или арахисовое масло, а также и эликсиры и т.п. фармацевтические носители. Композиции для ингаляции или инсуффляции включают растворы и суспензии в фармацевтически приемлемых, водных или органических растворителях или их смесях, и порошки. Жидкие или твердые композиции могут содержать подходящие фармацевтически приемлемые вспомогательные вещества, как описано выше. В некоторых вариантах композиции вводят перорально или интраназально в дыхательные пути для местного или системного воздействия. Композиции могут быть распылены с использованием небулайзера и инертных газов. Распыленные растворы можно вдыхать непосредственно из устройства для распыления, или устройство для распыления может быть присоединено к палатке, маскам или вентилятору с перемежающимся положительным давлением. Раствор, суспензию или композиции в форме порошка можно вводить через рот или интраназально из устройств, которые доставляют препарат соответствующим образом. Количество соединения или композиции для введения больному будет варьировать в зависимости от состава композиции для введения, цели введения, например профилактика или терапия, состояния больного, способа введения и т.п. При терапевтическом применении композиции можно вводить пациенту, который уже страдает заболеванием, в количестве, достаточном для излечивания или, по меньшей мере, частично для остановки симптомов заболевания и его осложнений. Эффективные дозы будут зависеть от патологического состояния, подлежащего лечению, а также от решения клинициста, которое будет зависеть от таких факторов, как тяжесть заболевания, возраст, масса тела, общее состояние больного и т.п. Композиции, которые вводят больному, могут приобретать форму фармацевтических композиций,описанных выше. Указанные композиции могут быть стерилизованы традиционными методами стерилизации или стерилизующей фильтрацией. Водные растворы могут быть расфасованы для применения в форме растворов или лиофилизированы, лиофилизированный препарат объединяют со стерильным водным носителем перед введением. pH препаратов соединения обычно будет составлять от 3 до 11, более предпочтительно от 5 до 9 и наиболее предпочтительно от 7 до 8. Следует понимать, что применение некоторых упомянутых выше вспомогательных веществ, носителей или стабилизаторов будет приводить к образованию фармацевтических солей. Терапевтические дозы соединений по данному изобретению могут варьировать в соответствии, например, с конкретным показанием, для которого назначено лечение, способом введения соединения, состоянием здоровья и патологическим состоянием больного и решением врача. Доля или концентрация соединения по изобретению в фармацевтической композиции может варьировать в зависимости от целого ряда факторов, в том числе дозировки, химических свойств (например, гидрофобность) и способа введения. Например, соединения по изобретению могут быть предоставлены в водном буферизованном физиологическом растворе, содержащем от приблизительно 0,1 до приблизительно 10% мас./об. соединения для парентерального введения. Некоторые типичные интервалы дозы составляют от приблизительно 1 мг/кг до приблизительно 1 г/кг массы тела в сутки. В некоторых вариантах интервал дозы составляет от приблизительно 0,01 до приблизительно 100 мг/кг массы тела в сутки. Вероятно, дозы будут зависеть от таких переменных, как вид и степень прогрессирования заболевания или расстройства, общее состояние здоровья конкретного пациента, относительная биологическая эффективность выбранного соединения,состав вспомогательных веществ и способ введения. Эффективные дозы могут быть экстраполированы на базе кривых "доза-реакция", полученных в результате исследований in vitro или на животных моделях. Соединения по изобретению могут также быть введены в комбинации с одним или больше дополнительных активных ингредиентов, которые могут включать какое-либо фармацевтическое средство,например противовирусные средства, вакцины, антитела, средства для усиления иммунитета, иммуносупрессанты, противовоспалительные средства и т.п. Изобретение будет описано более подробно с помощью конкретных примеров. Следующие приме- 18022669 ры приведены для целей иллюстрации и не предназначены для ограничения изобретения каким-либо образом. Для специалистов в данной области будут очевидными различные некритические параметры,которые могут быть изменены или модифицированы с получением, по существу, таких же результатов. Обнаружено, что соединения из примеров являются ингибиторами IDO по результатам одного или больше анализов, описанных в данном описании. Примеры Пример 1. 4-(2-[(Аминосульфонил)амино]этиламино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5 оксадиазол-3-карбоксимидамид Малононитрил [Aldrich, продуктМ 1407] (320,5 г, 5 моль) добавляют к воде (7 л), нагревают до 45C и перемешивают в течение 5 мин. Полученный раствор охлаждают на ледяной бане и добавляют натрия нитрит (380 г, 5,5 моль). Когда температура достигает 10 С, добавляют 6 н. раствор хлористоводородной кислоты (55 мл). Происходит умеренно экзотермическая реакция, и температура достигает 16C. После 15 мин охлаждающую баню удаляют и реакционную смесь перемешивают в течение 1,5 ч при 16-18C. Реакционную смесь охлаждают до 13C и добавляют 50% водный раствор гидроксиламина(990 г, 15 моль) в виде одной порции. Температуру увеличивают до 26C. После окончания экзотермической реакции охлаждающую баню удаляют и перемешивание продолжают в течение 1 ч при 26-27C,затем реакционную смесь медленно нагревают до кипения с обратным холодильником. Кипячение с обратным холодильником продолжают в течение 2 ч и затем реакционную смесь охлаждают в течение ночи. Реакционную смесь перемешивают на ледяной бане и добавляют порциями 6 н. раствор хлористоводородной кислоты (800 мл) в течение 40 мин до достижения pH 7,0. Перемешивание продолжают на ледяной бане при 5C. Остаток собирают фильтрованием, тщательно промывают водой и сушат под вакуумом (50C) с получением целевого продукта (644 г, 90%). ЖХМС для C3H6N5O2 (M+H)+: соотношение массы к заряду=144,0. 13 С ЯМР (75 МГц, CD3OD):156,0, 145,9, 141,3. Стадия В. 4-Амино-N-гидрокси-1,2,5-оксадиазол-3-карбоксимидоила хлорид 4-Амино-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамид (422 г, 2,95 моль) добавляют к смеси воды (5,9 л), уксусной кислоты (3 л) и 6 н. раствору хлористо-водородной кислоты (1,475 л, 3 экв.) и суспензию перемешивают при 42-45C до полного растворения. Добавляют натрия хлорид (518 г, 3 экв.) и раствор перемешивают на бане, которая содержит смесь лед/вода/метанол. Добавляют раствор натрия нитрита (199,5 г, 0,98 экв.) в воде (700 мл) в течение 3,5 ч, поддерживая температуру ниже 0C. После окончания добавления перемешивание продолжают на ледяной бане в течение 1,5 ч и затем реакционную смесь нагревают до 15C. Осадок собирают фильтрованием, тщательно промывают водой, помещают в этилацетат (3,4 л), обрабатывают безводным натрия сульфатом (500 г) и перемешивают в течение 1 ч. Суспензию фильтруют сквозь натрия сульфат (200 г) и фильтрат упаривают на роторном вращающемся испарителе. Остаток растворяют в метил трет-бутиловом эфире (5,5 л), обрабатывают углем (40 г),перемешивают в течение 40 мин и фильтруют сквозь броунмиллерит. Растворитель удаляют с помощью роторного испарителя и полученный продукт сушат под вакуумом (45C) с получением целевого продукта (256 г, 53,4%). ЖХМС для C3H4ClN4O2 (М+H)+: соотношение массы к заряду=162,9. 13 С ЯМР (100 МГц, CD3OD):155,8, 143,4, 129,7. Стадия С. 4-Амино-N'-гидрокси-N-(2-метоксиэтил)-1,2,5-оксадиазол-3-карбоксимидамид 4-Амино-N-гидрокси-1,2,5-оксадиазол-3-карбоксимидоилхлорид (200,0 г, 1,23 моль) смешивают с этилацетатом (1,2 л). При 0-5 С 2-метоксиэтиламин [Aldrich, продукт 143693] (119,0 мл, 1,35 моль) добавляют в виде одной порции при перемешивании. Температуру реакционной смеси увеличивают до 41C. Реакционную смесь охлаждают до 0-5C. Добавляют триэтиламин (258 мл, 1,84 моль). После перемешивания в течение 5 мин ЖХМС показывает завершение реакции. Реакционную смесь промывают водой (500 мл) и рассолом (500 мл), сушат над натрия сульфатом и упаривают с получением целевого продукта (294 г, 119%) в виде темного неочищенного масла. ЖХМС для C6H12N5O3 (M+H)+: соотношение массы к заряду=202,3. 1H ЯМР (400 МГц, ДМСО-d6):10,65 (с, 1H), 6,27 (с, 2H), 6,10 (т, J=6,5 Гц,1H), 3,50 (м, 2H), 3,35 (д, J=5,8 Гц, 2H), 3,08 (с, 3H). Стадия D. N'-Гидрокси-4-[(2-метоксиэтил)амино]-1,2,5-оксадиазол-3-карбоксимидамид 4-Амино-N'-гидрокси-N-(2-метоксиэтил)-1,2,5-оксадиазол-3-карбоксимидамид (248,0 г, 1,23 моль) смешивают с водой (1 л). Добавляют калия гидроксид (210 г, 3,7 моль). Реакционную смесь кипятят с обратным холодильником при 100C, выдерживая при этой температуре в течение ночи (15 ч). Данные ТСХ с использованием 50% раствора этилацетата (содержащего 1% аммония гидроксида) в гексане показывают завершение реакции (для продукта Rf=0,6, для исходного материала Rf=0,5). ЖХМС также показывает завершение реакции. Реакционную смесь охлаждают до комнатной температуры и экстрагируют этилацетатом (31 л). Объединенные растворы этилацетата сушат над натрия сульфатом и упаривают с получением целевого продукта (201 г, 81%) в виде неочищенного твердого вещества практически белого цвета. ЖХМС для C6H12N5O3 (М+H)+: соотношение массы к заряду=202,3. 1H ЯМР (400 МГц, ДМСО-d6):10,54 (с, 1H), 6,22 (с, 2H), 6,15 (т, J=5,8 Гц, 1H), 3,45 (т, J=5,3 Гц, 2H), 3,35 (м, 2H), 3,22 (с, 3H). Стадия Е. N-Гидрокси-4-[(2-метоксиэтил)амино]-1,2,5-оксадиазол-3-карбоксимидоила хлоридN'-гидрокси-4-[(2-метоксиэтил)амино]-1,2,5-оксадиазол-3 карбоксимидамид (50,0 г, 0,226 моль) растворяют в 6,0 М водном растворе хлористо-водородной кислоты (250 мл, 1,5 моль). Добавляют натрия хлорид (39,5 г, 0,676 моль) с последующим добавлением воды(250 мл) и этилацетата (250 мл). При 3-5C предварительно подготовленный водный раствор (100 мл) натрия нитрита (15,0 г, 0,217 моль) медленно добавляют в течение 1 ч. Реакционную смесь перемешивают при 3-8C, выдерживая при этой температуре в течение 2 ч и затем при комнатной температуре в течение уик-энда. ЖХМС показывает завершение реакции. Реакционную смесь экстрагируют этилацетатом(2200 мл). Объединенные растворы этилацетата сушат над натрия сульфатом и упаривают с получением целевого продукта (49,9 г, 126%) в виде неочищенного твердого вещества белого цвета. ЖХМС дляN-Гидрокси-4-[(2-метоксиэтил)амино]-1,2,5-оксадиазол-3-карбоксимидоилхлорид (46,0 г, 0,208 моль) смешивают с водой (300 мл). Смесь нагревают до 60C. Добавляют 3-бром-4-фторанилин [Oakwood products, продукт 013091] (43,6 г, 0,229 моль) и перемешивают в течение 10 мин. Добавляют натретый раствор (300 мл воды) натрия бикарбоната (26,3 г, 0,313 моль) в течение 15 мин. Реакционную смесь перемешивают при 60C, выдерживая при этой температуре в течение 20 мин. ЖХМС показывает завершение реакции. Реакционную смесь охлаждают до комнатной температуры и экстрагируют этилацетатом (2300 мл). Объединенные растворы этилацетата сушат над натрия сульфатом и упаривают с получением целевого продукта (76,7 г, 98%) в виде неочищенного твердого вещества коричневого цвета. ЖХМС для C12H14BrFN5O3 (M+H)+: соотношение массы к заряду=374,0, 376,0. 1H ЯМР (400 МГц,ДМСО-d6):11,55 (с, 1H), 8,85 (с, 1H), 7,16 (т, J=8,8 Гц, 1H), 7,08 (дд, J=6,1, 2,7 Гц, 1H), 6,75 (м, 1H), 6,14 мл) нагревают до 60 С и перемешивают в течение 20 мин. ЖХМС показывает завершение реакции. Реакционную смесь охлаждают до комнатной температуры, промывают 1 н. раствором HCl (2750 мл), сушат над натрия сульфатом и упаривают с получением целевого продукта (80,4 г, 98%) в виде неочищенного твердого вещества коричневого цвета. ЖХМС для C13H12BrFN5O4 (M+H)+: соотношение массы к заряду=400,0, 402,0. 1H ЯМР (400 МГц, ДМСО-d6):7,94 (т, J=8,2 Гц, 1H), 7,72 (дд, J=9,1, 2,3 Гц, 1H),7,42 (м, 1H), 6,42 (т, J=5,7 Гц, 1H), 3,46 (т, J=5,4 Гц, 2H), 3,36 (т, J=5,8 Гц, 2H), 3,26 (с, 3H). Стадия Н. 4-(3-Бром-4-фторфенил)-3-4-[(2-гидроксиэтил)амино]-1,2,5-оксадиазол-3-ил-1,2,4 оксадиазол-5(4H)-он(37 мл, 0,392 моль) в течение 15 мин. Реакционную смесь нагревают до -10C в течение 30 мин. ЖХМС показывает завершение реакции. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. При 0-5C реакционную смесь медленно гасят насыщенным раствором натрия бикарбоната (1,5 л) в течение 30 мин. Температуру реакционной смеси повышают до 25C. Реакционную смесь экстрагируют этилацетатом (2500 мл, органическая фракция, которая экстрагируется первой, - на дне, и органическая фракция, которая экстрагируется второй, - вверху). Объединенные органические фракции сушат над натрия сульфатом и упаривают с получением целевого продукта (75 г, 99%) в виде неочищенного твердого вещества коричневого цвета. ЖХМС для C12H10BrFN5O4 (M+H)+: соотношение массы к заряду=386,0, 388,0. 1H ЯМР (400 МГц, ДМСО-d6):8,08 (дд, J=6,2, 2,5 Гц, 1H), 7,70 (м, 1H), 7,68 (т, J=8,7 Гц, 1H), 6,33 (т, J=5,6 Гц, 1H), 4,85 (т, J=5,0 Гц, 1H), 3,56 (дд, J=10,6, 5,6 Гц, 2H), 3,29 (дд, J=11,5, 5,9 Гц,2H). Стадия К раствору 4-(3-бром-4-фторфенил)-3-4-[(2-гидроксиэтил)амино]-1,2,5-оксадиазол-3-ил-1,2,4 оксадиазол-5(4H)-она (1,5 кг, 3,9 моль, содержит также некоторое количество бромсодержащего соединения) в этилацетате (12 л) добавляют метансульфонилхлорид (185 мл, 2,4 моль) по каплям в течение 1 ч при комнатной температуре. Триэтиламин (325 мл, 2,3 моль) добавляют по каплям в течение 45 мин, во время чего температуру реакционной смеси повышают до 35C. По прохождении 2 ч реакционную смесь промывают водой (5 л), раствором соли (1 л), сушат над натрия сульфатом, объединяют еще с тремя объемами такой же реакционной смеси и растворители удаляют под вакуумом с получением целевого продукта (7600 г, количественный выход) в виде твердого вещества рыжевато-коричневого цвета. ЖХМС для C13H11BrFN5O6SNa (M+Na)+: соотношение массы к заряду=485,9, 487,9. 1H ЯМР (400 МГц, ДМСОd6):8,08 (дд, J=6,2, 2,5 Гц, 1H), 7,72 (м, 1H), 7,58 (т, J=8,7 Гц, 1H), 6,75 (т, J=5,9 Гц, 1H), 4,36 (т, J=5,3 Гц, 2H), 3,58 (дд, J=11,2, 5,6 Гц, 2H), 3,18 (с, 3H). Стадия К раствору 2-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]-1,2,5 оксадиазол-3-иламино)этил метансульфоната (2,13 кг, 4,6 моль, который содержит также некоторое количество бромсодержащего соединения) в диметилформамиде (4 л) при перемешивании в 22-л колбе добавляют натрия азид (380 г, 5,84 моль). Реакционную смесь нагревают до 50C, выдерживая при этой температуре в течение 6 ч, выливают в смесь лед/вода (8 л) и экстрагируют смесью этилацетат/гептан (20 л, 1:1). Органическую фракцию промывают водой (5 л) и раствором соли (5 л) и растворители удаляют под вакуумом с получением целевого продукта (1464 г, 77%) в виде твердого вещества рыжеватокоричневого цвета. ЖХМС для C12H8BrFN8O3Na (M+Na)+: соотношение массы к заряду=433,0, 435,0. 1H ЯМР (400 МГц, ДМСО-d6):8,08 (дд, J=6,2, 2,5 Гц, 1H), 7,72 (м, 1H), 7,58 (т, J=8,7 Гц, 1H), 6,75 (т, J=5,7 Гц, 1H), 3,54 (т, J=5,3 Гц, 2H), 3,45 (дд, J=11,1, 5,2 Гц, 2H). Натрия йодид (1080 г, 7,2 моль) добавляют к 3-4-[(2-азидоэтил)амино]-1,2,5-оксадиазол-3-ил-4(3-бром-4-фторфенил)-1,2,4-оксадиазол-5(4H)-он (500 г, 1,22 моль) в метаноле (6 л). Смесь перемешивают в течение 30 мин и в ходе этого периода происходит умеренное выделение тепла. Добавляют по каплям хлортриметилсилан (930 мл, 7,33 моль) в виде раствора в метаноле (1 л) с такой скоростью, чтобы температура не превышала 35C, и реакционную смесь перемешивают в течение 3,5 ч при комнатной температуре. Реакционную смесь нейтрализуют 33 мас.% раствором натрия тиосульфата пентагидрата в воде (1,5 л), разбавляют водой (4 л) и pH доводят до 9 осторожным добавлением твердого калия карбоната (250 г добавляют маленькими порциями: наблюдается образование пены). Добавляют ди-третбутилдикарбонат (318 г, 1,45 моль) и реакционную смесь перемешивают при комнатной температуре. Дополнительное количество калия карбоната (200 г) добавляют порциями по 50 г в течение 4 ч, чтобы убедиться, что pH составляет приблизительно или выше 9. После перемешивания при комнатной температуре в течение ночи твердое вещество фильтруют, растирают с водой (2 л) и затем с МТБЭ (1,5 л). Всего осуществляют 11 таких циклов (5,5 кг, 13,38 моль). Объединенные твердые вещества растирают со смесью ТГФ/дихлорметан (24 л, 1:1, 4 цикла в колбе роторного испарителя объемом 20 л, 50C, 1 ч),фильтруют и промывают дихлорметаном (по 3 л каждый цикл) с получением твердого вещества практически белого цвета. Неочищенный материал растворяют при 55C тетрагидрофураном (5 мл/г), обрабатывают обесцвечивающим углем (2 мас.%) и силикагелем (2 мас.%) и фильтруют в горячем состоянии сквозь броунмиллерит с получением продукта в виде твердого вещества практически белого цвета (5122 г). Объединенные фильтраты МТБЭ, ТГФ и дихлорметан упаривают под вакуумом и хроматографируют(2 кг силикагеля, гептан с градиентом 0-100% этилацетата, 30 л) с получением дополнительной порции продукта (262 г). Объединенные твердые вещества сушат до получения требуемой массы в конвекционной печи (5385 г, 83%). В колбу объемом 22 л помещают водорода хлорид (4 н. раствор в 1,4-диоксане, 4 л, 16 моль). Добавляют порциями трет-бутил-[2-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]1,2,5-оксадиазол-3-иламино)этил]карбамат (2315 г, 4,77 моль) в виде твердого вещества в течение 10 мин. Суспензию перемешивают при комнатной температуре, и она постепенно превращается в густую пасту, которую невозможно перемешивать. После стояния в течение ночи при комнатной температуре,пасту суспендируют в этилацетате (10 л), фильтруют, повторно суспендируют в этилацетате (5 л), фильтруют и сушат до получения требуемой массы с получением целевого продукта в виде твердого вещества белого цвета (объединяют с продуктами других циклов, использовали 5 кг исходного материала, 4113 г,95%). ЖХМС для C12H11BrFN6O3 (M+H)+: соотношение массы к заряду=384,9, 386,9. 1 Н ЯМР (400 МГц,ДМСО-d6):8,12 (м, 4H), 7,76 (м, 1 ч), 7,58 (т, J=8,7 Гц, 1 ч), 6,78 (т, J=6,1 Гц, 1 ч), 3,51 (дд, J=11,8, 6,1 Гц, 2H), 3,02 (м, 2H). Стадия L. трет-Бутил-([2-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]1,2,5-оксадиазол-3-иламино)этил]аминосульфонил)карбамат В круглодонную колбу объемом 5 л помещают хлорсульфонилизоцианат [Aldrich, продукт 142662] (149 мл, 1,72 моль) и дихлорметан (1,5 л) и охлаждают с использованием ледяной бани до 2C. Добавляют по каплям трет-бутанол (162 мл, 1,73 моль) в дихлорметане (200 мл) с такой скоростью, чтобы температура не превысила 10C. Полученный раствор перемешивают при комнатной температуре в течение 30-60 мин с получением трет-бутил-[хлорсульфонил]карбамата. В колбу объемом 22 л помещают 3-4-[(2-аминоэтил)амино]-1,2,5-оксадиазол-3-ил-4-(3-бром-4 фторфенил)-1,2,4-оксадиазол-5(4H)-она гидрохлорид (661 г, 1,57 моль) и 8,5 л дихлорметана. После охлаждения до -15C на бане лед/соль добавляют раствор трет-бутил-[хлорсульфонил]карбамата (полученный, как описано выше) с такой скоростью, чтобы температура не превысила -10 С (время добавления 7 мин). После перемешивания в течение 10 мин добавляют триэтиламин (1085 мл, 7,78 моль) с такой скоростью, чтобы температура не превысила -5C (время добавления 10 мин). Охлаждающую баню удаляют, реакционную смесь нагревают до 10C, делят на две порции и нейтрализуют 10% конц. растворомHCl (4,5 л каждая порция). Каждую порцию переносят в делительную лейку объемом 50 л и разбавляют этилацетатом до образования раствора твердого вещества белого цвета (25 л). Слои разделяют и орга- 22022669 ническую фракцию промывают водой (5 л), раствором соли (5 л) и растворители удаляют под вакуумом с получением твердого вещества практически белого цвета. Твердое вещество растирают с МТБЭ (21,5 л) и сушат до получения требуемой массы с получением твердого вещества белого цвета. Таким же образом обрабатывают общее количество исходного материала 4113 г (5409 г, 98%). 1H ЯМР (400 МГц, ДМСОd6):10,90 (с, 1H), 8,08 (дд, J=6,2, 2,5 Гц, 1H), 7,72 (м, 1H), 7,59 (т, J=8, 6 Гц, 1H), 6,58 (т, J=5,7 Гц, 1H),3,38 (дд, J=12,7, 6,2 Гц, 2 H), 3,10 (дд, J=12,1, 5,9 Гц, 2H), 1,41 (с, 9H). Стадия М. В колбу объемом 22 л, содержащую смесь трифторуксусная кислота/вода (8,9 л, 98:2), порциями добавляют трет-бутил ([2-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]-1,2,5 оксадиазол-3-иламино)этил]аминосульфонил)карбамат (1931 г, 3,42 моль) в течение 10 мин. Полученную смесь перемешивают при комнатной температуре в течение 1,5 ч, растворители удаляют под вакуумом и перегоняют дихлорметаном (2 л). Полученное твердое вещество обрабатывают второй раз новой смесью трифторуксусная кислота/вода (8,9 л, 98:2), нагревают в течение 1 ч до 40-50C, растворители удаляют под вакуумом и перегоняют дихлорметаном (32 л). Полученное твердое вещество белого цвета сушат под вакуумом при 50C, выдерживая при этой температуре в течение ночи. Всего таким способом было обработано 5409 г (4990 г, количественный выход). ЖХМС для C12H12BrFN7O5S (M+H)+: соотношение массы к заряду=463,9, 465,9. 1 Н ЯМР (400 МГц, ДМСО-d6):8,08 (дд, J=6,2, 2,5 Гц, 1H), 7,72 (м,1H), 7,59 (т, J=8,7 Гц, 1H), 6,67 (т, J=5,9 Гц, 1H), 6,52 (т, J=6,0 Гц, 1H), 3,38 (дд, J=12,7, 6,3 Гц, 2H), 3,11(дд, J=12,3, 6,3 Гц). Стадия N. 4-(2-[(Аминосульфонил)амино]этиламино)-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5 оксадиазол-3-карбоксимидамид. К неочищенной смеси N-[2-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3 ил]-1,2,5-оксадиазол-3-иламино)этил]сульфамида (2,4 моль), содержащей остаточное количество трифторуксусной кислоты, при перемешивании в колбу объемом 22 л добавляют ТГФ (5 л). Полученный раствор охлаждают до 0C с использованием ледяной бани, добавляют 2 н. раствор NaOH (4 л) с такой скоростью, чтобы температура не превысила 10C. После перемешивания при комнатной температуре в течение 3 ч (ЖХМС показывает отсутствие исходного материала) pH доводят до 3-4 концентрированиемHCl (500 мл). ТГФ удаляют под вакуумом и полученную смесь экстрагируют этилацетатом (15 л). Органическую фракцию промывают водой (5 л), раствором соли (5 л) и растворители удаляют под вакуумом с получением твердого вещества. Твердое вещество растирают с МТБЭ (22 л), объединяют с тремя другими реакционными смесями такого ж объема и сушат в течение ночи в конвекционной печи с получением твердого вещества белого цвета (3535 г). Твердое вещество перекристаллизуют (322 л колба,смесь вода/этанол, 2:1, 14,1 л каждая колба) и сушат в конвекционной печи при температуре 50C до получения требуемой массы названного в заголовке соединения в виде твердого вещества практически белого цвета (3290 г, 78%). ЖХМС для C11H14BrFN7O4S (M+H)+: соотношение массы к заряду=437,9, 439,9. 1H ЯМР (400 МГц, ДМСО-d6):11,51 (с, 1H), 8,90 (с, 1H), 7,17 (т, J=8,8 Гц, 1H), 7,11 (дд, J=6,1, 2,7 Гц,1H), 6,76 (м, 1H), 6,71 (т, J=6,0 Гц, 1H), 6,59 (с, 2 H), 6,23 (т, J=6,1 Гц, 1H), 3,35 (дд, J=10,9, 7,0 Гц, 2H),3,10 (дд, J=12,1, 6,2 Гц, 2H). Конечный продукт представляет собой безводное кристаллическое твердое вещество. Определенное содержание воды меньше 0,1% титрования по методу Карла Фишера. Получены данные рентгеноструктурного анализа порошка (РГАП) (дифрактометр для порошков Rigaku MiniFlex; Cu при 1,054056 с фильтром K; начальный угол=3, угол остановки=45, отбор образца=0,02, скорость сканирования=2) и представлены на фиг. 1. Перечень 2-тета пиков приведен в табл. 1 ниже. Интервал температуры плавления твердого вещества определен на приборе Mettler Toledo Differential Scanning Calorimetry (DSC, DSC) 822. Образец нагревали от 40 до 240C со скоростью нагревания 10C на 1 мин. Термограмма DSC (фиг. 2) демонстрирует Tonset при 162,7C и Tpeak при 163,8C. Термогравиметрический анализ (ТГА, TGA) (фиг. 3) показывает потери в массе 0,3% при нагревании от 20 до 150C при скорости нагревания 10C/мин с использованием прибора TAQ500. Таблица 1 Названное в заголовке соединение получают в соответствии с методикой из примера 17 стадия Е, с использованием N'-гидрокси-4-(2-[(метилсульфонил)амино]этиламино)-1,2,5-оксадиазол-3-карбоксимидамида и 3-бром-4-фторанилина [Oakwood Products, Inc., продукт 013091] как исходных материалов. ЖХМС для C12H15BrFN6O4S (M+H)+: соотношение массы к заряду=437,0, 439,0. 1H ЯМР (400 МГц,ДМСО-d6):11,49 (с, 1H), 8,90 (с, 1H), 7,17 (м, 2H), 7,09 (дд, J=6,3, 2,5 Гц, 1H), 6,26 (т, J=6,1 Гц, 1H), 3,33 Названное соединение получают в соответствии с методикой из примера 5, стадия А, с использованием 4-амино-N-(3-бром-4-фторфенил)-N'-гидрокси-1,2,5-оксадиазол-3-карбоксимидамида [см. публикацию патентной заявки США 2006/0258719] как исходного материала, с выходом 98%. ЖХМС для Названное соединение получают в соответствии с методикой из примера 5, стадия В, с использованием 3-(4-амино-1,2,5-оксадиазол-3-ил)-4-(3-бром-4-фторфенил)-1,2,4-оксадиазол-5(4H)-она как исходного материала, с выходом 81%. ЖХМС для C12H5BrF4N5O4 (M+H)+: соотношение массы к заряду=437,9,439,9. 1H ЯМР (400 МГц, ДМСО-d6):7,92-7,89 (м, 1H), 7,54-7,52 (м, 2H). Стадия С. 4-(3-Бром-4-фторфенил)-3-4-[(3-метоксипропил)амино]-1,2,5-оксадиазол-3-ил-1,2,4 оксадиазол-5(4H)-он(6,7 мл, 34 ммоль) по каплям. Реакционную смесь перемешивают при 0C, выдерживая при этой температуре в течение 15 мин, обрабатывают раствор N-4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4 оксадиазол-3-ил]-1,2,5-оксадиазол-3-ил-2,2,2-трифторацетамидом (10 г, 23 ммоль) в тетрагидрофуране(47 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 72 ч. Реакционную смесь упаривают, разбавляют этилацетатом (200 мл), обрабатывают трифторуксусной кислотой (20 мл) и водой(20 мл) и нагревают до 50C, выдерживая при этой температуре в течение 6 ч. Реакционную смесь упаривают, разбавляют этилацетатом (200 мл) и промывают водой (380 мл), насыщенным раствором натрия бикарбоната (280 мл) и раствором соли (80 мл), сушат над безводным натрия сульфатом, фильтруют и упаривают до неочищенного остатка. Полученный материал очищают на силикагеле с получением целевого продукта (6,4 г, 54%) в виде твердого вещества белого цвета. ЖХМС для C14H14BrFN5O4 Раствор 4-(3-бром-4-фторфенил)-3-4-[(3-метоксипропил)амино]-1,2,5-оксадиазол-3-ил-1,2,4 оксадиазол-5(4H)-она (6,3 г, 14 ммоль) в дихлорметане (60 мл) при -78C обрабатывают 1 М раствором бора трибромида в дихлорметане (28 мл, 28 ммоль) и перемешивают при 25C, выдерживая при этой температуре в течение 2 ч. Реакционную смесь охлаждают до 0C и гасят насыщенным раствором натрия бикарбоната (100 мл). Водную фракцию отделяют и экстрагируют дихлорметаном (2150 мл). Объединенные органические фракции промывают раствором соли (100 мл), сушат над безводным натрия суль- 25022669 фатом, фильтруют и упаривают до неочищенного твердого вещества практически белого цвета. Полученный материал очищают на силикагеле с получением целевого продукта (4,0 г, 73%) в виде твердого вещества белого цвета. ЖХМС для C13H12BrFN5O4 (M+H)+: соотношение массы к заряду=400,0, 402,0. 1 Н ЯМР (400 МГц, ДМСО-d6): 88,07 (дд, J=6,2, 2,5 Гц, 1H), 7,72-7,68 (м, 1H), 7,59 (дд, J=8,8, 8,6 Гц, 1H), 6,54(0,75 мл, 9,7 ммоль) и N,N-диизопропилэтиламином (2,6 мл, 15 ммоль) и перемешивают при 25C, выдерживая при этой температуре в течение 2 ч. Реакционную смесь разбавляют водой (20 мл) и экстрагируют дихлорметаном (20 мл). Органическую фракцию отделяют, сушат над безводным натрия сульфатом, фильтруют и упаривают с получением мезилата, который используют без дальнейшей очистки. Раствор неочищенного мезилата в N,N-диметилформамиде (24 мл) обрабатывают натрия азидом (0,73 г, 11 ммоль) и нагревают до 85C, выдерживая при этой температуре в течение 2 ч. Реакционную смесь разбавляют этилацетатом (300 мл) и промывают водой (100 мл), насыщенным раствором натрия бикарбоната (100 мл) и раствором соли (100 мл), сушат над безводным натрия сульфатом, фильтруют и упаривают с получением целевого продукта (3,2 г, 99%). Полученный материал используют без дополнительной очистки. ЖХМС для C13H10BrFN8O3Na (M+Na)+: соотношение массы к заряду=446,9, 448,9. Стадия F. 3-4-[(3-Аминопропил)амино]-1,2,5-оксадиазол-3-ил-4-(3-бром-4-фторфенил)-1,2,4 оксадиазол-5(4H)-она гидройодид Раствор 3-4-[(3-азидопропил)амино]-1,2,5-оксадиазол-3-ил-4-(3-бром-4-фторфенил)-1,2,4 оксадиазол-5(4H)-она (2,0 г, 4,7 ммоль) в метаноле (36 мл) обрабатывают натрия йодидом (4,2 г, 28 ммоль) и перемешивают при 25C, выдерживая при этой температуре в течение 5 мин. Реакционную смесь обрабатывают раствором хлортриметилсилана (3,6 мл, 28 ммоль) в метаноле (7 мл) по каплям и перемешивают при 25C, выдерживая при этой температуре в течение 40 мин. Реакционную смесь медленно выливают в раствор натрия тиосульфата (5,0 г, 32 ммоль) в воде (200 мл), охлажденного до 0C. Осажденное твердое вещество отфильтровывают, промывают водой и сушат с получением целевого продукта (2,3 г, 93%) в виде твердого вещества. ЖХМС для C13H13BrFN6O3 (M+H)+: соотношение массы к заряду=399,0, 401,0. 1H ЯМР (400 МГц, ДМСО-d6):8,08 (дд, J=6,1, 2,3 Гц, 1H), 7,74-7,70 (м, 1H), 7,60(2,5 мл) нагревают в микроволновом реакторе при 130C, выдерживая при этой температуре в течение 10 мин. Реакционную смесь упаривают с получением неочищенного остатка. Полученный материал очищают препаративной ЖХМС с получением целевого продукта (96 мг, 71%) в виде твердого вещества. ЖХМС для C13H14BrFN7O5S (M+H)+: соотношение массы к заряду=478,0, 480,0. 1H ЯМР (400 МГц,ДМСО-d6):8,07 (дд, J=6,2, 2,5 Гц, 1H), 7,73-7,69 (м, 1H), 7,59 (дд, J=8,8, 8,6 Гц, 1H), 6,57-6,51 (м, 4 H),3,31-3,26 (м, 2H), 2,92-2,87 (м, 2H), 1,79-1,72 (м, 2H).N-[3-(4-[4-(3-бром-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]-1,2,5 оксадиазол-3-иламино)пропил]сульфамида (35 мг, 73 мкмоль) в метаноле (1 мл) обрабатывают 2 М раствором NaOH (0,3 мл, 0,6 ммоль) и перемешивают при 25C, выдерживая при этой температуре в течение 30 мин. Реакционную смесь обрабатывают уксусной кислотой (50 мкл, 0,9 ммоль), фильтруют и очищают препаративной ЖХМС с получением целевого продукта (14 мг, 42%) в виде твердого вещества. ЖХМС для C12H16BrFN7O4S (M+H)+: соотношение массы к заряду=451,8, 453,9. 1H ЯМР (400 МГц,ДМСО-d6):11,5 (с, 1H), 8,89 (с, 1H), 7,17 (дд, J=8,8, 8,6 Гц, 1H), 7,09 (дд, J=6,1, 2,7 Гц, 1H), 6,76-6,72 (м,1H), 6,56 (дд, J=6,1, 6,1 Гц, 1H), 6,51 (с, 2H), 6,17 (дд, J=5,9, 5,9 Гц, 1H), 3,27-3,21 (м, 2H), 2,94-2,88 (м,2H), 1,78-1,71 (м, 2H). Пример 4. N-(3-Бром-4-фторфенил)-N'-гидрокси-4-(3-[(метилсульфонил)амино]пропиламино)1,2,5-оксадиазол-3-карбоксимидамид Названное соединение получают в соответствии с методикой из примера 17, стадия А, с использованием N-(3-аминопропил)(трет-бутокси)карбоксамида [Aldrich продукт 436992] как исходного материала, с выходом 70%. ЖХМС для C4H13N2O2S ([М-Вос+Н]+H)+: соотношение массы к заряду=153,1. Стадия В. N-(3-Аминопропил)метансульфонамид гидрохлорид Названное соединение получают в соответствии с методикой из примера 17, стадия В, с использованием трет-бутил-3-[(метилсульфонил)амино]пропилкарбамата как исходного материала. ЖХМС для Названное соединение получают в соответствии с методикой из примера 17, стадия С, с использованием N-(3-аминопропил)метансульфонамид гидрохлорида и 4-амино-N-гидрокси-1,2,5-оксадиазол-3 карбоксимидоилхлорида [приготовленного в соответствии с примером 1, стадии А-В] как исходных материалов, с выходом 19% Стадия Названное соединение получают в соответствии с методикой из примера 17, стадия D, с использованием 4-амино-N'-гидрокси-N-3-[(метилсульфонил)амино]пропил-1,2,5-оксадиазол-3-карбоксимидамида как исходного материала. ЖХМС для C7H15N6O4S (М+H)+: соотношение массы к заряду=279,0. Стадия Е. N-(3-Бром-4-фторфенил)-N'-гидрокси-4-(3-[(метилсульфонил)амино]пропиламино)1,2,5-оксадиазол-3-карбоксимидамид. Названное в заголовке соединение получают в соответствии с методикой из примера 17, стадия Е, с использованием Раствор 4-амино-N'-(3-хлор-4-фторфенил)-N'-гидрокси-3,2,5-оксадиазол-3-карбоксимидамида (80 г,0,29 моль) [см. публикацию патентной заявки США 2006/0258719] в тетрагидрофуране (500 мл) обрабатывают раствором 1,1'-карбонилдиимидазола (53 г, 0,32 моль) в тетрагидрофуране (200 мл) и кипятят с обратным холодильником в течение 1 ч. Реакционную смесь охлаждают до 25C и упаривают до точки,где осаждается большое количество твердого вещества. Гетерогенную смесь разбавляют этилацетатом(1,5 л) и промывают 1 н. раствором HCl (2300 мл), водой (300 мл) и раствором соли (200 мл). Органическую фракцию отделяют, сушат над безводным натрия сульфатом, фильтруют и упаривают с получением целевого продукта (88 г, количественный выход) в виде твердого вещества практически белого цвета. Полученный материал используют без дальнейшей очистки. ЖХМС для C10H6ClFN5O3 (М+H)+: соотношение массы к заряду=298,0. 1H ЯМР (400 МГц, ДМСО-d6):7,96 (дд, J=6,6, 2,3 Гц, 1H), 7,69-7,60 (м,2H), 6,60 (с, 2H). Стадия В. Раствор 3-(4-амино-1,2,5-оксадиазол-3-ил)-4-(3-хлор-4-фторфенил)-1,2,4-оксадиазол-5(4H)-она (15 г, 50 ммоль) в дихлорметане (120 мл) обрабатывают трифторуксусным ангидридом (14 мл, 100 ммоль),охлаждают до 0C и обрабатывают пиридином (8,2 мл, 100 ммоль). Реакционную смесь перемешивают при 25C, выдерживая при этой температуре в течение 10 мин, охлаждают до 0C и гасят водой (10 мл). Реакционную смесь разбавляют этилацетатом (500 мл) и промывают 1 н. раствором HCl (300 мл), водой(2200 мл) и раствором соли (200 мл). Органическую фракцию отделяют, сушат над безводным натрия сульфатом, фильтруют и упаривают до объема 50 мл. Полученный раствор нагревают (40-50C) и обрабатывают гексаном (600 мл) при энергичном перемешивании и затем петролейным эфиром (200 мл). Смесь перемешивают при 0C, выдерживая при этой температуре в течение 30 мин, и твердое вещество отделяют фильтрацией, промывают гексаном и сушат с получением целевого продукта (19,7 г, 99%) в виде твердого вещества белого цвета. ЖХМС для C12H5ClF4N5O4 (М+H)+: соотношение массы к заряду=394,0. 1H ЯМР (400 МГц, ДМСО-d6):7,82 (дд, J=6,6, 2,5 Гц, 1H), 7,59 (дд, J=9,0, 9,0 Гц, 1H), 7,527,47 (м, 1H). Стадия С. 4-(3-Хлор-4-фторфенил)-3-(4-[2-(тритиламино)этил]амино-1,2,5-оксадиазол-3-ил)1,2,4-оксадиазол-5(4H)-он Раствор 2-(тритиламино)этанола (10 г, 33 ммоль) [ЕР 599220 и J. Org. Chem. (2001), 66, 7615] и трифенилфосфина (8,7 г, 33 ммоль) в тетрагидрофуране (65 мл) при 0C обрабатывают диизопропилазодикарбоксилатом (7,0 мл, 35 ммоль) по каплям. Реакционную смесь перемешивают при 0C, выдерживая при этой температуре в течение 15 мин, обрабатывают раствором N-4-[4-(3-хлор-4-фторфенил)-5-оксо 4,5-дигидро-1,2,4-оксадиазол-3-ил]-1,2,5-оксадиазол-3-ил-2,2,2-трифторацетамида (9,3 г, 24 ммоль) в тетрагидрофуране (28 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 16 ч. Реакционную смесь упаривают, разбавляют этилацетатом (350 мл), охлаждают до 0C, обрабатывают 1 н. раствором HCl (200 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 1 ч. Реакционную смесь обрабатывают дополнительно 1 н. раствором HCl (150 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 3 ч. Органическую фракцию отделяют, промывают насыщенным раствором натрия бикарбоната (200 мл) и раствором соли (100 мл), сушат над безводным натрия сульфатом, фильтруют и упаривают до желтой пены, которую повторно упаривают с гексаном с получением маслянистого твердого вещества. Маслянистое твердое вещество обрабатывают метил третбутил эфиром (50 мл) и перемешивают с получением гетерогенной смеси. Твердое вещество отфильтровывают, промывают метил трет-бутил эфиром (30 мл) и сушат с получением целевого продукта (10 г,74%) в виде белого твердого вещества. ЖХМС для C31H24ClFN6O3Na (M+Na)+: соотношение массы к заряду=605,2. 1H ЯМР (300 МГц, ДМСО-d6):7,97 (дд, J=6,7, 2,6 Гц, 1H), 7,71-7,66 (м, 1H), 7,60 (дд, J=9,1,8,8 Гц, 1H), 7,40-7,37 (м, 6H), 7,28-7,23 (м, 6 H), 7,18-7,12 (м, 3H), 6,59 (дд, J=5,9, 5,6 Гц, 1H), 3,37-3,31 (м,2H), 2,96 (дд, J=7,6, 7,6 Гц, 1H), 2,27-2,19 (м, 2H). Стадия Предварительно подготовленный раствор триизопропилсилана (3,4 мл, 17 ммоль) и трифторуксусной кислоты(44 мл,57 0 ммоль) добавляют к 4-(3-хлор-4-фторфенил)-3-(4-[2(тритиламино)этил]амино-1,2,5-оксадиазол-3-ил)-1,2,4-оксадиазол-5(4H)-она (6,5 г, 11 ммоль) и полученную суспензию перемешивают при 25C, выдерживая при этой температуре в течение 30 мин. Реакционную смесь фильтруют и промывают трифторуксусной кислотой. Фильтрат упаривают до состояния масла, которое разбавляют метанолом (25 мл), охлаждают до 0 С, обрабатывают 4 М раствором HCl в 1,4-диоксане (14 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 15 мин. Смесь упаривают до твердого вещества, которое обрабатывают диэтиловым эфиром (50 мл) и фильтруют. Твердое вещество промывают диэтиловым эфиром (50 мл) и сушат с получением целевого продукта(4,1 г, 98%) в виде твердого вещества белого цвета. ЖХМС для C12H11ClFN6O3 (M+H)+: соотношение массы к заряду=341,1. 1 Н ЯМР (300 МГц, ДМСО-d6):8,05-8,00 (м, 4H), 7,75-7,69 (м, 1H), 7,64 (дд, J=9,1,8,8 Гц, 1H), 6,77 (дд, J=5,9, 5,9 Гц, 1H), 3,54-3,47 (м, 2H), 3,04-2,99 (м, 2H). Стадия Е. Раствор хлорсульфонилизоцианата (2,0 мл, 23 ммоль) в дихлорметане (70 мл) обрабатывают третбутиловым спиртом (2,2 мл, 23 ммоль) при 0C и перемешивают при 25C, выдерживая при этой температуре в течение 1 ч. Полученную смесь добавляют к суспензии 3-4-[(2-аминоэтил)амино]-1,2,5 оксадиазол-3-ил-4-(3-хлор-4-фторфенил)-1,2,4-оксадиазол-5(4H)-она гидрохлорида (4,3 г, 11 ммоль) в дихлорметане (70 мл). Реакционную смесь обрабатывают раствором триэтиламина (6,3 мл, 45 ммоль) в дихлорметане (20 мл) при 0C и перемешивают при 25C, выдерживая при этой температуре в течение 3 ч. Реакционную смесь разбавляют 0,1 н. раствором HCl и экстрагируют этилацетатом (2100 мл). Объединенные органические фракции промывают раствором соли (100 мл), сушат над безводным натрия сульфатом, фильтруют и упаривают до твердого вещества белого цвета. Твердое вещество белого цвета разбавляют дихлорметаном (100 мл), обрабатывают трифторуксусной кислотой (20 мл) и перемешивают при 25C, выдерживая при этой температуре в течение 3 ч. Реакционную смесь упаривают до неочищенного остатка, который очищают хроматографией на силикагеле с получением целевого продукта (3,7 г,78%) в виде твердого вещества белого цвета. ЖХМС для C12H12ClFN7O5S (M+H)+: соотношение массы к заряду=420,0. 1 Н ЯМР (300 МГц, ДМСО-d6):7,98 (дд, J=6,4, 2,1 Гц, 1H), 7,70-7,60 (м, 2H), 6,66 (т, J=5,9 Гц, 1H), 6,57 (с, 2H), 6,52 (т, J=5,9 Гц, 1H), 3,42-3,35 (м, 2H), 3,13-3,06 (м, 2H). Стадия F. 4-(2-[(Аминосульфонил)амино]этиламино)-N-(3-хлор-4-фторфенил)-N'-гидрокси-1,2,5 оксадиазол-3-карбоксимидамид. РастворN-[2-(4-[4-(3-хлор-4-фторфенил)-5-оксо-4,5-дигидро-1,2,4-оксадиазол-3-ил]-1,2,5 оксадиазол-3-иламино)этил]сульфамида (3,7 г, 8,8 ммоль) в метаноле (70 мл) обрабатывают 2 М раствором NaOH (18 мл, 35 ммоль) и перемешивают при 25C, выдерживая при этой температуре в течение 2 ч. Реакционную смесь гасят с помощью 6 н. раствора HCl до pH 7 и удаляют метанол при сниженном давлении. Осажденное твердое вещество фильтруют и промывают водой с получением целевого продукта(3,2 г, 92%) в виде твердого вещества белого цвета. ЖХМС для C11H14ClFN7O4S (М+H)+: соотношение массы к заряду=394,0. 1H ЯМР (400 МГц, ДМСО-d6):7,96 (дд, J=6,8, 2,1 Гц, 0,05H), 7,32-7,29 (м, 0, 1H),7,18 (дд, J=9,1, 9,1 Гц, 0,95H), 6,93 (дд, J=6,4, 2,7 Гц, 0,95H), 6,71-6,66 (м, 0,95H), 6,33 (шс, 1H), 3,35-3,27
МПК / Метки
МПК: A61P 31/00, A61P 35/00, A61P 27/00, A61P 43/00, C07D 271/08, A61P 29/00, A61P 1/00, A61P 17/00, A61K 31/4245, A61P 19/00, A61P 11/00, A61P 37/00, A61P 25/00
Метки: 1,2,5-оксадиазолы, ингибиторов, качестве, индоламин-2,3-диоксигеназы
Код ссылки
<a href="https://eas.patents.su/30-22669-125-oksadiazoly-v-kachestve-ingibitorov-indolamin-23-dioksigenazy.html" rel="bookmark" title="База патентов Евразийского Союза">1,2,5-оксадиазолы в качестве ингибиторов индоламин-2,3-диоксигеназы</a>
Предыдущий патент: Прекомпозиция серного цемента и изделие из серного цемента
Следующий патент: Способ формования алюминиевых торцевых резервуаров теплообменников
Случайный патент: Способ получения эфиров глиоксиловой кислоты или их гидратов












