Тиадиазолы и оксадиазолы и их применение в качестве ингибиторов фосфодиэстеразы-7
Номер патента: 7179
Опубликовано: 25.08.2006
Авторы: Андрианжара Шарль, Лортиуа Эдвиж, Вернье Фабрис, Бернарделли Патрик, Дюкро Пьер
Формула / Реферат
1. Соединение, имеющее следующую формулу (I):

в которой Y представляет собой О или S;
R1 представляет собой С4-С10алкил, С2-С10алкенил, С2-С10алкинил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которых
X1 представляет собой одинарную связь, С1-С6алкилен, С2-С6алкенилен, циклоалкилен, арилен или двухвалентный гетероцикл, и
R4 представляет собой
1) Н, =O, NO2, CN, галоген, С1-С6галогеналкил, С1-С6алкил, биоизостер карбоновой кислоты,
2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,
3) C(=O)NR7R8, C(=S)NR7R8, C(=CH-NO2)NR7R8, C(=N-CN)NR7R8, C(=N-SO2NH2)NR7R8, C(=NR7)NHR8, C(=NR7)R8, C(=NR9)NHR8, C(=NR9)R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10, C(=NR9)R10, C(=CH-NO2)NR9R10, C(=N-SO2NH2)NR9R10, C(=N-CN)NR9R10 или C(=S)NR9R10;
R2 представляет собой C1-С6алкил, циклоалкил,
каждый возможно замещенный одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из
1) Н, биоизостера карбоновой кислоты,
2) СООН, СОО(С1-С6алкил), ОН, O(С1-С6)алкил,
3) C(=O)NR11R12 или NR11R12, в которых R11 и R12 являются одинаковыми или разными и выбраны из Н и C1-C6алкила;
R3 представляет собой Х2-R'3, где
Х2 представляет собой одинарную связь или группу, выбранную из С1-С4алкилена, С2-С6алкенилена, С2-С6алкинилена, каждого возможно замещенного одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из
1) Н, C1-С3алкила, С3-С4циклоалкила, арила, гетероцикла, =O, CN,
2) OR5, =NR5 или
3) NR13R14, где R13 и R14 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10;
R'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами Х3-R17, одинаковыми или разными, в которых
Х3 представляет собой одинарную связь, С1-С6алкилен, С2-С6алкенилен, С2-С6алкинилен, циклоалкилен, арилен, двухвалентный гетероцикл или двухвалентную полициклическую группу, и
R17 представляет собой
1) Н, =O, NO2, CN, C1-С6галогеналкил, галоген, циклоалкил,
2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,
3) C(=O)NR15R16, C(=S)NR15R16, C(=N-CN)NR15R16, C(=N-SO2NH2)NR15R16, C(=CH-NO2)NR15R16, SO2NR15R16, C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=N-CN)NR9R10, C(=N-SO2NH2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10,
4) гетероцикл, возможно замещенный одной или несколькими группами R5;
R5 и R6 являются одинаковыми или разными и выбраны из
Н, C1-С6алкила, С2-С6алкенила, С2-С6алкинила; Х4-циклоалкила, Х4-циклоалкенила, Х4-арила, Х4-гетероцикла или Х4-полициклической группы, в которых Х4 представляет собой одинарную связь, C1-С6алкилен или С2-С6алкенилен;
каждого(ой) возможно замещенного(ой) одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из галогена, =O, COOR20, CN, OR20, С1-С6алкила, возможно замещенного OR20, О-С1-С6алкила, возможно замещенного OR20, С(=O)-С1-С6алкила, C1-С6галогеналкила,
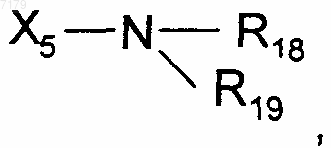
где Х5 представляет собой одинарную связь или С1-С6алкилен, и R18, R19 и R20 являются одинаковыми или разными и выбраны из Н или С1-С6алкила; Х6-гетероцикла, Х6-арила, Х6-циклоалкила, Х6-циклоалкенила, Х6-полициклической группы, в которых Х6 выбран из одинарной связи или С1-С6алкилена, причем эти группы являются возможно замещенными одной или несколькими группами, одинаковыми или разными, выбранными из галогенов, СООR21, OR21 или (СН2)nNR21R22, где n является числом 0, 1 или 2, и R21 и R22 являются одинаковыми или разными и выбраны из Н или С1-С6алкила;
R9 выбран из Н, CN, ОН, С1-С6алкила, O-C1-С6алкила, арила, гетероцикла, SO2NH2 или
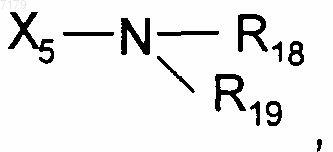
где Х5 представляет собой одинарную связь или С1-С6алкилен и R18 и R19 являются одинаковыми или разными и выбраны из Н или С1-С6алкила;
R10 выбран из водорода, С1-С6алкила, циклопропила или гетероцикла;
или его фармацевтически приемлемое производное,
при условии,что
когда R1 представляет собой фенил, тогда он несет на себе по меньшей мере один заместитель, иной чем Н,
когда Х2 представляет собой одинарную связь, и оба R1 и R'3 представляют собой фенил, тогда каждый R1 и R'3 несет на себе по меньшей мере один заместитель, иной чем Н,
когда Х2 представляет собой одинарную связь, и R'3 представляет собой фенил, тогда R'3 не замещен сложным эфиром или карбоновой кислотой в орто-положении,
когда Y представляет собой О, и R3 представляет собой фенил или циклоалкил, незамещенный или замещенный, тогда R1 является иным, чем замещенный 1,3,5-триазин,
атом радикала R3, который связан с тиадиазольной группой, является атомом углерода,
за исключением следующих соединений:
(3,5-дифенил-3Н-[1,3,4]оксадиазол-2-илиден)нафталин-2-ил-амин,
трет-бутил-(3-трет-бутил-5-фенил-3H-[1,3,4]оксадиазол-2-илиден)амин,
диэтиловый эфир 2-[(3-метил-5-фенил-3Н-[1,3,4]оксадиазол-2-илиденамино)метилен]малоновой кислоты,
[4-(4-метоксифенил)-5-(4-метоксифенилимино)-4,5-дигидро[1,3,4]оксадиазол-2-ил]фенилметанон,
(4-метоксифенил)-[4-(4-метоксифенил)-5-(4-метоксифенилимино)-4,5-дигидро[1,3,4]оксадиазол-2-ил]метанон,
[4-(4-фторфенил)-5-(4-метоксифенилимино)-4,5-дигидро[1,3,4]оксадиазол-2-ил]фенилметанон,
1-фенил-1-[4-фенил-5-(5-трифторметил-2H-[1,2,4]триазол-3-илимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]метанон,
1-[4-фенил-5-(5-трифторметил-2H-[1,2,4]триазол-3-илимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]-1-тиофен-2-ил-метанон,
1-фенил-1-(4-фенил-5-п-толилимино-4,5-дигидро[1,3,4]тиадиазол-2-ил)метанон,
циклогексил-[3-(2,4,6-трихлорфенил)-5-(2,3,3-триметилциклопент-1-енилметил)-3H-[1,3,4]тиадиазол-2-илиден]амин,
2-(3,5-дифенил-3H-[1,3,4]тиадиазол-2-илиденамино)-1,4-дифенил-бут-2-ен-1,4-дион,
диметиловый эфир 2-[3-фенил-5-(1-фенилметаноил)-3H-[1,3,4]тиадиазол-2-илиденамино]-бут-2-ендиовой кислоты,
диметиловый эфир 2-[5-(1-фенилметаноил)-3-п-толил-3H-[1,3,4]тиадиазол-2-илиденамино]-бут-2-ендиовой кислоты и
диметиловый эфир 2-[3-(4-хлорфенил)-5-(1-фенилметаноил)-3H-[1,3,4]тиадиазол-2-илиденамино]бут-2-ендиовой кислоты,
и где
циклоалкил представляет собой насыщенный монокарбоцикл, содержащий от 3 до 10 атомов углерода;
циклоалкенил представляет собой ненасыщенный монокарбоцикл, содержащий от 3 до 10 атомов углерода и содержащий 1 или 2 двойные связи;
арил представляет собой ненасыщенный карбоцикл, содержащий только атомы углерода в циклической структуре в количестве от 5 до 10;
гетероцикл представляет собой ненасыщенный или насыщенный моноцикл, содержащий в циклической структуре от 1 до 7 атомов углерода и от 1 до 4 гетероатомов, одинаковых или разных, выбранных из атомов азота, серы и кислорода;
полициклическая группа включает в себя по меньшей мере два цикла, одинаковых или разных, выбранных из арила, гетероцикла, циклоалкильных, циклоалкенильных групп, конденсированных друг с другом с образованием указанной полициклической группы;
бициклическая группа представляет собой полициклическую группу, которая включает в себя два цикла, выбранные из арила, гетероцикла, циклоалкила или циклоалкенила, конденсированных друг с другом с образованием указанной бициклической группы;
биоизостер карбоновой кислоты представляет собой тетразол, гидроксамовую кислоту, изоксазол, гидрокситиадиазол, сульфонамид, сульфонилкарбоксамид, фосфонаты, фосфонамиды, фосфинаты, сульфонаты, ацилсульфонамид, меркаптоазол, ацилцианамиды.
2. Соединение формулы (I) по п.1, где R1 представляет собой С4-С6алкил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,
каждый(ая) возможно замещенный(ая) одной или несколькими группами Х1-R4, одинаковыми или разными, в которых
X1 представляет собой одинарную связь, двухвалентный гетероцикл или C1-С6алкилен, и
R4 выбран из
1) Н, =O, галогена, CN, C1-С6галогеналкила, предпочтительно СF3, C1-С6алкила, биоизостера карбоновой кислоты,
2) COOR5, SO2R5, OR5, C(=O)R5,
3) C(=O)NR7R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6, С(=O)R5, SO2R5, C(=NR9)NHR10, C(=NR9)R10 или C(=S)NR9R10, где R5 выбран из водорода или C1-С6алкила, возможно замещенного ОН, и R6, R9 и R10 являются одинаковыми или разными и выбраны из водорода или C1-С6алкила.
3. Соединение по любому из пп.1-2, где R2 представляет собой С1-С6алкил.
4. Соединение по любому из пп.1-3, где R3 представляет собой Х2-R'3, где
Х2 представляет собой одинарную связь, С1-C4алкилен, С2-С6алкенилен или С2-С6алкинилен, и
R'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X3-R17, одинаковыми или разными, в которых
Х3 представляет собой одинарную связь или C1-С6алкилен, и
R17 представляет собой
1) Н, =O, NO2, CN, C1-С6галогеналкил, галоген, циклоалкил,
2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,
3) C(=O)NR15R16, C(=S)NR15R16, C(=N-CN)NR15R16, C(=CH-NO2)NR15R16, SO2NR15R16, C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=N-CN)NR9R10, C(=NR9)NHR10 или C(=NR9)R10,
4) гетероцикл, возможно замещенный одной или несколькими группами R5.
5. Соединение по любому из пп.1-4, где R1 представляет собой циклоалкил, предпочтительно циклогексан, циклоалкенил, арил, предпочтительно фенил, или бициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которых
X1 представляет собой одинарную связь или двухвалентный гетероцикл, и
R4 выбран из
1) Н, галогена, CF3, =O,
2) COOR5, OR5,
3) C(=O)NR5R6,
где R5 и R6 являются одинаковыми или разными и выбраны из водорода или метила.
6. Соединение по любому из пп.1-5, где R2 представляет собой СН3.
7. Соединение по любому из пп.1-6, в котором R3 представляет собой X2-R'3, где
Х2 представляет собой одинарную связь, С1-C4алкилен или С2-С6алкенилен, и
R'3 представляет собой циклоалкил, арил, предпочтительно фенил, гетероцикл или полициклическую группу;
каждый(ую) возможно замещенный(ую) одной или несколькими группами Х3-R17, одинаковыми или разными, в которых
Х3 представляет собой одинарную связь или -СН2-, и
R17 представляет собой
1) Н, CN, CF3, галоген, NO2,
2) COOR5, SO2R5, OR5, C(=O)R5,
3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в котоЁых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=NR9)NHR10, C(=NR9)R10 или C(=N-CN)NR9R10,
4) гетероцикл, возможно замещенный одной или несколькими группами R5.
8. Соединение по пп.2, 3 и 4.
9. Соединение по пп.5, 6 и 7.
10. Соединение по п.1, где R1 представляет собой циклогексан, фенил или бициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которых
X1 представляет собой одинарную связь или двухвалентный гетероцикл, и
R4 выбран из
1) Н, галогена, CF3,
2) СООН, ОН,
3) C(=O)NR7R8, где R7 и R8 являются одинаковыми или разными и выбраны из Н или C1-С6алкила,
R2 представляет собой СН3, и
R3 представляет собой Х2-R'3, где
X2 представляет собой одинарную связь, С1-С4алкилен или С2-С6алкенилен, и
R'3 представляет собой фенил, гетероцикл или полициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X3-R17, одинаковыми или разными, в которых
Х3 представляет собой одинарную связь, и
R17 представляет собой:
1) CN, ОН, CF3, =O, C1-С6алкокси, галоген,
2) COOR5, SO2R5,
3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, C(=O)R5, C(=O)NR5R6, R5 или R6,
4) гетероцикл, возможно замещенный одной или несколькими группами R5.
11. Соединение по любому из пп.1-10, где Y представляет собой S.
12. Соединение по любому из пп.1-10, где Y представляет собой О.
13. Соединение, выбранное из группы, состоящей из
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
(1R*,2R*)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанкарбоновой кислоты,
(S)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-фенилэтанола,
2-{2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенил}этанола,
{1-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклопентил}метанола,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанкарбоновой кислоты,
5-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-фторбензойной кислоты,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2,5,6-трифторбензойной кислоты,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]пропиламина,
(S)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бутан-1-ола,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклобутиламина,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]азепан-2-она,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклопентилмина,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогептиламина,
(S)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-3-метилбутан-1-ола,
2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-метилпропан-1-ола,
трет-бутил-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]изопропиламина,
4-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-(1-этилпропил)амина,
4-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенола,
N-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексан-1,2-диамина,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-(4-фторфенил)амина,
N-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексан-1,4-диамина,
(1R*,2S*)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанола,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-(4-трифторметилфенил)амина,
3-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенола,
5-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-гидроксибензойной кислоты,
(1-аза-бицикло[2.2.2]окт-3-ил)-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенола,
(R)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бутан-1-ола,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-(3-фторфенил)амина,
(3-хлорфенил)-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
{3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенил}уксусной кислоты,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензамида,
бицикло[2.2.1]гепт-2-ил-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
(1R*,2R*)-2-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанола,
5-(5-циклогексил-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино)-2-метоксифенола,
3-(5-циклогексил-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино)бензойной кислоты,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-4-гидроксибензойной кислоты,
(5-циклогексил-3-метил-3H-[1,3,4]тиадиазол-2-илиден)-(3-метансульфонилфенил)амина,
(1R*,2R*)-2-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанола,
циклогексил-[5-(2,4-дихлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
[5-(2-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
циклогексил-[3-метил-5-(4-трифторметилфенил)-3H-[1,3,4]тиадиазол-2-илиден]амина,
циклогексил-(3-метил-5-пиридин-4-ил-3H-[1,3,4]тиадиазол-2-илиден)амина,
[5-(3-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензонитрила,
циклогексил-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
[3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]диметиламина,
циклогексил-[5-(3-метокси-4-нитрофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
2,4-дихлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
циклогексил-(3-метил-5-тиофен-3-ил-3H-[1,3,4]тиадиазол-2-илиден)амина,
циклогексил-[5-(3,5-дихлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
циклогексил-[5-(2-этил-5-метил-2Н-пиразол-3-ил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
[5-(3-хлор-2,6-диметоксифенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
циклогексил-(5-изоксазол-5-ил-3-метил-3H-[1,3,4]тиадиазол-2-илиден)амина,
циклогексил-[3-метил-5-(5-пиридин-2-ил-тиофен-2-ил)-3H-[1,3,4]тиадиазол-2-илиден]амина,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксибензол-1,3-диола; соединения с трифторметансульфоновой кислотой,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2,3-диметоксифенола, соединения с трифторметансульфоновой кислотой,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
2-хлор-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-6-метоксифенола; соединения с 1,1,1-трифторметансульфоновой кислотой,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N,N-диэтилбензолсульфонамида,
{5-[4-хлор-3-(4-метилпиперазин-1-сульфонил)фенил]-3-метил-3H-[1,3,4]тиадиазол-2-илиден}циклогексиламина,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-4-илметил-бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-изопропил-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-[2-(2-метокси-этокси)этил]бензолсульфонамида,
С-хлор-(циклогексилимино-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(диметиламиногидрокси-пропил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2,3-дигидрокси-пропил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-(2-гидрокси-3-пирролидин-1-ил-пропил)бензолсульфонамида,
2-хлор-5-(циклогексилиминометил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-диэтиламиноэтил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-диметиламино-пропил)-N-этилбензолсульфонамида,
метилового эфира [5-(4-хлорфенил)-2-циклогексилимино-[1,3,4]тиадиазол-3-ил]уксусной кислоты,
метилового эфира 3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-гидроксиэтил)бензамида,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-метилбензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензол-1,2-диола,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2,6-диметоксифенола,
6-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)пиридин-2-ола,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензол-1,2,3-триола,
2-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)хинолин-8-ола,
циклогексил-(3-метил-5-пиразин-2-ил-3H-[1,3,4]тиадиазол-2-илиден)амина,
5-[(Е)-2-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)винил]-2-метоксифенола,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксифенола,
циклогексил-(3-метил-5-хинолин-8-ил-3H-[1,3,4]тиадиазол-2-илиден)амина,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]диметиламина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
[5-(5-хлор-1Н-индол-2-ил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексил-амина; соединения с трифторметансульфоновой кислотой,
2-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенола; соединения с 1,1,1-трифторметансульфоновой кислотой,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксифенола, соединения с 1,1,1-трифторметансульфоновой кислотой,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенола, соединения с 1,1,1-трифторметансульфоновой кислотой,
циклогексил-[5-(3,4-диметоксифенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
[5-(3-бром-4-метоксифенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
циклогексил-[5-(4-метоксифенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амина,
циклогексил-(3-метил-5-фенил-3H-[1,3,4]тиадиазол-2-илиден)амина,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенола,
метилового эфира 4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-гидроксибензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
гидрохлорида 4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2Н-тетразол-5-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-хинолин-8-ил-бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2,6-диметоксипиридин-3-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-изопропилбензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этилбензамида,
циклогексил-{5-[4-(1-этил-1Н-тетразол-5-ил)фенил]-3-метил-3H-[1,3,4]тиадиазол-2-илиден}амина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-диметиламиноэтил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-4-илметилбензамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N,N-диэтилбензолсульфонамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-изобутилбензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-метилбензамида,
4-(циклогексилиминометил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-диметиламиноэтил)-N-метил-бензамида,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-1-(3-гидроксиметил-пиперидин-1-ил)метанона,
трет-бутилового эфира 2-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензоиламино]-3-(4-гидроксифенил)пропионовой кислоты,
2-({1-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]метаноил}амино)-3-(4-гидроксифенил)пропионовой кислоты, соединения с 2,2,2-трифторуксусной кислотой,
трет-бутилового эфира (S)-2-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил) бензоиламино]пропионовой кислоты,
(S)-2-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензоиламино]пропионовой кислоты; соединения с 2,2,2-трифторуксусной кислотой,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-(4-пиридин-2-ил-пиперазин-1-ил)метанона,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-[4-(4-фторфенил)пиперазин-1-ил]метанона,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(3,4,5-триметоксибензил)бензамида,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-(4-пиримидин-2-ил-пиперазин-1-ил)метанона,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-(4-метилпиперазин-1-ил)метанона,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-[3-(4-метилпиперазин-1-ил) пропил]бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(1-этилпирролидин-2-илме-тил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-3-илметилбензамида,
N-бензил-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
N-(1-бeнзилпипepидин-4-ил)-4-(5-циклoгeкcилиминo-4-мeтил-4,5-дигидpo[1,3,4]тиадиазол-2-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-этил-2Н-пиразол-3-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-морфолин-4-ил-этил)бензамида,
[5-(4-((N-циано-N'-этилморфолин)карбоксимидамид)фенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-пирролидин-1-ил-этил)бензамида,
циклогексил-(3-метил-5-пиридин-3-ил-3H-[1,3,4]тиадиазол-2-илиден)амина,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
(5-бензю[1,3]диоксол-5-ил-3-метил-3H-[1,3,4]тиадиазол-2-илиден)циклогексиламина,
циклогексил-[3-метил-5-(3,4,5-триметоксифенил)-3H-[1,3,4]тиадиазол-2-илиден]амина,
4-(5-циклопентилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензонитрила,
4-(5-циклогептилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензонитрила,
4-[5-(4-фторфенилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-(3-гидроксифенилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
5-[5-(4-цианофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-фторбензойной кислоты,
4-[4-метил-5-(цис-4-метилциклогексилимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[4-метил-5-(транс-4-метилциклогексилимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-(транс-4-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-(бицикло[2.2.1]гепт-2-илимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-((1R*,2R*)-2-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-((1R*,2S*)-2-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
4-[5-((1R*,3S*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензонитрила,
(1R*,3R*)-3-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанола,
4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензойной кислоты,
4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]-N-(2-морфолин-4-ил-этил)бензамида,
4-[5-(транс-4-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензойной кислоты,
4-[5-(транс-4-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]-N-(2-гидрокси-1,1-диметилэтил)бензамида,
4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]-N-(2-гидрокси-1,1-диметилэтил)бензамида,
N-трет-бутил-4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
N-(1,1-диметил-3-оксобутил)-4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
N-(2-циано-1,2,2-триметилэтил)-4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
метилового эфира 1-{4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензоиламино}циклопропанкарбоновой кислоты,
4-(5-циклопентилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
4-(5-циклогептилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
4-[5-(4-фторфенилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-(3-гидроксифенилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
5-[5-(4-карбамоилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-фторбензойной кислоты,
4-[4-метил-5-(4-метилциклогексилимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-(4-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-(бицикло[2.2.1]гепт-2-илимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-((1R*,2R*)-2-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-((1R*,2S*)-2-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-((1R*,3S*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[4-метил-5-(3-оксоциклогексилимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-(3,3-дифторциклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-((1R*,3R*)-3-фторциклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
4-[5-(циклогекс-3-енилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]бензамида,
(1R*,3R*)-3-{3-метил-5-[4-(1Н-тетразол-5-ил)фенил]-3H-[1,3,4]тиадиазол-2-илиденамино}циклогексанола,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-гидроксибензойной кислоты,
3-[5-(4-цианофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[5-(4-карбамоилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
2-фтор-5-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанкарбоновой кислоты,
[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]пиперидин-1-ил-амина,
[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден](тетрагидропиран-4-ил)амина,
3-[5-(4-ацетиламинофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
N-{4-[5-(транс-4-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]фенил}ацетамида,
N-{4-[5-((1R*,3S*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]фенил}ацетамида,
N-{4-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]фенил}ацетамида,
N-{5-[5-((1R*,3R*)-3-гидроксициклогексилимино)-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил]пиридин-2-ил}ацетамида,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензонитрила,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-[3-(1Н-тетразол-5-ил)фенил]амина,
3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-N-гидроксибензамидина,
3-{3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенил}-[1,2,4]оксадиазол-5-ола,
[5-(4-бром-3-метилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метилбензонитрила,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метилбензамида,
[5-(4-бром-3-метоксифенил)-3-метил-2,3-дигидро[1,3,4]тиадиазол-2-ил]циклогексиламина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксибензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-гидроксибензамида,
метилового эфира 4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-нитро-бензойной кислоты,
метилового эфира 2-амино-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
метилового эфира 2-ацетиламино-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
2-амино-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
7-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-3H-хиназолин-4-она,
7-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)хиназолин-4-иламина,
7-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-1Н-хиназолин-2,4-диона,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксибензолсульфонамида,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксибензолсульфонамида,
метилового эфира 3-[5-(3-цианофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[5-(3-цианофенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[3-метил-5-пиридин-2-ил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
3-[5-(4-хлор-3-сульфамоилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензонитрила,
циклогексил-{3-метил-5-[4-(1Н-тетразол-5-ил)фенил]-3H-[1,3,4]тиадиазол-2-илиден}амина,
циклогексил-[3-метил-5-(4-нитрофенил)-3H-[1,3,4]тиадиазол-2-илиден]амина,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фениламина,
[5-(4-(N-циано-N'-(2-диметиламиноэтил)карбоксимидамид)фенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
N-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]ацетамида,
[5-(4-(бис-этилсульфониламино)фенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
[5-(4-(1-(2-диметиламиноэтил)амино-2-нитровиниламино)фенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
(Е)-N1-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-2-нитроэтен-1,1-диамина,
[5-(N-циано-N'-метил-4-карбоксимидамидфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
[5-(4-(N-циано-N'-аминокарбоксимидамид)фенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламина,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]амида этансульфоновой кислоты,
[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-фенил]мочевины,
1-[4-(циклогексилиминометил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-3-(2-диметиламиноэтил)мочевины,
2-хлор-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
метилового эфира 2-хлор-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
2-хлор-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
метилового эфира 4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]оксадиазол-2-ил)бензойной кислоты и
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]оксадиазол-2-ил)бензамида.
14. Соединение по п.13, выбранное из группы, состоящей из
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2-метоксибензол-1,3-диола; соединения с трифторметансульфоновой кислотой,
5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-2,3-диметоксифенола; соединения с трифторметансульфоновой кислотой,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N,N-диэтилбензолсульфонамида,
{5-[4-хлор-3-(4-метилпиперазин-1-сульфонил)фенил]-3-метил-3H-[1,3,4]тиадиазол-2-илиден}циклогексиламина,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-4-илметил-бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этилбензолсульфон-амида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-изопропил-N-(2-морфолин-4-ил-этил)бензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-[2-(2-метокси-этокси)этил]бензолсульфонамида,
С-хлор-(циклогексилиминометил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(диметиламиногидроксипро-пил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2,3-дигидроксипро-пил)-N-этилбензолсульфонамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этил-N-(2-гидрокси-3-пирролидин-1-ил-пропил)бензолсульфонамида,
3-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-хинолин-8-ил-бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2,6-диметоксипиридин-3-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-изопропилбензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-этилбензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-диметиламиноэтил)бенза-мида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-4-илметилбензамида,
2-хлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N,N-диэтилбензолсульфонамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-метилбензамида,
трет-бутилового эфира 2-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензо-иламино]-3-(4-гидроксифенил)пропионовой кислоты,
(S)-2-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензоиламино]-3-(4-гид-роксифенил)пропионовой кислоты; соединения с 2,2,2-трифторуксусной кислотой,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(3,4,5-триметоксибензил)бен-замида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-[3-(4-метилпиперазин-1-ил) пропил]бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-пиридин-3-илметилбензамида,
N-(1-бензилпиперидин-4-ил)-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил) бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-этил-2Н-пиразол-3-ил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-морфолин-4-ил-этил)бензамида,
4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-N-(2-пирролидин-1-ил-этил)бензамида,
3-[5-(4-карбамоилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойной кислоты,
[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]-[3-(1Н-тетразол-5-ил)фенил]амина,
метилового эфира 2-амино-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензойной кислоты,
2-амино-4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензамида,
7-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)-3H-хиназолин-4-она,
7-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)хиназолин-4-иламина,
N-[4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]ацетамида и
1-[4-(циклогексилиминометил-4,5-дигидро[1,3,4]тиадиазол-2-ил)фенил]-3-(2-диметиламиноэтил)мочевины.
15. Фармацевтическая композиция, содержащая соединение формулы (I)
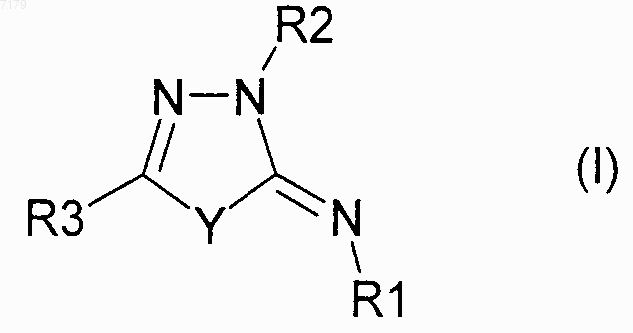
где Y представляет собой О или S;
R1 представляет собой С1-С10алкил, С2-С10алкенил, С2-С10алкинил, циклоалкил, циклоалкенил, гетероцикл, арил или полициклическую группу,
каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которых
X1 представляет собой одинарную связь, C1-С6алкилен, С2-С6алкенилен, циклоалкилен, арилен или двухвалентный гетероцикл, и
R4 представляет собой
1) Н, =O, NO2, CN, галоген, C1-С6галогеналкил, C1-С6алкил, биоизостер карбоновой кислоты,
2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,
3) C(=O)NR7R8, C(=S)NR7R8, C(=N-CN)NR7R8, C(=N-SO2NH2)NR7R8, C(=CH-NO2)NR7R8, C(=NR7)NHR8, C(=NR7)R8, C(=NR9)NHR8, C(=NR9)R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10, C(=NR9)R10, C(=CH-NO2)NR9R10, C(=N-SO2NH2)NR9R10, С(=N-СN)NR9R10 или C(=S)NR9R10;
R2 представляет сосющ C1-С6алкил, циклоалкил, каждый возможно замещенный одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из
1) Н, биоизостера карбоновой кислоты,
2) СООН, СОО(С1-С6алкил), ОН, O(С1-С6)алкил,
3) C(=O)NR11R12 или NR11R12, в которых R11 и R12 являются одинаковыми или разными и выбраны из Н и C1-C6 алкила;
R3 представляет собой Х2-R'3, где
Х2 представляет собой одинарную связь или группу, выбранную из С1-С4алкилена, С2-С6алкенилена, С2-С6алкинилена, каждого возможно замещенного одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из
1) Н, C1-С3алкила, С3-С4циклоалкила, арила, гетероцикла, =O, CN,
2) OR5, =NR5 или
3) NR13R14, в котором R13 и R14 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10;
R'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,
каждый(ую) замещенный(ую) одной или несколькими группами X3-R17, одинаковыми или разными, в которых
Х3 представляет собой одинарную связь, C1-С6алкилен, С2-С6алкенилен, циклоалкилен, арилен, двухвалентный гетероцикл или двухвалентную полициклическую группу, и
R17 представляет собой
1) Н, =O, NO2, CN, C1-С6галогеналкил, галоген, биоизостер карбоновой кислоты, циклоалкил,
2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,
3) C(=O)NR15R16, C(=S)NR15R16, C(=N-CN)NR15R16, C(=N-SO2NH2)NR15R16, C(=CH-NO2)NR15R16, SO2NR15R16, C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=N-CN)NR9R10, C(=N-SO2NH2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10,
4) гетероцикл, возможно замещенный одной или несколькими группами R5;
где R5 и R6 являются одинаковыми или разными и выбраны из Н, C1-С6алкила, С2-С6алкенила, С2-С6алкинила; Х4-циклоалкила, Х4-циклоалкенила, Х4-арила, Х4-гетероцикла или Х4-полициклической группы, в которых Х4 представляет собой одинарную связь, C1-С6алкилен или С2-С6алкенилен,
каждого(ой) возможно замещенного(ой) одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из галогена, =O, COOR20, CN, OR20, C1-С6алкила, возможно замещенного OR20, O-C1-С6алкила, возможно замещенного OR20, С(=O)-С1-С6 алкила, C1-С6галогеналкила,
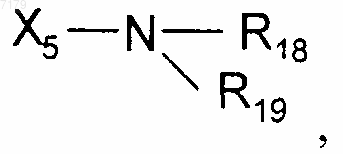
где Х5 представляет собой одинарную связь или C1-С6алкил, и R18, R19 и R20 являются одинаковыми или разными и выбраны из Н или C1-С6алкила; Х6-гетероцикла, Х6-арила, Х6-циклоалкила, Х6-циклоалкенила, Х6-полициклической группы, в которых Х6 выбран из одинарной связи или C1-С6алкилена, причем эти группы являются возможно замещенными одной или несколькими группами, одинаковыми или разными, выбранными из галогенов, COOR21, OR21 или (CH2)nNR21R22, в которых n является числом 0, 1 или 2, и R21 и R22 являются одинаковыми или разными и выбраны из Н или С1-С6алкила;
R9 выбран из Н, CN, ОН, C1-С6алкила, О-С1-С6алкила, арила, гетероцикла, SO2NH2 или
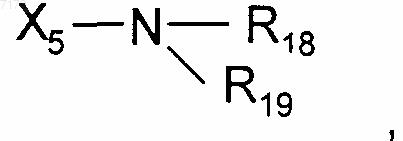
где X5 представляет собой одинарную связь или С1-С6алкилен, и R18 и R19 являются одинаковыми или разными и выбраны из Н или C1-С6алкила;
R10 выбран из водорода, C1-С6алкила, циклопропила или гетероцикла;
или его фармацевтически приемлемое производное, вместе с фармацевтически приемлемым носителем,
при условии, что соединение формулы (I) не является этиловым эфиром 4-[2-формилимино-5-(4-метоксифенил)-[1,3,4]тиадиазол-3-ил]масляной кислоты или этиловым эфиром 4-[5-(4-хлорфенил)-2-формилимино-[1,3,4]тиадиазол-3-ил]масляной кислоты;
и где циклоалкил представляет собой насыщенный монокарбоцикл, содержащий от 3 до 10 атомов углерода;
циклоалкенил представляет собой ненасыщенный монокарбоцикл, содержащий от 3 до 10 атомов углерода и содержащий 1 или 2 двойные связи;
арил представляет собой ненасыщенный карбоцикл, содержащий только атомы углерода в циклической структуре в количестве от 5 до 10;
гетероцикл представляет собой ненасыщенный или насыщенный моноцикл, содержащий в циклической структуре от 1 до 7 атомов углерода и от 1 до 4 гетероатомов, одинаковых или разных, выбранных из атомов азота, серы и кислорода;
полициклическая группа включает в себя по меньшей мере два цикла, одинаковых или разных, выбранных из арила, гетероцикла, циклоалкильных, циклоалкенильных групп, конденсированных друг с другом с образованием указанной полициклической группы;
бициклическая группа представляет собой полициклическую группу, которая включает в себя два цикла, выбранные из арила, гетероцикла, циклоалкила или циклоалкенила, конденсированных друг с другом с образованием указанной бициклической группы;
биоизостер карбоновой кислоты представляет собой тетразол, гидроксамовую кислоту, изоксазол, гидрокситиадиазол, сульфонамид, сульфонилкарбоксамид, фосфонаты, фосфонамиды, фосфинаты, сульфонаты, ацилсульфонамид, меркаптоазол, ацилцианамиды.
16. Фармацевтическая композиция по п.15, содержащая соединение формулы (I), в которой R1, R2, R3 и Y являются такими, как определено в п.15, при условии, что когда R1 представляет собой С(=O)-Н, тогда R2 не представляет собой (СН2)3-С(=O)ОСН2СН3.
17. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из пп.1-14 вместе с фармацевтически приемлемым носителем.
18. Фармацевтическая композиция по пп.15, 16 или 17 для лечения заболевания, для которого релевантным является лечение ингибитором ФДЭ7.
19. Способ лечения заболевания, для которого релевантным является лечение ингибитором ФДЭ7, при котором млекопитающему, в частности человеку, нуждающемуся в этом, вводят эффективное количество соединения формуыы (I) по любому из пп.1-14.
20. Способ по п.19, где заболевание, которое нужно лечить, выбрано из заболеваний, связанных с Т-клетками, аутоиммунных заболеваний, воспалительных заболеваний, респираторных заболеваний, заболеваний центральной нервной системы, аллергических заболеваний, заболеваний эндокринной или экзокринной частей поджелудочной железы или желудочно-кишечных заболеваний.
21. Способ по п.19, при котором заболевание, которое нужно лечить, выбрано из висцеральной боли, воспалительного заболевания кишечника, остеоартрита, рассеянного склероза, хронической обструктивной болезни легких (ХОБЛ), астмы, рака, синдрома приобретенного иммунодефицита (СПИДа) или отторжения трансплантата.
22. Применение соединения формулы (I) по любому из пп.1-14 для производства лекарственного средства для лечения заболеваний, для которых релевантным является лечение ингибитором ФДЭ7.
23. Применение по п.22, где заболевание, которое нужно лечить, выбрано из заболеваний, связанных с Т-клетками, аутоиммунных заболеваний, воспалительных заболеваний, респираторных заболеваний, заболеваний центральной нервной системы, аллергических заболеваний, заболеваний эндокринной или экзокринной частей поджелудочной железы или желудочно-кишечных заболеваний.
24. Применение по п.22, где заболевание, которое нужно лечить, выбрано из висцеральной боли, воспалительного заболевания кишечника, остеоартрита, рассеянного склероза, хронической обструктивной болезни легких (ХОБЛ), астмы, рака, синдрома приобретенного иммунодефицита (СПИДа) или отторжения трансплантата.
25. Применение соединения формулы (I) по любому из пп.1-14 в качестве лекарственного средства.
26. Способ получения 1,3,4-тиадиазола формулы (I) по любому из пп.1-11, 13 или 14, где Y представляет собой S, включающий следующие стадии, на которых
(а) проводят взаимодействие замещенного гидразина R2NHNH2, в котором R2 является таким, как определено в п.1, с сероуглеродом и МеХ, где Х является уходящей группой, с получением соединения формулы 1

(б) проводят взаимодействие S-метилдитиокарбазата 1 с хлорангидридом карбоновой кислоты R3COCl, где R3 является таким, как определено в п.1, с получением ацилированного метилдитиокарбазата 2
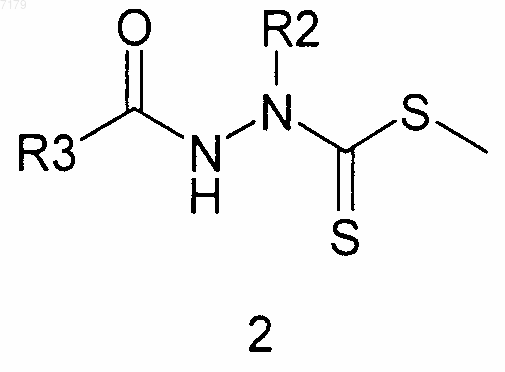
(в) осуществляют циклизацию ацилированного метилдитиокарбазата 2 в 1,3,4-тиадиазол 3
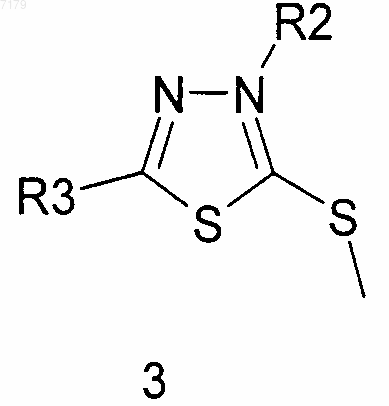
(г) проводят взаимодействие 1,3,4-тиадиазола 3 с амином R1NH2, где R1 является таким, как определено в п.1, с получением соединения формулы (I), где Y представляет собой S,
(д) выделяют соединение формулы (I).
27. Способ получения 1,3,4-тиадиазола формулы (I) по любому из пп.1-11, 13 или 14, где Y представляет собой S, включающий следующие стадии, на которых
(а) проводят взаимодействие замещенного гидразина R2NHNH2, где R2 является таким, как определено в п.1, с замещенным изотиоцианатом SCNR1, где R1 является таким, как определено в п.1, с получением замещенного тиосемикарбазида 5
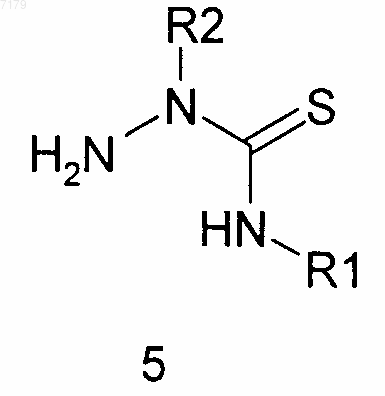
(б) проводят взаимодействие тиосемикарбазида 5 с альдегидом R3CHO, где R3 является таким, как определено в п.1, с получением тиосемикарбазона 6
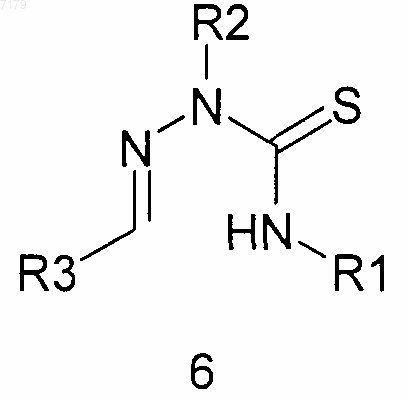
(в) осуществляют циклизацию тиосемикарбазона 6 в соединение формулы (I), где Y представляет собой S,
(г) выделяют соединение формулы (I).
28. Способ получения 1,3,4-тиадиазола формулы (I) по любому из пп.1-11, 13 или 14, где Y представляет собой S, включающий следующие стадии, на которых
(а) проводят взаимодействие карбоновой кислоты R3COOH, где R3 является таким, как определено в п.1, с указанным ниже тиосемикарбазидом 5'

с получением 1,3,4-тиадиазола 7

(б) проводят взаимодействие 1,3,4-тиадиазола 7 с R2X, где R2 является таким, как определено в п.1, а Х является уходящей группой, с получением соединения формулы (I), где Y представляет собой S,
(в) выделяют соединение формулы (I).
29. Способ получения 1,3,4-тиадиазола формулы (I) по любому из пп.1-11, 13 или 14, включающий следующие стадии, на которых
(а) проводят взаимодействие карбоновой кислоты R3COOH, где R3 является таким, как определено в п.1, с указанным ниже тиосемикарбазидом 5
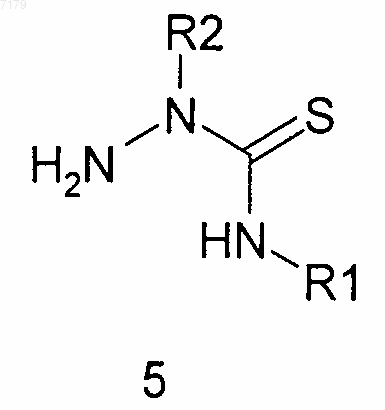
с получением конечного соединения формулы I, в котором Y представляет собой S,
(б) выделяют соединение формулы (I).
30. Способ получения 1,3,4-оксадиазола формулы (I) по любому из пп.1-10 или 12, где Y представляет собой О, включающий следующие стадии, на которых
(а) проводят взаимодействие замещенного гидразина R2NHNH2, где R2 является таким, как определено в п.1, с замещенным изотиоцианатом SCNR1, где R1 является таким, как определено в п.1, с получением замещенного тиосемикарбазида 5
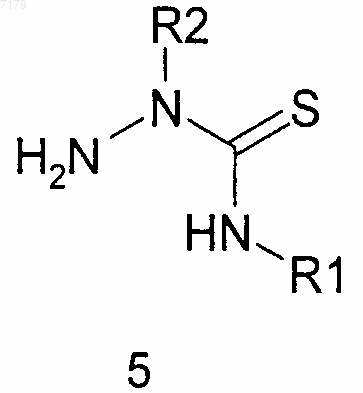
(б) проводят взаимодействие тиосемикарбазида 5 с R3-C(=O)Cl, в котором R3 является таким, как определено в п.1, с образованием требуемого тиосемикарбазида 8
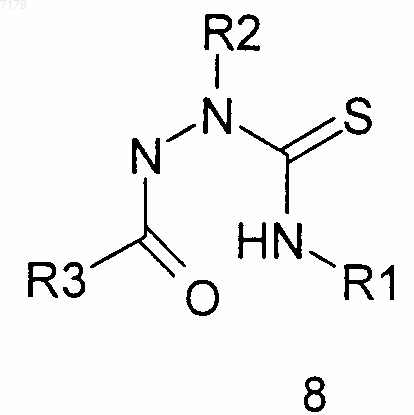
в) осуществляют циклизацию тиосемикарбазида 8 в конечное соединение формулы (I), где Y представляет собой О,
(г) выделяют соединение формулы (I).
Текст
007179 Область изобретения Изобретение относится к новым тиадиазолам и оксадиазолам, способам их получения и к их применению в качестве ингибиторов фосфодиэстеразы 7 (ФДЭ 7). Предшествующий уровень техники Фосфодиэстеразы (ФДЭ) играют важную роль во многих биологических процессах, гидролизуя ключевые вторичные мессенджеры 3',5'-циклические аденозин- и гуанозин-монофосфаты (цАМФ и цГМФ соответственно) до их соответствующих 5'-монофосфатных нуклеотидов. Следовательно, ингибирование активности ФДЭ приводит к увеличению внутриклеточных уровней цАМФ и цГМФ, которые активируют специфические метаболитические пути фосфорилирования белков, вовлеченных в разнообразные функциональные реакции. По меньшей мере одиннадцать изоферментов циклический нуклеотид-фосфодиэстераз млекопитающего, пронумерованных от ФДЭ 1 до ФДЭ 11, было идентифицировано на основе первичной структуры, специфичности к субстрату или чувствительности к кофакторам или ингибиторным лекарственным средствам. Среди этих фосфодиэстераз ФДЭ 7 является цАМФ-специфичной ФДЭ. Определение биохимических и фармакологических характеристик показало высокую аффинность цАМФ-специфичной ФДЭ(Кm=0,2 М), на которую не оказывали воздействия мощные селективные ингибиторы изофермента цГМФ фосфодиэстераз. ФДЭ 7 или ее активность была обнаружена в линиях Т-клеток, в линиях В-клеток, клеточных линиях эпителия дыхательных путей (АЕ) и в некоторых фетальных тканях. Увеличение уровней цАМФ путем селективного ингибирования ФДЭ 7 представляется потенциально перспективным подходом к специфическому блокированию опосредованных Т-клетками иммунных ответов. Дальнейшие исследования показали, что повышение внутриклеточных уровней цАМФ может модулировать воспалительные и иммунологические процессы. При этом селективном подходе вероятно могли бы отсутствовать побочные эффекты, связанные с известными селективными ингибиторами(например селективными ингибиторами ФДЭ 3 или ФДЭ 4), которые ограничивают их применение. Функциональная роль ФДЭ 7 в Т-клеточной активации также известна, поэтому селективные ингибиторы ФДЭ 7 могли бы стать кандидатами для лечения болезней, связанных с Т-клетками. АЕ клетки принимают активное участие в воспалительных заболеваниях дыхательных путей, высвобождая медиаторы, такие как метаболиты арахидоната и цитокины. Селективное ингибирование ФДЭ 7 может быть полезным противовоспалительным подходом к лечению заболеваний, связанных с АЕ клетками. Таким образом, существует потребность в селективных ингибиторах ФДЭ 7, которые активны в очень низких концентрациях, т.е. в микромолярных ингибиторах, предпочтительно наномолярных ингибиторах. Сущность изобретения Согласно изобретению предложены фармацевтические композиции, содержащие соединение,имеющее приведенную ниже формулу (I)R1 представляет собой С 4-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь, С 1-С 6 алкилен, С 2-С 6 алкенилен, циклоалкилен, арилен или двухвалентный гетероцикл, иR4 представляет собой 1) Н, =O, NO2, CN, галоген, C1-С 6 галогеналкил, C1-С 6 алкил, биоизостер карбоновой кислоты,2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,3) C(=O)NR7R8, C(=S)NR7R8, C(=CH-NO2)NR7R8, C(=N-CN)NR7R8, C(=N-SO2NH2)NR7R8,C(=NR7)NHR8, C(=NR7)R8, C(=NR9)NHR8, C(=NR9)R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10,C(=NR9)R10, C(=CH-NO2)NR9R10, C(=N-SO2NH2)NR9R10, C(=N-CN)NR9R10 или C(=S)NR9R10;R2 представляет собой C1-С 6 алкил, циклоалкил, каждый возможно замещенный одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из 1) Н, биоизостера карбоновой кислоты,2) СООН, СОО(С 1-С 6 алкил), ОН, O(С 1-С 6)алкила,-1 007179 3) C(=O)NR11R12 или NR11R12, в которых R11 и R12 являются одинаковыми или разными и выбраны из Н и С 1-С 6 алкила;R3 представляет собой Х 2-R'3, где Х 2 представляет собой одинарную связь или группу, выбранную из С 1-С 4 алкилена, С 2 С 6 алкенилена, С 2-С 6 алкинилена, каждого возможно замещенного одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из 1) Н, C1-С 3 алкила, С 3-С 4 циклоалкила, арила, гетероцикла, =O, CN,2) OR5, =NR5 или 3) NR13R14, где R13 и R14 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6,C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10;R'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь, С 1-С 6 алкилен, С 2-С 6 алкенилен, С 2-С 6 алкинилен, циклоалкилен, арилен, двухвалентный гетероцикл или двухвалентную полициклическую группу, иR17 представляет собой 1) Н, =O, NO2, CN, C1-С 6 галогеналкил, галоген, циклоалкил,2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,3) C(=O)NR15R16, C(=S)NR15R16, C(=N-CN)NR15R16, C(=N-SO2NH2)NR15R16, C(=CH-NO2)NR15R16,SO2NR15R16, C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5,C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=N-CN)NR9R10, C(=N-SO2NH2)NR9R10, C(=NR9)NHR10 илиC(=NR9)R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5; где R5 и R6 являются одинаковыми или разными и выбраны из Н, С 1-С 6 алкила, С 2-С 6 алкенила, С 2 С 6 алкинила; Х 4-циклоалкила, Х 4-циклоалкенила, Х 4-арила, Х 4-гетероцикла или Х 4-полициклической группы, в которых Х 4 представляет собой одинарную связь, С 1-С 6 алкилен или С 2-С 6 алкенилен; каждого(ой) возможно замещенного(ой) одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из галогена, =O, COOR20, CN, OR20, C1-С 6 алкила, возможно замещенного OR20, O-C1-С 6 алкила, возможно замещенного OR20, C(=O)-C1-C6 алкила, C1-С 6 галогеналкила, где Х 5 представляет собой одинарную связь или С 1-С 6 алкилен, и R18, R19 и R20 являются одинаковыми или разными и выбраны из Н или С 1-С 6 алкила; Х 6-гетероцикла, Х 6-арила, Х 6-циклоалкила, Х 6 циклоалкенила, Х 6-полициклической группы, в которых Х 6 выбран из одинарной связи или C1 С 6 алкилена, причем эти группы являются возможно замещенными одной или несколькими группами,одинаковыми или разными, выбранными из галогенов, COOR21, OR21 или (CH2)nNR21R22, где n является числом 0, 1 или 2, и R21 и R22 являются одинаковыми или разными и выбраны из Н или C1-С 6 алкила; где Х 5 представляет собой одинарную связь или C1-С 6 алкилен, и R18 и R19 являются одинаковыми или разными и выбраны из Н или C1-С 6 алкила;R10 выбран из водорода, С 1-С 6 алкила, циклопропила или гетероцикла; или его фармацевтически приемлемое производное, вместе с фармацевтически приемлемым носителем,при условии, что соединение формулы (I) не является этиловым эфиром 4-[2-формилимино-5-(4 метоксифенил)-[1,3,4]тиадиазол-3-ил]масляной кислоты, этиловым эфиром 4-[5-(4-хлорфенил)-2 формилимино-[1,3,4]тиадиазол-3-ил]масляной кислоты. Изобретение также относится к новым соединениям, имеющим формулу (I), указанную выше. Эти соединения являются селективными ингибиторами ФДЭ 7. Их можно применять при лечении различных заболеваний, таких как заболевания, связанные с Т-клетками, аутоиммунные заболевания,воспалительные заболевания, респираторные заболевания, заболевания центральной нервной системы(ЦНС), аллергические заболевания, заболевания эндокринной или экзокринной частей поджелудочной железы, желудочно-кишечные заболевания, висцеральная боль, воспалительное заболевание кишечника,остеоартрит, рассеянный склероз, хроническая обструктивная болезнь легких (ХОБЛ), астма, рак, синдром приобретенного иммунодефицита (СПИД) или отторжение трансплантата. Изобретение также относится к способам получения указанных выше соединений.-2 007179 Далее, изобретение относится к применению соединения формулы (I) для получения лекарственного средства для профилактики или лечения расстройств, для которых лечение ингибитором ФДЭ 7 является релевантным. Согласно изобретению предложен также способ лечения расстройства, для которого релевантным является лечение ингибитором ФДЭ 7, при котором млекопитающему, нуждающемуся в этом, вводят эффективное количество соединения формулы (I). Изобретение также относится к фармацевтической композиции, содержащей соединение формулы(I) вместе с фармацевтически приемлемым носителем. Изобретение также относится к фармацевтической композиции для лечения расстройства, для которого релевантным является лечение ингибитором ФДЭ 7, содержащей соединение формулы (I) вместе с фармацевтически приемлемым носителем. Подробное описание изобретения Согласно настоящему изобретению предложены фармацевтические композиции, содержащие соединения, имеющие формулу I в которой R1, R2, R3 и Y являются такими, как определено выше, за исключением соединений, перечисленных выше. В следующем ниже и в предшествующем тексте подразумевается, что арил относится к ненасыщенному карбоциклу, содержащему только атомы углерода в циклической структуре в количестве от 5 до 10, в том числе фенил, нафтил или тетрагидронафтил; подразумевается, что гетероцикл относится к ненасыщенному или насыщенному моноциклу, содержащему от 1 до 7 атомов углерода в циклической структуре и по меньшей мере один гетероатом в циклической структуре, такой как азот, кислород или сера, предпочтительно от 1 до 4 гетероатомов, одинаковых или разных, выбранных из атомов азота, серы и кислорода; подходящие гетероциклы включают морфолинил, пиперазинил, пирролидинил, пиперидинил, пиримидинил, 2- и 3-фуранил, 2- и 3-тиенил, 2 пиридил, 2- и 3-пиранил, гидроксипиридил, пиразолил, изоксазолил, тетразол, имидазол, триазол и т.п.; полициклические группы включают в себя по меньшей мере два цикла, одинаковых или разных,выбранных из арила, гетероцикла, циклоалкильных, циклоалкенильных групп, конденсированных друг с другом с образованием указанной полициклической группы, такой как 2- и 3-бензотиенил, 2- и 3 бензофуранил, 2-индолил, 2- и 3-хинолинил, акридинил, хиназолинил, индолил, бензо[1,3]диоксолил и 9 тиоксантанил; предпочтительные полициклические группы включают в себя 2 или 3 цикла, как определено выше; более предпочтительные полициклические группы включают в себя 2 цикла (бициклические заместители), как определено выше; бициклические группы относятся к двум циклам, которые являются одинаковыми или разными и которые выбраны из арила, гетероцикла, циклоалкила или циклоалкенила, конденсированных друг с другом с образованием указанных бициклических групп; подразумевается, что галоген относится к фтору, хлору, брому или йоду; подразумевается, что низший алкил означает, что алкил является прямым или разветвленным и содержит от 1 до 6 атомов углерода; примеры низших алкильных групп включают метил, этил, пропил,бутил, изопропил, трет-бутил, изобутил, н-бутил, пентил, гексил и т.п.; подразумевается, что алкенил относится к прямой или разветвленной ненасыщенной цепи атомов углерода, содержащей одну или несколько двойных связей, предпочтительно одну или две двойных связи; предпочтительные алкенилы содержат от 3 до 6 атомов углерода и одну двойную связь; подразумевается, что алкинил относится к прямой или разветвленной ненасыщенной цепи атомов углерода, содержащей одну или несколько тройных связей, предпочтительно одну или две тройные связи; предпочтительные алкинилы содержат от 3 до 6 атомов углерода и одну тройную связь; подразумевается, что низший галогеналкил относится к низшему алкилу, замещенному одним или несколькими галогенами; предпочтительные низшие галогеналкильные группы включают пергалогеналкильные группы, такие как СF3; подразумевается, что циклоалкил относится к насыщенному монокарбоциклу, содержащему от 3 до 10 атомов углерода. Предпочтительные циклоалкильные группы включают циклопропил, циклобутил,циклопентил, циклогексил и циклогептил; подразумевается, что циклоалкенил относится к ненасыщенному монокарбоциклу, содержащему от 3 до 10 атомов углерода; предпочтительные циклоалкенильные группы содержат 1 или 2 двойных связей; примерами подходящего циклоалкенила являются 3-циклогексен, 3-циклогептен или т.п.; биоизостер карбоновой кислоты имеет классическое значение;-3 007179 общеизвестные биоизостеры карбоновой кислоты представляют собой тетразол, гидроксамовую кислоту, изоксазол, гидрокситиадиазол, сульфонамид, сульфонилкарбоксамид, фосфонаты, фосфонамиды, фосфинаты, сульфонаты, ацилсульфонамид, меркаптоазол, ацилцианамиды. Предпочтительными фармацевтическими композициями являются композиции, содержащие соединение формулы (I), в которой R1, R2, R3 и Y являются такими, как определено выше, при условии, что когда R1 представляет собой С(=O)-Н, тогда R2 не представляет собой (СН 2)3-С(=O)ОСН 2 СН 3. Настоящее изобретение также относится к соединениям формулы (I)R1 представляет собой С 4-С 10 алкил, С 2-С 10 алкенил, С 2-С 10 алкинил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь, C1-С 6 алкилен, С 2-С 6 алкенилен, циклоалкилен, арилен или двухвалентный гетероцикл, иR4 представляет собой 1) Н, =O, NO2, CN, галоген, С 1-С 6 галогеналкил, C1-С 6 алкил, биоизостер карбоновой кислоты,2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,3) C(=O)NR7R8, C(=S)NR7R8, C(=CH-NO2)NR7R8, C(=N-CN)NR7R8, C(=N-SO2NH2)NR7R8,C(=NR7)NHR8, C(=NR7)R8, C(=NR9)NHR8, C(=NR9)R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10,C(=NR9)R10, C(=CH-NO2)NR9R10, C(=N-SO2NH2)NR9R10, С(=N-СN)NR9R10 или C(=S)NR9R10;R2 представляет собой С 1-С 6 алкил, циклоалкил, каждый возможно замещенный одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из 1) Н, биоизостера карбоновой кислоты,2) СООН, СОО(С 1-С 6 алкил), ОН, O(С 1-С 6 алкил),3) C(=O)NR11R12 или NR11R12, в которых R11 и R12 являются одинаковыми или разными и выбраны из Н и С 1-С 6 алкила;X2 представляет собой одинарную связь или группу, выбранную из С 1-С 4 алкилена, С 2 С 6 алкенилена, С 2-С 6 алкинилена, каждого возможно замещенного одной или несколькими группами, которые являются одинаковыми или разными и которые выбраны из 1) Н, С 1-С 3 алкила, С 3-С 4 циклоалкила, арила, гетероцикла, =O, CN,2) OR5, =NR5 или 3) NR13R14, где R13 и R14 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6,C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=NR9)NHR10 или C(=NR9)R10;R'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь, С 1-С 6 алкилен, С 2-С 6 алкенилен, С 2-С 6 алкинилен, циклоалкилен, арилен, двухвалентный гетероцикл или двухвалентную полициклическую группу, иR17 представляет собой 1) Н, =O, NO2, CN, C1-С 6 галогеналкил, галоген, циклоалкил,2) COOR5, C(=O)R5, C(=S)R5, SO2R5, SOR5, SO3R5, SR5, OR5,3) C(=O)NR15R16, C(=S)NR15R16, C(=N-CN)NR15R16, C(=N-SO2NH2)NR15R16, C(=CH-NO2)NR15R16,SO2NR15R16, C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5,C(=S)NR9R10, C(=CH-NO2)NR9R10, C(=N-CN)NR9R10, C(=N-SO2NH2)NR9R10, C(=NR9)NHR10 илиC(=NR9)R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5; где R5, R6, R9 и R10 являются такими, как определено выше, при условии, что когда R1 представляет собой фенил, тогда он несет на себе по меньшей мере один заместитель,иной чем Н,когда Х 2 представляет собой одинарную связь, и оба из R1 и R'3 представляют собой фенил, тогда каждый из R1 и R'3 несет на себе по меньшей мере один заместитель, иной чем Н,когда X2 представляет собой одинарную связь, и R'3 представляет собой фенил, тогда R'3 не замещен сложным эфиром или карбоновой кислотой в орто-положении,-4 007179 когда Y представляет собой О, и R3 представляет собой фенил или циклоалкил, незамещенный или замещенный, тогда R1 является иным, чем замещенный 1,3,5-триазин,атом радикала R3, который связан с тиадиазольной группой, является атомом углерода,за исключением следующих соединений:(3,5-дифенил-3 Н-[1,3,4]оксадиазол-2-илиден)нафталин-2-ил-амин,трет-бутил-(3-трет-бутил-5-фенил-3H-[1,3,4]оксадиазол-2-илиден)амин,диэтиловый эфир 2-[(3-метил-5-фенил-3 Н-[1,3,4]оксадиазол-2-илиденамино)метилен]малоновой кислоты,[4-(4-метоксифенил)-5-(4-метоксифенилимино)-4,5-дигидро-[1,3,4]оксадиазол-2-ил]фенилметанон,(4-метоксифенил)-[4-(4-метоксифенил)-5-(4-метоксифенилимино)-4,5-дигидро-[1,3,4]оксадиазол-2 ил]метанон,[4-(4-фторфенил)-5-(4-метоксифенилимино)-4,5-дигидро-[1,3,4]оксадиазол-2-ил]-фенилметанон,1-фенил-1-[4-фенил-5-(5-трифторметил-2H-[1,2,4]триазол-3-илимино)-4,5-дигидро[1,3,4]тиадиазол 2-ил]метанон,1-[4-фенил-5-(5-трифторметил-2 Н-[1,2,4]триазол-3-илимино)-4,5-дигидро[1,3,4]тиадиазол-2-ил]-1 тиофен-2-ил-метанон,1-фенил-1-(4-фенил-5-п-толилимино-4,5-дигидро[1,3,4]тиадиазол-2-ил)метанон,циклогексил-[3-(2,4,6-трихлорфенил)-5-(2,3,3-триметилциклопент-1-енилметил)-3H-[1,3,4]тиадиазол-2-илиден]амин,2-(3,5-дифенил-3H-[1,3,4]тиадиазол-2-илиденамино)-1,4-дифенил-бут-2-ен-1,4-дион,диметиловый эфир 2-[3-фенил-5-(1-фенилметаноил)-3 Н-[1,3,4]тиадиазол-2-илиденамино]-бут-2 ендиовой кислоты,диметиловый эфир 2-[5-(1-фенилметаноил)-3-п-толил-3H-[1,3,4]тиадиазол-2-илиденамино]-бут-2 ендиовой кислоты и диметиловый эфир 2-[3-(4-хлорфенил)-5-(1-фенилметаноил)-3H-[1,3,4]тиадиазол-2-илиденамино]бут-2-ендиовой кислоты. Предпочтительными соединениями формулы (I) являются соединения, в которых R1 представляет собой С 4-С 6 алкил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь, двухвалентный гетероцикл или С 1-С 6 алкилен, иR4 выбран из 1) Н, =O, галогена, CN, C1-С 6 галогеналкила, предпочтительно СF3, С 1-С 6 алкила, биоизостера карбоновой кислоты,2) COOR5, SO2R5, OR5, C(=O)R5,3) C(=O)NR7R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10, C(=NR9)R10 или C(=S)NR9R10. Другими предпочтительными соединениями формулы (I) являются соединения, в которых R2 представляет собой С 1-С 6 алкил. Далее, предпочтительными соединениями формулы (I) являются соединения, в которых R3 представляет собой Х 2-R'3, где Х 2 представляет собой одинарную связь, С 1-C4 алкилен, С 2-С 6 алкенилен или С 2-С 6 алкинилен, иR'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь или C1-С 6 алкилен, иC(=O)NR15R16,C(=S)NR15R16,C(=N-CN)NR15R16,C(=CH-NO2)NR15R16,SO2NR15R16,C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CHNO2)NR9R10, C(=N-CN)NR9R10, C(=NR9)NHR10 или C(=NR9)R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Особенно предпочтительными соединениями формулы (I) являются соединения, в которых R1 представляет собой циклоалкил, предпочтительно циклогексан, циклоалкенил, арил, предпочтительно фенил, или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь или двухвалентный гетероцикл иR4 выбран из 1) Н, галогена, CF3, =O,-5 007179 2) COOR5, OR5,3) C(=O)NR5R6. Другими особенно предпочтительными соединениями формулы (I) являются соединения, в которыхR2 представляет собой СН 3. Также особенно предпочтительными соединениями формулы (I) являются соединения, в которыхR3 представляет собой Х 2-R'3, где Х 2 представляет собой одинарную связь, С 1-С 4 алкилен или С 2-С 6 алкенилен, иR'3 представляет собой циклоалкил, арил, предпочтительно фенил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь или -CH2-, иR17 представляет собой 1) Н, CN, CF3, галоген, NО 2,2) COOR5, SO2R5, OR5, C(=O)R5,3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10,C(=NR9)NHR10, C(=NR9)R10 или C(=N-CN)NR9R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Более предпочтительными соединениями формулы (I) являются соединения, в которыхR1 представляет собой С 4-С 6 алкил, циклоалкил, циклоалкенил, гетероцикл, арил или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которых Х 1 представляет собой одинарную связь, двухвалентный гетероцикл или С 1-С 6 алкилен, иR4 выбран из 1) Н, =O, галогена, CN, C1-С 6 галогеналкила, предпочтительно СF3, C1-С 6 алкила, биоизостера карбоновой кислоты,2) COOR5, SO2R5, OR5, C(=O)R5,3) C(=O)NR7R8, SO2NR7R8 или NR7R8, в которых R7 и R8 являются одинаковыми или разными и выбраны из R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=NR9)NHR10, C(=NR9)R10 или C(=S)NR9R10,R2 представляет собой C1-С 6 алкил, иR3 представляет собой Х 2-R'3, где Х 2 представляет собой одинарную связь, С 1-С 4 алкилен, С 2-С 6 алкенилен или С 2-С 6 алкинилен, иR'3 представляет собой циклоалкил, циклоалкенил, арил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь или C1-С 6 алкилен, иC(=O)NR15R16,C(=S)NR15R16,C(=N-CN)NR15R16,C(=CH-NO2)NR15R16,SO2NR15R16,C(=NR15)NHR16, C(=NR15)R16, C(=NR9)NHR16, C(=NR9)R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, С(=O)R5, SO2R5, C(=S)NR9R10, C(=CHNO2)NR9R10, C(=N-CN)NR9R10, C(=NR9)NHR10 или C(=NR9)R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Другими более предпочтительными соединениями формулы (I) являются соединения, в которых R1 представляет собой циклоалкил, предпочтительно циклогексан, циклоалкенил, арил, предпочтительно фенил, или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь или двухвалентный гетероцикл, иR4 выбран из 1) Н, галогена, СF3, =O,2) COOR5, OR5,3) C(=O)NR5R6,R2 представляет собой СН 3, иR3 представляет собой Х 2-R'3, где Х 2 представляет собой одинарную связь, С 1-С 4 алкилен или С 2-С 6 алкенилен, иR'3 представляет собой циклоалкил, арил, предпочтительно фенил, гетероцикл или полициклическую группу,-6 007179 каждый(ую) возможно замещенный(ую) одной или несколькими группами X3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь или -СН 2-, иR17 представляет собой 1) Н, СN, СF3, галоген, NO2,2) COOR5, SO2R5, OR5, C(=O)R5,3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10,C(=NR9)NHR10, C(=NR9)R10 или C(=N-CN)NR9R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Другими более предпочтительными соединениями формулы (I) являются соединения, в которых Y представляет собой О, R1 представляет собой циклоалкил, предпочтительно циклогексан, циклоалкенил,арил, предпочтительно фенил, или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь или двухвалентный гетероцикл, иR4 выбран из 1) Н, галогена, СF3, =O,2) COOR5, OR5,3) C(=O)NR5R6,R2 представляет собой СН 3, иR3 представляет собой X2-R'3, где Х 2 представляет собой одинарную связь, С 1-С 4 алкилен или С 2-С 6 алкенилен, иR'3 представляет собой циклоалкил, арил, предпочтительно фенил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами Х 3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь или -CH2-, иR17 представляет собой 1) Н, CN, СF3, галоген, NO2,2) COOR5, SO2R5, OR5, C(=O)R5,3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, R5, R6, C(=O)NR5R6, C(=O)R5, SO2R5, C(=S)NR9R10, C(=CH-NO2)NR9R10,C(=NR9)NHR10, C(=NR9)R10 или C(=N-CN)NR9R10,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Более конкретно, группой соединений формулы (I), которые, как было установлено, представляют собой особый интерес, являются соединения, в которых R1 представляет собой циклогексан, фенил или бициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X1-R4, одинаковыми или разными, в которыхX1 представляет собой одинарную связь или двухвалентный гетероцикл, иR4 выбран из 1) Н, галогена, СF3,2) СООН,ОН,3) C(=O)NR7R8, в котором R7 и R8 являются одинаковыми или разными и выбраны из Н или С 1 С 6 алкила,R2 представляет собой СН 3, иR3 представляет собой X2-R'3, где Х 2 представляет собой одинарную связь, С 1-С 4 алкилен или С 2-С 6 алкенилен, иR'3 представляет собой фенил, гетероцикл или полициклическую группу,каждый(ую) возможно замещенный(ую) одной или несколькими группами X3-R17, одинаковыми или разными, в которых Х 3 представляет собой одинарную связь, иR17 представляет собой 1) CN, ОН, СF3, =O, C1-С 6 алкокси, галоген,2) COOR5, SO2R5,3) C(=O)NR15R16, SO2NR15R16 или NR15R16, в которых R15 и R16 являются одинаковыми или разными и выбраны из ОН, C(=O)R5, C(=O)NR5R6, R5 или R6,4) гетероцикл, возможно замещенный одной или несколькими группами R5. Наиболее предпочтительными соединениями формулы (I) являются соединения, в которых Y представляет собой S. Предпочтительно в каждом из указанных выше определений радикала R1I104.1 4-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]оксадиазол-2-ил)бензамид. Соединения, используемые в данном изобретении, включают фармацевтически приемлемые производные соединений формулы (I), такие как сольваты, гидраты, фармацевтически приемлемые соли и полиморфы (дескрипторы различных кристаллических решеток). Фармацевтически приемлемые соли соединения формулы (I) включают соли, имеющие основную часть, и соли, имеющие кислотную часть. Под выражением "фармацевтически приемлемая соль соединения формулы (I), имеющая основную часть" подразумевается то, что оно относится к солям присоединения соединений формулы (I), которые могут быть образованы из нетоксичных неорганических или органических кислот, такие как, например, соли бромистоводородной, соляной, серной, фосфорной,азотной, уксусной, янтарной, винной, лимонной, малеиновой, гидроксималеиновой, бензойной, фумаровой, толуолсульфоновой и изэтионовой кислот и т.п.; в эту категорию соединений по изобретению также входят различные четвертичные аммониевые соли производных (I). Под выражением "фармацевтически приемлемая соль соединения формулы (I), имеющая кислотную часть", подразумевается то, что оно относится к обыкновенным солям соединений формулы (I), которые могут быть образованы из нетоксичных неорганических или органических оснований, таких как, например, гидроксиды щелочных металлов и щелочно-земельных металлов (натрия, калия, магния и кальция), амины (дибензилэтилендиамин, триметиламин, пиперидин, пирролидин, бензиламин и т.п.) или, альтернативно, четвертичных аммониевых гидроксидов, таких как гидроксид тетраметиламмония (смотри также публикацию "Pharmaceutical salts",Berge S.M. et al. (1997) J. Pharm. Sci. 66: 1-19, которая включена в этот документ посредством ссылки). Предполагается также применение такого пролекарства соединения по изобретению, которое может встретиться специалисту в данной области техники (Bundgaard, et al., Acta Pharm. Suec., 1987; 24: 233246). Способ получения Соединения по данному изобретению могут быть синтезированы согласно общим протоколам синтеза А-Д с использованием описанной здесь методологии, которая известна специалисту. Исходные соединения либо имеются в продаже, либо могут быть получены путями, известными специалисту (М. Akbar Ali, S.E. Livingston and D.J. Philipps, Inorganica Chimica Acta, 6, 11 (1972); P.Molina, A. Tarraga, A. Espinosa; Synthesis, 690 (1988); P. Molina, A. Tarraga, A. Espinosa; Heterocycles,vol.29, 12 (1989. На стадии 1 замещенный гидразин подвергают взаимодействию с сероуглеродом и алкилйодидом,таким как метилйодид, с образованием целевого 2-замещенного S-алкилдитиокарбазата (1). Можно использовать различные растворители, условия синтеза и основания, которые легко определит специалист. Например, и без какого-либо ограничения, для реакции замещенного гидразина с сероуглеродом можно использовать спиртовой раствор гидроксида калия при температуре, не превышающей 15 С. Метилйодид можно добавлять к этому раствору или к разбавленному (например, водой) раствору. На стадии 2 замещенный S-метилдитиокарбазат подвергают взаимодействию с соответствующей группой R3CO-X, в которой Х является уходящей группой, такой как галоген. Предпочтительно, R3COX представляет собой хлорангидрид карбоновой кислоты (R3COCl). Реакцию можно проводить, например, в толуоле, как растворителе, при нагревании с обратным холодильником. Получают соответствующий ацилированный метилдитиокарбазат (2). На стадии 3 ацилированный метилдитиокарбазат подвергают циклизации в целевой 1,3,4 тиадиазол. Реакцию можно проводить в присутствии уксусного ангидрида (УА) и перхлората НСlO4 в эфире предпочтительно при температуре между -5 и 5 С, предпочтительно 0 С, или в присутствии триметилсилилтрифторметансульфоната в дихлорметане, предпочтительно при температуре между 0 и 25 С. После перемешивания при комнатной температуре в течение нескольких часов получают промежуточное соединение, которое представляет собой перхлорат 1,3,4-тиадиазолия (3). На стадии 4 1,3,4-тиадиазол (или его перхлорат или сульфонат) подвергают взаимодействию с соответствующим амином R1NH2 с образованием конечного соединения. Реакцию можно проводить в спирте, таком как этанол, в качестве растворителя (растворитель также может быть апротонным растворителем, таким как диоксан, диметилформамид (ДМФ) или ацетонитрил), в присутствии основания, такого как триэтиламин, и предпочтительно при температуре между 40 и 110 С, предпочтительно между 40 и 80 С. Протокол Б. Исходные соединения либо имеются в продаже, либо могут быть получены путями, известными специалисту (R. Noto, P. Lo Meo, M. Gruttadauria, G. Werber; J. Heterocyclic Chem., 33, 863 (1996. На стадии 1 замещенный изотиоцианат подвергают взаимодействию с замещенным гидразином с образованием целевого замещенного тиосемикарбазида (5). Реакцию можно проводить в спирте, например метаноле, и/или воде при температуре между -5 и 15 С, предпочтительно при 0 С. На стадии 2 замещенный тиосемикарбазид подвергают взаимодействию с альдегидом R3CHO с образованием целевого тиосемикарбазона (6). Реакцию можно проводить в спирте, например метаноле, при температуре между 50 и 90 С, предпочтительно при 75 С. На стадии 3 замещенный тиосемикарбазон подвергают циклизации с образованием соединения (I). Реакцию можно проводить в спирте, например этаноле, при температуре между 20 и 110 С, предпочтительно при 75 С, в присутствии окислителя, такого как FeCl3. Исходные соединения либо имеются в продаже, либо могут быть получены путями, известными специалисту (FR-A-7712352, DE-A-4418066 и FR-A-8015072). На первой стадии карбоновую кислоту подвергают взаимодействию с производным тиосемикарбазида (5') с получением целевого 1,3,4-тиадиазола (7). Реакцию можно проводить в апротонном растворителе, таком как диоксан, при нагревании с обратным холодильником в присутствии дегидратирующего реагента, например РОСl3. На второй стадии целевой 1,3,4-тиадиазол подвергают взаимодействию с R2X, где Х является уходящей группой, такой как трифторметансульфонат, йодид или бромид. Реакцию можно проводить в апротонном растворителе, таком как диоксан или ДМФ (если R2-X представляет собой алкилйодид или-бромид), предпочтительно при комнатной температуре (КТ) или при нагревании с получением соединения (I). Протокол Г. 1 Cтадия Исходные соединения либо имеются в продаже, либо могут быть получены путями, известными специалисту. На первой стадии карбоновую кислоту подвергают взаимодействию с замещенным производным тиосемикарбазида (5) с получением конечного 1,3,4-тиадиазола (I). Реакцию можно проводить в апротонном растворителе, таком как диоксан, при нагревании с обратным холодильником и при температуре между 75 и 120 С в присутствии дегидратирующего реагента, например РОСl3. Растворитель, время реакции, температуру, катализатор, если он используется, можно варьировать на всех описанных выше стадиях для всех путей так, как, по мнению специалиста, будет целесообразно. Протокол Д. 3 Cтадия. См. J.M. Kane, M.A. Staeger, Synthetic communication, 22 (1), 1-11 (1992). Исходные соединения либо имеются в продаже, либо могут быть получены способами, известными специалисту (R. Noto, P. Lo Meo, M. Gruttadauria, G. Werber; J. Heterocyclic Chem., 33, 863 (1996. На стадии 1 замещенный изотиоцианат подвергают взаимодействию с замещенным гидразином с образованием целевого замещенного тиосемикарбазида (5). Реакцию можно проводить в спирте, например метаноле, и/или воде при температуре между -5 и 15 С, предпочтительно при 0 С. На стадии 2 замещенный тиосемикарбазид подвергают взаимодействию с хлорангидридом карбоновой кислоты с образованием целевого тиосемикарбазида (8). Реакцию можно проводить в основной- 15007179 среде, такой как пиридин, при комнатной температуре, или в апротонном растворителе в присутствии основания, такого как пиридин или триэтиламин. На стадии 3 замещенный тиосемикарбазид подвергают циклизации с получением соединения (I). Реакцию можно проводить в спирте, например метаноле, при температуре например 75 С в присутствии оксида ртути (НgО). Фармацевтические композиции Продукты по изобретению вводят в форме композиций, которые являются подходящими в зависимости от природы и тяжести состояния, которое лечат. Суточная доза для людей обычно находится в пределах между 2 мг и 1 г активного ингредиента, которую можно принимать в одной или более чем одной индивидуальной дозах. Композиции приготавливают в формах, которые совместимы с назначенным путем введения, в таких как, например, таблетки, таблетки, покрытые оболочкой, капсулы, полоскания,аэрозоли, порошки для ингаляции, суппозитории, клизмы, пены (такие как ректальные пены), гели или суспензии. Эти композиции получают способами, которые известны специалистам, и содержат от 0,5 до 60 мас.% активного ингредиента (соединения по изобретению) и от 40 до 99,5 мас.% фармацевтического наполнителя или носителя, который подходит и совместим с действующим началом и физической формой назначенной композиции. Препараты в твердой форме включают порошки, таблетки, дисперсные гранулы, капсулы, облатки и суппозитории. Твердый носитель может представлять собой одно или более веществ, которые также могут действовать в качестве разбавителей, корригентов, солюбилизаторов, смазывающих агентов, суспендирующих агентов, связывающих агентов или разрыхлителей для таблеток; он может быть также инкапсулирующим материалом. В порошках носителем является тонкоизмельченное твердое вещество,которое находится в смеси с тонкоизмельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих соотношениях и спрессован до требуемых формы и размера. Порошки, таблетки, облатки или инкапсулируемые формы для капсул предпочтительно содержат от 5 до приблизительно 70% активного компонента. Подходящими носителями являются карбонат магния, стеарат магния, тальк, лактоза, сахар, пектин, декстрин, крахмал, трагакант, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, низкоплавкий воск, масло какао и т.п. Таблетки, порошки, облатки и капсулы можно использовать как твердые лекарственные формы,подходящие для перорального введения. Лекарственное средство может доставляться в виде спрея (либо в контейнере под давлением с подходящим клапаном, либо в контейнере не под давлением с дозирующим клапаном). Препараты в жидкой форме включают растворы, суспензии и эмульсии. В качестве примера жидких препаратов, подходящих для парентерального введения, могут быть приведены стерильные водные или водно-пропиленгликолевые растворы активных соединений. Жидкие препараты могут быть приготовлены также в виде раствора в водно-полиэтиленгликолевом растворе. Водные растворы для перорального введения могут быть приготовлены путем растворения активного компонента в воде и добавления подходящих красителей, корригентов, стабилизаторов и загустителей, если требуются. Водные суспензии для перорального применения могут быть получены путем диспергирования тонкоизмельченного активного компонента в воде вместе с вязким веществом, таким как природные, синтетические камеди, смолы, метилцеллюлоза, натрийкарбоксиметилцеллюлоза, и другими суспендирующими агентами, известными в практике приготовления фармацевтических препаратов. Для приготовления суппозиторных препаратов сначала плавят низкоплавкий воск, такой как смесь глицеридов жирных кислот, и масло какао, и в них путем, например, перемешивания диспергируют активный ингредиент. Расплавленную гомогенную смесь затем вливают в формы подходящего размера и оставляют охлаждаться и затвердеть. Клизмы получают по методикам, известным для приготовления растворов, предназначенных для ректального введения. Пены получают в соответствии известными способами (эти пены могут быть очень похожи на пены, применяемые для введения препарата, такого как 5ASA, для лечения проктоколита). Предпочтительно фармацевтический препарат находится в стандартной лекарственной форме. В такой форме препарат разделен на стандартные дозы, содержащие подходящие количества лекарственного средства. Стандартная лекарственная форма может представлять собой упакованный препарат, причем упаковка содержит дискретные количества препарата, например упакованные таблетки, капсулы и порошки в пузырьках или ампулах. Стандартная лекарственная форма может представлять собой также саму капсулу, облатку или таблетку, или может представлять собой соответствующее число любой из этих упакованных форм. Способы лечения Соединения по изобретению являются селективными ингибиторами ФДЭ 7. Их можно применять при лечении различных заболеваний, так как они могут модулировать воспалительные и иммунологические процессы благодаря увеличению внутриклеточных уровней цАМФ. А именно: заболевания, которые можно успешно лечить, включают заболевания, связанные с Тклетками, аутоиммунные заболевания, воспалительные заболевания, респираторные заболевания, забо- 16007179 левания центральной нервной системы, аллергические заболевания, заболевания эндокринной или экзокринной частей поджелудочной железы, желудочно-кишечные заболевания, висцеральную боль, воспалительное заболевание кишечника, остеоартрит, рассеянный склероз, хроническую обструктивную болезнь легких (ХОБЛ), астму, рак, синдром приобретенного иммунодефицита (СПИД) или отторжение трансплантата. Соединения по изобретению имеют низкие значения ИК 50, обычно самое большое 5 мкМ, предпочтительно ниже 1 мкМ и даже ниже 100 нМ. Наконец, изобретение относится к способу лечения упомянутых выше заболеваний, при котором млекопитающему, в частности человеку, нуждающемуся в этом, вводят эффективное количество соединения по изобретению. Следующие примеры иллюстрируют изобретение, не ограничивая его. Примеры Соединения по изобретению названы с помощью компьютерной программы "AutoNom Version 4.0". Протокол А. Промежуточное соединение 1. Протокол А. Промежуточное соединение 1 а. R2 = метил. Метиловый эфир N-метилгидразинкарбодитиокислоты. Метилгидразин (370 ммоль, 19,43 мл) добавляли к раствору гидроксида калия (370 ммоль, 20,7 г) в 90%-ном водном растворе спирта (130 мл). Смесь охлаждали до 5 С, затем по каплям за 1 ч при интенсивном перемешивании добавляли сероуглерод (370 ммоль, 22,2 мл), при этом температуре смеси не позволяли увеличиться выше 7 С. Полученный желтый раствор разбавляли водой (300 мл) и медленно добавляли метилйодид (370 ммоль, 23,34 мл) при интенсивном перемешивании смеси. После перемешивания, продолжавшегося в течение 3 ч при 10-15 С, белые кристаллы 2-метил-S-метилдитиокарбазата (1 а) отфильтровывали, промывали смесью этанола и петролейного эфира (1:1) с получением 38 г целевого соединения. Выход: 84%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 2.32 (s, 3H), 3.60 (s, 3H), 5.55 (s, 2H). Промежуточное соединение 2. Протокол А. Промежуточное соединение 2 а. R2 = метил, R3 = 4-хлорфенил. Метиловый эфир N'-[1-(4-хлорфенил)метаноил]-N-метилгидразинкарбодитиокислоты. Соответствующий хлорангидрид карбоновой кислоты (73,39 ммоль, 9,30 мл) (R3COCl) добавляли к суспензии 2-метил-S-метилдитиокарбазата (73,39 ммоль, 10 г) в толуоле (80 мл). Смесь перемешивали при нагревании с обратным холодильником в течение 4 ч, затем оставляли охлаждаться в течение ночи. Твердые вещества отделяли фильтрованием, промывали водой, а затем эфиром с получением 15 г ожидаемого 3-ацил-2-метил-3-метилдитиокарбазата (2 а). Выход = 74%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 2.45 (s, 3H), 3.65 (s, 3H), 7.65 (dd, 2H), 7.90 (dd, 2H), 11.68 (s, 1H). Промежуточное соединение 2 б. R2 = метил, R3 = 4-(метилсульфонил)фенил. Метиловый эфир N'-[1-(4-метансульфонилфенил)метаноил]-N-метилгидразинкарбодитиокислоты. Хлорангидрид получали из соответствующей бензойной кислоты. Соответствующий хлорангидрид карбоновой кислоты (1,68 ммоль, 0,39 г) добавляли к суспензии 2 метил-S-метилдитиокарбазата (1,77 ммоль, 0,24 г) в толуоле (2 мл). После 5 ч нагревания с обратным холодильником смесь охлаждали в течение ночи, перетирали в эфире и перемешивали 2 ч при КТ с получением 440 мг ожидаемого продукта (2 б) в виде белого твердого вещества. Выход = 82%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 2.5 (s, 3H), 3.30 (s, 3H), 3.65 (s, 3H), 8.15 (m, 4H), 11.9(s, 1H). Промежуточное соединение 2 в. R2 = метил, R3 = 4-цианофенил. Метиловый эфир N'-[1-(4-цианофенил)метаноил]-N-метилгидразинкарбодитиокислоты. Соответствующий хлорангидрид карбоновой кислоты (22,77 ммоль, 3,77 г) (R3COCl) добавляли к суспензии 2-метил-S-метилдитиокарбазата (22,77 ммоль, 3,10 г) в толуоле (25 мл). Смесь перемешивали- 17007179 при нагревании с обратным холодильником в течение 3 ч 30 мин, затем оставляли охлаждаться в течение ночи. Твердое вещество отделяли фильтрованием, промывали водой, затем эфиром и сушили с получением 4,15 г ожидаемого 3-ацил-2-метил-S-метилдитиокарбазата (2 в). Выход = 68%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 2.45 (s, 3H), 3.65 (s, 3H), 8.05 (m, 4H), 11.85 (s, 1H). Промежуточное соединение 2 г. R2 = метил, R3 = 4-ацетиламинофенил. Метиловый эфир N'-(4-ацетиламинобензоил)-N-метилгидразинкарбодитиокислоты. Хлорангидрид получали из соответствующей бензойной кислоты. К суспензии соответствующего хлорангидрида карбоновой кислоты (10 ммоль, 1,4 г) в толуоле (30 мл) добавляли триэтиламин (20 ммоль, 2,8 мл), а затем 2-метил-3-метилдитиокарбазат (12 ммоль, 2,4 г). Смесь выдерживали при 90 С в течение 2 ч и концентрировали при пониженном давлении. Остаток переносили в дихлорметан, промывали водой, концентрировали при пониженном давлении и промывалиH-ЯМР (400 МГц, ДМСО)млн-1: 2.10 (s, 3H), 2.45 (s, 3H), 3.65 (s, 3H), 7.85 (d, 2 Н), 7.90 (d, 2H),10.30 (s, 1 Н), 11.40 (s, 1H). Промежуточное соединение 2 д. R2 = метил, R3 = 4-ацетиламино-3-пиридил. Метиловый эфир N'-(6-ацетиламинопиридин-3-карбонил)-N-метилгидразинкарбодитиокислоты. Хлорангидрид получали из соответствующей бензойной кислоты. К суспензии соответствующего хлорангидрида карбоновой кислоты (63 ммоль, 11 г) в толуоле (150 мл) добавляли триэтиламин (130 ммоль), а затем 2-метил-8-метилдитиокарбазат (62 ммоль, 9 г). После выдерживания в течение 3 ч при комнатной температуре смесь концентрировали при пониженном давлении. Остаток переносили в дихлорметан, промывали однократно водой, концентрировали при пониженном давлении и очищали хроматографией на силикагеле (95:5 (дихлорметан (ДХМ)/МеОН с получением 9 г указанного в заголовке соединения. Выход = 50%. 1MC (m/z) / M+1 = 298,99 Промежуточное соединение 3. Протокол А. Промежуточное соединение 3 а. R2 = метил, R3 = 4-хлорфенил. 5-(4-Хлорфенил)-3-метил-2-(метилтио)перхлорат 1,3,4-тиадиазолия. К суспензии (2 а) (54,4 ммоль, 15 г) в эфире (150 мл) при 0 С медленно добавляли уксусный ангидрид (30 мл), а затем по каплям добавляли HClO4 (70%, 65,33 ммоль, 5,61 мл) при 0 С в течение 1 ч. Полученную в результате смесь перемешивали при КТ в течение ночи и осадок отделяли фильтрованием,промывали эфиром, а затем сушили на воздухе с получением 19 г указанного в заголовке соединения (3 а) в виде белого твердого вещества. Выход = 97%. 1MC (m/z)/М+1 = 257/259. Промежуточное соединение 3 б. R2 = метил, R3 = 4-(метилсульфонил)фенил. 5-(4-Метансульфонилфенил)-3-метил-2-(метилтио)перхлорат 1,3,4-тиадиазолия. К суспензии (2 б) (0,69 ммоль, 0,22 г) в эфире (3 мл) при 0 С медленно добавляли уксусный ангидрид (0,4 мл), а затем по каплям добавляли HClO4 (70%, 0,90 ммоль, 0,080 мл) при 0 С в течение 1 ч. Полученную в результате смесь затем оставляли нагреваться до КТ и перемешивали в течение 3 ч. Осадок отделяли фильтрованием, затем сушили на воздухе с получением 220 мг ожидаемого перхлората 3 метил-2-метилтио[1,3,4]тиадиазолия (3 б) в виде белого твердого вещества. Выход = 78%. 1MC (m/z)/M+1 = 301/303. Промежуточное соединение 3 в. R2 = метил, R3 = 4-цианофенил. 5-(4-Цианофенил)-3-метил-2-(метилтио)перхлорат 1,3,4-тиадиазолия. К суспензии промежуточного соединения (2 в) (15,64 ммоль, 4,15 г) в эфире (50 мл) и уксусного ангидрида (13,3 мл) по каплям при 0 С добавляли HClO4 (70%, 18,76 ммоль, 1,6 мл) и перемешивали в течение 15-30 мин при 0 С. Полученную в результате смесь перемешивали в течение 1 ч 30 мин при комнатной температуре и осадок отделяли фильтрованием, промывали эфиром, а затем сушили на воздухе с получением 5,22 г указанного в заголовке соединения (3 в) в виде белого твердого вещества. Выход = 96%. 1- 18007179 К суспензии (2 г) (4,3 ммоль, 1,28 г) в дихлорметане (15 мл) по каплям добавляли триметилсилилтрифторметансульфонат (12,9 ммоль, 2,34 мл). Полученную смесь перемешивали в течение ночи. Осадок отделяли фильтрованием и затем сушили при пониженном давлении с получением 1,3 г ожидаемого трифлата 3-метил-2-метилтио[1,3,4]тиадиазолия (3 г) в виде белого твердого вещества. Выход = 72%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 2.10 (s, 3H), 3.10 (s, 3H), 4.15 (s, 3H), 7.80 (dd, 2 Н), 7.95 (dd, 2H),10.40 (s, 1H). Промежуточное соединение 3 д. R2 = метил, R3 = 4-ацетиламино-3-пиридил. 5-(6-Ацетиламинопиридин-3-ил)-3-метил-2-(метилтио)перхлорат 1,3,4-тиадиазолия. К суспензии (2 д) (3,4 ммоль, 1 г) в эфире (11 мл) медленно добавляли уксусный ангидрид (2 мл), а затем по каплям при 0 С за 1 ч добавляли HClO4 (70%, 4 ммоль, 0,7 г). Затем полученную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. При 0 С добавляли дополнительное количество HClO4 (70%, 0,7 ммоль, 0,1 г), и смесь перемешивали в течение 2 ч. Осадок отделяли фильтрованием, промывали AcOEt, затем сушили при пониженном давлении с получением 1 г ожидаемого 3 д. Выход = 77%. 1MC (m/z)/M+1 = 280,92. Соединение I. Протокол А. Пример 11. R1 = 3-бензойная кислота, R2 = метил, R3 = 4-хлорфенил. 3-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойная кислота. К суспензии перхлората 1,3,4-тиадиазолия (3 а) (0,7 ммоль, 0,25 г) в этаноле (3,5 мл) добавляли 3 аминобензойную кислоту (1,05 ммоль, 0,144 г) и триэтиламин (0,7 ммоль, 0,098 мл) и эту смесь выдерживали при 70 С в течение 7 ч. Твердое вещество, образовавшееся после охлаждения в течение ночи до КТ, отделяли фильтрованием, получая 0,180 г ожидаемого соединения. Выход = 74,3%. 1MC (m/z)/M+1 = 346/348. ВЭЖХ (УФ чистота,= 214 нм) = 99,03%. Следующие соединения получали по методике, описанной в примере I.1, с использованием соответствующих промежуточных соединений и реагентов. Целевые продукты получали после очистки хроматографией на силикагеле.- 19007179 Соединение 11.10 получали по методике, описанной в примере I1 (3 ч при 75 С), с использованием соответствующих промежуточных соединений и реагентов (протокол А). Смесь фильтровали и фильтрат упаривали до сухого состояния. Остаток очищали хроматографией на силикагеле, элюируя дихлорметаном, содержащим от 0 до 5% метанола, а затем изократическим элюированием ДХМ/МеоН (90/10). Выход = 7,0%. 1MC (m/z)/M+1 = 352/354. ВЭЖХ (УФ чистота,= 214 нм) = 97,61%. Пример I2. R1 = 2-бензойная кислота, R2 = метил, R3 = 4-хлорфенил. 2-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойная кислота. К суспензии перхлората 1,3,4-тиадиазолия (3 а) (0,7 ммоль, 0,25 г) в этаноле (3 мл) добавляли 2 аминобензойную кислоту (0,84 ммоль, 0,115 г) и триэтиламин (0,7 ммоль, 0,098 мл), и смесь нагревали при 70 С в течение 7 ч. Твердое вещество, образовавшееся после охлаждения, отфильтровывали, получая 210 мг ожидаемого соединения. Выход = 87%. 1MC (m/z)/M+1 = 346/348. ВЭЖХ (УФ чистота,= 214 нм) = 97,64%. Пример I2.1. R1 = (4-фтор)-3-бензойная кислота, R2 = метил, R3 = 4-хлорфенил. 5-[5-(4-Хлорфенил)-3-метил-3H[1,3,4]тиадиазол-2-илиденамино]-2-фторбензойная кислота. Соединение I2.1 получали по методике, описанной в примере I2, с использованием соответствующих промежуточных соединений и реагентов (протокол А). Осадок, полученный после охлаждения, промывали ЕtOН с получением 0,250 г указанного в заголовке соединения. Выход = 60%. 1MC (m/z)/М+1 = 364/366. ВЭЖХ (УФ чистота,= 214 нм) = 95,77%. Пример I2.2. R1 = (2,4,5-фтор)-3-бензойная кислота, R2 = метил, R3 = 4-хлорфенил. 3-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2,5,6-трифторбензойная кислота. Соединение I2.2 получали по методике, описанной в примере 12, с использованием соответствующих промежуточных соединений и реагентов. В качестве растворителя использовали ацетонитрил и реакционную смесь нагревали при 80C в течение 24 ч (протокол А). Твердое вещество, образовавшееся после охлаждения, отфильтровывали и промывали МеОН, получая 0,250 г указанного в заголовке соединения. Выход = 48,6%. 1[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]пропиламин. К суспензии перхлората 1,3,4-тиадиазолия (3 а) (0,28 ммоль, 0,10 г) в метаноле (4 мл) добавляли пропиламин (1,35 ммоль, 0,115 мл) и триэтиламин (0,28 ммоль, 0,038 мл) и эту реакционную смесь нагревали при 55 С в течение 5 ч. После охлаждения смесь упаривали до сухого состояния и неочищенный продукт хроматографировали на силикагеле (Alltech колонка, 2 г диоксида кремния) со смесью циклогексана и ЕtOАс (98:2) с получением ожидаемого соединения. Выход = 0,03 г, 45,2%. 1MC (m/z)/M+1 = 268/270. ВЭЖХ (УФ чистота,= 214 нм) = 97,60%. Следующие соединения получали по методике, описанной в примере I3, с использованием соответствующих промежуточных соединений и реагентов. Следующие соединения получали по методике, описанной в примере I3, с использованием соответствующих промежуточных соединений и реагентов и изопропилового спирта в качестве растворителя.(1R,2S)-2-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанол. Соединение I3.25 получали по методике, описанной в примере I3 (протокол А), с использованием изопропилового спирта в качестве растворителя. Указанный в заголовке продукт выделяли хроматографией на силикагеле (Alltech, 2 г диоксида кремния), элюируя дихлорметаном, содержащим от 0 до 1% метанола. Выход =0,015 г, 12%. 1MC (m/z)/M+1 = 324/3256. ВЭЖХ (УФ чистота,= 214 нм) = 96,62%. Следующее соединение получали по методике, описанной в примере I3, с использованием изопропилового спирта в качестве растворителя. Пример I4. R1 = 3-бензойная кислота, R2 = метил, R3 = 4-(метансульфонил)фенил. 3-[5-(4-Метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]бензойная кислота. К суспензии перхлората 1,3,4-тиадиазолия (3 б) (0,547 ммоль, 0,22 г) в этаноле (2,5 мл) добавляли 3 аминобензойную кислоту (0,547 ммоль, 0,075 г) и триэтиламин (0,601 ммоль, 0,084 мл) и реакционную смесь выдерживали в течение 6 ч при 75 С. После охлаждения в течение ночи осадок отфильтровывали,промывали этанолом, затем очищали на силикагеле с градиентным элюированием: ДХМ, затем ДХМ:МеОН (95:5), получая 70 мг ожидаемого соединения. Выход = 33%. 1MC (m/z)/М+1 = 390. ВЭЖХ (УФ чистота,= 214 нм) = 95,14%. Следующие соединения получали по методике, описанной в примере I4, с использованием избытка триэтиламина (10 экв.) и соответствующего амина (10 экв.). Реакционную смесь нагревали с обратным холодильником в течение 5 ч.- 22007179 Пример I5. R1 = 3-гидроксифенил, R2 = метил, R3 = 4-хлорфенил. 3-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]фенол. В этом примере триэтиламин заменяли полистиролморфолиновой смолой, а для удаления оставшегося аминопроизводного использовали изоцианатную смолу. Суспензию морфолиновой смолы (0,70 ммоль, 0,20 г) и 3-аминофенола (0,84 ммоль, 0,09 г) в этаноле (3,5 мл) перемешивали при КТ в течение 5 мин, после чего добавляли перхлорат 1,3,4-тиадиазолия(3 а) (0,70 ммоль, 0,25 г). После выдерживания в течение 5 ч при 70 С, перед фильтрованием смолы смесь оставляли охлаждаться. Неочищенное вещество, полученное после выпаривания растворителя, очищали хроматографией на силикагеле (Alltech колонка, 2 г диоксида кремния) с градиентным элюированием: ДХМ и МеОН:ДХМ (99:1), получая смесь (0,07 г) оставшегося аминопроизводного и ожидаемого соединения. К этой смеси в ДХМ (7 мл) / МеОН (0,5 мл) добавляли изоцианатную смолу (2,44 ммоль, 2,00 г) и суспензию перемешивали при КТ в течение ночи. После фильтрования смолы фильтрат упаривали до сухого состояния с получением 30 мг чистого продукта. Выход = 13,5%. 1MC (m/z)/M+1 = 318/320. ВЭЖХ (УФ чистота,= 214 нм) = 98,44%. Пример I6. R1 = 4-гидрокси-3-бензойная кислота, R2 = метил, R3 = 4-хлорфенил. 5-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]-2-гидроксибензойная кислота. Соединение I6 получали по методике, описанной в примере I2 (протокол А). Осадок, полученный после охлаждения, промывали ДХМ, затем очищали хроматографией на силикагеле (Alltech колонка, 5 г диоксида кремния), элюируя смесью ДХМ/МеОН от 100/0 до 85/15. Выход = 17,0%. 1MC (m/z)/М+1 = 362/364. ВЭЖХ (УФ чистота, Х = 214 нм) = 95,89%. Следующие соединения получали по методике, описанной в примере I6, с использованием соответствующих промежуточных соединений и реагентов. Триэтиламин заменяли или морфолиновой смолой,или пиридином.- 23007179 Пример I7. R1 = Экзо-2-норборнил, R2 = метил, R3 = 4-хлорфенил. Бицикло[2.2.1]гепт-2-ил-[5-(4-хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амин. Соединение I7 получали по методике, описанной в примере I3, с использованием соответствующих промежуточных соединений и реагентов (протокол А). Указанный в заголовке продукт выделяли хроматографией на силикагеле (Alltech, 2 г диоксида кремния) с градиентом смеси циклогексана и ЕtOАс: от 100:0 до 97:3. Выход = 44,8%. 1(1R,2R)-2-[5-(4-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанол. Соединение I8 получали по методике, описанной в примере I3, с использованием соответствующих промежуточных соединений и реагентов (протокол А). Триэтиламин заменяли морфолиновой смолой (2,1 ммоль, 0,61 г, загрузка 3,47 ммоль/г); смесь морфолиновой смолы и гидрохлорида транс-2-аминоциклогексанола (2,1 ммоль, 0,318 г) перемешивали в этаноле (3,5 мл) при КТ в течение 5 мин, после чего добавляли перхлорат 3-метил-2 метилтио[1,3,4]тиадиазолия (3 а) (0,7 ммоль, 0,25 г). Остаток подвергали хроматографии на силикагелеMC (m/z)/М+1 = 324/326. ВЭЖХ (УФ чистота,= 214 нм) = 99,9%. Следующие соединения получали по методике, описанной в примере I8, с использованием соответствующих промежуточных соединений и реагентов.(1R,2R)-2-[5-(4-Метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиденамино]циклогексанол. Соединение I9 получали по методике, описанной в примере I4 (протокол А). Перхлорат 3-метил-2-метилтио[1,3,4]тиадиазолия (3 б) (0,372 ммоль, 0,15 г), гидрохлорид транс-2 аминоциклогексанола (0,410 ммоль, 0,062 г) и триэтиламин (0,7814 ммоль, 0,109 мл) подвергали взаимодействию в этаноле (1,5 мл). Неочищенный продукт два раза хроматографировали на силикагеле смесью ДХМ:МеОН (98:2) с получением указанного в заголовке продукта. Выход = 0,030 г, 23%. 1N-(Циклогексил)-1-метилгидразинкарботиоамид. Необходимый для синтеза циклогексилизотиоцианат (70,8 ммоль, 10 г) растворяли в метаноле (35 мл), и этот раствор по каплям добавляли (30 мин) к перемешанному раствору метилгидразина (134,5 ммоль, 7 мл) в воде (35 мл) при 0 С. После смешения раствор оставляли перемешиваться при КТ в течение ночи. Осадок удаляли фильтрованием. Твердое вещество промывали холодным ЕtOН с получением 11,7 г ожидаемого производного 5 а. Выход: 88,7%. 1N-Циклогексилгидразинкарботиоамид. Необходимый для синтеза циклогексилизотиоцианат (141 ммоль, 20 мл) растворяли в метаноле (30 мл), и этот раствор по каплям добавляли (35 мин) к перемешанному раствору гидразингидрата (423 ммоль, 13,2 мл) в метаноле (200 мл) при 0 С. После смешения раствор оставляли перемешиваться при КТ в течение ночи. Осадок удаляли фильтрованием. Твердое вещество промывали холодным ЕtOН с получением 14,9 г ожидаемого производного (5 б). Выход: 61%. 1MC (m/z)/M+1 =174,25. Промежуточное соединение 5 в. R1 = метиловый эфир 3-бензойной кислоты, R2 = Н. Гидразинкарботиоамид, N-(метиловый эфир 3-бензойной кислоты). 3-Метоксикарбонилизотиоцианат (77,6 ммоль, 15 г) по каплям добавляли (30 мин) к перемешиваемому раствору гидразингидрата (97 ммоль, 4,7 мл) в метаноле (40 мл) при -10 С. После перемешивания при -10 С в течение 5 ч раствор оставляли перемешиваться при комнатной температуре в течение ночи. Осадок отфильтровывали и промывали холодным метанолом с получением 15,4 г ожидаемого соединения. Выход: 88%. 1MC (m/z)/М+1 = 226. Промежуточное соединение 6. Протокол Б. Промежуточное соединение 6 а. R1 = циклогексил, R2 =метил, R3 = 2,4-дихлорфенил. Гидразинкарботиоамид, N-циклогексил-2-[(2,4-хлорфенил)метилен]. Суспензию 2-метилтиосемикарбазида (5 а) (2,67 ммоль, 500 мг) в этаноле (5 мл) и 2,4 дихлорбензальдегиде (2,94 ммоль, 515 мг) нагревали при 75 С в течение 18 ч. После охлаждения образовавшийся осадок отфильтровывали и промывали холодным этанолом, получая 876 мг указанного в заголовке соединения. Выход: 95,3%. 1(s, 1H), 8.20 (d, 1H), 8.50 (d, 1H). Пример I. Протокол Б. Пример I10. R1 = циклогексил, R2 = метил, R3 = 2,4-дихлорфенил. Циклогексил-[5-(2,4-дихлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амин. Соответствующий тиосемикарбазон (полученный по методике, описанной в примере 6 а) (2,3 ммоль,800 мг) суспендировали в этаноле (5 мл) и добавляли окислитель FеСl36 Н 2O (5,06 ммоль, 1,38 г), растворенный в этаноле (5 мл). Смесь нагревали при 75 С в течение 19 ч (ТСХ контроль). Для завершения ре- 25007179 акции добавляли 1,15 ммоль (0,31 г) окислителя. Смесь концентрировали путем отгонки растворителя и неочищенное вещество солюбилизировали в этилацетате. Неорганические соли удаляли экстракцией водой. Органический слой промывали раствором NaCl, сушили над сульфатом магния, фильтровали и перегоняли с получением остатка, который хроматографировали на колонке с силикагелем (с использованием градиентного элюирования смесью этилацетата и циклогексана в качестве растворителя, начиная с соотношения 5/95) и выделяли 230 мг чистого тиадиазолина. Основным побочным продуктом, образовавшимся в ходе этой реакции, является 1,2,4-триазолин-5-тион. Выход: 35%. 1[5-(2-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламин. Соединение I10.1 получали по методике, описанной в I10, с использованием соответствующих промежуточных соединений и реагента. Остаток подвергали хроматографии на силикагеле, элюируя циклогексаном, содержащим от 0 до 6% AcOEt. Выход: 6%. 1MC (m/z)/M+1 = 310,2. ВЭЖХ (УФ чистота,= 214 нм): 99,9%. Пример I11. R1 = циклогексил, R2 = метил, R3 = 4-(трифторметил)фенил. Циклогексил-[3-метил-5-(4-трифторметилфенил)-3H-[1,3,4]тиадиазол-2-илиден]амин. Соответствующий тиосемикарбазон (полученный по методике, описанной в примере 6 а) (2 ммоль,700 мг) суспендировали в этаноле (5 мл) и добавляли окислитель FеСl36 Н 2O (4,4 ммоль, 1,21 г), растворенный в этаноле (5 мл). Смесь нагревали при 75 С в течение 19 ч. Смесь концентрировали путем отгонки растворителя и неочищенное вещество солюбилизировали в этилацетате. Неорганические соли удаляли водной экстракцией. Органический слой промывали раствором NaCl, сушили над сульфатом магния,фильтровали и перегоняли с получением остатка, который хроматографировали на колонке с силикагелем (с использованием градиентного элюирования смесью этилацетата и циклогексана в качестве растворителя, начиная с соотношения 5/95) и выделяли 290 мг чистого тиадиазолина. Выход: 42%. 1(m, 1H), 3.60 (s, 3H), 7.85-7.95 (m, 4H). МС (m/z)/М+1 = 342,6. ВЭЖХ (УФ чистота,= 214 нм) 99,9%. Пример I12. R1 = циклогексил, R2 = метил, R3 = 4-пиридил. Циклогексил-(3-метил-5-пиридин-4-ил-3H-[1,3,4]тиадиазол-2-илиден)амин. Соединение I12 получали по методике, описанной в примере I11, с использованием соответствующих промежуточных соединений и реагентов (протокол Б). Смесь концентрировали перегонкой при пониженном давлении, и остаток растворяли в воде. Затем водную смесь подщелачивали насыщенным раствором NaHCO3 и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором NaCl и сушили над сульфатом магния, фильтровали и перегоняли с получением остатка, который очищали хроматографией на силикагеле (элюент: циклогексан/этилацетат, 95/5). Выход: 80%. 1[5-(3-Хлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламин. Соединение I13 получали по методике, описанной в примере I10, с использованием соответствующих промежуточных соединений и реагентов (протокол Б). Остаток подвергали хроматографии на силикагеле, элюируя циклогексаном, содержащим от 0 до 6% AcOEt. Выход: 23%. 1- 26007179 МС (m/z)/М+1 = 308. ВЭЖХ (УФ чистота,= 214 нм): 99,9%. Пример I14. R1 = циклогексил, R2 = метил, R3 = 4-цианофенил. 4-(5-Циклогексилимино-4-метил-4,5-дигидро-[1,3,4]тиадиазол-2-ил)бензонитрил. Соединение I14 получали по методике, описанной в примере I10, с использованием соответствующих промежуточных соединений и реагентов (протокол Б). Остаток подвергали хроматографии на силикагеле, элюируя циклогексаном, содержащим от 0 до 8% AcOEt. Выход: 10%. 1MC (m/z)/М+1 = 299,2. ВЭЖХ (УФ чистота,= 214 нм): 99,3%. Пример I15. R1 = циклогексил, R2 = метил, R3 = 4-метилсульфонилфенил. Циклогексил-[5-(4-метансульфонилфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амин. Соединение I15 получали по методике, описанной в примере I10, с использованием соответствующих промежуточных соединений и реагентов (протокол Б). Остаток подвергали хроматографии на силикагеле, элюируя циклогексаном, содержащим от 0 до 10% AcOEt. Больший выход I15 достигается при его получении согласно протоколу Г. Выход: 3%. 1 Промежуточное соединение 7. Протокол В. Промежуточное соединение 7 а. R1 = циклогексил, R3 = 4-хлор-3-сульфамоилфенил. 2-Хлор-5-(5-циклогексиламино-[1,3,4]тиадиазол-2-ил)бензолсульфонамид. К смеси 4-хлор-3-сульфамоилбензойной кислоты (6,36 ммоль, 1,5 г) и тиосемикарбазида (56) (6,36 ммоль, 1,10 г) в диоксане (40 мл) при 60 С добавляли РОСl3 (6,36 ммоль, 600 мкл) и эту смесь нагревали с обратным холодильником в течение 2 ч 30 мин и 16 ч при КТ. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали разбавленным раствором NH4OH. Полученный желтый осадок собирали фильтрованием, промывали водой, а затем сушили под вакуумом над P2O5 с получением 2 г целевого продукта. Выход = 84%. 1(m, 1H), 7.66-7.82 (m, 3H), 7.90 (m, 1H), 8.25-8.37 (br, 2H). МС (m/z)/М+1 = 373/375. Промежуточное соединение 7 б. R1 = циклогексил, R3 = 2,4-дихлор-5-сульфамоилфенил. 2,4-Дихлор-5-(5-циклогексиламино-[1,3,4]тиадиазол-2-ил)бензолсульфонамид. К смеси 2,4-дихлорбензойной кислоты (1,85 ммоль, 500 мг) и тиосемикарбазида (5 б) (1,85 ммоль,320 мг) в безводном диоксане (10 мл) при 70-80 С добавляли РОСl3 (1,85 ммоль, 173 мкл) и эту смесь нагревали при 95 С в течение 5 ч. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали насыщенным раствором NаНСО 3 до рН 8-7. Полученный осадок собирали фильтрованием, промывали водой и очищали хроматографией на силикагеле с использованием циклогексан/этилацетат в качестве элюента с получением 351 мг указанного в заголовке соединения. Выход: 46,3%. 1MC (m/z)/M+1 = 407,1. ВЭЖХ (УФ чистота,= 214 нм): 97,1%. Промежуточное соединение 7 в. R1 = циклогексил, R3 = 3-тиенил. Циклогексил-(5-тиофен-3-ил-[1,3,4]тиадиазол-2-ил)амин. К смеси 3-тиофенкарбоновой кислоты (3,9 ммоль, 500 мг) и тиосемикарбазида 5 б (3,9 ммоль, 675 мг) в безводном диоксане (10 мл) при 60-65 С добавляли РОСl3 (5 ммоль, 473 мкл) и смесь нагревали при 95 С в течение 5 ч. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали насыщенным раствором NаНСО 3 до рН 8-7. Полученный осадок собирали фильтрованием и промывали водой. Затем твердое вещество сушили под вакуумом,получая 965 мг целевого соединения (7 в). Выход: 93%. 1[5-(3-Хлор-2,6-диметоксифенил)-[1,3,4]тиадиазол-2-ил]-циклогексиламин. К смеси 3-хлор-2,6-диметоксибензойной кислоты (2,3 ммоль, 500 мг) и тиосемикарбазида 5 б (2,3 ммоль, 399 мг) в безводном диоксане (10 мл) при 70-80 С добавляли РОСl3 (2,3 ммоль, 215 мкл) и эту смесь нагревали при 95 С в течение 5 ч. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали насыщенным раствором NаНСО 3 до рН 87. Полученный осадок собирали фильтрованием, промывали водой и сушили под вакуумом. Твердое вещество подвергали флэш-хроматографии, элюируя смесью этилацетата и циклогексана, с получением 115 мг указанного в заголовке соединения. Выход: 14%. 1[5-(3-Бром-4-метоксифенил)-[1,3,4]тиадиазол-2-ил]-циклогексиламин. К смеси 3-бром-4-метоксибензойной кислоты (2,16 ммоль, 500 мг) и тиосемикарбазида 5 б (2,16 ммоль, 375 мг) в безводном диоксане (10 мл) при 60-65 С добавляли РОСl3 (2,8 ммоль, 262 мкл) и эту смесь нагревали при 95 С в течение 5 ч. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали насыщенным раствором NаНСО 3 до рН 87. Полученный осадок собирали фильтрованием, промывали водой и сушили под вакуумом. Твердое вещество солюбилизировали в 50 мл смеси дихлорметана и метанола (7/3), к которой добавляли морфолиновую смолу (13,88 ммоль, 4 г). Смесь перемешивали в течение ночи для удаления избытка кислоты. Морфолиновую соль отфильтровывали, и органический слой концентрировали перегонкой при пониженном давлении с получением 740 мг очищенного продукта (7 д). Выход: 92,8 %. 1(m, 2H), 3.45-3.55 (m, 1H), 7.45 (dd, 1H), 7.65 (dd, 1H), 7.80 (dd, 1H), 7.85 (dd, 1H). Промежуточное соединение 7 е. R1 = циклогексил, R3 = 2-пиразинил. Циклогексил-(5-пиразин-2-ил-[1,3,4]тиадиазол-2-ил)амин. К смеси 2-пиразинкарбоновой кислоты (2,885 ммоль, 0,358 г) и тиосемикарбазида (5 б) (2,885 ммоль, 0,5 г) в безводном диоксане (10 мл) при 90 С добавляли хлорангидрид фосфорной кислоты (3,751 ммоль, 0,350 мл) и эту смесь нагревали при 95 С в течение 5 ч. Смесь затем подщелачивали насыщенным раствором бикарбоната натрия до рН 7, затем экстрагировали EtOAc. Органическую фазу сушили над МgSO4 и упаривали до сухого состояния с получением ожидаемого продукта. Выход = 0,6 г, 79,6%. 1H-ЯМР (400 МГц, ДМСО)млн-1: 1.20-1.44 (m, 5H), 1.56-1.63 (b, 1H), 1.70-1.77 (b, 2H), 2.00-2.05 (b,2H), 3.60-3.68 (b, 1H), 8.22 (d, 1H), 8.67-8.69 (m, 2H), 9.28 (s,1H). Промежуточное соединение 7 ж. R1 = циклогексил, R3 = 3,4-дигидроксифенил. 4-(5-Циклогексиламино-[1,3,4]тиадиазол-2-ил)бензол-1,2-диол. К смеси 3,4-дигидроксибензойной кислоты (2,885 ммоль, 0,445 г) и тиосемикарбазида (5 б) (2,885 ммоль, 0,500 г) в безводном диоксане (10 мл) при 90 С добавляли хлорангидрид фосфорной кислоты(3,751 ммоль, 0,350 мл) и эту смесь нагревали при 95 С в течение 5 ч. Смесь подщелачивали насыщенным раствором бикарбоната натрия до рН 7, затем перемешивали при КТ в течение ночи. Осадок отфильтровывали, промывали гексаном, затем сушили с получением указанного в заголовке соединения. Выход: 71%. 1[5-(4-Хлор-фенил)-[1,3,4]тиадиазол-2-ил]циклогексиламин. Тиосемикарбазон (6 б) (полученный из 5 б, следуя схеме получения 6 а) (10 ммоль, 3 г) суспендировали в этаноле (50 мл) и добавляли окислитель FеСl36 Н 2O (23 ммоль, 6,3 г) Смесь нагревали с обратным холодильником в течение 3 ч. Смесь концентрировали перегонкой растворителя и неочищенного вещество солюбилизировали в этилацетате. Органический слой промывали водой, сушили над сульфатом магния, фильтровали и перегоняли с получением остатка, который еще раз окисляли FeCl36 Н 2 О (3 г) в этаноле (50 мл). Смесь нагревали с обратным холодильником в течение 3 ч и в течение 12 ч при КТ. Смесь концентрировали перегонкой растворителя и неочищенное вещество солюбилизировали в этилацетате. Неорганические соли удаляли водной экстракцией. Органический слой промывали растворомNaCl, сушили над сульфатом магния, фильтровали и перегоняли с получением остатка, который перетирали и промывали циклогексаном с получением 2,5 г указанного в заголовке продукта. Выход 85% 1(5 б) (2,468 ммоль, 427 мг) в диоксане (10 мл) при 65 С добавляли РОСl3 (3,2 ммоль, 300 мкл) и эту смесь нагревали при 95 С в течение 3 ч 30 мин. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали разбавленным раствором NH4OH. Полученный осадок собирали фильтрованием, промывали водой, а затем сушили под вакуумом над P2O5 с получением 675 мг целевого продукта. Выход = 80%. 1(m, 2H), 3.45-3.57 (m, 1H), 3.90 (s, 3H), 7.25 (s, 1H) 7.30 (s 1H), 7.85(d, 1H), 9.90(s, 1H). Промежуточное соединение 7 к. R1 = метиловый эфир 3-бензойной кислоты, R3 = 3-цианофенил. Метиловый эфир 3-[5-(3-цианофенил)-[1,3,4]тиадиазол-2-иламино]бензойной кислоты. К смеси 3-цианобензойной кислоты (2,92 ммоль, 0,43 г) и (5 в) (3 ммоль, 0.7 г) в диоксане (10 мл) при 85 С добавляли РОСl3 (3,8 ммоль, 350 мкл) и эту смесь нагревали при 95 С в течение 3 ч 30 мин. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества, которое подщелачивали насыщенным водным раствором NаНСО 3. Полученный осадок собирали фильтрованием, последовательно промывали водой и эфиром, а затем сушили под вакуумом с получением 0,5 г целевого продукта. Выход: 49%. 1MC (m/z)/М+1 = 337. Промежуточное соединение 7 л. R1 = метиловый эфир 3-бензойной кислоты, R3 = 2-пиридил. Метиловый эфир 3-(5-пиридин-2-ил-[1,3,4]тиадиазол-2-иламино)бензойной кислоты. К смеси пиколиновой кислоты (2,92 ммоль, 0,36 г) и (5 в) (3 ммоль, 0,7 г) в диоксане (10 мл) при 85 С добавляли РОСl3 (3,8 ммоль, 350 мкл) и эту смесь нагревали при 95 С в течение 5 ч. Растворитель удаляли перегонкой при пониженном давлении с получением неочищенного вещества. Добавляли метанол, и полученный осадок собирали фильтрованием, промывали метанолом и сушили под вакуумом с получением 0,59 г (61%) целевого продукта. На следующей стадии неочищенное вещество использовали без очистки. 1MC (m/z)/М+1 =313/314/315. Пример I. Протокол В. Пример I16. R1 = циклогексил, R2 = метил, R3 = 2,4-дихлор-5-сульфамоилфенил. 2,4-Дихлор-5-(5-циклогексилимино-4-метил-4,5-дигидро[1,3,4]тиадиазол-2-ил)бензолсульфонамид. К раствору 1,3,4-тиадиазола 7 б (0,195 ммоль, 80 мг) в безводном диоксане (10 мл) добавляли метилтрифторметансульфонат (0,23 ммоль, 27 мкл). Полученную в результате смесь перемешивали в течение 24 ч. Для завершения реакции к этому раствору добавляли 0,527 ммоль (64 мкл) метилтрифторметансульфоната и 0,585 ммоль (82 мкл) триэтиламина. Фильтрат концентрировали перегонкой при пониженном давлении. Продукт очищали колоночной хроматографией на силикагеле (элюируя смесью циклогексана и этилацетата, 80/20) с получением 48 мг указанного в заголовке продукта. Выход: 58%.MC (m/z)/M+1: 421,3. ВЭЖХ (УФ чистота,= 214 нм): 99,4%. Пример I17. R1 = циклогексил, R2 = метил, R3 = 3-тиенил. Циклогексил-(3-метил-5-тиофен-3-ил-3H-[1,3,4]тиадиазол-2-илиден)амин. К раствору 1,3,4-тиадиазола 7 в (0,75 ммоль, 200 мг) в безводном диоксане (10 мл) добавляли метилтрифторметансульфонат (1,13 ммоль, 128 мкл). Полученную в результате смесь перемешивали в течение 24 ч. Для завершения реакции к этому раствору добавляли 0,225 ммоль (26 мкл) метилтрифторметансульфоната и 0,675 ммоль (94 мкл) триэтиламина. Смесь концентрировали перегонкой при пониженном давлении и остаток растворяли в воде. Затем водную смесь подщелачивали (рН = 5-6) насыщенным раствором NaHCO3 в этилацетате. Органический слой насыщали NaCl и сушили над сульфатом магния,фильтровали и перегоняли с получением остатка, который очищали хроматографией на силикагеле,элюируя циклогексаном, содержащим от 0 до 15% AcOEt, получая 80 мг целевого продукта. Выход: 38%. 1MC (m/z)/М+1 = 280,23. ВЭЖХ (УФ чистота,= 214 нм): 99,9%. Пример I17.1. R1 = циклогексил, R2 = метил, R3 = 3,5-дихлорфенил. Циклогексил-[5-(3,5-дихлорфенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]амин. Соединение I17.1 получали по методике, описанной в примере I17, с использованием соответствующих промежуточных соединений и реагентов. Выход: 43%. 1MC (m/z)/M+1 = 342,2. ВЭЖХ (УФ чистота,= 214 нм): 99,9%. Соединение I17.2 получали по методике, описанной в примере I17, с использованием соответствующих промежуточных соединений и реагентов.[5-(3-Хлор-2,6-диметоксифенил)-3-метил-3H-[1,3,4]тиадиазол-2-илиден]циклогексиламин. К раствору 1,3,4-тиадиазола 7 г (0,226 ммоль, 80 мг) в безводном диоксане (10 мл) добавляли метилтрифторметансульфонат (0,27 ммоль, 31 мкл). Полученную в результате смесь перемешивали в течение 24 ч. Для завершения реакции к этому раствору добавляли 0,068 ммоль (7 мкл) метилтрифторметансульфоната. Смесь концентрировали перегонкой при пониженном давлении и остаток растворяли в воде. Затем водную смесь подщелачивали (рН = 5-6) насыщенным раствором NаНСО 3 и экстрагировали этилацетатом. Органический слой промывали насыщенным раствором NaCl и сушили над сульфатом магния,фильтровали и перегоняли с получением остатка, который очищали хроматографией на силикагеле (элюент: циклогексан/этилацетат, 80/20). Получали 11 мг целевого продукта. Выход: 13%. 1MC (m/z)/М+1 = 368,26. ВЭЖХ (УФ чистота,= 214 нм): 99,7%. Соединение I18.1 получали по методике, описанной в примере I18, с использованием соответствующих промежуточных соединений и реагентов: Пример I18.2. R1 = циклогексил, R2 = метил, R3 = 2-(5-пиридин-2-ил)тиенил. Циклогексил-[3-метил-5-(5-пиридин-2-ил-тиофен-2-ил)-3H-[1,3,4]тиадиазол-2-илиден]амин. Соединение I18.2 получали по методике, описанной в примере I18, с использованием соответствующих промежуточных соединений и реагентов. Остаток очищали хроматографией на силикагеле с градиентным элюированием циклогексаном, содержащим от 0 до 10% этилацетата. Выход: 57%. 1
МПК / Метки
МПК: A61K 31/4245, C07D 271/113, C07D 417/10, C07D 285/135, A61K 31/55, C07D 453/02, A61K 31/433, C07D 417/14, A61K 31/439, C07D 417/04, C07D 417/12
Метки: тиадиазолы, качестве, ингибиторов, применение, фосфодиэстеразы-7, оксадиазолы
Код ссылки
<a href="https://eas.patents.su/30-7179-tiadiazoly-i-oksadiazoly-i-ih-primenenie-v-kachestve-ingibitorov-fosfodiesterazy-7.html" rel="bookmark" title="База патентов Евразийского Союза">Тиадиазолы и оксадиазолы и их применение в качестве ингибиторов фосфодиэстеразы-7</a>
Предыдущий патент: Производные &beta-d-нуклеозида в качестве лекарственного средства для лечения инфекции вируса гепатита c у хозяина
Следующий патент: Обрабатывающая композиция
Случайный патент: Способ получения гидроксамовых кислот












