Сульфонилпиразольные и сульфонилпиразолиновые производные карбоксамидина как антагонисты 5-ht6
Номер патента: 21543
Опубликовано: 30.07.2015
Авторы: Лувезейн Ван Арнольд, Зоргдрагер Ян, Ивема Баккер Ваутер И., Крюсе Корнелис Г., Кейзер Хискиас Г., Нэт Ван Дер Мартина А.В.
Формула / Реферат
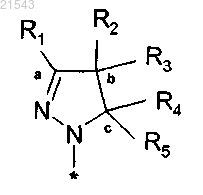
1. Соединение формулы (1)
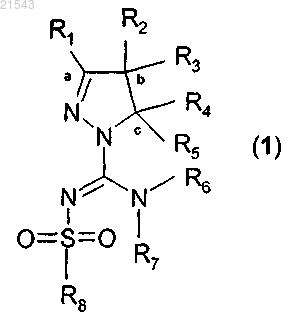
или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, где
R1 обозначает атом водорода или незамещенную (C1-4)алкильную группу;
R2 и R3 независимо представляют собой атом водорода, незамещенную (C1-4)алкильную группу, (C1-4)алкильную группу, замещенную одним или более атомов галогена, фенил(С1-4)алкокси(C1-4)алкильную группу, или
R1 и R2 вместе с атомами углерода, обозначенными "а" и "b", образуют С5-8циклоалкильное кольцо, или
R2 и R3 вместе с атомом углерода, обозначенным "b", образуют С3-8циклоалкильное кольцо, или
R2 и R3 вместе с атомом углерода, обозначенным "b", образуют С5-8гетероциклоалкильное кольцо, незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила, или
R4 и R5 независимо представляют собой атом водорода, незамещенную (C1-4)алкильную группу или моноциклическую ароматическую или гетероароматическую группу, причем указанные группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, или
R3 и R4 вместе с атомами углерода, обозначенными "b" и "с", образуют С5-8гетероциклоалкильное кольцо, незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила;
R6 и R7 независимо представляют собой атом водорода, или (C1-4)алкильную группу, или (C1-4)алкильную группу, замещенную одним или более атомами галогена, или (C1-3)алкоксигруппу, или ди(С1-3)алкиламино(C1-3)алкильную группу, или моноциклическую ароматическую группу, или С5-8циклоалкильную или С5-8гетероциклоалкильную группу, причем циклические группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, при условии, что исключен N-(4,6-диметил-2-пиримидинил)-4,5-дигидро-N'-[(4-метилфенил)сульфонил]-5-фенил-1Н-пиразол-1-карбоксимидамид, или
R6 и R7 вместе с атомом азота, к которому они присоединены, образуют С5-8гетероциклоалкильную группу;
R8 представляет собой моноциклическую или конденсированную бициклическую ароматическую или гетероароматическую группу, причем указанные группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, трифторметила, атома фтора, атома хлора, атома брома, (C1-3)алкилокси, трифторметокси и амино, или
R8 представляет собой -СН=СН-фенильную группу, или
R8 представляет собой группу NR11R12, где R11 и R12 независимо представляют собой атом водорода, незамещенную (C1-3)алкильную группу или фенильную или бензильную группу,
где указанная ароматическая группа или гетероароматическая группа представляет собой 5- или 6-членное кольцо, содержащее 0, 1 или 2 гетероатома, выбранных из азота, кислорода и серы, и где указанное С5-8гетероциклоалкильное кольцо представляет собой пиперидинил, пиперазинил или тетрагидропиранил.
2. Соединение по п.1 формулы (1) или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, в которых
R1 обозначает атом водорода или
R1 и R2 вместе с атомами углерода, обозначенными "а" и "b", образуют циклогексильное кольцо;
R2 и R3 независимо представляют собой атом водорода или (C1-3)алкильную группу или
R2 и R3 вместе с атомом углерода, обозначенным "b", образуют циклопентильное или циклогексильное кольцо;
R4 и R5 независимо представляют собой атом водорода или (C1-3)алкильную группу;
R6 и R7 независимо представляют собой атом водорода, или (С1-3)алкильную группу, или (C1-4)алкильную группу, замещенную одним или более атомами галогена, или метоксигруппу, или циклогексильную группу, или 4-пиперидинильную группу;
R8 имеет значения, которые указаны в п.1.
3. Соединение по п.1 формулы (1)
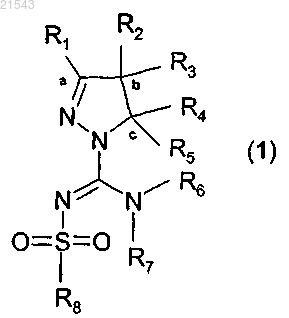
или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, где фрагмент
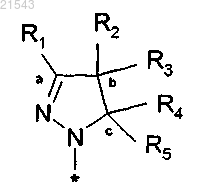
выбран из
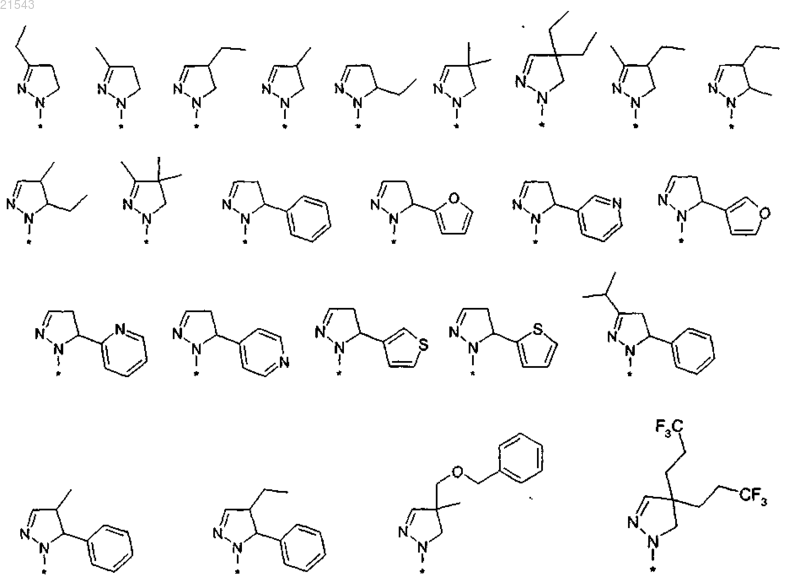
или R1 и R2 вместе с атомами углерода, обозначенными "а" и "b", образуют С5-8циклоалкильное кольцо, или
R2 и R3 вместе с атомом углерода, обозначенным "b", образуют С3-8циклоалкильное или С5-8гетероциклоалкильное кольцо, незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила, или
R3 и R4 вместе с атомами углерода, обозначенными "b" и "с", образуют С5-8гетероциклоалкильное кольцо, незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила;
R6 и R7 независимо представляют собой атом водорода, или (C1-4)алкильную группу, или (C1-4)алкильную группу, замещенную одним или более атомами галогена, или (C1-3)алкоксигруппу, или ди(C1-3)алкиламино(C1-3)алкильную группу, или моноциклическую ароматическую группу, или С5-8циклоалкильную или C5-8гетероциклоалкильную группу, причем циклические группы являются незамещенными или замещенными одним или более заместителями, выбранными из (С1-3)алкила, при условии, что R6 и R7 не могут представлять собой N-(4,6-диметил-2-пиримидинил)-4,5-дигидро-N'-[(4-метилфенил)сульфонил]-5-фенил-1Н-пиразол-1-карбоксимидамид, или
R6 и R7 вместе с атомом азота, к которому они присоединены, образуют С5-8гетероциклоалкильную группу;
R8 представляет собой моноциклическую или конденсированную бициклическую ароматическую или гетероароматическую группу, причем указанные группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, трифторметила, атома фтора, атома хлора, атома брома, (C1-3)алкилокси, трифторметокси и амино, или -СН=СН-фенильную группу, или группу -NR11R12, где R11 и R12 независимо представляют собой атом водорода, (C1-3)алкильную группу или фенильную или бензильную группу,
где указанная ароматическая группа или гетероароматическая группа представляет собой 5- или 6-членное кольцо, содержащее 0, 1 или 2 гетероатома, выбранных из азота, кислорода и серы, и где указанное С5-8гетероциклоалкильное кольцо представляет собой пиперидинил, пиперазинил или тетрагидропиранил.
4. Соединение по п.1 или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, где фрагмент
выбран из
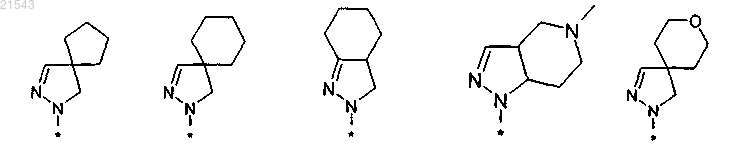
и где R6, R7 и R8 имеют значения, которые указаны в п.1.
5. Соединение по п.1 формулы (1) или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, где
R1, R4, R5 и R6 представляют собой атом водорода;
R2 и R3 независимо представляют собой (C1-3)алкильную группу или
R2 и R3 вместе с атомом углерода, обозначенным "b", образуют циклопентильное или циклогексильное кольцо;
R7 представляет собой (C1-3)алкильную группу;
R8 имеет значения, которые указаны в п.1.
6. Соединение, выбранное из соединений формул
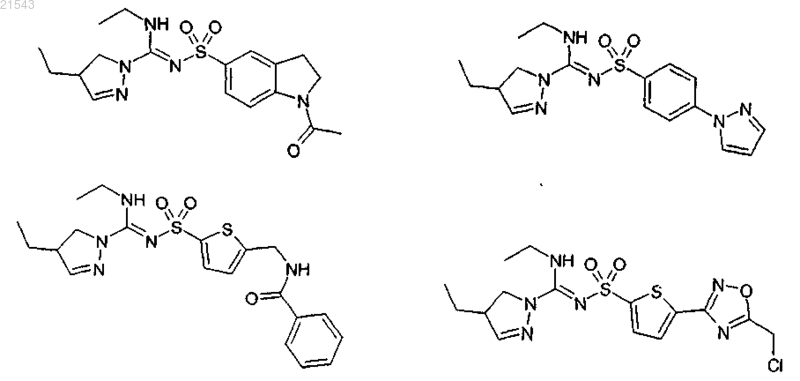
7. Соединение по любому из пп.1-6 или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, причем указанное соединение представляет собой оптически активный энантиомер.
8. Лекарственное средство, включающее соединение по любому из пп.1-7 или его фармакологически приемлемую соль, гидрат или сольват.
9. Лекарственное средство по п.8 для лечения следующих заболеваний: болезнь Паркинсона, шизофрения, состояние тревоги, депрессия, психозы, эпилепсия, обсессивно-компульсивные расстройства, болезнь Альцгеймера, возрастное снижение когнитивной функции, небольшое когнитивное ухудшение, расстройства сна, отмена употребления кокаина, этанола или никотина, боль и диабет типа 2.
10. Соединения общей формулы (1х)
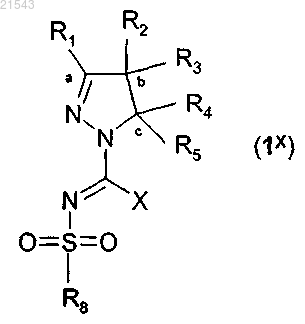
где X представляет собой галоген или S-(C1-4)алкил и
другие символы имеют значения, указанные в п.1,
и их таутомеры, стереоизомеры и N-оксиды, а также фармакологически приемлемые соли, гидраты и сольваты указанных соединений формулы (1х) и их таутомеры, стереоизомеры и N-оксиды, причем такие соединения полезны при синтезе соединений общей формулы (1).
11. Соединения общей формулы (1z)
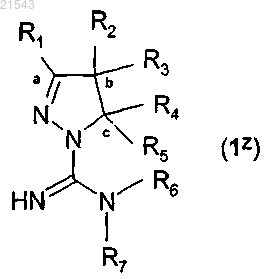
где символы имеют значения, которые указаны в п.1,
и их таутомеры, стереоизомеры и N-оксиды, причем такие соединения полезны при синтезе соединений общей формулы (1) при условии, что если R1, R2, R3, R5 и R6 представляют собой атом водорода и R4 обозначает фенил, то R7 не может быть атомом водорода или 4,6-диметилпиримидин-2-илом; и при условии, что если R2, R3, R5, R6 и R7 представляют собой атом водорода и R1 обозначает метил, то R4 не может быть фенилом, 2-гидроксифенилом или 4-метилфенилом.
12. Применение соединения по любому из пп.1-7 для получения фармацевтической композиции для лечения или профилактики следующих заболеваний: болезнь Паркинсона, шизофрения, состояние тревоги, депрессия, психозы, эпилепсия, обсессивно-компульсивные расстройства, болезнь Альцгеймера, возрастное снижение когнитивной функции, небольшое когнитивное ухудшение, расстройства сна, отмена употребления кокаина, этанола или никотина, боль и диабет типа 2.
Текст
СУЛЬФОНИЛПИРАЗОЛЬНЫЕ И СУЛЬФОНИЛПИРАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ КАРБОКСАМИДИНА КАК АНТАГОНИСТЫ 5-HT6 Изобретение касается сульфонилпиразолиновых производных карбоксамидина как антагонистов рецепторов 5-НТ 6 и новых промежуточных соединений, полезных для их синтеза. Изобретение также касается применений таких соединений и композиций, в особенности их применения при введении пациентам с целью достижения терапевтического эффекта при болезни Паркинсона, шизофрении,состоянии тревоги, депрессии, психозах, эпилепсии, обсессивно-компульсивных расстройствах, болезни Альцгеймера, возрастном снижении когнитивной функции, небольшом когнитивном ухудшении,расстройствах сна, отмене употребления кокаина, этанола или никотина, боли и диабете типа 2. Соединения имеют общую формулу (1) где символы имеют значения, данные в описании. Ивема Баккер Ваутер И., Кейзер Хискиас Г., Нэт Ван Дер Мартина А.В., Крюсе Корнелис Г., Лувезейн Ван Арнольд,Зоргдрагер Ян (NL) Область техники Это изобретение относится к области фармацевтической и органической химии и касается сульфонилпиразолиновых производных карбоксамидина, промежуточных соединений, составов и способов. Предпосылки изобретения Серотонин (5-гидрокситриптамин или 5-НТ), ключевой трансмиттер периферической и центральной нервной системы, модулирует физиологические и патологические функции в широком диапазоне,опосредованные рядом семейств рецепторов, обозначаемых 5-HT1, 5-НТ 2, 5-НТ 3, 5-НТ 4, 5-НТ 5, 5-НТ 6 и 5 НТ 7. Хотя функции трех последних менее понятны, чем функции остальных, обычно принимают, что соединения, которые селективно блокируют 5-НТ-опосредованную трансдукцию сигнала, являются новыми важными целевыми лекарственными средствами. Крысиный рецептор 5-НТ 6 был клонирован в двух различных группах (Ruat, 1993; Sebben, 1994) и вскоре после этого клонировали человеческий рецептор, имеющий 89% идентичность последовательности (Kohen, 1996). В настоящее время большой интерес к рецептору 5-НТ 6 обусловлен тем, что некоторые психотропные агенты представляют собой антагонисты с высокой аффинностью к человеческому рецептору 5-НТ 6 (Kohen, 1996; Roth, 1994). Эти соединения включают амитриптилин (Ki=65 нМ) и атипические антипсихотические средства: клозапин (Ki=9,5 нМ), оланзапин (Ki=10 нМ) и кветиапин(Ki=33 нМ). Однако ни одно из этих соединений не является селективным. Первыми селективными антагонистами рецепторов 5-НТ 6, о которых сообщалось, являются Ro 04-6790 и Ro 63-0563. Их применимость ограничена их средней аффинностью (Ki=50 и 12 нМ соответственно) и плохой фармакокинетикой(Sleight, 1998). При разработке селективных антагонистов рецепторов 5-НТ 6 Ro-04-6790 и SB-271046 появилось несколько сообщений по активности этих соединений на моделях когнитивной функции. SB271046 улучшает характеристики поведения в водном лабиринте Морриса (Rogers, 1999). Эти результаты согласуются с обнаружением того факта, что хроническое интрацеребровентрикулярное введение антисмысловых олигонуклеотидов, направленных к последовательности рецептора 5-НТ 6, ведет к улучшениям в некоторых измерениях характеристик поведения в водном лабиринте Морриса (Bentley, 1999b). Недавно сообщалось о влиянии антагонистов 5-НТ 6 и 5 -НТ 6-антисмысловых олигонуклеотидов на снижение приема пищи у крыс (Bentley, 1997; Bentley, 1999 а; Woolley, 2001). Ожирение представляет собой состояние, характеризующееся повышением содержания жира в организме, результатом которого является избыток массы тела выше общепринятых норм. Ожирение является наиболее важным расстройством питания в западном мире и представляет главную проблему для здоровья во всех индустриальных странах. Это расстройство ведет к повышенной смертности вследствие увеличения числа случаев таких заболеваний как сердечно-сосудистые заболевания, пищеварительные заболевания, респираторные заболевания, рак и диабет типа 2. 5-НТ 6-селективные лиганды идентифицированы как потенциально полезные при лечении или профилактике некоторых расстройств центральной нервной системы, таких как болезнь Паркинсона, шизофрения, состояние тревоги, депрессия, психозы, эпилепсия, обсессивно-компульсивные расстройства,болезнь Альцгеймера, возрастное снижение когнитивной функции, небольшое когнитивное ухудшение,расстройства сна, отмена употребления кокаина, этанола или никотина, боль и диабет типа 2. Целью настоящего изобретения является обеспечение эффективных и селективных 5-НТ 6 антагонистов, химически не имеющих отношения ни к одному из известных 5-НТ 6 антагонистов, соединений, применимых для лечения определенных расстройств ЦНС. Раскрытие изобретения Неожиданно было обнаружено, что некоторые сульфонилпиразолиновые производные карбоксамидина являются антагонистами рецепторов 5-НТ 6. Изобретение представляет соединение общей формулы или его таутомер, стереоизомер, N-оксид или фармакологически приемлемая соль, гидрат или сольват любого из вышеупомянутых производных, гдеR1 обозначает атом водорода или незамещенную (С 1-4)алкильную группу;R2 и R3 независимо представляют собой атом водорода, незамещенную (C1-4)алкильную группу,(C1-4)алкильную группу, замещенную одним или более атомов галогена, фенил(C1-4)алкоксиR2 и R3 вместе с атомом углерода, обозначенным "b", образуют С 5-8 гетероциклоалкильное кольцо,незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила, илиR4 и R5 независимо представляют собой атом водорода, незамещенную (С 1-4)алкильную группу или моноциклическую ароматическую или гетероароматическую группу, причем указанные группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, илиR3 и R4 вместе с атомами углерода, обозначенными "b" и "с", образуют С 5-8 гетероциклоалкильное кольцо, незамещенное или замещенное одним или более заместителями, выбранными из (C1-3)алкила;R6 и R7 независимо представляют собой атом водорода, или (C1-4)алкильную группу, или(С 1-4)алкильную группу, замещенную одним или более атомами галогена, или (C1-3)алкоксигруппу, или ди(C1-3)алкиламино(С 1-3)алкильную группу, или моноциклическую ароматическую группу, или С 5-8 циклоалкильную или С 5-8 гетероциклоалкильную группу, причем циклические группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, при условии, что исключен N-(4,6-диметил-2-пиримидинил)-4,5-дигидро-N'-[(4-метилфенил)сульфонил]-5-фенил 1 Н-пиразол-1-карбоксимидамид, илиR8 представляет собой моноциклическую или конденсированную бициклическую ароматическую или гетероароматическую группу, причем указанные группы являются незамещенными или замещенными одним или более заместителями, выбранными из (C1-3)алкила, трифторметила, атома фтора, атома хлора, атома брома, (C1-3)алкилокси, трифторметокси и амино, илиR8 представляет собой группу -NR11R12, где R11 и R12 независимо представляют собой атом водорода, незамещенную (С 1-3)алкильную группу или фенильную или бензильную группу,где указанная ароматическая группа или гетероароматическая группа представляет собой 5- или 6 членное кольцо, содержащее 0, 1 или 2 гетероатома, выбранных из азота, кислорода и серы, и где указанное С 5-8 гетероциклоалкильное кольцо представляет собой пиперидинил, пиперазинил или тетрагидропиранил. Изобретение касается рацематов, смесей диастереомеров, а также индивидуальных стереоизомеров соединений, имеющих формулу (1). Изобретение также касается Е-изомера, Z-изомера и E/Z-смесей соединений, имеющих формулу (1). Изобретение, в частности, касается соединения общей формулы (1) или его таутомера, стереоизомера, N-оксида или фармакологически приемлемой соли, гидрата или сольвата любого из вышеупомянутых производных, гдеR1 обозначает атом водорода илиR2 и R3 независимо представляют собой атом водорода или (C1-3)алкильную группу илиR2 и R3 вместе с атомом углерода, обозначенным "b", образуют циклопентильное или циклогексильное кольцо;R4 и R5 независимо представляют собой атом водорода или (C1-3)алкильную группу;R6 и R7 независимо представляют собой атом водорода, или (C1-3)алкильную группу, или(C1-4)алкильную группу, замещенную одним или более атомами галогена, или метоксигруппу, или циклогексильную группу, или 4-пиперидинильную группу;R8 имеет значения, которые даны выше. Соединения по изобретению формулы (1), а также их фармакологически приемлемые соли обладают антагонистической активностью относительно рецептора 5-НТ 6. Они полезны при лечении расстройств, включающих рецепторы 5-НТ 6, или поддающихся лечению посредством манипуляции с этими рецепторами. Например, при следующих заболеваниях: болезнь Паркинсона, шизофрения, состояние тревоги, депрессия, психозы, эпилепсия, обсессивно-компульсивные расстройства, болезнь Альцгеймера,возрастное снижение когнитивной функции, небольшое когнитивное ухудшение, расстройства сна, отмена употребления кокаина, этанола или никотина, боль и диабет типа 2. Другие варианты изобретения включают, но не ограничены этим фармацевтические композиции для лечения, например, расстройства или состояния, поддающегося лечению посредством блокирования 5-НТ 6 рецепторов, причем указанные композиции содержат соединение формулы (1) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель; способы лечения расстройства или состояния, поддающегося лечению, посредством блокирования рецепторов 5-НТ 6, причем указанные способы включают введение нуждающемуся в таком лечении млекопитающему соединения формулы (1) или его фармацевтически приемлемой соли; способы лечения расстройства или состояния, выбранного из перечисленных здесь расстройств,причем указанные способы включают введение нуждающемуся в таком лечении млекопитающему со-2 021543 единения формулы (1) или его фармацевтически приемлемой соли; способы лечения расстройства или состояния, выбранного из перечисленных здесь расстройств,причем указанные способы включают введение нуждающемуся в таком лечении пациенту соединения формулы (1) или его фармацевтически приемлемой соли; способы антагонистического воздействия на рецептор 5-НТ 6, которые включают введение нуждающемуся в этом субъекту эффективного количества соединения формулы (1). Изобретение также касается соединений и способов лечения расстройства или состояния, выбранного из перечисленных здесь расстройств, причем указанный способ включает введение пациенту, нуждающемуся в таком лечении, соединения формулы (1) или его фармацевтически приемлемой соли. Соединения по изобретению обладают антагонистической активностью относительно рецепторов 5 НТ 6. Эту активность соединений по изобретению легко продемонстрировать, например, применяя одно или более из описанных здесь исследований или исследований, известных в данной области. Изобретение также касается промежуточных соединений, используемых в этих способах. Выделение и очистку описанных здесь соединений и промежуточных соединений можно проводить, если требуется, любым подходящим методом разделения или очистки, таким как, например, фильтрование, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, толстослойная хроматография, препаративная жидкостная хроматография при низком или высоком давлении или комбинация этих методов. Конкретные иллюстрации подходящих методик разделения и выделения можно взять из описания препаратов и примеров. Однако, конечно, можно также использовать другие эквивалентные методики разделения или выделения. Соединения по настоящему изобретению могут содержать один или более асимметрических центров и, таким образом, могут встречаться в виде рацематов и рацемических смесей, отдельных энантиомеров, диастереомерных смесей и индивидуальных диастереомеров. В зависимости от природы различных заместителей молекула может иметь дополнительные асимметрические центры. Каждый такой асимметрический центр независимо дает два оптических изомера. Все возможные оптические изомеры и диастереомеры в виде смесей и чистых или частично очищенных соединений принадлежат данному изобретению. Настоящее изобретение включает все такие изомерные формы этих соединений. Формула (1) показывает структуру класса соединений без предпочтительной стереохимии. Независимый синтез этих диастереомеров или их хроматографическое разделение можно осуществить способами, известными в данной области, модифицируя подходящим образом раскрытую в них методологию. Их абсолютную стереохимию можно определить методом рентгеновской кристаллографии кристаллических продуктов или кристаллических промежуточных соединений, которые, если необходимо, получают дериватизацией при помощи реагента, содержащего асимметрический центр известной абсолютной конфигурации. Рацемические смеси соединений можно разделить на индивидуальные энантиомеры способами, хорошо известными в данной области, такими как взаимодействие рацемической смеси соединений с энантиомерно чистым соединением с образованием диастереомерной смеси и последующим разделением индивидуальных диастереомеров стандартными способами, такими как фракционированная кристаллизация или хроматография. Взаимодействие часто заключается в образовании солей при использовании энантиомерно чистой кислоты или основания, например, (-)-ди-паратолуоил-D-винной кислоты и/или (+)-ди-пара-толуоил-b-винной кислоты. Затем можно преобразовать диастереомерные производные в чистые энантиомеры посредством отщепления добавленного хирального остатка. Рацемическую смесь соединений можно также разделить непосредственно хроматографическими способами, используя хиральные стационарные фазы: способы, хорошо известные в данной области. По-другому, любой энантиомер соединения можно получить стереоселективным синтезом, используя оптически чистые исходные материалы или реагенты известной конфигурации, способами, хорошо известными в данной области. Цис- и транс-изомеры соединения формулы (1) или его фармацевтически приемлемой соли также включены в данное изобретение, и оно также касается таутомеров соединений формулы (1) или их фармацевтически приемлемых солей. Некоторые из кристаллических форм соединений могут существовать в виде полиморфов, подразумевается, что полиморфы как таковые включены в изобретение. Кроме того, некоторые из соединений могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Такие сольваты также относятся к области данного изобретения. Соединения по изобретению также можно применять в качестве реагентов или стандартов в биохимическом исследовании неврологической функции, дисфункции и заболевания. Определения Общие термины, используемые при описании раскрытых здесь соединений, имеют свои обычные значения. Используемый здесь термин "алкил" обозначает одновалентную насыщенную разветвленную или линейную углеводородную цепь. Пока не утверждается иное, такие цепи могут содержать от 1 до 18 атомов углерода. Типичными примерами таких алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, трет-пентил, гексил, изогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, геп-3 021543 тадецил, октадецил и подобные. Алкильная группа, квалифицированная как "низшая", содержит от 1 до 6 атомов углерода. Такое же содержание углерода распространяется на исходный термин "алкан" и производные термины, такие как "алкокси". Содержание углерода в различных углеводородсодержащих фрагментах указывается приставкой, обозначающей минимальное и максимальное число атомов углерода во фрагменте, т.е. приставка Сх-Су определяет присутствующее количество атомов углерода от целого значения "х" до целого значения "у" включительно. Например, выражение "(C1-3)алкил" обозначает метил,этил, н-пропил или изопропил, и выражение "(C1-4)алкил" обозначает метил, этил, н-пропил, изопропил,н-бутил, 2-бутил, изобутил или 2-метил-н-пропил. Термин "алкенил" обозначает линейные или разветвленные углеводородные радикалы, имеющие одну или более двойных связей углерод-углерод, такие как винил, аллил, бутенил и др., и представляет, например, (С 2-4) алкенил. В "алкинильных" группах линейные или разветвленные углеводородные радикалы имеют одну или более тройных связей углеродуглерод, например, этинил, пропаргил, 1-бутинил, 2-бутинил и др., и представляют собой, например,(C2-4) алкинил. Пока не утверждается иное, "алкенильные" и "алкинильные" цепи могут содержать от 1 до 18 атомов углерода. Термин "ацил" обозначает алкил(C1-3)карбонил, арилкарбонил или арил-(C1-3)алкилкарбонил. Термин "арил" включает моноциклические или конденсированные бициклические ароматические или гетероароматические группы, включая (но не ограничиваясь этим) фурил, тиенил, пирролил, оксазолил, тиазолил, имидазолил, имидазо[2,1-b][1,3]тиазолил, пиразолил, изоксазолил, изотиазолил, пиридил,пиридазинил, пиримидинил, пиразинил, 1,3,5-триазинил, фенил, индазолил, индолил, индолизинил, изоиндолил, бензо[b]фуранил, 1,2,3,4-тетрагидронафтил, 1,2,3,4-тетрагидроизохинолинил, инданил, инденил, бензо[b]тиенил, 2,3-дигидро-1,4-бензодиоксин-5-ил, бензимидазолил, бензотиазолил, бензо[1,2,5]тиадиазолил, пуринил, хинолинил, изохинолинил, фталазинил, хиназолинил, хиноксалинил, 1,8 нафтиридинил, нафтил, птеридинил или азуленил. Термин "гало" или "галоген" обозначает хлор, фтор, бром или йод; "гетеро", как в термине "гетероалкил", "гетероароматический" и др. обозначает содержание одного или более атомов N, О или S; термин"гетероалкил" включает алкильные группы с гетероатомами в любом положении, включая, таким образом, N-связанные, О-связанные или S-связанные алкильные группы. Выражение "замещенный" означает, что указанная группа или фрагмент несет один или более заместителей. Поскольку любая группа может нести множество заместителей, и имеется многообразие возможных заместителей, заместители выбраны независимо и не должны быть одинаковыми. Выражение"незамещенный" означает, что указанная группа не несет заместителей. Выражение "необязательно замещен" означает, что группа может быть или не быть дополнительно замещенной одной или более группами, выбранными из следующих: C1-8 алкил, C1-8 алкенил, С 1-8 алкинил, арил, фтор, хлор, бром, гидроксил, С 1-8 алкилокси, С 1-8 алкенилокси, арилокси, ацилокси, амино, С 1-8 алкиламино, ди(C1-8)алкиламино,ариламино, тио, C1-8 алкилтио, арилтио, алкилсульфонил, арилсульфонил, алкилсульфинил, арилсульфинил, циано, оксо, нитро, ацил, амидо, C1-8 алкиламидо, ди(C1-8)алкиламидо, карбоксил, или два необязательных заместителя могут вместе с атомами углерода, к которому они присоединены, образовывать 5 или 6-членное ароматическое или неароматическое кольцо, содержащее 0, 1 или 2 гетероатома, выбранные из атомов азота, кислорода или серы. Необязательные заместители могут сами нести дополнительные необязательные заместители. Предпочтительные необязательные заместители включают С 1-3 алкил,такой как, например, метил, этил и трифторметил, фтор, хлор, бром, гидроксил, С 1-3 алкилокси, такой как,например, метокси, этокси и трифторметокси, и амино. Выражение "независимо" в отношении заместителей означает, что, если возможно наличие более одного такого заместителя, то заместители могут быть одинаковыми или отличаться друг от друга."С 3-8 циклоалкил" обозначает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или циклооктил; "С 5-8 гетероциклоалкил" относится к циклам, содержащим гетероатом, включая пиперидинил, пиперазинил и тетрагидропиранил; выражение "С 5-10 бициклоалкильная группа" относится к карбобициклическим кольцевым системам, включая (но не ограничиваясь этим) группы бицикло[2,2,1]гептанил, бицикло[3,3,0]октанил или бицикло[3,1,1]гептанил; выражение "С 6-10 трициклоалкильная группа" относится к карботрициклическим кольцевым системам, включая (но не ограничиваясь этим) группы 1-адамантил, норадамантил или 2-адамантил. Выражение "С 8-11 тетрациклоалкильная группа" относится к карботетрациклическим кольцевым системам, включая (но не ограничиваясь этим) группы кубил, гомокубил или бис-гомокубил. Термины "окси", "тио" и "карбо", используемые здесь как часть другой группы, касаются, соответственно, атома кислорода, атома серы и карбонильной группы (С=O), служащих линкером между двумя группами, такими как, например, гидроксил, оксиалкил, тиоалкил, карбоксиалкил и др. Термин "амино",используемый здесь сам по себе или как часть другой группы, относится к атому азота, который может быть либо конечным атомом, либо линкером между двумя другими группами, где группа может представлять собой первичный, вторичный или третичный амин (соответственно, два атома водорода связаны с атомом азота, один атом водорода связан с атомом азота, и ни одного атома водорода не связано с атомом азота). Термины "сульфинил" и "сульфонил" используемые здесь как часть другой группы, касаются групп -SO- или - SO2- соответственно. Используемое здесь выражение "уходящая группа" (L) обозначает заряженный или незаряженный атом или группу, которая уходит при реакции замещения или реакции обмена. Данное выражение относится к группам, легко поддающимся замещению нуклеофилом, таким как амин, тиол или спиртовой нуклеофил. Такие уходящие группы хорошо известны в данной области. Примеры включают, но не ограничены этим, N-гидроксисукцинимид, N-гидроксибензотриазол, галогениды (Br, Cl, I), трифлаты, мезилаты, тозилаты и подобные.N-оксиды упомянутых выше соединений включены в изобретение. Третичные амины могут давать или не давать N-оксидные метаболиты. Степень, до которой происходит N-окисление, варьируется от следовых количеств до почти количественной конверсии. N-оксиды могут быть более активны, чем соответствующие им третичные амины, или менее активны. Хотя N-оксиды можно легко восстановить химическими средствами до соответствующих третичных аминов, в организме человека это происходит в разной степени. Некоторые N-оксиды претерпевают почти количественную восстановительную конверсию до соответствующих третичных аминов, в других случаях конверсия представляет собой всего лишь следовую реакцию или даже полностью отсутствует (Bickel, 1969). Любое соединение, претерпевающее in vivo метаболизм с образованием биологически активного агента (т.е. соединения формулы (1, представляет собой пролекарство в рамках области и духа данной заявки. Пролекарства являются терапевтическими агентами, которые неактивны сами по себе, но трансформируются в один или более активных метаболитов. Таким образом, в способах лечения по настоящему изобретению выражение "введение" включает лечение различных описанных расстройств конкретно раскрытым соединением или соединением, которое конкретно не раскрыто, но после введения пациенту преобразуется в указанное соединение in vivo. Пролекарства представляют собой биологически обратимые производные лекарственных молекул, используемые для преодоления некоторых барьеров применения исходных лекарственных молекул. Эти барьеры включают, но не ограничены этим, растворимость,проницаемость, стабильность, пресистемный метаболизм и ограничения целенаправленности (Bundgaard,1985; King, 1994; Stella, 2004; Ettmayer, 2004; Jarvinen, 2005). Пролекарства, т.е. соединения, которые при введении людям любым известным способом претерпевают метаболизм в соединения формулы (1), составляют часть изобретения. В частности, это касается соединений с первичными или вторичными амино- или гидроксигруппами. Можно проводить взаимодействие таких соединений с органическими кислотами с получением соединений, имеющих формулу (1), в которых присутствует дополнительная группа,которая легко удаляется после введения, например (но не ограничиваясь этим), амидина, енамина, основания Манниха, гидроксилметиленового производного, О-ацилоксиметиленкарбаматного производного,карбамата, сложного эфира, амида или енаминона. Выражение "кристаллическая форма" относится к различным твердым формам одного и того же соединения, например полиморфам, сольватам и аморфным формам. "Полиморфы" представляют собой кристаллические структуры, в которых соединение может кристаллизоваться в виде разных кристаллических упаковок, которые все имеют одинаковый элементный состав. Полиморфизм является часто встречающимся явлением, подверженным влиянию некоторых условий кристаллизации, таких как температура, степень перенасыщения, наличие примесей, полярность растворителя, скорость охлаждения. Различные полиморфы обычно имеют разные картины рентгеновской дифракции, спектры твердотельного ЯМР, инфракрасные или Рамановские спектры, температуры плавления, плотность, твердость, кристаллическую форму, оптические и электрические свойства, стабильность и растворимость. Используемый при перекристаллизации растворитель, скорость кристаллизации, температура хранения и другие факторы могут вызывать преобладающее образование одного кристалла. "Сольваты", как правило, представляют собой кристаллическую форму, которая содержит либо стехиометрические, либо нестехиометрические количества растворителя. Часто в течение процесса кристаллизации некоторые соединения имеют тенденцию захватывать молекулы растворителя при фиксированном молярном отношении в кристаллическом твердом состоянии, образуя, таким образом, сольват. Если растворителем является вода,могут образовываться "гидраты". Соединение формулы (1) и его фармацевтически приемлемые соли могут существовать в виде гидратов или сольватов, и такие гидраты и сольваты также включены в настоящее изобретение. Примеры таких соединений включают гидрат 1/10, 1/4 гидрат, 1/2 гидрат, моногидрат,дигидрохлорид 1/2 гидрат, дигидрохлорид дигидрат, дигидрохлорид 3/2 гидрат и подобные. "Аморфные" формы представляют собой некристаллические материалы без дальнего порядка и обычно не дают характерной картины рентгеновской дифракции порошка. Кристаллические формы описаны в общих чертах исследователями Byrn (1995) и Martin (1995). Для большей краткости описания, некоторые из данных здесь количественных выражений не имеют уточнения "примерно". Используется ли выражение "примерно" явно или не используется, понятно,что каждое указанное здесь количество, как подразумевается, относится к данному фактическому значению, и также подразумевается, что оно касается приближения к такому данному значению, которое разумно выводится на основании обычных знаний в данной области, включая приближения, обусловленные условиями эксперимента и/или измерения для данного значения. Выражения "селективный" и "селективность" касаются соединений, которые демонстрируют реакционную способность относительно конкретного рецептора (например, рецептора 5-НТ 6), не демонстри-5 021543 руя значительной конкурирующей реакционной способности по отношению к другому рецептору (например, к другим подтипам рецептора 5-НТ). Таким образом, например, селективные соединения по настоящему изобретению могут демонстрировать реакционную способность относительно 5-НТ 6 рецепторов, не демонстрируя значительной конкурирующей реакционной способности по отношению к другим рецепторам 5-НТ. В одном варианте соединение по настоящему изобретению имеет по меньшей мере примерно 10-кратную селективность в отношении рецептора 5-НТ 6, по меньшей мере примерно 50 кратную селективность в отношении рецептора 5-НТ 6, по меньшей мере примерно 100-кратную селективность в отношении рецептора 5-НТ 6, по меньшей мере примерно 250-кратную селективность в отношении рецептора 5-НТ 6 или по меньшей мере примерно 500-кратную селективность относительно заданной цели. На всем протяжении описания и формулы изобретения данной спецификации не предполагается,что слово "включать" и его вариации, например, "включающий" и "включает", исключает другие добавки, компоненты, целые числа или стадии. Притом что соединения формулы (1) можно вводить в виде сырого химического вещества, предпочтительно представлять их в виде "фармацевтической композиции". Согласно еще одному аспекту настоящее изобретение касается фармацевтической композиции, содержащей соединение формулы (1) или его фармацевтически приемлемую соль или сольват вместе с одним или более фармацевтически приемлемых носителей и необязательно одним или более других терапевтических ингредиентов. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами состава и не вредным для реципиента. Используемый здесь термин "композиция" включает продукт, содержащий указанные ингредиенты в предварительно определенных количествах или пропорциях, а также любой продукт, который прямо или опосредованно получается из комбинирования указанных ингредиентов в указанных количествах. Что касается фармацевтических композиций, этот термин включает продукт, содержащий один или более активных ингредиентов и необязательный носитель, включающий инертные ингредиенты, а также любой продукт, который прямо или опосредованно получается в результате комбинирования, комплексообразования или агрегации любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. Вообще, фармацевтические композиции получают посредством однородного и тщательного объединения активного ингредиента с жидким носителем, или тонко измельченным твердым носителем, или тем и другим и, если необходимо, последующего формования продукта в виде требуемого препарата. Фармацевтическая композиция включает количество рассматриваемого активного соединения, достаточное для оказания требуемого эффекта на прогрессирование или состояние заболевания. Таким образом, фармацевтические композиции по настоящему изобретению включают любую композицию, полученную смешиванием соединения по настоящему изобретению и фармацевтически приемлемого носителя. Выражение "фармацевтически приемлемый" подразумевает, что носитель, разбавитель или наполнитель должен быть совместим с другими ингредиентами состава и не быть вредным для реципиента. В контексте этого изобретения выражение "комбинированный препарат" включает обе подходящие комбинации, подразумевая соединение формулы (1) и один или более других лекарственных средств,физически объединенных в один препарат, например, таблетку или жидкость для инъекций, а также"комплект", содержащий соединение формулы (1) и один или более других лекарственных средств в виде отдельных дозированных форм вместе с инструкциями по применению, необязательно с дополнительными средствами для содействия введению составляющих соединений, например, этикетками или рисунками. При подходящих комбинациях фармакотерапия по определению является одновременной. Содержимое "комплекта" можно вводить одновременно или с различными временными интервалами. Терапия, будучи сопутствующей или последовательной, зависит от характеристик других используемых лекарственных средств, таких характеристик как начало и продолжительность действия, содержание в плазме, клиренс и др., а также от заболевания, его стадии и характеристик индивидуального пациента. Аффинность соединений по изобретению к рецепторам 5-НТ 6 определяют, как описано выше. Из связывающей аффинности, измеряемой для данного соединения формулы (1), можно определить теоретическую наименьшую эффективную дозу. При концентрации соединения, равной двойному измеряемому Ki-значению, почти 100% рецепторов 5-НТ 6, вероятно, будут заняты соединением. Перевод этой концентрации в мг соединения на кг массы пациента дает теоретическую наименьшую эффективную дозу,при условии идеальной биодоступности. Фармакокинетика, фармакодинамика и другие соображения могут менять фактически вводимую дозу в сторону большего и меньшего значения. Типичная дневная доза активных ингредиентов меняется внутри диапазона и зависит от различных факторов, таких как подходящее показание, способ введения, возраст, масса и пол пациента, и может быть определена лечащим врачом. Вообще, введение пациенту общей разовой дневной дозы или отдельными дозами можно осуществлять в количестве, например, от 0,001 до 10 мг/кг массы тела в день и чаще от 0,01 до 1,000 мг в день всех активных ингредиентов. Такие дозы вводят нуждающемуся в лечении пациенту от одного до трех раз в день или так часто, как требуется для эффективности, и в течение по меньшей мере двухме-6 021543 сячного периода, чаще в течение по меньшей мере шести месяцев или постоянно. Используемое здесь выражение "терапевтически эффективное количество" относится к количеству терапевтического агента, необходимому для лечения состояния, поддающегося лечению посредством введения композиции по изобретению. Это количество равно количеству, достаточному для проявления детектируемой терапевтической или облегчающей реакции в тканевой системе животного или человека. Эффект может включать, например, лечение перечисленных здесь состояний. Точное эффективное количество для субъекта зависит от размера и здоровья субъекта, природы и распространения состояния, подвергаемого лечению, рекомендаций лечащего врача (исследователя, ветеринара, практикующего терапевта или другого клинициста) и терапии или комбинаций терапий, выбранных для применения. Таким образом, бесполезно определять заранее точное эффективное количество. Выражение "фармацевтически приемлемая соль" относится к тем солям, которые в рамках области оглашенного медицинского заключения пригодны для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражения, аллергической реакции и подобного и соизмеримы с разумным соотношением польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Их можно получить на месте при конечном выделении и очистке соединения по изобретению или отдельно посредством взаимодействия соединений с фармацевтически приемлемыми нетоксическими основаниями или кислотами, включая неорганические или органические основания и неорганические или органические кислоты (Berge, 1977). Форму "свободного основания" можно регенерировать посредством контакта соли с основанием или кислотой и выделения исходного соединения обычным образом. Исходная форма соединения отличается от различных форм солей некоторыми физическими свойствами, такими как растворимость в полярных растворителях, но в другом отношении соли эквивалентны исходной форме соединения для целей настоящего изобретения. Термин "комплекс" относится к комплексу соединения по изобретению, например, соединения формулы (1), координированного с ионом металла, в котором по меньшей мере один атом металла хелатирован или секвестирован. Комплексы получают способами, хорошо известными в данной области(Dwyer, 1964). Используемый здесь термин "лечение" относится к любому лечению состояния или заболевания млекопитающего, например, человека и включает: (1) ингибирование заболевания или состояния, т.е. остановку его развития, (2) облегчение заболевания или состояния, т.е. вызов состояния регресса, или (3) прекращение симптомов заболевания. Выражение "ингибировать" включает свое общепринятое значение, которое включает препятствование, предупреждение, сдерживание, облегчение, улучшение и замедление, прекращение или обращение прогрессирования, тяжести или результирующего симптома. Как таковой, настоящий способ включает оба лечебных введения, терапевтическое и/или профилактическое, какое целесообразно. Используемое здесь выражение "лекарственная терапия", как предполагается, включает профилактические, диагностические и терапевтические режимы, осуществляемые in vivo или ex vivo на людях или других млекопитающих. Термин "млекопитающие" включает экономически важных животных, таких как коровы, овцы и свиньи, в особенности, те, которые дают мясо, а также домашних животных, спортивных животных, животных зоопарков, и людей, причем последние предпочтительны. Используемый здесь термин "субъект" относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который является объектом лечения, наблюдения или эксперимента. Используемое здесь выражение "расстройства, связанные с массой тела" относится к расстройствам, вызванным дисбалансом между потреблением энергии и расходом энергии, результатом которого является аномальная (например, избыточная) масса тела. Такие расстройства, связанные с массой тела,включают ожирение (Roth, 1994; Sibley, 1993; Sleigh, 1995, 1997). "Ожирение" относится к состоянию,при котором человек имеет индекс массы тела (BMI), рассчитанный как масса, поделенная на квадрат роста (кг/м 2), по меньшей мере 25,9. Обычно люди с нормальной массой имеют BMI от 19,9 до 25,9. Ожирение может быть обусловлено любой причиной, генетическим или внешним воздействием. Примеры расстройств, которые могут вызывать ожирение, или являться причиной ожирения, включают переедание и булимию, поликистозное заболевание яичника, краниофарингиому, синдром Прадера-Вилли,синдром Фролиха, диабет типа II, дефицит гормона роста (GH), малый рост обычного типа, синдром Тернера и другие патологические состояния, демонстрирующие пониженную метаболическую активность или снижение затрат энергии в покое, как процент общей массы тела без жира, например у детей с острой лимфобластной лейкемией. Пример 1. Аналитические методы. Спектры ядерного магнитного резонанса (1 Н ЯМР) определяют в указанном растворителе, используя прибор Bruker ARX 400 (1 Н: 400 МГц) или Varian VXR 200 1 Н: 200 МГц) при 300 К, если не указано по-другому. Спектры определяют в дейтерированном хлороформе или ДМСО, получаемых от CambridgeIsotope Laboratories Ltd. Химические сдвигиданы в м.д. в сторону низкого поля от тетраметилсилана(1 Н). Константы взаимодействия J даны в Гц. Форма пика в ЯМР спектрах указана символами "кв" (квартет), "дкв" (дублет квартетов), "т" (триплет), "дт" (дублет триплетов), "д" (дублет), "дд (дублет дублетов),"ддд" (дублет дублета дублетов), "с" (синглет), "шс" (широкий синглет) и "м" (мультиплет). Сигналы NH и ОН идентифицируют после смешивания образца с каплей D2O. Флэш-хроматография представляет собой очистку с использованием указанного элюента и силикагеля (силикагель 60 Merck: 0,040-0,063 мм). Температуру плавления регистрируют на приборе для определения температур плавления Buchi В-545. Все взаимодействия, включающие соединения, чувствительные к влаге и/или кислороду, проводят в безводной атмосфере азота. Взаимодействия контролируют,применяя тонкослойную хроматографию (ТСХ) на стеклянных пластинах, покрытых диоксидом кремния(Merck, предварительное покрытие из силикагеля 60 F254), с указанным элюентом. Пятна проявляют при воздействии УФ-света (254 нм) или I2. Жидкостная хроматография - масс-спектрометрия (ЖХ-МС): система ЖХ-МС состоит из 2 микронасосов Perkin Elmer серии 200. Насосы связаны друг с другом через 50-мкл Т-миксер, соединенный с автоматическим пробоотборником Gilson 215. Метод заключается в следующем. А=100% воды с 0,025% НСООН и 10 ммоль NH4HCOO pH 3 В=100% ACN с 0,025% НСООН Автоматический пробоотборник имеет 2-мкл инжекторную петлю и соединен с колонкой Waters Atlantis C18 304,6 мм с 3-мкм частицами. Колонку термостатируют в колоночной печи Perkin Elmer серии 200 при 40 С. Колонка соединена с УФ-фотометром Perkin Elmer серии 200 с 2,7-мкл проточной кюветой. Длину волны устанавливают 254 нм. УФ-фотометр соединен с масс-спектрометром Sciex API 150EX. Масс-спектрометр имеет следующие параметры: диапазон сканирования: 150-900 а.е.м.; полярность: положительная; режим сканирования: профиль; разрешение Q1: UNIT; шаг: 0,10 а.е.м.; время сканирования кадра: 0,500 с; NEB: 10; CUR: 10 IS: 5200; ТЕМ: 325; DF: 30; FP: 225 и ЕР: 10. Детектор светорассеяния соединен с Sciex API 150. Детектор светорассеяния представляет собой Sedere Sedex 55, работающий при 50 С и 3 бар N2. Вся система контролируется компьютером PowerMac G3. Пример 2. Общие аспекты синтеза. Подходящие способы синтеза заявленных соединений и промежуточных соединений, содержащих пиразолиновые фрагменты, осуществляют способами, аналогичными способам, раскрытым ранее в WO 01/70700, использующим 4,5-дигидро-1 Н-пиразольные или 4,5-дигидро-3 Н-пиразольные строительные блоки, которые либо доступны коммерчески, либо их получают, как описано ниже. Способ 1. В способе 1 используются сульфонилкарбаматы общей формулы (I), которые можно получить, например, взаимодействием сульфонамидов с метилхлороформиатом или ди-трет-бутилдикарбонатом в присутствии основания. Продукты их взаимодействия с пиразолинами общей формулы (II) можно впоследствии преобразовать в хлориминовые промежуточные соединения общей формулы (III), используя галогенирующие агенты, такие как PCl3, POCl3/ДМАП или 2-хлор-1,3-диметилимидазолинийхлорид(ДМХ), с последующим взаимодействием с аминами, получая сульфонилпиразолиновые производные карбоксамидина общей формулы (IV). Способ 2. В способе 2 используют N-(бис-алкилсульфанилметилен)сульфонамидные структуры общей формулы (V), которые можно получить из сульфонамидов взаимодействием с CS2 в присутствии KOH с последующим взаимодействием с алкилгалогенидом, например метилйодидом. Две S-алкильные функциональности можно потом заменить на амины, предпочтительно исходя из пиразолиновых строительных блоков с получением структур общей формулы (VI) и получая сульфонилпиразолиновые производные карбоксамидина общей формулы (IV). Способ 3. В способе 3 используются алкилизотиокарбамидные фрагменты или подходящие формы их солей общей формулы (IX), легко получаемые взаимодействием тиокарбамидных строительных блоков с алкилгалогенидами, например, метилйодидом, которые могут взаимодействовать с пиразолинами в присутствии основания с получением пиразолиновых производных карбоксамидина общей формулы (X). Последние могут реагировать с сульфонилгалогенидами (X=Br, Cl, F, предпочтительно Cl) в присутствии основания с получением сульфонилпиразолиновых производных карбоксамидина общей формулы (IV). Выбор конкретных синтетических методик зависит от факторов, известных специалистам в данной области, таких как совместимость функциональных групп с используемыми реагентами, возможность использования защитных групп, катализаторов, активирующих и связывающих реагентов и основные структурные особенности, имеющиеся в конечном получаемом соединении. Фармацевтически приемлемые соли можно получить, применяя стандартные методики, хорошо известные в данной области, например перемешивание соединений по настоящему изобретению с подходящей кислотой, например, неорганической кислотой или органической кислотой. Пример 3. Синтез пиразолиновых промежуточных соединений. 3-Этил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (24,55 мл) растворяют в МеОН (50 мл) и охлаждают на бане со льдом. К этому раствору добавляют этилвинилкетон (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Баню со льдом убирают и смесь перемешивают в течение 2 ч при комнатной температуре, после чего МеОН выпаривают при пониженном давлении. Продукт получают вакуумной перегонкой (70 С, 20 мбар) с выходом 7,22 г бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,15 (т, J=8 Гц, 3 Н), 2,34 (кв, J=8 Гц, 2 Н), 2,59 (т, J=10 Гц, 2 Н), 3,10 3-Метил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (29,2 мл) растворяют в МеОН (50 мл). К этому раствору добавляют метилвинилкетон (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 50 С. Смесь перемешивают в течение 2 ч при 50 С, после чего выпаривают МеОН при пониженном давлении. Продукт получают вакуумной перегонкой (68-82 С, 20 мбар) с выходом 11,8 г бесцветной жидкости. 1 Н ЯМР (400 МГц, ДМСО-d6):1,88 (с, 3 Н), 2,47 (т, J=10 Гц, 2 Н), 3,15 (т, J=10 Гц, 2 Н), 6,10 4-Этил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (58 мл) растворяют в МеОН (300 мл) и охлаждают на бане со льдом. К этой смеси добавляют раствор 2-этилакролеина (100 г) в МеОН (100 мл) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Баню со льдом убирают и перемешивают смесь в течение ночи при комнатной температуре, после чего выпаривают МеОН при пониженном давлении. Продукт получают вакуумной 4-Метил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (16,65 мл) растворяют в CH3CN (50 мл) и охлаждают на бане со льдом. К этой смеси добавляют раствор 2-метилакролеина (24,02 г) в CH3CN (50 мл). Баню со льдом убирают и смесь перемешивают в течение ночи при комнатной температуре, после чего выпаривают CH3CN при пониженном давлении. Продукт получают вакуумной перегонкой (102-108 С, 250 мбар) с выходом 7,0 г в бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,18 (д, J=7 Гц, 3 Н), 2,90 (т, J=9 Гц, 1 Н), 3,00-3,12 (м, 1 Н), 3,51 (т, J=9 Гц, 1 Н), 5,48 (ушир.с, 1 Н), 6,73 (ушир.с, 1 Н). 5-Этил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (12,1 мл) растворяют в МеОН (50 мл) и охлаждают на бане со льдом. К этой смеси добавляют раствор 2-пентенала (24,4 мл) в МеОН (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Баню со льдом убирают и перемешивают смесь в течение 2,5 ч при комнатной температуре с последующим выпариванием при пониженном давлении. Продукт получают вакуумной перегонкой (68-72 С, 25 мбар) с выходом 8,25 г бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):0,92 (т, J=7,5 Гц, 3 Н), 1,42-1,61 (м, 2 Н), 2,36 (ддд, J=17, 8 и 2 Гц, 1 Н),2,76 (ддд, J=17, 10 и 2 Гц, 1 Н), 3,51-3,62 (м, 1 Н), 5,35 (ушир.с, 1 Н), 6,76 (ушир.с, 1 Н). 4,4-Диметил-4,5-дигидро-3 Н-пиразол. 2,2-Диметил-1,3-пропандиамин (20,0 г) растворяют в Н 2 О (80 мл) и МеОН (20 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (30%, 120 мл) и NaClO (10%, 350 мл). Реакционную смесь перемешивают в течение ночи при комнатной температуре, экстрагируют ДХМ, органический слой сушат над Na2SO4 и растворитель выпаривают при пониженном давлении. Вакуумная перегонка(102-105 С, 250 мбар) дает 11,4 г бесцветного аморфного маслянистого соединения. 1 Н ЯМР (200 МГц, CDCl3):1,05 (с, 6 Н), 4,13 (с, 4 Н). По-другому, это соединение синтезируют следующим образом: 4,4-Диметил-4,5-дигидро-3 Н-пиразол. 2,2-Диметил-1,3-пропандиамин (8,97 г) растворяют в Н 2 О (45 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (30%, 54 мл) и NaClO (10%, 157 мл), поддерживая температуру ниже 25 С. Затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и экстрагируют ДХМ (245 мл). Объединенные органические слои экстрагируют водным сульфитом натрия(20%, 25 мл), промывают водой (225 мл), сушат над Na2SO4 и выпаривают при пониженном давлении(200 мбар при 50 С), получая 8,89 г бесцветной жидкости (содержащей некоторое количество остаточного ДХМ). 1 Н ЯМР (200 МГц, CDCl3):1,05 (с, 6 Н), 4,13 (с, 4 Н). 2,2-Диэтилмалононитрил. Малононитрил (15,2 г) смешивают с ТБАБ (3,0 г, 4 мол.%) и этилйодидом (36,8 мл, 2 экв.). После перемешивания в течение 30 мин при комнатной температуре смесь охлаждают на бане со льдом, добавляют частями KOtBu (51,6 г, 2 экв.), баню со льдом убирают и смесь перемешивают в течение 30 мин при комнатной температуре. Экстракция ДХМ/Н 2 О, сушка над Na2SO4 и выпаривание при пониженном давлении дают 40 г сырого материала, который очищают методом флэш-хроматографии, элюируя ДХМ. Это дает 20,4 г оранжевого масла, которое отверждается при стоянии. 1 Н ЯМР (400 МГц, CDCl3):1,29 (т, J=7,5 Гц, 6 Н), 2,00 (кв, J=7,5 Гц, 4 Н). 2,2-Диэтилпропан-1,3-диамин. Суспензию LiAlH4 (4,66 г) в сухом Et2O (100 мл) охлаждают на бане со льдом и добавляют по капле раствор 2,2-диэтилмалононитрила (5,0 г) в Et2O (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 20 С. Смесь перемешивают в течение ночи при комнатной температуре, охлаждают на бане со льдом и гасят, добавляя Н 2 О (5 мл), 2 М водный NaOH (10 мл) и снова Н 2 О (5 мл). Суспензию фильтруют, осадок на фильтре промывают Et2O и объединенные фильтраты выпаривают досуха при пониженном давлении, получая 5,0 г прозрачной светло-желтой жидкости. 1 Н ЯМР (400 МГц, CDCl3):0,80 (т, J=8 Гц, 6 Н), 1,08 (ушир.с, 4 Н), 1,22 (кв, J=8 Гц, 4 Н), 2,52 (с,4 Н). 4,4-Диэтил-4,5-дигидро-3 Н-пиразол. 2,2-Диэтилпропан-1,3-диамин (5,0 г) помещают в смесь Н 2 О (40 мл) и МеОН (10 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (24,2 мл 30% раствора, 6 экв.) и NaClO (54,9 мл 10% раствора, 2,4 экв.), баню со льдом убирают и смесь перемешивают 2 ч при комнатной температуре. Экстракция ДХМ, сушка над Na2SO4 и выпаривание при пониженном давлении дают 3,51 г прозрачной желтой жидкости, содержащей 77% ожидаемого продукта и 23% диаминового исходного вещества. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):0,78 (т, J=7,5 Гц, 6 Н), 1,36 (кв, J=7,5 Гц, 4 Н), 4,14 (с, 4 Н). Циклопентан-1,1-дикарбонитрил. Малононитрил (15,0 г) растворяют в сухом ДМФА (200 мл) и охлаждают на бане со льдом. Затем добавляют по капле ДБУ (75 мл, 2,2. экв.) и 1,4-дибромбутан (29,6 мл, 1,1 экв.). Баню со льдом убирают,добавляют еще 100 мл сухого ДМФА и смесь перемешивают при 80 С в течение 2 ч. После охлаждения до температуры окружающей среды добавляют ДХМ и смесь промывают 5 раз 5% водным NaHCO3. Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении, получая 40 г черного маслянистого вещества. Это вещество очищают методом флэш-хроматографии, элюируя смесью ПЭ:ЭА=9:1(Rf=0,35, проявляют I2), получая 23,4 г бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,94-2,03 (м, 4 Н), 2,41 (т, J=7 Гц, 4 Н). С-(1-Аминометилциклопентил)метиламин. Суспензию LiAlH4 (4,74 г) в сухом Et2O (100 мл) охлаждают на бане со льдом и добавляют по капле раствор циклопентан-1,1-дикарбонитрила (5,0 г) в Et2O (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 20 С. Смесь перемешивают в течение ночи при комнатной температуре, охлаждают на бане со льдом и гасят, добавляя Н 2 О (5 мл), 2 М водный NaOH (10 мл) и снова Н 2 О (5 мл). Суспензию фильтруют, осадок на фильтре промывают Et2O и объединенные фильтраты выпаривают досуха при пониженном давлении, получая 4,95 г прозрачной бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,24 (ушир.с, 4 Н), 1,22-1,40 (м, 4 Н), 1,55-1,64 (м, 4 Н), 2,62 (с, 4 Н). 2,3-Диазаспиро[4,4]нон-2-ен. С-(1-Аминометилциклопентил)метиламин (4,87 г) помещают в смесь Н 2 О (40 мл) и МеОН (10 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (23,9 мл 30% раствора, 6 экв.) иNaClO (54,3 мл 10% раствора, 2,4 экв.), баню со льдом убирают и смесь перемешивают 2 ч при комнатной температуре. Экстракция ДХМ, сушка над Na2SO4 и выпаривание при пониженном давлении дают 3,74 г прозрачной светло-желтой жидкости, содержащей 90% ожидаемого продукта и 10% диаминового исходного вещества. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):1,48-1,57 (м, 4 Н), 1,62-1,69 (м, 4 Н), 4,26 (с, 4 Н). Циклогексан-1,1-дикарбонитрил. Малононитрил (15,0 г) растворяют в сухом ДМФА (200 мл). Затем добавляют ДБУ (75 мл) и 1,5-дибромпентан (34 мл) при 0 С (баня со льдом). Баню со льдом убирают и реакционную смесь перемешивают в течение 2 ч при 80 С. После охлаждения реакционную смесь выливают в ДХМ. Органический слой промывают несколько раз 5% NaHCO3, органический слой сушат над Na2SO4 и выпаривают растворитель при пониженном давлении. Сырой продукт очищают методом флэш-хроматографии, элюируя смесью ПЭ:EtOAc (9:1) и получая 25,7 г белых кристаллов. 1 Н ЯМР (400 МГц, CDCl3):1,48-1,61 (м, 2 Н), 1,68-1,84 (м, 4 Н), 2,13 (т, J=6 Гц, 4 Н). С-(1-Аминометилциклогексил)метиламин. Циклогексан-1,1-дикарбонитрил (20,0 г) помещают в сухой Et2O (70 мл). Данную смесь добавляют по капле к суспензии LiAlH4 (17,0 г) в сухом Et2O (250 мл), охлажденной на бане со льдом. Смесь перемешивают в течение ночи при комнатной температуре, охлаждают на бане со льдом и гасят, добавляя Н 2 О (17,0 мл), 2 М водный NaOH (34,0 мл) и снова Н 2 О (17 мл). Суспензию фильтруют, осадок на фильтре промывают Et2O и объединенные фильтраты выпаривают досуха, получая 20,8 г прозрачной бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,05-1,55 (м, 14 Н), 2,61 (с, 4 Н). 2,3-Диазаспиро[4,5]дец-2-ен. С-(1-Аминометилциклогексил)метиламин (10,0 г) помещают в смесь Н 2 О (40 мл) и МеОН (10 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (44,3 мл 30% раствора, 6 экв.) иNaClO (125,5 мл 10% раствора, 2,4 экв.), баню со льдом убирают и смесь перемешивают в течение 45 мин при комнатной температуре. Экстракция ДХМ, сушка над Na2SO4 и выпаривание при пониженном давлении дают 8,7 г прозрачной, светло-желтой жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,24-1,53 (м, 10 Н), 4,17 (с, 4 Н). Этиловый эфир 2-(2-метил-[1,3]диоксолан-2-ил)масляной кислоты. Метил-2-этилацетоацетат (100 мл) помещают в толуол (250 мл). Добавляют этиленгликоль (46,9 мл,1,35 экв.) и каталитическое количество p-TsOH.H2O и кипятят смесь с обратным холодильником в течение ночи в условиях Дина-Старка. После охлаждения до температуры окружающей среды смесь промывают 5% водным NaHCO3 и насыщенным водным NaCl, органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении. Остаток очищают повторной вакуумной перегонкой (118-128 С, 15 мбар), получая 85,5 г продукта. 1 Н ЯМР (200 МГц, CDCl3):0,90 (т, J=7 Гц, 3 Н), 1,28 (т, J=7 Гц, 3 Н), 1,40 (с, 3 Н), 1,59-1,83 (м, 2 Н),2,56 (дд, J=11,5 и 4 Гц, 1 Н), 3,90-4,06 (м, 4 Н), 4,18 (м, 2 Н). 2-(2-Метил-[1,3] диоксолан-2-ил)бутан-1-ол Этиловый эфир 2-(2-метил-[1,3]диоксолан-2-ил)масляной кислоты (85,5 г) помещают в сухой Et2O(50 мл). Данную смесь добавляют по капле к суспензии LiAlH4 (16,1 г) в сухом Et2O (200 мл), охлаждают на бане со льдом. Смесь кипятят с обратным холодильником в течение 4 ч, охлаждают на бане со льдом и гасят, добавляя Н 2 О (16,1 мл), 2 М водный NaOH (32,2 мл) и снова Н 2 О (16,1 мл). Суспензию фильтруют, осадок на фильтре промывают Et2O и выпаривают объединенные фильтраты досуха. Остаток (49 г) очищают вакуумной перегонкой (112-125 С, 15 мбар), получая 43,5 г прозрачной бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):0,98 (т, J=7,5 Гц, 3 Н), 1,10-1,24 (м, 1 Н), 1,31 (с, 3 Н), 1,50-1,75 (м, 2 Н),3,12, (ушир.с, 1 Н), 3,59-3,76 (м, 2 Н), 3,94-4,02 (м, 4 Н). 3-Гидроксиметилпентан-2-он. 2-(2-Метил-[1,3]диоксолан-2-ил)бутан-1-ол (43,5 г) помещают в смесь Н 2 О (100 мл) и EtOH (10 мл) и добавляют концентрированный водный HCl (1 мл). Смесь кипятят с обратным холодильником в течение 2 ч, охлаждают до температуры окружающей среды, нейтрализуют 2 М водным NaOH, насыщают сульфатом аммония и дважды экстрагируют Et2O. Объединенные органические слои сушат над Na2SO4 и выпаривают досуха. Желтоватый остаток (25,7 г) очищают вакуумной перегонкой, получая 20,7 г прозрачного бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):0,95 (т, J=7,5 Гц, 3 Н), 1,49-1,76 (м, 2 Н), 2,21 (с, 3 Н), 2,64 (м, 1 Н), 3,683,84 (м, 3 Н). 2-Этил-3-оксобутиловый эфир уксусной кислоты. 3-Гидроксиметилпентан-2-он (20,7 г) растворяют в CHCl3 (150 мл) и охлаждают на бане со льдом. Добавляют уксусный ангидрид (80 мл), а затем ДМАП (2,18 г) и перемешивают смесь в течение ночи при комнатной температуре. После охлаждения на бане со льдом добавляют по капле МеОН (120 мл) и смесь выливают в насыщенный водный раствор NaHCO3. После двух экстракций ДХМ объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении, получая 28,0 г светло-желтой(квинтет, J=6,5 Гц, 1 Н), 4,20 (д, J=7 Гц, 3 Н). 4-Этил-3-метил-4,5-дигидро-1 Н-пиразол. 2-Этил-3-оксобутиловый эфир уксусной кислоты (23,0 г) помещают в сухой ТГФ (75 мл) и добавляют ДБУ (23,9 мл). Смесь перемешивают при комнатной температуре в течение 15 мин, получая промежуточный 3-метиленпентан-2-он. Добавляют МеОН (75 мл), а затем добавляют по капле гидразингидрат (7,75 мл). Результирующую смесь перемешивают в течение ночи при комнатной температуре и выпаривают при пониженном давлении. Остаток очищают вакуумной перегонкой (94-106 С, 15 мбар), получая 7,9 г прозрачной бесцветной жидкости. 1 Н ЯМР (400 МГц, CDCl3):0,95 (т, J=7,5 Гц, 3 Н), 1,33-1,83 (м, 2 Н), 1,92 (с, 3 Н), 2,78 (м, 1 Н), 3,01 2-Диметиламинометилциклогексанон. К циклогексанону (259 мл) добавляют формальдегид (37,2 мл 37% водного раствора) и диметиламингидрохлорид (40,8 г). Перемешиваемую смесь медленно нагревают и кипятят с обратным холодильником в течение 1 ч. После охлаждения до температуры окружающей среды добавляют Н 2 О и смесь дважды экстрагируют Et2O. Водный слой делают щелочным, добавляя 50% водный NaOH (27,5 мл), и затем дважды экстрагируют ДХМ. Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении, получая 66,6 г светло-желтой жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,34-1,47 (м, 1 Н), 1,60-1,78 (м, 2 Н), 1,81-1,92 (м, 1 Н), 1,98-2,09 (м, 1 Н),2,16-2,55 (м, 5 Н), 2,21 (с, 6 Н), 2,69 (дд, J=13 и 6 Гц, 1 Н). 3,3 а,4,5,6,7-Гексагидро-2 Н-индазол. Гидразингидрат (28,0 мл) растворяют в n-BuOH (200 мл) и охлаждают на бане со льдом. Добавляют по капле раствор 2-диметиламинометилциклогексанона (64,0 г) в n-BuOH (50 мл), смесь медленно нагревают и кипятят с обратным холодильником в течение 20 ч. Подогретый растворитель выпаривают при пониженном давлении. Остаток очищают вакуумной перегонкой (64-67 С, 28 Па), получая 24,2 г прозрачной бесцветной жидкости. Данный материал используют на следующих стадиях без дополнительной очистки. 4-Этил-5-метил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (12,4 мл) растворяют в МеОН (100 мл) и охлаждают на бане со льдом. К данной смеси добавляют раствор 2-этилбут-2-енала (25 г) в МеОН (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Баню со льдом убирают и перемешивают смесь при комнатной температуре в течение 2 дней. Растворитель выпаривают при пониженном давлении. Вакуумная перегонка (90-100 С, 20 мбар) дает 16,9 г светло-желтой жидкости, содержащей требуемый продукт в виде диастереомерной смеси и гидразон с соотношением примерно 1:2. Этот материал используют на следующих стадиях без дополнительной очистки. 5-Этил-4-метил-4,5-дигидро-1 Н-пиразол. В атмосфере N2 растворяют гидразингидрат (63,9 мл, 10 экв.) в МеОН (100 мл) и охлаждают на бане со льдом. К этой смеси добавляют раствор 2-метилпент-2-енала (15,0 мл) в МеОН (50 мл) с такой скоростью, чтобы поддерживать температуру ниже 10 С. Баню со льдом убирают и смесь перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении. Вакуумная перегонка (40-45 С, 15 мбар) дает 9,5 г светло-желтой жидкости, содержащей требуемый продукт в виде диастереомерной смеси и гидразон при соотношении примерно 1:1. Этот материал используют на следующих стадиях без дополнительной очистки. 4-Гидрокси-3,3-диметилбутан-2-он. К 25 мл 3-метилбутан-2-она добавляют 7,01 г параформальдегида и 36,0 мл трифторуксусной кислоты. Смесь кипятят с обратным холодильником в течение 7 ч. После охлаждения добавляют 300 мл Н 2 О и 100 г (5 экв.) NaHCO3. Суспензию фильтруют и органический слой отделяют. Осадок на фильтре промывают два раза ДХМ, объединенные фильтраты сушат над Na2SO4 и растворитель выпаривают при пониженном давлении, получая 23,7 г оранжевой жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,17 (с, 6 Н), 2,17 (с, 3 Н), 2,38 (т, J=7 Гц, 1 Н), 3,65 (д, J=7 Гц, 2 Н). 2,2-Диметил-3-оксобутиловый эфир метансульфоновой кислоты 23,7 г 4-гидрокси-3,3-диметилбутан-2-она растворяют в 150 мл ДХМ. Добавляют 49,5 мл (3 экв.) пиридина и 17,5 мл (1,1 экв.) мезилхлорида и смесь перемешивают при комнатной температуре в течение 20 ч. Суспензию фильтруют и осадок на фильтре промывают два раза ДХМ. Фильтрат промывают 1 МHCl и водный слой экстрагируют два раза ДХМ. Объединенные фильтраты сушат над Na2SO4 и выпаривают растворитель при пониженном давлении, получая 41,2 г коричневой жидкости. 1 Н ЯМР (400 МГц, CDCl3):1,24 (с, 6 Н), 2,20 (с, 3 Н), 3,03 (с, 3 Н), 4,21 (с, 2 Н). 3,4,4-Триметил-4,5-дигидро-1 Н-пиразол. 39,2 г 2,2-диметил-3-оксобутилового эфира метансульфоновой кислоты растворяют в 200 мл МеОН и охлаждают на бане со льдом. Добавляют по капле 21,6 мл (2,2 экв.) гидразингидрата и реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют, добавляют 5% NaHCO3 и экстрагируют 3 раза ДХМ. Объединенные органические слои сушат над Na2SO4 и растворитель выпаривают при пониженном давлении, получая 19,5 г оранжевой жидкости. Вакуумная перегонка 10 г данной жидкости дает 6,4 г светло-желтой жидкости (76-78 С, 20 мбар). 1 Н ЯМР (400 МГц, CDCl3):1,14 (с, 6 Н), 1,86 (с, 3 Н), 3,14 (с, 2 Н), 4,00 (ушир.с, 1 Н). 3-Диметиламино-1-фенилпропан-1-он гидрохлорид. К раствору 0,5 мл концентрированного водного HCl в 40 мл EtOH добавляют ацетофенон (30,0 г),параформальдегид (10,0 г) и диметиламингидрохлорид (26,5 г) и кипятят смесь с обратным холодильником в течение 3 ч. Смесь охлаждают до комнатной температуры и осадок фильтруют, промывают ацетоном и сушат в вакууме, получая 37,2 г белого кристаллического вещества. 1 Н ЯМР (200 МГц, ДМСО-d6):2,84 (с, бН), 3,38-3,55 (м, 2 Н), 3,57-3,74 (м, 2 Н), 7,48-7,73 (м, 3 Н),7,97-8,10 (м, 2 Н). 3-Фенил-4,5-дигидро-1 Н-пиразол. В атмосфере N2 3-диметиламино-1-фенилпропан-1-он гидрохлорид (37,2 г) растворяют в теплом МеОН (75 мл) и медленно добавляют к раствору гидразингидрата (23 мл) и 50% водного NaOH (12 мл) в МеОН (30 мл), перемешиваемому при 50 С. Смесь кипятят с обратным холодильником в течение 2 ч и выпаривают при пониженном давлении. Добавляют к остатку ледяную воду и после перемешивания в течение 5 мин отфильтровывают образовавшееся твердое вещество. Остаток помещают в Et2O, сушат над Na2SO4 и выпаривают досуха при пониженном давлении, получая 19,7 г желтого масла со степенью чистоты 80%, которое используют на следующих стадиях без дополнительной очистки. 1-(4-Хлорфенил)-3-диметиламинопропан-1-он гидрохлорид. К EtOH (80 мл) добавляют парахлорацетофенон (77,3 г, 0,50 моль), диметиламингидрохлорид (52,7 г, 0,65 моль), параформальдегид (19,8 г, 0,66 моль) и концентрированный водный HCl (1 мл) и кипятят смесь с обратным холодильником в течение 5 ч. Смесь охлаждают до 40 С, добавляют ацетон (400 мл) и далее охлаждают смесь при перемешивании до 20 С. Осадок фильтруют, промывают ацетоном и ПЭ и сушат на воздухе, получая 69,5 г продукта, который используют без дополнительной очистки на сле- 16021543(12 мл) в МеОН (30 мл), перемешивают при 50 С. Смесь кипятят с обратным холодильником в течение 2 ч и выпаривают при пониженном давлении. К остатку добавляют воду с последующей экстракцией ДХМ. Органическую фазу дважды промывают водой, сушат и выпаривают при пониженном давлении,получая 25,0 г желтого твердого вещества, т.пл. 90-100 С. 4-Фенил-4,5-дигидро-1 Н-пиразол. В атмосфере N2 диметиламингидрохлорид (7,27 г) и формалин (37%) (6,63 мл) добавляют к фенилацетальдегиду (10 мл) и перемешивают в течение ночи при комнатной температуре. Реакционную смесь экстрагируют один раз диэтиловым эфиром, органический слой сушат над MgSO4 и помещают раствор,содержащий промежуточный 2-фенилпропенал, в МеОН. Добавляют гидразингидрат (7,87 мл) и реакционную смесь перемешивают в течение 2 ч при 50 С (Et2O выпаривают). Смесь концентрируют при пониженном давлении. Остаток растворяют в ДХМ и сушат над MgSO4 с последующим выпариванием при пониженном давлении, получая 3,12 г желтого масла, которое используют на следующей стадии без дополнительной очистки. 3-Фенил-бут-3-ен-2-он. 1-Фенилпропан-2-он (40,8 г) растворяют в 200 мл МеОН. Добавляют формалин (37%) (79 мл), пиперидин (4 мл) и НОАс (4 мл) и реакционную смесь перемешивают в течение 3 ч при 60 С. Реакционную смесь выпаривают досуха при пониженном давлении. Остаток помещают в диэтиловый эфир и экстрагируют водой. Органический слой промывают 1 М HCl, сушат над MgSO4 и выпаривают при пониженном давлении, получая 36,3 г желтой жидкости. 1 Н ЯМР (400 МГц, CDCl3):2,41 (с, 3 Н), 5,87 (с, 1 Н), 6,18 (с, 1 Н), 7,24-7,40 (м, 5 Н). 3-Метил-4-фенил-4,5-дигидро-1 Н-пиразол. Гидразингидрат (12,06 мл) добавляют к 3-фенил-бут-3-ен-2-ону (36,3 г) в МеОН (200 мл). Реакционную смесь перемешивают в течение ночи при температуре кипения с обратным холодильником. Растворитель выпаривают при пониженном давлении. Остаток помещают в диэтиловый эфир и промывают водой. Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении. Сырой материал очищают методом колоночной флэш-хроматографии, элюируя смесью ДХМ:МеОН=98:2 и получая 19,7 г оранжевого масла, содержащего 65% требуемого продукта, которое используют на следующих стадиях без дополнительной очистки. 5-Фенил-4,5-дигидро-1 Н-пиразол. В атмосфере N2 добавляют гидразингидрат (9,2 мл) к раствору коричного альдегида (10,0 г) в tBuOH (20 мл). Смесь кипятят с обратным холодильником в течение ночи, а затем концентрируют при пониженном давлении. Добавляют к остатку воду и водную фазу дважды экстрагируют ДХМ. Объединенные органические слои промывают водой, сушат над Na2SO4 и концентрируют при пониженном давлении. Это дает 10,46 г желтого масла, содержащего 85% требуемого продукта, которое используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (200 МГц, CDCl3):2,61-2,80 (м, 1 Н), 3,04-3,23 (м, 1 Н), 4,72 (дд, J=8 и 10 Гц, 1 Н), 5,60-6,10 5-Фуран-2-ил-4,5-дигидро-1 Н-пиразол. В атмосфере N2 добавляют гидразингидрат (4,0 мл) к раствору 3-(2-фурил) акролеина (5,0 г) в tBuOH (25 мл). Смесь кипятят с обратным холодильником в течение 2 дней, с последующим выпариванием при пониженном давлении. Остаток помещают в ДХМ и дважды экстрагируют 5% водным NaHCO3. Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении. Это дает 5,3 г желтого масла, содержащего 45% ожидаемого продукта и 55% промежуточного гидразона, который расходуется,претерпевая замыкание цикла. Дополнительные 24 ч кипячения с обратным холодильником в n-BuOH дают (после обработки) 5,6 г коричневого масла, содержащего 58% ожидаемого продукта и 42% гидразона. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы пиразолина в 1 Н ЯМР (400 МГц, CDCl3):2,87-3,08 (м, 2 Н), 4,72-4,81 (м, 1 Н), 6,87 (ушир.с,1 Н). 3-(3,4-Дигидро-2 Н-пиразол-3-ил)пиридин. В атмосфере N2 добавляют гидразингидрат (3,65 мл, 2 экв.) к раствору 3-(3-пиридил)акролеина (5,0 г) в t-BuOH (25 мл). Смесь кипятят с обратным холодильником в течение 3 дней с последующим выпариванием при пониженном давлении. Остаток помещают в ДХМ и промывают 5% водным NaHCO3. Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении. Это дает 5,0 г красного масла, содержащего 74% ожидаемого продукта и 26% промежуточного гидразона, который расходуется,претерпевая замыкание цикла. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы пиразолина в 1 Н ЯМР (400 МГц, CDCl3):2,63-2,75 (м, 1 Н), 3,133,25 (м, 1 Н), 4,72-4,82 (м, 1 Н), 6,85 (ушир.с, 1 Н). 3-Фуран-3-илпропенал. 6,08 г (трифенилфосфоранилиден)ацетальдегида суспендируют в 10 мл сухого ДМФА. Добавляют 1,67 мл (1 экв.) 3-фуральдегида и смесь перемешивают в течение ночи при 80 С. Смесь помещают в ЭА и 4 раза промывают 5% водным NaHCO3, органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток суспендируют в ПЭ, фильтруют и концентрируют в вакууме, получая 1,47 г светло-коричневого масла, содержащего 68% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы в 1 Н ЯМР (400 МГц, CDCl3):6,45 (дд, J=8 и 16 Гц, 1 Н), 9,63 (д, J=8 Гц, 1 Н). 5-Фуран-3-ил-4,5-дигидро-1 Н-пиразол. 5,84 мл (10 экв.) гидразингидрата добавляют к 20 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 1,47 г 3-фуран-3-илпропенала в 20 мл диэтилового эфира. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют 5% водный NaHCO3 и смесь 3 раза экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток улавливают на SCX-ионообменной колонке, промывают МеОН и элюируют 1 М NH3 в МеОН, получая после выпаривания 950 мг оранжевого масла, содержащего 85% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):2,62-2,72 (м, 1 Н), 2,97-3,07 (м, 1 Н), 4,62-4,71 (м, 1 Н), 5,57-5,74 (ушир.с,1 Н), 6,36 (ушир.с, 1 Н), 6,87 (ушир.с, 1 Н), 7,35-7,41 (м, 2 Н). 3-Пиридин-2-илпропенал. 6,08 г (трифенилфосфоранилиден)ацетальдегида суспендируют в 10 мл сухого ДМФА. Добавляют 1,90 мл (1 экв.) пиридин-2-карбальдегида и смесь перемешивают в течение ночи при комнатной температуре. Смесь помещают в ЭА и 4 раза промывают 5% водным NaHCO3, органическую фазу сушат надNa2SO4, фильтруют и концентрируют в вакууме. Остаток суспендируют в ПЭ, фильтруют и концентрируют в вакууме, получая 1,50 г темно-желтого масла, содержащего 80% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Н ЯМР (400 МГц, CDCl3):7,09 (дд, J=8 и 16 Гц, 1 Н), 7,30-7,36 (м, 1 Н), 7,49-7,59 (м, 2 Н), 7,77 (дт,J=8, 8 и 2 Гц, 1 Н), 8,67-8,74 (м, 1 Н), 9,81 (д, J=8 Гц, 1 Н). 2-(3,4-Дигидро-2 Н-пиразол-3-ил)пиридин. 4,56 мл (10 экв.) гидразингидрата добавляют к 20 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 1,25 г 3-пиридин-2-илпропенала в 20 мл диэтилового эфира. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют 5% водный NaHCO3 и 5 раз экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток улавливают на SCXионообменной колонке, промывают МеОН и элюируют 1 М NH3 в МеОН, получая 1,28 г коричневого масла, содержащего 90% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):2,84-2,94 (м, 1 Н), 3,19-3,29 (м, 1 Н), 4,82-4,90 (м, 1 Н), 6,83 (ушир.с, 1 Н),7,17-7,23 (м, 1 Н), 7,35-7,40 (м, 1 Н), 7,69 (дт, J=7,5, 7,5 и 2 Гц, 1 Н), 8,53-8,58 (м, 1 Н). 3-Пиридин-4-илпропенал. 6,08 г (трифенилфосфоранилиден)ацетальдегида суспендируют в 10 мл сухого ДМФА. Добавляют 1,93 мл (1 экв.) пиридин-4-карбальдегида и смесь перемешивают в течение ночи при комнатной температуре. Смесь помещают в ЭА и 4 раза промывают 5% водным NaHCO3, органическую фазу сушат надNa2SO4, фильтруют и концентрируют в вакууме. Остаток суспендируют в ПЭ, фильтруют и концентрируют в вакууме, получая 1,17 г желтого масла, содержащего 80% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):6,85 (дд, J=8 и 16 Гц, 1 Н), 7,39-7,47 (м, 3 Н), 8,70-8,74 (м, 2 Н), 9,78 (д,J=8 Гц, 1 Н). 4-(3,4-Дигидро-2 Н-пиразол-3-ил)пиридин. 4,27 мл (10 экв.) гидразингидрата добавляют к 20 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 1,17 г 3-пиридин-4-илпропенала в 20 мл диэтилового эфира. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют 5% водный NaHCO3 и 5 раз экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток улавливают на SCXионообменной колонке, промывают МеОН и элюируют 1 М NH3 в МеОН, получая 1,23 г коричневого масла, содержащего 90% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):2,61-2,71 (м, 1 Н), 3,15-3,25 (м, 1 Н), 4,68-4,76 (м, 1 Н), 6,82 (ушир.с, 1 Н),7,25-7,30 (м, 2 Н), 8,55-8,60 (м, 2 Н). 3-Тиофен-3-илпропенал. 10,0 г (трифенилфосфоранилиден)ацетальдегида суспендируют в 10 мл сухого ДМФА. Добавляют 2,88 мл (1 экв.) тиофен-3-карбальдегида и смесь перемешивают в течение ночи при 80 С. Смесь помещают в ЭА и 4 раза промывают 5% водным NaHCO3, органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток суспендируют в ПЭ, фильтруют и концентрируют в вакууме, получая 4,16 г оранжевого масла, содержащего 54% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы в 1 Н ЯМР (400 МГц, CDCl3):6,54 (дд, J=8 и 16 Гц, 1 Н), 9,66 (д, J=8 Гц, 1 Н). 5-Тиофен-3-ил-4,5-дигидро-1 Н-пиразол. 14,6 мл (10 экв.) гидразингидрата добавляют к 50 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 4,16 г 3-тиофен-3-илпропенала в 25 мл диэтилового эфира. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют 5% водный NaHCO3 и 3 раза экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 4,12 г оранжевого масла, содержащего 70% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы пиразолина в 1 Н ЯМР (400 МГц, CDCl3):2,782,88 (м, 1 Н), 3,03-3,13 (м, 1 Н), 4,77-4,86 (м, 1 Н), 6,86 (ушир.с, 1 Н). 3-Тиофен-2-илпропенал. 10,0 г (трифенилфосфоранилиден)ацетальдегида суспендируют в 10 мл сухого ДМФА. Добавляют 3,07 мл (1 экв.) тиофен-2-карбальдегида и смесь перемешивают в течение ночи при 80 С. Смесь помещают в ЭА и 4 раза промывают 5% водным NaHCO3, органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток суспендируют в ПЭ, фильтруют и концентрируют в вакууме, получая 4,27 г оранжевого масла, содержащего 50% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы в 1 Н ЯМР (400 МГц, CDCl3):6,52 (дд, J=8 и 16 Гц, 1 Н), 9,63 (д, J=8 Гц, 1 Н). 5-Тиофен-2-ил-4,5-дигидро-1 Н-пиразол. 15,0 мл (10 экв.) гидразингидрата добавляют к 50 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 4,27 г 3-тиофен-2-илпропенала в 25 мл диэтилового эфира. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют 5% водный NaHCO3 и 3 раза экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 5,58 г оранжевого масла, содержащего 70% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы пиразолина в 1 Н ЯМР (400 МГц, CDCl3):2,772,86 (м, 1 Н), 3,08-3,18 (м, 1 Н), 4,95-5,03 (м, 1 Н), 6,88 (ушир.с, 1 Н). 3-Изопропил-5-фенил-4,5-дигидро-1 Н-пиразол. 0,38 мл 3-метил-2-бутанона растворяют в 10 мл ДХМ. Добавляют 0,36 мл (1 экв.) бензальдегида, а затем добавляют по капле 1,50 мл трифторметансульфонового ангидрида. Смесь перемешивают в течение 1 ч при комнатной температуре. Затем добавляют 10 мл МеОН и 0,87 мл (5 экв.) гидразингидрата. Смесь перемешивают в течение 30 мин при комнатной температуре и концентрируют в вакууме. Остаток помещают в ДХМ, экстрагируют 5% водным NaHCO3 и органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 520 мг коричневого масла, содержащего примерно 50% требуемого продукта, которое используют на следующих стадиях без дополнительной очистки. 4-Метил-5-фенил-4,5-дигидро-1 Н-пиразол. 5,22 мл (1 экв.) гидразингидрата добавляют к 100 мл диэтилового эфира. Эмульсию охлаждают на бане со льдом. Добавляют по капле 15,0 мл 2-метил-3-фенилпропенала и смесь перемешивают в течение ночи при комнатной температуре. Добавляют Н 2 О, органический слой отделяют и экстрагируют водный слой диэтиловым эфиром. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Применение вакуума дает 5,9 г требуемого продукта (смесь диастереомерных пар) в виде прозрачной жидкости (76-82 С, 0,2-0,3 мбар). 1 Н ЯМР (400 МГц, CDCl3) первой диастереомерной пары:0,71 (д, J=7 Гц, 3 Н), 3,20-3,31 (м, 1 Н),4,77 (д, J=10 Гц, 1 Н), 6,73 (ушир.с, 1 Н), 7,23-7,42 (м, 5 Н), 8,55-8,60 (м, 2 Н). 1 Н ЯМР (400 МГц, CDCl3) второй диастереомерной пары:1,24 (д, J=7 Гц), 3 Н), 2,90-3,11 (м, 1 Н),4,22 (д, J=11 Гц, 1 Н), 6,71 (ушир.с, 1 Н), 7,23-7,42 (м, 5 Н), 8,55-8,60 (м, 2 Н). 2-Бензилиденбутиральдегид. 30,0 мл бензальдегида растворяют в 150 мл EtOH и охлаждают на бане со льдом. Добавляют 5,01 мл 45% KOH (0,2 экв.), а затем добавляют по капле 16,5 мл бутиральдегида. Смесь перемешивают в течение 3 дней при комнатной температуре, подкисляют 1 М HCl и экстрагируют эфиром. Органический слой сушат над Na2SO4, фильтруют и концентрируют в вакууме. Применение вакуума дает 20,4 г желтой жидкости (78-82 С, 0,6 мбар), содержащей 70% требуемого продукта. Этот материал используют на следующих стадиях без дополнительной очистки. Характеристические сигналы в 1 Н ЯМР (400 МГц, CDCl3):1,15 (т, J=7,5 Гц, 3 Н), 2,57 (кв, J=7,5 Гц, 1 Н), 7,22 (с, 1 Н), 9,56 (с, 1 Н). 4-Этил-5-фенил-4,5-дигидро-1 Н-пиразол. 62 мл (10 экв.) гидразингидрата добавляют к 150 мл диэтилового эфира. Эмульсию охлаждают на бане лед/NaCl до -10 С. Добавляют по капле раствор 20,4 г 2-бензилиденбутиральдегида в 100 мл эфира при -10 С и перемешивают при -10 С в течение 3 ч. Смесь перемешивают в течение ночи (на бане со льдом) и оставляют медленно нагреваться до комнатной температуры. Добавляют Н 2 О, отделяют органический слой и 2 раза экстрагируют водный слой диэтиловым эфиром. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Применение вакуума дает 6,1 г прозрачной жидкости (102-106 С, 0,6 мбар), содержащей 94% требуемого продукта (смесь диастереомерных пар). Характеристические сигналы первой диастереомерной пары: 1 Н ЯМР (400 МГц, CDCl3):0,83 (т, J=6,5 Гц, 3 Н), 3,03-3,13 (м, 1 Н), 4,74-4,81 (м, 1 Н), 6,83 (ушир.с,1 Н). Характеристические сигналы второй диастереомерной пары: 1 Н ЯМР (400 МГц, CDCl3):1,00 (т, J=7,5 Гц, 3 Н), 2,84-2,93 (м, 1 Н), 4,28-4,34 (м, 1 Н), 6,76 (ушир.с,1 Н).(1-Метил-1,2,5,6-тетрагидропиридин-3-ил)метанол. 15,0 г гидробромида метилового эфира 1-метил-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты помещают в ЭА и экстрагируют 2 М NaOH. Органический слой отделяют, а водный слой снова экстрагируют ЭА. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая 8,27 г свободного основания в виде желтого масла (84%). 6,5 г LiAlH4 (3,2 экв.) суспендируют в 100 мл сухого ТГФ и охлаждают на бане со льдом. К данной смеси добавляют по капле раствор 8,27 г метилового эфира 1-метил-1,2,5,6-тетрагидропиридин-3-карбоновой кислоты (свободное основание) в 50 мл сухого ТГФ. Смесь перемешивают в течение 3 ч при комнатной температуре. Смесь охлаждают на бане со льдом и добавляют по капле 6,5 мл Н 2 О, 13 мл 2 М NaOH и 6,5 мл Н 2 О. Остаток фильтруют, промывают эфиром и фильтрат концентрируют в вакууме, получая 6,7 г бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):2,18-2,26 (м, 2 Н), 2,36 (с, 3 Н), 2,49 (т, J=6 Гц, 2 Н), 2,92-2,97 (м, 2 Н),4,00 (ушир.с, 2 Н), 5,68 (ушир.с, 1 Н). 1-Метил-1,2,5,6-тетрагидропиридин-3-карбальдегид. 2,88 мл оксалилхлорида (2,4 экв.) растворяют в 20 мл ДХМ. Смесь охлаждают до -78 С и добавляют по капле раствор 3,37 мл ДМСО (2,0 экв.) в 10 мл ДХМ. Смесь перемешивают в течение 15 мин при 78 С. Добавляют по капле раствор 3,0 г (1-метил-1,2,5,6-тетрагидропиридин-3-ил)метанола в 10 мл ДХМ, поддерживая температуру ниже -65 С. Смесь перемешивают в течение 15 мин при -78 С. Добавляют по капле 9,81 мл триэтиламина (3,0 экв.) и затем дают смеси нагреться до комнатной температуры. Добавляют 50 мл ДХМ, сохраняя перемешивание смеси. Смесь перемешивают в течение 1 ч при комнатной температуре. Добавляют Н 2 О, органический слой отделяют, а водный слой снова экстрагируют ДХМ. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют, получая 3,24 г оранжевого масла (85% чистые), которое используют без дополнительной очистки на следующей стадии. 1 Н ЯМР (400 МГц, CDCl3):2,43 (с, 3 Н), 2,48-2,60 (м, 4 Н), 3,11-3,15 (м, 2 Н), 6,85 (м, 1 Н), 9,43 (с,1 Н). 5-Метил-3 а,4,5,6,7,7 а-гексагидро-1 Н-пиразоло[4,3-е]пиридин. 3,2 г 1-метил-1,2,5,6-тетрагидропиридин-3-карбальдегида растворяют в 10 мл n-BuOH. Добавляют 2 экв. гидразингидрата, смесь кипятят с обратным холодильником в течение 24 ч и затем концентрируют в вакууме. Остаток помещают в ДХМ и экстрагируют 2 М NaOH, органическую фазу сушат над Na2SO4,фильтруют и концентрируют в вакууме, получая 1,78 г коричневого масла, которое используют без дополнительной очистки на следующей стадии.(3 экв.) и 10,0 мл бензилбромида (1 экв.). Смесь кипятят с обратным холодильником в течение ночи. Концентрирование на диоксиде кремния и очистка методом колоночной флэш-хроматографии (элюент смесь ПЭ:эфир=95:5) дает 4,11 г бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):2,93 (т, J=7 Гц, 4 Н), 3,50 (т, J=7 Гц, 4 Н), 3,74 (с, 2 Н), 7,22-7,37 (м, 5 Н). 1-Бензилпиперидин-4,4-дикарбонитрил. 0,57 г малонитрила растворяют в 20 мл ДМФА. Добавляют 1,31 г K2CO3 (1,1 экв.) и смесь перемешивают в течение 2 ч при 65 С. Добавляют по капле раствор 2,0 г бензил-бис-(2-хлорэтил)амина (1 экв.) в 10 мл ДМФА при 65 С и перемешивают смесь еще 3 ч при 65 С. После охлаждения смесь разбавляют ЭА и экстрагируют 5% водным NaHCO3. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 2,02 г оранжевого масла, содержащего 85% ожидаемого продукта и 15% бензил-бис-(2-хлорэтил)амина. Этот материал используют на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):2,24 (т, J=5,5 Гц, 4 Н), 2,50-2,75 (ушир.с, 4 Н), 3,55 (с, 2 Н), 7,22-7,42 (м,5 Н). С-(4-Аминометил-1-бензилпиперидин-4-ил)метиламин. 1,50 г LiAlH4 (3 экв.) суспендируют в 100 мл сухого диэтилового эфира и охлаждают на бане со льдом. К данной смеси добавляют по капле раствор 2,99 г 1-бензилпиперидин-4,4-дикарбонитрила в 50 мл сухого ТГФ. Смесь перемешивают в течение ночи при комнатной температуре. Смесь охлаждают на бане со льдом и добавляют по капле 1,5 мл Н 2 О, 3 мл 2 М NaOH и 1,5 мл Н 2 О. Остаток фильтруют, промывают ТГФ и фильтрат концентрируют в вакууме, получая 2,63 г желтого масла, содержащего примерно 60% требуемого продукта, которое используют без дополнительной очистки на следующей стадии. 1 Н ЯМР (400 МГц, CDCl3):1,00-1,60 (ушир.с, 2 Н), 1,46 (т, J=5,5 Гц, 4 Н), 2,40 (т, J=5,5 Гц, 4 Н), 2,65(с, 4 Н), 3,50 (с, 2 Н) 7,20-7,36 (м, 5 Н). 8-Бензил-2,3,8-триазаспиро[4,5]дец-2-ен. 2,48 г С-(4-аминометил-1-бензилпиперидин-4-ил)метиламина суспендируют в 40 мл Н 2 О и 10 мл МеОН и охлаждают на бане со льдом. Одновременно добавляют по капле 6,7 мл 30% Н 2 О 2 (6 экв.) и 15,2 мл 10% NaClO (2,4 экв.). Смесь перемешивают при комнатной температуре в течение 1 ч. Смесь экстрагируют 2 раза ДХМ, объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют,получая 2,20 г желтого масла, которое используют без дополнительной очистки на следующей стадии. Согласно способу 2 соединение 155 получают, используя данный пиразолиновый строительный блок. Исходя из него, удаление бензильной защиты (АСЕ-хлорид в 1,2-ДХЭ, а затем МеОН) дает соединение 156, которое метилируют посредством восстановительного алкилирования СН 2 О)n в присутствии Метилмалонитрил. К малононитрилу (10,00 г; 151,32 ммоль; 2,0 экв.) добавляют йодметан (4,71 мл; 75,66 25 ммоль; 1,0 экв.) и тетрабутиламмонийбромид (0,98 г; 3,03 ммоль; 0,04 экв.). Смесь перемешивают при комнатной температуре в течение 30 мин, затем охлаждают на бане со льдом и медленно добавляют трет-бутилат калия (8,49 г; 75,66 ммоль; 1,0 экв.) (добавление начинают до отверждения смеси). Смесь перемешивают в течение 2 ч при комнатной температуре. Добавляют воду, а затем дважды проводят экстракцию ДХМ. Сушка над Na2SO4, фильтрование и удаление растворителя дают 10 г коричневой жидкости, которую очищают методом колоночной флэш-хроматографии, элюируя смесью ДХМ:ПЭ=1:1, 3:1 и ДХМ и получая 3,25 г прозрачной жидкости (отверждается при стоянии). 1 Н ЯМР (400 МГц, CDCl3):1,79 (д, J=7,5 Гц, 3 Н), 3,79 (кв, J=7,5 Гц, 1 Н). 2-Бензилоксиметил-2-метилмалононитрил. Метилмалонитрил (3,22 г; 39,40 ммоль; 1,0 экв.) растворяют в ТГФ (35 мл). Добавляют бензилхлорметиловый эфир (7,54 г; 43,35 ммоль; 1,1 экв.) и йодид натрия (0,20 г; 1,33 ммоль; 0,03 экв.). Желтую суспензию охлаждают на бане со льдом и добавляют небольшими порциями гидрид натрия (1,89 г; 47,29 ммоль; 1,2 экв.). Образуется более белый осадок. Смесь перемешивают в течение 30 мин при комнатной температуре, разбавляют эфиром и экстрагируют 5% водным NaHCO3. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 9,6 г желтой жидкости/масла. Очистка методом колоночной флэш-хроматографии (элюирование смесью ЭА:ПЭ=1:4) дает 6,2 г желтого масла. 1 Н ЯМР (400 МГц, CDCl3):1,78 (с, 3 Н), 3,72 (с, 1 Н), 4,71 (с, 2 Н), 7,31-7,43 (м, 5 Н). 2-Бензилоксиметил-2-метилпропан-1,3-диамин.LiAlH4 (3,22 г; 84,84 ммоль; 3,0 экв.) суспендируют в 30 мл сухого диэтилового эфира и охлаждают на бане со льдом. Добавляют по капле раствор 2-бензилоксиметил-2-метилмалононитрила (5,72 г; 28,28 ммоль; 1,0 экв.) в 20 мл сухого диэтилового эфира. Суспензию перемешивают при комнатной температуре в течение 4 ч и затем охлаждают на бане со льдом. К данной смеси добавляют 3,22 мл H2O, 6,44 мл 2 М NaOH и 3,22 мл H2O. Осадок отфильтровывают и промывают эфиром. Фильтрат концентрируют при пониженном давлении, получая 5,47 г (84%) бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):0,84 (с, 3 Н), 2,59-2,69 (м, 4 Н) 3,29 (с, 2 Н), 4,49 (с, 2 Н), 7,24-7,39 (м,5 Н). 4-Бензилоксиметил-4-метил-4,5-дигидро-3 Н-пиразол. 5,92 г 2-бензилоксиметил-2-метилпропан-1,3-диамина растворяют в воде (40 мл) и МеОН (10 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле 30% Н 2 О 2 (16,1 мл) и 10% NaClO (36,5 мл). Результирующую белую эмульсию перемешивают в течение ночи при комнатной температуре. Смесь экстрагируют ДХМ, органическую фазу сушат над Na2SO4, фильтруют и концентрируют в вакууме, получая 5,69 г светло-желтого масла, содержащего примерно 70% требуемого продукта, которое используют без дополнительной очистки на следующей стадии. 1 Н ЯМР (400 МГц, CDCl3):1,05 (с, 3 Н), 3,22 (с, 2 Н), 4,11-4,20 (м, 2 Н), 4,29-4,38 (м, 2 Н), 4,48 (с,2 Н), 7,24-7,39 (м, 5 Н).(9,49 мл) и ТБАБ (1,22 г), а затем частями добавляют KOtBu (8,49 г). Смесь перемешивают в течение 4 ч при комнатной температуре, помещают в ДХМ и экстрагируют 3 раза 5% водным NaHCO3. Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении. Сырой материал очищают методом флэш-хроматографии, элюируя смесью ПЭ:Et2O 65:35 (Rf=0,24, проявляют KMnO4), получая 2,49 г-10 С. К этому раствору добавляют по капле ВН 3 ТГФ (56 мл 1 М раствора в ТГФ, 5 экв.), смеси дают нагреться до комнатной температуры и затем перемешивают при 60 С в течение 6 ч. Смесь охлаждают на бане со льдом и добавляют HCl (24,2 мл 6 М водного раствора, 13 экв.). Смеси дают нагреться до комнатной температуры и перемешивают в течение 2 ч. Смесь нейтрализуют 2 М водным NaOH и экстрагируют три раза ДХМ. Водный слой выпаривают досуха, остаток перемешивают с CHCl3, твердые вещества отфильтровывают и органическую фазу выпаривают при пониженном давлении, получая 1,0 г(2,5 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (4,8 мл 30% раствора, 6 экв.) и NaClO (12,4 мл 10% раствора, 2,4 экв.), баню со льдом убирают и перемешивают смесь в течение ночи при комнатной температуре. Экстракция ДХМ, сушка над Na2SO4 и выпаривание при пониженном давлении дают 380 мг прозрачной светло-желтой жидкости, содержащей 85% ожидаемого продукта и 15% исходного диамина. Этот материал используют на следующих стадиях без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):1,49 (т, 4 Н), 3,65 (т, 4 Н), 4,28 (с, 4 Н). 2,2-бис-(2,2,2-трифторэтил)малононитрил. Малононитрил (20,15 ммоль) и 1-йод-3,3,3-трифторпропан (42,65 ммоль) растворяют в 30 мл сухого ТГФ и охлаждают смесь на бане лед/соль. Добавляют частями 1,61 г NaH (40,3 ммоль), поддерживая температуру ниже 5 С. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч и выпаривают при пониженном давлении. Сырой материал очищают методом флэш-хроматографии, элюируя ДХМ и получая 0,76 г масла. 1 Н ЯМР (400 МГц, CDCl3):2,62-2,49 (м, 4 Н), 2,31-2,24 (м, 4 Н). 2,2-бис-(2,2,2-Трифторэтил)пропан-1,3-диамин. 340 мг LiAlH4 (8,95 ммоль) суспендируют в 15 мл сухого Et2O и охлаждают на бане со льдом. Добавляют по капле раствор 760 мг 2,2-бис-(2,2,2-трифторэтил)малононитрила в Et2O с такой скоростью,чтобы поддерживать температуру ниже 20 С. Смесь перемешивают в течение ночи при комнатной температуре, охлаждают на бане со льдом и гасят, добавляя Н 2 О (0,35 мл), 2 М водный NaOH (0,70 мл) и снова Н 2 О (0,35 мл). Суспензию фильтруют, осадок на фильтре промывают Et2O и объединенные фильтраты выпаривают досуха при пониженном давлении, получая 0,72 г масла. Этот материал используют на следующей стадии без дополнительной очистки. 4,4-бис-(2,2,2-Трифторэтил)-4,5-дигидро-3 Н-пиразол. 2,2-бис-(2,2,2-Трифторэтил)пропан-1,3-диамин (720 мг) помещают в смесь Н 2 О (3 мл) и МеОН (0,75 мл) и охлаждают на бане со льдом. Одновременно добавляют по капле Н 2 О 2 (1,7 мл 30% раствора, 6 экв.) и NaClO (3,85 мл 10% раствора, 2,4 экв.), баню со льдом убирают и смесь перемешивают в течение ночи при комнатной температуре. Смесь экстрагируют ДХМ, органическую фазу сушат над MgSO4; выпаривание при пониженном давлении дает 0,82 г масла, содержащего 50% ожидаемого продукта и 50% исходного диамина. Этот материал используют на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):4,25 (с, 2 Н), 2,24-1,85 (м, 4 Н), 1,85-1,43 (м, 4 Н). Пример 4. Синтез конкретных соединений. Способ 1. Метиловый эфир (2-хлорбензолсульфонил)карбаминовой кислоты. К 25,0 г 2-хлорбензолсульфонамида добавляют 75 мл ацетонитрила и 45,2 мл (2,5 экв.) триэтиламина. Смесь охлаждают на бане со льдом и медленно по капле добавляют 15,1 мл метилхлорформиата. Смесь перемешивают в течение ночи при комнатной температуре и концентрируют в вакууме. Добавляют воду и водный слой промывают два раза эфиром. Подкисление водного слоя 2 М HCl ведет к образованию белого осадка. Суспензию фильтруют, остаток промывают H2O и сушат в вакууме, получая 19,1 г белого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):3,58 (с, 3 Н), 7,52-7,61 (м, 1 Н), 7,62-7,72 (м, 2 Н), 8,10 (дд, J=8 и 1,5 Гц, 1 Н), 12,42 (ушир.с, 1 Н). 2-Хлор-N-(4-этил-4,5-дигидропиразол-1-карбонил)бензолсульфонамид. 8,5 г 4-этил-4,5-дигидро-1 Н-пиразола растворяют в 75 мл толуола. Добавляют 19,0 г метилового эфира (2-хлорбензолсульфонил)карбаминовой кислоты и кипятят смесь с обратным холодильником в течение 4 ч. После охлаждения образуется осадок. Суспензию фильтруют, остаток промывают ПЭ и сушат в вакууме, получая 20,3 г белых кристаллов. 1 Н ЯМР (200 МГц, ДМСО-d6):0,90 (т, J=7,5 Гц, 3 Н), 1,30-1,70 (м, 2 Н), 3,00-3,40 (м, 1 Н), 3,25 (т,J=10,5 Гц, 1 Н), 3,74 (т, J=10,5 Гц, 1 Н), 7,08 (с, 1 Н), 7,40-7,73 (м, 3 Н), 8,03-8,16 (м, 1 Н), 10,00 (ушир.с, 1 Н). 2-Хлор-N-диэтиламино-4-этил-4,5-дигидропиразол-1-ил]метилен]бензолсульфонамид (соединение 1). 2,0 г 2-хлор-N-4-этил-4,5-дигидропиразол-1-карбонил)бензолсульфонамида растворяют в 10 мл ДХЭ. Добавляют 1,07 г 2-хлор-1,3-диметилимидазолинийхлорида (ДМХ) и 1,75 мл ТЭА и смесь кипятят с обратным холодильником в течение 1,5 ч, получая промежуточный хлоримин на месте. Затем добавляют 5 мл (избыток) диэтиламина и смесь перемешивают в течение ночи при комнатной температуре. Смесь концентрируют в вакууме и добавляют Н 2 О. Экстракция ДХМ (2 раза), сушка объединенных органических слоев над Na2SO4, выпаривание досуха и очистка методом флэш-хроматографии (эфир,Rf=0,35) дают 320 мг желтого масла. 1 Н ЯМР (400 МГц, CDCl3):0,95 (т, J=7,5 Гц, 3 Н), 1,16 (т, J=7 Гц, 6 Н), 1,44-1,66 (м, 2 Н), 3,00-3,10N-(бис-метилсульфанилметилен)-2-хлорбензолсульфонамид. К 41,6 г 2-хлорбензолсульфонамида добавляют 300 мл ДМФА и 22 мл сероуглерода. Смесь охлаждают на бане со льдом. Добавляют по капле раствор 29 г KOH (15,0 мл) в 100 мл Н 2 О с такой скоростью,чтобы поддерживать температуру ниже 10 С. Смесь перемешивают в течение 30 мин при 5 С. Затем добавляют по капле 32 мл MeI с такой скоростью, чтобы поддерживать температуру ниже 10 С. Потом смеси дают нагреться до комнатной температуры и перемешивают еще 30 мин. Добавляют Н 2 О, и образуется осадок. Его отфильтровывают и промывают Н 2 О. Остаток растирают в EtOH, отфильтровывают и сушат в вакууме, получая 42,6 г белых кристаллов. 1 Н ЯМР (200 МГц, CDCl3):2,57 (с, 6 Н), 7,32-7,60 (м, 3 Н), 8,11-8,27 (ушир.д, J=7,5 Гц, 1 Н). 2-Хлор-N-[(4-этил-4,5-дигидропиразол-1-ил)метилсульфанилметилен]бензолсульфонамид. 500 мг 4-этил-4,5-дигидро-1 Н-пиразола растворяют в 10 мл пиридина. Добавляют 1,51 г N-(бисметилсульфанилметилен)-2-хлорбензолсульфонамида и кипятят смесь с обратным холодильником в течение ночи. Смесь концентрируют в вакууме и добавляют Н 2 О, затем дважды выполняют экстракцию ДХМ. Объединенные органические слои сушат над Na2SO4 и концентрируют в вакууме. Сырой продукт очищают методом флэш-хроматографии (градиент ДХМ:ацетон от 100:0 до 95:5), получая 1,30 г желтого масла. 1 Н ЯМР (400 МГц, CDCl3):1,02 (т, J=7,5 Гц, 3 Н), 1,55-1,77 (м, 2 Н), 2,28 (с, 3 Н), 3,27-3,39 (м, 1 Н),4,13 (дд, J=11,5 и 6,5 Гц, 1 Н), 4,58 (т, J=11,5 Гц, 1 Н), 7,16 (д, J=2 Гц, 1 Н), 7,39 (дт, J=7,5 и 2 Гц, 1 Н), 7,46 2). 1,30 г 2-хлор-N-[(4-этил-4,5-дигидропиразол-1-ил)метилсульфанилметилен]бензолсульфонамида растворяют в 10 мл МеОН. Добавляют 5 мл (избыток) 70% раствора этиламина в Н 2 О и смесь перемешивают в течение 1 ч при комнатной температуре. Смесь концентрируют в вакууме и сырой продукт очищают методом флэш-хроматографии (эфир, Rf=0,33), получая 1,09 г бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):0,95 (т, J=7,5 Гц, 3 Н), 1,16 (т, J=7 Гц, 3 Н), 1,44-1,69 (м, 2 Н), 3,03-3,18(дд, J=7,5 и 2 Гц, 1 Н). Аналогичным образом получают соединения из приведенной ниже таблицы с пометкой "способ 2". Способ 3. 1-Этил-2-метилизотиокарбамид гидройодид. 20,5 г этилтиокарбамида растворяют в 100 мл EtOH. Смесь охлаждают на бане со льдом и добавляют по капле 13,5 мл (1,1 экв.) MeI. Смесь перемешивают в течение 1 ч при комнатной температуре и концентрируют в вакууме, получая 48,3 г светло-желтого масла. 1 Н ЯМР (400 МГц, ДМСО-d6):1,17 (т, J=7,5 Гц, 3 Н), 2,61 (с, 3 Н), 3,34 (кв, J=7,5 Гц, 2 Н), 9,10 4,N-Диэтил-4,5-дигидропиразол-1-карбоксамидин гидрохлорид. 19,36 г 4-этил-4,5-дигидро-1 Н-пиразола растворяют в 100 мл толуола. Добавляют 48,5 г 1-этил-2 метилизотиокарбамид гидройодида и 33,8 мл ДИПЭА и кипятят смесь с обратным холодильником в течение 48 ч. Смесь концентрируют, добавляют 2 М NaOH, а затем экстрагируют ДХМ (три раза). Объединенные органические слои сушат над Na2SO4 и растворитель выпаривают в вакууме, получая 32,7 г(99%) красного масла, содержащего 75% требуемого продукта по данным ЯМР. Масло растворяют вEtOH и добавляют по капле 194 мл 1 М HCl в EtOH. Смесь перемешивают при комнатной температуре в течение 30 мин и концентрируют в вакууме. Кристаллизация из смеси CH3CN:МТБЭ=1:1 дает 11,52 г(29%) требуемого продукта в виде бежевого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):0,96 (т, J=7,5 Гц, 3 Н), 1,16 (т, J=7 Гц, 3 Н), 1,46-1,72 (м, 2 Н), 3,32 Этиламино-(4-этил-4,5-дигидропиразол-1-ил)метиленамид бензо[1,2,5]тиадиазол-4-сульфоновой кислоты (соединение 78). 300 мг 4,N-диэтил-4,5-дигидропиразол-1-карбоксамидин гидрохлорида суспендируют в 10 мл ДХМ. Добавляют 0,53 мл ДИПЭА и 310 мг бензо[1,2,5]тиадиазол-4-сульфонилхлорида и смесь перемешивают в течение ночи при комнатной температуре. Смесь промывают 5% NaHCO3 и 2 М NaOH, органический слой сушат над Na2SO4 и растворитель выпаривают в вакууме, получая 410 мг красно-коричневого масла. Сырой продукт очищают методом флэш-хроматографии (ДХМ: ацетон=98:2, Rf=0,18), получая 350 мг 1-Этил-2-метилизотиокарбамид гидройодид. 20,0 г этилтиокарбамида суспендируют в 100 мл EtOH и добавляют по капле 30 г (1,1 экв.) MeI, при этом смесь становится прозрачным желтым раствором. Затем смесь перемешивают в течение 1 ч при комнатной температуре и концентрируют в вакууме, получая 48,1 г желтого масла. 1 Н ЯМР (400 МГц, ДМСО-d6):1,17 (т, J=7,5 Гц, 3 Н), 2,61 (с, 3 Н), 3,34 (кв, J=7,5 Гц, 2 Н), 9,10N-Этил-4,4-диметил-4,5-дигидропиразол-1-карбоксамидин гидрохлорид. 12,0 г 4,4-диметил-4,5-дигидро-3 Н-пиразола растворяют в 100 мл пиридина. Добавляют раствор 30,0 г 1-этил-2-метилизотиокарбамид гидройодида в 50 мл пиридина и кипятят смесь с обратным холодильником в течение 20 ч. Смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении, остаток помещают в ДХМ (120 мл). Органическую фазу экстрагируют 2 н. NaOH (2120 мл), промывают водой (120 мл), сушат над Na2SO4 и выпаривают при пониженном давлении, получая 16,3 г (79%) оранжевого масла. Масло (10,0 г) помещают в EtOAc (50 мл) и нагревают до 60 С. После удаления источника тепла дозируют 5-6 н. раствор HCl в изопропаноле (20 мл) в течение периода 4 мин. После охлаждения до комнатной температуры добавляют EtOAc (50 мл) за 4 мин и смесь перемешивают при 20 С в течение 90 мин. Образовавшиеся кристаллы собирают фильтрованием и промывают EtOAc(20 мл) с последующей сушкой при пониженном давлении и мягком нагревании, получая 6,52 г (54%) требуемого продукта в виде желтого твердого вещества. 1 Н ЯМР (400 МГц, ДМСО-d6):1,13 (т, J=7 Гц, 3 Н), 1,24 (с, 6 Н), 3,27-3,34 (м, 2 Н), 3,64 (с, 2 Н), 7,26 3-Хлор-N-[(4,4-диметил-4,5-дигидропиразол-1-ил)этиламинометилен]бензолсульфонамид (соединение 33). 6,39 г N-этил-4,4-диметил-4,5-дигидропиразол-1-карбоксамидин гидрохлорида суспендируют в 65 мл ДХМ. Добавляют 12,0 мл ДИПЭА и 3,96 мл 3-хлорбензолсульфонилхлорида и суспензию перемешивают в течение 20 ч при комнатной температуре, получая в результате темно-коричневый мутный раствор. Смесь экстрагируют 2 М NaOH (2125 мл) и 1 М HCl (2125 мл), промывают водой (100 мл) и сушат органический слой над Na2SO4 с последующим выпариванием при пониженном давлении, получая 7,70 г коричневого масла. Масло (1,0 г) растворяют в МТБЭ (3 мл) при кипячении с обратным холодильником и медленно охлаждают раствор до комнатной температуры, инициируя кристаллизацию. Суспензию перемешивают в течение 10 мин при комнатной температуре, добавляют гексан (6 мл) за 1 мин. Результирующую суспензию перемешивают в течение 20 мин при комнатной температуре и 50 мин при 0 С и продукт собирают фильтрованием и промывают гексаном (1 мл). Сушка при пониженном давлении и 40 С дает 0,85 г светло-коричневого твердого вещества, т.пл. 62-67 С. Аналогичным образом получают соединения из приведенной ниже таблицы с пометкой "способ 3".
МПК / Метки
МПК: C07D 231/06, C07D 409/04, C07D 401/04, C07D 407/04, C07D 409/14, A61P 25/00, C07D 403/12, A61K 31/415, C07D 417/12, C07D 213/12, C07D 407/12, C07D 401/12, C07D 409/12, A61K 31/4155, C07D 513/04
Метки: 5-ht6, производные, антагонисты, карбоксамидина, сульфонилпиразольные, сульфонилпиразолиновые
Код ссылки
<a href="https://eas.patents.su/30-21543-sulfonilpirazolnye-i-sulfonilpirazolinovye-proizvodnye-karboksamidina-kak-antagonisty-5-ht6.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфонилпиразольные и сульфонилпиразолиновые производные карбоксамидина как антагонисты 5-ht6</a>
Предыдущий патент: Система и способ гидратации алкиленоксида
Следующий патент: Триарильные соединения и фармацевтические композиции, их содержащие
Случайный патент: N-сульфонилпирролы и их применение в качестве ингибиторов гистондезацетилазы












