Ингибиторы hdac
Номер патента: 17074
Опубликовано: 28.09.2012
Авторы: Дэй Франческа Энн, Дэвидсон Алан Хорнсби, Моффат Дэвид Фестус Чарльз, Дональд Аластейр Дэвид Грэхем
Формула / Реферат
1. Соединение формулы (I) или его соль, N-оксид, гидрат или сольват
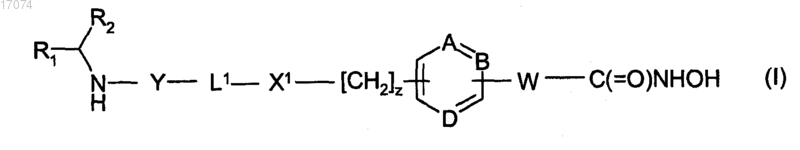
где А, В и D независимо представляют собой =С- или =N-;
W представляет собой двухвалентный радикал -СН=СН- или -СН2СН2-;
R1 представляет собой карбоксильную кислотную группу (-СООН) или эфирную группу;
R2 представляет собой боковую цепь природной или синтетической альфа-аминокислоты;
Y представляет собой связь, -С(=O)-, -S(=O)2-, -C(=O)O-, -C(=O)NR3-, -C(=S)-NR3, -C(=NH)NR3 или
-S(=O)2NR3-, где R3 представляет собой водород или необязательно замещенный (C1-C6)алкил;
L1 представляет собой двухвалентный радикал формулы -(Alk1)m(Q)n(Alk2)p-, где m, n и р независимо равны 0 или 1;
Q представляет собой (i) необязательно замещенный двухвалентный моно- или бициклический карбоциклический или гетероциклический радикал, имеющий 5-13 членов кольца, или (ii) в случае, когда оба m и р равны 0, двухвалентный радикал формулы -X2-Q1- или -Q1-X2-, где X2 представляет собой -О-, S- или NRA-, RA представляет собой водород или необязательно замещенный (C1-C3)алкил и Q1 представляет собой необязательно замещенный двухвалентный моно- или бициклический карбоциклический или гетероциклический радикал, имеющий 5-13 членов кольца;
Alk1 и Alk2 независимо представляют необязательно замещенные двухвалентные (C3-C7)циклоалкильные радикалы или необязательно замещенные с прямой или разветвленной цепью (C1-C6)алкиленовые, (C2-C6)алкениленовые или (C2-C6)алкиниленовые радикалы, которые могут необязательно содержать или иметь на конце простую эфирную (-O-), тиоэфирную (-S-) или амино (-NRA-) связь, где RA представляет собой водород или необязательно замещенный (C1-C3)алкил;
X1 представляет собой связь, -С(=O) или -S(=O)2-, -NR4C(=O)-, -C(=O)NR4-, -NR4C(=O)NR5-, -NR4S(=O)2- или -S(=O)2NR4-, где R4 и R5 независимо представляют собой водород или необязательно замещенный (C1-C6)алкил;
z равен 0 или 1;
где "необязательно замещенный" означает необязательно замещенный с помощью вплоть до четырех совместимых заместителей, каждый из которых независимо может быть (C1-C6)алкилом, (C1-C6)алкокси, гидрокси, гидрокси(C1-C6)алкилом, меркапто, меркапто(C1-C6)алкилом, (C1-C6)алкилтио, фенилом, галогеном (включая фтор, бром и хлор), трифторметилом, трифторметокси, нитро, нитрилом (-CN), оксо,
-СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB, -SO2NRARB, -NH2,
-NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA, -NRBCOORA, -NHSO2ORA,
-NRBSO2OH, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB, -NRACONHRB, -NHCONRARB или
-NRACONRARB, где RA и RB независимо представляют собой (C1-C6)алкил, (C3-C6)циклоалкил, фенил или моноциклический гетероарил, имеющий 5 или 6 атомов кольца или RA и RB, когда присоединены к одному и тому же атому азота, образуют циклическую аминогруппу; и где гетероатомы выбираются из S, N и О;
при условии, что когда А, В и D, каждый, представляет собой =С- и W представляет собой -СН=СН- и R1 представляет собой карбоксильную кислотную группу или его метиловый или трет-бутиловый эфир, тогда R2 не является боковой цепью триптофана, а именно индол-3-илметила.
2. Соединение по п.1, где А, В и D, каждый, представляют собой =С- или один из А, В и D представляет собой =N- и остальные представляют собой =С-.
3. Соединение по п.1 или 2, где радикал HONHC(=O)-W- присоединен к кольцу, содержащему А, В и С в положении мета- или пара- по отношению к радикалу R1R2CHNHYL1X1[CH2]z-.
4. Соединение по любому из пп.1-3, где радикал R1R2CHNHYL1X1[CH2]z- выбран из R1R2CHNHSO2-, R1R2CHNHCO-, R1R2CHNHCH2-, R1R2CHNH(CH2)O3- и следующих:
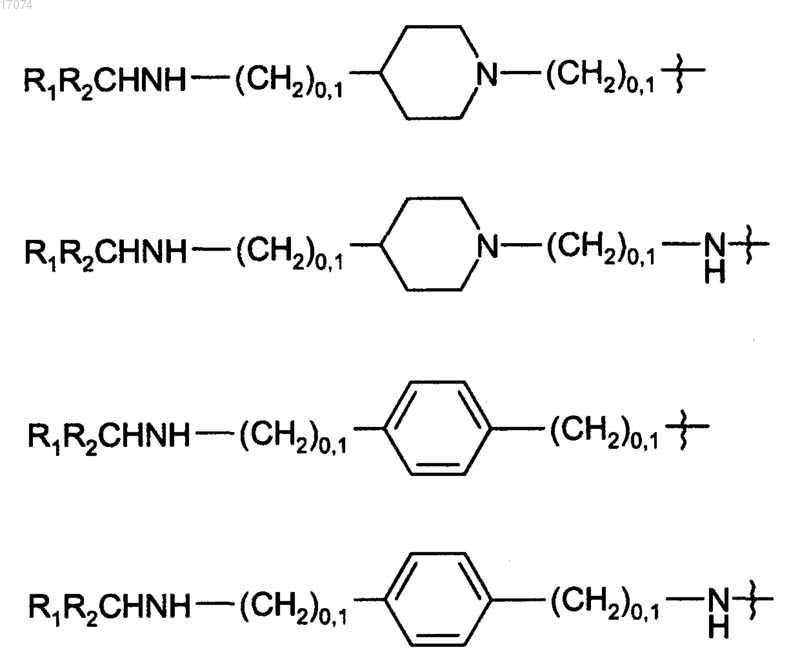
5. Соединение по любому из пп.1-3, где радикал -YL1X1[CH2]z- представляет собой -СН2-.
6. Соединение по любому из предыдущих пунктов, где R1 представляет собой эфирную группу формулы
-(C=O)OR9, где R9 представляет собой R20R21R22C, где:
(i) R20 представляет собой водород или необязательно замещенный (C1-C3)алкил-(Z1)а-[(C1-C3)алкил]b- или (C2-C3)алкенил-(Z1)a[(C1-C3)алкил]b-; а и b независимо равны 0 или 1; Z1 представляет собой -О-, -S- или
-NRc-, где Rc представляет собой водород или (C1-C3)алкил; R21 и R22 независимо представляют собой водород или (C1-C3)алкил-;
(ii) R20 представляет собой водород или необязательно замещенный R12R13N-(C1-C3)алкил-, где R12 представляет собой водород или (C1-C3)алкил и R13 представляет собой водород или (C1-C3)алкил; или R12 и R13 вместе с атомом азота, с которым они связаны, образуют необязательно замещенное моноциклическое гетероциклическое кольцо, содержащее 5 или 6 атомов кольца или бициклическую гетероциклическую кольцевую систему, содержащую от 8 до 10 атомов кольца, и R21 и R22 независимо представляют собой водород или (C1-C3)алкил-; или
(iii) R20 и R21, взятые вместе с атомом углерода, с которым они связаны, образуют необязательно замещенное моноциклическое карбоциклическое кольцо, содержащее от 3 до 7 атомов кольца или бициклическую карбоциклическую кольцевую систему, содержащую от 8 до 10 атомов кольца, и R22 представляет собой водород.
7. Соединение по п.6, где R9 представляет собой метил, этил, н- или изопропил, н-, втор- или трет-бутил, циклогексил, аллил, фенил, бензил, 2-, 3- или 4-пиридилметил, N-метилпиперидин-4-ил, тетрагидрофуран-3-ил или метоксиэтил.
8. Соединение по п.6, где R9 представляет собой циклопентил.
9. Соединение по любому из предыдущих пунктов, где R2 представляет собой циклогексилметил, циклогексил, пиридин-3-илметил, втор-бутил, трет-бутил, 1-бензилтио-1-метилэтил, 1-метилтио-1-метилэтил или 1-меркапто-1-метилэтил.
10. Соединение по любому из пп.1-8, где R2 представляет собой фенил, бензил, фенилэтил, трет-бутоксиметил или изобутил.
11. Соединение по любому из пп.1-8, где R2 представляет собой СН(СН3)2, циклогексил, -CH2O(трет-Bu),
-CH2S(трет-Bu) или фенил.
12. Соединение по п.1, выбранное из группы, состоящей из
циклопентил-(2S)-циклогексил({4-[(1E)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]бензил}амино)ацетата,
циклопентил-N-{4-[(1Е)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]бензил}-L-лейцината,
циклопентил-(2S)-циклогексил({4-[3-(гидроксиамино)-3-оксопропил]бензил}амино)ацетата,
циклопентил-N-{4-[3-(гидроксиамино)-3-оксопропил]бензил}-L-лейцината,
трет-бутил-N-{4-[3-(гидроксиамино)-3-оксопропил]бензил}-L-лейцината,
циклопентил-(2S)-циклогексил [({6-[(1Е)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]пиридин-3-ил}метил)амино]ацетат,
циклопентил-N-({6-[(1Е)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]пиридин-3-ил}метил)-L-лейцината,
циклопентил-(2S)-циклогексил [({6-[3-(гидроксиамино)-3-оксопропил]пиридин-3-ил}метил)амино]ацетата,
трет-бутил-N-({6-[3-(гидроксиамино)-3-оксопропил]пиридин-3-ил}метил)-L-лейцината,
циклопентил-(2S)-циклогексил [({5-[(1E)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]пиридин-2-ил}метил) амино]ацетата,
трет-бутил N-({5-[(1Е)-3-(гидроксиамино)-3-оксопроп-1-ен-1-ил]пиридин-2-ил}метил)-L-лейцината,
циклопентил-(2S)-циклогексил[({5-[3-(гидроксиамино)-3-оксопропил]пиридин-2-ил}метил)амино]ацетата,
трет-бутил-N-({5-[3-(гидроксиамино)-3-оксопропил]пиридин-2-ил}метил)-L-лейцината,
и их солей, N-оксидов, гидратов или сольватов.
13. Применение соединения по любому из пп.1-12 для получения лекарственного препарата для лечения пролиферации раковых клеток, болезни Гентингтона, болезни Альцгеймера или ревматоидного артрита.
14. Фармацевтическая композиция, содержащая соединение по любому из пп.1-12 и фармацевтически приемлемый носитель.
15. Фармацевтическая композиция по п.14, которая пригодна для местного применения и у которой в соединении формулы (I) радикал R2 связан с атомом углерода, к которому он присоединен через метиленовый радикал -СН2-.
Текст
Соединения формулы (I), ингибирующие HDAC активность, где А, В и D независимо представляют собой =С- или =N-; W представляет собой двухвалентный радикал -СН=СН- или СН 2 СН 2-; R1 представляет собой карбоксильную кислотную группу (-СООН) или эфирную группу, которая гидролизуется с помощью одного или большего количества внутриклеточных карбоксиэстрерных ферментов до карбоксильной кислотной группы; R2 представляет собой боковую цепь природной или синтетической альфа-аминокислоты; z равен 0 или 1; Y, L1 и X1 являются теми, как определено в формуле изобретения. Дэвидсон Алан Хорнсби, Моффат Дэвид Фестус Чарльз, Дэй Франческа Энн, Дональд Аластейр Дэвид Грэхем 017074 Данное изобретение относится к соединениям, которые ингибируют ферменты, являющиеся представителями семейства гистоновой дезацетилазы, и к их применению в лечении заболеваний, сопровождающихся пролиферацией клеток, включая раки, полиглутаминовые болезни, например болезнь Гентингтона, нейродегенеративные заболевания, например болезнь Альцгеймера, аутоиммунные заболевания, например ревматоидный артрит и отторжение пересаженных органов, диабет, гематологические расстройства, воспалительные заболевания, сердечно-сосудистые заболевания, атеросклероз и воспалительные осложнения инфекции. Уровень техники В эукариотических клетках ДНК уложена вместе с гистонами, образуя хроматин. Приблизительно 150 пар оснований ДНК закручены дважды вокруг октамера гистонов (по два гистона 2 А, 2 В, 3 и 4), образуя нуклеосому, основную единицу хроматина. Упорядоченная структура хроматина нуждается в модификации, чтобы обеспечить возможность транскрипции соответствующих генов. Регуляция транскрипции является ключевой для дифференцировки, пролиферации и апоптоза и, следовательно, жестко контролируется. Контроль изменений в структуре хроматина (и, следовательно, транскрипции) опосредуется ковалентными модификациями гистонов, наиболее характерно в N-концевых участках. Ковалентные модификации (например, метилирование, ацетилирование, фосфорилирование и убиквитинилирование) боковых цепей аминокислот ферментно опосредуются (обзор ковалентных модификаций гистонов и их роль в регуляции транскрипции могут быть найдены в S.L. Berger, Oncogene, 2001, 20, 3007-3013. См.Biochem. Sci, 1997, 22, 128-132 для обзора ацетилирования гистонов и транскрипции). Ацетилирование гистонов связано с областями хроматина, которые являются транскрипционно активными, в то время как нуклеосомы с низкими уровнями ацетилирования являются, как правило, транскрипционно "молчащими". Состояние ацетилирования гистонов контролируется двумя классами ферментов с противоположным действием: гистонацетилтрансферазами (HATs) и гистондезацетилазами"замолканию" подавляющих опухолевый рост генов (в качестве обзора возможной роли HDACs в канцерогенезе см. S.G. Gray and В.Т. The, Curr. Mol. Med., 2001, 1, 401-429). Ингибиторы ферментов HDAC описаны в литературе и демонстрируют индукцию реактивации транскрипции некоторых генов, что приводит к подавлению пролиферации раковых клеток, вызывает апоптоз и подавление опухолевого роста у животных (см. обзор W.K. Kelly et al., Expert Opin. Investig. Drugs, 2002, 11, 1695-1713). Такие находки предполагают, что ингибиторы HDAC обладают терапевтическим потенциалом в лечении пролиферативных заболеваний, таких как рак (О.Н. Kramer et al., Trends Endocrinol, 2001, 12, 294-300; D.M. Vigushinand R.С. Coombes, Anticancer Drugs, 2002, 13, 1-13). Кроме того, в других источниках высказывается мнение, что патологическая активность HDAC или ацетилирование гистонов участвует в следующих заболеваниях и расстройствах: полиглутаминовая болезнь, например болезнь Гентингтона (R.E. Hughes, Curr Biol, 2002, 12, R141-R143; A. McCampbell et al.,Proc Soc. Natl. Acad. Sci, 2001, 98, 15179-15184; E. Hockly et al., Proc. Soc. Natl. Acad. Sci, 2003 100, 20412046), другие нейродегенеративные заболевания, например болезнь Альцгеймера (В. Hempen and J.P.Brion, J. Neuropathol. Exp. Neurol, 1996, 55, 964-972), аутоиммунные заболевания и отторжение пересаженного органа (S. Skov et al., Blood, 2003, 101, 1430-1438; N. Mishra et al., J. Clin. Invest, 2003, 111, 539552), диабет (A.L. Mosley and S. Ozcan, J. Biol. Chem., 2003, 278, 19660-19666) и осложнения диабета,инфекция (включая протозойную инвазию) (S.J. Darkin-Rattray et al., Proc. Soc. Natl. Acad. Sci, 1996, 93,13143-13147 и гематологические расстройства, включая талассемию (О. Witt et al., Blood, 2003, 101,2001-2007). Наблюдения, содержащиеся в этих работах, предполагают, что ингибирование HDAC будет обладать терапевтической пользой при упомянутых или родственных заболеваниях. Много типов соединений ингибиторов HDAC было предложено, и некоторые такие соединения в настоящее время изучаются клинически в отношении лечения рака. Например, следующие патентные публикации раскрывают такие соединения: Большинство из HDAC ингибиторов, известных в уровне техники, имеют структурную модель, которая может быть представлена формулой (А) где кольцо А представляет собой карбоциклическую или гетероциклическую кольцевую систему с необязательными заместителями R и[Линкер] представляет собой линкерный радикал различных типов. Гидроксаматная группа функционирует как связывающая металл группа, взаимодействуя с ионом металла на активном сайте HDAC фермента, который находится в основании ячейки в кольцевой структуре фермента. Кольцо или кольцевая система А находится внутри или на входе ячейки, содержащей ион металла, с радикалом -[Линкер]- глубоко растирающимся в ячейке, связывая А с металлсвязанной гидроксамовой кислотной группой. В уровне техники и от случая к случаю в настоящем описании кольцо или кольцевую систему А иногда упоминают как "головную группу" ингибитора. Применение пролекарств для улучшения доставки в намеченные органы и ткани или для преодоления недостатков фармакокинетических свойств исходного лекарственного средства является хорошо известным подходом в медицинской химии. Введение пролекарств в виде сложных эфиров, например, которые гидролизуются карбоксиэстеразами сыворотки in vivo до активных исходных кислот, может приводить к более высоким уровням исходной кислоты, чем введение самой кислоты. Сущность изобретения Настоящее изобретение делает доступным новый класс ингибиторов HDAC, обладающих фармацевтической применимостью в лечении заболеваний, таких как рак или воспаление, которое улучшается за счет внутриклеточного ингибирования HDAC, один из подвидов которых содержит альфааминокислотную сложноэфирную группу, которая облегчает проникновение агента через клеточную стенку и тем самым обеспечивает действие карбоксиэстеразы, направленное на гидролиз сложного эфира, высвобождая исходную кислоту. Будучи заряженной кислота не транспортируется свободно из клетки, где она, таким образом, накапливается, повышая внутриклеточную концентрацию активного ингибитора HDAC. Это приводит к повышению мощности и длительности действия. Этот подкласс соединений по изобретению, следовательно, характеризуется наличием альфа-аминокислотной сложноэфирной группы, которая является субстратом для внутриклеточной карбоксиэстеразы (также обозначаемой в данном описании, как "эстеразный лейтмотив"), ковалентно связанной с исходным молекулярным каркасом и с соответствующими деэтерифицированными исходными кислотами. Подробное описание изобретения В соответствии с изобретением предложено соединение формулы (I) или его соль, N-оксид, гидрат или сольват где А, В и D независимо представляют собой =С- или =N-;W представляет собой двухвалентный радикал -СН=СН- или -СН 2 СН 2-;R1 представляет собой карбоксильную кислотную группу (-СООН) или эфирную группу, которая гидролизуется с помощью одного или большего количества внутриклеточных карбоксиэфирных ферментов до карбоксильной кислотной группой;R2 представляет собой боковую цепь природной или синтетической альфа-аминокислоты;-S(=O)2NR3-, где R3 представляет собой водород или необязательно замещенный (C1-C6)алкил;L представляет собой двухвалентный радикал формулы -(Alk1)m(Q)n(Alk2)p-, где m, n и р независимо равны 0 или 1;Q представляет собой (i) необязательно замещенный двухвалентный моно- или бициклический карбоциклический или гетероциклический радикал, имеющий 5-13 членов кольца, или (ii) в случае, когда оба m и р равны 0, двухвалентный радикал формулы -X2-Q1- или -Q1X2-, где X2 представляет собой -О-,S- или NRA-, где RA представляет собой водород или необязательно замещенный (C1-C3)алкил и Q1 представляет собой необязательно замещенный двухвалентный моно- или бициклический карбоциклический или гетероциклический радикал, имеющий 5-13 членов кольца, независимо представляют необязательно замещенные двухвалентные (C3-C7)циклоалкильные радикалы или необязательно замещенный с прямой или разветвленной цепью (C1-C6)алкиленовые, (C2-C6)алкениленовые или (C2-C6)алкиниленовые радикалы, которые могут необязательно содержать или заканчиваться простой эфирной (-O-), тиоэфирной (-S-)-2 017074 или амино (-NRA-) связью, где RA представляет собой водород или необязательно замещенный (C1C3)алкил;X1 представляет собой связь; -С(=O) или -S(=O)2-; -NR4C(=O)-, -C(=O)NR4-, -NR4C(=O)NR5-,-NR4S(=O)2- или -S(=O)2NR4-, где R4 и R5 независимо представляют собой водород или необязательно замещенный (C1-C6)алкил;-СН=СН- и R1 представляет собой карбоксильную кислотную группу или его метиловый или третбутиловый эфир, тогда R2 не является боковой цепью триптофана, а именно индол-3-илметила. Хотя вышеприведенное определение потенциально включает молекулы с высоким молекулярным весом, предпочтительным является, в соответствии с общими принципами медицинской химической практики, чтобы соединения, с которыми данное изобретение связано, имели бы молекулярную массу не более чем 600. В другом широком аспекте изобретение предусматривает применение соединения по изобретению в приготовлении композиции для ингибирования активности гистондеацетилазы. Соединения, с которыми данное изобретение связано, могут применяться для ингибирования активности гистондеацетилазы, ex vivo или in vivo. В одном аспекте изобретения соединения по данному изобретению могут применяться в приготовлении композиции для лечения пролиферативного заболевания, полиглутаминовой болезни, нейродегенеративного заболевания, аутоиммунного заболевания, воспалительного заболевания, отторжения пересаженного органа, диабета, гематологических расстройств или инфекции. В другом аспекте данное изобретение предусматривает способ лечения вышеприведенных видов заболеваний, который включает введение субъекту, страдающему такой болезнью, эффективного количества соединения по изобретению. Терминология. Термин "сложный эфир" или "этерифицированная карбоксильная группа", означает группуR9O(C=O)-, в которой R9 представляет собой группу, определяющую сложный эфир, номинально производную от спирта R9OH. Как используют в настоящем описании, термин "(Са-Cb)алкил", где а и b представляют собой целые числа, относится к прямой или разветвленной цепи алкильного радикала, имеющего от а до b атомов углерода. Таким образом, когда а равен 1 и b равен 6, тогда, например, термин включает метил, этил, нпропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил и н-гексил. Как используют в настоящем описании, термин "двухвалентный (Са-Cb)алкиленовый радикал", где а и b представляют собой целые числа, относится к насыщенной углеводородной цепи, имеющей от а доb атомов углерода и две ненасыщенные валентности. Как используют в настоящем описании, термин "(Са-Cb)алкенил", где а и b представляют собой целые числа, относится к прямой или разветвленной цепи алкенильного остатка, имеющего от а до b атомов углерода, по крайней мере одну двойную связь, либо Е или Z стереохимию, где возможно. Термин включает, например, винил, аллил, 1- и 2-бутенил и 2-метил-2-пропенил. Как используют в настоящем описании, термин "двухвалентный (Ca-Cb)алкениленовый радикал" означает углеводородную цепь, имеющую от а до b атомов углерода, по крайней мере одну двойную связь и две ненасыщенные валентности. Как используют в настоящем описании, термин "(Ca-Cb)алкинил", где а и b представляют собой целые числа, относится к углеводородным группам с прямой или разветвленной цепью, имеющим от а до b атомов углерода и имеющим, кроме того, одну тройную связь. Для а=2 и b=6 этот термин включает, например, этинил, 1-пропинил, 1- и 2-бутинил, 2-метил-2-пропинил, 2-пентинил, 3-пентинил, 4-пентинил,2-гексинил, 3-гексинил, 4-гексинил и 5-гексинил. Как используют в настоящем описании, термин "двухвалентный (Ca-Cb)алкиниленовый радикал",где а и b представляют собой целые числа, относится к двухвалентной углеводородной цепи, имеющей от а до b атомов углерода и по крайней мере одну тройную связь. Как используют в настоящем описании, термин "карбоциклический" относится к моно-, двух- или трициклическому радикалу, имеющему вплоть до 16 атомов в кольце, все из которых являются атомами углерода, и включает арил и циклоалкил. Как используют в настоящем описании, термин "циклоалкил" относится к моноциклическому насыщенному карбоциклическому радикалу, имеющему от 3-8 атомов углерода, и включает, например,циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Как используют в настоящем описании, общий термин "арил" относится к моно-, ди- или трициклическому карбоциклическому ароматическому радикалу и включает радикалы, имеющие два моноциклических карбоциклических ароматических кольца, которые непосредственно связаны ковалентной связью. Иллюстрацией таких радикалов являются фенил, бифенил и нафтил. Как используют в настоящем описании, общий термин "гетероарил" относится к моно-, ди- или трициклическому ароматическому радикалу, содержащему один или большее количество гетероатомов,-3 017074 выбранных из S, N и О, и включает радикалы, имеющие два таких моноциклических кольца или одно такое моноциклическое кольцо и одно моноциклическое арильное кольцо, которые непосредственно связаны ковалентной связью. Иллюстрацией таких радикалов являются тиенил, бензтиенил, фурил, бензфурил, пирролил, имидазолил, бензимидазолил, тиазолил, бензтиазолил, изотиазолил, бензизотиазолил,пиразолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, изотиазолил, триазолил, бензтриазолил, тиадиазолил, оксадиазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, триазинил, индолил и индазолил. Как используют в настоящем описании, общий термин "гетероциклил" или "гетероциклический" включает "гетероарил", как определено выше, и его неароматические значения относятся к моно-, диили трициклическому неароматическому радикалу, содержащему один или большее количество гетероатомов, выбранных из S, N и О и к группам, состоящим из моноциклического неароматического радикала,содержащего один или большее количество таких гетероатомов, которое ковалентно связаны с другим таким радикалом или с моноциклическим карбоциклическим радикалом. Иллюстрацией таких радикалов являются пирролильные, фуранильные, тиенильные, пиперидинильные, имидазолильные, оксазолильные, изоксазолильные, тиазолильные, тиадиазолильные, пиразолильные, пиридинильные, пирролидинильные, пиримидинильные, морфолинильные, пиперазинильные, индолильные, бензфуранильные, пиранильные, изоксазолильные, бензимидазолильные, метилендиоксифенильные, этилендиоксифенильные,малеимидные и сукцинимидные группы. Если иное не определено в контексте, в котором это встречается, термин "замещенный", как используют к любому остатку в настоящем описании, означает замещенный с помощью вплоть до четырех совместимых заместителей, каждый из которых независимо может быть, например, (C1-C6)алкилом, (C1C6)алкокси, гидрокси, гидрокси(C1-C6)алкилом, меркапто, меркапто(C1-C6)алкилом, (C1-C6)алкилтио,фенилом, галогеном (включая фтор, бром и хлор), трифторметилом, трифторметокси, нитро, нитрилом(-CN), оксо, -СООН, -COORA, -CORA, -SO2RA, -CONH2, -SO2NH2, -CONHRA, -SO2NHRA, -CONRARB,-SO2NRARB, -NH2, -NHRA, -NRARB, -OCONH2, -OCONHRA, -OCONRARB, -NHCORA, -NHCOORA,-NRBCOORA, -NHSO2ORA, -NRBSO2OH, -NRBSO2ORA, -NHCONH2, -NRACONH2, -NHCONHRB,-NRACONHRB, -NHCONRARB или -NRACONRARB, где RA и RB независимо представляют собой (C1C6)алкил, (C3-C6)циклоалкил, фенил или моноциклический гетероарил, имеющий 5 или 6 атомов кольца или RA и RB, когда присоединены к одному и тому же атому азота, образуют циклическую аминогруппу(например, морфолино, пиперидинил, пиперазинил или тетрагидропирролил). "Необязательный заместитель" может быть один из вышеупомянутых заместителей. Как используют в настоящем описании, термин "заместитель азота" означает заместитель на атоме азота, который выбран из следующих: амино(C1-C6)алкил, например, аминоэтил, (C1-C3)алкиламино(C1C6)алкил-, (C1-C3)диалкиламино(C1-C6)алкил, гидрокси(C1-C6)алкил, например гидроксиэтил, (C1C3)алкокси(C1-C6)алкил-, например метоксиэтил, меркапто(C1-C3)алкил, (C1-C3)алкил, меркапто(C1C6)алкил-, карбоксамидо(C1-C6)алкил, например CH2CONH2, аминосульфонил(C1-C6)алкил-, например-CH2SO2NH2, (C1-C3)алкиламиносульфонил(C1-C6)алкил-, например -CH2SO2NHMe, (C1-С 3)диалкиламиносульфонил(C1-C6)алкил, например CH2SO2NMe2, (C1-C6)алканоил, (C1-C6)алкилсульфонил, аминосульфонил (-SO2NH2), (C1-C6)алкиламиносульфонил, например -SO2NHMe, (C1-С 6)диалкиламиносульфонил, например -SO2NMe2, необязательно замещенный фениламиносульфонил, карбоксамидо(-CONH2), (C1-C6)алкиламинокарбонил, (C1-C6)диалкиламинокарбонил, морфолинил (C1-C6)алкил,имидазолил(C1-C6)алкил, триазолил(C1-C6)алкил или моноциклический гетероциклоалкил(C1-C6)алкил,необязательно замещенный в имидазолильном, триазолильном или гетероциклильном кольце, например пиперидинил(C1-C6)алкил, пиперазинил(C1-C6)алкил или 4-C1-C6)алкил)пиперазинил(C1-C6)алкил. Термин "боковая цепь природной или синтетической альфа-аминокислоты" относится к группе R2 в природной или синтетической аминокислоте формулы NH2-CH(R2)-COOH. Примеры боковых цепей природных альфа-аминокислот включают такие, как аланин, аргинин, аспаргин, аспарагиновая кислота, цистеин, цистин, глутаминовая кислота, гистидин, 5-гидроксилизин, 4 гидроксипролин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан,тирозин, валин, -аминоадипиновая кислота, -амино-н-масляная кислота, 3,4-дигидроксифенилаланин,гомосерин, -метилсерин, орнитин, пипеколиновая кислота и тироксин. Природные альфа-аминокислоты, которые содержат функциональные заместители, например амино, карбоксильные, гидрокси, меркапто, гуанидильные, имидазолильные или индолильные группы как свои характерные боковые цепи, включают аргинин, лизин, глутаминовую кислоту, аспарагиновую кислоту, триптофан, гистидин, серин, треонин, тирозин и цистеин. Когда R2 в соединениях по изобретению представляет собой одну из этих боковых цепей, функциональный заместитель может необязательно быть защищенным. Термин "защищенный", когда используют по отношению к функциональному заместителю в боковой цепи природной альфа-аминокислоты, означает производное такого заместителя, который является,по существу, нефункциональным. Например, карбоксильные группы могут быть этерифицированы (например, как (C1-C6)алкиловый эфир), аминогруппы могут быть преобразованы в амиды (например, какNHCO(C1-C6)алкиламид) или карбаматы (например, как NHC(=O)O(C1-C6)алкил или NHC(=O)OCH2Ph карбамат), гидроксильные группы могут быть преобразованы в простые эфиры (например, O(C1-C6)алкил или OC1-C6)алкил)фениловый эфир) или сложные эфиры (например, OC(=O)(C1-C6)алкиловый эфир) и тиольные группы могут быть преобразованы в тиоэфиры (например, трет-бутиловый или бензиловый тиоэфир) или тиоэфиры (например, SC(=O)(C1-C6)алкиловый тиоэфир). Примеры боковых цепей синтетических альфа-аминокислот включают те, которые представлены ниже при рассмотрении подходящих R2 групп для применения в соединениях по настоящему изобретению. Как используют в настоящем описании, термин "соль" включает основно-аддитивные, кислотноаддитивные и четвертичные соли соединений по изобретению, которые являются кислотными, могут образовывать соли, включая фармацевтически приемлемые соли, с основаниями, такими как гидроксиды щелочных металлов, например гидроксиды натрия и калия; гидроксиды щелочно-земельных металлов,например гидроксиды кальция, бария и магния; с органическими основаниями, например N-метил-Dглюкамином, холин трис-(гидроксиметил)аминометаном, L-аргинином, L-лизином, N-этилпиперидином,дибензиламином и им подобные. Те соединения формулы (I), которые являются щелочными, могут образовывать соли, включая фармацевтически приемлемые соли с неорганическими кислотами, например с галогенводородными кислотами, такими как хлорводородной или бромводородной кислотами, серной кислотой, азотной кислотой или фосфорной кислотой и им подобными и с органическими кислотами,например с уксусной, винно-каменной, янтарной, фумаровой, малеиновой, яблочной, салициловой, лимонной, метансульфоновой, п-толуолсульфоновой, бензойной, бензолсульфоновой, глутаминовой, молочной и миндальной кислотами и им подобными. Предполагается, что соединения по изобретению могут быть выделены в гидратной или сольватной форме. Термин "сольват" используют в настоящем описании, чтобы описать молекулярный комплекс,включающий соединение по изобретению и стехиометрическое количество из одной или большего количества молекул фармацевтически приемлемого растворителя, например этанола. Термин "гидрат" используют, когда указанный растворитель представляет собой воду. Соединения по изобретению, которые содержат один или большее количество реальных или потенциально хиральных центров, из-за присутствия асимметричных атомов углерода могут существовать в виде диастереомеров с R или S стереохимией на каждом хиральном центре. Изобретение включает все такие диастереомеры и их смеси. Дальнейшее рассмотрение. Как установлено выше, сложные эфиры соединений по изобретению представляют собой первичные пролекарства соответствующих карбоксильных кислот, в которые они преобразуются с помощью внутриклеточных эстераз. Тем не менее, при условии, что они остаются негидролизуемыми, сложные эфиры могут иметь HDAC собственную ингибиторную активность. Соединения по изобретению включают не только сложный эфир, но также соответствующие карбоксильные и гидролизные продукты. Гидроксаматная группа -C(=O)NHOH. В соединениях по изобретению гидроксаматная группа функционирует как связывающая металл группа, взаимодействуя с ионом металла на активном сайте HDAC фермента, который находится в основании ячейки в кольцевой структуре фермента. Кольцо, содержащее А, В и D. Каждый из А, В и D может быть -С=, или по крайней мере один из А, В и D может быть -N=, или А может быть -С= и В и D, каждый, могут быть -N=. Радикал -Y-L'-X1'-[СН 2]2.L1 может быть выбран из:-NR1S(=O)2(CH2)mAr-, где R1 и R2 независимо представляют собой водород, (C1-C4)алкил или заместитель азота, m равно 0, 1, 2 или 3 и Ar представляет собой двухвалентный фенильный радикал или двухвалентный моно- или бициклический гетероарильный радикал, имеющий от 5 до 13 членов кольца;(iii) необязательно замещенного, с прямой или разветвленной цепью (C1-C6)алкилена, (C2C6)алкенилена или (C2-C6)алкиниленового радикала, который может необязательно содержать или заканчиваться эфирной (-O-), тиоэфирной (-S-) или амино (-NRA-) связью, где RA представляет собой водород,(C1-C3)алкил или заместитель азота. В радикале L1, Alk1 и Alk2, когда присутствуют, могут быть выбраны из, например, -СН 2-,-СН 2 СН 2-, -СН 2 СН 2 СН 2-, -CH2O-, -CH2CH2O-, -СН 2 СН 2 СН 2- и двухвалентного циклопропила, циклопентила и циклогексильных радикалов. Также в радикале L1, Q1 может быть, например, 1,4-фениленом. Также в радикале L1, m и р могут быть равны 0 или n и р могут быть равны 0, пока m равно 1 или m,n и р могут все быть равны 0. Конкретными примерами радикала -Y-L1-X1-[CH2]z- являются -С(=O)-, -C(=O)NH-, -(CH2)v-,-5 017074-(CH2)vO-, -C(=O)-(CH2)v-, -C(=O)(CH2)vO-, -C(=O)NH(CH2)w-, -C(=O)NH(CH2)wO где v равен 1, 2, 3 или 4 и w равен 1, 2 или 3. Среди предпочтительных -Y-L1-X1-[CH2]z- радикалов являются радикалы -СН 2-, -CH2O-, -C(=O)CH2, -C(=O)-CH2O-, -C(=O)-NH-CH2- или -C(=O)-NH-CH2O-.X1 может быть, например, -NR3-, -S-, -О-, -C(=O)NR3-, -NR3C(=O)- или -C(=O)O-, где R3 представляет собой водород, (C1-C6)алкил или заместитель азота или в других случаях связь. В радикале L1, Alk1 и Alk2, когда они присутствуют, могут быть выбраны из -СН 2-, -СН 2 СН 2-,-СН 2 СН 2 СН 2- и двухвалентных циклопропильных, циклопентильных и циклогексильных радикалов. В радикале L1, Q1 может быть, например, двухвалентным фенильным радикалом или моно- или трициклическим гетероарильным радикалом, имеющим от 5 до 13 членов кольца, таким как 1,4-фенилен. Конкретными примерами радикала -L1-X1-[CH2]z- являются -(СН 2)3NH-, -CH2C(=O)NH-,-CH2CH2C(=O)NH-, -CH2C(O)O-, -CH2S-, -CH2CH2C(O)O-, -(CH2)4NH-, -CH2CH2S-, -CH2O, -CH2CH2O В простой подгруппе соединений по изобретению радикал -YL1X1-[CH2]z- представляет собой-СН 2-. Эфирная группа R1. Эфирная группа R1 может быть одной из тех, которая в соединении по изобретению гидролизуется с помощью одного или большего количества внутриклеточных карбоксиэстеразных ферментов до карбоксильной кислотной группы. Внутриклеточные карбоксиэстеразные ферменты, способные к гидролизу эфирной группы соединения по изобретению до соответствующей кислоты, включают три изотипа известных ферментов hCE-1, hCE-2 и hCE-3 человека. Хотя они, как рассматривается, являются основными ферментами, другие ферменты такие, как бифенилгидролаза (ВРН) может также играть роль в гидролизе сложного эфира. В целом, если карбоксиэстераза гидролизует свободный эфир аминокислоты до исходной кислоты, она будет благодаря N-карбонильной зависимости от hCE-2 и hCE-3, рассмотренных ниже,также гидролизовать сложный эфир в случае ковалентного конъюгирования с HDAC ингибитором. Следовательно, анализ деления клетки обеспечивает непосредственно быстрый и простой первый скрининг сложных эфиров, которые имеют требуемый гидролизуемый профиль. Сложный эфир мотивированно выбирают по той причине, что это направление может быть вновь проанализировано в карбоксиэстеразном опыте, в случае коъюгирования с ингибитором через выбранную химию связывания, для подверждения того, что это еще карбоксиэстеразный субстрат в этом уровне. Исходя из требования того, что они должны быть гидролизуемы с помощью внутриклеточных карбоксиэстеразных ферментов, примеры особенных сложных эфирных групп R1 включают такие формулы(i) R20 представляет собой водород или необязательно замещенный (C1-C3)алкил-(Z1)-[(C1C3)алкил]b- или (C2-C3)алкенил-(Z1)a-[(C1-C3)алкил]b-, где а и b независимо равны 0 или 1 и Z1 представляет собой -О-, S- или-NRc-, где Rc представляет собой водород или (C1-C3)алкил; и R21 и R22 независимо представляют собой водород или (C1-C3)алкил-;(ii) R20 представляет собой водород или необязательно замещенный R12R13N-(C1-C3)алкил-, где R12 представляет собой водород или (C1-C3)алкил и R13 представляет собой водород или (C1-C3)алкил; илиR12 и R13 вместе с атомом азота, с которыми они связаны, образуют необязательно замещенное моноциклическое гетероциклическое кольцо из 5- или 6- атомов кольца или бициклическую гетероциклическую кольцевую систему, содержащую от 8 до 10 атомов кольца и R21 и R22 независимо представляют собой водород или (C1-C3)алкил-; или(iii) R20 и R21 взятые вместе с атомом углерода, с которым они связаны, образуют необязательно замещенное моноциклическое карбоциклическое кольцо, содержащее от 3 до 7 атомов кольца или бициклическую карбоциклическую кольцевую систему, содержащую от 8 до 10 атомов кольца и R22 представляет собой водород. Внутри этих классов R9 может быть, например, метилом, этилом, н- или изопропилом, н-, втор- или трет-бутилом, циклогексилом, аллилом, фенилом, бензилом, 2-, 3- или 4-пиридилметилом, Nметилпиперидин-4-илом, тетрагидрофуран-3-илом, метоксиэтилом, индонилом, норбонилом, диметиламиноэтилом, морфолиноэтилом. В настоящем описании предпочтительным значением R9 является циклопентил. Макрофаги, как известно, играют ключевую роль в воспалительных расстройствах, посредством-6 017074 высвобождения цитокинов, в частности TNF и IL-1 (van Roon et al., Arthritis and Rheumatism, 2003,1229-1238). При ревматоидном артрите они являются основными факторами поддержки воспаления и разрушения суставов. Макрофаги также участвуют в опухолевом росте и развитии опухоли (Naldini andCarraro, Curr Drug Targets Inflamm Allergy, 2005, 3-8). Таким образом, агенты, которые избирательно нацелены на пролиферацию и функцию макрофагальных клеток, могут быть полезными в лечении рака и аутоиммунного заболевания. Нацеливание на конкретные типы клеток, как ожидается, будет приводить к снижению побочных эффектов. Изобретатели открыли способ нацеливания ингибиторов на клетки, которые экспрессируют hCE-1, в частности макрофаги и другие клетки, полученные из миеломоноцитарного ростка, такие как моноциты, остеокласты и дендритные клетки. Это основано на наблюдении, что способ, с помощью которого мотив эстеразы соединен с ингибитором, определяет гидролизуется ли он всеми тремя карбоксилэстеразами человека или только hCE-1, и таким образом, накапливается ли он или нет в клетках различных типов. В частности, было обнаружено, что макрофаги и другие клетки, происходящие из миело-моноцитарного ростка, и нормальные и раковые, содержат человеческую карбоксилэстеразу hCE-1, тогда как другие клеточные типы нет. В общей формуле (I), где атом азота в эстеразном лейтмотиве R1CH(R2)NH- непосредственно не связан с карбонильной группой (-С(=O)-), т.е. когда Y не является -С(=O), -С(=O)O- или -C(=O)NR3- радикалом, сложный эфир будет гидролизоваться только hCE-1 и, следовательно, ингибиторы будут избирательно накапливаться в клетках макрофагального происхождения. Боковая цепь R2 аминокислоты. Исходя из требования того, что эфирная группа R1 гидролизуется с помощью внутриклеточных ферментов карбоксилэстеразы, идентичность боковой цепи группы R2 не является критической для немакрофаговых выбранных соединений. Примеры боковых цепей аминокислоты включают(C1-C6)алкил, фенил, 2-, 3- или 4-гидроксифенил, 2-, 3- или 4-метоксифенил, 2-, 3- или 4 пиридилметил, бензил, фенилэтил, 2-, 3- или 4-гидроксибензил, 2-, 3- или 4-бензилоксибензил, 2-, 3- или 4-(C1-C6)алкоксибензил и бензилоксиC1-C6)алкил)группы; характерную группу природной -аминокислоты, в которой любая функциональная группа может быть защищена; группы -[Alk]nR6, где Alk представляет собой (C1-C6)алкильную или (C2-C6)алкенильную группу,необязательно прерываемую с помощью одного или большего числа -О- или -S-атомов или -N(R7)- группы [где R7 представляет собой атом водорода или (C1-C6)алкильную группу], n равно 0 или 1 и R6 представляет собой необязательно замещенный циклоалкил или циклоалкенильную группу; бензильную группу, замещенную в фенильном кольце с помощью группы формулы -OCH2COR8,где R8 представляет собой гидроксил, амино, (C1-C6)алкокси, фенил(C1-C6)алкокси, (C1-C6)алкиламино,диC1-C6)алкил)амино, фенил(C1-C6)алкиламино, остаток аминокислоты или галоидангидрид кислоты,сложный эфир или его амидное производное, указанный остаток является связанным через амидную связь, указанная аминокислота выбрана изглицина илиаланина, валина, лейцина, изолейцина, фенилаланина, тирозина, триптофана, серина, треонина, цистеина, метионина, аспаргина, глутамина, лизина,гистидина, аргинина, глутаминовой кислоты и аспарагиновой кислоты; гетероциклическую(C1-C6)алкильную группу, являющейся или незамещенной или моно- или дизамещенной в гетероциклическом кольце галогеном, нитро, карбокси, (C1-C6)алкокси, циано, (C1C6)алканоилом, трифторметил(C1-C6)алкилом, гидрокси, формилом, амино, (C1-C6)алкиламино, ди(C1C6)алкиламино, меркапто, (C1-C6)алкилтио, гидрокси(C1-C6)алкилом, меркапто(C1-C6)алкилом или (C1C6)алкилфенилметилом; и группа -CRaRbRc, в которой каждый из Ra, Rb и Rc независимо представляет собой водород, (C1-C6)алкил, (C2-C6)алкенил, (C2C6)алкинил, фенил(C1-C6)алкил, (C3-C8)циклоалкил; илиRc представляет собой водород и Ra и Rb независимо представляют собой фенил или гетероарил, такой как пиридил; илиRc представляет собой водород, (C1-C6)алкил, (C2-C6)алкенил, (C2-C6)алкинил, фенил(C1-C6)алкил или (C3-C8)циклоалкил и R3 и Rb вместе с атомом углерода, с которыми они связаны, образуют содержащий от 3 до 8 членов циклоалкил или от 5- до 6-членное гетероциклическое кольцо; илиRa и Rb, каждый независимо, представляют собой (C1-C6)алкил, (C2-C6)алкенил, (C2-C6)алкинил, фенил(C1-C6)алкил или группу, как определено для Rc ниже, иную, чем водород или Ra и Rb вместе с атомом углерода, с которыми они связаны, образуют циклоалкильное или гетероциклическое кольцо и Rc представляет собой водород, -ОН, -SH, галоген, -CN, -СО 2 Н, (C1-C4)перфторалкил, -СН 2 ОН, -CO2(C1C6)алкил, -O(C1-C6)алкил, -O(C2-C6)алкенил, -S(C1-C6)алкил, -SO(C1-C6)алкил, -SO2(C1-C6)алкил, -S(C2C6)алкенил, -SO(C2-C6)алкенил, -SO2(C2-C6)алкенил или группу -Q-W, где Q представляет собой связь или -О-, -S-, -SO- или -SO2- и W представляет собой фенил, фенилалкил, (C3-C8)циклоалкил, (C3-7 017074C8)циклоалкилалкил, (C4-C8)циклоалкенил, (C4-C8)циклоалкенилалкил, гетероарил или гетероарилалкильную группу, в которой группа W может необязательно быть замещена одним или большим количеством заместителей, независимо выбранных из гидроксила, галогена, -CN, -СО 2 Н, -CO2(C1-C6)алкила,-CONH2, -CONH(C1-C6)алкила, -CONHC1-C6)алкила)2, -СНО, -СН 2 ОН, (C1-C4)перфторалкила,-O(C1-C6)алкила, -S(C1-C6)алкила, -SO(C1-C6)алкила, -SO2(C1-C6)алкила, -NO2, -NH2, -NH(C1-C6)алкила,-NC1-C6)алкила)2, -NHCO(C1-C6)алкила, (C1-C6)алкила, (C2-C6)алкенила, (C2-C6)алкинила, (C3C8)циклоалкила, (C4-C8)циклоалкенила, фенила или бензила. Примеры специфических R2 групп включают водород ("боковая цепь" глицин), бензил, фенил, циклогексилметил, циклогексил, пиридин-3-илметил, трет-бутоксиметил, изобутил, втор-бутил, трет-бутил,1-бензилтио-1-метилэтил, 1-метилтио-1-метилэтил, 1-меркапто-1-метилэтил и фенилэтил. В данный момент предпочтительные R2 группы включают фенил, бензил и изобутил, циклогексил и третбутоксиметил. Для соединений по изобретению, которые не вводятся системно, сложные эфиры с низкой скоростью расщепления карбоксилэстеразой являются предпочтительными, так как они менее чувствительны к пресистемному метаболизму. Их способность достигать тканей-мишеней интактными, таким образом,возрастает, и сложный эфир может быть превращен внутри клеток ткани-мишени в кислотный продукт. Тем не менее, для местного введения, где эфир либо непосредственно наносится на ткань-мишень или направляется на нее, например, посредством ингаляции, часто желательно, чтобы этот эфир имел высокую скорость расщепления эстеразой, чтобы свести к минимуму системное воздействие и последующие нежелательные побочные эффекты. В соединениях по данному изобретению, если атом углерода, соседствующий с альфа-углеродом альфа-аминокислотного эфира, является монозамещенным, т.е. R2 являетсяCH2RZ (RZ является монозаместителем), тогда сложные эфиры имеют тенденцию быть расщепленными более быстро, чем если бы этот атом углерода был ди- или тризамещенным, как в случае, когда R2 является, например, фенилом или циклогексилом. Для макрофаговых выбранных соединений боковые цепи, такие как валин (т.е. -СН(СН 3)2), циклогексилглицин (т.е. циклогексил), трет-бутилсерин (т.е. -CH2O(трет-Bu, трет-бутилцистеин (т.е.-CH2S(трет-Bu и фенилглицин (т.е. фенил), являются в настоящем описании предпочтительными. Одна из подгрупп соединений по изобретению имеет формулу (IA) где W, R1 и R2 являются теми, как определено и в дальнейшем рассмотрено выше. Другая подгруппа соединений по изобретению имеет формулу (IB) где W, R1 и R2 являются теми, как определено и в дальнейшем рассмотрено выше. Еще другая подгруппа соединений по изобретению имеет формулу (IC) где W, R1 и R2 являются теми, как определено и в дальнейшем рассмотрено выше. Альтернативные воплощения. Соединения формулы (I) по изобретению характеризуются присоединением альфа-аминокислоты или эстераз-гидролизуемого альфа-аминокислотного эфирного остатка формулы R1R2CHNH- к кольцу,содержащему А, В и D через линкерный радикал -YL1X1[CH2]z-. Вместо N-присоединения в указанном направлении альфа-аминокислота или эстераз-гидролизуемый эфирный остаток альфа-аминокислоты,может иметь С-присоединение к кольцу, содержащему А, В и D через линкерный радикал, присоединенный к его альфа-углеродному атому. Таким образом, альтернативное воплощение по изобретению включает соединения формулы (II) и их соли, N-оксиды, гидраты и сольваты где А, В, D, W, L1 и z являются теми, как определено и рассмотрено выше в отношении соединений формулы (I);-NR3(C=O)NR5-, где R3 и R5 являются теми, как определено и рассмотрено выше в отношении соединений формулы (I);R представляет собой радикал формулы (X) или (Y) где R1 является тем, как определено и рассмотрено выше в отношении соединений формулы (I);R6 представляет собой водород; или необязательно замещенный (C1-C6)алкил, (C3-C7)циклоалкил,арил или гетероарил или -(C=O)R3, -(C=O)OR3 или -(C=O)NR3, где R3 является тем, как определено и рассмотрено выше в отношении соединений формулы (I). В соединениях формулы (II), когда атом азота в структуре сложного эфира является замещенным,но непосредственно не связан с карбонилом, т.е. когда в формуле X, R6 не является Н или группой, связанной с азотом через -С(=O)-, С(=O)O- или -C(=O)NR3- радикал или в формуле Y кольцевая система непосредственно не связывает -С(=O)-, -С(=O)O- или -C(=O)NH- радикал с азотом эстеразного лейтмотива, сложный эфир будет гидролизоваться только с помощью hCE-1 и поэтому ингибиторы будут накапливаться только в макрофагах.R6 может быть, тем не менее, необязательно замещенным (C1-C6)алкилом, (C3-C7)циклоалкилом,арилом или гетероарилом, например метилом, этилом, н- или изопропилом, циклопропилом, циклопентилом, циклогексилом, фенилом или пиридилом. В случаях, где макрофаг конкретно не требуется, R6 может быть водородом или -(C=O)R7, где R7 представляет собой необязательно замещенный (C1C6)алкил, такой как метил, этил, н-или изопропил или н-, изо- или втор-бутил, (C3-C7)циклоалкил, такой как циклопропил, циклопентил, циклогексил, фенил, пиридил, тиенил, фенилC1-C6)алкил)-, тиенилC1C6)алкил)- или пиридилC1-C6)алкил)-, такой как бензил, 4-метоксифенилметилкарбонил, тиенилметил или пиридилметил.R6 может также быть, например -(C=O)OR7 или-(С=O)NHR7, где R7 представляет собой водород или необязательно замещенный (C1-C6)алкил, такой как метил, этил или н- или изопропил. Для соединений формулы (II), которые предназначены для системного введения, сложные эфиры с низкой скоростью расщепления эстеразами предпочтительны, поскольку они менее чувствительны к пресистемному метаболизму. Их способность достигать своих тканей-мишеней интактными, таким образом, возрастает, и сложный эфир может быть превращен внутри клеток ткани-мишени в кислотный продукт. Тем не менее, для местного применения, когда сложный эфир либо непосредственно применяется к ткани-мишени или направляется туда посредством, например, ингаляции, часто будет желательно, чтобы сложный эфир имел высокую скорость расщепления эстеразами, чтобы свести к минимуму системное воздействие и последующие нежелательные побочные эффекты. Если атом углерода, к которому группа(-СН 2)-, тогда эфиры имеют тенденцию быть расщепленными более быстро, чем если бы этот углерод был замещенным, или являться частью кольцевой системы, такой как фенильное или циклогексильное кольцо. Для соединений по изобретению, которые предназначены для системного введения, сложные эфиры с низкой скоростью расщепления эстеразами предпочтительны, поскольку они менее чувствительны к пресистемному метаболизму. Их способность достигать их тканей мишеней интактными, таким образом,возрастает, и сложный эфир может быть превращен внутри клеток ткани-мишени в кислотный продукт. Тем не менее, для местного применения, когда сложный эфир либо непосредственно применяется к ткани-мишени или направляется туда посредством, например, ингаляции, часто будет желательно, чтобы сложный эфир имел высокую скорость расщепления эстеразами, чтобы свести к минимуму системное воздействие и последующие нежелательные побочные эффекты. В соединениях данного изобретения,если атом углерода, соседний с альфа-атомом углерода альфа-аминокислотного сложного эфира, является монозамещенным, т.е. R2 является CH2RZ (RZ является монозаместителем), тогда эфиры имеют тенденцию быть расщепленными быстрее, чем если бы этот атом углерода был ди- или тризамещенным, как в случае, когда R2 является, например, фенилом или циклогексилом. Применение. Как упоминалось выше, соединения, с которыми связано изобретение, являются ингибиторами активности HDAC, и следовательно являются применимыми в лечении заболеваний, таких как рак, псориаз, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, хроническая обструктивная болезнь легких, астма, рассеянный склероз, диабет, атопический дерматит, болезнь "трансплантат против хозяина", или системная красная волчанка и ревматоидный артрит. Необходимо понимать, что конкретный уровень дозирования для конкретного пациента будет зависеть от множества факторов, включая активность конкретного применяемого соединения, возраст, массу тела, общее состояние здоровья, пол, диету, время введения, путь введения, скорость выделения, комбинирование лекарственных препаратов и тяжесть конкретного заболевания, подвергнутого лечению. Оп-9 017074 тимальные уровни дозирования и частота введения будет определена в клинических испытаниях. Тем не менее, ожидается, что обычная доза будет находиться в пределах от 0,001 до 50 мг на 1 кг массы тела. Соединения, с которыми связано изобретение, могут быть приготовлены для введения посредством любого пути, соответствующего их фармакокинетическим свойствам. Композиции для перорального введения могут быть в форме таблеток, капсул, порошков, гранул, пастилок, жидких или гелеобразных препаратов, таких как растворы или суспензии для перорального, местного или парентерального введения (в стерильном виде). Таблетки и капсулы для перорального введения могут быть в дозированной лекарственной форме и могут содержать традиционные наполнители, такие как связывающие агенты,например сироп, гуммиарабик, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например лактозу, сахар, кукурузный крахмал, кальция фосфат, сорбит или глицин; смазывающее таблетирующее вещество, например магния стеарат, тальк, полиэтиленгликоль или оксид кремния; дезинтегрирующие вещества, например картофельный крахмал или подходящие смачивающие агенты, такие как натрия лаурилсульфат. Таблетки могут иметь оболочку в соответствии с технологиями, хорошо известными в обычной фармацевтической практике. Жидкие пероральные препараты могут быть в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта для восстановления с помощью воды или другого подходящего носителя перед употреблением. Такие жидкие препараты могут содержать традиционные вспомогательные вещества, такие как суспендирующие агенты, например сорбит, сироп, метилцеллюлоза, глюкозный сироп, гидрогенизированные желатином пищевые жиры; эмульгаторы, например лецитин, сорбитанмоноолеат или гуммиарабик; неводные носители (которые могут включать пищевые масла), например миндальное масло, фракционированное кокосовое масло, масляные эфиры, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например метил- или пропилпарагидроксибензоат или сорбиновая кислота и при необходимости традиционные ароматизаторы или красители. Для местного применения на кожу лекарственный препарат может быть произведен в виде крема,лосьона или мази. Кремовые или мазевые составы, которые могут использоваться для препарата, являются традиционными составами, хорошо известными в специальности, например, такими, как описанные в стандартных руководствах по фармацевтике, таких как British Pharmacopoeia. Для местного применения путем ингаляции лекарственный препарат может быть приготовлен для аэрозольного введения, например, в виде распылителей за счет высокого давления или ультразвуковых распылителей, или предпочтительно в виде дозированных аэрозолей с пропеллентом или для введения тонкоизмельченного порошка без пропеллента, например, в виде ингаляционных капсул или других систем доставки "сухого порошка". Наполнители, такие как, например, пропелленты (например, Frigen в случае дозированных аэрозолей), поверхностно-активные вещества, эмульгаторы, стабилизаторы, консерванты, ароматизаторы и наполнители (например, лактоза в случае порошковых ингаляторов), могут присутствовать в таких ингаляционных препаратах. С целью ингаляций большое число устройств доступно, с помощью которых могут быть получены и введены аэрозоли с оптимальным размером частиц,используя методику ингаляции, которая подходит пациенту. Наряду с применением адаптеров (спейсеров и экспандеров) и грушевидных контейнеров (например, Nebulator, Volumatic), и автоматических устройств, испускающих струю спрея (Autohaler), для дозированных аэрозолей, в частности, в случае порошковых ингаляторов, множество технических решений возможно (например, Diskhaler, Rotadisk,Turbohaler или ингаляторы, например, описанные в Европейской патентной заявке ЕР 0505321). Для местного применения на глаз лекарственный препарат может быть произведен в виде раствора или суспензии в подходящем стерильном вводном или неводном носителе. Дополнительные вещества,например буферы, такие как натрия метабисульфит или динатрия эдеат; консерванты, включая бактерицидные и фунгицидные агенты, такие как фенилмеркурия ацетат или нитрат, бензалкония хлорид или хлоргексидин, и загустители, такие как гипромеллоза, могут быть также включены. Активный ингредиент может также быть введен парентерально в стерильной среде. В зависимости от применяемого носителя и концентрации лекарственный препарат может быть суспендирован или растворен в носителе. Предпочтительно вспомогательные вещества, такие как местные анестетики, консерванты и буферные агенты, могут быть растворены в носителе. Синтез. Имеются многочисленные синтетические стратегии синтеза соединений, которых касается настоящее изобретение, но все они основаны на химии, известной среднему специалисту в области органики. Таким образом, соединения по изобретению могут быть синтезированы в соответствии с методиками,описанными в обычных литературных источниках и хорошо известных среднему специалисту. Обычными литературными источниками являются "Advanced organic chemistry", 4 Edition (Wiley), J. March;"Comprehensive Organic Transformation", 2nd Edition (Wiley), R.C. Larock; "Handbook of Heterocyclic Chemistry", 2nd Edition (Pergamon), A.R. Katritzky; обзоры статей, таких как найденных в "Synthesis", "Асе.Chem. Res.", "Chem. Rev" или первичных литературных источников, идентифицированных с помощью обычных автономных литературных поисков или из вторичных источников, таких как "Chemical Abstracts" или "Beilstein". Направления синтеза, используемые при получении соединений по примерам,- 10017074 представленным ниже, могут быть адаптированы для получения аналогичных соединений. Следующие примеры демонстрируют получение конкретных соединений по изобретению и их(350 мл) и охлаждают до температуры 0-5 С. Триметилфосфоноацетат (26 мл, 0.160 моль) загружают по каплям, поддерживая температуру реакционной смеси ниже 15 С. Затем реакционную смесь нагревают и перемешивают при комнатной температуре в течение 1.5 ч перед подкислением до значения рН 1. Полученный осадок фильтруют и сушат в вакууме, что дает указанный в заголовке продукт в виде твердого вещества бледно-желтого цвета (29.5 г, квант).H ЯМР (300 МГц, d6-DMSO) : 7.89-7.52 (5 Н, м), 6.59 (1H, д, J=16.2 Гц), 3.7 (3 Н, с). Стадия 2. Получение метил-(2E)-3-[4-(гидроксиметил)фенил]акрилата (промежуточное соединение А). Продукт, полученный на стадии 1 (10 г, 48 ммоль), добавляют к ТГФ (80 мл) и охлаждают до температуры 0-5 С. Добавляют по каплям боран-ТГФ комплекс, 1 М раствор в ТГФ (97 мл, 96 ммоль), полученной реакционной смеси дают возможность нагреться до комнатной температуры и перемешивают в течение 2 ч. Затем ее гасят смесью 1:1 10% HCl водный раствор/ТГФ, затем органику удаляют в вакууме. Остаток экстрагируют EtOAc (250 мл) и объединенную органику промывают насыщенным растворомNaHCO3 (50 мл), затем рассолом (50 мл), сушат (MgSO4) и концентрируют в вакууме, что дает указанный в заголовке продукт в виде масла желтого цвета (2.75 г, 30%). 1 Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение метил-3-[4-(гидроксиметил)фенил]пропановой кислоты (промежуточное соединение В). Промежуточное соединение А (3 г, 15.6 ммоль) и ацетат палладия (0.3 г, 1.3 ммоль) добавляют к 0.5 N KaOH водный раствор (50 мл), продувают водородом и перемешивают в атмосфере водорода в течение 4.5 ч. Реакционную смесь фильтруют через целит, промывают DCM (30 мл), подкисляют до значения рН 1 с 10% HCl водный раствор и экстрагируют EtOAc (230 мл). Объединенную органику сушат (MgSO4) и концентрируют в вакууме, что дает указанный в заголовке продукт в виде твердого вещества бледножелтого цвета (2.85 г, 94%). 1 Указанное в заголовке соединение получают из 3-формилбензойной кислоты с помощью методики,аналогичной методике, используемой для получения промежуточного соединения А. 1 Указанное в заголовке соединение получают из промежуточного соединения с помощью методики,аналогичной методике, используемой для получения промежуточного соединения В. 1 Н ЯМР (300 МГц, d6-DMSO) : 6.73-7.25 (4 Н, м), 5.13 (1 Н, т, J=5.7 Гц), 4.76 (2 Н, д, J=5.7 Гц; 3.60- 13017074 Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение 6-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]никотиновой кислоты. 6-Метилникотиновую кислоту (5 г, 36 ммоль) и этилглиоксалат (50% раствор в толуоле 8.7 мл,44 ммоль) добавляют к Ас 2 О (25 мл) и перемешивают в атмосфере азота. Реакционную смесь нагревают при температуре 130 С в течение 3 ч, затем дают возможность остыть до комнатной температуры в течение более 17 ч. Затем реакционную смесь гасят водой (10 мл) и концентрируют досуха в вакууме, что дает продукт в виде твердого вещества коричневого цвета (11.6 г, 100%). м/е=222 [М+Н]+. Стадия 2. Получение этил-(2E)-3-[5-(гидроксиметил)пиридин-2-ил]акрилата (промежуточное соединение Е). Боран-ТГФ комплекс (1 М раствор в ТГФ - 84 мл, 0.084 моль) добавляют по каплям к суспензии продукта, полученного на стадии 1 (11.6 г, 52 ммоль) в ТГФ (100 мл), в атмосфере азота. Реакционную смесь перемешивают при комнатной температуре в течение 1.5 ч, затем гасят с помощью 2 NHCl водный раствор (20 мл). ТГФ удаляют в вакууме, остаток подщелачивают до значения рН 9 с помощьюK2CO3, затем экстрагируют EtOAc (330 мл). Органические фазы объединяют, сушат (MgSO4), затем концентрируют в вакууме, что дает сырой продукт в виде масла коричневого цвета. Очистка с помощью хроматографии на колонке дает требуемый продукт в виде твердого вещества желтого цвета (1.86 г,25%). 1 Указанное в заголовке соединение получают из промежуточного соединения Е с помощью методики, аналогичной методике, используемой для получения промежуточного соединения В. 1- 14017074 Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение (6-метилпиридин-3-ил)метанола. К суспензии литийалюминийгидрида (7.24 г, 191 ммоль) в Et2O (400 мл) при температуре -78 С добавляют через канюлю в течение более 1 ч раствор метил-6-метилникотината (19.62 г, 130 ммоль) в Et2O(200 мл). После завершения добавления смесь перемешивают в течение еще 3 ч. Избыток литийалюминийгидрида гасят путем добавления по каплям EtOAc (40 мл). Смесь затем нагревают, используя баню воды со льдом и затем гасят насыщенным раствором NH4Cl (500 мл). Эфирный слой декантируют и добавляют EtOAc (500 мл). Смесь энергично перемешивают и органический слой снова декантируют. Методику экстрагирования повторяют дважды (500 мл EtOAc). Объединенные органические экстракты сушат (MgSO4) и концентрируют, чтобы получить на выходе требуемый продукт (13.6 г, 85%). 1H ЯМР (300 МГц, CDCl3) : 8.39 (1H, с), 7.62 (1H, дд, J=2.1, 8.1 Гц), 7.14 (1H, д, J=7.8 Гц), 4.68 (2 Н,с), 2.54 (3 Н, с). Стадия 2. Получение 6-метилникотинальдегида. К охлажденному (баня со льдом) раствору продукта, полученного на стадии 1 (14.85 г, 120.6 ммоль) в DCM (1000 мл), добавляют оксид магния (100 г) порциями по 10 г в течение более 30 мин. Смесь нагревают до комнатной температуры и перемешивают в течение 45 мин и затем фильтруют через целит. Остатки промывают DCM (500 мл) и объединенные порции DCM концентрируют, чтобы получить на выходе требуемый продукт. 1(1H, д, J=8.1 Гц), 2.60 (3 Н, с). Стадия 3. Получение метил-(2E)-3-(6-метилпиридин-3-ил)акрилата. К раствору продукта, полученного на стадии 2 (14.60 г, 120 ммоль), в воде (600 мл) добавляютK2CO3 (55 г, 398 ммоль). Смесь охлаждают (баня со льдом) и добавляют по каплям триметилфосфоноацетат (25 мл, 154 ммоль) в течение более 10 мин. Смесь перемешивают в течение 5 мин и затем нагревают до комнатной температуры и перемешивают в течение еще 1 ч. Продукт собирают фильтрованием и промывают водой (250 мл), затем сушат в вакууме, чтобы получить на выходе требуемый продуктH ЯМР (300 МГц, d6-DMSO) : 8.74 (1H, д, J=2.1 Гц), 8.08 (1H, дд, J=2.4, 8.1 Гц), 7.66 (1H, д, J=16.2 Гц), 7.32 (1H, д, J=8.1 Гц), 6.74 (1H, д, J=16.2 Гц), 3.73 (3 Н, с), 2.50 (3 Н, с). Стадия 4. Получение метил-(2E)-3-(6-метил-1-оксидопиридин-3-ил)акрилата. К раствору продукта, полученного на стадии 3 (10.04 г, 57 ммоль) в DCM (250 мл), добавляютmCPBA (10.1 г, 10.7 г, 4.7 г, 147 ммоль) тремя порциями в течение более часа. Смесь сушат путем добавления безводного сульфата магния и фильтруют, промывая еще порцией DCM (200 мл). Смесь концентрируют, затем помещают непосредственно на колонку с силикагелем и элюируют смесью 10% метанолDCM, чтобы получить на выходе требуемый продукт (10.35 г, 94%). 1(1H, д, J=8.1 Гц), 3.74 (3 Н, с), 2.34 (3 Н, с). Стадия 5. Получение метил-(2E)-3-[6-(гидроксиметил)пиридин-3-ил]акрилата (промежуточное соединение G). К охлажденному (баня со льдом) раствору продукта со стадии 4 (24.60 г, 127 ммоль) в ТГФ (500 мл) добавляют трифторуксусный ангидрид (25 мл, 180 ммоль). Смесь перемешивают в течение 15 мин и затем нагревают до комнатной температуры. После перемешивания в течение 1 ч, раствор охлаждают (баня со льдом) и полученную смесь гасят путем осторожного добавления насыщенного раствора NaHCO3(1000 мл). Продукт экстрагируют DCM (3500 мл), затем очищают с помощью флэш-хроматографии на колонке (10% МеОН в DCM), чтобы получить на выходе требуемый продукт (13.97 г, 57%). 1 Указанное в заголовке соединение получают из кислоты промежуточного соединения G с помощью методики, аналогичной методике, используемой для получения промежуточного соединения В. 1 Указанное в заголовке соединение получают, исходя из следующей методики.- 16017074 Получение. Промежуточные соединения, указанные выше, получают из соответствующих аминокислот и спиртов в соответствии со способами, описанными ниже. Способ I. Способ I (на примере промежуточного соединения J1). Стадия 1. Получение циклопентил-(2S)-[(трет-бутоксикарбонил)амино](циклогексил)ацетата. К раствору (S)-2-трет-бутоксикарбониламино-3-циклогексилпропионовой кислоты (5 г, 19.4 ммоль) в ДМФА (50 мл) при температуре 0 С добавляют циклопентанол (8.8 мл, 97.15 ммоль), EDC (4.09 г,21.37 ммоль) и наконец DMAP (237 мг, 1.94 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 18 ч. ДМФА удаляют в вакууме, что дает прозрачное масло. Его разделяют между водой и EtOAc. Органическую фазу сушат (MgSO4) и концентрируют в вакууме. Сырой экстракт очищают с помощью хроматографии на колонке (25% EtOAC в гептане), чтобы получить на выходе требуемый продукт в виде прозрачного масла (14.87 г, 55%). 1H ЯМР (300 МГц, d6-DMSO) : 7.09 (1H, д), 5.08 (1H, т), 3.76 (1H, т), 1.50-1.85 (10 Н, широкий м),1.39 (9 Н, с), 1.00-1.25 (9 Н, широкий м). Стадия 2. Получение гидрохлорида циклопентил-(2S)-амино(циклогексил)ацетата (промежуточное соединение J1). Продукт, полученный на стадии 1 (14.87 г, 45.69 ммоль), растворяют в DCM (100 мл) и обрабатывают смесью 4 М раствор HCl/диоксан (22.8 мл, 91.38 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 24 ч. Сырую смесь концентрируют при пониженном давлении, что дает масло оранжевого цвета. Его растирают в порошок с Et2O, что дает осадок белого цвета. Затем масло промывают Et2O, что дает требуемый продукт в виде порошка белого цвета (7.78 г,65%). 1H ЯМР (300 МГц, d6-DMSO) : 8.45 (3 Н, широкий с), 5.22 (1H, т), 3.28 (1H, д), 1.95-1.50 (10H1 широкий м), 1.30-0.90 (9 Н, широкий м). Способ II (на примере промежуточного соединения L1). Стадия 1. Образование сложного эфира для получения на выходе тозилатной соли циклопентил(2S)-амино(фенил)ацетата (промежуточное соединение L1). К суспензии (S)-фенилглицина (5 г, 33.1 ммоль) в циклогексане (150 мл) добавляют циклопентанол(29.84 мл, 331 ммоль) и п-толуолсульфоновую кислоту (6.92 г, 36.4 ммоль). Реактор оборудуют ловушкой Дина-Старка и нагревают до температуры 135 С до завершения растворения. Через 12 ч реакционную смесь охлаждают до комнатной температуры, приводя к высаждению твердого вещества белого цвета. Твердое вещество фильтруют и промывают EtOAc перед высушиванием при пониженном давлении,что дает требуемый продукт в виде порошка белого цвета (11.01 г, 85%). 1H ЯМР (300 МГц, d6-DMSO) : 8.82 (2 Н, широкий с), 8.73 (1H, широкий с), 7.47 (7 Н, м), 7.11 (2 Н,д), 5.25 (1H, широкий с), 5.18 (1H, м), 2.29 (3 Н, с), 1.87-1.36 (8 Н, м). Способ III (на примере промежуточного соединения О). Стадия 1. Получение [(2S)-2-[(бензилокси)карбонил]амино-3-[трет-бутоксипропаноил]окси. К раствору (S)-2-бензилоксикарбониламино-3-трет-бутоксипропионовой кислоты (25 г,84.65 ммоль) в ДМФА (250 мл) при температуре 0 С добавляют циклопентанол (15.36 мл, 169.3 ммоль),EDCl (17.85 г, 93.11 ммоль) и наконец DMAP (1.03 г, 8.46 ммоль). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 18 ч. ДМФА удаляют в вакууме, что дает масло желтого цвета. Его распределяют между водой и EtOAc. Органическую фазу сушат (MgSO4) и концентриру- 17017074 ют в вакууме. Сырой экстракт очищают с помощью хроматографии на колонке (25% EtOAc в гептане),чтобы получить на выходе требуемый продукт в виде прозрачного масла. Его используют непосредственно на следующей стадии без определения аналитических данных. Стадия 2. Получение циклопентил-O-трет-бутил-L-серината (промежуточное соединение О). Продукт, полученный на стадии 1, растворяют в EtOAc (150 мл), обрабатывают Pd(OH)2 (10 мол.%) и перемешивают в атмосфере водорода в течение 32 ч. По завершении реакции катализатор удаляют фильтрованием через целит и фильтрат концентрируют в вакууме, чтобы получить на выходе требуемый продукт в виде прозрачного масла (15.96 г, 82% после двух стадий). 1 Все указанные выше промежуточные соединения используют в реакциях аминокислотного связывания в виде свободных оснований. Среднему специалисту будет очевидно, что каждое свободное основание может быть получено путем титрование солей, описанных выше подходящим неорганическим основанием (например, NaHCO3). Пример 1.- 21017074 Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение натриевой соли 3-формилбензолсульфоната. Бензальдегид (10 г, 94 ммоль) добавляют по каплям к 20% раствору триоксида серы в дымящей серной кислоте (25 мл) и перемешивают в атмосфере азота, поддерживая температуру реакционной смеси ниже 40 С. Реакционную смесь перемешивают при температуре 40 С в течение 18 ч. Затем ее гасят на льду (60 г) и водный раствор экстрагируют EtOAc (100 мл). Водную фазу обрабатывают СаСО 3 пока не прекратится выделение СО 2 (рН 6). Полученный осадок фильтруют, промывают водой и фильтрат подщелачивают Na2CO3 до значения рН 8. Осадок удаляют фильтрованием и фильтрат упаривают досуха в вакууме. Остаток промывают МеОН, фильтруют и промывки концентрируют, что дает требуемый продукт в виде твердого вещества белого цвета (7.94 г, 81%). 1H ЯМР (300 МГц, CD3OD) : 9.88 (1H, с), 8.19 (1H, с), 7.99 (2 Н, дд), 7.63 (1H, т, J=7.8 Гц). Стадия 2. Получение натриевой соли 3-[(1E)-3-метокси-3-оксопроп-1-ен-1-ил]бензолсульфоната. Продукт, полученный на стадии 1 (13.8 г, 66 ммоль), и K2CO3 (18.3 г, 132 ммоль) растворяют в воде(70 мл). Добавляют по каплям триметилфосфоноацетат (14.51 г, 80 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 15 ч. Полученный осадок фильтруют, промывают МеОН и сушат в вакууме, что дает требуемый продукт в виде твердого вещества белого цветаH ЯМР (300 МГц, d6-DMSO) : 7.84 (1H, с), 7.65-7.70 (3 Н, м), 7.40 (1H, т, J=7.5 Гц), 6.60 (1H, д,J=16.2 Гц), 3.73 (1H, с). Стадия 3. Получение метил-(2E)-3-[3-([(1S)-2-(циклопентилокси)-2-оксо-1 фенилэтил]аминосульфонил)фенил]акрилата. Продукт, полученный на стадии 2 (5.75 г, 22 ммоль), добавляют к толуолу (17.5 мл) и ДМФА (6 капель) в атмосфере азота. Добавляют по каплям тионилхлорид (4.75 мл, 66 ммоль), затем реакционную смесь нагревают при температуре кипения с обратным холодильником в течение 1 ч. Затем ее концентрируют досуха и остаток растворяют в толуоле (50 мл), фильтруют и фильтрат концентрируют досуха,что дает твердое вещество желтого цвета. Его растворяют в DCM (7 мл) и добавляют к раствору промежуточного соединения L1 (1.91 г, 4.9 ммоль) в пиридине (2.5 мл) и DCM (10 мл). Реакционную смесь перемешивают в течение 2 ч при комнатной температуре и затем концентрируют досуха в вакууме и остаток разделяют между EtOAc (50 мл) и 10% HCl водный раствор (50 мл). Органическую фазу промывают водой (50 мл), насыщенным раствором NaHCO3 (50 мл) и рассолом (50 мл), затем сушат (MgSO4) и концентрируют в вакууме, что дает продукт в виде масла желтого цвета (1.77 г, 54%). м/е=442 [М-Н]-. Стадия 4. Получение(2E)-3-[3-([(1S)-2-(циклопентилокси)-2-оксо-1-фенилэтил]аминосульфонил)фенил]акриловой кислоты. Продукт, полученный на стадии 3 (1.77 г, 4 ммоль), и иодид лития (2.67 г, 20 ммоль) добавляют к пиридину (17,7 мл) и затем нагревают при температуре кипения с обратным холодильником в течение 24 ч. Реакционную смесь охлаждают, гасят до значения рН 1 с помощью 10% HCl водный раствор и экстрагируют DCM (220 мл). Объединенную органику промывают 10% HCl водный раствор (40 мл), затем рассо- 22017074 лом (40 мл), сушат (MgSO4) и концентрируют в вакууме, что дает масло коричневого цвета (1.19 г, 73%). м/е=428 [М-Н]-. Стадия 5. Получение циклопентил-(2S)-[(3-(1E)-3-[(1-изобутоксиэтокси)амино]-3-оксопроп-1-ен 1-илфенил)сульфонил]амино(фенил)ацетата. Продукт, полученный на стадии 4 (1.19 г, 2.8 ммоль), EDCl (0.64 г, 3.3 ммоль) и HOBt (0.45 г,3.3 ммоль) добавляют к DCM (10 мл) и перемешивают при комнатной температуре в течение 30 мин. Добавляют промежуточное соединение I (2.0 мл, 14 ммоль) и триэтиламин (2.0 мл, 14 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1.5 ч. Реакционную смесь разделяют водой, водную фазу экстрагируют DCM (20 мл) и объединенную органику концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на колонке, что дает продукт в виде масла коричневого цвета (0.17 г, 11%). м/е=543 [М-Н]-. Стадия 6. Получение циклопентил-(2S)-[(3-[(1E)-3-(гидроксиамино)-3-оксопроп-1-ен-1 ил]фенилсульфонил)амино](фенил)ацетата (пример 1). Продукт, полученный на стадии 5 (170 мг, 0.31 ммоль), растворяют в безводном DCM (5 мл). Добавляют 4 N раствор HCl в диоксане (0.16 мл, 0.63 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют досуха в вакууме,что дает твердое вещество коричневого цвета. Очистка с помощью препаративной HPLC дает твердое вещество желтого цвета (9 мг, 5%).(5 Н, с), 6.54 (1H, д, J=15.9 Гц), 4.94 (1H, м), 1.22-1.70 (8 Н, м). Соединения по следующим примерам получают, используя аналогичные методики.- 23017074 Указанное в заголовке соединение получают, исходя из следующей методики.toluene=толуол, pyridine=пиридин, dioxane=диоксан. Стадия 1. Получение 3-[(1E)-3-метокси-3-оксопроп-1-ен-1-ил]бензойной кислоты. 3-Карбоксибензальдегид (25 г, 0.167 моль) и K2CO3 (69 г, 0.499 моль) добавляют к воде (250 мл) и охлаждают до температуры 0-5 С. Загружают по каплям триметилфосфоноацетат (32.3 мл, 0.2 моль),поддерживая температуру реакционной смеси ниже 15 С. Реакционную смесь нагревают и перемешивают при комнатной температуре в течение 17 ч. Смесь подкисляют до значения рН 1, фильтруют и сушат в вакууме, что дает продукт в виде твердого вещества грязно-белого цвета (37.25 г, 100% - несущественная влажность). 1H ЯМР (300 МГц, CD3OD) : 8.23 (1H, с), 8.06 (1H, д, J=7.8 Гц), 7.86 (1H, д, J=7.5 Гц), 7.75 (1H, д,J=15.9 Гц), 6.61 (1 Н, д, J=16.2 Гц), 7.54 (1H, т), 3.81 (3 Н, с). Стадия 2. Получение метил-(2E)-3-(3-[(1S)-1-циклогексил-2-(циклопентилокси)-2 оксоэтил]карбамоилфенил)акрилата. Продукт, полученный на стадии 1 (5 г, 24 ммоль), добавляют к толуолу (20 мл) и ДМФА (6 капель) в атмосфере азота. К реакционной смеси загружают по каплям тионилхлорид (5.3 мл, 72 ммоль), который затем нагревают при температуре кипения с обратным холодильником в течение 1 ч. Затем реакционную смесь охлаждают и концентрируют досуха в вакууме, остаток растворяют в толуоле (40 мл), фильтруют и фильтрат концентрируют, что дает продукт в виде твердого вещества бледно-желтого цвета (6.1 г,100% - некоторое количество ДМФА). Промежуточное соединение J1 (0.5 г, 1.9 ммоль) добавляют к пиридину (1 мл) и DCM (10 мл). Твердое вещество бледно-желтого цвета (0.51 г, 2.3 ммоль) растворяют в DCM (5 мл) и загружают в реакционную смесь, которую перемешивают в течение 18 ч при комнатной температуре. Затем ее концентрируют досуха в вакууме и остаток разделяют между EtOAc (20 мл) и 10%HCl водный раствор (20 мл). Органическую фазу промывают водой (20 мл), насыщенным раствором NaHCO3(20 мл) и рассолом (20 мл), затем концентрируют в вакууме, что дает продукт в виде масла желтого цвета(0.83 г, квант.). Его переносят на следующую стадию без дополнительной очистки или определения аналитических данных. Стадия 3. Получение (2E)-3-(3-[(1S)-1-циклогексил-2-(циклопентилокси)-2-оксоэтил]карбамоилфенил)акриловой кислоты. Продукт, полученный на стадии 2 (0.83 г, 2.0 ммоль), и иодид лития (1.34 г, 10 ммоль) добавляют к пиридину (8.3 мл) и нагревают при температуре кипения с обратным холодильником в течение 3 дней. Реакционную смесь охлаждают, гасят до значения рН 1 с помощью 10% HCl водный раствор и экстрагируютDCM (220 мл). Объединенную органику промывают 10% HCl водный раствор (20 мл), затем рассолом(20 мл), сушат (MgSO4) и концентрируют в вакууме, что дает масло коричневого цвета (0.22 г, 23% после трех стадий). м/е=400 [М+Н]+.- 24017074 Стадия 4. Получение циклопентил-(2S)-циклогексил[(3-(1E)-3-[(1-изобутоксиэтокси)амино]-3 оксопроп-1-ен-1-илбензоил)амино]ацетата. Продукт, полученный на стадии 3 (0.22 г, 0.55 ммоль), EDCl (0.13 г, 0.66 ммоль) и HOBt (0.09 г,0.66 моль) добавляют к DCM (10 мл) и перемешивают при комнатной температуре в течение 30 мин. Загружают промежуточное соединение I (0.23 мл, 1.65 ммоль) и триэтиламин (0.23 мл, 1.65 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 3.5 ч. Реакционную смесь разделяют водой, водную фазу экстрагируют DCM (20 мл) и объединенную органику концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на колонке, что дает продукт в виде масла коричневого цвета (0.14 г, 50%). м/е=537 [M+Na]+. Стадия 5. Получение циклопентил-(2S)-циклогексил(3-[(1E)-3-(гидроксиамино)-3-оксопроп-1-ен 1-ил]бензоиламино)ацетата (пример 5). Продукт, полученный на стадии 4 (140 мг, 0.27 ммоль), растворяют в безводном DCM (5 мл). Загружают 4 N раствор HCl в диоксане (0.16 мл, 0.54 моль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Смесь концентрируют досуха в вакууме, что дает масло желтого цвета. Очистка с помощью препаративной HPLC дает твердое вещество розового цвета (68 мг,61%).(1 Н, д, J=8.4 Гц), 7.72 (1H, д, J=8.4 Гц), 7.54-7.49 (2 Н, м), 6.55 (1H, д, J=15.9 Гц), 5.11 (1 Н, м), 4.25 (1H, т,J=7.8 Гц), 1.92-1.47 (13 Н, м), 1.35-1.00 (6 Н, м). Соединения по следующим примерам получают, используя аналогичные методики. Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение (2E)-3-(4-гидроксифенил)-N-(1-изобутоксиэтокси)акриламида. 4-Гидроксикоричную кислоту (1 г, 6.1 ммоль), EDCl (1.76 г, 9.1 ммоль) и HOBt (1.24 г, 9.1 ммоль) добавляют к DCM (20 мл) и перемешивают при комнатной температуре в течение 45 мин. Добавляют промежуточное соединение I (4.2 мл, 30.5 ммоль) и триэтиламин (4.1 мл, 30.5 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1.5 ч. Реакционную смесь разделяют водой, водную фазу экстрагируют DCM (20 мл) и объединенную органику сушат (MgSO4) и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на колонке, что дает продукт в виде прозрачного масла (1.39 г, 82%). м/е=278 [М-Н]-. Стадия 2. Получение (2E)-3-[4-(3-бромпропокси)фенил]-N-(1-изобутоксиэтокси)акриламида. Продукт, полученный на стадии 1 (0.66 г, 2.4 ммоль), 3-бромпропан-1-ол (0.24 мл, 2.6 ммоль) и трифенилфосфин (0.96 г, 4.8 ммоль) добавляют к DCM (20 мл) и перемешивают в атмосфере азота в течение 10 мин. Загружают по каплям DIAD (0.56 мл, 2.9 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь концентрируют досуха в вакууме, что дает масло бледно-желтого цвета. Очистка с помощью хроматографии на колонке дает продукт в виде твердого вещества белого цвета (0.68 г, 72%). м/е=398/400 [М-Н]-. Стадия 3. Получение циклопентил-(2S)-циклогексил[3-(4-(1E)-3-[(1-изобутоксиэтокси)амино]-3 оксопроп-1-ен-1-илфенокси)пропил]аминоацетата. Промежуточное соединение J1 (0.14 г, 0.54 ммоль), K2CO3 (0.3 г, 2.2 ммоль) и иодид натрия (0.16 г,- 26017074 1.07 ммоль) добавляют к ДМФА (5 мл) и нагревают до температуры 70 С. Продукт, полученный на стадии 2 (0.22 г, 0.55 ммоль), растворяют в ДМФА (2 мл) и загружают в реакционную смесь, которую перемешивают при температуре 70-80 С в атмосфере азота в течение 24 ч. Затем загружают продукт, полученный на стадии 2 (0.1 г, 0.25 ммоль), и полученную реакционную смесь перемешивают при температуре 80 С в течение 4.5 ч. Затем реакционную смесь концентрируют досуха в вакууме, остаток отделяют с водой (10 мл) и EtOAc (10 мл) и водную фазу экстрагируют EtOAc (10 мл). Объединенную органику промывают рассолом (10 мл), сушат (MgSO4) и концентрируют в вакууме, что дает сырой продукт в виде масла желтого цвета. Очистка с помощью хроматографии на колонке дает продукт в виде прозрачного масла (0.1 г, 34%). м/е=546 [М+Н]+. Стадия 4. Получение циклопентил-(2S)-циклогексил[(3-4-[(1E)-3-(гидроксиамино)-3-оксопроп-1 ен-1-ил]феноксипропил)амино]ацетата. Продукт, полученный на стадии 3 (100 мг, 0.31 м моль), растворяют в безводном DCM (0.4 мл), загружают МеОН (0.5 мл). TFA (0.1 мл) и полученную реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем ее концентрируют досуха в вакууме, что дает масло желтого цвета. Очистка с помощью препаративной HPLC дает продукт в виде твердого вещества белого цвета (10 мг,12%).(2 Н, м). Соединения по следующим примерам получают, используя аналогичные методики.- 27017074 Указанное в заголовке соединение получают, исходя из следующей методики. Стадия 1. Получение (2E)-3-[3-(гидроксиметил)фенил]акриловой кислоты. Промежуточное соединение С (16.04 г, 83.5 ммоль) добавляют к 1 М NaOH водный раствор (28 мл) и МеОН (41 мл) и перемешивают при комнатной температуре в течение 15.5 ч. МеОН удаляют в вакууме и остаток промывают EtOAc. Водную фазу подкисляют до значения рН 1 и полученный осадок фильтруют и сушат в вакууме, что дает указанный в заголовке продукт в виде твердого вещества белого цвета(7.29 г, 49%). м/е=179 [М+Н]+. Стадия 2. Получение (2E)-3-[3-(1-гидроксиэтил)фенил]-N-(1-изобутоксиэтокси)акриламида. Продукт, полученный на стадии 1 (7.29 г, 41 ммоль), EDCl (9.4 г, 49 ммоль) и HOBt (6.6 г,49 ммоль) добавляют к DCM (100 мл) и перемешивают при комнатной температуре в течение 30 мин. Загружают промежуточное соединение I (17.3 мл, 123 ммоль) и триэтиламин (28.5 мл, 205 ммоль) и полученную реакционную смесь перемешивают при комнатной температуре в течение 2.5 ч. Реакционную смесь разделяют водой, водную фазу экстрагируют DCM (50 мл) и объединенную органику сушат(MgSO4) и концентрируют в вакууме. Сырой продукт очищают с помощью хроматографии на колонке,что дает продукт в виде масло бледно-желтого цвета (6.54 г, 54%). 1 Н ЯМР (300 МГц, CD3OD) : 7.71-7.33 (5 Н, м), 6.57 (2 Н, д, J=15.6 Гц), 5.01 (1H, м), 4.65 (2 Н, с),3.32 (2 Н, м), 1.40 (3 Н, д, J=5.4 Гц), 0.93 (6 Н, м). Стадия 3. Получение (2E)-3-(3-формилфенил)-N-(1-изобутоксиэтокси)акриламида. Продукт, полученный на стадии 2 (6.5 г, 22 ммоль), и диоксид магния (9.6 г, 100 ммоль) перемешивают в DCM (100 мл) при комнатной температуре в течение 16 ч. Реакционную смесь фильтруют через целит и фильтрат концентрируют досуха, что дает продукт в виде твердого вещества серого цвета (4.8 г,75%). 1 Н ЯМР (300 МГц, CDCl3) : 10.05 (1H, с), 8.06 (1H, с), 7.97-7.52 (4 Н, м), 6.55 (1H, д), 5.05 (1H, м),3.35 (2 Н, м), 1.47-1.44 (3 Н, м), 0.94 (6 Н, м). Стадия 4. Получение циклопентил-(2S)-циклогексил[(3-(1E)-3-[(1-изобутоксиэтокси)амино]-3 оксопроп-1-ен-1-илбензил)амино]ацетата. Продукт, полученный на стадии 3 (0.3 г, 1.03 ммоль), и промежуточное соединение J1 (0.32 г,1.22 ммоль) растворяют в 1,2-дихлорэтане (10 мл). Загружают STAB (0.33 г, 1.56 ммоль) и полученную реакционную смесь перемешивают в атмосфере азота в течение 1 ч. Затем ее гасят насыщенным раствором NaHCO3 (10 мл). Водную фазу экстрагируют DCM (210 мл) и объединенную органику сушат(MgSO4) и концентрируют досуха в вакууме, что дает продукт в виде масла коричневого цвета (0.59 г,100%). м/е=50 [М+Н]+.- 28017074 Стадия 5. Получение циклопентил-(2S)-циклогексил(3-[(1E)-3-(гидроксиамино)-3-оксопроп-1-енил]бензиламино)ацетата (пример 12). 4 N Раствор HCl в диоксане (0.59 мл, 2.4 ммоль) добавляют к раствору продукта со стадии 4 (0.59 г,1.2 ммоль) в DCM и полученную реакционную смесь перемешивают в течение 3 ч. Затем ее концентрируют досуха в вакууме, что дает масло желтого цвета. Очистка с помощью препаративной HPLC дает требуемый продукт в виде твердого вещества белого цвета (11.5 мг, 2.4%).LCMS чистота 95%. м/е=400.5 [М+Н]+. 1 Н ЯМР (300 МГц, d6-DMSO) : 10.75 (1H, с), 9.03 (1H, с), 7.25-7.51 (5 Н, м), 6.45 (1H, д, J=15.6 Гц),5.09 (1H, м), 3.64 (2 Н, дд), 2.83 (1H, м), 1.42-1.93 (13 Н, м), 0.92-1.25 (6 Н, м). Соединения по следующим примерам получают, используя аналогичные методики.
МПК / Метки
МПК: C07D 295/088, A61K 31/223, A61K 31/44, C07D 213/56, A61P 35/00, C07D 209/20, C07C 259/06, A61K 31/496, A61K 31/4468, C07D 211/58, C07D 241/04, A61K 31/445, C07C 311/19, C07D 211/26, A61K 31/444
Метки: ингибиторы
Код ссылки
<a href="https://eas.patents.su/30-17074-ingibitory-hdac.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы hdac</a>