Ингибиторы тромбина
Номер патента: 2767
Опубликовано: 29.08.2002
Авторы: Цирке Томас, Мак Хельмут, Зайтц Вернер, Бём Ханс-Йоахим, Хорнбергер Вильфрид, Хёффкен Ханс Вольфганг, Козер Штефан, Пфайффер Томас
Формула / Реферат
1. Ингибиторы тромбина формулы (I)
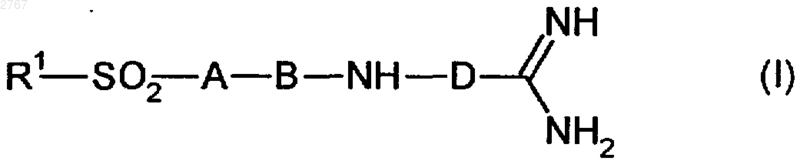
где R1 - алкил с 1-20 атомами углерода, фенил- или нафтилалкил с 1-10 атомами углерода в алкильной части, группа R2OOC-(CH2), где R2 означает водород или алкил с 1-10 атомами углерода,
А - остаток a-аминокислоты формулы (II)
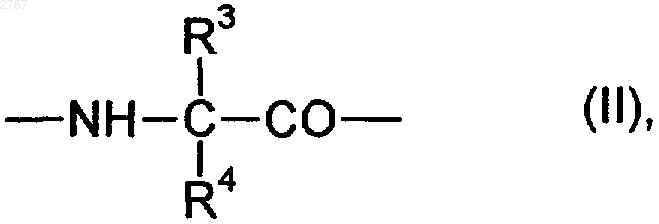
где R3 - водород, алкил с 1-8 атомами углерода, циклоалкил с 3-7 атомами углерода, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,
R4 - водород, алкил с 1-8 атомами углерода, циклоалкил с 3-7 атомами углерода, циклоалкилметилен с 3-7 атомами углерода в алкильной части, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,
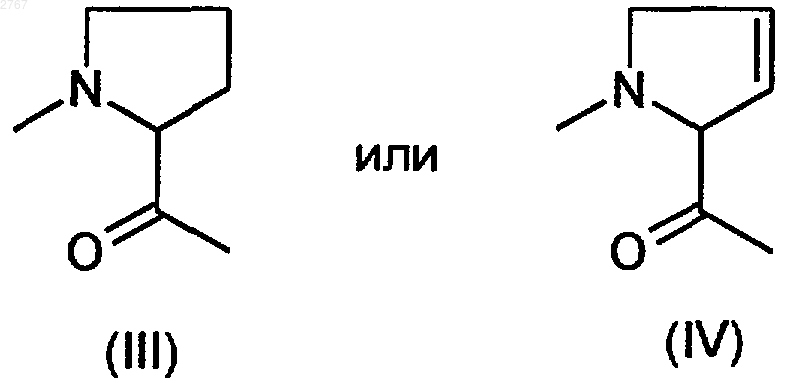
В - циклический остаток a-аминокислоты формулы (III) или (IV)
D - структурный фрагмент формулы (V) или (VI)
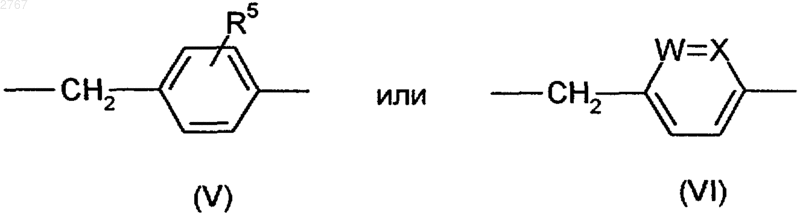
где R5 означает алкокси с 1-6 атомами углерода,
один из радикалов W и Х означает азот, а другой - группу СН,
их стереоизомеры и их соли с физиологически переносимыми кислотами, в которых амидиновая функция может иметься в моно- или бис-защищенной форме.
2. Соединнения формулы (VII)
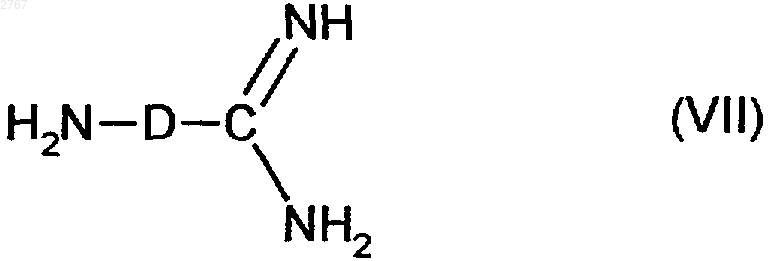
где D имеет указанное в п.1 значение, при этом амидиновая функция может иметься в моно- или бис-защищенной форме.
3. Соединения формулы (VIII)
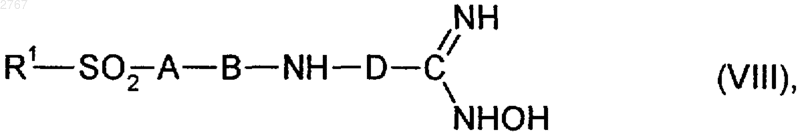
где R1, А, В и D имеют указанное в п.1 значение.
4. Соединения, содержащие структурный фрагмент формулы (IX)
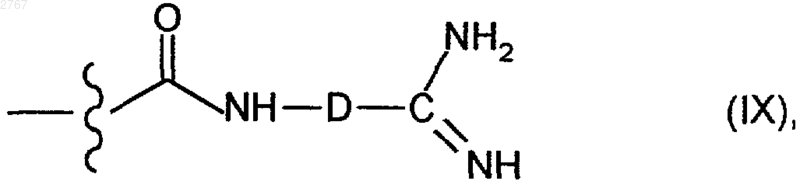
где D имеет указанное в п.1 значение.
5. Ингибиторы тромбина формулы (I) по п.1 для применения при лечении и профилактике тромбинзависящих тромбоэмболических событий.
Евразийский патент действует на территории всех Договаривающихся государств, кроме AM и MD.
Текст
1 Изобретение относится к ингибиторам тромбина, в частности к пептидным ингибиторам тромбина. Международная заявка WO94/29336 описывает пептидные ингибиторы тромбина. Задачей изобретения является расширение ассортимента высокоэффективных пептидных ингибиторов тромбина. Поставленная задача решается предлагаемыми ингибиторами тромбина формулы (I) где R1 - алкил с 1-20 атомами углерода, фенилили нафтилалкил с 1-10 атомами углерода в алкильной части, группа R2OOC-(CH2), где R2 означает водород или алкил с 1-10 атомами углерода,А - остаток -аминокислоты формулы (II) где R3 - водород, алкил с 1-8 атомами углерода,циклоалкил с 3-7 атомами углерода, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,R4 - водород, алкил с 1-8 атомами углерода, циклоалкил с 3-7 атомами углерода, циклоалкилметилен с 3-7 атомами углерода в алкильной части, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,В - циклический остаток -аминокислоты формулы (III) или (IV)D - структурный фрагмент формулы (V) или (VI) где R5 означает алкокси с 1-6 атомами углерода,один из радикалов W и Х означает азот, а другой - группу СН,их стереоизомерами и их солями с физиологически переносимыми кислотами,в которых амидиновая функция может иметься в моно- или бис-защищенной форме. Радикал R1 предпочтительно означает алкил с 1-10 атомами углерода, в частности метил,фенилалкил с 1-4 атомами углерода в алкильной части, в частности бензил и фенэтил, и группуR2OOC(CH2), где R2 означает водород или метил. А предпочтительно означает глицин, аланин, валин, лейцин, изолейцин, фенил- или циклогексилглицин, фенил- или циклогексилаланин, -метилциклогексилаланин, дифенил- или дициклогексилаланин.R5 предпочтительно означает метокси. Дополнительными объектами изобретения являются соединения формул (VII) и (VIII) где R1, А, В и D имеют вышеуказанное значение и в формуле (VII) амидиновая функция может иметься в моно- или бис-защищенной форме,которые представляют собой промежуточные продукты для получения соединений формулы(I). Кроме того, они представляют собой ценные вещества для синтеза ингибиторов серинпротеазы. Дальнейшим объектом изобретения является структурный фрагмент формулы (IX) который представляет собой ценный компонент ингибиторов серинпротеазы и, в частности, ингибиторов тромбина. Соединения формулы (I) могут иметься как таковые или в виде их солей с физиологически переносимыми кислотами, такими как, например, соляная кислота, лимонная кислота,винная кислота, молочная кислота, фосфорная кислота, метансульфокислота, уксусная кислота,муравьиная кислота, малеиновая кислота, фумаровая кислота, янтарная кислота, гидроксиянтарная кислота, серная кислота, глутаровая кислота, аспарагиновая кислота, пировиноградная кислота, бензойная кислота, глюкуроновая кислота, щавелевая кислота, аскорбиновая кислота и ацетилглицин. Как уже указывалось выше, амидиновая функция в соединениях формулы (I) может быть моно- или бис-защищена аминозащитной группой. В качестве защитной группы особенно пригодны бензилоксикарбонильные и третбутилоксикарбонильные группы. То же самое относится к амидиновой функции в соединениях формулы (VII). Соединения формулы (I), которые относятся к категории малотоксичных веществ,можно получать из -аминокислоты Н-А-ОН или N-защищенной циклической аминокислоты В-ОН по схемам (I) или (II). В вышеприведенных схемах R6 означает водород или алкил с 1-4 атомами углерода, R7 алкил с 1-4 атомами углерода, предпочтительно метил или трет-бутил, R8 - группу где Р означет защитную группу, предпочтительно трет-бутоксикарбонил или бензилоксикарбонил. В качестве альтернативы защищенные аминокислоты Р-А-ОН и H-B-OR7 можно сочетать с получением дипептида P-A-B-OR7 и затем после отщепления Р подвергать взаимодействию с группой R1SO2Cl или после отщепленияR7 - с соединениями формулы (VII), причем последовательность реакций может быть любой.R1-SO2-A-OH можно и непосредственно сочетать с с получением целевого продукта (I). Если в вышеуказанных последовательностях реакций применяют амидинсодержащие промежуточные продукты в защищенном виде,то защитную(ые) группу(ы) отщепляют на конечной стадии. Если R8 представляет собой амид, то после образования групп структуры или можно превращать до нитрила и дальше до амидина. Необходимые реакции сочетания осуществляют по стандартным условиям пептидной хи 002767Verlag, 1084). Трет-бутилоксикарбонильные защитные группы отщепляют с помощью смеси соляной кислоты и диоксана или смеси СF3 СООН и хлористого метилена, а бензилоксикарбонильные защитные группы - путем гидрогенолиза или с помощью фтористого водорода. Омыление функций сложных эфиров осуществляют с помощью гидроокиси натрия или гидроокиси лития в среде спиртового растворителя, такого как метанол или этанол. Сложные трет-бутиловые эфиры подвергают омылению кислотами, например, СF3 СООН. Взаимодействие с сульфонилхоридами R1SО 2 Сl в присутствии органического основания,такого как триэтиламин, пиридин или N,Nдиизопропилэтиламин, осуществляют в среде органических растворителей, таких как хлористый метилен, тетрагидрофуран или диметилформамид. В случае свободных функций карбоновой кислоты реакцию осуществляют в присутствии водных растворов гидроокиси или карбоната щелочного металла. Получение амидинов из предшественников нитрила осуществляют по классическому синтезу Пиннера (см. R. Roger и D. G. Neilson в источнике "Chem. Rev." 1961 г., 61, 179) или предпочтительно по модифицированному синтезу Пиннера, в ходе которого в качестве промежуточного продукта получают соли сложных иминотиоэфиров (см. Н. Vieweg и др. в источнике"Pharmazie" 1984 г., 39, 226). Каталитическое гидрирование N-гидроксиамидинов, доступных в результате присоединения гидроксиламина к цианогруппе, никелем Ренея или палладием на угле в среде спиртовых растворителей также приводит к получению амидинов (см. В.J.Broughton и др. в источнике "J. Med. Chem." 1975 г., 18, 1117). Еще одним объектом изобретения являются ингибиторы тромбина вышеприведенной формулы (I) для применения лечения и профилактике тромбинзависящих тромбоэмболических событий. Предлагаемые соединения можно ввести стандартным образом орально или парентерально (подкожно, внутривенно, внутримышечно,внутрибрюшинно, ректально). Введение может также осуществляться с помощью паров или спрей через полость носоглотки. Дозировка зависит от возраста, состояния и веса пациента, а также от вида введения. Суточная доза активного начала на пациента составляет, как правило, около 10-2000 мг при оральной даче и около 1-200 мг при парентеральной даче. Эту дозу можно давать в виде 2-4 разовых доз или раз в сутки в виде депопрепарата. Новые соединения можно применять в виде принятых галенических форм в твердом или 5 жидком виде, например в качестве таблеток,таблеток с пленочным покрытием, капсул, порошков, гранул, драже, суппозиториев, растворов, мазей, кремов или спреев. Их получают стандартным образом. При этом активные начала можно перерабатывать вместе со стандартными галеническими вспомогательными средствами, такими как, например, связывающие вещества, наполнители, консерванты, разрыхлители, регуляторы текучести, смягчители, смачиватели, диспергаторы, эмульгаторы, растворители, средства продленного действия, антиокислители и/или рабочие газы (см. Н. Sucker и др. в источнике "Pharmazeutische Technologie", изд.Thieme-Verlag, Штутгарт, 1978 г.). Полученные таким образом препараты содержат активное начало, как правило, в количестве 0,1-99 вес.%. Пример 1. N-метилсульфонил-(D)-фенилаланилпролин-(2-метокси-4-амидино)-бензиламид в виде ацетата.(а). 3-Нитро-4-метилбензонитрил. К 1 л дымящей азотной кислоты при температуре -10 С в течение 90 мин добавляют 399 г (2,56 моль) 4-метилбензонитрила. Через час после этого смесь подают на 2,5 л ледяной воды. При этом осаждается твердое вещество, которое отделяют с помощью нутч-фильтра и промывают водой до нейтральной реакции. Выход: 363 г (88%). 1(б). 3-Амино-4-метилбензонитрил. 120 г 3-нитро-4-метилбензонитрила суспендируют в 1,2 л этанола и гидрируют в присутствии 7 г 10%-го палладия на угле и 50 л водорода при комнатной температуре. После отделения катализатора растворитель удаляют. Получают 95 г чистого продукта (97%). 1(в). 3-Гидрокси-4-метил-бензонитрил. К 85 г (0,72 моль) 3-амино-4-метилбензонитрила в 1,8 л 6 н. соляной кислоты при температуре 0-5 С в течение 0,5 ч прикапывают раствор 49,2 г (0,72 моль) NaNO2 в 217 мл воды. Потом перемешивают еще 30 мин при 0-5 С и затем еще час при температуре кипения. После охлаждения раствора продукт экстрагируют этилацетатом, после чего продукт в виде фенолата экстрагируют холодной как лед 5 н. гидроокисью натрия. Водную фазу подкисляют с помощью 6 н. соляной кислоты до достижения рН 3, после чего продукт экстрагируют этилацетатом. Получают 41 г (43%) продукта. 1 6 формамида, прикапывают к суспензии 0,11 моль гидрида натрия и 30 мл диметилформамида и перемешивают до прекращения образования Н 2. Потом к смеси прикапывают 10,6 мл (0,17 моль) метилйодида и перемешивают в течение часа при комнатной температуре. Раствор подают на ледяную воду и продукт экстрагируют смесью диэтилового эфира и этилацетата в соотношении 7:1. После отгонки растворителя продукт медленно закристаллизуется. Получают 14,8 г(д). 4-Бромметил-3-метоксибензонитрил. 14,7 г (0,1 моль) 3-метокси-4-метилбензонитрила растворяют в 210 мл 1,2-дихлорэтана, в течение часа порциями бромируют с помощью 19,1 г (0,11 моль) N-бромсукцинимида в присутствии каталитических количеств азобисизобутиронитрила при 82 С, после чего перемешивают еще 30 мин при 82 С. После добавления нгептана отделяют выпавший сукцинимид и растворитель отгоняют. Выход: 18,5 г (82%). 1(е). 4-Фталимидометил-3-метоксибензонитрил. 24,4 г (108 моль) 4-бромметил-3-метоксибензонитрила, растворенного в 125 мл диметилформамида и 20,0 г фталимида калия, перемешивают 24 ч при комнатной температуре и час при 50 С. Смесь подают в воду, при этом продукт выпадает в виде твердого вещества. Получают 21,5 г (68%) продукта. 1(ж). 4-Аминометил-3-метоксибензонитрил. К 21,2 г (73 ммоль) 4-фталимидометил-3 метоксибензонитрила, растворенного в 290 мл тетрагидрофурана, добавляют 10,6 мл гидрата гидразина и перемешивают при комнатной температуре в течение 20 ч. Затем к смеси прикапывают 180 мл 2 н. соляной кислоты и через 1,5 ч растворитель полностью отгоняют. Остаток подают в метил-трет-бутиловый эфир, экстрагируют 1 н. соляной кислотой, доводят до рН 9-10 с помощью 2 н. гидроокиси натрия и экстрагируют хлористым метиленом. Получают 8,0 г(з). Трет-бутилоксикарбонилпролин-(4 циано-2-метокси)бензиламид. 16,0 г (50 ммоль) трет-бутилоксикарбонилпролина, растворенного в 80 мл тетрагидрофурана, перемешивают вместе с 5,7 г гидроксисукцинимида и 10,2 г дициклогексилкарбодии 7 мида в хлористом метилене в течение 30 мин при 0 С. Затем при 0 С к смеси прикапывают 8,0 г (50 ммоль) 4-аминометил-3-метоксибензолнитрила, растворенного в 50 мл тетрагидрофурана, и перемешивают при комнатной температуре в течение 20 ч. Твердое вещество отфильтровывают, фильтрат смешивают с тем же самым объемом этилацетата и промывают холодным 5%-м раствором бикарбоната натрия,а также насыщенным раствором хлористого натрия. Получают 11,5 г (65%) продукта. 1(и). Пролин-(2-метокси-4-циано)бензиламид. 11,4 г (31,7 ммоль) трет-бутилоксикарбонилпролин-(2-метокси-4-циано)бензиламида растворяют в 130 мл хлористого метилена и насыщают соляной кислотой при 0-5 С. Через 2 ч трет-бутилоксикарбонильная группа полностью отщеплена. Растворитель удаляют в вакууме и продукт без дополнительной очистки применяют на следующей стадии. 1(й). Трет-бутилоксикарбонил-(D)-(4-метокси)фенилаланилпролин-(2-метокси-4-циано)бензиламид. 1,55 г (5,25 ммоль) трет-бутилоксикарбонил-(D)-фенилаланин-(4-метокси)гидроксила,3,9 мл диизопропилэтиламина и 1,55 г (5,25 ммоль) гидрохлорида пролин-(2-метокси-4 циано)бензиламида объединяют при -5 С с 4,4 мл (5,9 ммоль) ангидрида пропанфосфоновой кислоты (50%-го в этилацетате) в 35 мл хлористого метилена и перемешивают в течение часа при 0 С. Реакционную смесь последовательно промывают 1 н. гидроокисью натрия, 1 н. соляной кислотой и насыщенным раствором поваренной соли, после чего сушат над сульфатом натрия. После отгонки растворителя получают 2,4 г твердого вещества. 1(к). Дигидрохлорид (D)-(4-метокси)фенилаланилпролин-(2-метокси-4-амидино)бензиламид. Нитрил по известному способу (см. патентDE4121947) подвергают реакции с получением тиоамида, который превращают в амидин. Из нитрила получают 2,2 г тиоамида. 1(м, 4 Н); 1,35-1,10 (с, 9 Н). 2,2 г тиоамида подвергают взаимодействию с метилйодидом и метанольным раствором аммиака, очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и метанола в соотношении 9:1 и получают 1,7 г амидина в виде гидройодида. 1H-ЯМР (ДМСО-d6;в млн.д.): 9,28 (с,2 Н); 8,87 (с, 2 Н); 8,75/7,95 (ст, 1 Н); 7,40-6,65 (м,7 Н, Аr-Н); 4,45-4,10 (м, 4 Н); 3,90 (с, 3 Н); 3,70 (с,3 Н); 3,7-3,4/3,0 - 2,6 (м, 4 Н); 1,95-1,55 (м, 4 Н); 1,30/1,22 (2 с, 9 Н). Гидройодид амидина с помощью ионообменника типа IRA 420 переводят в гидрохлорид амидина, который растворяют в 50 мл хлористого метилена и насыщают соляной кислотой при температуре 0-5 С. После перемешивания в течение часа растворитель отгоняют. Получают 1,0 г амидина в виде дигидрохлорида. Массспектр в результате бомбардировки быстрыми атомами (в дальнейшем: бба"): (M+) = 453 1 Н-ЯМР (ДМСО-d6;в млн.д.): 9,50 (5 шир., 2 Н); 9,25 (с шир., 2 Н); 8,85-8,65 (широкий сигнал, 3 Н); 7,40 (с, 1 Н); 7,35 (д, 1 Н); 7,30 (д,1 Н); 7,15 (д, 2 Н); 6,90 (д, 2 Н); 4,35-4,10 (м, 4 Н); 3,85 (с, 3 Н); 3,75 (с, 3 Н); 3,75-3,55 (м, 2 Н); 3,202,80 (м, 2 Н); 1,90-1,40 (м,4 Н).(л). Ацетат N-метилсульфонил-(D)-(4 метокси)фенилаланилпролин-(2-метокси-4 амидино)бензиламида. К раствору 0,9 г (2 ммоль) вышеуказанного гидрохлорида амидина в 20 мл пиридина при 0 С добавляют 0,23 г (2 ммоль) хлорида метансульфокислоты и перемешивают в течение ночи при комнатной температуре. Растворитель отгоняют и остаток очищают путем колоночной хроматографии с применением в качестве элюента смеси дихлорметана, метанола и 50%-й уксусной кислоты в соотношении 45:5:1,5. Элюат единых фракций отгоняют, к концу с добавлением толуола, и остаток подвергают сублимационной сушке. Получают 0,5 г ацетата в виде белого аморфного порошка. Масс-спектр (бба): 531 (М+). Пример 2. N-метилсульфонил-(D)-фенилаланилпролин-(-метил-4-амидино)бензиламид.(а). N-(п-цианобензил)бензофенонимин. К раствору 150 г (0,8 моль) 97%-го бензофенонимина и 144,8 г (0,74 моль) п-цианобензилбромида в 450 мл ацетонитрила добавляют 270 г (2,0 моль) безводного карбоната калия и перемешивают в течение 6 ч при комнатной температуре. Неорганические соли отсасывают,растворитель почти полностью отгоняют, остаток смешивают с 300 мл воды и несколько раз экстрагируют этилацетатом. Органическую фазу два раза промывают водой, сушат над сульфатом натрия и сгущают досуха. После дигериро 9 вания с диэтиловым эфиром получают 180 г продукта в виде белых кристаллов. Т.п.: 101102 С.(б). 1-(4-Цианофенил)этиламин. К раствору диизопропиламида лития, полученному из 8,15 г (0,08 моль) диизопропиламина и 48,3 мл (0,08 моль) 15%-го раствора бутиллития в гексане, в 100 мл абс. тетрагидрофурана при температуре -70 С прикапывают 20,7 г (0,07 моль) N-(п-цианобензил)бензофенонимина и перемешивают в течение 15 мин. Затем к смеси прикапывают 9,94 г (0,07 моль) метилйодида и температуре реакционной смеси дают повышаться до комнатной температуры. После добавления 100 мл воды несколько раз экстрагируют диэтиловым эфиром, эфирную фазу промывают 5%-м раствором лимонной кислоты, 5%-м раствором бикарбоната натрия и водой, сушат над сульфатом натрия и диэтиловый эфир отгоняют. Остаток растворяют в 150 мл тетрагидрофурана, к раствору добавляют 100 мл 1 н. соляной кислоты и перемешивают в течение ночи при комнатной температуре. Из реакционной смеси в вакууме отгоняют тетрагидрофуран, остающуюся кислотную фазу несколько раз экстрагируют диэтиловым эфиром для удаления бензофенона, после чего кислотную фазу при охлаждении льдом подщелачивают с помощью водного раствора карбоната калия и маслянистое основание экстрагируют хлористым метиленом. Экстракт сушат над карбонатом калия. После удаления хлористого метилена получают 9,7 г (95%) желтоватого масла, которое без дальнейшей очистки используют на следующей стадии.(в). Трет-бутилоксикарбонил-(D)-фенилаланилпролин-(-метил-4-циано)бензиламид. К раствору 3,65 г (25 ммоль) 1-(4 цианофенил)этиламина и 9,1 г (25 ммоль) третбутилоксикарбонил-(D)-фенилаланинпролингидроксила в 150 мл хлористого метилена при температуре -5 С прикапывают 16,2 г диизопропиламина и 22 мл (30 ммоль) ангидрида пропанфосфоновой кислоты (50%-го раствора в этилацетате). Перемешивают 2 ч, при этом температуре дают повышаться с -5 до 20 С. Органическую фазу промывают водой, 5%-м раствором бикарбоната натрия и 5%-м раствором лимонной кислоты, сушат над сульфатом натрия и сгущают досуха. Получают слабо желтоватый кристаллический остаток, который без дальнейшей очистки используют на следующей стадии.(г). Дигидрохлорид (D)-фенилаланилпролин-(-метил-4-амидино)бензиламида. 4,1 г вышеуказанного соединения и 4 мл триэтиламина растворяют в 40 мл пиридина,при 0 С насыщают сероводородом и оставляют стоять в течение ночи при комнатной температуре. Согласно контролю тонкослойной хроматографией с применением в качестве элюента 10 смеси дихлорметана и метанола в соотношении 9:1 конверсия до тиоамида осуществлена полностью. Для выделения тиоамида пиридин почти полностью отгоняют в вакууме, остаток подают в 250 мл этилацетата и промывают раствором поваренной соли, 5%-м раствором лимонной кислоты и раствором бикарбоната натрия. После сушки и отгонки растворителя получают 4,1 г чистого кристаллического тиоамида. Тиоамид растворяют в 150 мл ацетона и после добавки 7 мл метилйодида смесь оставляют стоять при комнатной температуре в течение 6 ч. После удаления растворителя аморфный остаток перемешивают вместе с сухим диэтиловым эфиром и сушат. Гидройодид сложного метилового эфира S-метилтиоимидной кислоты растворяют в 50 мл этанола, смешивают с 15 мл 10%-го раствора ацетата аммония и нагревают до 60 С в течение 3 ч. Для выделения целевого продукта растворитель удаляют, остаток растворяют в 100 мл дихлорметана, нерастворимые компоненты отфильтровывают и дихлорметан отгоняют. В результате дигерирования со смесью этилацетата и диэтилового эфира отделяют растворимые в ней примеси. Остающуюся смесь солей йодида и ацетата растворяют в смеси ацетона и воды в соотношении 3:2,переводят в чистый ацетат с помощью ионообменника типа IRA и подвергают сублимационной сушке. Выделяют белый порошок. Т.п.: 110115 С. Вышеуказанное соединение растворяют в 70 мл дихлорметана и смешивают с 80 мл насыщенного соляной кислотой этилацетата. Через короткое время образуется осадок, к которому добавляют еще диэтиловый эфир. Последний отсасывают, промывают диэтиловым эфиром до полного удаления соляной кислоты и сушат в вакууме. Получают белые кристаллы. Т.п.: 190-195 С. Масс-спектр (бба): 407 (M+).(д). Ацетат N-метилсульфонил-(D)-фенилаланилпролин-(-метил-4-амидино)бензиламида. Целевое соединение получают аналогично примеру 1(д) в виде белого аморфного порошка. Масс-спектр (бба): 485 (М+). Пример 3. N-Метилсульфонил-(D)-циклогексилаланилпролин-(2-метокси-4-амидино)бензиламид. Аналогично примеру 1(й) 1,70 г (6,26 ммоль) трет-бутилоксикарбонил-(D)-циклогексилаланингидроксила с помощью 1,85 г (6,26 ммоль) гидрохлорида пролин-(2-метокси-4 циано)бензиламида (пример 1(и конденсируют до получения 2,7 г трет-бутилоксикарбонил-(D)циклогексилаланинпролин-(2-метокси-4-циано)бензиламида, после чего трет-бутилоксикарбонильную защитную группу в дихлорметане отщепляют хлористо-водородным газом. 2,0 г (4,45 ммоль) гидрохлорида Н-(D)циклогексилаланинпролин-(2-метокси-4-циано)бензиламида в 40 мл дихлорметана и 8,9 ммоль 11 диизопропилэтиламина при температуре 0 С подвергают взаимодействию с 0,7 мл метилсульфонилхлорида с получением 2,0 г соответствующего сульфонамида. Нитрил по известному способу (см. патентDE4121947) через стадию тиоамида переводят в амидин. После превращения гидройодида амидина до гидроацетата амидина (см. пример 4(б получают 0,8 г метилсульфонил-(D)-циклогексилаланинпролин-(2-метокси-4-амидино)бензиламида, который аналогично примеру 1(л) очищают путем колоночной хроматографии. Масс-спектр (бба): (M+H)+ = 496. Пример 4. N-Метилсульфонил-(D,L)-дифенилаланилпролин-(2-метокси-4-амидино)бензиламид.(17,6 ммоль) гидрохлорида Н-пролин-(2 метокси-4-циано)бензиламида подвергают реакции аналогично примеру 1(й), после чего продукт очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и 4,5%-го метанола. Получают 5,6 г продукта. 1(1 Н, NH, (2 диастереомера или же ротамера; 7,5-6,9 (14 Н); 5,35-4,95 (м, 1 Н); 4,5-4,1 (3 Н); 4,03,0 (3 Н); 3,90 и 3,85 (с, 3 Н (2 диастереомера; 2,1-1,1 (13 Н).(б). Метилсульфонил-(D,L)-дифенилаланилпролин-(2-метокси-4-амидино)бензиламид. 3,55 г (6,0 ммоль) трет-бутилоксикарбонилзащищенного соединения примера 4(а) в 30 мл дихлорметана с помощью хлористоводородного газа расщепляют на 3,1 г гидрохлорида Н-(D,L)-дифенилаланинпролин-(2 метокси-4-циано)бензиламида и 1,5 г (2,9 ммоль) этого гидрохлорида в 30 мл дихлорметана и 1,1 мл диизопропилэтиламина при 0 С перемешивают вместе с 0,24 мл метилсульфонилхлорида в течение 2 ч. Органическую фазу промывают 0,5 н. соляной кислотой, водой и насыщенным раствором хлористого натрия, после чего сушат, и продукт очищают путем колоночной хроматографии на силикагеле с применением в качестве элюента смеси дихлорметана и 5%-го метанола. Получают 1,15 г метилсульфонил-(D,L)дифенилаланилпролин-(2-метокси-4-циано)бензиламида. 1,15 г (2,1 ммоль) этого нитрила по известному способу (см. патент DE4121947) через стадию тиоамида переводят в амидин. Получают 1,3 г тиоамида и 0,95 г гидройодида амидина, который с помощью ионообменника типа 12 дино)бензиламида с 95%-й чистотой (в результате высокопроизводительной жидкостной хроматографии). Масс-спектр (бба): (M+H)+= 578. Пример 5. Ацетат N-метилсульфонил-(D)фенилаланилпролин-(6-амидино)-3-пиколиламида.(а). 2-Циано-5-(азидометил)пиридин. К раствору 8,8 г (0,07 ммоль) 2-циано-5(гидроксиметил)пиридина (см. международную заявку WO83/01446) и 6,9 г триэтиламина в 200 мл хлористого метилена при комнатной температуре прикапывают 14,5 г (0,07 моль) ангидрида трифторуксусной кислоты, растворенного в 20 мл хлористого метилена, после чего перемешивают в течение 2 ч. Хлористый метилен отгоняют, остаток растворяют в смеси 50 мл толуола и 50 мл диметилсульфоксида,смешивают с 11,2 г (0,17 моль) азида натрия и 0,7 г бромида тетрабутиламмония и перемешивают при комнатной температуре в течение ночи. Реакционную смесь подают в 300 мл воды и несколько раз экстрагируют диэтиловым эфиром. Продукт сушат над сульфатом натрия, диэтиловый эфир отгоняют и получают 6,8 г желтоватых кристаллов, которые без дальнейшей очистки подают на следующую реакцию.(б). 2-Циано-5-(аминометил)пиридин. Полученное по стадии (а) соединение растворяют в 45 мл тетрагидрофурана и 1,2 мл воды и при перемешивании порциями смешивают с 11,2 г трифенилфосфина. Реакционную смесь оставляют стоять в течение ночи при комнатной температуре. После отгонки растворителя остаток подают в 100 мл диэтилового эфира, выпавший трифенилфосфиноксид отсасывают и фильтрат доводят до рН = 2 с помощью эфирной соляной кислоты. Выпавший гидрохлорид отсасывают,промывают диэтиловым эфиром и дигерируют последовательно с толуолом и горячим изопропанолом. Отделяют 4,7 г (40%) гидрохлорида. Т.п.: 253-256 С (разл.).(в). трет-Бутилоксикарбонил-(D)-фенилаланилпролин-(6-циано)-3-пиколиламид. К раствору 2,11 г (12,5 ммоль) 2-циано-5(аминометил)пиридина и 4,5 г (12,5 ммоль) трет-бутилоксикарбонил-D-фенилаланинпролингидроксила в 70 мл дихлорметана при температуре -5 С прикапывают 8,12 г диизопропилэтиламина и потом 11 мл (15 ммоль) ангидрида пропанфосфоновой кислоты (50%-го раствора в этилацетате). Перемешивают 2 ч, при этом температуре дают повышаться от -5 до 20 С. Органическую фазу промывают водой, 5%-м раствором бикарбоната натрия и 5%-м раствором лимонной кислоты, сушат над сульфатом натрия и сгущают досуха. Получают слабо желтоватый кристаллический остаток, который без дальнейшей очистки подают на следующую реакцию. Т.п.: 167-170 С.(г). N-Метилсульфонил-(D)-фенилаланилпролин-(6-амидино)-3-пиколиламидацетат. Вышеуказанное соединение растворяют в 100 мл изопропанола, смешивают с раствором 2,3 г соляной кислоты в 20 мл изопропанола и нагревают до 50 С в течение 5 ч, при этом гидрохлорид более не защищенного соединения отделяется. Гидрохлорид отсасывают и холодным изопропанолом промывают до полного удаления соляной кислоты. 2,5 г (6,5 ммоль) указанного гидрохлорида суспендируют в 50 мл дихлорметана. После добавления 1,35 г (13,5 ммоль) триэтиламина получают раствор, к которому при температуре 0-5 С прикапывают 0,7 г(6,1 ммоль) хлорида метансульфоновой кислоты, растворенного в 10 мл дихлорметана. Реакционную смесь перемешивают в течение 5 ч при комнатной температуре, после чего ее встряхивают вместе с водой, 5%-м раствором лимонной кислоты и 5%-м раствором бикарбоната натрия. Сушат над сульфатом натрия, растворитель отгоняют и выкристаллизуют вязкий, маслянистый остаток из смеси этилацетата и диэтилового эфира в соотношении 1:1. 4,1 г вышеуказанного соединения и 4 мл триэтиламина растворяют в 40 мл пиридина,при 0 С насыщают сероводородом и дают стоять в течение ночи при комнатной температуре. Согласно контролю тонкослойной хроматографией с применением в качестве элюента смеси дихлорметана и метанола в соотношении 9:1 конверсия до тиоамида осуществлена полностью. Для выделения тиоамида пиридин почти полностью отгоняют в вакууме, остаток подают в 250 мл этилацетата и промывают раствором поваренной соли, 5%-м раствором лимонной кислоты и раствором бикарбоната натрия. После сушки и отгонки растворителя получают 4,1 г чистого кристаллического тиоамида. Тиоамид растворяют в 150 мл ацетона и после добавки 7 мл метилйодида оставляют стоять при комнатной температуре в течение 6 ч. Растворитель отгоняют, аморфный остаток размешивают в среде сухого диэтилового эфира и сушат. Гидройодид сложного метилового эфираS-метилтиоимидной кислоты растворяют в 50 мл этанола, смешивают с 15 мл 10%-го раствора ацетата аммония и нагревают до 60 С в течение 3 ч. Для выделения продукта растворитель отгоняют, остаток растворяют в 100 мл дихлорметана, нерастворимые компоненты отфильтровывают и потом дихлорметан отгоняют. Путем дигерирования со смесью этилацетата и диэтилового эфира отделяют растворимые в ней примеси. Остающуюся смесь солей йодида и ацетата растворяют в смеси ацетона и воды в соотношении 3:2, переводят в чистый ацетат с помощью ионообменника типа IRA и подвергают сублимационной сушке. Выделяют белый аморфный порошок. Т.п.: 128-137 С. Масс-спектр (бба): 473 (M+H+).(а). трет-Бутилоксикарбонил-(D)-циклогексилглицилпролин. 29 г (0,113 моль) трет-бутилоксикарбонил(D)-циклогексилглицина и 18,7 г (0,113 моль) гидрохлорида сложного пролинметилового эфира суспендируют в 300 мл дихлорметана и прикапыванием 58,3 г (0,45 моль) диизопропилэтиламина переводят в раствор. После охлаждения до -15 С к раствору прикапывают 113 мл(0,147 моль) ангидрида пропанфосфоновой кислоты (50%-го раствора в этилацетате) и перемешивают в течение часа. После добавления 200 мл воды органическую фазу отделяют и промывают водным раствором карбоната калия, 0,5 н. соляной кислотой и 5%-м раствором бикарбоната. Сушат над сульфатом натрия, растворитель отгоняют, маслянистый остаток (41 г) растворяют в 400 мл этанола, смешивают с 120 мл 1 н. гидроокиси натрия и перемешивают 2 ч при комнатной температуре. После отгонки спирта водную фазу разбавляют водой и несколько раз экстрагируют метил-трет-бутиловым эфиром. Водную фазу подкисляют раствором гидросульфата калия и три раза экстрагируют дихлорметаном. После сушки и отгонки хлористого метилена к маслянистому остатку добавляют смесь диизопропилового эфира и н-гексана в соотношении 1:3. При этом получают 28 г белых кристаллов. Т.п.: 145-148 С.(б). трет-Бутилоксикарбонил-(D)-циклогексилглицилпролин-(6-циано)-3-пиколиламид. 26,6 г (0,075 моль) трет-бутилоксикарбонил-(D)-циклогексилглицилпролина и 12,7 г (0,075 моль) гидрохлорида 6-циано-3 пиколиламина суспендируют в 300 мл дихлорметана и смешивают с 47 г (0,364 моль) диизопропилэтиламина. При -10 С к смеси прикапывают 66 мл ангидрида пропанфосфоновой кислоты (50%-го раствора этилацетата), при 0 С перемешивают в течение часа, смешивают с 200 мл воды и дихлорметановую фазу отделяют. После промывки органической фазы 0,1 н. натровым щелоком и водой сушат и растворитель отгоняют. Остаток подают в 100 мл этилацетата,причем быстро начинается кристаллизация, которую добавкой 150 мл н-гексана завершают. Отсасывают, сушат и получают 31,4 г (89% теории) белых кристаллов. Т.п.: 150-151 С.(в). Ацетат N-метилсульфонил-(D)-циклогексилглицилпролин-(6-амидино)-3-пиколиламида. Аналогично примеру 5(г) из вышеуказанного трет-бутилоксикарбонильного соединения отщепляют защитную группу, подвергают взаимодействию с хлоридом метансульфокислоты и цианогруппу переводят в амидин. Ацетат выде 15 ляют в виде белых кристаллов. Т.п.: 250-256 С(а). 5-Карбоксамидо-2-пиколиламин. К раствору 3,5 г (24 ммоль) 2-циано-5 карбоксамидопиридина в 80 мл метанола и 20 мл конц. аммиака добавляют 3 г никеля Ренея и гидрируют при комнатной температуре. Приблизительно через 7 ч водород полностью поглощен. После отсасывания катализатора фильтрат сгущают и остаток растворяют в 20 мл 2 н. соляной кислоты и 20 мл метанола. В результате добавления 150 мл этилацетата отделяется гидрохлорид, который отсасывают и сушат (3,7 г). Свободное основание расплавляется при 198202 С.(б). 5-Циано-2-пиколиламин. 41 г (0,22 моль) 5-карбоксамидо-2 пиколиламина суспендируют в 150 мл метанола и 300 мл хлористого метилена, охлаждают до 10 С и добавлением 150 мл триэтиламина переводят в раствор. Затем прикапывают раствор 47,6 г (0,22 моль) (Вос)2O и перемешивают в течение 4 ч при комнатной температуре. После отгонки растворителя остаток смешивают с насыщенным раствором карбоната калия и 5 раз экстрагируют хлористым метиленом. Объединенные экстракты сушат и растворитель отгоняют, к концу при добавлении толуола. 5,4 г остатка суспендируют в 40 мл диоксана и 15 мл хлористого метилена, смешивают с 4,3 г пиридина, после чего при 0 С прикапывают 5,2 г ангидрида трифторуксусной кислоты. При этом образуется прозрачный раствор. После добавления 100 мл воды экстрагируют этилацетатом, органическую фазу промывают разбавленной лимонной кислотой, раствором бикарбоната натрия и водой. После сушки и отгонки растворителя получают около 5 г желтого масла, которое растворяют в 15 мл изопропанола и 30 мл этилацетата, после чего смешивают с 35 мл эфирного раствора соляной кислоты. Смесь оставляют стоять в течение ночи, потом выпавший гидрохлорид отсасывают и сушат. Получают 4 г белых кристаллов. Т.п.: 230234 С.(а). трет-Бутилоксикарбонил-3,4-дегидропролин-(6-карбоксамидо)-3-пиколиламид. 5,0 г (23,4 ммоль) трет-бутилоксикарбонил-3,4-дегидропролина вместе с 5,25 г дигидрохлорида 6-карбоксамидо-3-пиколиламина и 32,1 мл (187 ммоль) диизопропилэтиламина суспендируют в 50 мл дихлорметана и при 05C при перемешивании каплями смешивают с 23,5 мл ангидрида пропанфосфоновой кислоты(50%-го раствора в этилацетате), после чего перемешивают в течение ночи при комнатной температуре. Раствор разбавляют дихлорметаном до получения 150 мл, экстрагируют последовательно 20%-м раствором бисульфата натрия и 5%-м раствором лимонной кислоты, сушат над сульфатом натрия и упаривают в ротационном испарителе. Водные фазы еще три раза экстрагируют дихлорметаном, органическую фазу сушат, упаривают в ротационном испарителе и вместе с целевым продуктом без дальнейшей очистки подают на следующую реакцию.(б). Гидрохлорид Н-3,4-дегидропролин-(6 карбоксамидо)-3-пиколиламида. Сырой продукт стадии (а) растворяют в 100 мл дихлорметана и после добавки 10 мл 5-м. соляной кислоты в среде диэтилового эфира перемешивают в течение 2 ч при комнатной температуре (контроль тонкослойной хроматографией). После полного упаривания в ротационном испарителе в вакууме перегоняют в присутствии толуола в вакууме и сырой продукт перекристаллизуют из 200 мл этанола. При этом получают 5,03 г и в результате сгущения маточного раствора еще 0,3 г продукта (80,4% теории). После элементарного анализа продукт имеется в качестве моногидрохлорида.(в). трет-Бутилоксикарбонил-(D)-циклогексилаланил-3,4-дегидропролин-(6-карбоксамидо)-3-пиколиламид. 5,06 г (18,66 ммоль) трет-бутилоксикарбонил-(D)-циклогексилаланина перемешивают вместе с 5,28 г (18,66 ммоль) гидрохлорида Н 3,4-дегидропролин-(6-карбоксамидо)-3-пиколиламида и 9,55 мл (56 ммоль) диизопропилэтиламина в 75 мл дихлорметана, после чего при 05 С к смеси каплями добавляют 18,6 мл ангидрида пропанфосфоновой кислоты (50%-го раствора в этилацетате). Перемешивают при комнатной температуре в течение ночи, при этом выпадает осадок. После отсасывания осадка, 5 кратного экстрагирования раствора 5%-й лимонной кислотой, взятой в количестве по 25 мл,(согласно тонкослойной хроматографии в орга 17 нической фазе более не имеется диизопропилэтиламина) органическую фазу несколько раз промывают насыщенным раствором бикарбоната натрия, сушат над сульфатом натрия и сгущают в вакууме. Для минимизации количества побочного продукта, пропанфосфоновой кислоты, остаток подают в этилацетат, несколько раз экстрагируют насыщенным раствором гидрокарбоната, сушат над сульфатом натрия и упаривают в ротационном испарителе. Выход: 7,0 г(г). трет-Бутилоксикарбонил-(D)-циклогексилаланил-3,4-дегидропролин-(6-циано)-3-пиколиламид. 7,0 г (14 ммоль) трет-бутилоксикарбонил(D)-циклогексилаланил-3,4-дегидропролин-(6 карбоксамидо)-3-пиколиламида растворяют вместе с 9,5 мл (56 ммоль) диизопропилэтиламина в 100 мл хлористого метилена, охлаждают до температуры 0-5 С, после чего каплями смешивают с 3,5 мл (25,2 ммоль) ангидрида трифторуксусной кислоты. После перемешивания в течение 2 ч при комнатной температуре исходное соединение полностью превращено (контроль тонкослойной хроматографией). Потом раствор три раза экстрагируют 20%-м раствором сульфата нитрия, три раза - насыщенным раствором бикарбоната натрия и один раз - насыщенным раствором поваренной соли. Сушат над сульфатом натрия и упаривают в ротационном испарителе. Выход: 6,6 г (98% теории).(д). Н-(D)-циклогексилаланил-3,4-дегидропролин-(6-циано)-3-пиколиламид. 6,6 г (13,75 ммоль) трет-бутилоксикарбонил-(D)-циклогексилаланил-3,4-дегидропролин-(6-циано)-3-пиколиламида растворяют в 15 мл изопропанола, смешивают с 12,5 мл 4 н. изопропанольного раствора соляной кислоты и перемешивают в течение 2 ч при 40 С (контроль тонкослойной хроматографией). Реакционную смесь сгущают в вакууме, остаток подают в воду, раствор три раза экстрагируют диэтиловым эфиром, водную фазу с помощью 20%-го натрового щелока доводят до рН = 9 и несколько раз экстрагируют дихлорметаном. Органическую фазу промывают насыщенным раствором поваренной соли, сушат над сульфатом натрия и упаривают в ротационном испарителе в вакууме. Выход: 4,3 г (82% теории).(ж). Метилсульфонил-(D)-циклогексилаланил-3,4-дегидропролин-(6-амидино)-3-пиколиламид. Соединение получают аналогично примеру 5(г) из метилсульфонил-(D)-циклогексилаланил 3,4-дегидропролин-(6-циано)-3-пиколиламида через стадию тиоамида и гидройодида сложного 18 метилового эфира S-метилтиоимидной кислоты. Выделяют белый аморфный порошок. Масс-спектр (бба) (М+Н)+=477 Т.пл.: 175-176 С. Пример 9. N-метилсульфонил-(D)-циклогексилглицил-3,4-дегидропролин-(6-амидино)3-пиколиламидацетат. Получение этого соединения осуществляют аналогично примеру 8. Получают белый аморфный порошок. Масс-спектр (бба) (М+Н)+=463. Пример 10. N-(Гидроксикарбонилметилен)сульфонил-(D)-циклогексилглицилпролин(6-амидино)-3-пиколиламид. Н-(D)-циклогексилглицилпролин-(6-циано)-3-пиколиламид примера 6(б) подвергают взаимодействию с хлоридом метоксикарбонилметиленсульфокислоты (см. источник "Tetrahedron Letters" 30, 2869, 1989 г.) с получением соответствующего сульфонамида. Функцию нитрила по известным способам (см. патент DE4121947) через стадию тиоамида переводят в амидиновую группу. Полученный при этом N-(метоксикарбонилметилен)сульфонил-(D)-циклогексилглицилпролин-(6-циано)-3-пиколиламид для гидролиза функции сложного эфира нагревают в смеси 4 н. соляной кислоты и диоксана при 80 С (контроль тонкослойной хроматографией), раствор сгущают, остаток очищают путем обратнофазной высокопроизводительной жидкостной хроматографии и водные фазы лиофилизуют. Получают аморфный порошок. Масс-спектр (бба): (М+Н)+= 509. Биологическая активность соединений согласно изобретению иллюстрируется результатами следующего опыта. Опыт. Крысам орально давали исследуемые соединения. За два дня до начала опыта в сонную артерию крыс вводили катетер для отбора крови. Через день после начала опыта в установленные моменты брали кровь, которую подавали в пластмассовые емкости, содержащие 1 ч.(0,13 ммоль/л) раствора цитрата натрия и 9 вес. ч. крови. Емкости центрифугировали с получением бедной тромбоцитами плазмиды. 100 мкл обработанной цитратом плазмы инкубировали при 37 С в течение 2 мин, после чего добавляли 100 мкл подогретого до 37 С реактива фирмы Берингер Маннхейм, DE и определяли время до образования сгустков. Исследуемые соединения и их активность ингибирования тромбина в мкмоль сведены в следующей таблице. Таблица Исследуемое соединение примера 4 5 6 7 8 19 Сравнение соединение примера 4 заявки WO 94/29336 Соединения примеров 1-3, 9 и 10 проявляют аналогичную активность ингибирования тромбина. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Ингибиторы тромбина формулы (I) где R1 - алкил с 1-20 атомами углерода, фенилили нафтилалкил с 1-10 атомами углерода в алкильной части, группа R2OOC-(CH2), где R2 означает водород или алкил с 1-10 атомами углерода,А - остаток -аминокислоты формулы (II) где R3 - водород, алкил с 1-8 атомами углерода,циклоалкил с 3-7 атомами углерода, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,R4 - водород, алкил с 1-8 атомами углерода, циклоалкил с 3-7 атомами углерода, циклоалкилметилен с 3-7 атомами углерода в алкильной части, фенил и нафтил, незамещенные или замещенные алкилом или алкоксилом, каждый с 1-4 атомами углерода, или фенил- или нафтилалкил с 1-3 атомами углерода в алкильной части,В - циклический остаток -аминокислоты формулы (III) или (IV)D - структурный фрагмент формулы (V) или (VI) где R5 означает алкокси с 1-6 атомами углерода,один из радикалов W и Х означает азот, а другой - группу СН,их стереоизомеры и их соли с физиологически переносимыми кислотами, в которых амидиновая функция может иметься в моно- или бисзащищенной форме. 2. Соединения формулы (VII) где D имеет указанное в п.1 значение, при этом амидиновая функция может иметься в моноили бис-защищенной форме. 3. Соединения формулы (VIII) где R1, А, В и D имеют указанное в п.1 значение. 4. Соединения, содержащие структурный фрагмент формулы (IX) где D имеет указанное в п.1 значение. 5. Ингибиторы тромбина формулы (I) по п.1 для применения при лечении и профилактике тромбинзависящих тромбоэмболических событий. Евразийский патент действует на территории всех Договаривающихся государств, кроме
МПК / Метки
МПК: A61P 7/02, A61K 38/55, C07K 5/06
Метки: тромбина, ингибиторы
Код ссылки
<a href="https://eas.patents.su/11-2767-ingibitory-trombina.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы тромбина</a>
Предыдущий патент: S-замещенные тиоловые эфиры 11&beta-бензальдоксимэстра-4,9-диенугольной кислоты, способ их получения и содержащие эти соединения фармацевтические композиции
Следующий патент: Пиразоло [3,4 - d] пиримидины с противоконвульсивным, противоаллергическим / противоастматическим действием
Случайный патент: Установка и способ сепарации конденсата газа из углеводородных смесей высокого давления












