Ингибиторы вирусной полимеразы
Номер патента: 13207
Опубликовано: 30.04.2010
Авторы: Тсантризос Йоула С., Брошу Кристиан, Больё Пьерр, Стаммерс Тимоти А., Пуарье Мартин, Тхавонекхам Боункхам, Ранкур Жан, Шабо Катрин
Формула / Реферат
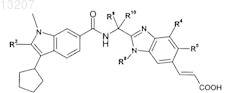
1. Соединение формулы (I) или его энантиомер, диастереоизомер или таутомер, включая его соль или сложный эфир
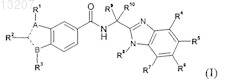
в которой один из А или В обозначает N, а другой В или А обозначает С, где ---- между двумя атомами С обозначает двойную связь и ----- между атомом С и атомом N обозначает ординарную связь; и
R1 обозначает Н или (С1-С6)алкил;
R2 выбран из группы, включающей арил и Het; указанные арил и Het необязательно замещены с помощью R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С1-С6)алкил, (С1-С6)алкоксигруппу и NH2;
R3 обозначает (С5-С6)циклоалкил, необязательно замещенный 1-4 атомами галогена;
R4 выбран из Н и галогена;
R7 представляет Н;
один из R5и R6 выбран из группы, включающей Het и (С2-С6)алкенил, где указанные Het и (С2-С6)алкенил, каждый необязательно, замещены R50, где R50 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей (С1-С6)алкил, -СООН, оксогруппу, гидроксигруппу и NH2;
а другой из R5 и R6выбран из группы, включающей Н, (С1-С6)алкил и (C1-С6)алкоксигруппу;
R8 обозначает (С1-С6)алкил;
R9 и R10, каждый независимо, выбраны из группы, включающей (С1-С6)алкил; или
R9 и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С3-С7)циклоалкил или (С5-С7)циклоалкенил, где указанные циклоалкил или циклоалкенил в каждом случае необязательно содержат в качестве заместителей (С1-С4)алкил;
где Het определяется, как 4-, 5-, 6- или 7-членный гетероцикл, содержащий от 1 до 4 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бигетероцикл, содержащий от 1 до 5 гетероатомов, если это возможно, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим.
2. Соединение по п.1 формулы (Ia)
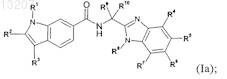
в которой R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 являются такими, как определено в п.1.
3. Соединение по п.1 формулы (Ib)

в которой R1, R2, R3, R4, R5, R6, R7, R8, R9 и R10 являются такими, как определено в п.1.
4. Соединение по одному из предыдущих пунктов, в котором R1выбран из группы, включающей Н, метил и этил.
5. Соединение по одному из предыдущих пунктов, в котором R2выбран из группы, включающей фенил и Het, выбранный из группы формул
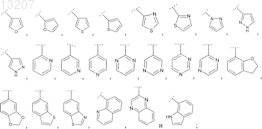
где указанные фенил и Het являются незамещенными или замещены R21, в которой R21 является таким, как определено в п.1.
6. Соединение по п.5, в котором R2 выбран из группы, включающей фенил и Het, выбранный из группы формул

где указанные фенил и Het являются незамещенными или замещены R21.
7. Соединение по одному из предыдущих пунктов, в котором R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу и NH2.
8. Соединение по п.7, в котором R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор и бром, метил, этил, пропил, 1-метилэтил, метокси-, этокси-, пропокси-, 1-метилэтоксигруппу и -NH2.
9. Соединение по одному из предыдущих пунктов, в котором R3 обозначает циклопентил или циклогексил, каждый из которых необязательно замещен 1 или 2 атомами фтора.
10. Соединение по одному из предыдущих пунктов, в котором R4 обозначает Н или Cl и R7 обозначает Н.
11. Соединение по одному из предыдущих пунктов, в котором один из R5 и R6 выбран из группы, включающей:
а) (С2-С4)алкенил, замещенный СООН, и Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:
i) СООН;
ii) (С1-С3)алкил и
iii) -NH2,
где Het обозначает 5- или 6-членный моноциклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S; и
другой из R5 и R6выбран из Н, (С1-С3)алкила и (С1-С3)алкоксигруппы.
12. Соединение по п.11, в котором один из R5 и R6 выбран из группы, включающей:
a) (С2-С4)алкенил, замещенный СООН; и
b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:
i) СООН;
ii) (С1-С3)алкил и
iii) -NH2,
где Het выбран из формул
![]()
и другой из R5 и R6выбран из группы, включающей Н, метил, метоксигруппу и этоксигруппу.
13. Соединение по п.12, в котором один из R5 и R6 выбран из группы, включающей:
a) -СН=СН-СООН и
b) Het, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей:
i) COOH;
ii) метил или этил и
iii) -NH2,
где Het выбран из формул
![]()
и другой из R5 и R6выбран из группы, включающей Н, метил, метоксигруппу и этоксигруппу.
14. Соединение по одному из предыдущих пунктов, в котором R8 представляет (С1-С5)алкил.
15. Соединение по п.14, в котором R8 выбран из группы, включающей метил, этил, пропил, 1-метилэтил, 2-метилпропил и 3-метилбутил.
16. Соединение по одному из предыдущих пунктов, в котором R9и R10, каждый независимо, выбраны из группы, включающей (С1-С3)алкил, или R9и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С3-С6)циклоалкил, (С5-С6)циклоалкенил; где указанные циклоалкил или циклоалкенил, каждый необязательно, замещены (С1-С4)алкилом.
17. Соединение по п.16, в котором группа ![]() выбрана из группы, включающей
выбрана из группы, включающей
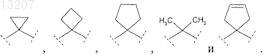
18. Соединение по п.1 формулы (I), в которой
один из А или В обозначает N, а другой В или А обозначает С, где ---- между двумя атомами С обозначает двойную связь и ---- между атомом С и атомом N обозначает ординарную связь; и
R1 обозначает Н или (С1-С6)алкил;
R2 обозначает арил или Het; указанные арил и Het необязательно замещены R21;
где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С1-С6)алкил и (С1-С6)алкоксигруппу;
R3 обозначает (С5-С6)циклоалкил, необязательно замещенный 1-4 атомами галогена;
R4 и R7, каждый независимо, представляют собой Н;
один из R5и R6 выбран из группы, включающей Het и (С2-С6)алкенил, где Het и (С2-С6)алкенил необязательно замещены R50;
в которой R50 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей (С1-С6)алкил, -СООН и -NH2;
а другой из R5 и R6выбран из группы, включающей Н, (С1-С6)алкил и (С1-С6)алкоксигруппу;
R8 обозначает (С1-С6)алкил;
R9 и R10, каждый независимо, выбраны из группы, включающей (С1-С6)алкил; или
R9 и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С3-С7)циклоалкил или (С5-С7)циклоалкенил;
где указанные циклоалкил или циклоалкенил, каждый, необязательно, замещены (С1-С4)алкилом;
где Het определяется как 4-, 5-, 6- или 7-членный гетероцикл, содержащий от 1 до 4 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бигетероцикл, содержащий от 1 до 5 гетероатомов, если это возможно, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим.
19. Соединение по п.1 формулы (I), в которой
R1 выбран из группы, включающей Н, метил и этил;
R2 выбран из группы, включающей фенил и Het, выбранный из группы формул
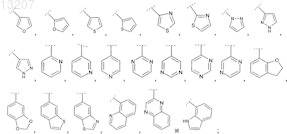
где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С1-С4)алкил, (С1-С4)алкоксигруппу и NH2;
R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен 1-4 атомами фтора;
R4 обозначает Н или галоген и R7 обозначает Н;
один из R5и R6 выбран из группы, включающей:
a) (С2-С4)алкенил, замещенный СООН; и
b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:
i) СООН;
ii) (С1-С3)алкил и
iii) NH2,
где Het обозначает 5- или 6-членный моноциклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, каждый из которых независимо выбран из группы, включающей O, N и S; и
другой из R5 и R6выбран из группы, включающей Н, (С1-С3)алкил и (C1-С3)алкоксигруппу;
R8 представляет собой (С1-С5)алкил и
R9 и R10, каждый независимо, выбраны из группы, включающей (С1-С3)алкил, или
R9 и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С3-С6)циклоалкил или (С5-С6)циклоалкенил; где указанные циклоалкил или циклоалкенил необязательно замещены (С1-С4)алкилом.
20. Соединение по п.1 формулы (I), в которой
R1 выбран из группы, включающей Н, метил и этил;
R2 выбран из группы, включающей фенил и Het, выбранный из группы формул
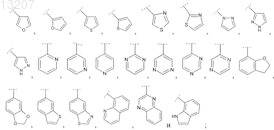
где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор, бром, метил, этил, пропил, 1-метилэтил, метокси-, этокси-, пропокси-, 1-метилэтоксигруппу и NH2;
R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен одним или двумя атомами фтора;
R4 обозначает Н или галоген и R7 обозначает Н;
один из R5и R6 выбран из группы, включающей:
a) (С2-С4)алкенил, замещенный СООН; и
b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:
i) СООН;
ii) (С1-С3)алкил и
iii) -NH2,
где Het выбран из формул
![]()
и другой из R5 и R6выбран из группы, включающей Н, метил, метоксигруппу и этоксигруппу;
R8 выбран из группы, включающей метил, этил, пропил, 1-метилэтил, 2-метилпропил, 3-метилбутил; и
группа ![]() выбрана из группы, включающей
выбрана из группы, включающей
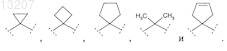
21. Соединение по п.1 формулы (I), в которой R1 выбран из группы, включающей Н, метил и этил; R2 выбран из группы, включающей фенил и Het, выбранный из группы формул
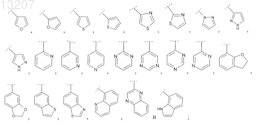
где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор, бром, метил, этил, пропил, 1-метилэтил, метокси-, этокси-, пропокси-, 1-метилэтоксигруппу и NH2;
R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен одним или двумя атомами фтора;
R4 обозначает Н или Cl и R7обозначает Н;
один из R5и R6 выбран из группы, включающей:
a) -СН=СН-СООН и
b) Het, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей:
i) COOH;
ii) метил или этил и
iii) -NH2,
где Het выбран из формул
![]()
и другой из R5 и R6выбран из группы, включающей Н, метил, метоксигруппу и этоксигруппу;
R8 выбран из группы, включающей метил, этил, пропил, 1-метилэтил, 2-метилпропил, 3-метилбутил; и
группа ![]() выбрана из группы, включающей
выбрана из группы, включающей
![]()
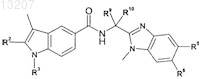
22. Соединение по п.1 формулы
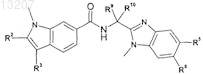
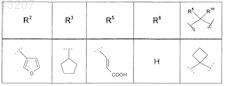
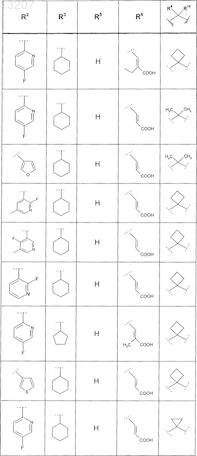
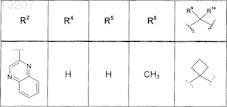
где значения R2, R3, R5, R6, R9 и R10 определены в следующей таблице:
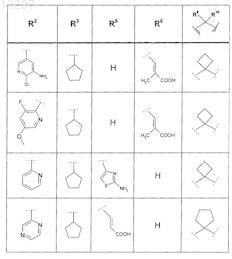
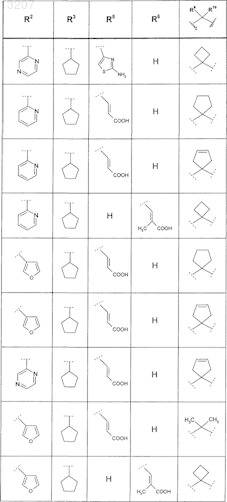
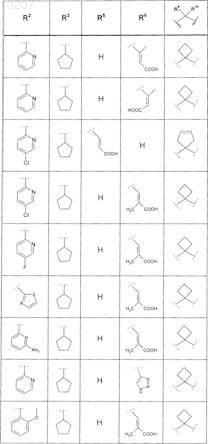
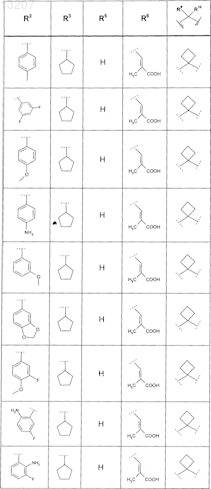
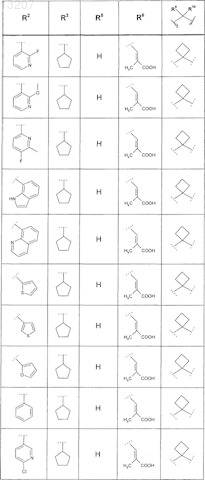
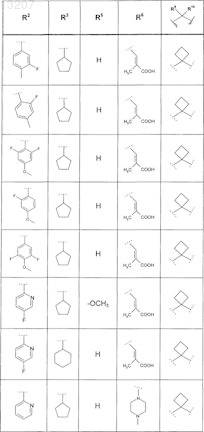
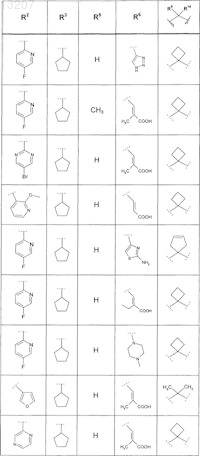
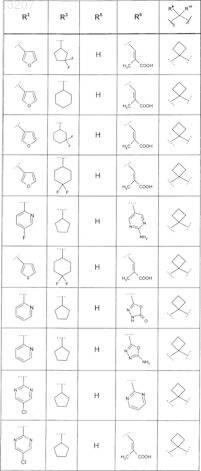

или соединение формулы
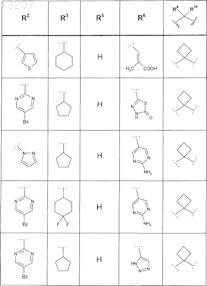
где значения R2, R3, R5, R6, R9 и R10 приведены в следующей таблице:
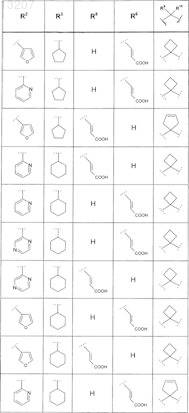
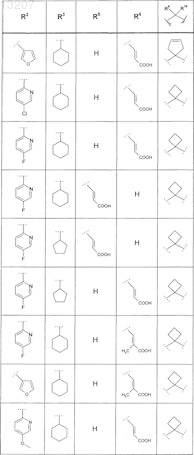
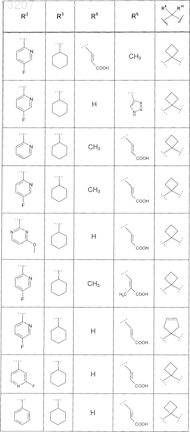
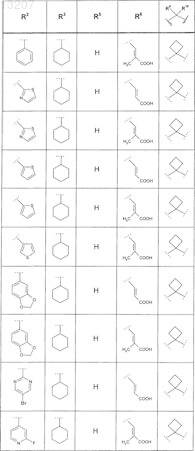
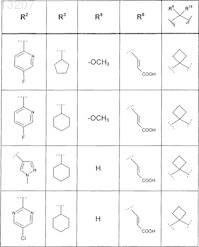
или соединение формулы
где значения R2, R4, R5, R8, R9 и R10 приведены в следующей таблице:
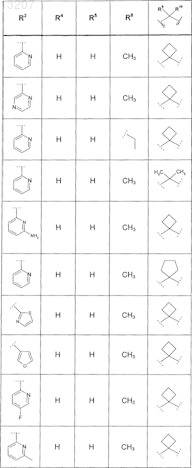
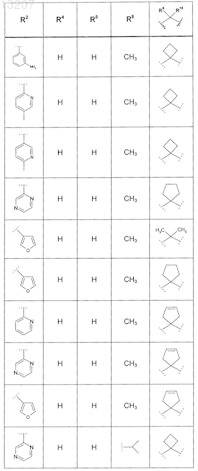
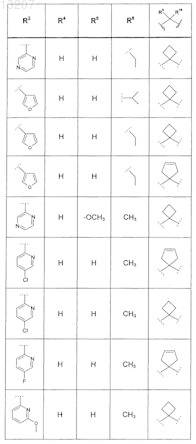
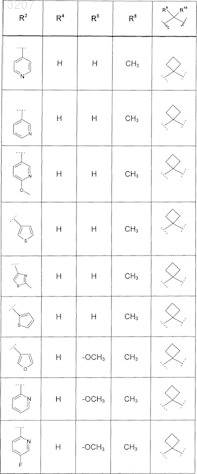
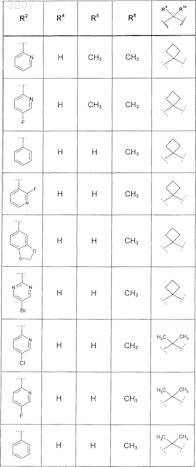
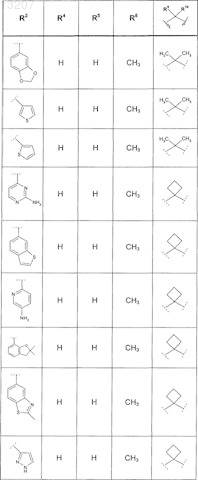
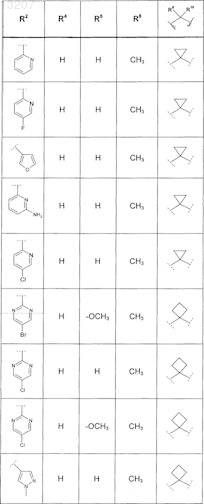
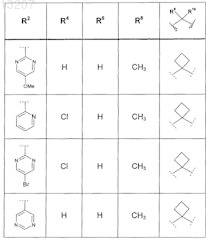
или соединение формулы
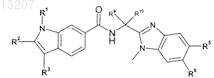
где значения R1, R2, R3, R5, R6, R9и R10 приведены в следующей таблице:
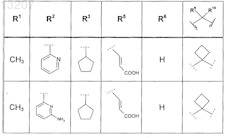
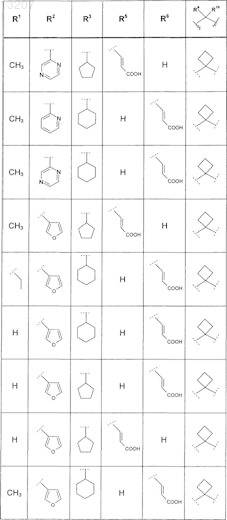
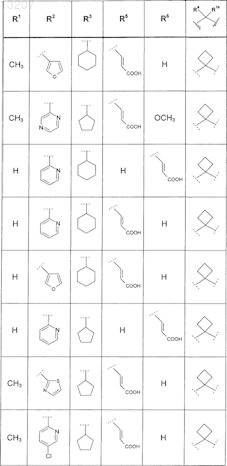

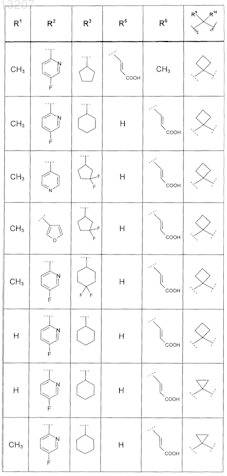
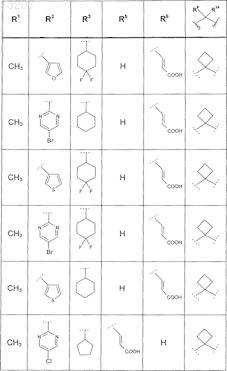
или его фармацевтически приемлемая соль или сложный эфир.
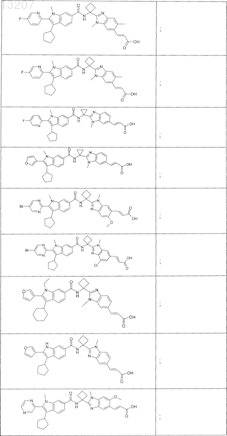
23. Соединение по п.1, выбранное из
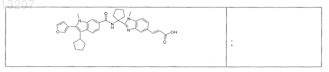
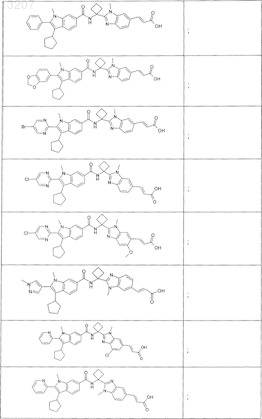
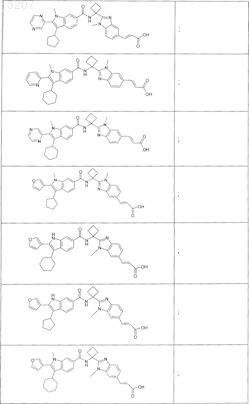

или его фармацевтически приемлемая соль или сложный эфир.
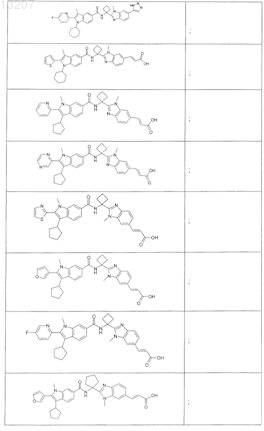
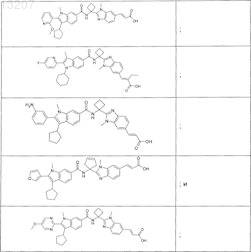
24. Соединение по п.1, выбранное из
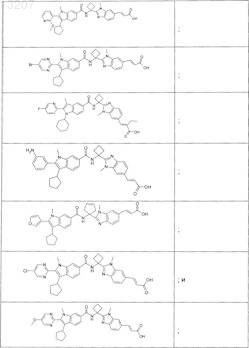
или его фармацевтически приемлемая соль или сложный эфир.
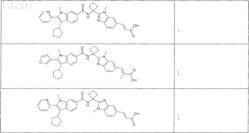
25. Соединение по п.1, выбранное из
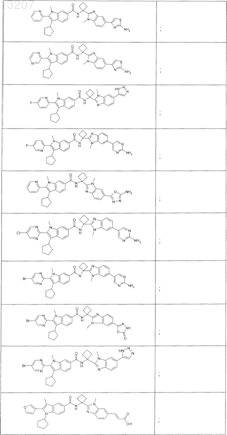

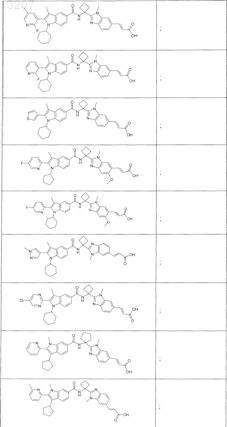
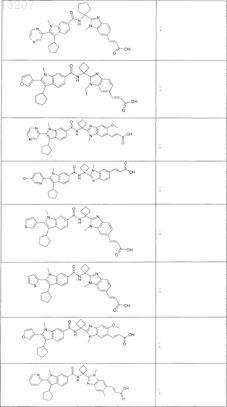
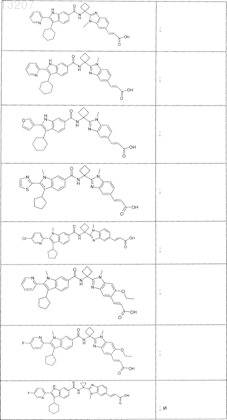
![]()
или его фармацевтически приемлемая соль или сложный эфир.
26. Фармацевтическая композиция, предназначенная для лечения или предупреждения инфекции ВГС, включающая эффективное количество соединения по одному из пп.1-25 или его фармацевтически приемлемой соли, или сложного эфира и фармацевтически приемлемый носитель.
27. Композиция по п.26, дополнительно включающая терапевтически эффективное количество одного или большего количества противовирусных средств.
28. Композиция по п.27, в которой указанное противовирусное средство выбрано из группы, включающей рибавирин и амантадин.
29. Композиция по п.27, в которой противовирусное средство является другим анти-ВГС средством.
30. Фармацевтическая композиция по п.29, в которой другим анти-ВГС средством является иммуномодулирующее средство, выбранное из группы, включающей a-, b-, d-, g-, t- и w-интерферон и их пэгилированные формы.
31. Композиция по п.29, в которой другим анти-ВГС средством является другой ингибитор ВГС полимеразы.
32. Композиция по п.29, в которой другим анти-ВГС средством является ингибитор ВГС NS3 протеазы.
33. Композиция по п.29, в которой другим анти-ВГС средством является ингибитор другой мишени цикла превращения ВГС.
34. Композиция по п.33, в которой указанный ингибитор другой мишени цикла превращения ВГС выбирается из группы, включающей ВГС геликазу, ВГС NS2/3 протеазу и ВГС ААСР и средство, которое оказывает мешающее воздействие на функцию белка NS5A.
35. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира в качестве ингибитора ВГС полимеразы.
36. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира в качестве ингибитора активности РНК-зависимой РНК-полимеразы фермента NS5B, кодируемого ВГС.
37. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира в качестве ингибитора репликации ВГС.
38. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира для предупреждения или лечения инфекции ВГС у млекопитающего.
39. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира для предупреждения или лечения инфекции ВГС у млекопитающего в комбинации с другим противовирусным средством.
40. Способ ингибирования РНК-зависимой РНК-полимеразной активности фермента NS5B, кодируемого ВГС, включающий воздействие на фермент NS5B эффективным количеством соединения по одному из пп.1-25 при условиях, при которых ингибируется РНК-зависимая РНК-полимеразная активность фермента NS5B.
41. Способ ингибирования репликации ВГС, включающий воздействие на клетку, инфицированную посредством ВГС, эффективным количеством соединения по одному из пп.1-25 при условиях, при которых ингибируется репликация ВГС.
42. Способ лечения или предупреждения инфекции ВГС у млекопитающего, включающий введение млекопитающему эффективного количества соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции.
43. Способ лечения или предупреждения инфекции ВГС у млекопитающего, включающий введение млекопитающему эффективного количества соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции в комбинации с другим противовирусным средством.
44. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира для изготовления лекарственного средства, предназначенного для лечения и/или предупреждения вирусной инфекции Flaviviridae.
45. Применение соединения по одному из пп.1-25, или его фармацевтически приемлемой соли, или сложного эфира для изготовления лекарственного средства, предназначенного для лечения и/или предупреждения инфекции ВГС.
46. Упаковка, включающая композицию, эффективную для лечения инфекции ВГС или ингибирования NS5B полимеразы ВГС, и упаковочный материал, включающий этикетку, которая указывает, что композицию можно применять для лечения инфекции вирусом гепатита С, в котором указанная композиция включает соединение по одному из пп.1-25, или его фармацевтически приемлемую соль, или сложный эфир.
Текст
013207 Область техники, к которой относится изобретение Настоящее изобретение относится к ингибиторам РНК-зависимых РНК-полимераз, предпочтительно к вирусным полимеразам семейства Flaviviridae, более предпочтительно к ВГС полимеразе. Уровень техники По оценкам ежегодно в США происходит примерно 30000 случаев новых инфицирований вирусом гепатита С (ВГС) (Kolykhalov, A.A., Mihalik, K., Feinstone, S.M.; Rice, С.М., 2000, J. Virol., 74: 2046-2051). ВГС нелегко уничтожается системой иммунной защиты хозяина; до 85% людей, инфицированных ВГС,становятся хронически инфицированными. Многие из этих стойких инфекций приводят к хроническому заболеванию печени, включая цирроз и печеночно-клеточный рак (Hoofnagle, J.H., 1997, Hepatology, 26: 15S-20S). По оценкам во всем мире имеется 170 млн носителей ВГС и связанная с ВГС терминальная стадия заболевания печени в настоящее время является основной причиной трансплантации печени. Только в США гепатит С ежегодно приводит к смерти 8000-10000 человек. За последующие 10-20 лет при отсутствии эффективного вмешательства это количество может утроиться. Не имеется вакцины,предупреждающей инфицирование посредством ВГС. В настоящее время единственным утвержденным к применению способом лечения пациентов, хронически инфицированных посредством ВГС, является лечение интерфероном или комбинацией интерферона с рибаривином. В некоторых странах для лечения хронического инфицирования гепатитом С недавно разрешены к применению в продаже пэгилированные варианты интерферона (пэгинтерферон альфа-2 а (Pegasys, Roche) и пэгинтерферон альфа-2b (ПЭГ-Intron, Schering по отдельности и в комбинации с рибаривином. Однако сообщают, что эти лекарственные средства приводят к стойкой реакции менее чем в 60% случаев. ВГС относится к семейству Flaviviridae, род hepacivirus, который включает три вида небольших оболочечных РНК-вирусов с "плюс-цепью" (Rice, C.M., 1996, "Flaviviridae: the viruses and theirPublishers, Philadelphia Pa.). Содержащий 9,6 тпн (тысяч пар нуклеотидов) геном ВГС содержит длинную открытую рамку считывания (ОРС), окруженную 5'- и 3'-нетранслированными областями (НТО). ВГС 5' НТО включает 341 нуклеотидов и выступает в качестве внутреннего рибосомного аминоацильного центра для независимой от кэп-группировки инициирования трансляции (Lemon, S.H., Honda, М., 1997,Semin. Virol., 8: 274-288). Полипротеин ВГС до и после трансляции расщепляется по меньшей мере на 10 отдельных полипептидов (Reed, K.E., Rice, С.М., 1999, Curr. Top. Microbiol. Immunol., 242: 55-84). Структурные белки образуются из сигнальных пептидаз на N-концевом участке полипротеина. Две вирусные протеазы опосредуют расщепления в прямом направлении с получением неструктурных (NS) белков,которые выступают в качестве компонентов ВГС РНК репликазы. NS2-3 протеаза охватывает С-концевую половину NS2 и N-концевую треть NS3 и катализирует цис-расщепление сайта NS2/3. Тот же участок NS3 также кодирует каталитический домен NS3-4A серинпротеазы, которая проводит расщепление четырех сайтов в прямом направлении. С-концевые две трети NS3 являются значительно консервативными из числа изолятов ВГС и обладают активностью по отношению к РНК-связывающей,РНК-стимулированной НТфазе и расплетанию РНК. Хотя фосфопротеины NS4B и NS5A также, вероятно, являются компонентами репликазы, их специфическая роль не установлена. Продукты С-концевого расщепления белка, NS5B, являются удлиняющей субъединицей ВГС репликазы, обладающим РНКзависимой РНК-полимеразной (RdRp) активностью (Behrens, S.E., Tomei, L., DeFrancesco, R., 1996,EMBO J., 15: 12-22; and Lohmann, V., Korner, F., Herian, U., Bartenschlager, R., 1997, J. Virol., 71: 84168428). Недавно при исследованиях на шимпанзе показано, что мутации, нарушающие активность NS5B,устраняют инфекционность РНК (Kolykhalov, А.А., Mihalik, K., Feinstone, S.M., Rice, СМ., 2000, J. Virol.,74: 2046-2051). Разработка новых и специфичных анти-ВГС лекарственных средств является высокоприоритетной задачей и специфические по отношению к вирусам функции, важные для репликации, являются наиболее привлекательными объектами при разработке лекарственных препаратов. Отсутствие РНК-зависимых РНК-полимераз у млекопитающих и тот факт, что этот фермент, видимо, важен для репликации вирусов,приводит к предположению о том, что NS5B полимераза является идеальным объектом для анти-ВГС лечения. В WO 01/47883, 02/04425, 03/000254, 03/007945, 03/010140, 03/026587, 03/101993, 04/005286,2004/064925, 2004/065367 и 2004/087714 описаны ингибиторы NS5B, предлагаемые для борьбы с ВГС. Индольные ингибиторы NS5B полимеразы ВГС раскрыты в WO 03/010141. Однако ингибиторы,предлагаемые в настоящем изобретении, отличаются от раскрытых в WO 03/010141 тем, что они неожиданно хорошо ингибируют активность при клеточном анализе репликации ВГС РНК. Краткое изложение сущности изобретения Настоящее изобретение относится к новой серии соединений, обладающих от хорошей до очень хорошей ингибирующей активностью по отношению к ВГС полимеразе и/или неожиданно хорошей активностью при клеточном анализе репликации ВГС РНК. Другие объекты настоящего изобретения будут понятны специалисту в данной области техники из приведенного ниже описания и примеров. В первом варианте осуществления настоящее изобретение относится к соединению, описываемому-1 013207 формулой (I), или к его энантиомеру, диастереоизомеру или таутомеру, включая его соль или сложный эфир в которой один из А или В обозначает N, а другой В или А обозначает С, гдемежду двумя атомами С обозначает двойную связь имежду атомом С и атомом N обозначает ординарную связь; иR2 выбран из группы, включающей арил и Het; указанные арил и Het необязательно замещены с помощью R21; где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С 1-С 6)алкил, (С 1-С 6)алкоксигруппу и NH2;(С 2-С 6)алкенил, каждый необязательно, замещены R50; где R50 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей (С 1-С 6)алкил, -СООН, оксогруппу, гидроксигруппу и NH2; а другой из R5 и R6 выбран из группы, включающей Н, (С 1-С 6)алкил и (C1-С 6)алкоксигруппу;R9 и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С 3-С 7)циклоалкил или (С 5-С 7)циклоалкенил; где указанные циклоалкил или циклоалкенил в каждом случае необязательно содержат в качестве заместителей (С 1-С 4)алкил; где Het определяется, как 4-, 5-, 6- или 7-членный гетероцикл, содержащий от 1 до 4 гетероатомов,каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бигетероцикл, содержащий от 1 до 5 гетероатомов, если это возможно, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим. В объем настоящего изобретения включены соединения формулы (I), описанные выше в настоящем изобретении, с которыми связана по меньшей мере одна из следующих: "распознающая метка", "метка сродства" и "фотохимически реакционноспособная группа". Соединения, предлагаемые в настоящем изобретении, обычно обладают ингибирующей активностью по отношению к ВГС полимеразе. В частности, соединения, предлагаемые в настоящем изобретении, ингибируют синтез РНК РНК-зависимой РНК-полимеразой ВГС, предпочтительно фермента NS5B,кодируемого ВГС. Кроме того, соединения, предлагаемые в настоящем изобретении, неожиданно хорошо ингибируют активность при клеточном анализе репликации ВГС РНК. Другим преимуществом соединений, предлагаемых в настоящем изобретении, является их очень низкая или низкая активность по отношению к другим полимеразам. Во втором варианте осуществления настоящее изобретение относится к применению соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции в качестве ингибитора ВГС полимеразы, предпочтительно в качестве ингибитора активности РНК-зависимой РНК-полимеразы фермента NS5B, кодируемого ВГС. В третьем варианте осуществления настоящее изобретение относится к применению соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции в качестве ингибитора репликации ВГС. В четвертом варианте осуществления настоящее изобретение относится к применению соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции для предупреждения или лечения инфекции ВГС у млекопитающего. В пятом варианте осуществления настоящее изобретение относится к способу ингибирования РНКзависимой РНК-полимеразной активности фермента NS5B, кодируемого ВГС, включающему воздействие на фермент NS5B эффективным количеством соединения формулы (I) при условиях, при которых ингибируется РНК-зависимая РНК-полимеразная активность фермента NS5B. В шестом варианте осуществления настоящее изобретение относится к способу ингибирования репликации ВГС, включающему воздействие на клетку, инфицированную посредством ВГС, эффективным количеством соединения формулы (I) при условиях, при которых ингибируется репликация ВГС. В седьмом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения инфекции ВГС у млекопитающего, включающему введение млекопитающему эффективно-2 013207 го количества соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции. В восьмом варианте осуществления настоящее изобретение относится к способу лечения или предупреждения инфекции ВГС у млекопитающего, включающему введение млекопитающему эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или сложного эфира,или его композиции в комбинации по меньшей мере с одним другим противовирусным средством. В девятом варианте осуществления настоящее изобретение относится к фармацевтической композиции, предназначенной для лечения или предупреждения инфекции ВГС, включающей эффективное количество соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, и фармацевтически приемлемый носитель. В соответствии с предпочтительным вариантом осуществления фармацевтическая композиция,предлагаемая в настоящем изобретении, дополнительно включает терапевтически эффективное количество одного или большего количества противовирусных средств. Примеры противовирусных средств включают, но не ограничиваются только ими, рибаривин и амантадин. В соответствии с другим предпочтительным вариантом осуществления фармацевтическая композиция, предлагаемая в настоящем изобретении, дополнительно включает по меньшей мере одно другое анти-ВГС средство в качестве противовирусного средства. В соответствии с более предпочтительным вариантом осуществления фармацевтическая композиция, предлагаемая в настоящем изобретении, включает дополнительное иммуномодулирующее средство в качестве другого анти-ВГС средства. Примеры дополнительных иммуномодулирующих средств включают, но не ограничиваются только ими, -, -, -, -, - и -интерфероны и их пэгилированные формы. В соответствии с другим более предпочтительным вариантом осуществления фармацевтическая композиция, предлагаемая в настоящем изобретении, дополнительно включает по меньшей мере один другой ингибитор ВГС полимеразы в качестве другого анти-ВГС средства. В соответствии с другим более предпочтительным вариантом осуществления фармацевтическая композиция, предлагаемая в настоящем изобретении, дополнительно включает по меньшей мере один ингибитор ВГС NS3 протеазы в качестве другого анти-ВГС средства. В соответствии с еще одним более предпочтительным вариантом осуществления фармацевтическая композиция, предлагаемая в настоящем изобретении, дополнительно включает по меньшей мере один ингибитор другой мишени цикла превращения ВГС в качестве другого анти-ВГС средства. Примеры таких ингибиторов других мишеней включают, но не ограничиваются только ими, средства, которые ингибируют мишень, выбранную из группы, включающей ВГС геликазу, ВГС NS2/3 протеазу и ВГС ААСР, и средства, которые оказывают мешающее воздействие на функции других вирусных мишеней,включая, но не ограничиваясь только им, белок NS5A. В десятом варианте осуществления настоящее изобретение относится к применению соединения формулы (I), предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли, или сложного эфира, или его композиции для изготовления лекарственного средства, предназначенного для лечения и/или предупреждения вирусной инфекции Flaviviridae, предпочтительно инфекции ВГС. В одиннадцатом варианте осуществления настоящее изобретение относится к препарату, включающему композицию, эффективную для лечения или предупреждения инфекции ВГС или ингибирования NS5B полимеразы ВГС, и упаковочный материал, включающий этикетку, которая указывает, что композицию можно применять для лечения инфекции вирусом гепатита С, в котором указанная композиция включает соединение формулы (I), предлагаемое в настоящем изобретении, или его фармацевтически приемлемую соль, или сложный эфир. Подробное описание изобретения Определения Если не указано иное, то применяются следующие определения. При использовании в настоящем изобретении термин "(С 1-Cn)алкил", в котором n является целым числом,по отдельности или в комбинации с другим радикалом означает ациклические обладающие линейной или разветвленной цепью алкильные радикалы, содержащие от 1 до n атомов углерода соответственно. Примеры таких радикалов включают, но не ограничиваются только ими, метил, этил, н-пропил, 1-метилэтил (изопропил),н-бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил (трет-бутил), н-пентил и т.п. Ниже обозначение Me означает метильную группу. Если алкильная группа замещена галогеном, то предпочтительно, если она является моно-, ди- или тризамещенной фтором или монозамещенной хлором или бромом. При использовании в настоящем изобретении термин "(С 2-Cn)алкенил", в котором n является целым числом, по отдельности или в комбинации с другим радикалом означает ненасыщенный ациклический обладающий линейной или разветвленной цепью радикал, содержащий от 2 до n атомов углерода, по меньшей мере два из которых связаны друг с другом двойной связью. Примеры таких радикалов включают, но не ограничиваются только ими, этенил (винил), 1-пропенил, 2-пропенил, 1-бутенил и т.п. Термин включает цис- и транс-изомеры и смеси (С 2-Cn)алкенильного радикала. (С 2-Cn)Алкенильный радикал может быть замещен по любому количеству его атомов углерода, к которым в ином случае присоединен-3 013207 атом водорода. При использовании в настоящем изобретении термин "(С 3-Cn)циклоалкил", в котором n является целым числом, по отдельности или в комбинации с другим радикалом означает циклоалкильный радикал, содержащий от 3 до n атомов углерода. Примеры таких радикалов включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. При использовании в настоящем изобретении термин "(C5-Cn)циклоалкенил", в котором n является целым числом, по отдельности или в комбинации с другим радикалом, означает ненасыщенный циклический радикал, содержащий от 5 до n атомов углерода. Примеры включают, но не ограничиваются только ими, циклопентенил и циклогексенил. При использовании в настоящем изобретении термин "(С 3-Cm)циклоалкил-(С 1-Cn)алкил-", где n и m являются целыми числами, по отдельности или в комбинации с другим радикалом означает обладающий линейной или разветвленной цепью алкильный радикал, содержащий от 1 до n атомов углерода, с которым ковалентно связан циклоалкильный радикал, содержащий от 3 до m атомов углерода. Примеры (С 3-С 7)циклоалкил-(С 1 С 6)алкила включают, но не ограничиваются только ими, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил, 1-циклопропилэтил, 2-циклопропилэтил, 1-циклобутилэтил, 2-циклобутилэтил,1-циклопентилэтил, 2-циклопентилэтил, 1-циклогексилэтил, 2-циклогексилэтил и т.п. При использовании в настоящем изобретении термин "защитная группа" обозначает защитные группы, которые можно использовать при синтетических превращениях, примеры которых приведены в публикации Greene, "Protective Groups in Organic Chemistry", John Wiley и Sons, New York (1981) and "ThePeptides: Analysis, Synthesis, Biology", Vol. 3, Academic Press, New York (1981). Карбоксильная группа обычно является защищенной с образованием сложного эфира, который можно расщепить и получить карбоновую кислоту. Защитные группы, которые можно использовать, включают, но не ограничиваются только ими: 1) алкильные сложноэфирные, такие как содержащие метил, этил, триметилсилилэтил и трет-бутил, 2) арилалкильные сложноэфирные, такие как содержащие бензил и замещенный бензил, или 3) сложные эфиры, которые можно расщепить обработкой мягкими основаниями или мягкими восстановительными реагентами, такие как трихлорэтильный и фенацильный сложные эфиры. При использовании в настоящем изобретении термин "арил", по отдельности или в комбинации с другим радикалом, означает 6- или 10-членный арил, т.е. ароматический радикал, содержащий 6 или 10 атомов углерода. Примеры включают, но не ограничиваются только ими, фенил, 1-нафтил и 2-нафтил. При использовании в настоящем изобретении термин "Het" означает 4-, 5-, 6- или 7-членный гетероцикл, содержащий от 1 до 4 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10 или 11-членный бигетероцикл, содержащий от 1 до 5 гетероатомов, если это возможно, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, если не указано иное. При использовании в настоящем изобретении термин "гетероатом" означает О, S или N. При использовании в настоящем изобретении термин "гетероцикл", по отдельности или в комбинации с другим радикалом, означает одновалентный радикал, полученный удалением атома водорода от 5-,6- или 7-членного насыщенного или ненасыщенного (включая ароматический) гетероцикла, содержащий от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Примеры таких гетероциклов включают, но не ограничиваются только ими, азетидин, пирролидин, тетрагидрофуран, тиазолидин, пиррол, тиофен, гидантоин, диазепин, 1 Н-имидазол, изоксазол, тиазол, тетразол, пиперидин, пиперазин, гомопиперидин, гомопиперазин, 1,4-диоксан, 4-морфолин, 4-тиоморфолин, пиридин, пиридинN-оксид, пиримидин и следующие гетероциклы: При использовании в настоящем изобретении термин "9- или 10-членный бигетероцикл " или "бигетероцикл" по отдельности или в комбинации с другим радикалом означает гетероцикл, определенный выше, сконденсированный с одним или большим количеством других циклов. Примеры таких бигетероциклов включают, но не ограничиваются только ими, индол, бензимидазол, тиазоло[4,5-b]-пиридин, хинолин, кумарин и следующие: При использовании в настоящем изобретении термин "галоген" означает атом галогена и включает фтор, хлор, бром и йод. При использовании в настоящем изобретении термин "ОН" обозначает гидроксигруппу. Специали-4 013207 сту в данной области техники хорошо известно, что гидроксигруппы могут быть заменены эквивалентами функциональных групп. Примеры таких эквивалентов функциональных групп, которые входят в настоящее изобретение, включают, но не ограничиваются только ими, простые эфиры, сульфгидрилы, простые тиоэфиры и первичные, вторичные и третичные амины. При использовании в настоящем изобретении термин "(C1-Cn)алкоксигруппа" обозначает атом кислорода,дополнительно связанный с (С 1-Cn)алкильным радикалом. Примеры (С 1-С 6)алкоксигрупп включают, но не ограничиваются только ими, метокси- (СН 3 О-), этокси- (СН 3 СН 2 О-), н-пропокси- (СН 3 СН 2 СН 2 О-), 1-метилэтокси(изопропокси-; (СН 3)2 СНО-), 1,1-диметилэтоксигруппу (трет-бутоксигруппу; (СН 3)3 СО-) и т.п. Если (C1Cn)алкоксигруппа является замещенной, предполагается, что она замещена по своему (С 1-Cn)алкильному фрагменту. Термин "оксогруппа" при использовании в настоящем изобретении означает атом кислорода, как заместитель, присоединенный к атому углерода с помощью двойной связи (=O). Предполагается, что, если термин "замещенный" относится к радикалу, содержащему более одного фрагмента, такому как (С 3-С 7)циклоалкил-(С 1-С 6)алкил-, такое замещение относится к обоим фрагментам, т.е. алкил, или циклоалкил, или они оба могут быть замещены входящими в определение заместителями. При использовании в настоящем изобретении термин "СООН" обозначает карбоксигруппу. Специалисту в данной области техники хорошо известно, что карбоксигруппы могут быть заменены эквивалентами функциональных групп. Примеры таких эквивалентов функциональных групп, которые входят в настоящее изобретение, включают, но не ограничиваются только ими, сложные эфиры, амиды, имиды,бороновыекислоты, фосфоновые кислоты, сульфоновые кислоты, тетразолы, триазолы, N-ацилсульфонилдиамиды (RCONHSO2NR2) и N-ацилсульфонамиды (RCONHSO2R). При использовании в настоящем изобретении термин "эквивалент функциональной группы" означает элемент или группу или его замещенное производное, которое может быть заменено другим элементом или группой или его замещенным производным, который обладает аналогичными электронными характеристиками, характеристиками гибридизации или связывания. Значки и во фрагментах формул используются взаимозаменяемым образом для обозначения связи или, в случае спироциклической группы, атома, которые связаны с остальной частью молекулы указанным образом. При использовании в настоящем изобретении термин "распознающая метка" означает любую группу, которая может быть связана с полимеразой или с соединением, предлагаемым в настоящем изобретении, так что, когда соединение ассоциируется с полимеразой-мишенью, такая метка обеспечивает распознавание, прямое или косвенное, соединения, так что его можно обнаружить, исследовать и количественно определить. Примеры таких "меток" включают, но не ограничиваются только ими, флуоресцентные метки, хемилюминесцентные метки, колориметрические метки, ферментные маркеры, радиоактивные изотопы и метки сродства, такие как биотин. Такие метки присоединяют к соединению или полимеразе по известным методикам. При использовании в настоящем изобретении термин "метка сродства" означает лиганд (которая может быть связана с полимеразой или с соединением, предлагаемым в настоящем изобретении) сильное сродство которой по отношению к рецептору можно использовать для извлечения из раствора объекта, к которому присоединен лиганд. Примеры таких лигандов включают, но не ограничиваются только ими,биотин и его производные, гистидиновый полипептид, полиаргинин, амилозный фрагмент сахара или определенный эпитоп, распознаваемый специфическим антителом. Такие метки сродства присоединяют к соединению или полимеразе по известным методикам. При использовании в настоящем изобретении термин "фотохимически реакционноспособная группа" означает группу, которая при активации светом превращается из инертной группы в реакционноспособную частицу, такую как свободный радикал. Такую группу можно использовать, например, в качестве метки фотосродства. Примеры таких групп включают, но не ограничиваются только ими, бензофеноны,азиды и т.п. Термин "его соль" означает любую молекулярную соль с кислотой и/или основанием соединения,предлагаемого в настоящем изобретении; предпочтительно его фармацевтически приемлемую соль. Термин "фармацевтически приемлемая соль" означает соль соединения формулы (I), которая в соответствии с тщательной медицинской оценкой пригодна для применения при взаимодействии с тканями человека и низших животных без нежелательной токсичности, проявления раздражения, аллергической реакции и т.п. в соответствии с разумным отношением риск/польза, обычно растворимую или диспергируемую в воде или масле и эффективную для предназначенного применения. Термин включает фармацевтически приемлемые молекулярные соли с кислотами и фармацевтически приемлемые молекулярные соли с основаниями. Примеры таких подходящих солей приведены, например, в публикации S.M. Birgeet al., J. Pharm. Sci., 1977, 66, p.1-19. Термин "фармацевтически приемлемая молекулярная соль с кислотой" означает такие соли, которые сохраняют биологическую эффективность и характеристики свободных оснований и которые не являются биологически или в другом отношении нежелательными, образованные с неорганическими ки-5 013207 слотами, такими как хлористо-водородная кислота, бромисто-водородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, фосфорная кислота и т.п., и с органическими кислотами, такими как уксусная кислота, трифторуксусная кислота, адипиновая кислота, аскорбиновая кислота, аспартамовая кислота, бензолсульфоновая кислота, бензойная кислота, масляная кислота, камфорная кислота, камфорсульфоновая кислота, коричная кислота, лимонная кислота, диглюконовая кислота, этансульфоновая кислота, глутаминовая кислота, гликолевая кислота, глицерофосфорная кислота, hemisulfic кислота, гексановая кислота, муравьиная кислота, фумаровая кислота, 2-гидроксиэтансульфоновая кислота (изетионовая кислота), молочная кислота, гидроксималеиновая кислота, яблочная кислота, малоновая кислота,миндальная кислота, мезитиленсульфоновая кислота, метансульфоновая кислота, нафталинсульфоновая кислота, никотиновая кислота, 2-нафталинсульфоновая кислота, щавелевая кислота, памоевая кислота,пектиновая кислота, фенилуксусная кислота, 3-фенилпропионовая кислота, триметилуксусная кислота,пропионовая кислота, пировиноградная кислота, салициловая кислота, стеариновая кислота, янтарная кислота, сульфаниловая кислота, виннокаменная кислота, п-толуолсульфоновая кислота, ундекановая кислота и т.п. Термин "фармацевтически приемлемая молекулярная соль с основанием" означает такие соли, которые сохраняют биологическую эффективность и характеристики свободных кислот и которые не являются биологически или в другом отношении нежелательными, образованные с неорганическими основаниями, такими как аммиак или гидроксид, карбонат или бикарбонат аммония или катиона металла,такого как натрий, калий, литий, кальций, магний, железо, цинк, медь, марганец, алюминий и т.п. Особенно предпочтительными являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых нетоксичных органических оснований, включают соли первичных, вторичных и третичных аминов, четвертичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как метиламин, диметиламин,триметиламин, этиламин, диэтиламин, триэтиламин, изопропиламин, трипропиламин, трибутиламин,этаноламин, диэтаноламин, 2-диметиламиноэтанол, 2-диэтиламиноэтанол, дициклогексиламин, лизин,аргинин, гистидин, кофеин, гидрабамин, холин, бетаин, этилендиамин, глюкозамин, метилглюкамин,теобромин, пурины, пиперазин, пиперидин, N-этилпиперидин, тетраметиламмониевые соединения, тетраэтиламмониевые соединения, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин,дициклогексиламин, дибензиламин, N,N-дибензилфенетиламин, 1-эфенамин, N,N'-дибензилэтилендиамин, полиамидные смолы и т.п. Особенно предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин, холин и кофеин. Термин "его сложный эфир" означает любой сложный эфир соединения, в котором любая из карбоксигрупп молекулы заменена алкоксикарбоксильной группой, включая, но не ограничиваясь только ими, их фармацевтически приемлемые сложные эфиры. При использовании в настоящем изобретении термин "фармацевтически приемлемый сложный эфир" по отдельности или в комбинации с другим заместителем означает сложные эфиры, такие как соединения формулы (I), в которых любая из карбоксигрупп молекулы, но предпочтительно концевая карбоксигруппа, заменена алкоксикарбоксильной группой в которой фрагмент R сложного эфира выбран из группы, включающей алкил (например, метил,этил, н-пропил, трет-бутил, н-бутил); алкоксиалкил (например, метоксиметил); алкоксиацил (например,ацетоксиметил); арилалкил (например, бензил); арилоксиалкил (например, феноксиметил); арил (например, фенил), необязательно замещенный галогеном, (С 1-С 4)алкил или (C1-С 4)алкоксигруппу. Другие подходящие сложные эфиры приведены в публикации Design of prodrugs, Bundgaard, H. Ed. Elsevier (1985). Такие фармацевтически приемлемые сложные эфиры обычно гидролизуются in vivo при инъекциях млекопитающему и превращаются в форму кислоты соединения формулы (I). В описанных выше сложных эфирах, если не указано иное, предпочтительно, чтобы любой содержащийся алкильный фрагмент включал от 1 до 16 атомов углерода, более предпочтительно от 1 до 6 атомов углерода. Предпочтительно, чтобы любой содержащийся в таких сложных эфирах арильный фрагмент включал фенильную группу. Предпочтительные сложные эфиры могут представлять собой (С 1-С 16)алкиловый сложный эфир, незамещенный бензиловый сложный эфир или бензиловый сложный эфир, замещенный по меньшей мере одним галогеном, (С 1-С 6)алкилом, (С 1-С 6)алкоксигруппой, нитрогруппой или трифторметилом. Термин "противовирусное средство" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует образование и/или репликацию вируса у млекопитающего. Они включают средства, которые оказывают мешающее воздействие на механизмы хозяина или вируса, необходимые для образования и/или репликации вируса у млекопитающего. Противовирусные средства включают, но не ограничиваются только ими, рибавирин, амантадин, VX-497 (меримеподиб, Vertex Pharmaceuticals), VX-498 (Vertex Pharmaceuticals), левовирин, вира-6 013207 мидин, цеплен (максамин), XTL-001 и XTL-002 (XTL Biopharmaceuticals). Термин "другое анти-ВГС средство" при использовании в настоящем изобретении означает такие средства, которые эффективны для ослабления или предупреждения прогрессирования связанных с гепатитом С симптомов заболевания. Такие средства можно выбрать из группы, включающей иммуномодулирующие средства, ингибиторы ВГС NS3 протеазы, другие ингибиторы ВГС полимеразы или ингибиторы другой мишени цикла превращения ВГС. Термин "иммуномодулирующее средство" при использовании в настоящем изобретении означает такие средства (соединения или биологические вещества), которые эффективны для усиления ала активации реакции иммунной системы у млекопитающего. Иммуномодулирующие средства включают, но не ограничиваются только ими, интерфероны класса I (такие как -, -, - и -интерфероны,-интерфероны, консенсусные интерфероны и азиало-интерфероны), интерфероны класса II (такие как-интерфероны) и их пэгилированные формы. Термин "ингибитор ВГС NS3 протеазы" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует функцию ВГС NS3 протеазы у млекопитающего. Ингибиторы ВГС NS3 протеазы включают, но не ограничиваются только ими, соединения, описанные в WO 99/07733, 99/07734, 00/09558, 00/09543, 00/59929, 02/060926,US 2002/0177725, WO 03/053349, 03/062265, 03/064416, 03/064455, 03/064456, 03/099316, 03/099274,2004/032827, 2004/037855, 2004/043339, 2004/072243, 2004/093798, 2004/094452, 2004/101602,2004/101605, 2004/103996, предложенное фирмой Boehringer Ingelheim для клинических испытаний соединение, обозначенное как BILN 2061, и предложенное фирмой Vertex для клинических испытаний соединение, обозначенное как VX-950. Термин "другой ингибитор ВГС полимеразы" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует функцию ВГС полимеразы у млекопитающего, причем это средство обладает структурой, отличающейся от структуры соединения, предлагаемой в настоящем изобретении, и предпочтительно связывается с центром ВГС центра, на который воздействуют соединения, предлагаемые в настоящем изобретении. Другие ингибиторы ВГС полимеразы включают ненуклеозиды, например соединения, описанные в WO 2004/087714(Merck), EP 1256628 A2 (Agouron), WO 02/04425 (Boehringer Ingelheim), 03/007945 (Boehringer Ingelheim),03/010140 (Boehringer Ingelheim), 03/010141 (Boehringer Ingelheim), 2004/064925 (Boehringer Ingelheim) и 2004/065367 (Boehringer Ingelheim). Кроме того, другие ингибиторы ВГС полимеразы также включают нуклеозидные аналоги, например соединения, описанные в WO 04/007512 (Merck/Isis), 04/003000(Merck/Isis), 01/90121 (Idenix), 01/60315 (Shire) и 01/32153 (Shire). Термин "ингибитор другой мишени цикла превращения ВГС" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует образование и/или репликацию ВГС у млекопитающего не путем ингибирования РНК-зависимой РНК-полимеразы ВГС. Они включают средства, которые оказывают мешающее воздействие на механизмы хозяина или ВГС вируса, необходимые для образования и/или репликации ВГС у млекопитающего. Ингибиторы другой мишени цикла превращения ВГС включают, но не ограничиваются только ими,средства, которые ингибируют мишень, выбранную из группы, включающей ВГС геликазу, ВГС NS2/3 протеазу и ВГС ААСР, и средства, которые оказывают мешающее воздействие на функции других вирусных мишеней, включая, но не ограничиваясь только ими, белок NS5A. Термин "ингибитор ВИЧ (вирус иммунодефицита человека)" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует образование и/или репликацию ВИЧ у млекопитающего. Они включают средства, которые оказывают мешающее воздействие на механизмы хозяина или вируса, необходимые для образования и/или репликации ВИЧ у млекопитающего. Ингибиторы ВИЧ включают, но не ограничиваются только ими, нуклеозидные ингибиторы, ненуклеозидные ингибиторы, ингибиторы протеазы, ингибиторы слияния и ингибиторы интегразы.-7 013207 Термин "ингибитор ВГА (вируса гепатита А)" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует образование и/или репликацию ВГА у млекопитающего. Они включают средства, которые оказывают мешающее воздействие на механизмы хозяина или вируса, необходимые для образования и/или репликации ВГА у млекопитающего. Ингибиторы ВГА включают, но не ограничиваются только ими, вакцины гепатита А,например харвикс (GlaxoSmithKline), VAQTA (Merck) и аваксим (Aventis Pasteur). Термин "ингибитор ВГВ (вируса гепатита В)" при использовании в настоящем изобретении означает средство (соединение или биологическое вещество), которое эффективно ингибирует образование и/или репликацию ВГВ у млекопитающего. Они включают средства, которые оказывают мешающее воздействие на механизмы хозяина или вируса, необходимые для образования и/или репликации ВГВ у млекопитающего. Ингибиторы ВГВ включают средства, которые ингибируют ВГВ вирусную ДНК полимеразу, и вакцины ВГВ. Конкретные примеры ингибиторов ВГВ включают, но не ограничиваются только ими, ламувидин (эпивир-ВГВ), адефовир дипивоксил, энтекавир, FTC (ковирацил), DAPD(DXG), L-FMAU (клевудин), АМ 365 (Amrad), Ldt (телбувидин), monoval-LdC (валторцитабин), АСН 126,443 (L-Fd4C) (Achillion), МСС 478 (Eli Lilly), Racivir (RCV), фтор-L- и -D-нуклеозиды, робустафлавон, ICN 2001-3 (ICN), Bam 205 (Novelos), XTL-001 (XTL), иминосахара (Nonyl-DNJ) (Synergy),HepBzyme; и иммуномодулирующие продукты, такие как интерферон-альфа-2b, НЕ 2000 (Hollis-Eden),терадигм (Epimmune), EHT899 (Enzo Biochem), тимосин-альфа-1 (задаксин), вакцину ВГВ ДНК (PowderJect), вакцину ВГВ ДНК (Jefferon Center), антиген ВГВ (OraGen), BayHep В (Bayer), Nabi-HB(Nabi) и средство против гепатита В (канген); и вакцины ВГВ, такие как следующие: энергикс В, рекомбивакс НВ, GenHevac В, гепакар, Bio-Hep В, TwinRix, комвакс, гексавак. Термин "интерферон класса I" при использовании в настоящем изобретении означает интерферон,выбранный из группы интерферонов, которые связываются с рецептором типа I. К ним относятся натуральные и полученные синтетически интерфероны класса I. Примеры интерферонов класса I включают,но не ограничиваются только ими, -, -, -, -интерфероны, -интерфероны, консенсусные интерфероны, азиало-интерфероны и их пэгилированные формы. Термин "интерферон класса II" при использовании в настоящем изобретении означает интерферон,выбранный из группы интерферонов, которые связываются с рецептором типа II. Примеры интерферонов класса II включают, но не ограничиваются только ими, -интерфероны и их пэгилированные формы. Как показано выше, в объем настоящего изобретения входит комбинированная терапия, при которой соединение формулы (I) или его фармацевтически приемлемая соль, или сложный эфир вводят совместно по меньшей мере с одним средством, выбранным из группы, включающей противовирусное средство, иммуномодулирующее средство, ингибитор ВГС NS3 протеазы, другой ингибитор ВГС полимеразы, ингибитор другой мишени цикла превращения ВГС, ингибитор ВИЧ, ингибитор ВГА и ингибитор ВГВ. Примеры таких средств приведены выше в разделе Определения. Конкретные предпочтительные примеры таких средств приведены ниже: противовирусные средства: рибавирин и амантадин; иммуномодулирующие средства: интерфероны класса I, интерфероны класса II и их пэгилированные формы; ингибиторы ВГС NS3 протеазы; другие ингибиторы ВГС полимеразы: нуклеозидные ненуклеозидные ингибиторы; ингибитор другой мишени цикла превращения ВГС, которые ингибируют мишень, выбранную из группы, включающей NS3 геликазу, ВГС NS2/3 протеазу и аминоацильный сайт рибосом (ААСР), или средство, которое оказывают мешающее воздействие на функцию белка NS5A; ингибиторы ВИЧ: нуклеозидные ингибиторы, ненуклеозидные ингибиторы, ингибиторы протеазы,ингибиторы слияния и ингибиторы интегразы; или ингибиторы ВГВ: средства, которые ингибируют ВГВ вирусную ДНК полимеразу или средство, которое является вакциной ВГВ. Эти дополнительные средства можно комбинировать с соединениями, предлагаемыми в настоящем изобретении, с образованием единой фармацевтической дозировочной формы. Альтернативно, эти дополнительные средства можно вводить пациенту по отдельности в качестве части множественной дозировочной формы, например, с использованием набора средств. Такие дополнительные средства можно вводить пациенту до, одновременно или после введения соединения формулы (I), или его фармацевтически приемлемой соли, или сложного эфира. При использовании в настоящем изобретении термин "лечение" означает введение соединения или композиции, предлагаемой в настоящем изобретении, для облегчения или устранения симптомов гепатита С и/или для уменьшения вирусной нагрузки пациента. При использовании в настоящем изобретении термин "предупреждение" означает введение соединения или композиции, предлагаемой в настоящем изобретении, после воздействия вируса на индивидуума, но до проявления симптомов заболевания, и/или до обнаружения вируса в крови для предупреждения появления симптомов заболевания и/или предупреждения появления в крови обнаруживаемых-8 013207 уровней вируса. Предпочтительные варианты осуществления Если не указано иное, все группы и заместители, включая, но не ограничиваясь только ими, R1, R2,R3, R4, R5, R6, R7, R8, R9, R10, R21, R50, RN1, RN2, А, В и Het, обладают значениями, указанными выше и ниже в настоящем изобретении. Ниже описаны предпочтительные варианты осуществления, групп и заместителей, предлагаемых в настоящем изобретении. Ядро Настоящее изобретение относится к соединениям формулы (Ia) Альтернативно, настоящее изобретение относится к соединениям формулы (Ib)R1. В соответствии с предпочтительным вариантом осуществления настоящего изобретения R1 выбран из группы, включающей Н, метил и этил. Более предпочтительно, если R1 обозначает метил.R2. Предпочтительно, если R2 выбран из группы, включающей фенил и Het, выбранный из группы формул где указанные фенил и Het являются незамещенными или замещены с помощью R21, в которой R21 является таким, как определено в настоящем изобретении. Более предпочтительно, если R2 выбран из группы, включающей фенил и Het, выбранный из группы формул где указанные фенил и Het являются незамещенными или замещены с помощью R21, в которой R21 является таким, как определено в настоящем изобретении.R21. Предпочтительно, если R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С 1-С 4)алкил, (C1-С 4)алкоксигруппу и NH2. Более предпочтительно, если R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимоR3. Предпочтительно, если R3 обозначает циклопентил или циклогексил, каждый из которых необязательно замещен 1 или 2 атомами фтора. Более предпочтительно, если R3 обозначает циклопентил или циклогексил.R5 и R6. Предпочтительно, если один из R5 и R6 выбран из группы, включающей: а) (С 2-С 4)алкенил, замещенный СООН и Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:iii) -NH2,где Het обозначает 5- или 6-членный моноциклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S; и другой из R5 и R6 выбран из Н, (С 1-С 3)алкила и (С 1-С 3)алкоксигруппы. Более предпочтительно, если один из R5 и R6 выбран из группы, включающей:b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей: и другой из R5 и R6 выбран из группы, включающей Н, метил, метоксигруппу и этоксигруппу. Еще более предпочтительно, если один из R5 и R6 выбран из группы, включающей:b) Het, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей:ii) метил или этил и(С 3-С 6)циклоалкил, (С 5-С 6)циклоалкенил; где указанные циклоалкил или циклоалкенил, каждый необязательно, замещены (С 1-С 4)алкилом. обозначает Наиболее предпочтительно, если группа В объем настоящего изобретения входят соединения формулы (I) в которой один из А или В обозначает N, а другой В или А обозначает С, гдемежду двумя атомами С обозначает двойную связь имежду атомом С и атомом N обозначает ординарную связь; иR2 обозначает арил или Het; указанные арил и Het необязательно замещены R21; где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген,(С 1-С 6)алкил и (С 1-С 6)алкоксигруппу;R4 и R7, каждый независимо, представляют собой Н; один из R5 и R6 выбран из группы, включающей Het и (С 2-С 6)алкенил, где Het и (С 2-С 6)алкенил необязательно замещены R50; в которой R50 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы,включающей (С 1-С 6)алкил, -СООН и -NH2; а другой из R5 и R6 выбран из группы, включающей Н, (С 1-С 6)алкил и (C1-С 6)алкоксигруппу;(С 3-С 7)циклоалкил или (С 5-С 7)циклоалкенил; где указанные циклоалкил или циклоалкенил, каждый необязательно, замещены (С 1-С 4)алкилом; где Het определяется как 4-, 5-, 6- или 7-членный гетероцикл, содержащий от 1 до 4 гетероатомов,каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим, или 8-, 9-, 10- или 11-членный бигетероцикл, содержащий от 1 до 5 гетероатомов, если это возможно, каждый из которых независимо выбран из группы, включающей О, N и S, который может быть насыщенным, ненасыщенным или ароматическим; или их соли. В объем настоящего изобретения также входят соединения формулы (I), предпочтительно формулыR2 выбран из группы, включающей фенил и Het, выбранный из группы формул где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей галоген, (С 1-С 4)алкил,(С 1-С 4)алкоксигруппу и NH2;R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен 1-4 атомами фтора;b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:iii) NH2,где Het обозначает 5- или 6-членный моноциклический насыщенный, ненасыщенный или ароматический гетероцикл, содержащий от 1 до 3 гетероатомов, каждый из которых независимо выбран из группы, включающей О, N и S; и другой из R5 и R6 выбран из группы, включающей Н, (С 1-С 3)алкил и (С 1-С 3)алкоксигруппу,R8 представляет собой (С 1-С 5)алкил иR9 и R10, каждый независимо, выбраны из группы, включающей (С 1-С 3)алкил, или R9 и R10 совместно с атомом С, к которому они присоединены, связаны так, что образуют (С 3-С 6)циклоалкил или (С 5-С 6)циклоалкенил; где указанные циклоалкил или циклоалкенил необязательно замещены (С 1-С 4)алкилом. Более предпочтительно, если R1 выбран из группы, включающей Н, метил и этил; R2 выбран из группы, включающей фенил и Het, выбранный из группы формул где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор, бром, метил,этил, пропил, 1-метилэтил, метокси-, этокси-, пропокси-, 1-метилэтоксигруппу и NH2;R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен одним или двумя атомами фтора;b) Het, который необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбран из группы, включающей:R2 выбран из группы, включающей фенил и Het, выбранный из группы формул где указанные фенил и Het являются незамещенными или замещены R21, где R21 обозначает 1, 2 или 3 заместителя, каждый из которых независимо выбран из группы, включающей фтор, хлор, бром, метил,этил, пропил, 1-метилэтил, метокси-, этокси-, пропокси-, 1-метилэтоксигруппу и NH2;R3 обозначает циклопентил или циклогексил, каждый из которых независимо замещен одним или двумя атомами фтора;b) Het, необязательно содержащий 1 или 2 заместителя, каждый из которых независимо выбран из группы, включающей:ii) метил или этил и В объем настоящего изобретения входит каждое отдельное соединение формулы (I), приведенное в табл. 1-4. Активность полимеразы Способность соединений формулы (I) ингибировать синтез РНК-зависимыми РНК-полимеразами ВГС можно продемонстрировать с помощью анализа, в котором можно измерить РНК-зависимую РНК-полимеразную активность ВГС. Подходящая методика анализа описана в примерах. Специфичность по отношению к РНК-зависимой РНК-полимеразной активности Чтобы продемонстрировать, что соединения, предлагаемые в настоящем изобретении, воздействуют путем специфического ингибирования ВГС полимеразы, ингибирующую активность соединений можно исследовать с помощью анализа, в котором измеряется активность РНК-зависимой РНК-полимеразы,не являющейся ВГС полимеразой, или с помощью анализа ДНК-зависимой РНК-полимеразы. Клеточная активность репликации ВГС РНК Способность соединений, предлагаемых в настоящем изобретении, ингибировать репликацию ВГС РНК в клетках можно продемонстрировать с помощью исследования ингибирующей активности путем клеточного анализа репликации ВГС РНК. Подходящая методика анализа описана в примерах. Если соединение формулы (I) или одна из его терапевтически приемлемых солей применяется в качестве противовирусного средства, его можно вводить перорально, местно или системно млекопитающим, включая, но не ограничиваясь только ими, людей, крупный рогатый скот, свиней, собак, кошек,кроликов и мышей, в разбавителе, содержащем один или большее количество фармацевтически приемлемых носителей, относительное содержание которых определяется растворимостью и химической природой соединения, выбранным путем введения и стандартной биологической практикой. Для перорального введения соединение или его терапевтически приемлемую соль можно приготовить в виде разовых дозировочных форм, таких как капсулы или таблетки, каждая из которых содержит- 13013207 заранее заданное количество активного ингредиента, составляющее от примерно 1 до примерно 500 мг, в фармацевтически приемлемом носителе. Для местного применения соединение можно приготовить в фармацевтически приемлемых носителях при равном от примерно 0,1 до примерно 5%, предпочтительно от примерно 0,5 до примерно 5% содержании активного ингредиента. Такие композиции могут представлять собой раствор, крем или лосьон. При системном введении соединение формулы (I) можно вводить путем внутривенной, подкожной или внутримышечной инъекции в композициях с фармацевтически приемлемыми разбавителями или носителями. Для введения путем инъекции предпочтительно использовать соединения в растворе в стерильном водном разбавителе, который также может содержать другие растворенные вещества, такие как буферы или консерванты, а также достаточные количества фармацевтически приемлемых солей или глюкозы, чтобы сделать раствор изотоническим. Подходящие разбавители и носители, которые можно использовать в указанных выше композициях, описаны в фармацевтической литературе, например в публикациях "Remington's The Science and Practice of Pharmacy", 19 th ed., Mack Publishing Company, Easton, Penn., 1995 и "Pharmaceutical Dosage FormsAnd Drugs Delivery Systems", 6 th ed., H.C. Ansel et al., Eds., Williams и Wilkins, Baltimore, Maryland, 1995. Дозировка соединения будет меняться в зависимости от вводимой формы и конкретного выбранного активного средства. Кроме того, она будет меняться в зависимости от конкретного субъекта, подвергающегося лечению. Обычно лечение начинают с использованием небольших увеличивающихся доз,пока не будет достигнут оптимальный для данных обстоятельств эффект. Обычно соединение формулы(I) предпочтительнее всего назначать в концентрациях, которые обычно приводят к эффективному противовирусному воздействию без проявления каких-либо вредных воздействий и неблагоприятных побочных эффектов. При пероральном введении соединение или его терапевтически приемлемую соль можно вводить в диапазоне от примерно 0,01 до примерно 200 мг/(кг массы тела) в день, а предпочтительный диапазон составляет от примерно 0,05 до примерно 100 мг/кг. При системном введении соединение формулы (I) можно вводить в дозе, составляющей от примерно 0,01 мг до примерно 100 мг/(кг массы тела) в день, хотя будут происходить указанные выше изменения. Для достижения эффективных результатов предпочтительнее всего использовать дозировку в диапазоне от примерно 0,05 мг до примерно 50 мг/(кг массы тела) в день. Если композиции, предлагаемые в настоящем изобретении, включают комбинацию соединения формулы (I) и одного или большего количества дополнительных профилактических или терапевтических средств, то соединение и дополнительное средство должны содержаться в дозах примерно от 10 до 100%,а более предпочтительно примерно от 10 до 80% в пересчете на дозу, вводимую в режиме монотерапии. Если эти соединения или их фармацевтически приемлемые соли приготовлены совместно с фармацевтически приемлемым носителем, то полученную композицию можно вводить in vivo млекопитающим, таким как человек, для ингибирования ВГС полимеразы или лечения, или предупреждения инфекции вирусом ВГС. Такое лечение также можно осуществлять путем применения соединений, предлагаемых в настоящем изобретении, в комбинации со средствами, которые включают, но не ограничиваются только ими: иммуномодулирующие средства, включая, но не ограничиваясь только ими, -, -, -, -, - и-интерфероны и их пэгилированные формы; другие противовирусные средства, такие как рибавирин,амантадин; другие ингибиторы ВГС NS5B полимеразы; ингибиторы других мишеней цикла превращения ВГС, которые включают, но не ограничиваются только ими, средства, которые ингибируют мишень,включая, но не ограничиваясь только ими, ВГС геликазу, ВГС NS2/3 протеазу, ВГС NS3 протеазу и ВГС ААСР и средства, которые оказывают мешающее воздействие на функции других вирусных мишеней,включая, но не ограничиваясь только ими, белок NS5A или их комбинации. Дополнительные средства можно комбинировать с соединениями, предлагаемыми в настоящем изобретении, с получением единичной дозировочной формы. Альтернативно, эти дополнительные средства можно вводить млекопитающему по отдельности в качестве части многокомпонентной дозировочной формы. Методология и синтез Синтез соединений, предлагаемых в настоящем изобретении, предпочтительно проводить по описанной общей методике, представленной ниже на схеме 1. Схема 1 Соединения формулы (I), в которой R1, R2, R3, R4, R3, R6, R7, R8 , R9 и R10 являются такими, как определено выше в настоящем изобретении, предпочтительно получать по реакции сочетания карбоновых кислот общей формулы II с аминами общей формулы III, как это показано на представленной выше схе- 14013207 ме 1, с использованием активирующих карбоксил реагентов, хорошо известных специалистам в данной области техники. Такие реагенты включают, но не ограничиваются только ими, ТУТБ, ТУГА, БОФ,BrOP, ЭДАК, ДЦК, изобутилхлорформиат и т.п. Альтернативно, карбоновые кислоты общей формулы II можно превратить в соответствующие хлорангидриды кислот с помощью стандартных реагентов, затем ввести в реакцию сочетания с аминными производными общей формулы III. В случае если R5 или R6 содержит защищенный путем образования сложного эфира фрагмент карбоновой кислоты, проводят реакцию омыления (с использованием методик, хорошо известных специалистам в данной области техники) и получают конечный продукт - продукт в виде свободной карбоновой кислоты. Промежуточные карбоновые кислоты формулы II можно получить по методикам, описанным вWO 03/010141, или по методикам, описанным в приведенных ниже примерах. Аминные промежуточные продукты формулы III можно получить по описанным общим методикам, представленным ниже на схемах 2 и 3. Схема 2 Аминные промежуточные продукты общей формулы III, представленные на схеме 1, можно получить из соответствующих диаминных предшественников общей формулы IV по реакции сочетания с подходящими ,-дизамещенными гидрохлоридами хлорангидридов аминокислот. Получение подходящих ,-дизамещенных гидрохлоридов хлорангидридов аминокислот из соответствующих ,-дизамещенных аминокислот можно выполнить так, как это описано в WO 03/007945 или 03/010141, или по методике, или ее модификации, описанной в публикации Е.S. Uffelman et al. (Org. Lett. 1999, 1, 1157). Амидный промежуточный продукт, образовавшийся по реакции сочетания, затем циклизуют путем нагревания с уксусной кислотой и получают аминные промежуточные продукты общей формулы III. Схема 3 Альтернативно, аминные промежуточные продукты общей формулы III, представленные на схеме 1, можно получить из соответствующих диаминных предшественников общей формулы IV по реакции сочетания с подходящими содержащими защитную группу Boc ,-дизамещенными аминокислотами,как это представлено на схеме 3, с использованием реагентов реакции сочетания, хорошо известных специалистам в данной области техники, таких как ТУТБ, ТУГА, БОФ, BrOP, ЭДАК, ДЦК, изобутилхлорформиат и т.п. Подходящие содержащие защитную группу Boc ,-дизамещенные аминокислоты можно получить из свободных ,-дизамещенных аминокислот по стандартным методикам, хорошо известным специалистам в данной области техники, таким как реакция с Вос 2 О (ди-трет-бутилкарбонат) в присутствии третичного амина, такого как триэтиламин и т.п. Амидный промежуточный продукт, образовавшийся по реакции сочетания, затем циклизуют путем нагревания с уксусной кислотой. Удаление группы Boc с получением аминного промежуточного продукта общей формулы III, представленного на схеме 1, проводят с использованием стандартных реагентов, известных специалисту в данной области техники. Такие реагенты включают, но не ограничиваются только ими, трифторуксусную кислоту, раствор HCl в диоксане и т.п. Получение диаминовых предшественников общей формулы IV, представленные выше на схемах 2 и 3, предпочтительно проводить по методикам, описанным в примерах, включая любые модификации этих методик и/или проведение дополнительных стадий синтеза, хорошо известных специалисту в данной области техники. Аминные промежуточные продукты общей формулы III, представленные на схеме 1, где один из R5 6 и R обозначает -CH=C(R50a)-COOR, где R50a выбран из группы, включающей Н, (С 1-С 6)алкил и галоген,и где R обозначает, например, метил или этил, можно получить из соответствующих аминных промежуточных продуктов общей формулы III, или их соответствующим образом защищенных производных, где- 15013207 один из R5 и R6 обозначает -COOR, где R обозначает, например, метил или этил по методикам, представленным ниже на схеме 4. Хотя схема 4 описывает получение конкретных аминных промежуточных продуктов общей формулы III, в которой R5 обозначает -CH=C(R50a)-COOR, специалист в данной области техники должен понимать, что, если R6 обозначает -COOR, то представленные методики или их модификации приводят к продукту, в котором R6 обозначает -CH=C(R50a)-COOR. Кроме того, специалист в данной области техники должен понимать, что методики, представленные на схеме 4, или их модификации также можно использовать для превращения диаминового предшественника общей формулы IV, представленного выше на схемах 2 и 3, или его соответствующим образом защищенного производного, или подходящего промежуточного продукта при его получении, в котором один из R5 и R6 обозначает-COOR, в диаминовый предшественник общей формулы IV, или его соответствующим образом защищенное производное, или подходящий промежуточный продукт при его получении, в котором один из R5 и R6 обозначает -CH=C(R50a)-COOR, где R50a и R являются такими, как определено выше в настоящем изобретении. Схема 4 Соответствующим образом аминный промежуточный продукт общей формулы IIIa, представленный выше на схеме 4, можно превратить в промежуточный спирт общей формулы IIIb путем обработки подходящим восстановительным реагентом, таким как ДИБАЛ-Г и т.п. Подходящие защитные группы(ЗГ) включают, но не ограничиваются только ими, карбаматные защитные группы, такие как Boc (третбутоксикарбонил) и т.п. Получение защищенных аминных промежуточных продуктов общей формулыIIIa из аминных промежуточных продуктов общей формулы III, представленных выше на схеме 1, можно выполнить с помощью стандартных методик, хорошо известных специалисту в данной области техники. Промежуточный спирт IIIb можно превратить в альдегидный промежуточный продукт IIIc с использованием стандартных окислительных реагентов, хорошо известных специалисту в данной области техники, таких как 1,1,1-трис-(ацетилокси-1,1-дигидро-1,2-бензйодоксол-3-(1 Н)-он (также известный,как перйодинан Десса-Мартина) и т.п. Альдегидный промежуточный продукт IIIc можно превратить в аминный промежуточный продукт общей формулы IIId по стандартной методике Хорнера-Эммонса или аналогичным методикам, таким как методика Виттига и т.п., хорошо известным специалисту в данной области техники, с последующим удалением ЗГ по известным стандартным методикам. В случае, когда ЗГ представляет собой группу Boc,такие методики включают, но не ограничиваются только ими, обработку кислотой, такой как трифторуксусная кислота, раствор HCl в диоксане и т.п. Аминные промежуточные продукты общей формулы III, представленные на схеме 1, где один из R5 6 и R обозначает -C(R50)=CH-COOR, где R50 обозначает (С 1-С 6)алкил и где R обозначает, например, метил или этил, можно получить из промежуточного продукта IIIc, представленного выше на схеме 4, по методикам, представленным ниже на схеме 5. Хотя схема 5 описывает получение конкретных аминных промежуточных продуктов общей формулы III, в которой R5 обозначает -C(R50)=CH-COOR, специалист в данной области техники должен понимать, что, если R6 обозначает -СНО, представленные методики или их модификации приводят к продукту, в котором R6 обозначает -C(R50)=CH-COOR. Кроме того, специалист в данной области техники должен понимать, что методики, представленные на схеме 5, или их модификации также можно использовать для превращения диаминового предшественника общей формулы IV, представленного выше на схемах 2 и 3, или его соответствующим образом защищенного производного, или подходящего промежуточного продукта при его получении, в котором один из R5 и R6 обозначает -СНО, в диаминовый предшественник общей формулы IV, или его соответствующим образом защищенное производное, или подходящий промежуточный продукт при его получении, в котором один из R5 и R6 обозначает -C(R50)=CH-COOR, где R50 и R являются такими, как определено выше в настоящем изобретении. Альдегидный промежуточный продукт IIIc (на схеме 4) можно превратить в кетон общей формулыIIIf путем алкилирования подходящим нуклеофильным алкилирующим реагентом, хорошо известным специалистам в данной области техники, таким как алкиллитий, и т.п., с последующим окислением промежуточного вторичного спирта в кетон с помощью окислительных реагентов, хорошо известных специалисту в данной области техники, таких как 1,1,1-трис-(ацетилокси)-1,1-дигидро-1,2-бензйодоксол-3(1 Н)-он (также известный как перйодинан Десса-Мартина) и т.п. Затем кетон IIIf можно превратить в аминный промежуточный продукт общей формулы IIId по стандартной методике Хорнера-Эммонса или аналогичным методикам, таким как методика Виттига, и т.п., хорошо известным специалисту в данной области техники, с последующим удалением ЗГ по известным стандартным методикам. В случае, когда ЗГ представляет собой группу Boc, такие методики включают, но не ограничиваются только ими, обработку кислотой, такой как трифторуксусная кислота, раствор HCl в диоксане и т.п. Альтернативно, аминные промежуточные продукты общей формулы III, представленные на схеме 1, где один из R5 и R6 обозначает -CH=C(R50a)-COOR, где R50a выбран из группы, включающей Н,(С 1-С 6)алкил и галоген, и где R обозначает (С 1-С 6)алкил, можно получить из соответствующих аминных промежуточных продуктов общей формулы III или их соответствующим образом защищенных производных, в которых один из R5 и R6 обозначает X, где X обозначает отщепляющую группу, такую как атома галогена, сульфонатный сложный эфир и т.п., при типичных условиях проведения реакции Хека,как представлено на схеме 6 и дополнительно описано в приведенных ниже примерах. Хотя схема 6 описывает получение конкретных аминных промежуточных продуктов общей формулы III, в которой R5 обозначает -CH=C(R50a)-COOR, специалист в данной области техники должен понимать, что, если R6 обозначает X, то представленные методики или их модификации приводят к продукту, в котором R6 обозначает -CH=C(R50a)-COOR. Кроме того, специалист в данной области техники должен понимать, что методики, представленные на схеме 6, или их модификации также можно использовать для превращения диаминового предшественника общей формулы IV, представленного выше на схемах 2 и 3, или его соответствующим образом защищенного производного, или подходящего промежуточного продукта при его получении, в котором один из R5 и R6 обозначает X, в диаминовый предшественник общей формулы IV,или его соответствующим образом защищенное производное, или подходящий промежуточный продукт при его получении, в котором один из R5 и R6 обозначает -CH=C(R50a)-COOR, в которой R50a и R являются такими, как определено выше в настоящем изобретении. Схема 6 Примеры Настоящее изобретение более подробно иллюстрируется приведенными ниже неограничивающими примерами. Как хорошо известно специалисту в данной области техники, если необходимо защитить компоненты реакции от воздействия воздуха или влаги, то реакции проводят в атмосфере азота или аргона. Температуры приведены в градусах Цельсия. Флэш-хроматографию проводят на силикагеле. Выраженные в процентах концентрации в растворах или отношения являются объемными, если не указано иное. Масс-спектроскопические исследования проводят с помощью масс-спектрометрии с ионизацией электрораспылением. Анализ с помощью ВЭЖХ проводят при стандартных условиях на колонке Combiscreen ODS-AQ C18 с обращенной фазой, YMC, 504,6 мм внутренний диаметр, 5 мкм, 120 при 220 нМ, при элюировании в линейном градиентном режиме так, как это описано в представленной ниже таблице (растворитель А представляет собой 0,1% ТФК в Н 2 О; растворитель В представляет собой 0,1% ТФК в CH3CN):- 17013207 Выше и ниже в настоящем изобретении используются следующие аббревиатуры и обозначения: АсОН: уксусная кислота; Ас 2 О: уксусный ангидрид; ВОС или Boc: трет-бутоксикарбонил; БОФ: бензотриазол-1-илокси-трис(диметиламино)фосфонийгексафторфосфат; БроФ: бром-трис(диметиламино)фосфонийгексафторфосфат;dba: дибензилиденацетон; ДЦК: 1,3-дициклогексилкарбодиимид; ДХМ: дихлорметан; ДЦМА: дициклогексилметиламин; ДИБАЛ-Г: диизобутилалюминийгидрид; МИСД: модифицированная Иглом среда Дульбекко; ДМФ: N,N-диметилформамид; ДМСО: диметилсульфоксид; ЕС 50: 50% эффективная концентрация; ЭДАК: то же, что и ЭДК; ЭДК: 1 -(3-диметиламинопропил)-3-этилкарбодиимидгидрохлорид; ИЭ-: электрораспыление (отрицательная ионизация); ИЭ+: электрораспыление (положительная ионизация);MeCN: ацетонитрил; МеОН: метанол; МС (ИЭ): масс-спектрометрия с электрораспылением; ЯМР: спектроскопия ядерного магнитного резонанса; ЗФФ: забуференный фосфатом физиологический раствор; Стадия 1. Индол-6-карбоновую кислоту 1-1 (5,0 г, 31,0 ммоль) растворяли в МеОН (100 мл), прибавляли каталитическое количество H2SO4 (1,0 мл) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 16 ч. Небольшое количество твердого K2CO3 прибавляли для нейтрализации избытка H2SO4 и перемешивание продолжали при КТ в течение 1 ч. Реакционную смесь концентрировали в вакууме для удаления МеОН, разбавляли с помощью насыщенным водным раствором NaHCO3(50 мл) и экстрагировали с помощью EtOAc (200 мл). Органический слой промывали рассолом(100 мл), сушили над безводным MgSO4 и концентрировали досуха. Полученный остаток очищали с помощью флэш-хроматографии на колонке, используя 30% EtOAc в гексане в качестве элюента, и получали чистый метиловый эфир 1-2 (4,78 г, выход 88%). Стадия 2. Метиловый эфир 1-2, полученный на стадии 1 (3,31 г, 18,9 ммоль), растворяли в MeCN (50 мл) и прибавляли каталитическое количество Yb(OTf)3 (586 мг, 0,95 ммоль). Прибавляли 2-циклопентен-1-он(7,76 мл, 94,5 ммоль) и реакционную смесь перемешивали при кипячении с обратным холодильником в течение 16 ч. Растворитель MeCN удаляли в вакууме, остаток повторно растворяли в EtOAc (200 мл) и экстрагировали насыщенным водным раствором NaHCO3 (100 мл), Н 2 О (50 мл) и рассолом (50 мл). Органический слой сушили над безводным MgSO4 и концентрировали досуха в вакууме. После очистки остатка с помощью флэш-хроматографии на колонке, используя 40% EtOAc в гексане в качестве растворителя в градиентном режиме, искомый циклопентаноновый аддукт 1-3 выделяли в виде порошкообразного вещества бежевого цвета (3,4 г, выход 70%). Стадия 3. К раствору промежуточного циклопентанонового аддукта 1-3, полученного на стадии 2 (3,81 г,14,8 ммоль), в безводном ДМФ (150 мл) при 0 С медленно прибавляли NaH (60% дисперсия в масле, 770 мг, 19,2 ммоль). Реакционную смесь перемешивали при 0 С в течение 5 мин, затем по каплям прибавляли MeI (1,2 мл, 19,2 ммоль) и перемешивание продолжали при 0 С в течение 3 ч. Смеси давали нагреться до КТ и реакцию останавливали путем прибавления насыщенного водного раствора NH4Cl (200 мл). Смесь экстрагировали с помощью EtOAc (2500 мл) и органический слой промывали насыщенным водным раствором NH4Cl (2200 мл), Н 2 О (200 мл) и рассолом (200 мл). Объединенные органические слои сушили над безводным MgSO4, выпаривали досуха и остаток очищали с помощью флэш-хроматографии на колонке (с использованием 30% EtOAc в гексане в качестве элюента) и выделяли N-метилиндольный промежуточный продукт 1-4 в виде бежевого твердого вещества (3,1 г, выход 77%). Стадия 4. В запаянной трубке N-метилиндольный промежуточный продукт 1-4, полученный на стадии 3(1,4 г, 5,16 ммоль), и ДАТС (2,7 мл, 20,6 ммоль) растворяли в CH2Cl2 (50 мл) и перемешивали при кипячении с обратным холодильником в течение 3 дней. Смесь медленно выливали в насыщенный водный раствор NaHCO3 (50 мл) и после прекращения выделения СО 2 смесь экстрагировали с помощью CH2Cl2(2100 мл). Объединенные органические слои промывали рассолом (50 мл), сушили над безводнымMgSO4 и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии на колонке (с использованием растворителей в градиентном режиме от 10 до 20% EtOAc в гексане) и выделяли метиловый эфир 3-(3,3-дифторциклопентил)-1-метил-1H-индол-6-карбоновой кислоты 1-5 (750 мг, выход 50%). Метиловый эфир 3-(3,3-дифторциклопентил)-1-метил-1H-индол-6-карбоновой кислоты 1-5 превращали в промежуточные карбоновые кислоты формулы IIa, в которой R2 является таким, как определено выше в настоящем изобретении, по методикам, описанным в WO 03/010141. Эти промежуточные продукты можно превратить в соединения общей формулы I по методикам, представленным выше на схеме 1 и описанным в WO 03/010141. Стадия 1. Смесь 4-хлор-3-нитрокоричной кислоты 2-1 (500 мг, 2,2 ммоль) и раствор метиламина в ТГФ (2 М,8 мл, 16 ммоль) нагревали в запаянной трубке при 80 С в течение 20 ч. Затем смесь охлаждали до комнатной температуры и концентрировали в оранжевое твердое вещество 2-2, которое использовали на следующей стадии без дополнительной очистки. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метиламина (CH3NH2) на приведенной выше стадии 1 на соответствующий R8-NH2. Стадия 2. Неочищенную промежуточную 4-метиламино-3-нитрокоричную кислоту 2-2, полученную на стадии 1 (488 мг, 2,2 ммоль), растворяли в метаноле (20 мл) и прибавляли эфирный раствор диазометана,пока анализ с помощью ВЭЖХ не указывал на полное превращение кислоты в метиловый эфир. Раствор концентрировали досуха и получали 540 мг метилового эфира 2-3 в виде оранжевого твердого вещества,которое использовали на стадии 3 без дополнительной очистки. Стадия 3. Неочищенный метиловый эфир 2-3, полученный на стадии 2 (540 мг, 2,2 ммоль) и дигидрат SnCl2(2,25 г, 10 ммоль) растворяли в этаноле (20 мл) и смесь перемешивали при 80 С в течение 4 ч. После этого периода смесь охлаждали до комнатной температуры и медленно прибавляли к насыщенному водному раствору NaHCO3. Реакционную смесь экстрагировали этилацетатом (100 мл), органический слой сушили над безводным MgSO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке, используя градиентный режим гексана в этилацетате (от 50 до 30%), и получали метиловый эфир (Е)-3-(3-амино-4-метиламинофенил)акриловой кислоты 2-4 в виде желтого твердого вещества (245 мг). Пример 3. Метиловый эфир (Е)-3-[2-(1-аминоциклобутил)-1-метил-1H-бензимидазол-5-ил]акриловой кислоты. Метиловый эфир (Е)-3-(3-амино-4-метиламинофенил)акриловой кислоты 2-4, полученный в примере 2 (40 мг, 0,194 ммоль), суспендировали в CH2Cl2 (3 мл) и прибавляли гидрохлорид хлорангидрида 1-аминоциклобутанкарбоновой кислоты, полученной из 1-аминоциклобутанкарбоновой кислоты по измененной методике, описанной в публикации Е.S. Uffelman et al. (Org. Lett. 1999, 1, 1157), (31 мг,0,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, затем концентрировали и получали белое твердое вещество. Затем твердое вещество растворяли в уксусной кислоте(5 мл) и нагревали при 60 С в течение 20 ч. Неочищенную реакционную смесь разбавляли насыщенным водным раствором NaHCO3, экстрагировали с помощью CH2Cl2 (250 мл) и рассолом, органический слой сушили над безводным MgSO4 и растворитель удаляли при пониженном давлении и получали метиловый эфир (Е)-3-[2-(1-аминоциклобутил)-1-метил-1H-бензимидазол-5-ил]акриловой кислоты 3-1 в виде светло-коричневого вспененного вещества (53 мг). Раствор 3-циклопентил-1-метил-2-пиридин-2-ил-1H-индол-6-карбоновой кислоты 4-1, полученной по методикам, описанным в WO 03/010141 (31,1 мг, 0,97 ммоль), метиловый эфир (Е)-3-[2-(1-аминоциклобутил)-1-метил-1H-бензимидазол-5-ил]акриловой кислоты 4-2, полученный из этилового эфира аналога соединения 2-4 по методике, аналогичной описанной в примере 3 (27,7 мг, 0,97 ммоль), ТУГА (47,9 мг, 0,126 ммоль) и Et3N(58 мкл, 0,42 ммоль) в ДМСО (2 мл) перемешивали при КТ в течение 3 ч. После этого периода прибавляли NaOH (280 мкл, 2,5 н.) и реакционную смесь перемешивали при КТ в течение 16 ч. Реакционную смесь нейтрализовывали путем прибавления нескольких капель уксусной кислоты и очищали на содержащей обращенную фазу С 18 полупрепаративной колонке для ВЭЖХ (с использованием растворителей в градиентном режиме от 5 до 100% MeCN в Н 2 О (все растворители содержали 0,1% трифторуксусной кислоты и выделяли конечный ингибитор (Е)-3-(2-1-[(3-циклопентил-1-метил-2-пиридин-2-ил-1H-индол 6-карбонил)амино]циклобутил-1-метил-1H-бензимидазол-5-ил)акриловую кислоту 4-3 (соединение 4001, табл. 4) в виде белого аморфного твердого вещества, обладающего чистотой 95% (45 мг, выход 78%). 1 Н ЯМР (400 МГц, ДМСО):1,48-1,58 (m, 2H), 1,75-1,85 (m, 6H), 1,85-1,95 (m, 1 Н), 2,05-2,15 (m,1H), 2,69-2,76 (т, 2 Н), 2,98-3,10 (m, 3 Н), 3,63 (s, 3 Н), 3,82 (s, 3 Н), 6,59 (d, J=16 Гц, 1H), 7,42 (dd, J=0,8 и 5,7 Гц, 1 Н), 7,51 (d, J=1,1 Гц, 1 Н), 7,53 (d, J=8,5 Гц, 1 Н), 7,65 (d, J=8,5 Гц, 1H), 7,71 (d, J=8,4 Гц, 1 Н), 7,76 (d,J=16 Гц, 1H), 7,82 (d, J=8,4 Гц, 1 Н), 7,92 (ddd, J=1,6 и 7,8 Гц, 1H), 8,01 (s, 1H), 8,04 (s, 1H), 8,73 (d, J=4,1 Гц, 1H), 9,45 (s, 1H). Пример 5. 1-[5-Е)-2-Карбамоилэтенил)-1-метил-1H-бензимидазол-2-ил]циклобутиламид 3-циклопентил-1 метил-2-пиразин-2-ил-1H-индол-6-карбоновой кислоты. Стадия 1. 3-Циклопентил-1-метил-2-пиразин-2-ил-1H-индол-6-карбоновую кислоту 5-1 (полученную по методикам,описанным в WO 03/010141) и этиловый эфир (Е)-3-[2-(1-аминоциклобутил)-1-метил-1H-бензимидазол-5 ил]акриловой кислоты 4-2 вводили в реакцию сочетания с последующим омылением этилового эфира по методикам, аналогичным описанным в примере 4, и получали (Е)-3-(2-1-[(3-циклопентил-1-метил-2-пиразин-2-ил 1H-индол-6-карбонил)амино]циклобутил-1-метил-1H-бензимидазол-5-ил)акриловую кислоту 5-2 (соединение 4003, табл. 4). 1 Н ЯМР (400 МГц, ДМСО-d6):1,50-1,58 (m, 2H), 1,78-1,20 (m, 7H), 2,05-2,15 (m, 1H), 2,65-2,75 (m,2H), 2,97-3,10 (m, 3 Н), 3,66 (s, 3 Н), 3,81 (s, 3 Н), 6,57 (d, J=16,0 Гц, 1H), 7,55 (dd, J=1,0 и 8,4 Гц, 1H), 7,68(68 мг, 0,18 ммоль), гидрокарбонат аммония (20 мг, 0,26 ммоль) и Et3N (36 мкл, 0,26 ммоль) в ДМСО (3 мл) перемешивали при КТ в течение 3 ч. Реакционную смесь нейтрализовывали путем прибавления нескольких капель уксусной кислоты и очищали на содержащей обращенную фазу C18 полупрепаративной колонке для ВЭЖХ (с использованием растворителей в градиентном режиме от 5 до 100% MeCN в Н 2 О (все растворители содержали 0,1% трифторуксусной кислоты и выделяли ингибитор, 1-[5-Е)-2-карбамоилэтенил)-1-метил-1Hбензимидазол-2-ил]циклобутиламид 3-циклопентил-1-метил-2-пиразин-2-ил-1H-индол-6-карбоновой кислоты 5-3 (соединение 1005, табл. 1) в виде бледно-желтого аморфного твердого вещества, обладающего чистотой 95% (17 мг, 34% выход).(1,0 мл) перемешивали при кипячении с обратным холодильником в течение 3 дней. Растворитель выпаривали в вакууме и остаток повторно растворяли в EtOAc (200 мл), промывали холодной Н 2 О(50 мл), холодным насыщенным водным раствором NaHCO3 (50 мл) и холодным рассолом (50 мл). Органический слой затем сушили над безводным MgSO4, концентрировали досуха и получали метиловый эфир 6-2 в виде белого твердого вещества, которое использовали без очистки на стадии 2. Стадия 2. К раствору неочищенного метилового эфира 6-2, полученного на стадии 1 (55,2 ммоль), в МеОН(200 мл) прибавляли катализатор Перлмана (20% гидроксид палладия на угле, 1,0 г) и смесь перемешивали в атмосфере Н 2 в течение 20 ч при КТ. Смесь фильтровали через целит и концентрировали досуха. Остаток повторно растворяли в ТГФ (200 мл), Ас 2 О (6,2 мл, 66 ммоль) прибавляли и раствор перемешивали при КТ в течение 3 ч. Реакционную смесь концентрировали досуха в вакууме и остаток повторно растворяли в минимальном объеме трет-бутилметилового эфира (150 мл). Эфирную суспензию перемешивали при КТ в течение 1 ч, а затем прибавляли гексан (100 мл) и осаждали искомый ацетилированный промежуточный продукт в виде белого твердого вещества. Твердое вещество промывали гексаном, сушили и получали ацетилированное соединение 6-3 высокой чистоты (10,1 г, выход 88%). Стадия 3. Раствор ацетилированного сложного эфира 6-3, полученного на стадии 2 (8,42 г, 40,6 ммоль), и нитрата калия (5,0 г, 50 ммоль) в AcOH:H2SO4 (соотношение 1:1, 200 мл) перемешивали при КТ в течение 2 ч и при 40 С в течение еще 2 ч. Неочищенную затем реакционную смесь медленно выливали на лед(1 л) и перемешивали в течение 20 мин. Образовавшийся осадок отфильтровывали, промывали несколько раз с помощью Н 2 О и получали смесь в основном двух продуктов, искомого 4-нитроизомера 6-4 и нежелательного 6-нитроизомера 6-5 (соотношение 1:2), которые разделяли после флэш-хроматографии на колонке с использованием 30% EtOAc в гексане в качестве элюента. Чистый 4-нитроизомер 6-4 выделяли в виде желтого твердого вещества (2,05 г, выход 20%). Стадия 4. Промежуточный 4-нитропродукт 6-4, полученный на стадии 3 (2,05 г, 8,13 ммоль), растворяли в ТГФ (50 мл) и раствор охлаждали до 0 С, а затем медленно прибавляли MeI (2,51 мл, 40,6 ммоль) иt-BuONa (4,46 г, 46,4 ммоль). Реакционную смесь перемешивали при КТ в течение 15 ч, прибавляли Н 2 О(50 мл) и водную смесь промывали трет-бутилметиловым эфиром (20 мл). Водный слой подкисляли до рН 3 с помощью 1 н. HCl и затем экстрагировали с помощью EtOAc (100 мл). Органический слой промывали рассолом (50 мл), сушили над безводным MgSO4 и концентрировали досуха и получалиN-метилированное соединение 6-6 в виде смолообразного вспененного вещества, которое использовали непосредственно на стадии 5 без очистки. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, в которых R8 не обозначает метил, можно получить путем замены метилйодида (CH3I) на приведенной выше стадии 4 на соответствующий R8-X, где X обозначает отщепляющую группу, такую как Cl, Br, I, метансульфонат (мезилат),п-толуолсульфонат (тозилат), трифторметансульфонат (трифлат) и т.п. Стадия 5. Раствор метилированного производного 6-6, полученного на стадии 4 (8 ммоль), в МеОН (10 мл) иHCl (8 н., 15 мл) перемешивали при 70 С в течение 20 ч. Растворитель выпаривали в вакууме и остаток подвергали распределению между насыщенным водным раствором NaHCO3 (20 мл) и EtOAc (50 мл). Органический слой промывали рассолом, сушили над безводным MgSO4, концентрировали и получали метиловый эфир 6-7 в виде оранжевого твердого вещества (1,54 г), которое использовали на стадии 6 без очистки. Стадия 6. Раствор неочищенного метилового эфира 6-7, полученного на стадии 5 (1,54 г, 6,7 ммоль), в МеОН(30 мл) обрабатывали при условиях каталитического гидрирования с использованием Pd/C (10%, 150 мг) в атмосфере Н 2 при КТ в течение 2 ч. Реакционную смесь фильтровали через целит, концентрировали и получали метиловый эфир 4-амино-2-метил-5-(метиламино)бензойной кислоты 6-8 в виде пурпурного твердого вещества (1,33 г), которое являлось достаточно чистым (подтверждено с помощью ЯМР), чтобы его можно было использовать без дополнительной очистки. Пример 7. Метиловый эфир 2-(1-трет-бутоксикарбониламиноциклобутил)-3,6-диметил-3H-бензимидазол-5 карбоновой кислоты. 1-1,1-Диметилэтоксикарбонил)амино)циклобутанкарбоновой кислоты (1,40 г, 6,5 ммоль) растворяли в CH2Cl2 (45 мл) и вводили в реакцию с ТУТБ в присутствии Et3N в течение периода времени, равного 30 мин для предварительной активации кислоты. Раствор метилового эфира 4-амино-2-метил-5(метиламино)бензойной кислоты 6-8, полученного в примере 6 (1,33 г, 6,85 ммоль), в CH2Cl2 (10 мл) медленно прибавляли в течение 30 мин и перемешивание реакционной смеси продолжали в течение 20 ч. Реакционную смесь концентрировали досуха, остаток повторно растворяли в АсОН (10,0 мл) и перемешивали при 70 С в течение 2 ч для обеспечения циклизации бензимидазольного кольца. Реакционную смесь концентрировали досуха и остаток растворяли в EtOAc (250 мл), экстрагировали с помощью насыщенного водного раствора NaHCO3 (2100 мл) и рассола (100 мл). Органический слой сушили над безводным MgSO4 и выпаривали досуха. Остаток очищали с помощью флэш-хроматографии на колонке(с использованием растворителей в градиентном режиме от 40 до 50% EtOAc в гексане), получали чистый метиловый эфир 2-(1-трет-бутоксикарбониламиноциклобутил)-3,6-диметил-3H-бензимидазол-5 карбоновой кислоты 7-1 в виде бежевого твердого вещества (1,41 г, выход 55%) и извлекали некоторое количество непрореагировавшего исходного диамина. Метиловый эфир 2-(1-трет-бутоксикарбониламиноциклобутил)-3,6-диметил-3H-бензимидазол-5 карбоновой кислоты 7-1 можно превратить в аминный промежуточный продукт общей формулы III,представленный на схеме 1, с использованием стандартных реагентов, известных специалисту в данной области техники. Такие реагенты включают, но не ограничиваются только ими, трифторуксусную кислоту, раствор HCl в диоксане и т.п. Соответствующий аминный промежуточный продукт общей формулыIII, представленный на схеме 1, затем можно превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4. Пример 8. Этиловый эфир (Е)-3-[2-(1-аминоциклобутил)-3,6-диметил-3H-бензимидазол-5-ил]-2-метилакриловой кислоты. Стадия 1. Метиловый эфир 2-(1-трет-бутоксикарбониламиноциклобутил)-3,6-диметил-3H-бензимидазол-5 карбоновой кислоты 7-1, полученный в примере 7 (1,41 г, 3,8 ммоль), растворяли в ТГФ (40 мл) и рас- 23013207 твор охлаждали до 0 С. Медленно прибавляли раствор ДИБАЛ-Г (18 мл, 1M в ТГФ, 18 ммоль) и реакционную смесь перемешивали при 0 С в течение 1 ч и затем при 50 С в течение 4 ч. Реакционную смесь охлаждали до КТ, очень медленно прибавляли раствор калийнатрийтартрата (1 М, 50 мл) и перемешивание продолжали в течение 1 ч при КТ. Раствор концентрировали в вакууме для удаления большей части ТГФ и экстрагировали с помощью EtOAc (200 мл). Органический слой промывали насыщенным водным раствором NaHCO3 (50 мл) и рассолом (50 мл), сушили над безводным MgSO4 и концентрировали досуха. Остаток очищали с помощью флэш-хроматографии на колонке, используя растворители в градиентном режиме от 50% EtOAc в гексане до чистого EtOAc и затем до 3% МеОН в EtOAc, и получали чистый спирт 8-1 в виде желтого твердого вещества (1,09 г, выход 84%). Стадия 2. Раствор спирта 8-1, полученного на стадии 1 (1,09 г, 3,16 ммоль), и перйодинан Десса-Мартина(1,70 г, 4,0 ммоль) в CH2Cl2 (40 мл) перемешивали при КТ в течение 2 ч. Растворитель выпаривали в вакууме и остаток очищали с помощью флэш-хроматографии на колонке, используя EtOAc:гексан (1:1 соотношение), и получали чистый альдегид 8-2 (605 мг, выход 56%). Стадия 3. Раствор триэтил-2-фосфонопропионата (0,228 мл, 1,06 ммоль) в ТГФ (5,4 мл) охлаждали до 0 С и прибавляли NaH (42,5 мг, 60% в масле, 1,06 ммоль). Смесь перемешивали при 0 С в течение 30 мин, а затем медленно прибавляли раствор альдегида 8-2, полученного на стадии 2 (300 мг в 3 мл ТГФ,0,874 ммоль), и перемешивание продолжали при КТ в течение 20 ч. Смесь разбавляли с помощью EtOAc(100 мл) и промывали насыщенным водным раствором NaHCO3 (230 мл) и рассолом (30 мл). Органический слой сушили над безводным MgSO4 и концентрировали в коричневый остаток, который затем очищали с помощью флэш-хроматографии на колонке, используя растворители в градиентном режиме от 40 до 60% EtOAc в гексане, и получали содержащий защитную группу N-Boc сложный эфир 8-3 в виде желтого вспененного вещества (85 мг, 23% выход). Стадия 4. Гидролиз защитной группы Boc проводили количественно путем прибавления 4 н. HCl в диоксане(2 мл) и перемешивали раствор при КТ в течение 1 ч. После выпаривания растворителя в вакууме выделяли чистый этиловый эфир (Е)-3-[2-(1-аминоциклобутил)-3,6-диметил-3H-бензимидазол-5-ил]-2 метилакриловой кислоты 8-4 в виде желтого твердого вещества (79 мг). Специалисту в данной области техники должно быть понятно, что триэтил-2-фосфонопропионат,использованный на стадии 3 этой методики, можно заменить на соответствующим образом замещенные производные и получить аналоги общей формулы IIIe, представленные выше на схеме, где R50 является таким, как определено выше в настоящем изобретении. Кроме того, метиловые эфиры также можно получить аналогичным образом с использованием соответствующего реагента. Соединение 8-4 и его аналоги общей формулы IIIe, приведенной выше, затем можно превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4. Пример 9. 3-Фтор-4-нитробензальдегид. Стадия 1. В двугорлую колбу (снабженную внутренним термометром) помещали ледяную уксусную кислоту АсОН (252 мл), уксусный ангидрид (252,0 мл) и 2-фтор-4-метил-1-нитробензол 9-1 (25,0 г, 161 ммоль) при -10 С. При охлаждении к раствору в течение 5 мин по каплям прибавляли концентрированную серную кислоту (40 мл), а затем очень медленно прибавляли оксид хрома(VI) (45 г, 450 ммоль); скорость прибавления должна быть очень низкой (1,5 ч), так чтобы поддерживать температуру ниже 10 С. После прибавления CrO3 прозрачный бесцветный раствор приобретал янтарную окраску, а в конце прибавления становился темно-коричневым. После завершения прибавления реакционную смесь перемешивали в течение еще 45 мин (анализ с помощью ВЭЖХ показывал, что реакция протекла на 70%). Смолообразную частичную суспензию выливали на лед (1,6 л) и полученную массу разбавляли с помощью Н 2 О до объема, равного 3 л, и к этому моменту продукт начинал осаждаться. После фильтрования бежевое твердое вещество промывали холодной Н 2 О и получали белое твердое вещество. Твердое вещество затем суспендировали в холодном 2% NaHCO3 (250 мл), фильтровали и повторно промывали холодной Н 2 О и получали диацетат 9-2 (22 г, содержащий некоторое количество непрореагировавшего исходного вещества) в виде белого твердого вещества, которое использовали без обработки на стадии 2.- 24013207 Стадия 2. Во флаконе с винтовой пробкой диацетат 9-2, полученный на стадии 1 (1,0 г, 3,7 ммоль), растворяли в ледяной уксусной кислоте (10,0 мл), а затем прибавляли Н 2 О (1,0 мл) и концентрированную HCl(1,0 мл). Полученную частично растворимую смесь нагревали при 115 С в течение 45 мин. Большую часть растворителей удаляли в вакууме и получали смолообразный остаток, оставшуюся кислоту и Н 2 О дважды удаляли с помощью азеотропной перегонки со смесью CH2Cl2-гексан и получали искомый полуочищенный 3-фтор-4-нитробензальдегид 9-3 в виде желтого твердого вещества (600 мг). Это соединение дополнительно очищали с помощью флэш-хроматографии на колонке (с использованием 20% EtOAc в гексанах в качестве элюента) для удаления небольших количеств непрореагировавшего 2-фтор-4-метил 1-нитробензола 9-1 (полный выход 35%). Пример 10. Этиловый эфир (Е)-3-(4-амино-3-(метиламино)фенил)акриловой кислоты.(60% дисперсия в масле, 314 мг, 7,84 ммоль) и смесь перемешивали в течение 30 мин. После этого периода прибавляли 3-фтор-4-нитробензальдегид 9-3, полученный в примере 9 (1,06 г, 6,27 ммоль), и перемешивание продолжали при КТ в течение 16 ч. Реакцию останавливали путем прибавления Н 2 О (20 мл) и продукт экстрагировали с помощью EtOAc (2100 мл). Объединенные органические слои промывали рассолом, сушили над безводным MgSO4, концентрировали и получали коричный сложный эфир 10-1 в виде светло-оранжевого твердого вещества, которое использовали на стадии 2 без очистки. Специалисту в данной области техники должно быть понятно, что аналоги, содержащие различные заместители у циннаматной двойной связи, можно получить путем замены триэтилфосфоноацетата, используемого в этой методике, на соответствующим образом замещенные производные или путем замены альдегида 9-3 на соответствующий кетон. Кроме того, циннаматные метиловые эфиры также можно получить аналогичным образом с использованием соответствующего реагента. Стадия 2. Циннаматный сложный эфир 10-1, полученный на стадии 1 (6,27 ммоль), и метиламин (2 M B ТГФ,6,3 мл, 12,5 ммоль) растворяли в ДМСО (6 мл) и реакционную смесь перемешивали при КТ в течение 2 ч. После этого периода смесь разбавляли с помощью EtOAc (100 мл) и органический слой промывали с помощью Н 2 О (330 мл) и рассола (50 мл), сушили над безводным MgSO4, концентрировали и получали неочищенный метиламиновый промежуточный продукт 10-2 в виде оранжевого твердого вещества. Этот продукт использовали на стадии 3 без очистки. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метиламина (CH3NH2) на приведенной выше стадии 2 на соответствующий R8-NH2. Стадия 3. 3-Метиламино-4-нитроциннаматный сложный эфир 10-2, полученный на стадии 2 (2-2, 150 мг), и дигидрат SnCl2 (950 мг, 4,2 ммоль) растворяли в этаноле (10 мл) и смесь перемешивали при 80 С в течение 20 ч. Смесь охлаждали до комнатной температуры и концентрировали досуха. Остаток растворяли в этилацетате (100 мл), медленно прибавляли к насыщенному водному раствору NaHCO3 и перемешивали в течение 30 мин. Органический слой затем экстрагировали охлажденным льдом рассолом, сушили над безводным MgSO4 и растворитель удаляли при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на колонке (с использованием градиента от 70 до 60% гексана в этилацетате) и получали этиловый эфир (Е)-3-(4-амино-3-(метиламино)фенил)акриловой кислоты 10-3 в виде желтого твердого вещества (100 мг). Этиловый эфир (Е)-3-(4-амино-3-(метиламино)фенил)акриловой кислоты можно превратить в аминные производные общей формулы III, представленные на схеме 1, по методикам, приведенным в примерах 3 или 7, и затем превратить в ингибиторы общей формулы I, представленные на схеме 1 с использованием методики, приведенной в примере 4. Стадия 1. Раствор 2-метил-4-нитробензонитрила 11-1 (2,53 г, 15,6 ммоль) в водном растворе NaOH (10%,31,0 мл) и водном растворе Н 2 О 2 (10%, 16 мл) перемешивали при кипячении с обратным холодильником в течение 2,5 ч. Циркуляцию воды в холодильнике останавливали на 5-10 мин (чтобы обеспечить удаление растворенного аммиака) и затем поток воды возобновляли и кипячение с обратным холодильником продолжали в течение еще 1,5 ч. Реакционную смесь охлаждали до КТ по каплям до установления значения рН, равного 3, прибавляли HCl (концентрированную) и в этот момент карбоновая кислота 11-2 осаждалась в виде оранжевого твердого вещества (3,60 г). Карбоновую кислоту использовали на стадии 2 без очистки. Стадия 2. Раствор кислоты 11-2, полученной на стадии 1 (3,60 г, 15,6 ммоль), в МеОН (30 мл) и HCl (4 н. HCl в диоксане, 2,0 мл) кипятили с обратным холодильником в течение 48 ч. Растворитель выпаривали досуха в вакууме и полученный остаток повторно растворяли в EtOAc (200 мл). Раствор промывали насыщенным водным раствором NaHCO3 (100 мл) и рассолом (100 мл), сушили над безводным MgSO4, выпаривали досуха и получали промежуточный сложный эфир 11-3 в виде желтого твердого вещества(2,38 г). Это вещество использовали на стадии 3 без очистки. Стадия 3. К раствору сложного эфира 11-3, полученного на стадии 2 (1,27 г, 6,5 ммоль) в H2SO4 (концентрированная, 13,0 мл), предварительно охлажденного до 0 С, очень медленно прибавляли KNO3 (760 мг,7,5 ммоль). Через несколько минут перемешивания баню со льдом удаляли и реакционную смесь перемешивали при КТ в течение 20 ч. Затем реакционную смесь медленно выливали на лед (50 мл), перемешивали до плавления льда и искомый динитропродукт 11-4 осаждали и фильтровали (1,55 г светложелтого и немного влажного твердого вещества). Это соединение использовали без обработки на стадии 4. Стадия 4. К раствору промежуточного динитропродукта 11-4, полученного на стадии 3 (1,55 г, 6,45 ммоль) в ТГФ (15,0 мл) при 0 С, прибавляли раствор метиламина (2 М в ТГФ, 15,2 мл, 32,3 ммоль), баню со льдом удаляли и реакционную смесь перемешивали при КТ в течение 1,5 ч. Раствор концентрировали для удаления части ТГФ и затем разбавляли с помощью EtOAc (100 мл). Органический слой промывали с помощью Н 2 О (50 мл) и рассола (50 мл), сушили над безводным MgSO4, концентрировали и получали метиламиновый промежуточный продукт 11-5 в виде оранжевого твердого вещества (1,26 г). Соединение использовали на стадии 5 без дополнительной очистки. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метиламина (CH3NH2) на приведенной выше стадии 4 на соответствующий R8-NH2. Стадия 5. К раствору метиламинового производного 11-5, полученного на стадии 4 (1,25 г, 5,58 ммоль), вEtOH-Н 2 О (110 мл, 1:1 соотношение), прибавляли K2CO3 (4,62 г, 33,5 ммоль) и Na2S2O4 и смесь перемешивали при КТ в течение 3 ч. Прибавляли дополнительное количество Н 2 О (30 мл) и смесь концентрировали в вакууме для удаления большей части EtOH. Затем реакционную смесь разбавляли с помощьюEtOAc (200 мл) и органический слой отделяли и экстрагировали рассолом. Органический слой сушили над безводным MgSO4, концентрировали в вакууме и получали метиловый эфир 5-амино-2-метил-4(метиламино)бензойной кислоты 11-6 (927 мг, выход 86%) в виде коричневого твердого вещества. Соединение 11-6 можно превратить в соответствующие аминные промежуточные продукты общей формулы III, представленные на схеме 1, на которой R6 обозначает СН 3 и R5 обозначает -СООСН 3, по методикам, приведенным в примерах 3 или 7. Эти аминные промежуточные продукты затем можно превратить в аминные промежуточные продукты общей формулы III, представленные на схеме 1, на которой- 26013207 аминные промежуточные продукты общей формулы III, представленные на схеме 1, затем можно превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4. Пример 12. Метиловый эфир (Е)-3-(5-амино-2-этокси-4-(метиламино)фенил)акриловой кислоты. Стадия 1. 2-Этокси-4-нитробензойную кислоту 12-1 (1,56 г; 7,38 ммоль) растворяли в метаноле (15 мл) и полученный раствор перемешивали при 0 С. Медленно прибавляли раствор диазометана в этиловом эфире,пока сохранялась желтая окраска, и перемешивали в течение еще 20 мин. Растворители выпаривали и получали метиловый эфир 12-2 в виде бледно-желтого твердого вещества (1,66 г, количественный выход), которое использовали на стадии 2 без дополнительной очистки. Стадия 2. Сложный эфир 12-2, полученный на стадии 1 (1,60 г; 7,10 ммоль), растворяли в сухом толуоле и раствор охлаждали до -78 С в атмосфере азота. Прибавляли раствор диизобутилалюминийгидрида в тетрагидрофуране (1 М; 8 мл; 8 ммоль) и реакционной смеси давали нагреться до температуры окружающей среды. Через 1 ч и еще через 1,5 ч таким же образом прибавляли еще две порции ДИБАЛ-Г (7 и 10 мл). Через 0,5 ч после последнего прибавления реакционную смесь охлаждали до 0 С и медленно прибавляли 1 н. HCl (25 мл) и смесь энергично перемешивали в течение 0,5 ч. Затем органические растворители выпаривали и водный остаток экстрагировали этилацетатом (250 мл) и промывали водой (50 мл) и рассолом (50 мл). Объединенные экстракты затем сушили над MgSO4, выпаривали и получали спирт 12-3 в виде бледно-желтого волокнистого твердого вещества (1,40 г; количественный выход), которое использовали без обработки на стадии 3. Стадия 3. Мутный раствор 1,1,1-трис-(ацетилокси-1,1-дигидро-1,2-бензйодоксол-3-(1H)-она (перйодинана Десса-Мартина) (2,32 г; 5,47 ммоль) в дихлорметане (40 мл + 5 мл для промывки) при перемешивании прибавляли к раствору спирта 12-3, полученного на стадии 2 (0,98 г; 4,97 ммоль), в ДХМ (40 мл) и реакционную смесь перемешивали при температуре окружающей среды в атмосфере азота. Через 4 ч прибавляли смесь насыщенный раствор NaHCO3/10% Na2S2O3 (1:1, 160 мл) и смесь энергично перемешивали,пока фазы не становились прозрачными (примерно 0,5 ч). Органическую фазу отделяли и водную фазу экстрагировали дихлорметаном (50 мл) и промывали насыщенным раствором NaHCO3 (2150 мл). Объединенные органические фазы затем сушили над MgSO4, выпаривали и получали альдегид 12-4 в виде бледно-желтого твердого вещества (960 мг; 99%), которое использовали без обработки на стадии 4. Стадия 4. Гидрид натрия (95% сухой порошок; 158 мг; 6,25 ммоль) суспендировали в безводном ТГФ (10 мл) и при 0 С в атмосфере азота по каплям прибавляли триметилфосфоноацетат (0,945 мл; 5,84 ммоль), что приводило к образованию твердой белой массы, которую было невозможно перемешивать. Затем по каплям прибавляли раствор альдегида 12-4, полученного на стадии 3 (950 мг; 4,87 ммоль), в ТГФ (7 мл + 3 мл промывка), что приводило к окрашиванию в желтый цвет и медленному растворению белой твердой массы. По окончании прибавления реакционной смеси давали нагреться до температуры окружающей среды. Через 15 ч мутную реакционную смесь выпаривали с получением бледно-желтого твердого вещества,которое экстрагировали этилацетатом (250 мл) и промывали насыщенным раствором NaHCO3(375 мл). Объединенные экстракты сушили над MgSO4, выпаривали и получали циннаматный сложный эфир 12-5 в виде бледно-желтого твердого вещества (1,212 г; 99%), которое использовали на стадии 5 без дополнительной очистки. Специалисту в данной области техники должно быть понятно, что триметилфосфоноацетат, используемый в этой методике, можно заменить на соответствующим образом замещенные производные и получить аналоги, содержащие различные заместители у циннаматной двойной связи. Стадия 5. 4-Нитро-2-этоксициннамат 12-5, полученный на стадии 4 (303 мг, 1,206 ммоль), растворяли в концентрированной серной кислоте (3 мл) и раствор охлаждали до 0 С. Прибавляли нитрат калия (128 мг,- 27013207 1,27 ммоль) и смесь перемешивали в течение 3,5 ч при комнатной температуре. По окончании реакционную смесь выливали на лед и осадившееся твердое вещество собирали фильтрованием. Неочищенный продукт 12-6 промывали водой, сушили в вакууме и использовали без очистки на стадии 6 (390 мг). Стадия 6. Динитропроизводное 12-6, полученное на стадии 5 (390 мг), растворяли в ТГФ (3 мл) и прибавляли метиламин в ТГФ (3,02 мл 2 М раствора в ТГФ). После перемешивания в течение 30 мин летучие вещества удаляли при пониженном давлении и оранжевое твердое вещество 12-7 использовали без обработки на стадии 7. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метиламина (CH3NH2) на приведенной выше стадии 6 на соответствующий R8-NH2. Стадия 7. Нитроарен 12-7, полученный на стадии 6, суспендировали в смеси EtOH (12 мл) и воды (12 мл) и прибавляли K2CO3 (1,00 г, 6 экв.), а затем гидросульфид натрия (1,26 г, 6 экв.). Смесь перемешивали в течение 4 ч при комнатной температуре и EtOH удаляли при пониженном давлении. Остаток экстрагировали с помощью EtOAc и органическую фазу промывали рассолом и сушили (MgSO4). Удаление растворителя и очистка остатка с помощью флэш-хроматографии (от 50 до 75% EtOAc в гексане) давали метиловый эфир (Е)-3-(5-амино-2-этокси-4-(метиламино)фенил)акриловой кислоты 12-8 (162 мг). Метиловый эфир (Е)-3-(5-амино-2-этокси-4-(метиламино)фенил)акриловой кислоты 12-8 можно превратить в аминные промежуточные продукты общей формулы III, указанные в примере 1, по методикам, описанным в примерах 3 или 7, и затем превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4. Специалисту в данной области техники также должно быть понятно, что ингибиторы общей формулы I, представленные на схеме I, где R6 обозначает -ОСН 3 и R5 обозначает -CH=C(R50)-COOR, можно получить с использованием методики, приведенной в примере 12, но с использованием в качестве исходного вещества предшественника, идентичного соединению 12-1, но с заменой этоксигруппы на метоксигруппу. Пример 13. Метиловый эфир 4-амино-2-метокси-5-(метиламино)бензойной кислоты. Стадия 1. Метил-2-метокси-5-нитробензоат 13-1 (6,21 г, 29,4 ммоль) суспендировали в МеОН (100 мл) и прибавляли 20% Pd(OH)2/C (500 мг). Смесь перемешивали в атмосфере водорода (1 атм.) в течение 18 ч. Катализатор удаляли фильтрованием и растворитель выпаривали при пониженном давлении и получали остаток - соединение 13-2 (5,256 г), которое использовали без обработки на стадии 2. Стадия 2. Анилин 13-2, полученный на стадии 1 (5,23 г), растворяли в ТГФ (50 мл) и прибавляли уксусный ангидрид (2,984 г). Смесь перемешивали в течение ночи при комнатной температуре. Белую суспензию концентрировали при пониженном давлении и получали белую пасту, прибавляли трет-бутилметиловый эфир (ТБМЭ, 20 мл) и при перемешивании медленно прибавляли гексан (100 мл). Затем суспензию перемешивали в течение еще 2 ч и твердое вещество собирали фильтрованием. Продукт 13-3 промывали гексаном и сушили на воздухе (6,372 г). Стадия 3. 90% Азотную кислоту (9 мл) разбавляли водой (9 мл) и охлаждали до 0 С. Анилид 13-3, полученный на стадии 2 (5,905 г), прибавляли одной порцией и смесь перемешивали в течение 30 мин на бане из воды со льдом. Затем реакционную смесь по каплям прибавляли к воде со льдом (700 мл) и осадившееся желтое твердое вещество собирали фильтрованием, промывали водой и сушили на воздухе. Оранжевое твердое вещество (5,907 г) по данным 1 Н ЯМР представляло собой обладающую составом 2:1 смесь со- 28013207 единений. Экстракция полученного при этом водного фильтрата с помощью EtOAc давала еще 1 г вещества, которое объединяли с первой порцией и очищали с помощью флэш-хроматографии на силикагеле с использованием 15% EtOAc в CHCl3 в качестве элюента. Получали оранжевое твердое вещество 13-4(4,11 г) (один изомер). Стадия 4. Нитроанилид 13-4, полученный на стадии 3 (3,580 г), растворяли в ТГФ (50 мл) и раствор охлаждали льдом. Двумя порциями с интервалом в 3,5 ч прибавляли йодметан (4,155 мл, 66,7 ммоль, 5 экв.) и трет-бутоксид натрия (6,414 г, 66,7 ммоль, 5 экв.). Перемешивание при комнатной температуре продолжали в течение еще 20 ч после второго прибавления. ТГФ выпаривали при пониженном давлении и прибавляли воду (100 мл). Темно-красный раствор промывали с помощью ТБМЭ (100 мл). Водную фазу подкисляли концентрированной HCl и экстрагировали с помощью EtOAc (2100 мл). Объединенные органические экстракты сушили и концентрировали и получали соединение 13-5 в виде темно-красного порошкообразного вещества (3,78 г), которое использовали без обработки на стадии 5. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метилйодида (CH3I) на приведенной выше стадии 4 на соответствующийR8-X, где X обозначает отщепляющую группу, такую как Cl, Br, I, метансульфонат (мезилат),п-толуолсульфонат (тозилат), трифторметансульфонат (трифлат) и т.п. Стадия 5. Свободную карбоновую кислоту 13-5, полученную на стадии 4 (3,75 г), суспендировали в 8 М HCl(100 мл) и смесь перемешивали при 100 С в течение 8 ч. После охлаждения до комнатной температуры летучие вещества выпаривали в вакууме и остаток 3 раза выпаривали совместно с МеОН. Стадия 6. Остаток, полученный на стадии 5, повторно суспендировали в МеОН (100 мл) и охлаждали водой со льдом. По каплям прибавляли тионилхлорид (5,10 мл, 5 экв.) и суспензию перемешивали при 65 С в течение 4 ч. Летучие вещества удаляли при пониженном давлении и остаток 13-6 дважды выпаривали совместно с МеОН (100 мл) и затем толуолом (2100 мл). Стадия 7. Остаток 13-6, полученный на стадии 6, затем растворяли в МеОН (200 мл), прибавляли 20%Pd(OH)2/C (500 мг) и смесь перемешивали в течение ночи при равном 1 атм давлении газообразного водорода. Затем катализатор удаляли фильтрованием и раствор выпаривали досуха. Остаток растворяли вEtOAc и раствор промывали водным раствором NaHCO3 и сушили (MgSO4). Удаление растворителей давало твердое вещество, которое суспендировали в ТБМЭ (50 мл) и нагревали при 60 С в течение 30 мин. Затем к горячему раствору медленно прибавляли равный объем гексана и осадившийся метиловый эфир 4-амино-2-метокси-5-(метиламино)бензойной кислоты 13-7 собирали фильтрованием, промывали с помощью ТБМЭ-гексан и сушили (2,00 г). Метиловый эфир 4-амино-2-метокси-5-(метиламино)бензойной кислоты 13-7 можно превратить в соответствующие аминовые промежуточные продукты общей формулы III, представленные на схеме 1,по методикам, приведенным в примерах 3 или 7. Эти аминовые промежуточные продукты затем можно превратить в аминовые промежуточные продукты общей формулы III, представленные на схеме 1, на которой R5 обозначает -ОСН 3 и R6 обозначает -CH=C(R50)-COOR, по методике, приведенной в примере 8. Все эти аминовые промежуточные продукты общей формулы III, представленные на схеме 1, затем можно превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики,приведенной в примере 4. Специалисту в данной области техники должно быть понятно, что методику, описанную в примере 13, можно применить к соединению compound 12-2, полученному в примере 12, или к его аналогу, в котором этоксигруппа заменена на метоксигруппу, и получить диаминовые предшественники общей формулы IV, представленные на схеме 2 или 3, на которой R6 обозначает ОСН 3 или OEt. Такие диаминовые предшественники также можно превратить в аминовые промежуточные продукты общей формулы III,представленные на схеме 1, по методикам, приведенным в примерах 3 или 7, и затем превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4.(30 мл) и прибавляли избыток метиламина (2 M в ТГФ, 21 мл, 42 ммоль). Реакционную смесь перемешивали при КТ, пока анализ с помощью ВЭЖХ не подтверждал полное превращение (2-3 ч). Затем мутный раствор выпаривали с получением оранжевого твердого вещества, которое экстрагировали этилацетатом (250 мл) и промывали с помощью 1 н. HCl (встряхивали до исчезновения темно-коричневой окраски; 100 мл), водой (100 мл) и рассолом (60 мл). Объединенные экстракты сушили над безводнымMgSO4, выпаривали и получали метиламиновый промежуточный продукт 14-1 в виде оранжевого порошкообразного вещества, которое использовали на стадии 2 без дополнительной очистки. Специалисту в данной области техники должно быть понятно, что другие диаминовые промежуточные продукты общей формулы IV, представленные выше на схемах 2 и 3, где R8 не обозначает метил,можно получить путем замены метиламина (CH3NH2) на приведенной выше стадии 1 на соответствующий R8-NH2. Стадия 2. Раствор n-BuLi (2,5 М в ТГФ, 14,4 мл, 36,0 ммоль) в безводном ТГФ (60 мл) медленно прибавляли к раствору ТМС-диазометана (10% в гексане, 18 мл, 36,0 ммоль) при -78 С. Смесь перемешивали при-78 С в течение 30 мин, а затем медленно прибавляли раствор метиламинового промежуточного продукта 14-1, полученного на стадии 1 (2,16 г, 12,0 ммоль, растворенный в 2 мл ТГФ). Реакционную смесь перемешивали при -78 С в течение 1 ч и затем ему давали нагреться до КТ и перемешивали в течение еще 3 ч, а затем реакцию останавливали путем прибавления Н 2 О. Неочищенную смесь подвергали распределению между насыщенным водным раствором NaHCO3 (30 мл) и EtOAc (60 мл), водный слой повторно экстрагировали с помощью EtOAc (260 мл) и объединенные органические слои промывали рассолом,сушили над безводным MgSO4 и концентрировали досуха. Остаток очищали с помощью флэшхроматографии на колонке (с использованием 20% EtOAc в гексане в качестве элюента) и получали искомый алкин 14-2 в виде светло-коричневого твердого вещества (445 мг, 21% выход). Стадия 3. В толстостенной пробирке высокого давления алкин 14-2, полученный на стадии 2 (260 мг, 1,48 ммоль), растворяли в сухом ДМСО (6,0 мл) и прибавляли ТМС-азид (0,392 мл, 2,96 ммоль). Реакционную смесь нагревали при 140 С в течение 2 ч, затем охлаждали и экстрагировали с помощью EtOAc(50 мл) и промывали рассолом (250 мл). Органический слой сушили над безводным MgSO4, выпаривали и получали неочищенный триазол 14-3 в виде желто-коричневого твердого вещества, которое использовали на стадии 4 без дополнительной очистки. Стадия 4. Неочищенный триазоловый промежуточный продукт 14-3, полученный на стадии 3 (1,10 ммоль),растворяли в EtOH (10 мл) и Н 2 О (6 мл), что приводило к небольшому осаждению исходного вещества,прибавляли K2CO3 (0,91 г, 6,58 ммоль) и гидросульфит натрия (1,15 г, 6,58 ммоль) и реакционную смесь перемешивали в течение 2 ч при КТ. Затем реакционную смесь экстрагировали с помощью EtOAc(50 мл), органический слой промывали с помощью Н 2 О (50 мл) и рассолом (30 мл), сушили над безводным MgSO4 и выпаривали с получением коричневой смолы, которая содержала N2-метил-4-(1H[1,2,3]триазол-4-ил)бензол-1,2-диамин 14-4 (наряду с другими второстепенными продуктами). Неочищенный N2-метил-4-(1H-[1,2,3]триазол-4-ил)бензол-1,2-диамин можно превратить без дополнительной очистки в соответствующие аминовые промежуточные продукты общей формулы III, представленные на схеме 1, по методикам, приведенным в примерах 3 или 7, и затем превратить в ингибиторы общей формулы I, представленные на схеме 1, с использованием методики, приведенной в примере 4.
МПК / Метки
МПК: C07D 413/04, C07D 403/14, A61K 31/4184, C07D 401/14, C07D 417/12, A61P 31/14, C07D 417/14, C07D 409/14, C07D 401/12, C07D 471/04, C07D 413/14
Метки: ингибиторы, полимеразы, вирусной
Код ссылки
<a href="https://eas.patents.su/30-13207-ingibitory-virusnojj-polimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы вирусной полимеразы</a>
Следующий патент: Способ получения гидрохлорида оксикодона, содержащего менее 25 ч./млн 14- гидроксикодеинона
Случайный патент: Лечение резистентных к лекарственным препаратам опухолей


































