6-замещённые 2-хинолиноны и 2-хиноксалиноны как ингибиторы поли(адф-рибоза)полимеразы
Номер патента: 10488
Опубликовано: 30.10.2008
Авторы: Ваутерс Вальтер Баудевейн Леопольд, Сомерс Мария Викторина Франциска, Мабир Доминик Жан-Пьер, Ван Дюн Якобус Альфонсус Йозефус, Гийемон Жером Эмиль Жорж
Формула / Реферат
1. Соединения формулы (I)
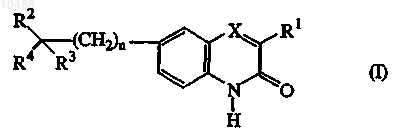
их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
n равно 0 или 1;
X представляет собой N или CR5, где R5 означает водород;
R1 представляет собой C1-6-алкил;
R2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4, может образовывать =0;
R3 представляет собой радикал, выбранный из (а-1), (а-2) или (а-3)

или группу формулы (b-1), то есть -Z-;
s равно 0, 1 или 2;
R4 представляет собой водород, C1-6-алкил, фуранил, пиридинил, арил-С1-6-алкил или группу формулы 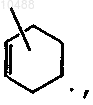 где арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6-алкилоксигруппой;
где арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6-алкилоксигруппой;
R6 представляет собой -СНО, C1-6-алкил, пиперидинил-С1-6-алкил, арилкарбонилпиперидинил-С1-6-алкил или арилС1-6алкил (C1-6-алкил)амино-С1-6алкил;
R7 представляет собой водород или C1-6-алкил;
R8 представляет собой C1-6-алкил; если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4)

или
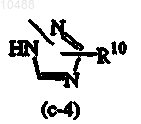
и каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С1-6-алкилокси-С1-6-алкиламиногруппу, при условии, что если n равно 0, X представляет собой N, R2 означает водород, R3 представляет собой группу формулы (b-1), Z означает гетероциклическую кольцевую систему (с-2) или (с-4), указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота и R10 представляет собой водород, то R4 отличается от C1-6-алкила или пиридинила.
2. Соединение по п.1, в котором
n равно 0;
X представляет собой N или CR5, где
R5 означает водород;
R1 представляет собой C1-6-алкил;
R2 представляет собой водород или гидроксигруппу или, взятый вместе с R4, может образовывать =O;
R3 представляет собой радикал, выбранный из (а-1) или (а-2);
s равно 0 или 1;
R6 представляет собой -СНО или C1-6-алкил и
R4 представляет собой водород, C1-6-алкил или группу формулы 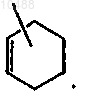
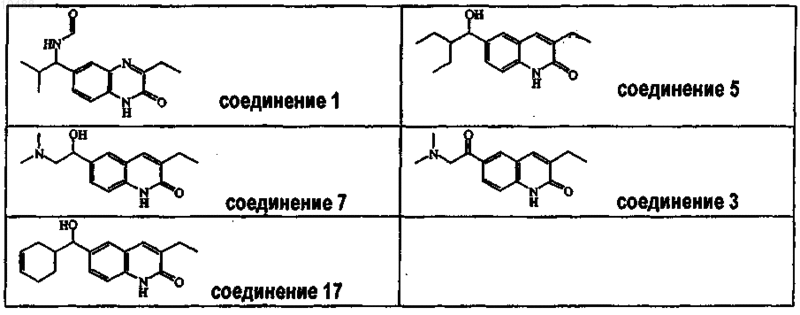
3. Соединение по п.1 или 2, в котором соединение выбрано из соединения ь 1, соединения ь 5, соединения ь 7, соединения ь 3 и соединения ь 17.
4. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по п.1-3.
5. Способ получения фармацевтической композиции по п.4, включающий тщательное смешение фармацевтически приемлемых носителей и соединения по пп.1-3.
6. Применение соединения для получения лекарственного препарата для лечения расстройства, опосредованного PARP, в котором указанное соединение представляет собой соединение формулы (I)
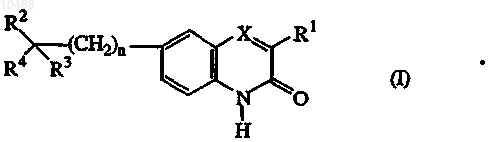
его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, где
n равно 0 или 1;
X представляет собой N или CR5, где
R5 означает водород;
R1 представляет собой C1-6-алкил;
R2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4, может образовывать =O;
R3 представляет собой радикал, выбранный из (а-1), (а-2) или (а-3)

или группу формулы (b-1), то есть -Z-;
s равно 0, 1 или 2;
R4 представляет собой водород, C1-6-алкил, фуранил, пиридинил, арил-С1-6-алкил или группу формулы 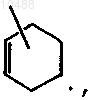
где арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6-алкилоксигруппой;
R6 представляет собой -СНО, C1-6-алкил, пиперидинил-С1-6-алкил, арилкарбонилпиперидинил-С1-6-алкил или арилС1-6алкил (C1-6-алкил)амино-С1-6-алкил;
R7 представляет собой водород или C1-6-алкил;
R8 представляет собой C1-6-алкил; если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4)
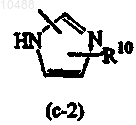
или
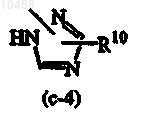
и каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С1-6-алкилокси-С1-6-алкиламиногруппу,
при условии, что если
n равно 0, X представляет собой N, R2 означает водород, R3 представляет собой группу формулы (b-1), Z означает гетероциклическую кольцевую систему (с-2) или (с-4), указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота и R10 представляет собой водород, то R4 отличается от C1-6-алкила или пиридинила.
7. Применение по п.6 ингибитора PARP формулы (I) для изготовления лекарственного препарата для лечения расстройства, опосредованного PARP-1.
8. Применение по пп.6 и 7, в котором лечение включает в себя химиосенсибилизацию.
9. Применение по пп.6 и 7, в котором лечение включает в себя радиосенсибилизацию.
10. Способ получения соединения по п.1, включающий:
а) гидролиз промежуточных продуктов формулы (VIII) известными способами путем обработки промежуточных продуктов формулы (VIII) соответствующими реагентами, такими как хлорид олова, уксусная кислота и соляная кислота, в присутствии инертного растворителя, например тетрагидрофурана
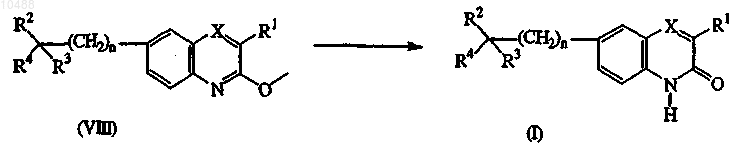
b) циклизацию промежуточных продуктов формулы (X) известными способами в соединения формулы (I), в которых X представляет собой СН, обозначенные как соединения формулы (I-j), предпочтительно в присутствии подходящей кислоты Льюиса, например хлорида алюминия, без или в подходящем растворителе, таком как, например, ароматический углеводород, например бензол, хлорбензол, метилбензол и подобные; галогенированные углеводороды, например трихлорметан, тетрахлорметан и подобные; и простой эфир, например тетрагидрофуран, 1,4-диоксан и подобные или смеси указанных растворителей;

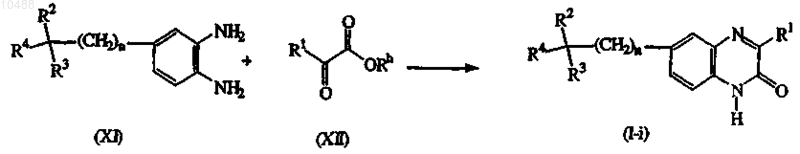
с) конденсацию соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII), в котором Rh представляет собой C1-6-алкил, с образованием соединений формулы (I), в которых X представляет собой N, обозначенных как соединения формулы (I-i), в присутствии карбоновой кислоты, например уксусной кислоты и подобной, минеральной кислоты, такой как, например, соляная кислота, серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота и подобные.
Текст
010488 Данное изобретение относится к ингибиторам PARP и предусматривает соединения и композиции,содержащие предложенные соединения. Более того, данное изобретение предусматривает способы применения предложенных ингибиторов PARP, например, в качестве лекарственных препаратов. Нуклеарный фермент поли(АДФ-рибоза)полимераза-1 (PARP-1) является членом группы PARPферментов, состоящей из PARP-1 и некоторых недавно идентифицированных новых поли(АДФрибозилирующих) ферментов. PARP относится также к поли(аденозин-5'-дифосфорибоза)полимеразе или PARS (поли(АДФ-рибоза)синтетазе).PARP-1 представляет собой главный нуклеарный белок 116 kDa, состоящий из трех доменов: домена, связывающего N-терминальную ДНК, содержащего два цинковых пальца, домена аутомодификации и С-терминального каталитического домена. Он присутствует почти во всех эукариотах. Фермент синтезирует поли(АДФ-рибозу), разветвленный полимер, который состоит из более чем 200 структурных элементов АДФ-рибозы. Акцепторы белка поли(АДФ-рибозы) непосредственно или косвенно вовлечены в поддержание работоспособности ДНК. Они включают в себя гистоны, топоизомеразы, ДНК- и РНКполимеразы, ДНК-лигазы и зависимые от Са 2+- и Mg2+-эндонуклеазы. Белок PARP экспрессируется на высоком уровне во многих тканях, наиболее заметно в иммунной системе, сердце, мозге и половых клетках. В нормальных физиологических условиях существует минимальная активность PARP. Однако повреждения ДНК вызывают немедленную активацию PARP до 500-кратной. Среди многих функций, свойственных PARP, и особенно PARP-1, главная роль состоит в облегчении восстановления ДНК АДФ-рибозилированием и, следовательно, в координации числа восстановленных белков ДНК. В результате PARP-активации заметно уменьшаются уровни NAD+. Экстенсивная активация PARP дает некоторое истощение NAD+ в клетках, страдающих от массированного повреждения ДНК. Короткий полупериод существования поли(АДФ-рибозы) приводит к высокой скорости оборота. Как только поли(АДФ-рибоза) образуется, она быстро разлагается существенно активной поли(АДФрибоза) гликогидролазой (PARG) вместе с фосфодиэстеразой и (АДФ-рибоза) протеинлиазой. PARP иPARG образуют цикл, который превращает большое количество NAD+ в АДФ-рибозу. Менее чем в течение часа сверхстимуляция PARP способна вызвать падение NAD+ и АТФ до менее 20% от нормального уровня. Такой сценарий особенно вреден при ишемии, когда недостаточность кислорода уже резко ставит под угрозу выход клеточной энергии. Последующее продуцирование свободных радикалов во время реперфузии полагают главной причиной повреждения ткани. Частично падение АТФ, которое типично во многих органах во время ишемии и реперфузии, может быть связано с истощением NAD+, вызванным оборотом поли(АДФ-рибозы). Таким образом, ожидают, что ингибирование PARP или PARG сохраняет уровень клеточной энергии, тем самым усиливая выживание ишемических тканей после инсульта. Синтез поли(АДФ-рибозы) вовлечен также в индуцированную экспрессию ряда генов, важных для воспалительной реакции. Ингибиторы PARP подавляют продуцирование индуцируемой синтазы оксида азота (iNOS) в макрофагах, селектина Р-типа и межклеточных адгезионных молекул-1 (ICAM-1) в эндотелиальных клетках. Указанная активность лежит в основе сильного противовоспалительного действия,проявляемого ингибиторами PARP. Ингибиторы PARP способны уменьшать некроз путем предупреждения транслокации и инфильтрации нейтрофилов в поврежденные ткани.PARP активируют фрагментами поврежденной ДНК и после активирования катализируют присоединение до 100 структурных элементов АДФ-рибозы к различным нуклеарным белкам, включая гистоны и сами PARP. Во время сильных клеточных напряжений экстенсивная активация PARP может быстро привести к повреждению или гибели клеток в результате истощения запасов энергии. Поскольку каждая молекула регенерированной NAD+ поглощает четыре молекулы АТФ, при массированной активацииPARP NAD+ истощается и при попытках повторного синтеза NAD+ АТФ может также оказаться истощенной. Сообщают, что активация PARP играет ключевую роль в нейротоксичности, индуцированной какNMDA, так и NO. Это продемонстрировано на кортикальных культурах и на гиппокампальных срезах,при которых предупреждение токсичности прямо коррелировалось с силой ингибирования PARP. Потенциальная роль ингибиторов PARP при лечении нейродегенеративных заболеваний и травм головы таким образом установлена, даже если механизм действия пока не ясен. Аналогично, показано, что простые инъекции ингибиторов PARP уменьшают размер инфаркта, вызванного ишемией и реперфузией сердечной или скелетной мышцы у кроликов. В указанных исследованиях простая инъекция 3-аминобензамида (10 мг/кг), либо за одну минуту до окклюзии, либо за одну минуту до реперфузии, вызывала аналогичные уменьшения величины инфаркта на сердце (32-42%), тогда как 1,5-дигидроизохинолин (1 мг/кг), другой ингибитор PARP, в сравнимых размерах (38-48%) уменьшал величину инфаркта. Указанные результаты делают разумным предположение, что ингибиторыPARP могут предохранять от ишемии сердца или от реперфузионных повреждений ткани скелетных мышц. Активация PARP может также быть использована для измерения повреждений в результате нейротоксичных инсультов, вызванных воздействием любого из следующих индукторов, подобных глутамату-1 010488 метаболита N-метил-4-фенилпиридина (МРР+), которые участвуют в патологических состояниях, таких как удар, болезнь Альцгеймера и болезнь Паркинсона. Другие исследования продолжают изучение роли активации PARP в церебральных тучных клетках in vitro и в нейротоксичности МРТР. Избыточная невральная экспозиция глутамата, который служит в качестве преобладающего нейротрансмиттера центральной нервной системы и действует на рецепторы N-метил-D-аспарагината (NMDA) и рецепторы других подтипов, часто может наступить как результат удара или других нейродегенеративных процессов. Лишенные кислорода нейроны высвобождают глутамат в больших количествах во время ишемического инсульта мозга, такого как удар, или сердечного приступа. Указанное избыточное высвобождение глутамата, в свою очередь, вызывает сверхстимуляцию (эксцитотоксичность) рецепторов N-метилD-аспартата (NMDA), АМРА, каината и MGR, которые открывают ионные каналы и позволяют (происходить) неконтролируемому течению ионов (например, Са 2+ и Na+ в клетки и K+ из клеток), приводя к сверхстимуляции нейронов. Сверхстимулированные нейроны выделяют больше глутамата, создавая ответную петлю или эффект домино, который немедленно приводит к повреждению или гибели клетки через продуцирование протеаз, липаз и свободных радикалов. Избыточная активация рецепторов глутамата вовлечена в различные неврологические заболевания и состояния, включая эпилепсию, удар, болезнь Альцгеймера, болезнь Паркинсона, амиотропный латеральный склероз (ALS), болезнь Хантингтона, шизофрению, хронические боли, ишемию и потерю нейронов вследствие гипоксии, гипогликемии,ишемии, травмы и поражения нервов. Воздействие и стимулирование глутамата вовлечены также в качестве основы для компульсивных расстройств, в частности, лекарственной зависимости. Доказательством служат наблюдения на многих видах животных, а также в церебральных кортикальных культурах, обработанных глутаматом или NMDA, показывающие, что антагонисты глутаматных рецепторов (то есть соединения, которые блокируют глутамат от связывания или от активации его рецептора) блокируют невральные повреждения после сосудистого приступа. Попытки предупредить эксцитотоксичность путем блокирования рецепторов NMDA, АМРА, каината и MGR оказались затруднительными, так как каждый рецептор имеет множество мест, с которыми может связаться глутамат, и поэтому нахождение эффективной смеси антагонистов или универсального антагониста для предупреждения связывания глутамата со всеми рецепторами и проверки указанной теории трудны. Более того, многие композиции, которые эффективны при блокировании рецепторов, являются также токсичными для животных. В настоящее время не существует известного эффективного способа лечения глутаматных расстройств как такового. Стимуляция рецепторов NMDA глутаматом, например, активация фермента нейрональной синтазы оксида азота (nNOS), приводит к образованию оксида азота (NO), который также опосредует нейротоксичность. Нейротоксичность NMDA может быть предупреждена обработкой ингибиторами синтазы оксида азота (NOS) или прицельным генетическим разрушением nNOS in vitro. Другим применением ингибиторов PARP является лечение повреждений периферических нервов и последующего патологического болевого синдрома, известного как невропатические боли, такие как индуцированные хроническим сжимающим повреждением (CCI) всего седалищного нерва, и при которых наступает транссинаптическое изменение дорсального отростка спинного мозга, характеризующееся гиперхроматозом цитоплазмы и нуклеоплазмы (так называемые темные нейроны). Существуют также доказательства, что ингибиторы PARP применимы для лечения воспалительных заболеваний кишечника, таких как колит. В частности, колит вызывали у крыс внутрипросветным введением гаптентринитробензолсульфокислоты в 50%-м этаноле. Обработанные крысы получали 3 аминобензамид, специфический ингибитор активности PARP. Ингибирование активности PARP уменьшало воспалительную реакцию и восстанавливало морфологию и энергетический статус дистальной толстой кишки. Дополнительные данные подтверждают, что ингибиторы PARP применимы для лечения артрита. Далее, ингибиторы PARP, по-видимому, применимы для лечения диабета. Показано, что ингибиторыPARP применимы для лечения эндотоксинового бактериально-токсического шока или септического шока. Ингибиторы PARP также могут быть использованы для увеличения продолжительности жизни и пролиферативной способности клеток, включая лечение таких заболеваний, как старение кожи, болезнь Альцгеймера, атеросклероз, остеоартрит, остеопороз, мышечная дистрофия, дегенеративные заболевания скелетных мышц с репликационным физиологическим старением, старческая дегенерация мышц, иммунное дряхление, СПИД и другие старческие иммунные заболевания; и для экспрессии в меняющиеся гены стареющих клеток. Известно также, что ингибиторы PARP, такие как 3-аминобензамид, влияют на общее восстановление ДНК при ответных реакциях, например, на пероксид водорода или ионизирующую радиацию. Основная роль PARP в восстановлении разрывов тяжей ДНК хорошо установлена, особенно если они вызваны непосредственно ионизирующей радиацией или косвенно после ферментативного восстановления повреждений ДНК, вызванных метилирующими агентами, ингибиторами топоизомеразы I и другими химиотерапевтическими агентами, такими как цисплатина и блеомицин. Ряд исследований с использованием нокаутированных мышей, транс-доминантных моделей ингибирования (сверэкспрессия домена, связывающего ДНК), антисмысловых и низкомолекулярных ингибиторов продемонстриро-2 010488 вали роль PARP в восстановлении и выживании клетки после нанесения повреждения ДНК. Ингибирование ферментативной активности PARP должно привести к повышенной чувствительности опухолевых клеток по отношению к терапии, повреждающей ДНК. Сообщают, что ингибиторы PARP эффективны в радиочувствительных (гипоксических) опухолевых клетках и эффективны при предупреждении опухолевых клеток от регенерации летального или сублетального повреждения ДНК после радиационной терапии, предположительно благодаря способности предупреждать повторное соединение разрывов тяжей ДНК и путем влияния некоторых проводящих путей сигнальной системы поврежденной ДНК. Ингибиторы PARP могут быть использованы для лечения рака. Дополнительно, в патенте США 5177075 обсуждены некоторые изохинолины, использованные для повышения летального действия ионизирующей радиации или химиотерапевтических агентов на опухолевые клетки. Weltin и др., Влияние 6(5-фенантридинона, ингибитора поли(АДФ-рибоза)полимеразы на культивированные опухолевые клетки, Oncol. Res., 6:9, 399-403 (1994) обсуждают ингибирующее действие PARP, уменьшающее пролиферацию опухолевых клеток, и отмечают синергический эффект, если опухолевые клетки одновременно обрабатывают алкилирующим лекарственным средством. Современный исчерпывающий обзор состояния техники опубликован Li и Zhang в IDrugs 2001,4(7): 804-812. Продолжает существовать необходимость в эффективных и сильных ингибиторах PARP и, более конкретно, в ингибиторах PARP-1, которые дают минимальные побочные эффекты. Данное изобретение относится к соединениям, композициям и способам, ингибирующим активность PARP, для лечения рака и/или предупреждения повреждений клеток, тканей и/или органов, вызванных повреждениями или гибелью клеток, например, некроза или апоптоза. Соединения и композиции данного изобретения особенно применимы при повышении эффективности химиотерапии и радиотерапии, при которых первичным результатом лечения является повреждение ДНК в клетках-мишенях. В патенте ЕР 371564, опубликованном 6 июня 1990 г., предложены (1H-азол-1-илметил)замещенные производные хинолина, хиназолина или хиноксалина. Описанные соединения подавляют секрецию ретиноевых кислот в плазме. Более конкретно, предложены 3-этил-6-[2-метил-1-(1H-1,2,4 триазол-1-ил)пропил]-2-(1H)хиноксалинон (соединение 20 в данной заявке), 3-этил-6-[1-(1Hимидазол-1-ил)-2-метилпропил]-2(1H)хиноксалинон (соединение 21 в данной заявке), 6-[2-метил-1(1H-1,2,4-триазол-1-ил)пропил]-3-(2-тиенил)-2(1H)хиноксалинон (соединение 22 в данной заявке), 6[2-метил-1-(1H-1,2,4-триазол-1-ил)пропил]-3-(тиенил-2-(1H)хиноксалинон (соединение 23 в данной заявке), 6-[1-(1H-имидазол-1-ил)-2-метилпропил]-3-(3-тиенил)-2(1H)хиноксалинон (соединение 24 в данной заявке) и 6-[1-(1H-имидазол-1-ил)пентил]-3-метил-2(1H)хиноксалинон (соединение 25 в данной заявке). Данное изобретение относится к соединениям формулы (I)X представляет собой N или CR5, где R5 представляет собой водород или, взятый вместе с R1, может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;R2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4, может образовывать =O;R7 представляет собой водород или С 1-6-алкил;R9 представляет собой ди (С 1-6-алкил)амино-С 1-6-алкил; или R3 представляет собой группу формулы -Z- (b-1),гдеZ представляет собой гетероциклическую кольцевую систему, выбранную из где каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил, аминокарбонил,гидроксигруппу, группу формулы арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6 алкилоксигруппой; при условии, если n равно О, X представляет собой N, R2 представляет собой водород, R3 представляет собой группу (b-1), Z представляет собой гетероциклическую кольцевую систему (с-2 или (с-4), где указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота, и R10 представляет собой водород; то R4 отличается от C1-6-алкила или пиридинила. Всякий раз, когда гетероциклическая кольцевая система Z содержит фрагмент -СН 2-, -СН= или NH-, заместитель R10 или остаток молекулы может быть присоединен к атому углерода или азота, у которого один или оба атома водорода замещены. Соединения формулы (I) могут также существовать в их таутомерных формах. Хотя указанные формы точно не обозначены вышеуказанной формулой, они также включены в объем данного изобретения. Далее в описании объяснен ряд терминов, использованных в предшествующих определениях и ниже. Указанные термины иногда употреблены как таковые или в сложных терминах. Как употреблено в предшествующих определениях и ниже, галоген означает фтор, хлор, бром и иод; C1-6-алкил означает насыщенный углеводородный радикал с линейной или разветвленной цепью,содержащий от 1 до 6 атомов углерода, такой как, например, метил, этил, пропил, бутил, пентил, гексил,1-метилэтил, 2-метилпропил, 2-метилбутил, 2-метилпентил и подобные; C1-6-алкандиил означает двухвалентный насыщенный углеводородный радикал с линейной и разветвленной цепью, содержащий от 1 до 6 атомов углерода, такой как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5 пентандиил, 1,6-гександиил и их разветвленные изомеры, такие как 2-метилпентандиил, 3 метилпентандиил, 2,2-диметилбутандиил, 2,3-диметилбутандиил и подобные; С 2-6-алкенил означает углеводородный радикал с линейной или разветвленной цепью, содержащий одну двойную связь и содержащий от 2 до 6 атомов углерода, такой как, например, этенил, 2-пропенил,3-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил и подобные; С 3-10-циклоалкил включает в себя циклические углеводородные группы, содержащие от 3 до 10 атомов углерода, такие как циклопропил,циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклооктил и по-4 010488 добные. Термин аддитивная соль включает соли, которые соединения формулы (I) способны образовывать с органическими или неорганическими основаниями, такими как амины, основания щелочных металлов и основания щелочно-земельных металлов или четвертичные аммониевые основания, или с органическими или неорганическими кислотами, такими как минеральные кислоты, сульфокислоты, карбоновые кислоты или фосфорсодержащие кислоты. Термин аддитивная соль дополнительно включает фармацевтически приемлемые соли, комплексы металлов и сольваты и их соли, которые способны образовывать соединения формулы (I). Термин фармацевтически приемлемые соли означает аддитивные соли фармацевтически приемлемых кислот или оснований. Аддитивные соли фармацевтически приемлемых кислот или оснований,как упомянуто выше, означают содержащие терапевтически активные аддитивные солевые формы нетоксичных кислот и нетоксичных оснований, которые способны образовывать соединения формулы (I). Соединения формулы (I), которые обладают основными свойствами, могут быть превращены в их фармацевтически приемлемые аддитивные соли обработкой указанных основных форм соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, соляная или бромисто-водородная кислота; серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть бутандиовая кислота),малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, пара-толуолсульфоновая, цикламеновая, салициловая, пара-аминосалициловая, памовая и подобные кислоты. Соединения формулы (I), которые обладают кислотными свойствами, могут быть превращены в их фармацевтически приемлемые аддитивные соли с основаниями обработкой указанной кислотной формы подходящим органическим или неорганическим основанием. Соответствующие формы солей с основаниями включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например соли бензатина, N-метил-D-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и подобные. Термины кислотные или основные аддитивные соли включают в себя гидраты и аддитивные формы с растворителем, которые способны образовывать соединения формулы (I). Примерами указанных форм являются, например, гидраты, алкоголяты и подобные. Термин комплексы металлов означает комплекс, образованный соединением формулы (I) и одной или более органической или неорганической солью или солями металла. Примерами указанных органических или неорганических солей являются галогениды, нитраты, сульфаты, фосфаты, ацетаты, трифторацетаты, трихлорацетаты, пропионаты, тартраты, сульфонаты, например метилсульфонаты, 4 метилфенилсульфонаты, салицилаты, бензоаты и подобные металлов второй основной группы периодической системы, например, соли магния или кальция, третьей или четвертой основных групп, например,алюминия, олова, свинца, и также от первой до восьмой побочных групп периодической системы, такие как, например, соли хрома, марганца, железа, кобальта, никеля, меди, цинка и подобные. Термин стереохимически изомерные формы соединений формулы (I), как употреблен выше, означает все возможные соединения, состоящие из тех же атомов, соединенных в той же последовательности, но имеющие различные не взаимозаменяемые трехмерные структуры, которые могут образовывать соединения формулы (I). Если не указано или определено иначе, химическое название соединения охватывает смесь всех возможных стереохимически изомерных форм, которые способно образовать указанное соединение. Указанные смеси могут содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Все стереохимически изомерные формы соединений формулы (I), как в чистом виде, так и в смеси друг с другом, считаются входящими в объем данного изобретения.N-оксидные формы соединений формулы (I) означают включение таких соединений формулы (I), в которых один или несколько атомов азота окислены до так называемого N-оксида, в частности, такие Nоксиды, в которых N-окислены один или более атомов азота пиперидина, пиперазина или пиридазинила. Всякий раз, когда использован термин соединения формулы (I), это означает также включение Nоксидных форм, фармацевтически приемлемых аддитивных солей с кислотами или основаниями и всех стереоизомерных форм. Соединения, описанные в ЕР 371564, подавляют элиминацию ретиноевой кислоты в плазме. В ЕР 371564 предложены соединения: 3-этил-6-[2-метил-1-(1H-1,2,4-триазол-1-ил)пропил]-2-(1H)хиноксалинон (соединение 20 в данной заявке), 3-этил-6-[1-(1H-имидазол-1-ил)-2-метилпропил]2(1H)хиноксалинон (соединение 21 в данной заявке), 6-[2-метил-1-(1H-1,2,4-триазол-1-ил)пропил]-3(2-тиенил)-2(1H)хиноксалинон (соединение 22 в данной заявке), 6-[2-метил-1-(1H-1,2,4-триазол-1 ил)пропил]-3-(тиенил)-2(1H)хиноксалинон (соединение 23 в данной заявке), 6-[1-(1H-имидазол-1-ил)2-метилпропил]-3-(3-тиенил)-2(1H)хиноксалинон ( 24 в данной заявке) и 6-[1-(1H-имидазол-1 ил)пентил]-3-метил-2-(1H)хиноксалинон (соединение 25 в данной заявке). Неожиданно было обнаружено, что соединения данного изобретения проявляют PARP-ингибирующее действие.-5 010488 Первая группа представляющих интерес соединений состоит из соединений формулы (I), к которым относятся одно или более из следующих ограничений:c) R3 представляет собой радикал, выбранный из (а-1), (а-2) или (а-3) или означает группу формулыg) если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4); иh) каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С 1-6-алкилоксиС 1-6-алкиламиногруппу. Вторая группа представляющих интерес соединений состоит из таких соединений формулы (I), к которым относятся одно или более из следующих ограничений:d) R2 представляет собой водород или гидроксигруппу или, взятый вместе с R4, может образовывать =O;h) R4 представляет собой водород, C1-6-алкил или группу формулы Третья группа представляющих интерес соединений состоит из таких указанных соединений формулы (I) первой группы представляющих интерес соединений или второй группы представляющих интерес соединений, в которых Z представляет собой гетероциклическую кольцевую систему, отличающуюся от гетероциклической кольцевой системы формулы (с-2) или (с-4). Группа предпочтительных соединений состоит из соединений формулы (I), в которых n равно 0 или 1; X представляет собой N или CR5, где R5 означает водород; R3 представляет собой радикал, выбранный из (а-1), (а-2) или (а-3) или представляет собой группу формулы (b-1), то есть -Z-; s равно 0, 1 или 2; R6 представляет собой -СНО, C1-6-алкил, пиперидинил-С 1-6-алкил, арилкарбонилпиперидинил-С 1-6-алкил или арил-С 1-6-алкил (C1-6-алкил)амино-С 1-6 алкил; R8 представляет собой C1-6-алкил; если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4); и каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С 1-6 алкилокси-С 1-6-алкиламиногруппу. Дополнительная группа предпочтительных соединений состоит из указанных соединений формулы(I), в которых n равно 0; X представляет собой N или CR5, где R5 означает водород; R1 представляет собой C1-6-алкил; R2 представляет собой водород или гидроксигруппу или, взятый вместе с R4, может образовывать =0; R3 представляет собой радикал, выбранный из (а-1) или (а-2); s равно 0 или 1; R6 представляет собой -СНО или C1-6-алкил; и R4 представляет собой водород, C1-6-алкил или группу формулы Равным образом дополнительная группа предпочтительных соединений состоит из таких соединений формулы (I), группы предпочтительных соединений или дополнительной группы предпочтительных соединений, в которых Z представляет собой гетероциклическую кольцевую систему, отличающуюся от гетероциклической кольцевой системы формулы (с-2) или (с-4). Наиболее предпочтительными соединениями являются соединения 1, соединение 5, соединение 7, соединение 3 и соединение 17.-6 010488 Соединения формулы (I) могут быть получены согласно общим способам, описанным в ЕР 371564. Ряд указанных способов получения будет описан далее более подробно. Другие способы получения конечных соединений формулы (I) описаны в примерах. Соединения формулы (I), в которых R2 представляет собой водород, a R3 представляет собой -NR7CHO, где R7 означает водород или метил, обозначенные в описании как соединения формулы (I-b), могут быть получены, исходя из соединений формулы (I), в которых R2, взятый вместе с R3, образует =O, обозначенных в описании как соединения формулы (I-а), в присутствии формамида или метилформамида,обозначенных в описании как промежуточные соединения формулы (II) и муравьиной кислоты. Соединения формулы (I), в которых R3 представляет собой гидроксигруппу, обозначенные в описании как соединения формулы (I-c), могут быть получены превращением кетогруппы соединений формулы (I-а) в гидроксигруппу действием соответствующих восстановителей, например, боргидрида натрия, в подходящем растворителе, например, метаноле или тетрагидрофуране. Соединения формулы (I-а) могут быть получены превращением соединений формулы (I-c), в которых R2 представляет собой водород, обозначенных в описании как соединения формулы (I-c-1), в присутствии подходящего окислителя, такого как трехоксид хрома, и кислоты, такой как серная кислота, в подходящем растворителе, таком как 2-пропанон. Промежуточные соединения формулы (IV), в которых W представляет собой уходящую группу, например хлор, бром, метансульфонилоксигруппу или бензолсульфонилоксигруппу, могут быть получены из соединений формулы (I-c-1) обработкой указанных соединений подходящим реагентом, например метансульфонилоксихлоридом или бензолсульфонилоксихлоридом или галогенирующим реагентом,таким как, например, РОСl3 или SOCl2. Соединения формулы (I), определенные как соединения формулы (I), в которых Rb имеет значения,определенные для R6 и Rc - определенные для R7 или Rb и Rc, взятые вместе с азотом, к которому они присоединены, образуют соответствующую гетероциклическую кольцевую систему, как определено дляZ, обозначенные в описании как соединения формулы (I-h), могут быть получены взаимодействием промежуточного продукта формулы (IV) с промежуточным продуктом формулы (V). Реакция может быть проведена в инертном для реакции растворителе, таком как диметилформамид или ацетонитрил, и, возможно, в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия или триэтиламин. Соединения формулы (I) могут также быть превращены друг в друга известными реакциями или-7 010488 превращениями функциональных групп. Ряд указанных превращений уже описан выше. Другими примерами являются гидролиз эфиров карбоновых кислот в соответствующие карбоновые кислоты или спирты; гидролиз амидов в соответствующие карбоновые кислоты или амины; гидролиз нитрилов до соответствующих амидов; аминогруппы у имидазола или фенила могут быть заменены на водород известными на современном уровне техники реакциями диазотирования и замещения диазогруппы водородом; спирты могут быть превращены в сложные эфиры и простые эфиры; первичные амины могут быть превращены во вторичные или третичные амины; двойные связи могут быть погидрированы до соответствующих простых связей; остаток йода у фенильной группы может быть превращен в сложноэфирную группу включением монооксида углерода в присутствии подходящего палладиевого катализатора. Исходя из этого, соединения формул (I), (I-a), (I-b), (I-c), (I-c-1), (I-h), (I-i), (I-j) и (Ik) могут быть подвергнуты следующим превращениям в любом желательном порядке:(i) превращение соединения формулы (I) в другое соединение формулы (I);(ii) превращение соединения формулы (I) в его соответствующую аддитивную соль или N-оксид;(iii) превращение фармацевтически приемлемой аддитивной соли или N-оксида соединения формулы (I) в исходное соединение формулы (I);(iv) получение стереохимически изомерной формы соединения формулы (I) или ее фармацевтически приемлемой аддитивной соли или N-оксида. Промежуточные продукты формулы (VII), в которых Rd и Re представляют собой соответствующие радикалы или, взятые вместе с атомом углерода, к которому они присоединены, образуют соответствующую гетероциклическую кольцевую систему, как определено для Z, могут быть получены гидролизом промежуточных продуктов формулы (VI), в которой R3 представляет собой группу формулы (b-1) или радикал формулы (а-1), где s отличается от О, обозначенный в описании как Rg, согласно известным на современном уровне техники способам, таким как перемешивание промежуточного продукта (VI) в водном растворе кислоты в присутствии инертного растворителя, например, тетрагидрофурана. Подходящей кислотой является, например, соляная кислота. Соединения формулы (I), в которой R2 представляет собой водород, a Rg, как определено выше,обозначенные в описании как соединения формулы (I-k), могут быть получены, исходя из промежуточных продуктов формулы (VII) селективным гидрированием указанного промежуточного продукта соответствующим восстановителем, таким как, например, катализатор на основе благородного металла, такой как платина-на-угле, палладий-на-угле и подобные и соответствующим восстановителем, таким как водород, в подходящем растворителе, таком как метанол. Соединения формулы (I) могут быть получены гидролизом промежуточных продуктов формулы(VIII) согласно известным на современном уровне техники способам, подвергая промежуточные продукты формулы (VIII) воздействию соответствующих реагентов, таких как хлорид олова, уксусная кислота и соляная кислота, в присутствии инертного растворителя, например, тетрагидрофурана. Соединения формулы (I) могут быть получены, исходя из N-оксидов формулы (IX), превращением промежуточных продуктов формулы (IX) в присутствии подходящего реагента, такого как карбонат натрия или уксусный ангидрид, и, если целесообразно, в растворителе, таком как дихлорметан. Соединения формулы (I), в которых X представляет собой СН, обозначенные как соединения формулы (I-j), могут быть получены циклизацией промежуточного продукта формулы (X). Реакция циклизации промежуточного продукта (X) может быть проведена в соответствии с известными на современном уровне техники методиками циклизации. Предпочтительно реакцию ведут в присутствии подходящей кислоты Льюиса, например, хлорида алюминия, либо без растворителя, либо в подходящем растворителе, таком как, например, ароматический углеводород, например бензол, хлорбензол, метилбензол и подобные; галогенированные углеводороды, например, трихлорметан, тетрахлорметан и подобные; простой эфир, например тетрагидрофуран, 1,4-диоксан и подобные; или смеси указанных растворителей. В некоторых случаях скорость реакции могут увеличить повышенные температуры, предпочтительно от 70 до 100 С, и перемешивание. Соединения формулы (I), в которых X представляет собой N, обозначенные в описании как соединения формулы (I-i), могут быть получены конденсацией соответствующего орто-диаминобензола формулы (XI) со сложным эфиром формулы (XII), в котором Rh представляет собой C1-6-алкил. Конденсация замещенного орто-диамина формулы (XI) и сложного эфира формулы (XII) может быть проведена в присутствии карбоновой кислоты, например, уксусной кислоты или подобной, минеральной кислоты, такой как, например, соляная кислота, серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота и подобные. Иногда для увеличения скорости реакции могут быть целесообразны повышенные температуры, а в некоторых случаях реакция может быть проведена даже при температуре кипения реакционной смеси. Вода, которая высвобождается в процессе конденсации, может быть удалена из смеси азеотропной перегонкой, перегонкой и подобными способами. Промежуточные продукты формулы (XI) могут быть получены реакцией восстановления нитросоединения до амина, исходя из промежуточного продукта формулы (XIII), в присутствии металлического катализатора, такого как никель Ренея, и соответствующего восстановителя, такого как водород, в подходящем растворителе, таком как метанол. Промежуточные продукты формулы (XIII) могут быть получены гидролизом промежуточных продуктов формулы (XIV) согласно известным на современном уровне техники способам, таким как перемешивание промежуточного продукта (XIV) в водном растворе кислоты в присутствии инертного растворителя, например, тетрагидрофурана. Подходящей кислотой является, например, соляная кислота. Промежуточные продукты формулы (X) могут быть удобно получены взаимодействием анилина формулы (XV) с галогенидом формулы (XVI) в присутствии основания, такого как пиридин, в подходящем растворителе, таком как дихлорметан. Промежуточные продукты формулы (VIII), в которых n равно 0, R2 представляет собой водород или гидроксигруппу и если R2 представляет собой водород, то R3 означает гидроксигруппу, обозначенные в описании как промежуточные продукты формулы (VIII-а), могут быть получены обработкой промежуточного продукта формулы (XVII), в которой W представляет собой галоген, литийорганическим реагентом, таким как, например, н-бутиллитий, в инертном растворителе, например, тетрагидрофуране, и последующим взаимодействием указанного промежуточного продукта с промежуточным продуктом формулы (XVIII), в котором R1 представляет собой водород или радикал, как определено для R3. Данное изобретение относится также к соединению формулы (I), как определено выше, для применения в медицине. Соединения данного изобретения обладают PARP-ингибирующими свойствами, как можно видеть из экспериментальной части ниже. В данном изобретении рассмотрено также применение соединений при изготовлении лекарственных препаратов для лечения любого заболевания и расстройства у животного, описанного в описании,где указанные соединения являются соединениями формулы (I) их N-оксидными формами, фармацевтически приемлемыми аддитивными солями и стереохимически изомерными формами, в которыхX представляет собой N или CR5, где R5 означает водород или, взятый вместе с R1, может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;R2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4 может образовывать =O;R7 представляет собой водород или С 1-6-алкил;R9 представляет собой ди (C1-6-алкил)амино-С 1-6-алкил; или R3 представляет собой группу формулы -Z- (b-1),в которойZ представляет собой гетероциклическую кольцевую систему, выбранную из где каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил, аминокарбонил,гидроксигруппу, группы формулR4 представляет собой водород, C1-6-алкил, фуранил, пиридинил, C1-6-алкиларил или группу формулы арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6 алкилоксигруппой. Ввиду своих связывающих PARP свойств соединения данного изобретения могут быть использованы в качестве контрольных препаратов или изотопных индикаторов; в этом случае один из атомов молекулы может быть заменен, например, радиоактивным изотопом. Для изготовления фармацевтических композиций данного изобретения эффективное количество конкретного соединения в форме аддитивной соли с основанием или кислотой в качестве активного ингредиента соединяют с фармацевтически приемлемым носителем с образованием тщательно перемешанной смеси; причем носитель может принимать широкий ряд форм в зависимости от желательной для введения формы готового препарата. Указанные фармацевтические композиции желательно готовить в стандартной лекарственной форме, подходящей предпочтительно для введения перорально, ректально,чрескожно или путем парентеральной инъекции. Например, при изготовлении композиций в оральной лекарственной форме может быть использована любая применимая фармацевтическая среда, такая как,например, вода, гликоли, масла, спирты и подобные в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмал, сахара, каолин,скользящие вещества, связующие, дезинтегрирующие агенты и подобные в случае порошков, пилюль,капсул и таблеток. Вследствие легкости введения таблетки и капсулы представляют собой наиболее предпочтительные пероральные лекарственные стандартные формы, в случае которых очевидно используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно представляет собой стерильную воду, по меньшей мере как большую часть, хотя могут быть включены другие ингредиенты, например, для повышения растворимости. В качестве растворов для инъекций, например,могут быть приготовлены такие растворы, в которых носитель представляет собой физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть приготовлены суспензии для инъекций, могут быть использованы соответствующие жидкие носители,суспендирующие агенты и подобные. В композициях, пригодных для чрескожного введения, носитель может содержать агент, улучшающий пенетрацию и/или подходящий смачивающий агент, возможно соединенные с подходящими добавками любой природы в незначительных пропорциях; причем добавки не должны оказывать заметного вредного действия на кожу. Указанные добавки могут облегчить введение в кожу и/или могут быть полезными для изготовления желаемых композиций. Указанные композиции могут быть введены различными путями, например, как трансдермальные бляшки, точечно или в виде мази. Особенно предпочтительно готовить вышеупомянутые фармацевтические композиции в стандартных лекарственных формах для легкости введения и единообразия дозировки. Стандартная лекарственная форма, как использовано в описании и формуле изобретения, означает физически дискретные единицы, пригодные для единообразного дозирования, каждая единица содержит предварительно определенное количество активного ингредиента, рассчитанного для получения желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами указанных стандартных- 11010488 лекарственных форм являются таблетки (включая таблетки с насечками или с покрытием), капсулы, пилюли, пакетики с порошками, облатки, растворы или суспензии для инъекций, чайные ложечки, столовые ложки и подобные и их отдельные составные части. Соединения данного изобретения пригодны для лечения или предотвращения повреждения, вызванного повреждением или гибелью клетки в результате некроза или апоптоза; могут облегчать повреждения нейрональных или сердечно-сосудистых тканей, включая последствия ограниченной ишемии,инфаркта миокарда и реперфузионных изменений; способны лечить различные заболевания и состояния,вызванные или обостренные активностью PARP; могут продлевать или увеличивать продолжительность жизни или пролиферативную способность клеток; способны изменять экспрессию генов стареющих клеток; способны к радиосенсибилизации и/или химиосенсибилизации клеток. Обычно ингибирование активности PARP оберегает клетки от потери энергии, предупреждая, в случае нервных клеток, необратимую деполяризацию нейронов и таким образом обеспечивая нейрозащиту. По указанным причинам данное изобретение дополнительно относится к способу введения терапевтически эффективного количества идентифицированных выше соединений в количестве, достаточном для ингибирования активности PARP, для лечения или предупреждения поражения ткани в результате повреждения или гибели клетки, вызванных некрозом или апоптозом, для действия на нервную активность, не опосредованную токсичностью NMDA, для действия на нервную активность, опосредованную токсичностью NMDA, для лечения поражений нервной ткани, вызванных ишемическими и реперфузионными повреждениями, неврологических заболеваний и нейродегенеративных заболеваний; для предупреждения или лечения сосудистого приступа; для лечения или предупреждения сердечнососудистых заболеваний; для лечения других состояний и/или расстройств, таких как старческая мышечная дегенерация, другие старческие иммунные заболевания и СПИД, воспаления, подагра, артрит, атеросклероз, кахексия, рак, дегенеративные заболевания скелетных мышц вследствие репликационного старения, диабет, травмы головы, воспалительные заболевания кишечника (такие как колит и болезнь Крона), мышечная дистрофия, остеоартрит, остеопороз, хронические и/или острые боли (такие как невропатические боли), почечная недостаточность, ишемия сетчатки, септический шок (такой как эндотоксиновый бактериально-токсический шок) и старение кожи, для продления жизни и пролиферативной способности клеток; для изменения экспрессии генов стареющих клеток; для химиосенсибилизации и/или радиосенсибилизации (гипоксических) опухолевых клеток. Данное изобретение относится также к лечению заболеваний и состояний у животных, включающему введение указанному животному терапевтически эффективного количества идентифицированных выше соединений. В частности, данное изобретение относится к способу лечения, предупреждения или ингибирования неврологических расстройств у животного, который предусматривает введение указанному животному терапевтически эффективного количества идентифицированных выше соединений. Неврологические расстройства подбирают из группы, состоящей из периферической невропатии, вызванной психическим нарушением или болезненным состоянием, травматического повреждения мозга, физического поражения спинного мозга, приступа, связанного с повреждением мозга, ограниченной ишемии, глобальной ишемии, реперфузионного поражения, демиенилизирующего заболевания и неврологического расстройства,связанного с нейродегенерацией. Данное изобретение также включает применение соединений формулы (I) для ингибирования активности PARP для лечения, предупреждения или ингибирования поражений тканей, вызванных повреждением или гибелью клеток в результате некроза или апоптоза, для лечения, предупреждения или ингибирования неврологических заболеваний животного. Термин предупреждение нейродегенерации включает способность предупреждать нейродегенерацию у пациентов с диагнозом нейродегенеративное заболевание или при риске развития нового дегенеративного заболевания и для предупреждения дополнительной нейродегенерации у пациентов, которые уже страдают от или имеют симптомы нейродегенеративного заболевания. Термин лечение, как использован в описании, охватывает любое лечение заболевания и/или состояния животного, в частности, человека, и предусматривает: (i) предупреждение наступления заболевания и/или состояния у субъекта, который может быть предрасположен к заболеванию и/или состоянию, но еще не имеет диагноза; (ii) ингибирование заболевания и/или состояния, то есть задержка его развития; (iii) ослабление заболевания и/или состояния, то есть способствование обратному развитию заболевания и/или состояния. Термин радиосенсибилизатор, как использован в описании, определяет молекулу, предпочтительно молекулу с низкой молекулярной массой, введенной животному в терапевтически эффективных количествах для повышения чувствительности клеток к ионизирующей радиации и/или для способствования лечения заболевания, которое лечится ионизирующей радиацией. Заболеваниями, которые излечиваются ионизирующей радиацией, являются опухолевые заболевания, доброкачественные и злокачественные опухоли и раковые клетки. Лечение ионизирующей радиацией других заболеваний, не перечисленных в описании, также охватывается данным изобретением. Термин химиосенсибилизатор, как использовано в описании, определяет молекулу, предпочтительно молекулу с низкой молекулярной массой, введенную животным в терапевтически эффективных- 12010488 количествах, для повышения чувствительности клеток к химиотерапии и/или способствования лечению заболевания, которое лечится химиотерапией. Заболеваниями, которые излечиваются химиотерапией,являются опухолевые заболевания, доброкачественные и злокачественные опухоли и раковые клетки. Химиотерапевтическое лечение других заболеваний, не перечисленных в описании, также охватывается данным изобретением. Соединения, композиции и способы данного изобретения, в частности, применимы для лечения или предупреждения поражения тканей, вызванных гибелью или повреждением клеток в результате некроза или апоптоза. Соединения данного изобретения могут быть противораковыми средствами, название которых охватывает также средства против роста опухолевых клеток и антинеопластичные средства. Например, способы в соответствии с изобретением применимы для лечения рака и химиочувствительных и/или радиочувствительных опухолевых клеток при раке, таком как опухоли, продуцирующие АСТН, острый лимфоцитарный лейкоз, острый нелимфоцитарной лейкоз, рак коры надпочечника, рак мочевого пузыря,рак головного мозга, рак молочной железы, цервикальный рак, хронический лимфоцитарный лейкоз,хронический миелоцитарный лейкоз, рак прямой кишки, лимфома Т-клеток кожи, внутриматочный рак,рак пищевода, саркома Эвинга, рак желчного пузыря, лейкоз ворсинчатой клетки, рак головы и шеи,лимфома Ходкинса, саркома Капоши, рак почки, рак легких (малые и/или немалые клетки), злокачественный перитонеальный выпот, злокачественный плевральный выпот, меланома, мезотелиома, множественная миелома, нейробластома, лимфома не-Ходкинса, остеосаркома, яичниковый рак, рак яичника (зародышевой клетки), рак простаты, рак поджелудочной железы, рак полового члена, ретинобластома, рак кожи, саркома мягких тканей, карцинома клетки простого плоского эпителия, рак желудка, тестикулярный рак, рак щитовидной железы, трофобластические неоплазмы, рак матки, вагинальный рак, рак вульвы и опухоль Вилмса. Поэтому соединения данного изобретения могут быть использованы в качестве радиосенсибилизаторов и/или химиосенсибилизаторов. Известно, что радиосенсибилизаторы повышают чувствительность раковых клеток к токсическому действию ионизирующей радиации. В литературе предложено несколько механизмов способа действия радиосенсибилизаторов, включая радиосенсибилизаторы гипоксической клетки (например, 2 нитроимидазолы и диоксиды бензотриазина) симулируют кислород или в качестве альтернативы ведут себя подобно биовосстановителю при гипоксии; радиосенсибилизаторы негипоксической клетки (например, галогенированные пиримидины) могут быть аналогами оснований ДНК и предпочтительно внедряются в ДНК опухолевых клеток и при этом способствуют индуцированному радиацией расщеплению молекул ДНК и/или предупреждают нормальный механизм восстановления ДНК; выдвинуты также гипотезы других различных потенциальных механизмов действия радиосенсибилизаторов при лечении заболеваний. Многие протоколы лечения раковых заболеваний в настоящее время используют радиосенсибилизаторы в связи с облучением рентгеновскими лучами. Примеры радиосенсибилизаторов, активированных рентгеновскими лучами, включают, но не ограничивают, следующие: метронидазол, мизонидазол, дезметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, ЕО 9, RB 6145, никотинамид, 5-бромдезоксиуридин (BUdR), 5-йоддезоксиуридин IUdR), бромдезоксицитидин,фтордезоксиуридин (FudR), гидроксимочевина, цисплатина и их терапевтически эффективные аналоги и производные. Фотодинамическая терапия (PDT) рака использует видимый свет в качестве радиационного активатора чувствительного агента. Примеры фотодинамических радиосенсибилизаторов включают, но не ограничивают, следующие: производные гематопорфирина, фотофрин, производные бензопорфирина,этиопорфирин олова, феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и производные. Радиосенсибилизаторы могут быть введены вместе с терапевтически эффективным количеством одного или более других соединений, включая, но, не ограничивая: соединения, которые способствуют внедрению радиосенсибилизатора в клетку-мишень; соединения, которые регулируют поток лекарственных средств, питательных веществ и/или кислорода к клетке-мишени; химиотерапевтические агенты,которые действуют на опухоль с или без дополнительного облучения; или терапевтически эффективные соединения для лечения рака или другого заболевания. Примеры дополнительных терапевтических агентов, которые могут быть использованы вместе с радиосенсибилизаторами, включают, но не ограничивают: 5-фторурацил, лейковорин, 5'-амино-5'-дезокситимидин, кислород, карбоген, переливание красных клеток, перфторуглероды (например, флуозоль 10DA), 2,3-DPG, BW12C, блокаторы кальциевых каналов,пентоксифиллин, антиангиогенезные соединения, гидралазин и LBSO. Примеры химиотерапевтических агентов, которые могут быть использованы совместно с радиосенсибилизаторами, включают, но не ограничивают: адриамицин, камптотецин, карбоплатину, цисплатину, даунорубицин, доцетаксел, доксорубицин, интерферон (альфа, бета, гамма), интерлейкин 2, иринотекан, паклитаксел, топотекан и их терапевтически эффективные аналоги и производные. Химиосенсибилизаторы могут быть введены совместно с терапевтически эффективным количест- 13010488 вом одного или более других соединений, включая, но не ограничивая: соединения, которые способствуют внедрению химиосенсибилизаторов в клетку-мишень; соединения, которые регулируют поток лекарственных средств, питательных веществ и/или кислорода в клетку-мишень; химиотерапевтические агенты, которые действуют на опухоль, или другие терапевтически активные соединения для лечения рака или другого заболевания. Примеры дополнительных терапевтических средств, которые могут быть использованы совместно с химиосенсибилизаторами, включают, но не ограничивают метилирующие агенты, ингибиторы топоизомеразы I и другие химиотерапевтические агенты, такие как цисплатина и блеомицин. Соединения формулы (I) могут также быть использованы для определения или идентификации рецепторов PARP и более конкретно, рецепторов PARP-1. Для указанной цели соединения формулы (I) могут быть мечеными. Указанная метка может быть выбрана из группы, состоящей из радиоизотопа,спиновой метки, антигенной метки, флуоресцентной группы или химиолюминесцентной группы фермента. На современном уровне техники будет легко определить эффективное количество из результатов проб, представленных ниже. Обычно считают, что эффективное количество составляет от 0,01 мг/кг до 100 мг/кг массы тела и, в частности, от 0,05 до 10 мг/кг массы тела. Может быть целесообразно вводить требуемую дозу в виде двух, трех, четырех или более поддоз с соответствующими интервалами в течение дня. Указанные поддозы могут быть изготовлены как стандартные лекарственные формы, например,содержащие от 0,5 до 500 мг и, в частности, от 1 мг до 200 мг активного ингредиента на стандартную лекарственную форму. Следующие примеры иллюстрируют данное изобретение. Экспериментальная часть Далее "BuLi" означает бутиллитий, "DCM" означает дихлорметан, "DIPE" означает простой диизопропиловый эфир, ДМФА означает N,N-диметилформамид, "EtOAc" означает этилацетат, "EtOH" означает этанол, "МЕК" означает метилэтилкетон, МеОН означает метанол и ТГФ означает тетрагидрофуран. А. Получение промежуточных соединений Пример А 1 а)Получение промежуточного продукта 1(0,0144 моль) в муравьиной кислоте (4,93 мл) и формамида (18,2 мл) перемешивали при 160 С в течение 15 ч, затем охлаждали до комнатной температуры, выливали в ледяную воду, подщелачивали концентрированным раствором гидроксида аммония и экстрагировали EtOAc. Органический слой отделяли,сушили (MgSO4), фильтровали и растворитель упаривали досуха, получая 4,8 г промежуточного продукта 1.b) Получение промежуточного продукта 2 Смесь промежуточного продукта 1 (0,0144 моль) в МеОН (50 мл) гидрировали под давлением 3 бара в течение 1 ч с никелем Ренея (3,4 г) в качестве катализатора. После поглощения Н 2 (3 экв.) катализатор отфильтровывали через целит, промывали МеОН и фильтрат упаривали досуха. Продукт использовали без дополнительной очистки, получая 4,7 г промежуточного продукта 2. Пример А 2. Получение промежуточных продуктов 3 и 4 Хлорид алюминия (0,6928 моль) прибавляли порциями к раствору хлорацетилхлорида (0,5196 моль) в DCM (50,2 мл), поддерживая температуру ниже 30 С. Затем прибавляли 3-этил-2(1H)-хинолинон(0,1732 моль), поддерживая температуру ниже 30 С. Смесь перемешивали и кипятили с обратным холодильником в течение 15 ч, охлаждали и выливали в ледяную воду. Осадок отфильтровывали, промывали водой и извлекали DCM. Органический раствор перемешивали и фильтровали. Осадок сушили, получая(MgSO4), фильтровали и растворитель упаривали досуха, получая 20,46 г промежуточного продукта 4. Пример A3. а) Получение промежуточного продукта 5 Смесь 6-бром-2-хлор-3-метилхинолина (0,04483 моль) и CH3ONa (0,224 моль) в МеОН (200 мл) перемешивали при 70 С в течение 36 ч. Смесь охлаждали, выливали на лед, прибавляли EtOAc и смесь экстрагировали EtOAc. Органический слой промывали водой, сушили (MgSO4), отфильтровывали и упаривали, получая 11 г (97%) промежуточного продукта 5.b) Получение промежуточного продукта 6 1,6 М BuLi в гексане (0,0619 моль) прибавляли по каплям при -60 С в токе N2 к смеси промежуточного продукта 5 (0,0476 моль) в ТГФ (200 мл). Смесь перемешивали при -60 С в течение 1 ч. По каплям при -60 С прибавляли смесь 3-(диметиламино)-1-(2-фуранил)-1-пропанона (0,0571 моль) в ТГФ (100 мл). Смесь перемешивали при -60 С в течение 2 ч и затем при -40 С в течение 1 ч. Смесь выливали в насыщенный раствор хлорида аммония и экстрагировали EtOAc. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель упаривали. Продукт использовали без дополнительной очистки,получая 16,2 г промежуточного продукта 6. с) Получение промежуточного продукта 7 Смесь промежуточного продукта 6 (0,0476 моль) в 3 н соляной кислоте (254 мл) и ТГФ (128 мл) перемешивали и кипятили с обратным холодильником в течение 6 ч. Смесь выливали на лед, подщелачивали концентрированным раствором гидроксида аммония и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали хроматографированием на колонке с силикагелем (15-40 мкм) (элюент: DCM/MeOH/NH4OH 95/5/0,2). Чистые фракции собирали и растворитель упаривали, получая 4 г (27%) промежуточного продукта 7. Пример А 4. Получение промежуточного продукта 8 1,6 М н-BuLi в гексане (0,129 моль) прибавляли по каплям при -60 С в токе N2 к смеси 6-бром-3 этил-2-метоксихинолина (0,0996 моль) в ТГФ (265 мл). Смесь перемешивали при -60 С в течение 1 часа. Прибавляли по каплям при -60 С смесь 2-этилбутаналя (0,119 моль) в ТГФ (100 мл). Смесь перемешивали при -60 С в течение 2 ч, затем при -40 С в течение 1 ч, выливали в насыщенный раствор хлорида аммония и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали. Продукт использовали без дополнительной очистки, получая 28,62 г промежуточного продукта 8. Пример А 5. а) Получение промежуточного продукта 9 Раствор (2-бромэтил)бензола (0,174 моль) в простом диэтиловом эфире (125 мл) прибавляли по каплям при 0 С к суспензии Mg-стружки (0,21 моль) в простом диэтиловом эфире (125 мл) и смесь перемешивали при 0 С в течение 1 ч. Прибавляли по каплям при 0 С раствор 3-метил-6-хинолинкарбоксальдегида (0,116 моль) в ТГФ(200 мл) и смесь перемешивали при комнатной температуре в течение 2 ч. Смесь выливали в ледяную воду, фильтровали через целит и продукт экстрагировали EtOAc. Органический слой промывали водой,сушили (MgSO4), фильтровали и упаривали. Остаток кристаллизовали из смеси EtOAc/простой диэтило- 15010488 вый эфир, получая 19 г (59%) промежуточного продукта 9.b) Получение промежуточного продукта 10 Перманганат калия (19 г) прибавляли по каплям при 5 С в атмосфере N2 к раствору промежуточного продукта 9 (0,069 моль) в DCM (300 мл) и трис[2-(2-метоксиэтокси)этил]амина (2 мл) и смесь перемешивали при комнатной температуре в течение ночи. Смесь фильтровали через целит и фильтрат упаривали, получая 17 г (90%) промежуточного продукта 10. с) Получение промежуточного продукта 11 Раствор 3-хлорбензолкарбопероксокислоты (0,123 моль) в DCM (200 мл) прибавляли при 5 С в атмосфере N2 к раствору промежуточного продукта 10 (0,062 моль) в DCM (200 мл), смесь перемешивали при 5 С в течение 1 ч и затем при комнатной температуре в течение 3 ч. Прибавляли водный 10%-й карбонат калия и продукт экстрагировали DCM. Органический слой промывали водой, сушили (MgSO4),отфильтровывали и упаривали. Продукт использовали без дополнительной очистки, получая 18 г (100%) промежуточного продукта 11.d) Получение промежуточного продукта 12 10%-й карбонат калия (250 мл) прибавляли при комнатной температуре к раствору промежуточного продукта 11 (0,062 моль) в DCM (250 мл) и смесь перемешивали в течение 10 мин. Порциями прибавляли тозилхлорид (0,093 моль) и смесь перемешивали при комнатной температуре в течение 2 ч. Осадок отфильтровывали, промывали водой и сушили. Остаток (10,1 г) перекристаллизовывали из 2-пропанона,получая 2,8 г (72%) промежуточного продукта 12. В. Получение конечных соединений Пример В 1. Получение конечного соединения 1 Смесь промежуточного продукта 2 (0,011 моль) и этилового эфира 2-оксобутановой кислоты (0,022 моль) в EtOH (40 мл) перемешивали при 60 С в течение 6 часов и затем охлаждали до комнатной температуры. Растворитель упаривали. Остаток извлекали насыщенным раствором NaHCO3. Смесь экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали досуха. Остаток очищали хроматографированием на колонке с силикагелем (15-40 мкм) (элюент:DCM/MeOH/NH4OH 99/1/0,1 и 85/15/0,1). Чистые фракции собирали и растворитель упаривали. Остаток(1,9 г) очищали хроматографированием на колонке с силикагелем (15-40 мкм) (элюент: циклогексан/2 пропанол/NH4OH 88/12/1). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из DIPE. Осадок отфильтровывали и сушили, получая 0,33 г (11%) соединения 1, температура плавления 204 С. Пример В 2. Получение конечного соединения 2 Хлорид алюминия (0,234 моль) порциями прибавляли к раствору N- [4-[1-(1H-имидазол-1-ил)-2 метилпропил]фенил]-2-метил-3-фенил-2-пропенамида (0,026 моль) в хлорбензоле (60 мл) и смесь перемешивали при 100 С в течение 3 ч. Смесь выливали в ледяную воду, подщелачивали NH4OH и экстрагировали DCM. Смесь фильтровали через целит и фильтрат декантировали. Органический слой сушили(MgSO4), отфильтровывали и упаривали досуха. Остаток очищали хроматографированием на колонке с силикагелем (35-70 мкм) (элюент: DCM/MeOH/NH4OH 95/5/0,1). Чистые фракции собирали и упаривали. Остаток (4 г) кристаллизовали из МЕК, получая 2,12 г (29%) соединения 2, температура плавления 211,4 С.- 16010488 Пример В 3. Получение конечного соединения 3 Гидрохлорид диметиламина (0,3 моль) порциями прибавляли при комнатной температуре в токе N2 к суспензии карбоната калия (0,3603 моль) в ДМФА (300 мл). Смесь перемешивали в течение 30 мин. Осторожно прибавляли смесь промежуточного продукта 3 (0,06 моль) и промежуточного продукта 4(0,06 моль). Смесь перемешивали при комнатной температуре в течение 30 мин. Прибавляли ледяную воду. Осадок отфильтровывали, промывали водой и фильтрат экстрагировали DCM. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали досуха. Остаток (16,6 г) очищали хроматографированием на колонке с силикагелем (20-45 мкм) (элюент: DCM/MeOH/NH4OH 95/5/0,2). Чистые фракции собирали и растворитель упаривали. Остаток (4,9 г) кристаллизовали из 2-пропанола и МеОН. Осадок отфильтровывали и сушили, получая 1,2 г соединения 3, температура плавления 180 С. Пример В 4. Получение конечного соединения 4 Смесь промежуточного продукта 7 (0,0113 моль) в МеОН (60 мл) гидрировали при 40 С под давлением 4,8 бара в течение 6 ч с 10%-м Pd/C (0,35 г) в качестве катализатора. После поглощения Н 2 (1 экв.) катализатор отфильтровывали через целит и фильтрат упаривали. Остаток извлекали водой и концентрированным раствором гидроксида аммония и экстрагировали DCM. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель упаривали. Остаток очищали хроматографированием на колонке с силикагелем (15-40 мкм) (элюент: DCM/MeOH/NH4OH 95/5/0,5 и 93/7/0,5). Чистые фракции собирали и растворитель упаривали. Остаток кристаллизовали из 2-пропанона и простого диэтилового эфира. Осадок отфильтровывали и сушили, получая 0,69 г (20%) соединения 4. Пример В 5. Получение конечного соединения 5 Смесь промежуточного продукта 8 (0,0996 моль) в 3 н. соляной кислоте (426 мл) и ТГФ (274 мл) перемешивали при 70 С в течение ночи, затем выливали на лед, подщелачивали концентрированным раствором NH4OH и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали. Остаток кристаллизовали из DCM. Осадок отфильтровывали и сушили, получая 15,21 г (56%) соединения 5. Пример В 6. Получение конечного соединения 6 Смесь промежуточного продукта 12 (0,013 моль) в формамиде (61,8 мл) и муравьиной кислоте (30 мл) перемешивали и кипятили с обратным холодильником в течение 36 ч. Смесь охлаждали до комнатной температуры, выливали в ледяную воду и отфильтровывали. Осадок промывали водой, 2 пропаноном и простым диэтиловым эфиром. Осадок сушили и перекристаллизовывали из смеси МеОН/ТГФ, получая 1,74 г (40%) соединения 6, температура плавления 221,3 С. Пример В 7. Получение конечного соединения 7 Гидроборат натрия (0,051 моль) прибавляли при 0 С в токе N2 к раствору соединения 3 (0,0116 моль) в МеОН (50 мл). Смесь перемешивали в течение 1 ч и выливали в воду. Органический растворитель упаривали. Водный концентрат извлекали DCM и водой и смесь экстрагировали. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали досуха. Остаток кристаллизовали из 2-пропанона и МеОН. Осадок отфильтровывали, промывали простым диэтиловым эфиром и сушили, получая 1,2 г соединения 7, температура плавления 131 С. В табл. F-1 приведены соединения, которые были получены в соответствии с одним из приведенных примеров. В таблицах использованы следующие сокращения. Фармакологические примеры Анализ ингибирующей активности PARP-1 in vitro с использованием близости сцинтилляции Соединения данного изобретения были испытаны in vitro по методике SPA (фирменной AmershamPharmacia Biotech). В принципе, анализ относится к хорошо установленной технологии SPA для определения поли(ADP-рибозил)ирования биотинилированных белков-мишеней, то есть гистонов. Указанное рибозилирование индуцируют, используя фермент PARP-1, активированный ник-ДНК, и [3 Н]никотинамидадениновый динуклеотид ([3H]-NAD+) в качестве ADP-рибозильного донора. В качестве стимулятора активности фермента PARP-1 готовили ник-ДНК. Для этого 25 мг ДНК(поставщик: Sigma) растворяли в 25 мл буферного раствора ДНКазы (10 мМ трис-HCl, рН 7,4; 0,5 мг/мл бычьего сывороточного альбумина (BSA); 5 мМ MgCl26H2O и 1 мМ KCl), к которому прибавляли 50 мкл раствора ДНКазы (1 мг/мл в 0,15 М NaCl). После инкубирования в течение 90 мин при 37 С реакцию прерывали прибавлением 1,45 г NaCl с последующим дополнительным инкубированием при 58 С в течение 15 мин. Реакционную смесь охлаждали на льду и диализировали при 4 С соответственно в течение 1,5 и 2 ч 1,5 л 0,2 М KCl и дважды 1,5 л 0,01 М KCl в течение 1,5 и 2 ч, соответственно. Смесь аликвотировали и сохраняли при -20 С. Гистоны (1 мг/мл, тип II-A, поставщик: Sigma) биотинилировали, используя набор для биотинилирования Amersham и хранили аликвотированными при -20 С. Основной раствор гранул 100 мг/мл SPA поли(винилтолуол)(PVT) (поставщик: Amersham) готовили в PBS. Основной раствор [3H]-NAD+ готовили прибавлением 120 мкл [3 Н]-NAD+ (0,1 мCi/мл, поставщик: NEN) к б мл инкубационного буферного раствора (50 мМ трис/HCl, рН 8; 0,2 мМ DTT; 4 мМ MgCl2). Раствор 4 мМ NAD+(поставщик: Roche) готовили в инкубационном буферном растворе (из 100 мМ основного раствора в воде, хранившегося при -20 С). Фермент PARP-1 получали, используя известную технологию, то есть клонирование и экспрессию белка, исходя из кДНК печени человека. Информация, касающаяся использования последовательности белка фермента PARP-1, включая литературные ссылки, может быть найдена в базе данных Swiss-Prot под первичным номером доступа Р 09874. Биотинилированные гистоны и гранулыPVT-SPA смешивали и предварительно инкубировали в течение 30 мин при комнатной температуре. Фермент PARP-1 (часто в зависимости от концентрации) смешивали с ник-ДНК и смесь предварительно инкубировали в течение 30 мин при 4 С. Равные части указанного раствора гистонов/гранул PVTSPA и раствора фермента PARP-1/ДНК смешивали и 75 мкл указанной смеси вместе с 1 мкл соединения в ДМСО и 25 мкл [3 Н]-NAD+ вносили в лунки 96-луночного микропланшета для титрования. Конечные концентрации инкубационной смеси составляли 2 мкг/мл биотинилированных гистонов, 2 мг/мл гранулPVT-SPA, 2 мкг/мл ник-ДНК и от 5 до 10 мкг/мл фермента PARP-1. После инкубирования смеси в течение 15 мин при комнатной температуре реакцию прерывали прибавлением 100 мкл 4 мМ NAD+ в инкубационном буферном растворе (конечная концентрация 2 мМ) и планшеты перемешивали. Гранулам давали осаждаться в течение по меньшей мере 15 мин и планшеты переносили в Top- 19010488CountNXT (Packard) для подсчета сцинтилляции, значения выражали в виде числа в минуту (cpm). Для каждого эксперимента параллельно проводили контрольные опыты (содержащие фермент PARP-1 и ДМСО без соединения), слепое инкубирование (содержащее ДМСО, но без фермента PARP-1 или соединения) и анализы (содержащие фермент PARP-1 и соединение, растворенное в ДМСО). Все испытанные соединения растворяли и затем дополнительно разбавляли ДМСО. Сначала соединения испытывали в концентрации 10-6 М. Если соединение проявляло активность при 10-6 М, составляли кривую зависимости доза-ответ, для которой соединения испытывали при концентрациях от 10-5 М до 10-8 М. В каждой пробе слепое значение вычитали из контрольного и пробного значений. Контрольная проба представляла максимальную активность фермента PARP-1. Для каждого образца количество cpm выражали в процентах от среднего значения cpm контроля. Если целесообразно, вычисляли значение IC50 (концентрацию лекарственного средства, необходимую для ослабления активности фермента PARP-1 на 50% от контрольной),используя линейную интерполяцию между экспериментальными точками выше и ниже уровня 50%. При этом действия испытанных соединений выражают как pIC50 (значение отрицательного логарифма значения IC50). Для подтверждения правильности пробы SPA включали эталонное соединение, 4-амино-1,8 нафталимид. Испытанные соединения проявили ингибирующее действие при начальной тестовой концентрации 10-6 М (см. табл. 2). Анализ ингибирования активности PARP-1 in vitro фильтрацией Соединения данного изобретения были испытаны пробой фильтрации in vitro на активность PARP-1(вызванной в присутствии ник-ДНК) путем определения активности поли (ADP-рибозил)ирования гистона с применением [32P]-NAD в качестве ADP-рибозильного донора. Радиоактивные рибозилированные гистоны осаждали трихлоруксусной кислотой (ТСА) в 96-луночные фильтрационные планшеты и внедряли сцинтилляционный счетчик, использующий измерение [32 Р]. Готовили смесь гистонов (основной раствор: 5 мг/мл в Н 2 О), NAD+ (основной раствор: 100 мМ в Н 2 О) и [32 Р]-NAD+ в инкубационном буферном растворе (50 мМ трис/HCl, рН 8; 0,2 мМ DTT; 4 мМMgCl2). Готовили также смесь фермента PARP-1 (5-10 мкг/мл) и ник-ДНК. Ник-ДНК получали, как описано в анализе in vitro ингибирующей активности PARP-1 с использованием SPA. 75 мкл смеси фермента PARP-1/ДНК с 1 мкл соединения в ДМСО и 25 мкл смеси гистон-NAD+/[32 Р] -NAD+ прибавляли в лунки 96-луночного фильтрационного планшета (0,45 мкм, поставщик: Millipore). Конечные концентрации в инкубационной смеси составляли 2 мкг/мл гистонов, 0,1 мМ NAD+, 200 мкМ (0,5 мкС) [32P]-NAD+ и 2 мкг/мл ник-ДНК. Планшеты инкубировали в течение 15 мин при комнатной температуре и реакцию прерывали прибавлением 10 мкл охлажденной льдом 100%-й ТСА с последующим прибавлением 10 мкл охлажденного льдом раствора BSA (1% в Н 2 О). Белковую фракцию оставляли осаждаться на 10 мин при 4 С и планшеты отфильтровывали в вакууме. Затем каждую лунку планшета промывали 1 мл 10%-й охлажденной льдом ТСА, 1 мл 5%-й охлажденной льдом ТСА и 1 мл 5%-й ТСА при комнатной температуре. Наконец, к каждой лунке прибавляли 100 мкл сцинтилляционного раствора (Microscint 40, Packard) и планшеты переносили в TopCountNXT (поставщик: Packard) для подсчета сцинтилляции и значения выражали в виде числа в минуту (cpm). Для каждого эксперимента параллельно проводили контрольные опыты (содержащие фермент PARP-1 и ДМСО без соединения), слепое инкубирование (содержащее ДМСО, но без фермента PARP-1 или соединения) и анализы (содержащие фермент PARP-1 и соединение, растворенное в ДМСО). Все соединения растворяли и затем дополнительно разбавляли ДМСО. Сначала соединения испытывали в концентрации 10-5 М. Если соединения проявляли активность при 10-5 М,составляли кривую зависимости доза-ответ, где соединения испытывали при концентрациях от 10-5 М до 10-8 М. В каждой пробе слепое значение вычитали из контрольного и тестового значений. Контрольный образец представлял максимальную активность фермента PARP-1. Для каждого примера количество cpm выражали в процентах от среднего значения cpm контроля. Если целесообразно, вычисляли значение IC50(концентрацию лекарственного средства, необходимую для ослабления активности фермента PARP-1 на 50% от контрольной), используя линейную интерполяцию между экспериментальными точками выше и ниже 50%-го уровня. При этом действие испытанных соединений выражали как pIC50 (значение отрицательного логарифма значения IC50). Для подтверждения достоверности фильтрационной пробы в качестве эталонного соединения использовали 4-амино-1,8-нафталимид. Испытанные соединения проявили ингибирующее действие при начальной тестовой концентрации 10-5 М (см. табл. 2). Соединения могут быть дополнительно оценены в пробе клеточной химио- и/или радиочувствительности, в пробе, измеряющей ингибирование активности эндогенной PARP-1 в линиях раковых клеток и, в конце концов, in vivo в пробе на радиочувствительность. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I) их N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеR2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4, может образовывать =0; или группу формулы (b-1), то есть -Z-;R4 представляет собой водород, C1-6-алкил, фуранил, пиридинил, арил-С 1-6-алкил или группу форгде арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6 мулы алкилоксигруппой;R6 представляет собой -СНО, C1-6-алкил, пиперидинил-С 1-6-алкил, арилкарбонилпиперидинил-С 1-6 алкил или арилС 1-6 алкил (C1-6-алкил)амино-С 1-6 алкил;R7 представляет собой водород или C1-6-алкил;R8 представляет собой C1-6-алкил; если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4) и каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С 1-6-алкилоксиС 1-6-алкиламиногруппу, при условии, что если n равно 0, X представляет собой N, R2 означает водород,R3 представляет собой группу формулы (b-1), Z означает гетероциклическую кольцевую систему (с-2) или (с-4), указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота и R10 представляет собой водород, то R4 отличается от C1-6-алкила или пиридинила. 2. Соединение по п.1, в которомR2 представляет собой водород или гидроксигруппу или, взятый вместе с R4, может образовыватьR4 представляет собой водород, C1-6-алкил или группу формулы 3. Соединение по п.1 или 2, в котором соединение выбрано из соединения 1, соединения 5, соединения 7, соединения 3 и соединения 17. 4. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и в качестве активного ингредиента терапевтически эффективное количество соединения по п.1-3. 5. Способ получения фармацевтической композиции по п.4, включающий тщательное смешение фармацевтически приемлемых носителей и соединения по пп.1-3. 6. Применение соединения для получения лекарственного препарата для лечения расстройства,опосредованного PARP, в котором указанное соединение представляет собой соединение формулы (I) его N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы, гдеR2 представляет собой водород или гидроксигруппу или, взятый вместе с R3 или R4, может образовывать =O; или группу формулы (b-1), то есть -Z-;R4 представляет собой водород, C1-6-алкил, фуранил, пиридинил, арил-С 1-6-алкил или группу формулы где арил представляет собой фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6 алкилоксигруппой;R6 представляет собой -СНО, C1-6-алкил, пиперидинил-С 1-6-алкил, арилкарбонилпиперидинил-С 1-6 алкил или арилС 1-6 алкил (C1-6-алкил)амино-С 1-6-алкил;R7 представляет собой водород или C1-6-алкил;R8 представляет собой C1-6-алкил; если R3 представляет собой группу формулы (b-1), то Z означает гетероциклическую кольцевую систему, выбранную из (с-2) или (с-4) и каждый R10 независимо друг от друга представляет собой водород, C1-6-алкил или С 1-6-алкилоксиС 1-6-алкиламиногруппу,при условии, что еслиn равно 0, X представляет собой N, R2 означает водород, R3 представляет собой группу формулы (b1), Z означает гетероциклическую кольцевую систему (с-2) или (с-4), указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота и R10 представляет собой водород, то R4 отличается от C1-6-алкила или пиридинила. 7. Применение по п.6 ингибитора PARP формулы (I) для изготовления лекарственного препарата для лечения расстройства, опосредованного PARP-1. 8. Применение по пп.6 и 7, в котором лечение включает в себя химиосенсибилизацию. 9. Применение по пп.6 и 7, в котором лечение включает в себя радиосенсибилизацию. 10. Способ получения соединения по п.1, включающий: а) гидролиз промежуточных продуктов формулы (VIII) известными способами путем обработки промежуточных продуктов формулы (VIII) соответствующими реагентами, такими как хлорид олова,уксусная кислота и соляная кислота, в присутствии инертного растворителя, например тетрагидрофуранаb) циклизацию промежуточных продуктов формулы (X) известными способами в соединения формулы (I), в которых X представляет собой СН, обозначенные как соединения формулы (I-j), предпочтительно в присутствии подходящей кислоты Льюиса, например хлорида алюминия, без или в подходящем растворителе, таком как, например, ароматический углеводород, например бензол, хлорбензол, метил- 23010488 бензол и подобные; галогенированные углеводороды, например трихлорметан, тетрахлорметан и подобные; и простой эфир, например тетрагидрофуран, 1,4-диоксан и подобные или смеси указанных растворителей; с) конденсацию соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы(XII), в котором Rh представляет собой C1-6-алкил, с образованием соединений формулы (I), в которых X представляет собой N, обозначенных как соединения формулы (I-i), в присутствии карбоновой кислоты,например уксусной кислоты и подобной, минеральной кислоты, такой как, например, соляная кислота,серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4 метилбензолсульфокислота и подобные.
МПК / Метки
МПК: A61P 43/00, A61K 31/498, C07D 401/12, C07D 241/44, C07D 407/06, C07D 409/14
Метки: ингибиторы, поли(адф-рибоза)полимеразы, 2-хиноксалиноны, 6-замещённые, 2-хинолиноны
Код ссылки
<a href="https://eas.patents.su/25-10488-6-zameshhyonnye-2-hinolinony-i-2-hinoksalinony-kak-ingibitory-poliadf-ribozapolimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">6-замещённые 2-хинолиноны и 2-хиноксалиноны как ингибиторы поли(адф-рибоза)полимеразы</a>
Предыдущий патент: Производные тетрагидронафтиридина, пригодные в качестве лигандов рецептора н3 гистамина
Следующий патент: Спортивный мяч кубической формы с трубчатыми гранями
Случайный патент: Фармацевтические композиции, содержащие антагонистическое моноклональное антитело к cd40, и их применение












