Лечение резистентных к лекарственным препаратам опухолей
Формула / Реферат
1. Применение соединения формулы I
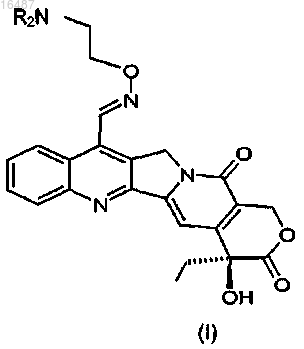
где R представляет собой водород или C1-С4-алкил, для изготовления лекарственного средства для лечения резистентных к лекарственным препаратам опухолей у пациентов, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I.
2. Применение по п.1, где R представляет собой водород или метил.
3. Применение по п.1 или 2, где резистентная к лекарственным препаратам опухоль выбрана из группы, включающей саркому, карциному, карциноидную опухоль кости, нейроэндокринную опухоль, лимфоидную лейкемию, острую промиелоцитарную лейкемию, миелоидную лейкемию, моноцитарную лейкемию, мегакариобластную лейкемию и болезнь Ходжкина.
4. Применение по пп.1-2, в котором опухоль представляет собой карциному простаты.
5. Способ лечения опухоли, резистентной к лекарственным препаратам у пациентов, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I, включающий введение терапевтически эффективного количества соединения формулы I

где R представляет собой водород или C1-C4-алкил, или фармацевтической композиции, содержащей фармацевтически приемлемые носители и/или наполнители.
Текст
Представлен подкласс производных камптотецина, пригодных для приготовления лекарственного средства для лечения резистентных к лекарственным препаратам опухолей и для введения пациентам, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I.(71)(73) Заявитель и патентовладелец: СИГМА-ТАУ ИНДУСТРИЕ ФАРМАСЬЮТИКЕ РИУНИТЕ С.П.А. 016487 Область техники, к которой отностся изобретение Изобретение касается применения подкласса производных камптотецина для приготовления лекарственного средства для лечения резистентных к лекарственным препаратам опухолей и/или для введения пациентам, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I. Уровень техники, к которой относится изобретение Производные камптотецина представляют собой ингибиторы ДНК-топоизомеразы I, которые проявили себя как выдающийся класс противораковых средств. Вместе с таксанами ингибиторы топоизомеразы I, по-видимому, являются наиболее важным новым классом противораковых лекарственных средств, внедренных в клиническую практику. Доклинические испытания продемонстрировали значительную in vitro и in vivo активность ингибиторов топоизомеразы I, таких как камптотецин и его производные, в отношении широкого круга опухолей. Результаты клинических испытаний были многообещающими, как показано регистрацией двух ингибиторов топоизомеразы, а именно топотекана и иринотекана (также известного как СРТ-11), во многих европейских странах и в США, для лечения пациентов с овариальным и колоректальным раком, соответственно. Другие производные в настоящее время находятся на разных стадиях клинической разработки. В патентной заявке ЕР 1044977 и в J. Med. Chem., 2001, 44, 3264-3274, описаны производные камптотецина, которые содержат замещенный по атому кислорода алкилоксимный фрагмент в положении 7,и которые обладают противораковой активностью, более высокой, чем топотекан как сравнительное соединение. Более того, эти производные камптотецина, содержащие иминогруппу в положении 7, также проявляют повышенный терапевтический индекс. Среди этих соединений одна из предпочтительных молекул была показана как 7-трет-бутоксииминометилкамптотецин (СРТ 184, также известный какST1481 или гиматекан). Основное свойство аналогов камптотецина состоит в их активности в отношении ДНКтопоизомеразы I, но за пределами этого сходства соединения в значительной степени различаются по противораковой активности, фармакологии и метаболизму. Несмотря на хорошую переносимость и эффективность камптотецинов при испытаниях на животных, их низкий терапевтический индекс все еще остается главным препятствием на пути их клинического применения, наряду с обратимостью взаимодействия лекарственного средства в трехчастном комплексе (лекарственное средство-фермент-ДНК) и нестабильностью лактонового цикла, которые препятствуют эффективности их действия против медленнорастущих опухолей. Наконец, экспериментальные модели показали, что противоопухолевая активность камптотецинов сильно зависит от графика введения лекарственного средства, фактически требуя либо пролонгированного режима введения малыми дозами, либо применения повторяющихся прерывистых режимов дозирования. Несмотря на то, что были разработаны новые противораковые лекарственные препараты, и поэтому теперь некоторые злокачественные новообразования излечимы, устойчивость к лекарственным препаратам в химиотерапии, в том числе к производным камптотецина, является главным ограничением терапевтического применения для некоторых опухолей у человека, и все еще существуют многочисленные первичные и рецидивные случаи, не поддающиеся лечению. ДНК-топоизомераза I недавно была исследована для определения механизма изначальной или приобретенной резистентности к Топотекану или СРТ-11, и в некоторых регионах человеческой топоизомеразы I был идентифицирован ряд мутаций, которые влияют на резистентность к производным камптотецина (Benedetti et al., 1993, Cancer Res., 53, 4343; Fiorani et al., J. Biol.Chem., 2003; October, 31; 278(44): 43268-43275; Chrencik et al., 2004; JMB, 339, 773-784). Более того, мутации в топоизомеразе I, возникающие после химиотерапии с применением СРТ-11 у пациентов с диагнозом NSCLC (немелкоклеточный рак легкого), наводят на мысль, что развитие резистентности к иринотекану у некоторых пациентов может включать мутацию топоизомеразы I (Tsurutaniet al., 2002, Lung Cancer, 35, 299-304). Хотя значимость мутаций топоизомеразы I для резистентности к СРТ требует дальнейшего изучения, считается, что огромный клинический интерес представляет получение производного камптотецина,которое, кроме его типичного фармакологического профиля, проявляет активность в отношении мутированной топоизомеразы I. Описание изобретения При использовании топоизомеразы I "дикого типа" и двух мутированных человеческих топоизомераз I, которые сообщают резистентность к производным камптотецина (то есть, камптотецину, топотекану, SN-38), неожиданно было обнаружено, что некоторые производные камптотецина (см. результаты для ST1968 и ST1969) способны ингибировать Топоизомеразу I "дикого типа", а также мутированные человеческие топоизомеразы I. Поэтому главной целью настоящего изобретения является применение соединения формулы I где R представляет собой водород или C1-C4-алкил, для изготовления лекарственного препарата для лечения резистентных к лекарственным средствам опухолей и для введения пациентам, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I. Такой полиморфизм в гене, кодирующем ДНК-топоизомеразу I, может быть врожденным или может развиться у некоторых пациентов в дополнение к фармацевтическому лечению, например, в дополнение к лечению камптотецинами. Соединения формулы (I) также включают таутомеры, геометрические изомеры, оптически активные формы, такие как энантиомеры, диастереомеры, и рацемические формы, а также фармацевтически приемлемые соли соединений формулы (I). Предпочтительные фармацевтически приемлемые соли формулы (I) представляют собой соли, полученные присоединением кислот, образуемые из фармацевтически приемлемых кислот, такие как гидрохлорид, гидробромид, сульфат или бисульфат, фосфат или гидрофосфат, ацетат, бензоат, сукцинат,фумарат, малеат, лактат, цитрат, тартрат, глюконат, метансульфонат, бензолсульфонат и паратолуолсульфонат. Предпочтительно R представляет собой водород или метил. Предпочтительно соединения фрмулы (I) представляют собой 7-(2-амино)этоксииминометилкамптотецин, (ST1968, также известный как СРТ 188) и 7-(2-диметиламино)этоксииминометилкамптотецин (ST1969). Резистентные к лекарственным препаратам опухолевые патологии, которые могут подвергаться лечению согласно настоящему изобретению, выбраны из группы, включающей саркому, овариальную карциному, в частности карциному простаты, карциноидную опухоль кости, нейроэндокринную опухоль,лимфоидную лейкемию, острую промиелоцитарную лейкемию, миелоидную лейкемию, моноцитарную лейкемию, лимфобластную лейкемию и болезнь Ходжкина. Соединения формулы (I) могут быть получены из легкодоступных исходных материалов с использованием нижеприведенных общих способов и методик. Следует принять во внимание, что там, где приведены типичные или предпочтительные экспериментальные условия (то есть температуры реакции, продолжительность, молярные количества реагентов, растворители и т.д.), могут быть также применены другие экспериментальные условия, если не оговорено иное. Оптимальные реакционные условия могут варьировать в зависимости от конкретных используемых реагентов или растворителей, но такие условия могут быть определены специалистом в этой области путем обычной оптимизации методик. Конкретная ссылка делается на способы, описанные в патентной заявке ЕР 1044977 и в J. Med. Chem., 2001, 44, 3264-3274. Способ лечения млекопитающих, страдающих резистентной к лекарственным препаратам опухолевой патологией, включающий введение терапевтически эффективного количества соединения формулы(I), как описано выше, представляет один из аспектов настоящего изобретения. Поэтому, согласно настоящему изобретению, пациент, страдающий опухолевой патологией, которая была доказана как резистентная к лечению общеупотребительными предписанными противоопухолевыми лекарственными препаратами, такими как камптотецины (например, иринотекан, топотекан, гиматекан), платиновые комплексы (например, карбоплатин) или таксаны (например, паклитаксел, доцетаксел), может быть успешно подвергнут лечению соединением формулы (I). Термин "терапевтически эффективное количество" здесь относится к количеству терапевтического средства, необходимому для лечения, облегчения целевой болезни или состояния, или для проявления выраженного терапевтического действия. Для любого соединения терапевтически эффективная доза может быть оценена первоначально либо в испытаниях на клеточной культуре, например, на неопластических клетках, либо на модельных животных, обычно мышах или крысах. Модельное животное может быть также использовано для определения приемлемого концентрационного диапазона и пути введения. Такая информация может быть затем использована для определения действенных дозировок и путей введения человеку. Точное эффективное количество для человеческого субъекта будет зависеть от серьезности болезненного состояния, общего состояния здоровья субъекта, возраста, массы тела и пола субъекта, режима питания, времени и частоты введения, комбинирования лекарственного(-ных) средства(-ств), аллергических реакций и характеристик переносимости/восприимчивости к терапевтическому воздействию. Это количество может быть определено в ходе экспериментов и входит в компетенцию практикующего врача. В общем эффективная доза будет составлять от 0,01 мг/кг до 100 мг/кг, предпочтительно-2 016487 от 0,05 до 50 мг/кг. Композиции могут быть введены пациенту отдельно или могут быть введены в комбинации с прочими средствами, лекарственными препаратами или гормонами. Лекарственное средство может также содержать фармацевтически приемлемый носитель для введения терапевтического средства. Такие носители включают антитела и прочие полипептиды, гены и другие терапевтические средства, такие как липосомы, при условии, что носитель сам по себе не вызывает продуцирования антител, вредных для лица, принимающего композицию, и который может быть введен без чрезмерной токсичности. Пригодные носители могут представлять собой крупные, медленно метаболизирующие макромолекулы, такие как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, сополимеры аминокислот и инактивированные вирусные частицы. Подробное обсуждение фармацевтически приемлемых носителей можно найти в издании Remington's Pharmaceutical Sciences (Mack Pub. Co., Нью-Джерси, 1991). Фармацевтически приемлемые носители в терапевтических композициях могут дополнительно содержать жидкости, такие как вода, глицерин и этанол. Вспомогательные вещества, такие как смачивающие средства и эмульгаторы, буферные вещества для регулирования величины рН и тому подобные, могут дополнительно присутствовать в таких композициях. Такие носители обеспечивают возможность приготовления препаративных форм из фармацевтических композиций в виде таблеток, пилюль, драже,капсул, жидкостей, гелей, сиропов, суспензий и тому подобных, для проглатывания пациентом. Будучи приготовленными в виде препаративных форм, композиции согласно изобретению могут быть введены непосредственно субъекту. Субъекты, которые подвергаются лечению, могут быть животными; в частности, может проводиться лечение человеческих субъектов. Лекарственное средство согласно этому изобретению может быть введено любым из нескольких путей, включающих, но не ограниченных ими, оральное, внутривенное, внутримышечное, внутриартериальное, интрамедуллярное, внутриоболочечное, внутрижелудочковое, подкожное или чрескожное применение, с применением подкожных, внутрибрюшинных, интраназальных, кишечных, местных, подъязычных, интравагинальных, ректальных средств, или локальной доставки в пораженную ткань после хирургической операции. Дозировка в ходе лечения может быть режимом одноразовой дозы или режимом многократных доз. Изобретение будет иллюстрировано более подробно с помощью неограничивающих примеров и фигур. Описание чертежа На чертеже показан in vivo эффект некоторых производных камптотецина на человеческую ДНКтопоизомеразу I "икого типа" или мутантную, экспрессированную в дрожжах Saccharomyces cerevisiae. Культуры дрожжевых клеток, трансформированные плазмидными векторами YcpGal1hTOP1(WT), YcpGal1htop1K720E и YcpGal1 (пустой вектор), были подвергнуты серийным разбавлениям (10-кратное разбавление слева направо) и нанесены пятнами на пластины с минимальной средой без урацила на основе агара, содержащей 2% галактозы и 45 мкМ камптотецина, ST1481, ST1968, ST1969, ST1600 и ST1976. Примеры Пример 1. In vivo эффект некоторых производных камптотецина на человеческую ДНКтопоизомеразу I "дикого типа" или мутантную, экспрессированную в дрожжах Saccharomyces cerevisiae. Методы Штамм Saccharomyces cerevisiae, использованный для клонирования человеческой ДНКтопоизомеразы I "дикого типа" (hTOP1) и мутантной топоизомеразы I был: EKY2 (МАТ, ura3-52,his3200, leu 21, trp163, top1TPR1), как описано авторами Bjornsti et al., 1989 (Cancer Res., 49, 63186323). Плазмиды, использованные для трансформирования дрожжей, несущих полномерную человеческую Топоизомеразу I "дикого типа" (YCpGAL1hTOP1), были описаны авторами Bjornsti et al., 1989(Cancer Res., 49, 6318-6323), и мутированная Топоизомераза I YCpGAL1htop1K720E была продуцирована путем олигонуклеотид-направленного мутагенеза с использованием способа, описанного авторами Fiorani et al., 1998 (J. Biol. Chera., 14, 8425-8433): В обеих плазмидах экспрессии топоизомеразы были под контролем индуцибельного галактокиназного промотора дрожжей GAL1. Перед трансформированием дрожжевых клеток ДНК (литий-ацетатный метод) дрожжи были выращены на твердой среде. Они были рассеяны штрихом в чашках Петри диаметром 90 мм, содержащих стерильную твердую среду (YPDA) (10 г дрожжей, 20 г пептона, 20 г декстрозы, 0,7 г аденина, 20 г глюкозы, 20 г агара на литр). Колонии были выращены через 48 ч при температуре 30 С. За сутки до трансформирования одиночную дрожжевую колонию трансформируемого штамма инокулировали в 5 мл стерильной жидкой среде YPDA (вышеупомянутой среде без агара). Колонию выращивали до насыщения в течение ночи при перемешивании при температуре 30 С. На следующий день 5 мл насыщенной культуры были разбавлены в 100 мл жидкой среды YPDA и выращены при температуре 30 С до достижения оптической плотности 1,0 при длине волны 600 нм. Клетки центрифугировали в течение 5 мин при скорости 4000g при комнатной температуре, и осадок в пробирке ресуспендировали в 25 мл раствора (Т/Е),содержащего 10 мМ Трис-EDTA с величиной рН 7,5, 1 мМ EDTA и 100 мМ ацетата лития. Дрожжевую-3 016487 суспензию центрифугировали в течение 5 мин при скорости 4000g при комнатной температуре. Осадок в пробирке ресуспендировали в свежем вышеописанном растворе (около 500 мкл) для получения 2109 клеток/мл. Для трансформирования 200 мкг ДНК-носителя смешали с 1 мкг трансформирующей ДНК и 200 мкл дрожжевых клеток в микропробирке типа "эппендорф". Затем добавили 1,2 мл раствора ТЕ/ацетата лития, содержащего 40% полиэтиленгликоля (PEG), и дрожжевую суспензию выдерживали при перемешивании в течение 30 мин при температуре 30 С. Тепловой шок выполняли путем выдерживания дрожжевой суспензии при температуре 42 С в течение 15 мин. Затем ее центрифугировали в течение 5 с при комнатной температуре. Дрожжи ресуспендировали в ТЕ-буфере и наносили на полную минимальную (СМ) среду без одного компонента (dropout) в чашках Петри. Среду СМ предварительно готовили из 1,3 г порошка без одного компонента, содержащего различные аминокислоты без урацила, 1,7 г дрожжевого азотистого основания без аминокислот и сульфата аммония, 5 г сульфата аммония, 20 г глюкозы и 20 г агара на литр). Чашки Петри инкубировали при температуре 30 С до появления трансформантов. Для выполнения in vivo капельного теста трансформанты инокулировали в 5 мл стерильной жидкой среды СМ и выращивали в течение ночи при перемешивании при температуре 30 С. На следующий день разбавляли дрожжевые колонии для достижения оптической плотности 0,3 при длине волны 600 нм. Начиная с этого первого разбавления, другие серийные разбавления (1:10, 1:100, 1:1000) были выполнены на 96-луночных плашках. 5 мкл каждого разбавления помещали на чашки Петри диаметром 90 мм, содержащие твердую среду СМ. Для контрольных образцов добавляли 2% глюкозы или 2% галактозы; для образцов, обработанных производными камптотецина, добавляли 2% галактозы и лекарственные средства в концентрации 45 мкМ. Дрожжевые колонии инкубировали при температуре 30 С в течение 48-72 часов и визуально анализировали невооруженным глазом. Результаты Активность производных камптотецина оценивали по жизнеспособности дрожжевых клеток,трансформированных человеческой ДНК-топоизомеразой I "дикого типа" (YCpGAL1hTOP1) или человеческой мутантной ДНК-топоизомеразой I YCpGAL1htop1K720E, по показателям числа дрожжевых колоний, выросших в агаре. ST1968, ST1969, ST1481 (гиматекан), ST1600 (7-[2-(4-морфолинил)этокси]иминометилкамптотецин) и ST1976 (7-(4-амино)бензилоксииминометилкамптотецин) и камптотецин (СРТ) проявили ингибирование роста дрожжей, трансформированных ДНК-топоизомеразой I "дикого типа"(фиг. 1). Неожиданно оказалось, что только ST1968 и ST1969 были способны ингибировать рост трансформированного мутанта YCpGAL1htop1K720E (см. фиг. 1). Культуры дрожжевых клеток, трансформированные YcpGal1hTOP1(WT), YcpGal1htop1K720E иYcpGall (пустой вектор) были подвергнуты серийным разбавлениям (10-кратное разбавление слева направо) и нанесены пятнами на пластины с минимальной средой без урацила на основе агара, содержащей 2% галактозы и 45 мкМ камптотецина, ST1481, ST1968, ST1969, ST1600 и ST1976. Пример 2. In vivo противоопухолевая активность на резистентных к лекарственным средствам опухолевых чужеродных трансплантационных моделях.ST1968 показал широкий спектр эффективности против различных резистентных чужеродных трансплантационных опухолевых моделей. При использовании режима q4d-дозирования ("каждые 4 суток"), с повторением для 3-5 доз, ST1968 сравнивали с иринотеканом или другими известными химиотерапевтическими средствами в отношении различных моделей человеческих опухолей (табл. 2), в том числе овариальной карциномы A2780/ADR с мультилекарственной резистентностью, для которой характерна оверэкспрессия PgP-гликопротеина, платино-резистентной A2780/DDP овариальной карциномы иDU145RC1 камптотецин-резистентной карциномы простаты, которая была ранее выбрана путем продолжительного воздействия 9-нитрокамптотецина на клетки DU145 с врожденной чувствительностью(Urasaki Y. et al., 2001, Cancer Res., 61, 1964-9). На этой выбранной линии опухолевых клеток была найдена мутация Топоизомеразы I, которая изменяет аргининовый 364 кодон на гистидиновый (R364H). Точка мутации 364 Н была локализована в сильно преобразованном коре, регионе Топоизомеразы I, в пределах 361-364-аминокислотных остатков топоизомеразы I, важных для резистентности к камптотецину. Более того, эта точка мутации находится очень близко к каталитическому тирозину. Резистентность топоизомеразы I/R364H, вероятно, может быть приписана потере критически важной водородной связи между R364H и Е-циклическим лактонным фрагментом камптотецина. Методы Экспоненциально растущие опухолевые клетки были впрыснуты подкожно голым атимическим мышам. Количество опухолевых клеток было заранее выбрано по кривой роста. Мышей помещали в клетки из макролона (с размерами 33,21513 см) с питанием через крышку из нержавеющей стали и стерильной и непылящей глинистой подстилкой. Животных содержали в цикле чередования света и темноты, при поддержании постоянных температуры и влажности. Параметры помещений для животных были следующими: температура 222 С, относительная влажность 5510%, воздухообмен фильтрованного воздуха примерно 15-20 раз в час и 12-часовой циркадный цикл с искусственным светом (7 ч утра, 7 ч вечера). По требованию условия окружающей среды фиксировали, и данные сохранялись в записях-4 016487 Архивов Содержания Животных. Питьевую воду подавали без ограничений. Каждая мышь ежедневно получала полную гранулированную пищу (GLP 4RF21, Mucedola) на всем протяжении исследования. Аналитические сертификаты на пищу и воду для животных сохранены в исходных условиях Sigma-Tau. Все животные были взвешены перед началом эксперимента и были разделены на разные группы по дозировке. Каждая клетка была идентифицирована бумажным ярлыком, указывающим: номер клетки,группу, дату инъекции опухолевых клеток, дату начала лечения, наименование испытуемого образца,дозу и путь введения, дату гибели. Рост опухоли контролировали раз в две недели измерениями диаметра опухоли с помощью кронциркуля Vernier. Объем опухоли (TV, мм 3) рассчитывался следующим образом: [длина(мм)ширина(мм 2)]/2, где ширина и длина представляли собой самый короткий и самый длинный диаметры каждой опухоли, соответственно. Эффективность лекарственного лечения была определена как: а) ингибирование объема опухоли(TVI%) у леченных мышей сравнительно с контрольными, рассчитываемое как: 100-[(средний объем опухоли у леченных животных/средний объем опухоли у контрольных животных)100]; b) LCK (log10 убитых клеток), рассчитанный по формуле LCK=(Т-С)/3,32DT, где Т и С представляют собой средние периоды времени (в днях), требуемые для достижения объема 1000 мм 3 для леченной (Т) и контрольной(С) опухоли, соответственно, и DT представляет собой время удвоения контрольных опухолей; CR означает отсутствие признаков опухоли, продолжающееся в течение по меньшей мере 10 дней. Токсичность лекарственной терапии была определена следующим образом: потеря массы тела в процентах (% BWLmax)=100-(средняя BW день x/средняя BW день 1100), где BWx представляет собой среднюю массу тела (BW) в день максимальной потери в ходе лечения, и BW1 представляет собой среднюю массу тела (BW) в первый день лечения. Результаты Эффективность ST1968 в показателях ингибирования объема опухоли (TVI%) или логарифма убитых клеток (LCK) или полного отклика (CR) относительно трех различных резистентных к лекарственным средствам опухолевых чужеродных трансплантационных моделей была значительно улучшена по сравнению с иринотеканом или топотеканом или химиотерапевтическими средствами, такими как паклитаксел и карбоплатин (см. табл. 2). В частности, ST1968 показал более высокий противоопухолевый эффект в показателях количества полного отклика по меньшей мере в течение 10 дней после последнего лечения. Более того, ST1968 проявил высокое постоянство действия на рост опухоли после завершения лечения, поскольку показатель LCK был более высоким, чем таковой, обнаруженный для других лекарственных препаратов. Неожиданно оказалось, что эффективность ST1968 в показателях ингибирования объема опухоли(TVT%) или логарифма убитых клеток (LCK) против мутированной топоизомеразы I клеточной линииDU145RC.1 была увеличена относительно таковой, наблюдаемой против DU145 чувствительной карциномы простаты. Таблица 2 Противоопухолевая активность ST1968 на резистентных к лекарственным средствам опухолевых чужеродных трансплантационных моделях-5 016487 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения формулы I где R представляет собой водород или C1-С 4-алкил, для изготовления лекарственного средства для лечения резистентных к лекарственным препаратам опухолей у пациентов, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I. 2. Применение по п.1, где R представляет собой водород или метил. 3. Применение по п.1 или 2, где резистентная к лекарственным препаратам опухоль выбрана из группы, включающей саркому, карциному, карциноидную опухоль кости, нейроэндокринную опухоль,лимфоидную лейкемию, острую промиелоцитарную лейкемию, миелоидную лейкемию, моноцитарную лейкемию, мегакариобластную лейкемию и болезнь Ходжкина. 4. Применение по пп.1-2, в котором опухоль представляет собой карциному простаты. 5. Способ лечения опухоли, резистентной к лекарственным препаратам у пациентов, которые проявляют полиморфизм в гене, кодирующем ДНК-топоизомеразу I, включающий введение терапевтически эффективного количества соединения формулы I где R представляет собой водород или C1-C4-алкил, или фармацевтической композиции, содержащей фармацевтически приемлемые носители и/или наполнители.
МПК / Метки
МПК: A61P 35/00, A61K 31/4745
Метки: препаратам, резистентных, опухолей, лечение, лекарственным
Код ссылки
<a href="https://eas.patents.su/7-16487-lechenie-rezistentnyh-k-lekarstvennym-preparatam-opuholejj.html" rel="bookmark" title="База патентов Евразийского Союза">Лечение резистентных к лекарственным препаратам опухолей</a>
Предыдущий патент: Обнаружение и мониторинг частичного разряда в линии электропередачи
Следующий патент: Способ и реактор для анаэробной очистки сточных вод
Случайный патент: Система и способ управления тепловой энергией в здании, оборудованном шахтой для лифтовых установок











