7-фенилалкилзамещённые 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(адф-рибоза)полимеразы
Номер патента: 11211
Опубликовано: 27.02.2009
Авторы: Мабир Доминик Жан-Пьер, Гийемон Жером Эмиль Жорж, Сомерс Мария Викторина Франциска, Ваутерс Вальтер Баудевейн Леопольд, Ван Дюн Якобус Альфонсус Йозефус
Формула / Реферат
1. Соединение формулы (I)
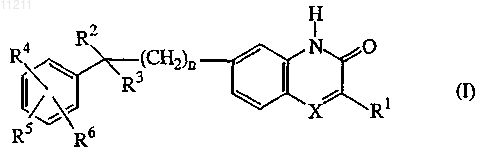
его N-оксидные формы, аддитивные соли и стереохимически изомерные формы, где
n равно 0, 1 или 2;
X означает N или CR7, где R7 означает водород;
R1 означает C1-6-алкил;
R2 означает водород;
R3 означает радикал, выбираемый из группы, включающей -(CH2)s-NR8R9 (а-1), -O-Н (а-2),
где s означает 0 или 2;
R8 означает C1-6-алкил или арилС1-6-алкил(C1-6-алкил)аминоС1-6-алкил;
R9 означает водород или С1-6-алкил;
либо R3 означает группу формулы -(CH2)t-Z- (b-1),
где t равно 0;
Z означает гетероциклическую кольцевую систему, выбираемую из группы, включающей
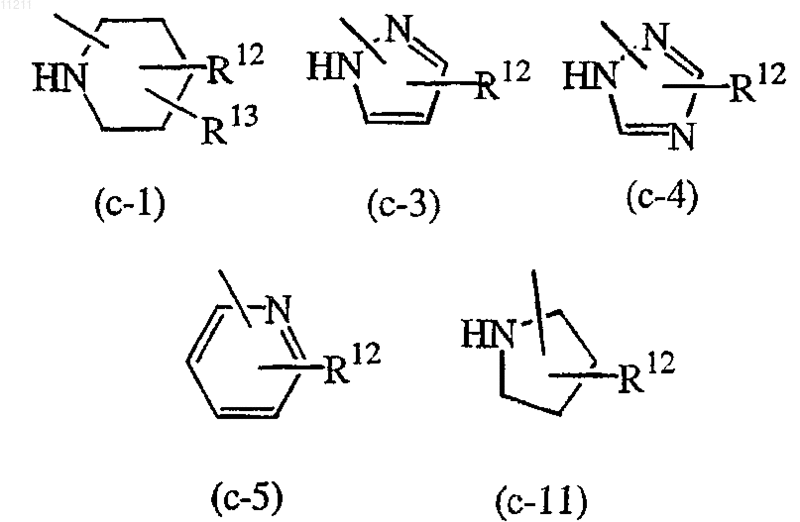
где R12 означает водород или С1-6-алкилоксиС1-6-алкиламино; и
R13 означает водород;
каждый из R4, R5 и R6 означает независимо водород, галоген или C1-6-алкил;
арил означает фенил.
2. Соединение по п.1, где
n равно 0 или 1; X означает N или CR7, где R7 означает водород; R1 означает C1-6-алкил; R2 означает водород; R3 означает радикал, выбираемый из (а-1) или (а-2), или означает группу формулы (b-1); s равно 0 или 2; R8 означает C1-6-алкил или арилС1-6-алкил(C1-6-алкил)аминоС1-6-алкил; t равно 0; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1), (с-3), (с-4), (с-5) или (с-11); каждый R12 независимо означает водород или С1-6-алкилоксиС1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород, галоген или C1-6-алкил.
3. Соединение по пп.1 и 2, где
n равно 0 или 1; X означает N; R1 означает C1-6-алкил; R2 означает водород; R3 означает радикал формулы (а-1) или группу формулы (b-1) ; s равно 0; R8 означает арилС1-6-алкил(C1-6-алкил)аминоС1-6-алкил; t равно 0; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1); каждый R12 независимо означает водород или С1-6-алкилоксиС1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород или галоген.
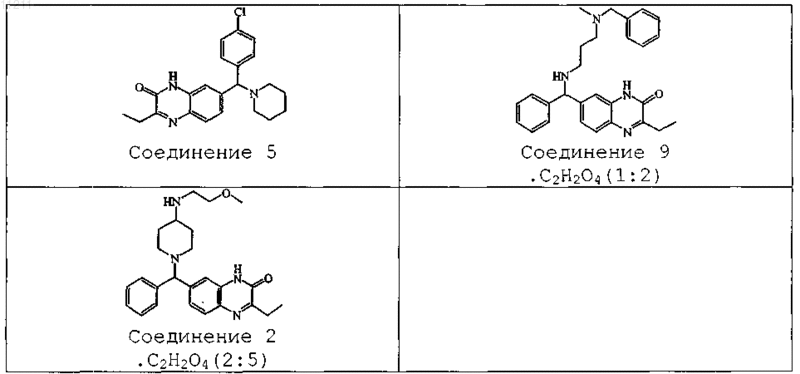
4. Соединение по пп.1, 2 и 3, выбираемое из соединения ь 5, соединения ь 9 и соединения ь 2.
5. Применение соединения по одному из пп.1-4 в качестве лекарственного средства для лечения PARP-опосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак, рак груди, рак яичника, рак (половой клетки) яичника, рак предстательной железы, тестикулярный рак, рак шейки матки, рак влагалища и рак вульвы.
6. Фармацевтическая композиция, включающая фармацевтически приемлемые носители и, в качестве активного ингредиента, терапевтически эффективное количество соединения по пп.1-4.
7. Способ получения фармацевтической композиции по п.6, включающий однородное смешение фармацевтически приемлемых носителей и соединения по пп.1-4.
8. Применение соединения по пп.1-4 для получения лекарственного средства для лечения PARP-опосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак, рак груди, рак яичника, рак (половой клетки) яичника, рак предстательной железы, тестикулярный рак, рак шейки матки, рак влагалища и рак вульвы.
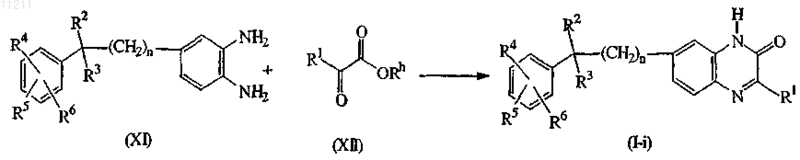
9. Способ получения соединения по п.1, отличающийся тем, что он включает конденсацию соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII), где Rh означает С1-6-алкил до соединений формулы (I), где X означает N, обозначенных как соединения формулы (I-i), в присутствии карбоновой кислоты, например уксусной кислоты и тому подобного, минеральной кислоты, такой как, например, хлористо-водородная кислота, серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота и тому подобное.
Текст
011211 Настоящее изобретение относится к ингибиторам PARP и представляет соединения и композиции,содержащие рассматриваемые соединения. Кроме того, настоящее изобретение относится к способам применения описанных ингибиторов PARP, например, в качестве лекарственных средств. Нуклеарный фермент поли(АДФ-рибоза)полимераза-1 (PARP-1) является членом семейства ферментов PARP, состоящего из PARP-1 и нескольких недавно идентифицированных новых поли(АДФрибозилирующих)ферментов. PARP носит также название поли(аденозин-5'-дифосфорибоза)полимераза или PARS (поли(АДФ-рибоза)синтетаза).PARP-1 является основным ядерным белком в 116 кДа, состоящим из трех доменов, таких как Nконцевой ДНК-связывающий домен, состоящий из двух цинкосодержащих пальцеобразных областей,аутомодификационный домен и С-концевой каталитический домен. Указанный PARP-1 присутствует почти во всех эукариотах. Фермент синтезирует поли(АДФ-рибозу), разветвленный полимер, содержащий свыше 200 звеньев АДФ-рибоза. Акцепторы белка поли(АДФ-рибозы) прямо или опосредованно вовлечены в поддержание целостности ДНК. Такие акцепторы включают гистоны, топоизомеразы, ДНКи РНК-полимеразы, ДНК-лигазы и Са 2+- и Mg2+-зависимые эндонуклеазы. PARP-белок экспрессируется на высоком уровне во многих тканях, что особо касается клеток иммунной системы, сердца, головного мозга и клеток зародышевой линии. В нормальных физиологических состояниях проявляется минимальная активность PARP. Однако нарушение ДНК вызывает немедленную активацию PARP до 500-кратного уровня. Из числа многих функций, принадлежащих PARP, и, в особенности, PARP-1, основная роль состоит в содействии репарации ДНК путем АДФ-рибозилирования и, таким образом, координировании ряда ДНК-репаративных белков. В результате активации PARP, NAD+-уровни существенно снижаются. Экстенсивная активация PARP ведет к сильному уменьшению NAD+ в клетках, страдающих массивным нарушением ДНК. Короткое время полужизни поли(АДФ-рибозы) приводит к ускоренному обмену веществ. Поли(АДФ-рибоза), как только образуется, быстро распадается под действием конститутивно активной поли(АДФ-рибоза)гликогидролазы (PARG), вместе с фосфодиэстеразой и (АДФрибоза)протеинлиазой. PARP и PARG образуют цикл, превращающий большое количество NAD+ в АДФрибозу. Менее чем за час избыточная стимуляция PARP может вызвать снижение NAD+ и АТФ до уровня менее 20% от нормального. Такой вариант развития событий в особенности разрушителен при ишемии, когда кислородная недостаточность уже существенно нарушает выделение энергии клетками. Считается, что последующее продуцирование свободных радикалов при реперфузии является основной причиной повреждения ткани. Часть сокращения АТФ, что является типичным для многих органов при ишемии и реперфузии, может быть связана с элиминацией NAD+, вызванной метаболизмом поли(АДФрибозы). Таким образом, можно ожидать, что ингибирование PARP или PARG сохранит клеточный энергетический уровень, тем самым потенцируя выживание ишемических тканей после инсульта. Синтез поли(АДФ-рибозы) также вовлечен в индуцированную экспрессию ряда генов, существенных для воспалительной реакции. Ингибиторы PARP подавляют продуцирование индуцируемого комплекса оксид азота-синтаза (iNOS) в макрофагах, Р-типа селекции и фактора межклеточной адгезии-1(ICAM-1) в эндотелиальных клетках. Такая активность лежит в основе сильных противовоспалительных эффектов, проявляемых ингибиторами PARP. Ингибирование PARP способно снижать некроз посредством предотвращения транслокации и инфильтрации нейтрофилов к поврежденным тканям.PARP активируется нарушенными ДНК-фрагментами и, будучи активированным, катализирует присоединение до 100 АДФ-рибоза-звеньев к различным ядерным белкам, включая гистоны и самиPARP. При большинстве клеточных стрессов экстенсивная активация PARP может быстро привести к повреждению клеток или гибели через уменьшение запасов энергии. Поскольку четыре молекулы АТФ расходуется на каждую молекулу регенерируемого NAD+, содержание NAD+ снижается при массивной активации PARP, при попытках ресинтеза NAD+, содержание АТФ также может снижаться. Сообщается, что активация PARP играет ключевую роль как в NMDA-, так и NO-индуцируемой нейротоксичности. Это продемонстрировано на кортикальных культурах и гиппокампальных срезах, где предупреждение токсичности непосредственно коррелируется с эффективностью ингибирования PARP. Таким образом подтверждается возможная роль ингибиторов PARP в терапии нейродегенеративных заболеваний и травмы головного мозга, хотя точный механизм действия до сих пор не выявлен. Подобным образом было продемонстрировано, что разовые инъекции ингибиторов PARP снижают объем инфаркта, вызванного ишемией и реперфузией сердечной или скелетной мышцы у кроликов. В этих исследованиях, разовая инъекция 3-аминобензамида (10 мг/кг), либо за одну минуту до окклюзии,либо за одну минуту до реперфузии, вызывает подобные снижения в объеме инфаркта в сердце (32-42%),тогда как 1,5-дигидроксиизохинолин (1 мг/кг), другой ингибитор PARP, снижает объем инфаркта в сопоставимой степени (38-48%). Эти результаты дают основание предположить, что ингибиторы PARP могут восстанавливать сердце с уже имеющимся ишемическим нарушением или реперфузионное нарушение ткани скелетной мышцы. Активация PARP может также быть использована в качестве меры нарушения, сопровождающего нейротоксические инсульты, возникающие при воздействии каких-либо следующих индуцирующих фак-1 011211 торов, таких как глутамат (через стимуляцию рецептора NMDA), реакционноспособные кислородные промежуточные соединения, амилоидный -белок, N-метил-4-фенил-1,2,3,6-тетрагидропиридин (МРТР) или соответствующий активный метаболит N-метил-4-фенилпиридин (МРР+), участвующих в патологических состояниях, таких как внезапный удар, болезнь Альцгеймера и болезнь Паркинсона. Другие исследования продолжили выяснения роли активации PARP в зернистых клетках мозжечка in vitro и в МРТР-нейротоксичности. Избыточное невральное воздействие глутамата, который служит преобладающим нейромедиатором центральной нервной системы и действует на N-метил-D-аспартат(NMDA)рецепторы и другие субтипы рецепторов, наиболее часто возникает в результате внезапного удара или других нейродегенеративных процессов. Лишенные кислорода нейроны высвобождают глутамат в больших количествах во время ишемического мозгового инсульта, как, например, во время внезапного удара или инфаркта миокарда. Такое избыточное высвобождение глутамата в свою очередь вызывает сверхстимуляцию (эксайтотоксичность) N-метил-D-аспартат-(NMDA-), AMPA-, каинатного и MGRрецепторов, что открывает ионные канальцы и разрешает неконтролируемый поток ионов (например,Са 2+ и Na+ в клетки и K+ из клеток), вызывающий сверхстимуляцию нейронов. Сверхстимулированные нейроны секретируют больше глутамата, создавая контур обратной связи или эффект "домино", который в конечном счете приводит к нарушению клетки или гибели через продуцирование протеаз, липаз и свободных радикалов. Избыточная активация глутаматных рецепторов вовлечена в различные неврологические болезни и состояния, такие как эпилепсия, внезапный удар, болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз (ALS), болезнь Хантингтона, шизофрения, хроническая боль,ишемия и утрата нейронов вслед за гипоксией, гипогликемией, ишемией, травмой и нервным инсультом. Воздействие глутамата и стимуляция вовлечены, в качестве исходных предпосылок, в компульсивные нарушения, в частности, лекарственную зависимость. Доказательство включает данные, полученные на многих видах животных, а также в церебрально-кортикальных культурах, обработанных глутаматом илиNMDA, о том, что антагонисты глутаматного рецептора (т.е., соединения, которые блокируют глутамат от связывания с соответствующим рецептором или активации рецептора) блокируют нервное нарушение,следующее за васкулярным приступом. Попытки предупредить эксайтотоксичность путем блокированияNMDA-, АМРА-, каинатного и MGR-рецепторов оказались затруднительными, поскольку каждый рецептор имеет множество участков, с которыми может быть связан глутамат, а следовательно, обнаружение эффективной смеси антагонистов или универсального антагониста для предотвращения связывания глутамата с каждым из рецепторов и возможности исследования этого предположения, осложнены. Кроме того, многие композиции, эффективные в блокировании рецепторов, также являются токсичными для животных. По существу, в настоящее время не существует эффективного лечения глутаматных нарушений. Стимуляция NMDA-рецепторов посредством глутамата, например, активирует фермент нейрональный оксид азота-синтаза (nNOS), приводящий к образованию оксида азота (NO), который также опосредует нейротоксичность. NMDA-нейротоксичность можно предотвратить с помощью ингибиторов оксид азота-синтазы (NOS) или посредством направленного генетического разрушения nNOS in vitro. Другим применением PARP-ингибиторов является лечение повреждений периферического нерва и возникающего в результате патологического болевого синдрома, известного как невропатическая боль,такого как вызывается хроническим сжатием (CCI) общего седалищного нерва и при котором возникает транссинаптическая альтерация спинного рога спинного мозга, характеризующаяся гиперхроматозмом цитоплазма и неоплазма (так называемые "темные" нейроны). Существует также доказательство того, что PARP-ингибиторы полезны для лечения воспалительных заболеваний кишечника, таких как колит. В частности, колит был вызван у крыс путем внутрипросветного введения гаптентринитробензолсульфокислоты в 50% этаноле. Подвергаемым лечению крысам давали 3-аминобензамид, специфический ингибитор PARP-активности. Ингибирование PARP-активности снижает воспалительную реакцию и восстанавливает морфологию и энергетический статус дистальной ободочной кишки. Еще одно доказательство позволяет предположить, что PARP-ингибиторы полезны для лечения артрита. Кроме того, доказано, что PARP-ингибиторы полезны для лечения диабета. Обнаружено также,что PARP-ингибиторы полезны для лечения эндотоксического шока или септического шока.PARP-ингибиторы были также применены для увеличения продолжительности жизни и пролиферативного понтенциала клеток, что включает лечение таких заболеваний, как старение кожи, болезнь Альцгеймера, атеросклероз, остеоартрит, остеопороз, мышечная дистрофия, дегенеративные болезни скелетной мышцы, включающие репликативное старение, старческая мышечная дегенерация, старение иммунной системы, СПИД и другое заболевание, связанное со старением иммунной системы; и изменение экспрессии генов стареющих клеток. Известно также, что PARP-ингибиторы, такие как 3-аминобензамид, воздействуют в целом на репарацию ДНК под влиянием, например, пероксида водорода или ионизирующего излучения. Решающая роль PARP в репарации разрывов нитей ДНК точно установлена, в особенности, разрывов, вызванных непосредственным воздействием ионизирующего излучения или возникающих опосредованно, после ферментативной репарации повреждений ДНК, вызванных метилирующими средствами,-2 011211 ингибиторами топоизомеразы I и другими химиотерапевтическими средствами, такими как цисплатин и блеомицин. Ряд исследований, с использованием "нокаутированных" мышей, моделей трансдоминантного ингибирования (сверхпродукция ДНК-связывающего домена), антисмысловых и низкомолекулярных ингибиторов, демонстрирует роль PARP в репарации и выживании клеток после вызывания нарушения ДНК. Ингибирование ферментативной активности PARP приводит к повышенной чувствительности опухолевых клеток в отношении разрушающей ДНК терапии. Сообщается, что PARP-ингибиторы являются эффективными в радиосенсибилизации (гипоксических) опухолевых клеток и эффективно препятствуют выходу опухолевых клеток из потенциально летального и сублетального нарушения ДНК после радиационной терапии, по-видимому, благодаря способности предупреждать соединение разрывов нитей ДНК и влиять на некоторые сигнальные пути нарушений ДНК.PARP-ингибиторы были применены для лечения злокачественного новообразования. Кроме того,патент США 5177075 описывает некоторые изохинолины, полезные для усиления летального воздействия ионизирующего излучения или химиотерапевтических средств на опухолевые клетки. Weltin et al.,"Effect of 6(5-Phenanthridinone, an Inhibitor of Poly(ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6:9, 399-403 (1994), описывает ингибирование активности PARP, сниженную пролиферацию опухолевых клеток и заметный синергический эффект при совместной обработке опухолевых клеток алкилирующим лекарственным средством. Всеобъемлющий обзор существующего уровня техники недавно опубликован Li and Zhang в IDrags 2001, 4(7): 804-812. Продолжает оставаться потребность в эффективных и сильнодействующих PARP-ингибиторах, и более предпочтительно, ингибиторах PARP-1, оказывающих минимальное побочное действие. Настоящее изобретение касается соединений, композиций и способов, предназначенных для ингибирования активности PARP, в целях лечения злокачественного новообразования и/или предупреждения нарушений клеток, ткани и/или органов, обусловленных нарушениями или гибелью клеток вследствие, например,некроза или апоптоза. Соединения и композиции по настоящему изобретению в особенности полезны для повышения эффективности химиотерапии и лучевой терапии, где первичный эффект лечения состоит в том, что вызываются нарушения ДНК в мишеневых клетках. ЕР 371564, опубликованный 6 июня 1990 г., описывает (1H-азол-1-илметил)замещенные производные хинолина, хиназолина или хиноксалина. Указанные соединения подавляют элиминацию из плазмы ретиноевых кислот. Более подробно описаны соединение 3-этил-7-[1H-имидазол-1-илфенилметил]2(1H)хиноксалинон (соединение 19 по настоящей заявке) и соединение 7-[(4-хлорфенил)-1Hимидазол-1-илметил]-3-метил-2(1H)хиноксалинон (соединение 20 по настоящей заявке). Настоящее изобретение относится к соединениям формулы (I)N-оксидным формам, аддитивным солям и стереохимически изомерным формам указанных соединений, где n равно 0 или 1;R9 означает водород или C1-6-алкил; либо R3 означает группу формулы -(CH2)t-Z- (b-1),гдеZ означает гетероциклическую кольцевую систему, выбираемую из группы, включающей где R12 означает водород или С 1-6-алкилоксиС 1-6-алкиламино; и R13 означает водород; каждый из R4, R5 и R6 означает независимо водород, галоген или C1-6-алкил; арил означает фенил. Всегда, когда гетероциклическая кольцевая система Z содержит -СН 2-, -СН= или -NH- группу, заместители R12 и R13 или остаток молекулы могут быть связаны с атомом углерода или азота, в этом случае замещаются один или более атомов водорода. Соединения формулы (I) могут также существовать в таутомерных формах. Подразумевается, что такие формы, хотя в явном виде не отражены в приведенной выше формуле, входят в объем настоящего изобретения. Далее поясняется ряд терминов, использованных в приведенных выше определениях и ниже. Эти термины временами используются как таковые, а где-то входят в составные термины. Как использовано в приведенных выше определениях и ниже, галоген в основном означает фтор,хлор, бром и йод; C1-6-алкил означает линейные или разветвленные насыщенные углеводородные радикалы с 1-6 атомами углерода, такие как, например, метил, этил, пропил, бутил, пентил, гексил, 1 метилэтил, 2-метилпропил, 2-метилбутил, 2-метилпентил и тому подобное; С 1-6-алкандиил означает бивалентные линейные или разветвленные насыщенные углеводородные радикалы с 1-6 атомами углерода,такие как, например, метилен, 1,2-этандиил, 1,3-пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6 гександиил и разветвленные изомеры, такие как 2-метилпентандиил, 3-метилпентандиил, 2,2 диметилбутандиил, 2,3-диметилбутандиил и тому подобное; тригалогенС 1-6-алкил означает C1-6-алкил,содержащий три одинаковых или различных галогеновых заместителя, например, трифторметил, С 2-6 алкенил означает линейные или разветвленные углеводородные радикалы, содержащие одну двойную связь и состоящие из 2-6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2 пентенил, 3-пентенил, 3-метил-2-бутенил и тому подобное; С 3-6-алкинил означает линейные или разветвленные углеводородные радикалы, содержащие одну тройную связь и состоящие из 3-6 атомов углерода,такие как, например, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-гексинил и тому подобное; С 3-10-циклоалкил включает циклические углеводородные группы с 3-10 углеродами, такие как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил, циклооктил и тому подобное. Термин "аддитивная соль" включает соли, которые способны образовывать соединения формулы (I) с органическими или неорганическими основаниями, такими как амины, основания щелочных металлов и основания щелочноземельных металлов или четвертичные аммониевые основания, либо с органическими или неорганическими кислотами, такими как минеральные кислоты, сульфокислоты, карбоновые кислоты или фосфорсодержащие кислоты. Термин "аддитивная соль" также включает фармацевтически приемлемые соли, комплексы с металлами и сольваты, и соответствующие соли, которые способны образовывать соединения формулы (I). Термин "фармацевтически приемлемые соли" означает фармацевтически приемлемые кислотноили основно-аддитивные соли. Подразумевается, что вышеупомянутые фармацевтически приемлемые кислотно- или основно-аддитивные соли включают терапевтически активные нетоксические кислотно- и нетоксические основно-аддитивные формы солей, которые способны образовывать соединения формулы(I). Соединения формулы (I), обладающие основными свойствами, могут быть превращены в соответствующие фармацевтически приемлемые кислотно-аддитивные соли путем обработки указанной основной формы подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галоидводородные кислоты, например, хлористо-водородная или бромисто-водородная кислота; серная; азотная; фосфорная и тому подобные кислоты; или органические кислоты, такие как, например,уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая, малоновая, янтарная(т.е. бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая,этансульфоновая,бензолсульфоновая,п-толуолсульфоновая,цикламовая,салициловая,паминосалициловая, памовая и тому подобные кислоты. Соединения формулы (I), обладающие кислотными свойствами, могут быть превращены в фармацевтически приемлемые основно-аддитивные соли путем обработки указанных кислотных форм подхо-4 011211 дящим органическим или неорганическим основанием. Подходящие основные солевые формы включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например соли лития, натрия, калия, магния, кальция и тому подобные, соли с органическими основаниями, например, соли с бензатином, N-метил-D-глюкамином, гидрабамином, и соли с аминокислотами, такими как, например,аргинин, лизин и тому подобное. Термины "кислотно-" или "основно-аддитивная соль" также включают гидраты и аддитивные формы с растворителем, которые способны образовывать соединения формулы (I). Примерами таких форм служат, например, гидраты, алкоголяты и тому подобное. Термин "комплексы металлов" означает комплекс, образованный между соединением формулы (I) и одной или более органической или неорганической солью или солями металла. Примеры указанных органических или неорганических солей включают галогениды, нитраты, сульфаты, фосфаты, ацетаты,трифторацетаты, трихлорацетаты, пропионаты, тартраты, сульфонаты например, метилсульфонаты, 4 метилфенилсульфонаты, салицилаты, бензоаты и тому подобное, металлов второй основной группы периодической системы, например, соли магния или кальция, третьей или четвертой основной группы, например, алюминия, олова, свинца, а также первой-восьмой группы переходных металлов периодической системы, таких как, например, хром, марганец, железо, кобальт, никель, медь, цинк и тому подобное. Термин "стереохимически изомерные формы соединения формулы (I)", как использовано здесь ранее, означает все возможные соединения, состоящие из тех же самых атомов, связанных той же последовательностью связей, но имеющие отличные пространственные структуры, не являющиеся равноценными, которые могут существовать для соединения формулы (I). Если не оговорено противное или не указано особо, химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которые может образовывать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Подразумевается, что все стереохимически изомерные формы соединения формулы (I), как в чистом виде,так и в смеси друг с другом, входят в объем настоящего изобретения. Подразумевается, что N-оксидные формы соединения формулы (I) включают те соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида, в особенности, те Nоксиды, где один или более азотов пиперидина, пиперазина или пиридазинила являются N-окисленными. Подразумевается, что всякий раз, когда используется, термин "соединения формулы (I)" включает также N-оксидные формы, фармацевтически приемлемые кислотно- или основно-аддитивные соли и все стереоизомерные формы. Соединения, описанные в ЕР 371564, подавляют элиминацию из плазмы ретиноевых кислот. Соединение 3-этил-7-[1H-имидазол-1-илфенилметил]-2(1H)-хиноксалинон (соединение No. 19 по настоящей заявке) и соединение 7-[(4-хлорфенил)-1H-имидазол-1-илметил]-3-метил-2(1H)-хиноксалинон (соединение No. 20 по настоящей заявке) описаны в ЕР 371564. Неожиданно было обнаружено, что соединения по настоящему изобретению обладают PARP-ингибирующей активностью. Первая группа рассматриваемых соединений включает те соединения формулы (I), в отношении которых применимы одно или более следующих ограничений: а) n равно 0 или 1; в) X означает N или CR7, где R7 означает водород;e) R3 означает радикал, выбираемый из (а-1) или (а-2), или означает группу формулы (b-1);i) Z означает гетероциклическую кольцевую систему, выбираемую из (с-1), (с-3), (с-4), (с-5) или (с 11);j) каждый R12 независимо означает водород или C1-6-алкилоксиС 1-6-алкиламино;k) каждый R13 независимо означает водород иl) каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород, галоген или C1-6 алкил. Вторая группа рассматриваемых соединений включает те соединения формулы (I), в отношении которых применимы одно или более следующих ограничений:d) R3 означает радикал формулы (а-1) или группу формулы (b-1);h) Z означает гетероциклическую кольцевую систему, выбираемую из (с-1);i) каждый R12 независимо означает водород или C1-6-алкилоксиС 1-6-алкиламино;j) каждый R13 независимо означает водород иk) каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород или галоген. Третья группа рассматриваемых соединений включает те соединения формулы (I), относящиеся к первой группе рассматриваемых соединений или второй группе рассматриваемых соединений, где Z означает гетероциклическую кольцевую систему, отличную от гетероциклической кольцевой системы формулы (с-4). Группу предпочтительных соединений составляют те соединения формулы (I), где n равно 0 или 1;X означает N или CR7, где R7 означает водород; R1 означает С 1-6-алкил; R2 означает водород; R3 означает радикал, выбираемый из (а-1) или (а-2), или означает группу формулы (b-1); s равно 0, 1 или 2; R8 означает C1-6-алкил или арилС 1-6-алкил (C1-6-алкил)аминоС 1-6-алкил; t равно 0, 1 или 2; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1), (с-3), (с-4), (с-5) или (с-11); каждый R12 независимо означает водород или С 1-6-алкилоксиС 1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород, галоген или C1-6-алкил. Другую группу предпочтительных соединений составляют те соединения формулы (I), где n равно 0 или 1; X означает N; R1 означает C1-6-алкил; R2 означает водород; R3 означает радикал формулы (а-1) или группу формулы (b-1); s равно 0; R8 означает арилС 1-6-алкил (C1-6-алкил)аминоС 1-6-алкил; t равно 0; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1); каждый R12 независимо означает водород или С 1-6-алкилоксиC1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4,R5 и R6 независимо выбирают из группы, включающей водород или галоген. Еще одна группа предпочтительных соединений включает те соединения формулы (I), относящиеся к первой группе рассматриваемых соединений или второй группе рассматриваемых соединений, где Z означает гетероциклическую кольцевую систему, отличную от гетероциклической кольцевой системы формулы (с-4). Наиболее предпочтительными соединениями являются соединение 5, соединение 9, соединение 2 и соединение 1. Соединения формулы (I) могут быть получены по общим методикам, описанным в ЕР 371564. Ряд таких препаративных способов описан ниже более подробно. Другие способы получения конечных соединений формулы (I) описаны в примерах. Соединения формулы (I), где R2 означает водород и R3 означает -NR9-CHO, где R9 означает водород или метил, носящие здесь название соединений формулы (1-b), могут быть получены, исходя из соединений формулы (I), где R2 вместе с R3 образует =O, называемых здесь также соединениями формулы (Iа), в присутствии формамида или метилформамида, обозначенных как гетероциклическую кольцевую систему, выбираемую из (с-1) или (с-2); каждый R12 независимо означает водород или С 1-6-алкилоксиС 1-6 алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород или галоген. Еще одна группа предпочтительных соединений включает те соединения формулы (I), относящиеся к первой группе рассматриваемых соединений или второй группе рассматриваемых соединений, где Z означает гетероциклическую кольцевую систему, отличную от гетероциклической кольцевой системы формулы (с-2) или (с-4). Наиболее предпочтительными соединениями являются соединение 5, соединение 9, соединение 2 и соединение 1. Соединения формулы (I) могут быть получены по общим методикам, описанным в ЕР 371564. Ряд таких препаративных способов описан ниже более подробно. Другие способы получения конечных соединений формулы (I) описаны в примерах. Соединения формулы (I), где R2 означает водород и R3 означает -NR9-CHO, где R9 означает водород или метил, носящие здесь название соединений формулы (I-b), могут быть получены исходя из соединений формулы (I), где R2 вместе с R3 образует =O, называемых здесь также соединениями формулы (I-а), в присутствии формамида или метилформамида, обозначенных как промежуточные соединения формулы Соединения формулы (I), где R3 означает гидрокси, носящие здесь название соединений формулы(I-c), могут быть получены превращением кетоновой группы соединения формулы (I-a) в гидроксигруппу, с применением соответствующего восстановителя, например, натрийборгидрида, в подходящем растворителе, например метаноле и тетрагидрофуране. Соединения формулы (I-а) могут быть получены превращением соединений формулы (I-c), где R2 означает водород, называемых здесь соединениями формулы (I-c-1), в присутствии подходящего окислителя, такого как триоксид хрома, и кислоты, такой как серная кислота, в подходящем растворителе, таком как 2-пропанон. Соединения формулы (I), где R2 означает водород и R3 означает радикал формулы (с-1), названные соединения формулы (I-f), могут быть получены осуществлением взаимодействия соединений формулы(I), где R2 означает водород и R3 означает радикал формулы (с-8), названных соединениями формулы (Id), с амином формулы (III), где Ra означает соответствующий радикал, в присутствии подходящего растворителя, такого как метанол, и подходящего реагента, такого как натрийцианоборгидрид. Промежуточные соединения формулы (IV), где W означает соответствующую уходящую группу,такие как, например, хлор, бром, метансульфонилокси или бензолсульфонилокси, могут быть получены из соединений формулы (I-c-1) путем обработки указанных соединений подходящим реагентом, например, метансульфонилоксихлоридом или бензолсульфонилоксихлоридом, или галогенирующим реагентом, таким как POCl3 или SOCl2. Соединения формулы (I), определяемые как соединения формулы (I), где Rb принимает значения,указанные для R8, и Rc принимает значения, указанные для R9, или Rb и Rc вместе с атомом азота, к которому присоединены, образуют соответствующую гетероциклическую кольцевую систему, указанную дляZ, называемые соединениями формулы (I-h), могут быть получены путем взаимодействия промежуточного соединения формулы (IV) с промежуточным соединением формулы (V). Взаимодействие может быть осуществлено в реакционно-инертном растворителе, таком как диметилформамид или ацетонитрил,и, необязательно, в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия или триэтиламин. Соединения формулы (I) могут также быть подвергнуты взаимному превращению, основываясь на известном уровне техники взаимодействия или превращения функциональных групп. Ряд таких превращений уже описан выше. Другими примерами являются гидролиз эфиров карбоновых кислот до соответствующих карбоновых кислот или спиртов; гидролиз амидов до соответствующих карбоновых кислот или аминов; гидролиз нитрилов до соответствующих амидов; аминогруппы на имидазоле или фениле могут быть замещены водородом по известным из уровня техники реакциям диазотирования и последующим замещением диазогруппы водородом; спирты могут быть превращены в сложные эфиры или простые эфиры; первичные амины могут быть превращены во вторичные или третичные амины; двойные связи могут быть гидрированы до соответствующих простых связей; йод-радикал на фенильной группе может быть превращен в сложноэфирную группу пропусканием монооксида углерода в присутствии подходящего палладиевого катализатора. Следовательно, соединения формулы (I), (I-a), (I-b), (I-c), (I-c-1), (I-d), (I-е), (I-f), (I-h), (I-i), (I-j) и (Ik) могут быть, необязательно, подвергнуты одному или более следующим превращениям в любом требуемом порядке:(i) превращению соединения формулы (I) в другое соединение формулы (I);(ii) превращению соединения формулы (I) в соответствующую приемлемую соль или соответствующий N-оксид;(iii) превращению фармацевтически приемлемой соли или N-оксида соединения формулы (I) в исходное соединение формулы (I);(iv) получению стереохимической изомерной формы соединения формулы (I) или фармацевтически приемлемой соли, или соответствующего N-оксида. Промежуточные соединения формулы (VII), где Rd и Re означают соответствующие радикалы или вместе с углеродом, к которому присоединены, образуют соответствующую гетероциклическую кольцевую систему, как указано для Z, могут быть получены гидролизом промежуточных соединений формулы(VI), где R3 означает группу формулы (b-1) или радикал формулы (а-1), где s не равен 0, называемый-8 011211 здесь Rg, по известным из уровня техники способам, таким как перемешивание промежуточного соединения (VI) в водном кислотном растворе в присутствии реакционно-инертного растворителя, например,тетрагидрофурана. Подходящей кислотой является, например, хлористо-водородная кислота. Соединения формулы (I), где R2 означает водород и Rg принимает вышеуказанные значения, называемые соединениями формулы (I-k), могут быть получены, исходя из промежуточных соединений формулы (VII), путем селективного гидрирования указанного промежуточного соединения соответствующим восстанавливающим агентом, как, например, с применением инертного катализатора, такого как платина-на-угле, палладий-на-угле и тому подобное, и соответствующего восстановителя, такого как водород, в подходящем растворителе, таком как метанол. Соединения формулы (I) могут быть получены гидролизом промежуточных соединений формулы(VIII), по известным из уровня техники способам, при воздействии на промежуточные соединения формулы (VIII) соответствующими реагентами, такими как хлорид олова, уксусная кислота и хлористоводородная кислота, в присутствии реакционно-инертного растворителя, например, тетрагидрофурана. Соединения формулы (I) могут быть получены исходя из N-оксидов формулы (IX) путем превращения промежуточных соединений формулы (IX) в присутствии подходящего реагента, такого как карбонат натрия или ангидрид уксусной кислоты, когда это целесообразно, в растворителе, таком как дихлорметан. Соединения формулы (I), где X означает СН, называемые в описании соединения формулы (I-j), могут также быть получены циклизацией промежуточного соединения формулы (X). Реакция циклизации промежуточных соединений формулы (X) может также быть выполнена согласно известным из уровня техники приемам циклизации. Предпочтительно взаимодействие осуществляют в присутствии подходящей кислоты Льюиса, например, алюминийхлорида, либо в чистом виде, либо в подходящем растворителе, таком как, например, ароматический углеводород, например, бензол, хлорбензол, метилбензол и тому подобное; галогенированные углеводороды, например, трихлорметан, тетрахлорметан и тому подобное; простой эфир, например тетрагидрофуран, 1,4-диоксан и тому подобное; или смеси указанных растворителей. Слегка повышенные температуры, предпочтительно 70-100 С, и перемешивание могут увеличить скорость реакции. Соединения формулы (I), где X означает N, называемые в описании соединения формулы (I-i), могут быть получены конденсацией соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII), где Rh означает C1-6-алкил. Конденсация замещенного ортодиамина формулы (XI) и сложного эфира формулы (XII) может быть проведена в присутствии карбоновой кислоты, например,уксусной кислоты и тому подобного, минеральной кислоты, такой как, например, хлористо-водородная кислота, серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота и тому подобное. Слегка повышенные температуры позволяют повысить скорость реакции, и в некоторых случаях взаимодействие может даже быть проведено при нагревании реакционной смеси до температуры кипения с обратным холодильником. Выделяющаяся во время конденсации вода может быть удалена из смеси путем азеотропной перегонки, перегонки и тому подобными способами. Промежуточные соединения формулы (XI) могут быть получены по реакции восстановления нитрогруппы до амино, исходя из промежуточного соединения формулы (XIII) в присутствии катализатора на основе металла, такого как никель Ренея, и тетрагидрофуране, и осуществлением последующего взаимодействия указанного промежуточного соединения с промежуточным соединением формулы (XVIII),где R1 означает водород или радикал, значения которого соответствуют R3. Настоящее изобретение также относится к соединениям вышеуказанной формулы (I) для применения в качестве лекарственного средства. Соединения по настоящему изобретению обладают PARP-ингибирующими свойствами, как видно из приведенной ниже экспериментальной части. Настоящее изобретение относится к применению соединений для получения лекарственного средства для лечения любых описанных в описании болезней или нарушений у млекопитающего, где указанными соединениями являются соединения формулы (I)N-оксидным формам, фармацевтическим приемлемым аддитивным солям и стереохимически изомерным формам указанных соединений, гдеR9 означает водород или C1-6-алкил;- 10011211 либо R3 означает группу формулы -(CH2)t-Z- (b-1),гдеZ означает гетероциклическую кольцевую систему, выбираемую из группы, включающей где R12 означает водород или С 1-6-алкилоксиС 1-6-алкиламино; и R13 означает водород; каждый из R4, R5 и R6 означает независимо водород, галоген или C1-6-алкил; арил означает фенил. Настоящее изобретение также относится к применению соединений формулы (I) в качестве лекарственного средства для лечения PARP-опосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак, рак груди, рак яичника, рак (половой клетки) яичника, эндометриальный рак, рак предстательной железы, тестикулярный рак, рак шейки матки, рак влагалища и рак вульвы. А также к применению соединения (I) для получения лекарственного средства для лечения PARPопосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак,рак груди, рак яичника, рак (половой клетки) яичника, эндометриальный рак, рак предстательной железы, тестикулярный рак, рак шейки матки, рак влагалища и рак вульвы. В частности, соединение формулы (I-1) означает 3-этил-7-[1H-имидазол-1-илфенилметил]-2(1H)хиноксалинон (соединение 19 по настоящей заявке) или соединение 7-[(4-хлорфенил)-1H-имидазол-1 илметил]-3-метил-2(1H)-хиноксалинон (соединение 20 по настоящей заявке). Ввиду способности к связыванию PARP соединения по настоящему изобретению могут быть использованы в качестве стандартных соединений или меченых соединений, в этом случае один из атомов молекулы может быть замещен, например, радиоактивным изотопом. Для получения фармацевтических композиций по настоящему изобретению эффективное количество отдельного соединения, в форме основно- или кислотно-аддитивной соли, в качестве где каждый из R12 независимо означает водород, С 1-6-алкил, аминокарбонил, гидрокси, С 1-6-алкилоксиС 1-6-алкил, C1-6-алкилоксиС 1-6-алкиламино, ди(фенилС 2-6-алкенил), пиперидинилС 1-6 алкил, С 3-10-циклоалкил, С 3-10-циклоалкилС 1-6-алкил, арилокси(гидрокси)С 1-6-алкил, галогениндазолил,арилС 1-6-алкил, арилС 2-6-алкенил, морфолино, C1-6-алкилимидазолил или пиридинилС 1-6-алкиламино; и каждый из R13 независимо означает водород, пиперидинил или арил; каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород, галоген, тригалогенметил, тригалогенметокси, C1-6-алкил, C1-6-алкилокси, ди(С 1-6-алкил)амино, ди (C1-6-алкил)аминоС 1-6 алкилокси или C1-6-алкилоксикарбонил; или когда R5 и R6 находятся на смежных позициях, указанные заместители могут вместе образовывать бивалентный радикал формулы- 11011211 арил означает фенил или фенил, замещенный галогеном, C1-6-алкилом или C1-6-алкилокси. Настоящее изобретение также относится к применению соединений формулы (I) для получения лекарственного средства для лечения одного или более из описанных в описании заболеваний или нарушений у млекопитающего, где соединение представляет собой соединение формулы (I-1)N-оксидные формы, фармацевтически приемлемые аддитивные соли и стереохимически изомерные формы указанных соединений, гдеR1 означает метил или этил;R3 означает группу формулы (b-1);-Z означает гетероциклическую кольцевую систему (с-2), где указанная гетероциклическая кольцевая система -Z соединена с остатком молекулы с помощью атома азота;R15 означает водород, галоген, C1-6-алкил или C1-6-алкилокси. В частности, соединение формулы (I-1) означает 3-этил-7-[1H-имидазол-1-илфенилметил]-2(1H)хиноксалинон (соединение 19 по настоящей заявке) или соединение 7-[(4-хлорфенил)-1H-имидазол-1 илметил]-3-метил-2(1H)-хиноксалинон (соединение 20 по настоящей заявке). Ввиду способности к связыванию PARP соединения по настоящему изобретению могут быть использованы в качестве стандартных соединений или меченых соединений, в этом случае один из атомов молекулы может быть замещен, например, радиоактивным изотопом. Для получения фармацевтических композиций по настоящему изобретению эффективное количество отдельного соединения, в форме основно- или кислотно-аддитивной соли, в качестве активного ингредиента, объединяют с фармацевтически приемлемым носителем в однородную смесь, указанный носитель может принимать целый ряд форм в зависимости от формы препарата, требуемого для введения. Эти фармацевтические композиции целесообразно выпускать в стандартной лекарственной форме, пригодной предпочтительно для введения перорального, ректального, чрескожного введения, или путем парентеральной инъекции. Например, для получения композиции в лекарственной форме, предназначенной для перорального введения, может быть использована любая общепринятая фармацевтическая среда,такая как, например, вода, гликоли, масла, спирты и тому подобное в случае препаратов в жидкой форме для перорального введения, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители,такие как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, дезинтегрирующие средства и тому подобное в случае порошков, пилюль, капсул и таблеток. По причине простоты применения, таблетки и капсулы представляют собой наиболее удобную стандартную лекарственную форму для перорального введения, в этом случае обычно используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно включает стерильную воду, по крайней мере, большей частью, хотя, например, для придания растворимости, могут быть включены другие ингредиенты. Например, могут быть получены растворы для инъекции, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть также получены суспензии для инъекции, в этом случае могут быть использованы подходящие жидкие носители, суспендирующие средства и тому подобное. В композициях, пригодных для чрескожного введения,носитель, необязательно, включает вещество, способствующее проникновению, и/или подходящее смачивающее средство, необязательно, в комбинации с подходящими вспомогательными добавками любого характера в незначительных относительных количествах, при этом указанные добавки не должны оказывать заметного вредного воздействия на кожу. Указанные добавки могут облегчать введение через кожу и/или способствовать получению требуемых композиций. Эти композиции могут быть введены различными способами, например, с помощью трансдермального пластыря, точечным нанесением, в виде мази. В особенности целесообразно формулировать вышеупомянутые фармацевтические композиции в стандартную лекарственную форму для удобства введения и равномерности дозирования. Стандартная лекарственная форма, как использовано в описании и приложенных пунктах, означает физически дискретные единицы, пригодные в качестве разовых доз, каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное на получение заданного терапевтического действия, в совокупности с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая разделенные таблетки или таблетки, покрытые оболочкой), капсулы,- 12011211 пилюли, пакетики с порошком, облатки, растворы или суспензии для инъекции, формы, измеряемые чайной ложкой с верхом, столовой ложкой с верхом, и тому подобное, и формы разделенных многократных доз. Соединения по настоящему изобретению могут лечить или предупреждать повреждения ткани,возникающие в результате нарушения клеток или гибели вследствие некроза или апоптоза; могут уменьшать интенсивность повреждения нервной или сердечно-сосудистой ткани, включая повреждения,сопровождающие очаговую ишемию, инфаркт миокарда и реперфузионное нарушение; могут лечить различные болезни или состояния, вызванные или обостренные активностью PARP; могут продлевать или увеличивать продолжительности жизни или пролиферативную способность клеток; могут изменять экспрессию генов стареющих клеток; могут радиосенсибилизировать и/или химиосенсибилизировать клетки. Обычно, ингибирование PARP-активности предохраняет клетки от энергетических потерь, предупреждая, в случае нервных клеток, необратимую деполяризацию нейронов, и тем самым, обеспечивает нейропротективное действие. Поэтому настоящее изобретение также относится к способу введения терапевтически эффективных количеств вышеуказанных соединений в количестве, достаточном для ингибирования PARP-активности,для лечения или предупреждения повреждения ткани, возникающего в результате нарушения клеток или гибели вследствие некроза или апоптоза, для обеспечения нейронной активности, не опосредованнойNMDA-токсичностью, для обеспечения нейронной активности, опосредованной NMDA-токсичностью,для лечения повреждения нервной ткани, возникающего при ишемии и реперфузионном нарушении,неврологических нарушениях и нейродегенеративных заболеваниях; для предупреждения или лечения васкулярного приступа; для лечения или предупреждения сердечно-сосудистых нарушений; для лечения других состояний и/или заболеваний, таких как старческая мышечная дегенерация, СПИД и другое заболевание, связанное со старением иммунной системы, воспаление, подагра, артрит, атеросклероз, кахексия, злокачественное новообразование, дегенеративные болезни скелетной мышцы, включающие репликативное старение, диабет, травма головного мозга, воспалительные заболевания кишечника (такие как колит и болезнь Крона), мышечная дистрофия, остеоартрит, остеопороз, хроническая и/или острая боль(такая как невропатическая боль), почечная недостаточность, ретинальная ишемия, септический шок (такой как эндотоксический шок) и старение кожи, для увеличения продолжительности жизни и пролиферативного потенциала клеток; для изменения экспрессии генов стареющих клеток; для химиосенсибилизации и/или радиосенсибилизации (гипоксических) опухолевых клеток. Настоящее изобретение также относится к лечению заболеваний и состояний у животного, которое включает введение указанному животному терапевтически эффективного количества вышеуказанных соединений. В частности, настоящее изобретение относится к способу лечения, предупреждения или подавления неврологического нарушения у животного, который включает введение указанному животному терапевтически эффективного количества вышеуказанных соединений. Неврологическое нарушение выбирают из группы, включающей такие нарушения, как периферическая невропатия, вызванная телесным повреждением или болезненным состоянием, травматическое повреждение головного мозга, травма позвоночника, внезапный удар, связанный с повреждением головного мозга, очаговая ишемия, глобальная ишемия, реперфузионное нарушение, демиелинизирующее заболевание и неврологическое нарушение, связанное с нейродегенерацией. Настоящее изобретение также относится к применению соединений формулы (I) для ингибирования PARP-активности, для лечения, предупреждения или сдерживания повреждения ткани, возникающего в результате нарушения клеток или гибели по причине некроза или апоптоза, для лечения, предупреждения или подавления неврологического нарушения у животного. Термин "предупреждение нейродегенерации" включает способность предупреждать нейродегенерацию у пациентов с впервые выявленным нейродегенеративным заболеванием или при риске развития впервые нейродегенеративного заболевания и для предупреждения дальнейшей нейродегенерации у пациентов, уже страдающих указанным заболеванием или имеющих симптомы нейродегенеративного заболевания. Термин "лечение", как использован в описании, охватывает любое лечение болезни и/или состояния у животного, в особенности, человека, и включает: (i) предупреждение возникновения болезни и/или состояния у пациента, имеющего предрасположенность к заболеванию и/или состоянию, но не имеющего установленного диагноза; (ii) сдерживание заболевания и/или состояния, т.е. остановка развития; (iii) ослабление заболевания и/или состояния, т.е. достижение регрессии заболевания и/или состояния. Термин "радиосенсибилизатор", как использован в описании, означает молекулу, предпочтительно,молекулу с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для увеличения чувствительности клеток к ионизирующему излучению и/или ускорения лечения заболеваний, излечимых с помощью ионизирующего излучения. Болезни, которые излечимы с помощью ионизирующего излучения, включают новообразования, доброкачественные и злокачественные опухоли и раковые клетки. Лечение ионизирующим излучением других, не перечисленных в описании, болезней,также охватывается настоящим изобретением. Термин "химиосенсибилизатор", как использован в описании, означает молекулу, предпочтительно- 13011211 молекулу с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для увеличения чувствительности клеток к химиотерапии и/или ускорения лечения заболеваний,излечимых с помощью химиотерапии. Болезни, которые излечимы с помощью химиотерапии, включают новообразования, доброкачественные и злокачественные опухоли и раковые клетки. Химиотерапевтическое лечение других, не перечисленных в описании, болезней, также охватывается настоящим изобретением. Соединения, композиции и способы по настоящему изобретению в особенности полезны для лечения и профилактики повреждения ткани, возникающего в результате гибели или нарушения клеток вследствие некроза или апоптоза. Соединения по настоящему изобретению могут служить "противораковыми средствами", где указанный термин также охватывает "средства против роста опухолевых клеток" и "антинеопластичные вещества". Например, способы по изобретению полезны для лечения злокачественных новообразований и химиосенсибилизирования и/или радиосенсибилизирования опухолевых клеток в злокачественных новообразованиях, включающих такие как АСТН-продуцирующие опухоли, острый лимфоцитарный лейкоз,острый нелимфоцитарный лейкоз, рак коры надпочечника, рак мочевого пузыря, рак мозга, рак молочной железы, рак шейки матки, хронический лимфоцитарный лейкоз, хронический миелоцитарный лейкоз, рак ободочной и прямой кишки, кожная Т-клеточная лимфома, эндометриальный рак, рак пищевода,желчнопузырная саркома Юинга (Ewing), волосатоклеточный лейкоз, рак головы и шеи, лимфома Ходжкина, саркома Капоши, рак почек, рак печени, рак легкого (мелкоклеточный и/или немелкоклеточный),злокачественный перитонеальный экссудат, злокачественный плевральный выпот, меланома, мезотелиома, множественная миелома, нейробластома, неходжкинская лимфома, остеогенная саркома, рак яичника, рак (половой клетки) яичника, рак предстательной железы, рак поджелудочной железы, рак полового члена, ретинобластома, рак кожи, саркома мягких тканей, плоскоклеточная карцинома, рак желудка, тестикулярный рак, рак щитовидной железы, трофобластическая неоплазма, рак матки, рак влагалища, рак вульвы и опухоль Вильмса. Следовательно, соединения по настоящему изобретению могут быть использованы в качестве "радиосенсибилизатора" и/или "химиосенсибилизатора". Известно, что радиосенсибилизаторы повышают чувствительность раковых клеток к токсическому действию ионизирующего излучения. В литературе обсуждены некоторые механизмы действия радиосенсибилизаторов, включающие следующие: радиосенсибилизаторы гипоксических клеток (например,соединения 2-нитроимидазола и соединения бензотриазиндиоксида) имитируют кислород или, альтернативно, ведут себя как биоредуктивные средства при гипоксии; радиосенсибилизаторы негипоксических клеток (например, галогенированые пиримидины) могут являться аналогами оснований ДНК и избирательно включаются в ДНК раковых клеток и, тем самым, способствуют индуцированному излучением расщеплению молекул ДНК и/или препятствуют нормальным механизмам репарации ДНК; а также были предложены другие различные механизмы действия радиосенсибилизаторов при терапии заболеваний. Многие протоколы лечения раковых заболеваний используют в настоящее время радиосенсибилизаторы в сочетании с рентгеновским облучением. Примеры активирующих рентгеновское излучение радиосенсибилизаторов включают, но не в порядке ограничения, следующие: метронидазол, мизонидазол, дезметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, Е 09, RB 6145,никотинамид, 5-бромдеоксиуридин (BUdR), 5-йоддеоксиуридин (IUdR), бромдеоксицитидин, фтордеоксиуридин (FudR), гидроксимочевина, цисплатин и терапевтически эффективные аналоги и производные указанных препаратов. Фотодинамическая терапия (PDT) раковых опухолей использует видимый свет в качестве радиационного активатора сенсибилизатора. Примеры фотодинамических радиосенсибилизаторов включают, но не в порядке ограничения, следующие: производные гематопорфирина, фотофрин, производные бензопорфирина, этиопорфирин олова, феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины,цинкфталоцианин и терапевтически эффективные аналоги и производные указанных препаратов. Радиосенсибилизаторы могут быть введены совместно с терапевтически эффективным количеством одного или более других соединений, включающих, но не в порядке ограничения, следующие: соединения, способствующие включению радиосенсибилизаторов в мишеневые клетки; соединения, регулирующие приток терапевтических средств, питательных веществ и/или кислорода в мишеневые клетки; химиотерапевтические средства, действующие на опухоль в отсутствие или в присутствии дополнительного излучения или другие терапевтически эффективные соединения для лечения рака и других заболеваний. Примеры вспомогательных терапевтических средств, которые могут быть использованы в сочетании с радиосенсибилизаторами, включают, но не в порядке ограничения, следующие: 5-фторурацил,лейковорин, 5'-амино-5'-деокситимидин, кислород, карбоген, переливания эритроцитов, перфторуглероды (например, Fluosol 10 DA), 2,3-DPG, BW12C, блокаторы кальциевых каналов, пентоксифиллин, соединения, препятствующие ангиогенезу, гидралазин и LBSO. Примеры химиотерапевтических средств,которые могут быть использованы в сочетании с радиосенсибилизаторами, включают, но не в порядке ограничения, следующие: адриамицин, камптотецин, карбоплатин, цисплатин, даунорубицин, доцетаксел, доксорубицин, интерферон (альфа, бета, гамма), интерлейкин 2, иринотекан, паклитаксел, топотекан- 14011211 и терапевтически эффективные аналоги и производные указанных препаратов. Химиосенсибилизаторы могут быть введены совместно с терапевтически эффективным количеством одного или более других соединений, включающих, но не в порядке ограничения, следующие: соединения, способствующие включению химиосенсибилизаторов в мишеневые клетки; соединения, регулирующие приток терапевтических средств, питательных веществ и/или кислорода в мишеневые клетки; химиотерапевтические средства, действующие на опухоль, или другие терапевтически эффективные соединения для лечения рака и других заболеваний. Примеры вспомогательных терапевтических средств,которые могут быть использованы в сочетании с химиосенсибилизаторами, включают, но не в порядке ограничения, следующие: метилирующие агенты, ингибиторы топоизомеразы I и другие химиотерапевтические средства, такие как цисплатин и блеомицин. Соединения формулы (I) могут также быть использованы для обнаружения или идентификацииPARP, и, точнее, рецептора PARP-1. С этой целью в соединения формулы (I) могут быть введены радиоактивные метки. Указанная метка может быть выбрана из группы, включающей такие метки, как радиоизотоп, спиновая метка, антигенная метка, флуоресцентная группа с ферментной меткой или химилюминесцентная группа. Специалист в данной области легко может определить эффективное количество на основе результатов приведенных ниже испытаний. Обычно считается, что эффективное количество должно составлять от 0,001 до 100 мг/кг массы тела, и, в особенности, от 0,005 до 10 мг/кг массы тела. Может быть целесообразно введение требуемой дозы в виде двух, трех, четырех или более подразделенных доз, с соответствующими интервалами, в течение дня. Указанные подразделенные дозы могут быть формулированы в виде стандартных лекарственных форм, например, содержащих от 0,05 до 500 мг, и, предпочтительно, от 0,1 до 200 мг активного ингредиента на стандартную лекарственную форму. Следующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть В описании далее, "BuLi" означает бутиллитий, "МеОН" означает метанол, "DIPE" означает диизопропиловый эфир, "ДМФА" означает N,N-диметилформамид, "DME" означает 1,2-диметоксиэтан,"DCM" означает дихлорметан, "EtOAc" означает этилацетат, "ТГФ" означает тетрагидрофуран, "MEK" означает метилэтилкетон. А. Получение промежуточных соединений Пример А 1. а) Получение промежуточного соединения 1 Азотную кислоту (дымящую) (26,7 мл) добавляют по каплям при комнатной температуре к раствору N-[4-(2-оксо-2-фенилэтил)фенил]ацетамида (0,2128 моль) в ангидриде уксусной кислоты (1100 мл),поддерживая температуру ниже 30 С. Смесь перемешивают в течение 1 ч, выливают в ледяную воду и нейтрализуют концентрированным раствором NH4OH. Осадок отделяют фильтрованием, промывают водой и диэтиловым эфиром и сушат, получая 40 г (63%) промежуточного соединения 1.b) Получение промежуточного соединения 2 Гидроборат натрия (0,1056 моль) добавляют порциями, при 10 С, в токе N2, к раствору промежуточного соединения 1 (0,096 моль) в метаноле (350 мл). Смесь перемешивают при 10 С в течение 30 мин,выливают в ледяную воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, получая 22 г (76%) промежуточного соединения 2. с) Получение промежуточного соединения 3 Метилсульфонилхлорид (0,076 моль) добавляют по каплям при 0 С, в токе N2, к суспензии промежуточного соединения 2 (0,038 моль) и триэтиламина (0,076 моль) в DCM (100 мл). Смесь перемешивают в течение 12 ч. Растворитель выпаривают (без нагревания). Продукт используют без дополнительной очистки, получая (колич.) промежуточное соединение 3.d) Получение промежуточного соединения 4 Смесь промежуточного соединения 3 (0,038 моль), 1 Н-имидазола (0,076 моль) и карбоната калия(0,076 моль) в ацетонитриле (300 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 15 ч, затем охлаждают до комнатной температуры, выливают в ледяную воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSCO4), фильтруют и растворитель выпаривают досуха. Остаток очищают хроматографией на колонке с силикагелем (элюент: смесьDCM/CH3OH/NH4OH 95/5/0,1). Чистые фракции собирают и растворитель выпаривают, получая 4,5 г(34%) промежуточного соединения 4. е) Получение промежуточного соединения 5 Смесь промежуточного соединения 4 (0,0128 моль) в гидроксиде натрия (110 мл) и этаноле (30 мл) перемешивают при комнатной температуре в течение 3 ч, выливают на лед и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха, получая 2,75 гf) Получение промежуточного соединения 6 Смесь промежуточного соединения 5 (0,0089 моль) в метаноле (150 мл) гидрируют при давлении 3 бар в течение 45 мин с никелем Ренея (3 г) в качестве катализатора. После поглощения Н 2 (3 эквив.), катализатор фильтруют через целит, и фильтрат упаривают досуха, получая 2,59 г (100%) промежуточного соединения 6. Пример А 2. а) Получение промежуточного соединения 7 Смесь 3,4-бензофенондиамина (0,1743 моль) и этил-2-оксобутаноата (0,3486 моль) в этаноле (820 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 5 ч и затем охлаждают. Растворитель выпаривают. Остаток поглощают водным насыщенным раствором NaHCO3. Смесь экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Остаток (70,3 г) очищают хроматографией на колонке с силикагелем (элюент: смесь DCM/2-пропанол 98/2; 20-45 5 м). Чистые фракции собирают и растворитель выпаривают, получая 15,5 г промежуточного соединения 7. Часть полученного продукта кристаллизуют из диэтилового эфира и петролейного эфира. Осадок отделяют фильтрованием и сушат, получая 0,85 г промежуточного соединения 7, температура плавления 197 С.b) Получение промежуточного соединения 8 Гидроборат натрия (0,0719 моль) добавляют при 0 С, в токе N2, к суспензии промежуточного соединения 7 0,0719 моль в метаноле (300 мл) и ТГФ (100 мл. Смесь перемешивают в течение 30 мин и выливают в ледяную воду. Осадок отделяют фильтрованием, промывают водой и сушат. Часть (0,7 г) этой фракции (8,33 г) кристаллизуют из смеси метанола и воды. Осадок отделяют фильтрованием и сушат, получая 0,59 г промежуточного соединения 8, температура плавления 202 С. с) Получение промежуточного соединения 9- 16011211 Метансульфонилхлорид (0,009421 моль) добавляют при 0 С, в токе N2, к суспензии промежуточного соединения 8 (0,0043 моль) и триэтиламина (0,0108 моль) в DCM (10 мл) и ТГФ (10 мл). Смесь перемешивают при комнатной температуре в течение 5 ч. Растворитель выпаривают охлажденным. Продукт используют без дополнительной очистки, получая (100%) промежуточное соединение 9.d) Получение промежуточного соединения 10(0,0402 моль) в этаноле (100 мл) гидрируют при 40 С в течение 2 ч и затем при комнатной температуре, при давлении 3 бар, в течение 3 ч с помощью Pd/C 10% (1 г) в качестве катализатора. После поглощения Н 2 (1 эквив.) катализатор фильтруют через целит, промывают этанолом и фильтрат упаривают. Продукт используют без дополнительной очистки, получая 6,5 г (99%) промежуточного соединения 10. Пример A3. а) Получение промежуточного соединения 11 Смесь 6-бром-2-хлор-3-метилхинолина (0,0697 моль) и NaOCH3 30% (0,3483 моль) в метаноле (90 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 15 ч. Смесь охлаждают, выливают в ледяную воду и экстрагируют DCM. Органический слой отделяют, сушат(MgSO4), фильтруют и растворитель выпаривают досуха. Продукт используют без дополнительной очистки, получая 12,2 г (69%) промежуточного соединения 11.b) Получение промежуточного соединения 12H-BuLi (0,0624 моль) добавляют по каплям при -60 С, в токе N2, к раствору промежуточного соединения 11 (0,048 моль) в ТГФ (100 мл), и смесь перемешивают при -60 С в течение 1 ч. Добавляют по каплям раствор 2-бензоилэтилдиметиламина (0,0576 моль) в ТГФ (100 мл). Смеси дают нагреться до -20 С при перемешивании и затем перемешивают в течение 2 ч. Смесь выливают в водный раствор NH4Cl и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают досуха. Продукт используют без дополнительной очистки, получая 17,68 г (колич.) промежуточного соединения 12. с) Получение промежуточного соединения 13 Смесь промежуточного соединения 12 (0,0496 моль) в 3 н. HCl (261 мл) и ТГФ (133 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 8 ч. Смесь охлаждают,выливают на лед, подщелачивают концентрированным раствором NH4OH и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают почти досуха. Остаток очищают хроматографией на колонке с силикагелем (15-40 мкм) (элюент: смесь DCM/CH3OH/NH4OH 95/5/1). Чистые фракции собирают и растворитель выпаривают, получая 6 г (36%) промежуточного соединения 13.d) Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (0,0178 моль) в 3 н. HCl (90 мл) и ТГФ (47 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 2 дней. Смесь охлаждают,выливают на лед, подщелачивают концентрированным раствором NH4OH и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают почти досуха. Остаток кристаллизуют из диэтилового эфира. Осадок отделяют фильтрованием и сушат, получая 1,5 г промежуточного соединения 14.- 17011211 Пример А 4. а) Получение промежуточного соединения 15 Смесь (4-амино-3-нитрофенил)-(4-хлорфенил)метанона (0,0686 моль) в DCM (200 мл) и ацетилхлориде (20 мл) перемешивают в течение 12 ч при комнатной температуре и затем растворитель выпаривают досуха. Остаток поглощают диэтиловым эфиром (50 мл), после чего требуемый продукт отделяют фильтрованием и сушат, получая 21,6 г (99%) промежуточного соединения 15, температура плавления 138 С.b) Получение промежуточного соединения 16 Смесь промежуточного соединения 15 (0,066 моль) в метаноле (200 мл) перемешивают при 0 С и добавляют по каплям раствор натрийгидробората (0,066 моль) в воде, затем реакционную смесь перемешивают в течение 1 ч при комнатной температуре и растворитель выпаривают. Остаток экстрагируют смесью DCM/CH3OH/H2O и экстракт сушат (MgSO4). Наконец, растворитель выпаривают и требуемый продукт собирают, получая 20,4 г (97%) промежуточного соединения 16, температура плавления 198 С. с) Получение промежуточного соединения 17 В 3-горлой реакционной колбе (500 мл), снабженной капельной воронкой и термометром, смесь промежуточного соединения 16 (0,062 моль) и триэтиламина (0,125 моль) в DCM (200 мл) охлаждают до 0 С и добавляют по каплям, поддерживая температуру 0-5 С, метансульфонилхлорид (0,125 моль), затем реакционную смесь перемешивают в течение 4 ч при комнатной температуре и выливают в воду (1000 мл). Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают, получая 18 гd) Получение промежуточного соединения 18 Смесь промежуточного соединения 17 (0,088 моль), пиперидина (0,446 моль) и карбоната калия(0,442 моль) в ацетонитриле (250 мл) с незначительным количеством KI перемешивают при 40 С в течение 12 ч и растворитель выпаривают (вак.). Остаток поглощают водой и смесь экстрагируют DCM. Органический слой сушат (MgSO4) и растворитель выпаривают досуха. Остаток очищают жидкостной хроматографией на силикагеле (элюент: DCM). Содержащие продукт фракции собирают и растворитель выпаривают, получая 16 г (47%, масло) промежуточного соединения 18. е) Получение промежуточного соединения 19 Смесь промежуточного соединения 18 (0,0413 моль) в гидроксиде натрия (1,5 н) (160 мл) и смеси ТГФ/метанол (10 мл) перемешивают в течение 48 ч при комнатной температуре, затем раствор нейтрализуют до рН 7, экстрагируют EtOAc и промывают водой. Органический слой сушат (MgSO4) и растворитель выпаривают досуха. Маслянистый остаток (12,5 г) очищают жидкостной хроматографией высокого разрешения на силикагеле (элюент: смесь DCM/СН 3 ОН 99/1). Содержащие продукт фракции собирают иh) Получение промежуточного соединения 20 Смесь промежуточного соединения 19 (0,0289 моль) в метаноле (200 мл) гидрируют в течение 2 ч в присутствии никеля Ренея (10 г) в качестве катализатора. После поглощения H2 (3 эквив.), раствор фильтруют через слой целита, получая 9,1 г промежуточного соединения 20 (используемое как таковое на следующей реакционной стадии, без дополнительной очистки).B. Получение конечных соединений Пример B1. Получение соединения 1 Смесь промежуточного соединения 6 (0,0089 моль) и этил-2-оксобутаноата (0,0178 моль) в метаноле (50 мл) перемешивают и нагревают до температуры кипения с обратным холодильником в течение 15 ч, затем охлаждают до комнатной температуры, выливают в ледяную воду и экстрагируют DCM. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают почти досуха. Остаток(3,1 г) очищают хроматографией на колонке с силикагелем (15-40 мкм) (элюент: смесь толуол/2 пропанол/NH4OH 85/15/0,8). Требуемую фракцию собирают и растворитель выпаривают. Остаток очищают хроматографией на колонке с силикагелем (15-40 мкм) (элюент: смесь толуол/2-пропанол/NH4OH 85/15/0,8). Очищенные фракции собирают и выпаривают растворитель. Остаток (0,3 г) кристаллизуют из 2-пропанона и диэтилового эфира. Осадок отделяют фильтрованием и сушат, получая 0,3 г (10%) соединения 1, температура плавления 166 С. Пример В 2. Получение соединения 2 Смесь промежуточного соединения 9 (0,0043 моль), промежуточного соединения 10 (0,0052 моль) и карбоната калия (0,0129 моль) в ацетонитриле (15 мл) перемешивают при 80 С в течение 15 ч, затем охлаждают до комнатной температуры, выливают в ледяную воду и экстрагируют EtOAc. Органический слой отделяют, сушат (MgSO4), фильтруют и растворитель выпаривают почти досуха. Остаток (2,2 г) очищают хроматографией на колонке с силикагелем (15-40 мкм) (элюент: смесь DCM/CH3OH/NH4OH 95/5/0,2). Очищенные фракции собирают и выпаривают растворитель. Остаток (0,27 г) растворяют в 2 пропаноне и превращают в соль этандикислоты (2:5). Осадок отделяют фильтрованием и сушат, получая 0,25 г соединения 2, температура плавления 98 С. Пример B3. Получение соединения 3(0,36 г) в качестве катализатора в течение 16 ч при давлении 3 бар. После поглощения H2 (1 экв.), катализатор фильтруют через целит и фильтрат выпаривают почти досуха. Остаток (3,58 г) очищают хроматографией на колонке с силикагелем (15-40 мкм) (элюент: смесь DCM/CH3OH/NH4OH 93/7/0,5). Чистые фракции собирают и растворитель выпаривают. Остаток (1,45 г) кристаллизуют из метилэтилкетона. Осадок отделяют фильтрованием, промывают диэтиловым эфиром и сушат, получая 0,82 г (30%) соединения 3. Натрийгидроборат (0,0719 моль) добавляют при 0 С в токе N2 к суспензии промежуточного соединения 7 (0,0719 моль) в метаноле (300 мл) и ТГФ (100 мл). Смесь перемешивают в течение 30 мин и выливают в ледяную воду. Осадок отделяют фильтрованием, промывают водой и сушат. Часть (0,7 г) этой фракции (8,33 г) кристаллизуют из метанола и воды. Осадок отделяют фильтрованием и сушат, получая 0,59 г соединения 4, температура плавления 202 С. Пример В 5. Получение соединения 5 Раствор 2-оксобутановой кислоты (0,0294 моль) в уксусной кислоте (30 мл) добавляют к раствору промежуточного соединения 20 (0,0288 моль) в воде (70 мл) при 0 С и реакционную смесь перемешивают в течение 2 ч при 0 С. Полученный раствор выливают в смесь соль-вода, нейтрализуют гидроксидом натрия (3 н) и экстрагируют DCM. Органический слой сушат (MgSO4), и растворитель выпаривают досуха. Остаток очищают жидкостной хроматографией на силикагеле (элюент: смесь толуол/2 пропанол/NH4OH 90/10/0,1). Две содержащие продукт фракции собирают и растворитель выпаривают. Вышеуказанные фракции после очистки кристаллизуют смесью простой диэтиловый эфир/DCM/MEK и полученный продукт собирают, получая 1,15 г соединения 5. В табл. F-1 перечислены соединения, полученные по одному из приведенных выше примеров. В таблице использованы следующие обозначения: Co.No. означает соединение номер, Ex. [Bn] означает тот же способ, что описан в Вn примерах. Фармакологический пример Испытание на PARP-1-ингибирующую активность методом сцинтилляционного эффекта близости(SPA) in vitro Соединения по настоящему изобретению испытывают in vitro на основе SPA-технологии (запатентовано Amersham Pharmacia Biotech). Принцип испытания, испытание основано на общепринятой SPA-технологии обнаружения поли(АДФ-рибозил)ирования мишеневых белков, т.е. гистонов. Такое рибозилирование индуцируют, используя фермент PARP-1, активированный ДНК с одноцепочечным разрывом, и [3 Н]никотинамидадениндинуклеотид ([3H]-NAD+) в качестве АДФ-рибозил-донора. В качестве индуктора активности фермента PARP-1 получают ДНК с одноцепочечным разрывом. Для этой цели 25 мг ДНК (поставщик: Sigma) растворяют в 25 мл ДНКаза-буфере (10 мМ Tris-HCl, pH 7,4; 0,5 мг/мл альбумина телячьей сыворотки (BSA); 5 мМ MgCl2.6 Н 2 О и 1 мМ KCl), к которому добавляют 50 мкл ДНКаза-раствора (1 мг/мл в 0,15 М NaCl). После инкубации в течение 90 мин при 37 С реакцию обрывают добавлением 1,45 г NaCl с последующей дополнительной инкубацией при 58 С в течение 15 мин. Реакционную смесь охлаждают на льду и осуществляют диализ при 4 С в течение, соответственно, 1,5 и 2 ч против 1,5 л 0,2 M раствора KCl и дважды против 1,5 л 0,01 М раствора KCl в течение 1,5 и 2 ч, соответственно. Смесь делят на аликвоты и хранят при -20 С. Гистоны (1 мг/мл, тип II-A, поставщик: Sigma) биотинилируют, используя набор для биотинилирования от Amersham, и хранят в виде аликвотных проб при -20 С. Исходный раствор 100 мг/мл SPA-поли(винилтолуол)(PVT)-гранулы (поставщик: Amersham) получают в PBS. Основной раствор [3 Н]-NAD+ получают добавлением 120 мкл [3H]NAD+ (0,1 мКю/мл, поставщик: NEN) к 6 мл инкубационного буфера (50 мМ Tris/HCl, pH 8; 0,2 мМ DTT; 4 мМ MgCl2). Раствор 4 мМ NAD+ (поставщик: Roche) получают в инкубационном буфере (из 100 мМ основного раствора в воде, хранящегося при -20 С). Фермент PARP-1 получают по известным технологиям, т.е. клонированием и экспрессией белка, исходя из кДНК печени человека. Информация, касающаяся применения протеиновой последовательности фермента PARP-1, включая литературные ссылки,может быть найдена в базе данных Swiss-Prot под первичным входящим номером Р 09874. Биотинилированные гистоны и PVT-SPA-гранулы смешивают и предварительно инкубируют в течение 30 мин при комнатной температуре. PARP-1-фермент (концентрация зависит от партии) смешивают с ДНК с одноцепочечным разрывом и смесь предварительно инкубируют в течение 30 мин при 4 С. Равные порции этого раствора гистоны/PVT-SPA-гранулы и раствора PARP-1-фермент/ДНК смешивают и добавляют на ячейку 96-луночного микротитрационного планшета 75 мкл полученной смеси вместе с 1 мкл соединения в ДМСО и 25 мкл [3H]-NAD+. Конечные концентрации в инкубационной смеси составляют 2 мкг/мл для биотинилированных гистонов, 2 мг/мл для PVT-SPA-гранул, 2 мкг/мл для ДНК с одноцепочечным разрывом и в пределах 5-10 мкт/мл для PARP-1-фермента. После инкубации смеси в течение 15 мин при комнатной температуре реакцию обрывают добавлением 100 мкл 4 мМ NAD+ в инкубационном буфере- 22011211 Гранулам дают осадиться по меньшей мере в течение 15 мин, и планшеты переносят в TopCountNXT (Packard) для счета сцинтилляций, и значения выражают через число импульсов в минуту(имп/мин). Для каждого эксперимента параллельно выполняют контроли (содержащие фермент PARP-1 и ДМСО без соединения), слепой инкубационный опыт (содержащий ДМСО, но без фермента PARP-1 или соединения) и пробы (содержащие фермент PARP-1 и соединение, растворенное в ДМСО). Все испытуемые соединения растворяют и окончательно в дальнейшем разбавляют ДМСО. Сначала соединения испытывают при концентрации 10-6 М. Если соединения обнаруживают активность при 10-6 М, строят кривую зависимости доза-отклик, где соединения исследуют при концентрациях в пределах от 10-5 М до 10-8 М. В каждом испытании нулевое значение вычитают как из значений для контроля, так и значений для пробы. Контрольная проба соответствует максимальной активности фермента PARP-1. Для каждой пробы количество имп/мин выражают в процентах от средней величины имп/мин для контролей. Когда это целесообразно, IC50-значения (концентрация лекарственного средства, необходимая для снижения активности фермента PARP-1 до 50% от контроля) рассчитывают, используя линейную интерполяцию между экспериментальными точками, несколько выше и ниже 50% уровня. Здесь действия испытуемых соединений выражены через pIC50 (отрицательное значение log от значения IC50). В качестве стандартного соединения вводят 4-амино-1,8-нафталимид для подтверждения правильности SPAиспытания. Испытуемые соединения, проявившие ингибирующую активность при начальной экспериментальной концентрации 10-6 М (см. табл. 2). Фильтрационный анализ на PARP-1-ингибирующую активность in vitro Соединения по настоящему изобретению испытывают на основе фильтрационного анализа in vitro,оценивая PARP-1-активность (инициируемую в присутствии ДНК с одноцепочечным разрывом) через активность в поли(АДФ-рибозил)ировании гистонов с применением [32P]-NAD в качестве АДФ-рибозилдонора. Радиоактивные рибозилированные гистоны осаждают с помощью трихлоруксусной кислоты (ТСА) в 96-луночных планшетах для фильтрования, и включенный [32 Р] измеряют, используя счет сцинтилляций. Получают смесь гистонов (исходный раствор: 5 мг/мл в Н 2 О), NAD+ (исходный раствор: 100 мМ в Н 2 О) и [32 Р]-NAD+ в инкубационном буфере (50 мМ Tris/HCl, pH 8; 0,2 мМ DTT; 4 мМ MgCl2). Получают также смесь фермента PARP-1 (5-10 мкг/мл) и ДНК с одноцепочечным разрывом. ДНК с одноцепочечным разрывом получают, как описано в SPA in vitro для PARP-1-ингибирующей активности. 75 мкл смеси фермент PARP-1/ДНК вместе с 1 мкл соединения в ДМСО и 25 мкл смеси гистоны-NAD+/[32 Р]-NAD+ добавляют на лунку 96-луночного планшета для фильтрования (0,45 мкм, поставщик Millipore). Конечные концентрации в инкубационной смеси составляют 2 мкг/мл для гистонов, 0,1 мМ для NAD+, 200 мкМ (0,5 мкКю) для [32 Р]-NAD+ и 2 мкг/мл для ДНК с одноцепочечным разрывом. Планшеты инкубируют в течение 15 мин при комнатной температуре и реакцию обрывают добавлением 10 мкл охлажденной льдом 100% ТСА с последующим добавлением 10 мкл охлажденного льдом раствора BSA (1% в H2O). Белковой фракции дают осадиться в течение 10 мин при 4 С и планшеты подвергают вакуумному фильтрованию. Планшеты последовательно промывают, на каждую лунку, 1 мл 10% охлажденной льдом ТСА, 1 мл 5% охлажденной льдом ТСА и 1 мл 5% ТСА при комнатной температуре. Наконец, к каждой лунке добавляют по 100 мкл сцинтилляционного раствора (Microscint 40, Packard), и планшеты переносят в TopCountNXT (поставщик: Packard) для счета сцинтилляций, и значения выражают через число импульсов в минуту (имп/мин). Для каждого эксперимента параллельно выполняют контроли (содержащие фермент PARP-1 и ДМСО без соединения), слепой инкубационный опыт (содержащий ДМСО, но без фермента PARP-1 или соединения) и пробы (содержащие фермент PARP-1 и соединение, растворенное в ДМСО). Все испытуемые соединения растворяют и окончательно в дальнейшем разбавляют ДМСО. Сначала соединения испытывают при концентрации 10-5 М. Если соединения обнаруживают активность при 10-5 М, строят кривую зависимости доза-отклик, где соединения исследуют при концентрациях в пределах от 10-5 М до 10-8 М. В каждом испытании нулевое значение вычитают как из значений для контроля, так и значений для пробы. Контрольная проба соответствует максимальной активности фермента PARP-1. Для каждой пробы количество имп/мин выражают в процентах от средней величины имп/мин для контролей. Когда это целесообразно, IC50-значения (концентрация лекарственного средства,необходимая для снижения активности фермента PARP-1 до 50% от контроля) рассчитывают, используя линейную интерполяцию между экспериментальными точками, несколько выше и ниже 50% уровня. Здесь действия испытуемых соединений выражены через pIC50 (отрицательное значение log от значенияIC50). В качестве стандартного соединения вводят 4-амино-1,8-нафталимид для подтверждения правильности фильтрационного анализа. Испытуемые соединения, проявившие ингибирующую активность при начальной экспериментальной концентрации 10-5 М (см. табл. 2). Соединения могут быть дополнительно оценены методами испытания на химио- и/или радиосенсибилизацию, испытания, оценивающего ингибирование эндогенной активности PARP-1 в линиях раковых клеток и, наконец, испытанием на радиосенсибилизацию in vivo. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)R9 означает водород или С 1-6-алкил; либо R3 означает группу формулы -(CH2)t-Z- (b-1),где t равно 0;Z означает гетероциклическую кольцевую систему, выбираемую из группы, включающей где R12 означает водород или С 1-6-алкилоксиС 1-6-алкиламино; иn равно 0 или 1; X означает N или CR7, где R7 означает водород; R1 означает C1-6-алкил; R2 означает водород; R3 означает радикал, выбираемый из (а-1) или (а-2), или означает группу формулы (b-1); s равно 0 или 2; R8 означает C1-6-алкил или арилС 1-6-алкил(C1-6-алкил)аминоС 1-6-алкил; t равно 0; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1), (с-3), (с-4), (с-5) или (с-11); каждый R12 независимо означает водород или С 1-6-алкилоксиС 1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород, галоген или C1-6-алкил. 3. Соединение по пп.1 и 2, гдеn равно 0 или 1; X означает N; R1 означает C1-6-алкил; R2 означает водород; R3 означает радикал формулы (а-1) или группу формулы (b-1) ; s равно 0; R8 означает арилС 1-6-алкил(C1-6-алкил)аминоС 1-6 алкил; t равно 0; Z означает гетероциклическую кольцевую систему, выбираемую из (с-1); каждый R12 независимо означает водород или С 1-6-алкилоксиС 1-6-алкиламино; каждый R13 независимо означает водород и каждый из R4, R5 и R6 независимо выбирают из группы, включающей водород или галоген. 4. Соединение по пп.1, 2 и 3, выбираемое из соединения 5, соединения 9 и соединения 2. 5. Применение соединения по одному из пп.1-4 в качестве лекарственного средства для леченияPARP-опосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак, рак груди, рак яичника, рак (половой клетки) яичника, рак предстательной железы, тестикулярный рак, рак шейки матки, рак влагалища и рак вульвы. 6. Фармацевтическая композиция, включающая фармацевтически приемлемые носители и, в качестве активного ингредиента, терапевтически эффективное количество соединения по пп.1-4. 7. Способ получения фармацевтической композиции по п.6, включающий однородное смешение фармацевтически приемлемых носителей и соединения по пп.1-4. 8. Применение соединения по пп.1-4 для получения лекарственного средства для лечения PARPопосредованного нарушения, такого как лейкемия, лимфома, меланома, рак кожи, эндометриальный рак,рак груди, рак яичника, рак (половой клетки) яичника, рак предстательной железы, тестикулярный рак,рак шейки матки, рак влагалища и рак вульвы. 9. Способ получения соединения по п.1, отличающийся тем, что он включает конденсацию соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII), где Rh означает С 1-6 алкил до соединений формулы (I), где X означает N, обозначенных как соединения формулы (I-i), в присутствии карбоновой кислоты, например уксусной кислоты и тому подобного, минеральной кислоты,такой как, например, хлористо-водородная кислота, серная кислота, или сульфокислоты, такой как, например, метансульфокислота, бензолсульфокислота, 4-метилбензолсульфокислота и тому подобное.
МПК / Метки
МПК: C07D 401/06, C07D 241/44, C07D 403/06, A61K 31/498, A61P 43/00
Метки: ингибиторов, 2-хиноксалиноны, 2-хинолиноны, качестве, поли(адф-рибоза)полимеразы, 7-фенилалкилзамещённые
Код ссылки
<a href="https://eas.patents.su/26-11211-7-fenilalkilzameshhyonnye-2-hinolinony-i-2-hinoksalinony-v-kachestve-ingibitorov-poliadf-ribozapolimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">7-фенилалкилзамещённые 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(адф-рибоза)полимеразы</a>
Предыдущий патент: Ручное упаковочное устройство
Следующий патент: Новые соединения бензотиадиазина, способ их получения и фармацевтические композиции, которые их содержат
Случайный патент: Штифт для прикрепления вкладыша












