6-алкенил и 6-фенилалкил замещённые 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(адф-рибоза) полимеразы
Номер патента: 9875
Опубликовано: 28.04.2008
Авторы: Гийемон Жером Эмиль Жорж, Мабир Доминик Жан-Пьер, Ваутерс Вальтер Баудевейн Леопольд, Сомерс Мария Викторина Франциска, Ван Дюн Якобус Альфонсус Йозефус
Формула / Реферат
1. Соединение формулы (I)
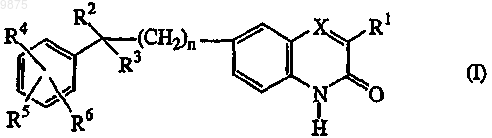
его N-оксидные формы, соли присоединения и стереохимически изомерные формы,
где n равно 0, 1 или 2;
X является N или CR7, где R7 является водородом или взятый вместе с R1 может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;
R1 является C1-6алкилом или тиофенилом;
R2 является водородом, гидрокси, C1-6алкилом, С3-6алкинилом или взятый вместе с R3 может образовывать =O;
R3 является радикалом, выбранным из
-(CH2)S-NR8R9 (а-1),
-O-Н (а-2),
-O-R10 (а-3),
-S-R11 (а-4) или
-CуN (а-5),
где s равно 0, 1, 2 или 3;
R8, R10 и R11, каждый независимо, выбирают из -СНО, C1-6алкила, гидроксиС1-6алкила, C1-6алкил-карбонила, амино, C1-6алкиламино, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилоксикарбонила, С1-6алкилкарбониламиноС1-6алкила, пиперидинилС1-6алкиламинокарбонила, пиперидинила, пиперидинилС1-6алкила, C1-6алкилокси, тиофенилС1-6алкила, пирролилС1-6алкила, арилС1-6алкилпиперидинила, арилкарбонилС1-6алкила, арилкарбонилпиперидинилС1-6алкила, галогениндазолилпиперидинилС1-6алкила, арилС1-6 алкил(C1-6алкил)аминоС1-6алкила, и
R9 является водородом или C1-6алкилом; или
R3 является группой формулы -(CH2)t-Z (b-1),
где t равно 0, 1, 2 или 3;
-Z является гетероциклической кольцевой системой, выбранной из
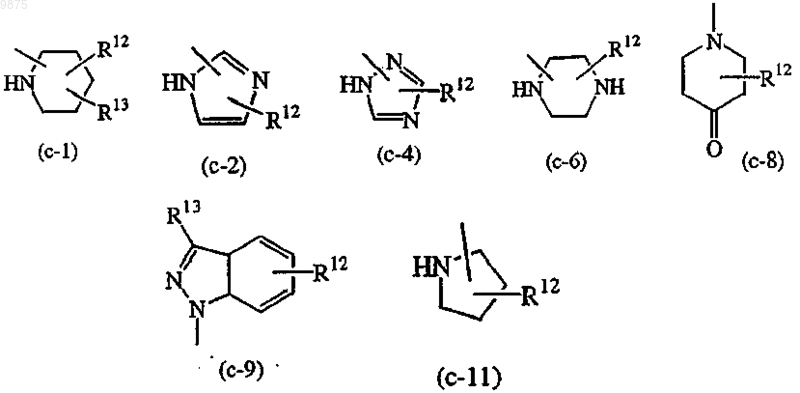
где R12 является водородом, галогеном, C1-6алкилом, аминокарбонилом, амино, гидрокси, арилом,
С1-6алкиламиноС1-6алкилокси, С1-6алкилоксиС1-6алкилом, С1-6алкилоксиС1-6алкиламино, арилС1-6алкилом, ди(фенилС2-6алкенилом), пиперидинилом, пиперидинилС1-6алкилом, С3-10циклоалкилом, С3-10циклоалкилС1-6алкилом, арилокси(гидрокси)C1-6алкилом, галогениндазолилом, арилС1-6алкилом, арилС1-6алкенилом, арилС1-6алкиламино, морфолино, C1-6алкилимидазолилом, пиридинилС1-6алкиламино; и
R13 является водородом, пиперидинилом или арилом;
R4, R5 и R6, каждый независимо, выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, C1-6алкила, C1-6алкилокси, амино, аминоС1-6алкила, ди(С1-6алкил)амино, ди(С1-6алкил)аминоС1-6 алкилокси или С1-6алкилоксикарбонила или С1-6алкила, замещенного 1, 2 или 3 заместителями, независимо выбранными из гидрокси, C1-6алкилокси или аминоС1-6алкилокси; или
когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы
-О-СН2-О (d-1),
-O-(CH2)2-O- (d-2),
-CH=CH-CH=CH- (d-3) или
-NH-C(O)-NR14=CH- (d-4),
где R14 является C1-6алкилом;
арил является фенилом, фенилом, замещенным галогеном, C1-6алкилом или С1-6алкилокси;
при условии, что когда n равно О, X является N, R1 является C1-6алкилом, R2 является водородом, R3 является группой формулы (b-1), t равно 0, -Z является гетероциклической кольцевой системой (с-2), где указанная гетероциклическая кольцевая система присоединена к остатку молекулы атомом азота, и
R12 является водородом или C1-6алкилом; тогда
по меньшей мере один из заместителей R4, R5 или R6 не является водородом, галогеном, C1-6алкилокси, тригалогенметилом, метилом или изопропилом.
2. Соединение по п.1,
где R1 является C1-6алкилом;
R3 является радикалом, выбранным из (а-1), (а-2), (а-3) или (а-5) или является группой формулы (b-1);
s равно 0, 1 или 2;
R8 и R10, каждый независимо, выбирают из -СНО, C1-6алкила, гидроксиС1-6алкила, ди(C1-6алкил) аминоС1-6алкила, С1-6алкилкарбониламиноС1-6алкила, пиперидинилС1-6алкила, пиперидинилС1-6алкиламинокарбонила, C1-6алкилокси, тиофенилС1-6алкила, пирролилС1-6алкила, арилС1-6алкилпиперидинила, арилкарбонилС1-6алкила, арилкарбонилпиперидинилС1-6алкила, галогениндазолилпиперидинилС1-6алкила или арилС1-6алкил (C1-6алкил) аминоС1-6алкила;
t равно 0 или 2;
Z является гетероциклической кольцевой системой, выбранной из (с-1), (с-4), (с-6), (с-8), (с-9) или (с-11);
R12 является водородом, С1-6алкилом, аминокарбонилом,

С1-6алкилоксиС1-6алкиламино, ди(фенилС2-6алкенилом), пиперидинилС1-6алкилом, С3-10циклоалкилом, С3-10циклоалкилС1-6алкилом, галогениндазолилом или арилС2-6алкенилом;
R4, R5 и R6, каждый независимо, выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, C1-6алкила, C1-6алкилокси, ди(C1-6алкил)амино, ди(C1-6алкил)аминоС1-6алкилокси или C1-6алкилоксикарбонила; и когда R5 и R6 находятся в смежных положениях и взятые вместе образуют двухвалентный радикал формулы (d-1) или (d-2).
3. Соединение по пп.1 и 2, где n равно 0; X является СН; R1 является C1-6алкилом; R2 является водородом; R3 является группой формулы (b-1); t равно 2; -Z является гетероциклической кольцевой системой, выбранной из (с-1); R12 является водородом; R13 является водородом и R5 и R6 находятся в смежных положениях и взятые вместе могут образовывать двухвалентный радикал формулы (d-2).
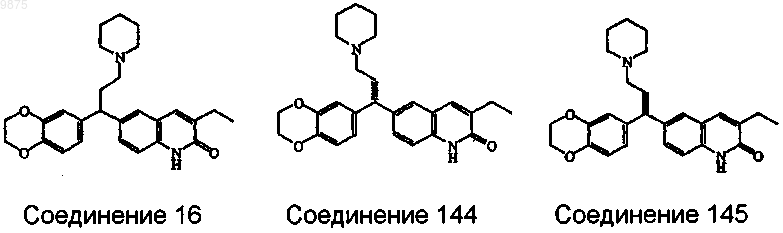
4. Соединение по пп.1, 2 и 3, где соединением является соединение ь 16, соединение ь 144, и соединение ь 145
5. Соединение формулы (VII-а)
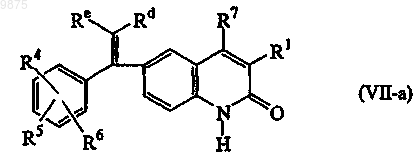
его N-оксидные формы, соли присоединения и стереохимически изомерные формы,
где R1, R4, R5, R6, R7 и арил являются такими, как определено в п.1;
Re является водородом или, взятый вместе с Rd, может образовывать двухвалентный радикал формулы -(CH2)2-NR15-(CH2)2- (е-1) или -CH2-NR16-(CH2)3- (е-2), где R15 и R16, каждый независимо, выбирают из водорода, С1-6алкила,
С1-6алкилоксиС1-6алкила, пиперидинилС1-6алкила, С3-10циклоалкилС1-6алкила, арилокси (гидрокси)С1-6алкила, арилС1-6алкила или арилС2-6алкенила; или
Rd является ди (C1-6алкил) аминоС1-6алкилом шыш пиперидинилС1-6алкилом.
6. Применение соединения по любому из пп.1-5 в качестве лекарственного препарата.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемые носители и терапевтически эффективное количество соединения по пп.1-5 в качестве активного ингредиента.
8. Способ получения фармацевтической композиции по п.7, где фармацевтически приемлемые носители и соединение по пп.1-5 тщательно смешивают.
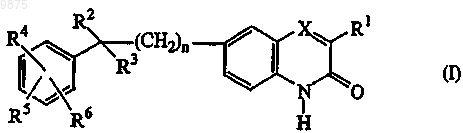
9. Применение соединения для производства лекарственного средства для лечения PARP опосредованного заболевания, где указанным соединением является соединение формулы (I)
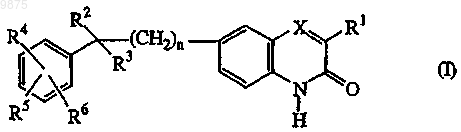
его N-оксидные формы, соли присоединения и стереохимически изомерные формы,
где n равно 0, 1 или 2;
X является N или CR7, где R7 является водородом или взятый вместе с R1 может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;
R1 является C1-6алкилом или тиофенилом;
R2 является водородом, гидрокси, C1-6алкилом, С3-6алкинилом или, взятый вместе с R3, может образовывать =O;
R3 является радикалом, выбранным из
-(CH2)s-NR8R9 (а-1),
-O-Н (a-2),
-O-R10 (a-3),
-S-R11 (а-4) или
-CуN (а-5),
где s равно 0, 1, 2 или 3;
R8, R10 и R11, каждый независимо, выбирают из -СНО, C1-6алкила, гидроксиС1-6алкила, C1-6алкилкарбонила, амино, C1-6алкиламино, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилоксикарбонила, С1-6алкилкарбониламиноС1-6алкила, пиперидинилС1-6алкиламинокарбонила, пиперидинила, пиперидинилС1-6алкила, C1-6алкилокси, тиофенилС1-6алкила, пирролилС1-6алкила, арилС1-6алкилпиперидинила, арилкарбонилС1-6 алкила, арилкарбонилпиперидинилС1-6алкила, галогениндазолилпиперидинилС1-6алкила, арилС1-6алкил (C1-6алкил)аминоС1-6алкила и
R9 является водородом или C1-6алкилом или
R3 является группой формулы -(CH2)t-Z (b-1),
где t равно 0, 1, 2 или 3;
-Z является гетероциклической кольцевой системой, выбранной из
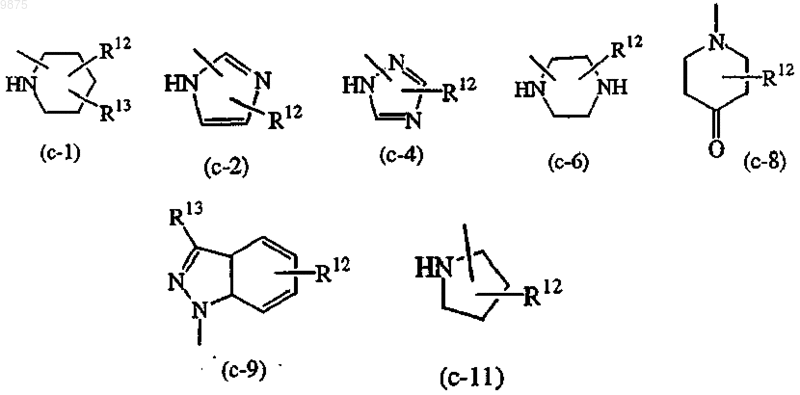
где R12 является водородом, галогеном, C1-6алкилом, аминокарбонилом, амино, гидрокси, арилом,
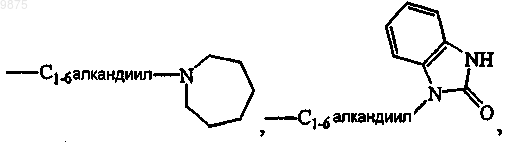
С1-6алкиламиноС1-6алкилокси, С1-6алкилоксиС1-6алкилом, C1-6алкилоксиС1-6алкиламино, арилС1-6ал-килом, ди(фенилС2-6алкенилом), пиперидинилом, пиперидинилС1-6алкилом, С3-10циклоалкилом, С3-10циклоалкилС1-6алкилом, арилокси(гидрокси)С1-6алкилом, галогениндазолилом, арилС1-6алкилом, арилС2-6алкенилом, арилС1-6алкиламино, морфолино, C1-6алкилимидазолилом, пиридинилС1-6алкиламино; и
R13 является водородом, пиперидинилом или арилом;
R4, R5 и R6, каждый независимо, выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, C1-6алкила, C1-6алкилокси, амино, аминоС1-6алкила, ди(C1-6алкил)амино, ди(C1-6алкил)аминоС1-6алкилокси или C1-6алкилоксикарбонила или C1-6алкила, замещенного 1, 2 или 3 заместителями, независимо выбранными из гидрокси, C1-6алкилокси или аминоС1-6алкилокси; или
когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы
-O-СН2-O (d-1),
-О-(СН2)2-О- (d-2),
-СН=СН-СН=СН- (d-3) или
-NH-C(O)-NR14=CH- (d-4),
где R14 является С1-6алкилом;
арил является фенилом, фенилом, замещенным галогеном, С1-6алкилом или С1-6алкилокси.
10. Применение соединения по п.5 для производства лекарственного средства для лечения PARP опосредованного заболевания.
11. Применение по пп.9-10, где лечение включает химиосенсибилизацию.
12. Применение по пп.9-10, где лечение включает радиосенсибилизацию.
13. Комбинация соединения с химиотерапевтическим средством, в которой указанным соединением является соединение формулы (I)
его N-оксидные формы, соли присоединения и стереохимически изомерные формы,
где n равно 0, 1 или 2;
X является N или CR7, где R7 является водородом или взятый вместе с R1 может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;
R1 является C1-6алкилом или тиофенилом;
R2 является водородом, гидрокси, С1-6алкилом, С3-6алкинилом или, взятый вместе с R3, может образовывать =O;
R3 является радикалом, выбранным из
-(CH2)S-NR8R9 (а-1),
-O-Н (а-2),
-O-R10 (а-3),
-S-R11 (а-4) или
-CуN (а-5),
где s равно 0, 1, 2 или 3;
R8, R10 и R11, каждый независимо, выбирают из -СНО, С1-6алкила, гидроксиС1-6алкила, C1-6алкилкарбонила, амино, C1-6алкиламино, ди(C1-6алкил)аминоС1-6алкила, C1-6алкилоксикарбонила, С1-6алкилкар-бониламиноС1-6алкила, пиперидинилС1-6алкиламинокарбонила, пиперидинила, пиперидинилС1-6алкила, С1-6алкилокси, тиофенилС1-6алкила, пирролилС1-6алкила, арилС1-6алкилпиперидинила, арилкарбонилС1-6 алкила, арилкарбонилпиперидинилС1-6алкила, галогениндазолилпиперидинилС1-6алкила, арилС1-6алкил(С1-6алкил)аминоС1-6алкила и
R9 является водородом или С1-6алкилом;
или R3 является группой формулы -(CH2)t-Z (b-1), где t равно 0, 1, 2 или 3;
-Z является гетероциклической кольцевой системой, выбранной из
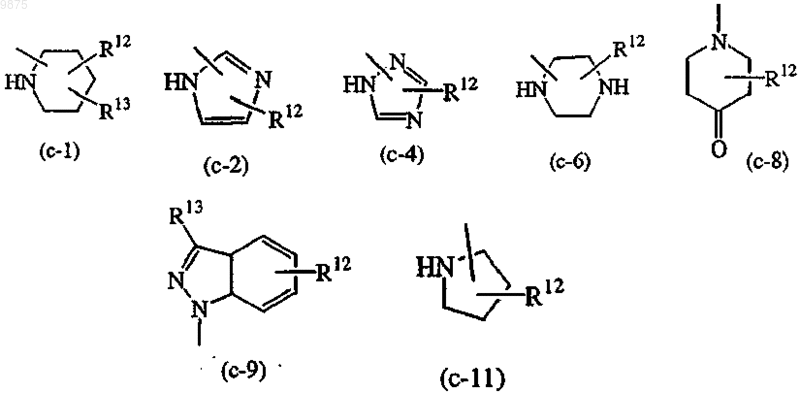
где R12 является водородом, галогеном, C1-6алкилом, аминокарбонилом, амино, гидрокси, арилом,
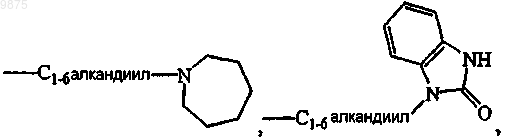
С1-6алкиламиноС1-6алкилокси, C1-6алкилоксиС1-6алкилом, С1-6алкилоксиС1-6алкиламино, арилС1-6алкилом, ди(фенилС2-6алкенилом), пиперидинилом, пиперидинилС1-6алкилом, С3-10циклоалкилом, С3-10циклоалкилС1-6алкилом, арилокси(гидрокси)C1-6алкилом, галогениндазолилом, арилС1-6алкилом, арилС2-6 алкенилом, арилС1-6алкиламино, морфолино, C1-6алкилимидазолилом, пиридинилС1-6алкиламино; и
R13 является водородом, пиперидинилом или арилом;
R4, R5 и R6, каждый независимо, выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, C1-6алкила, C1-6алкилокси, амино, аминоС1-6алкила, ди (C1-6алкил)амино, ди(C1-6алкил)аминоС1-6алкилокси или C1-6алкилоксикарбонила или C1-6алкила, замещенного 1, 2 или 3 заместителями, независимо выбранными шч гидрокси, C1-6алкилокси или аминоС1-6алкилокси; или
когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы
-O-CH2-O (d-1),
-О-(СН2)2-О- (d-2),
-СН=СН-СН=СН- (d-3) или
-NH-C(О)-NR14=CH- (d-4),
где R14 является C1-6алкилом;
арил является фенилом, фенилом, замещенным галогеном, C1-6алкилом или C1-6алкилокси.
14. Комбинация соединения по п.5 с химиотерапевтическим средством.
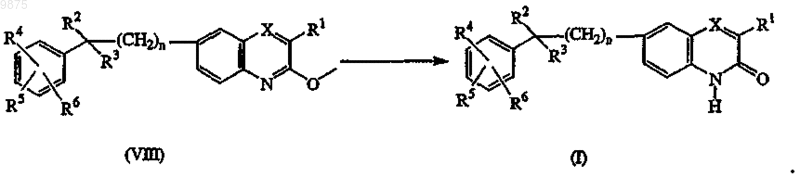
15. Способ получения соединения по п.1 или 5, характеризующийся гидролизом промежуточных соединений формулы (VIII) известными в данной области методами, путем взаимодействия промежуточного соединения формулы (VIII) с соответствующими реагентами, такими как хлорид олова, уксусная кислота и хлористо-водородная кислота, в присутствии реакционно-инертного растворителя, например тетрагидрофурана
16. Способ получения соединения по п.1 или 5, характеризующийся циклизацией промежуточного соединения формулы (X) известными в данной области методами циклизации в соединения формулы (I), где X является СН, называемые соединениями формулы (I-j), предпочтительно в присутствии соответствующей кислоты Льюиса, например хлорида алюминия, или в чистом виде, или в соответствующем растворителе, таком как, например, ароматический углеводород, например бензол, хлорбензол, метилбензол и подобные; галогенированные углеводороды, например трихлорметан, тетрахлорметан и подобные; простой эфир, например тетрагидрофуран, 1,4-диоксан и подобные; или в смеси таких растворителей
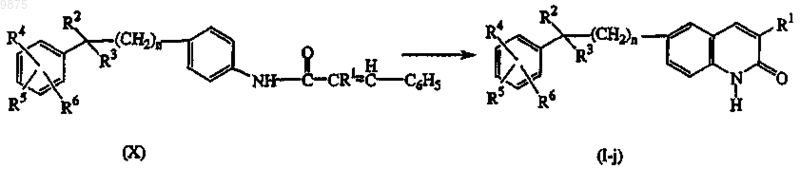
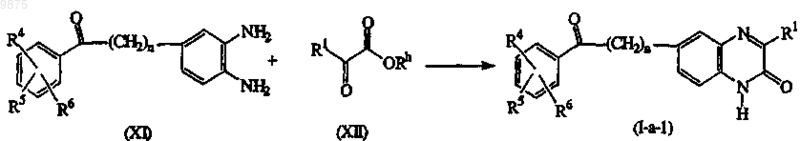
17. Способ получения соединения по п.1 или 5, характеризующийся конденсацией соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII) в соединения формулы (I), где X является N и R2, взятый вместе с R3, образует =O, называемые соединениями формулы (I-а-1), в присутствии карбоновой кислоты, например уксусной и подобными, минеральной кислоты, такой как, например, хлористо-водородная кислота, серная кислота, или сульфоновая кислота, такая как, например, метансульфоновая кислота, бензолсульфоновая кислота, 4-метилбензолсульфоновая кислота и подобные
18. Способ получения соединения по п.1 или 5, характеризующийся гидролизом промежуточных соединений формулы (VI), где R3 является группой формулы (b-1) или радикалом формулы (а-1), где s не равен 0, называемый как Rg, известными в данной области способами, такими как перемешивание промежуточного соединения (VI) в водном растворе кислоты в присутствии реакционно-инертного растворителя с образованием промежуточных соединений и соединений формулы (VII), где Rd и Re являются соответствующими радикалами или, взятые вместе с углеродом, к которому они присоединены, образуют соответствующую гетероциклическую кольцевую систему, как определено в -Z
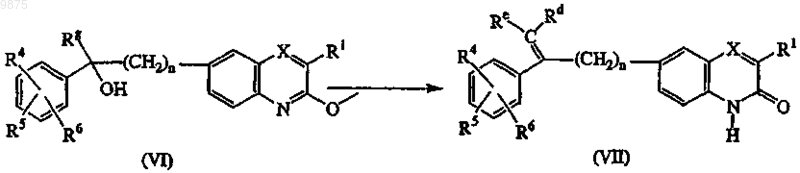
и преобразованием промежуточных соединений формулы (VII) селективным гидрированием указанного промежуточного соединения соответствующим восстанавливающим агентом и соответствующим восстановителем в соответствующем растворителе с образованием соединений формулы (I), где R2 является водородом и Rg определен выше, называемые соединениями формулы (I-i)

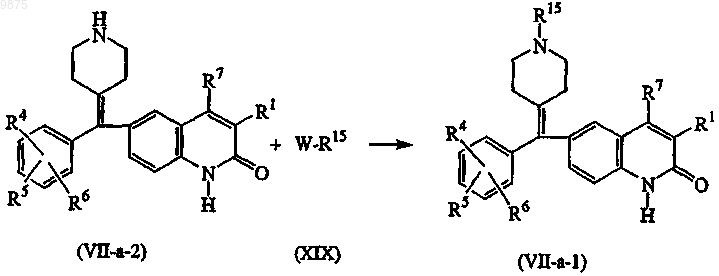
19. Способ получения соединения по п.5, характеризующийся взаимодействием соединения формулы (VII-а), где Re, взятый вместе с Rd, образует двухвалентный радикал формулы (е-1) или (е-2) (например, двухвалентный радикал формулы (е-1)) и R15 или R16 (например, R15) являются водородом, называемые соединениями формулы (VII-a-2), с промежуточным соединением формулы (XIX), где W является соответствующей уходящей группой, такой как, например, хлор, бром, метансульфонилокси или бензолсульфонилокси, и R15 или R16 (например, R15) не являются водородом, с образованием соединений формулы (VII-a-1), определяемые как соединения формулы (VII-а), где Re, взятый вместе с Rd, образует двухвалентный радикал формулы (е-1) или (е-2) (например, двухвалентный радикал формулы (е-1)) и R15 или R16 (например, R15) не являются водородом, в реакционно-инертном растворителе
20. Способ получения соединения по п.5, характеризующийся взаимодействием соединения формулы (VII-a-2) с промежуточным соединением формулы (XX), где R является соответствующим заместителем, с образованием соединений формулы (VII-а), где R15 или R16 (например, R15) являются арилокси(гидрокси) C1-6алкилом, называемые соединениями формулы (VII-a-3), в присутствии 2-пропанола

Текст
009875 Область техники, к которой относится изобретение Настоящее изобретение относится к ингибиторам поли(АДФ-рибоза)полимеразы (PARP) и предлагает соединения и композиции, содержащие раскрываемые соединения. Кроме того, настоящее изобретение предлагает способы применения раскрываемых ингибиторов PARP, например, в качестве лекарственного средства. Предпосылки изобретения Ядерный фермент поли(АДФ-рибоза)полимераза-1 (PARP-1) является представителем семействаPARP ферментов, состоящего из PARP-1 и нескольких недавно идентифицированных новых поли(АДФрибозилирующих) ферментов. PARP так же называется, как поли(аденозин-5'-дифосфорибоза)полимераза или PARS (поли(АДФ-рибоза)синтетаза).PARP-1 является главным ядерным белком с молекулярной массой 116 кДа, состоящим из трех доменов: N-концевого ДНК связывающего домена, содержащего два "цинковых пальца", аутомодифицирующего домена и С-концевого каталитического домена. Он присутствует почти во всех эукариотах. Фермент синтезирует поли(АДФ-рибозу), разветвленный полимер, который может состоять из более чем 200 единиц АДФ-рибозы. Акцепторы поли(АДФ-рибозы) белка непосредственно или косвенно участвуют в поддержании целостности ДНК. Они включают гистоны, топоизомеразы, ДНК и РНК полимеразы,ДНК лигазы и Са 2+- и Mg2+-зависимые эндонуклеазы.PARP белок экспрессируется на высоком уровне во многих тканях, наиболее заметно в иммунной системе, сердце, мозге и зародышевых клетках. В нормальных физиологических условиях активностьPARP минимальна. Однако повреждение ДНК вызывает немедленное повышение активности PARP до 500 раз. Среди многих функций, приписываемых PARP и особенно PARP-1, главной является его роль в облегчении репарации ДНК путем АДФ-рибозилирования и поэтому координации ряда белков репарируемой ДНК. В результате активации PARP значительно снижаются уровни NAD+ (никотинамид адениндинуклеотид, окисленная форма). Экстенсивная активация PARP ведет к резкому снижению NAD+ в клетках, страдающих от массового повреждения ДНК. Короткий период полужизни поли(АДФ-рибозы) приводит к высокой интенсивности цикла. Как только образуется поли(АДФ-рибоза), она быстро деградирует под действием постоянно активной поли(АДФ-рибоза)глюкогидролазы (PARG), вместе с фосфодиэстеразой и (АДФ-рибоза) белка лиазы. PARP и PARG формируют цикл, который превращает большое количество NAD+ в АДФ-рибозу. Менее чем через 1 ч чрезмерное стимулирование PARP может вызвать падение NAD+ и АТФ до значения ниже 20% от нормального уровня. Такой сценарий особенно опасен при ишемии, когда потеря кислорода уже резко нарушила энергообразование в клетках. Предполагают,что последующее образование свободного радикала при реперфузии является главной причиной повреждения ткани. Частично падение АТФ, которое является типичным во многих органах при ишемии и реперфузии, могло бы быть связано с падением содержания NAD+ из-за цикла поли(АДФ-рибозы). Таким образом, ожидается, что ингибирование PARP или PARG будет сохранять энергетический уровень клеток, тем самым, потенцируя выживание ишемических тканей после повреждения. Синтез поли(АДФ-рибозы) также вовлечен в индуцированную экспрессию ряда генов, важных для воспалительной реакции. Ингибиторы PARP подавляют продукцию синтазы индуцибельного оксида азота (iNOS) в макрофагах, Р-селектина и молекул межклеточной адгезии-1 (ICAM-1) в эндотелиальных клетках. Такая активность подчеркивает сильное противовоспалительное действие, проявляемое ингибиторами PARP. Ингибирование PARP способно снизить некроз в результате предотвращения перемещения и инфильтрации нейтрофилов в пораженные ткани.PARP активируется поврежденными фрагментами ДНК и, однажды активировавшись, катализирует присоединение до 100 единиц АДФ-рибозы к множеству ядерных белков, включая гистоны и сам PARP. При значительных клеточных стрессах экстенсивная активация PARP может быстро привести к повреждению или гибели клеток из-за истощения запасов энергии. Так как на каждую молекулу регенерированной NAD+ расходуются четыре молекулы АТФ, NAD+ истощается в результате массивной активацииPARP, при попытках ресинтезировать NAD+, АТФ также может истощиться. Было сообщено, что активация PARP играет ключевую роль как в NMDA-, так и в NOиндуцированной нейротоксичности. Это было продемонстрировано на кортикальных культурах и гиппокампальных срезах, в которых предотвращение токсичности прямо коррелирует с эффективностью ингибирования PARP. Таким образом, признана потенциальная роль ингибиторов PARP при лечении нейродегенеративных заболеваний и травмы головы, хотя точный механизм их действия еще не выяснен. Аналогично было показано, что однократные инъекции ингибиторов PARP уменьшали размер инфаркта, вызванного ишемией и реперфузией сердечной или скелетной мышцы у кроликов. В этих исследованиях однократная инъекция 3-аминобензамида (10 мг/кг) или за одну минуту до закупорки, или за одну минуту до реперфузии вызывала аналогичные уменьшения размера инфаркта в сердце (32-42%), в то время как 1,5-дигидроксиизохинолин (1 мг/кг), другой ингибитор PARP, уменьшал размер инфаркта в сопоставимой степени (38-48%). Эти результаты позволяют предположить, что ингибиторы PARP могли бы улучшить заранее состояние ишемического сердца или реперфузионную травму ткани скелетной мышцы. Активация PARP может также быть использована в качестве меры, оценивающей повреждения-1 009875 вследствие нейротоксических повреждений, полученных от воздействия любого из следующих индукторов, таких как глутамат (через стимуляцию NMDA рецептора), промежуточные продукты реактивного кислорода, амилоидный -белок, N-метил-4-фенил-1,2,3,6-тетрагидропиридин (МРТР) или его активный метаболит N-метил-4-фенилпиридин (МФП+), которые участвуют в патологических состояниях, таких как удар, болезнь Альцгеймера и болезнь Паркинсона. Другие исследования продолжили изучение роли активации PARP в нервных клетках мозжечка in vitro и в нейротоксичности МРТР. Избыточная нейральная экспозиция для глутамата, который служит в качестве доминирующего нейротрансмиттера центральной нервной системы, и действует на N-метил-D-аспартат (NMDA) рецепторы и другие подвиды рецепторов, чаще всего происходит в результате удара или других нейродегенеративных процессов. Лишенные кислорода нейроны выделяют в больших количествах глутамат при ишемическом поражении мозга, таком как удар, или при сердечном приступе. Это избыточное выделение глутамата, в свою очередь, вызывает чрезмерную стимуляцию (токсическое возбуждение) рецепторов N-метил-D-аспартата(NMDA), АМРА (-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота), Kainate и MGR, которые открывают ионные каналы и дают неконтролируемый поток ионов (например, Са 2+ и Na+ в клетки иK+ из клеток), приводящего к чрезмерной стимуляции нейронов. Чрезмерно стимулированные нейроны выделяют больше глутамата, создавая петлю обратной связи или эффект домино, который в конечном счете приводит к повреждению или гибели клеток в силу продуцирования протеаз, липаз и свободных радикалов. Избыточная активация рецепторов глутамата влечет за собой различные неврологические заболевания и состояния, включающие эпилепсию, удар, болезнь Альцгеймера, болезнь Паркинсона,боковой амиотрофический склероз (ALS), болезнь Хантингтона, шизофрению, хроническую боль, ишемию и гибель нейронов вследствие гипоксии, гипогликемии, ишемии, травмы, и нервного повреждения. Экспозиция и стимуляция глутамата также приводит к компульсивным нарушениям, особенно к лекарственной зависимости. Доказательство включает полученные данные на многих видах животных, так же как и на церебральных кортикальных культурах, обработанных глутаматом или NMDA, что антагонисты рецептора глутамата (например, соединения, которые блокируют глутамат от связывания или активации его рецептора) блокируют неврологическое повреждение в связи с сосудистым ударом. Попытки предотвратить токсическое возбуждение путем блокирования NMDA, AMPA, Kainate и MGR рецепторов оказались сложным делом, так как каждый рецептор имеет множество мест, к которым глутамат может присоединиться и, следовательно, нахождение эффективной смеси антагонистов или универсального антагониста для предотвращения связывания глутамата ко всему рецептору и возможность проверки этой теории вызывала большие сложности. Кроме того, многие из композиций, которые являются эффективными для блокирования рецепторов, являются также токсичными для животных. По существу, в настоящее время нет известного эффективного лечения отклонений от нормы глутамата. Стимуляция NMDA рецепторов глутаматом, например, активирует фермент нейронной синтазы оксида азота (nNOS), ведя к образованию оксида азота (NO), который также медиирует нейротоксичность. NMDA нейротоксичность может быть предотвращена в результате лечения ингибиторами синтазы оксида азота (NOS) или через направленный генетический разрыв nNOS in vitro. Другим применением ингибиторов PARP является лечение повреждений периферических нервов, в результате которого развивается синдром патологической боли, известный как невропатическая боль,такая как вызванная хроническим сжимающим повреждением (ХСП) общего седалищного нерва, и в котором происходит транссиноптическая альтерация серого вещества спинного мозга, характеризуемая гиперхроматозом цитоплазмы и нуклеоплазмы (так называемые "черные" нейроны). Существует также доказательство, что ингибиторы PARP могут применяться для лечения воспалительных заболеваний кишечника, таких как колит. Например, колит вызывали у крыс путем внутрипросветного введения гаптентринитробензолсульфоновой кислоты в 50% этаноле. Подвергаемые лечению крысы получали 3-аминобензамид, специфический ингибитор PARP активности. Ингибирование PARP активности уменьшало воспалительную реакцию и восстанавливало морфологию и энергетический статус дистальной ободочной кишки. Дополнительное доказательство наводит на мысль, что ингибиторы PARP могут применяться для лечения артритов. Кроме того, очевидно, что ингибиторы PARP подходят для лечения диабета. Было показано, что ингибиторы PARP могут применяться для лечения эндотоксического шока или септического шока. Ингибиторы PARP могут также применяться для расширения ресурса и пролиферативной способности клеток, включая лечение таких заболеваний как старение кожи, болезнь Альцгеймера, атеросклероз, остеоартрит, остеопороз, мышечная дистрофия, дегенеративные болезни скелетных мышц, включающие реплекативное старение, возрастную дегенерацию мышц, старение иммунной системы, ВИЧ и другие иммунные заболевания, связанные со старением; и для изменения экспрессии гена стареющих клеток. Также известно, что ингибиторы PARP, такие как 3-аминобензамид, воздействуют на полную репарацию ДНК в ответ, например, на действие перекиси водорода или ионизирующей радиации. Четко установлена основная роль PARP в репарации разрывов цепей ДНК, особенно когда они вы-2 009875 званы непосредственно ионизирующим излучением или, косвенно после ферментативной репарации повреждений ДНК, вызванных метилирующими агентами, ингибиторами топоизомераз I и другими химиотерапевтическими средствами, такими как циспластин и блеомицин. Многочисленные исследования с использованием "нокаутированных" мышей, моделей транс-доминантного ингибирования (чрезмерной экспрессии ДНК-связывающего домена), антисмысловых ингибиторов и ингибиторов с малой молекулярной массы, продемонстрировали роль PARP в репарации и выживании клеток после индуцирования повреждения ДНК. Ингибирование ферментативной активности PARP должно привести к повышенной чувствительности опухолевых клеток к лечению повреждений ДНК. Было сообщено, что ингибиторы PARP являются эффективными для радиосенсибилизации (гипоксической) опухолевых клеток и эффективными для предотвращения опухолевых клеток от восстановления потенциально летального и сублетального повреждения ДНК после лучевой терапии, вероятно за счет их способности предотвращать соединение разрыва цепи ДНК и за счет воздействия на несколько сигнальных путей повреждения ДНК. Ингибиторы PARP применяли для лечения рака. Кроме того, в патенте США 5177075 обсуждаются некоторые изохинолины для усиления летальных действий ионизирующего излучения или химиотерапевтических средств на опухолевые клетки. Weltin et al., в "Effect of 6 (5-Phenanthridinone, an Inhibitor ofPoly (ADP-ribose) Polymerase, on Cultured Tumor Cells", Oncol. Res., 6: 9, 399-403 (1994), обсуждаются ингибирование активности PARP, пониженная пролиферация опухолевых клеток и явный синергетический эффект при одновременной обработке опухолевых клеток алкилирующими лекарственными препаратами. Недавний исчерпывающий обзор достижений в этой области был опубликован Li и Zhang в журнале IDrugs 2001, 4 (7): 804-812. Существует постоянная необходимость в эффективных и сильнодействующих ингибиторах PARP,и, более конкретно, ингибиторов PARP-1, которые обладают минимальными побочными эффектами. Настоящее изобретение предлагает соединения, композиции и способы ингибирования активности PARP для лечения рака и/или для предотвращения клеточных повреждений, повреждений тканей и/или органов, возникающих в результате повреждения или гибели клеток, например, из-за некроза или апоптоза. Соединения и композиции настоящего изобретения особенно подходят для повышения эффективности химиотерапии и лучевой терапии, в случае когда первичный эффект лечения вызывает повреждение ДНК в целевых клетках. Уровень техники В Европейском патенте 371564, опубликованном 6 июня 1990 г., раскрываются (1 Н-азол-1 илметил)замещенный хинолин, хиназолин или производные хиноксалина. Описанные соединения подавляют элиминацию из плазмы ретиноевых кислот. Более конкретно раскрыты соединения 6-[(1 Нимидазол-1-ил)(4-метоксифенил)метил]-3-метил-2(1 Н)-хиноксалинон (соединение 128 настоящей заявки), 3-этил-6-(1 Н-имидазол-1-илфенилметил)-2(1 Н)-хиноксалинон (соединение 127 настоящей заявки) и 6-[(4-хлорфенил)-1 Н-имидазол-1-илметил]-3-метил-2(1 Н)-хиноксалинон (соединение 146 настоящей заявки). Описание изобретения Это изобретение относится к соединениям формулы (I)-3 009875 двухвалентный радикал формулы -СН=СН-СН=СН-;R2 является водородом, гидроксилом, С 1-6 алкилом,С 3-6 алкенилом или взятый вместе с R3 может образовывать =O;R8, R1 и R11, каждый независимо, выбирают из -СНО, C1-6 алкила, гидроксиС 1-6 алкила, C1-6 алкилкарбонила, амино, С 1-6 алкиламино, ди(C1-6 алкил) аминоС 1-6 алкила, С 1-6 алкилоксикарбонила, C1-6 алкилкарбониламиноС 1-6 алкила, пиперидинилС 1-6 алкиламинокарбонила, пиперидинила, пиперидинилС 1-6 алкила, С 1-6 алкилокси, тиофенилС 1-6 алкила, пирролилС 1-6 алкила, арилС 1-6 алкилпиперидинила, арилкарбонилС 1-6 алкила, арилкарбонилпиперидинилС 1-6 алкила, галогениндазолилпиперидинилС 1-6 алкила или арилС 1-6 алкил (C1-6 алкил) аминоС 1-6 алкила; иR9 является водородом или C1-6 алкилом; или R3 является группой формулы-Z является гетероциклической кольцевой системой, выбранной из где R12 является водородом, галогеном, C1-6 алкилом, аминокарбонилом, амино, гидрокси, арилом, С 1-6 алкиламиноС 1-6 алкилокси, С 1-6 алкилоксиС 1-6 алкилом, С 1-6 алкилоксиС 1-6 алкиламино, арилС 1-6 алкилом, ди(фенилС 2-6 алкенилом), пиперидинилом, пиперидинилС 1-6 алкилом, С 3-10 циклоалкилом, С 3-10 циклоалкилС 1-6 алкилом, арилокси (гидрокси) C1-6 алкилом, галогениндазолилом, арилС 1-6 алкилом, арилС 2-6 алкенилом, арилС 1-6 алкиламино, морфолино, C1-6 алкилимидазолилом или пиридинилС 1-6 алкиламино;R4, R5 и R6 каждый независимо выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, С 1-6 алкила, C1-6 алкилокси, амино, аминоС 1-6 алкила, ди(C1-6 алкил)амино, ди(C1-6 алкил)аминоС 1-6 алкилокси или C1-6 алкилоксикарбонила, или C1-6 алкила, замещенного 1, 2 или 3 заместителями, независимо выбранными из гидрокси, С 1-6 алкилокси или аминоС 1-6 алкилокси; или когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы(d-4),-NH-C(O)-NR14=CHгде R14 является C1-6 алкилом; арил является фенилом, фенилом, замещенными галогеном, C1-6 алкилом или C1-6 алкилокси; при условии, что когда n равно О, X является N, R1 является С 1-6 алкилом, R2 является водородом, R3 является группой формулы (b-1), t равен О, Z является гетероциклической кольцевой системой (с-2), где указанная гетероциклическая кольцевая система Z присоединена к остатку молекулы атомом азота, и R12 является водородом или C1-6 алкилом; тогда по меньшей мере один из заместителей R4, R5 или R6 не является водородом, галогеном, С 1-6 алкилокси и тригалогенметилом. Когда же гетероциклическая кольцевая система Z содержит -СН 2-, -СН=, или -NH- фрагмент, заместители R12 и R13 или остаток молекулы могут быть присоединены к атому углерода или азота, в этом случае один или оба водородных атома заменен. Соединения формулы (I) могут существовать в таутомерных формах. Хотя такие формы специально не указываются в вышеприведенной формуле, предполагается, что они входят в объем настоящего изобретения. Ряд терминов, используемых в выше и нижеприведенных определениях, объясняются ниже по тексту. Эти термины используются иногда или сами по себе, или в комбинированных терминах. При использовании в предшествующих определениях и в дальнейшем галоген является общим термином для фтора, хлора, брома и иода; C1-6 алкил означает линейные или разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 6 углеродных атомов, такие как, например, метил, этил,пропил, бутил, пентил, гексил, 1-метилэтил, 2-метилпропил, 2-метилбутил, 2-метилпентил и подобные;C1-6 алкандиил означает двухвалентные линейные и разветвленные насыщенные углеводородные радикалы, содержащие от 1 до 6 углеродных атомов, такие как, например, метилен, 1,2-этандиил, 1,3 пропандиил, 1,4-бутандиил, 1,5-пентандиил, 1,6-гександиил и их разветвленные изомеры, такие как, 2 метилпентандиил, 3-метилпентандиил, 2,2-диметилбутандиил, 2,3-диметилбутандиил и подобные; тригалогенметил означает метил, содержащий три одинаковых или различных галогеновых заместителей,например трифторметил; С 2-6 алкенил означает линейные или разветвленные углеводородные радикалы,содержащие одну двойную связь и от 2 до 6 углеродных атомов, такие как, например, этинил, 2 пропенил, 3-бутенил, 2-пентинил, 3-пентинил, 3-метил-2-бутенил и подобные; С 3-6 алкинил означает линейные и разветвленные углеводородные радикалы, содержащие одну тройную связь и от 3 до 6 углеродных атомов, такие как, например, 2-пропинил, 3-бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3 гексинил и подобные; С 3-10 циклоалкил включает циклические углеводородные группы, имеющие от 3 до 10 углеродных атомов, такие как циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил,циклогексенил, циклогептил, циклооктил и подобные. Термин "соль присоединения" относится к солям, которые соединения формулы (I) могут образовывать с органическими или неорганическими основаниями, такими как амины, основания щелочных металлов и основания щелочно-земельных металлов, или четвертичные аммониевые основания или с органическими, или неорганическими кислотами, такими как минеральные кислоты, сульфокислоты,карбоновые кислоты или фосфорсодержащие кислоты. Термин "соль присоединения", кроме того, относится к фармацевтически приемлемым солям, комплексам металлов и сольватам и их солям, которые могут образовывать соединения формулы (I). Термин "фармацевтически приемлемые соли" означает фармацевтически приемлемые соли присоединения кислот или оснований. Это означает, что фармацевтически приемлемые соли присоединения кислот или оснований, указанные выше, включают терапевтически активные нетоксичные формы соли присоединения кислоты и основания, которые соединения формулы (I) могут образовывать. Соединения формулы (I), которые обладают основными свойствами, могут быть преобразованы в их фармацевтически приемлемые соли присоединения кислоты путем обработки названной основной формы соответствующей кислотой. К соответствующим кислотам относятся, например, неорганические кислоты, такие как галоидоводородные кислоты, например хлористо-водородная или бромисто-водородная кислота; серная; азотная; фосфорная и другие подобные кислоты; или органические кислоты, такие как, например,уксусная, пропионовая, гликолевая, молочная, пировиноградная, щавелевая, малоновая, янтарная (то есть бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая,этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламиновая, салициловая, п-аминосалициловая, памовая и подобные кислоты. Соединения формулы (I), которые обладают кислотными свойствами, могут быть преобразованы в их фармацевтически приемлемые соли присоединения основания путем обработки названной кислотной формы соответствующим органическим или неорганическим основанием. К соответствующим формам основной соли относятся, например, соли аммония, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и подобные, соли с органическими основаниями, например соли бензатина, N-метил-O-глюкамина, гидрабамина, и соли с аминокислотами, такими как, например, аргинин, лизин и подобные. Термины соль присоединения кислоты или основания также относится к гидратным и сольватным формам присоединения, которые соединения формулы (I) могут образовывать. Примерами таких форм-5 009875 являются, например, гидраты, алкоголяты и подобные. Термин "комплексы металлов" означает комплекс, образованный соединением формулы (I) с одной или более органической или неорганической солью или солями металла. Примеры указанных органических или неорганических солей включают галогениды, нитраты, сульфаты, фосфаты, ацетаты, трифторацетаты, трихлорацетаты, пропионаты, тартраты, сульфонаты, например метилсульфонаты, 4 метилфенилсульфонаты, салицилаты, бензоаты и подобные, соли металлов второй главной группы периодической системы, например соли магния и кальция, третьей и четвертой главной группы, например алюминия, олова, свинца, а также от первой до восьмой переходных групп периодической системы, таких как, например, хрома, марганца, железа, кобальта, никеля, меди, цинка и подобных. Термин стереохимически изомерные формы соединений формулы (I), используемый выше, означает все возможные соединения, составлены из одних и тех же атомов, соединенных одной и той же последовательностью связей, но имеющие различные трехмерные структуры, которые не являются взаимозаменяемыми, которыми соединения формулы (I) могут обладать. Если не приведено или указано иначе,химическое обозначение соединения охватывает смесь всех возможных стереохимически изомерных форм, которыми указанное соединение обладает. Указанная смесь может содержать все диастереоизомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Предполагается, что все стереохимически изомерные формы соединений формулы (I), как в чистой форме, так и в смеси друг с другом, входят в объем настоящего изобретения.N-оксидные формы соединений формулы (I) означают такие соединения формулы (I), в которых один или несколько атомов азота окислены в так называемый N-оксид, особенно такие N-оксиды, в которых один или более азотов пиперидина, пиперазина или пиридазинила являются N-окисленными. Как использовано в данном описании, термин "соединения формулы (I)" означает, что он включает также N-оксидные формы, фармацевтически приемлемые соли присоединения кислоты или основания и все стериоизомерные формы. Соединения, описанные в ЕР 371564, подавляют элиминирование из плазмы ретиноевых кислот. В ЕР 371564 были раскрыты 6-[(1 Н-имидазол-1-ил)(4-метоксифенил)метил]-3-метил-2(1 Н)-хиноксалинон(соединение 127 настоящей заявки) и 6-[(4-хлорфенил)-1 Н-имидазол-1-илметил]-3-метил-2(1 Н)хиноксалинон (соединение 146 настоящей заявки). Неожиданно было обнаружено, что соединения настоящего изобретения проявляют ингибирующую активность по отношению к PARP. Первая группа представляющих интерес соединений состоит из тех соединений формулы (I), на которые накладываются одно или более из следующих ограничений:b) R3 является радикалом, выбранным из (а-1), (а-2), (а-3) или (а-5), или является группой формулыd) R8 и R10, каждый независимо, выбирают из -СНО, С 1-6 алкила, гидроксиС 1-6 алкила, ди(С 1-6 алкил) аминоС 1-6 алкила, С 1-6 алкилкарбониламиноС 1-6 алкила, пиперидинилС 1-6 алкила, пиперидинилС 1-6 алкиламинокарбонила, C1-6 алкилокси, тиофенилС 1-6 алкила, пирролилС 1-6 алкила, арилС 1-6 алкилпиперидинила,арилкарбонилС 1-6 алкила, арилкарбонилпиперидинилС 1-6 алкила, галогениндазолилпиперидинилС 1-6 алкила или арилС 1-6 алкил (C1-6 алкил) аминоС 1-6 алкила;f) Z является гетероциклической кольцевой системой, выбранной из (с-1), (с-2), (с-4), (с-6), (с-8), (с 9) или (с-11);g) R12 является водородом, С 1-6 алкилом, аминокарбонилом, С 1-6 алкилоксиС 1-6 алкиламино, ди(фенилС 2-6 алкенилом), пиперидинилС 1-6 алкилом, С 3-10 циклоалкилом, С 3-10 циклоалкилС 1-6 алкилом, галогениндазолилом или арилС 2-6 алкенилом;h) R4, R5 и R6 каждый независимо выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, С 1-6 алкила, C1-6 алкилокси, ди(C1-6 алкил)амино, ди(C1-6 алкил) аминоС 1-6 алкилокси или C1-6 алкилоксикарбонила; иi) когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (d-1) или (d-2). Вторая группа представляющих интерес соединение состоит из таких соединений формулы (I), на которые накладываются одно или более из следующих ограничений:b) X является CR7, где R7 является водородом или, взятый вместе с R1, может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;e) R3 является радикалом, выбранным из (а-1), (а-2) или (а-3) или является группой формулы(b-1);g) R8 и R10, каждый независимо, выбирают из -СНО, C1-6 алкила, ди(C1-6 алкил)аминоС 1-6 алкила, пиперидинилС 1-6 алкила, арилкарбонилпиперидинилС 1-6 алкила, галогениндазолилпиперидинилС 1-6 алкила или арилС 1-6 алкил(C1-6 алкил)аминоС 1-6 алкила;i) Z является гетероциклической кольцевой системой, выбранной из (с-1) , (с-2) или (с-6) ;j) R12 является водородом, С 1-6 алкилоксиС 1-6 алкиламино или пиперидинилС 1-6 алкилом;k) R13 является водородом или арилом;l) R4, R5 и R6, каждый независимо, выбирают из водорода или тригалогенметила; иm) когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (d-1) или (d-2). Третья группа представляющих интерес соединений состоит из таких соединений формулы (I), первой группы представляющих интерес соединений или второй группы представляющих интерес соединений, где Z является гетероциклической кольцевой системой, отличной от гетероциклической кольцевой системы формулы (с-2) или (с-4). Группа предпочтительных соединений состоит из соединений формулы (I), где R1 является C1-6 алкилом; R3 является радикалом, выбранном из (а-1), (а-2), (а-3) или (а-5), или является группой формулы(b-1); s равно 0, 1 или 2; R8 и R10 каждый независимо выбирают из -СНО, C1-6 алкила, гидроксиС 1-6 алкила,ди(C1-6 алкил)аминоС 1-6 алкила, С 1-6 алкилкарбониламиноС 1-6 алкила, пиперидинилС 1-6 алкила, пиперидинилС 1-6 алкиламинокарбонила, С 1-6 алкилокси, тиофенилС 1-6 алкила, пирролилС 1-6 алкила, арилС 1-6 алкилпиперидинила, арилкарбонилС 1-6 алкила, арилкарбонилпиперидинилС 1-6 алкила, галогениндазолилпиперидинилС 1-6 алкила или арилС 1-6 алкил (С 1-6 алкил)аминоС 1-6 алкила; t равно 0 или 2; Z является гетероциклической кольцевой системой, выбранной из (с-1), (с-2),(с-4), (с-6), (с-8), (с-9) или (с-11); R12 является водородом, С 1-6 алкилом, аминокарбонилом, С 1-6 алкилоксиС 1-6 алкиламино, ди(фенилС 2-6 алкенилом), пиперидинилС 1-6 алкилалкилом, С 3-10 циклоалкилом, С 3-10 оциклоалкилС 1-6 алкилом, галогениндазолилом или арилС 2-6 алкенилом; R4, R5 и R6, каждый независимо, выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, С 1-6 алкила, С 1-6 алкилокси, ди(С 1-6 алкил)амино, ди(C1-6 алкил)аминоС 1-6 алкилокси или С 1-6 алкилоксикарбонила; и когда R5 иR6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (b-1) или (d-2). Дополнительная группа предпочтительных соединений состоит из таких соединений формулы (I),где n равно 0; X является CR7, где R7 является водородом, или взятый вместе с R1 может образовывать двухвалентный радикал формулы -CH=CH-CH=CH-; R1 является C1-6 алкилом; R2 является водородом; R3 является радикалом, выбранным из (а-1), (а-2) или (а-3) или является группой формулы (b-1); s равно 0 или 2; R8 и R10, каждый независимо, выбирают из -СНО, C1-6 алкила, ди(C1-6 алкил)аминоС 1-6 алкила, пиперидинилС 1-6 алкила, арилкарбонилпиперидинилС 1-6 алкила, галогениндазолилпиперидинилС 1-6 алкила или арилС 1-6 алкил(C1-6 алкил)аминоС 1-6 алкила; t равно 0 или 2; Z является гетероциклической кольцевой системой, выбранной из (с-1), (с-2) или (с-6); R12 является водородом, С 1-6 алкилоксиС 1-6 алкиламино или пиперидинилС 1-6 алкилом; R13 является водородом или арилом;R , R и R6, каждый независимо, выбирают из водорода или тригалогенметила; и когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (d-1) или(d-2). Другая дополнительная группа предпочтительных соединений состоит из таких соединений формулы (I), группы предпочтительных соединений или дополнительной группы предпочтительных соединений, в которых Z является гетероциклической кольцевой системой, отличной от системы формулы (с-2) или (с-4). Группа более предпочтительных соединений состоит из тех соединений формулы (I), где n равно 0;X является CH; R1 является C1-6 алкилом; R2 является водородом; R3 является группой формулы (b-1); t равно 2; Z является гетероциклической кольцевой системой, выбранной из (с-1); R12 является водородом; 4R13 является водородом; и R5 и R6 находятся в смежных положениях и взятые вместе образуют двухвалентный радикал формулы (d-2). Наиболее предпочтительными соединениями являются соединение 16, соединение 144 и соединение 145 Соединения формулы (I) могут быть получены общими способами, описанными в ЕР 371564. Ряд таких способов получения будут описаны ниже более подробно. Другие способы получения целевых соединений формулы (I) описаны в примерах. Соединения формулы (I), где R2 является водородом и R3 является -NR9-CHO, где R9 является водородом или метилом, называемые соединениями формулы (I-b), могут быть получены, исходя из соединений формулы (I), где R2, взятый вместе с R3, образует =O, называемые соединениями формулы (I-а), в присутствии формамида или метилформамида, называемые промежуточными соединениями формулы(II), и муравьиной кислоты. Соединения формулы (I), где R3 является гидрокси, называемые соединениями формулы (I-c), могут быть получены преобразованием кетонового фрагмента соединений формулы (I-а) в гидроксильную группу, с соответствующим восстановителем, например боргидридом натрия, в подходящем растворителе, например метаноле и тетрагидрофуране. Соединения формулы (I-а) могут быть получены преобразованием соединений формулы (I-c), гдеR2 является водородом, называемые соединениями формулы (I-с-1), в присутствии соответствующего окислителя, такого как триоксид хрома, и кислоты, такой как серная кислота, в подходящем растворителе, таком как 2-пропанон. Соединения формулы (I), где R2 является водородом и R3 является радикалом формулы (с-1), называемые соединениями формулы (1-f), могут быть получены взаимодействием соединений формулы (I),где R2 является водородом и R3 является радикалом формулы (с-8), называемые соединениями формулы(I-d), с амином формулы (III), где Ra является соответствующим радикалом, в присутствии подходящего растворителя, такого как метанол, и подходящего реагента, такого как цианборгидрид натрия. Промежуточные соединения формулы (IV), где W является соответствующей уходящей группой,такой как, например, хлор, бром, метансульфонилокси или бензолсульфонилокси, могут быть получены из соединений формулы (I-c-1) путем обработки указанных соединений соответствующим реагентом,например метансульфонилоксихлоридом или бензолсульфонилоксихлоридом, или галогенирующим агентом, таким как, например, POCl3 или SOCl2. Соединения формулы (I), определенные как соединения формулы (I), где Rb является таким, как определено в R8, и Rc является таким, как определено в R9, или Rb и Rc, взятые вместе с азотом, к которому они присоединены, образуют соответствующую гетероциклическую кольцевую систему, как определено в Z, называемые соединениями формулы (I-h), могут быть получены реакцией промежуточного соединения формулы (IV) с промежуточным соединение формулы (V). Реакция может быть осуществлена в реакционноинертном растворителе, таком как диметилформамид или ацетонитрил, и необязательно в присутствии соответствующего основания, такого как, например, карбонат натрия, карбонат калия или триэтиламин. Соединения формулы (I) могут быть также преобразованы друг в друга путем известных в данной области реакций или трансформаций функциональных групп. Ряд таких трансформаций уже описаны выше. Другими примерами являются гидролиз сложных эфиров карбоновых кислот в соответствующие карбоновые кислоты или спирты; гидролиз амидов в соответствующие карбоновые кислоты или амины; гидролиз нитрилов в соответствующие амиды; аминогруппы на имидазоле или фениле могут быть заменены водородом путем известных в данной области реакций диазотирования и последующей замены диазогруппы водородом; спирты могут быть преобразованы в сложные и простые эфиры; первичные амины могут быть преобразованы во вторичные и третичные амины; двойные связи могут быть прогидрированы соответствующей одинарной связи; йодный радикал на фенильной группе может быть преобразован в сложноэфирную труппу путем введения монооксида углерода в присутствии соответствующего палладиевого катализатора. Поэтому соединения формулы (I), (I-a), (I-a-1), (I-b), (I-c), (I-c-1), (I-d), (I-е), (I-f), (I-h), (I-i) и (I-j) могут необязательно быть подвергнуты одному или более из следующих преобразований в любом желаемом порядке:i) преобразование одного соединения формулы (I) в другое соединение формулы (I);ii) преобразование соединения формулы (I) в соответствующую приемлемую ее соль или N-оксид;iii) преобразование фармацевтически приемлемой соли или N-оксида формулы (I) в исходное соединение формулы (I);iv) получение стереохимически изомерной формы соединения формулы (I) или ее фармацевтически приемлемой соли или N-оксида. Промежуточные соединения формулы (VII), где Rd и Re являются соответствующими радикалами,или, взятые вместе с углеродным атомом, к которому они присоединены, образуют гетероциклическую кольцевую систему, как определено в Z, могут быть получены гидролизом промежуточных соединений формулы (VI), где R3 является группой формулы (b-1) или радикалом формулы (а-1), где s не равен нулю,называемый как R9, известными в данной области способами, такими как перемешивание промежуточного соединения (VI) в водном растворе кислоты в присутствии реакционноинертного растворителя, например, тетрагидрофурана. Соответствующей кислотой является, например, хлористо-водородная кислота. Соединения формулы (I), где R2 является водородом и R9 определен выше, называемые соединениями формулы (I-i), могут быть получены, исходя из промежуточных соединений формулы (VII), путем селективного гидрирования указанного промежуточного соединения соответствующим восстановителем,таким как, например, катализатор на основе благородного металла, такого как платина на активированном угле, палладий на активированном угле и подобные, и соответствующим восстановителем, таким как водород, в соответствующим растворителе, таком как метанол. Соединения формулы (I) могут быть получены гидролизом промежуточных соединений формулы(VIII), известными в данной области способами, путем взаимодействия промежуточных соединений формулы (VIII) с соответствующими реагентами, такими как хлорид олова, уксусная кислота и хлористоводородная кислота, в присутствии реакционноинертного растворителя, например тетрагидрофурана. Соединения формулы (I) могут быть получены, исходя из N-оксидов (IX), путем преобразования промежуточных соединений формулы (IX) в присутствии подходящего реагента, такого как карбонат натрия или уксусный ангидрид, и когда это необходимо, в растворителе, таком как дихлорметан. Соединения формулы (I), где X является СН, называемые соединениями формулы (I-j), могут быть также получены путем циклизации промежуточного соединения формулы (X). Реакция циклизации промежуточных соединений формулы (X) может быть осуществлена по известным в данной области способам циклизации. Предпочтительно реакцию проводить в присутствии соответствующей кислоты Льюиса, например хлорида алюминия, или в чистом виде, или в соответствующем растворителе, таком как,например, ароматический углеводород, например бензол, хлорбензол, метилбензол и подобные; галогенированные углеводороды, например трихлорметан, тетрахлорметан и подобные, простой эфир, например тетрагидрофуран, 1,4-диоксан и подобные; или в смеси таких растворителей. При некоторых повышенных температурах, предпочтительно в интервале 70-100 С, и перемешивании может увеличиваться скорость реакции. Соединения формулы (I), где X является N и R2, взятый вместе с R3, образует =O, называемые соединениями формулы (I-а-1), могут быть получены путем конденсации соответствующего ортобензолдиамина формулы (XI) со сложным эфиром формулы (XII), где Rh является C1-6 алкилом. Конденсация замещенного ортодиамина формулы (XI) и сложного эфира формулы (XII) может быть проведена в присутствии карбоновой кислоты, например уксусной кислоты и подобной, минеральной кислоты, такой как, например, хлористо-водородная кислота, серная кислота, или сульфоновой кислоты, такой как, например, метансульфоновая кислота, бензолсульфоновая кислота, 4-метилбензолсульфоновая кислота и подобные. При некоторых повышенных температурах может увеличиваться скорость реакции и в некоторых случаях реакция может осуществляться при температуре кипения реакционной смеси с обратным олодильником. Вода, которая выделяется при конденсации, может быть удалена из смеси азеотропной перегонкой, отгонгой и подобными способами. Промежуточные соединения формулы (XI) могут быть получены реакцией восстановления нитрогруппы в аминогруппу, исходя из промежуточного соединения формулы (XIII) в присутствии катализа- 10009875 тора на основе металла, такого как никель Ренея, и соответствующего восстановителя, такого как водород, в подходящем растворителе, таком как метанол. Промежуточные соединения формулы (XIII) могут быть получены гидролизом промежуточных соединений формулы (XIV), известными в данной области способами, такими как перемешивание промежуточного соединения (XIV) в водном растворе кислоты в присутствии реакционноинертного растворителя, например тетрагидрофурана. Соответствующей кислотой является, например, хлористо-водородная кислота. Промежуточные соединения формулы (X) удобно получать взаимодействием анилина формулы Промежуточные соединения формулы (VIII), где R2 является водородом или гидроксилом и, когдаR является водородом, то R3 является гидроксилом, называемые промежуточными соединениями формулы (VIII-а), могут быть получены обработкой промежуточного соединения формулы (XVII), где W является галогеном, литийорганическим реагентом, таким как н-бутиллитий, в реакционно-инертном растворителе, например тетрагидрофуране, и последующим взаимодействием указанного промежуточного соединения с промежуточным соединением формулы (XVIII), где R1 является водородом или радикалом, как определено в R3. 2 Настоящее изобретение также относится к соединению формулы (VII), где n равно О, X являетсяCR7 и Re и Rd, значения которых будут определены ниже, называемые соединениями формулы (VII-a) его N-оксидным формам, солям присоединения и стереохимически изомерным формам,где R1, R4, R5, R6, R7 и арил являются такими, как определено для соединений формулы (I);Re является водородом, или взятый вместе с Rd, может образовывать двухвалентный радикал формулы-CH2-NR16-(CH2)3(е-2),где R15 и R16 каждый независимо выбирают из водорода, С 1-6 алкила, С 1-6 алкилоксиС 1-6 алкила, пиперидинилС 1-6 алкила, С 3-10 циклоалкилС 1-6 алкила, арилокси(гидрокси)- 11009875 С 1-6 алкила, арилС 1-6 алкила или арилС 2-6 алкенила; илиRd является ди(C1-6 алкил)аминоС 1-6 алкилом или пиперидинилС 1-6 алкилом. Первая группа представляющих интерес соединений формулы (VII-а) состоит из тех соединений формулы (VII-а), на которые накладывается одно и более из следующих ограничений:b) R15 и R16, каждый независимо, выбирают из водорода, С 1-6 алкила, арилокси (гидрокси) С 1-6 алкила, арилС 1-6 алкила или арилС 2-6 алкенила;c) R4, R5 и R6, каждый независимо, выбирают из водорода или галогена;d) когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (b-2) и (b-4); иe) арил является фенилом или фенилом, замещенным галогеном или С 1-6 алкилокси. Вторая группа представляющих интерес соединений формулы (VII-a) состоит из соединений формулы (VII-а), на которые накладывается одно и более из следующих ограничений:b) Re является водородом или, взятый вместе с Rd, может образовывать двухвалентный радикал формулы (е-1);c) R15 и R16, каждый независимо, выбирают из водорода или арилС 2-6 алкенила;e) когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (b-2); иf) арил является фенилом, замещенным галогеном или C1-6 алкилокси. Группа предпочтительных соединений состоит из таких соединений формулы (VII-a), где R1 является С 1-6 алкилом; когда Re является радикалом формулы (а-1) или (а-2), тогда R15 и R16, каждый независимо, выбирают из водорода, С 1-6 алкила, арилокси (гидрокси) C1-6 алкила, арилС 1-6 алкила или арилС 2-6 алкенила; R4, R5 и R6, каждый независимо, выбирают из водорода или галогена, или когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (b-2) или (b-4); и арил является фенилом или фенилом, замещенным галогеном или C1-6 алкилокси. Дополнительная группа предпочтительных соединений состоит из таких соединений формулы (VIIа), где R1 является C1-6 алкилом; Re является водородом или, взятый вместе с Rd, может образовывать двухвалентный радикал формулы (а-1); R15 и R16, каждый независимо, выбирают из водорода или арилС 2-6 алкенила; R4, R5 и R6, каждый независимо, выбирают из водорода, или когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы (b-2); и арил является фенилом, замещенным галогеном или С 1-6 алкилокси. Соединения формулы (VII-a-1), определяемые как соединения формулы (VII-а), в которых Re, взятый вместе с Rd, образует двухвалентный радикал формулы (е-1) или (е-2) (например, двухвалентный радикал формулы (е-1 и R15 или R16 (например, R15) не являются водородом, могут быть получены взаимодействием соединения формулы (VII-a), где Re, взятый вместе с Rd, образует двухвалентный радикал формулы (е-1) или (е-2) (например, двухвалентный радикал формулы (е-1, и R15 или R16 (например,R15) являются водородом, называемые соединениями формулы (VII-a-2), с промежуточным соединением формулы (XIX), где W является соответствующей уходящей группой, такой как, например, хлор, бром,метансульфонилокси или бензолсульфонилокси, и R15 или R16 (например, R15) не являются водородом. Реакция может быть осуществлена в реакционноинертном растворителе, таком как, например, карбонат натрия, карбонат калия или триэтиламин. Соединения формулы (VII-а), где R15 или R16 (например, R15) являются арилокси(гидрокси)C1-6 алкилом, называемые соединениями формулы (VII-a-3), могут быть получены взаимодействием соединения формулы (VII-a-2) с промежуточным соединением формулы (XX), где R является соответствующим заместителем, в присутствии 2-пропанола. Настоящее изобретение также относится к соединениям формулы (I) или формулы (VII-a), определенным выше, для применения в качестве лекарственного средства. Соединения настоящего изобретения обладают свойствами ингибирования PARP, как будет видно далее из экспериментальной части. Настоящее изобретение также предлагает применение соединений для производства лекарственного средства для лечения одного или более описанных в данном описании заболеваний и расстройств у животного, где указанным соединением является соединение формулы (I)X является N или CR7, где R7 является водородом или, взятый вместе с R1, может образовывать двухвалентный радикал формулы -СН=СН-СН=СН-;R9 является водородом или С 1-6 алкилом; или R3 является группой формулы -(CH2)t-Z (b-1),где t равно 0, 1, 2 или 3;-Z является гетероциклической кольцевой системой, выбранной изR4, R5 и R6 каждый независимо выбирают из водорода, галогена, тригалогенметила, тригалогенметокси, C1-6 алкила, C1-6 алкилокси, амино, аминоС 1-6 алкила, ди (C1-6 алкил) амино, ди(C1-6 алкил)аминоС 1-6 алкилокси или С 1-6 алкилоксикарбонила, или C1-6 алкила, замещенного 1, 2 или 3 заместителями, независимо выбранными из гидрокси, C1-6 алкилокси или аминоС 1-6 алкилокси; или когда R5 и R6 находятся в смежных положениях, взятые вместе, могут образовывать двухвалентный радикал формулы-NH-C(O)-NR14=CH(d-4),где R14 является C1-6 алкилом; арил является фенилом, фенилом, замещенным галогеном, C1-6 алкилом или C1-6 алкилокси. Настоящее изобретение также предлагает применение соединений формулы (I) для производства лекарственного средства для лечения одного или более описанных выше заболеваний у животного, где соединением является соединение формулы (I-k)R1 является метилом или этилом;R3 является группой формулы (b-1);-Z является гетероциклической кольцевой системой (с-2), в которой указанная гетероциклическая кольцевая система -Z присоединена к остатку молекулы атомом азота;R12 является водородом или C1-6 алкилом иR17 является галогеном или С 1-6 алкилокси, или когда R1 является этилом, тогда R17 может быть водородом. Более конкретно,соединением формулы(I-k) является 6-[(1 Н-имидазол-1-ил)(4 метоксифенил)метил]-3-метил-2(1 Н)-хиноксалинон (соединение 128), 3-этил-6-(1 Н-имидазол-1 илфенилметил)-2(1 Н)-хиноксалинон (соединение 127) и 6-[(4-хлорофенил)-1 Н-имидазол-1-илметил]3-метил-2(1 Н)-хиноксалинон (соединение 146). Настоящее изобретение также предлагает применение соединений формулы (VII-a) для производства лекарственного средства для лечения одного или более описанных в данном описании заболеваний у животного. Соединения настоящего изобретения могут лечить или предотвращать повреждение ткани в результате повреждения или гибели клеток из-за некроза или апоптоза; могут исправлять повреждение нервной или сердечно-сосудистой ткани, которое включает очаговую ишемию, инфаркт миокарда и травму в результате реперфузии; могут лечить различные заболевания и состояния, вызванные или обостренные активностью PARP; могут продлевать или увеличивать ресурс или пролиферативную способность клеток; могут изменять экспрессию генов стареющих клеток; могут радиосенсибилизировать и/или химиосенсибилизировать клетки. Обычно ингибирование активности PARP предохраняет клетки от энергетических потерь, предотвращая в случае нервных клеток необратимую деполяризацию нейронов, и таким образом, обеспечивает нейрозащитное действие. В связи с вышеуказанными причинами, настоящее изобретение, кроме того, относится к способу введения терапевтически эффективного количества идентифицированных выше соединений в количестве, достаточном для ингибирования активности PARP, для лечения или предотвращения повреждения ткани в результате повреждения или гибели клеток из-за некроза или апоптоза, для воздействия на нейронную активность, не опосредованную NMDA токсичностью, для воздействия на нейронную активность, опосредованную NMDA токсичностью, для лечения повреждения нервной ткани в результате ишемии и репефузионной травмы, неврологических расстройств и нейродегенеративных заболеваний; для предотвращения или лечения сосудистых нарушений; для лечения или предотвращения сердечнососудистых заболеваний; для лечения других состояний и/или расстройств, таких как возрастное перерождение мышц, СПИД и другие иммунные возрастные заболевания, воспаление, подагра, артрит, атеросклероз, кахексия, рак, дегенеративные заболевания скелетных мышц, включающие реплекативное старение, диабет, головная травма, воспалительные заболевания кишечника (такие как колит и болезнь Крона), мышечная дистрофия, остеоартрит, остеопороз, хроническая и/или острая боль (такая как невропатическая боль), почечная недостаточность, ишемия сетчатки, септический шок (такой как эндотоксический шок), и старение кожи, для увеличения ресурса и пролиферативной способности клеток; для изменения экспрессии генов стареющих клеток; или хемосенсибилизации и/или радиосенсибилизации (гипоксических) опухолевых клеток. Настоящее изобретение также относится к лечению заболеваний и состояний у животного, которое включает введение указанному животному терапевтически эффективного количества идентифицированных выше соединений. В частности, настоящее изобретение относится к способу лечения, предотвращения или ингибирования неврологического заболевания у животного, который включает введение указанному животному терапевтически эффективного количества идентифицированных выше соединений. Неврологическое расстройство выбирают из группы, состоящей из периферической невропатии, вызванной физическим повреждением или болезненным состоянием, травматического повреждения мозга, физического повреждения спинного мозга, удара, связанного с повреждением мозга, очаговой ишемии, глобальной ишемии,реперфузионного повреждения, демиелинизирующего заболевания и неврологического расстройства,связанного с нейродегенерацией. Настоящее изобретение также предлагает применение соединений формулы (I) и соединений формулы (VII-а) для ингибирования активности PARP, для лечения, предотвращения или ингибирования повреждения ткани в результате повреждения или гибели клеток из-за некроза или апоптоза, для лечения, предотвращения или ингибирования неврологического расстройства у животного. Термин "предотвращение нейродегенерации" включает способность предотвращать нейродегенерацию у пациентов с повторно поставленным диагнозом нейродегенеративного заболевания или при риске развития нового дегенеративного заболевания и для предотвращения дополнительной нейродегенерации у пациентов, которые уже страдают или имеют симптомы нейродегенеративного заболевания. Термин "лечение", используемый в описании, охватывает любое лечение заболевания и/или состояния у животного, особенно у человека, и включает: (i) предотвращение возникновения заболевания и/или состояния у субъекта, который может быть предрасположен к заболеванию и/или состоянию, но которому еще не поставлен диагноз о том, что он болен; (ii) ингибирование заболевания и/или состояния, например остановка его развития; (iii) облегчение течения болезни и/или состояния, например, приводящее к регрессии заболевания и/или состояния. Термин "радиосенсибилизатор", используемый в описании, определяет молекулу, предпочтительно с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для- 15009875 увеличения чувствительности клеток к ионизирующему излучению и/или для ускорения лечения заболеваний, которые поддаются лечению ионизирующим излучением. Такие заболевания включают заболевания с новообразованиями, доброкачественные и злокачественные опухоли и раковые клетки. Ионизирующая лучевая терапия для других заболеваний, не приведенных в описании, также предлагаются настоящим изобретением. Термин "химиосенсибилизатор", используемый в описании, определяет молекулу предпочтительно с низкой молекулярной массой, вводимую животным в терапевтически эффективных количествах для увеличения чувствительности клеток к химиотерапии и/или для ускорения лечения заболеваний, которые поддаются лечению химиотерапией. Заболевания, которые поддаются лечению химиотерапией, включают заболевания с новообразованиями, доброкачественные и злокачественные опухоли и раковые клетки. Химиотерапия для других заболеваний, не приведенных в описании, также предлагается настоящим изобретением. Соединения, композиции и способы настоящего изобретения особенно полезны для лечения или предотвращения повреждения ткани в результате повреждения или гибели клеток из-за некроза или апоптоза. Соединения настоящего изобретения могут быть "противораковыми средствами", термин, который также включает "средства против роста опухолевых клеток" и "противоопухолевые средства". Например,способы изобретения полезны для лечения рака и чувствительных к химио- и/или лучевой терапии опухолевых клеток при злокачественных новообразованиях, таких как АКТГ-продуцирующие опухоли, острый лимфобластный лейкоз, острый нелимфобластный лейкоз, рак коры надпочечников, рак мочевого пузыря, рак мозга, рак молочной железы, рак шейки матки, хронический лимфолейкоз, хронический миелолейкоз, колоректальный рак, кожная Т-клеточная лимфома, рак эндометрия, рак пищевода, саркома Юинга, рак желчного пузыря, лейкоз ворсистых клеток, рак головы и шеи, лимфома Ходжкина, саркома Капоши, рак почки, рак печени, рак легких (мелкоклеточный и/или немелкоклеточный), злокачественный перитонеальный выпот, злокачественный плевральный выпот, меланома, мезотелиома, множественная миелома, нейробластома, неходжкинская лимфома, остеосаркома, рак яичников, рак яичников(герминально-клеточный), рак предстательной железы, рак поджелудочной железы, рак полового члена,ретинобластома, рак кожи, саркома мягких тканей, плоскоклеточный рак, рак желудка, рак яичек, рак щитовидной железы, трофобластические опухоли, рак матки, рак влагалища, рак вульвы и опухоль Вильмса. Поэтому, соединения настоящего изобретения могут быть использованы как "радиосенсибилизатор" и/или "химиосенсибилизатор". Известно, что радиосенсибилизаторы увеличивают чувствительность раковых клеток к токсическому действию ионизирующего излучения. В литературе было предложено несколько механизмов действия радиосенсибилизаторов, включая: радиосенсибилизаторы гипоксической клетки (например, соединения 2-нитроимидазола и соединения диоксида бензотриазина), имитирующие кислород или, альтернативно,проявляющие себя как биовосстановительные средства при гипоксии; радиосенсибилизаторы негипоксической клетки (например, галогенированные пиримидины) могут быть аналогами оснований ДНК и предпочтительно внедряются в ДНК раковых клеток и таким образом ускоряют вызываемый излучением распад молекул ДНК и/или препятствуют нормальным механизмам репарации ДНК; и были выдвинуты гипотезы по поводу других различных механизмов действия для радиосенсибилизаторов при лечении заболевания. Во многих схемах лечения рака постоянно используют радиосенсибилизаторы в сочетании с рентгеновским излучением. Примеры радиосенсибилизаторов, активируемых рентгеновским излучением, включают, но не ограничиваются ими, метронидазол, мизонидазол, дезметилмизонидазол, пимонидазол, этанидазол, ниморазол, митомицин С, RSU 1069, SR 4233, ЕО 9, RB 6145, никотинамид, 5 бромдезоксиуридин (BUdR), 5-иоддезоксиуридин (IUdR), бромдезоксицитидин, фтордезоксиуридин(FudR), гидроксимочевину, цисплатин и их терапевтически эффективные аналоги и производные. Фотодинамическая терапия (ФТП) рака использует видимый свет в качестве радиационного активатора сенсибилизатора. Примеры фотодинамических радиосенсибилизаторов включают, но ограничиваясь ими,производные гематопорфирина, фотофрин (Photofrin), производные бензопорфирина, этиопорфирин олова, феоборбид-а, бактериохлорофилл-а, нафталоцианины, фталоцианины, фталоцианин цинка и их терапевтически эффективные аналоги и производные. Радиосенсибилизаторы могут вводиться в сочетании с терапевтически эффективным количеством одного или более других соединений, включая, но ограничиваясь ими, соединения, которые ускоряют внедрение радиосенсибилизаторов в клетки-мишени; соединения, которые регулируют поток лекарств,питательных веществ и/или кислорода к клеткам-мишеням; химиотерапевтические средства, которые действуют на опухоль с или без дополнительного облучения; или другие терапевтически эффективные соединения для лечения рака и других заболеваний. Примеры дополнительных терапевтических средств,которые могут быть использованы в сочетании с радиосенсибилизаторами, включают, но ограничиваясь ими, 5-фторурацил, лейковорин, 5'-амино-5'дезокситимидин, кислород, карбоген, переливание эритроцитарной массы, перфторуглероды (например, Fluosol 10 DA), 2,3-DPG, BW12C, блокаторы кальциевых каналов, пентоксифилин, соединения, подавляющие рост сосудов, гидралазин и LBSO. Примеры химио- 16009875 терапевтических средств, которые могут быть использованы в сочетании с радиосенсибилизаторами,включают, но ограничиваясь ими, адриамицин, камтотецин, карбоплатин, цисплатин, даунорубицин, доцетаксел, доксорубицин, интерферон (альфа, бета, гамма), интерлейкин-2, иринотекан, паклитаксел, топотекан и их терапевтически эффективные аналоги и производные. Химиосенсибилизаторы могут быть введены в сочетании с терапевтически эффективным количеством одного или более соединений, включая, но не ограничиваясь ими, соединения, которые ускоряют внедрение химиосенсибилизаторов в клетки-мишени; соединения, которые регулируют поток лекарств,питательных веществ и/или кислорода к клеткам-мишеням; химиотерапевтические средства, которые действуют на опухоль или другие терапевтически эффективные соединения для лечения рака и других заболеваний. Примеры дополнительных терапевтических средств, которые могут быть использованы в сочетании с химиосенсибилизаторами, включают, но ограничиваясь ими, метилирующие средства, ингибиторы топоизомеразы I и другие химиотерапевтические средства, такие как цисплатин и блеомицин. Соединения формулы (I) и соединения формулы (VII-а) могут также применяться для обнаружения или идентификации PARP, и в особенности PARP-1 рецептора. Для этой цели в соединения может быть введена метка. Указанная метка может быть выбрана из группы, содержащей радиоизотоп, спиновую метку, антигенную метку, ферментную метку флуоресцентной группы или хемилюминесцентной группы. Для получения фармацевтических композиций данного изобретения эффективное количество конкретного соединения в форме соли присоединения основания или кислоты в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, который может принимать различные формы в зависимости от желаемой для введения формы препарата. Желательно,чтобы эти фармацевтические композиции находились в единичной дозированной форме, удобной предпочтительно для перорального введения, ректального, подкожного или для парентеральной инъекции. Например, при получении композиций в пероральной дозированной форме быть использована любая из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и подобные в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие, дезинтегрирующие вещества и подобные в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения таблетки и капсулы являются наиболее удобными пероральными единичными дозированными формами, очевидно в том случае, когда используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по меньшей мере, в качестве основного компонента, хотя могут быть включены и другие ингредиенты, например, для улучшения растворимости. Растворы для инъекций, например, могут быть приготовлены в носителе, который содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора с раствором глюкозы. Суспензии для инъекций могут быть также приготовлены в соответствующих жидких носителях, могут применяться суспендирующие и подобные средства. В композициях, удобных для подкожного введения, носитель необязательно содержит средство, усиливающее проникновение, и/или подходящий увлажняющий агент, необязательно объединяемый с подходящими добавками любой природы в небольших количествах, которые не вызывают значительного вредного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения желаемых композиций. Эти композиции могут быть введены различными способами, например в виде трансдермального пластыря, в виде наклейки, в виде мази. Особенно удобно составлять вышеуказанные фармацевтические композиции в дозированной единичной форме для облегчения введения и постоянства дозы. Дозированная единичная форма согласно описанию и формуле изобретения означает физически дискретные единицы, удобные в качестве разовых доз,каждая из которых содержит заданное количество активного ингредиента, вычисленное для достижения желаемого терапевтического действия в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных единичных форм являются таблетки (включая таблетки с насечкой и таблетки с покрытием), капсулы, пилюли, пакетики с порошком, галеты, растворы или суспензии для инъекций,чайные ложки, столовые ложки и подобные, и поделенные на кратные части. Для специалиста в данной области не составляет труда определить эффективное количество на основе представленных в описании результатов тестов. Обычно полагают, что эффективное количество составляет от 0,001 до 100 мг/кг массы тела и, в частности, от 0,005 до 10 мг/кг массы тела. Удобно вводить требуемую дозу в виде двух, трех, четырех или более субдоз через соответствующие интервалы в течение дня. Указанные субдозы можно готовить в виде единичных дозированных форм, например, содержащих от 0,05 до 500 мг и, в частности, от 0,1 до 200 мг активного ингредиента на единичную дозированную форму. Следующие примеры иллюстрируют настоящее изобретение. Экспериментальная часть Далее в описании "BuLi" означает бутиллитий, "МеОН" означает метанол, "ДИПЭ" означает диизопропиловый эфир, "ДМФА" означает N,N-диметилформамид, "ДХМ" означает дихлорметан, "ДМСО" означает диметилсульфоксид, "EtOAc" означает этилацетат, "ТГФ" означает тетрагидрофуран, "МЭК" означает метилэтилкетон.- 17009875 А. Получение промежуточных соединений Пример А 1. а) Получение промежуточного соединения 1 Раствор бромбензола (0,316 моль) в диэтиловом эфире добавляли по каплям к раствору Mg стружки(0,316 моль) в диэтиловом эфире при комнатной температуре и смесь перемешивали в течение 1 ч 30 мин. Смесь охлаждали до 0 С, добавляли по каплям 3-метил-6-хинолинкарбоксальдегид (0,263 моль) в ТГФ(200 мл) и смесь перемешивали в течение 2 ч. Смесь выливали в насыщенный водный раствор хлорида аммония и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Остаток (65,65 г) кристаллизовали из ДИПЭ. Продукт использовали без дополнительной очистки, получая 45,92 г (70%) промежуточного соединения 1.b) Получение промежуточного соединения 2 Перманганат калия (0,24 моль) добавляли порциями к раствору промежуточного соединения 1 (0,16 моль) в ДХМ (300 мл) и триэтаноламинтрис(2-метоксиэтил)ового эфира (5 мл) и смесь перемешивали в течение 2 ч. Смесь фильтровали через целит и выпаривали досуха, получая 35 г (88%) промежуточного соединения 2. с) Получение промежуточного соединения 3 Раствор промежуточного соединения 2 (0,142 моль) в ДХМ (200 мл) добавляли по каплям к раствору 3-хлорбензолпероксокарбоновой кислоты (0,283 моль) в ДХМ при комнатной температуре и смесь перемешивали в течение 12 ч. Смесь выливали в воду, подщелачивали карбонатом калия и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха, получая 32,68 г (87%) промежуточного соединения 3.d) Получение промежуточного соединения 4 Тозилхлорид (0,145 моль) добавляли порциями к смеси промежуточного соединения 3 (0,121 моль) в ДХМ (300 мл) и карбонату калия 10% (665 мл) и смесь перемешивали в течение 1 ч 30 мин. Добавляли ДХМ и воду, смесь фильтровали через целит и экстрагировали ДХМ. Органический слой сушили(MgSO4), фильтровали и выпаривали досуха. Остаток (36,43 г) очищали колоночной хроматографией на силикагеле (элюент: ДХМ/МеОН 98/2). Чистые фракции собирали и выпаривали. Остаток (4,09 г) кристаллизовали из 2-пропанона, получая 1,67 г (5%) промежуточного соединения 4, температура плавления 264,60 С. е) Получение промежуточного соединения 5 Смесь промежуточного соединения 4 (0,037 моль) и N-метилформамида (1,85 моль) в муравьиной кислоте (15 мл) перемешивали и нагревали при 160 С в течение 48 ч. Смесь охлаждали до комнатной температуры, выливали в ледяную воду, подщелачивали карбонатом калия 10% и экстрагировали EtOAc. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток кристаллизовали из диэтило- 18009875 вого эфира. Часть (3 г) остатка (7 г) перекристаллизовывали из смеси ДХМ/диэтиловый эфир, получая 2,15 г промежуточного соединения 5, температура плавления 189,8 С. Пример А 2. Получение промежуточного соединения 6nBuLi 1.6M в гексане (0,0382 моль) добавляли по каплям при 60 С в токе N2 к смеси 6-бром-3-этил 2-метоксихинолина (0,03 моль) в ТГФ (50 мл). Смесь перемешивали при -60 С в течение 1 ч. Добавляли по каплям раствор 2,3-дигидро-1,4-бензодиоксин-6-карбоксальдегида (0,0361 моль) в ТГФ (50 мл). Смесь перемешивали при -60 С в течение 2 ч, затем при -40 С в течение 1 ч, выливали в воду и гидроксиду аммония и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Продукт использовали без дополнительной очистки, получая 10,56 г промежуточного соединения 6.b) Получение промежуточного соединения 7 Смесь промежуточного соединения 6 (0,0398 моль) в хлористо-водородной кислоте 3 н (100 мл) и ТГФ (20 мл) перемешивали при 60 С в течение 12 ч, затем выливали в ледяную воду и гидроксид аммония и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Осадок помещали в 2-пропанон и ДИПЭ, отфильтровывали и сушили, получая 6,2 г (47%) промежуточного соединения 7, температура плавления 232 С. Пример A3. а) Получение промежуточного соединения 8nBuLi 1,6M (0,102 моль) добавляли по каплям при -78 С к раствору 6-бром-2-хлор-3-этилхинолина(0,085 моль) в ТГФ (200 мл) в токе N2. Смесь перемешивали при -78 С в течение 1 ч. Добавляли по каплям раствор N-метокси-N-метилбензамида (0,085 моль) в ТГФ (50 мл) при -78 С. Смесь перемешивали при температуре от -78 С до 0 С в течение 2 ч 30 мин, гидролизовали водой и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSCO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: циклотексан/EtOAc 93/7). Чистые фракции собирали и растворитель выпаривали. Остаток (7,5 г, 30%) кристаллизовали из 2 пропанона. Осадок отфильтровывали и сушили, получая 7,15 г (28%) промежуточного соединения 8,температура плавления 94 С.b) Получение промежуточного соединения 9 Смесь промежуточного соединения 8 (0,169 моль) в хлористо-водородной кислоте 3 н (250 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч. Смесь охлаждали до комнатной температуры и фильтровали. Осадок промывали водой, затем 2-пропаноном и затем диэтиловым эфиром. Продукт использовали без дополнительной очистки, получая 26 г (55%) промежуточного соединения 9. с) Получение промежуточного соединения 10 Гидроборат натрия (0,018 моль) добавляли порциями при 0 С в атмосфере N2 к раствору промежуточного соединения 9 (0,018 моль) в МеОН (100 мл), смесь перемешивали при 5 С в течение 1 ч и затем при комнатной температуре в течение 1 ч. Смесь выливали в ледяную воду и фильтровали. Осадок про- 19009875 мывали 2-пропаноном и диэтиловым эфиром и перекристаллизовывали из смеси 2-пропанон/MeOH, получая 2,6 г (52%) промежуточного соединения 10, температура плавления 235,7 С. Пример А 4. а) Получение промежуточного соединения 11 2-метил-2-пропанол, соль калия (0,21 моль) и затем МеОН (10,5 мл) добавляли при 0 С к раствору тозилметилизоцианида (0,085 моль) в ДМСО (300 мл). Добавляли промежуточное соединение 2 (0,06 моль) при 5 С и смесь перемешивали при 5 С в течение 1 ч. Смесь выливали в ледяную воду и экстрагировали ДХМ. Органический слой промывали Зн раствором хлористо-водородной кислоты и выпаривали досуха. Остаток перекристаллизовывали из диэтилового эфира, получая 6,3 г (40%) промежуточного соединения 11.b) Получение промежуточного соединения 12 Раствор 3-хлорбензолпероксокарбоновой кислоты (0,048 моль) в ДХМ добавляли при 0 С к раствору промежуточного соединения 11 (0,024 моль) в ДХМ и смесь перемешивали при комнатной температуре в течение 12 ч. Смесь промывали 10% карбонатом калия и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали, получая 6,28 г (94%) промежуточного соединения 12. Пример А 5. а) Получение промежуточного соединения 13. Раствор промежуточного соединения 1 (0,08 моль) в ДХМ (300 мл) охлаждали до 0 С. Добавляли по каплям тионилхлорид (0,4 моль) и смесь перемешивали при комнатной температуре в течение 12 ч. Смесь выливали в ледяную воду, подщелачивали гидроксидом аммония и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Продукт использовали без дополнительной очистки, получая 21,5 г промежуточного соединения 13.b) Получение промежуточного соединения 14 Смесь промежуточного соединения 13 (0,08 моль), 1H-1,2,4-триазола (0,24 моль) и карбоната калия(0,24 моль) в ацетонитриле (200 мл) перемешивали и нагревали при 80 С в течение 48 ч. Смесь выливали в воду и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Остаток (25,22 г) очищали колоночной хроматографией на силикагеле (элюент: ДХМ/МеОН 97/3). Чистые фракции собирали и выпаривали, получая 14,3 г (60%) промежуточного соединения 14. с) Получение промежуточного соединения 15 Раствор промежуточного соединения 14 (0,043 моль) и 3-хлорбензолпероксокарбоновой кислоты(0,086 моль) в ДХМ (150 мл) перемешивали при комнатной температуре в течение 12 ч. Смесь выливали- 20009875 в воду, подщелачивали гидроксидом аммония и экстрагировали ДХМ. Органический слой сушили(MgSO4), фильтровали и упаривали досуха. Продукт использовали без дополнительной очистки, получая 14 г промежуточного соединения 15. Пример А 6. а) Получение промежуточного соединения 16 Смесь промежуточного соединения 4 (0,076 моль) в формамиде (300 мл) и муравьиной кислоте (100 мл) перемешивали при 160 С в течение недели и выливали в ледяную воду. Осадок отфильтровывали,ополаскивали водой, затем диэтиловым эфиром и сушили. Остаток кристаллизовали из ДХМ/МеОН. Осадок отфильтровывали и сушили, получая 14,5 г (65%) промежуточного соединения 16, температура плавления 260 С.b) Получения промежуточных соединений 17 и 18 Смесь промежуточного соединения 16 (0,044 моль) в 6 н хлористо-водородной кислоте (290 мл) перемешивали при 100 С в течение 4 ч и 30 мин, затем доводили до комнатной температуры. Осадок отфильтровывали, промывали водой, затем диэтиловым эфиром, получая 13,5 г. (100%) промежуточного соединения 18 в виде моногидрохлоридной соли, температура плавления 260 С. Часть этой фракции(11,8 г) подщелачивали гидроксидом натрия и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 9,95 г промежуточного соединения 17. Пример А 7. Получение промежуточного соединения 19 Смесь 1,1'-карбонилбис-1 Н-имидазола (0,0794 моль) в ТГФ (100 мл) перемешивали при комнатной температуре в течение 15 мин. Медленно добавляли смесь промежуточного соединения 18 (0,0265 моль) в ТГФ (100 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Продукт использовали без дополнительной очистки, получая 7,7 г (100%) промежуточного соединения 19. Пример А 8. а) Получение промежуточного соединения 20- 21009875 Смесь промежуточного соединения 12 (0,022 моль) и тозилхлорида (0,033 моль) в 10% карбонате калия (100 мл) и ДХМ (100 мл) перемешивали при комнатной температуре в течение 1 ч. Смесь экстрагировали ДХМ. Органический слой сушили (MgSO4) , фильтровали и выпаривали. Остаток перекристаллизовывали из диэтилового эфира, получая 5 г (84%) промежуточного соединения 20, температура плавления 227,5 С.b) Получение промежуточного соединения 21 Промежуточное соединение 20 (0,015 моль) в MeOH/NH3 7 н (100 мл) гидрировали на никеле Ренея(4 г) в качестве катализатора при комнатной температуре в течение 6 ч при давлении 3 бар и колбу продували N2. После поглощения H2 (2 экв.) катализатор отфильтровывали и фильтрат упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: ДХМ/MeOH/NH4OH 90/10/0,1). Чистые фракции собирали и выпаривали, получая 3 г (73%) промежуточного соединения 21. Пример А 9. а) Получение промежуточного соединения 22 Гидроборат натрия (0,15 моль) добавляли порциями при 5 С в атмосфере N2 к смеси промежуточного соединения 4 (0,075 моль) в МеОН (500 мл) и ТГФ (500 мл). Смесь перемешивали при 5 С в течение 1 ч и затем при комнатной температуре в течение 1 ч. Смесь выливали на лед и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали. Часть (3 г) остатка (36,82 г, 92%) перекристаллизовывали из диэтилового эфира и ТГФ, получая 2 г промежуточного соединения 22, температура плавления 237,7 С.b) Получение промежуточного соединения 23 Тионилхлорид (10 мл) добавляли по каплям к раствору промежуточного соединения 22 (0,0162 моль) в ДХМ (200 мл) при 0 С. По окончанию добавления смесь перемешивали при комнатной температуре в течение 12 ч. Смесь выпаривали в вакууме и продукт использовали без дополнительной очистки,получая 4,6 г (100%) промежуточного соединения 23. Пример А 10. а) Получение промежуточного соединения 24 Смесь промежуточного соединения 4 (0,076 моль) в фосфорилхлориде (60 мл) перемешивали при 60 С в течение 5 ч. Смесь выпаривали досуха, остаток переносили на лед, подщелачивали NaHCO3 и экстрагировали EtOAc. Органический слой сушили (MgSO4), фильтровали и выпаривали. Продукт использовали без дополнительной очистки, получая 18 г (86%) промежуточного соединения 24.b) Получение промежуточного соединения 25 Метилат натрия (0,16 моль) добавляли к раствору промежуточного соединения 24 (0,035 моль) в- 22009875 МеОН (100 мл) и смесь перемешивали и кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали до комнатной температуры, выливали в ледяную воду и экстрагировали EtOAc. Органический слой сушили (MgSO4), фильтровали и выпаривали. Остаток кристаллизовали из диэтилового эфира, получая 7 г (72%) промежуточного соединения 25. с) Получение промежуточного соединения 26n-BuLi (0,0539 моль) медленно добавляли при -70 С в токе N2 к раствору 1-метил-1 Н-имидазола(0,0539 моль) в ТГФ (80 мл). Смесь перемешивали при -70 С в течение 30 мин. Добавляли хлортриэтилсилан (0,0539 моль). Давали смеси нагреться до комнатной температуры и затем охлаждали до -70 С. Медленно добавляли n-BuLi (0,0539 моль). Смесь перемешивали при -70 С в течение 1 ч, затем давали смеси нагреться до -15 С и охлаждали до -70 С. Добавляли раствор промежуточного соединения 25(0,0414 моль) в ТГФ (50 мл). Давали смеси нагреться до комнатной температуры и затем перемешивали при комнатной температуре в течение ночи. Добавляли воду. Смесь экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (28 г) очищали колоночной хроматографией на силикагеле (20-45 мкм) (элюент: ДХМ/МеОН/NH4OH 96,5/3,5/0,1). Чистые фракции собирали и растворитель выпаривали, получая 9,7 г (65%) промежуточного соединения 26. Пример A11. а) Получение промежуточного соединения 21 Смесь N-(2-метоксиэтил)-1-(фенилметил)-4-пиперидинамина (0,0402 моль) в этаноле (100 мл) гидрировали при 40 С в течение 2 ч и затем при комнатной температуре при давлении 3 бар в течение 3 ч наPd/C 10% (1 г) в качестве катализатора. После поглощения H2 (1 экв.) катализатор отфильтровывали через целит, катализатор промывали этанолом и фильтрат выпаривали. Продукт использовали без дополнительной очистки, получая 6,5 г (99%) промежуточного соединения 27.b) Получение промежуточного соединения 28 30% метилат натрия в MeOH (138 мл) добавляли к смеси 2-бром-6-хлорфенантридина (0,124 моль) в МеОН (413 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи, затем выливали на лед и экстрагировали ДХМ. Осадок отфильтровывали и сушили. Фильтрат сушили (MgSO4),фильтровали и выпаривали. Остаток (19,7 г) очищали колоночной хроматографией на силикагеле (20-45 мкм) (элюент:ДХМ/циклогексан 30/70). Чистые фракции собирали и растворитель выпаривали, получая 9,6 г (27%) промежуточного соединения 28. с) Получение промежуточного соединения 29nBuLi 1,6M (0,028 моль) добавляли по каплям при -78 С в токе N2 к смеси промежуточного соединения 28 (0,014 моль) в ТГФ (40 мл). Смесь перемешивали при -78 С в течение 1 ч. Добавляли смесь 2,3 дигидро-1,4-бензодиоксин-6-карбоксальдегида (0,0305 моль) в ТГФ (40 мл). Смесь перемешивали при(MgSO4), фильтровали и растворитель выпаривали. Остаток (11,2 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: циклогексан/EtOAc 70/30). Чистые фракции собирали и растворитель выпаривали, получая 4 г (77%) промежуточного соединения 29.d) Получение промежуточного соединения 30 Смесь промежуточного соединения 29 (0,0107 моль) в 3 н хлористо-водородной кислоте (40 мл) и- 23009875 ТГФ (10 мл) перемешивали, кипятили с обратным холодильником в течение ночи и выливали в воду. Осадок отфильтровывали и сушили, получая 3,7 г (97%) промежуточного соединения 30. е) Получение промежуточного соединения 31 Тионилхлорид (10 мл) добавляли при комнатной температуре к смеси промежуточного соединения 30 (0,0028 моль) в ДХМ (10 мл). Смесь перемешивали при комнатной температуре в течение ночи. Растворитель выпаривали досуха. Продукт использовали без дополнительной очистки, получая 1,3 г (количественно) промежуточного соединения 31. Пример А 12. Получение промежуточного соединения 32nBuLi 1,6M (0,0451 моль) медленно добавляли при -78 С в токе N2 к раствору 6-бром-3-этил-2 метоксихинолина (0,0376 моль) в ТГФ (200 мл). Смесь перемешивали в течение 90 мин и снова охлаждали до -78 С. Смесь пиперонилальдегида (0,0376 моль) в ТГФ (100 мл) добавляли по каплям. Смесь перемешивали в течение 2 ч, выливали в воду и хлорид аммония и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (14,9 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: ДХМ/МеОН 99/1). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из диэтилового эфира. Осадок отфильтровывали и сушили, получая 1 г промежуточного соединения 32, температура плавления 116 С. Пример А 13. а) Получение промежуточного соединения 33 Тионилхлорид (0,069 моль) добавляли по каплям при 10 С в атмосфере N2 к раствору промежуточного соединения 10 (0,0183 моль) в ДХМ (50 мл) и смесь перемешивали при 10 С в течение 1 ч при комнатной температуре в течение ночи. Смесь упаривали и остаток помещали в ДХМ. Смесь подщелачивали 10% карбонатом калия и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали, получая 5,10 г (94%) промежуточного соединения 33.b) Получение промежуточного соединения 34(150 мл) перемешивали при 40 С в токе N2 в течение 15 мин и затем быстро добавляли при 40 С в токеN2 к раствору промежуточного соединения 33 (0,0987 моль) в ДМФА (150 мл). Смесь перемешивали в токе N2 в течение 12 ч. Растворитель выпаривали досуха. Остаток помещали в воду и ДХМ, промывали 3 н хлористо-водородной кислотой и декантировали. Водный слой подщелачивали гидроксидом аммония и экстрагировали ДХМ. Объединенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (17 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент: ДХМ/MeOH/NH4OH 97/25/0,5). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из смеси 2-пропанон/ДИПЭ. Осадок отфильтровывали и сушили, получая 3,2 г промежуточного соединения 34. Пример А 14. а) Получение промежуточного соединения 35 1-Ацетил-4-пиперидинкарбонилхлорид (0,1227 моль) медленно добавляли при 5 С к смеси хлорида алюминия (0,2699 моль) в 1,2-дихлорэтане (25 мл). Смесь нагревали до 65 С. Добавляли 2,3-дигидро-1,4 бензодиоксин (0,18405 моль). Смесь перемешивали при 65 С в течение 15 ч, охлаждали до комнатной температуры, выливали в воду и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали досуха. Остаток (44,44 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: ДХМ/МеОН 97,5/2,5). Чистые фракции собирали и растворитель выпаривали. Часть (0,2 г) остатка (27 г, 76%) кристаллизовали из МЭК и ДИПЭ. Осадок отфильтровывали и сушили, получая промежуточное соединение 35, температура плавления 102 С.b) Получение промежуточного соединения 36nBuLi 1,6M в гексане (0,09 моль) медленно добавляли при -78 С в токе N2 к раствору 6-бром-3 этил-2-метоксихинолина (0,075 моль) в ТГФ (200 мл). Смесь перемешивали в течение 1 ч. Смесь промежуточного соединения 35 (0,075 моль) в ТГФ (100 мл) добавляли по каплям при -78 С. Смесь перемешивали при -30 С в течение 2 ч, выливали в воду и хлорид аммония и экстрагировали EtOAc. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (37,1 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: ДХМ/MeOH/NH4OH 97/3/0,15). Нужные фракции собирали и выпаривали растворитель. Остаток кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили, получая 0,8 г промежуточного соединения 36, температура плавления 114 С. с) Получение промежуточного соединения 37 Смесь промежуточного соединения 36 (0,0504 моль) в 3 н хлористоводородной кислоте (400 мл) и ТГФ (200 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч, затем выливали в ледяную воду, подщелачивали гидроксидом аммония и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: ДХМ/MeOH/NH4OH 90/10/0,1). Чистые фракции собирали и растворитель выпаривали. Остаток кристаллизовали из ДИПЭ. Осадок отфильтровывали и сушили, получая 7,45 гd) Получение промежуточного соединения 38 Смесь промежуточного соединения 37 (0,015 моль) в МеОН (100 мл) гидрировали при 50 С при давлении 20 бар в течение 15 ч на Pd/C 10% (1,3 г) в качестве катализатора. После поглощения Н 2 катализатор отфильтровывали. Гидрирование продолжали. После поглощения Н 2 катализатор отфильтровывали и фильтрат выпаривали досуха. Остаток (5,4 г) очищали колоночной хроматографией на силикагеле(15-40 мкм) (элюент: ДХМ/MeOH/NH4OH 85/15/1). Нужные фракции собирали и растворитель выпаривали, получая 3,5 г (54%) промежуточного соединения 38. Пример А 15. а) Получение промежуточного соединения 39nBuLi 1,6 М (0,02986 моль) добавляли при -78 С в токе N2 к раствору 6-бром-3-этил-2 метоксихинолина (0,02488 моль) в ТГФ (120 мл). Смесь перемешивали при -30 С в течение 1 ч и снова охлаждали до -70 С. Медленно добавляли смесь 1-(2,3-дигидро-1,4-бензодиоксин-6-ил)-3-(1 пиперидинил)-1-пропанона (0,02488 моль) в ТГФ (60 мл). Смесь перемешивали при -70 С в течение 1 ч,выливали в воду и хлорид аммония и экстрагировали EtOAc. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали досуха. Остаток (14,92 г) очищали колоночной хроматографией на силикагеле (15-35 мкм) (элюент: ДХМ/MeOH/NH4OH 94/6/0,1). Нужные фракции собирали и растворитель выпаривали, получая 7,2 г (63%) промежуточного соединения 39.b) Получение промежуточных соединений 40, 41 и 42 Смесь промежуточного соединения 39 (0,0123 моль) в 6 н хлористо-водородной кислоте (95 мл) и ТГФ (38 мл) перемешивали и кипятили с обратным холодильником в течение 15 ч, охлаждали до комнатной температуры, выливали на лед, подщелачивали концентрированным раствором гидроксида аммония и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали досуха. Остаток очищали колоночной хроматографией на силикагеле (5-35 мкм) (элюент: ДХМ/MeOH/NH4OH 94/6/0,5). Три нужных фракции собирали и их растворители выпаривали, получая 2,1 г F1 (Е изомер), 2 г F2 (Z изомер) и 0,67 г промежуточного соединения 40 (смесь E+Z изомеров). И F1 и F2 фракции кристаллизовали из 2-пропанона. Осадок отфильтровывали и сушили, получая 0,7 г промежуточного соединения 41 (Е) и 0,7 г промежуточного соединения 42 (Z). Пример А 16. Получение промежуточного соединения 43-Этилциннамоилхлорид (0,107 моль) добавляли при 0 С к раствору 4-(1H-имидазол-1 илфенилметил)бензамина (0,089 моль) в пиридине (20 мл) и ДХМ (150 мл) и смесь перемешивали в течение 4 ч. Смесь выпаривали досуха, остаток подщелачивали гидроксидом аммония и экстрагировали ДХМ. Органический слой сушили (MgSO4), фильтровали и выпаривали досуха. Продукт использовали без дополнительной очистки, получая промежуточное соединение 43. Пример А 17. а) Получение промежуточного соединения 44 К раствору 1-(4-хлорфенил)-2-(4-нитрофенил)этанона (0,09064 моль) в МеОН (500 мл) добавляли никель Ренея (25 г). Смесь перемешивали при пониженном давлении (3 бар) в течение 30 мин. Затем горячую реакционную смесь фильтровали. Растворитель выпаривали, получая промежуточное соединение 44.b) Получение промежуточного соединения 45 К раствору промежуточного соединения 44 (0,252 моль) в ДХМ (600 мл) добавляли по каплям ангидрид уксусной кислоты (71,5 мл). Смесь перемешивали в течение 1 ч при комнатной температуре. Затем смесь выливали в холодную воду, нейтрализовали концентрированным гидроксидом аммония, декантировали, промывали, сушили и растворитель выпаривали, получая 72 г (99%) промежуточного соединения 45, температура плавления 190 С. с) Получение промежуточного соединения 46 К смеси промежуточного соединения 45 (0,25 моль) в ангидриде уксусной кислоты (500 мл) при комнатной температуре, добавляли порциями азотную кислоту (дымящаяся) (39,6 мл). Смесь перемешивали в течение 1 ч. Затем смесь выливали в ледяную воду, нейтрализовали концентрированным гидроксидом аммония, фильтровали, промывали МЭК и сушили, получая 47 г (56,5%) промежуточного соединения 46, температура плавления 145 С.d) Получение промежуточного соединения 47 Смесь промежуточного соединения 46 (0,1202 моль) в 3 н хлористо-водородной кислоте (100 мл) и ТГФ (300 мл) перемешивали при 60 С в течение 12 ч, выливали в воду и экстрагировали три раза ДХМ(380 мл). Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 34 г (97%) промежуточного соединения 47, температура плавления 112 С. е) Получение промежуточного соединения 48 Смесь промежуточного соединения 47 (0,0103 моль) в MeOH (350 мл) гидрировали при комнатной температуре при давлении 3 бар в течение 90 мин на никеле Ренея (34 г) в качестве катализатора. После поглощения H2 (3 экв.) катализатор отфильтровывали через целит, промывали МеОН и фильтрат выпаривали, получая 23 г (75%) промежуточного соединения 48, температура плавления 12 8 С.f) Получение промежуточных соединений 49 и 50 Смесь промежуточного соединения 48 (0,0882 моль) в воде (160 мл) перемешивали при 0 С. Добавляли порциями раствор 2-оксомасляной кислоты (0,112 моль) в уксусной кислоте (70 мл) при 0 С. Смеси давали нагреться до комнатной температуры, затем перемешивали при комнатной температуре в течение 12 ч, выливали в воду и 3 н гидроксид натрия и экстрагировали ДХМ и МеОН. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток (33 г) растворяли в смеси ДХМ/МеОН/NH4OH 97/3/0,1. Осадок отфильтровывалии дважды кристаллизовали из МеОН и ДХМ. Осадок отфильтровывали и сушили, получая 0,64 г (3%) промежуточного соединения 49, температура плавления 228 С.Фильтрат очищали колоночной хроматографией на силикагеле (20-45 мкм) (элюент:- 27009875 ДХМ/MeOH/NH4OH 97/3/0,1). Нужные фракции собирали и растворитель выпаривали. Остаток кристаллизовали из 2-пропанона и диэтилового эфира. Осадок отфильтровывали и сушили, получая 1,5 г (5%) промежуточного соединения 50, температура плавления 236 С. Пример А 18. а) Получение промежуточного соединения 51 К раствору промежуточного соединения 4 6 (0,141 моль) в МеОН (500 мл), охлажденному до 10 С,добавляли порциями гидроборат натрия (0,0141 моль). Затем добавляли воду и осадок отфильтровывали,промывали и сушили, получая 44 г (93,2%) промежуточного соединения 51.b) Получение промежуточного соединения 52 К раствору промежуточного соединения 51 (0,131 моль) в ДХМ (400 мл) добавляли триэтиламин(36,6 мл). Смесь охлаждали до 0 С. Затем добавляли по каплям метансульфонилхлорид (20,35 мл). Смесь перемешивали в течение ночи при комнатной температуре. Затем смесь выливали в ледяную воду, декантировали, промывали, сушили (MgSO4) и растворитель выпаривали, получая 58 г (100%) промежуточного соединения 52. с) Получение промежуточного соединения 53 Смесь промежуточного соединения 52 (0,131 моль) в ацетонитриле (400 мл), 1 Н-имидазола (0,658 моль) и карбоната калия (89,06 г) перемешивали при 80 С в течение ночи. Растворитель выпаривали досуха и затем осадок помещали в ДХМ, декантировали, промывали, сушили и растворитель выпаривали. Остаток (35 г) очищали колоночной хроматографией на силикагеле (элюент: ДХМ/МеОН 98/2), получая 13 г (27,6%) промежуточного соединения 53, температура плавления 131 С.d) Получение промежуточного соединения 54 Смесь промежуточного соединения 53 (0,0352 моль) в 2 н гидроксида натрия (130 мл) и этаноле (13 мл) перемешивали при комнатной температуре в течение 24 ч, затем реакционную смесь нейтрализовали хлористоводородной кислотой и экстрагировали ДХМ. Органический слой промывали водой, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток кристаллизовали из смеси ДИПЭ/2 пропанон и собирали образовавшийся осадок, получая 10 г (82,8%) промежуточного соединения 54, температура плавления 153 С. е) Получение промежуточного соединения 55 Смесь промежуточного соединения 54 (0,0292 моль) в МеОН (100 мл) гидрировали при комнатной температуре в течение 1 ч на никеле Ренея (10 г) в качестве катализатора. После поглощения Н 2 (3 экв.)- 28009875 раствор фильтровали через целит и растворитель выпаривали (в вакууме), получая 9,1 г промежуточного соединения 55 (используемого в следующей реакции без дополнительной очистки). Пример А 19. а) Получение промежуточного соединения 56 К раствору промежуточного соединения 46 (0,141 моль) в МеОН (500 мл), охлажденному до 10 С,добавляли порциями гидроборат натрия (0,0141 моль). Затем добавляли воду и отфильтровывали осадок,промывали и сушили, получая 44 г (93,2%) промежуточного соединения 56.b) Получение промежуточного соединения 57 Метилсульфонилхлорид (0,048 моль) медленно добавляли при 0 С к раствору промежуточного соединения 56 (0,0239 моль) и триэтаноламина (0,048 моль) в ДХМ (80 мл). Смеси давали нагреться до комнатной температуры в течение 4 ч. Растворитель выпаривали досуха. Продукт использовали без дополнительной очистки, получая промежуточное соединение 57. с) Получение промежуточного соединения 58 Смесь промежуточного соединения 57 (0,02 91 моль), пирролидина (0,0871 моль) и карбоната калия(0,0868 моль) в ацетонитриле (150 мл) перемешивали и кипятили с обратным холодильником в течение 12 ч, затем охлаждали, фильтровали, промывали ацетонитрилом, снова фильтровали и растворитель выпаривали досуха. Остаток помещали в ДХМ и воду. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток (12 г) очищали колоночной хроматографией на силикагеле (15-40 мкм) (элюент:ДХМ/MeOH/NH4OH 99/1/0,1). Чистые фракции собирали и растворитель выпаривали, получая 1,7 г (15%) промежуточного соединения 58.d) Получение промежуточного соединения 59 Смесь промежуточного соединения 58 (0,00438 моль) в 3 н гидроксиде натрия (80 мл) и этаноле (20 мл) перемешивали при комнатной температуре в течение 12 ч, выливали в воду и экстрагировали ДХМ. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая 1,2 г(80%) промежуточного соединения 59. е) Получение промежуточного соединения 60 Смесь промежуточного соединения 59 (0,00347 моль) в МеОН (80 мл) гидрировали при комнатной температуре при давлении 3 бар в течение 30 мин на никеле Ренея (1,2 г) в качестве катализатора. После поглощения водорода H2 (3 экв.) катализатор отфильтровывали через целит, промывали МеОН и фильтрат выпаривали. Продукт использовали без дополнительной очистки, получая 0,98 г промежуточного соединения 60. Пример А 20. а) Получение промежуточного соединения 61 Реакция (I). Смесь 4-хлор-3-нитробензойной кислоты (0,125 моль) в тионилхлориде (30 мл) и хлороформе (60 мл) перемешивали и кипятили с обратным холодильником в течение 4,5 ч и затем реакционную смесь концентрировали досуха с получением остатка (I). Реакция (II). Остаток (I) растворяли в хлорбензоле (65 мл) и образовавшийся раствор добавляли по каплям при охлаждении (ледяная баня) к перемешиваемой суспензии хлорида алюминия (0,188 моль) в хлорбензоле (65 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре и выливали в воду со льдом, затем экстрагировали ДХМ. Экстракт промывали раствором NaHCO3 и водой,затем сушили (MgSO4) и концентрировали (в вакууме) досуха. Остаток кристаллизовали из 2-пропанола и нужный продукт собирали, получая 23,7 г промежуточного соединения 61, температура плавления 83,4 С.b) Получение промежуточного соединения 62 Смесь промежуточного соединения 61 (0,06 моль) и NH3 (10 г) в МеОН (180 мл) и диоксида тиофана (20 мл) нагревали в течение ночи в нагревательной трубке при 120-130 С, затем отгоняли МеОН при пониженном давлении и остаток перемешивали в кипящем растворе разбавленной хлористо-водородной кислоты. Смесь охлаждали и образовавшийся осадок отфильтровывали, затем промывали водой и перекристаллизовывали из этанола. Наконец, необходимый продукт собирали, получая 12 г (72,3%) промежуточного соединения 62, температура плавления 200,9 С. с) Получение промежуточного соединения 63 Смесь промежуточного соединения 62 (0,0686 моль) в ДХМ (200 мл) и ацетилхлориде (20 мл) перемешивали в течение 12 ч при комнатной температуре и затем растворитель выпаривали досуха. Остаток помещали в диэтиловый эфир (50 мл), затем необходимый продукт отфильтровывали и сушили, получая 21,6 г (99%) промежуточного соединения 63, температура плавления 138 С.d) Получение промежуточного соединения 64 Смесь промежуточного соединения 63 (0,066 моль) в МеОН (200 мл) перемешивали при 0 С и по каплям добавляли раствор гидробората натрия (0,066 моль) в воде, затем реакционную смесь перемешивали в течение 1 ч при комнатной температуре и растворитель выпаривали. Остаток экстрагировали ДХМ/MeOH/Н 2 О и экстракт сушили (MgSO4). Наконец, растворитель выпаривали и необходимый продукт собирали, получая 20,4 г (97%) промежуточного соединения 64, температура плавления 198 С. е) Получение промежуточного соединения 65 В трехгорлой реакционной колбе (500 мл), снабженной капельной воронкой и термометром, смесь промежуточного соединения 64 (0,062 моль) и триэтиламина (0,125 моль) в ДХМ (200 мл) охлаждали до 0 С и добавляли по каплям метилсульфонилхлорид (0,125 моль), поддерживая температуру при 0-5 С,- 30
МПК / Метки
МПК: A61K 31/4704, C07D 403/06, C07D 241/44, A61P 1/04, C07D 405/14, C07D 407/06, C07D 405/06, C07D 407/12, C07D 401/06, C07D 215/227, A61K 31/498
Метки: 6-фенилалкил, качестве, поли(адф-рибоза, 6-алкенил, замещённые, ингибиторов, полимеразы, 2-хинолиноны, 2-хиноксалиноны
Код ссылки
<a href="https://eas.patents.su/30-9875-6-alkenil-i-6-fenilalkil-zameshhyonnye-2-hinolinony-i-2-hinoksalinony-v-kachestve-ingibitorov-poliadf-riboza-polimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">6-алкенил и 6-фенилалкил замещённые 2-хинолиноны и 2-хиноксалиноны в качестве ингибиторов поли(адф-рибоза) полимеразы</a>
Следующий патент: Морфолинилсодержащие бензимидазолы в качестве ингибиторов репликации респираторно-синцитиального вируса
Случайный патент: Кристаллическая форма ii каберголина












