Производные пиразола как ингибиторы ионных каналов, активируемых высвобождением кальция (crac)
Номер патента: 24630
Опубликовано: 31.10.2016
Авторы: Мутуппаланиаппан Пейяппан, Мерикапуди Гаятри Сваруп, Ваккаланка Сваруп Кумар В.С., Висванадха Срикант
Формула / Реферат
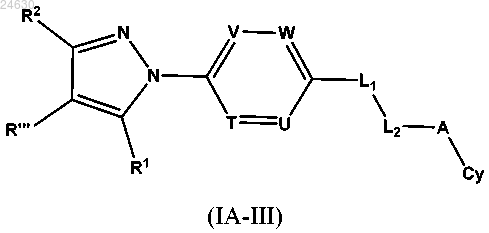
1. Соединение формулы
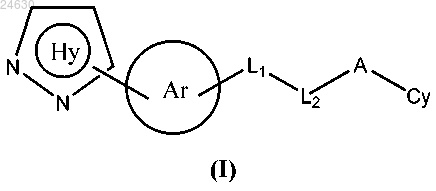
или его фармацевтически приемлемая соль, где кольцо Ну представляет собой

необязательно содержащее в качестве заместителя R"';
R1 и R2 являются одинаковыми или различными и независимо выбраны из СН3, CH2F, CHF2, CF3, С(3-5) циклоалкила, при условии, что:
а) R1 и R2 не представляют собой одновременно CF3,
б) R1 и R2 не представляют собой одновременно СН3,
в) если R1 представляет собой CF3, то R2 не представляет собой СН3, и
г) если R1 представляет собой СН3, то R2 не представляет собой CF3, кольцо Аr представляет собой
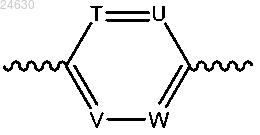
(i) T выбран из CRa и N, причем Ra представляет собой галоген, и каждый из U, V и W независимо выбран из CRa и N, причем Ra в каждом случае представляет собой водород или галоген; или
(ii) каждый из Т, U, V и W независимо выбран из CRa и N, при этом Ra в каждом случае представляет собой водород или галоген, при условии что по меньшей мере один из Т, U, V и W представляет собой N;
L1 и L2 совместно представляют собой -NH-C(=O)-, -C(=O)NH- или -NH-CR'R"-;
А отсутствует или выбран из -(CR'R")- и -NH;
R' и R" представляют собой водород, или R' и R" могут быть объединены с образованием циклопропильного, циклобутильного, циклопентильного или циклогексильного кольца;
R''' представляет собой галоген;
Су выбран из моноциклического 3-15-членного гетероциклила, содержащего по меньшей мере один гетероатом, выбранный из N, О и S; фенила и моноциклического 5-6-членного гетероарила, содержащего по меньшей мере один гетероатом, выбранный из N, О и S, каждый из которых необязательно замещен одним или более галогеном, С(1-8) алкилом или SOqC(1-8) алкилом; и
в каждом случае q независимо представляет собой 0, 1 или 2;
при условии, что соединение формулы (I) не включает N-бензил-6-(3,5-дициклопропил-1Н-пиразол-1-ил]пиридазин-3-амин.
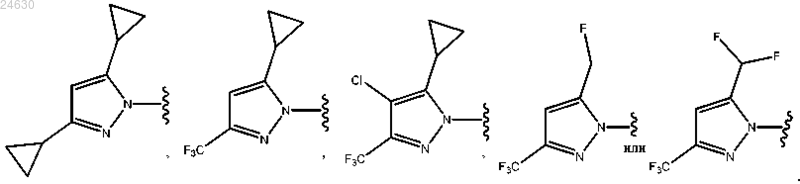
2. Соединение по п.1, отличающееся тем, что Ну является
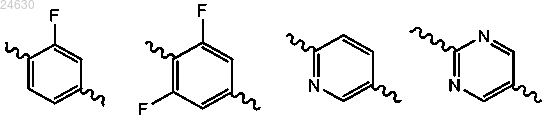
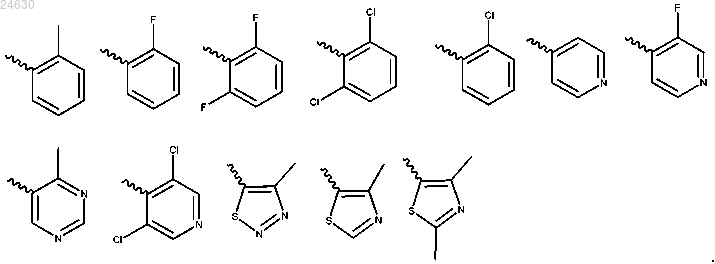
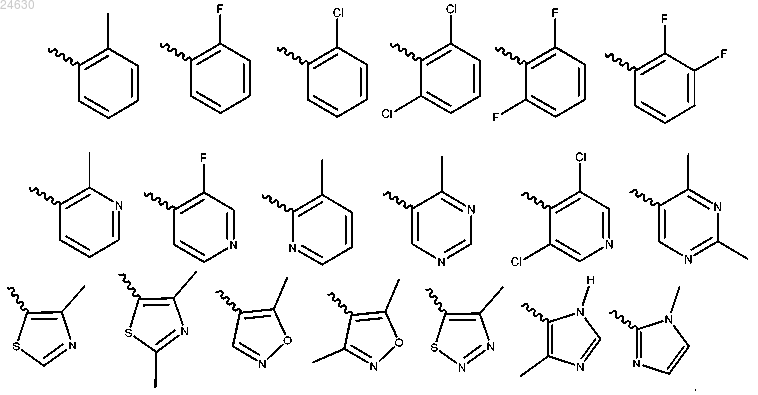
3. Соединение по п.1 или 2, отличающееся тем, что Ar выбран из
4. Соединение по любому из пп.1-3, отличающееся тем, что L1 и L2 совместно представляют собой -NH-C(=O)-.
5. Соединение по любому из пп.1-4, отличающееся тем, что А отсутствует или представляет собой -(CR'R")-.
6. Соединение по любому из пп.1-5, отличающееся тем, что Су выбран из
7. Соединение формулы
или его фармацевтически приемлемая соль, где
R1 и R2 являются одинаковыми или различными и независимо выбраны из CH2F, CHF2, СБ3 и циклопропила при условии, что оба R1 и R2 не представляют собой одновременно CF3,
Т выбран из CF и N и каждый из U, V и W независимо выбран из СН, CF и N;
L1 и L2 совместно представляют собой -NH-C(=O)-, -C(=O)NH- или -NH-CR'R"-;
А отсутствует или выбран из -(CR'R")- и -NH;
R' и R" представляют собой водород, или R' и R" могут быть объединены с образованием циклопропильного, циклобутильного, циклопентильного или циклогексильного кольца;
R''' представляет собой водород или галоген;
Су выбран из моноциклического 3-15-членного гетероциклила, содержащего по меньшей мере один гетероатом, выбранный из N, О и S; фенила и моноциклического 5-6-членного гетероарила, содержащего по меньшей мере один гетероатом, выбранный из N, О и S, каждый из которых необязательно замещен одним или более галогеном, С(1-8) алкилом или SOqC(1-8) алкилом; и
в каждом случае q независимо представляет собой 0, 1 или 2.
8. Соединение по п.7, отличающееся тем, что один из R1 и R2 представляет собой CF3, а другой представляет собой циклопропил.
9. Соединение по любому из пп.7 или 8, отличающееся тем, что Т представляет собой CF и U, V, W представляют собой СН, CF или N.
10. Соединение по любому из пп.7-9, отличающееся тем, что L1 и L2 совместно представляют собой -NH-C(=O)-.
11. Соединение по любому из пп.7-10, отличающееся тем, что А отсутствует.
12. Соединение по любому из пп.7-11, отличающееся тем, что Су представляет собой
13. Соединение, выбранное из
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-4-метилтиазол-5-карбоксамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-3,5-диметилизоксазол-4-карбоксамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-2-метилбензамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-2,3-дифторбензамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-2,6-дифторбензамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]никотинамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]изоникотинамида;
N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-4-метилпиримидин-5-карбоксамида;
N-[4-(4-хлор-3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-4-метилтиазол-5-карбоксамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-2,4-диметилтиазол-5-карбоксамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-3,5-диметилизоксазол-4-карбоксамида;
6-(3,5-дициклопропил-1H-пиразол-1-ил)-N-о-толилникотинамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-2-фторбензамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-2,3-дифторбензамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-2,6-дифторбензамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]никотинамида дигидрохлорида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]изоникотинамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-3-фторизоникотинамида;
3,5-дихлор-N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]изоникотинамида;
N-[6-(3,5-дициклопропил-1H-пиразол-1-ил)пиридин-3-ил]-4-метилпиримидин-5-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-4-метилтиазол-5-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-5-метилизоксазол-4-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-3,5-диметилизоксазол-4-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2-метилбензамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2,3-дифторбензамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2,6-дифторбензамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}никотинамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}изоникотинамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-3-фторизоникотинамида;
3,5-дихлор-N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}изоникотинамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-4-метилпиримидин-5-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-N,4-диметилпиримидин-5-карбоксамида;
N-{4-[4-хлор-5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-{4-[4-хлор-5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2-(пиридин-2-ил)ацетамида;
1-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-3-(4-метилпиримидин-5-ил)мочевины;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2,6-дихлорбензамида;
4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-N-(2,3-дифторфенил)-3-фторбензамида;
4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-N-(2,6-дифторфенил)-3-фторбензамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-4-метил-1,2,3-тиадиазол-5-карбоксамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-4-метилтиазол-5-карбоксамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-3,5-диметилизоксазол-4-карбоксамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил] пиридин-3-ил}-2-метилбензамида;
2-хлор-N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}бензамида;
N-(6-(5 -циклопропил-3-(трифторметил)-1H-пиразол-1-ил)пиридин-3-ил)-2-фторбензамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-2,3-дифторбензамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-2,6-дифторбензамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}пиколинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-3-метилпиколинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}никотинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-2-метилникотинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}изоникотинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-3-фторизоникотинамида;
3,5-дихлор-N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}изоникотинамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-4-метилпиримидин-5-карбоксамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-2-(пиридин-2-ил)ацетамида;
N-{6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-2-(пиридин-4-ил)ацетамида;
N-{4-[4-хлор-5-циклопропил-3-(трифторметил)-1Н-пиразол-1-ил]-3-фторфенил}-4-метилпиримидин-5-карбоксамида;
1-{6-[3-циклопропил-5-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-3-(4-метилтиазол-5-ил)мочевины;
6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-N-(2,3-дифторфенил)никотинамида;
6-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-N-(2,6-дифторфенил)никотинамида;
N-{6-[4-хлор-5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиридин-3-ил}-4-метилтиазол-5-карбоксамида;
N-{2-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиримидин-5-ил}-2,6-дифторбензамида;
3,5-дихлор-N-[4-(3,5-дициклопропил-1H-пиразол-1-ил)-3-фторфенил]изоникотинамида;
N-(2-хлор-6-фторфенил)-4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторбензамида;
N-{2-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиримидин-5-ил}-4-метилтиазол-5-карбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3,5-дифторфенил}-4-метилпиримидин-5-карбоксамида;
{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-1-фенилциклобутанкарбоксамида;
N-{4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фторфенил}-4-метилоксазол-5-карбоксамида;
N-{2-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]пиримидин-5-ил}-4-метилпиримидин-5-карбоксамида;
4-[5-циклопропил-3-(трифторметил)-1H-пиразол-1-ил]-3-фтор-N-(4-метилпиримидин-5-ил)бензамида;
N-{4-[3-циклопропил-5-(дифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2,6-дифторбензамида и
N-{4-[5-циклопропил-3-(дифторметил)-1H-пиразол-1-ил]-3-фторфенил}-2,6-дифторбензамида,
или его фармацевтически приемлемая соль.
14. Применение соединения по любому из пп.1-13 для получения лекарственного средства для ингибирования активности депо-управляемого кальциевого канала (SOC) при контактировании комплекса канала SOC или его части с указанным соединением.
15. Применение соединения по любому из пп.1-13 для получения лекарственного средства для ингибирования ионного канала, активируемого высвобождением кальция (CRAC), у млекопитающего при введении млекопитающему указанного соединения.
16. Применение соединения по любому из пп.1-13 для получения лекарственного средства для лечения заболевания, нарушения или состояния, на которое оказывает положительное влияние ингибирование ионного канала, активируемого высвобождением кальция (CRAC).
17. Применение соединения по любому из пп.1-13 для получения лекарственного средства для лечения рака.
18. Применение соединения по любому из пп.1-13 для получения лекарственного средства для лечения аутоиммунного нарушения или воспаления.
19. Применение по п.18 для лечения ревматоидного артрита.
20. Применение по п.18 для лечения астмы.
21. Применение по п.18 для лечения хронической обструктивной болезни легких (ХОБЛ).
22. Фармацевтическая композиция, содержащая соединение по любому из пп.1-13 и фармацевтически приемлемый носитель.
Текст
ПРОИЗВОДНЫЕ ПИРАЗОЛА КАК ИНГИБИТОРЫ ИОННЫХ КАНАЛОВ,АКТИВИРУЕМЫХ ВЫСВОБОЖДЕНИЕМ КАЛЬЦИЯ (CRAC) Описаны ингибиторы ионных каналов, активируемых высвобождением кальция (CRAC),способы их получения, фармацевтические композиции, содержащие их, а также способы лечения с их применением. Настоящее изобретение также относится к способам лечения немелкоклеточного рака легких (NSCLC) при помощи ингибиторов CRAC, а также способам определения терапевтических средств для лечения и диагностирования рака. Мутуппаланиаппан Пейяппан, Висванадха Срикант, Мерикапуди Гаятри Сваруп (IN),Ваккаланка Сваруп Кумар В.С. (CH) Настоящая заявка заявляет о приоритете предварительных заявок на патент Индии 2440/СНЕ/2009 от 8 октября 2009 года; 2636/СНЕ/2009 от 30 октября 2009 года; 158/СНЕ/2010 от 25 января 2010 года; 1513/СНЕ/2010 от 2 июня 2010 года; 1514/СНЕ/2010 от 2 июня 2010 года; и предварительной заявки на патент США 61/265540 от 1 декабря 2009 года, каждая из которых включена в настоящую заявку путем ссылки. Область техники Настоящее изобретение относится к ингибиторам ионных каналов, активируемых высвобождением кальция (CRAC) формулы I и их фармацевтически приемлемым солям, способам их получения и получения содержащих их композиций, а также способам лечения с их помощью. Уровень техники Регуляция внутриклеточного уровня кальция является ключевым элементом трансдукции сигналов в клетки и внутри них. Клеточные реакции факторов роста, нейротрансмиттеров, гормонов и различных других сигнальных молекул инициируются посредством кальций-зависимых процессов. Важность ионов кальция как вторичного мессенджера подчеркивается многими различными механизмами, которые работают вместе для поддержания кальциевого гомеостаза. Изменения внутриклеточной концентрации свободных ионов кальция представляет наиболее распространенное и важное событие системы сигналов для регуляции плеторы клеточных реакций. Широко распространенный путь входа кальция в клетку проходит через депо-управляемые каналы (SOC), т.е. многие типы клеток используют депо-управляемые каналы ионов кальция в качестве принципиальных путей притока ионов кальция. Этот механизм включается вслед за высвобождением ионов кальция из депо, где истощенные депо приводят к активации ионных каналов, активируемых высвобождением кальция (CRAC). Каналы CRAC, подсемейство депо-управляемых каналов, активируются высвобождением кальция из внутриклеточных депо, в частности из эндоплазматической сети (ER). Эти каналы являются ключевыми факторами в регуляции широкого ряда клеточных функций, включая сокращение мышц, секрецию белков и жидкостей, а также контроль роста и пролиферации клетки, и поэтому играют существенную роль в различных заболеваниях, таких как иммунные заболевания и аллергические реакции. Среди нескольких биофизически раздельных депо-управляемых потоков наиболее хорошо охарактеризованным и наиболее селективным по отношению к ионам кальция является поток CRAC. Так, каналы CRAC опосредуют важные функции от секреции до генной экспрессии и клеточного роста, и образуют сеть, важную для активации иммунных клеток, которые запускают адаптивную иммунную реакцию. Недавно было установлено, что два белка, молекула стромального взаимодействия (STIM1) и модулятор CRAC 1(CRACM1 или Orai1), являются важными компонентами, полностью воспроизводящими и усиливающими потоки CRAC в гетерологичных экспрессионных системах с одинаковыми биофизическими отпечатками. У млекопитающих существует несколько гомологов этих белков: STIM1 и STIM2 в эндоплазматической сети и CRACM1, CRACM2 и CRACM3 в плазматической мембране. Потоки CRAC были изначально открыты в лимфоцитах и мастоцитах, и в то же время были охарактеризованы в различных клеточных линиях, таких как дрозофила S2, В-клетки DT40, гепатоциты, дентритные, мегакариотические клетки и клетки Мадин-Дарби почек собак. В лимфоцитах и мастоцитах активация посредством антигена или рецепторов Fc инициирует высвобождение ионов кальция из внутриклеточных депо, обусловленное вторичным мессенджером инозитол (1,4,5)-трифосфат (Ins(l,4,5)P3),что в свою очередь приводит к притоку ионов кальция через каналы CRAC в плазматическую мембрану. Депо-управляемые потоки Са 2+, охарактеризованные в гладких мышцах, эпидермальных клетках А 431,эндотелиальных клетках различных тканей и клеточных линиях рака простаты, демонстрируют измененные биофизические характеристики, что позволяет предположить особое молекулярное происхождение. Например, приток ионов кальция через клеточную мембрану является важным для активации лимфоцитов и адаптивных иммунных реакций. Показано, что колебания [Са 2+], инициированные стимуляцией TCR (рецептором антигена Т-клеток), являются заметными и включают только один путь притока ионов кальция, а именно депо-управляемый канал CRAC. См., например, Lewis "Calcium signalling mechanisms in T lymphocytes," Annu. Rev. Immunol. 19, (2001), 497-521; Feskeet al. "Ca calcineurin signalling incells of the immune system," Biochem. Biophys. Res. Commun. 311, (2003), 1117-1132; Hogan et al. "Transcriptional regulation by calcium, calcineurin, and NFAT," Genes Dev. 17, (2003) 2205-2232. В настоящее время четко установлено, что внутриклеточный кальций играет важную роль в различных клеточных функциях, и что его концентрация регулируется притоком ионов кальция через ионные каналы на клеточной мембране. Каналы ионов кальция, расположенные в нервной, эндокринной,сердечнососудистой и костной системах, которые модулируются мембранным потенциалом, называются потенциал-управляемыми каналами Са 2+ (VOC). Эти каналы классифицируются на подтипы L, N, Р, Q, R и Т. Избыточный приток Са 2+ через каналы VOC вызывает гипертонию и дисфункцию мозга. Напротив,каналы ионов кальция на воспалительных клетках, включая лимфоциты, мастоциты и нейтрофилы, могут активироваться независимо от их мембранного потенциала. Показано, что этот тип канала ионов кальция действует в кризис и обострение воспаления и аутоиммунных заболеваний. Сообщалось, что в Т-клетках ранние этапы активации состоят из пред- и пост-Са 2+ событий. Стимулирование рецепторов Т-клеток-1 024630 индуцирует пред-Са 2+ события, включая генерацию IP3 с последующим высвобождением Са 2+ из эндоплазматической сети (ER). В пост-Са 2+ событиях истощение Са 2+ в ER вызывает активацию каналовCRAC, и емкостный приток Са 2+ через канал CRAC поддерживает высокую внутриклеточную концентрацию Са 2+ ([Са 2+]i). Эта пролонгированная высокая [Са 2+]i активирует цитозольную сигнальную трансдукцию для выработки липидных медиаторов (напр., LTD4), цитокинов [напр., интерлейкина-2 (IL-2)] и металлопротеиназ матрикса, которые участвуют в патогенезе воспалительных и аутоиммунных заболеваний. Эти факты позволяют предположить, что модуляторы канала CRAC могут быть полезными для лечения заболеваний, вызванных активацией воспалительных клеток без побочных эффектов, наблюдаемых у стероидов. Поскольку модуляторы канала VOC вызывают обратные события в нервной и сердечнососудистой системах, то может быть необходимым, чтобы модуляторы канала CRAC демонстрировали достаточную селективность в отношении каналов VOC, если они предназначены для применения в качестве противовоспалительных лекарств. Соответственно, было оговорено, что модуляторы канала CRAC являются полезными для лечения,предупреждения и/или улучшения заболеваний или нарушений, связанных с ионным каналом, активируемым высвобождением кальция, включая, но не ограничиваясь этим, воспаления, гломерулонефрит,увеит, заболевания или расстройства печени, заболевания или расстройства почек, хронические обструктивные заболевания легких, ревматоидный артрит, воспалительные заболевания кишечника, васкулит,дерматит, остеоартроз, воспалительные заболевания мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, отторжение аллогенного или ксеногенного трансплантата, отторжение при трансплантации, заболевания "трансплантат против хозяина", системную красную волчанку, диабет I типа, легочный фиброз, дерматомиозит, тиреоидит, миастению, аутоиммунную гемолитическую анемию, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз печени, аллергический конъюнктивит, гепатит и атопический дерматит, бронхиальную астму, синдром Шегрена, рак и другие пролиферативные заболевания и аутоиммунные заболевания или расстройства. См., напр., Международные публикации WO 2005/009954, WO 2005/009539, WO 2005/009954, WO 2006/034402, WO 2006/081389, WO 2006/081391, WO 2007/087429, WO 2007/087427,WO 2007087441, WO 200/7087442, WO 2007/087443, WO 2007/089904, WO 2007109362, WO 2007/112093, WO 2008/039520, WO 2008/063504, WO 2008/103310, WO 2009/017818, WO 2009/017819,WO 2009/017831, WO 2010/039238, WO 2010/039237, WO 2010/039236, WO 2009/089305 и WO 2009/038775, а также публикации США : US 2006/0173006 и US 2007/0249051. Идентифицированные ингибиторы канала CRAC включают SKF 96365 (1), Эконазол (2) и L651582 (3): Однако эти молекулы страдают недостаточной силой и селективностью в отношении каналов VOC и поэтому непригодны для терапевтического применения. В недавних публикациях Taiji et al. (EuropeanJournal of Pharmacology, 560, 225-233, 2007) и Yasurio Yonetoky et al. (Bio. Med. Chem., 16, 9457-9466,2008) описан селективный ингибитор канала CRAC под кодом YM-58483, способный ингибировать функцию Т-клеток и предположительно обладающий некоторым преимуществом для лечения воспалительных заболеваний, включая бронхиальную астму.YM-58483 В публикации Yasurio Yonetoky et al. вещество YM-58483 описано как селективное в отношении каналов CRAC по сравнению с потенциал-управляемыми каналами (VOC) с коэффициентом селективности 31. Другие описанные модуляторы канала CRAC включают различные биариловые и/или гетероциклические соединения карбоксанилида, включая, например, РСТ или заявки на патент США, переданныеMed. Chem., 14, 5370-5383, 2006. Все эти патенты и/или заявки на патент, а также раскрытие литературы,являются включенными в настоящую заявку путем ссылки в полном объеме для всех целей. Рак является основной проблемой здравоохранения в Индии, США и многих других частях мира. В настоящее время 1 из 4 смертей в Индии происходит из-за рака. Рак легких является основной причиной раковых смертей в мире из-за его высокого коэффициента заболеваемости и смертности, с 5-годовым оценочным периодом жизни - 10% случаев немелкоклеточного рака легких (NSCLC). Сообщалось, что необходимы дальнейшие исследования механизмов онкогенеза и хеморезистентности рака легких для улучшения степени выживаемости (Jemal A, et ah, Cancer Statistics, CA Cancer. J. Clin., 56, 106-130, 2006). Существует четыре основных типа NSCLC, а именно аденокарцинома, карцинома сквамозных клеток,брохноальвеолярная карцинома и крупноклеточная карцинома. Аденокарцинома и карцинома сквамозных клеток являются наиболее распространенными типами NSCLC на основании клеточной морфологии(Travis et al., Lung Cancer Principles and Practice, Lippincott-Raven, New York, 361-395, 1996). Аденомарцинома характеризуется более периферичным расположением в легких, и часто имеет мутацию в онкоген K-ras (Gazdar et ah, Anticancer Res., 14,261-267, 1994). Карцинома сквамозных клеток обычно расположена более центрально и часто несет мутации гена р 53 (Niklinska et ah, Folia Histochem. Cytobioh, 39,147-148, 2001). Большинство NSCLC характеризуются наличием мутации ras, делая таким образом пациента относительно нечувствительным к лечению известными ингибиторами киназ. В результате существующее лечение рака обычно ограничивается цитотоксичными лекарствами, хирургией и лучевой терапией. Существует необходимость в лечении, имеющем меньшее количество побочных эффектов и более специфично направленном на раковые клетки, которое является менее инвазивным, а также в улучшении прогноза для пациентов. Идентификация инициирующих клеток рака легких и связанных маркеров может быть полезной для оптимизации терапевтических подходов и для предиктивной и прогностической информации для пациентов с раком легких. Соответственно, сохраняется необходимость в новых способов прогнозирования, оценки и лечения пациентов, страдающих раком легких. По-прежнему сохраняется неудовлетворенная и острая потребность в низкомолекулярных модуляторах, обладающих специфичностью в отношении Stim1 и/или Orai1 для регуляции и/или модуляции активности каналов CRAC, в частности, для лечения заболеваний и расстройств, связанных с CRAC. Сущность изобретения Настоящее изобретение относится к соединениям формулы (I), способам их получения, содержащим их композициям и способам лечения с их помощью. В частности, соединения формулы (I) и их фармацевтически приемлемые соли являются модуляторами ионных каналов, активируемых высвобождением кальция, полезными для лечения, предупреждения, ингибирования и/или улучшения заболеваний или расстройств, связанных с ионными каналами,активируемыми высвобождением кальция. В одном аспекте настоящего изобретения представлено соединение формулы (I) или его таутомер, его пролекарство, его N-оксид, его фармацевтически приемлемый сложный эфир или его фармацевтически приемлемая соль, где кольцо Ну представляет собой кольцо Ну необязательно замещено R'";R1 и R2 являются одинаковыми или различными и независимо выбраны из СН 3, CH2F, CHF2, CF3,С(3-5) циклоалкила, при условии, что: а) R1 и R2 не представляют собой одновременно CF3,б) R1 и R2 не представляют собой одновременно СН 3,в) если R1 является CF3, то R2 не является СН 3, и г) если R1 является СН 3, то R2 не является CF3; кольцо Ar представляет собой(i) T выбран из CRa и N, причем Ra представляет собой галоген, и каждый из U, V и W независимо выбран из CRa и N, причем Ra в каждом случае представляет собой водород или галоген; или(ii) каждый из Т, U, V и W независимо выбран из CRa и N, при этом Ra в каждом случае представляет собой водород или галоген, при условии что по меньшей мере один из Т, U, V и W представляет собойL1 и L2 вместе представляют собой -NH-C(=O)-, -C(=O)NH- или -NH-CR'R; А отсутствует или выбран из -(CR'R")-, -NH;R' и R представляют собой водород, или R' и R могут быть объединены с образованием циклопропильного, циклобутильного, циклопентильного или циклогексильного кольца;Cy выбран из моноциклического гетероциклила, фенила и моноциклического гетероарила; в каждом случае q независимо представляет собой целое число 0, 1 или 2; при условии (е), что соединение формулы (I) не является:N-бензил-6-(3,5-дициклопропил-1 Н-пиразол-1-ил)пиридазин-3-амином. В одном предпочтительном варианте R1 является циклопропилом. В одном предпочтительном варианте R2 является CF3. В соответствии с одним предпочтительным вариантом Ну является Дополнительно предпочтительным является соединение формулы (I), где Ну является Дополнительно предпочтительным является соединение формулы (I), где Ну является В соответствии с одним предпочтительным вариантом Аr является Дополнительно предпочтительным является соединение формулы (I), где Ar является В соответствии с одним предпочтительным вариантом L1 и L2 вместе представляют собой -NHC(=O)-, -C(=O)NH- или -NH-CH2-. В соответствии с одним предпочтительным вариантом А отсутствует или выбран из -(CR'R")- или-NH. Более предпочтительно А является -CH2- или -(CR'R")-,где R' и R соединены с образованием 3-6-членного кольца. Дополнительно предпочтительным является соединение формулы (I), где А является Дополнительно предпочтительным является соединение формулы (I), где А является Дополнительно предпочтительным является соединение формулы (I), где А отсутствует. Дополнительно предпочтительным является соединение формулы (I), где А является -CH2-. В соответствии с одним предпочтительным вариантом Су является Дополнительно предпочтительным является соединение формулы (I), где Су является Дополнительно предпочтительным является соединение формулы (I), где Су является Дополнительно предпочтительным является соединение формулы (I), где Су является Другой вариант является соединением, имеющим формулу (IA) или его таутомером, его пролекарством, его N-оксидом, его фармацевтически приемлемым сложным эфиром или его фармацевтически приемлемой солью, где переменные (напр., R'", R1, R2, T, U, V, W,L1, L2, А и Су) определяются так, как описано выше в отношении формулы (I), при условии, что соединения соединение формулы (IA) не является каким-либо соединением условий (а-е), как определено выше. Другой вариант является соединением, имеющим формулу (IA-I) или его таутомером, его пролекарством, его N-оксидом, его фармацевтически приемлемым сложным эфиром или его фармацевтически приемлемой солью, где переменные (напр, R'", R1, R2, T, U, V, W,А и Су) определяются так, как описано выше в отношении формулы (I), при условии, что соединение формулы (IA) не является каким-либо соединением условий (а-е), определенных выше. Дополнительно предпочтительным является соединение формулы (IA-I) или его таутомер, его пролекарство, его N-оксид, его фармацевтически приемлемый сложный эфир или его фармацевтически приемлемая соль, гдеR1 и R2 являются одинаковыми или различными, и независимо выбраны из CH2F, CHF2, CF3 и циклопропила; при условии, чтоa) R1 и R2 не представляют собой одновременно CF3;R является водородом или галогеном; Т, U, V, W независимо являются CRa или N;Ra является водородом или галогеном; А отсутствует; и Су выбран из моноциклического арила или моноциклического гетероарила, при условии, что соединение формулы (IA) не является каким-либо соединением в условии (е), определенном выше. Дополнительно предпочтительным является соединение формулы (IA-I), где оба R1 и R2 представляют собой циклопропил. Дополнительно предпочтительным является соединение формулы (IA-I), где один из R1 и R2 является CF3, а другой является циклопропилом. Дополнительно предпочтительным является соединение формулы (IA-I), где R1 является циклопропилом, a R2 является CF3. Дополнительно предпочтительным является соединение формулы (IA-I), где Т, U, V, W являются СН, CF или N. Дополнительно предпочтительным является соединение формулы (IA-I), где Т является CF или N, и каждый из U, V и W является СН. Дополнительно предпочтительным является соединение формулы (IA-I), где каждый из Т и V является CF или N, и каждый из U и W является СН. Дополнительно предпочтительным является соединение формулы (IA-I), где А отсутствует. Дополнительно предпочтительным является соединение формулы (IA-I), где Су выбран из Дополнительно предпочтительным является соединение формулы (IA-I), где Су является Другой вариант является соединением, имеющим формулу (IA-III) или его таутомер, пролекарство, N-оксид, фармацевтически приемлемый сложный эфир или фармацевтически приемлемая соль, гдеR1 и R2 являются одинаковыми или различными, и независимо выбраны из CH2F, CHF2, CF3, циклопропила, при условии, что оба R1 и R2 не представляют собой одновременно CF3,Т выбран из CF и N, и каждый из U, V и W независимо выбран из СН, CF, и N;L1 и L2 вместе представляют собой -NH-C(=O)-, -C(=O)NH-, или -NH-CR'R"-; А отсутствует или выбран из -(CR'R )- и -NH;R' и R представляют собой водород, или R' и R могут быть объединены с образованием циклопропильного, циклобутильного, циклопентильного или циклогексильного кольца;R представляет собой водород или галоген; Су выбран из моноциклического гетероциклила, моноциклического арила и моноциклического гетероарила, в каждом случае q независимо представляет собой 0, 1 или 2. Дополнительно предпочтительным является соединение формулы (IA-III), где оба R1 и R2 представляют собой циклопропил. Дополнительно предпочтительным является соединение формулы (IA-III), где один из R1 и R2 является CF3, а другой является циклопропилом. Дополнительно предпочтительным является соединение формулы (IA-III), где один из R1 и R2 является CF3, а другой является CH2F, CHF2. Дополнительно предпочтительным является соединение формулы (IA-III), где R1 является циклопропилом, a R2 является CF3. Дополнительно предпочтительным является соединение формулы (IA-III), где Т является CF или N. Дополнительно предпочтительным является соединение формулы (IA-III), где U, V, W являются СН, CF или N. Дополнительно предпочтительным является соединение формулы (IA-III), где L1 и L2 вместе представляют собой -NH-C(=O)-, C(=O)NH- или -NH-CH2-. Дополнительно предпочтительным является соединение формулы (IA-III), где А отсутствует, является -NH- или -CH2-. Дополнительно предпочтительным является соединение формулы (IA-III), где Су выбран из Дополнительно предпочтительным является соединение формулы (IA-III), где Су выбран из Типичные соединения настоящего изобретения включают соединения, указанные ниже и в табл. 1, а также их фармацевтически приемлемые соли. Настоящее изобретение не следует толковать, как ограничивающееся ими.N-4-[5-циклопропил-3-(дифторметил)-1 Н-пиразол-1-ил]-3-фторфенил-2,6-дифторбензамид; или их таутомер, пролекарство, N-оксид, фармацевтически приемлемый сложный эфир или фармацевтически приемлемая соль. Таблица 1 Соединения настоящего изобретения (напр., соединения формул I, IA, IA-I и/или IA-III, включая их фармацевтически приемлемые сложные эфиры и соли) являются полезными для лечения, предупреждения, ингибирования и/или улучшения заболеваний и нарушений, связанных с ионными каналами, активируемым высвобождением кальция (CRAC). Другой вариант настоящего изобретения является способом лечения заболевания или нарушения посредством модуляции каналов CRAC путем введения пациенту, нуждающемуся в таком лечении, эффективного количества соединения настоящего изобретения (напр., соединения формулы I, IA, IA-I и/или IA-III), как определено выше. Другой вариант настоящего изобретения является способом лечения заболевания или нарушения посредством модуляции каналов CRAC путем введения пациенту, нуждающемуся в таком лечении, эффективного количества соединения настоящего изобретения (напр., соединения формулы I, IA, IA-I и/или IA-III), как определено выше, в комбинации (одновременно или последовательно), по меньшей мере, с одним другим противовоспалительным средством. Соединения настоящего изобретения могут ингибировать депо-управляемые кальциевые входы, нарушать связь единиц SOCE, изменять функциональные взаимодействия белков, образующих комплексы депо-управляемых кальциевых каналов, и изменять функциональные взаимодействия STIM1 с Orai1. Эти соединения являются блокаторами пор каналов SOC и блокаторами пор каналов CRAC. Соединения,описанные в настоящем документе, модулируют внутриклеточный кальций и используются при лечении заболеваний, нарушений или состояний, в которых модуляция внутриклеточного кальция имеет благотворный эффект. В одном варианте соединения, описанные в настоящем документе, ингибируют депоуправляемые кальциевые входы. В одном варианте соединения настоящего изобретения, способные модулировать внутриклеточные уровни кальция, нарушают связь единиц SOCE. В другом варианте соединения настоящего изобретения способные модулировать внутриклеточные уровни кальция, изменяют функциональные взаимодействия белков, образующих комплексы депо-управляемых кальциевых каналов. В одном варианте соединения настоящего изобретения, способные модулировать внутриклеточные уровни кальция, изменяют функциональные взаимодействия STIM1 с Orai1. В одном варианте соединения настоящего изобретения, способные модулировать внутриклеточные уровни кальция, являются блокаторами пор каналов SOC. В других вариантах соединения настоящего изобретения, способные модулировать внутриклеточные уровни кальция, являются блокаторами пор каналов CRAC. В одном аспекте соединения настоящего изобретения, способные модулировать внутриклеточные уровни кальция, ингибируют электрофизиологический ток (Isoc), напрямую связанный с активированными каналами SOC. В одном аспекте соединения, способные модулировать внутриклеточные уровни кальция, ингибируют электрофизиологический ток (ICRAC), напрямую связанный с активированными каналами CRAC. Соединения настоящего изобретения полезны для лечения заболеваний, состояний или нарушений,благодаря модуляции внутриклеточного кальция, включая, но не ограничиваясь этим, иммунные системные заболевания (напр., аутоиммунные заболевания), заболевания или нарушения, включающие воспаление (напр., астму, хроническое обструктивное заболевание легких, ревматоидный артрит, воспалительную болезнь кишечника, гломерулонефрит, нейровоспалительные заболевания, рассеянный склероз,увеит и расстройства иммунной системы), рак и другие пролиферативные заболевания, заболевания или нарушения печени и заболевания или нарушения почек. В одном варианте соединения, описанные в настоящем документе, используются в качестве иммуносуппресантов для предотвращения (или ингибирования) отторжения при трансплантации, отторжения аллогенных или ксеногенных трансплантатов (органы, костный мозг, стволовые клетки, другие клетки и ткани) и/или заболевания "трансплантат против хозяина". Например, соединения настоящего изобретения могут использоваться для предотвращения(или ингибирования) отторжения трансплантата в результате трансплантации ткани или органа. Соединения настоящего изобретения могут использоваться также для предотвращения (или ингибирования) заболевания "трансплантат против хозяина" в результате трансплантации костного мозга или стволовых клеток. Более конкретно, соединения формулы I, IA, IA-I и/или IA-III являются полезными для лечения различных воспалительных заболеваний, включая, но не ограничиваясь этим, воспаления, гломерулонефрит, увеит, заболевания или расстройства печени, заболевания или расстройства почек, хронические обструктивные заболевания легких, ревматоидный артрит, воспалительные заболевания кишечника, васкулит, дерматит, остеоартроз, воспалительные заболевания мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, отторжение аллогенного или ксеногенного трансплантата, отторжение при трансплантации, заболевания "трансплантат против хозяина", системную красную волчанку, диабет I типа, легочный фиброз, дерматомиозит, тиреоидит, миастению, аутоиммунную гемолитическую анемию, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз печени, аллергический конъюнктивит, гепатит и атопический дерматит, астму и синдром Шегрена. Соединения, описанные в настоящем документе, модулируют активность, модулируют взаимодействие или связываются или взаимодействуют по меньшей мере с одной частью белков в депоуправляемом комплексе кальциевого канала. В одном варианте соединения, описанные в настоящем до- 12024630 кументе, модулируют активность, модулируют взаимодействие или связываются или взаимодействуют,по меньшей мере, с одной частью белков в комплексе ионного канала, активируемого высвобождением кальция. В одном варианте соединения, описанные в настоящем документе, снижают уровень функциональных комплексов депо-управляемых ионных каналов. В другом варианте соединения, описанные в настоящем документе, снижают уровень активированных комплексов депо-управляемых ионных каналов. В дополнительном варианте комплексы депо-управляемых ионных каналов являются комплексами ионных каналов, активированных высвобождением кальция. Соединения настоящего изобретения, способные модулировать внутриклеточный уровень кальция для лечения заболеваний или нарушений, при введении пациенту, страдающему заболеванием или нарушением, эффективно снижают, улучшают или исключают симптом или проявление заболевания, состояния или нарушения. В других вариантах соединения описанные в настоящем документе, вводятся пациенту, предрасположенному к заболеванию, состоянию или нарушению, у которого еще не проявились симптомы заболевания, состояния или нарушения, и предотвращают или откладывают развитие симптомов. В дополнительных вариантах соединения настоящего изобретения обладают такими эффектами самостоятельно или в комбинации с другими агентами, или действуют для усиления терапевтического эффекта другого агента. За счет ключевой роли кальция в регуляции клеточной пролиферации в целом, ингибиторы ионных каналов могут действовать как обратимые цитостатические агенты, которые могут быть полезными для лечения любых болезненных процессов, которые характеризуются аномальной клеточной пролиферацией, напр., доброкачественной гиперплазии предстательной железы, наследственного аденоматозного полипоза, нейро-фиброматоза, атеросклероза, фиброза легких, артрита, псориаза, гломерулонефрита, рестеноза после ангиопластики или сосудистой хирургии, гипертрофического формирования рубца, воспалительных заболеваний кишечника, отторжения при трансплантации, эндотоксического шока и грибковых инфекций. Соединения настоящего изобретения, как модуляторы апоптоза, являются полезными для лечения рака (включая, но не ограничиваясь этим, вышеупомянутые типы), вирусных инфекций (включая, но не ограничиваясь этим, вирус герпеса, поксвирус, вирус Эпштейна-Барра, вирус Синдбиса и аденовирусы),профилактики развития СПИДа у ВИЧ-инфицированных лиц, аутоиммунных заболеваний (включая, но не ограничиваясь этим, системную красную волчанку, волчанку, аутоиммунный гломерулонефрит, ревматоидный артрит, псориаз, воспалительные заболевания кишечника и аутоиммунный сахарный диабет),нейродегенеративных заболеваний (включая, но не ограничиваясь этим, болезнь Альцгеймера, деменцию, связанную со СПИДом, болезнь Паркинсона, боковой амиотрофический склероз, пигментный ретинит, спинальную мышечную атрофию и мозжечковую дегенерацию), миелодиспластического синдрома, апластической анемии, ишемической травмы, связанной с инфарктом миокарда, инсульта и реперфузии, аритмии, атеросклероза, заболеваний печени, вызванных токсинами или алкоголем, гематологических заболеваний (включая, но не ограничиваясь этим, хроническую анемию и апластическую анемию),дегенеративных заболеваний опорно-двигательного аппарата (включая, но не ограничиваясь этим, остеопороз и артрит), аспирин-чувствительного риносинусита, муковисцидоза, рассеянного склероза, болезни почек и боль при раке. Соединения настоящего изобретения могут модулировать уровень клеточного синтеза РНК и ДНК. Поэтому эти агенты являются полезными для лечения вирусных инфекций(включая, но не ограничиваясь этим, ВИЧ, вирус папилломы человека, вирус герпеса, поксвирус, вирус Эпштейна-Барра, вирус Синдбиса и аденовирус). Соединения настоящего изобретения являются полезными для химиопрофилактики рака. Химиопрофилактика определяется как замедление развития инвазивного рака путем блокирования инициирующих мутагенных событий или путем блокирования развития пред-раковых клеток, которые являются уже поврежденными, или ингибирование рецидива опухоли. Эти соединения являются также полезными для замедления ангиогенеза опухоли и метастаза. Соединения настоящего изобретения являются также полезными в комбинации (при совместном или последовательном введении) с известными противораковыми способами лечения, такими как лучевая терапия, или с цитостатическими или цитоксическими или противораковыми средствами, такими как, например, но не ограничиваясь этим, ДНК-взаимодействующие средства, такие как цисплатин или доксорубицин; ингибиторы топоизомеразы II, такие как этопозид; ингибиторы топоизомеразы I, такие как СРТ-11 или топотекан; тубулин-взаимодействующие средства, такие как паклитаксел, доцетаксел или эпотилоны (например, иксабепилон), природного или синтетического происхождения; гормональными средствами, такими как тамоксифен; ингибиторами тимидилат синтазы, такими как 5-фторурацил; и антиметаболитами, такими как метотрексат, другими ингибиторами тирозинкиназы, такими как Iressa иOSI-774; ингибиторами ангиогенеза; ингибиторами EGF; ингибиторами VEGF; ингибиторами CDK; ингибиторами SRC; ингибиторами c-Kit; ингибиторами Her1/2 и моноклональными антителами, направленными против рецепторов фатора роста, такими как эрбитукс (EGF) и герцептин (Her3), а также другими модуляторами протеинкиназы. В настоящем изобретении дополнительно представлены фармацевтические композиции, включающие одно или более соединений формулы I, IA, IA-I и/или IA-III, и фармацевтически приемлемый носи- 13024630 тель. Другой вариант настоящего изобретения является лекарственной формой, включающей одно или более соединений настоящего изобретения, необязательно с фармацевтически приемлемым носителем. Лекарственная форма может быть, например, твердой лекарственной формой для перорального применения, такой как таблетки или капсулы. Подробное описание изобретения Если не определено иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно подразумевается в области, к которой относится заявленный предмет обсуждения. В случае, если существует несколько определений используемых в настоящем документе терминов, преимуществом обладает то, которое описано в данном разделе. Следует понимать, что изложенное выше общее описание и следующее подробное описание являются лишь примерными и пояснительными, и не являются ограничивающими заявленный предмет обсуждения. В настоящей заявке применение единственного числа включает множественное число, если специально не оговорено иное. Следует отметить, что в настоящем описании и приложенной формуле изобретения единственное число включает ссылку на множественное число, если из контекста очевидно не следует обратное. В настоящее заявке использование "или" означает "и/или", если не указано иное. Кроме того, использование термина "включая", а также других форм, таких как "включают", "включает" и "включен", не является ограничивающим. Определение стандартных терминов химии и молекулярной биологии можно найти в справочных изданиях, включая, но не ограничиваясь этим, Carey and Sundberg "ADVANCED ORGANIC CHEMISTRY 4th edition" Vols. A (2000) and В (2001), Plenum Press, New York и "MOLECULAR BIOLOGY OF THECELL 5th edition" (2007), Garland Science, New York. Если не указано иное, то обычные способы массспектроскопии, ЯМР, ВЭЖХ, белковой химии, биохимии, методик рекомбинантной ДНК и фармакологии, являются подразумевающимися в рамках вариантов, описанных в настоящем документе. Если не даны конкретные определения, то используемая номенклатура, лабораторные методики и способы, аналитическая химия, и медицинская и фармацевтическая химия, описанные в настоящем документе, являются такими, как используются в обычной практике. В некоторых вариантах стандартные методики используются для химических анализов, фармацевтического приготовления, составления композиций и доставки, а также для лечения пациентов. В других вариантах стандартные методики используются для рекомбинатной ДНК, синтеза олигонуклеотидов, и культур тканей и трансформации (напр.,электропорации, липофекции). В более точных вариантах методики реакций и очистки выполнены, например, с использованием наборов по спецификациям производителя, или так, как описано в настоящем документе. Вышеупомянутые способы и методики обычно выполняются стандартными способами и так,как описано в различных общих и более подробных ссылках, цитируемых и рассматриваемых в настоящем описании. В настоящем документе следует использовать следующие определения, если не указано иное. Дополнительно многие из групп, определенных в настоящем документе, могут быть необязательно замещенными. Перечень заместителей в определении является примерным, и его не следует толковать как ограничение заместителей, определенных где-либо в настоящем описании. Термин "алкил" относится к углеводородному радикалу с прямой или разветвленной цепью, состоящему только из атомов углерода и водорода, не содержащему ненасыщенности, имеющему от одного до восьми атомов углерода, и который присоединен к остальной части молекулы посредством одинарной связи, напр., метил, этил, н-пропил, 1-метилэтил (изопропил), н-бутил, н-пентил и 1,1-диметилэтил(трет-бутил). Термин " (C1-6) алкил" относится к алкильной группе, как определено выше, имеющей до 6 атомов углерода. Термин "алкенил" относится к алифатической углевродородной группе, содержащий двойную углерод-углеродную связь, и который может иметь прямую или разветвленную цепь, имеющую от 2 до 10 атомов углерода, напр., этенил, 1-пропенил, 2-пропенил (аллил), изо-пропенил, 2-метил-1-пропенил, 1 бутенил и 2-бутенил. Термин " (C1-6) алкенил" относится к алкенильной группе, как определено выше,имеющей до 6 атомов углерода. Термин "алкинил" относится к углеводородому радикалу с прямой или разветвленной цепью, имеющему, по меньшей мере, одну тройную углерод-углеродную связь, и имеющему от 2 до 12 атомов углерода (предпочтительными являются радикалы, имеющие от 2 до до 10 атомов углерода), например,этинил, пропинил и бутинил. Термин "(C1-6) алкинил" относится к алкинильной группе, как определено выше, имеющей до 6 атомов углерода. Термин "алкокси" обозначает алкильную группу, как определено выше, присоединенную через кислородный мостик к остальной части молекулы. Типичными примерами этих групп являются -ОСН 3 и ОС 2 Н 5. Термин "циклоалкил" обозначает неароматическую моно- или мультициклическую кольцевую систему, имеющую от 3 до 12 атомов углерода, такую как циклопропил, циклобутил, циклопентил и циклогексил. Не ограничивающие примеры мультициклических циклоалкильных групп включают пергидро- 14024630 нафтиловую, адамантиловую, норборниловую группы (мостиковые циклические группы) или спиробициклические группы, например, спиро (4,4) нон-2-ил. Термин "циклоалкилалкил" относится к циклическому содержащему кольцо радикалу, содержащему от 3 до 8 атомов углерода, напрямую присоединенных к алкильной группе, которая затем присоединена к основной структуре любым углеродом в алкильной группе, что приводит к образованию стабильной структуры, такой как циклопропилметил, циклобутилэтил и циклопентилэтил. Термин "циклоалкенил" относится к циклическому содержащему кольцо радикалу, содержащему в кольце от 3 до 8 атомов углерода по меньшей мере с одной двойной углерод-углеродной связью, такому как циклопропенил, циклобутенил и циклопентенил. Термин "арил" относится к ароматическому радикалу, имеющему от 6 до 20 атомов углерода, такому как фенил, нафтил, тетрагидронафтил, инданил и бифенил. Термин "арилалкил" относится к ариловой группе, как определено выше, напрямую связанной с алкильной группой, как определено выше, напр., -CH2C6H5 и -С 2 Н 5 С 6 Н 5. Термин "гетероциклическое кольцо" относится к неароматическому 3-15-членному радикалу, который состоит из атомов углерода и, по меньшей мере, одного гетероатома, выбранного из группы, состоящей из азота, фосфора, кислорода и серы. Для целей настоящего изобретения гетероциклический кольцевой радикал может быть моно-, би-,три- или тетрациклической кольцевой системой, которая может включать конденсированные, мостиковые или спирокольцевые системы, и атомы азота, фосфора, углерода, кислорода или серы в гетероциклическом кольцевом радикале могут быть необязательно окислены до различных окисленных состояний. Кроме того, атом азота может быть необязательно кватернизован. Гетероциклический кольцевой радикал может быть присоединен к основной структуре через любой гетероатом или атом углерода, что приводит к образованию устойчивой структуры. Термин "гетероарил" относится к любому необязательно замещенному 5-14-членному ароматическому кольцу, имеющему один или более атомов, выбранных из N, О и S в качестве кольцевых атомов. Гетероарил может быть моно-, би- или трициклической кольцевой системой. Примеры таких гетероариловых кольцевых радикалов включают, но не ограничиваясь этим, оксазолил, тиазолил, имидазолил,пирролил, фуранил, пиридинил, пиримидинил, пиразинил, бензофуранил, индолил, бензотиазолил, бензоксазолил, карбазолил, хинолил и изохинолил. Гетероариловый кольцевой радикал может быть присоединен к основной структуре через любой гетероатом или атом углерода, что приводит к образованию устойчивой структуры. Примеры таких "гетероциклических кольцевых" или "гетероариловых" радикалов включают, но не ограничиваясь этим, азетидинил, акридинил, бензодиоксолил, бензодиоксанил, бензофуранил, карбазолил, циннолинил, диоксоланил, индолизинил, нафтиридинил, пергидроазепинил, феназинил, фенотиазинил, феноксазинил, фталазинил, пиридил, птеридинил, пуринил, хиназолинил, хиноксалинил, хинолинил, изохинолинил, тетразоил, имидазолил, тетрагидроизохинолил, пиперидинил, пиперазинил, 2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролидинил, 2-оксоазепинил, азепинил, пирролил, 4-пиперидонил, пирролидинил, пиразинил, пиримидинил, пиридазинил, оксазолил, оксазолинил,оксазолидинил, триазолил, инданил, изоксазолил, изоксазолидинил, морфолинил, тиазолил, тиазолинил,тиазолидинил, изотиазолил, хинуклидинил, изотиазолидинил, индолил, изоиндолил, индолинил, изоиндолинил, октагидроиндолил, октагидроизоиндолил, хинолил, изохинолил, декагидроизохинолил, бензимидазолил, тиадиазолил, бензопиранил, бензотиазолил, бензооксазолил, фурил, тетрагидрофурил, тетрагидропиранил, тиенил, бензотиенил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, диоксафосфоланил, оксадиазолил, хроманил, изохроманил и т.п. Термин "гетероарилалкил" относится к гетероариловому кольцевому радикалу, как определено выше, напрямую связанному с алкильной группой. Гетероарилалкильный радикал может быть присоединен к основной структуре через любой атом углерода алкильной группы, что приводит к образованию устойчивой структуры. Термин "гетероциклилалкил" относится к гетероциклическому кольцевому радикалу, как определено выше, напрямую связанному с алкильной группой. Гетероциклилалкильный радикал может быть присоединен к основной структуре через атом углерода алкильной группы, что приводит к образованию устойчивой структуры. Термин "замещенный", если не указано иное, относится к замещению любой из комбинаций следующих заместителей: водород, гидрокси, галоген, карбоксил, циано, нитро, оксо (=O),тио(=S) Замещенный или незамещенный алкил, замещенный или незамещенный алкокси, замещенный или незамещенный алкенил, замещенный или незамещенный алкинил, замещенный или незамещенный арил, замещенный или незамещенный арилалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный циклоалкенил, замещенный или незамещенный арил, замещенный или незамещенный гетероарил, замещенное или незамещенное гетероциклилалкильное кольцо, замещенный или незамещенный гетероарилалкил, замещенное или незамещенное гетероциклическое кольцо, замещенный или незамещенный гуанидин, -COORx, -C(O)Rx, -C(S)Rx, -C(O)NRxRy, -C(O)ONRxRy, -NRyRz,-NRxCONRyRz, -N(Rx)SORy, -N(Rx)SO2Ry, -(=N-N(Rx)Ry), -NRx C(O)ORy, -NRxRy, -NRxC(O)Ry-, -NRxC(S)Ry-ONO2, где Rx, Ry и Rz в каждой из представленных выше групп может быть атомом водорода, замещенным или незамещенным алкилом, замещенным или незамещенным алкокси, замещенным или незамещенным алкенилом, замещенным или незамещенным алкинилом, замещенным или незамещенным арилом, замещенным или незамещенным арилалкилом, замещенным или незамещенным циклоалкилом, замещенным или незамещенным циклоалкенилом, замещенным или незамещенным амино, замещенным или незамещенным арилом, замещенным или незамещенным гетероарилом, замещенным гетероциклилалкильным кольцом, замещенным или незамещенным гетероарилалкилом, замещенным или незамещенным гетероциклическим кольцом, или любые два из Rx, Ry и Rz могут объединяться с образованием замещенного или незамещенного насыщенного или ненасыщенного 3-10-членного кольца, которое может необязательно включать гетероатомы, которые могут быть одинаковыми или различными, и являются выбранными из О, NRx или S. Заместители в вышеупомянутых "замещенных" группах не могут быть дополнительно замещены. Например, если заместитель у "замещенного алкила" является "замещенным арилом", то заместитель у "замещенного арила" не может быть "замещенным алкенилом". Замещение или комбинация заместителей, предполагаемых в настоящем изобретении, предпочтительно являются такими, которые приводят к образованию устойчивого соединения. Термин "галоген" или "гало" относится к радикалам фтора, хлора, брома и йода. Термин "защитная группа" или "PG" относится к заместителю, который используется для блокировки или защиты определенной функциональной группы. Другие функциональные группы соединения могут остаться активными. Например, "защитная группа для аминогруппы" является заместителем, прикрепленным к аминогруппе, блокирующим или защищающим аминную функциональность соединения. Применимые защитные группы для аминогрупп включают, но не ограничиваясь этим, ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-фторенилметиленоксикарбонил(Fmoc). Аналогично, "защитная группа для гидрокси-группы" относится к заместителю гидроксигруппы, который блокирует или защищает гидроксильную функциональность. Подходящие защитные группы для гидроксигрупп включают, но не ограничиваясь этим, ацетил и силил. Термин "защитная группа для карбоксигруппы" относится к заместителю карбоксигруппы, который блокирует или защищает карбоксильную функциональность. Подходящие защитные группы для карбоксигрупп включают, но не ограничиваясь этим, -CH2CH2SO2Ph, цианоэтил, 2-(триметилсилил)этил, 2-(триметилсилил)этоксиметил-1,2-толуолсульфонил)этил, 2-(п-нитрофенилсульфенил)этил-1,2-дифенил-1-фосфино)этил и нитроэтил. Общее описание защитных групп и их применение описано в книге Т. W. Greene, Protective Groupsin Organic Synthesis, John WileySons, New York, 1991. Термин "стереоизомер" относится к соединениям, которые имеют одинаковый химический состав,но отличаются в отношении расположения атомов и групп в пространстве. Они включают энантиомеры,диастереомеры, геометрические изомеры, атропизомеры или конформационные изомеры. Все стереоизомеры соединений, описанных в настоящем документе, входят в рамки настоящего изобретения. Рацемические смеси также охватываются границами настоящего изобретения. Поэтому отдельные стереохимические изомеры, а также энантиомерные, диастереомерные и геометрические (или конформационные) смеси соединений настоящего изобретения находятся в пределах настоящего изобретения. Термин "таутомер" относится к соединениям, которые характеризуются относительно простым взаимопревращением изомерных форм в равновесии. Эти изомеры предполагаются входящими в настоящее изобретение. Термин "пролекарство" относится к соединениям, которые являются неактивными промежуточными веществами соединений, которые превращаются в свою активную форму в организме в ходе нормальных метаболических процессов. Термин "сложный эфир" относится к соединениям, которые образованы по реакции между кислотой и спиртом с отщеплением воды. Сложный эфир может быть представлен формулой RCOOR', где R является основным соединением, a R' является сложноэфирной группой(напр., этиловой группой). Дополнительно настоящее изобретение включает также соединения, которые отличаются только наличием одного или более изотопно обогащенного атома, например, заменой водорода дейтерием и т.п. Фармацевтически приемлемые соли, образующие часть настоящего изобретения, включают соли,полученные из неорганических оснований, таких как Li, Na, К, Са, Mg, Fe, Cu, Zn и Мn; соли органических оснований, таких как N,N'-диацетилэтилендиамин, глюкамин, триэтиламин, холин, гидроксид, дициклогексиламин, метформин, бензиламин, триалкиламин и тиамин; хиральные основания, такие как алкилфениламин, глицинол и фенил глицинол; соли природных аминокислот, таких как глицин, аланин,валин, лейцин, изолейцин, норлейцин, тирозин, цистин, цистеин, метионин, пролин, гидроксипролин,гистидин, омитин, лизин, аргинин и серии; четвертичные аммониевые соли соединений настоящего изобретения с алкилгалогенидами или алкилсульфатами, такие как MeI and (Me)2SO4; неприродных аминокислот, таких как D-изомеры или замещенные аминокислоты; гуанидина или замещенного гуанидина,где заместители выбраны из нитро, амино, алкила, алкенила, алкинила, аммония, или замещенные аммониевые соли и соли алюминия. Соли могут включать соли присоединения кислот, где это уместно, которые являются сульфатами, нитратами, фосфатами, перхлоратами, боратами, гидрогалогенидами, ацета- 16024630 тами, тартратами, малеатами, цитратами, фумаратами, сукцинатами, пальмитатами, метансульфонатами,бензоатами, салицилатами, бензолсульфонатами, аскорбатами, глицерофосфатами и кетоглутаратами. Термин "субъект" или "пациент" охватывает млекопитающих и животных, не являющихся млекопитающими. Примеры млекопитающих включают, но не ограничиваясь этим, любых членов класса млекопитающих: людей, приматов, не являющихся человеком, таких как шимпанзе, и других обезьян и видов обезьян; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; и лабораторных животных, включая грызунов,таких как крысы, мыши и морские свинки. Примеры животных, не являющихся млекопитающими,включают, но не ограничиваясь этим, птиц и рыб. В одном варианте представленных в настоящем документе способов и композиций млекопитающим является человек. Термины "лечить" или "лечение", используемые в настоящем документе, включают облегчение, ослабление или улучшение симптомов заболевания, нарушения или состояния, предотвращение появления дополнительных симптомов, улучшение или предотвращение основных причин симптомов, подавление болезни, нарушения или состояния, например, остановку развития заболевания, нарушения или состояния, облегчение болезни, нарушения или состояния, что приводит к регрессу заболевания, нарушения или состояния, снимая состояние, вызванное заболеванием, нарушением или состоянием, или прекращение симптомов заболевания, нарушения или состояния, профилактически и/или терапевтически. При использовании в настоящем документе термин "белок-мишень" относится к белку или части белка, способной связываться или взаимодействовать с соединением, описанным в настоящем документе, таким как соединение, способное модулировать белок STIM и/или белок Orai. В некоторых вариантах белок-мишень является белком STIM. В других вариантах белком-мишенью является белок Orai, а в других вариантах соединения направлены на оба белка STIM и Orai. Термин "белок STIM" относится к любому белку, расположенному в эндоплазматической сети или плазматической мембране, который активирует увеличение скорости притока кальция в клетку через канал CRAC. (STIM относится к молекуле стромального взаимодействия). Используемый в настоящем документе "белок STIM" включает, но не ограничиваясь этим, STIM-1 млекопитающих, такой как STIM-1 человека и грызунов (напр., мышей), DSTIM Drosophila melanogaster, C-STIM С. elegans, STIM Anopheles gambiae и STIM-2 млекопитающих,такой как STIM-2 человека и грызунов (напр., мышей). Как описано в настоящем документе, установлено, что такие белки включены, участвуют и/или обеспечивают депо-управляемый кальциевый вход или его модуляцию, цитоплазматическую буферизацию кальция и/или модулирование уровней кальция внутрь, или движение кальция внутрь, внутри или из внутриклеточных кальциевых депо (напр., эндоплазматической сети). Под терминами "активирует" или "активация" следует понимать способность белка STIM повышающе регулировать, стимулировать, усиливать или другим способом облегчать поток кальция внутрь клетки через канал CRAC. Предполагается, что взаимное влияние белка STIM и каналаCRAC может возникать как при прямом, так и при косвенном молекулярном взаимодействии. Соответственно, белок STIM является трансмембранным белком, который связан или находится в непосредственной близости канала CRAC. Термин "фрагмент" или "производное", при упоминании в отношении белка (напр., STIM, Orai) означает белки или полипептиды, которые сохраняют, в основном, ту же биологическую функцию или активность по меньшей мере в одном анализе, что и природный(-е) белок(белки). Например, фрагмент или производное эталонного белка преимущественно сохраняет по меньшей мере 50% активности природного белка, по меньшей мере 75% или по меньшей мере 95% активности природного белка, что устанавливается, например, анализом притока кальция. При использовании в настоящем документе, "улучшение" относится к улучшению заболевания или состояния, или, по меньшей мере, частичного облегчения симптомов, связанных с заболеванием или состоянием. При использовании в настоящем документе, улучшение симптомов конкретного заболевания,нарушения или состояния путем введения определения соединения или фармацевтической композиции относится к любому снижению серьезности, задержке возникновения, замедлению развития или сокращению продолжительности, как перманентному, так и временному, долговременному или кратковременному, которые обусловлены или связаны с введением этого соединения или композиции. Термин "модулирует", при использовании в настоящем документе, означает взаимодействие с белком-мишенью, как напрямую, так и косвенно, так, чтобы изменять активность белка-мишени, включая,лишь в качестве примера, ингибирование активности мишени, или ограничение или снижение активности мишени. При использовании в настоящем документе, термин "модулятор" относится к соединению,которое изменяет активность мишени (напр., белка-мишени). Например, в некоторых вариантах, модулятор вызывает увеличение или снижение величины определенной активности мишени по сравнению с величиной этой активности в отсутствие модулятора. В некоторых вариантах модулятор является ингибитором, который снижает величину одной или более активностей мишени. В некоторых вариантах ингибитор полностью предотвращает одну или более активностей мишени. Используемый в настоящем документе термин "модуляция" в отношении внутриклеточного кальция относится к любому изменению или регулировке внутриклеточного кальция, включая, но не ограничиваясь, изменение концентрации кальция в цитоплазме и/или внутриклеточных органеллах хранения кальция, напр., эндоплазматической сети, или изменение кинетики кальциевых потоков внутрь, наружу и внутри клеток. В одном аспекте модуляция относится к снижению. Термины "ингибирует", "ингибирование" или "ингибитор" активности канала SOC или активности канала CRAC, используемые в настоящем документе, относятся к ингибированию активности депо-управляемых кальциевых каналов или активности кальциевых каналов, управляемых высвобождением кальция. Термин "приемлемый" в отношении рецептуры, композиции или компонента, используемый в настоящем документе, означает отсутствие устойчивого отрицательного воздействия на общее здоровье пациента, проходящего лечение. Термин "фармацевтически приемлемый" относится к молекулярным частицам и композициям, которые являются физиологически переносимыми и обычно не дают аллергических или аналогичных неблагоприятных реакций, таких как расстройство желудка, головокружение, при введении человеку. Предпочтительно, при использовании в настоящем документе термин "фармацевтически приемлемый" означает одобренный регулирующим органом федерального или государственного руководства, или перечисленный в Фармакопее США или других общепринятых фармакопеях для применения для животных, и более предпочтительно для людей. Термин"фармацевтическая композиция" относится к смеси соединения настоящего изобретения с другими химическими компонентами, такими как носители, стабилизаторы, разбавители, диспергирующие агенты,суспендирующие агенты, загущающие агенты и/или формообразующие вещества. Соединения и фармацевтические композиции настоящего изобретения могут вводиться различными способами введения, включая, но не ограничиваясь этим, внутривенное, пероральное, аэрозольное,парентеральное, глазное, пульмональное и местное введение. Термины "эффективное количество" или "терапевтически эффективное количество", при использовании в настоящем документе относятся к достаточному количеству вводимого средства или соединения,которое облегчает до некоторой степени один или более симптомов заболевания или состояния, подлежащего лечению. Результатом является снижение и/или смягчение признаков, симптомов или причин заболевания, или любые другие желаемые изменения биологической системы. Например, "эффективное количество" для терапевтического применения является количеством соединения настоящего изобретения, необходимым для обеспечения клинически значимого снижения симптомов заболевания. В некоторых вариантах соответствующее "эффективно" количество в каждом индивидуальном случае определяется с использованием методик, таких как исследование с увеличением дозы. Термин "усиление", используемый в настоящем документе, означает увеличение или пролонгирование силы или продолжительности желаемого эффекта. Так, в отношении усиления эффекта терапевтических средств, термин"усиление" относится к способности увеличивать или пролонгировать силу или продолжительность действия других терапевтических средств на систему. Термин "количество, эффективное для усиления", используемый в настоящем документе, относится к количеству, достаточному для усиления действия другого терапевтического средства в заданной системе. Термин "носитель", используемый в настоящем документе, относится к относительно нетоксичным химическим соединениям или агентам, которые облегчают внедрение соединения в клетки или ткани. Термин "разбавитель" относится к химическим соединениям, которые используются для разбавления заданного соединения перед его доставкой. В некоторых вариантах разбавители используются для стабилизации соединений, поскольку они обеспечивают более стабильную среду. Соли, растворенные в буферных растворах (которые также обеспечивают контроль рН или его поддержание), используются в качестве разбавителей, включая, но не ограничиваясь этим, фосфатный буферный солевой раствор. При использовании в настоящем документе, термин "внутриклеточный кальций" относится к кальцию, расположенному в клетке без определения конкретного клеточного расположения. В противоположность этому, "цитозольный" или "цитоплазматический" в отношении кальция, относится к кальцию,расположенному в цитоплазме клетки. При использовании в настоящем документе, влияние на внутриклеточный кальций является любым изменением любого аспекта внутриклеточного кальция, включая, но не ограничиваясь этим, изменение внутриклеточного уровня кальция, расположения и движения кальция внутрь, наружу или внутри клетки или внутриклеточного кальциевого депо или органеллы. Например, в некоторых вариантах влияние на внутриклеточный кальций является изменением свойств, таких как, например, кинетика, чувствительность, скорость, амплитуда и электрофизиологические характеристики потока кальция или движения,которое возникает в клетке или ее части. В некоторых вариантах влияние на внутриклеточный кальций является изменением любого внутриклеточного кальций-модулирующего процесса, включая депоуправляемый кальциевый вход, цитозольная буферизация кальция и уровни кальция внутри, или движение кальция внутрь, наружу или внутри внутриклеточного кальциевого депо. Любой из этих аспектов оценивается различными способами, включая, но не ограничиваясь этим, оценку уровня кальция или другого иона (в частности, катиона), движения кальция или другого иона (в частности, катиона), колебания уровня кальция или другого иона (в частности, катиона), кинетики потоков кальция или другого иона (в частности, катиона) и/или транспорт кальция или другого иона (в частности, катиона) через мембрану. Изменение является любым статистически значимым отклонением. Так, например, в некоторых вариантах, если указывается, что внутриклеточный кальций в исследуемой клетке и контрольной клетке различны, то эта разница является статистически значимой разницей. Модуляция внутриклеточного кальция является изменением или регулировкой внутриклеточного кальция, включая, но не ограничиваясь этим, изменение концентрации кальция или уровня в цитоплазме и/или внутриклеточных органеллах хранения кальция, напр., эндоплазматической сети, изменение движения кальция внутрь, наружу или внутри клетки или внутриклеточного кальциевого депо или органеллы, изменение расположения кальция внутри клетки и изменение кинетики или других свойств, потоков кальция внутрь, наружу или внутри клеток. В некоторых вариантах внутриклеточная модуляция кальция включает изменение или регулировку, напр., сокращение или ингибирование, депо-управляемого кальциевого входа, цитозольной буферизации кальция, уровней кальция внутри, или движения кальция внутрь, наружу или внутри внутриклеточного кальциевого депо или органеллы, и/или основного или остаточного уровня цитозольного кальция. Модуляция внутриклеточного кальция включает изменение или регулировку движения рецептор-опосредованного иона (напр., кальция), движения иона, управляемого вторичным мессенджером (напр., кальция), притока кальция внутрь или оттока кальция из клетки и/или поглощение иона (напр., кальция) или высвобождение из внутриклеточных отделов, включая, например, эндосомы и лизосомы. При использовании в настоящем документе термин "включен" в отношении взаимосвязи между белком и одним аспектом внутриклеточного кальция или регуляцией внутриклеточного кальция, означает, что если экспрессия или активность белка в клетке является пониженной, измененной или исключенной, то существует сопутствующее или связанное снижение, изменение или исключение одного или более аспектов внутриклеточного кальция или регуляции внутриклеточного кальция. Такое изменение или снижение экспрессии или активности возникает в результате действия изменения экспрессии гена, кодирующего белок или путем изменения уровня этого белка. Белок, включенный в аспект внутриклеточного кальция, такой как, например, депо-управляемый кальциевый вход, является, таким образом, белком,который обеспечивает или участвует в аспекте внутриклеточного кальция или регуляции внутриклеточного кальция. Например, белок, обеспечивающий депо-управляемый кальций вход, является белкомSTIM и/или белком Orai. При использовании в настоящем документе, белок, который является компонентом кальциевого канала, является белком, который участвует в мульти-белковом комплексе, образующем этот канал. При использовании в настоящем документе, "катионный вход" или "кальциевый вход" в клетку относится к входу катионов, таких как кальций, во внутриклеточное расположение, такое как цитоплазма клетки, или в полость внутриклеточной органеллы или запасающий центр. Так, в некоторых вариантах,катионный вход является, например, движением катионов в цитоплазму клетки из внеклеточной среды или из внутриклеточной органеллы или запасающего центра, или движение катионов внутрь внутриклеточной органеллы или запасающего центра из цитоплазмы или внеклеточной среды. Движение кальция в цитоплазму из внутриклеточной органеллы или запасающего центра также упоминается как "высвобождение кальция" из органеллы или запасающего центра. При использовании в настоящем документе "реакция клетки" относится к любой клеточной реакции, которая является результатом движения иона внутрь клетки, из нее или внутри клетки. В некоторых вариантах реакция клетки связана с любой клеточной активностью, которая зависит, по меньшей мере, частично, от ионов, таких как, например, кальций. Виды такой активности необязательно включают, например, клеточную активацию, экспрессию генов, эндоцитоз, экзоцитоз, направленную миграцию клеток и апоптическую смерь клеток. При использовании в настоящем документе, "иммунные клетки" включают клетки иммунной системы и клетки, которые выполняют функцию или проявляют активность в иммунной реакции, такие как,но не ограничиваясь этим, Т-клетки, В-клетки, лимфоциты, макрофаги, дендритные клетки, нейтрофилы,эозинофилы, базофилы, мастоциты, клетки плазмы, белые кровяные клетки, антиген-представляющие клетки и природные клетки-киллеры. При использовании в настоящем документе "цитокин" или "цитокины" относится к маленьким растворимым белкам, секретируемым клетками, которые в некоторых вариантах изменяют поведение или свойства секретирующей клетки или другой клетки. Цитокины связываются с рецепторами цитокинов и запускают характеристики или свойства в клетке, например, пролиферацию, гибель или дифференцировку клеток. Примеры цитокинов включают, но не ограничиваясь этим, интерлейкины (напр., IL-2, IL-3, IL4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12, IL-13, IL-15, IL-16, IL-17, IL-18, IL-1.альфа., IL-1.бета. иIL-1 RA), колониестимулирующий фактор гранулоцитов (G-CSF), колониестимулирующий фактор гранулоцитов-макрофагов (GM-CSF), онкостатин М, эритропоэтин, ингибирующий фактор лейкемии (LIF),интерфероны, В 7.1 (известный также как CD80), В 7.2 (известный также как В 70, CD86), члены семейства"Депо-управляемый кальциевый вход" или "SOCE" относится к механизму, по которому высвобождение ионов кальция из внутриклеточных депо координируется притоком ионов через плазматическую мембрану. Клеточный кальциевый гомеостаз является результатом сложения регуляторных систем, включенных в контроль внутриклеточного уровня кальция и его движений. Клеточный кальциевый гомеостаз достигается, по меньшей мере, частично, путем связывания кальция и в результате движения кальция внутрь из наружу клетки через плазматическую мембрану, а также внутри клетки за счет движения кальция через мембраны внутриклеточных органелл, включая, например, эндоплазматическую сеть, саркоплазматическую сеть, митохондрии и эндоцитозные органеллы, включая эндосомы и лизосомы. Движение кальция через клеточные мембраны осуществляется специализированными белками. Например, кальций из внеклеточного пространства поступает в клетку через различные кальциевые каналы и натрий/кальциевый обменник, и активно выдавливается из клетки кальциевыми насосами и натрий/кальциевыми обменниками. Кальций также высвобождается из внутренних депо через инозитолтрифосфатные или рианодиновые рецепторы, и вероятно поглощается этими органеллами посредством кальциевых насосов. Кальций поступает в клетки через один из нескольких основных классов каналов,включая, но не ограничиваясь этим, потенциал-управляемые кальциевые каналы (VOC), депоуправляемые кальциевые каналы (SOC) и натрий/кальциевые обменники, работающие в обратном режиме. Каналы VOC активируются деполяризацией мембраны и находятся в легковозбудимых клетках, таких как нервные и мышечные клетки, и по большей части не присутствуют в невозбудимых клетках. При некоторых условиях Са 2+ также поступает в клетки через Na+-Са 2+ обменники, работающие в обратном режиме. Эндоцитоз представляет другой процесс, в результате которого клетки поглощают кальций из внеклеточной среды через эндосомы. Кроме того, некоторые клетки, напр., экзокринные клетки, высвобождают кальций посредством экзоцитоза. Концентрация цитозольного кальция точно регулируется остаточным уровнем, обычно оцениваемым на уровне около 0,1 мкМ в клетках млекопитающих, тогда как внеклеточная концентрация кальция обычно составляет около 2 мМ. Эта точная регуляция способствует трансдукции сигналов внутрь и внутри клеток за счет временного потока кальция через плазматическую мембрану и мембраны внутриклеточных органелл. Существует большое разнообразие внутриклеточного транспорта кальция и буферных систем в клетках, которые служат для образования сигналов внутриклеточного кальция и поддерживают низкую остаточную концентрацию цитоплазматического кальция. В покоящихся клетках принципиальными компонентами, включенными в поддержание базового уровня кальция, являются кальциевые насосы и утечки в эндоплазматической сети и плазматической мембране. Нарушение остаточного уровня цитозольного кальция влияет на передачу таких сигналов и усиливает дефекты в ряде клеточных процессов. Например, клеточная пролиферация включает пролонгированную кальциевую последовательность сигналов. Другие клеточные процессы включают, но не ограничиваясь этим, секрецию, сигналинг и оплодотворение, включают кальциевый сигналинг. Рецепторы поверхности клетки, активирующие фосфолипазу С (PLC) создают цитозольные Са 2+ сигналы из внутри- и внеклеточных источников. Собственное временное повышение [Са 2+]1 (внутриклеточной концентрации кальция) является результатом высвобождения Са 2+ из эндоплазматической сети(ER), которое запускается продуктом PLC, инозитол-1,4,5-трифосфатом (Р 3), открывая рецепторы IP3 вER (Streb et al. Nature, 306, 67-69, 1983). Затем осуществляется следующая фаза непрерывного поступления Са 2+ через плазматическую мембрану, через специализированные депо-управляемые кальциевые каналы (SOC) (в случае иммунных клеток каналы SOC являются кальциевыми каналами, управляемыми высвобождением кальция (CRAC в плазматической мембране. Депо-управляемый вход Са 2+ (SOCE) является процессом, в котором опустошение хранилищ Са 2+ само активирует каналы Са 2+ в плазматической мембране для облегчения повторного наполнения этих хранилищ (Putney, Cell Calcium, 7, 1-12,1986; Parekh et al, Physiol. Rev. 757-810; 2005).SOCE выполняет больше, чем просто предоставляет Са 2+ для повторного наполнения хранилищ, но и сам создает постоянные сигналы Са 2+, которые контролируют такие важные функции как экспрессия генов, метаболизм клеток и экзоцитоз (Parekh and Putney, Physiol. Rev. 85, 757-810 (2005). В лимфоцитах и мастоцитах активация рецепторов антигена или Fc вызывает высвобождение Са 2+ из внутриклеточных депо, что в свою очередь приводит к притоку Са 2+ через каналы CRAC в плазматической мембране. Последующее повышение внутриклеточного Са 2+ активирует кальциневрин, фосфатазу, которые регулируют фактор транскрипции NFAT. В покоящихся клетках NFAT является фосфорилированным, и находится в цитоплазме, но при дефосфорилировании при помощи кальциневрина NFAT перемещается в ядро и активирует различные генетические программы в зависимости от стимулирующих условий и типа клетки. В ответ на инфекции и во время отторжения трансплантата NFAT взаимодействует с фактором транскрипции АР-1 (Fos-Jun) в ядрах Т-клеток "эффектора", транс-активируя таким образом гены цитокинов, гены, которые регулируют пролиферацию Т-клеток и другие гены, которые управляют активной иммунной реакцией (Rao et al., Annu Rev Immunol, 1997; 15:707-47). Напротив,в Т-клетках, распознающих собственно антигены, NFAT активируется в отсутствие АР-1 и активирует транскрипциональную программу, известную также как "ангергия", которая подавляет аутоиммунные реакции (Macian et al., Transcriptional mechanisms underlying lymphocyte tolerance. Cell. 2002 Jun. 14; 109(6):719-31). В подклассе Т-клеток, известных как регуляторные Т-клетки, которые подавляют аутоиммунитет, опосредованный самореактивными эффекторными Т-клетками, NFAT взаимодействует с фактором транскрипции FOXP3 для активации генов, ответственных за супрессорную функцию (Wu et Эндоплазматическая сеть (ER) осуществляет различные процессы. ER играет роль агонистчувствительного хранилища и приемника Са 2+, в ее полости осуществляется складирование и переработка белка. Здесь многочисленные Са 2+-зависимые сопровождающие белки обеспечивают вновь синтезированным белкам правильное складирование и отправку в соответствующий пункт назначения. ER также включена в везикулярную направленную миграцию, высвобождение стрессовых сигналов, регуляцию метаболизма холестерина и апоптоз. Для многих из этих процессов необходим внутриполостной Са 2+, и неправильное скручивание белков, стрессовые реакции ER и апоптоз вероятно вызываются истощением Са 2+ в ER в течение продолжительного периода времени. Благодаря своей роли как источника Са 2+, понятно, что содержание Са 2+ в ER должно падать после стимуляции. Однако для сохранения функциональной целостности ER жизненно необходимо, чтобы содержание Са 2+ не падало слишком низко или сохранялось на низком уровне. Поэтому повторное наполнение ER ионами Са 2+ является основным процессом для всех эукариотических клеток. Из-за падения содержания Са 2+ в ER активируется депоуправляемые каналы Са 2+ в плазматической мембране, главная функция этого пути входа Са 2+, предположительно, заключается в поддержании уровня Са 2+ в ER, что является необходимым для надлежащего синтеза белков и их складирования. Однако депо-управляемые каналы Са 2+ имеют и другие важные роли. Понимание депо-управляемых кальциевых входов было предоставлено электрофизиологическими исследованиями, в результате которых было установлено, что процесс опустошения депо активирует ток Са 2+ в мастоцитах, именуемый током, активируемым высвобождением Са 2+ или ICRAC- ICRAC является непотенциал-активируемым, внутренне выпрямляемым и заметно селективным для Са 2+. Он обнаруживается в нескольких типах клеток, в основном, гемопоэтического происхождения. ICRAC не является единственным депо-управляемым током, и в настоящее время понятно, что депо-управляемый приток охватывает семейство Са 2+-проницаемых каналов, с различными свойствами в различных типах клеток. ICRAC был первым описанным депо-управляемым током Са 2+, и он остается распространенной моделью изучения депо-управляемых притоков. Влияние соединений или агентов на внутриклеточный кальций может контролироваться при помощи различных методов скрининга/идентификации, которые предназначены для прямой или косвенной оценки или измерения клеточного (включая цитозольные и внутриклеточные органеллы или отделы) кальция и/или движения ионов внутрь, внутри или из клетки, органеллы, кальциевого депо или их частей(напр., мембраны). Для оценки уровней кальция и движения ионов или потоков могут использоваться различные способы. Конкретный используемый способ и применяемые условия зависят от конкретного аспекта внутриклеточного кальция, который подлежит мониторингу или оценке. Например, в некоторых аспектах реагенты и условия могут использоваться для конкретной оценки депо-управляемого кальциевого входа, остаточных уровней цитозольного кальция, буферизации кальция и уровней кальция, а также поглощения или высвобождения внутриклеточными органеллами и кальциевыми депо. Альтернативно,влияние соединения или агента на внутриклеточный кальций может контролироваться или оцениваться с использованием, например, клетки, внутриклеточной органеллы или отдела кальциевого депо, мембраны(включая, напр., обособленный участок мембраны или двойной липидный слой) или бесклеточной системой анализа (напр., внешний мембранный пузырек). В основном, некоторые аспекты внутриклеточного кальция контролируются или оцениваются в присутствии тестового агента и в сравнении с контролем,например, внутриклеточный кальций в отсутствие тестового агента. Заболевания, нарушения или состояния Клинические исследования демонстрируют, что канал CRAC является совершенно необходимым для активации генов, лежащих в основе реакции Т-клеток на антиген. Постоянное поступление кальция необходимо для активации лимфоцитов и адаптивной иммунной реакции. Кальциевый вход в лимфоциты возникает преимущественно через каналы CRAC. Увеличенный кальций приводит к активации NFAT и экспрессии цитокинов, необходимой для иммунной реакции. Ингибирование депо-управляемого кальциевого входа является эффективным путем предотвращения активации Т-клеток. Ингибирование активности канала CRAC при помощи соединений, модулирующих внутриклеточный уровень кальция, предоставляет средства обеспечения иммуноподавляющей терапии, как показано элиминированием депо-управляемого кальциевого входа, замеченного у пациентов с тяжелым комбинированным иммунодефицитом (ТКИД). Т-клетки, фибробласты и в некоторых случаях В-клетки пациентов с иммунодефицитом Т-клеток или ТКИД, имеющих принципиальный дефект активации Т-клеток,демонстрируют существенное нарушение депо-управляемого кальциевого входа. Пациент с ТКИД имеют недостаток адаптивной иммунной реакции, но без повреждения или токсичных явлений в основных органах. Фенотип пациентов с ТКИД показывает, что ингибирование каналов CRAC является эффективной стратегией для иммуноподавления. Заболевания/нарушения, включающие воспаление, и заболевания/нарушения, связанные с иммунной системой. В некоторых вариантах заболевания нарушения или состояния, которые лечатся или предупреждаются с использованием соединений, описанных в настоящем документе, которые способны модулировать внутриклеточные уровни кальция, а также композиции и способы, представленные в настоящем документе для идентификации соединений, способных модулировать внутриклеточные уровни кальция,- 21024630 включают заболевания, состояния или нарушения, включающие воспаление и/или связанные с иммунной системой. Эти заболевания включают, но не ограничиваясь этим, астму, хроническое обструктивное заболевание легких, ревматоидный артрит, воспалительное заболевание кишечника, гломерулонефрит,нейровоспалительные заболевания, такие как рассеянный склероз, и расстройства иммунной системы. Активация нейтрофилов (PMN) за счет воспалительных медиаторов частично достигается за счет увеличения концентрации цитозольного кальция. Предполагается, в частности, что депо-управляемый кальциевый приток играет важную роль в активации PMN. Было показано, что травмы увеличивают депоуправляемый кальциевый приток PMN, и что пролонгированное увеличение концентрации цитозольного кальция в результате увеличенного депо-управляемого кальциевого притока, вероятно, изменяет стимулреакцию, связанную с хемотаксинами и вносит свой вклад в дисфункцию PMN после травмы. Поэтому модуляция цитозольной концентрации кальция PMN посредством депо-управляемых кальциевых каналов может быть полезной для регуляции PMN-опосредованного воспаления и сохранения сердечнососудистой функции после повреждения, шока или сепсиса. Кальций играет критическую роль в активации лимфоцитов. Активация лимфоцитов, напр., путем стимуляции антигенов, приводит к быстрому увеличению внутриклеточной концентрации свободного кальция и активации факторов транскрипции, включая ядерный фактор активированных Т-клеток (NFAT), NF-.каппа.В, JNK1, MEF2 и CREB. NFAT является ключевым транскрипционным регулятором генов IL-2 (и других цитокинов). Постоянное повышение внутриклеточного уровня кальция необходимо для удержания NFAT в транскрипционно активном состоянии, и зависит от депо-управляемого кальциевого входа. Снижение или блокирование депоуправляемого кальциевого входа в лимфоцитах блокирует кальцийзависимую активацию лимфоцитов. Так, в некоторых вариантах, модуляция белка STIM и/или белка Orai и в частности депо-управляемого кальциевого входа (например, снижение, исключение депо-управляемого кальциевого входа) в лимфоцитах является способом лечения иммунных и связанных с иммунной системой нарушений, включая, например, хронические иммунные заболевания/нарушения, острые иммунные заболевания/нарушения,аутоиммунные иммуннодефицитные заболевания/нарушения, заболевания/нарушения, включающие воспаление, отторжение органа-трансплантата и заболевания "трансплантат против хозяина", а также измененных (например, гиперактивных) иммунных реакций. Например, в некоторых вариантах лечение аутоиммунного заболевания/нарушения включает снижение, блокирование или исключение депоуправляемого кальциевого входа в лимфоциты. Примеры иммунных нарушений включают, например, псориаз, ревматоидный артрит, васкулиты,воспалительное заболевание кишечника, дерматит, остеоартрит, бронхиальную астму, воспалительные заболевания мышц, аллергический ринит, вагинит, интерстициальный цистит, склеродермию, остеопороз, экзему, отторжение аллогенных или ксеногенных трансплантатов (органов, костного мозга, стволовых клеток и других клеток и тканей), заболевание "трансплантат против хозяина", системную красную волчанку, воспалительные заболевания, диабет I типа, легочный фиброз, дерматомиозит, синдром Шегрена, тиреоидит (например, Хасимото и аутоиммунный тиреоидит), миастению, аутоиммунную гемолитическую анемию, рассеянный склероз, муковисцидоз, хронический рецидивирующий гепатит, первичный билиарный цирроз печени, аллергический конъюнктивит и аллергический дерматит. В других вариантах соединения, описанные в настоящем документе, которые способны модулировать внутриклеточные уровни кальция, их композиции и способы, представленные в настоящем документе для идентификации соединений, способных модулировать внутриклеточные уровни кальция, используются в связи с лечением злокачественных новообразований, включая, но не ограничиваясь этим,злокачественные новообразования лимфоретикулярного происхождения, рак мочевого пузыря, рак молочной железы, рак толстой кишки, рак эндометрия, рак головы и шеи, рак легких, меланому, рак яичников, рак простаты и рак прямой кишки. Предполагается, что депо-управляемый кальциевый вход играет важную роль в клеточной пролиферации в раковых клетках. Ингибирование SOCE является достаточным для предотвращения пролиферации клеток опухоли. Производное пиразола ВТР-2, прямой блокатор ICRAC ингибирует SOCE и пролиферацию клеток Jurkat и клеток рака толстой кишки. Более того, для стабильного SOCE необходимо митохондриальное поглощение Са 2+, и предупреждение митохондриального поглощения Са 2+ приводит к ингибированию SOCE. Стимуляция клеток Jurkat индуцирует устойчивый SOCE и активацию Са 2+-зависимого фосфатаза кальциневрина, который дефосфорилирует NFAT, промотируя экспрессию интерлейкина-2 и пролиферацию. В других вариантах соединения, способные модулировать внутриклеточные уровни кальция, ингибируют SOCE и используются для лечения рака или других пролиферативных заболеваний или состояний. В некоторых вариантах заболевания нарушения или состояния, которые лечатся или предупреждаются с использованием соединений, описанных в настоящем документе, которые способны модулировать внутриклеточные уровни кальция, а также композиции и способы, представленные в настоящем документе для идентификации соединений, способных модулировать внутриклеточные уровни кальция,включают, например, заболевания и нарушения печени. Эти заболевания, состояния или нарушения включают, но не ограничиваясь этим, повреждение печени, например, в результате трансплантации, гепатита и цирроза. Депо-управляемый кальциевый вход участвует в хроническом заболевании печени, а также в трансплантационном повреждении после консервирования холодом и теплого дезоксигенирования. В некоторых вариантах заболевания, нарушения или состояния, которые лечатся или предупреждаются с использованием соединений, описанных в настоящем документе, которые способны модулировать внутриклеточные уровни кальция, а также композиции и способы, представленные в настоящем документе для идентификации соединений, способных модулировать внутриклеточные уровни кальция,включают заболевания и нарушения почек. Мезангиальная клеточная гиперплазия зачастую является основной особенностью таких заболеваний и нарушений. В других вариантах такие заболевания и нарушения вызваны иммунологическими или другими механизмами повреждения, включая IgAN, мембранопролиферативный гломерулонефрит или волчаночный нефрит. Дисбаланс в управлении репликацией мезангиальных клеток также играет ключевую роль в патогенезе прогрессирующей почечной недостаточности. Обновление мезангиальных клеток в нормальных почках взрослого человека является очень низким со скоростью обновления менее 1%. Яркой особенностью гломерулярных/почечных заболеваний является мезангиальная гиперплазия в результате повышенной скорости пролиферации или пониженной потери мезангиальных клеток. Если мезангиальная клеточная пролиферация индуцируется без потери клеток, например, в результате митогенной стимуляции, то в результате наблюдается мезангиопролиферативный гломерулонефрит. Данные показывают, что регуляторы роста мезангиальных клеток, в частности, факторы роста, предположительно действуют путем регуляции депо-управляемых кальциевых каналов. В других вариантах модуляторы депо-управляемых кальциевых входов способствуют лечению гломерулярных заболеваний путем ингибирования пролиферации мезангиальных клеток. В одном аспекте соединения, описанные в настоящем документе, модулируют внутриклеточный кальций, как например, но не ограничиваясь этим, модулирование (напр., снижение или ингибирование) активности канала SOC, такое как ингибирование активности канала CRAC (напр., ингибирование ICRAC,ингибирование SOCE), в клетках иммунной системы (напр., лимфоцитах, белых кровяных тельцах, Тклетках, В-клетках), фибробластах (или клетках, полученных из фибробластов), или эпидермальных,дермальных или клетках кожи (напр., кератиноцитах). В некоторых вариантах этап модулирования одного или более белков, участвующих в модулировании внутриклеточного кальция (напр., белка STIM и/или белка Orai), включает, например, снижение уровня, экспрессии, активности, функции и/или молекулярного взаимодействия белка. Например, если клетка демонстрирует увеличение уровней кальция или недостаток регуляции одного аспекта модуляции внутриклеточного кальция, например, депо-управляемого кальциевого входа, то в других вариантах модуляция включает снижение уровня, экспрессии, активности или функции, или молекулярного взаимодействия белка, напр., белка STIM и/или белка Orai. В следующей общей методологии, описанной в настоящем документе, представлен способ и методика получения и использования соединений настоящего изобретения, которые являются скорее иллюстративными, чем ограничивающими. Также могут быть разработаны дополнительные модификации представленной методологии и дополнительные новые способы для достижения и осуществления целей настоящего изобретения. Соответственно, следует понимать, что могут быть и другие варианты, которые охватываются общей идеей и рамками настоящего изобретения, как определено в представленном здесь описании. Общий способ получения соединения формулы (I) Соединения настоящего изобретения могут быть получены по следующим способам. Если не указано иное, то все переменные, при использовании в представленной ниже формуле, следует понимать как представляющие те группы, которые описаны выше в отношении формулы (IA). Эти способы могут точно так же применяться для других соединений формулы (I) (напр., I, IA, IA-I, и/или IA-III). На схеме 1 представлен общий способ синтеза соединения формулы (IA), где L1 и L2 вместе являются -NH-CO-, R является водородом или галогеном, а все другие переменные R, R1, R2, T, U, V, W, А и Су являются такими, как описано выше в отношении формулы (IA). Соединения формулы 1 могут реагировать с соединением формулы 2 (напр., фенил гидразином) с образованием соединения формулы 3. Соединение формулы 3 затем можно нитровать, например, с использованием смеси концентрированной H2SO4 и концентрированной HNO3 с образованием соединения формулы 4. Восстановление соединения формулы 4, как, например, при помощи FeCl3 и гидразина, в присутствии активированного угля, дает соответствующее аминное соединение формулы 5 а, где R'" является водородом. Альтернативно, галогенирование с последующим восстановлением соединения формулы 4 дает соответствующее аминное соединение формулы 5b, где R является галогеном. Соединение формулы 5 а или 5b может быть связано с различными другими промежуточными соединениями в присутствии подходящего связывающего агента, с образованием соединения формулы (IA). Соединение формулы 5 а или 5b может быть связано с: i. Су-А-СООН с использованием одного или более амидных связывающих агентов, таких как (бензотриазол-1-илокси)трис(диметиламино) фосфонийгексафторфосфат (реагент ВОР) или N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид (EDC); ii. с хлоридами кислот формулы Су-А-COCl; или iii. изоцианатами формулы Cy-NCO, где А является NH. На схеме 2 представлен общий способ синтеза соединения формулы (IA), где L1 и L2 вместе являются -NH-CO-, R является водородом или галогеном, а все другие переменные R, R1, R2, T, U, V, W, А и Су являются такими, как описано выше в отношении формулы (IA). Этап-1 Этап-1. Кетон формулы а может конденсироваться со сложным эфиром формулы b в присутствии основания, такого как алкоксид металла, напр., этоксид натрия, с получением дикетона формулы 1. Этап-2. Соединение формулы 1 может быть превращено в пиразоловое соединение формулы 2 а по реакции с гидразином. Соединение формулы 2 а может реагировать с соединением формулы 2b, где Lg является уходящей группой (такой как галоген) в присутствии подходящего основания, такого как карбонат щелочного металла, напр., CS2CO3, для получения соединения формулы 4, которое может быть подвержено такой же последовательности преобразований, как описано выше на схеме 1, для получения соединения формулы IA. На схеме 2 А представлен общий способ синтеза соединения формулы (IA), где L1 и L2 вместе являются -CO-NH-, R'" является водородом или галогеном, а все другие переменные R, R1, R2, T, U, V, W, А и Су являются такими, как описано выше в отношении формулы (IA). Соединение формулы 2 а может реагировать с соединением формулы 2 с, где Lg является уходящей группой (такой как галоген) в присутствии подходящего основания, такого как карбонат щелочного металла, напр., CS2CO3, для получения соединения формулы 4 а, которое затем может быть гидролизовано для получения соединения формулы 5 с. Соединение формулы 5 с может быть связано с Cy-A-NH2 с использованием одного или более амидных связывающих агентов, таких как (бензотриазол-1 илокси)трис(диметиламино) фосфонийгексафтор фосфат (реагент ВОР) или N-(3-диметиламинопропш)N'-этилкарбодиимида гидрохлорид (EDC). Такие же способы с определенными модификациями, известными специалистам в данной области, могут использоваться для синтеза соединений формулы I, IA, IA-I и/или IA-III, где переменные следует понимать как представляющие те группы, которые описаны выше в отношении формулы I, IA, IA-I и/или IA-III с использованием соответствующих промежуточных продуктов и реагентов. Экспериментальная часть В настоящем описании используются следующие аббревиатуры: EDC.HCl [N-(3-диметиламинопропил)-N'-этилкарбодиимида гидрохлорид], HOBt [гидроксибензотриазол], TEA (триэтиламин), ДМФ(диметилформамид), AcOEt (этилацетат), ДХМ (дихлорметан), ДМСО (диметилсульфооксид), ТГФ (тетрагидрофуран). Если не упомянуто иное, то выделение продукта реакции включает распределение реакционной смеси между водной и органической фазами, указанными в круглых скобках, разделение и высушивание над Na2SO4 органического слоя и выпаривание растворителя для получения остатка. Если не указано иное, то очистка включает колоночную хроматографию с использованием силикагеля в качестве неподвижной фазы и смеси петролейного эфира (кипящего при 60-80 С) и этилацетата или дихлорметана и метанола соответствующей полярности в качестве подвижных фаз. RT относится к комнатной температуре (-25-28 С). Промежуточное соединение 1. 1,3-Дициклопропилпропан-1,3-дион. Этоксид натрия (8 г, 117,64 ммоль) добавили к раствору циклопропил метил кетона (5 г, 59,4 ммоль) и метил циклопропан карбоксилата (12 мл, 118,9 ммоль) в ДМСО (30 мл). Полученную смесь нагревали при 60 С в течение ночи, а затем охладили до 0 С. После погашения реакционной смеси 6 н. раствором HCl, в результате выделения продукта реакции (Н 2 О/AcOEt) получили указанное в заголовке соединение в виде коричневой жидкости, которое использовали без какой-либо очистки. 1H-ЯМР ( ppm, CDCl3, 400 MHz): 16.05 (bs, 0.6 Н),5.72 (s, 0.6H) 3.78 (s, 0.8H), 2.08-2.0 (m, 0.8H), 1.62-1.53 (m, 1.2H), 1.12-1.05 (m, 4H), 0.97-0.83 (m, 4H). MS(m/z): 153.2 [M+H]+. Промежуточное соединение 2. 1-Циклопропил-4,4,4-трифторбутан-1,3-дион. Использовали способ, описанный для промежуточного соединения 1. Из циклопропил метил кетона(10 мг, 119 ммоль), этил 2,2,2-трифторацетата (29 мл, 237 ммоль), ДМСО (60 мл) и этоксида натрия (16,1 г, 237 ммоль) получили указанное в заголовке соединение (15 г) в виде коричневой жидкости, которое использовали на следующем этапе без очистки. 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 5.65 (s, 2H), 2.16-2.04(m, 1H), 1.18-1.12 (m, 2H), 0.98-0.94 (m, 2H). Промежуточное соединение 3. 4,4,4-Трифтор-1-(фуран-2-ил)бутан-1,3-дион. Использовали способ, описанный для промежуточного соединения 1. Из 1-(фуран-2-ил)этанона (5 г,45,4 ммоль), этил 2,2,2-трифторацетата (12,9 г, 90,8 ммоль), ДМСО (30 мл) и этоксида натрия (6,2 г, 90,8 ммоль) количественно получили указанное в заголовке соединение в виде коричневой жидкости, и использовали его без очистки. 1 Н-ЯМР ( ppm, ДМСО-d6, 400 MHz): 9.10 (bs, 1H), 8.15 (s, 1H), 7.96 (d, J=1,1H), 6.85-6.81 (m, 1H), 6.70 (s, 1H). Промежуточное соединение 4. 3,5-Дициклопропил-1 Н-пиразол. Промежуточное соединение 1 (5,3 г, 35 ммоль) и гидразингидрат (1,8 мл, 38,3 ммоль) в этаноле (20 мл) дефлегмировали в течение ночи. В результате выделения продукта реакции (H2O/AcOEt) после охлаждения смеси до комнатной температуры получили указанное в заголовке соединение в виде твердого коричневого вещества. Т. пл.: 161-164 С. 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 15.2 (bs, 1H), 5.65 (s, 1H),2.16-2.09 (m, 2H), 1.18-1.14 (m, 4H), 0.98-0.94 (m, 4H). MS (m/z): 149.04 [M+H]+. Промежуточное соединение 5. 5-Циклопропил-3-(трифторметил)-1 Н-пиразол. Промежуточное соединение 2 (0,120 г, 0,66 ммоль) и гидразингидрат (0,04 мл, 0,72 ммоль) растворили в этаноле (6 мл) и дефлегмировали в течение ночи. В результате выделения продукта реакции (H2O/AcOEt) после охлаждения смеси до комнатной температуры получили указанное в заголовке соединение в виде твердого коричневого вещества (0,114 г). Промежуточное соединение 6. 5-(Фуран-2-ил)-1-фенил-3-(трифторметил)-1 Н-пиразол. Использовали способ, описанный для промежуточного соединения 4. Из промежуточного соединения 3 (4 г, 19,4 ммоль) и фенилгидразина (2,31 г, 21,3 ммоль) получили указанное в заголовке соединение в виде твердого белого вещества. 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 7.52-7.48 (m, 3 Н), 7.46-7.40 (m, 3H),6.91 (s, 1H), 6.36-6.33 (m, 1H), 5.96 (d, J=7.4, 1H). Промежуточное соединение 7. 1-Фенил-3-(трифторметил)-1 Н-пиразол-5-карбоновая кислота. Промежуточное соединение 6 (2,84 г, 10,2 ммоль) растворили в ацетоне (120 мл) и добавили к нему раствор KMnO4 (11,2 г, 71,45 ммоль в 135 мл воды). Смесь нагревали при 60 С в течение 3 часов, а затем охладили до комнатной температуры. К реакционной смеси добавили изопропиловый спирт и перемешивали при комнатной температуре в течение ночи. Реакционную смесь отфильтровали через целит, а фильтрат выпарили под высоким вакуумом. Осадок растворили в 1 н. NaOH и промыли петролейным эфиром. Водный слой подкислили 2 н. раствором HCl для получения твердого вещества. Твердое вещество отфильтровали и высушили под высоким вакуумом для получения указанного в заголовке соединения(2,3 г) в виде твердого белого вещества. 1H-ЯМР ( ppm, CDCl3, 400 MHz): 7.57-7.42 (m, 5H), 7.30 (s, 1H). Промежуточное соединение 8. Метил 1-фенил-3-(трифторметил)-1 Н-пиразол-5-карбоксилат. Промежуточное соединение 7 (1,55 г, 6,0 ммоль) растворили в МеОН (15 мл), охладили до 0 С и добавили тионилхлорид (1,3 мл, 18,2 ммоль). Реакционную смесь нагревали до 60 С в течение ночи. В результате выделения продукта реакции (AcOEt:H2O) с последующим выпариванием под высоким вакуумом получили указанное в заголовке соединение в виде твердого желтого вещества. 1H-ЯМР ( ppm,CDCl3, 400 MHz): 7.51-7.47 (m, 3 Н), 7.46-7.41 (m, 2H), 7.50 (s, 1H), 3.82 (s, 3 Н). Промежуточное соедине- 25024630 ние 9: 3,5-дициклопропил-1-(4-нитрофенил)-1 Н-пиразол: Раствор промежуточного соединения 4 (2,0 г,13,5 ммоль) и Cs2CO3 (5,51 г, 40,5 ммоль) в ДМСО (15 мл) нагревали при 160 С под азотом в течение 0,5 ч. К смеси добавили 4-хлор-1-нитробензол (6,38 г, 40,5 ммоль) и перемешивали при той же температуре в течение 4 ч. В результате выделения продукта реакции (H2O/AcOEt) и очистки получили указанное в заголовке соединение (0,8 г). 1H-ЯМР ( ppm, CDCl3, 400 MHz): 8.32 (d, J=9.0, 2H), 7.92 (d, J=9.0, 2H),5.76 (s, 1H), 1.97-1.91 (m, 1H), 1.86-1.80 (m, 1H), 1.09-1.04 (m, 2H), 0.98-0.94 (m, 2H), 0.83-0.75 (m, 4H). Промежуточное соединение 10. 3,5-Дициклопропил-1-(2-фтор-4-нитрофенил)-1 Н-пиразол. Раствор промежуточного соединения 4 (2,0 г, 13,5 ммоль) и К 2 СО 3 (5,5 г, 40,6 ммоль) в ДМСО (20 мл) нагревали при 120 С под азотом в течение 0,5 ч. К смеси добавили 3,4-дифтор-1-нитробензол (2,15 г,13,5 ммоль) и перемешивали при той же температуре в течение 2 ч. В результате выделения продукта реакции (H2O/AcOEt) и очистки получили указанное в заголовке соединение в виде твердого желтого вещества (3,16 г). 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 8.19-8.12 (m, 2H), 7.78 (t, J=7.9, 1H), 5.70 (s, 1H),2.10-2.00 (m, 1H), 1.68-1.58 (m, 1H), 1.08-0.92 (m, 4H), 0.82-0.74 (m, 2H), 0.72-0.65 (m, 2H). Промежуточное соединение 11. 2-(3,5-Дициклопропил-1 Н-пиразол-1-ил)-5-нитропиридин. Раствор промежуточного соединения 4 (8,0 г, 54,05 ммоль) и К 2 СО 3 (27,96 г, 202,6 ммоль) в ДМСО(60 мл) нагревали при 110 С под азотом в течение 0,5 ч. К смеси добавили 2-хлор-5-нитропиридин (12,8 г, 80,75 ммоль) и перемешивали при той же температуре в течение 2 ч. В результате выделения продукта реакции (H2O/AcOEt) и очистки получили указанное в заголовке соединение (3,03 г). 1H-ЯМР ( ppm,CDCl3, 400 MHz): 9.24 (d, J=2.6, 1H), 8.51 (dd, J=2.6, 9.9, 1H), 8.10 (d, J=9.2, 1H), 5.72 (s, 1H), 2.90-2.75 (m,1H), 1.99-1.90 (m, 1H), 1.06-0.93 (m, 4H), 0.82-0.64 (m, 4H). Промежуточное соединение 12. Этил 6-(3,5-дициклопропил-1 Н-пиразол-1-ил)никотинат. Раствор промежуточного соединения 4 (2,0 г, 13,5 ммоль) и К 2 СО 3 (5,6 г, 40,5 ммоль) в ДМСО (15 мл) нагревали при 120 С под азотом в течение 0,5 ч. К смеси добавили этил-6-хлорниконинат (3,8 г, 20,3 ммоль) и перемешивали при 160 С в течение 4 ч. В результате выделения продукта реакции (H2O/AcOEt) и очистки получили указанное в заголовке соединение (0,26 г). 1H-ЯМР ( ppm, CDCl3, 400 MHz): 8.958.90 (m, 1H), 8.38 (dd, J=2.2, 8.7, 1H), 7.91 (d, J=8.7, 1H), 5.93 (s, 1H), 4.35 (q, J=4.12, 2 Н), 2.88-2.78 (m,1H), 1.91-1.83 (m, 1H), 1.33 (t, J=7.1, 3 Н), 0.99-0.85 (m, 4H), 0.62-0.55 (m, 4 Н). MS (m/z): 298.3 ([M+H]+). Промежуточное соединение 13. 5-Циклопропил-1-(4-нитрофенил)-3-(трифторметил)-1 Н-пиразол. Использовали способ, описанный для промежуточного соединения 9. Из промежуточного соединения 5 (1,0 г, 5,67 ммоль), Cs2CO3 (5,5 г, 16,9 ммоль), ДМСО (4 мл) и 4-хлор-1-нитробензола (1,93 г, 14,1 ммоль) получили указанное в заголовке соединение (0,7 г). 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 8.38 (d,J=7.08, 2 Н), 7.92 (d, J=7.08, 2 Н), 6.32 (s, 1H), 1.89-1.82 (m, 1H), 1.19-1.11 (m, 2H), 0.89-0.85 (m, 2H), MS(m/s): 298.15 [M+H]+. Промежуточное соединение 14. 5-Циклопропил-1-(2-фтор-4-нитрофенил)-3-(трифторметил)-1 Нпиразол. Раствор промежуточного соединения 5 (6,3 г, 35 ммоль) и К 2 СО 3 (14,6 г, 105 ммоль) в ДМСО (20 мл) нагревали при 120 С под азотом в течение 30 мин. К этой смеси добавили 1,2-дифторнитробензол(5,68 г, 35 ммоль) и перемешивали при той же температуре в течение 2 ч. В результате выделения продукта (H2O/AcOEt) и очистки получили указанное в заголовке соединение (7,52 г). 1 Н-ЯМР ( ppm,ДМСО-d6, 400 MHz): 8.49 (dd, J=2.4, 9.9, 1H), 8.47-8.27 (m, 1H), 8.04-8.02 (m, 1H), 6.73 (s, 1H), 1.76-1.68(m, 1H), 0.99-0.90 (m, 2H), 0.84-0.74 (m, 2H). Промежуточное соединение 15. 5-Циклопропил-1-(2,6-дифтор-4-нитрофенил)-3-(трифторметил)1 Н-пиразол. Промежуточное соединение 5 (1 г, 5,7 ммоль) и 3,4,5-трифторнитробензол (1 г, 5,7 ммоль) растворили в ТГФ и добавили гидрид натрия (274 мг, 11,3 ммоль). Смесь дефлегмировали в течение 2 ч, и охладили реакционную смесь до комнатной температуры и погасили водой. В результате выделения продукта (H2O/AcOEt) получили заданный продукт в виде желтой тягучей жидкости. 1 Н-ЯМР ( ppm, CDCl3,400 MHz): 8.05-8.01 (m, 2H), 6.31 (s, 1H), 1.60-1.50 (m, 1H), 1.00-0.91 (m, 2H), 0.80-0.71 (m, 2H). Промежуточное соединение 16. 2-[5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]-5 нитропиридин. Раствор промежуточного соединения 5 (1.0 г, 5,67 ммоль) и К 2 СО 3 (2,35 г, 17,03 ммоль) в ДМСО(10 мл) нагревали при 90 С под азотом в течение 30 мин. К этой смеси добавили 2-хлор-5-нитропиридин(1,35 г, 8,5 ммоль) и перемешивали при той же температуре в течение 2 ч. В результате выделения продукта (H2O/AcOEt) и очистки получили указанное в заголовке соединение (0,30 г). 1 Н-ЯМР ( ppm,CDCl3, 400 MHz): 9.33 (d, J=2.5, 1H), 8.62 (dd, J=2.8, 9.0, 1H), 8.19 (d, J= 9.0, 1H), 6.29 (s, 1H), 2.92-2.83 (m,1H), 1.60-1.50 (m, 2H), 0.79-0.70 (m, 2H). Промежуточное соединение 17. 2-[5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]-5 нитропиримидин. Промежуточное соединение 5 (500 мг, 2,84 ммоль) и 2-хлор-4-нитропиримидин (452 мг, 2,84 ммоль) растворили в ТГФ и охладили до 0 С. К этой смеси медленно добавили гидрид натрия (136 мг,5,7 ммоль), и нагревали реакционную смесь с дефлегматором. Через один час реакционную смесь охла- 26024630 дили до комнатной температуры и погасили водой. В результате выделения продукта (H2O/AcOEt) и очистки получили заданный продукт (455 мг) в виде твердого белого вещества. 1 Н-ЯМР ( ppm, CDCl3,400 MHz): 9.58 (s, 2H), 6.37 (s, 1H), 2.82-2.74 (m, 1H), 1.18-1.10 (m, 2H), 0.82-0.75 (m, 2H). Промежуточное соединение 18. Метил 1-(4-нитрофенил)-3-(трифторметил)-1 Н-пиразол-5 карбоксилат. Промежуточное соединение 8 (2 г, 7,4 ммоль) растворили в уксусной кислоте (15 мл), охладили до 0 С и по каплям добавили нитрующую смесь (6 мл HNO3 и 6 мл H2SO4). Реакционную смесь нагревали до 60 С в течение ночи. В результате выделения продукта реакции (AcOEt:H2O) и очистки на силикагеле(силикагель 60-120 меш) с использованием этилацетата и петролеиного эфира (3:97) в качестве элюента получили указанное в заголовке соединение в виде твердого белого вещества (850 мг). 1 Н-ЯМР ( ppm,CDCl3, 400 MHz): 8.37 (d, J=9, 2 Н), 7.68 (d, J=9, 2 Н), 7.31 (s, 1H), 3.87 (s, 3H). Промежуточное соединение 19. [1-(4-Нитрофенил)-3-(трифторметил)-1 Н-пиразол-5-ил]метанол. Промежуточное соединение 18 (0,662 г, 2,1 ммоль) растворили в смеси ТГФ (5 мл) и МеОН (5 мл) и добавили боргидрид натрия (79 мг, 2,1 ммоль). Цвет реакционной смеси изменился на розовый, затем добавили две капли воды. Реакционную смесь оставили перемешиваться при комнатной температуре на 1 ч, и на этом этапе цвет изменился с розового на бледно-желтый. Реакционную смесь оставили дополнительно перемешиваться на ночь. В результате выделения продукта (AcOEt/H2O) и выпаривания органического слоя под вакуумом получили указанное в заголовке соединение (558 мг) в виде твердого белого вещества. 1 Н-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.42 (d, J=8.9, 2H), 8.01 (d, J=8.9, 2H), 7.01 (s, 1H), 5.77(t, J=5.4, 1H), 4.63 (d, J=5.4, 2 Н). Промежуточное соединение 20. 1-(4-Нитрофенил)-3-(трифторметил)-1 Н-пиразол-5-карбальдегид. Оксалилхлорид (0,32 мл, 3,8 ммоль) растворили в ДХМ, охладили до -78 С и добавили ДМСО (0,5 мл, 7,6 ммоль), и перемешивали в течение 30 мин. Добавили промежуточное соединение 19 (550 мг, 1,9 ммоль), перемешивали при -78 С в течение 20 мин и добавили триэтиламин (1,06 мл, 7,6 ммоль). Реакционную смесь нагрели до 0 С, а затем медленно нагрели до комнатной температуры. В результате выделения продукта (H2O/AcOEt) получили указанное в заголовке соединение (375 мг). 9.85 (s, 1H), 8.41 (d,J=8.6, 2 Н), 7.99 (d, J=8.5, 2 Н), 7.84 (s, 1H). Промежуточное соединение 21. 5-(Фторметил)-1-(4-нитрофенил)-3-(трифторметил)-1 Н-пиразол. Промежуточное соединение 19 (0,5 г, 1,75 ммоль) растворили в ДХМ (10 мл) и охладили реакционную смесь до 0 С. По каплям добавили (диэтиламино)серы трифторид (0,46 мл, 3,5 ммоль) и оставили реакционную смесь перемешиваться при комнатной температуры на 30 мин. После завершения реакции реакционную смесь разбавили ДХМ, а затем промыли водой. ДХМ удалили на ротационном испарителе для получения неочищенного продукта. Неочищенный продукт очистили колоночной хроматографией,используя этилацетат и петролейный эфир (7:97) в качестве элюента, для получения указанного в заголовке соединения (0,41 г) в виде твердого желтого вещества. 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 8.42 (d,J=9, 2H), 7.86 (d, J=9, 2H), 6.94 (d, J=3.4, 1H), 5.42 (d, J=48.4, 2H). Промежуточное соединение 22. 5-(Дифторметил)-1-(4-нитрофенил)-3-(трифторметил)-1 Н-пиразол. Промежуточное соединение 20 (500 мг, 1,75 ммоль) растворили в ДХМ, охладили до 0 С и добавили (диэтиламино)серы трифторид (0,46 мл, 3,5 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин. К реакционной смеси добавили воду, и отделенный слой ДХМ высушили над безводным Na2SO4 и удалили ДХМ на ротационном испарителе для получения неочищенного продукта. В результате очистки (силикагель 60-120 меш) [этилацетат:петролейный эфир (60:40)] получили указанное в заголовке соединение в виде твердого желтого вещества. 1 Н-ЯМР ( ppm, CDCl3, 400 MHz): 8.42 (d,J=9.1, 2H), 7.79 (d, J=9.1, 2H), 7.06 (s, 1H), 6.73 (t, J=53, 1H). Промежуточное соединение 23. 4-Хлор-3,5-дициклопропил-1-(2-фтор-4-нитрофенил)-1 Н-пиразол. Промежуточное соединение 10 (1,15 г, 3,40 ммоль) растворили в ДМФ и добавили Nхлорсукцинимид (0,64 г, 4,8 ммоль) при 0 С. Затем реакционную смесь оставили перемешиваться при комнатной температуре на 2 ч. После завершения реакции, в результате выделения продукта (EtOAc) и очистки получили указанное в заголовке соединение (0,575 г). 1 Н-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.18-8.09 (m, 2H), 7.64 (t, J=8.3, 1H), 1.98-1.90 (m, 1H), 1.82-1.72 (m, 1H), 0.90-0.80 (m, 4H), 0.68-0.60 (m,4H). Промежуточное соединение 24. 4-Хлор-5-циклопропил-1-(4-нитрофенил)-3-(трифторметил)-1 Нпиразол. Промежуточное соединение 13 (1 г, 3,36 ммоль) растворили в ДМФ и добавили N-хлорсукцинимид(0,54 г, 4,0 ммоль) при 0 С. Затем реакционную смесь оставили перемешиваться при комнатной температуре на 2 ч. После завершения реакции, в результате выделения продукта (EtOAc) получили указанное в заголовке соединение (0,802 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.39 (d, J=9, 2H), 7.82 (d, J=9, 2H),1.91-1.80 (m, 1H), 1.10-1.00 (m, 2H), 0.80-0.72 (m, 2H). Промежуточное соединение 25. 5-Циклопропил-1-(2-фтор-4-нитрофенил)-3-(трифторметил)-1 Нпиразол. Промежуточное соединение 14 (1,05 г, 3,40 ммоль) растворили в ДМФ и добавили N- 27024630 хлорсукцинимид (0,545 г, 4,08 ммоль) при 0 С. Затем реакционную смесь оставили перемешиваться при комнатной температуре на 2 ч. После завершения реакции, в результате выделения продукта (EtOAc) и очистки получили указанное в заголовке соединение (1 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.238.16 (m, 2H), 7.72 (t, J=7.5, 1H), 1.82-1.70 (m, 1H), 0.99-0.82 (m, 2H), 0.74-0.65 (m, 2H). Промежуточное соединение 26. 2-[4-Хлор-5-циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]-5 нитропиридин. Промежуточное соединение 16 (1,5 г, 5,0 ммоль) растворили в ДМФ и добавили N-хлорсукцинимид(0,8 г, 6 ммоль) при 0 С. Затем реакционную смесь оставили перемешиваться при комнатной температуре на 2 ч. После завершения реакции, в результате выделения продукта (EtOAc) и очистки получили указанное в заголовке соединение (0,802 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 9.34 (d, J=2.5, 1H), 8.65(dd, J=2.5, 9, 1H), 8.09 (d, J=9, 1H), 2.48-2.38 (m, 1H), 1.13-1.03 (m, 2H), 0.90-0.82 (m, 2H). Промежуточное соединение 27. 4-(3,5-Дициклопропил-1 Н-пиразол-1-ил)анилин. Порошок железа (0,88 г, 15,8 ммоль) и хлорид аммония (17 мг, 0,3 ммоль) добавили к раствору промежуточного соединения 9 (0,85 г, 3,15 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение получаса. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) после концентрирования объединенных слоев получили указанное в заголовке соединение в виде твердого желтого вещества (0,68 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.11 (d,J=8.6, 2H), 6.61 (d, J=8.6, 2H), 5.65 (s, 1H), 5.24 (s, 2H), 1.81-1.74 (m, 1H), 1.67-1.60 (m, 1H), 0.86-0.77 (m,4 Н), 0.61-0.56 (m, 4 Н). MS (m/z): 240.3 [М+Н]+. Промежуточное соединение 28. 4-(3,5-Дициклопропил-1 Н-пиразол-1-ил)-3-фторанилин. Порошок железа (1,86 г, 34,8 ммоль) и хлорид аммония (30 мг, 0,7 ммоль) добавили к раствору промежуточного соединения 10 (2 г, 7,0 ммоль) в EtOH/H2O (2:1, 30 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили указанное в заголовке соединение в виде твердого желтого вещества (1,34 г). Промежуточное соединение 29. 4-(4-Хлор-3,5-дициклопропил-1 Н-пиразол-1-ил)-3-фторанилин. Порошок железа (0,48 г, 8,9 ммоль) и хлорид аммония (9 мг, 0,17 ммоль) добавили к раствору промежуточного соединения 23 (0,57 г, 1,8 ммоль) в EtOH/H2O (2:1, 7,5 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) после концентрирования объединенных слоев получили промежуточное соединение 29 в виде твердого желтого вещества (0,46 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.02 (t, J=8.6,1H), 6.45-6.38 (m, 2 Н), 5.74 (s, 2H), 1.85-1.76 (m 1H), 1.61-1.52 (m, 1H), 0.90-0.82 (m, 2H), 0.78-0.70 (m,4H), 0.69-0.60 (m, 2H). MS (m/z): 291.98 [M+H]+ Промежуточное соединение 30. 6-(3,5-Дициклопропил-1 Н-пиразол-1-ил)пиридин-3-амин. Порошок железа (0,79 г, 14,17 ммоль) и хлорид аммония (15 мг, 0,28 ммоль) добавили к раствору промежуточного соединения 11 (0,77 г, 2,86 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) после концентрирования объединенных слоев получили промежуточное соединение 30 в виде твердого желтого вещества (0,570 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.75 (d,J=2.5, 1H), 7.27 (d, J=8.6, 1H), 7.06 (dd, J=2.7, 8.6, 1H), 5.67 (s, 1H), 5.43 (s, 2H), 2.39-2.27 (m, 1H), 1.88-1.74(m, 1H), 0.90-0.72 (m, 4H), 0.69-0.50 (m, 4H). Промежуточное соединение 31. 4-[5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]анилин. Использовали способ, описанный для промежуточного соединения 27. Из промежуточного соединения 13 (0,69 г, 2,32 ммоль), EtOH-H2O (2:1, 12 мл), Fe (0,64 г, 15,8 ммоль) и NH4Cl (0,012 мг, 0,22 ммоль) получили указанное в заголовке соединение в виде твердого желтого вещества (0,49 г). 1H-ЯМР(m, 1H), 0.94-0.89 (m, 2 Н), 0.77-0.73 (m, 2 Н). MS (m/z): 268.1 [М+Н]+. Промежуточное соединение 32. 4-[4-Хлор-5-циклопропил-3-(трифторметил)-1 Н-пиразол-1 ил]анилин. Порошок железа (0,67 г, 12,05 ммоль) и хлорид аммония (25 мг, 4,8 ммоль) добавили к раствору промежуточного соединения 24 (0,800 г, 2,41 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили промежуточное соединение 32 в виде твердого желтого вещества (0,720 г). 1 Н-ЯМР (5 ppm, ДМСО-d6, 400 MHz): 7.19 (d, J=8.6,2 Н), 6.63 (d, J=8.6, 2 Н), 5.51 (s, 2H), 1.89-1.80 (m, 1H), 0.88-0.80 (m, 2 Н), 0.65-0.61 (m, 2 Н). Промежуточное соединение 33. 4-[3-Циклопропил-5-(трифторметил)-1 Н-пиразол-1-ил]-3 фторанилин. Порошок железа (4,75 г, 85,1 ммоль) и хлорид аммония (90 мг, 1,7 ммоль) добавили к раствору промежуточного соединения 14 (5 г, 17 ммоль) в EtOH/H2O (2:1, 45 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2 О/AcOEt) после концентрирования объединенных слоев получили указанное в заголовке- 28024630 соединение в виде твердого желтого вещества (4,3 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.16 (t, J=8.5,1H), 6.50-6.45 (m, 3H), 5.86 (s, 2H), 1.60-1.51 (m, 1H), 0.91-0.82 (m, 2H), 0.76-0.69 (m, 2H). Промежуточное соединение 34. 4-(4-Хлор-5-циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил)-3 фторанилин. Порошок железа (0,8 г, 56 ммоль) и хлорид аммония (300 мг, 5,8 ммоль) добавили к раствору промежуточного соединения 26 (1,0 г, 2,88 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили промежуточное соединение 34 в виде твердого бледно-желтого вещества (0,87 г). 1 Н-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.19 (t, J=8.6,1H), 6.50-6.45 (m, 2H), 5.91 (s, 2H), 1.72-1.62 (m, 1H), 0.87-0.79 (m, 2H), 0.76-0.67 (m, 2H). Промежуточное соединение 35. 4-(5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил)-3,5 дифторанилин. Порошок железа (1,14 г, 20,5 ммоль) и хлорид аммония (21 мг, 0,41 ммоль) добавили к раствору промежуточного соединения 15 (1,36 г, 4,1 ммоль) в EtOH/H2O (2:1, 30 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили указанное в заголовке соединение в виде твердого желтого вещества (680 мг). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 6.54 (s,1H), 6.37 (d, J=10.6, 2 Н), 6.24 (s, 2H), 1.59-1.49 (m, 1H), 0.92-0.84 (m, 2 Н), 0.74-0.66 (m, 2 Н). MS (m/z): 304.06 ([М+Н]+). Промежуточное соединение 36. 6-[5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]пиридин-3 амин. Порошок железа (0,279 г, 5,00 ммоль) и хлорид аммония (5 мг, 0,09 ммоль) добавили к раствору промежуточного соединения 16 (0,77 г, 2,86 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) после концентрирования объединенных слоев получили промежуточное соединение 36 в виде твердого желтого вещества (0,239 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.84 (d,J=2.6, 1H), 7.33 (d, J=8.6, 1H), 7.12 (dd, J=2.6, 8.6, 1H), 6.49 (s, 1H), 5.69 (s, 2H), 2.45-2.36 (m, 1H), 0.90-0.81(m, 2H), 0.74-0.65 (m, 2H).MS (m/z): 269.2 [M+H]+. Промежуточное соединение 37. 6-[4-Хлор-5-циклопропил-3-(трифторметил)-1 Н-пиразол-1 ил]пиридин-3-амин. Порошок железа (1,56 г, 28,0 ммоль) и хлорид аммония (600 мг, 11,2 ммоль) добавили к раствору промежуточного соединения 26 (1,7 г, 5,60 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили промежуточное соединение 37 в виде твердого желтого вещества (1,1 г). 1 Н-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.04 (s, 1H), 7.39(d, J=8.2, 1H), 7.20 (d, J=8, 1H), 4.26 (s, 2H), 2.10-1.99 (m, 1H), 1.96-1.85 (m, 2H), 1.84-1.70 (m, 2H). Промежуточное соединение 38. 2-[5-Циклопропил-3-(трифторметил)-1 Н-пиразол-1-ил]пиримидин 5-амин. Порошок железа (466 мг, 1,67 ммоль) и хлорид аммония (8 мг, 0,17 ммоль) добавили к раствору промежуточного соединения 17 (0,41 г, 1,41 ммоль) в EtOH/H2O (2:1, 7,5 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили указанное промежуточное соединение 38 в виде твердого желтого вещества (0,35 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 8.20 (s, 2H), 6.52 (s, 1H), 5.99 (s, 2H), 2.22-2.12 (m. 1H), 1.00-0.85 (m, 2H), 0.80-0.68 (m, 2H). MS (m/z): 267.73 ([M-H]-). Промежуточное соединение 39. 4-[5-(Фторметил)-3-(трифторметил)-1 Н-пиразол-1-ил]анилин. Порошок железа (434 мг, 7,78 ммоль) и хлорид аммония (8 мг, 0,15 ммоль) добавили к раствору промежуточного соединения 21 (450 мг, 1,56 ммоль) в EtOH/H2O (2:1, 15 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили указанное в заголовке соединение (335 мг) в виде твердого желтого вещества (460 мг). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.16 (d, J=8.6, 2H), 7.12 (d, J=2.8, 1H), 6.65 (d, J=8.6, 2H), 5.5 (s, 2 Н), 5.4 (d, J=48.3, 2 Н). Промежуточное соединение 40. 4-[5-(Дифторметил)-3-(трифторметил)-1 Н-пиразол-1-ил]анилин. Порошок железа (0,39 г, 7,78 ммоль) и хлорид аммония (90 мг, 1,7 ммоль) добавили к раствору промежуточного соединения 22 (0,41 г, 1,41 ммоль) в EtOH/H2O (2:1, 7,5 мл) и дефлегмировали смесь в течение одного часа. Смесь отфильтровали через целит, и промыли целит этанолом. В результате выделения продукта (H2O/AcOEt) и концентрирования объединенных слоев получили указанное промежуточное соединение 40 в виде твердого желтого вещества (0,35 г). 1H-ЯМР ( ppm, ДМСО-d6, 400 MHz): 7.29 (s, 1H), 7.16 (d, J=8.7, 2 Н), 7.10 (t, J=53, 1H), 6.64 (d, J=8.7, 2 Н), 5.60 (s, 2H). Промежуточное соединение 41. 2-Хлор-N-[4-(3,5-дициклопропил-1 Н-пиразол-1-ил)фенил] ацетамид.
МПК / Метки
МПК: C07D 231/12, A61K 31/4155, C07D 401/04, A61K 31/415, C07D 413/12, C07D 417/14, A61P 35/00, C07D 403/14, C07D 403/12, C07D 401/12, C07D 413/14, C07D 401/14, C07D 417/12, C07D 403/04
Метки: каналов, активируемых, производные, crac, ингибиторы, кальция, высвобождением, ионных, пиразола
Код ссылки
<a href="https://eas.patents.su/30-24630-proizvodnye-pirazola-kak-ingibitory-ionnyh-kanalov-aktiviruemyh-vysvobozhdeniem-kalciya-crac.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразола как ингибиторы ионных каналов, активируемых высвобождением кальция (crac)</a>
Предыдущий патент: Моноклональные антитела, связывающие b7h6, и их применение
Следующий патент: Способ нейтрализации катализатора полимеризации
Случайный патент: Устойчивое к глифосату растение сахарной свеклы












