Производные пиразола для лечения инфекции вируса иммунодефицита человека (вич)
Номер патента: 7184
Опубликовано: 25.08.2006
Авторы: Стаппл Пол Энтони, Селби Мэттью Данкан, Маубрей Чарлз Эрик, Прайс Дейвис Энтони, Джоунз Лин Хауард
Формула / Реферат
1. Соединение формулы (I)
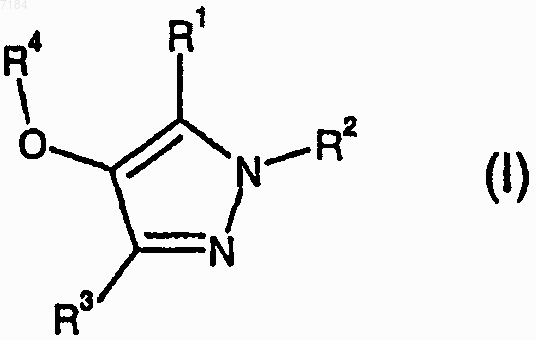
или его фармацевтически приемлемые соль, сольват или производное, где
либо R1 представляет собой Н, С1-С6алкил, С3-С7циклоалкил, фенил, бензил, галогено, -CN, -OR7, -CO2R10, -CONR5R10, R8 или R9, причем указанные С1-С6алкил, С3-С7циклоалкил, фенил и бензил возможно замещены галогено, -CN, -OR10, S(O)xR10, -CO2R10, -CONR5R10, -OCONR5R10, -NR5CO2R10, -NR10R11, -NR5COR10, -SO2NR5R10,-NR5CONR5R10, -NR5SO2R10 или R10; и
R2 представляет собой Н, С1-С6алкил, С3-С6алкенил, С3-С6алкинил, С3-С7циклоалкил, С3-С7циклоалкенил, фенил, бензил, R8 или R9, причем указанные С1-С6алкил, С3-С7циклоалкил, фенил и бензил возможно замещены галогено, -OR5, -OR12, -CN, -CO2R7, -OCONR5R5, -CONR5R5, -C(=NR5)NR5OR5, -CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR5, -NR5COR8, -NR5COR12, -NR5CO2R5, -NR5CON R5R5, -SO2NR5R5, -NR5SO2R5, -NR5SO2NR5R5, R8 или R9;
либо R1 и R2, взятые вместе, представляют собой неразветвленный С3-С4алкилен, возможно замещенный оксо, возможно, где одна метиленовая группа указанного С3-С4алкилена заменена атомом кислорода или атомом азота, причем указанный атом азота возможно замещен R10;
R3 представляет собой Н, С1-С6алкил, С3-С7циклоалкил, фенил, бензил, галогено, -CN, -OR7, -CO2R5, -CONR5R5, R8 или R9, причем указанные С1-С6алкил, С3-С7циклоалкил, фенил и бензил возможно замещены галогено, -CN, -OR5, -CO2R5, -CONR5R5, -OCONR5R5, -NR5CO2R5, -NR6R6, -NR5COR5, -SO2NR5R5, -NR5CONR5R5, -NR5SO2R5, R8 или R9;
R4 представляет собой фенил, нафтил или пиридил, причем каждый возможно замещен R8, галогено, -CN, С1-С6алкилом, С1-С6галогеноалкилом, С3-С7циклоалкилом, С1-С6алкокси, -CONR5R5, OR13, SoxR6, O-(С1-С6алкилен)-CONR5R5, O-(С1-С6aлкилeн)-NR5R5 или O-(С1-С6алкилен)-ОR6;
каждый R5 независимо представляет собой либо Н, С1-С6алкил или С3-С7циклоалкил, либо, когда две группы R5 присоединены к одному и тому же атому азота, эти две группы, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил или морфолинил, причем указанные азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил и морфолинил возможно замещены С1-С6алкилом или С3-С7циклоалкилом;
каждый R6 независимо представляет собой либо Н, С1-С6алкил, либо С3-С7циклоалкил;
R7 представляет собой С1-С6алкил или С3-С7циклоалкил;
R8 представляет собой пяти- или шестичленную ароматическую гетероциклическую группу, которая содержит (1) от 1 до 4 гетероатом(ов) азота, либо (2) 1 или 2 гетероатом(а) азота и 1 гетероатом кислорода или серы, либо (3) 1 или 2 гетероатом(а) кислорода или серы, причем указанная гетероциклическая группа возможно замещена галогено, оксо, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(С1-С6алкилен)-NR5R5, С1-С6алкилом, фтор(С1-С6)алкилом или С3-С7циклоалкилом;
R9 представляет собой 4-7-членную насыщенную или частично ненасыщенную гетероциклическую группу, которая содержит (1) 1 или 2 гетероатом(а) азота, либо (2) 1 гетероатом азота и 1 гетероатом кислорода или серы, либо (3) 1 гетероатом кислорода или серы, причем указанная гетероциклическая группа возможно замещена оксо, С1-С6алкилом, С3-С7циклоалкилом, -SO2R5, -CONR5R5, -COOR5, -СО-(С1-С6алкилен)-ОR5 или -COR5 и возможно замещена по атому углерода, который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5, -NR5CОNR5R5, -NR5SO2R5 или -CN;
R10 представляет собой Н, R8, R9, R13, С1-С6алкил, С3-С7циклоалкил или -(С1-С6алкил)-(С3-С7циклоалкил), причем указанные С1-С6алкил и С3-С7циклоалкил возможно замещены -OR5, -OR13, R8, R9, R13 или -COR13;
R11 представляет собой Н, С1-С6алкил или С3-С7циклоалкил, причем указанные С1-С6алкил и С3-С7циклоалкил возможно замещены -OR5, -NR5R5, -NR5COR5, -CONR5R5, R8 или R9;
R12 представляет собой С1-С6алкил, замещенный R8, R9, -OR5, -CONR5R5, -NR5COR5 или -NR5R5;
R13 представляет собой фенил, возможно замещенный галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(С1-С6алкилен)-NR5R5, С1-С6алкилом, галогено(С1-С6)алкилом или С3-С7циклоалкилом; и
х равно 0, 1 или 2;
при условии, что (а) когда R1 и R3 оба представляют собой фенил, R2 не является метилом; и (б) когда R1 представляет собой этокси и R3 представляет собой этоксикарбонил, R2 нe является фенилом.
2. Соединение по п.1, где R1, взятый отдельно, представляет собой Н, С1-С6алкшы, С3-С7циклоалкил или -OR7, причем указанные С1-С6алкил и С3-С7циклоалкил возможно замещены галогено, -CN, -OR10, S(O)xR10, -CO2R10, -CONR5R10, -OCONR5R10, -NR5CO2R10, -NR10R11, -NR5COR10, -SO2NR5R10, -NR5CONR5R10, -NR5SO2R10 или R10.
3. Соединение по п.1 или 2, где R1, взятый отдельно, представляет собой Н, С1-С6алкил, С3-С7циклоалкил или -OR7, причем указанный С1-С6алкил возможно замещен галогено, -OR10, -NR10R11, -NR5COR10 или R10.
4. Соединение по любому из пп.1-3, где R2, взятый отдельно, представляет собой Н, С1-С6алкил, С3-С6алкенил или R9, причем указанный С1-С6алкил возможно замещен галогено, -OR5, -OR12, -CN, -CO2R7, -OCONR5R5, -CONR5R5, -C(=NR5)NR5OR5, -CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR5, -NR5COR8, -NR5COR12, -NR5CO2R5, -NR5CONR5R5, -SO2NR5R5, -NR5SO2R5, R8 или R9.
5. Соединение по любому из пп.1-4, где R2, взятый отдельно, представляет собой Н, С1-С6алкил, С3-С6алкенил или R9, причем указанный С1-С6алкил возможно замещен -OR5, -OR12, -CN, -CO2R7, -CONR5R5, -C(=NR5)NR5OR5, -CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR8, -NR5COR12, -NR5CO2R5, R8 или R9.
6. Соединение по п.1, где R1 и R2, взятые вместе, представляют собой неразветвленный С3-С4алкилен, возможно замещенный оксо, где одна метиленовая группа указанного С3-С4алкилена заменена атомом кислорода или атомом азота, причем указанный атом азота возможно замещен R10.
7. Соединение по пп.1-6, где R1 и R2, взятые вместе, представляют собой неразветвленный пропилен, где одна метиленовая группа заменена атомом кислорода, или неразветвленный бутилен, где одна метиленовая группа заменена атомом азота, причем указанные пропилен и бутилен возможно замещены оксо, а указанный атом азота возможно замещен R10.
8. Соединение по любому из пп.1-7, где R3 представляет собой Н или С1-С6алкил, причем указанный С1-С6алкил возможно замещен галогено, -CN, -OR5, -CO2R5, -CONR5R5, -OCONR5R5, -NR5CO2R5, -NR6R6, -NR5COR5, -SO2NR5R5, -NR5CONR5R5, -NR5SO2R5, R8 или R9.
9. Соединение по любому из пп.1-8, где R3 представляет собой Н или С1-С6алкил.
10. Соединение по любому из пп.1-9, где R4 представляет собой фенил, возможно замещенный R8, галогено, -CN, С1-С6алкилом, С1-С6галогеноалкилом, С3-С7циклоалкилом, С1-С6алкокси, -CONR5R5, OR13, SoxR6, O-(С1-С6алкилен)-CONR5R5, О-(С1-С6алкилен)-NR5R5 или O-(С1-С6алкилен)-ОR6, или нафтил.
11. Соединение по любому из пп.1-10, где R4 представляет собой фенил, замещенный R8, галогено, -CN, С1-С6алкилом, С1-С6галогеноалкилом, С3-С7циклоалкилом, С1-С6алкокси, -CONR5R5, OR13, SoxR6, O-(С1-С6алкилен)-CONR5R5, О-(С1-С6алкилен)-NR5R5 или O-(С1-С6алкилен)-ОR6.
12. Соединение по любому из пп.1-11, где R4 представляет собой фенил, замещенный R8, галогено, -CN, С1-С6алкилом, С1-С6галогеноалкилом, С3-С7циклоалкилом или С1-С6алкокси.
13. Соединение по любому из пп.1-12, где R4 представляет собой фенил, замещенный галогено, -CN или С1-С6алкилом.
14. Соединение по любому из пп.1-13, где R8 представляет собой пирролил, имидазолил, пиразолил, 1,2,3-триазолил, 1,2,4-триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, фуранил, тиенил, пиридинил, пиридазинил, пиримидинил или пиразинил, причем каждый возможно замещен галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(С1-С6алкилен)NR5R5, С1-С6алкилом, фтор(С1-С6)алкилом или С3-С7циклоалкилом.
15. Соединение по любому из пп.1-14, где R8 представляет собой имидазолил, пиразолил, 1,2,4-триазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, пиридинил, пиразинил или пиримидинил, причем каждый возможно замещен галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(С1-С6aлкилeн)-NR5R5, С1-С6алкилом, фтор(С1-С6)алкилом или С3-С7циклоалкилом.
16. Соединение по любому из пп.1-15, где R8 представляет собой имидазолил, пиразолил, 1,2,4-триазолил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, пиридинил, пиразинил или пиримидинил, причем каждый возможно замещен -OR5, -NR5R5 или С1-С6алкилом.
17. Соединение по любому из пп.1-16, где R9 представляет собой азетидинил, тетрагидропирролил, пиперидинил, азепинил, оксетанил, тетрагидрофуранил, тетрагидропиранил, оксепинил, морфолинил, пиперазинил или диазепинил, причем каждый возможно замещен оксо, С1-С6алкилом, С3-С7циклоалкилом, -SO2R5, -CONR5R5, -COOR5, -СО-(С1-С6алкилен)-ОR5 или -COR5 и возможно замещен по атому углерода, который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5, -NR5CОNR5R5, -NR5SO2R5 или -CN.
18. Соединение по любому из пп.1-17, где R9 представляет собой азетидинил, пиперидинил, тетрагидрофуранил, пиперазинил или морфолинил, причем каждый возможно замещен окёю, С1-С6алкилом, С3-С7циклоалкилом, -SO2R5, -CONR5R5, -COOR5, -СО-(С1-С6алкилен)-ОR5 или -COR5 и возможно замещен по атому углерода, который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5, -NR5CОNR5R5, -NR5SO2R5 или -CN.
19. Соединение по любому из пп.1-18, где R9 представляет собой азетидинил, пиперидинил, тетрагидрофуранил, пиперазинил или морфолинил, причем каждый возможно замещен С1-С6алкилом, -SO2R5, -CONR5R5, -COOR5, -СО-(С1-С6алкилен)-ОR5 или -COR5 и возможно замещен по атому углерода, который не является соседним с гетероатомом, -OR5 или -NR5COR5.
20. Соединение по любому из пп.1-19, где R10 представляет собой Н, R8, R9, R13, С1-С6алкил или -(С1-С6алкил)-(С3-С7циклоалкил), причем указанный С1-С6алкил возможно замещен -OR5, -OR13, R8, R9, R13 или -COR13.
21. Соединение по любому из пп.1-20, где R10 представляет собой Н, R8, R9, R13, С1-С6алкил или -(С1-С6алкил)-(С3-С7циклоалкил), причем указанный С1-С6алкил возможно замещен -OR5 или R13.
22. Соединение по любому из пп.1-21, где R11 представляет собой Н или С1-С6алкил, причем указанный С1-С6алкил возможно замещен -OR5, -NR5R5, -NR5COR5, -CONR5R5, R8 или R9.
23. Соединение по любому из пп.1-22, где R11 представляет собой Н или С1-С6алкил, причем указанный С1-С6алкил возможно замещен -OR5 или -NR5COR5.
24. Соединение по любому из пп.1-23, где R12 представляет собой С1-С4алкил, замещенный R8, R9, -OR5, -CONR5R5, -NR5COR5 или -NR5R5.
25. Соединение по любому из пп.1-24, где R12 представляет собой С1-С4алкил, замещенный R9, -OR5, -NR5CОR5 или -NR5R5.
26. Соединение по любому из пп.1-25, где R13 представляет собой фенил, замещенный галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(С1-С6aлкилeн)-NR5R5, С1-С6алкилом, галогено(С1-С6)алкилом или С3-С7циклоалкилом.
27. Соединение по любому из пп.1-26, где R13 представляет собой фенил, замещенный галогено, -CN, -CONR5R5, -SO2NR5R5 или -OR5.
28. 2-[4-(3,5-Дихлорфенокси)-3,5-диметил-1Н-пиразол-1-ил]этанол;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол;
[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]ацетонитрил;
5-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]метил}-1H-пиразол-3-ол;
6-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}-2-метил-4(3Н)-пиримидинон;
2-амино-6-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}-4(3H)-пиримидинон;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]-N-гидроксиэтанимидамид;
метил-[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]ацетат;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]ацетамид;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]ацетогидразид;
5-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}-1,3,4-оксадиазол-2(3Н)-он;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этиламин;
3-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}-1,2,4-оксадиазол-5-ол;
5-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}-1,3,4-оксадиазол-2-амин;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-2-метоксиацетамид;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-2-пиридинкарбоксамид;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-2-пиразинкарбоксамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}бензонитрил;
4-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-3,5-диметилбензонитрил;
3-хлор-4-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}бензонитрил;
5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-2-фторбензонитрил;
2-[4-(4-хлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(3-хлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(2-хлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
2-[4-(2,6-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(2,3-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(2,4-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
2-[3,5-диэтил-4-(2-фторфенокси)-1Н-пиразол-1-ил]этанол;
2-[3,5-диэтил-4-(3-фторфенокси)-1H-пиразол-1-ил]этанол;
2-[4-(3,5-диметилфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
2-[3,5-диэтил-4-(4-фтор-3-метилфенокси)-1H-пиразол-1-ил]этанол;
2-[4-(2,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(2,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(3,4-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
2-[4-(2,6-дифторфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
2-[4-(2,5-дифторфенокси)-3,5-диэтил-1Н-пиразол-1-ил]этанол;
2-[4-(3,5-дифторфенокси)-3,5-диэтил-1H-пиразол-1-ил]этанол;
4-(3,5-дихлорфенокси)-3,5-диэтил-1-(2-метоксиэтил)-1Н-пиразол;
4-(3,5-дихлорфенокси)-3,5-диэтил-1 -(метоксиметил)-1H-пиразол;
4-(3,5-дихлорфенокси)-3,5-диэтил-1-метил-1Н-пиразол;
4-(3,5-дихлорфенокси)-3-этил-1H-пиразол;
4-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}морфолин;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-N-(2-метоксиэтил)амин;
1-(1-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-4-пиперидинил)этанон;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-N,N-диметиламин;
N-[2-({2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}амино)этил]ацетамид;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-N-метиламин;
N-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}-N-(тетрагидро-2-фуранилметил)амин;
3-{[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]метил}морфолин;
1-(3-азетидинил)-4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол;
7-(3,5-дихлорфенокси)-6-этил-2,3-дигидропиразоло[5,1-b][1,3]оксазол;
4-(3,5-дихлорфенокси)-3,5-диметил-1H-пиразол;
1-[4-(3,5-дихлорфенокси)-3,5-диэтил-1Н-пиразол-1-ил]-2-пропанол;
2-{2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]этокси}этанамин;
4-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}морфолин;
4-(3,5-дихлорфенокси)-3-метил-5-[(2-метил-1H-имидазол-1-ил)метил]-1H-пиразол;
2-[4-(3,5-дихлорфенокси)-3-этил-5-метокси-1H-пиразол-1-ил]этанол;
1-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-1H-1,2,4-триазол;
3-[(3,5-диэтил-1H-пиразол-4-ил)окси]бензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}бензонитрил;
2-[4-(3-цианофенокси)-3,5-диэтил-1H-пиразол-1-ил]ацетамид;
этил-[4-(3-цианофенокси)-3,5-диэтил-1Н-пиразол-1-ил]ацетат;
1-аллил-4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол;
N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-N-(4-метоксибензил)амин;
N-(циклопропилметил)[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]метанамин;
[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]-N,N-диметилметанамин;
[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]-N-метилметанамин;
1-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-4-метилпиперазин;
1-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-4-пиперидинкарбоксамид;
N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-2-метоксиэтанамин;
1-ацетил-4-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}пиперазин;
N-[2-({[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}амино)этил]ацетамид;
N-(1-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-4-пиперидинил)ацетамид;
1-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-4-метоксипиперидин;
3-хлор-5-[(3,5-диметил-1H-пиразол-4-ил)окси]бензонитрил;
3-{[5-(аминометил)-3-метил-1Н-пиразол-4-ил]окси}-5-хлорбензонитрил;
3-хлор-5-{[3-метил-5-(1-пиперазинилметил)-1H-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(5-{[(4-цианобензил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(3-метил-5-{[4-(метилсульфонил)-1-пиперазинил]метил}-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[4-(метоксиацетил)-1-пиперазинил]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
метил-4-{[4-(3-хлор-5-цианофенокси)-3-метил-1H-пиразол-5-ил]метил}-1-пиперазинкарбоксилат;
4-[({[4-(3-хлор-5-цианофенокси)-3-метил-1H-пиразол-5-ил]метил}амино)метил]бензолсульфонамид;
4-(3,5-дихлорфенокси)-5-(метоксиметил)-3-метил-1Н-пиразол;
3-трет-бутил-4-(3,5-дихлорфенокси)-5-метил-1Н-пиразол;
4-(3,5-дихлорфенокси)-3-этил-5-метил-1H-пиразол;
4-циано-N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}бензамид;
3-циано-N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}бензамид;
N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-N-(3-пиридинилметил)амин;
3-({5-[(4-ацетил-1-пиперазинил)метил]-3-метил-1Н-пиразол-4-ил}окси)-5-хлорбензонитрил;
3-хлор-5-[(5-{[(4-цианобензил)(метил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(4-цианобензил)(2-гидроксиэтил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-({3-метил-5-[(2-метил-1Н-имидазол-1-ил)метил]-1Н-пиразол-4-ил}окси)бензонитрил;
2-(4-(3,5-дихлорфенокси)-3-метил-5-{[(3-пиридинилметил)амино]метил}-1Н-пиразол-1-ил)этанол;
5-[(3-изопропил-5-метил-1H-пиразол-4-ил)окси]изофталонитрил;
5-{[1-(2-гидроксиэтил)-3-изопропил-5-метил-1Н-пиразол-4-ил]окси}изофталонитрил;
3-(3,5-дихлорфенокси)-2-этил-6,7-дигидропиразоло[1,5-а]пиразин-4(5H)-он;
3-(3,5-дихлорфенокси)-2-этил-4,5,6,7-тетрагидропиразоло[1,5-а]пиразин;
3-(3,5-дихлорфенокси)-2-этил-5-метил-4,5,6,7-тетрагидропиразоло[1,5-а]пиразин;
4-[(3-(3,5-дихлорфенокси)-2-этил-6,7-дигидропиразоло[1,5-а]пиразин-5(4H)-ил)метил]бензонитрил;
3-(3,5-дихлорфенокси)-2-этил-5-(4-метоксибензил)-4,5,6,7-тетрагидропиразоло[1,5-а]пиразин;
[1-(2-аминоэтил)-4-(3,5-дихлорфенокси)-3-этил-1H-пиразол-5-ил]метанол;
2-[4-(3,5-дихлорфенокси)-5-(этоксиметил)-3-этил-1H-пиразол-1-ил]этиламин;
2-[4-(3,5-дихлорфенокси)-3-этил-5-(1Н-пиразол-1-илметил)-1Н-пиразол-1-ил]этиламин;
N-{[1-(2-аминоэтил)-4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-5-ил]метил}-N-(4-метоксибензил)амин;
4-[({[1-(2-аминоэтил)-4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-5-ил]метил}амино)метил]бензонитрил;
2-[5-[(4-ацетил-1-пиперазинил)метил]-4-(3,5-дихлорфенокси)-3-этил-1H-пиразол-1-ил]этиламин;
N-[2-({[1-(2-аминоэтил)-4-(3,5-дихлорфенокси)-3-этил-1H-пиразол-5-ил]метил}амино)этил]ацетамид;
гидробромид [4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метанамина;
N-{[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]метил}-N-(4-фторбензил)амин;
4-[({[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензонитрил;
3-хлор-5-[(1,3,5-триметил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(4-цианобензил)амино]метил}-1,3-диметил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[1-(2-гидроксиэтил)-3,5-диметил-1H-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-{[5-{[(4-цианобензил)амино]метил}-1-(2-гидроксиэтил)-3-метил-1Н-пиразол-4-ил]окси}бензонитрил;
4-[({[4-(3-хлор-5-цианофенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-фторбензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-метилбензонитрил;
5-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрил;
3-хлор-5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}бензонитрил;
3-[(3,5-диэтил-1H-пиразол-4-ил)окси]-5-фторбензонитрил;
5-[(3,5-диэтил-1H-пиразол-4-ил)окси]изофталонитрил;
3-[(3,5-диэтил-1H-пиразол-4-ил)окси]-5-метилбензонитрил;
3-хлор-5-[(3,5-диэтил-1Н-пиразол-4-ил)окси]бензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-метилбензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-хлорбензонитрил;
5-{[1-(2-аминоэтил)-3,5-диэтил-1Н-пиразол-4-ил]окси}изофталонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-фторбензонитрил;
5-[(3-циклопропил-5-этил-1H-пиразол-4-ил)окси]изофталонитрил;
5-[(3-трет-бутил-5-метил-1Н-пиразол-4-ил)окси]изофталонитрил;
5-[(5-этил-3-изопропил-1Н-пиразол-4-ил)окси]изофталонитрил;
4-(3,5-дихлорфенокси)-3,5-диэтил-1-(1-метил-3-азетидинил)-1Н-пиразол;
2-[4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-1-ил]этиламин;
2-[4-(3,5-дихлорфенокси)-5-этил-1Н-пиразол-1-ил]этиламин;
трет-бутил-2-[4-(3,5-дихлорфенокси)-3-этил-5-(гидроксиметил)-1Н-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[4-(3,5-дихлорфенокси)-5-(этоксиметил)-3-этил-1Н-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[5-(бромметил)-4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[5-(аминометил)-4-(3,5-дихлорфенокси)-3-этил-1H-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[5-[(4-ацетил-1-пиперазинил)метил]-4-(3,5-дихлорфенокси)-3-этил-1H-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[4-(3,5-дихлорфенокси)-3-этил-5-(1Н-пиразол-1-илметил)-1Н-пиразол-1-ил]этилкарбамат;
трет-бутил-2-[5-({[2-(ацетиламино)этил]амино}метил)-4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-1-ил]этилкарбамат;
трет-бутил-2-(4-(3,5-дихлорфенокси)-3-этил-5-{[(4-метоксибензил)амино]метил}-1H-пиразол-1-ил)этилкарбамат;
трет-бутил-2-[5-{[(4-цианобензил)амино]метил}-4-(3,5-дихлорфенокси)-3-этил-1Н-пиразол-1-ил]этилкарбамат;
3-{[5-(бромметил)-1,3-диметил-1H-пиразол-4-ил]окси}-5-хлорбензонитрил;
3-[(3,5-диэтил-1-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-{[3,5-диэтил-1-(2-метоксиэтил)-1H-пиразол-4-ил]окси}бензонитрил;
3-({5-[2-(бензилокси)этил]-3-этил-1H-пиразол-4-ил}окси)-5-фторбензонитрил;
3-{[3-этил-5-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-фторбензонитрил;
3-({5-[2-(4-цианофенокси)этил]-3-этил-1H-пиразол-4-ил}окси)-5-фторбензонитрил;
3-[(3-этил-5-{2-[(2-метил-3-пиридинил)окси]этил}-1H-пиразол-4-ил)окси]-5-фторбензонитрил;
3-({3-этил-5-[2-(3-пиридинилокси)этил]-1H-пиразол-4-ил}окси)-5-фторбензонитрил;
3-[(5-{2-[(2-амино-3-пиридинил)окси]этил}-3-этил-1H-пиразол-4-ил)окси]-5-фторбензонитрил;
5-({5-[2-(бензилокси)этил]-3-этил-1Н-пиразол-4-ил}окси)изофталонитрил;
5-{[3-этил-5-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрил;
3-{[5-(аминометил)-1-(2-гидроксиэтил)-3-метил-1H-пиразол-4-ил]окси}-5-хлорбензонитрил;
5-[(1-аллил-3-трет-бутил-5-метил-1H-пиразол-4-ил)окси]изофталонитрил;
5-{[3-трет-бутил-1-(2-гидроксиэтил)-5-метил-1H-пиразол-4-ил]окси}изофталонитрил;
5-{[1-(2-аминоэтил)-3-трет-бутил-5-метил-1H-пиразол-4-ил]окси}изофталонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(1H-1,2,4-триазол-1-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(4-оксо-1(4H)-пиридинил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(1Н-1,2,3-триазол-1-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(2H-1,2,3-триазол-2-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-фторбензамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(1Н-пиразол-1-ил)бензамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(2-оксо-1(2Н)-пиридинил)бензамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(6-оксо-1(6Н)-пиридазинил)бензамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(2,3-диметил-5-оксо-2,5-дигидро-1Н-пиразол-1-ил)бензамид;
5-{[3-циклопропил-5-этил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрил;
5-{[5-циклопропил-3-этил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрил;
5-{[5-этил-1-(2-гидроксиэтил)-3-изопропил-1H-пиразол-4-ил]окси}изофталонитрил;
5-{[3-этил-1-(2-гидроксиэтил)-5-изопропил-1H-пиразол-4-ил]окси}изофталонитрил;
2-[4-(3,5-дицианофенокси)-3,5-диэтил-1H-пиразол-1-ил]этилкарбамат;
N-{2-[4-(3,5-дицианофенокси)-3,5-диэтил-1H-пиразол-1-ил]этил}сульфамид;
N-{2-[4-(3,5-дицианофенокси)-3,5-диэтил-1Н-пиразол-1-ил]этил}-2-метоксиацетамид;
5-{[1-(3-азетидинил)-3,5-диэтил-1Н-пиразол-4-ил]окси}изофталонитрил;
5-{[3,5-диэтил-1-(3-гидроксипропил)-1Н-пиразол-4-ил]окси}изофталонитрил;
5-[(3,5-диэтил-1-метил-1Н-пиразол-4-ил)окси]изофталонитрил;
5-{[3,5-диэтил-1-(2-метоксиэтил)-1H-пиразол-4-ил]окси}изофталонитрил;
5-{[1-(3-аминопропил)-3,5-диэтил-1H-пиразол-4-ил]окси}изофталонитрил;
метил-[4-(3,5-дицианофенокси)-3,5-диэтил-1Н-пиразол-1-ил]ацетат;
2-[4-(3,5-дицианофенокси)-3,5-диэтил-1Н-пиразол-1-ил]ацетамид;
5-{[3,5-диэтил-1-(гидроксиметил)-1Н-пиразол-4-ил]окси}изофталонитрил;
3-[({[4-(3-циано-5-фторфенокси)-3-метил-1H-пиразол-5-ил]метил}амино)метил]бензамид;
4-[({[4-(3-циано-5-фторфенокси)-3-метил-1H-пиразол-5-ил]метил}амино)метил]бензамид;
4-[({[4-(3,5-дицианофенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензамид;
3-[({[4-(3-хлор-5-цианофенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензамид;
4-[({[4-(3-циано-5-метилфенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензамид;
4-[({[4-(3-цианофенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]бензамид;
5-[(3,5-дициклопропил-1Н-пиразол-4-ил)окси]изофталонитрил;
5-{[3,5-дициклопропил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрил;
5-{[1-(2-аминоэтил)-3,5-дициклопропил-1H-пиразол-4-ил]окси}изофталонитрил;
3-{[3-циклопропил-1-(2-гидроксиэтил)-5-метил-1H-пиразол-4-ил]окси}-5-метилбензонитрил;
3-{[5-циклопропил-1-(2-гидроксиэтил)-3-метил-1Н-пиразол-4-ил]окси}-5-метилбензонитрил;
3-[3-циклопропил-1-(2-аминоэтил)-5-метил-1H-пиразол-4-илокси]-5-метилбензонитрил;
3-[(3-циклопропил-5-метил-1Н-пиразол-4-ил)окси]-5-метилбензонитрил;
3-{[1-(3-аминопропил)-3,5-диэтил-1Н-пиразол-4-ил]окси}-5-метилбензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-4-метоксибензонитрил;
2-[3,5-диэтил-4-(1-нафтилокси)-1Н-пиразол-1-ил]этанол;
2-[3,5-диэтил-4-(2-нафтилокси)-1H-пиразол-1-ил]этанол;
2-{4-[3,5-ди(1H-пиразол-1-ил)фенокси]-3,5-диэтил-1H-пиразол-1-ил}этанол;
2-{3,5-диэтил-4-[3-фтор-5-(1H-пиразол-1-ил)фенокси]-1H-пиразол-1-ил}этанол;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-метоксибензонитрил;
2-[4-(3,5-дифторфенокси)-3,5-диэтил-1H-пиразол-1-ил]этиламин;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-фторбензамид;
3-[(3-изопропил-5-метил-1Н-пиразол-4-ил)окси]-5-метилбензонитрил;
3-{[1-(2-аминоэтил)-3-изопропил-5-метил-1H-пиразол-4-ил]окси}-5-метилбензонитрил;
2-[4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразол-1-ил]-N-(2-пиридинилметил)ацетамид;
[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]ацетонитрил;
1-{[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]ацетил}пиперидин;
(3R)-1-{[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]ацетил}-3-пиперидинол;
N-(2,4-дихлорбензил)-2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]ацетамид;
2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]-N-(6-метил-2-пиридинил)ацетамид;
2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]-N-[4-(трифторметил)бензил]ацетамид;
N-(3-хлорбензил)-2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]ацетамид;
2-[4-(3,5-дихлорфенокси)-3-метил-1H-пиразол-5-ил]-N-[2-(трифторметил)бензил]ацетамид;
2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]-N-(4-фторбензил)ацетамид;
N-бензил-2-[4-(3,5-дихлорфенокси)-3-метил-1Н-пиразол-5-ил]-N-метилацетамид;
3-хлор-5-[(5-{[(2-хлорбензил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-({5-[(бензиламино)метил]-3-метил-1H-пиразол-4-ил}окси)-5-хлорбензонитрил;
3-[(5-{[бензил(метил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]-5-хлорбензонитрил;
3-хлор-5-{[5-({[(5-хлор-2-пиридинил)метил]амино}метил)-3-метил-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(3-метил-5-{[(4-пиридинилметил)амино]метил}-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(3-метил-5-{[(4-метилбензил)амино]метил}-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(3-метоксипропил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
4-[2-({[4-(3-хлор-5-цианофенокси)-3-метил-1H-пиразол-5-ил]метил}амино)этил]бензолсульфонамид;
3-хлор-5-{[3-метил-5-({[(1S)-1-фенилэтил]амино}метил)-1H-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(5-{[(4-хлорбензил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(3-метил-5-{[метил(2-фенилэтил)амино]метил}-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-({3-метил-5-[(1H-пиразол-3-иламино)метил]-1Н-пиразол-4-ил}окси)бензонитрил;
N-[2-({[4-(3-хлор-5-цианофенокси)-3-метил-1H-пиразол-5-ил]метил}амино)этил]ацетамид;
3-хлор-5-[(5-{[(3-хлорбензил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[5-({[3-фтор-5-(трифторметил)бензил]амино}метил)-3-метил-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(3-метил-5-{[(6-метил-2-пиридинил)амино]метил}-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(4-гидрокси-6-метил-2-пиримидинил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(4-фторбензил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[5-({[(1R)-2-гидрокси-1-фенилэтил]амино}метил)-3-метил-1H-пиразол-4-ил]окси}бензонитрил;
3-({5-[(бензиламино)метил]-3-метил-1Н-пиразол-4-ил}окси)-5-хлорбензонитрил;
3-хлор-5-[(5-{[(3-метоксибензил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[3-метил-5-({[4-(трифторметил)бензил]амино}метил)-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-{[5-({[(1R)-1-(гидроксиметил)-2-метилпропил]амино}метил)-3-метил-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(5-{[(2-метоксибензил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[3-метил-5-({[2-(2-тиенил)этил]амино}метил)-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(3-метил-5-{[(3-пиридинилметил)амино]метил}-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-{[3-метил-5-({[2-(трифторметил)бензил]амино}метил)-1Н-пиразол-4-ил]окси}бензонитрил;
3-хлор-5-[(5-{[(2,4-дихлорбензил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(3-метил-5-{[(2-пиридинилметил)амино]метил}-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(3,4-дихлорбензил)амино]метил}-3-метил-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(3-метил-5-{[(3-фенилпропил)амино]метил}-1H-пиразол-4-ил)окси]бензонитрил;
3-хлор-5-[(5-{[(4-метоксибензил)амино]метил}-3-метил-1Н-пиразол-4-ил)окси]бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(метилсульфанил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(метилсульфинил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(метилсульфонил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-[2-(диметиламино)этокси]бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-[2-(метиламино)этокси]бензонитрил;
2-(3-циано-5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}фенокси)ацетамид;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(2-метоксиэтокси)бензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-метоксибензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-(1Н-пиразол-1-ил)бензонитрил;
3,5-дихлорфенил-3-метил-5-[(3-метил-1,2,4-оксадиазол-5-ил)метил]-1Н-пиразол-4-иловый эфир;
3-фтор-5-{[1-(2-гидроксиэтил)-5-метил-3-(трифторметил)-1Н-пиразол-4-ил]окси}бензонитрил;
5-[(3,5-диэтил-1-{2-[(2-метоксиэтокси)метокси]этил}-1H-пиразол-4-ил)окси]изофталонитрил;
3-циано-5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}бензамид;
5-{[5-этил-3-(1-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрил;
5-{[5-этил-3-(1-гидроксиэтил)-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(5-трифторметил-1,2,4-оксадиазол-3-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-(5-метил-1,2,4-оксадиазол-3-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(5-этил-1,2,4-оксадиазол-3-ил)бензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}-5-(5-изопропил-1,2,4-оксадиазол-3-ил)бензонитрил;
5-[({[4-(3-хлор-5-цианофенокси)-3-метил-1H-пиразол-5-ил]метил}амино)метил]никотинамид;
2-[({[4-(3-хлор-5-цианофенокси)-3-метил-1Н-пиразол-5-ил]метил}амино)метил]изоникотинамид;
ди(трет-бутил)-2-[4-(3,5-дицианофенокси)-3,5-диэтил-1H-пиразол-1-ил]этилфосфат;
2-[4-(3,5-дицианофенокси)-3,5-диэтил-1H-пиразол-1-ил]этилдигидрофосфат;
сульфат 5-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрила;
5-{[3,5-диэтил-1-(2-гидроксиэтил)-1Н-пиразол-4-ил]окси}изофталонитрил;
тозилат 5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрила;
мезилат 5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрила;
бис-мезилат 3-{[1-(2-аминоэтил)-3,5-диэтил-1Н-пиразол-4-ил]окси}-5-метилбензонитрила;
фосфат 3-{[1-(2-аминоэтил)-3,5-диэтил-1Н-пиразол-4-ил]окси}-5-метилбензонитрила;
(L)-тapтpaт 3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-метилбензонитрила;
сукцинат 3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-метилбензонитрила;
(L)-цитрат 3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-метилбензонитрила
или их фармацевтически приемлемые соль, сольват или производное.
29. 3-{[3,5-Диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-фторбензонитрил;
3-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}-5-метилбензонитрил;
5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}изофталонитрил;
3-хлор-5-{[3,5-диэтил-1-(2-гидроксиэтил)-1H-пиразол-4-ил]окси}бензонитрил;
5-[(3,5-диэтил-1H-пиразол-4-ил)окси]изофталонитрил;
3-[(3,5-диэтил-1H-пиразол-4-ил)окси]-5-метилбензонитрил;
3-хлор-5-[(3,5-диэтил-1H-пиразол-4-ил)окси]бензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1Н-пиразол-4-ил]окси}-5-метилбензонитрил;
3-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}-5-хлорбензонитрил;
5-{[1-(2-аминоэтил)-3,5-диэтил-1H-пиразол-4-ил]окси}изофталонитрил
или их фармацевтически приемлемые соль, сольват или производное.
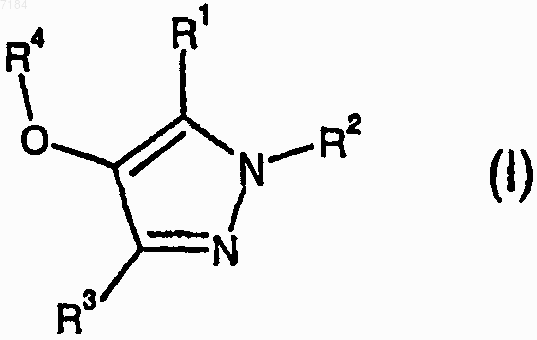
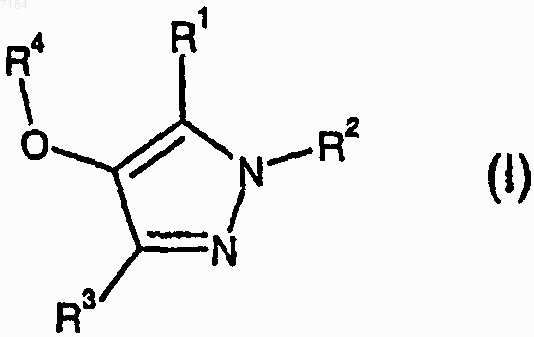
30. Соединение формулы (I)
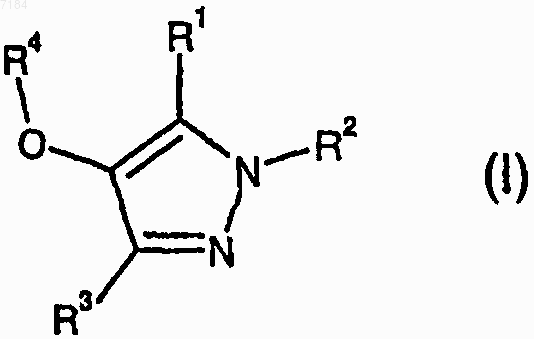
или его фармацевтически приемлемые соль или сольват, где
R1 представляет собой Н, С1-С6алкил, -OС1-С6алкил, -ОС3-С7циклоалкил, причем указанный С1-С6алкил возможно замещен R15;
R2 представляет собой Н, С1-С3алкил, пропенил или С-связанный R15, причем указанный С1-С3алкил возможно замещен -ОН, -ОСН3, -OCH2CH2NH2, -CN, -СO2СН3, -CONH2, -C(=NH)NH2, -CONHNH2, -NH2, -NНСН3, -N(СН3)2, -NНСН2СН2NНСОСН3, -NНСН2СН2OСН3, -NHCH2R15, -NHCOR15, -NНСОСН2OСН3 или R15;
R3 представляет собой С1-С6алкил;
R4 представляет собой фенил, возможно замещенный галогено, -CN, С1-С6алкилом, С1-С6галогеноалкилом, С3-С7циклоалкилом или С1-С6алкокси; и
R15 представляет собой азетидинил, тетрагидрофуранил, морфолинил, пиперазинил, пиразолил, оксадиазолил, пиридинил или пиримидинил, причем каждый возможно замещен -ОН, -NH2, оксо, или С1-С6алкилом, или группой -СО(С1-С6алкил).
31. Фармацевтическая композиция, включающая в себя соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное по любому из пп.1-30 вместе с одним или более чем одним фармацевтически приемлемым эксципиентом, разбавителем или носителем.
32. Фармацевтическая композиция по п.31, включающая в себя один или более чем один дополнительный терапевтический агент.
33. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-30 в качестве лекарственного средства.
34. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-30 в качестве ингибитора или модулятора обратной транскриптазы.
35. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-30 в лечении инфекции вируса иммунодефицита человека (ВИЧ) или генетически родственной ретровирусной инфекции либо проистекающего из нее синдрома приобретeнного иммунодефицита (СПИДа).
36. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-30 для производства лекарственного средства, обладающего ингибирующей или модулирующей активностью в отношении обратной транскриптазы.
37. Применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного по любому из пп.1-30 для производства лекарственного средства для лечения инфекции ВИЧ или генетически родственной ретровирусной инфекции либо проистекающего из нее синдрома приобретённого иммунодефицита (СПИДа).
38. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, кроме случаев, когда либо R1, либо R3 представляют собой галогено, -OR7 или -CN, при котором осуществляют конденсацию соединения формулы (II), (VI) или (VII)
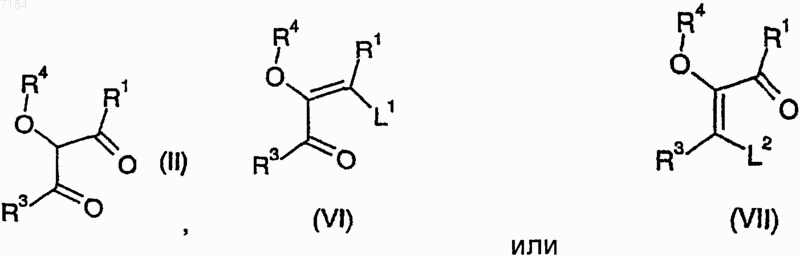
где R1, R3 и R4 являются такими, как определено в п.1, и L1 и L2 представляют собой подходящую уходящую группу, с соединением формулы
H2NNHR2 (V),
где R2 является таким, как определено в п.1, либо его солью или гидратом и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
39. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R1 представляет собой -OR7, при котором соединеэшх формулы (XIII)
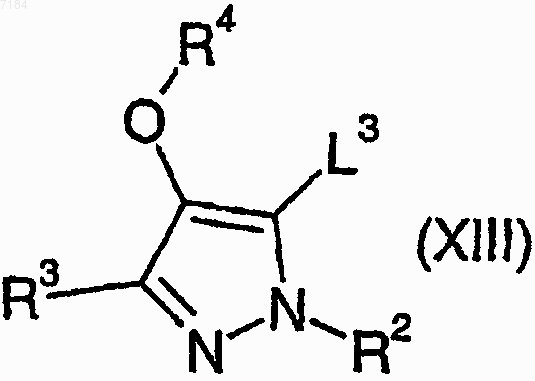
где R2, R3 и R4 являются такими, как определено в п.1, и L3 представляет собой подходящую уходящую группу, подвергают взаимодействию со спиртом формулы (XXI)
R7OH (XXI),
где R7 является таким, как определено в п.1, в присутствии подходящего палладиевого катализатора и монооксида углерода и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
40. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R3 представляет собой -OR7, при котором соединение формулы (XIV)
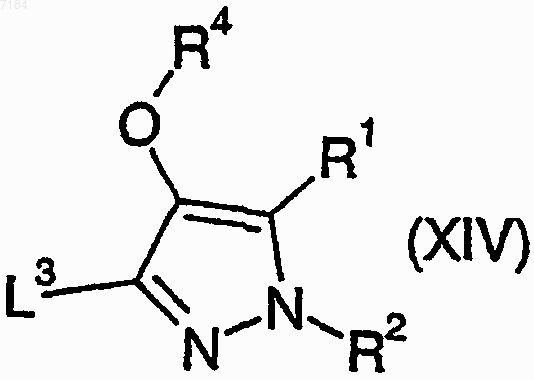
где R1, R2 и R4 являются такими, как определено в п.1, и L3 представляет собой подходящую уходящую группу, подвергают взаимодействию со спиртом формулы (XXI)
R7OH (XXI),
где R7 является таким, как определено в п.1, в присутствии подходящего палладиевого катализатора и монооксида углерода и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
41. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R1 представляет собой -OR7, при котором соединение формулы (XV)
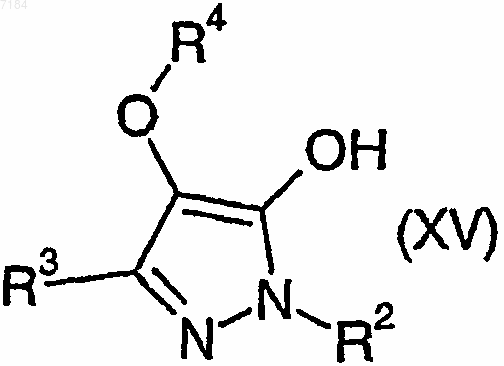
где R2, R3 и R4 являются такими, как определено в п.1, подвергают взаимодействию с соединением формулы (XXI)
R7OH (XXI),
где R7 является таким, как определено в п.1, в условиях дегидратации и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
42. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R3 представляет собой -OR7, при котором соединение формулы (XVI)
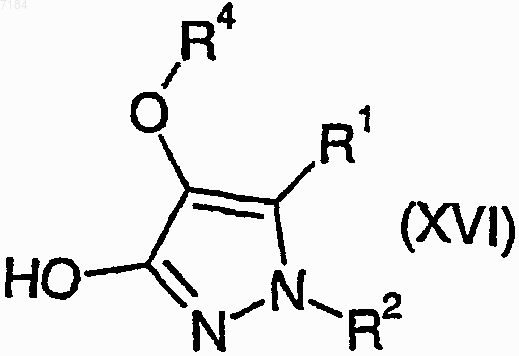
где R1, R2 и R4 являются такими, как определено в п.1, подвергают взаимодействию с соединением формулы (XXI)
R7OH (XXI),
где R7 является таким, как определено в п.1, в условиях дегидратации и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
43. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R1 представляет собой галогено, при котором соединение формулы (XV)
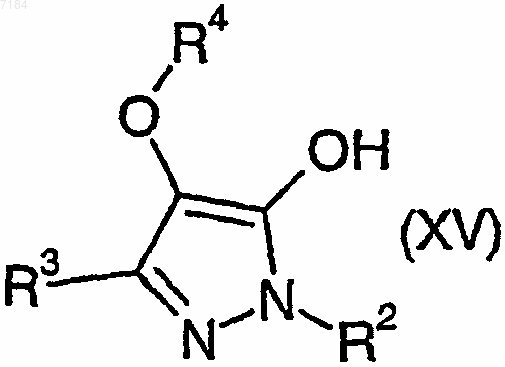
где R2, R3 и R4 являются такими, как определено в п.1, подвергают взаимодействию с галогенирующим агентом и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
44. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, в котором R3 представляет собой галогено, при котором соединение формулы (XVI)
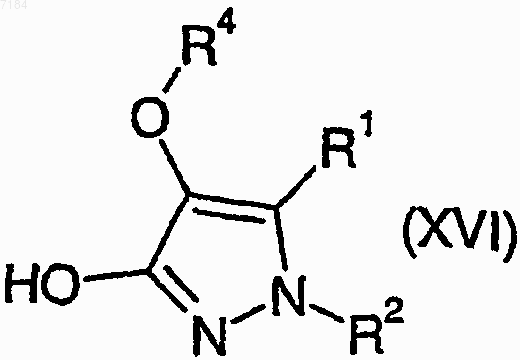
где R1, R2 и R4 являются такими, как определено в п.1, подвергают взаимодействию с галогенирующим агентом и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное.
45. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, при котором осуществляют взаимопревращение соединения формулы (I) в другое соединение формулы (I) и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное
46. Способ получения соединения формулы (I) или его соли, сольвата или фармацевтически приемлемого производного по любому из пп.1-30, при котором удаляют защиту с защищенного производного соединения формулы (I) и, возможно, превращают полученное соединение формулы (I) в его фармацевтически приемлемые соль, сольват или производное
47. Соединение формул (II), (VI), (VII), (XIII) или (XIV)
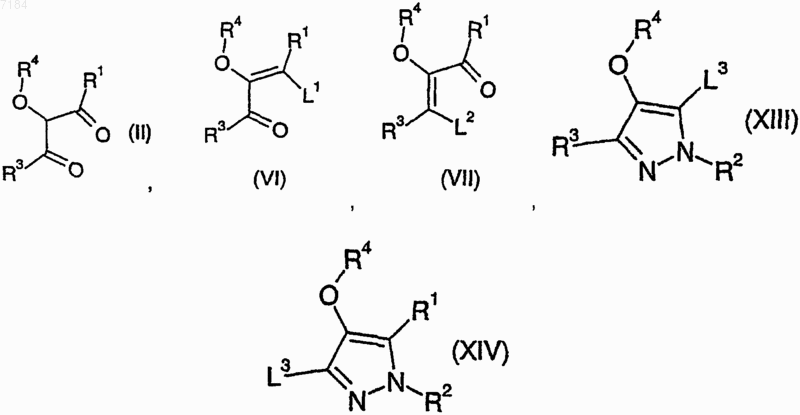
где R1, R2, R3 и R4 являются такими, как определено в п.1, и L1, L2 и L3 представляют собой подходящие уходящие группы.
Текст
007184 Настоящее изобретение относится к производным пиразола и способам их получения, промежуточным соединениям, которые используются при их получении, композициям, которые их содержат, и применениям таких производных. Соединения по настоящему изобретению связываются с ферментом обратной транскриптазой и являются ее модуляторами, в особенности ингибиторами. Обратная транскриптаза вовлечена в инфекционный жизненный цикл ВИЧ, и соединения, которые препятствуют функционированию этого фермента,показали эффективность в лечении состояний, которые включают в себя СПИД. Существует постоянная необходимость в обеспечении новыми и более хорошими модуляторами, в особенности ингибиторами,обратной транскриптазы ВИЧ, поскольку вирус способен мутировать, становясь устойчивым к воздействиям известных модуляторов. Соединения по настоящему изобретению являются полезными в лечении множества расстройств,включая такие расстройства, в которые вовлечено ингибирование обратной транскриптазы. Интересующие расстройства включают в себя расстройства, вызванные вирусом иммунодефицита человека (ВИЧ) и генетически родственными ретровирусами, такие как синдром приобретенного иммунодефицита(СПИД). В заявке на европейский патент ЕР 0786455 А 1 описан класс соединений имидазола, которые ингибируют рост ВИЧ. Класс N-фенилпиразолов, которые действуют как ингибиторы обратной транскриптазы, описан в J. Med. Chem., 2000, 43, 1034. Противовирусную активность приписывают группе производных N-(гидроксиэтил)пиразола в патенте США 3303200. Согласно настоящему изобретению предложено соединение формулы или его фармацевтически приемлемые соль, сольват или производное, где либо R1 представляет собой Н, C1-С 6 алкил, С 3-С 7 циклоалкил, фенил, бензил, галогено, -CN, -OR7,-CO2R10, -CONR5R10, R8 или R9, причем указанные C1-С 6 алкил, C3-С 7 циклоалкил, фенил и бензил возможно замещены галогено, -CN, -OR10, S(О)xR10, -CO2R10, -CONR5R10, -OCONR5R10, -NR5CO2R10,-NR10R11, -NR5COR10, -SO2NR5R10,-NR5CONR5R10, -NR5SO2R10 или R10 иR2 представляет собой Н, C1-С 6 алкил, C3-С 6 алкенил, C3-С 6 алкинил, C3-С 7 циклоалкил, C3 С 7 циклоалкенил, фенил, бензил, R8 или R9, причем указанные C1-С 6 алкил, C3-С 7 циклоалкил, фенил и бензил возможно замещены галогено, -OR5, -OR12, -CN, -CO2R7, -OCONR5R5, -CONR5R5,-C(=NR5)NR5OR5, -CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR5, -NR5COR8, -NR5COR12, -NR5CO2R5,-NR5CONR5R5, -SO2NR5R5,-NR5SO2R5, -NR5SO2NR5R5, R8 или R9; либо R1 и R2, взятые вместе, представляют собой неразветвленный C3-С 4 алкилен, возможно замещенный оксо, возможно, где одна метиленовая группа указанного C3-С 4 алкилена заменена атомом кислорода или атомом азота, причем указанный атом азота возможно замещен R10;R4 представляет собой фенил, нафтил или пиридил, причем каждый возможно замещен R8, галогено, -CN, C1-С 6 алкилом, C1-С 6 галогеноалкилом, C3-С 7 циклоалкилом, C1-С 6 алкокси, -CONR5R5, -OR13,SOxR6, О-(C1-С 6 алкилен)-CONR5R5, О-(C1-С 6 алкилен)-NR5R5 или O-(C1-С 6 алкилен)-ОR6; каждый R5 независимо представляет собой либо Н, C1-С 6 алкил или C3-С 7 циклоалкил, либо, когда две группы R5 присоединены к одному и тому же атому азота, эти две группы, взятые вместе с атомом азота, к которому они присоединены, представляют собой азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил или морфолинил, причем указанные азетидинил, пирролидинил, пиперидинил, гомопиперидинил, пиперазинил, гомопиперазинил и морфолинил возможно замещены C1-С 6 алкилом или C3-С 7 циклоалкилом; каждый R6 независимо представляет собой либо Н, C1-С 6 алкил, либо C3-С 7 циклоалкил;R8 представляет собой пяти- или шестичленную ароматическую гетероциклическую группу, которая содержит (1) от 1 до 4 гетероатом(ов) азота, либо (2) 1 или 2 гетероатом(а) азота и 1 гетероатом кислорода или серы, либо (3) 1 или 2 гетероатом(ов) кислорода или серы, причем указанная гетероциклическая группа возможно замещена галогено, оксо, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5,-NR5R5, -(C1-С 6 алкилен)-NR5R5, C1-С 6 алкилом, фтор(C1-С 6)алкилом или C3-С 7 циклоалкилом;R9 представляет собой 4-7-членную насыщенную или частично ненасыщенную гетероциклическую группу, которая содержит (1) 1 или 2 гетероатом(а) азота, либо (2) 1 гетероатом азота и 1 гетероатом ки-1 007184 слорода или серы, либо (3) 1 гетероатом кислорода или серы, причем указанная гетероциклическая группа возможно замещена оксо, C1-С 6 алкилом, C3-С 7 циклоалкилом, -SO2R5, -CONR5R5, -COOR5, -СО-(C1 С 6 алкилен)-ОR5 или -COR5 и возможно замещена по атому углерода, который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5, -NR5CONR5R5, -NR5SO2R5 или -CN;R10 представляет собой Н, R8, R9, R13, C1-С 6 алкил, C3-С 7 циклоалкил или -(C1-С 6 алкил)-(С 3 С 7 циклоалкил), причем указанные C1-С 6 алкил и C3-С 7 циклоалкил возможно замещены -OR5, -OR13, R8,R9, R13 или -COR13;R11 представляет собой Н, C1-С 6 алкил или C3-С 7 циклоалкил, причем указанные C1-С 6 алкил и С 3 С 7 циклоалкил возможно замещены -OR5, -NR5R5, -NR5COR5, -CONR5R5, R8 или R9;-NR SO2R5, -OR5, -NR5R5, -(C1-С 6aлкилeн)-NR5R5, C1-С 6 алкилом, галогено(C1-С 6)алкилом или С 3 С 7 циклоалкилом; и х равно 0, 1 или 2; при условии, что (а) когда R1 и R3 оба представляют собой фенил, R2 не является метилом; и (б) когда R1 представляет собой этокси и R3 представляет собой этоксикарбонил, R2 нe является фенилом. В вышеуказанных определениях галогено означает фторо, хлоро, бромо или иодо. Если не указано иначе, группы алкил, алкенил, алкинил, алкилен и алкокси, содержащие требуемое число атомов углерода, могут иметь неразветвленную или разветвленную цепь. Примеры алкила включают в себя метил,этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и трет-бутил. Примеры алкенила включают в себя этенил, пропен-1-ил, пропен-2-ил, пропен-3-ил, 1-бутен-1-ил, 1-бутен-2-ил, 1-бутен-3-ил, 1-бутен-4 ил, 2-бутен-1-ил, 2-бутен-2-ил, 2-метилпропен-1-ил или 2-метилпропен-3-ил. Примеры алкинила включают в себя этинил, пропин-1-ил, пропин-3-ил, 1-бутин-1-ил, 1-бутин-3-ил, 1-бутин-4-ил, 2-бутин-1-ил. Примеры алкилена включают в себя метилен, 1,1-этилен, 1,2-этилен, 1,1-пропилен, 1,2-пропилен, 2,2 пропилен и 1,3-пропилен. Примеры алкокси включают в себя метокси, этокси, н-пропокси, изопропокси,н-бутокси, изобутокси, втор-бутокси и тpeт-бутокси. Примеры циклоалкила включают в себя циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Когда R1 и R2 взяты вместе, они образуют наряду с атомом азота и атомом углерода пиразольного кольца, к которому они присоединены, 5- или 6 членное кольцо. Когда гетероциклическая группа R8 и R9 присоединена к гетероатому кислорода, серы или азота, гетероциклическая группа R8 и R9 должна быть присоединена через атом углерода кольца. Кроме того, когда гетероциклическая группа R9 присоединена к гетероатому кислорода, серы или азота,гетероциклическая группа R9 должна быть присоединена через атом углерода кольца, который не является соседним с гетероатомом кольца. Фармацевтически приемлемые соли соединений формулы (I) включают в себя их соли присоединения кислот и соли с основаниями. Подходящие соли присоединения кислот образуются из кислот, которые образуют нетоксичные соли, и их примерами служат гидрохлорид, гидробромид, гидроиодид, сульфат, бисульфат, нитрат, фосфат,гидрофосфат, ацетат, малеат, фумарат, лактат, тартрат, цитрат, глюконат, сукцинат, сахарат, бензоат,метансульфонат, этансульфонат, бензолсульфонат, паратолуолсульфонат и памоат. Подходящие соли с основаниями образуются из оснований, которые образуют нетоксичные соли, и их примерами служат соли натрия, калия, алюминия, кальция, магния, цинка и диэтаноламина. Для обзора подходящих солей смотри Berge et al., J. Pharm. Sci., 66, 1-19, 1977. Фармацевтически приемлемые сольваты соединений формулы (I) включают в себя их гидраты. Также соединения формулы (I) включают в себя их полиморфные модификации. Соединения формулы (I) могут быть модифицированы по любой из функциональных групп в соединениях для создания их фармацевтически приемлемых производных. Примеры таких производных описаны в: Drugs of Today, Volume 19, Number 9, 1983, рр. 499-538; Topics in Chemistry, Chapter 31, pp. 306-316; и в "Design of Prodrugs" by H. Bundgaard, Elsevier, 1985, Chapter 1 (эти сообщения приведены здесь посредством ссылки). Они включают в себя сложные эфиры, карбонатные эфиры, гемиэфиры,фосфатные эфиры, нитроэфиры, сульфатные эфиры, сульфоксиды, амиды, сульфонамиды, карбаматы,азосоединения, фосфамиды, гликозиды, простые эфиры, ацетали и кетали. Соединение формулы (I) может содержать один или более чем один асимметрический атом углерода и поэтому может существовать в двух и более чем в двух стереоизомерных формах. Настоящее изобретение включает в себя индивидуальные стереоизомеры соединений формулы (I) вместе с их индивидуальными таутомерами там, где это целесообразно, и их смеси. Разделение диастереоизомеров может быть достигнуто посредством общепринятых методик, например, посредством дробной кристаллизации, хроматографии или высокоэффективной жидкостной хроматографии (ВЭЖХ) смеси стереоизомеров соединения формулы (I) или его подходящих соли или производного. Индивидуальный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения, либо посредством разделения, такого как ВЭЖХ соответствующего рацемата с применением подходящего хирального носителя, либо посредством-2 007184 дробной кристаллизации диастереоизомерных солей, образованных посредством взаимодействия соответствующего рацемата с подходящей оптически активной кислотой или основанием, как целесообразно. Предпочтительно R1, взятый отдельно, представляет собой Н, C1-С 6 алкил, С 3-С 7 циклоалкил или 7-OR , причем указанные C1-С 6 алкил и C3-С 7 циклоалкил возможно замещены галогено, -CN, -OR10,S(O)xR10, -CO2R10, -CONR5R10, -OCONR5R10, -NR5CO2R10, -NR10R11, -NR5COR10, -SO2NR5R10,-NR5CONR5R10, -NR5SO2R10 или R10. Предпочтительно R1, взятый отдельно, представляет собой Н, C1-С 6 алкил, С 3-С 7 циклоалкил или 7-OR , причем указанный C1-С 6 алкил возможно замещен галогено, -OR10, -NR10R11, -NR5COR10 или R10. Предпочтительно R1, взятый отдельно, представляет собой Н, C1-С 4 алкил, циклопропил или -ОСН 3,причем указанный C1-С 4 алкил возможно замещен бромо, -ОН, -O(C1-С 2 алкил), -NR10R11, -NHCOR13 илиR10. Предпочтительно R1, взятый отдельно, представляет собой Н, -СН 3, -СН 2 СН 3, -СН(СН 3)2, -С(СН 3)3,циклопропил, -ОСН 3, -СН 2OН, -СН 2OСН 3, -СН 2OСН 2 СН 3, -CH2Br, -CH2NH2, -СН 2NНСН 3, -СН 2N(СН 3)2,-СН 2NНСН 2(циклопропил),-СН 2NНСН 2 СН 2OСН 3,-CH2NHCH2CH2NHCOCH3,-СН 2NНСО(4 цианофенил), -СН 2NНСО(3-цианофенил), -СН 2NНСН 2(4-цианофенил), -CH2NHCH2(4-фторфенил),-СН 2NНСН 2(4-метоксифенил), -CH2NHCH2(4-аминосульфонилфенил), -СН 2NНСН 2(4-аминокарбонилфенил), -СН 2NНСН 2(пирид-3-ил), -СН 2N(СН 3)(4-цианофенилметил), -СН 2N(СН 2 СН 2OН)(4-цианофенилметил), 4-метоксипиперидин-1-илметил, 4-аминокарбонилпиперидин-1-илметил, 4-метилкарбониламинопиперидин-1-илметил, пиперазин-1-илметил, 4-метилпиперазин-1-илметил, 4-метилкарбонилпиперазин-1-илметил, 4-метоксиметилкарбонилпиперазин-1-илметил, 4-метоксикарбонилпиперазин 1-илметил, 4-метилсульфонилпиперазин-1-илметил, морфолин-4-илметил, 2-метилимидазол-1-илметил,пиразол-1-илметил или 1,2,4-триазол-1-илметил. Предпочтительно R1, взятый отдельно, представляет собой -СН 3, -СН 2 СН 3, циклопропил,-СН 2NHСН 2(4-цианофенил), -СH2NНСH2(4-фторфенил), -CH2NHCH2(4-мeтoкcифeнил), -СН 2NНСН 2(4 аминосульфонилфенил), -СН 2NНСН 2(4-аминокарбонилфенил). Предпочтительно R2, взятый отдельно, представляет собой Н, C1-С 6 алкил, C3-С 6 алкенил или R9,причем указанный C1-С 6 алкил возможно замещен галогено, -OR5, -OR12, -CN, -CO2R7, -OCONR5R5,-CONR5R5, -C(=NR5)NR5OR5, -CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR5, -NR5COR8, -NR5COR12,-NR5CO2R5, -NR5CONR5R5, -SO2NR5R5,-NR5SO2R5, R8 или R9. Предпочтительно R2, взятый отдельно, представляет собой Н, C1-С 6 алкил, C3-С 6 алкенил или R9,причем указанный C1-С 6 алкил возможно замещен -OR5, -OR12, -CN, -CO2R7, -CONR5R5, -C(=NR5)NR5OR5,-CONR5NR5R5, -NR6R6, -NR5R12, -NR5COR8, -NR5COR12, -NR5CO2R5, R8 или R9. Предпочтительно R2, взятый отдельно, представляет собой Н, C1-С 3 алкил, пропенил или R9, причем указанный C1-С 3 алкил возможно замещен -ОН, -ОСН 3, -OCH2CH2NH2, -CN, -СO2 СН 3, -СO2 СН 2 СН 3,-CONH2,-C(=NH)NHOH,-CONHNH2,-NH2,-NНСН 3,-N(СН 3)2,-NHCH2CH2NHCOCH3,-NНСН 2 СН 2OСН 3, -NHCH2R9, -NHCOR8, -NНСОСН 2OСН 3, -NНСO2 С(СН 3)3, R8 или R9. Предпочтительно R2, взятый отдельно, представляет собой Н, метил, -СН 2 СН=СН 2, -CH2CN,-СН 2OСН 3, -CH2CONH2, -CH2CONHNH2, -СН 2 СO2 СН 3, -СН 2 СO2 СН 2 СН 3, -CH2C(=NH)NHOH,-CH2CH2OH, -СН 2 СН 2OСН 3, -CH2CH2NH2, -СН 2 СН 2NНСОСН 2OСН 3, -СН 2 СН 2NНСO2 С(СН 3)3, 2-(пирид 2-илкарбониламино)эт-1-ил,2-(пиразин-2-илкарбониламино)эт-1-ил,-CH2CH2OCH2CH2NH2,-СН 2 СН 2NНСН 3,-СН 2 СН 2N(СН 3)2,-CH2CH2NHCH2CH2NHCOCH3,-СН 2 СН 2NНСН 2 СН 2OСН 3,-СН 2 СН(ОН)СН 3, (3-гидроксипиразол-5-ил)метил, 2-гидрокси-1,3,4-оксадиазол-5-илметил, 2-амино 1,3,4-оксадиазол-5-ил, 5-гидрокси-1,2,4-оксадиазол-3-илметил, 6-гидрокси-2-метилпиримидин-4-илметил,6-гидрокси-2-аминопиримидин-4-илметил,2-(морфолин-4-ил)эт-1-ил,2-(4-метилкарбонилпиперазин-1-ил)эт-1-ил, морфолин-3-илметил, 2-(тетрагидрофуран-2-илметиламино)эт-1-ил, 1-метилазетидин-3-ил или азетидин-3-ил. Предпочтительно R2, взятый отдельно, представляет собой Н, -СН 2 СН 2OН или -CH2CH2NH2. Предпочтительно R1 и R2, взятые вместе, представляют собой неразветвленный С 3-С 4 алкилен, возможно замещенный оксо, где одна метиленовая группа указанного С 3-С 4 алкилена заменена атомом кислорода или атомом азота, причем указанный атом азота возможно замещен R10. Предпочтительно R1 и R2, взятые вместе, представляют собой неразветвленный пропилен, где одна метиленовая группа заменена атомом кислорода, или неразветвленный бутилен, где одна метиленовая группа заменена атомом азота, причем указанные пропилен и бутилен возможно замещены оксо, а указанный атом азота возможно замещен R10. Предпочтительно R1 и R2, взятые вместе, представляют собой x-OCH2CH2-y, x-CONHCH2CH2-y,x-CH2NHCH2CH2-y, x-CH2N(CH3)CH2CH2-y, x-CH2N(4-цианофенилметил)CH2CH2-y или x-CH2N(4-метоксифенилметил)CH2CH2-y, где х представляет собой место присоединения к атому углерода пиразольного кольца, и у представляет собой место присоединения к атому азота пиразольного кольца. Предпочтительно R3 представляет собой Н или C1-С 6 алкил, причем указанный C1-С 6 алкил возможно замещен галогено, -CN, -OR5, -СО 2R5, -CONR5R5, -OCONR5R5, -NR5CO2R5, -NR6R6, -NR5COR5,-SO2NR5R5, -NR5CONR5R5, -NR5SO2R5, R8 или R9.-С(СН 3)3. Предпочтительно R3 представляет собой -СН 3, -СН 2 СН 3, -СН(СН 3)2 или циклопропил. Предпочтительно R4 представляет собой фенил, возможно замещенный R8, галогено, -CN, C1 С 6 алкилом, C1-С 6 галогеноалкилом, C3-С 7 циклоалкилом или C1-С 6 алкокси. Предпочтительно R4 представляет собой фенил, замещенный R8, галогено, -CN, C1-С 6 алкилом, C1 С 6 галогеноалкилом, C3-С 7 циклоалкилом или C1-С 6 алкокси. Предпочтительно R4 представляет собой фенил, замещенный галогено, -CN или C1-С 6 алкилом. Предпочтительно R4 представляет собой фенил, замещенный фторо, хлоро, -CN или метилом. Предпочтительно R4 представляет собой 3-цианофенил, 4-хлорфенил, 3-хлорфенил, 2-хлорфенил, 3 фторфенил, 2-фторфенил, 3,5-дихлорфенил, 2,6-дихлорфенил, 2,3-дихлорфенил, 2,4-дихлорфенил, 3,4 дихлорфенил, 3,5-дихлорфенил, 2,6-дифторфенил, 2,3-дифторфенил, 3,5-дифторфенил, 2,5-дифторфенил,3,5-дицианофенил, 3,5-диметилфенил, 4-фтор-3-метилфенил, 3-циано-4-фторфенил, 3-циано-5 фторфенил, 2-хлор-4-цианофенил, 3-хлор-5-цианофенил, 3-циано-5-метилфенил или 4-циано-2,6 диметилфенил. Предпочтительно R4 представляет собой 3,5-дицианофенил, 3-циано-5-фторфенил, 3-хлор-5 цианофенил или 3-циано-5-метилфенил. В альтернативном ряду предпочтений: Предпочтительно R4 представляет собой фенил, возможно замещенный R8, галогено, -CN, C1 С 6 алкилом, C1-С 6 галогеноалкилом, C3-С 7 циклоалкилом, C1-С 6 алкокси, -CONR5R5, OR13, SoxR6, O-(C1 С 6aлкилeн)-CONR5R5, O-(C1-С 6aлкилeн)-NR5R5 или O-(C1-С 6 алкилен)-ОR6; или нафтил. Предпочтительно R4 представляет собой фенил, замещенный R8, галогено, -CN, C1-С 6 алкилом, C1 С 6 галогеноалкилом, С 3-С 7 циклоалкилом, C1-С 6 алкокси, -CONR5R5, OR13, SoxR6, O-(C1-С 6aлкилен)CONR5R5, O-(C1-С 6aлкилeн)-NR5R5 или O-(C1-С 6 алкилен)-ОR6. Предпочтительно R8 представляет собой пирролил, имидазолил, пиразолил, 1,2,3-триазолил, 1,2,4 триазолил, тетразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, 1,2,4-оксадиазолил, 1,3,4 оксадиазолил, фуранил, тиенил, пиридинил, пиридазинил, пиримидинил или пиразинил, причем каждый возможно замещен галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(C1 С 6aлкилен)-NR5R5, C1-С 6 алкилом, фтор(C1-С 6)алкилом или С 3-С 7 циклоалкилом. Предпочтительно R8 представляет собой имидазолил, пиразолил, 1,2,4-триазолил, 1,2,4 оксадиазолил, 1,3,4-оксадиазолил, пиридинил, пиразинил или пиримидинил, причем каждый возможно замещен галогено, -CN, -COR5, -CONR5R5, -SO2NR5R5, -NR5SO2R5, -OR5, -NR5R5, -(C1-С 6aлкилeн)-NR5R5,C1-С 6 алкилом, фтор(C1-С 6)алкилом или С 3-С 7 циклоалкилом. Предпочтительно R8 представляет собой имидазолил, пиразолил, 1,2,4-триазолил, 1,2,4 оксадиазолил, 1,3,4-оксадиазолил, пиридинил, пиразинил или пиримидинил, причем каждый возможно замещен -OR5, -NR5R5 или C1-С 6 алкилом. Предпочтительно R8 представляет собой имидазолил, пиразолил, 1,2,4-триазолил, 1,2,4 оксадиазолил, 1,3,4-оксадиазолил, пиридинил, пиразинил или пиримидинил, причем каждый возможно замещен -ОН, -NH2 или метилом. Предпочтительно R8 представляет собой пиразол-1-ил, 2-метилимидазол-1-ил, 1,2,4-триазол-1-ил, 3 гидроксипиразол-5-ил, 2-гидрокси-1,3,4-оксадиазол-5-ил, 2-амино-1,3,4-оксадиазол-5-ил, 5-гидрокси 1,2,4-оксадиазол-3-ил, 2-метил-4-гидроксипиримидин-6-ил, 2-амино-4-гидроксипиримидин-6-ил, пиридин-3-ил, пиридин-2-ил или пиразин-2-ил. Предпочтительно R9 представляет собой азетидинил, тетрагидропирролил, пиперидинил, азепинил,оксетанил, тетрагидрофуранил, тетрагидропиранил, оксепинил, морфолинил, пиперазинил или диазепинил, причем каждый возможно замещен оксо, C1-С 6 алкилом, С 3-С 7 циклоалкилом, -SO2R5, -CONR5R5,-COOR5, -СО-(C1-С 6aлкилен)-ОR5 или -COR5 и возможно замещен по атому углерода, который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5, -NR5CONR5R5,-NR5SO2R5 или -CN. Предпочтительно R9 представляет собой азетидинил, пиперидинил, тетрагидрофуранил, пиперазинил или морфолинил, причем каждый возможно замещен оксо, C1-С 6 алкилом, С 3-С 7 циклоалкилом,-SO2R5, -CONR5R5, -COOR5, -СО-(C1-С 6 алкилен)-ОR5 или -COR5 и возможно замещен по атому углерода,который не является соседним с гетероатомом, галогено, -OR5, -NR5R5, -NR5COR5, -NR5COOR5,-NR5CONR5R5, -NR5SO2R5 или -CN. Предпочтительно R9 представляет собой азетидинил, пиперидинил, тетрагидрофуранил, пиперазинил или морфолинил, причем каждый возможно замещен C1-С 6 алкилом, -SO2R5, -CONR5R5, -COOR5,-СО-(C1-С 6 алкилен)-ОR5 или -COR5 и возможно замещен по атому углерода, который не является соседним с гетероатомом, -OR5 или -NR5COR5. Предпочтительно R9 представляет собой азетидинил, пиперидинил, тетрагидрофуранил, пиперазинил или морфолинил, причем каждый возможно замещен -СН 3, -SO2 СН 3, -CONH2, -СООСН 3,-4 007184-СОСН 2 ОСН 3 или -СОСН 3 и возможно замещен по атому углерода, который не является соседним с гетероатомом, -ОСН 3 или -NHCOCH3. Предпочтительно R9 представляет собой 4-метоксипиперидин-1-ил, 4-аминокарбонилпиперидин-1 ил, 4-метилкарбониламинопиперидин-1-ил, пиперазин-1-ил, 4-метилпиперазин-1-ил, 4-метилкарбонилпиперазин-1-ил, 4-метоксиметилкарбонилпиперазин-1 -ил, 4-метоксикарбонилпиперазин-1 -ил,4-метилсульфонилпиперазин-1-ил, морфолин-4-ил, тетрагидрофуран-2-ил, морфолин-3-ил, азетидин-3-ил или 1-метилазетидин-3-ил. Предпочтительно R10 представляет собой Н, R8, R9, R13, C1-С 6 алкил или -(C1-С 6 алкил)-(С 3 С 7 циклоалкил), причем указанный C1-С 6 алкил возможно замещен -OR5, -OR13, R8, R9, R13 или -COR13. Предпочтительно R10 представляет собой Н, R8, R9, R13, C1-С 6 алкил или -(C1-С 6 алкил)-(С 3 С 7 циклоалкил), причем указанный C1-С 6 алкил возможно замещен -OR5 или R13. Предпочтительно R10 представляет собой Н, R8, R9, R13, -СН 3, -СН 2 СН 3 или -СН 2(циклопропил),причем указанные -СН 3 и -СН 2 СН 3 возможно замещены -ОСН 3 или R13. Предпочтительно R10 представляет собой Н, R8, R9, R13, -СН 3, -СН 2 СН 3, -СН 3 СН 2OСН 3,-СН 2(циклопропил), 4-цианофенилметил, 4-фторфенилметил, 4-метоксифенилметил, 4-аминосульфонилфенилметил или 4-аминокарбонилфенилметил. Предпочтительно R11 представляет собой Н или C1-С 6 алкил, причем указанный C1-С 6 алкил возможно замещен -OR5, -NR5R5, -NR5COR5, -CONR5R5, R8 или R9. Предпочтительно R11 представляет собой Н или C1-С 6 алкил, причем указанный C1-С 6 алкил возможно замещен -OR5 или -NR5COR5. Предпочтительно R11 представляет собой Н, -СН 3 или -СН 2 СН 3, причем указанные -СН 3 и -СН 2 СН 3 возможно замещены -ОН или -NНСОСН 3. Предпочтительно R11 представляет собой Н, -СН 3, -СH2 СН 2NНСОСН 3 или -CH2CH2OH. Предпочтительно R12 представляет собой C1-С 4 алкил, замещенный R8, R9, -OR5, -CONR5R5,5-ОСН 3. Предпочтительно R13 представляет собой 4-цианофенил, 3-цианофенил, 4-фторфенил, 4 метоксифенил, 4-аминокарбонилфенил или 4-аминосульфонилфенил. Предпочтительные группы соединений по изобретению включают в себя все сочетания предпочтительных определений для отдельных заместителей, приведенных выше. Также предпочтительными согласно изобретению являются соединения формулы (I) или их фармацевтически приемлемые соли, сольваты или производные, гдеR1 представляет собой Н, C1-С 6 алкил, -ОC1-С 6 алкил, -ОC3-С 7 циклоалкил, причем указанный C1 С 6 алкил возможно замещен R15;R2 представляет собой Н, C1-С 3 алкил, пропенил или С-связанный R15, причем указанный C1-С 3 алкил возможно замещен -ОН, -ОСН 3, -OCH2CH2NH2, -CN, -СO2 СН 3, -CONH2, -C(=NH)NH2, -CONHNH2, -NH2,-NНСН 3, -N(СН 3)2, -NHCH2CH2NHCOCH3, -NНСН 2 СН 2OСН 3, -NHCH2R15, -NHCOR15, -NНСОСН 2OСН 3 или R15;R15 представляет собой азетидинил, тетрагидрофуранил, морфолинил, пиперазинил, пиразолил, оксадиазолил, пиридинил или пиримидинил, причем каждый возможно замещен -ОН, -NH2, оксо, или C1 С 6 алкилом или группой -СО(C1-С 6 алкил).-5 007184 Предпочтительные отдельные соединения по изобретению включают в себя примеры, приведенные ниже, в частности, примеры 117, 118, 119, 120, 122, 123, 124, 125, 126, 127 и 128, и их фармацевтически приемлемые соли и сольваты. Все соединения формулы (I) могут быть получены посредством общепринятых путей, таких как методы, которые описаны в общих способах, представленных ниже, или посредством конкретных способов, описанных в разделе "Примеры", или посредством способов, подобным им. Настоящее изобретение также охватывает один или более чем один любой из этих способов получения соединений формулы (I),в дополнение к любым новым промежуточным соединениям, используемым в нем. В следующих общих способах R1, R2, R3 и R4 являются такими, как определено выше для соединения формулы (I), если не указано иначе. Кроме случаев, когда либо R1, либо R3 представляют собой галогено, -OR7 или -CN, соединения формулы (I) могут быть получены при использовании способа, показанного на схеме 1, которая следует ниже. Согласно схеме 1 соединения формулы (I) могут быть получены посредством конденсации соединения формулы (II) с соединением формулы H2NNHR2 (V) или его солью или гидратом, возможно в присутствии кислоты или основания, причем основание предпочтительно представляет собой третичный амин, такой как триэтиламин, и кислота предпочтительно представляет собой уксусную кислоту. В типовом методе раствор соединения формулы (II) в подходящем растворителе, таком как этанол, обрабатывают соединением формулы (V) или его солью или гидратом и, в случае использования, подходящими кислотой или основанием при температуре от комнатной до температуры дефлегмации растворителя. В предпочтительном методе реакционную смесь нагревают с обратным холодильником. Схема 1 Функциональные эквиваленты соединений формулы (II) также можно использовать в этой реакции. Они включают в себя соединения формулы (VI) или (VII), в которых L1 и L2, соответственно каждый,представляет собой подходящую уходящую группу, предпочтительно -N(C1-С 6 алкил)2, наиболее предпочтительно -N(СН 3)2. Таким образом, соединение формулы (I) может быть получено посредством конденсации соединения формулы (VI) или (VII) с соединением формулы (V) или его солью или гидратом, возможно в присутствии кислоты или основания, причем основание предпочтительно представляет собой третичный амин, такой как триэтиламин, и кислота предпочтительно представляет собой уксусную кислоту. В типовом методе раствор соединения формулы (VI) или (VII) в подходящем растворителе, таком как этанол,обрабатывают соединением формулы (V) или его солью или гидратом и, в случае использования, подходящей кислотой или основанием при температуре от комнатной до температуры дефлегмации растворителя. В предпочтительном методе реакционную смесь нагревают с обратным холодильником. Соединения формулы (VI) или (VII) особенно подходят для синтеза соединений формулы (I), в которых R1 или R3 соответственно представляет собой Н. Соединения формулы (VI), в которых R1 представляет собой Н и L1 представляет собой диметиламино, могут быть получены посредством взаимодействия соединения формулы (VIII) с диметилацеталем диметилформамида при повышенной температуре, предпочтительно при температуре примерно 100 С. Соединения формулы (VII), в которых R1 представляет собой Н и L1 представляет собой диметиламино,могут быть получены посредством взаимодействия соединения формулы (IX) в тех же условиях. Другие-6 007184 соединения формулы (VI) или (VII), в которых L1 или L2 представляет собой диметиламино, могут быть получены аналогично Соединения формулы (VIII) либо имеются в продаже, либо могут быть получены посредством взаимодействия соединения формулы(XI) В типовом методе раствор соединения формулы (XI) в подходящем растворителе, таком как ацетон,обрабатывают подходящим основанием, таким как карбонат цезия, и соединением формулы (X). В предпочтительном методе реакционную смесь нагревают, например, с обратным холодильником. Возможно добавление нуклеофильного катализатора, такого как иодид натрия или иодид тетрабутиламмония. Соединения формулы (IX) либо имеются в продаже, либо могут быть получены из соединения формулы(XII) и соединения формулы (XI) при помощи того же способа, каким может быть получено соединение формулы (VIII) из соединения формулы (X). Соединения формулы (II) могут быть получены посредством взаимодействия соединения формулы(III) с соединением формулы (XI). В типовом методе раствор соединения формулы (III) в подходящем растворителе, таком как ацетон,обрабатывают соединением формулы (XI) и подходящим основанием, таким как карбонат калия или цезия, и нагревают, предпочтительно с обратным холодильником. Возможно добавление нуклеофильного катализатора, такого как иодид натрия или иодид тетрабутиламмония. Соединения формулы (III) либо имеются в продаже, либо могут быть получены посредством взаимодействия соединения формулы (IV) с хлорирующим реагентом. В типовом методе охлажденный раствор соединения формулы (IV) в подходящем растворителе, таком как ацетонитрил, обрабатывают сначала бромидом тетрабутиламмония и хлортриметилсиланом, а затем сухим диметилсульфоксидом. В другом типовом методе соединение формулы (IV) обрабатывают сульфурилхлоридом, возможно в присутствии подходящего растворителя, такого как дихлорметан. Соединения формулы (I), в которых R1 или R3 представляют собой -OR7, могут быть получены при использовании способа, показанного на схеме 2, следующей ниже, в которой R3 представляет собой C1 С 6 алкил и L3 представляет собой подходящую уходящую группу, предпочтительно трифторметансульфонат. На схеме 2 соединения формулы (I), в которых R1 представляет собой -OR7, могут быть получены посредством взаимодействия соединения формулы (XIII) со спиртом формулы(XXI) в присутствии подходящего палладиевого катализатора и монооксида углерода. В типовом методе смесь соединения формулы (XIII), подходящего палладиевого катализатора, такого как хлорид 1,1'бис(дифенилфосфино)ферроценпалладия (II), спирта формулы (XXI) и, возможно, подходящего растворителя, такого как N,N-диметилформамид, нагревают предпочтительно примерно до 50 С в атмосфере монооксида углерода, предпочтительно при давлении 345 кПа. Соединения формулы (XIII) могут быть получены посредством дериватизации соединения формулы (XV). В случае, когда L3 представляет собой трифторметансульфонат, подходящим дериватизирующим агентом является фенилтрифламид (фенилтрифторметансульфонамид). В типовом методе, когда L3 представляет собой трифторметансульфонат, раствор соединения формулы (XV) и подходящего основания, предпочтительно триалкиламинного основания, такого как триэтиламин, в подходящем растворителе, таком как дихлорметан, обрабатывают фенилтрифламидом. Соединение формулы (XV) может быть получено посредством взаимодействия соединения формулы (XVII) с соединением формулы (V) или его солью или гидратом, возможно в присутствии кислоты или основания, причем основание предпочтительно представляет собой третичный амин, такой как триэтиламин, и кислота предпочтительно представляет собой уксусную кислоту. В типовом методе раствор соединения формулы (XVII) в подходящем растворителе, таком как этанол, обрабатывают соединением формулы (V) или его солью или гидратом и, в случае использования, подходящими кислотой или основанием при температуре от комнатной до температуры дефлегмации растворителя. В предпочтительном методе реакционную смесь нагревают с обратным холодильником. Соединения формулы (XVII) могут быть получены посредством взаимодействия соединения формулы (XIX) с соединением формулы (XI). В типовом методе раствор соединения формулы (XVII) в подходящем растворителе, таком как ацетон, обрабатывают соединением формулы (XI) и подходящим основанием, таким как карбонат калия или цезия, и нагревают, предпочтительно с обратным холодильником. Возможно добавление нуклеофильного катализатора, такого как иодид натрия или иодид тетрабутиламмония. На схеме 2 соединения формулы (I), в которых R3 представляет собой -OR7, могут быть получены из соединения формулы (XX) при помощи того же способа, каким получают соединение формулы (I), в котором R1 представляет собой -OR7, из соединения формулы (XIX), как изложено выше, внося необходимые изменения. Хлоркетоэфиры формулы (XIX) и (XX) либо имеются в продаже, либо могут быть получены посредством хлорирования соответствующих кетоэфиров, например, при использовании сульфонилхлорида. Альтернативно соединения формулы (I), в которых R1 или R3 представляет собой -OR7, могут быть получены из соединений формулы (XV) или (XVI) соответственно, посредством взаимодействия с со-8 007184 единением формулы (XXI) в условиях дегидратации, например, при использовании реакции Мицунобу. В типовом методе раствор соединения формулы (XV) или (XVI) в подходящем растворителе, таком как тетрагидрофуран, обрабатывают диэтилазодикарбоксилатом, трифенилфосфином и соединением формулы (XXI). Соединения формулы (I), в которых R1 или R3 представляет собой галогено, могут быть получены посредством взаимодействия, соответственно, соединения формулы (XV) или соединения формулы(XVI) с подходящим галогенирующим агентом. В типовом методе соединение формулы (XV) или (XVI) обрабатывают РОСl3, возможно в присутствии подходящего растворителя, такого как диметилформамид,с получением соединения формулы (I), в котором R1 или R3 соответственно представляет собой хлор. Специалистам в данной области техники будет понятно, что во многих случаях соединения формулы (I) могут быть превращены в другие соединения формулы (I) посредством преобразований функциональных групп. Например: а) соединения формулы (I), в которых R2 представляет собой водород, могут быть превращены в соединения формулы (I), в которых R2 является возможно замещенным C1-C6 алкилом посредством взаимодействия с подходящим алкилирующим агентом. В типовом методе раствор соединения формулы (I), в котором R2 представляет собой водород, в подходящем растворителе, таком как этанол или N,Nдиметилформамид, обрабатывают алкилбромидом и основанием, таким как этоксид натрия или гидрид натрия, и нагревают при температуре от комнатной до температуры дефлегмации растворителя. Предпочтительным сочетанием является N,N-диметилформамид в качестве растворителя, гидрид натрия в качестве основания и комнатная температура. Примеры конкретных алкилирующих агентов включают в себя бромацетонитрил, этил-4-хлорацетоацетат, метилбромацетат и гидрохлорид хлорэтиламина. Применение дополнительных конкретных алкилирующих агентов проиллюстрировано в примерах, приведенных ниже; б) соединения формулы (I), в которых R1, R2 или R3 содержит эфирную функциональную группу,могут быть восстановлены подходящим восстановителем, таким как алюмогидрид лития, с получением соответствующих соединений формулы (I), в которых R1, R2 или R3 содержит гидроксигруппу. В типовом методе раствор соединения формулы (I), в котором R1, R2 или R3 содержит эфирную группу, в подходящем растворителе, таком как диэтиловый эфир, обрабатывают алюмогидридом лития, предпочтительно при охлаждении до температуры от -78 до 0 С; в) соединения формулы (I), в которых R1, R2 или R3 замещены гетероциклом формулы R6, могут быть получены посредством стандартных реакций образования гетероциклов, хорошо известных специалистам в данной области техники (смотри, например, Advanced Organic Chemistry, 3nd Edition, by GerryMarch или Comprehensive Heterocyclic Chemistry, A.R. Katritzky, C.W. Rees, E.F.V. Scriven, Volumes 1-11). Например, соединения формулы (I), в которых R2 представляет собой (2-амино-6-гидроксипиримидин-4 ил)метил, могут быть получены посредством последовательного взаимодействия соединения формулы(I), в котором R2 представляет собой водород, с хлорацетоацетатом и затем гидрохлоридом гуанидина. Эта и другие сходные реакции образования гетероциклов проиллюстрированы в примерах, приведенных ниже; и г) соединения формулы (I), в которых R1 или R3 представляет собой -CO2R5, где R5 отличен от Н,могут быть превращены в соединения формулы (I), в которых R1 или R3, соответственно, представляет собой -СO2 Н, посредством гидролиза. Типично реакцию будут проводить в подходящем растворителе,таком как водный этанол или водный 1,4-диоксан, и в присутствии основания, такого как гидроксид натрия. Такая кислота может быть превращена в первичный амид посредством взаимодействия с аммиаком и подходящим агентом сочетания, таким как карбодиимид, например, дициклогексилкарбодиимид. Такой первичный амид затем может быть превращен в нитрил посредством дегидратации при помощи подходящего дегидратирующего агента, такого как фосфорилхлорид. д) соединения формулы (I), в которых R1 или R3 представляет собой C1-С 6 алкил, могут быть превращены в соединения формулы (I), в которых R1 или R3, соответственно, представляет собой C1 С 6 алкил, замещенный галогено (таким как бромо), посредством галогенирования при использовании подходящего галогенирующего агента. Реакцию удобно проводить в присутствии растворителя, такого как галогеноалкан (например, дихлорметан), и температуре окружающей среды. Подходящие галогенирующие агенты включают в себя галогены (например, бром) или N-галогеносукцинимиды (например, Nбромсукцинимид). Соединения формулы (I), содержащие группу -ОН, -NH или -NH2, могут быть получены посредством удаления защиты с соответствующего соединения, несущего группу -ОР 1, -NP1 или NHP1, соответственно, где группа Р 1 представляет собой подходящую защитную группу. Примеры подходящих защитных групп будут очевидны специалисту в данной области техники [см., например, 'Protecting groups inOrganic Synthesis (Second Edition)' by Theodora W. Green and Peter G.M. Wuts, 1991, John Wiley and Sons]. Такие соединения, несущие группу -ОР 1, -NP1 или NHP1, могут быть получены при использовании методов, описанных выше, при внесении необходимых изменений. Соединения формулы (IV), (V) и (XXI) либо имеются в продаже, либо их легко получить при помощи способов, хорошо известных специалистам в данной области техники.-9 007184 Соединения формулы (I) могут быть введены отдельно, но обычно их будут вводить в смеси с подходящим фармацевтическим эксципиентом, разбавителем или носителем, выбранным в соответствии с намеченным путем введения и общепринятой фармацевтической практикой. Например, соединения формулы (I) могут быть введены перорально, трансбуккально или сублингвально в форме таблеток, капсул, множества частиц, гелей, пленок, овулей, эликсиров, растворов или суспензий, которые могут содержать корригенты или красители, для применения с немедленным, замедленным, модифицированным, непрерывным, импульсным или контролируемым высвобождением. Соединения формулы (I) также могут быть введены в виде быстродиспергируемых или быстрорастворимых лекарственных форм или в форме высокоэнергетической дисперсии или покрытых оболочкой частиц. Подходящие препараты соединений формулы (I) могут находиться в виде лекарственной формы, покрытой или непокрытой оболочкой, как требуется. Такие твердые фармацевтические композиции как, например, таблетки могут содержать эксципиенты, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция, гидрофосфат кальция, глицин и крахмал (предпочтительно кукурузный, картофельный или маниоковый крахмал), разрыхлители, такие как крахмалгликолят натрия, кроскармелоза натрия и некоторые комплексные силикаты, и связывающие вещества для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидроксипропилцеллюлоза (НРС), сахароза, желатин и аравийская камедь. Дополнительно могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота,глицерилбегенат и тальк. Общий пример В состав таблетки типично может входить от 0,01 до 500 мг активного соединения, тогда как общая масса таблетки с наполнителями может находиться в пределах от 50 до 1000 мг. Пример состава таблетки массой 10 мг проиллюстрирован ниже: Ингредиент Таблетки производят посредством общепринятого способа, например, прямым прессованием или влажным или сухим гранулированием. Ядра таблеток могут быть покрыты соответствующими покрытиями. Твердые композиции подобного типа также могут быть использованы как наполнители желатиновых и НРМС капсул. Предпочтительные эксципиенты в этом отношении включают в себя лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. Для водных суспензий и/или эликсиров соединения формулы (I) могут быть смешаны с различными подслащивающими веществами или корригентами, красящими веществами или красителями, с эмульгаторами и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и их сочетаниями. Соединения формулы (I) также могут быть введены парентерально, например внутривенно, внутриартериально, внутрибрюшинно, интратекально, интравентрикулярно, интрауретрально, интрастернально,интракраниально, внутримышечно или подкожно, или они могут быть введены посредством инфузии или безыгольной инъекции. Для такого парентерального введения их лучше всего использовать в форме стерильного водного раствора, который может содержать другие вещества, например достаточное количество солей или глюкозы, для того, чтобы сделать раствор изотоничным по отношению к крови. Водные растворы следует соответствующим образом забуферить (предпочтительно до рН от 3 до 9), если необходимо. Приготовление подходящих парентеральных препаратов в стерильных условиях легко проводить при помощи общепринятых фармацевтических методик, хорошо известных специалистам в данной области техники. Для перорального и парентерального введения пациентам-людям уровень суточной дозировки соединений формулы (I) будет обычно находиться в пределах от 0,01 до 30 мг/кг, предпочтительно от 0,01 до 5 мг/кг (в однократной или разделенных дозах). Таким образом, таблетки или капсулы с соединением формулы (I) могут содержать от 1 до 500 мг активного соединения для введения по отдельности или двух или более таблеток одновременно, как целесообразно. Врач, так или иначе, определит эффективную дозировку, которая будет наиболее подходящей для любого отдельного пациента и будет изменяться в зависимости от возраста, массы и ответной реакции конкретного пациента. Вышеуказанные дозировки являются примером среднестатистического случая. Конечно, могут быть индивидуальные случаи, когда полезными являются более высокие или более низкие дозировки, и они входят в объем настоящего изобретения. Специалисту в данной области- 10007184 техники будет понятно, что при лечении определенных состояний соединения формулы (I) могут быть взяты в виде однократной дозы, как необходимо или требуется. Соединения формулы (I) также можно вводить интраназально или посредством ингаляции и удобно доставлять в форме порошкового ингалятора или аэрозоля из баллончика под давлением, помпы, распылителя, пульверизатора или небулайзера, с применением или без применения подходящего пропеллента,например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134A [товарный знак]) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA[товарный знак]), диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единицу дозировки можно регулировать посредством установки клапана для доставки дозируемого количества. Баллончик под давлением, помпа, распылитель, пульверизатор или небулайзер могут содержать раствор или суспензию активного соединения, например, при использовании смеси этанола и пропеллента как растворителя, который может дополнительно содержать смазывающее вещество, например,сорбитантриолеат. В капсулы и картриджи (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе может быть включена порошковая смесь соединения формулы (I) и подходящей порошковой основы, такой как лактоза или крахмал. Альтернативно соединения формулы (I) могут быть введены в форме суппозитория или пессария,или они могут быть применены местно в форме геля, гидрогеля, лосьона, раствора, крема, мази или присыпки. Соединения формулы (I) также могут быть введены дермально или трансдермально, например,при помощи использования кожного пластыря. Они также могут быть введены посредством пульмонального или ректального пути введения. Они также могут быть введены посредством глазного пути введения. Для глазного применения соединения могут быть приготовлены в виде микронизированных суспензий в изотоническом, с отрегулированным рН, стерильном физиологическом растворе или, предпочтительно, в виде растворов в изотоническом, с отрегулированным рН, стерильном физиологическом растворе, возможно в сочетании с консервантом, таким как хлорид бензилалкония. Альтернативно, они могут быть введены в мазь, такую как вазелин. Для местного применения на кожу соединения формулы (I) могут быть приготовлены в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное, например, в смеси с одним или более чем одним из нижеследующих: минеральным маслом, жидким вазелином, белым вазелином, пропиленгликолем, соединением полиоксиэтилена или полиоксипропилена, эмульгирующим воском и водой. Альтернативно, они могут быть приготовлены в виде подходящего лосьона или крема, суспендированного или растворенного, например, в смеси одного или более чем одного из нижеследующих: минерального масла, сорбитанмоностеарата, полиэтиленгликоля, вазелинового масла, полисорбата 60,цетиловых эфиров, воска, цетеарилового спирта, 2-октилдодеканола, бензилового спирта и водой. Соединения формулы (I) также могут быть использованы в сочетании с циклодекстрином. Циклодекстрины, как известно, образуют комплексы включения и невключения с молекулами лекарственного средства. Образование комплекса лекарственное средство-циклодекстрин может изменить растворимость, скорость растворения, биодоступность и/или устойчивость молекулы лекарственного средства. Комплексы лекарственное средство-циклодекстрин как правило пригодны для большинства лекарственных форм и путей введения. В качестве альтернативы прямому комплексообразованию с лекарственным средством циклодекстрин может быть использован в виде вспомогательного вещества, например, в виде носителя, разбавителя или солюбилизатора. Наиболее часто используют альфа-, бета- и гаммациклодекстрины, и подходящие примеры описаны в WO-A-91/11172, WO-А-94/02518 и WO-A-98/55148. Следует понимать, что все приведенные здесь ссылки, касающиеся лечения, включают в себя терапевтическое, паллиативное и профилактическое лечение. Пероральное введение является предпочтительным. В объем настоящего изобретения включены воплощения, которые включают в себя совместное введение соединения по настоящему изобретению с одним или более чем одним дополнительным терапевтическим агентом, и композиции, содержащие соединение по настоящему изобретению вместе с одним или более чем одним дополнительным терапевтическим агентом. Такая комбинированная терапия особенно полезна для предупреждения и/или лечения инфекции, вызванной ВИЧ и родственными ретровирусами, которые могут быстро мутировать в штаммы, устойчивые к любой монотерапии. Альтернативно,дополнительные терапевтические агенты могут быть желательны для лечения заболеваний и состояний,которые являются следствием или сопутствуют заболеванию, которое лечат соединением по настоящему изобретению. Например, при лечении инфекции ВИЧ или родственной ретровирусной инфекции может оказаться желательным дополнительное лечение оппортунистических инфекций, неоплазм и других состояний, которые встречаются в результате иммунокомпрометированного состояния пациента, подвергаемого лечению. Предпочтительные сочетания по настоящему изобретению включают в себя одновременное или последовательное лечение соединением формулы (I), как оно определено выше, или его фармацевтически приемлемой солью и- 11007184 а) одним или более чем одним ингибитором обратной транскриптазы, таким как зидовудин, диданозин, залцитабин, ставудин, ламивудин, абакавир и адефовир; б) одним или более чем одним ненуклеозидным ингибитором обратной транскриптазы, таким как невирапин, делавирдин и эфавиренц; в) одним или более чем одним ингибитором протеазы ВИЧ, таким как индинавир, ритонавир, саквинавир и нелфинавир; г) одним или более чем одним антагонистом CCR5, таким как ТАК-779; д) одним или более чем одним антагонистом CXCR4, таким как AMD-3100; е) одним или более чем одним ингибитором интегразы; ж) одним или более чем одним ингибитором слияния вируса, таким как T-20; з) одним или более чем одним исследуемым лекарственным средством, таким как тризивир, KNI272, ампренавир, GW-33908, FTC, PMPA, S-1153, MKC-442, MSC-204, MSH-372, DMP450, PNU-140690,ABT-378, KNI-764, DPC-083, ТМС-120 или ТМС-125; или и) одним или более чем одним противогрибковым или антибактериальным агентом, таким как флюконазол. Активность соединений по изобретению в качестве ингибиторов обратной транскриптазы и в качестве агентов для лечения инфекций ВИЧ может быть определена при использовании следующих анализов. А. Ингибирование фермента обратной транскриптазы ВИЧ-1. Активность соединений по изобретению в отношении обратной транскриптазы можно проанализировать следующим образом. Используя очищенную рекомбинантную обратную транскриптазу ВИЧ-1(RT, ЕС, 2.7.7.49), полученную посредством экспрессии в Escherichia Coli, создали систему анализа на 96-луночных планшетах для анализа большого числа образцов при использовании либо ферментной системы анализа поли(rА)-олиго(dТ) обратная транскриптаза [3H]-SPA (Amersham NK9020), либо ферментной системы анализа [3 Н]-флэшпланшет (flashplate) (NEN - SMP 103), и следуя рекомендациям производителя. Соединения растворяли в 100% диметилсульфоксиде (ДМСО) и разбавляли подходящим буфером до конечной концентрации ДМСО 5%. Ингибирующую активность выражали в процентах ингибирования по отношению к ДМСО контролю. Концентрацию, при которой соединение ингибировало обратную транскриптазу на 50%, выражали в виде IС 50 соединения. Соединения по примерам 7, 20 и 51 при тестировании в соответствии с вышеуказанной методикой имели значения IC50 39000, 3200 и 248 нмоль соответственно. Б. Анализ культуры клеток вируса иммунодефицита человека (ВИЧ-1). Анти-ВИЧ активность выбранных примеров по изобретению анализировали посредством следующих методик. 1) Клетки SupT1 культивировали на среде RPMI-1640 с добавлением 10% фетальной телячьей сыворотки и разделяли так, чтобы они находились в фазе роста в день использования. 2) Соединения растворяли в 100% ДМСО и разбавляли вышеуказанной культуральной средой до заданных концентраций и вносили в 20 мкл аликвотах в 96-луночный микротитрационный планшет (конечная концентрация ДМСО 0,1%). 3) Для получения инфицированных клеток 100 мкл RF вирусов (TCID50 107/мл) добавляли к 106 клеток и инкубировали в течение 1 ч при 37 С. Клетки затем дважды промывали в фосфатно-солевом буферном растворе (PBS) и ресуспендировали в культуральной среде при плотности 2,2105 клеток/мл. 180 мкл этих инфицированных клеток переносили в лунки 96-луночного планшета, содержащие соединения. 4) Планшет инкубировали в СО 2-инкубаторе при 37 С в течение 4 дней. Скорости выживания клеток измеряли, следуя рекомендациям производителя (CellTiter 96 AQueous Non-Radioactive Assay Promega (номер по каталогу: G5430. Концентрацию, при которой соединение ингибировало цитотоксическое действие вируса на 50%, выражали в виде EC50. Таким образом, согласно данному изобретению предложены: 1) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное; 2) способ получения соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или производного; 3) фармацевтическая композиция, включающая в себя соединение формулы (I) или его фармацевтически приемлемые соль, сольват или производное вместе с фармацевтически приемлемым эксципиентом, разбавителем или носителем; 4) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в качестве лекарственного средства; 5) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в качестве ингибитора или модулятора обратной транскриптазы; 6) соединение формулы (I) или его фармацевтически приемлемые соль, сольват или композиция для применения в лечении инфекции ВИЧ или генетически родственной ретровирусной инфекции или проистекающего из нее синдрома приобретнного иммунодефицита (СПИДа);- 12007184 7) применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции для производства лекарственного средства, обладающего ингибирующей или модулирующей активностью в отношении обратной транскриптазы; 8) применение соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции для производства лекарственного средства для лечения инфекции ВИЧ или генетически родственной ретровирусной инфекции или проистекающего из нее синдрома приобретнного иммунодефицита (СПИДа); 9) способ лечения млекопитающего, включая человека, с использованием ингибитора или модулятора обратной транскриптазы, при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) либо его фармацевтически приемлемых соли, сольвата или композиции; 10) способ лечения млекопитающего, включая человека, для лечения инфекции ВИЧ или генетически родственной ретровирусной инфекции или проистекающего из нее синдрома приобретнного иммунодефицита (СПИДа), при котором указанного млекопитающего лечат эффективным количеством соединения формулы (I) или его фармацевтически приемлемых соли, сольвата или композиции; и 11) некоторые новые промежуточные соединения, раскрытые здесь. Следующие примеры иллюстрируют получение соединений формулы (I). Синтез некоторых промежуточных соединений, использованных при этом, описан в разделе "Получения", который следует за примерами. Спектры протонного магнитного резонанса (1 Н ЯМР) во всех случаях соответствовали предложенным структурам. Характеристические химические сдвигиданы в миллионных долях относительно тетраметилсилана, с использованием традиционных сокращений для обозначения главных пиков: например, s, синглет; d, дублет; t, триплет ; q, квартет; m, мультиплет; br, уширенный. Были использованы следующие сокращения: HRMS, масс-спектрометрия высокого разрешения; ВЭЖХ, высокоэффективная жидкостная хроматография; ЯЭО, ядерный эффект Оверхаузера; m.р., точка плавления; CDCl3, дейтерохлороформ; D6-ДМСО, дейтеродиметилсульфоксид; CD3OD, дейтерометанол. В случае использования тонкослойной хроматографии (ТСХ) обращались к ТСХ на силикагеле, используя пластины с силикагелем 60 F254, Rf представляет собой отношение расстояния, пройденного соединением, к расстоянию,пройденному фронтом растворителя на пластине ТСХ. Пример 1. 2-[4-(3,5-Дихлорфенокси)-3,5-диметил-1H-пиразол-1-ил]этанол. 2-Гидроксиэтилгидразин (21,5 мкл; 0,316 ммоль) добавляли к перемешиваемому раствору дикетона по получению 1 (75 мг; 0,287 ммоль) в этаноле (2,9 мл) при комнатной температуре в атмосфере азота и полученный оранжевый раствор нагревали с обратным холодильником в течение 18 ч. После охлаждения смесь концентрировали при пониженном давлении. Остаток растворяли в дихлорметане (20 мл) и промывали 2 М соляной кислотой (10 мл) и рассолом (10 мл), а затем сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось вязкое оранжевое масло. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле,элюируя смесью пентан:этилацетат (10:1, по объему), затем дихлорметаном, с получением соединения,указанного в заголовке (32 мг), в виде белого порошка, m.р.=114-115 С. 1 К перемешиваемому раствору хлоркетона по получению 2 (500 мг; 3,07 ммоль) в ацетоне (15 мл) последовательно добавляли 3,5-дихлорфенол (501 мг; 3,07 ммоль), карбонат калия (467 мг; 3,38 ммоль) и- 13007184 в конце иодид натрия (461 мг; 3,07 ммоль) при комнатной температуре и в атмосфере азота, получая оранжевую/красную суспензию. Смесь нагревали с обратным холодильником в течение 22,5 ч, получая желтую суспензию. После охлаждения смесь разбавляли водой (10 мл) и удаляли ацетон при пониженном давлении в вытяжном шкафу (осторожно: возможно присутствие остаточного слезоточивого отравляющего вещества). Остаток разбавляли 2 М соляной кислотой и экстрагировали дихлорметаном (120 мл; 210 мл). Объединенные органические слои промывали рассолом (20 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставался неочищенный 4-(3,5-дихлорфенокси)-3,5-гептандион в виде оранжевого масла (777 мг). Часть неочищенного 4-(3,5-дихлорфенокси)-3,5-гептандиона (250 мг; приблизительно 0,865 ммоль) растворяли в этаноле(8,6 мл) и обрабатывали 2-гидроксиэтилгидразином (65 мкл; 0,951 ммоль). Полученный раствор нагревали с обратным холодильником в течение 16 ч, получая красный раствор. После охлаждения смесь концентрировали при пониженном давлении и остаток растворяли в дихлорметане (20 мл). Полученный раствор промывали 2 М соляной кислотой (10 мл), 1 н. раствором гидроксида натрия (10 мл) и рассолом (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось оранжевое масло (102 мг). Неочищенный продукт очищали посредством флэшхроматографии на силикагеле, элюируя смесью метанол:дихлорметан (5:95, по объему), с получением соединения, указанного в заголовке (23 мг), в виде оранжевого масла, которое застывало в восковидное твердое вещество при стоянии. 1 Смесь хлоркетона по получению 2 (5 г; 30,8 ммоль), 3,5-дихлорфенола (5 г; 30,8 ммоль), карбоната цезия (10 г; 30,8 ммоль) и ацетона (40 мл) нагревали с обратным холодильником в течение 18 ч. После охлаждения твердое вещество удаляли посредством фильтрации и промывали дихлорметаном (100 мл). Объединенные фильтраты концентрировали при пониженном давлении. Неочищенный продукт растворяли в этаноле (20 мл), добавляли гидразингидрат (1,5 мл; 30,8 ммоль) и смесь нагревали при 60 С в течение 30 мин в атмосфере азота. После охлаждения смесь концентрировали при пониженном давлении и остаток очищали посредством флэш-хроматографии на силикагеле, элюируя смесью эфир:пентан (1:1, по объему), с получением соединения, указанного в заголовке (5,5 г), в виде желтого масла, которое застывало при выдерживании до тех пор, пока не оставалось желтое твердое вещество, m.р.=114-115 С. 1 Гидрид натрия (60% дисперсия в масле; 470 мг; 11,8 ммоль) добавляли к перемешиваемому раствору 4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразола (3 г; 10,5 ммоль; пример 3) в безводном N,Nдиметилформамиде (20 мл) при 0 С в атмосфере азота. Смесь перемешивали в течение 5 мин, за это время выделяли водород, а затем добавляли бромацетонитрил (0,81 мл; 11,6 ммоль). Желтый раствор становился темно-коричневым, и образовывался осадок. Добавляли дополнительно безводный N,Nдиметилформамид (5 мл) для поддержания растворения, и через 45 мин реакционную смесь гасили посредством добавления воды (1 мл). Смесь распределяли между водой (150 мл) и диэтиловым эфиром(2150 мл). Объединенные органические слои промывали водой (50 мл) и рассолом (100 мл), сушили над сульфатом магния и концентрировали при пониженном давлении. Неочищенный продукт очищали по Смесь эфира (120 мг; 0,29 ммоль) по получению 3, гидразингидрата (16 мг; 0,29 ммоль) и этанола (5 мл) перемешивали и нагревали при 60 С в течение 2 ч в атмосфере азота. После охлаждения смесь концентрировали при пониженном давлении и полученное белое твердое вещество перемешивали в этилацетате и затем собирали посредством фильтрации с получением соединения, указанного в заголовке (60 мг), в виде белого твердого вещества, m.р.=142-144 С. 1 Смесь эфира (140 мг; 0,34 ммоль) по получению 3, гидрохлорида ацетамидина (95 мг; 1,0 ммоль),этоксида натрия (68 мг; 1,0 ммоль) и этанола (5 мл) перемешивали и нагревали при 70 С в течение 1 ч в атмосфере азота. После охлаждения смесь концентрировали при пониженном давлении. Полученное масло растворяли в дихлорметане (50 мл), промывали водой (20 мл), сушили над сульфатом магния и концентрировали при пониженном давлении до тех пор, пока не оставалось соединение, указанное в заголовке, в виде белой пены (100 мг). 1- 15007184 Смесь эфира (150 мг; 0,365 ммоль) из получения 3, гидрохлорида гуанидина (104 мг; 1,08 ммоль) и этоксида натрия (73 мг; 1,08 ммоль) в этаноле (5 мл) перемешивали и нагревали при 70 С в течение 3 ч в атмосфере азота. После охлаждения смесь концентрировали при пониженном давлении и полученное масло растворяли в дихлорметане (50 мл), промывали водой (20 мл), сушили над сульфатом магния и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (90:10:1, по объему), с получением соединения, указанного в заголовке, в виде белого твердого вещества (30 мг), m.р.=238-240 С. 1 Гидрохлорид гидроксиламина (1,1 г; 15,8 ммоль) и карбонат калия (2,1 г; 15,2 ммоль) добавляли к суспензии нитрила (1 г; 3,1 ммоль) по примеру 4 в смеси метанола (25 мл) и воды (10 мл), которую затем нагревали с обратным холодильником в течение 3 дней. После охлаждения смесь экстрагировали дихлорметаном (2250 мл), и объединенные органические слои промывали рассолом (100 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, с получением продукта в виде белого твердого вещества (1,1 г), m.р.=128-130 С. 1 Метилбромацетат (984 мкл; 10 ммоль) и затем гидрид натрия (60% дисперсия в масле; 801 мг; 20,1 ммоль) добавляли к перемешиваемому раствору пиразола (2,6 г; 9,12 ммоль) по примеру 3 в безводномN,N'-диметилформамиде (25 мл) при 0 С в атмосфере азота. После перемешивания в течение 1 ч при 0 С добавляли воду со льдом (100 мл) и смесь экстрагировали эфиром (350 мл). Объединенные эфирные слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии на силикагеле, элюируя смесью этилацетат:пентан(20:80, по объему), с получением соединения, указанного в заголовке (780 мг), в виде желтого масла, которое частично кристаллизовалось при выдерживании. 1- 16007184 1,1'-Карбонилдиимидазол (71 мг; 0,44 ммоль) добавляли к перемешиваемому раствору кислоты (125 мг; 0,36 ммоль) по получению 4 в безводном N,N-диметилформамиде при комнатной температуре и реакционную смесь перемешивали в течение 30 мин. Концентрированный водный аммиак (d=0,880 г/см 3; приблизительно 0,1 мл; приблизительно 1,8 ммоль) добавляли и перемешивание продолжали в течение 10 мин. Растворитель удаляли при пониженном давлении и остаток распределяли между водой (10 мл) и этилацетатом (10 мл). Органический слой концентрировали при пониженном давлении и остаток очищали посредством хроматографии на силикагеле, элюируя этилацетатом, с получением соединения, указанного в заголовке, в виде белого твердого вещества (60 мг), m.р.=164-166 С. 1 Гидразингидрат (520 мкл; 10,9 ммоль) добавляли к раствору эфира (780 мг; 2,18 ммоль) по примеру 9 в этаноле (25 мл), и полученную смесь нагревали с обратным холодильником в течение 18 ч. После охлаждения осадок собирали посредством фильтрации и промывали эфиром (50 мл) с получением соединения, указанного в заголовке (550 г), в виде белого твердого вещества, m.р. 250 С. 1 Перемешиваемый раствор гидразида (275 мг; 0,77 ммоль) по примеру 11 и 1,1'-карбонилдиимидазол(187 мг; 1,16 ммоль) в диоксане (50 мл) нагревали с обратным холодильником в течение 18 ч. После охлаждения смесь концентрировали при пониженном давлении и остаток растворяли в дихлорметане (50 мл) и промывали водой (25 мл). Органический слой сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол (95:5, по объему), с получением соединения, указанного в заголовке (112 мг), в виде белого твердого вещества, m.р.=138-142 С. 1- 17007184 Смесь пиразола (390 мг; 1,37 ммоль) по примеру 3 и гидрохлорида хлорэтиламина (238 мг; 2,05 ммоль) перемешивали и нагревали при 150 С в течение 24 ч. После охлаждения смесь распределяли между насыщенным водным раствором бикарбоната натрия (100 мл) и дихлорметаном (250 мл). Объединенные органические слои промывали рассолом (30 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Полученное коричневое масло очищали посредством флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол (90:10, по объему), с получением соединения, указанного в заголовке (244 мг), в виде коричневого масла. 1 Этилхлороформиат (0,30 мл; 3,08 ммоль) добавляли к перемешиваемому раствору амидоксима по примеру 8 (500 мг; 1,39 ммоль) в пиридине (8 мл) при 0 С в атмосфере азота и полученный раствор перемешивали в течение 10 мин. Смесь концентрировали при пониженном давлении и остаток растворяли в смеси воды (4 мл), тетрагидрофурана (4 мл) и 1 М водного раствора гидроксида натрия (2 мл). Смесь нагревали с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и перемешивали в течение еще 2 дней. Полученный раствор разбавляли 2 М водной соляной кислотой (20 мл) и экстрагировали этилацетатом (250 мл). Объединенные органические слои промывали рассолом (50 мл), сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении до тех пор, пока не оставалось желтое масло. Масло очищали посредством колоночной флэш-хроматографии на силикагеле,элюируя смесью пентан:этилацетат (50:50, по объему), с получением белого твердого вещества. Твердое вещество растворяли в смеси тетрагидрофурана (1 мл) и 1 М водного раствора гидроксида натрия (10 мл) и затем нагревали с обратным холодильником в течение 24 ч. Полученный раствор разбавляли 2 М соляной кислотой (20 мл) и экстрагировали дихлорметаном (250 мл). Объединенные органические слои промывали рассолом (50 мл), сушили над сульфатом магния, фильтровали и выпаривали при пониженном давлении с получением соединения, указанного в заголовке (113 мг), в виде белого твердого вещества, m.р.=94-96 С. 1 Цианбромид (49 мг; 0,462 ммоль) добавляли к перемешиваемому раствору гидразида по примеру 11(150 мг; 0,420 ммоль) в этаноле (30 мл) при комнатной температуре в атмосфере азота, и полученный раствор нагревали до температуры дефлегмации в течение 2,5 ч. После, охлаждения смесь концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (98:1,75:0,25, по объему), с получением соединения, указанного в заголовке (71 мг),в виде белого порошка, m.р.=226-228 С. Раствор пиразола по примеру 13 (53 мг; 0,161 ммоль), гидрохлорид 1-(3-(диметиламино)пропил)-3 этилкарбодиимида (34 мг; 0,178 ммоль) и 4-(диметиламино)пиридина (22 мг; 0,178 ммоль) в дихлорметане (1 мл) добавляли к перемешиваемому раствору метоксиуксусной кислоты (14,2 мкл; 0,178 ммоль) в дихлорметане (1 мл) при комнатной температуре. Реакционную смесь перемешивали в течение 12 ч и затем концентрировали в потоке азота до тех пор, пока не оставалось желтое твердое вещество. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол (98:2, по объему), с получением соединения, указанного в заголовке (54 мг), в виде коричневого твердого вещества, m.р.=75-76 С. 1LRMS (электрораспыление): m/z [MH+] 400; m/z [M-(H+)] 398. Микроанализ: Найдено: С, 54,09; Н, 5,79; N, 10,39. С 18 Н 23 Сl2N3 О 3 требует С, 54,01; Н, 5,79; N,10,50%. Примеры 17 и 18. Соединения по следующим приведенным в таблице примерам общей формулы получали посредством способа, сходного со способом по примеру 16, используя соответствующую кислоту в качестве исходного материала и пиразол по примеру 13. Смесь хлоркетона по получению 2 (243 мг; 1,50 ммоль), 3-цианофенола (155 мг; 1,50 ммоль), карбоната цезия (488 мг; 1,50 ммоль) и ацетона (10 мл) нагревали с обратным холодильником в течение 2 ч. После охлаждения твердое вещество удаляли посредством фильтрации и фильтрат концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Масло растворяли в этаноле (10 мл), добавляли гидроксиэтилгидразин (114 мг; 1,50 ммоль) и смесь нагревали при 60 С в течение 18 ч. После охлаждения смесь концентрировали при пониженном давлении. Раствор остатка в дихлорметане(10 мл) промывали 2 М водной соляной кислотой (5 мл) и водой (5 мл), сушили над сульфатом магния,фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось желтое масло. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя этилацетатом, с получением соединения, указанного в заголовке (80 мг), в виде бесцветного масла. 1LRMS (электрораспыление): m/z [MH+] 286; m/z [MNa+] 308. Примеры с 20 по 38. Соединения по следующим приведенным в таблице примерам общей формулы получали посредством способа, сходного со способом по примеру 19, используя соответствующие фенолы и хлоркетон по получению 2. Гидрид натрия (60% дисперсия в масле; 34 мг; 0,850 ммоль) добавляли к перемешиваемому раствору 4-(3,5-дихлорфенокси)-3,5-диэтил-1H-пиразола по примеру 3 (200 мг; 0,701 ммоль) и метоксиэтилбромида (117 мг; 0,850 ммоль) в безводном N,N-диметилформамиде (2 мл) при 0 С в атмосфере азота. Смесь перемешивали при 0 С в течение 45 мин, за это время выделяли водород, а желтый раствор становился темно-коричневым. Реакционную смесь гасили посредством добавления воды (5 мл) и смесь концентрировали при пониженном давлении. Остаток растворяли в этилацетате (20 мл) и промывали водой(10 мл) и рассолом (10 мл), а затем сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Неочищенный продукт очищали посредством флэш-хроматографии на силикагеле, элюируя смесью пентан:диэтиловый эфир (80:20, по объему), с получением соединения, указанного в заголовке (140 мг), в виде бесцветного масла.LRMS (термораспыление): m/z [MH+] 343. Микроанализ: Найдено: С, 56,25; Н, 5,94; N, 7,95. C16H20Cl2N2O2 требует С, 55,99; Н, 5,87; N, 8,16%. Примеры 40 и 41. Соединения по следующим приведенным в таблице примерам общей формулы получали посредством способа, сходного со способом по примеру 39, используя соответствующие галогениды и пиразол по примеру 3. Раствор енамина по получению 6 (2,88 г; 10,0 ммоль) и гидразингидрата (0,49 мл; 10,0 ммоль) в этаноле (10 мл) нагревали с обратным холодильником в течение 12 ч. После охлаждения добавляли дополнительно гидразингидрат (0,49 мл; 10,0 ммоль) и реакционную смесь нагревали с обратным холодильником в течение 3 ч. После охлаждения смесь концентрировали при пониженном давлении и остаток очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью циклогексан:этилацетат (80:20, по объему), а затем циклогексан:этилацетат (60:40, по объему), с получением соединения, указанного в заголовке (620 мг), в виде желтого масла. 1 Тетроксид осмия (1,00 мл 2,5%-ного раствора (мас./об.) в трет-бутаноле) добавляли по каплям к перемешиваемому раствору пиразола по примеру 64 (3,00 г; 9,23 ммоль) и периодата натрия (4,93 г; 23,1 ммоль) в ацетоне (90 мл) и воде (30 мл) при комнатной температуре. Через 5 мин образовывался белый осадок и суспензию перемешивали в течение еще 3 ч. Твердое вещество удаляли посредством фильтрации и фильтрат концентрировали при пониженном давлении. Остаток распределяли между этилацетатом(300 мл) и водой (100 мл) и органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, с получением промежуточного альдегида. Аликвоту альдегида (100 мг; 0,305 ммоль) растворяли в дихлорметане (5 мл) и добавляли морфолин (30 мг; 0,344 ммоль) и ледяную уксусную кислоту (17,1 мкл; 0,305 ммоль). После перемешивания при комнатной температуре в течение 5 мин триацетоксиборогидрид натрия (95 мг; 0,451 ммоль) добавляли одной порцией и реакционную смесь перемешивали в течение 1 ч. Спустя это время, полученную смесь разбавляли дихлорметаном (20 мл) и распределяли между водой (30 мл) и дихлорметаном (20 мл). Органическую фазу промывали 2 М водным раствором гидроксида натрия (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством флэшхроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (95:4:1, по объему), с получением соединения, указанного в заголовке (125 мг), в виде бесцветного масла. 1LRMS (термораспыление): m/z [MH+] 398. Микроанализ: Найдено: С, 57,18; Н, 6,31; N, 10,36. С 19 Н 25 Сl2N3O2 требует С, 57,29; Н, 6,33; N, 10,55%. Примеры с 44 по 49. Соединения по следующим приведенным в таблице примерам общей формулы получали посредством способа, сходного со способом по примеру 43, используя соответствующий амин в качестве исходного материала и пиразол по примеру 64. Гидрид натрия (60% дисперсия в масле; 37 мг; 0,925 ммоль) добавляли к перемешиваемому раствору мезилата по получению 11 (273 мг; 0,925 ммоль) и пиразола по примеру 3 (220 мг; 0,772 ммоль) в безводном N,N-диметилформамиде (4 мл) при 0 С в атмосфере азота. Смесь нагревали при 50 С в течение 3 ч, за это время желтый раствор становился темно-коричневым. Реакционную смесь гасили посредством добавления воды (5 мл) и смесь концентрировали при пониженном давлении. Раствор остатка в этилацетате (20 мл) промывали водой (10 мл) и рассолом (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Масло растворяли в дихлорметане (3 мл), добавляли трифторуксусную кислоту (1 мл) и реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате (10 мл) и промывали 1 М водной соляной кислотой (25 мл). Объединенные водные фазы нейтрализовали твердым карбонатом натрия и экстрагировали этилацетатом (320 мл). Объединенные этилацетатные слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (95:4:1, по объему),с получением соединения, указанного в заголовке (3 мг), в виде бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3): =1,15 (m, 6 Н), 2,41 (q, 2H), 2,51 (q, 2H), 2,89 (m, 2H), 3,30 (m, 2H), 3,58- 25007184 Гидрид натрия (60% дисперсия в масле; 30 мг; 0,750 ммоль) добавляли к перемешиваемому раствору пиразола по примеру 3 (200 мг; 0,702 ммоль) и 1-бензгидрил-3-азетидинилметансульфоната (222 мг; 0,702 ммоль) (см. J. Org. Chem., 1972, 37, 3953) в безводном N,N-диметилформамиде (5 мл) при 0 С в атмосфере азота. Смесь нагревали при 50 С в течение 4 ч и затем охлаждали до комнатной температуры. Реакционную смесь гасили посредством добавления воды (30 мл) и водную смесь экстрагировали эфиром (250 мл). Объединенные органические фазы промывали водой (10 мл) и рассолом (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Масло очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя дихлорметаном, с получением промежуточного соединения (60 мг) в виде желтого масла. Масло растворяли в дихлорметане (5 мл), и добавляли 1-хлорэтилхлорформиат (20 мкл; 0,182 ммоль) при комнатной температуре в атмосфере азота. Смесь нагревали с обратным холодильником в течение 4 ч,охлаждали до комнатной температуры и концентрировали при пониженном давлении до тех пор, пока не оставалось желтое масло. Масло растворяли в метаноле (5 мл) и полученный раствор нагревали с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (95:4:1, по объему), с получением соединения, указанного в заголовке (17 мг), в виде бесцветного масла. 1 Трифлат по получению 15 (282 мг; 0,500 ммоль), трибутилвинилолово (175 мкл; 0,600 ммоль), дибензилиденацетон палладия (23 мг; 0,025 ммоль), трифениларсин (12 мг; 0,040 ммоль) и хлорид лития(64 мг; 1,50 ммоль) нагревали в N,N-диметилформамиде (3 мл) при 80 С в атмосфере азота в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и распределяли между водой (20 мл) и этилацетатом (20 мл). Органический слой промывали рассолом (10 мл), сушили над сульфатом магния,фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью пентан:этилацетат (90:10, по объему), с получением соединения, указанного в заголовке (34 мг), в виде бесцветного масла. 1 Смесь 3-хлор-2,4-пентандиона (5,00 г; 37,0 ммоль), 3,5-дихлорфенола (6,03 г; 37,0 ммоль), карбоната цезия (12,0 г; 37,0 ммоль) и ацетона (40 мл) нагревали с обратным холодильником в течение 18 ч. После охлаждения твердое вещество удаляли посредством фильтрации, и фильтрат концентрировали при пониженном давлении. Промежуточное соединение растворяли в этаноле (30 мл) и добавляли гидразингидрат (1,85 г; 37,0 ммоль), и смесь нагревали при 60 С в течение 30 мин. После охлаждения смесь концентрировали при пониженном давлении, и остаток очищали посредством колоночной флэшхроматографии на силикагеле, элюируя смесью этилацетат:пентан (30:70, по объему), с получением соединения, указанного в заголовке (3,00 г), в виде желтого масла, которое застывало при выдерживании до тех пор, пока не оставалось желтое твердое вещество, m.р.=85-87 С. 1 Тетроксид осмия (1,00 мл 2,5%-ного раствора (мас./об.) в трет-бутаноле) добавляли по каплям к перемешиваемому раствору пиразола по примеру 64 (3,00 г; 9,23 ммоль) и периодата натрия (4,93 г; 23,1 ммоль) в ацетоне (90 мл) и воде (30 мл) при комнатной температуре. Через 5 мин образовывался белый осадок и суспензию перемешивали в течение еще 3 ч. Твердое вещество удаляли посредством фильтрации и фильтрат концентрировали при пониженном давлении. Остаток распределяли между этилацетатом(300 мл) и водой (100 мл) и органическую фазу отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении с получением промежуточного альдегида. Аликвоту альдегида (250 мг; 0,765 ммоль) растворяли в тетрагидрофуране (5 мл) и хранили в атмосфере азота. В отдельную колбу к перемешиваемому раствору метилмагнийбромида (0,51 мл, 3 М раствора в эфире; 1,53 ммоль) в тетрагидрофуране (5 мл) добавляли безводный трихлорид церия (377 мг; 1,53 ммоль) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 1,5 ч и по каплям добавляли альдегид в тетрагидрофуране. Смесь перемешивали в течение 12 ч и затем реакционную смесь гасили 1 М водной уксусной кислотой при комнатной температуре. Смесь разбавляли дихлорметаном (20 мл), промывали водой (5 мл) и рассолом (5 мл), сушили над сульфатом магния,фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью пентан:этилацетат (70:30, по объему), с получением соединения, указанного в заголовке (30 мг), в виде бесцветного масла. 1 Гидрид натрия (60% дисперсия в масле; 24 мг; 0,600 ммоль) добавляли к перемешиваемому раствору пиразола по примеру 2 (100 мг; 0,303 ммоль) в безводном N,N-диметилформамиде (4 мл) при 0 С в атмосфере азота. Смесь перемешивали при 0 С в течение 30 мин и добавляли гидрохлорид 2 хлорэтиламина (53 мг; 0,455 ммоль). Реакционную смесь перемешивали при 0 С в течение 30 мин, а затем перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь охлаждали до 0 С,добавляли дополнительно гидрид натрия (60% дисперсия в масле; 24 мг; 0,600 ммоль) и гидрохлорид 2 хлорэтиламина (53 мг; 0,455 ммоль), и реакционную смесь перемешивали в течение 1 ч. Реакционную смесь гасили посредством добавления воды (5 мл) и экстрагировали эфиром (10 мл). Органический слой промывали 2 М водной соляной кислотой (30 мл). Кислоту нейтрализовали твердым карбонатом натрия и экстрагировали эфиром (320 мл). Объединенные эфирные слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (95:4:1, по объему), с получением соединения, указанного в заголовке (21 мг), в виде бесцветного масла. 1 Морфолин (140 мкл; 1,59 ммоль) добавляли одной порцией к перемешиваемому раствору бромида по получению 8 (200 мг; 0,531 ммоль) в изопропаноле (4 мл) при комнатной температуре. Смесь нагревали при 50 С в течение 1 ч, охлаждали до комнатной температуры и концентрировали при пониженном давлении до тех пор, пока не оставалось желтое масло. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя этилацетатом, с получением соединения, указанного в заголовке (60 мг), в виде бесцветного масла. 1 Гидрид натрия (60% дисперсия в масле; 32 мг; 0,800 ммоль) добавляли к перемешиваемому раствору 2-метилимидазола (65 мг; 0,800 ммоль) в безводном N,N-диметилформамиде (5 мл) при 0 С в атмосфере азота. Смесь перемешивали в течение 10 мин и затем добавляли бромид по получению 8 (100 мг; 0,261 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь гасили посредством добавления 1 М водного раствора гидроксида натрия (5 мл) и смесь концентрировали при пониженном давлении. Раствор остатка в этилацетате (20 мл) промывали водой (10 мл) и рассолом (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак Трифлат по получению 15 (282 мг; 0,500 ммоль) растворяли в метаноле (3 мл) и 1,1'бис(дифенилфосфино)ферроценпалладий(II)хлорид (18 мг; 0,025 ммоль) добавляли одной порцией при комнатной температуре. Смесь нагревали при 50 С в атмосфере монооксида углерода (345 кПа; 50 ф/кв.дюйм) в течение 10 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении до тех пор, пока не оставалось коричневое масло. Масло растворяли в смеси тетрагидрофурана (0,5 мл), ледяной уксусной кислоты (1,0 мл) и воды (0,5 мл) и перемешивали при комнатной температуре в течение 12 ч. Растворитель удаляли в потоке азота до тех пор, пока не оставалось желтое твердое вещество, и неочищенный продукт очищали посредством колоночной флэшхроматографии на силикагеле, элюируя смесью дихлорметан:ацетонитрил (95:5, по объему) и затем смесью дихлорметан:ацетонитрил (90:10, по объему), с получением соединения, указанного в заголовке (6 мг), в виде бесцветного масла. Суспензию бромида по получению 8 (100 мг; 0,264 ммоль), 1,2,4-триазола (92 мг; 1,32 ммоль) и карбоната натрия (140 мг; 1,32 ммоль) в толуоле (5 мл) нагревали при 100 С в течение 12 ч. Суспензию охлаждали до комнатной температуры и добавляли 1 М водный раствор гидроксида натрия (5 мл). Смесь экстрагировали этилацетатом (320 мл), и объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалось прозрачное масло. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол:аммиак (95:4,5:0,5, по объему), с получением соединения, указанного в заголовке (62 мг), в виде бесцветного масла. 1 Гидразингидрат (153 мкл; 3,14 ммоль) добавляли к перемешиваемому раствору -дикетона по получению 9 (771 мг; 3,14 ммоль) в этаноле (16 мл), и полученный раствор нагревали с обратным холодильником в течение 12 ч. После охлаждения смесь концентрировали при пониженном давлении, и остаток очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью пентан:этилацетат (75:25, по объему), с получением соединения, указанного в заголовке (712 мг), в виде желтого твердого вещества, m.р.=81-84 С. 1 Пиразол по примеру 60 (200 мг; 0,829 ммоль) и гидрохлорид 2-хлорэтиламина (144 мг; 1,24 ммоль) нагревали в виде расплава при 150 С в течение 17 ч. После охлаждения твердое вещество растворяли в насыщенном водном гидрокарбонате натрия (15 мл) и экстрагировали дихлорметаном (210 мл). Объединенные органические фазы промывали 2 М водной соляной кислотой (20 мл), и водный слой нейтрализовали твердым карбонатом натрия и экстрагировали дихлорметаном (310 мл). Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении до тех пор, пока не оставалась оранжевая смола. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью дихлорметан:метанол (90:10), затем смесью дихлорметан:метанол:аммиак (90:9:1, по объему), с получением соединения, указанного в заголовке (124 мг), в виде бледно-желтого масла. Насыщенный раствор аммиака в метаноле (2,3 мл) добавляли к эфиру по примеру 63 (75 мг; 0,229 ммоль) в одном флаконе при комнатной температуре, затем флакон герметично закрывали и нагревали до 75 С в течение 17 ч. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении до тех пор, пока не оставалось пастообразное твердое вещество. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя дихлорметаном,затем смесью дихлорметан:метанол (99:1, по объему), с получением соединения, указанного в заголовке(49 мг), в виде белого твердого вещества, m.р.=159-160 С. 1 Раствор этилгидразиноацетата (88 мг; 0,571 ммоль) в этаноле (2,0 мл) добавляли к перемешиваемому раствору -дикетона по получению 9 (140 мг; 0,571 ммоль) и триэтиламина (88 мкл; 0,628 мл) в этаноле (1,0 мл) и полученный раствор нагревали с обратным холодильником в течение 18 ч. После охлаждения смесь концентрировали при пониженном давлении, и остаток распределяли между дихлорметаном(20 мл) и водой (10 мл). Органический слой отделяли, промывали рассолом (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали посредством колоночной флэш-хроматографии на силикагеле, элюируя смесью пентан:этилацетат Гидрид натрия (60% дисперсия в масле; 770 мг; 19,2 ммоль) добавляли к перемешиваемому раствору аллилбромида (1,70 мл; 19,2 ммоль) и пиразола по примеру 3 (5,00 г; 17,5 ммоль) в N,Nдиметилформамиде (20 мл) при 0 С в атмосфере азота. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь гасили посредством добавления воды (100 мл) и водную фазу экстрагировали эфиром (250 мл). Объединенные органические фазы промывали во- 30
МПК / Метки
МПК: A61K 31/415, C07D 403/06, C07D 401/12, C07D 413/06, C07D 405/12, A61K 31/4155, A61K 31/4162, C07D 403/12, C07D 231/18, C07D 231/20, A61P 31/18
Метки: вируса, иммунодефицита, производные, вич, лечения, человека, инфекции, пиразола
Код ссылки
<a href="https://eas.patents.su/30-7184-proizvodnye-pirazola-dlya-lecheniya-infekcii-virusa-immunodeficita-cheloveka-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиразола для лечения инфекции вируса иммунодефицита человека (вич)</a>
Предыдущий патент: Лиганды рецепторов 5-нт и их применение
Следующий патент: Новые фармацевтические композиции, содержащие флибансерин в полиморфной модификации а
Случайный патент: Фунгицидная смесь на базе протиоконазола и пираклостробина












