Пирролидиноны в качестве ингибиторов metap-2
Номер патента: 22299
Опубликовано: 30.12.2015
Авторы: Генрих Тимо, Кальдерини Мишель, Ценке Франк, Мусиль Дьордье
Формула / Реферат
1. Соединение формулы I
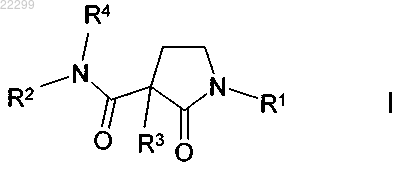
в которой R1 означает фенил, бензил, нафтил или бифенил, каждый из которых не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством Hal, CN, NHCOA, NHSO2A, SO2A и/или CONH2, А или (CH2)nHet;
R2 означает [C(R4)2]nAr2, (CH2)nCyc, CH[B(OH)2]CH2Het,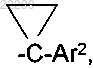 СН(СºСН)фенил, А или (CH2)nHet;
СН(СºСН)фенил, А или (CH2)nHet;R3 означает OH, N3, NH2 или F;
R4 означает Н или алкил, содержащий 1, 2, 3 или 4 атома С;
R2 и R4 вместе также означают алкилен, содержащий 2, 3, 4 или 5 атомов С, где одна группа СН2 также может быть заменена на NH, NA, N-COA, N-(CH2)nAr3, N-(CH2)nHet2, CH-A, CH-O-(CH2)nAr3, N-SO2A или О и/или может быть замещена посредством А;
Het означает пиридазинил, пиразолил, бензимидазолил, пиридил, дибензофуранил, карбазолил, индолил, дигидроиндолил, бензофуранил, дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил, хроманил, пиперазинил, морфолинил, тетрагидропиранил, хинолинил, изохинолинил, изоиндолил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, пуринил, нафтиридинил, пиримидинил, индазолил, фурил, тиенил, имидазолил, пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, бензотиазолил, имидазо[1,2-а]пиридинил, 1,3-бензодиоксолил, бензоксазолил, пиперидин-1-ил, пирролидин-1-ил, 1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А, ОА, СООА, СОА, CHO, (CH2)nCONH2, (CH2)nCONHA, (CH2)nCONA2, SO2A, NHSO2A, =O и/или Het1;
Het1 означает пиридазинил, пиразолил, пиридил, пиперазинил, морфолинил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, пиперидин-1-ил, пирролидин-1-ил, тетрагидропиранил, 1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А и/или ОА;
Het2 означает пиридил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил или тиадиазол;
А означает неразветвленный или разветвленный алкил, содержащий 1-10 атомов С, в котором 1-7 атомов Н могут быть заменены на F, Cl, Br, OH, CHO, CN и/или CONH2 и/или в котором одна или две группы СН и/или СН2, не расположенные рядом, могут быть заменены на О, N и/или NR4 или Сус;
Ar2 означает фенил, который не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством A, Hal, CN, OH и/или ОА;
Ar3 означает фенил, который не замещен или моно-, ди- или тризамещен посредством Hal, OH, ОА и/или А;
Сус означает циклический алкил, содержащий 3-7 атомов С;
Hal означает F, Cl, Br или I;
n означает 0, 1, 2, 3 или 4,
и его фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях.
2. Соединение по п.1, выбранное из следующей группы:
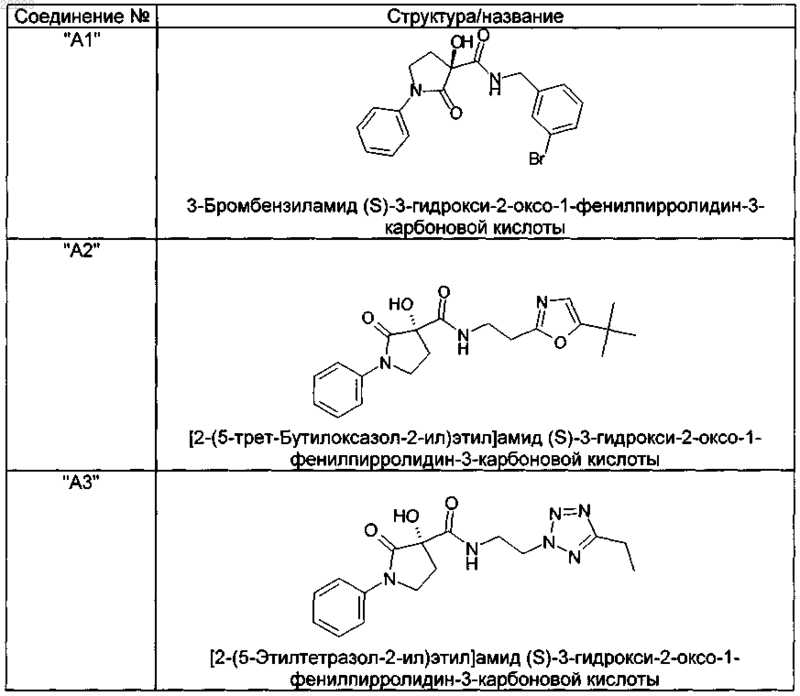
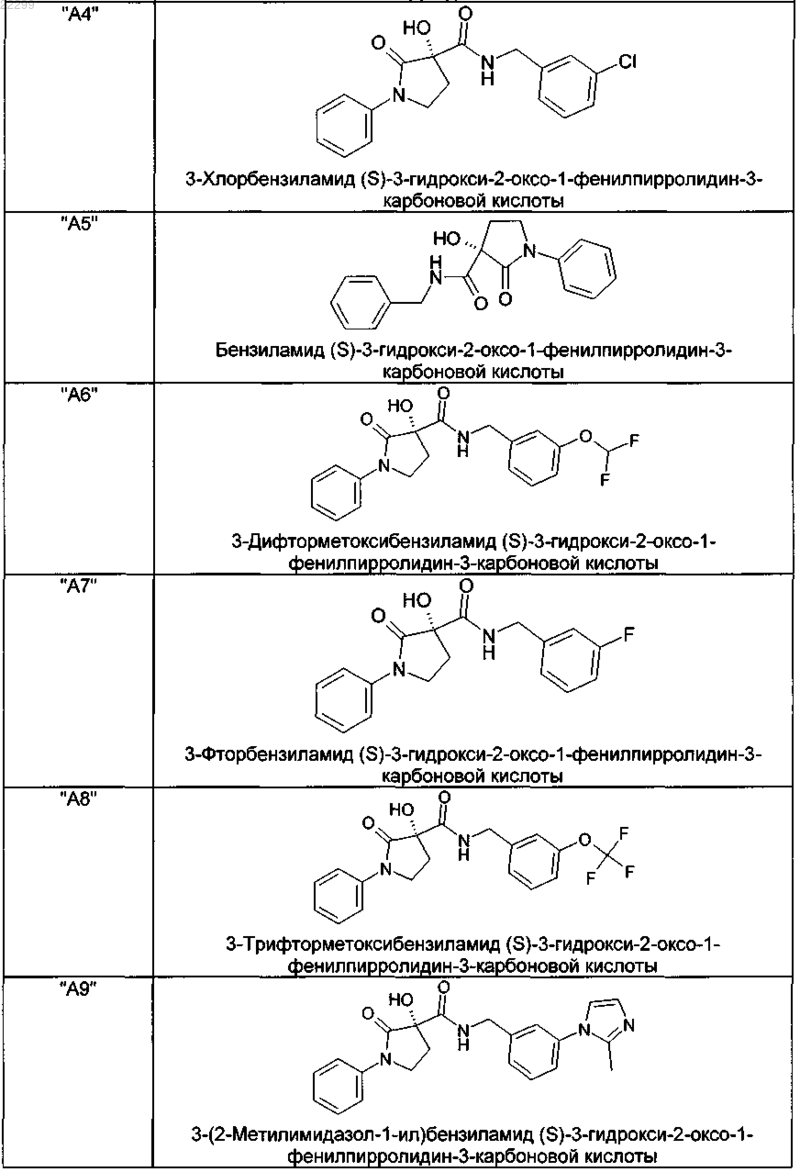
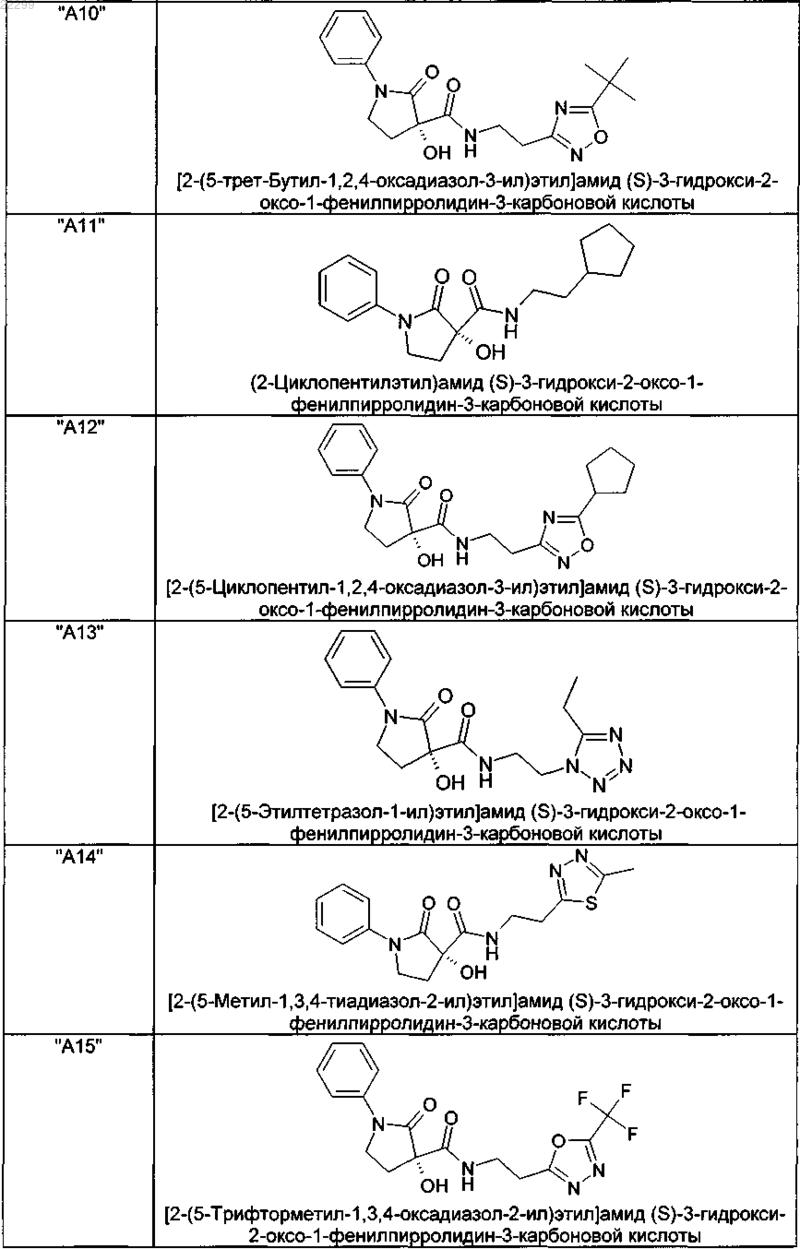
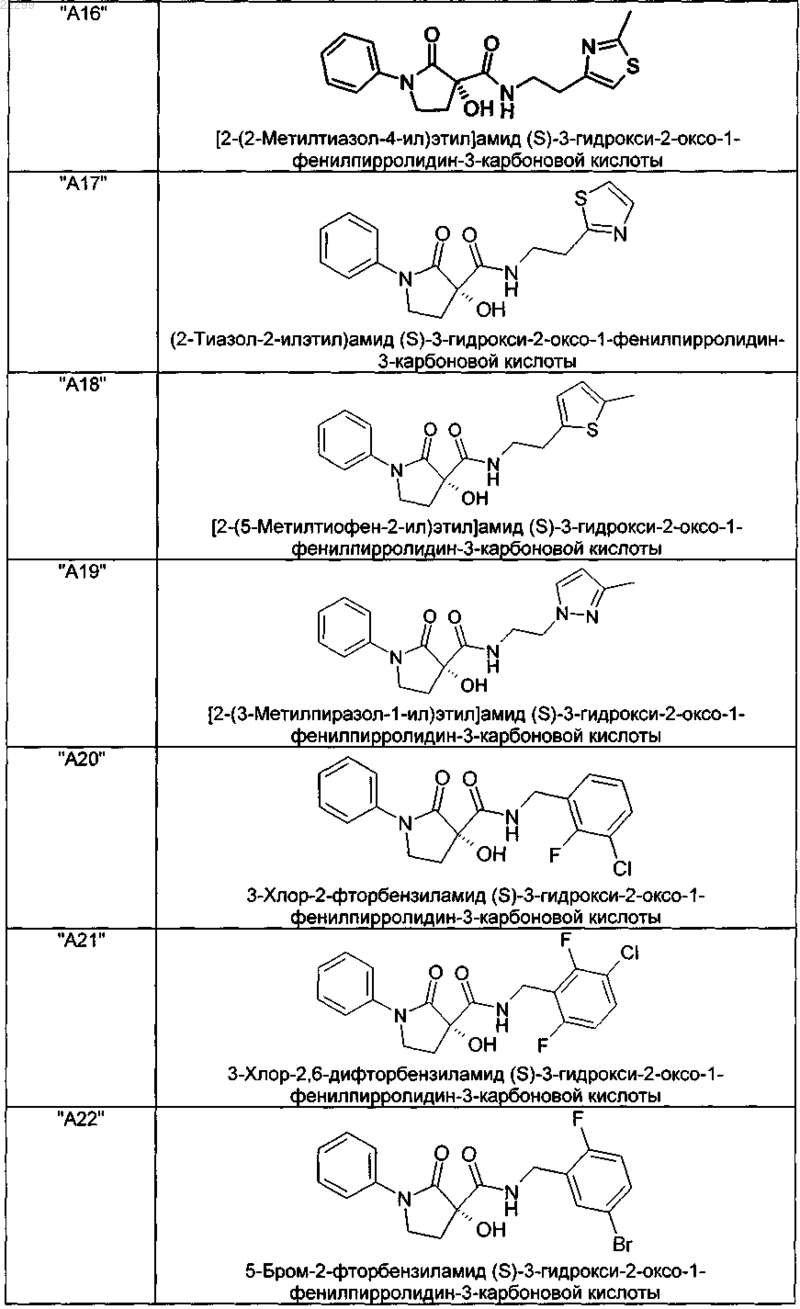

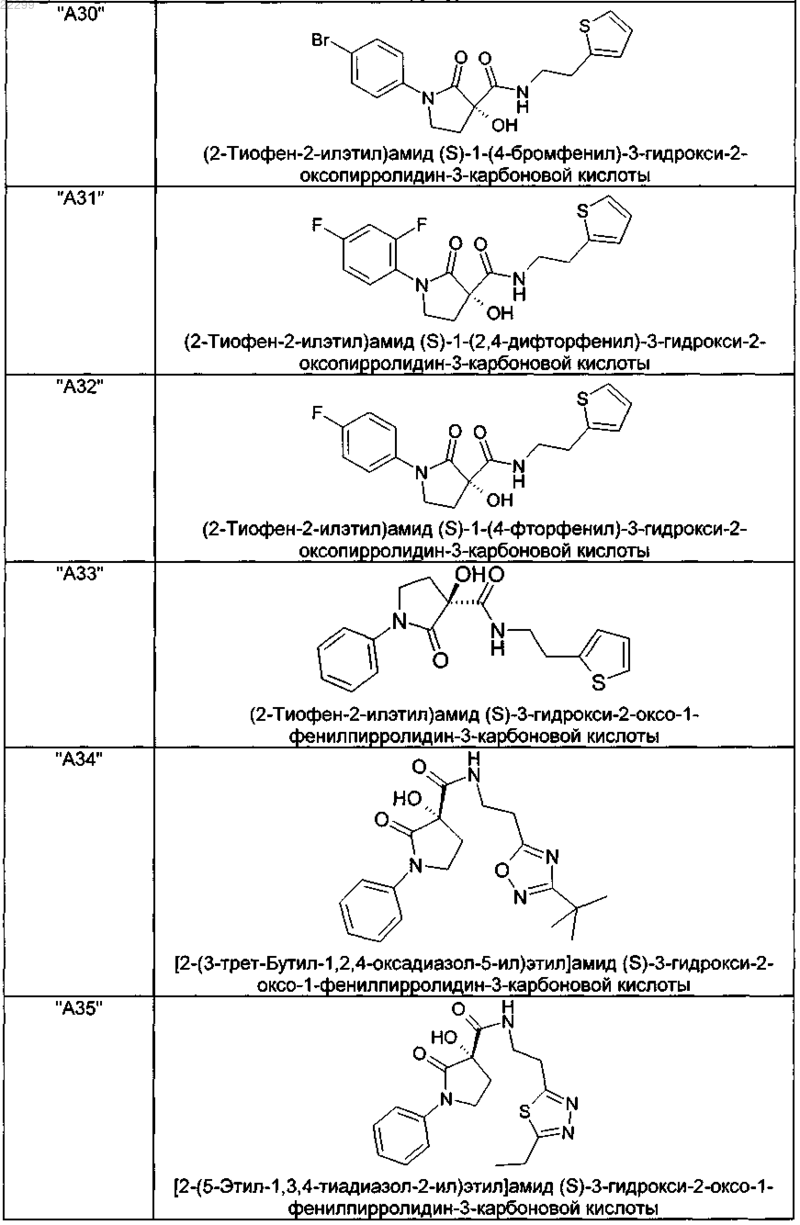
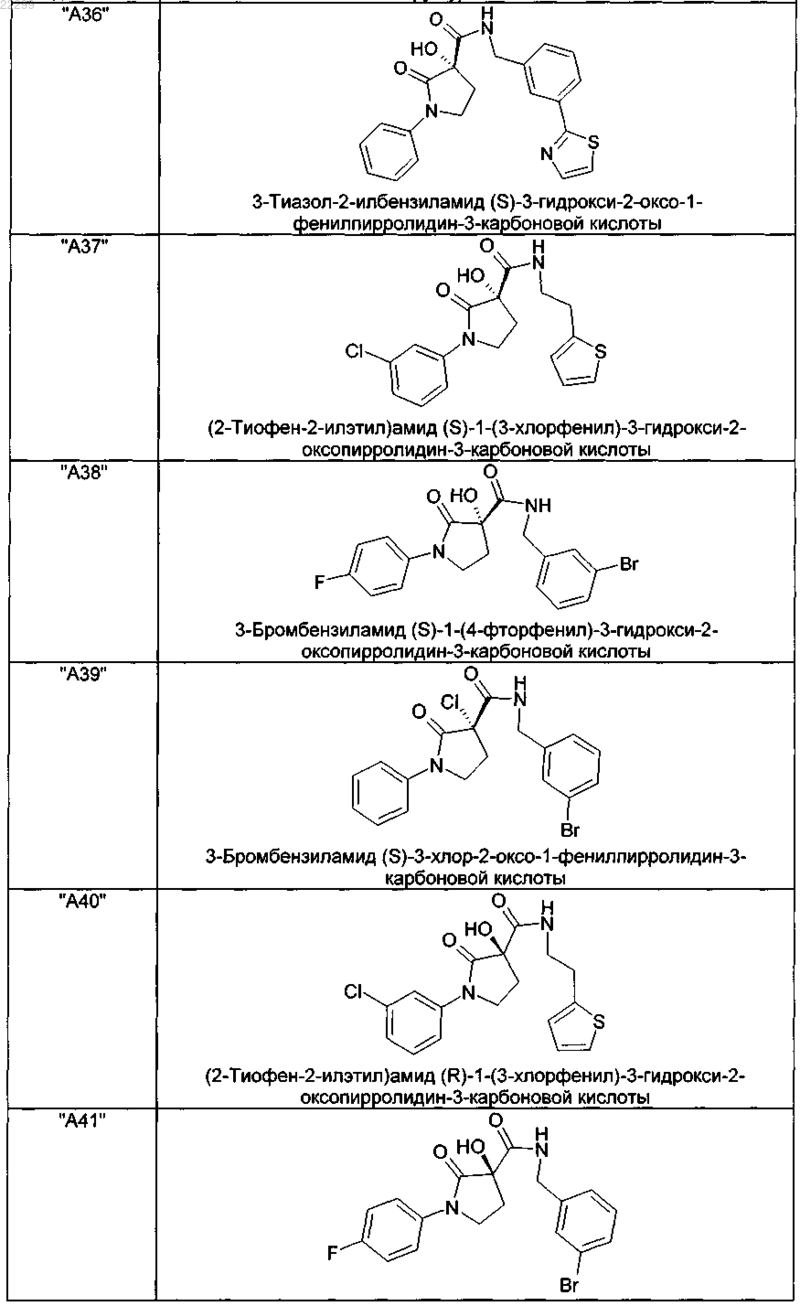


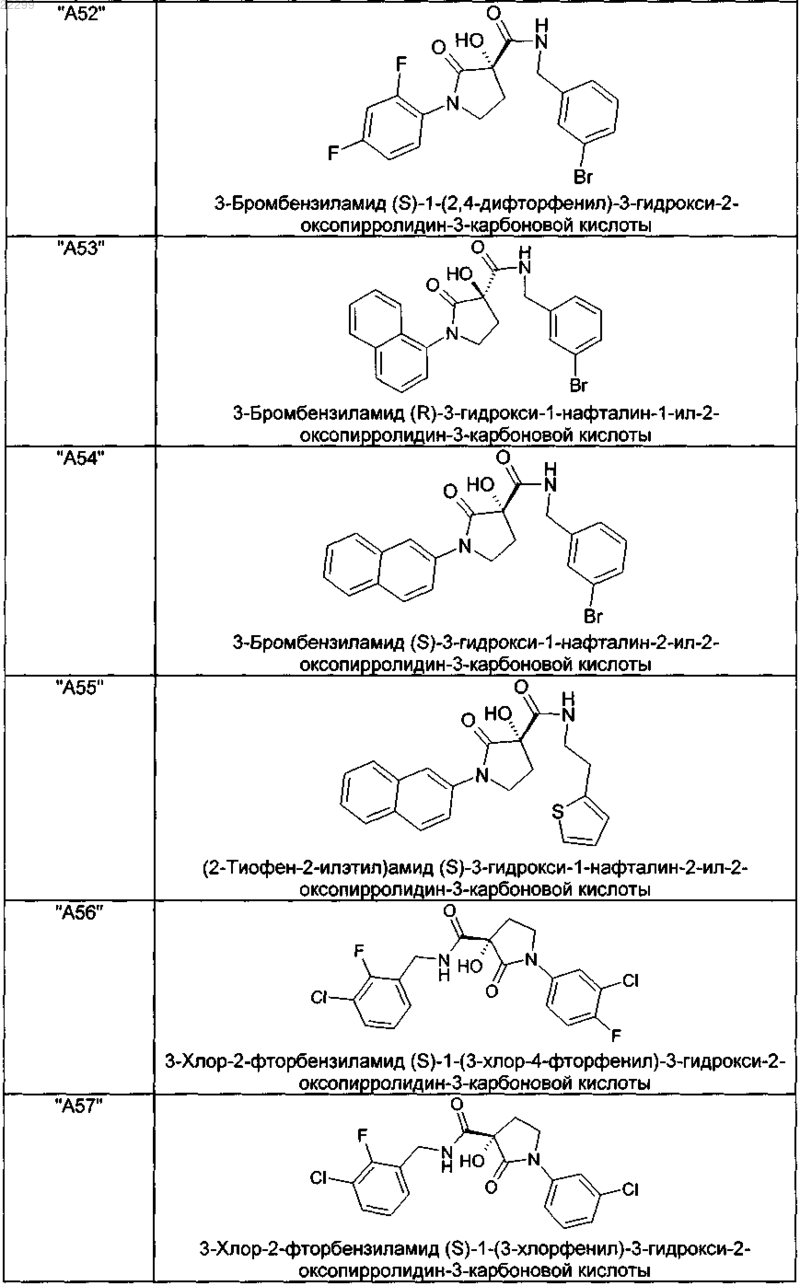
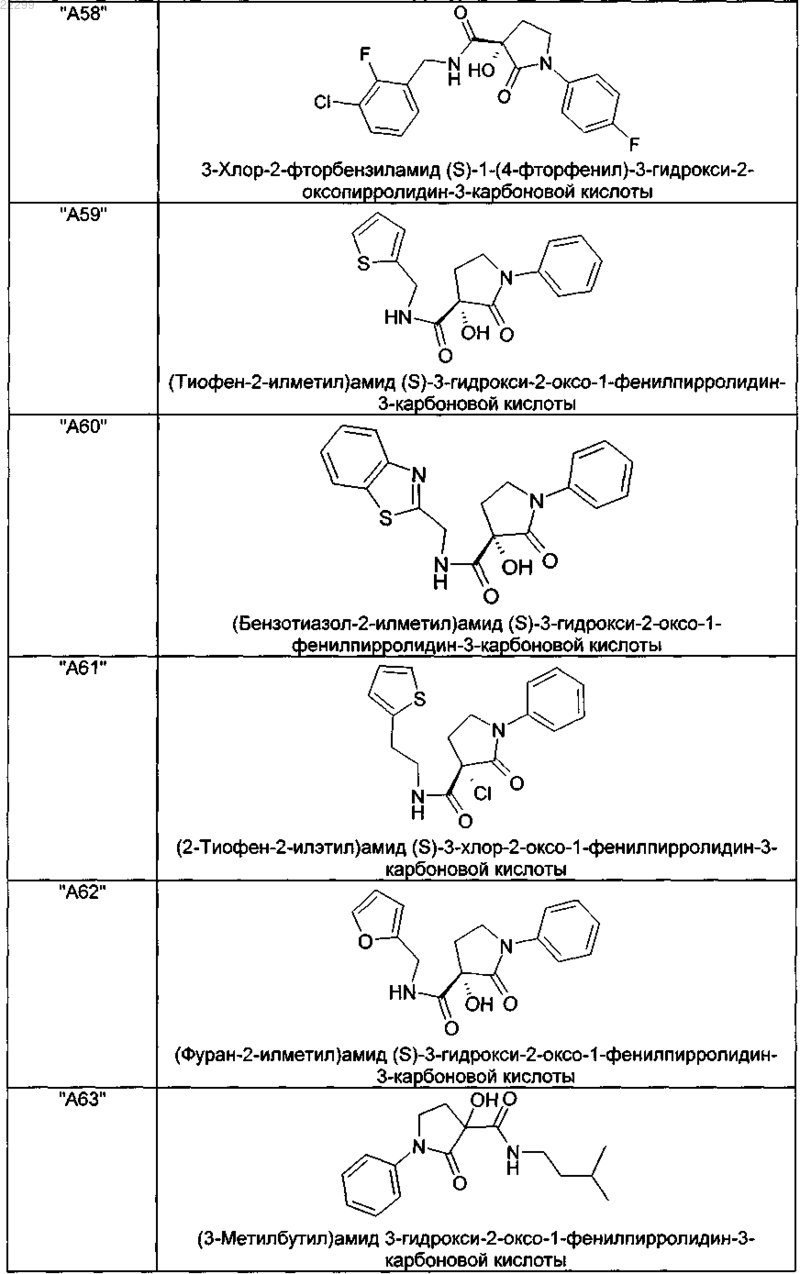
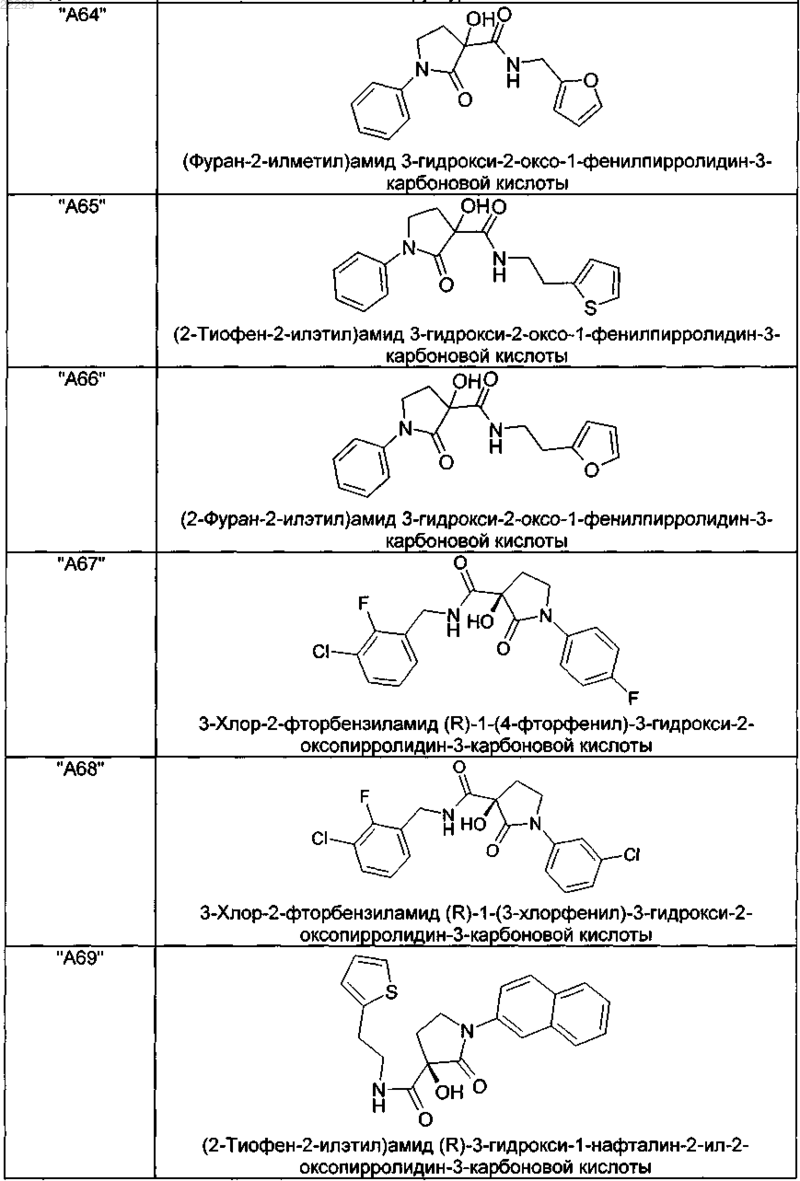
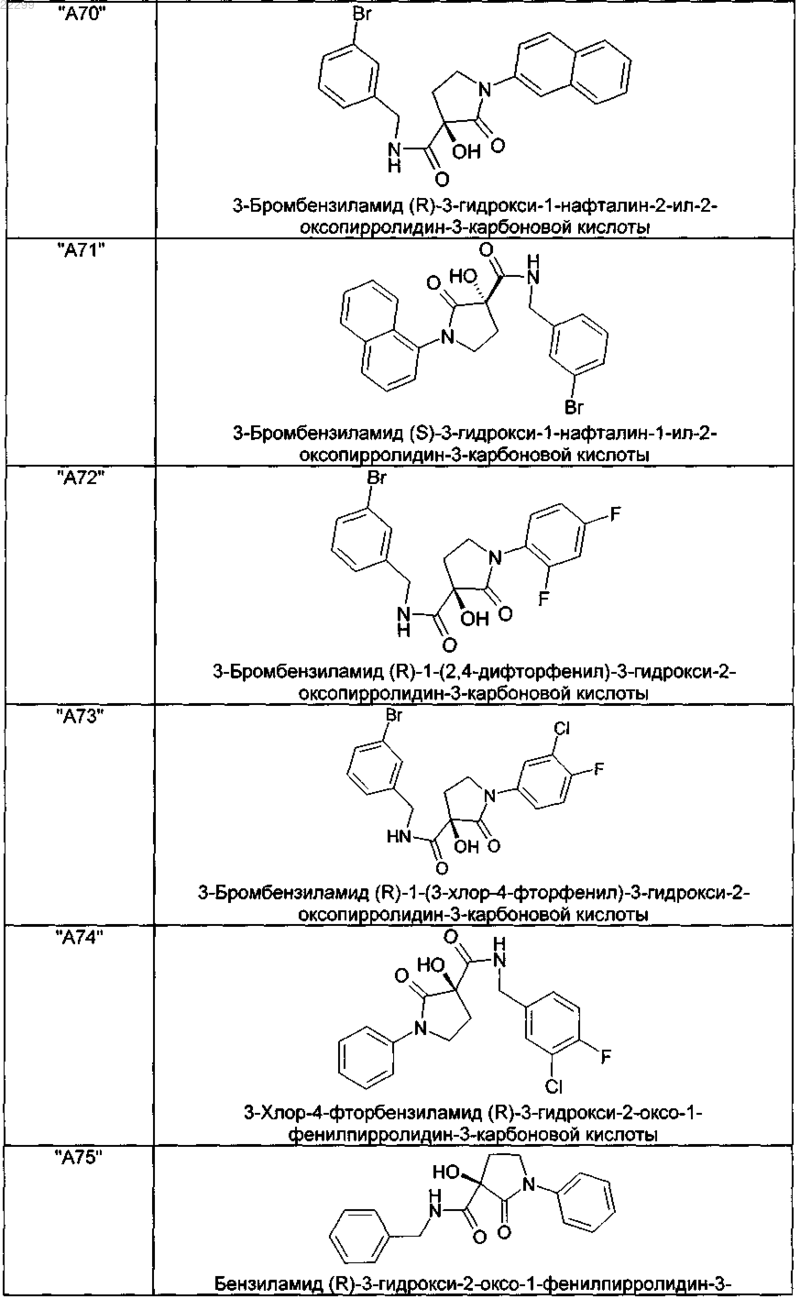
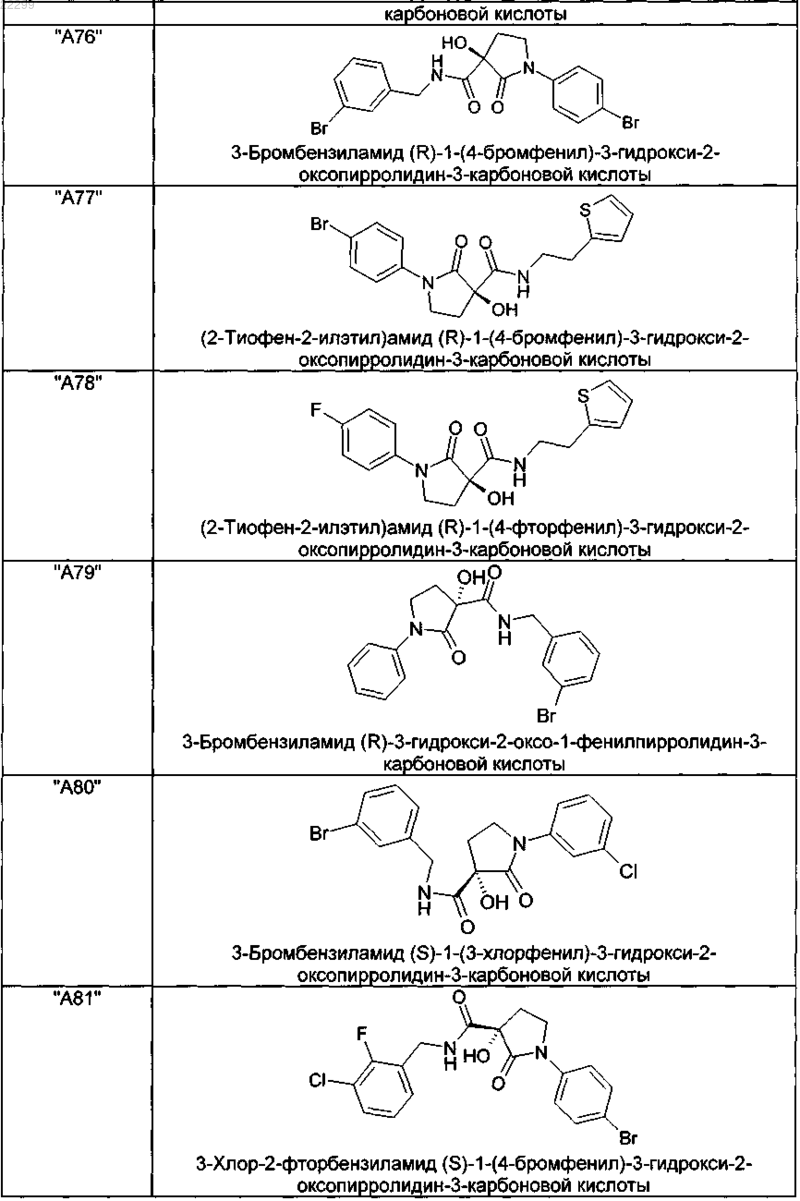
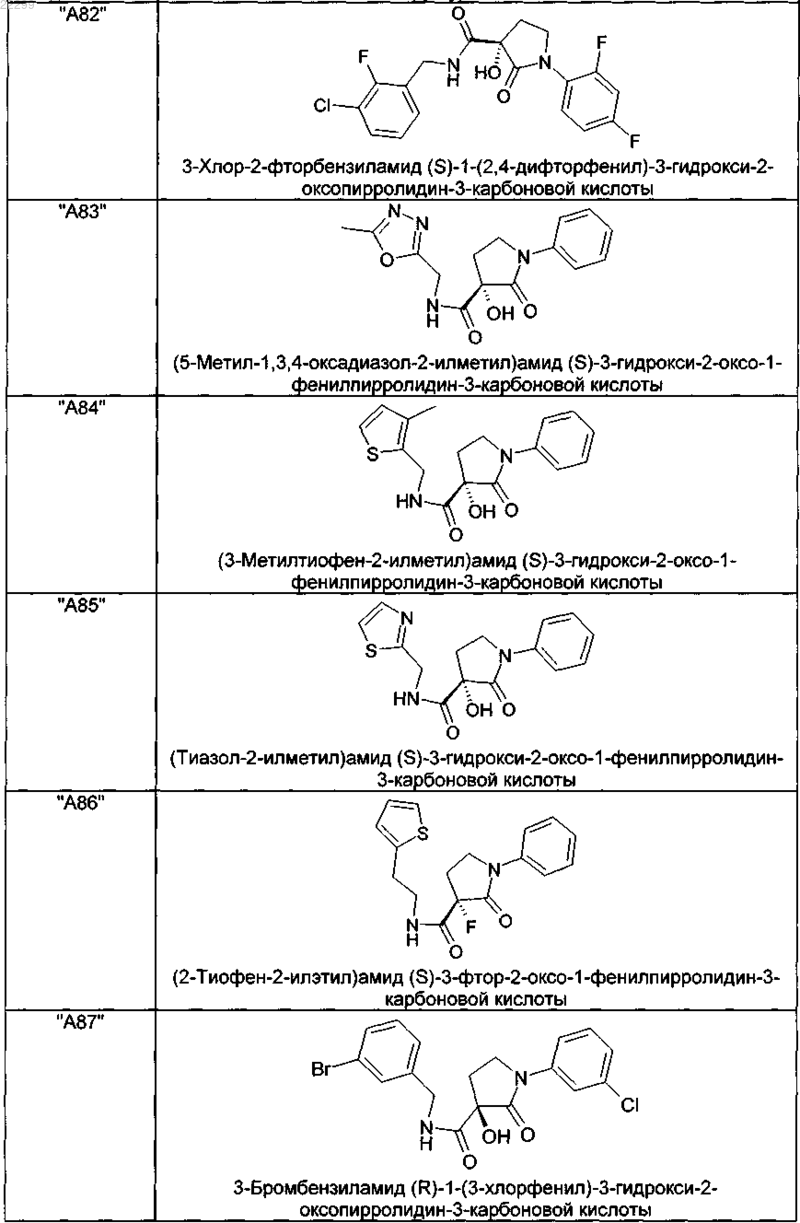

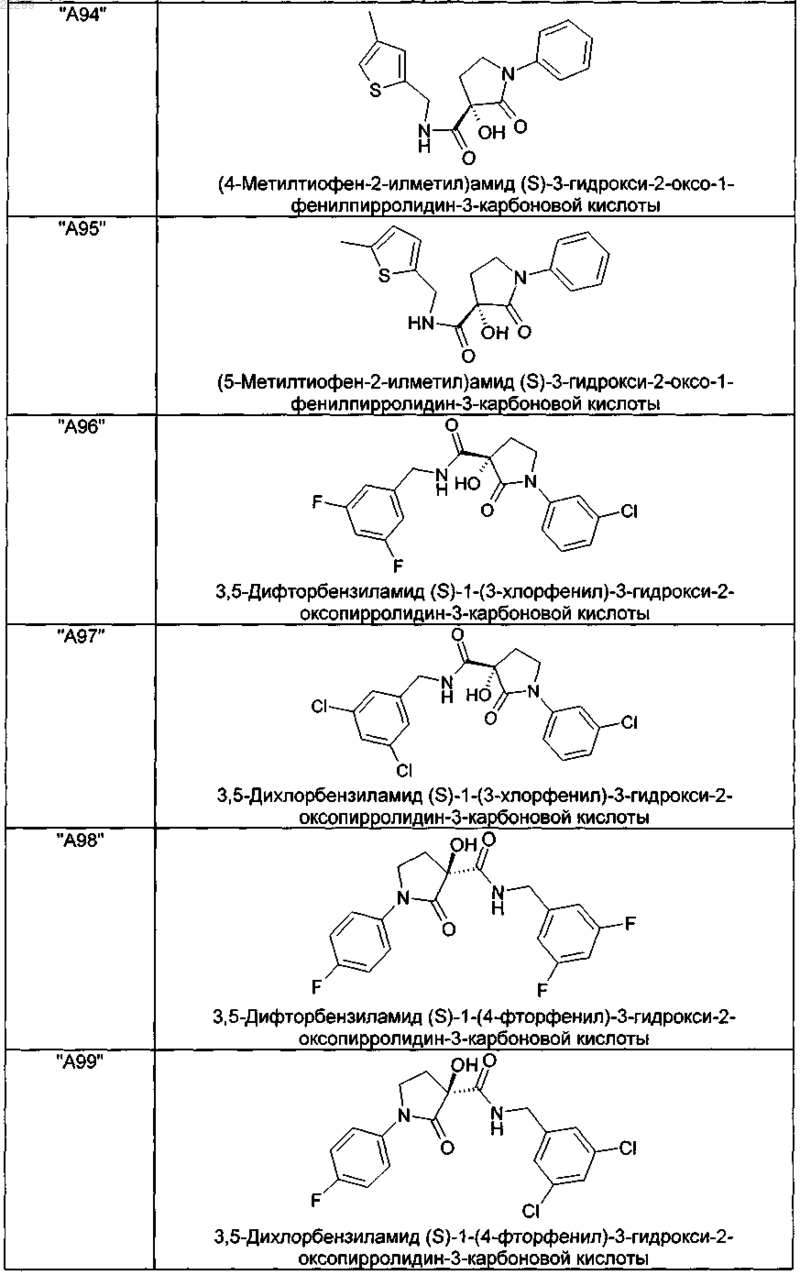
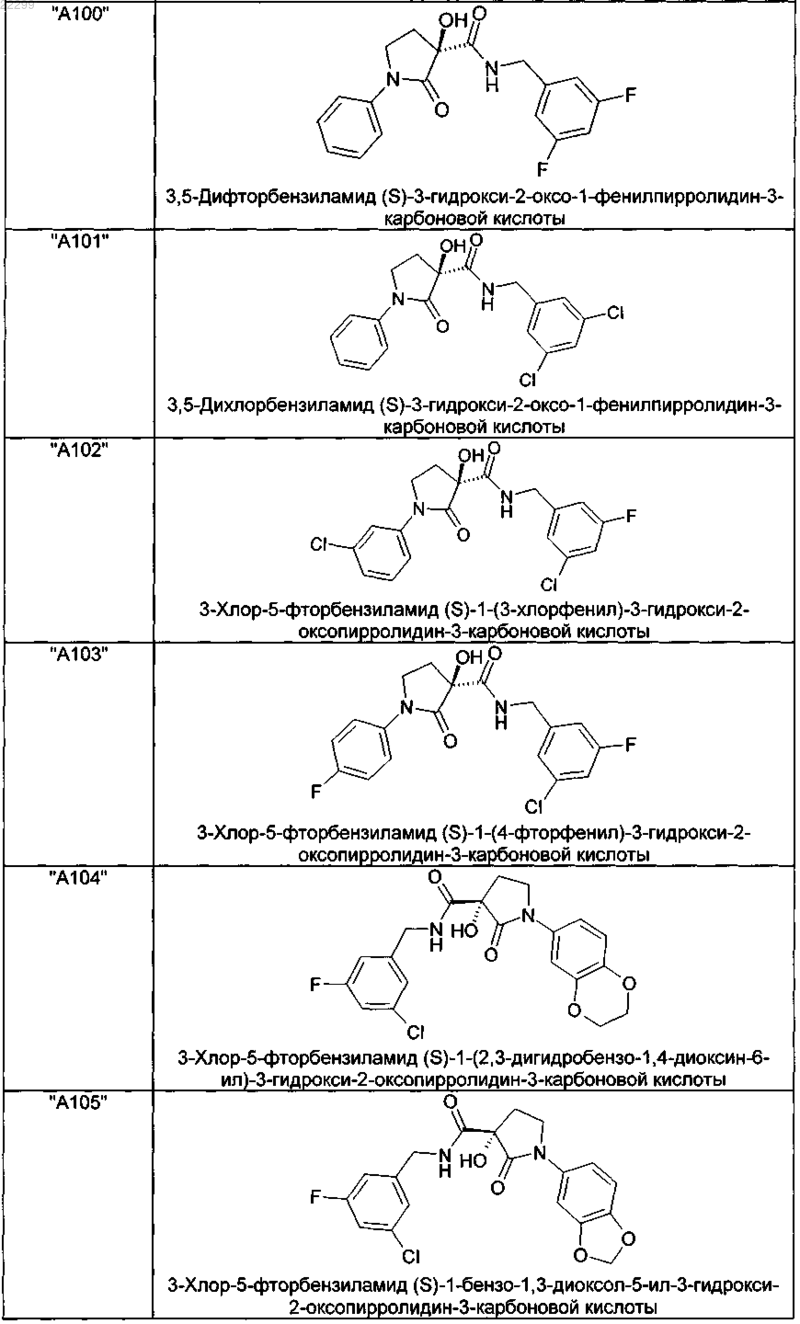
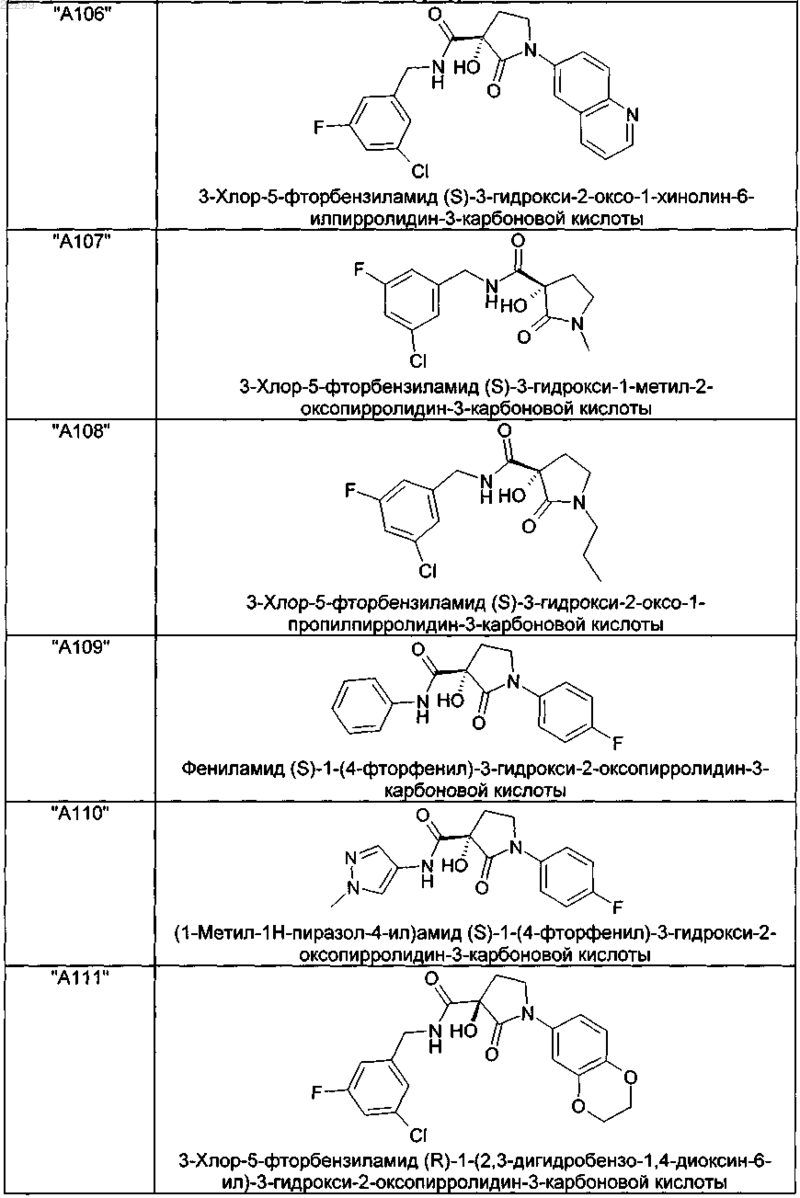
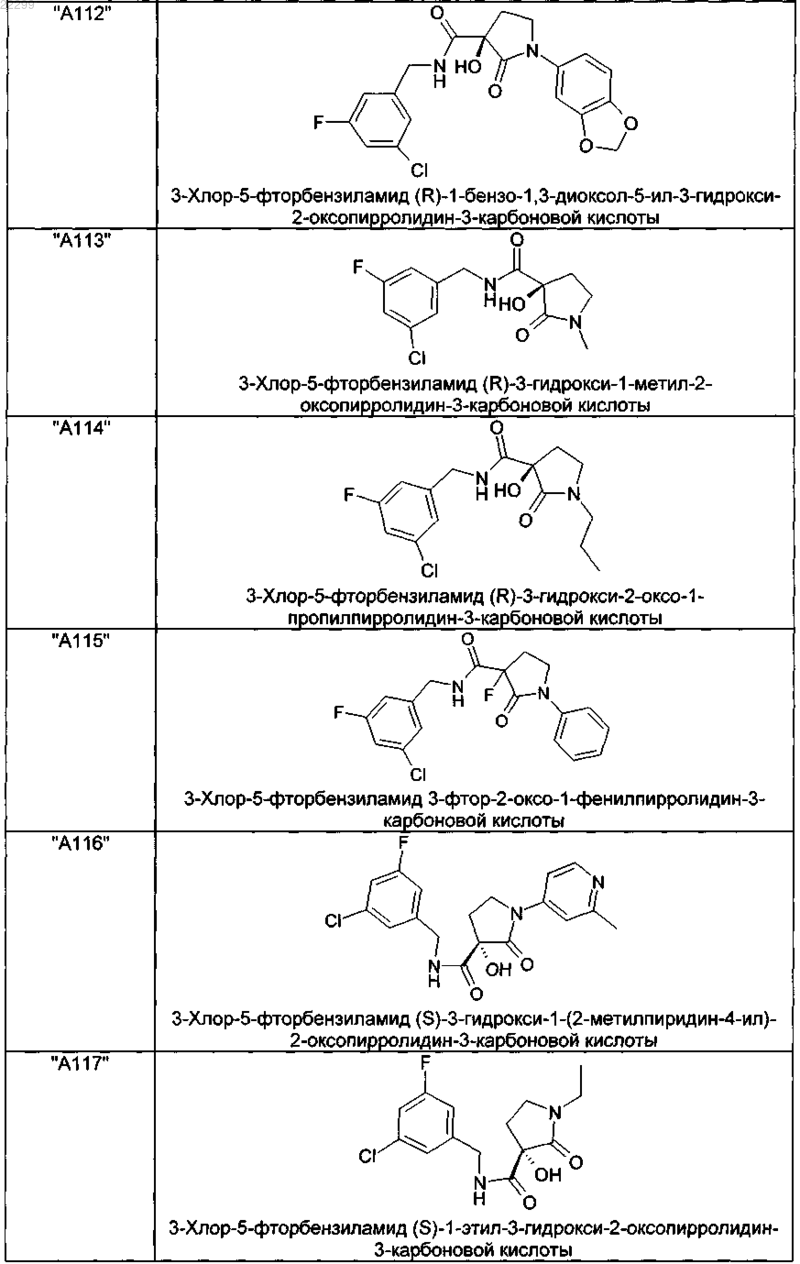

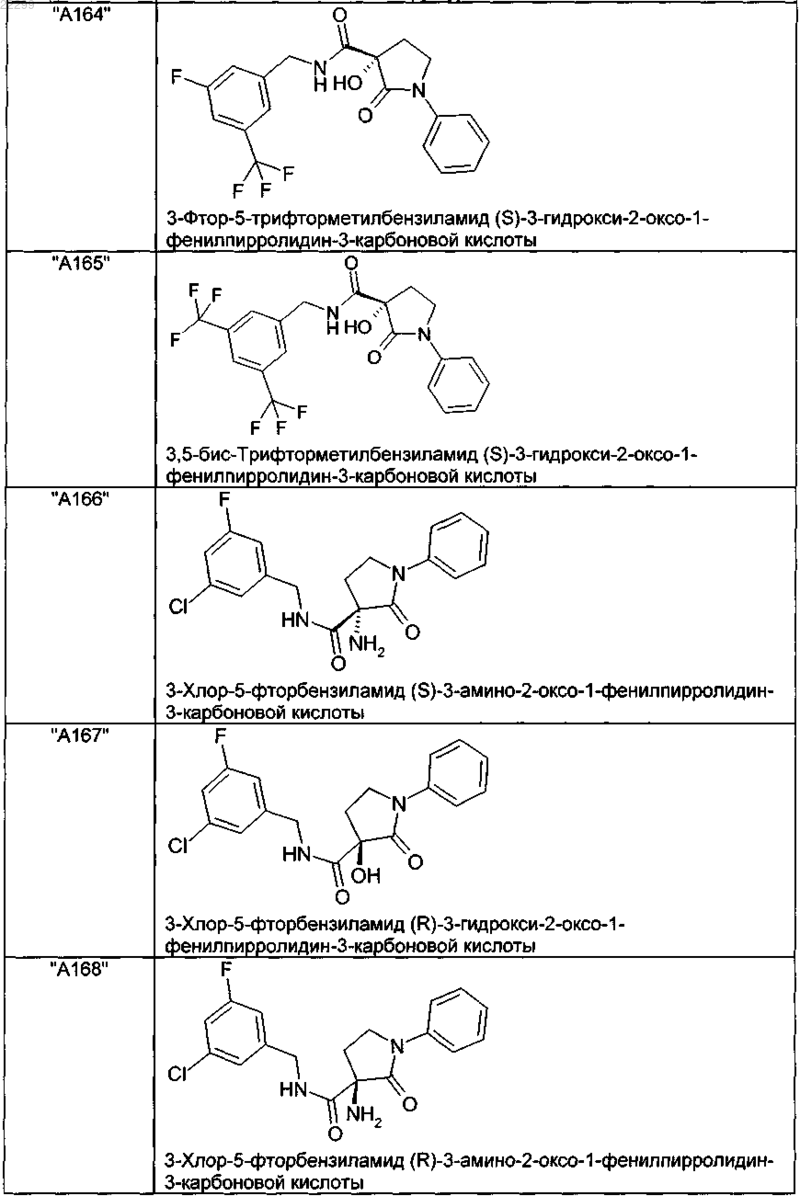
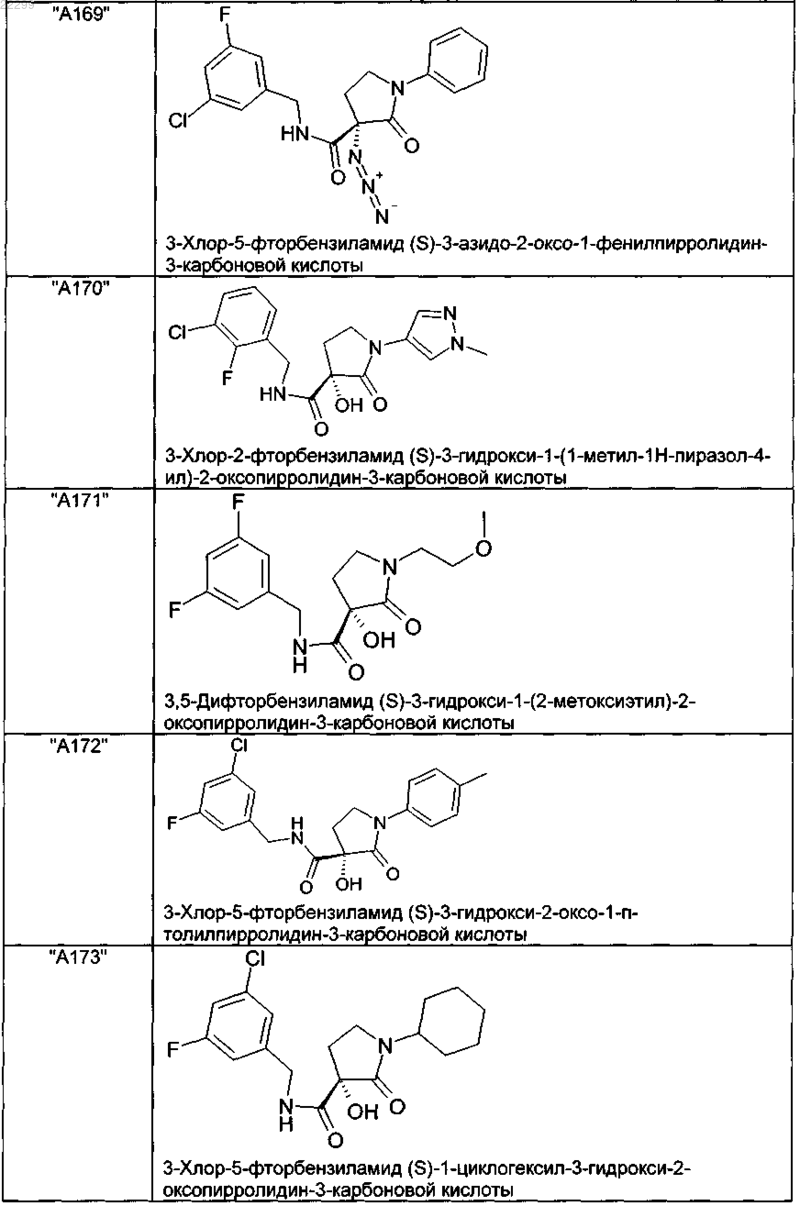
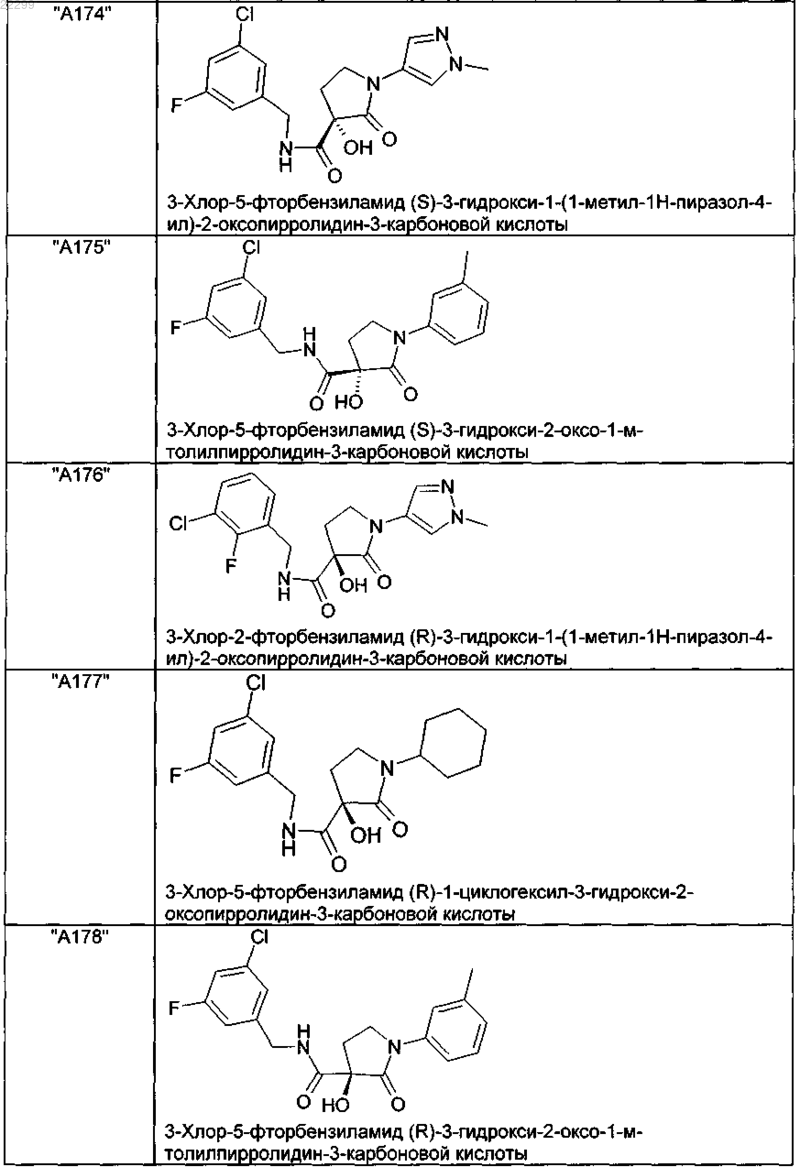
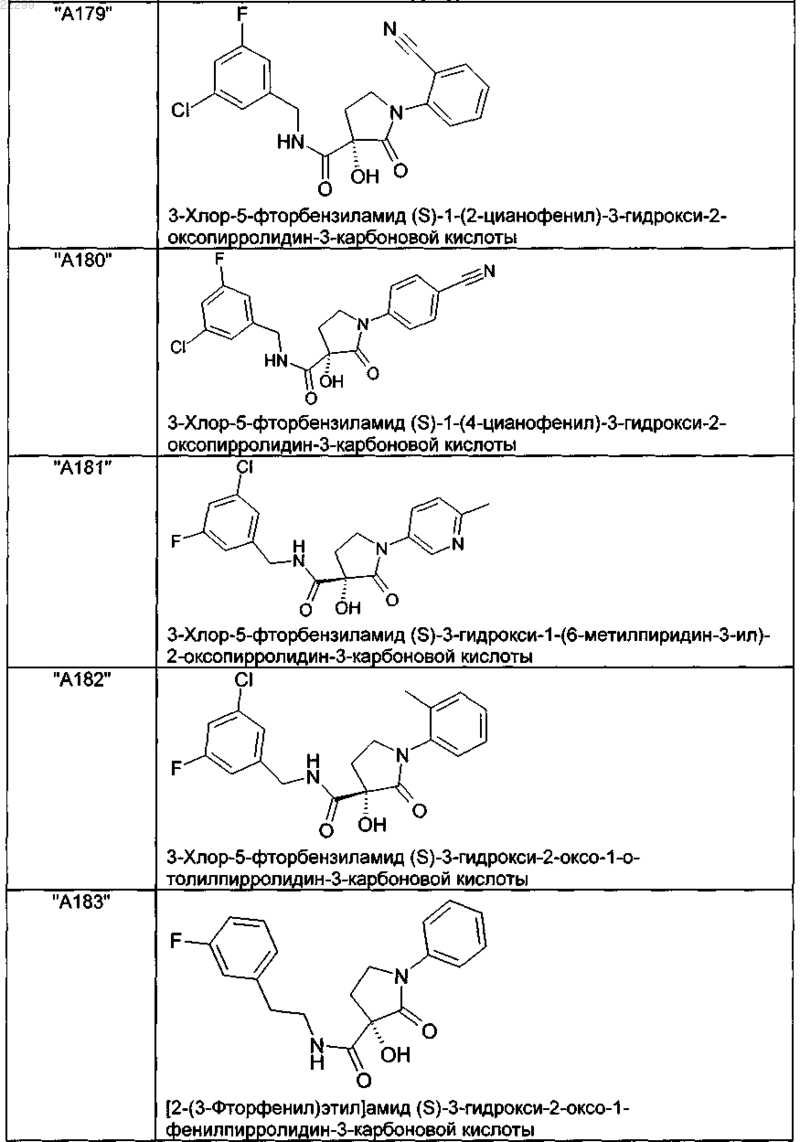
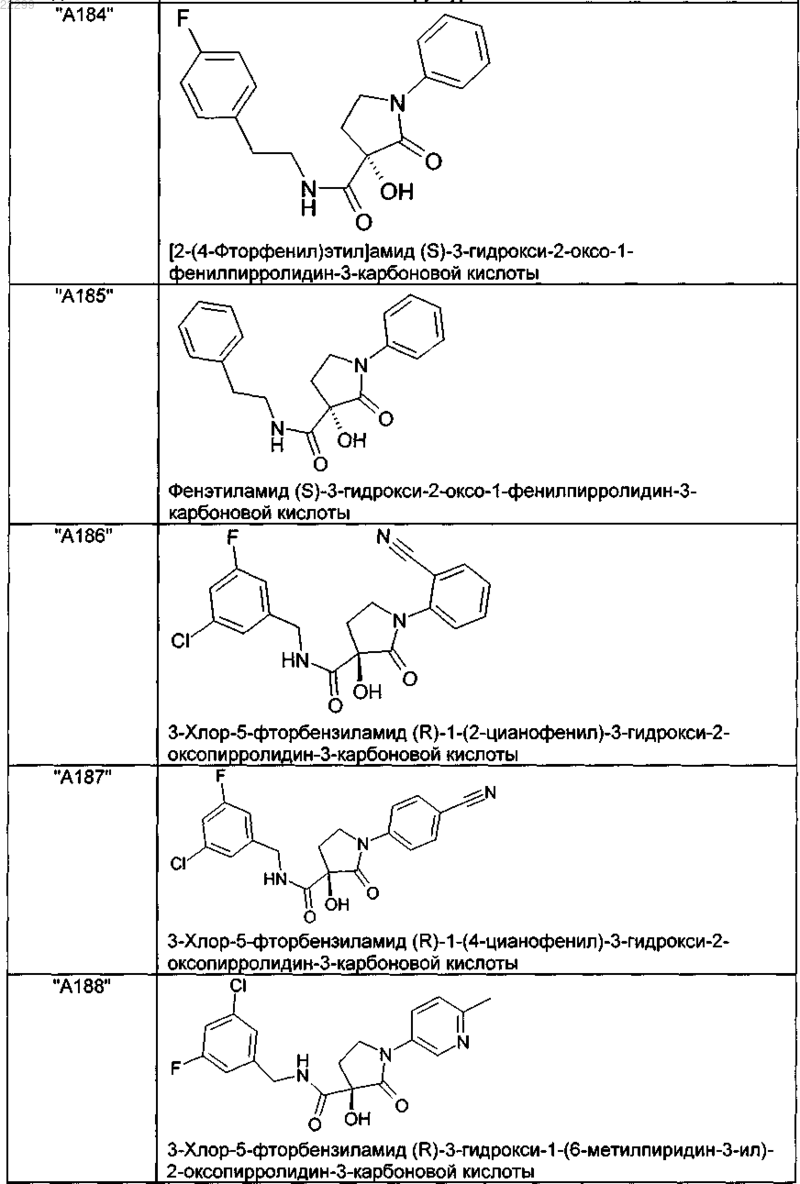
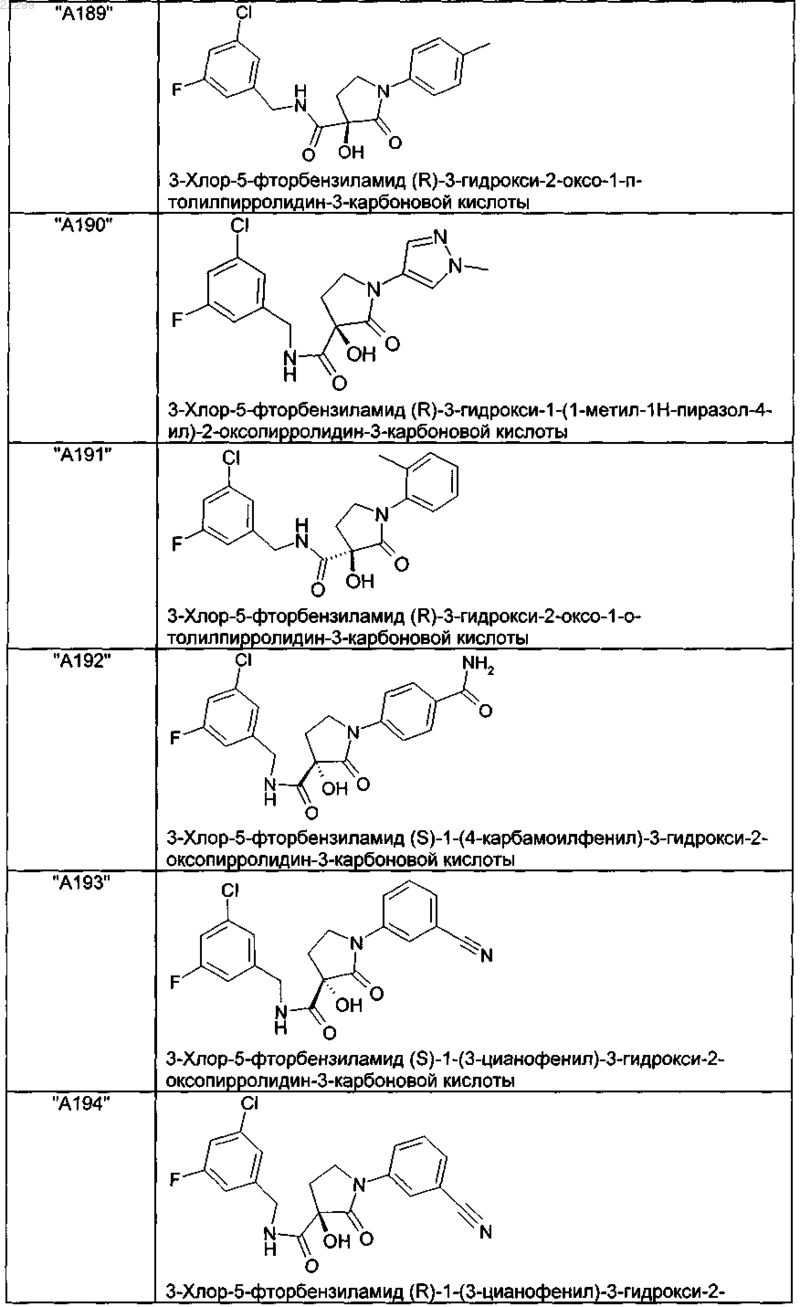
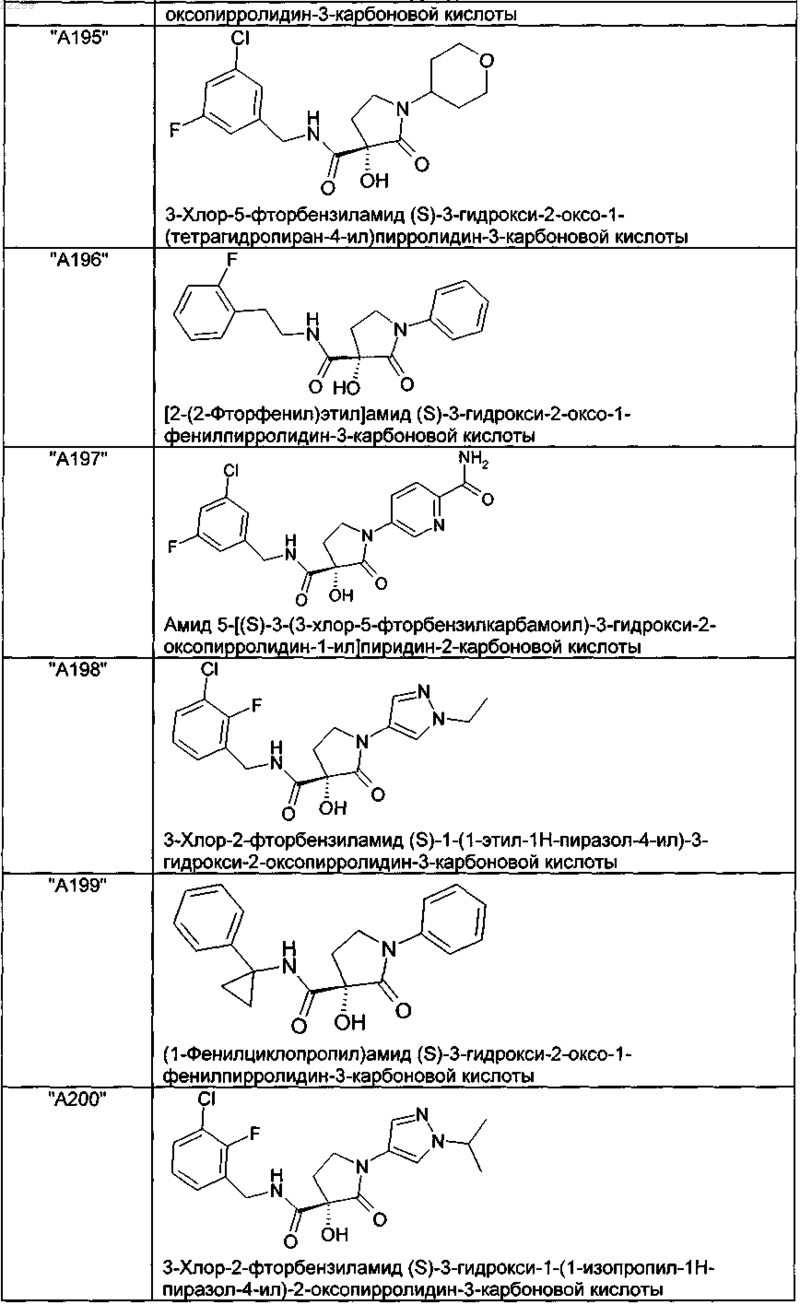
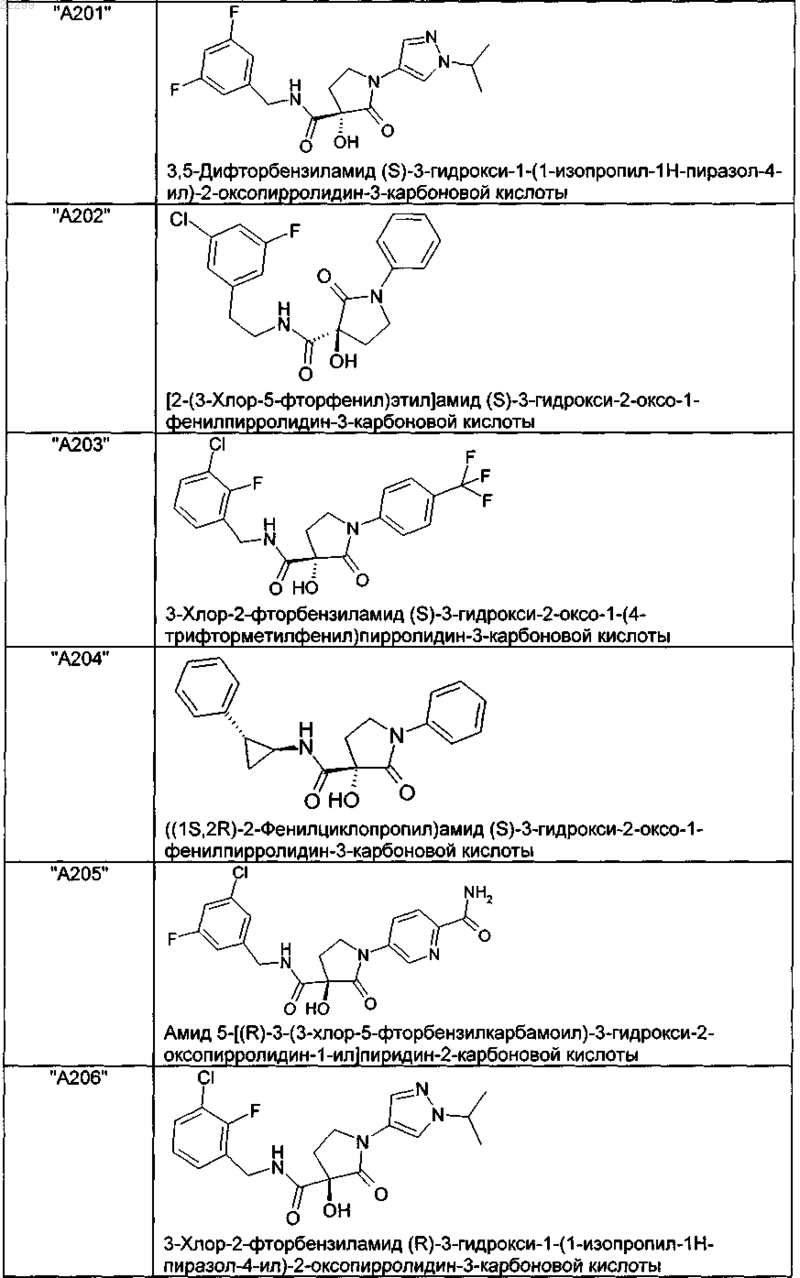
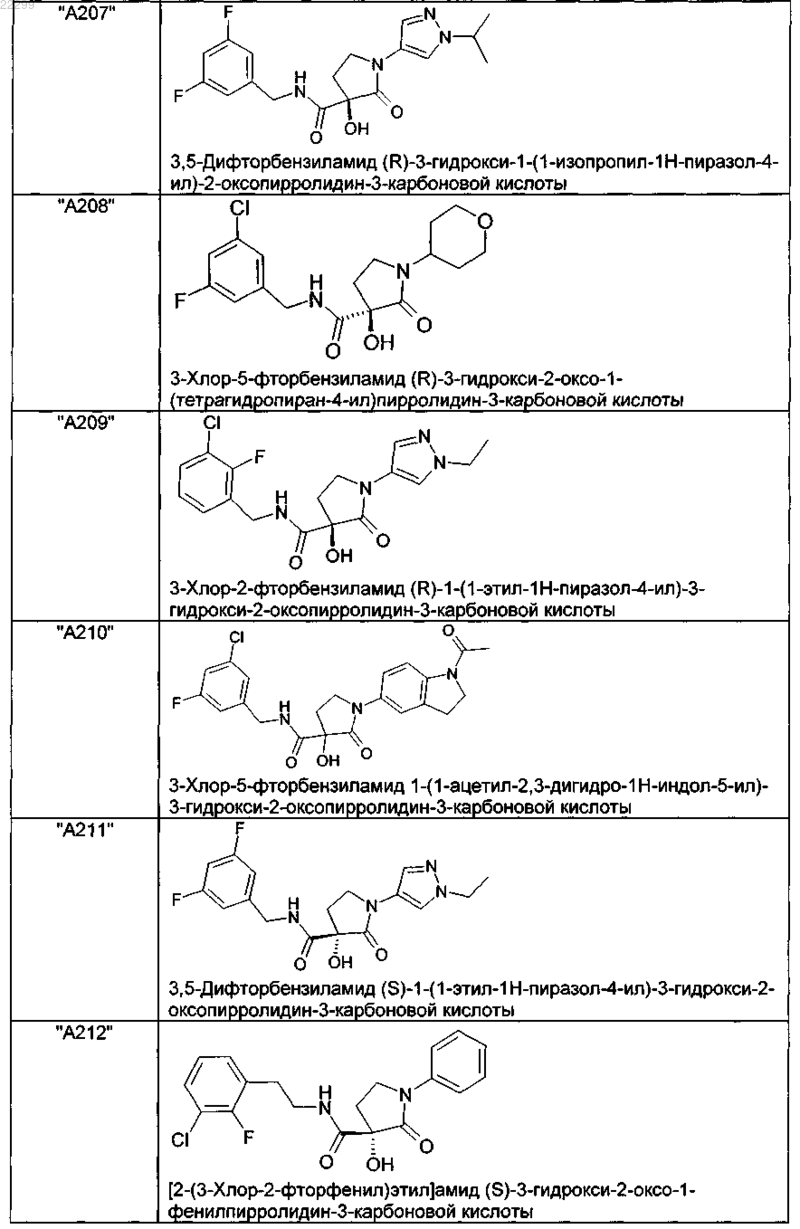

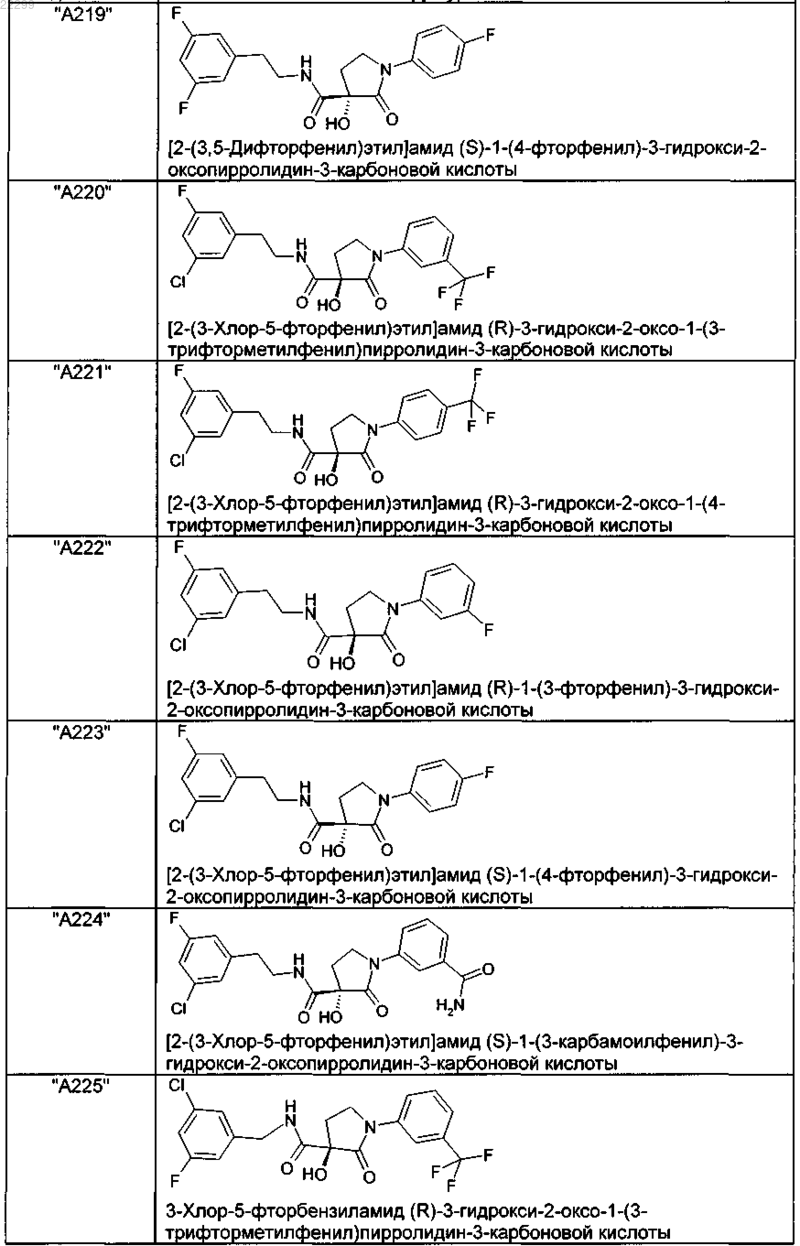
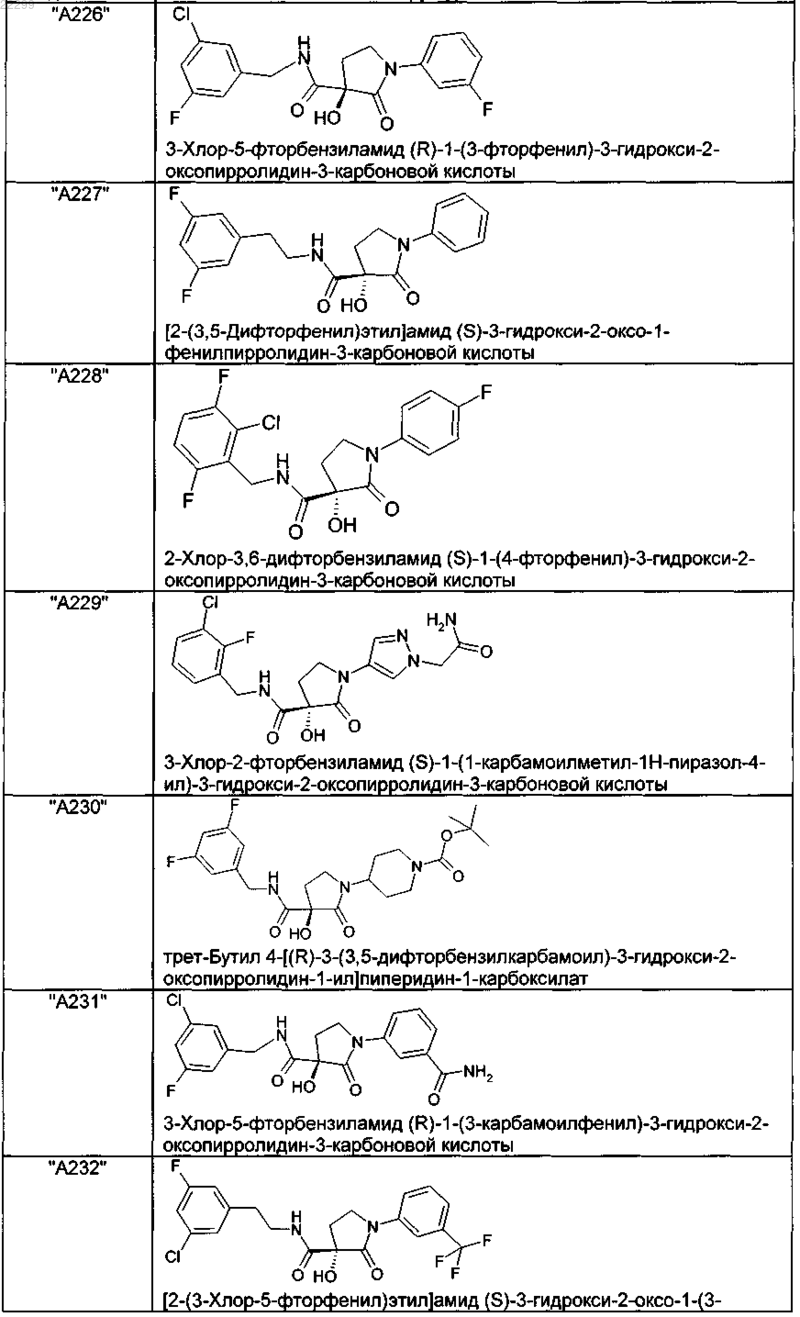
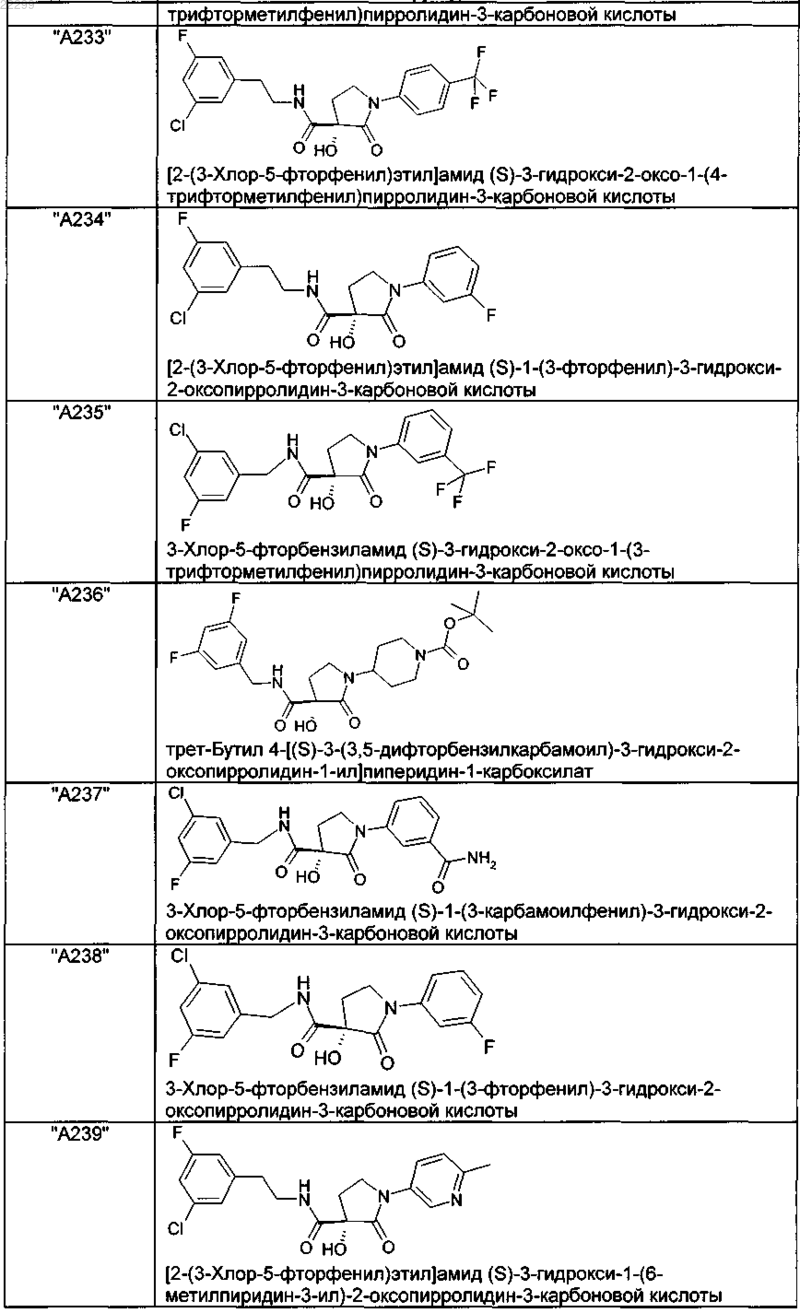
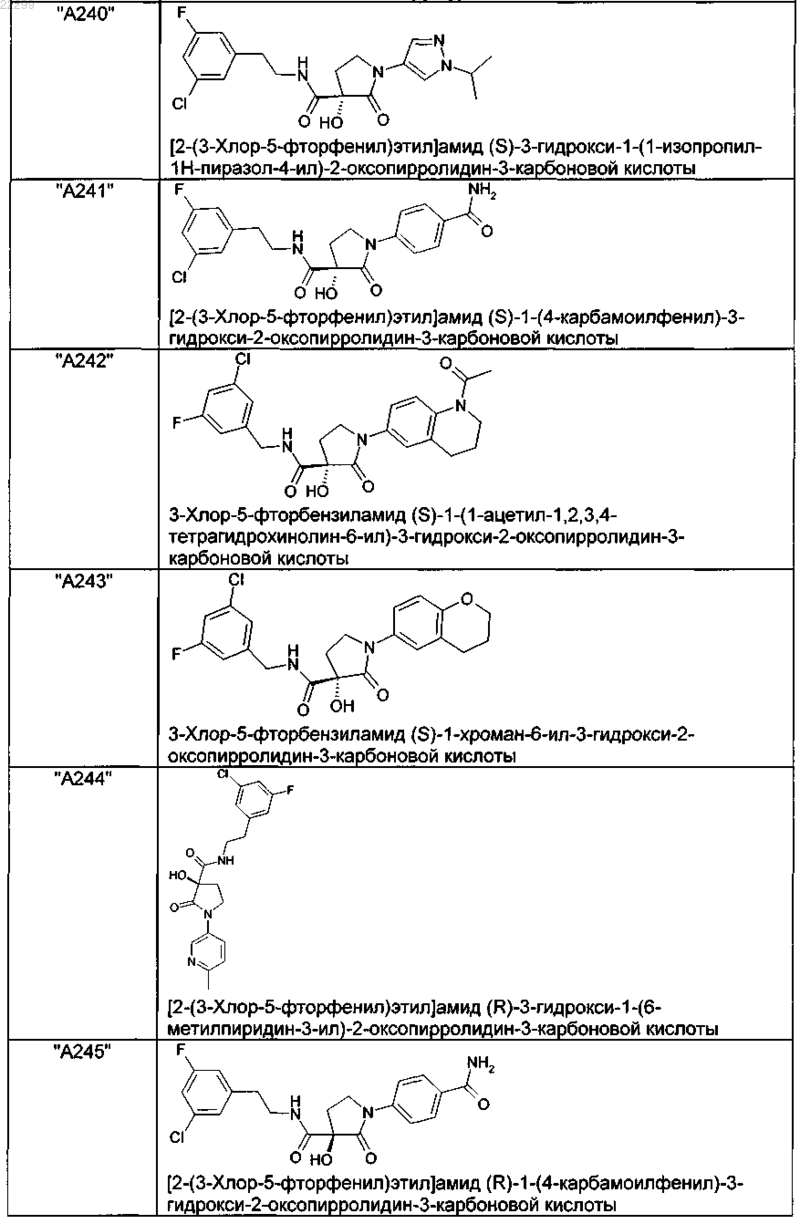
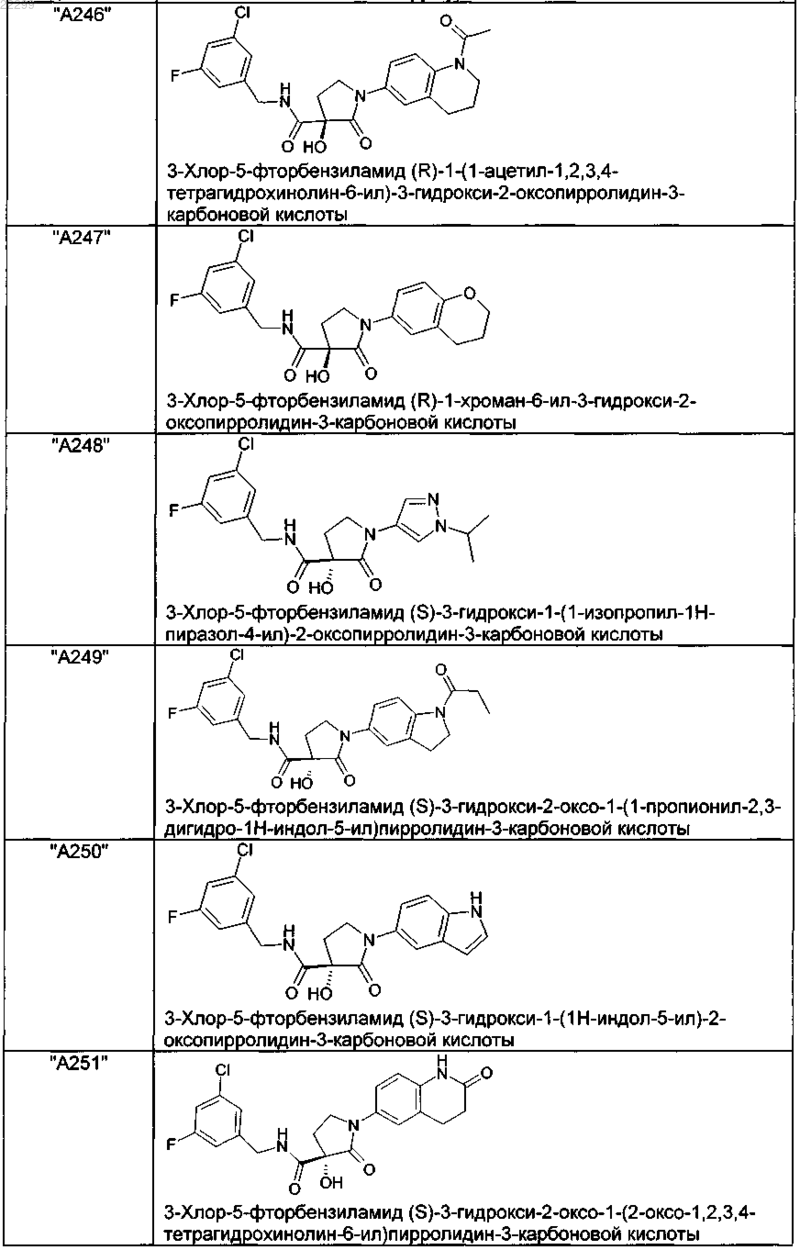
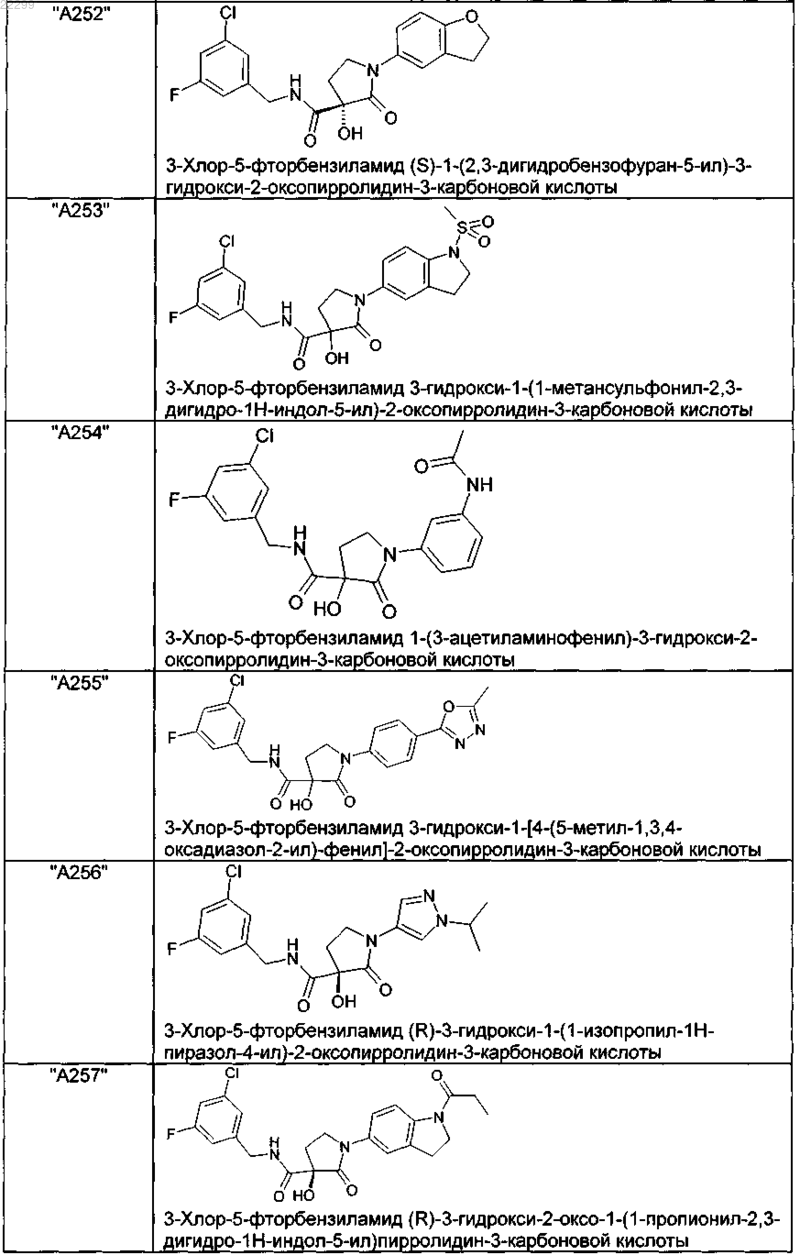
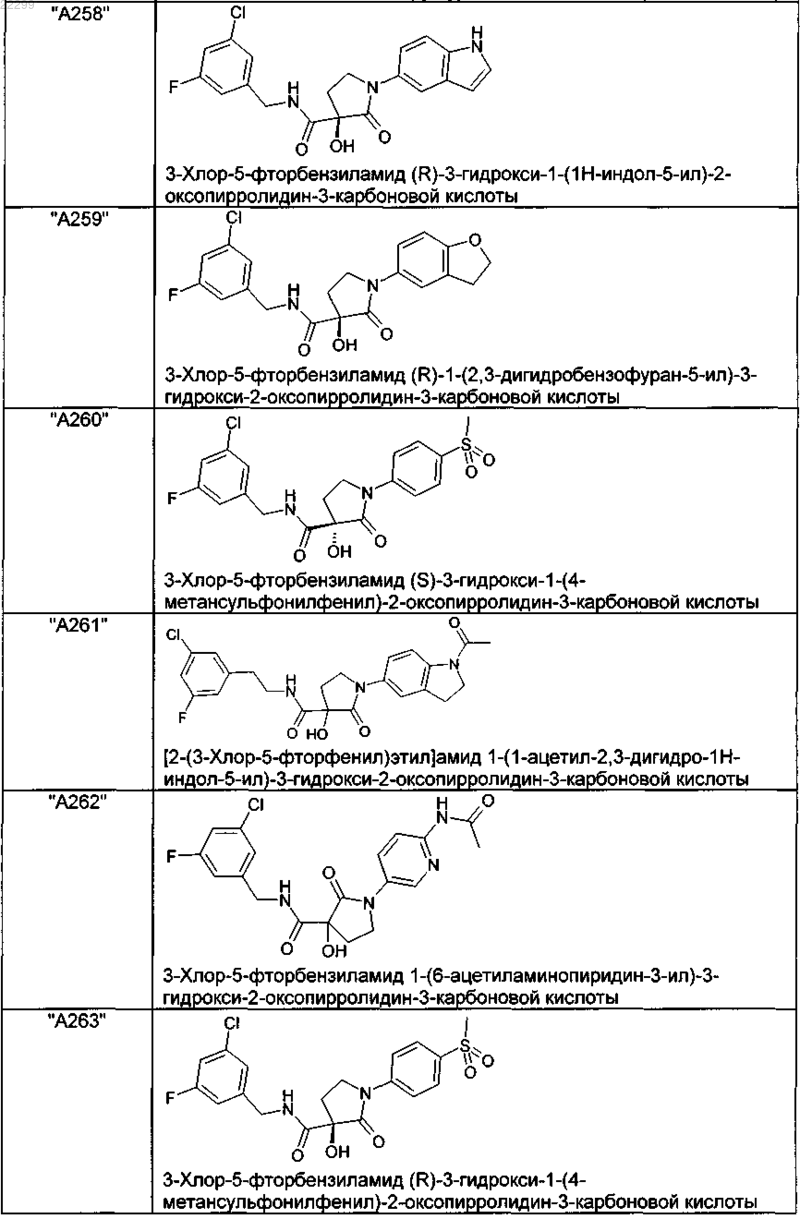
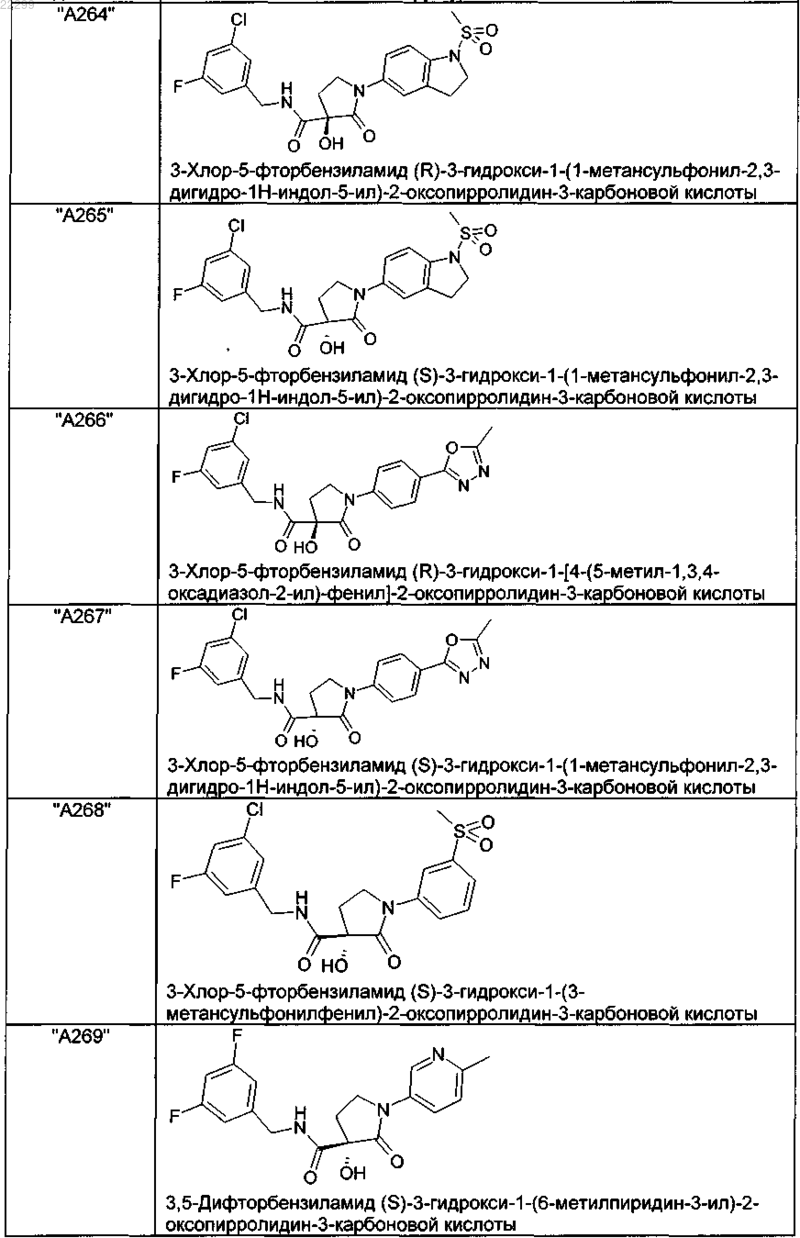


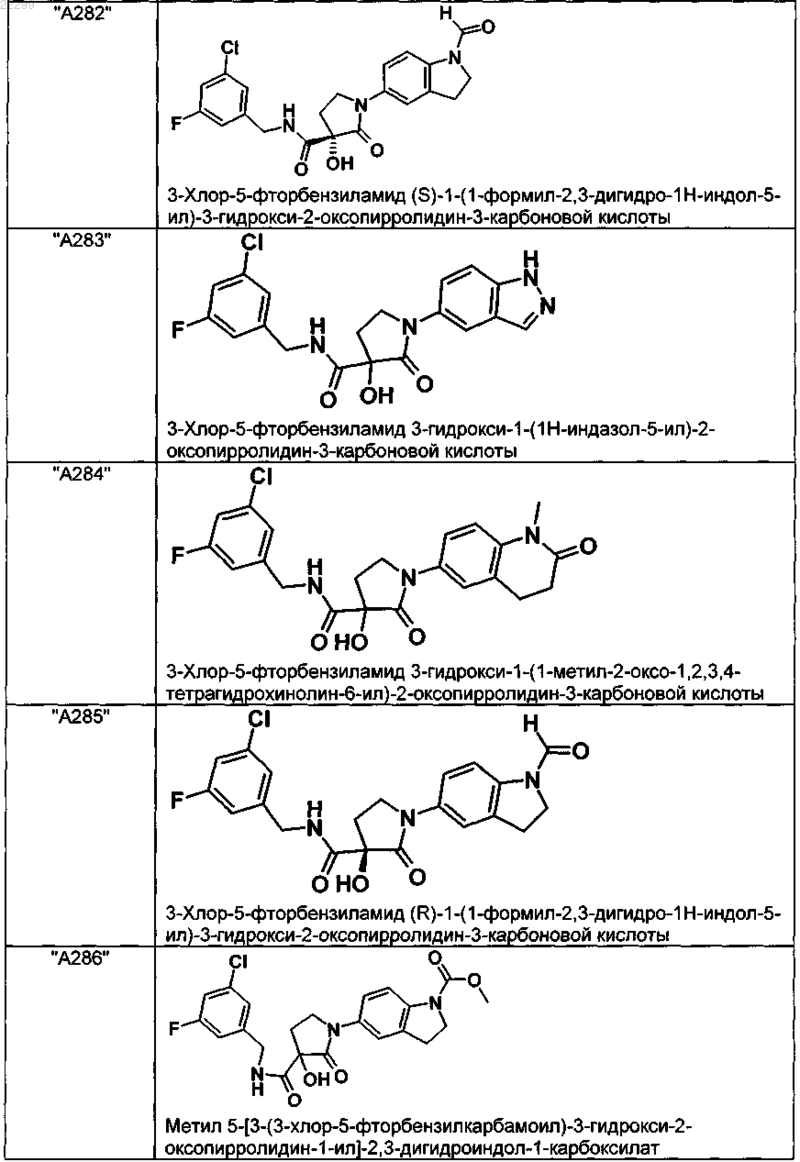
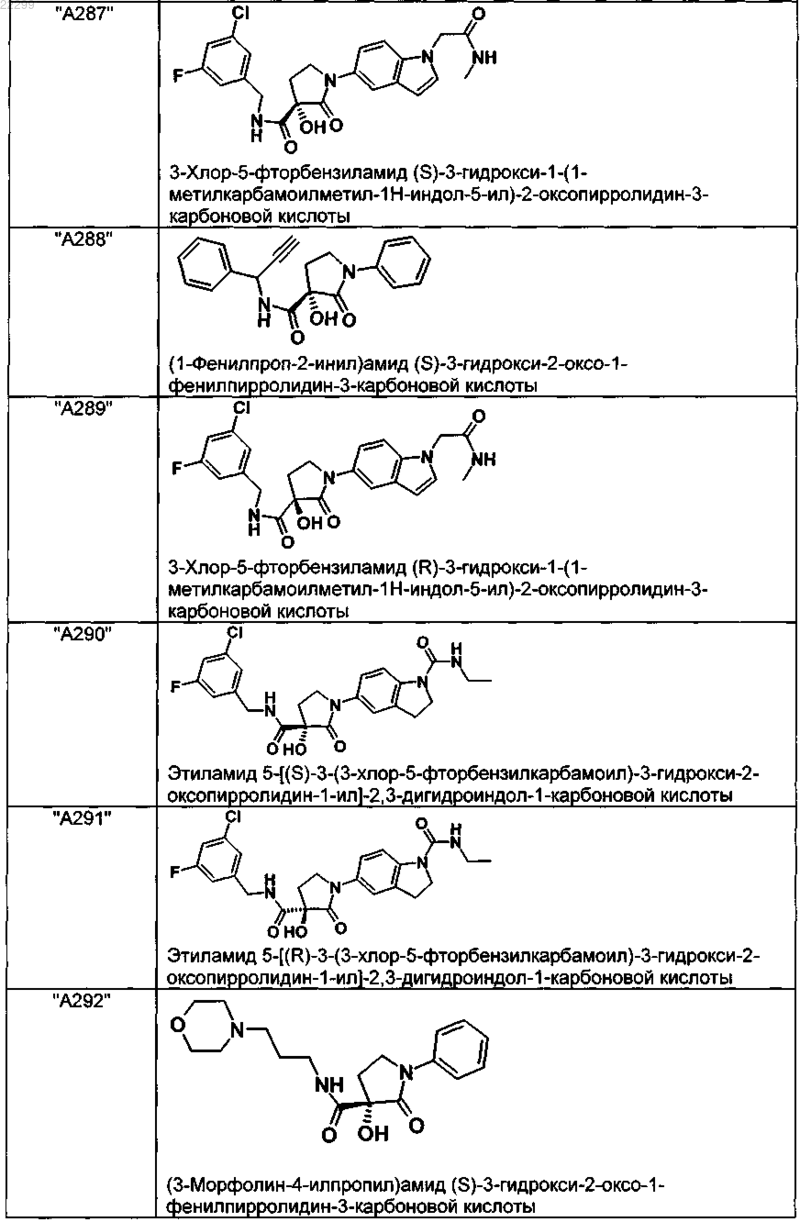
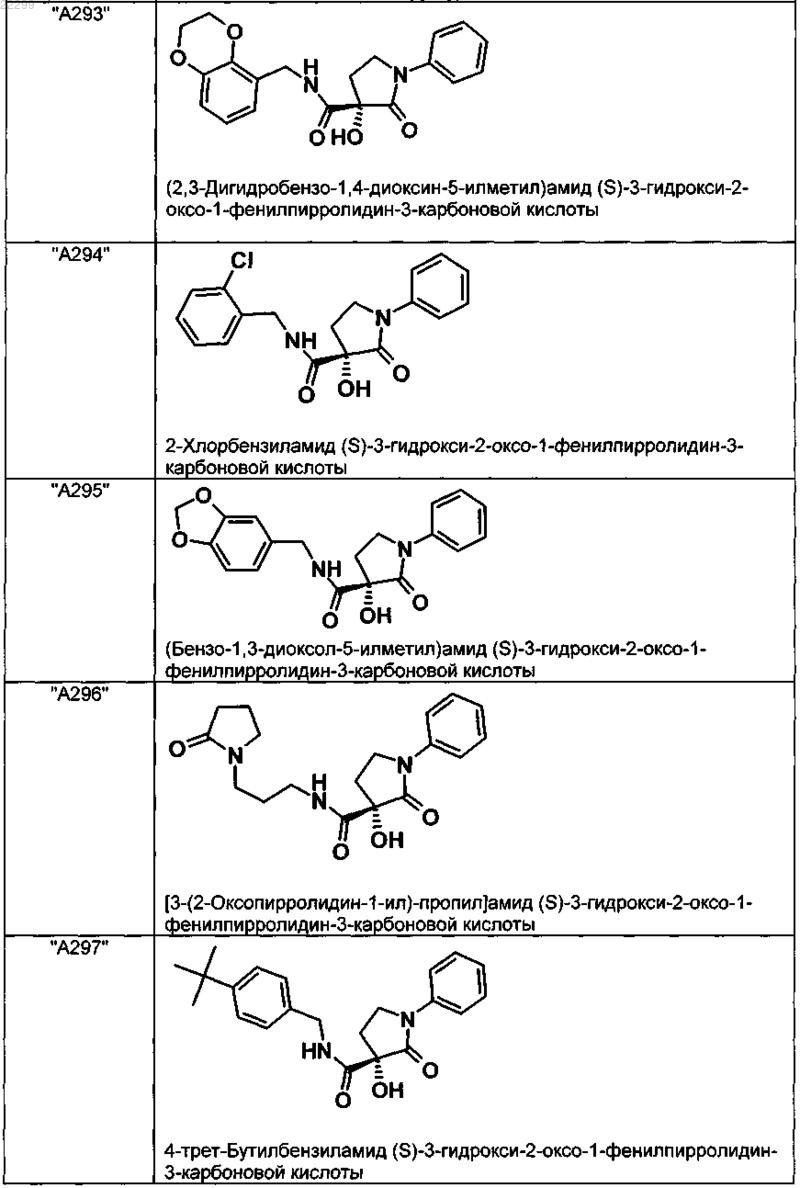
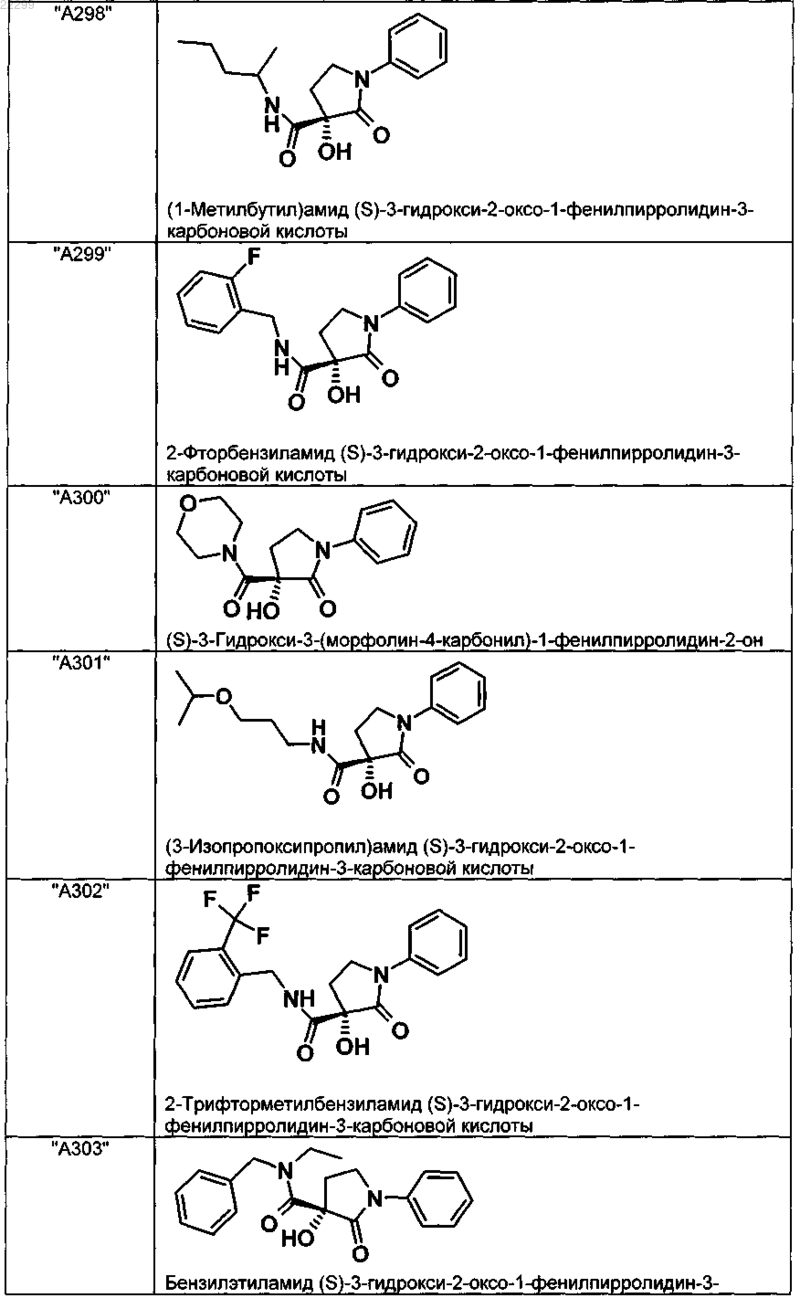
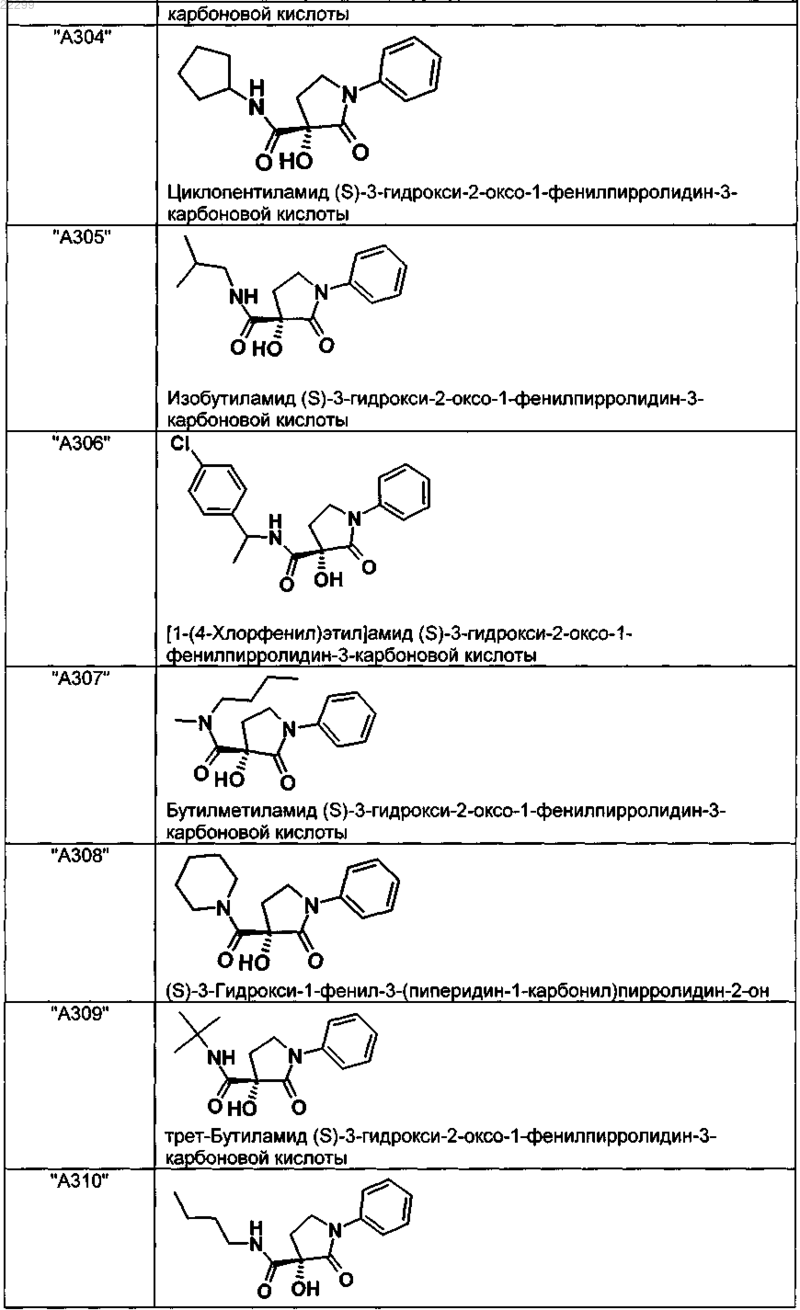
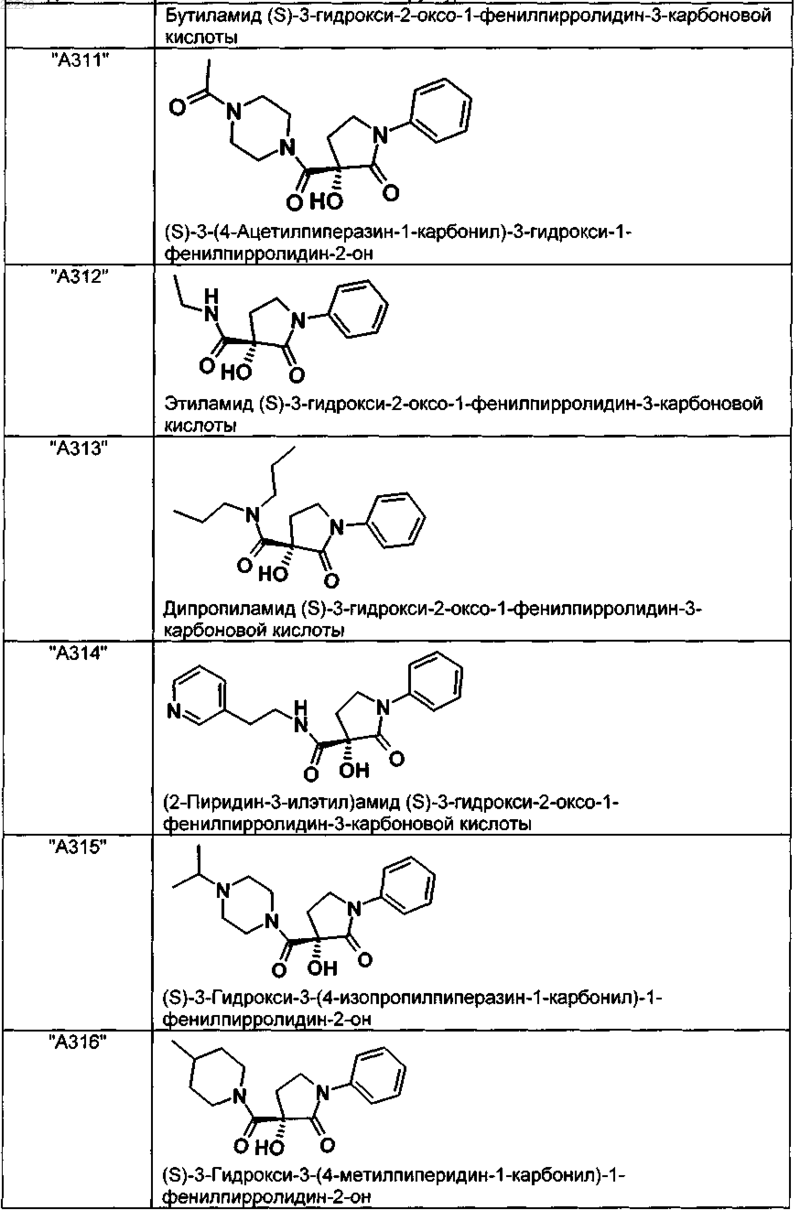
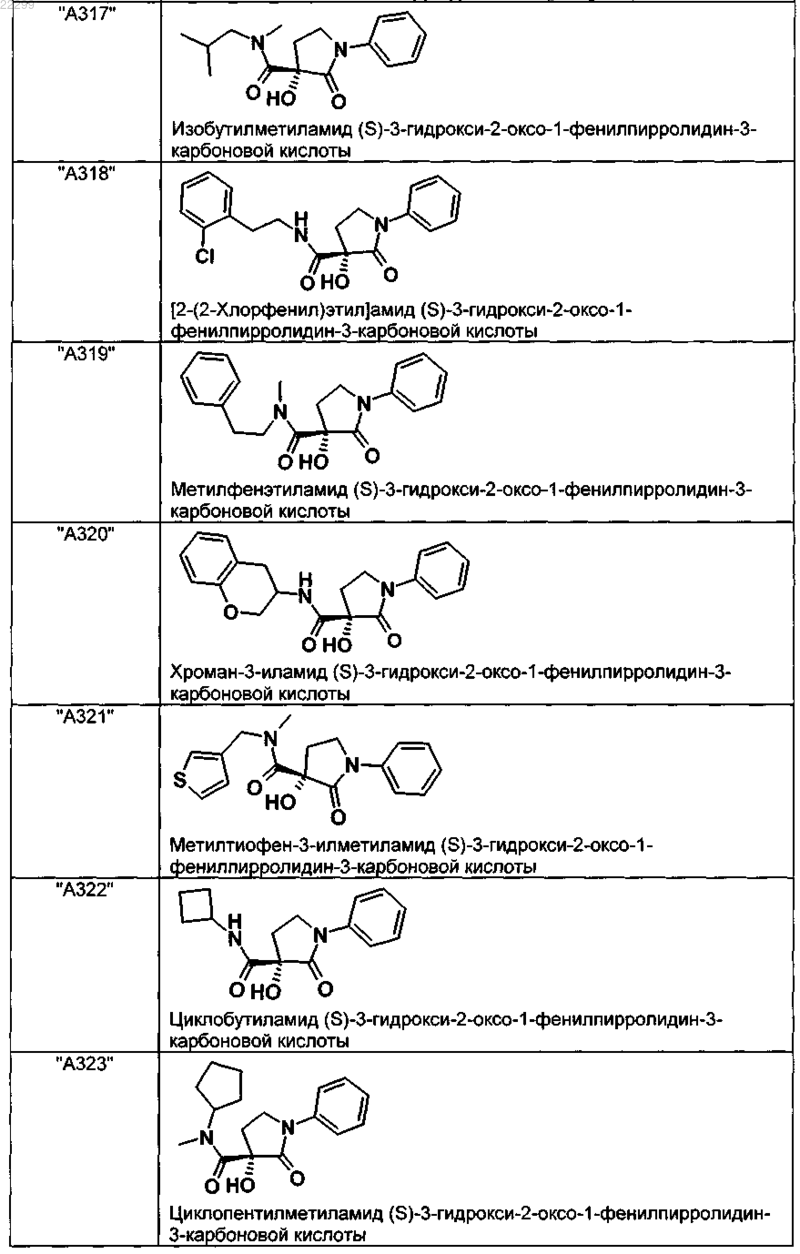
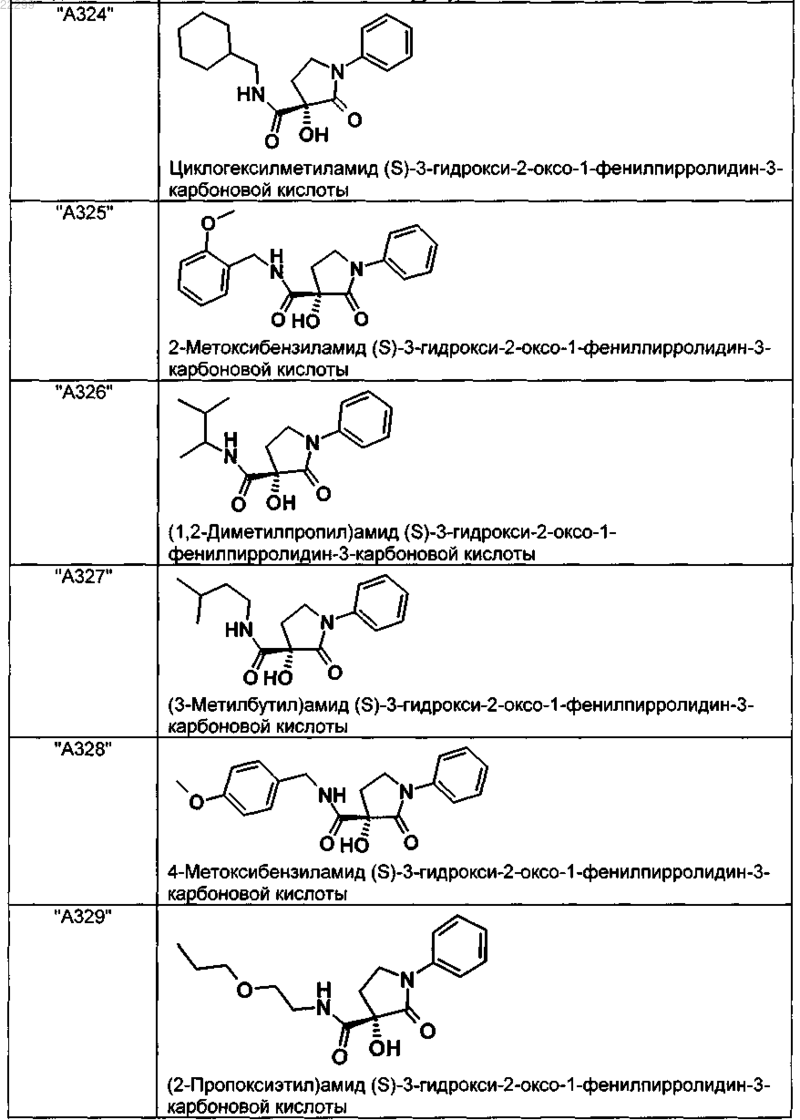
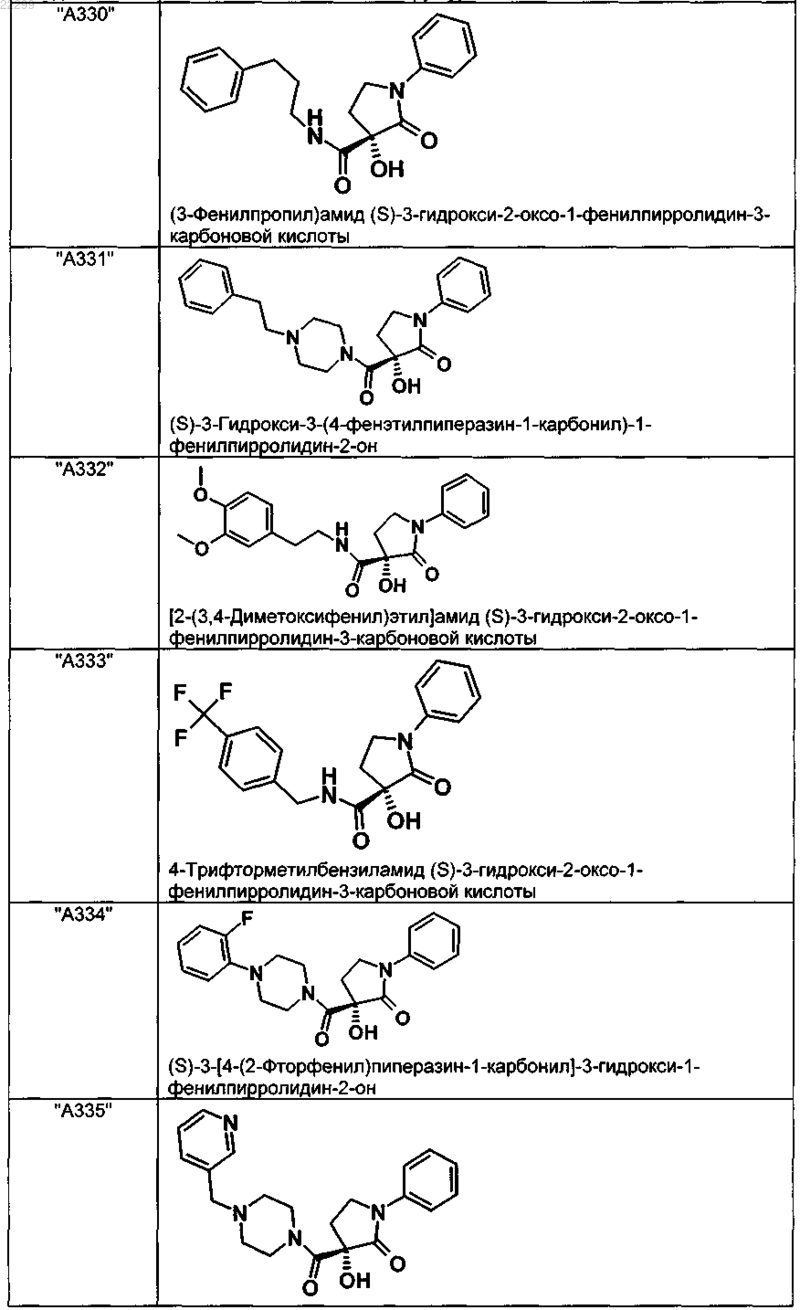
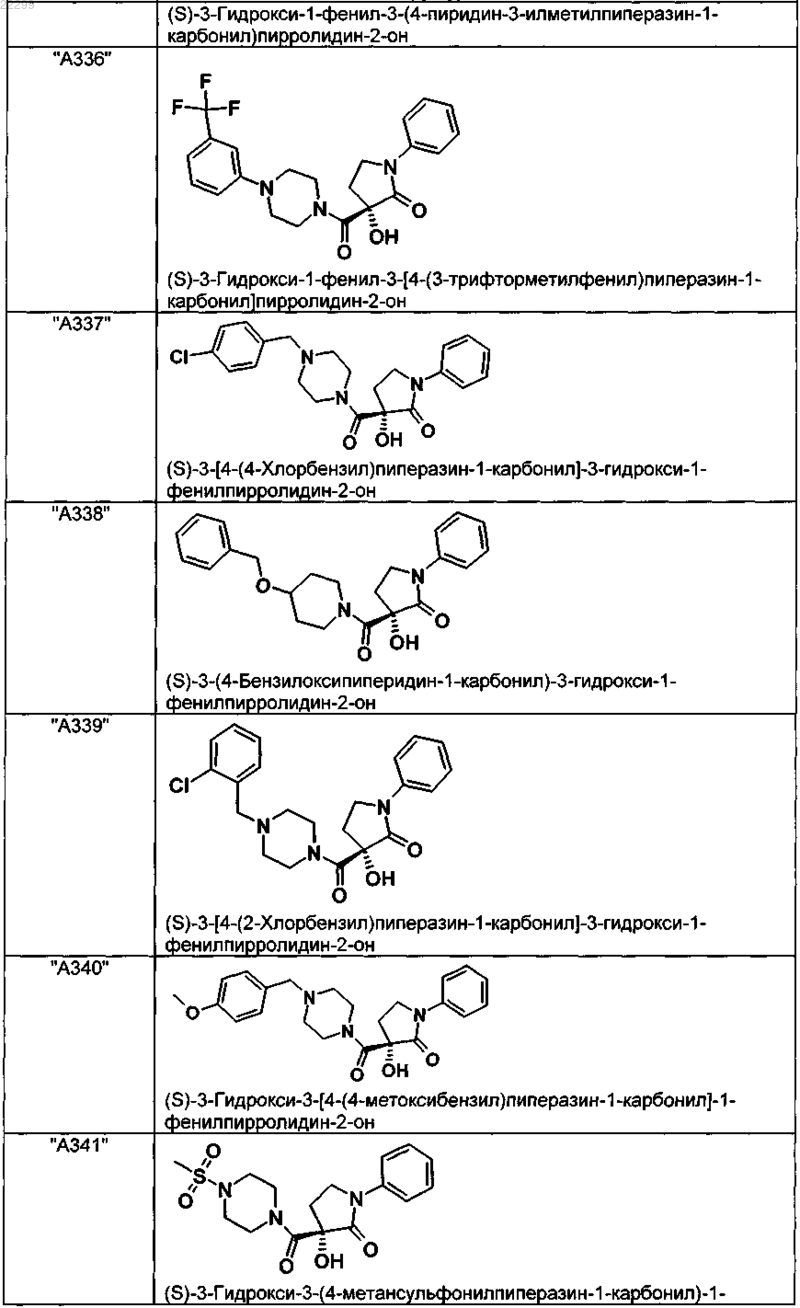
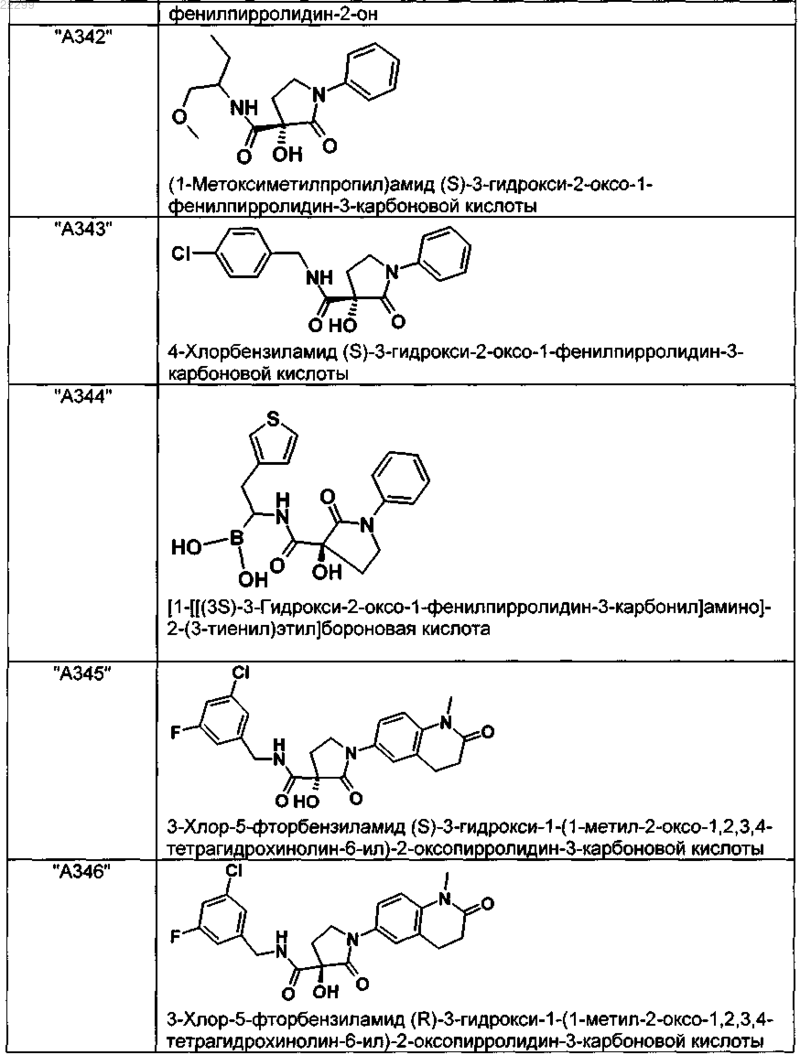
и его фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях.
3. Способ получения соединения формулы I по пп.1, 2 и его фармацевтически применимых солей и стереоизомеров, отличающийся тем, что соединение формулы II
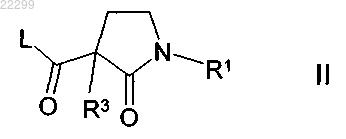
в которой R1 и R3 имеют значения, указанные в п.1; и L означает Cl, Br, I или свободную или реакционноспособную функционально модифицированную OH группу,
подвергают реакции с соединением формулы III
в которой R2 и R4 имеют значения, указанные в п.1,
и/или основание или кислоту формулы I превращают в одну из его (ее) солей.
4. Лекарственное средство, содержащее по меньшей мере одно соединение формулы I по пп.1, 2 и/или его фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества.
5. Применение соединения формулы I по пп.1, 2 и его фармацевтически применимых солей и стереоизомеров, включая их смеси во всех соотношениях, для лечения опухолей, метастазов опухолей, пролиферативных заболеваний мезангиальных клеток, гемангиомы, пролиферативной ретинопатии, ревматоидного артрита, атеросклеротической неоваскуляризации, псориаза, неоваскуляризации глаза, остеопороза, диабета и ожирения, лимфоидного лейкоза, лимфомы, малярии и гипертрофии предстательной железы.
6. Применение по п.5, где опухолевое заболевание выбирают из группы, включающей опухоль плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы, кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани, легкого, кожи; моноцитарный лейкоз, аденокарциному легкого, мелкоклеточную карциному легкого, рак поджелудочной железы, глиобластому, карциному молочной железы, острый миелобластный лейкоз, хронический миелобластный лейкоз, острый лимфолейкоз, хронический лимфолейкоз, ходжскинскую лимфому, неходжскинскую лимфому.
7. Применение соединения формулы I по пп.1, 2 и/или его физиологически приемлемых солей для лечения опухолей, где терапевтически эффективное количество соединения формулы I вводят в комбинации с соединением из группы, включающей 1) модулятор эстрогенового рецептора, 2) модулятор андрогенового рецептора, 3) модулятор ретиноидного рецептора, 4) цитотоксический агент, 5) антипролиферативный агент, 6) ингибитор пренил-протеин-трансферазы, 7) ингибитор HMG-CoA редуктазы, 8) ингибитор ВИЧ-протеазы, 9) ингибитор обратной транскриптазы и 10) другие ингибиторы ангиогенеза.
8. Применение соединения формулы I по пп.1, 2 и/или его физиологически приемлемых солей для лечения опухолей, где терапевтически эффективное количество соединения формулы I вводят в комбинации с радиотерапией и соединением из группы, включающей 1) модулятор эстрогенового рецептора, 2) модулятор андрогенового рецептора, 3) модулятор ретиноидного рецептора, 4) цитотоксический агент, 5) антипролиферативный агент, 6) ингибитор пренил-протеин-трансферазы, 7) ингибитор HMG-CoA редуктазы, 8) ингибитор ВИЧ-протеазы, 9) ингибитор обратной транскриптазы и 10) другие ингибиторы ангиогенеза.
Текст
в которой R1, R2, R3 и R4 имеют значения, указанные в п.1, являются ингибиторами метионинаминопептидазы и могут применяться для лечения опухолей.(71)(73) Заявитель и патентовладелец: МЕРК ПАТЕНТ ГМБХ (DE) в которой R1 означает фенил, бензил, нафтил или бифенил, каждый из которых не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством Hal, CN, NHCOA, NHSO2A, SO2A и/или CONH2, А или (CH2)nHet;R2 и R4 вместе также означают алкилен, содержащий 2, 3, 4 или 5 атомов С, где одна группа СН 2 также может быть заменена на NH, NA, N-COA, N-(CH2)nAr3, N-(CH2)nHet2, CH-A, CH-O-(CH2)nAr3,N-SO2A или О и/или может быть замещена посредством А;Het означает пиридазинил, пиразолил, бензимидазолил, пиридил, дибензофуранил, карбазолил, индолил, дигидроиндолил, бензофуранил, дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил, хроманил, пиперазинил, морфолинил, тетрагидропиранил, хинолинил, изохинолинил, изоиндолил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, пуринил, нафтиридинил, пиримидинил, индазолил, фурил, тиенил, имидазолил,пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, бензотиазолил, имидазо[1,2-а]пиридинил, 1,3-бензодиоксолил, бензоксазолил, пиперидин-1-ил, пирролидин-1-ил,1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А, ОА, СООА, СОА, CHO,(CH2)nCONH2, (CH2)nCONHA, (CH2)nCONA2, SO2A, NHSO2A, =O и/или Het1;Het1 означает пиридазинил, пиразолил, пиридил, пиперазинил, морфолинил, пиримидинил, фурил,тиенил, имидазолил, пирролил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, пиперидин-1-ил, пирролидин-1-ил, тетрагидропиранил, 1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил,1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А и/или ОА;Het2 означает пиридил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил или тиадиазол; А означает неразветвленный или разветвленный алкил, содержащий 1-10 атомов С, в котором 1-7 атомов Н могут быть заменены на F, Cl, Br, OH, CHO, CN и/или CONH2 и/или в котором одна или две группы СН и/или СН 2, не расположенные рядом, могут быть заменены на О, N и/или NR4 или Сус;Ar2 означает фенил, который не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством A, Hal, CN, OH и/или ОА;Ar3 означает фенил, который не замещен или моно-, ди- или тризамещен посредством Hal, OH, ОА и/или А; Сус означает циклический алкил, содержащий 3-7 атомов С;n означает 0, 1, 2, 3 или 4,и его фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях. Объектом настоящего изобретения является выявление новых соединений, обладающих ценными свойствами, в особенности тех, которые могут применяться для получения лекарственных средств. Было обнаружено, что соединения формулы I и их соли обладают чрезвычайно ценными фармакологическими свойствами, а также хорошей переносимостью. В частности, они демонстрируют регулирующее, модулирующее и/или ингибирующее действие на металлопротеазы, предпочтительно на метионинаминопептидазу (MetAP), особенно на подтип MetAP-2. Они могут применяться в качестве лекарственных средств против рака, а также в качестве лекарственных средств, которые положительно влияют на жировой обмен, а также в качестве лекарственных средств против воспаления. Было обнаружено, что S-энантиомер соединений в соответствии с изобретением значительно более активен по отношению к MetAP-2, чем его зеркальное отображение (R-энантиомер). Другие гидроксилзамещенные пирролидиноны известны из:WO 01/79157 описывает замещенные гидразиды и N-алкоксиамиды, которые обладают ингиби-1 022299 рующей активностью в отношении MetAP-2 и могут применяться для ингибирования ангиогенеза, в частности для лечения заболеваний, таких как, например, рак, развитие которого зависит от ангиогенеза.WO 02/081415 описывает ингибиторы MetAP-2, которые могут применяться для лечения рака, гемангиомы, пролиферативной ретинопатии, ревматоидного артрита, атеросклеротической неоваскуляризации, псориаза, неоваскуляризации глаза и ожирения.WO 2008/011114 описывает соединения в качестве ингибиторов ангиогенез и ингибиторовMetAP-2, которые могут применяться для лечения лимфоидного лейкоза и лимфомы. Действие соединений в соответствии с изобретением против рака заключается, в частности, в их действии против ангиогенеза. Доказано, что ингибирование ангиогенеза полезно при более чем 70 заболеваниях, таких как, например, рак яичников (F. Spinella et al. J. Cardiovasc. Pharmacol. 2004, 44, S. 140),рак молочной железы (А. Morabito et al. Crit. Rev. Oncol./Hematol. 2004, 49, 91), рак предстательной железы (В. Nicholson et al. Cancer Metastas. Rev. 2001, 20, 297), диабетическая слепота, псориаз и дегенерация желтого пятна (Е. Ng et al. Can. J. Ophthalmol. 2005, 23, 3706). Протеазы регулируют множество различных клеточных процессов, в частности модуляцию пептидов и белков, в частности превращение белков, созревание белков и процессинг сигнальных белков, разрушение аномальных белков и деактивацию/активацию регуляторных белков. В частности, аминотерминальная модификация образующихся пептидов представляет собой наиболее часто встречающуюся модуляцию. Аминопротеазами являются металлопротеазы, которые отщепляют аминокислоты от незащищенных N-концов пептидов или белков, что может быть осуществлено либо со-, либо посттрансляционным способом. Метионинаминопептидаза (MetAP) отщепляет терминальный метионин образующихся пептидов, в частности, если предпоследняя аминокислота является небольшой и незаряженной (например Gly, Ala, Ser, Thr, Val, Pro или Cys). Во многих процессах заболевания ангиогенез либо является центральным фактором такого заболевания, либо оказывает усугубляющие влияние на развитие заболевания. В случаях рака, например, ангиогенез приводит к увеличению опухоли в размерах и возможности к проникновению в другие органы. Другими заболеваниями, при которых играет важную роль ангиогенез, являются псориаз, артроз, артериосклероз и глазные болезни, такие как диабетическая ретинопатия, дегенерация желтого пятна, связанная со старением, покраснение радужной оболочки или неоваскулярная глаукома и, кроме того, воспаления. Соединения формулы I, на которых основано настоящее изобретение, композиции, которые содержат эти соединения, и описанные способы, таким образом, могут применяться для лечения этих заболеваний. Соответственно, соединения в соответствии с изобретением или их фармацевтически приемлемые соли вводят для лечения рака, включая солидные карциномы, такие как, например, карциномы (легких,поджелудочной железы, щитовидной железы, мочевого пузыря или ободочной кишки), миелоидные заболевания (например, миелоидный лейкоз) или аденомы (например, ворсинчатая аденома ободочной кишки). Опухоли, кроме того, включают моноцитарный лейкоз, опухоли мозга, мочеполовой системы, лимфатической системы, желудка, карциному гортани и легкого, включая аденокарциному легкого и мелкоклеточную карциному легкого, карциному поджелудочной железы и/или молочной железы. Настоящее изобретение, следовательно, относится к соединениям в соответствии с изобретением в качестве лекарственных средств и/или лекарственным средствам для лечения и/или профилактики указанных заболеваний и к применению соединений в соответствии с изобретением для лечения и/или профилактики указанных заболеваний. Можно показать, что соединения в соответствии с изобретением обладают антиканцерогенным действием. Соединения в соответствии с изобретением вводят пациенту,страдающему заболеванием, например, для ингибирования роста опухоли, для уменьшения воспаления,связанного с лимфопролиферативным заболеванием, для ингибирования отторжения трансплантата или неврологического повреждения вследствие восстановления тканей и т.д. Соединения согласно настоящему изобретению пригодны для профилактических или терапевтических целей. В данном контексте термин "лечение" используется в отношении как предотвращения заболеваний, так и лечения уже имеющихся состояний. Предотвращение пролиферации/жизнеспособности достигается путем введения соединений в соответствии с изобретением до развития заболевания с явной клинической картиной, например для предотвращения роста опухоли. Альтернативно, соединения применяются для лечения существующих заболеваний путем стабилизации или улучшения клинических симптомов у пациента. Хозяин или пациент может принадлежать к любому виду млекопитающих, например, такому как приматы, предпочтительно человек; грызуны, включая мышей, крыс и хомячков; кролики; лошади, коровы, собаки, кошки и т.д. Животные модели представляют интерес для экспериментальных исследований, поскольку они обеспечивают модель для лечения заболевания человека. Восприимчивость конкретной клетки к обработке соединениями в соответствии с изобретением может быть определена путем тестирования in vitro. Как правило, культуру клеток инкубируют с соединением в соответствии с изобретением при различных концентрациях в течение времени, которого достаточно для того, чтобы позволить активным агентам вызвать некроз клеток или ингибирование пролиферации клеток, жизнеспособности или миграции клеток, обычно в диапазоне приблизительно между 1 ч и 1 неделей. Тестирование in vitro может быть осуществлено с использованием культивируемых клеток из биопсийного образца. Затем определяют количество клеток, оставшихся после обработки. Доза варьируется в зависимости от конкретно применяемого соединения, конкретного заболевания, состояния пациента, и т.д. Терапевтической дозы обычно достаточно для уменьшения популяции нежелательных клеток в целевой ткани, в то время как жизнеспособность пациента сохраняется. Лечение, как правило, продолжают до тех пор, пока не будет достигнуто значительного сокращения, например по меньшей мере приблизительно 50% сокращения клеточной нагрузки, и может быть продолжено до тех пор, пока в организме, по существу, не будут обнаруживаться нежелательные клетки. Было обнаружено, что соединения в соответствии с изобретением вызывают специфичное ингибирование MetAP-2. Соединения в соответствии с изобретением предпочтительно демонстрируют выгодную биологическую активность, которую можно обнаружить в тестах, описанных, например, в данном документе. В таких тестах соединения в соответствии с изобретением демонстрируют и вызывают ингибирующее действие, которое обычно документируется посредством IC50 значений в пригодном диапазоне, предпочтительно в микромолярном диапазоне и более предпочтительно в наномолярном диапазоне. Кроме того, соединения в соответствии с изобретением могут применяться для достижения аддитивного или синергетического действия в определенных существующих методах химиотерапии и радиотерапии рака и/или для восстановления эффективности определенных существующих методов химиотерапии и радиотерапии рака. Соединения в соответствии с изобретением также могут применяться для лечения ожирения. HenriR. Lijnen et al. в Obesity, vol. 18, No. 12, 2241-2246 (2010) описывают применение фумагиллина, ингибитора MetAP-2, для уменьшения жировой ткани. Применение ингибиторов MetAP-2 (соединений типа фумагиллина) для лечения ожирения также описывается в WO 2011/085201 А 1. Соединения в соответствии с изобретением также могут применяться для лечения малярии. X.Chem et al. в ChemistryBiology, vol. 16, 193-202 (2009) описывают применение фумагиллина, ингибитора MetAP-2, для лечения малярии. Соединения в соответствии с изобретением также могут применяться для лечения доброкачественной гипертрофии предстательной железы. Применение ингибиторов MetAP-2 (соединений типа фумагиллина) для лечения доброкачественной гипертрофии предстательной железы описывается вWO 2011/085198 А 1. Под соединениями формулы I также подразумевают оптически активные формы (стереоизомеры) и фармацевтически применимые соли. Выражение "эффективное количество" означает количество лекарственного средства или фармацевтического активного соединения, которое вызывает в ткани, системе,животном или человеке биологическую или медицинскую ответную реакцию, которую стремится получить или ожидает, например, исследователь или врач. Кроме того, выражение "терапевтически эффективное количество" означает то количество, которое имеет следующие последствия по сравнению с соответствующим субъектом, который не получал этого количества: улучшение лечения, излечение, предотвращение или элиминация заболевания, синдрома, состояния, жалобы, расстройства или побочных действий или также уменьшение прогрессирования заболевания, состояния или расстройства. Выражение "терапевтически эффективное количество" также охватывает количества, которые являются эффективными для повышения нормальной физиологической функции. Изобретение также относится к применению смесей соединений формулы I, например смесей двух диастереомеров, например, в соотношении 1:1, 1:2, 1:3, 1:4, 1:5, 1:10, 1:100 или 1:1000. Особенно предпочтительными являются смеси стереоизомерных соединений. Изобретение относится к соединениям формулы I и их фармацевтически примененимым солям и к способу получения соединений формулы I и их фармацевтически применимых солей и стереоизомеров,который отличается тем, что: а) соединение формулы IIL означает Cl, Br, I или свободную или реакционноспособную функционально модифицированнуюOH группу,подвергают реакции с соединением формулы III в которой R2 и R4 имеют значения, указанные в п.1,и/или основание или кислоту формулы I превращают в одну из его (ее) солей. Выше и ниже радикалы R1, R2 и R3 имеют значения, указанные для формулы I, если специально не указано иное. А означает алкил, который является неразветвленным (линейным) или разветвленным, и содержит 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 атомов С. А предпочтительно означает метил, кроме того, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, кроме того, также пентил, 1-, 2- или 3-метилбутил,1,1-, 1,2- или 2,2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- или 4-метилпентил, 1,1-, 1,2-, 1,3-, 2,2-,2,3- или 3,3-диметилбутил, 1- или 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- или 1,2,2-триметилпропил, кроме того, предпочтительно, например, трифторметил. А предпочтительно означает неразветвленный или разветвленный алкил, содержащий 1-6 атомов С, в котором 1-7 атомов Н могут быть заменены на F, Cl, Br и/или OH. Кроме того, А предпочтительно означает неразветвленный или разветвленный алкил, содержащий 1-10 атомов С, в котором 1-7 атомов Н могут быть заменены на F, Cl, Br, OH, CHO, CN и/или CONH2 и/или в котором одна или две группы СН и/или СН 2, не расположенные рядом, могут быть заменены на О, N и/или NR4 или Сус.A особенно предпочтительно означает алкил, содержащий 1, 2, 3, 4, 5 или 6 атомов С, предпочтительно метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, трифторметил, пентафторэтил или 1,1,1-трифторэтил. Циклический алкил предпочтительно означает циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.R1 предпочтительно означает фенил, бензил, нафтил или бифенил, каждый из которых не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством Hal, CN, NHCOA, NHSO2A, SO2A и/илиAr2, кроме того, предпочтительно означает фенил, который не замещен или моно-, ди-, три-, тетраили пентазамещен посредством A, Hal, CN, OH и/или ОА.Het означает пиридазинил, пиразолил, бензимидазолил, пиридил, дибензофуранил, карбазолил, индолил, дигидроиндолил, бензофуранил, дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил, хроманил, пиперазинил, морфолинил, тетрагидропиранил, хинолинил, изохинолинил, изоиндолил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, пуринил, нафтиридинил, пиримидинил, индазолил, фурил, тиенил, имидазолил,пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, бензотиазолил, имидазо[1,2-а]пиридинил, 1,3-бензодиоксолил, бензоксазолил, пиперидин-1-ил, пирролидин-1-ил,1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А, ОА, СООА, СОА, CHO,(CH2)nCONH2, SO2A, NHSO2A, =O и/или Het1.Het особенно предпочтительно означает дигидроиндолил, бензофуранил, дигидробензофуранил,2,3-дигидробензо-1,4-диоксинил, хроманил, оксазолил, оксадиазолил, тетразолил, оксадиазолил, тиазолил, тиадиазолил, тиенил, фуранил, тетрагидропиранил, пиразолил, пиридил, бензотиазолил,2,3-дигидробензо-1,4-диоксинил, хинолил, изохинолил или пирролидинил, каждый из которых не замещен или моно- или дизамещен посредством А, СООА, СОА, CHO, (CH2)nCONH2, (CH2)nCONHA,(CH2)nCONA2, SO2A, NHSO2A, =O и/или пирролидинила. Независимо от дальнейших замещений Het1 означает пиридазинил, пиразолил, пиридил, пиперазинил, морфолинил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, пиперидин-1-ил, пирролидин-1-ил, тетрагидропиранил,1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А и/или ОА.Het1 особенно предпочтительно означает имидазолил, тиазолил или пирролидинил, каждый из которых не замещен или монозамещен посредством А.Hal предпочтительно означает F, Cl или Br, но также I, особенно предпочтительно F или Cl. Для всего изобретения все радикалы, которые встречаются более одного раза, могут быть одинаковыми или различными, т.е. они независимы друг от друга. Соединения формулы I могут иметь один или несколько хиральных центров и поэтому могут встречаться в разных стереоизомерных формах. Формула I охватывает все эти формы. Соответственно, изобретение, в частности, относится к соединениям формулы I, в которой по меньшей мере один из указанных радикалов имеет одно из предпочтительных значений, указанных вы-4 022299 ше. Некоторые предпочтительные группы соединений могут быть изображены с помощью следующих подформул Ia-If, которые соответствуют формуле I и в которых радикалы, не определенные более подробно, имеют значения, указанные для формулы I, но в которых: в Ia R1 означает фенил, бензил, нафтил или бифенил, каждый из которых не замещен или моно-, ди, три-, тетра- или пентазамещен посредством Hal, CN, NHCOA, NHSO2A, SO2A и/или CONH2; А или(CH2)nHet. в Ic: R3 означает OH, N3, NH2 или F. в Id: Het означает пиридазинил, пиразолил, бензимидазолил, пиридил, дибензофуранил, карбазолил,индолил, дигидроиндолил, бензофуранил, дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил, хроманил, пиперазинил, морфолинил, тетрагидропиранил, хинолинил, изохинолинил, изоиндолил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, пуринил, нафтиридинил, пиримидинил, индазолил, фурил, тиенил, имидазолил,пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, бензотиазолил, имидазо[1,2-а]пиридинил, 1,3-бензодиоксолил, бензоксазолил, пиперидин-1-ил, пирролидин-1-ил,1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А, ОА, СООА, СОА, CHO,(CH2)nCONH2, (CH2)nCONHA, (CH2)nCONA2, SO2A, NHSO2A, =O и/или Het1. в Ie: Het1 означает пиридазинил, пиразолил, пиридил, пиперазинил, морфолинил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол,пиперидин-1-ил, пирролидин-1-ил, тетрагидропиранил, 1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил,1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А и/или ОА. в If: R1 означает фенил, бензил, нафтил или бифенил, каждый из которых не замещен или моно-,ди-, три-, тетра- или пентазамещен посредством Hal, CN, NHCOA, NHSO2A, SO2A и/или CONH2; А илиR2 и R4 вместе также означают алкилен, содержащий 2, 3, 4 или 5 атомов С, где одна группа СН 2 также может быть заменена на NH, NA, N-COA, N-(CH2)nAr3, N-(CH2)nHet2, CH-A, CH-O-(CH2)nAr3,N-SO2A или О и/или может быть замещена посредством А;Het означает пиридазинил, пиразолил, бензимидазолил, пиридил, дибензофуранил, карбазолил, индолил, дигидроиндолил, бензофуранил, дигидробензофуранил, 2,3-дигидробензо-1,4-диоксинил, хроманил, пиперазинил, морфолинил, тетрагидропиранил, хинолинил, изохинолинил, изоиндолил, дигидрохинолинил, дигидроизохинолинил, тетрагидрохинолинил, тетрагидроизохинолинил, хиназолинил, хиноксалинил, фталазинил, пуринил, нафтиридинил, пиримидинил, индазолил, фурил, тиенил, имидазолил,пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, бензотиазолил, имидазо[1,2-а]пиридинил, 1,3-бензодиоксолил, бензоксазолил, пиперидин-1-ил, пирролидин-1-ил,1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил, 1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством A, OA, COOA, COA, CHO,(CH2)nCONH2, (CH2)nCONHA, (CH2)nCONA2, SO2A, NHSO2A, =O и/или Het1;Het1 означает пиридазинил, пиразолил, пиридил, пиперазинил, морфолинил, пиримидинил, фурил,тиенил, имидазолил, пирролил, оксазолил, изоксазолил, тиазолил, триазолил, тетразолил, тиадиазол, пиперидин-1-ил, пирролидин-1-ил, тетрагидропиранил, 1,2-оксазинан-2-ил, 1,2,5-оксадиазинан-2-ил,1,3-оксазинан-3-ил или гексагидропиримидинил, каждый из которых не замещен или моно-, ди- или тризамещен посредством А и/или ОА;Het2 означает пиридил, пиримидинил, фурил, тиенил, имидазолил, пирролил, оксазолил, оксадиазолил, изоксазолил, тиазолил, триазолил, тетразолил или тиадиазол; А означает неразветвленный или разветвленный алкил, содержащий 1-10 атомов С, в котором 1-7 атомов Н могут быть заменены на F, Cl, Br, OH, CHO, СОА, СООА, CN, CONA2, CONHA и/или CONH2,и/или в котором одна или две группы СН и/или СН 2, не расположенные рядом, могут быть заменены на О, N и/или NR4 или Сус;Ar2 означает фенил, который не замещен или моно-, ди-, три-, тетра- или пентазамещен посредством A, Hal, CN, OH и/или ОА;Ar3 означает фенил, который не замещен или моно-, ди- или тризамещен посредством Hal, OH, ОА и/или А; Сус означает циклический алкил, содержащий 3-7 атомов С;n означает 0, 1, 2, 3 или 4,и включают их фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях. Соединения формулы I, а также исходные вещества для их получения, кроме того, получают методами, известными per se, как описано в литературе (например, в стандартных работах, таких как HoubenWeyl, Methoden der organischen Chemie [Методы органической химии], Georg-Thieme-Verlag, Штутгарт),более точно, при реакционных условиях, которые являются известными и пригодными для указанных реакций. Также в данном случае можно использовать варианты, которые известны per se, но которые не упомянуты здесь более подробно. Соединения формулы I предпочтительно могут быть получены путем взаимодействия соединений формулы II с соединением формулы III. Соединения формулы II и формулы III в общем известны. Однако, если они являются новыми, то они могут быть получены с помощью методов, известных per se. В соединениях формулы II L предпочтительно означает Cl, Br, I или свободную или реакционноспособную модифицированную OH группу, такую как, например, активированный сложный эфир, имидазолид или алкилсульфонилокси, содержащий 1-6 атомов С (предпочтительно метилсульфонилокси или трифторметилсульфонилокси) или арилсульфонилокси, содержащий 6-10 атомов С (предпочтительно фенил- или п-толилсульфонилокси). Реакцию успешно проводят предпочтительно в присутствии дегидратирующего агента, такого как,например, карбодиимид, такой как N,N'-дициклогексилкарбодиимид ("DCCI"), 1,1'-карбонилдиимидазол или N-3-диметиламинопропил-N'-этилкарбодиимид ("DAPECI") и, кроме того, ангидрид пропанфосфоновой кислоты Т 3 Р (ср. Angew. Chem. 92, 129 (1980, дифенилфосфорилазид или 2-этокси-Nэтоксикарбонил-1,2-дигидрохинолин, необязательно в присутствии N-гидроксибензотриазола. Реакцию осуществляют в инертном растворителе и обычно проводят в присутствии вещества, связывающего кислоту, предпочтительно органического основания, такого как DIPEA, триэтиламин, диметиланилин, пиридин или хинолин. Также может быть полезным добавление гидроксида, карбоната или бикарбоната щелочного или щелочно-земельного металла или другой соли слабых кислот и щелочных или щелочно-земельных металлов, предпочтительно калия, натрия, кальция или цезия. В зависимости от применяемых условий время реакций находится в интервале между несколькими минутами и 14 днями, реакционная температура находится в интервале между приблизительно -15 и 150, обычно между 40 и 130, особенно предпочтительно между 60 и 110 С. Пригодными инертными растворителями являются, например, углеводороды, такие как гексан, петролейный эфир, бензол, толуол или ксилол; хлорированные углеводороды, такие как трихлорэтилен,1,2-дихлорэтан, четыреххлористый углерод, хлороформ или дихлорметан; спирты, такие как метанол,этанол, изопропанол, н-пропанол, н-бутанол или трет-бутанол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, тетрагидрофуран (ТГФ) или диоксан; гликолевые простые эфиры, такие как монометиловый или моноэтиловый эфир этиленгликоля, диметиловый эфир этиленгликоля (диглим); кетоны, такие как ацетон или бутанон; амиды, такие как ацетамид, диметилацетамид или диметилформамид (ДМФА); нитрилы, такие как ацетонитрил; сульфоксиды, такие как диметилсульфоксид (ДМСО); сероуглерод; карбоновые кислоты, такие как муравьиная кислота или уксусная кислота; нитросоединения, такие как нитрометан или нитробензол; сложные эфиры, такие как этилацетат, или смеси указанных растворителей. Особое предпочтение отдают гликолевым простым эфирам, таким как монометиловый эфир этиленгликоля, ТГФ, дихлорметану и/или ДМФА. Фармацевтические соли и другие формы. Соединения, раскрытые в изобретении, могут использоваться в своей конечной, несолевой форме. С другой стороны, настоящее изобретение также относится к применению таких соединений в форме их фармацевтически приемлемых солей, которые могут быть получены с помощью разнообразных органических и неорганических кислот и оснований в соответствии со способами, хорошо известными в данной области техники. Фармацевтически приемлемые солевые формы соединений формулы I получают, главным образом, с использованием традиционных способов. Если соединение формулы I содержит карбоксильную группу, то одна из его пригодных солей может быть образована с помощью реакции соединения с приемлемым основанием для получения соответствующей соли присоединения основания. Такими основаниями являются, например, гидроксиды щелочных металлов, включая гидроксид калия, гидроксид натрия и гидроксид лития; гидроксиды щелочно-земельных металлов, такие как гидроксид бария и гидроксид кальция; алкоксиды щелочных металлов, например этилат калия и пропилат натрия; а также различные органические основания, такие как пиперидин, диэтаноламин и N-метилглутамин. Сюда также включены соли алюминия соединений формулы I. Для некоторых соединений формулы I соли присоединения кислоты могут быть образованы путем обработки указанных соединений фармацевтически приемлемыми органическими и неорганическими кислотами, например галогеноводородами, такими как хлороводород, бромоводород или йодоводород, другими минеральными кислотами и их соответствующими солями, такими как сульфат, нитрат или фосфат, и т.п.; и алкил- и моноарилсульфонатами, такими как этансульфонат, толуолсульфонат и бензолсульфонат; и другими органическими кислотами, их соответствующими солями, такими как ацетат, трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат, аскорбат и т.п. Таким образом, фармацевтически приемлемые соли присоединения кислоты соединений формулы I включают следующие соли, но не ограничиваясь только ими: ацетат, адипат, альгинат, аргинат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бисульфит, бромид, бутират,камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат, цитрат, циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, этансульфонат, фумарат, галактерат (из слизевой кислоты), галактуронат, глюкогептаноат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат,йодид, изотионат, изобутират, лактат, лактобионат, малат, малеат, малонат, манделат, метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, пальмоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат, фталат. Кроме того, основные соли соединений в соответствии с изобретением включают, но не ограничиваясь только ими, соли алюминия, аммония, кальция, меди, железа(III), железа(II), лития, магния, марганца(III), марганца(II), калия, натрия и цинка. Предпочтительными среди перечисленных выше солей являются аммонийные; соли щелочных металлов натрия и калия и соли щелочно-земельных металлов кальция и магния. Соли соединений формулы I, которые происходят от фармацевтически приемлемых органических нетоксических оснований, включают, но не ограничиваясь только ими, соли первичных,вторичных и третичных аминов, замещенных аминов, также включая природные замещенные амины,циклические амины и основные ионообменные смолы, например аргинин, бетаин, кофеин, хлорпрокаин,холин, N,N'-дибензилэтилендиамин (бензатин), дициклогексиламин, диэтаноламин, диэтиламин,2-диэтиламиноэтанол,2-диметиламиноэтанол,этаноламин,этилендиамин,N-этилморфолин,N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лидокаин, лизин, меглумин, N-метил-D-глюкамин, морфолин, пиперазин, пиперидин, полиаминные смолы, прокаин, пурины,теобромин,триэтаноламин,триэтиламин,триметиламин,трипропиламин и трис(гидроксиметил)метиламин (трометамин). Соединения в соответствии с настоящим изобретением, которые включают основные азотсодержащие группы, могут быть кватернизированы с помощью таких агентов, как С 1-С 4-алкилгалогениды, например метил-, этил-, изопропил- и трет-бутилхлориды, бромиды и йодиды; ди-С 1-С 4-алкилсульфаты,например диметил-, диэтил- и диамилсульфаты; С 10-С 18-алкилгалогениды, например децил-, додецил-,лаурил-, миристил- и стеарилхлориды, бромиды и йодиды; и арил-С 1-С 4-алкилгалогениды, например,бензилхлорид и фенетилбромид. Указанные соли позволяют получать как растворимые в воде, так и растворимые в масле соединения в соответствии с изобретением. Предпочтительные фармацевтические соли, указанные выше, включают, но не ограничиваясь только ими, ацетат, трифторацетат, безилат, цитрат, фумарат, глюконат, гемисукцинат, гиппурат, гидрохлорид, гидробромид, изотионат, манделат, меглумин, нитрат, олеат, фосфонат, пивалат, фосфат натрия,стеарат, сульфат, сульфосалицилат, тартрат, тиомалат, тозилат и трометамин. Кислотно-аддитивные соли основных соединений формулы I получают путем приведения в контакт свободных оснований формы с достаточным количеством желаемой кислоты для получения соли традиционным способом. Свободное основание можно регенерировать путем приведения в контакт солевой формы с основанием и выделения свободного основания традиционным способом. Свободные основные формы в некоторой степени отличаются от своих соответствующих солевых форм своими определенными физическими свойствами, такими как растворимость в полярных растворителях; однако во всем остальном соли являются эквивалентными своим соответствующим свободным основным формам для целей настоящего изобретения. Как было указано, фармацевтически приемлемые соли присоединения основания соединений формулы I образуют с металлами или аминами, такими как щелочные металлы и щелочно-земельные металлы или органические амины. Предпочтительные металлы представляют собой натрий, калий, магний и кальций. Предпочтительные органические амины представляют собой N,N'-дибензилэтилендиамин,хлорпрокаин, холин, диэтаноламин, этилендиамин, N-метил-D-глюкамин и прокаин. Соли присоединения основания кислых соединений в соответствии с изобретением получают путем приведения в контакт свободной кислотной формы с достаточным количеством желаемого основания для получения соли традиционным способом. Свободная кислотная форма может быть регенерирована путем приведения в контакт солевой формы с кислотой и выделения свободной кислотной формы из-7 022299 вестным способом. Свободные кислотные формы в некоторой степени отличаются от своих соответствующих солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях; однако во всем остальном соли являются эквивалентными своим соответствующим свободным кислотным формам для целей настоящего изобретения. Если соединение в соответствии с изобретением включает более чем одну группу, которая способна к образованию фармацевтически приемлемых солей этого типа, то изобретение также охватывает составные соли. Примеры типичных составных солевых форм включают, но не ограничиваясь только ими,битартрат, диацетат, дифумарат, димеглумин, дифосфат, динатрий и тригидрохлорид. В свете вышеописанного можно увидеть, что выражение "фармацевтически приемлемая соль" в контексте данного описания подразумевает активное соединение, которое включает соединение формулы I в форме одной из своей соли, особенно в том случае, если указанная солевая форма обеспечивает указанному активному соединению улучшенные фармакокинетические свойства по сравнению со свободной формой указанного активного соединения или любой другой солью указанного активного соединения, которые использовались ранее. Фармацевтически приемлемая солевая форма активного соединения может также изначально обеспечивать желаемое фармакокинетическое свойство указанному активному соединению, которым оно ранее не обладало, а также может даже положительно влиять на фармакодинамику указанного активного соединения в отношении его терапевтической активности в организме. Кроме того, изобретение относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически применимые производные и стереоизомеры, включая их смеси во всех соотношениях, и необязательно наполнители и/или вспомогательные вещества. Лекарственные препараты могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного соединения на дозированную единицу. Такая единица может включать, например, от 0,5 мг до 1 г, предпочтительно от 1 до 700 мг, более предпочтительно от 5 до 100 мг,соединения в соответствии с изобретением, в зависимости от состояния, подвергаемого лечению, способа введения, а также возраста, веса тела и состояния пациента, или фармацевтические композиции могут вводиться в виде дозированных единиц, которые содержат заранее установленное количество активного соединения на дозированную единицу. Предпочтительными дозированными единицами лекарственных препаратов являются те, которые содержат суточную дозу или часть суточной дозы, как указано выше,или соответствующую порцию их активного соединения. Лекарственные средства этого типа также могут быть получены способом, который хорошо известен в области фармацевтики. Лекарственные препараты могут адаптироваться для введения при помощи любого подходящего способа, например, путем перорального (включая буккальное или подъязычное), ректального, назального, местного (включая буккальное, подъязычное или трансдермальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное или внутрикожное) введения. Такие препараты могут быть приготовлены с помощью любого способа, известного в области фармацевтики, например путем объединения активного соединения с наполнителем(ями) или вспомогательным(ыми) веществом(ами). Лекарственные препараты, адаптированные для перорального введения, могут вводиться в виде отдельных единиц, таких как, например, капсулы или таблетки; порошков или гранул; растворов или суспензий в водных или неводных жидкостях; пищевых пен или пенистых пищевых продуктов; или жидких эмульсий масло-в-воде или жидких эмульсий вода-в-масле. Таким образом, например, в случае перорального введения в виде таблетки или капсулы активный компонент может быть объединен с пероральным, нетоксичным и фармацевтически приемлемым инертным наполнителем, таким как, например, этанол, глицерин, вода и т.п. Порошки получают путем измельчения соединения до подходящего небольшого размера и смешивания его с фармацевтическим наполнителем, измельченным аналогичным способом, таким как, например, пищевой углеводород, такой как, например, крахмал или маннит. Также можно добавлять ароматизатор, консервант, диспергирующее вещество и краситель. Капсулы получают путем приготовления порошковой смеси, как описано выше, и заполнения ею желатиновых капсул определенной формы. Перед заполнением капсул к порошковой смеси можно добавлять скользящие и смазывающие вещества, такие как, например, высокодисперсная кремниевая кислота, тальк, стеарат магния, стеарат кальция или полиэтиленгликоль в твердой форме. Для улучшения доступности лекарственного средства, заключенного в капсулу, также можно добавлять дезинтегрирующее вещество или солюбилизатор, такой как, например, агар-агар, карбонат кальция или карбонат натрия. Дополнительно, при желании или необходимости, в смесь также можно добавлять подходящие связующие, смазывающие вещества, дезинтеграторы, а также красители. Подходящими связующими являются крахмал, желатин, природные сахара, такие как, например, глюкоза или бета-лактоза, подсластители, приготовленные из кукурузы, природных и синтетических резин, такие как, например, аравийская камедь, трагакантовая камедь или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воски и т.п. Смазывающие вещества, которые могут применяться в таких дозированных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и т.п. Дезинтеграторы включают, но не ограничиваясь только ими, крахмал, метилцеллюлозу, агар, бентонит, ксантановую камедь и т.п. Лекарственные средства в виде таблеток получают, например, путем приготовления порошковой смеси, гранулирования или сухого прессования смеси, добавления смазывающего вещества и дезинтегратора и прессования полученной смеси в таблетки. Порошковую смесь готовят путем смешивания соединения, измельченного подходящим образом, с разбавителем или основанием, как описано выше, и необязательно со связующим, таким как, например, карбоксиметилцеллюлоза, альгинат,желатин или поливинилпирролидон, замедлителем растворения, таким как, например, парафин, усилителем поглощения, таким как, например, четвертичная соль, и/или абсорбентом, таким как, например, бентонит, каолин или дикальцийфосфат. Порошковую смесь можно гранулировать путем смачивания связующим, таким как, например, сироп, крахмальная паста, слизь акации или растворы целлюлозы или полимерных веществ и прессования ее через сито. В качестве альтернативы грануляции порошковую смесь можно пропускать через таблетировочную машину, получая куски неправильной формы, которые распадаются, образуя гранулы. Гранулы можно замасливать путем добавления стеариновой кислоты,стеарата, талька или минерального масла для предотвращения слипания в таблетировочной литейной форме. После этого смазанную смесь спрессовывают, получая таблетки. Соединения в соответствии с изобретением также можно объединять с сыпучим инертным наполнителем и затем подвергать прямому прессованию, получая таблетки без осуществления стадий грануляции или сухого прессования. Таблетки также можно покрывать прозрачным или светонепроницаемым защитным слоем, состоящим из шеллакового запечатывающего слоя, слоя сахара или полимерного вещества и глянцевого слоя воска. К этим покрытиям также можно добавлять красители для возможности различения между разными дозируемыми единицами. Жидкости для перорального введения, такие как, например, раствор, сиропы и эликсиры, могут быть приготовлены в виде дозируемых единиц таким образом, чтобы они содержали заранее установленное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящим ароматизатором, тогда как эликсиры готовят с применением нетоксичной спиртовой среды. Суспензии могут быть приготовлены путем диспергирования соединения в нетоксичной среде. Также можно добавлять солюбилизаторы и эмульсификаторы, такие как, например, этоксилированные изостеариловые спирты и полиоксиэтиленовые эфиры сорбита, консерванты, ароматические добавки, такие как, например, масло мяты перечной, или натуральные заменители сахара или сахарин, или другие искусственные заменители сахара и т.п. Лекарственные препараты для перорального введения в виде дозированных единиц могут быть инкапсулированы в микрокапсулы, если это является желательным. Также лекарственный препарат может быть приготовлен таким образом, чтобы пролонгировать или замедлить высвобождение, например, путем применения покрытий или заделывания требуемого вещества в полимеры, воск и т.п. Соединения формулы I и их соли также могут вводиться в виде липосомных систем доставки, таких как, например, небольшие однослойные пузырьки, большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть образованы с помощью различных фосфолипидов, таких как, например,холестерин, стеариламин или фосфатидилхолины. Соединения формулы I и их соли также могут доставляться с помощью моноклональных антител в качестве индивидуальных носителей, к которым присоединены молекулы соединения. Соединения также могут быть соединены с растворимыми полимерами в качестве нацеливающих носителей лекарственных средств. Такими полимерами могут являться поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламидофенол, полигидроксиэтиласпартамидофенол или полиэтиленоксид-полилизин,замещенный пальмитоиловыми радикалами. Кроме того, соединения можно связывать с биоразлагаемыми полимерами, которые пригодны для обеспечения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, поли-эпсилон-капролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидроксипиранами, полицианоакрилатами и перекрестно сшитыми или амфипатическими блок-сополимерами гидрогелей. Лекарственные препараты, адаптированные для трансдермального введения, могут вводиться в виде независимых пластырей для длительного, тесного контакта с эпидермисом реципиента. Таким образом, например, активное соединение может доставляться из пластыря путем ионофореза, как в общем описано в Pharmaceutical Research, 3(6), 318 (1986). Фармацевтические композиции, адаптированные для местного введения, могут быть приготовлены в виде мазей, кремов, суспензий, лосьонов, порошков, растворов, паст, гелей, спреев, аэрозолей или масел. Для лечения глаз или других наружных тканей, например рта и кожи, предпочтительно применяются лекарственные препараты в виде местной мази или крема. Для приготовления лекарственного препарата в виде мази активное соединение может применяться с парафиновым или смешивающимся с водой мазевым основанием. Альтернативно, для получения крема активное соединение может быть приготовлено с основой для крема типа масло-в-воде или основой вода-в-масле. Лекарственные препараты, адаптированные для местного введения в глаза, включают глазные кап-9 022299 ли, в которых активное соединение растворено или суспендировано в подходящем носителе, предпочтительно в водном растворителе. Лекарственные препараты, адаптированные для местного введения в полость рта, включают лепешки, пастилки и жидкости для полоскания рта. Лекарственные препараты, адаптированные для ректального введения, могут вводиться в виде суппозиториев или клизм. Лекарственные препараты, адаптированные для интраназального введения, в которых носитель представляет собой твердое вещество, включают крупный порошок, имеющий размер частичек, например, в интервале 20-500 мкм, который вводится путем вдыхания, т.е. путем быстрого вдоха через нос из контейнера, содержащего порошок, который придерживают возле носа. Подходящие лекарственные препараты для введения в виде интраназального аэрозоля или носовых капель с жидкостью в качестве носителя включают растворы активного вещества в воде или в масле. Лекарственные препараты, адаптированные для введения путем ингаляции, включают тонкоизмельченные частички в виде пыли или тумана, которые могут быть получены с помощью различных диспергирующих устройств под давлением с аэрозолями, распылителями или инсуффляторами. Лекарственные препараты, адаптированные для вагинального введения, могут вводиться в виде пессариев, тампонов, кремов, гелей, паст, пен или аэрозолей. Лекарственные препараты, адаптированные для парентерального введения, включают водные или неводные стерильные растворы для инъекций, содержащие антиоксиданты, буферы, бактериостатические вещества и растворенные вещества, с помощью которых лекарственное средство поддерживается изотоническим по отношению к крови реципиента, подвергаемого лечению; и водные или неводные стерильные суспензии, которые могут содержать суспензионную среду и загустители. Лекарственные препараты могут вводиться с помощью емкостей для однократного или многократного введения, например запечатанных ампул и флаконов, и храниться в лиофилизированном состоянии, при этом непосредственно перед введением необходимо только добавить стерильную жидкость-носитель, например воду для инъекций. Растворы и суспензии для инъекций, приготовленные согласно рецептуре, могут быть приготовлены из стерильных порошков, гранул и таблеток. Также является очевидным, что дополнительно к предпочтительным вышеописанным составляющим, лекарственные препараты также могут содержать другие вещества, которые используются в данной области для конкретных типов лекарственных средств; например, лекарственные препараты, пригодные для перорального введения, могут содержать ароматизаторы. Терапевтически эффективное количество соединения формулы I зависит от многих факторов,включая, например, возраст и вес животного, определенное состояние, которое требует лечения, и его тяжесть, природу лекарственного средства и способ введения, и в конечном счете оно может быть определено лечащим врачом или ветеринаром. Однако эффективное количество соединения в соответствии с изобретением для лечения неопластического роста, например карциномы ободочной кишки или молочной железы, как правило, находится в интервале от 0,1 до 100 мг/кг веса тела реципиента (млекопитающего) в сутки и предпочтительно обычно находится в интервале от 1 до 10 мг/кг веса тела в сутки. Следовательно, действующее суточное количество для взрослого млекопитающего весом 70 кг обычно может составлять от 70 до 700 мг, где количество может вводиться в виде однократной дозы в день или обычно в виде ряда частичных доз (таких как, например, в виде двух, трех, четырех, пяти или шести) в день, таким образом, что общая суточная доза является аналогичной. Эффективное количество его соли может быть определено в виде доли эффективного количества соединения в соответствии с изобретением per se. Также предполагается, что подобные дозы пригодны для лечения других состояний,указанных в настоящем описании. Изобретение, кроме того, относится к лекарственным средствам, содержащим по меньшей мере одно соединение формулы I и/или его фармацевтически применимые соли и стереоизомеры, включая их смеси во всех соотношениях, и по меньшей мере одно дополнительное активное соединение лекарственного средства. Изобретение относится к применению соединения формулы I по пп.1, 2 и их фармацевтически применимых солей и стереоизомеров, включая их смеси во всех соотношениях для лечения опухолей, метастазов опухолей, пролиферативных заболеваний мезангиальных клеток, гемангиомы, пролиферативной ретинопатии, ревматоидного артрита, атеросклеротической неоваскуляризации, псориаза, неоваскуляризации глаза, остеопороза, диабета и ожирения, лимфоидного лейкоза, лимфомы, малярии и гипертрофии предстательной железы. Применение Соединения согласно настоящему изобретению пригодны в качестве фармацевтически активных соединений для млекопитающих, в особенности для людей, для лечения и контроля заболеваний. Эти заболевания включают пролиферацию опухолевых клеток, патологическую неоваскуляризацию (или ангиогенез), которая способствует росту солидных опухолей, неоваскуляризацию глаза (диабетическую ретинопатию, дегенерацию желтого пятна, связанную со старением, и т.п.), воспаление (псориаз, ревматоидный артрит и т.п.) и пролиферативные заболевания мезангиальных клеток. Настоящее изобретение охватывает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предотвращения развития опухолей, опухолевых заболеваний и/или метастазов опухолей. Опухолевое заболевание предпочтительно выбирают из группы, включающей опухоль плоского эпителия, мочевого пузыря, желудка, почек, головы и шеи, пищевода, шейки матки, щитовидной железы,кишечника, печени, головного мозга, предстательной железы, мочеполового тракта, лимфатической системы, желудка, гортани, легкого, кожи, моноцитарный лейкоз, аденокарциному легкого, мелкоклеточную карциному легкого, рак поджелудочной железы, глиобластому, карциному молочной железы, острый миелобластный лейкоз, хронический миелобластный лейкоз, острый лимфолейкоз, хронический лимфолейкоз, ходжскинскую лимфому, неходжскинскую лимфому. Также охватывается применение соединений по п.1 в соответствии с изобретением и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения остеопороза, диабета и ожирения. Также охватывается применение соединений по п.1 в соответствии с изобретением и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предотвращения заболевания, в которое вовлечен ангиогенез. Заболевание этого типа, в которое вовлечен ангиогенез, представляет собой заболевание глаз, такое как васкуляризация сетчатки, диабетическая ретинопатия, дегенерация желтого пятна, связанная со старением, и т.п. Ангиогенное заболевание предпочтительно выбирают из группы, включающей диабетическую ретинопатию, артрит, рак, псориаз, саркому Капоши, гемангиому, миокардиальный ангиогенез, неоваскуляризацию атеросклеротических бляшек, ангиогенные заболевания глаз, хороидальную неоваскуляризацию, ретролентальную фиброплазию, дегенерацию желтого пятна, отторжение трансплантированной роговицы, покраснение радужной оболочки, нейроглазную глаукому, синдром Остера-Веббера. Пролиферативное заболевание мезангиальных клеток предпочтительно выбирают из группы, включающей гломерулонефрит, диабетическую нефропатию, злокачественный нефросклероз, синдром тромботической микроангиопатии, отторжение трансплантата, гломерулопатию. Применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предотвращения воспалительных заболеваний также входит в объем настоящего изобретения. Примеры таких воспалительных заболеваний включают ревматоидный артрит, псориаз, контактный дерматит, отсроченную реакцию гиперчувствительности и т.п. Воспалительные заболевания предпочтительно выбирают из группы, включающей воспалительное заболевание кишечника, артрит, атеросклероз, астму, аллергии, воспалительное заболевание почек, рассеянный склероз, хроническое обструктивное заболевание легких, воспалительные заболевания кожи,заболевания пародонта, псориаз, иммунное заболевание, стимулируемое Т-клетками. Воспалительное заболевание кишечника предпочтительно выбирают из группы, включающей язвенный колит, болезнь Крона, неспецифический колит. Иммунное заболевание, стимулируемое Т-клетками, предпочтительно выбирают из группы, включающей аллергический энцефаломиелит, аллергический неврит, отторжение трансплантата, реакцию"трансплантат против хозяина", миокардит, тиреоидит, нефрит, системную красную волчанку, инсулинозависимый сахарный диабет. Заболевание из группы артрита предпочтительно выбирают из ревматоидного артрита, остеоартрита, синдрома Каплана, синдрома Фелти, синдрома Шегрена, анкилозирующего спондилита, болезни Стилла, хондрокальциноза, метаболического артрита, ревматической атаки, болезни Рейтера, синдрома Уисслера. Воспалительное заболевание почек предпочтительно выбирают из группы, включающей гломерулонефрит, поражение клубочков, нефротический синдром, интерстициальный нефрит, волчаночный нефрит, синдром Гудпасчера, гранулематоз Вегенера, почечный васкулит, IgA нефропатию, идиопатическую клубочковую болезнь. Воспалительное заболевание кожи предпочтительно выбирают из группы, включающей псориаз,атопический дерматит, контактную чувствительность, акне. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей приготовления лекарственного средства для лечения или предотвращения заболевания или состояния у млекопитающего, в котором, следуя указанному методу, терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему, нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и может быть определено специалистом в данной области техники без чрезмерных усилий. Настоящее изобретение также охватывает применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения или предотвращения ретинальной васкуляризации. Также охватывается применение соединений формулы I и/или их физиологически приемлемых солей для приготовления лекарственного средства для лечения и/или борьбы с индуцированным опухолью заболеванием у млекопитающего, в котором, следуя указанному методу, терапевтически эффективное количество соединения в соответствии с изобретением вводят больному млекопитающему, нуждающемуся в таком лечении. Терапевтическое количество изменяется в зависимости от конкретного заболевания и может быть определено специалистом в данной области техники без чрезмерных усилий. Раскрытые соединения формулы I могут вводиться в комбинации с другими терапевтическими средствами, включая противораковые агенты. Как используется в настоящем изобретении, термин "противораковый агент" относится к любому средству, которое вводят пациенту, страдающему раком, с целью лечения рака. Соединения формулы I также могут вводиться вместе с другими хорошо известными терапевтическими средствами, которые выбирают ввиду их особой пригодности для состояния, подлежащего лечению. Соединения согласно настоящему изобретению также пригодны для комбинации с известными противораковыми агентами. Эти известные противораковые агенты включают следующие: модуляторы эстрогенового рецептора, модуляторы андрогенового рецептора, модуляторы ретиноидного рецептора,цитотоксические агенты, антипролиферативные агенты, ингибиторы пренил-протеин-трансферазы, ингибиторы HMG-CoA редуктазы, ингибиторы ВИЧ протеазы, ингибиторы обратной транскриптазы и другие ингибиторы ангиогенеза. Соединения согласно настоящему изобретению особенно пригодны для введения одновременно с радиотерапией. Выражение "модуляторы эстрогенового рецептора" относится к соединениям, которые препятствуют или ингибируют связывание эстрогена с рецептором, независимо от механизма. Примеры модуляторов эстрогенового рецептора включают, но не ограничиваются только ими, тамоксифен, ралоксифен, идоксифен, LY353381, LY117081, торемифен, фулвестрант,4-[7-(2,2-диметил-1-оксопропокси-4-метил-2)-[4-[2-(1-пиперидинил)этокси]фенил]-2 Н-1-бензопиран-3 ил]фенил 2,2-диметилпропаноат, 4,4'-дигидроксибензофенон-2,4-динитрофенилгидразон и SH646. Выражение "модуляторы андрогенового рецептора" относится к соединениям, которые препятствуют или ингибируют связывание андрогенов с рецептором, независимо от механизма. Примеры модуляторов андрогенового рецептора включают финастерид и другие ингибиторы 5-редуктазы, нилутамид,флутамид, бикалутамид, лиарозол и абиратерон ацетат. Выражение "модуляторы ретиноидного рецептора" относится к соединениям, которые препятствуют или ингибируют связывание ретиноидов с рецептором, независимо от механизма. Примеры таких модуляторов ретиноидного рецептора включают бексаротен, третиноин, 13-цис-ретиноевую кислоту,9-цис-ретиноевую кислоту, -дифторметилорнитин, ILX23-7553, транс-N-(4'-гидроксифенил)ретинамид и N-4-карбоксифенилретинамид. Выражение "цитотоксические агенты" относится к соединениям, которые приводят к смерти клетки главным образом путем прямого действия на функционирование клетки или ингибируют или препятствуют миозису клетки, включая алкилирующие агенты, факторы некроза опухоли, интеркалирующие агенты, ингибиторы микротубулина и ингибиторы топоизомеразы. Примеры цитотоксических агентов включают, но не ограничиваясь только ими, тирапазимин, сертенеф, кахектин, ифосфамид, тазонермин, лонидамин, карбоплатин, алтретамин, преднимустин, дибромдулцитол, ранимустин, фотемустин, недаплатин, оксалиплатин, темозоломид, гептаплатин, эстрамустин,импросульфан тозилат, трофосфамид, нимустин, диброспидиум хлорид, пумитепа, лобаплатин, сатраплатин,профиромицин,цисплатин,ирофулвен,дексифосфамид,цис-аминдихлор(2 метилпиридин)платину, бензилгуанин, глуфосфамид, GPX100, (транс,транс,транс)-бис-мю-(гексан-1,6 диамин)му-[диаминплатина(II)]-бис-[диамин(хлор)платина(II)]тетрахлорид, диаризидинилспермин, триоксид мышьяка, 1-(11-додециламино-10-гидроксиундецил)-3,7-диметилксантин, зорубицин, идарубицин,даунорубицин, бисантрен, митоксантрон, пирарубицин, пинафид, валрубицин, амрубицин, антинеопластон, 3'-деамино-3'-морфолино-13-деоксо-10-гидроксикарминомицин, аннамицин, галарубицин, элинафид,MEN10755 и 4-деметокси-3-деамино-3-азиридинил-4-метилсульфонилдаунорубицин(см. WO 00/50032). Примеры ингибиторов микротрубулина включают паклитаксел, виндезин сульфат, 3',4'-дидегидро 4'-деокси-8'-норвинкалеукобластин, доцетаксол, ризоксин, доластатин, мивобулин изетионат, ауристатин, цемадотин, RPR109881, BMS184476, винфлунин, криптофицин, 2,3,4,5,6-пентафтор-N-(3-фтор-4 метоксифенил)бензолсульфонамид,ангидровинбластин,N,N-диметил-L-валил-L-валил-N-метил-Lвалил-L-пролил-1-пролин-трет-бутиламид, TDX258 и BMS188797. Ингибиторами топоизомеразы являются, например, топотекан, гикаптамин, иринотекан, рубитекан,6-этоксипропионил-3',4'-О-эксобензилиденчартреузин, 9-метокси-N,N-диметил-5-нитропиразоло[3,4,5kl]акридин-2-(6 Н)пропанамин,1-амино-9-этил-5-фтор-2,3-дигидро-9-гидрокси-4-метил-1H,12 Н- 12022299"Антипролиферативные агенты" включают антисмысловые РНК и ДНК олигонуклеотиды, такие как G3139, ODN698, RVASKRAS, GEM231 и INX3001 и антиметаболиты, такие как, например, эноцитабин, кармофур, тегафур, пентостатин, доксифлуридин, триметрексат, флударабин, капецитабин, галоцитабин, цитарабин окфосфат, гидрат фостеабина натрия, ралтитрексед, палтитрексид, эмитефур, тиазофурин, децитабин, нолатрексед, пеметрексед, нелзарабин, 2'-деокси-2'-метилиденцитидин, 2'-фторметилен 2'-деоксицитидин,N-[5-(2,3-дигидробензофурил)сульфонил]-N'-(3,4-дихлорфенил)мочевина,N6-[4-деокси-4-[N2-[2(Е),4(Е)-тетрадекадиеноил]глициламино]-L-глицеро-В-L-манногептопиранозил]аденин,аплидин,эктеинасцидин,троксацитабин,4-[2-амино-4-оксо-4,6,7,8-тетрагидро-3 Нпиримидино[5,4-b]-1,4-тиазин-6-ил-(S)-этил]-2,5-тиеноил-L-глутаминовая кислота,аминоптерин,5-фторурацил, аланозин, сложный эфир 11-ацетил-8-(карбамоилоксиметил)-4-формил-6-метокси-14 окса-1,11-диазатетрацикло(7.4.1.0.0)тетрадека-2,4,6-триен-9-илуксусной кислоты, свайнсонин, лометрексол, дексразоксан, метиониназа, 2'-циано-2'-деокси-N4-палмитоил-1-В-D-арабинофуранозил цитозин и 3-аминопиридин-2-карбоксальдегид тиосемикарбазон."Антипролиферативные агенты" также включают моноклональные антитела к факторам роста, отличающиеся от тех, которые перечислены для "ингибиторов ангиогенеза", такие как трастузумаб, и подавляющие опухоли гены, такие как р 53, которые могут быть доставлены с помощью переноса генов,опосредованного рекомбинантным вирусом (см., например, патент США 6069134). Доказательство действия фармакологических ингибиторов на пролиферацию/жизнеспособность опухолевых клеток в условиях in vitro. 1. Предпосылки. В описании настоящего опыта описано ингибирование активными соединениями пролиферации опухолевых клеток/жизнеспособности опухолевых клеток. Клетки высевают при пригодной плотности клеток в микротитровальные планшеты (96-луночный формат) и добавляют тестируемые вещества в виде серийных концентраций. После культивирования в течение четырех последующих дней в среде, содержащей сыворотку, пролиферация опухолевых клеток/жизнеспособность опухолевых клеток может быть определена с помощью тест-системы Alamar Blue. 2. Экспериментальная методика. 2.1. Культура клеток. Например, коммерчески доступные линии клеток карциномы ободочной кишки, линии клеток яичника, линии клеток предстательной железы или линии клеток молочной железы и т.п. Клетки культивируют в среде. При интервалах в несколько дней клетки отсоединяют от чашек для культивирования с помощью раствора трипсина и высевают при подходящем разведении в свежую среду. Клетки культивируют при 37 и 10% СО 2. 2.2. Высевание клеток. Определенное количество клеток (например, 2000 клеток) на культуру/лунку в объеме 180 мкл культуральной среды высевают в микротитровальные планшеты (культуральные планшеты на 96 лунок),используя многоканальную пипетку. После этого клетки культивируют в СО 2 термостате (37 С и 10% СО 2). 2.3. Добавление тестируемых веществ. Тестируемые вещества растворяют, например, в ДМСО и после этого используют в соответствующей концентрации (если это является желательным, в серийных разведениях) в среде для культивирования клеток. Стадии разведения могут адаптироваться в зависимости от эффективности активных соединений и желательного диапазона концентрации. К тестируемым веществам добавляют среду для культивирования клеток в соответствующих концентрациях. Добавление тестируемых веществ к клеткам можно осуществлять в день высевания клеток. Для этого в каждом случае 20 мкл раствора вещества из планшета с предварительным разведением добавляют к культурам/лункам. Клетки культивируют дополнительно в течение 4 дней при 37 С и 10% СО 2. 2.4. Измерение параметров цветной реакции. В каждом случае добавляют 20 мкл реагента Alamar Blue на лунку и микротитровальные планшеты инкубируют, например, дополнительно в течение 7 ч в СО 2 термостате (при 37 С и 10% СО 2). Планшеты анализируют на планшет-ридере с флуоресцентным фильтром при длине волны 540 нм. Планшеты мож- 13022299 но осторожно встряхивать непосредственно перед измерением. 3. Оценка. Значение абсорбции контрольной среды (без использования клеток и тестируемых веществ) вычитают из всех других значений абсорбции. Контроли (клетки без тестируемого вещества) устанавливают равными 100% и все другие значения абсорбции представляют относительно этих значений (например, в Значения IC50 (50% ингибирование) определяют с помощью статистических программ, таких как,например, RS1. IC50 данные для соединений в соответствии с изобретением представлены в табл. 1. Таблица 1 Определение ингибирования пролиферации ингибиторами метионинаминопептидазы 2 в BrdU тесте на пролиферацию (клеточный анализ). Ингибирование пролиферации определяют путем включения бромдезоксиуридина (BrdU) в эндотелиальные клетки пупочной вены человека (HUVEC, PromoCell, C-12200). HUVEC культивируют при 37 С и 5% СО 2 в минимальной среде (PromoCell, C-22200) с дополнительной смесью (PromoCell,C-39225). После отсоединения клеток при помощи трипсина/EDTA определяют число живых клеток и клетки высевают с плотностью 1000 клеток/лунку в общем объеме 175 мкл (лунки покрывают заранее либо дополненной культуральной средой в течение 1-2 ч при 37 С, либо 1,5% желатином в течение 0,5-2 ч при 37 С). После культивирования в течение 24 ч добавляют тестируемые вещества в различных концентрациях (например, в конечных концентрациях 30 мкМ-0,03 нМ, шагами с 10-кратным разбавлением) и объемом 25 мкл. ДМСО концентрацию поддерживают постоянной на уровне 0,3%. После культивирования в общей сложности в течение 48 или 72 ч добавляют 20 мкл бромдезоксиуридина (Roche,11647229001, разбавленный 1:1000 в культуральной среде, конечная концентрация 10 мкМ) и культивирование продолжают в течение дополнительных 20-24 ч. После инкубирования с тестируемыми веществами в общей сложности в течение 72 или 96 ч культуральную среду удаляют и осуществляют иммуногистохимическое определение для детектирования включения BrdU (BrdU ELISA, Roche,11647229001). С этой целью клетки обрабатывают в течение 30 мин при комнатной температуре фиксатором и потом инкубируют с меченным пероксидазой анти-BrdU антителом (разбавленным 1:100 в буфер для разведения антитела) в течение 60 мин при комнатной температуре. После трехкратного промывания DPBS буфером 1-кратной концентрации (Gibco,14200) ферментативную реакцию инициируют в ТМВ субстратном растворе. Нарастание окрашивания останавливают через 15 мин путем добавления 25 мкл 1 М раствора серной кислоты. Определение оптической плотности осуществляют в рамках 5 мин путем измерения при длине волны 450 нм. Используемые контроли представляют собой лунки, содержащие ДМСО-обработанные клетки (100% контроль), или пустые лунки (значение для холостой пробы). Чувствительность этого теста в отношении ингибиторов метионинаминопептидазы проверяют и подтверждают с использованием ингибитора - фумагиллина. Измерение активности MetAP-2. Активность MetAP-2 определяют с помощью сочетания ферментативных реакций. В качестве субстрата используют трипептид Met-Arg-Ser (MAS). Освобожденный метионин сперва превращается вMetox и Н 2 О 2 с помощью L-аминооксидазы (ААО). На второй стадии пероксидаза (POD) с помощью Н 2 О 2 катализирует окисление лейкокрасителя дианизидина до дианизидинаокс, увеличение содержания которого детектируют фотометрически при длине волны 450 нм. Активность MetAP-2 может быть зарегистрирована непрерывно в виде кинетики. Реакционная схема иллюстрирует, что 1 моль дианизидинаокс образуется на 1 моль метионина. Следовательно, активность фермента MetAP-2 может быть вычислена непосредственно в видеабсорбции на единицу времени. Классификация активности MetAP-2 (моль Met/единица времени) возможна с помощью коэффициента затухания дианизидинаокс. Изменение в затухании на единицу времени изображают графически и в визуально линейной области реакции осуществляют расчет наклона. Активности соединений обобщены в табл. 1. Измерение растворимости. Определение путем измерения растворимости во встряхиваемой колбе. Приготовление элюента: Примеры растворителя. Буфер: 3,954 г моногидрата дигидрофосфата натрия + 6,024 г хлорида натрия + 950 мл сверхчистой воды, рН устанавливают с использованием 0,1 М NaOH или 0,1 М HCl. Подготовка образцов. Образцы встряхивают при 37 С и 450 об/мин в течение 24 ч. Примерно через 7 ч значение рН образцов проверяют и регулируют при необходимости. Также проверяют, присутствует ли образец все еще в избытке. Незадолго до окончания времени встряхивания 24 ч вновь проверяют значение рН образцов и наличие осадка. Отделение сверхчистой воды: MilliQ gradient, Millipore, прибор: F3PN37462D. Встряхивающее устройство: TiMix контроль, Bhler. Инкубационный колпак: ТН 15 Bhler. рН метр: прибор 766 Calimatic Knick: pH 1. рН электрод: InLab 423 Mettler. ХИАД-МС (химическая ионизация при атмосферном давлении - масс-спектрометрия): (М+Н)+. Рацемические конечные продукты соединений в соответствии с изобретением или рацемические промежуточные соединения могут быть легко разделены как в аналитическом, так и в препаративном масштабе с помощью хиральной ЖХВР или СКЖХ колонки. ЯМР спектр снимают после добавления дейтерированной трифторуксусной кислоты. Методы. Условия анализа ЖХВР-МС. 1. Колонка: Acquity ВЕН С-18 (2,1100 мм, 1,7 мкм). 2. Подвижная фаза: А - 5 мМ ацетат аммония в воде, В - ацетонитрил. 3. Режим потока: градиентChromolite Performance RP18-e 100-4,6 мм. Градиент: смесь ацетонитрил/H2O, содержащая 0,01% муравьиной кислоты. Метод: Chromolith/Chromolith (удлиненная). Скорость потока: 3 мл/мин. Колонка: XBridge C8, 3,5 мкм, 4,650 мм. Растворитель А: вода + 0,1% ТФУ; растворитель В: ацетонитрил + 0,1% ТФУ. Скорость потока: 2 мл/мин. Градиент: 0 мин: 5% В, 8 мин: 100% В, 8,1 мин: 10%. Детектирование при 254 нм. Разделение энантиомеров. Разделение на Chiralcel OD-H с помощью смеси н-гептан/этанол = 70/30. Вещество растворяют в 10 мл смеси н-гептан/EtOH = 1/1 и разделяют посредством колонки 525 смChiralcel OD с 20 мкм материалом при скорости потока 100 мл/мин смеси н-гептан/этанол = 70/30. Выше и ниже все температуры указаны в С. В следующих примерах "обычная обработка" означает, что при необходимости добавляют воду, рН, при необходимости, устанавливают на значение между 2 и 10, в зависимости от строения конечного продукта, смесь экстрагируют этилацетатом или дихлорметан, фазы разделяют, органическую фазу сушат над сульфатом натрия и упаривают и продукт очищают с помощью хроматографии на силикагеле и/или путем кристаллизации. Т.пл.: температура плавления. Масс-спектрометрия (МС): ЭИ (ионизация электронным ударом) М+. ББА (бомбардировка быстрыми атомами) (М+Н)+. ЭРИ (электрораспылительная ионизация) (М+Н)+. ХИАД-МС (химическая ионизация при атмосферном давлении - масс-спектрометрия) (М+Н)+. Схемы синтеза для получения соединений формулы I. а) Путь 1: Кислоту превращают в соответствующий амид в реакции амидного сочетания и затем окисляют по углероду между двумя карбоксильными группами, используя третичный бутилгидропероксид в щелочной среде с получением спирта (с последующим разделением энантиомеров с помощью хроматографии).b) Путь 2: Альтернативно, было обнаружено, что при тех же окислительных условиях, как описано для пути 1 для амида, этиловый сложный эфир исходной кислоты не может быть окислен. Однако это становится возможным в присутствии хлорида церия. Производное хлора, полученное с 30% выходом,может быть разделено на энантиомеры аналогично спиртам и затем дериватизировано далее (дальнейшие реакции здесь не показаны, тем не менее, продуктами являются далее, например, "А 39", "А 43" иc) Однако применение фторида церия не дает аналогичные производные фтора. Реакция соединения спирта с DAST (трифторид диэтиламиносеры) в дихлорметане приводит к требуемому фторсодержащему аналогу. Исследование подтверждает инверсию на центре асимметрии, которая ожидается из соображений, относящихся к механизму реакции фторирования спиртов с использованием DAST. На схеме d) показано, каким образом могут быть получены N-ариллактамкарбоновые кислоты. Этот путь синтеза может быть легко осуществлен, если азотсодержащее соединение представляет собой жидкость. Было обнаружено, что совместное плавление исходных веществ, если азотсодержащее арильное соединение не представляет собой жидкость, не имеет преимущества. Однако целевой продукт получается в случае, если азотсодержащее арильное соединение расплавляют и сложный эфир дикарбоновой кислоты (кислоты Мельдрума) добавляют к этому расплаву. Схема е) показывает путь получения N-алкариллактамкарбоновой кислоты. Схема f) показывает еще один альтернативный путь, который осуществляют с целью обеспечить арильные радикалы на азотсодержащем лактаме, в котором аналогичное азотсодержащее соединение не является жидкостью. В данном случае азотсодержащий лактам сочетают с арилгалогенидом, причем эта стадия предпочтительно катализируется соединениями переходных металлов. 200 мг 1-фенил-2-оксо-3-пирролидинкарбоновой кислоты,155 мг гидрохлорида 2-тиофенэтиламина, 550 мг гидрохлорида N-(3-диметиламинопироил)-N'-этилкарбодиимида, 190 мг гидроксибензотриазола, 132 мкл триэтиламина и 5 мл ДМФА объединяют в микроволновом сосуде. После того как сосуд закупоривают с использованием перегородки, смесь нагревают при помощи микроволнового излучения (Emrys Optimiser, Personal Chemistry) (160 С, 5 мин). К партии добавляют воду. Образуется осадок. Воду добавляют до тех пор, пока не прекратится дальнейшее образование осадка. Осадок отфильтровывают с отсасыванием и сушат. Выход: 239 мг. Внешний вид: белое твердое вещество. Чистота: 100% (220 нм, УФ-след ЖХ-МС). ЖХ-МС: 315 (М+Н). ЖХВР: 3,03 (В.у./мин). ЖХВР метод: 11002 (прибор: LaChrom). Колонка: Chromolith Performance RP18e 100-3 мм. Скорость потока: 2 мл/мин (помпа: L-7100). Растворитель А: вода + 0,05% HCOOH. Растворитель В: ацетонитрил + 0,04% HCOOH. Длина волны: 220 нм (детектор: L-7455). Градиент: 0-0,2 мин: 99% А, 0,2-3,8 мин: 99% А - 100% В, 3,8-4,4 мин: 100% В, 4,4-4,5 мин: 100% В - 99% А, 4,5-5,1 мин: 99% А. ЖХ-МС метод: (прибор: Agilent 1100 серии). Колонка: Chromolith Speed Rod RP18e-50-4,6. Скорость потока: 2,4 мл/мин. Растворитель А: вода + 0,05% HCOOH. Растворитель В: ацетонитрил + 0,04% HCOOH. Длина волны: 220 нм. Градиент: 0-2,8 мин: 4% В - 100% В, 2,8-3,3 мин: 100% В. 100 мг амида, полученного в соответствии с а), растворяют в 10 мл трет-бутанола и добавляют 60 мг трет-бутилгидропероксида (70% в воде) и 0,2 мл этилата натрия (20% в этаноле). Смесь затем перемешивают при 90 С течение 4 ч. Партию упаривают практически досуха. К остатку добавляют воду и ЭА (этилацетат) и смесь экстрагируют при встряхивании. Органическую фазу сушат над Na2SO4, фильтруют с отсасыванием и упаривают досуха в вакууме с получением 80 мг продукта. Остаток растворяют в ДМСО и очищают с помощью препаративной ЖХВР. Фракции, содержащие продукт, объединяют и упаривают досуха в вакууме с получением 57 мг (54%) "А 65". Внешний вид: белое твердое вещество. Чистота: 100% (220 нм, УФ-след ЖХ-МС). ЖХ-МС: 331 (М+Н). ЖХВР: 2,88 (В.у./мин). ЖХВР метод: 11002 (прибор: LaChrom). Колонка: Chromolith Performance RP18e 100-3 мм. Скорость потока: 2 мл/мин (помпа: L-7100). Растворитель А: вода + 0,05% HCOOH. Растворитель В: ацетонитрил + 0,04% HCOOH. Длина волны: 220 нм (детектор: L-7455). Градиент: 0-0,2 мин: 99% А, 0,2-3,8 мин: 99% А - 100% В, 3,8-4,4 мин: 100% В, 4,4-4,5 мин: 100% В - 99% А, 4,5-5,1 мин: 99% А. ЖХ-МС метод: (прибор: Agilent 1100 серии). Колонка: Chromolith Speed Rod RP18e-50-4,6. Скорость потока: 2,4 мл/мин. Растворитель А: вода + 0,05% HCOOH. Растворитель В: ацетонитрил + 0,04% HCOOH. Длина волны: 220 нм. Градиент: 0-2,8 мин: 4% В - 100% В, 2,8-3,3 мин: 100% В. Метод преп. ЖХВР: 15351050 млempfindoequi.M (прибор: Agilent 1100 серии). Колонка: Chromolith Prep Rod RP18e. Скорость потока: 50 мл/мин. Растворитель А: ацетонитрил + 0,1% ТФУ. Растворитель В: вода + 0,1% ТФУ. Длина волны: 220 нм. Градиент: 1-15% ACN за 2 мин, 15-35% ACN за 8 мин, сбор с 2 до 11 мин. Разделение рацемата на энантиомеры. Аналитическое разделение на Chiralcel OD-H с помощью смеси н-гептан/этанол = 70:30. 40 мг рацемата растворяют в 10 мл смеси н-гептан/EtOH = 1:1 и разделяют с помощью 525 см колонки Chiralcel OD с 20 мкм веществом при скорости потока 100 мл/мин смеси н-гептан/этанол = 70:30. Собирали и упаривали 2 фракции. Фракция 1: m=20 мг энантиомера 1: энантиомерно чистый. Фракция 2: m=20 мг энантиомера 2: соотношение энантиомеров: 0,6% энантиомера 1:99,4% энантиомера 2. Пример 2. Получение 3-гидрокси-2-оксо-1-фенилпирролидин-3-карбоновой кислоты [промежуточное соединение для схемы синтеза b); путь 2]. Тионилхлорид (5,8 г) добавляют по каплям при 0 С к раствору 2-оксо-1-фенилпирролидин-3 карбоновой кислоты (5 г) в 5 мл этанола и смесь перемешивают при 80 С в течение 4 ч. После завершения реакции растворитель удаляют в вакууме и остаток распределяют между водой и этилацетатом. Органическую фазу промывают насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия и сушат над сульфатом натрия. Удаление растворителя и высушивающего вещества дает этил 2-оксо-1-фенилпирролидин-3-карбоксилат, который является достаточно чистым для дальнейших реакций. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 7,82-7,81 (t, J=2 Гц, 1H), 7,56-7,54 (m, 1 Н), 7,43-7,39 (t,J=8 Гц, 1 Н), 7,24-7,21 (m, 1 Н), 4,17-4,12 (m, 2 Н), 3,92-3,73 (m, 3 Н), 2,39-2,27 (m, 2 Н), 1,22-1,14 (t, J=7 Гц,3 Н). ЖХМС: масса, найдено (М+1, 234). Метод: А - 0,1% ТФУ в Н 2 О, В - 0,1% ТФУ в ацетонитриле: скорость потока - 2,0 мл/мин. Колонка: X Bridge C8 (504,6 мм, 3,5 мкм) "+" методика. Гептагидрат хлорида церия (1,59 г) добавляют к раствору этил 2-оксо-1-фенилпирролидин-3 карбоксилата (5 г) в 10 мл изопропанола и пропускают газообразный О 2 в течение 15 мин, смесь затем оставляют перемешиваться в течение 14 ч. Все летучие компоненты затем удаляют в вакууме и партию очищают с помощью хроматографии. Полученный этил 3-гидрокси-2-оксо-1-фенилпирролидин-3-карбоксилат анализируют с помощью хиральной ЖХВР и последствии разделяют на энантиомеры.R-энантиомер элюируется по истечении Rt (мин) 8,197.S-энантиомер элюируется по истечении Rt (мин) 11,240.LiOH/H2O (750 мг) добавляют к раствору этил (S)-3-гидрокси-2-оксо-1-фенилпирролидин-3 карбоксилата (1,5 г) в ТГФ/Н 2 О = 3:1 и смесь перемешивают в течение 4 ч. Растворитель затем удаляют в вакууме и партию подкисляют с использованием 1,5 н. HCl. Водную фазу экстрагируют этилацетатом и объединенные органические фазы сушат над сульфатом натрия с получением (S)-3-гидрокси-2-оксо-1-фенилпирролидин-3-карбоновой кислоты. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 7,68-7,65 (m, 2 Н), 7,42-7,37 (m, 2 Н), 7,20-7,15 (m, 1 Н), 6,53 (s,1 Н), 3,87-3,81 (m, 2 Н), 2,56-2,51 (m, 1 Н), 2,13-2,07 (m, 1 Н). ЖХМС: масса, найдено (М+1, 222). Метод: А - 0,1% ТФУ в Н 2 О, В - 0,1% ТФУ в ацетонитриле: скорость потока - 2,0 мл/мин. Колонка: X Bridge C8 (504,6 мм, 3,5 мкм) "+" методика.EDCI (3 экв.) и НОВТ (1,5 экв.) добавляют к раствору полученной выше кислоты (1 экв.) и амина(1,2 экв.) в сухом ДМФА (3 мл/ммоль) и смесь нагревают в микроволновой печи при 160 С в течение 20 мин. После завершения реакции растворитель удаляют в вакууме и очищают с помощью хроматографии.(S)-1-(3-хлорфенил)-3-гидрокси-2-оксопирролидин-3 3-Хлоранилин (10,45 г) добавляют к циклопропилзамещенной кислоте Мельдрума (6,6-диметил-5,7 диоксаспиро[2.5]октан-4,8-диону; 7 г) в сухом дихлорметане и смесь перемешивают при КТ в течение 14 ч. Партию затем промывают 10% раствором NaOH и водную фазу подкисляют с использованием 1 н.HCl до тех пор, пока не образуется бесцветный осадок. Этот осадок отфильтровывают и сушат в вакууме. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 12,89 (s, 1H), 7,83-7,82 (t, J=2 Гц, 1 Н), 7,57-7,54 (m, 1H), 7,437,39 (t, J=8 Гц, 1 Н), 7,23-7,20 (m, 1 Н), 3,92-3,79 (m, 2 Н), 3,63-3,59 (m, 1 Н), 2,36-2,25 (m, 2 Н). ЖХМС: масса, найдено (М+1, 240). Метод: А - 0,1% ТФУ в Н 2 О, В - 0,1% ТФУ в ацетонитриле: скорость потока - 2,0 мл/мин. Колонка: X Bridge C8 (504,6 мм, 3,5 мкм) "+" методика. Кислоту (0,2 г), полученную в соответствии с а), растворяют в сухом дихлорметане. Затем добавляют 2-тиофенэтиламин (127 мг), триэтиламин (25 мг) и Т 3 Р (399 мг) и партию перемешивают в течение 14 ч. Смесь подвергают водной обработке и экстрагируют дихлорметаном. Органическую фазу промывают водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия,сушат над сульфатом натрия, упаривают и хроматографируют на силикагеле. 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 8,36-8,35 (t, J=5,4 Гц, 1H), 7,85-7,84 (d, J=2 Гц, 1 Н), 7,56-7,54 Амид, полученный в соответствии с b), растворяют в трет-бутаноле (100 мг). Добавляют раствор трет-бутилгидропероксида (70% экв.) (0,051 г) и этилат натрия (20% в этаноле; 39 мг) и смесь перемешивают при 70 С течение 1 ч. После завершения реакции растворитель удаляют в вакууме и добавляют воду до тех пор, пока не образуется бесцветный осадок. Этот осадок отфильтровывают и хроматографируют. Энантиомеры получают с помощью хиральной препаративной ЖХВР. Энантиомер, который элюируется по истечении Rt (мин) 5,419, является активным соединением 300 мг этил (R)-3-гидрокси-2-оксо-1-фенилпирролидин-3-карбоксилата растворяют в сухом дихлорметане, при -78 С медленно добавляют 244 мг DAST и смесь перемешивают в течение дополнительных 4 ч. После завершения реакции партию выливают в насыщенный раствор гидрокарбоната натрия, водную фазу экстрагируют дихлорметаном и объединенные органические фазы сушат над сульфатом натрия. Высушивающее вещество и растворитель удаляют и остаток (180 мг) затем подвергают последующей реакции без дополнительной очистки. ЖХМС: масса, найдено (М+1, 252). Метод: А - 0,1% ТФУ в Н 2 О, В - 0,1% ТФУ в ацетонитриле: скорость потока - 2,0 мл/мин. Колонка: X Bridge C8 (504,6 мм, 3,5 мкм) "+" методика. 84 мг LiOH/H2O добавляют к раствору 180 мг этил (S)-3-фтор-2-оксо-1-фенилпирролидин-3 карбоксилата в ТГФ/Н 2 О = 3:1 и смесь перемешивают при КТ в течение 4 ч. После завершения реакции партию нейтрализуют с использованием 1,5 н. HCl. Водную фазу экстрагируют этилацетатом и органическую фазу сушат над сульфатом натрия. Удаление растворителя в вакууме дает 90 мг (S)-3-фтор-2-оксо 1-фенилпирролидин-3-карбоновой кислоты. ЖХМС: масса, найдено (М+1, 222). Метод: А - 0,1% HCOOH, В - MeOH: скорость потока - 1,0 мл/мин. Колонка: Atlantis DC18 (504,6 мм, 5 мкм) "+" методика. 230 мг EDCl, 65 мг HOBt добавляют к раствору 90 мг (S)-3-фтор-2-оксо-1-фенилпирролидин-3 карбоновой кислоты и 61 мг 2-тиофен-2-илэтиламина в сухом ДМФА и смесь нагревают в микроволновой печи при 160 С в течение 20 мин. После завершения реакции все летучие компоненты удаляют в вакууме и остаток очищают с помощью хроматографии с получением 23 мг "А 86". 1 Н ЯМР (400 МГц, ДМСО-d6):[м.д.] 8,72 (s, 1H), 7,69 (d, J=7,7 Гц, 2 Н), 7,50-7,40 (m, 2 Н), 7,33 (dd,J=5,1, 1,2 Гц, 1 Н), 7,23 (t, J=7,4 Гц, 1H), 6,94 (dd, J=5,1, 3,4 Гц, 1H), 6,89 (d, J=3,4 Гц, 1H), 3,97 (dd,J=9,2, 3,3 Гц, 1H), 3,92 (dd, J=6,2, 3,4 Гц, 1H), 3,48-3,37 (m, 2H), 2,98 (t, J=7,3 Гц, 2H), 2,77-2,62 (m, 1H),2,47-2,35 (m, 2H). 19 При температуре 0 С к раствору 2-оксо-1-фенилпирролидин-3-карбоновой кислоты (5 г) в этаноле добавляют тионилхлорид (5,8 г) и партию перемешивают при 80 С в течение 4 ч. После завершения реакции партию концентрируют в вакууме, остаток вносят в воду и экстрагируют этилацетатом. Органическую фазу промывают насыщенным раствором бикарбоната натрия и насыщенным раствором хлорида натрия и сушат над сульфатом натрия с получением этил 2-оксо-1-фенилпирролидин-3-карбоксилата Гептагидрат хлорида церия(III) (1,59 г) добавляют к раствору этил 2-оксо-1-фенилпирролидин-3 карбоксилата (5 г) в изопропаноле и пропускают О 2 в течение 15 мин. Партию перемешивают при КТ в течение 12 ч. После завершения реакции растворитель удаляют в вакууме и остаток очищают с помощью хроматографии на силикагеле. Этил 3-гидрокси-2-оксо-1-фенилпирролидин-3-карбоксилат (2,7 г) анализируют при помощи хиральной ЖХВР и очищают с помощью этого метода. Вещество, которое элюируется при Rt (мин) 8,197, представляет собой R-энантиомер (1,2 г), а вещество, которое элюируется при Rt(мин) 11,240, представляет собой S-энантиомер (1,2 г) (Chiralpak AD-H (2504,6 мм, 5 мкм); нгексан/изопропанол = 60:40). S-энантиомер необходимо использовать далее для синтеза спиртовых производных. В этой реакции окисления этил 3-хлор-2-оксо-1-фенилпирролидин-3-карбоксилат также образуется в виде рацемата с выходом 20%. Перед разделением спиртов на энантиомеры их отделяют (1 г) с помощью хроматографии на силикагеле, а также используют в рацемической форме на следующей стадии. 6.3. Синтез этил 3-азидо-2-оксо-1-фенилпирролидин-3-карбоксилата.NaN3 (58 мг, 0,89 ммоль) добавляют к раствору этил 3-хлор-2-оксо-1-фенилпирролидин-3 карбоксилата (0,2 г, 0,74 ммоль) в сухом DME (5 мл). Реакционный раствор перемешивают при 75 С под азотом в течение 14 ч. После завершения партию разбавляют этилацетатом и экстрагируют водой. Органическую фазу сушат над сульфатом натрия, концентрируют и остаток далее используют непосредственно на следующей стадии (200 мг, 97%). Тонкослойная хроматограмма: гексан/этилацетат = 7:3, Rf: 0,4. ЖХ/МС: 275,0 (М+Н на 1,275 мин). 1 Н ЯМР (ДМСО-d6, 400 МГц):[м.д.] 7,67-7,65 (m, 2H), 7,46-7,42 (m, 2 Н), 7,26-7,23 (m, 1 Н), 4,304,22 (m, 2 Н), 3,95-3,92 (m, 2 Н), 2,68-2,63 (m, 1 Н), 2,16-2,10 (m, 1 Н), 1,22 (t, J=7,08 Гц, 3 Н). 6.4. Синтез 3-азидо-2-оксо-1-фенилпирролидин-3-карбоновой кислоты.LiOH (91 мг, 2,1 ммоль) добавляют к раствору этил 3-азидо-2-оксо-1-фенилпирролидин-3 карбоксилата (0,2 г, 0,7 ммоль) в ТГФ (2 мл) и Н 2 О (1 мл) и партию перемешивают при КТ в течение 20 ч. После завершения реакции все летучие компоненты удаляют в вакууме, остаток разбавляют водой и подкисляют с использованием 1,5 н. раствора HCl. Полученный осадок отфильтровывают и промывают водой. Сушка в вакууме дает в качестве продукта бесцветное твердое вещество (150 мг, 84%). Тонкослойная хроматограмма: гексан/этилацетат = 7:3, Rf: 0,4. ЖХ/МС: 247,0 (М+Н на 1, 247 мин). 1 Н ЯМР (ДМСО-d6, 400 МГц):[м.д.] 7,68-7,66 (m, 2 Н), 7,45-7,41 (m, 2 Н), 7,25-7,21 (m, 1 Н), 3,953,89 (m, 2 Н), 2,64-2,59 (m, 1 Н), 2,13-2,05 (m, 1 Н). 6.5. Синтез (3-хлор-5-фторбензил)амида 3-азидо-2-оксо-1-фенилпирролидин-3-карбоновой кислоты(150 мг, 0,61 ммоль) в 5 мл дихлорметана. Реакционную смесь перемешивают при комнатной температуре под азотом в течение 4 ч. После завершения реакции добавляют воду и смесь экстрагируют до полного извлечения дихлорметаном. Объединенные органические фазы потом промывают водой и насыщенным раствором хлорида натрия и сушат над сульфатом натрия. После фильтрования и упаривания остаток очищают с помощью хроматографии на силикагеле с получением продукта в виде бесцветного твердого вещества (150 мг, выход 63%). Тонкослойная хроматограмма: хлороформ/метанол = 9,5:0,5), Rf: 0,3. ЖХ/МС: 388,1 (М+Н на 1, 388 мин).(3-хлор-5-фторбензил)амида 3-азидо-2-оксо-1-фенилпирролидин-3-карбоновой кислоты (100 мг,0,25 ммоль) в 2 мл метанола. Партию перемешивают при КТ течение 12 ч. После завершения реакции все летучие компоненты удаляют в вакууме и остаток очищают на силикагеле. Следующие соединения получают аналогично.
МПК / Метки
МПК: A61K 31/4015, C07D 409/12, C07D 405/04, C07D 401/12, A61P 35/00, C07D 405/14, C07D 207/277, C07D 413/10, A61K 31/402, C07D 403/04, C07D 401/06, C07D 413/12, A61K 31/4025, C07D 401/04, C07D 405/12, C07D 403/12
Метки: metap-2, ингибиторов, качестве, пирролидиноны
Код ссылки
<a href="https://eas.patents.su/30-22299-pirrolidinony-v-kachestve-ingibitorov-metap-2.html" rel="bookmark" title="База патентов Евразийского Союза">Пирролидиноны в качестве ингибиторов metap-2</a>
Предыдущий патент: Устройство и способ охлаждения фрагментов расплава
Следующий патент: Разделение энантиомеров 2-амино-3,6-дигидро-4-диметиламино-6-метил-1,3,5-триазина с использованием винной кислоты
Случайный патент: Способы получения 3-о-защищенных морфинов и 3-о-защищенных морфинондиенолкарбоксилатов












