Замещенные пирролидиноны в качестве ингибиторов 11-бета-гидроксистероиддегидрогеназы 1 типа
Номер патента: 16959
Опубликовано: 30.08.2012
Авторы: Уоллэйс Оуэн Брендан, Красутский Алексей Павлович, Сюй Яньпин, Аллен Джон Гордон, Йорк Джереми Шуленбург
Формула / Реферат
1. Соединение структурной формулы
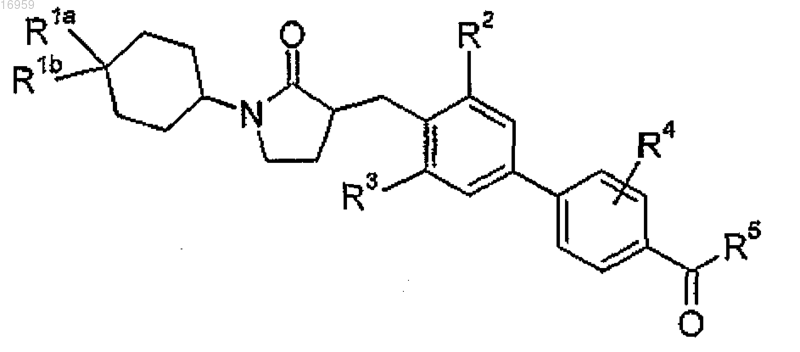
где R1a представляет собой -галоген;
R1b представляет собой -Н или -галоген;
R2 представляет собой -галоген;
R3 представляет собой -галоген;
R4 представляет собой -Н;
R5 представляет собой
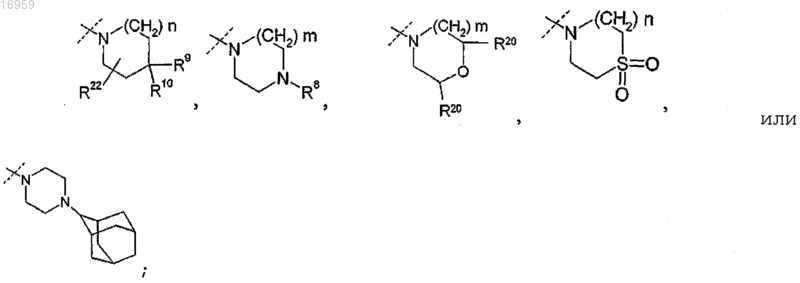
где пунктирной линией показано место присоединения R5 к остальной части молекулы;
n равно 1;
m имеет значение 1;
R8 представляет собой -(C1-C6)алкил (который может содержать в качестве заместителей от 1 до 3 атомов галогена);
R9 представляет собой -Н, -галоген, -СН3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);
R10 в каждом случае представляет собой независимо -Н или -галоген;
R20 представляет собой -Н;
R22 представляет собой -Н;
или фармацевтически приемлемая соль указанного соединения.
2. Соединение структурной формулы
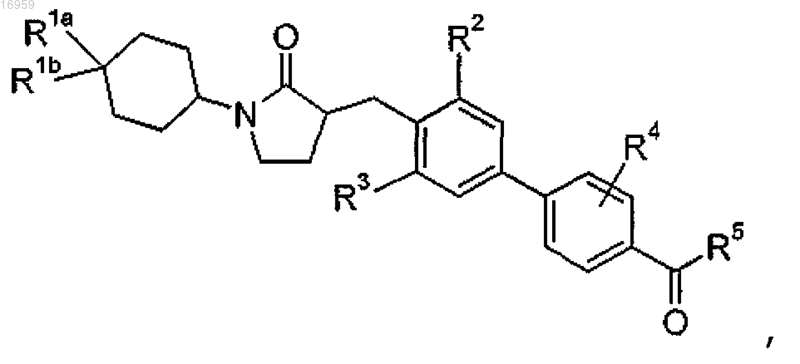
где R1a представляет собой -галоген;
R1b представляет собой -Н или -галоген;
R2 представляет собой -галоген;
R3 представляет собой -галоген;
R4 представляет собой -Н или -галоген;
R5 представляет собой
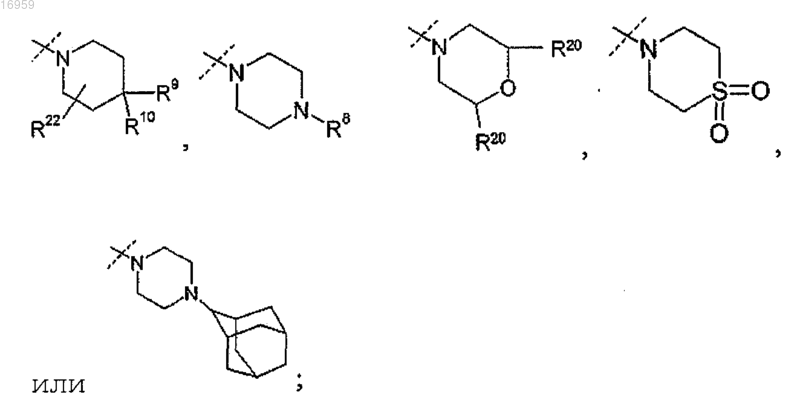
где пунктирной линией показано место присоединения R5 к остальной части молекулы;
R8 представляет собой -(C1-C6)алкил (который может содержать в качестве заместителей от 1 до 3 атомов галогена);
R9 представляет собой -Н, -галоген, -СН3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);
R10 в каждом случае представляет собой независимо -Н или -галоген;
R20 представляет собой -Н;
R22 представляет собой -Н.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R2 представляет собой атом хлора, фтора или брома и R3 представляет собой атом хлора, фтора или брома.
4. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой

где пунктирной линией показано место присоединения R5 к остальной части молекулы.
5. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой
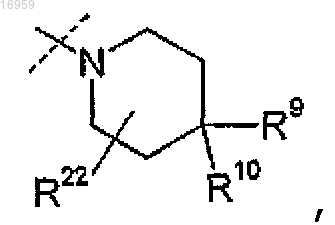
где пунктирной линией показано место присоединения R5 к остальной части молекулы.
6. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой
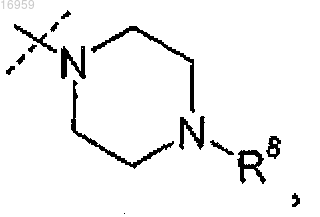
где пунктирной линией показано место присоединения R5 к остальной части молекулы.
7. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой

где пунктирной линией показано место присоединения R5 к остальной части молекулы.
8. Соединение по п.1, представляющее собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он, или фармацевтически приемлемая соль указанного соединения.
9. Соединение по п.1, представляющее собой (R)-3-[3,5-дихлор-4'-(1,1-диоксо-1l*6*-тиоморфолин-4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он, или фармацевтически приемлемая соль указанного соединения.
10. Соединение по п.1, выбранное из группы, включающей
(R)-3-{3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил}-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[3,5-дихлор-4'-(морфолин-4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[3,5-дихлор-4'-(1,1-диоксо-1l*6*-тиоморфолин-4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[4'-(4-трет-бутилпиперазин-1-карбонил)-3,5-дихлорбифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[3,5-дихлор-4'-(4,4-дифторпиперидин-1-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-[4'-(4-адамантан-2-илпиперазин-1-карбонил)-3,5-дихлорбифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он;
(R)-3-{3,5-дихлор-4'-[4-(2,2,2-трифторэтил)пиперазин-1-карбонил]бифенил-4-илметил}-1-(4,4-дифторциклогексил)пирролидин-2-он и
(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-цис-1-(4-фторциклогексил)пирролидин-2-он;
или фармацевтически приемлемая соль указанного соединения.
11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-10, стереоизомер или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель.
12. Применение соединения по любому из пп.1-10, стереоизомера или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства.
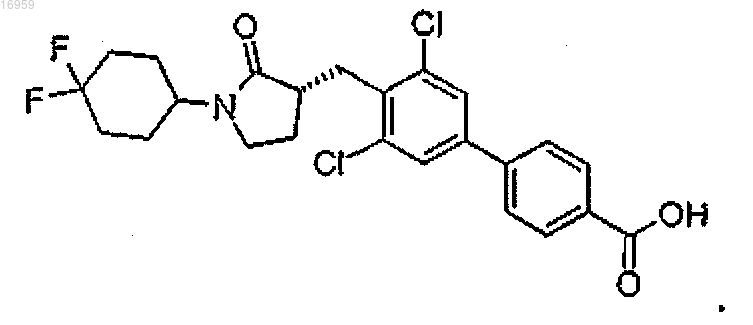
13. Промежуточное соединение для получения соединения по п.8 или 9, представляющее собой
Текст
В настоящем изобретении предложены новые соединения формулы I Аллен Джон Гордон, Красутский Алексей Павлович, Уоллэйс Оуэн Брендан, Сюй Яньпин, Йорк Джереми Шуленбург (US) Медведев В.Н. (RU) обладающие активностью в качестве антагониста 11-HSD 1 типа, а также способы получения указанных соединений. Согласно другому варианту реализации в настоящем изобретении предложены фармацевтические составы, содержащие соединения формулы I, a также способы применения указанных соединений и составов для лечения диабета, гипергликемии, ожирения,гипертонии, гиперлипидемии, метаболического синдрома, когнитивных расстройств и других состояний, связанных с активностью 11-HSD 1 типа.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 016959 По настоящей заявке испрашивается приоритет на основании предварительной заявки США 60/745467, поданной 24 апреля 2006 г. В настоящем изобретении предложены соединения, которые являются ингибиторами 11-гидроксистероиддегидрогеназы 1 типа ("11HSD1"), фармацевтические композиции на основе указанных соединений и применение указанных соединений и составов для лечения заболеваний у животных и людей, а также новые промежуточные соединения, подходящие для получения указанных ингибиторов. Соединения согласно настоящему изобретению обеспечивают эффективное и избирательное ингибирование 11HSD1 и, таким образом, подходят для лечения нарушений, на которые оказывает влияние модулирование 11HSD1, таких как диабет, метаболический синдром, когнитивные расстройства и др. Глюкокортикоиды, представляющие собой соединения, активные в тканях печени, жировой и мышечной тканях, являются важным классом регуляторов метаболизма глюкозы, липидов и белков. Хронический избыток глюкокортикоидов связывают с резистентностью к инсулину, ожирением внутренних органов, гипертонией и дислипидемией и рассматривают как классический признак метаболического синдрома. 11HSD1 является катализатором превращения неактивного кортизона в активный кортизол и связан с развитием метаболического синдрома. Результаты исследований, проведенных на грызунах и людях, указывают на связь 11HSD1 с метаболическим синдромом. Полученные данные позволяют предположить, что лекарственное средство, обеспечивающее специфическое ингибирование 11HSD1 у пациентов, страдающих диабетом 2 типа, способно обеспечивать снижение содержания глюкозы в крови за счет снижения глюконеогенеза в печени, снижение центрального ожирения, улучшение фенотипа атерогенных липопротеинов, понижение кровяного давления и снижение резистентности к инсулину. Кроме того, указанное лекарственное средство должно обеспечивать повышение эффективности воздействия инсулина на мышечную ткань и повышение секреции инсулина инсулярными бета-клетками. Результаты исследований, проведенных на животных и людях, также указывают на то, что избыток глюкокортикоидов приводит к ухудшению когнитивной функции. Недавние исследования показали, что инактивация 11HSD1 приводит к улучшению функции памяти как у людей, так и у мышей. Было показано,что ингибитор 11HSD карбеноксолон обеспечивает улучшение когнитивной функции у здоровых людей пожилого возраста и у больных диабетом 2 типа, и что инактивация гена 11HSD1 предотвращает возрастное ухудшение указанной функции у мышей. Кроме того, недавно было установлено, что избирательное ингибирование 11HSD1 фармацевтическим агентом приводит к улучшению памяти у мышей. В последние годы появился ряд публикаций, в которых сообщалось о средствах, ингибирующих 11-HSD1. См., например, публикацию международной заявки WO 2004/056744, в которой в качестве ингибиторов 11HSD предложены адамантилацетамиды, публикацию международной заявки WO 2005/108360, где в качестве ингибиторов 11HSD предложены производные пирролидин-2-она и пиперидин-2-она, и публикацию международной заявки WO 2005/108361, где в качестве ингибиторов 11-HSD предложены производные адамантилпирролидин-2-она. В настоящее время также известен ряд способов лечения заболеваний, связанных с 11HSD1; тем не менее, известные способы имеют один или более недостатков, включая низкую или недостаточную эффективность, неприемлемые побочные эффекты и противопоказания для отдельных категорий пациентов. Таким образом, необходим улучшенный способ лечения с применением альтернативных или улучшенных фармацевтических средств, обеспечивающих ингибирование 11HSD1 и излечение заболеваний, при которых указанное ингибирование оказывает положительное воздействие. Такой способ лечения и фармацевтические средства предложены в настоящем изобретении, в котором описан новый класс соединений, которые, как обнаружено, обладают высокой активностью и избирательностью в отношении ингибирования 11HSD1. В настоящем изобретении дано подробное описание структуры конкретных соединений и их активности. В настоящее время требуются новые способы лечения диабета, метаболического синдрома и когнитивных расстройств, поэтому одной из задач настоящего изобретения является обеспечение способа лечения этих заболеваний. В настоящем изобретении предложено соединение структурной формулы где пунктирной линией показано место присоединения R5 к остальной части молекулы; где n равно 1; где m имеет значение 1;R8 представляет собой -(C1-C6)алкил (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R9 представляет собой -Н, -галоген, -СН 3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R10 в каждом случае представляет собой независимо -Н или -галоген;R20 в каждом случае представляет собой -Н;R22 в каждом случае представляет собой -Н или фармацевтически приемлемая соль указанного соединения. Ещ одним объектом настоящего изобретения является соединение структурной формулы где пунктирной линией показано место присоединения R5 к остальной части молекулы;R8 представляет собой -(С 1-С 6)алкил (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R9 представляет собой -Н, -галоген, -СН 3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R10 в каждом случае представляет собой независимо -Н или -галоген;R20 в каждом случае представляет собой -Н;R22 в каждом случае представляет собой -Н. В одном из вариантов воплощения настоящего изобретения в представленных выше соединенияхR2 представляет собой атом хлора, фтора или брома и R3 представляет собой атом хлора, фтора или брома. В одном из вариантов воплощения настоящего изобретения в представленных выше соединениях где пунктирной линией показано место присоединения R5 к остальной части молекулы. В одном из вариантов воплощения настоящего изобретения в представленных выше соединениях где пунктирной линией показано место присоединения R5 к остальной части молекулы. В одном из вариантов воплощения настоящего изобретения в представленных выше соединениях где пунктирной линией показано место присоединения R5 к остальной части молекулы. В одном из вариантов воплощения настоящего изобретения в представленных выше соединениях где пунктирной линией показано место присоединения R5 к остальной части молекулы. Предпочтительно соединение,представляющее собой(R)-3-[3,5-дихлор-4'-(4 трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он,или фармацевтически приемлемая соль указанного соединения. Предпочтительно соединение, представляющее собой (R)-3-[3,5-дихлор-4'-(1,1-диоксо-16 тиоморфолин-4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он, или фармацевтически приемлемая соль указанного соединения. Предпочтительно соединение, выбранное из группы, включающей(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-цис-1-(4 фторциклогексил)пирролидин-2-он или фармацевтически приемлемая соль указанного соединения. Ещ одним объектом настоящего изобретения является фармацевтическая композиция, содержащая любое из перечисленных выше соединений, стереоизомер или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носитель. Другим объектом настоящего изобретения является применение любого из перечисленных выше соединений, стереоизомера или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства. Ещ одним объектом настоящего изобретения является промежуточное соединение, представляющее собой(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1 карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-она или R)-3-[3,5-дихлор-4'-(1,1-3 016959 диоксо-16-тиоморфолин-4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2 она. У пациентов, страдающих диабетом 2 типа, часто развивается резистентность к инсулину, вызывающая нарушение гомеостаза глюкозы и гипергликемию, которые приводят к повышению уровня заболеваемости и ранней смертности. Нарушение гомеостаза глюкозы связывают с ожирением, гипертонией и изменением метаболизма липидов, липопротеинов и аполипопротеинов. Больные диабетом 2 типа подвержены риску развития осложнений сердечно-сосудистой системы, например атеросклероза, ишемической болезни сердца, инсульта, заболевания периферических сосудов, гипертонии, нефропатии, нейропатии и ретинопатии. Поэтому терапевтическое регулирование гомеостаза глюкозы, липидного метаболизма, протекания таких заболеваний, как ожирение и гипертония, является важным для контроля и лечения сахарного диабета. Многие пациенты, обладающие резистентностью к инсулину, но при этом не страдающие диабетом 2 типа, также подвержены риску развития синдрома X или метаболического синдрома. Метаболический синдром наряду с наличием резистентности к инсулину также характеризуется развитием абдоминального ожирения, гиперинсулинемии, высоким кровяным давлением, низким содержанием липопротеинов высокой плотности (ЛПВП), высоким содержанием липопротеинов очень низкой плотности (ЛОНП), развитием гипертонии, атеросклероза, ишемической болезни сердца и хронической почечной недостаточности. Такие пациенты входят в группу риска развития указанных осложнений сердечно-сосудистой системы независимо от того, страдают ли они явным сахарным диабетом. Благодаря способности соединений согласно настоящему изобретению ингибировать 11HSD1 предложенные соединения подходят для лечения широкого круга состояний и нарушений, при которых ингибирование 11HSD1 оказывает положительное воздействие. Такие нарушения и состояния в настоящем описании определены как нарушения, связанные с диабетом и нарушения, связанные с метаболическим синдромом. Нарушения, связанные с диабетом или нарушения, связанные с метаболическим синдромом могут быть идентифицированы специалистом в данной области техники на основании оценки влияния 11HSD1 на патофизиологию конкретного нарушения, либо на основании оценки активности 11HSD1, обусловленной гомеостатической реакцией на конкретное нарушение. Таким образом, указанные соединения могут находить применение, например, для предотвращения, лечения или облегчения заболеваний, состояний или симптомов, связанных или являющихся следствием нарушений,связанных с диабетом или нарушений, связанных с метаболическим синдромом. Нарушения, связанные с диабетом или нарушения, связанные с метаболическим синдромом включают без ограничения диабет, диабет 1 типа, диабет 2 типа, гипергликемию, гиперинсулинемию,прекращение деятельности бета-клеток, усиление функции бета-клеток вследствие восстановления первой фазы инсулинового ответа, пищевую гипергликемию, предотвращение апоптоза, повышенное содержание глюкозы натощак (irapared fasting glucose, IFG), метаболический синдром, гипогликемию, гипер-/гипокалиемию, нормализацию содержания глюкагонов, улучшенное соотношение ЛПНП (липопротеинов низкой плотности)/ЛПВП, снижение частоты приема пищи, расстройства пищевого поведения,снижение веса, синдром поликистоза яичников, ожирение, обусловленное диабетом, медленно прогрессирующий аутоиммунный диабет у взрослых (latent autoimmune diabetes in adults, LADA), пересадку островковых клеток, диабет у детей, диабет во время беременности, отсроченные осложнения, обусловленные диабетом, микро- и макроальбуминурию, нефропатию, ретинопатию, синдром диабетической стопы,ослабление перистальтики кишечника вследствие приема глюкагонов, синдром укороченного кишечника, антидиарейный эффект, повышение желудочной секреции, снижение кровотока, эректильную дисфункцию, глаукому, послеоперационный стресс, облегчение повреждения тканей органов вследствие реперфузии кровотока после ишемии, ишемическое поражение сердца, сердечную недостаточность, застойную сердечную недостаточность, инсульт, инфаркт миокарда, аритмию, преждевременную смерть,антиапоптоз, заживление ран, пониженную толерантность к глюкозе, синдром резистентности к инсулину, метаболический синдром, синдром X, гиперлипидемию, дислипидемию, гипертриглицеридемию,гиперлипопротеинемию, гиперхолестеринемию, артериосклероз, включая атеросклероз, глюкагономы,острый панкреатит, сердечно-сосудистые заболевания, гипертонию, гипертрофию сердца, расстройства желудочно-кишечного тракта, ожирение, диабет, обусловленный ожирением, дислипидемию, связанную с диабетом, и др. Таким образом, в настоящем изобретении также предложен способ лечения нарушений, связанных с диабетом и нарушений, связанных с метаболическим синдромом, при этом предложенный способ обеспечивает ослабление или устранение нежелательных побочных эффектов, характерных для известных в настоящее время способов лечения. Кроме того, предложенные в настоящем изобретении соединения подходят для следующих применений: для ингибирования активности 11HSD1; подавления клеточного ответа, опосредуемого 11-HSD1, у млекопитающего; снижения содержания глюкозы в крови у млекопитающего; лечения заболеваний, обусловленных избыточной активностью 11HSD1; для лечения нарушений, связанных с диабетом и метаболическим синдромом, у млекопитающего; для лечения диабета, метаболического синдрома,ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта, нейропатии и для заживления ран. Таким образом, способы лечения согласно настоящему изобретению включают введение-4 016959 соединения формулы I в профилактических и терапевтических целях. Предложенные в настоящем изобретении соединения подходят для получения лекарственного средства для ингибирования активности 11HSD1; получения лекарственного препарата для подавления клеточного ответа, опосредуемого 11HSD1, у млекопитающего; получения лекарственного средства для снижения содержания глюкозы в крови у млекопитающего, получения лекарственного средства для лечения заболеваний, обусловленных чрезмерной активностью 11HSD1; получения лекарственного препарата для лечения нарушений, связанных с диабетом и метаболическим синдромом, у млекопитающего; и для получения лекарственного препарата для предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии, атеросклероза, ишемической болезни сердца, инсульта,нейропатии и неправильно протекающего заживления ран. Предложенная в настоящем избретении фармацевтическая композиция подходит для применения с целью ингибирования активности 11HSD1; подходит для применения с целью подавления клеточного ответа, опосредуемого 11HSD1; подходит для применения с целью снижения содержания глюкозы в крови у млекопитающего; подходит для применения для лечения нарушений, связанных с диабетом, и других нарушений, связанных с метаболическим синдромом, у млекопитающего; и подходит для применения для предотвращения или лечения диабета, метаболического синдрома, ожирения, гипергликемии,атеросклероза, ишемической болезни сердца, инсульта, нейропатии и неправильно протекающего заживления ран. Соединения согласно настоящему изобретению можно применять в сочетании с одним или более дополнительным активным веществом при любых подходящих соотношениях указанного соединения и указанного дополнительного вещества. Указанные дополнительные активные вещества могут быть, например, выбраны из группы, включающей противодиабетические средства, средства против ожирения,противогипертонические средства, средства для лечения осложнений и нарушений, обусловленных или связанных с диабетом, и средства для лечения осложнений и нарушений, обусловленных или связанных с ожирением. Далее представлено несколько групп таких комбинаций. При этом очевидно, что каждое из указанных средств может использоваться в сочетании с другими указанными средствами с образованием дополнительных комбинаций. Так, соединения согласно настоящему изобретению можно вводить в сочетании с одним или более противодиабетическим средством. Подходящие противодиабетические средства включают инсулин, производные и аналоги инсулина,например, средства, указанные в ЕР 792290 (Novo Nordisk A/S), например NB29-тетрадеканоил-дез-(В 30) инсулин человека; средства, указанные в ЕР 214826 и ЕР 705275 (Novo Nordisk A/S), например AspB28 инсулин человека; средства, указанные в US 5504188 (Eli Lilly), например LysB28ProB29 инсулин человека; средства, указанные в ЕР 368187 (Aventis), например Lantus; производные GLP-1 и GLP-1, например,указанные в публикации WO 98/08871 (Novo Nordisk A/S), а также гипогликемические средства, активные при пероральном введении. Гипогликемические средства, активные при пероральном введении, предпочтительно включают имидазолины, сульфонилмочевины, бигуаниды, меглитиниды, оксадиазолидиндионы, тиазолидиндионы,средства, повышающие чувствительность к инсулину, средства, повышающие секрецию инсулина, такие как глимпириды, ингибиторы -глюкозидазы, средства, воздействующие на АТФ-зависимые калиевые каналы -клеток, например вещества, расширяющие калиевые каналы, например, указанные в публикациях WO 97/26265, WO 99/03861 и WO 00/37474 (Novo Nordisk A/S), или митиглиниды или вещества,блокирующие калиевые каналы, такие как BTS-67582, натеглиниды, антагонисты глюкагонов, например,предложенные в WO 99/01423 и WO 00/39088 (Novo Nordisk A/S и Agouron Pharmaceuticals, Inc.), антагонисты GLP-1, ингибиторы ДПП-IV (дипептидилпептидазы-IV), ингибиторы ПТФ (протеинтирозинфосфатазы), ингибиторы ферментов печени, участвующих в стимулировании глюконеогенеза и глюкогенолиза, модуляторы обратного захвата глюкозы, активаторы глюкокиназы (ГК), например, предложенные в(Hoffman-La Roche), или предложенные в WO 03/00262, WO 03/00267 и WO 03/15774 (AstraZeneca), ингибиторы GSK-3 (гликогенсинтазкиназы-3 (glycogen synthase kinase-3, соединения, вызывающие изменение липидного метаболизма, такие как противолипидемические средства, например ингибиторы HMG СоА (статины), соединения, обеспечивающие снижение количества принимаемой пищи, лиганды PPAR(рецептора, активируемого пролифераторами пероксисомы (Peroxisome proliferator-activated receptor,включая подклассы PPAR-альфа, PPAR-гамма и PPAR-дельта, и агонисты RXR (ретиноидного Хрецептора (retinoid X receptor, такие как ALRT-268, LG-1268 или LG-1069. Соединения согласно настоящему изобретению вводят в сочетании с инсулином или производным или аналогом инсулина, например, NB29-тетрадеканоил-дез- (В 30) инсулином человека, AspB28 инсулином человека, Lys Pro инсулином человека, Lantus, или смешанным составом, содержащим одно или более из указанных соединений. Предложенные в настоящем изобретении соединения вводят в сочетании с сульфонилмочевиной,например глибенкламидом, глипизидом, толбатамидом, хлорпамидемом, толазамидом, глимепридом,-5 016959 гликазидом и глибуридом. Предложенные соединения вводят в сочетании с бигуанидом, например метформином. Предложенные соединения вводят в сочетании с меглитинидом, например репаглинидом или натеглинидом. Предложенные соединения вводят в сочетании со средством, повышающим чувствительность к инсулину, на основе тиазолидиндиона, например троглитазоном, циглитазоном, пиоглитазоном, росиглитазоном, изаглитазоном, дарглитазоном, энглитазоном, CS-011/CI-1037 или Т 174, или соединениями,предложенными в WO 97/41097, WO 97/41119, WO 97/41120, WO 00/41121 и WO 98/45292 (Dr. Reddy'sResearch Foundation). Предложенные соединения можно вводить в сочетании со средством, повышающим чувствительность к инсулину, например, таким как GI 262570, YM-440, МСС-555, JTT-501, AR-H039242, KRP-297,GW-409544, CRE-16336, AR-H049020, LY510929, МВХ-102, CLX-0940, GW-501516 или соединения,предложенные в WO 99/19313, WO 00/50414, WO 00/63191, WO 00/63192, WO 00/63193, такими как рагаглитазар (NN 622 или (-)DRF 2725) (Dr. Reddy's Research Foundation) и WO 00/23425, WO 00/23415,WO 00/23451, WO 00/23445, WO 00/23417, WO 00/23416, WO 00/63153, WO 63196, WO 00/63209, WO 00/63190 и WO 00/63189 (Novo Nordisk A/S). Предложенные соединения вводят в сочетании с ингибиторами -глюкозидазы, например воглибозом, эмиглитатом, миглитолом или акарбозом. Предложенные соединения вводят в сочетании с агентами, воздействующими на АТФ-зависимые калиевые каналы -клеток, например толбутамидом, глибенкламидом, глипизидом, гликазидом, BTS67582 или репаглинидом. Предложенные соединения можно вводить в сочетании с натеглинидом. Предложенные соединения вводят в сочетании с противолипидемическим или противогиперлипидемическим средством, например холестирамином, колестиполом, клофибратом, гемфиброзилом, ловастатином, правастатином, симвастатином, питавастатином, розувастатином, пробуколом, декстротироксином, фенофибратом или аторвастином. Предложенные соединения вводят в сочетании с соединениями, обеспечивающими снижение количества принимаемой пищи. Предложенные соединения вводят в сочетании с более чем одним из вышеуказанных соединений,например, в сочетании с метформином и сульфонилмочевиной, например глибуридом; в сочетании с сульфонилмочевиной и акарбозом; натеглинидом и метформином; репаглинидом и метформином; акарбозом и метформином; в сочетании с сульфонилмочевиной, метформином и троглитазоном; инсулином и сульфонилмочевиной; инсулином и метформином; инсулином, метформином и сульфонилмочевиной; инсулином и троглитазоном; инсулином и ловастатином, и др. Общепринятые термины, используемые для описания соединений, в настоящем описании используются в их обычном значении. В настоящем описании термины (C1-C3)алкил, (С 1-С 4)алкил или (С 1-С 6)алкил относятся к неразветвленным или разветвленным насыщенным алифатическим группам, содержащим указанное количество атомов углерода, таким как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил,трет-бутил и др. Термин (С 1-С 6)алкокси обозначает С 1-С 6-алкильную группу, присоединенную через атом кислорода, и включает, например, такие фрагменты, как метокси, этокси, н-пропокси, изопропокси и др. Термин галоген относится к атому фтора, хлора, брома или йода. Термин (С 3-C8)циклоалкил относится к насыщенному или частично насыщенному карбоциклу, содержащему от 3 до 8 атомов углерода, как правило, от 3 до 7 атомов углерода. Примеры (С 3-С 8)циклоалкила включают без ограничения циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и др. Термин который может содержать заместители или дополнительные заместители в настоящем описании указывает на то, что рассматриваемые группы могут содержать или не содержать один или более указанных заместителей. В случае, когда рассматриваемые группы содержат более одного заместителя, указанные заместители могут быть одинаковыми или различными. Кроме того, используемые термины независимо, представляют собой независимо, независимо выбраны из указывают на то,что рассматриваемые группы могут быть одинаковыми или различными. Некоторые из указанных терминов в описании структурных формул могут встречаться более одного раза; в этом случае каждый из терминов следует рассматривать независимо от других. Представляется очевидным, что используемый в настоящем описании термин пациент включает без ограничения морских свинок, собак, кошек, крыс, мышей, хомяков и приматов, включая человека. Предпочтительно пациентами являются люди. Термин пациент включает домашний скот. Под домашним скотом понимают животных, которых выращивают для получения пищевых продуктов. Примерами домашнего скота являются жвачные животные, такие как коровы, быки, телята, волы,овцы, буйволы, бизоны, козы и антилопы. Другие примеры домашнего скота включают свиней и птицу-6 016959 Термины лечение или лечить в настоящем описании употребляют в их традиционном значении,т.е. указанные термины обозначают контроль за состоянием пациента и уход за ним, направленные на предотвращение, снижение риска появления или развития данного конкретного состояния или заболевания, препятствование, сдерживание, облегчение, смягчение, замедление, прекращение, задержку или обратное развитие прогрессирования или тяжести состояния или заболевания, а также контролирование и/или лечение существующих признаков заболевания, нарушения или патологического состояния, указанного в настоящем описании, включая смягчение или облегчение симптомов или осложнений, или лечение или устранение указанного заболевания, нарушения или состояния. Способы лечения согласно настоящему изобретению включают как терапевтическое, так и профилактическое лечение. Используемый в настоящем описании термин терапевтически эффективное количество обозначает количество соединения согласно настоящему изобретению, обеспечивающее облегчение симптомов различных патологических состояний, указанных в настоящем описании. Конкретную дозу соединения согласно настоящему изобретению в каждом конкретном случае устанавливают отдельно, например, в зависимости от вводимого соединения, способа введения, состояния здоровья пациента и патологического состояния, подвергаемого лечению. Термин композиция обозначает фармацевтический состав и включает фармацевтичекий продукт,содержащий активный(ые) ингредиент(ы), включая соединения формулы I согласно настоящему изобретению, и неактивные ингредиенты, выступающие в качестве носителя. Соответственно, фармацевтический состав согласно настоящему изобретению включает любой состав, полученный в результате смешения соединения согласно настоящему изобретению с фармацевтически приемлемым носителем. Термин по существу чистый относится к чистой кристаллической форме соединения, содержащей более 90% целевой кристаллической формы, предпочтительно более 95% целевой кристаллической формы. Термин подходящий растворитель относится к любому растворителю или смеси растворителей,инертному по отношению к протекающей реакции, который обеспечивает достаточную солюбилизацию участвующих в реакции веществ с образованием среды, обеспечивающей эффективное протекание заданных реакций. Термин стандартная лекарственная форма обозначает физически раздельные дозы, подходящие для употребления в качестве единичных дозированных форм людьми и животными, при этом каждая из указанных доз содержит заранее заданное количество активного вещества, рассчитанное таким образом,чтобы обеспечивать желаемое терапевтическое воздействие, и подходящий фармацевтический носитель. Соединения согласно настоящему изобретению могут иметь один или более хиральный центр, при этом возможно существование ряда стереоизомеров различной конфигурации. Вследствие наличия указанных хиральных центров соединения согласно настоящему изобретению могут существовать в виде рацематов, индивидуальных энантиомеров или их смесей, а также диастереомеров или их смесей. Все указанные рацематы, энантиомеры, диастереомеры и их смеси находятся в рамках настоящего изобретения, включая чистые, частично очищенные или неочищенные смеси. Согласно некоторым примерам соединений, приведенным в настоящем описании, когда молекула содержит хиральный центр или центры и конфигурация такой молекулы известны, ее стереохимия отражена в названии или структурной формуле указанного соединения. Если стереохимия молекулы неизвестна или неустановлена, то название или структурная формула соединения не содержат таких указаний. Варианты реализации настоящего изобретения включают приведенные в настоящем описании примеры; при этом несмотря на то, что в конкретном примере соединение может представлять собой одну из хиральных или конформационных форм или их соль, другие варианты реализации настоящего изобретения включают все остальные стереоизомеры и/или конформационные формы представленных примеров соединений, а также их фармацевтически приемлемые соли. Такие варианты реализации включают любые выделенные энантиомеры, диастереомеры и/или конформеры указанных структур, а также любые смеси, содержащие более одной из таких форм. Кроме того, в случае, когда молекула содержит двойную связь или полностью или частично насыщенную циклическую систему, или молекула содержит более одного центра асимметрии или связь с ограниченной способностью к вращению, могут образовываться диастереомеры. При этом подразумевается, что любые диастереомеры, включая выделенные, чистые или частично очищенные диастереомеры или их смеси находятся в рамках настоящего изобретения. Кроме того, некоторые из соединений согласно настоящему изобретению могут существовать в виде различных таутомерных форм, при этом подразумевается, что любые таутомерные формы соединений, которые могут быть образованы, находятся в рамках настоящего изобретения. Термин энантиомерное обогащение в настоящем описании относится к увеличению количества одного из энантиомеров по отношению к другому. Удобным способом выражения полученной величины энантиомерного обогащения является использование понятия энантиомерного избытка, или ее, который может быть найден согласно следующему уравнению: где Е 1 представляет собой количество первого энантиомера, а Е 2 представляет собой количество второго энантиомера. Таким образом, при исходном соотношении энантиомеров 50:50, как, например, в рацемической смеси, в случае проведения энантиомерного обогащения указанной смеси, достаточного для обеспечения конечного соотношения 70:30, величина ее по отношению к первому изомеру составляет 40%. Однако, если указанное конечное соотношение составляет 90:10, величина ее по отношению к первому изомеру составляет 80%. Предпочтительно величина ее составляет более 90%, наиболее предпочтительно более 95%, особенно предпочтительно более 99%. Величина энантиомерного обогащения может быть легко установлена специалистом в данной области техники с помощью стандартных методов, таких как высокоэффективная жидкостная хроматография или хроматография на хиральных колонках. Выбор подходящей хиральной колонки, элюента и условий, обеспечивающих эффективное разделение пар энантиомеров, не представляет труда для рядового специалиста в данной области техники. Кроме того,конкретные стереоизомеры или энантиомеры соединений формулы I могут быть получены специалистом в данной области техники с помощью хорошо известных способов и методик, например указанных J.S.H. Wilen, "Stereochemistry of Organic Compounds" (Wiley-Interscience 1994), и заявке на европейский патентЕР-А-838448, опубликованной 29 апреля 1998 г. Примеры способов разделения включают перекристаллизацию и хиральную хроматографию. Соединения формулы I могут быть получены специалистом в данной области техники с помощью различных способов, некоторые из которых представлены далее в настоящем описании и иллюстрируются с помощью схем. Очередность выполнения операций, необходимая для получения конкретного соединения формулы I, зависит от конкретного синтезируемого соединения, исходного вещества и относительной лабильности содержащих заместители фрагментов. Реактивы или исходные материалы коммерчески доступны или в случае каких-либо затруднений могут быть легко синтезированы специалистом в данной области техники по стандартным методикам, обычно используемым в данной области техники,или по способам и схемам, представленным ниже. Приведенные далее схемы, препаративные примеры, примеры и методики даны с целью пояснения практического аспекта настоящего изобретения и никоим образом не ограничивают объем настоящего изобретения. Для специалиста в данной области техники очевидно, что возможные различные модификации изобретения не выходят за рамки настоящего изобретения. Все публикации, указанные в настоящем описании, предназначены для специалистов в данной области техники, на которых в первую очередь рассчитано настоящее изобретение. Оптимальная продолжительность реакций согласно схемам, препаративным примерам, примерам и методикам может быть установлена на основании наблюдения за протеканием реакции с помощью традиционных хроматографических методов. Кроме того, согласно настоящему изобретению реакции проводят в инертной атмосфере, например в атмосфере аргона или азота. Выбор растворителя в общем случае не является особенно важным; важно лишь, чтобы используемый растворитель являлся инертным в ходе данной реакции и обеспечивал достаточную для эффективного протекания реакции солюбилизацию реагентов. Соединения предпочтительно выделяют и очищают до того, как они начинают вступать в дальнейшие реакции. Некоторые соединения могут быть кристаллизоваться из реакционного раствора в процессе их образования и могут быть выделены с помощью фильтрования, или используемый в ходе реакции растворитель может быть удален путем экстракции, выпаривания или декантации. Промежуточные соединения и конечные продукты формулы I при необходимости могут дополнительно подвергаться очистке с помощью общепринятых способов, таких как перекристаллизация или хроматография с твердым носителем, таким как силикагель или оксид алюминия. Для специалиста в данной области техники очевидно, что некоторые заместители требуют особых условий проведения реакции. В такие соединения в ходе синтеза могут быть введены защитные группы,или указанные соединения могут быть модифицированы иным подходящим образом по способам, известным в данной области техники. Термины и аббревиатуры, используемые в конкретных схемах препаративных примерах, примерах и методиках, используются в их традиционном значении, если не указано иное. Например, в настоящем описании используются термины, имеющие следующие значения: "psi" означает фунты на квадратный дюйм; "TLC" относится к тонкослойной хроматографии; "HPLC" относится к высокоэффективной жидкостной хроматографии; "Rf" относится к коэффициенту удерживания; "Rt" относится ко времени удерживания; означает частей на миллион относительно тетраметилсилана;"MS" относится к масс-спектрометрии, масс-спектры обозначены [М+Н], если не указано иное;"MS(APCi) относится к масс-спектрометрии с химической ионизацией при атмосферном давлении; "UV" относится к ультрафиолетовой спектрометрии; "1 Н ЯМР" относится к протонному ядерному магнитному-8 016959 резонансу; "LCMS" относится к жидкостной хроматографии/масс-спектрометрии; "GC/MS" относится к газовой хроматографии/масс-спектрометрии; "IR" относится к инфракрасной спектрометрии, а указанные максимумы поглощения на ИК-спектрах представляют собой лишь некоторые наиболее интересные из всех имеющихся максимумов; "RT" означает комнатную температуру; "THF" означает тетрагидрофуран; "LAH" означает литийалюминий гидрид; "LDA" означает диизопропиламид лития; "DMSO" означает диметилсульфоксид; "DMF" означает диметилформамид; "EtOAc" означает этилацетат; "Pd-C" означает платину-на-углероде; "DCM" означает дихлорметан; "DMAP" означает диметиламинопиридин;[1,1'-бис(дифенилфосфино)ферроцен)дихлорпалладий(II), "EDCI" означает гидрохлорид N-этил-N'-(3 диметиламинопропил) карбодиимида, "DBU" означает 1,8-диазабицикло[5.4.0]ундецен-7, "TBSCl" означает трет-бутилдиметилсиланилоксиметилхлорид, "NBS" означает N-бромсукцинимид, "TsOH" означает п-толуолсульфокислоту, "DCE" означает дихлорэтан, "DAST" означает (диэтиламино)сульфотрифторид,"ЕА/Н" означает смесь этилацетата/гексана, "Pd2(dba)3" означает бис(дибензилиденацетон)палладий,"BINAP" означает 2,2'-бис(дифенилфосфино)-1,1'-динафталин, "NMP" означает N-метилпирроллидин,"TMSCN" означает триметилсилилцианид, "TBAF" означает тетрабутиламмонийфторид, "Tf2O" означает трифторметансульфоновый ангидрид, "TBSO" означает трет-бутилдиметилсиланилокси, "OTf" означает трифторметансульфонат, MeTi(Oi-Pr)3 означает метилтитантриизопропоксид, "BBr3" означает трибромид бора, "PBr3" означает трибромид фосфора, "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0),"ОАс" означает ацетат, "DME" означает диметилэтан, "Et2O" означает диэтиловый эфир, "(Ph3P)4Pd" означает тетракис(трифенилфосфин)палладий(0), "DMFDMA" означает N,N-диметилформамид диметилацеталь, "Et3N" означает триэтиламин, "tBu" означает трет-бутил, "DIPEA" означает диизопропилэтиламин, "EDC" означает -(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорид, "НОАс" означает уксусную кислоту, "boc" означает трет-бутоксикарбонил. В структурных формулах "Ph" означает фенил,"Me" означает метил, "Et" означает этил, "Bn" означает бензил, "МеОН" означает метанол, "OTf" означает трифторметансульфонат, "TIPSO" означает триизопропилсиланилокси, "TBSO" означает третбутилдиметилсиланилокси. Представленные в настоящем описании примеры даны с целью иллюстрации настоящего изобретения и никоим образом не ограничивают объем настоящего изобретения. Названия соединений в препаративных примерах и примерах получены с помощью AutoNom 2.2 в ChemDraw Ultra или AutoNom 2000 вH ЯМР спектры соединений в указанном растворителе были получены с помощью спектрометраVarian INOVA 400 MHz. LCMS были получены с помощью Agilent HP1100, оборудованного массспектрометром. В качестве неподвижной фазы использовали Waters Xterra C18 (2,150 мм, 3,5 мкм); согласно стандартному способу использовали градиент от 5 до 100% ацетонитрила/метанола (50:50) с добавлением 0,2% формиата аммония в течение 3,5 мин, после чего проводили выдержку при 100% компонента В в течение 0,5 мин при температуре в колонке, равной 50 С, и расходе 1,0 мл/мин. Другой стандартный способ предусматривает применение градиента от 5 до 100% ацетонитрила/метанола(50:50) с добавлением 0,2% формиата аммония в течение 7,0 мин, после чего проводили выдержку при 100% компонента В в течение 1,0 мин при температуре в колонке, равной 50 С, и расходе 1,0 мл/мин. Дополнительно проводили MS анализ с помощью Agilent MSD (прибор с обратной связью) согласно стандартному методу проточно-инъекционного анализа (Flow injection Analysis, FIA) без колонки при расходе 80% МеОН и 6,5 мМ ацетата аммония, равном 0,5 мл/мл, при этом время анализа составляло 30 с. Схема А Согласно схеме А в фенол 1, который может содержать заместители, вводят защитную группу (например, TBSCl) с образованием соединения 2. Соединение 2 далее превращают в альдегид 3. Соединение 3 взаимодействует с соединением, содержащим защитную группу (Pg) и уходящую группу (Lg), с образованием простого эфира 4. Защитная группа может представлять собой -СН 3 или -СН 2-фенил, а уходя-9 016959 щая группа может представлять собой мезилат или галоген. Предпочтительно Lg-Pg-соединение представляет собой 1-СН 3 или Br-СН 2-фенил. Полученный альдегид далее восстанавливают до спирта 5 и далее превращают в соединение 6. Предпочтительно соединение 5 галогенируют PBr3 с образованием 2 бромметилпроизводного. Введение и удаление защитных групп в соединения для получения соединений формулы I и других соединений хорошо известны специалисту в данной области техники и описаны в литературе (см., например, Greene and Wuts, Protective Groups in Organic Synthesis, Third Edition, John Wiley and Sons Inc.,1999) . Схема В На схеме В представлен стереоселективный синтез, приводящий к образованию промежуточного соединения 10. Соединение 8 получают ацилированием коммерчески доступного (R)-4 бензилоксазолидин-2-она 4-пентеноилхлоридом. Полученное соединение далее алкилируют соединением 6, которое может дополнительно содержать заместители (см. схему А) с образованием соединения 9. Соединение 9 далее окисляют с образованием в качестве промежуточного соединения альдегида 10 с помощью озона и трифенилфосфина или тетроксида осмия и окислителя, такого как метаперйодат натрия. Препаративный пример 1. 2,6-Дихлор-4-гидроксибензальдегид 3,5-Дихлорфенол (1 кг, 6,13 моль) растворили в 3 л диметилформамида (ДМФ) и охладили до 0 С. Добавили имидазол (918,74 г, 6,75 моль), а затем трет-бутилдиметилсилилхлорид (1017,13 г, 6,75 моль). Полученную смесь нагрели до комнатной температуры и перемешивали в течение 15 мин. Смесь вылили в воду (6 л) и экстрагировали простым эфиром (4 л). Органический слой дважды промыли водой, 10% водным раствором хлорида лития, затем насыщенным солевым раствором и сушили над сульфатом натрия, после чего фильтровали и концентрировали под вакуумом с образованием трет-бутил-(3,5 дихлорфенокси)диметилсилана (1700 г) в виде маслянистой жидкости. трет-Бутил-(3,5-дихлорфенокси)диметилсилан (425 г, 1,5 моль) растворили в 4 л осушенного тетрагидрофурана и охладили до -68 С. Медленно добавили 1,1 экв втор-бутиллития (103,1 г, 1,61 моль) при -68 С(1,75 ч). По окончании добавления реакционную смесь перемешивали при -70 С в течение 30 мин. Добавили диметилформамид (168,5 г, 2,3 моль) и перемешивали реакционную смесь при -70 С в течение 1 ч. Добавили 1 М раствор соляной кислоты в воде (3,5 л) и реакционную смесь оставили нагреваться до комнатной температуры. Реакционную смесь вылили в простой эфир (5 л), промыли водой, затем насыщенным солевым раствором, после чего сушили над сульфатом натрия и концентрировали под вакуумом с образованием твердого вещества оранжевого цвета. Полученное вещество растерли в порошок с добавлением холодного дихлорметана и отфильтровали, получив 250 г (80%) твердого вещества бледно-желтого цвета. Препаративный пример 2. 2,6-Дихлор-4-метоксибензальдегид 2,6-Дихлор-4-гидроксибензальдегид (120 г, 628,24 ммоль) объединили с карбонатом калия (173,65 г, 1256,5 ммоль) в 900 мл диметилформамида и обработали йодметаном (107 г, 753,9 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Отфильтровали частицы твердого вещества и вылили смесь в 6 л воды. Твердое вещество отфильтровали, несколько раз промыли водой,высушили на воздухе и растворили в этилацетате; промыли водой, затем насыщенным солевым раствором и сушили над сульфатом натрия. Затем отфильтровали и концентрировали под вакуумом до объема 100 мл, поскольку при дальнейшем концентрировании твердое вещество начинает разлагаться. Твердое вещество отфильтровали и сконцентрировали фильтрат с образованием второй порции продукта. Промыли гексаном, объединили все полученные твердые вещества и сушили под вакуумом с образованием 112,3 г твердого вещества грязно-белого цвета: 1 Н ЯМР (400 МГц, CDCl3)10,41 (с, 1 Н), 6,90 (с, 2 Н), 3,87 (с, 3 Н).- 10016959 Препаративный пример 3. 2,6-Дихлор-4-бензилоксибензальдегид Раствор смеси 2,6-дихлор-4-гидроксибензальдегида (250 г, 1,3 моль) и карбоната калия (361,8 г,2,62 моль) в 2 л диметилформамида обработали бензилбромидом (268,64 г, 1,57 моль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Отфильтровали частицы твердых веществ и вылили смесь в 12 л воды. Отфильтровали частицы твердых веществ, несколько раз промыли водой, высушили на воздухе и растворили в этилацетате. Раствор осушали над сульфатом магния,фильтровали и концентрировали под вакуумом до объема 1,5 л, после чего оставляли на ночь, а затем фильтровали. Твердое вещество промывали минимальным количеством гексана и сушили под вакуумом. Фильтрат концентрировали под вакуумом и растерли в порошок с добавлением гексана с образованием второй порции продукта, объединение которой с первой порцией обеспечивает получение 245 г кристаллов белого цвета. Указанную операцию повторили с образованием третьей порции в количестве 80 г в виде светлого желто-коричневого порошка (общий выход составил 88%): 1 Н ЯМР (400 МГц, ДМСО-d6)10,26 (с, 1 Н), 7,43 (м, 5 Н), 7,28 (с, 2 Н), 5,25 (с, 2 Н). Препаративный пример 4. (2,6-Дихлор-4-метоксифенил)метанол 2,6-Дихлор-4-метоксибензальдегид (112 г, 546 ммоль) суспендировали в 1500 мл этанола и охладили на ледяной бане до 7 С. Добавили боргидрид натрия (20,67 г, 546 ммоль) небольшими порциями с образованием раствора. Убрали ледяную баню и перемешивали реакционную смесь в течение 2 ч. Осторожно добавили реакционную смесь к насыщенному раствору хлорида аммония (4 л) и перемешивали до полного прекращения реакции. Затем провели экстракцию дихлорметаном (31 л) и сушили смешанный органический экстракт над сульфатом натрия, после чего отфильтровали и высушили под вакуумом, получив 113 г светлого желто-коричневого твердого вещества: 1 Н ЯМР (400 МГц, CDCl3)6,86 (с, 2 Н), 4,86 (с, 2 Н), 3,78 (с, 3 Н), 2,07 (с, 1 Н). Препаративный пример 5. (2,6-Дихлор-4-бензилоксифенил)метанол Титульное соединение было получено по существу в соответствии со способом согласно препаративному примеру 4. ЯМР (ДМСО-d6)7,38 (м, 4 Н), 7,33 (м, 1 Н), 7,12 (с, 2 Н), 5,14 (с, 2 Н), 5,05 (т, 1 Н), 4,59 (д, 2 Н). Препаративный пример 6. 2-Бромметил-1,3-дихлор-5-метоксибензол Растворили (2,6-дихлор-4-метоксифенил)метанол (113 г, 545,76 ммоль) в 1200 мл осушенного THF и охладили до 0 С в атмосфере азота. Добавили PBr3 (59,1 г, 218,3 ммоль) в атмосфере азота и перемешивали при 0 С в течение 30 мин. Вылили смесь в насыщенный водный раствор NaHCO3 и экстрагировали EtOAc. Высушили и сконцентрировали под вакуумом, получив 129,4 г продукта в виде твердого вещества грязно-белого цвета. ЯМР (CDCl3)6,88 (с, 2 Н), 4,73 (с, 2 Н), 3,79 (с, 3 Н). Препаративный пример 7. 2-Бромметил-1,3-дихлор-5-бензилоксибензол Титульное соединение было получено по существу в соответствии со способом согласно препаративному примеру 6 с выходом 89%. ES MS (m/z): 347 (М + 1). Препаративный пример 8. (R)-4-Бензил-3-пент-4-еноилоксазолидин-2-он Круглую 3-горлую колбу вместимостью 12 л, снабженную механическим перемешивающим устройством, входным отверстием для датчика температуры, входным отверстием для подачи азота и капельной воронкой вместимостью 1 л, продували азотом в течение 20 мин, после чего добавили (R)-4 бензил-2-оксазолидинон (250 г, 1,41 моль). Разбавили тетрагидрофураном (THF) (1,8 л) и охладили на бане из сухого льда/ацетона до температуры реакционной смеси, равной -74 С. С помощью полой трубки перенесли 1,6 М раствор в гексане н-бутиллития (970 мл, 1,552 моль) в капельную воронку и добавляли оксазолидинон с такой скоростью, чтобы температура реакционной смеси не превышала -65 С. По окончании добавления реакционную смесь при перемешивании оставляли охлаждаться на охлаждающей бане в течение 30 мин. Перенесли 4-пентеноилхлорид (175 мл, 1,585 моль) в капельную воронку и добавляли по каплям к анионному раствору в течение 25 мин. Перемешивали реакционную смесь в течение 45 мин на охлаждающей бане. Убирали баню и перемешивали реакционную смесь в течение 18 ч, при этом температура реакционной смеси постепенно приближалась к комнатной. Разбавили смесь 1 н. водным раствором соляной кислоты (1,5 л) и диэтиловым эфиром (1 л). Разделили слои и промыли органическую фазу водой (21 л), а затем насыщенным солевым раствором (1 л). Экстрагировали смесь промывных вод простым эфиром (1 л). Высушили объединенные органические фазы над безводным сульфатом магния, отфильтровали и сконцентрировали, получив 390 г светлого желто-коричневого масла. Полученное вещество очищали хроматографическим методом на силикагеле с использованием гексана:этилацетата,получив 345 г (94,5%) чистого вещества в виде масла желтого цвета. Препаративныйпример 9.(1,8 л) перемешали в круглой 3-горлой колбе вместимостью 12 л, снабженной датчиком температуры,входным отверстием для указанного датчика/подачи азота и капельной воронкой, в атмосфере азота и охладили до -75 С. Перенесли 1 М LiHMDS (1,6 л) в капельную воронку и проводили добавление с такой- 11016959 скоростью, чтобы температура реакционной смеси не превышала -60 С. По завершении добавления реакционную смесь перемешивали при -25 С в течение 30 мин, а затем охладили до примерно -60 С. По достижении указанной температуры добавили твердый 2-бромметил-1,3-дихлор-5-бензилоксибензол отдельными порциями в течение 5 мин. По завершении добавления реакционный сосуд перенесли на ацетоновую баню с температурой -10 С и выдерживали реакционную смесь при температуре ниже 10 С в течение 1 ч. Смесь охладили до 0 С, после чего погасили реакцию добавлением 2 л 1 н. водного раствора соляной кислоты. Смесь перенесли в делительную воронку вместимостью 22 л и разбавили 2,5 л воды и 2 л простого эфира. Слои разделили и экстрагировали водный слой простым эфиром. Объединенные органические фазы сушили над безводным сульфатом магния, отфильтровали и сконцентрировали, получив 800 г вязкого масла. Полученное вещество очищали хроматографическим методом на силикагеле с использованием гексана:этилацетата, получив 597 г (86%) вещества в виде бесцветного масла. Препаративный пример 10. (R)-4-R)-4-Бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6 дихлорбензил)-4-оксобутиральдегид Смесь (R)-4-бензил-3-[(S)-2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-он (100 г,190,68 ммоль) и дихлорметана (800 мл) охладили до -74 С. Через реакционную смесь барботировали озон, производимый генератором озона А-113 при значении расхода, равном 75%, при этом в качестве газа-носителя выступал воздух. Расход барботируемого газа составлял 5 куб.футов/мин, при этом барботирование проводили до появления голубой окраски раствора (в течение примерно 3 ч) . Добавили трифенилфосфин (60 г, 228,8 ммоль), растворенный в 200 мл дихлорметана, и оставили смесь при перемешивании на всю ночь, при этом температура смеси с течением времени постепенно приближалась к комнатной. Полученный раствор сконцентрировали под вакуумом и очищали хроматографическим методом на силикагеле с использованием градиента от 20 до 50% этилацетата в гексане, получив 82,1 г (82%) продукта в виде белой пены: MS (m/z): 526 (М+). Альтернативный способ получения (R)-4-R)-4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси 2,6-дихлорбензил)-4-оксобутиральдегида Смесь (R)-4-бензил-3-[(S)2-(4-бензилокси-2,6-дихлорбензил)пент-4-еноил]оксазолидин-2-она (0,96 г, 1,8 ммоль), THF (21 мл) и воды (7 мл) обработали 2,5% раствором тетроксида осмия в трет-бутаноле(46 мг, 0,18 ммоль). Добавили перйодат натрия (1,17 г, 5,5 ммоль) и перемешивали реакционную смесь в течение 4 ч при комнатной температуре. Погасили реакционную смесь водой и провели экстракцию этилацетатом. Органическую фазу промыли 1 н. водным раствором тиосульфата натрия, а затем насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния, отфильтровали и сконцентрировали под вакуумом. Полученный неочищенный продукт очищали методом хроматографии на силикагеле с использованием гексана:этилацетата в качестве элюента. Фракции, содержащие продукт, сконцентрировали под вакуумом, получив 0,46 г (48%) целевого продукта.CH2Cl2 (100 мл) обработали НОАс (0,4 мл, 8,0 ммоль). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Обработали реакционную смесь триацетоксиборгидридом натрия (6,8 г, 32 ммоль) и перемешивали еще в течение 4 ч при комнатной температуре. Погасили реакцию водой и отделили органический слой. Промыли органическое вещество насыщенным солевым раствором и сушили над MgSO4, затем отфильтровали и удалили растворитель. Полученный неочищенный продукт очищали методом хроматографии на силикагеле с использованием гексана:этилацетата в качестве элюента. Удалили растворитель и получили 1,8 г (48%) целевого продукта. MS (m/e): 468 (M+1). Препаративный пример 12.(R)-3-(2,6-Дихлор-4-гидроксибензил)-1-(4,4-дифторциклогексил)пирролидин-2-он Раствор 3-(4-бензилокси-2,6-дифторбензил)-1-(4,4-дифторциклогексил)пирролидин-2-она (1,8 г, 3,8 ммоль) в EtOAc (30 мл) обработали гидроксидом палладия-на-угле (0,2 г) и пропускали через раствор водород. Реакционную смесь перемешивали в течение ночи в атмосфере водорода при давлении, равном 1 атм. Отфильтровали реакционную смесь через целит для удаления катализатора. Удалили растворитель и получили 1,4 г (97%) целевого продукта. MS (m/e): 378 (M+1). Препаративный пример 13. Сложный эфир трифторметансульфоновой кислоты и 3,5-дихлор-4-[(R)1-(4,4-дифторциклогексил)-2-оксопирролидин-3-илметил]фенила Раствор 1-(4,4-дифторциклогексил)-3-(2,6-дифтор-4-гидроксибензил)пирролидин-2-она (1,4 г, 3,7 ммоль) в пиридине (15 мл) охладили до 0 С и обработали ангидридом трифторметансульфоновой кислоты (0,9 мл, 5,6 ммоль). Реакционной смеси дали охладиться до комнатной температуры. После перемешивания в течение 2 ч реакцию погасили 1 н. HCl и провели экстракцию EtOAc. Органическое вещество промыли насыщенным солевым раствором, сушили над MgSO4 и отфильтровали. После удаления растворителя получили 1,8 г (95%) целевого продукта. MS (m/e): 510 (M+1). Препаративный пример 14. Метиловый эфир 3',5'-дихлор-4'-[(R)-1-(4,4-дифторциклогексил)-2 оксопирролидин-3-илметил]бифенил-4-карбоновой кислоты Раствор эфира трифторметансульфоновой кислоты и 3,5-дихлор-4-[(R)-1-(4,4-дифторциклогексил)2-оксопирролидин-3-илметил]фенила (1,8 г, 3,5 ммоль), 4-метоксикарбонилфенилборной кислоты (1,3 г,7,0 ммоль) и тетракис(трифенилфосфин)палладия(0) (0,4 г, 0,4 ммоль) в DME (20 мл) обработали 2 М водным раствором K2CO3 (5,2 мл). Реакционную смесь нагрели до 80 С и перемешивали в течение ночи. Охладили реакционную смесь и погасили реакцию 1 н HCl. Провели экстракцию водной фазы EtOAc. Промыли органическое вещество насыщенным солевым раствором, просушили над MgSO4 и отфильтровали. Полученный неочищенный продукт очищали методом хроматографии на силикагеле с использованием гексана:этилацетата в качестве элюента. После удаления растворителя получили 1,0 г (57%) целевого продукта. MS (m/e): 498 (M+1). Препаративный пример 15. 3',5'-Дихлор-4'-[(R)-1-(4,4-дифторциклогексил)-2-оксопирролидин-3 илметил]бифенил-4-карбоновая кислота Раствор метилового эфира 3',5'-дихлор-4'-[(R)-1-(4,4-дифторциклогексил)-2-оксопирролидин-3 илметил]бифенил-4-карбоновой кислоты (препаративный пример 14) (1,0 г, 2,0 ммоль) в THF/воде (15 мл/5 мл) обработали 2 М водным раствором LiOH (3,0 мл). Реакционную смесь перемешивали в течение ночи при комнатной температуре. Погасили реакцию 1 н. HCl и провели экстракцию EtOAc. Полученное органическое вещество промыли насыщенным солевым раствором, просушили над MgSO4 и отфильтровали. После удаления растворителя получили 0,97 г (100%) целевого продукта. MS (m/e): 482 (M+1). Согласно схеме Е соединение 24 взаимодействует с метансульфонилхлоридом с образованием соединения 25. В соединении 25 мезилатная группа находится в транс-конфигурации. Соединение 25 взаимодействует с TBAF 5H2O с образованием цис-4-фторциклогексила 26. Препаративный пример 16.(R)-4-R)-4-бензил-2-оксооксазолидин-3-ил)-3-(4-бензилокси-2,6-дихлорбензил)-4 оксобутиральдегид (препаративный пример 10) (3,054 г, 5,8 ммоль), транс-4-аминоциклогексанол (1,35 г,11,6 ммоль), NaBH(OAc)3 (5,18 г, 23,21 ммоль) и уксусную кислоту (0,63 мл, 11,2 ммоль) в 50 мл 1,2 дихлорэтана и перемешивали в течение 12 ч при комнатной температуре. Погасили реакцию насыщенным раствором NaHCO3 и провели экстракцию этилацетатом. Промыли полученный экстракт насыщенным солевым раствором, просушили над сульфатом магния, отфильтровали и сконцентрировали. С по- 14016959 мощью флэш-хроматографии получили 1,39 г (54%) титульного соединения: масс-спектр (apci) m/z=448(R)-3-(4-Бензилокси-2,6-дихлорбензил)-транс-1-(4-гидроксициклогексил)пирролидин-2-он (препаративный пример 16) (1,37 г, 3,07 ммоль) смешали с имидазолом (0,527 г, 68,08 ммоль) в 10 мл осушенного DMF. Добавили по каплям триизопропилсилилхлорид (0,81 мл, 3,07 ммоль) и перемешивали при комнатной температуре в течение 5 ч. Погасили реакцию 1 н. HCl и провели экстракцию этилацетатом. Полученный экстракт промыли NaHCO3 и насыщенным солевым раствором. Просушили над сульфатом магния, отфильтровали и сконцентрировали. С помощью флэш-хроматографии получили 1,83 г (99%) титульного соединения: масс-спектр (apci) m/z=604 (M+H). Препаративный пример 18.(R)-3-(4-бензилокси-2,6-дихлорбензил)-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-2-она (препаративный пример 17) (1,83 г, 3,03 ммоль) с гидроксидом палладия (20% на угле) (0,200 г, 10 мас.%) в 100 мл этилацетатата. Через раствор в течение 5 мин барботировали водород при перемешивании при комнатной температуре. Реакционную смесь перемешивали в атмосфере водорода в течение 5 ч, затем отфильтровали через целит и удалили растворитель, получив 1,42 г титульного соединения (91%). Масс-спектр (apci) m/z=514 (M+H). Препаративный пример 19. Сложный эфир трифторметансульфоновой кислоты и 3,5-дихлор-4-[(R)2-оксо-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-3-илметил]фенила Растворили(R)-3-(2,6-дихлор-4-гидроксибензил)-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-2-он (препаративный пример 18) (1,42 г, 2,78 ммоль) в 10 мл осушенного пиридина при 0 С. Добавили по каплям ангидрид трифторметансульфоновой кислоты (0,71 мл, 4,17 ммоль). Перемешивали при комнатной температуре в течение 2 ч. Погасили реакцию 1 н. HCl и провели экстракцию этилацетатом. Полученный экстракт промыли 1 н. HCl, NaHCO3 и насыщенным солевым раствором. Просушили над сульфатом магния, отфильтровали и сконцентрировали. С помощью флэш-хроматографии получили 1,70 г (96%) титульного соединения: масс-спектр (apci) m/z=646 (M+H). Препаративный пример 20. Метиловый эфир 3',5'-дихлор-4'-[(R)-2-оксо-транс-1-(4 триизопропилсиланилоксициклогексил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты Смешали сложный эфир трифторметансульфоновой кислоты и 3,5-дихлор-4-[(R)-2-оксо-транс-1-(4 триизопропилсиланилоксициклогексил)пирролидин-3-илметил]фенила (препаративный пример 19) (1,70 г, 2,64 ммоль), (4-метоксикарбонилфенил)борную кислоту (0,57 6 г, 3,17 ммоль), тетракис(трифенилфосфин)палладий(0) (0,305 г, 0,26 ммоль) и 1,32 мл 2 М раствора K2CO3 в DME (10 мл). Перемешивали в течение 12 ч при 80 С. Погасили реакцию водой и провели экстракцию этилацетатом. Полученный экстракт промыли насыщенным солевым раствором и просушили над сульфатом магния. С помощью флэш-хроматографии получили 1,32 г (80%) титульного соединения: масс-спектр (apci)m/z=632 (M+H). Препаративный пример 21. 3',5'-Дихлор-4'-[(R)-2-оксо-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-3-илметил]бифенил-4-карбоновая кислота Метиловый эфир 3',5'-дихлор-4'-[(R)-2-оксо-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-3-илметил]бифенил-4-карбоновой кислоты (препаративный пример 20) (1,32 г,2,09 ммоль) добавили к МеОН (10 мл) и 1 н. раствору NaOH (10 мл). Перемешивали в течение 3 ч при нагревании с обратным холодильником. Удалили большую часть растворителя и погасили реакцию 1 нHCl. Отфильтровали образовавшийся белый осадок и промыли осадок на фильтре водой. Высушили осадок, получив 0,95 г (74%) титульного соединения: масс-спектр (apci) m/z=617 (M+H). Препаративный пример 22. (R)-3-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил 4-илметил]-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин-2-он Смешали 3',5'-дихлор-4'-[(R)-2-оксо-транс-1-(4-триизопропилсиланилоксициклогексил)пирролидин 3-илметил]бифенил-4-карбоновую кислоту (препаративный пример 21) (0,94 г, 1,52 ммоль), EDCI (0,358 г, 1,83 ммоль), N-метилморфолин (0,50 мл, 4,57 ммоль), НОВТ (0,511 г, 1,52 ммоль) и гидрохлорид 4 трифторметилпиперидина (0,466 г, 3,05 ммоль) в CH2Cl2 (15 мл) . Перемешивали в течение 12 ч при комнатной температуре. Погасили реакцию 1 н. HCl и провели экстракцию этилацетатом. Промыли полученный экстракт NaHCO3 и насыщенным солевым раствором. Просушили над сульфатом магния, отфильтровали и сконцентрировали. С помощью флэш-хроматографии получили 0,586 г (51%) титульного соединения: масс-спектр (apci) m/z=753 (M+H). Препаративный пример 23. (R)-3-[3,5-Дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил 4-илметил]-транс-1-(4-гидроксициклогексил)пирролидин-2-он Смешали (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-транс 1-(4-триизопропилсиланилоксициклогексил)пирролидин-2-он (препаративный пример 22) (0,548 г, 0,78 ммоль) и TBAF (1,55 мл, 1,55 ммоль) в 15 мл осушенного THF. Перемешивали при комнатной температуре в течение 2 ч. Погасили реакцию насыщенным раствором NaHCO3, провели экстракцию этилацета- 15016959 том и промыли насыщенным солевым раствором. Просушили над сульфатом магния, отфильтровали и сконцентрировали. С помощью флэш-хроматографии получили 0,448 г (97%) титульного соединения: масс-спектр (apci) m/z=596 (M+H). Препаративный пример 24. Сложный эфир метансульфоновой кислоты и транс-4-(R)-3-[3,5 дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-оксопирролидин-1-илциклогексана Растворили(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]транс-1-(4-гидроксициклогексил)пирролидин-2-он (препаративный пример 23) (0,419 г, 0,70 ммоль) в 10 мл осушенного дихлорметана при 0 С. Добавили триэтиламин (0,18 мл, 1,41 ммоль), а затем метансульфохлорид (0,06 мл, 0,77 ммоль). Перемешивали при комнатной температуре в течение 5 ч. Погасили реакцию 1 н. HCl и провели экстракцию этилацетатом. Промыли полученный экстракт 1 н. HCl, NaHCO3 и насыщенным солевым раствором. Просушили над сульфатом магния, отфильтровали и сконцентрировали. Отфильтровали через небольшой толщины слой диоксида кремния, получив 0,45 г (95%) титульного соединения: масс-спектр (apci) m/z=675 (M+H). Пример 1. (R)-3-3,5-дихлор-4'-[4-(2-фторэтил)пиперазин-1-карбонил]бифенил-4-илметил-1-(4,4 дифторциклогексил)пирролидин-2-он(0,2 г,0,4 ммоль),1-(2 фторэтил)пиперазиндитрифторуксусной кислоты (0,18 г, 0,5 ммоль), гидрохлорида N-(3 диметиламинопропил)-N-этилкарбодиимида (0,09 г, 0,5 ммоль), 1-гидроксибензотриазола (0,17 г, 0,5 ммоль) и 4-метилморфолина (0,18 мл, 1,7 ммоль) в CH2Cl2 (10 мл) перемешивали при комнатной температуре в течение ночи. Погасили реакцию 1 н. HCl и провели экстракцию EtOAc. Промыли полученное органическое вещество насыщенным солевым раствором, просушили над MgSO4 и отфильтровали. Очищали полученный неочищенный продукт хроматографическим методом на силикагеле с использованием в качестве элюента гексана:EtOAc. После удаления растворителя получили 0,09 г (39%) целевого продукта. MS (m/e): 596 (M+1). Представленные в табл. 1 в качестве примеров соединения были получены по существу в соответствии со способом согласно примеру 1, за исключением 1-(2-фторэтил)пиперазиндитрифторуксусной кислоты, при получении которой реактив был заменен на указанный в столбце 3 таблицы. Таблица 1TBAF3H2O (0,436 г, 1,36 ммоль) растворили в 5 мл ацетонитрила. Добавили воду (0,05 мл, 2,72 ммоль) и перемешивали в течение 10 мин. Добавили сложный эфир метансульфоновой кислоты и транс 4-(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-2-оксопирролидин 1-илциклогексана (препаративный пример 24) (0,458 г, 0,68 ммоль). Перемешивали при 80 С в течение 12 ч. Погасили реакцию насыщенным раствором NaHCO3 и провели экстракцию этилацетатом. Промыли полученный экстракт насыщенным солевым раствором, просушили над сульфатом магния, отфильтровали и сконцентрировали. С помощью флэш-хроматографии получили 0,036 г (9%) титульного соединения: масс-спектр (apci) m/z=599 (M+H). В следующем разделе представлен ферментный и функциональный анализы, помогающие охарактеризовать соединения согласно настоящему изобретению. Ферментативный анализ 11-HSD1 типа Активность человеческой 11-HSD1 типа измеряли при помощи флуоресцентного анализа, оценивая выработку НАДФН (NADPH, nicotinamide adenine dinucleotide phosphate, reduced form; восстановленный никотинамидадениндинуклеотидфосфат). Твердые соединения растворяли в ДМСО до концентрации 10 мМ. Двадцать микролитров каждого раствора затем переносили в колонку 96-луночного полипропиленового планшета марки Nunc, где производили дальнейшее разбавление в 50 раз с последующим двукратным титрованием, десять раз в поперечном направлении планшета, с добавлением дополнительного количества ДМСО и использованием автоматизированной системы Tecan Genesis 200, затем планшеты переносили в систему Tecan Freedom 200, снабженную 96-луночной головкой Tecan Temo и планшетным анализатором Ultra 384. Реагенты помещали в 96-луночные полипропиленовые планшеты Nunc и индивидуально распределяли по черным 96-луночным планшетам High Efficiency от Molecular DevicesPrionex, 0,1% Тритона Х 100), 3 мкл/лунка воды в лунки, содержащие соединение, или 3 мкл в контрольные и стандартные лунки, 6 мкл/лунка рекомбинантного человеческого фермента 11-HSD первого типа,2 мкл/лунка раствора соединения. Для окончательного определения процентного ингибирования добавляли ряд лунок, которые представляли собой минимум и максимум определения: один набор содержал субстрат с 667 мкМ карбеноксолона (фон), а другой набор содержал субстрат и фермент, но не содержал тестируемого соединения (максимальный сигнал). Конечные концентрации в ДМСО составляли 0,5% для всех соединений, контрольных и стандартных. Затем планшеты на 15 с помещали в шейкер с помощью манипулятора Тесаn, а затем закрывали и помещали в накопитель для инкубации в течение 3 ч при комнатной температуре. По завершении инкубации манипулятор Тесаn извлекал каждый планшет по отдельности из накопителя и помещал их в положение, в котором производили добавление 5 мкл/лунка раствора карбеноксолона с концентрацией 250 мкМ для прекращения ферментной реакции. Затем планшеты встряхивали еще в течение 15 с, а затем помещали в анализатор планшетов Ultra 384 (355 ЕХ/4 60 ЕМ), при помощи которого определяли флуоресценцию НАДФН. Данные, полученные для соединений, исследованных в испытании 11-HSD1, указаны ниже. Соединения, предложенные в настоящем изобретении, можно исследовать на селективность по от- 18016959 ношению к 11-HSD2 при помощи теста, аналогичного описанному для 11-HSD1, но проводимого с использованием фермента 11-HSD2. Испытание с использованием фермента 11-HSD2 может быть проведено при помощи способов, рассмотренных в настоящем описании, или способов, известных в данной области техники. Исследование клеток гладкой мускулатуры аорты человека Первичные клетки гладкой мускулатуры аорты человека (AoSMC) культивировали в питательной среде, содержащей 5% FBS при количестве пассажей, равном 6, а затем гранулировали путем центрифугирования и суспендировали при плотности 9104 клеток/мл в среде для количественного определения,содержащей 0,5% FBS и 12 нг/мл hTNF для стимулирования экспрессии 11-HSD1. Клетки высевали на 96-луночные аналитические планшеты для выращивания тканевой культуры с концентрацией 100 мкл/лунка (9103 клеток/лунка) и инкубировали в течение 48 ч при 37 С, 5% CO2. После индуцирования клетки инкубировали в течение 4 ч при 37 С, 5% СО 2 в среде для анализа, содержащей тестируемые соединения, добавляли 10 мкМ кортизона, растворенного в среде для анализа, при концентрации 10 мкл/лунка, и инкубировали в течение 16 ч при 37 С, 5% CO2. Среду из каждой лунки переносят на планшет для последующего анализа кортизола методом конкурентного флуоресцентного иммуноанализа с временным резонансным разрешением. В растворе конъюгат аллофикоцианина и (АРС)-кортизол и свободный кортизол конкурируют за связывание комплекса мышиное антитело к кортизону/европий (Eu)антимышиный IgG. Более высокие уровни свободного кортизола приводят к снижению переноса энергии от европия-IgG к комплексу АРС-кортизол, что снижает флуоресценцию АРС. Интенсивности флуоресценции европия и АРС измеряют, используя LJL Analyst AD. Возбуждение европия и АРС измеряют,используя возбуждение при 360 нм и эмиссионные фильтры на 615 и 650 нм, соответственно. Параметры временного разрешения для европия составляли: время интегрирования - 1000 мкс, задержка - 200 мкс. Параметры АРС составляли: время интегрирования - 150 мкс, задержка - 50 мкс. Интенсивности флуоресценции, измеренные для АРС, модифицировали делением на значение флуоресценции Eu (АРС/Eu). Это отношение затем использовали для определения неизвестной концентрации кортизола, которое осуществляли путем интерполяции с использованием стандартной кривой для кортизола, приведенной в соответствии с 4-параметрическим логистическим уравнением. Указанные концентрации затем использовали для определения активности соединений путем построения зависимости концентрации от % ингибирования, приведенной в соответствии с 4-параметрической кривой и показывающей IC50. Все рассмотренные в настоящем описании в качестве примеров соединения проявляли активность при анализе клеток гладкой мускулатуры человеческой аорты, причем во всех случаях IC50 составляла менее 300 нМ. Данные для некоторых соединений, полученные при анализе гладкомышечных клеток человеческой аорты, показаны ниже: Экспресс-анализ конверсии кортизона in vivo В общем случае, соединения вводили мышам перорально, и спустя определенное время после введения соединения, мышам делали подкожную инъекцию кортизона, и спустя еще некоторое время у мышей брали кровь на анализ. Отделяли сыворотку крови и анализировали методом LC-MS/MS, устанавливая уровень кортизона и кортизола, а затем устанавливали среднее содержание кортизола и процентное замедление в каждой группе испытуемых мышей. В частности, Harlan Sprague Dawley были поставлены самцы мышей C57BL/6, средняя масса тела которых составляла 25 г. Точные массы определяли сразу после получения мышей и затем мышей делили на группы на основании близких масс. Различные дозы соединений готовили в смесях 1 мас.% НЕС, 0,25 мас.% полисорбата 80, 0,05 мас.% противовспенивателя Dow Corning 1510-US на основании средней массы, которую принимали равной 25 г. Соединения вводили перорально, по 200 мкл каждому животному, а затем одному животному вводили подкожно 200 мкл кортизона, 30 мг/кг спустя 1-24 ч после введения соединения. Спустя 10 мин после стимулирования кортизоном, каждое животное забивали путем помещения на 1 мин в камеру, заполненнуюCO2, затем отбирали кровь путем пункции сердца в пробирки, для отделения сыворотки. После полного сворачивания крови в пробирках их центрифугировали при 2500g, 4 С в течение 15 мин, сыворотку переносили в лунки 96-луночных планшетов (блок пробирок Corning Inc., Costar 4410, 1,2 мл, полипро- 19016959 пилен) и замораживали планшеты при -20 С до начала анализа LC-MS/MS. Для анализа образцы сыворотки размораживали и осаждали белок добавлением ацетонитрила, содержащего внутренний стандартd4-кортизола. Образцы перемешивали на вортексе и центрифугировали. Супернатант удаляли и сушили в токе теплого азота. Экстракты вновь растворяли в смеси метанол/вода (1:1) и вводили в систему LCMS/MS. Уровни кортизона и кортизола оценивали в режиме селективного мониторинга реакции с последующей ACPI ионизацией на тройном квадрупольном масс-спектрофотометре. Данные экспресс-анализа конверсии кортизона in vivo, полученные для некоторых соединений,приведены ниже. Фармацевтически приемлемые соли и общие способы их приготовления известны в данной области техники. См., например, P. Stahl, et al., Handbook of pharmaceutical salts: properties, selection and use,(VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts," Journal of Pharmaceutical Sciences, vol. 66, No. 1, January 1977. Соединения, предлагаемые согласно настоящему изобретению, предпочтительно изготавливают в виде фармацевтических композиций, вводимых различными способами. Наиболее предпочтительными являются композиции для перорального введения. Такие фармацевтические композиции и способы их приготовления хорошо известны в данной области техники. См., например, Remington: The science and practice of pharmacy (A. Gennaro, et al., eds., 19th ed., Mack Publishing Co., 1995). Конкретная доза соединения формулы (I) или его фармацевтически приемлемой соли, необходимая для получения эффективного количества, определяемого согласно настоящему изобретению, зависит от конкретных обстоятельств и состояний, подвергаемых лечению. Выбор дозы, способа введения и частоты введения лучше всего поручить лечащему врачу. В общем случае, приемлемые и эффективные дозировки для перорального или парентерального введения составляют приблизительно от 0,1 до 10 мг/кг/сутки, что означает приблизительно от 6 до 600 мг и чаще от 30 до 200 мг для человека. Такие дозировки вводят пациенту, нуждающемуся в лечении, от одного до трех раз в сутки или с такой частотой,которая требуется для лечения заболевания, выбираемого из заболеваний, рассмотренных в настоящем описании. Специалист в области приготовления препаратов может легко выбрать нужную форму и способ введения в зависимости от конкретных характеристик выбранного соединения, нарушения или состояния, подвергаемого лечению, стадии развития нарушения или состояния или других важных факторов.(Remington's Pharmaceutical Sciences, 18th Edition, Mack Publishing Co. (1990. Заявляемые соединения могут быть введены при помощи ряда способов. При проведении лечения пациента, страдающего рассмотренным в настоящем описании заболеванием или склонного к развитию рассмотренного в настоящем описании заболевания, соединение, отвечающее формуле (I), или его фармацевтически приемлемая соль могут быть введены в любой форме или любым способом, который позволяет сделать эффективное количество указанного соединения или соли биодоступным, включая пероральное и парентеральное введение. Например, активные соединения могут быть введены ректально, перорально, ингаляцией или подкожным, внутримышечным, внутривенным, трансдермальным, интраназальным, ректальным, офтальмологическим, местным, сублингвальным, буккальным или другими способами. Для лечения рассмотренных в настоящем описании нарушений предпочтительным является пероральный способ введения. В тех случаях, когда пероральное введение невозможно или не является предпочтительным, композиция может быть приготовлена в форме, подходящей для парентерального введения, например внутривенного, внутрибрюшинного или внутримышечного введения. где пунктирной линией показано место присоединения R5 к остальной части молекулы;R8 представляет собой -(C1-C6)алкил (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R9 представляет собой -Н, -галоген, -СН 3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R10 в каждом случае представляет собой независимо -Н или -галоген;R22 представляет собой -Н; или фармацевтически приемлемая соль указанного соединения. 2. Соединение структурной формулы где пунктирной линией показано место присоединения R5 к остальной части молекулы;R8 представляет собой -(C1-C6)алкил (который может содержать в качестве заместителей от 1 до 3R9 представляет собой -Н, -галоген, -СН 3 (который может содержать в качестве заместителей от 1 до 3 атомов галогена);R10 в каждом случае представляет собой независимо -Н или -галоген;R22 представляет собой -Н. 3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R2 представляет собой атом хлора, фтора или брома и R3 представляет собой атом хлора, фтора или брома. 4. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой где пунктирной линией показано место присоединения R5 к остальной части молекулы. 5. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой где пунктирной линией показано место присоединения R5 к остальной части молекулы. 6. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой где пунктирной линией показано место присоединения R5 к остальной части молекулы. 7. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, отличающееся тем, что R5 представляет собой где пунктирной линией показано место присоединения R5 к остальной части молекулы. 8. Соединение по п.1, представляющее собой (R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1 карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он, или фармацевтически приемлемая соль указанного соединения. 9. Соединение по п.1, представляющее собой (R)-3-[3,5-дихлор-4'-(1,1-диоксо-16-тиоморфолин 4-карбонил)бифенил-4-илметил]-1-(4,4-дифторциклогексил)пирролидин-2-он, или фармацевтически приемлемая соль указанного соединения. 10. Соединение по п.1, выбранное из группы, включающей(R)-3-[3,5-дихлор-4'-(4-трифторметилпиперидин-1-карбонил)бифенил-4-илметил]-цис-1-(4 фторциклогексил)пирролидин-2-он; или фармацевтически приемлемая соль указанного соединения. 11. Фармацевтическая композиция, содержащая соединение по любому из пп.1-10, стереоизомер или фармацевтически приемлемую соль указанного соединения и фармацевтически приемлемый носи- 22016959 тель. 12. Применение соединения по любому из пп.1-10, стереоизомера или фармацевтически приемлемой соли указанного соединения для получения лекарственного средства. 13. Промежуточное соединение для получения соединения по п.8 или 9, представляющее собой
МПК / Метки
МПК: C07D 401/10, A61K 31/4015, C07D 413/10, C07D 207/27, A61P 3/00, C07D 417/10
Метки: типа, пирролидиноны, ингибиторов, 11-бета-гидроксистероиддегидрогеназы, качестве, замещенные
Код ссылки
<a href="https://eas.patents.su/24-16959-zameshhennye-pirrolidinony-v-kachestve-ingibitorov-11-beta-gidroksisteroiddegidrogenazy-1-tipa.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные пирролидиноны в качестве ингибиторов 11-бета-гидроксистероиддегидрогеназы 1 типа</a>
Предыдущий патент: Способ рекультивации отвала и применение полимера при обезвоживании суспензии измельченного минерального материала
Следующий патент: Маятниковый ветродвигатель
Случайный патент: Суспензия, содержащая фибриноген, тромбин и спирт, способ её получения, способ нанесения покрытия, способ сушки покрытия и коллагеновая губка с покрытием












