Замещенные производные индазола и азаиндазола в качестве модуляторов гамма-секретазы
Номер патента: 19702
Опубликовано: 30.05.2014
Авторы: Питерс Серж Мария Алоисиус, Бисхофф Франсуа Пол, Гейсен Хенрикус Якобус Мария, Минн Гарретт Берлонд
Формула / Реферат
1. Соединение формулы (I)
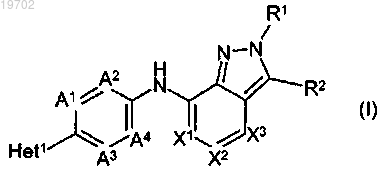
или его стереоизомерная форма,
где R1 представляет собой С1-6алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкилокси, цикло-С3-7алкила, тетрагидропиранила, тетрагидрофуранила и фенила; цикло-С3-7алкил; тетрагидропиранил; тетрагидрофуранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо необязательно замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, С1-4алкила, необязательно замещенного одним или более галогенами, и С1-4алкилокси, необязательно замещенного одним или более галогенами;
R2 представляет собой водород; циано или С1-4алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из С1-4алкилокси, галогена и NR3R4;
X1 представляет собой CH или N;
X2 представляет собой CR5 или N;
R5 представляет собой водород; галоген; циано; С1-4алкилокси или С1-4алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкилокси и NR3R4;
X3 представляет собой CR6 или N;
R6 представляет собой водород; галоген; циано; C1-4алкилокси или С1-4алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкилокси и NR3R4;
каждый R3 представляет собой независимо водород; С1-4алкил или С1-4ацил;
каждый R4 представляет собой независимо водород; C1-4алкил или С1-4ацил;
при условии, что не более чем два из X1, X2 и X3 представляют собой N;
А1 представляет собой CR7 или N, где R7 представляет собой водород; галоген или С1-4алкилокси;
каждый А2, А3 и А4 независимо представляют собой CH или N;
при условии, что не более чем два из А1, А2, А3 и А4 представляют собой N;
Het1 представляет собой 5-членный ароматический гетероцикл, имеющий формулу (а-1), (а-2), (а-3) или (а-4):
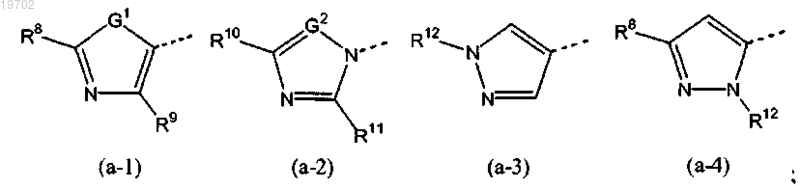
R8 представляет собой водород или С1-4алкил;
R9 представляет собой водород или С1-4алкил;
R10 представляет собой водород или С1-4алкил;
R11 представляет собой водород или С1-4алкил;
R12 представляет собой С1-4алкил;
G1 представляет собой O или S;
G2 представляет собой CH или N,
или его фармацевтически приемлемая аддитивная соль или сольват.
2. Соединение по п.1 или его стереоизомерная форма, где
R1 представляет собой С1-6алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкилокси, цикло-С3-7алкила и фенила; цикло-С3-7алкил; тетрагидропиранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкила и С1-4алкилокси;
R2 представляет собой водород; циано или С1-4алкил, необязательно замещенный одним или более NH2 заместителями;
X2 представляет собой CR5 или N;
R5 представляет собой водород; галоген; циано или C1-4алкил, необязательно замещенный одним или более NH2 заместителями;
X3 представляет собой CH или N;
А2 представляет собой CH или N;
А3 и А4 представляют собой CH;
Het1 представляет собой 5-членный ароматический гетероцикл, имеющий формулу (а-1), (а-2), (а-3) или (а-4);
R10 представляет собой С1-4алкил;
R11 представляет собой водород;
R8 представляет собой водород;
R12 представляет собой С1-4алкил,
или его фармацевтически приемлемая аддитивная соль или сольват.
3. Соединение по п.2 или его стереоизомерная форма, где
R1 представляет собой С1-6алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкилокси, цикло-С3-7алкила и фенила; цикло-С3-7алкил; тетрагидропиранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С1-4алкила и С1-4алкилокси;
R2 представляет собой водород; циано или С1-4алкил, необязательно замещенный одним или более NH2 заместителями;
X2 представляет собой CR5;
R5 представляет собой водород; галоген; циано или C1-4алкил, необязательно замещенный одним или более NH2 заместителями;
X3 представляет собой CH или N;
А2 представляет собой CH или N;
А3 и А4 представляют собой CH;
Het1 представляет собой 5-членный ароматический гетероцикл, имеющий формулу (а-1), (а-2), (а-3) или (а-4);
R10 представляет собой С1-4алкил;
R11 представляет собой водород;
R8 представляет собой водород;
R12 представляет собой С1-4алкил,
или его фармацевтически приемлемая аддитивная соль или сольват.
4. Соединение по п.1 или его стереоизомерная форма, где
R1 представляет собой фенил, замещенный одним С1-4алкилокси заместителем; или R1 представляет собой С1-6алкил, замещенный одним или более галогенами;
R2 представляет собой водород;
X1, X2 и X3 представляют собой CH;
А1 представляет собой CR7, где R7 представляет собой С1-4алкилокси;
А2, А3 и А4 представляют собой CH;
Het1 имеет формулу (а-1) или (а-2);
G1 представляет собой O;
G2 представляет собой CH;
R8 представляет собой С1-4алкил;
R10 представляет собой С1-4алкил;
R9 представляет собой водород,
или его фармацевтически приемлемая аддитивная соль или сольват.
5. Соединение по п.1 или его стереоизомерная форма, где R1 представляет собой фенил, замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из С1-4алкила и
С1-4алкилокси, или его фармацевтически приемлемая аддитивная соль или сольват.
6. Соединение по п.1 или его стереоизомерная форма, где R1 представляет собой С1-6алкил, необязательно замещенный одним или более галогенами, или его фармацевтически приемлемая аддитивная соль или сольват.
7. Соединение по п.1, где соединение выбрано из группы, состоящей из
N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-2-(2,2,2-трифторэтил)-2Н-индазол-7-амина и
N-[3-метокси-4-(4-метил-1Н-имидазол-1-ил)фенил]-2-(3-метоксифенил)-3-метил-2Н-индазол-7-амина, включая его любую стереохимически изомерную форму,
и его фармацевтически приемлемые аддитивные соли и сольваты.
8. Фармацевтическая композиция, включающая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения, определенного в любом из пп.1-7.
9. Применение соединения, определенного в любом из пп.1-7, в качестве лекарственного средства, модулирующего активность γ-секретазы.
10. Применение соединения, определенного в любом из пп.1-7, для лечения или профилактики заболевания или состояния, выбранных из болезни Альцгеймера, травматического повреждения головного мозга, умеренного когнитивного нарушения, старости, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, мультиинфарктной деменции, синдрома Дауна, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом.
11. Применение по п.10, в котором заболеванием является болезнь Альцгеймера.
Текст
ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИНДАЗОЛА И АЗАИНДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ ГАММА-СЕКРЕТАЗЫ Изобретение относится к замещенным производным индазола и азаиндазола формулы (I), гдеR1, R2, R3, R4, Y, А 1, А 2, А 3, А 4, X1, X2, X3 и Het1 имеют значения, определенные в пунктах формулы изобретения. Соединения настоящего изобретения полезны в качестве модуляторов гамма-секретазы. Изобретение дополнительно относится к способам получения таких соединений,к фармацевтическим композициям, включающим указанные соединения в качестве активного ингредиента, а также к применению указанных соединений в качестве лекарственных средств. Бишофф Франсуа Поль, Гейсен Хенрикус Якобус Мария, Питерс Серж Мария Алоисиус, Минн Гарретт Берлонд (BE) Медведев В.Н. (RU) Область изобретения Настоящее изобретение относится к новым замещенным производным индазола и азаиндазола, полезных в качестве модуляторов -секретазы. Изобретение дополнительно относится к способам получения таких новых соединений, к фармацевтическим композициям, включающим указанные соединения в качестве активного ингредиента, а также к применению указанных соединений в качестве лекарственных средств. Предшествующий уровень изобретения Болезнь Альцгеймера (AD) является прогрессирующим нейродегенеративным расстройством, отмечаемым потерей памяти, познания и стабильности поведения. AD причиняет страдания 6-10% населения в возрасте 65 и свыше и вплоть до 50% в возрасте 85 и свыше и является основной причиной деменции или старческого слабоумия и третьей ведущей причиной смерти после сердечно-сосудистых заболеваний и рака. В настоящее время нет эффективного лечения AD. Общая себестоимость, связанная с AD, в США превышает ежегодно 100 млрд долларов США.AD не имеет простой этиологии, однако она ассоциируется с определенными факторами риска,включающими (1) возраст, (2) наследственность и (3) травму головы; другие факторы включают токсины окружающей среды и низкие уровни воспитания или образования. Конкретные нейропатологические поражения лимбической системы и коры головного мозга включают внутриклеточные нейрофибриллярные сплетения, состоящие из гиперфосфорилированного тау-белка и внеклеточного отложения фибриллярных скоплений амилоидных бета-пептидов (амилоидных бляшек). Главным компонентом амилоидных бляшек являются амилоидные бета (А-бета, Абета или А) пептиды различной длины. Считается,что А вариант или разновидность его, которой является А 1-42-пептид (Абета-42), представляет собой главный агент, являющийся причиной амилоидного образования. Еще одной разновидностью является А 1-40-пептид (Абета-40). Бета-амилоид представляет собой протеолитический продукт белкапредшественника, бета-амилоидный белок-предшественник (бета-АРР или АРР). Семейные, ранние начальные аутосомные доминантные формы AD связываются с миссенсмутациями в -амилоидном белке-предшественнике (-АРР или АРР) и в пресенилиновых белках 1 и 2. У некоторых пациентов поздние формы начала AD коррелируют со специфическим аллелем аполипопротеинового Е (АроЕ) гена и, еще недавно, нахождением мутации в альфа-2-макроглобулине, которая может быть связана по крайней мере с 30% населения с AD. Несмотря на гетерогенность, все формы AD показывают сходные патологические проявления. Генетический анализ доказал наилучшие ключи к логическому терапевтическому подходу к AD. Все мутации, обнаруженные на настоящий момент, воздействуют на качественное или количественное продуцирование амилоидогенных пептидов, известных как Абета-пептиды (АР), особенно А 42, и дают убедительное подтверждение "амилоидного каскадного гипотезиса" AD (Tanzi and Bertram, 2005, Cell. 120, 545). Вероятная связь между генерированием А пептида и AD патологией подчеркивает необходимость лучшего понимания механизмов А продуцирования и убедительно подтверждает терапевтический подход при модулировании уровней А. Высвобождение А пептидов модулируется по крайней мере двумя протеолитическими активностями, рассматриваемыми как расщепление - и -секретазы на N-конце (met-Asp связь) и С-конце (остатки 37-42) А пептида соответственно. В секреторном пути имеется свидетельство того, что-секретаза расщепляется первой, ведя к секреции s-APP (s) и сохранению 11 кДа связанного с мембраной карбоксиконцевого фрагмента (CTF). Считают, что последний дает подъем А пептидам после расщепления -секретазой. Количество более длинной изоформы, А 42, селективно увеличивается у пациентов, несущих некоторые мутации конкретного белка (пресенилина), и данные мутации коррелируют с ранним наступлением наследственной болезни Альцгеймера. Поэтому многие исследователи считают,что А 42 является виновником патогенеза болезни Альцгеймера. В настоящее время стало ясно, что активность -секретазы не может приписываться одному белку, а фактически ассоциируется с собранием различных белков. Активность -секретазы свойственна комплексу многих белков, содержащему по крайней мере четыре компонента: гетеродимер пресенилина (PS), никастрин, aph-1 и pen-2. PS гетеродимер состоит из амино- и карбоксиконцевых PS фрагментов, генерируемых эндопротеолизом предшествующего белка. На границе данного гетеродимера находятся два аспартата каталитического сайта. В последнее время полагают, что никастрин служит в качестве рецептора субстрата -секретазы. Функции других членов-секретазы не известны, но они все необходимы для активности (Steiner, 2004, Curr. Alzheimer Research. 1(3); 175-181). Таким образом, хотя молекулярный механизм второй стадии расщепления остается до настоящего времени неуловимым, комплекс -секретазы стал одной из важнейших целей в поиске соединений для лечения болезни Альцгеймера. Предлагались разнообразные стратегии направленного воздействия на -секретазную мишень при болезни Альцгеймера, в диапазоне от направленного воздействия непосредственно на каталитический сайт, разработки субстрат-специфических ингибиторов и модуляторов активности -секретазы (Marjauxet al., 2004, Drug Discovery Today; Therapeutic Strategies, vol. 1, 1-6). Соответственно, было описано множество соединений, которые имеют целью секретазы (Lamer, 2004, Secretases as therapeutic targets inAlzheimer's disease; patents 2000-2004. Expert Opin. Ther. Patents. 14, 1403-1420). Действительно, данное решение было подтверждено биохимическими исследованиями, в которых было показано влияние некоторых нестероидных противовоспалительных лекарственных средств(NSAID) на -секретазу (US 2002/0128319; Eriksen (2003), J. Clin. Invest. 112, 440). Потенциальными ограничениями для использования NSAID для профилактики или лечения AD являются их ингибирование активности ферментов циклооксигеназы (СОХ), что может привести к нежелательным побочным эффектам и их низкому проникновению в ЦНС (Peretto et al., 2005, J. Med. Chem. 48, 5705-5720). Недавно потерпел неудачу NSAID R-флурбипрофен, энантиомер с недостатком COX-ингибирующей активности и связанной желудочной токсичности в крупнофазном III испытании, поскольку данное лекарство не улучшало способность думать или способность пациентов проявлять ежедневно значительно большую активность по сравнению с теми пациентами, которых держали на плацебо.US 2008/0280948 A1 относится к аминофенильным производным, которые являются модуляторами бета-амилоида.WO 2009/005729 относится к гетероциклическим соединениям и к их применению в качестве модуляторов -секретазы. Существует значительная потребность в новых соединениях, которые модулируют активность-секретазы, открывая, тем самым, новые пути лечения болезни Альцгеймера. Задачей настоящего изобретения является преодоление или устранение по меньшей мере одного из недостатков предшествующего уровня техники или предоставление полезной альтернативы. Соответственно, задачей настоящего изобретения является создание таких новых соединений. Краткое содержание изобретения Было найдено, что соединения настоящего изобретения полезны в качестве модуляторов-секретазы. Соединения согласно изобретению и их фармацевтически приемлемые композиции могут быть полезными при лечении или профилактике болезни Альцгеймера. Настоящее изобретение относится к новым соединениям формулы (I) и их стереоизомерным формам,где R1 представляет собой C1-6 алкил, необязательно замещенный одним или более заместителями,каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси,цикло-С 3-7 алкила, тетрагидропиранила, тетрагидрофуранила и фенила; цикло-С 3-7 алкил; тетрагидропиранил; тетрагидрофуранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо необязательно замещен одним или более заместителями, выбранными из группы, состоящей из галогена, циано,С 1-4 алкила, необязательно замещенного одним или более галогенами, и С 1-4 алкилокси, необязательно замещенного одним или более галогенами;R2 представляет собой водород; циано или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из C1-4 алкилокси, галогена и NR3R4;R5 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4;R6 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4, где каждый R3 представляет собой независимо водород; C1-4 алкил или С 1-4 ацил; каждый R4 представляет собой независимо водород; С 1-4 алкил или С 1-4 ацил; при условии, что не более чем два из X1, X2 и X3 представляют собой N; А 1 представляет собой CR7 или N, где R7 представляет собой водород; галоген или С 1-4 алкилокси; А 2, А 3 и А 4, каждый независимо, представляют собой CH или N при условии, что не более чем два 1 из А , А 2, А 3 и А 4 представляют собой N;R8 представляет собой водород или С 1-4 алкил;R9 представляет собой водород или С 1-4 алкил;R10 представляет собой водород или С 1-4 алкил;R11 представляет собой водород или С 1-4 алкил;G2 представляет собой CH или N,и их фармацевтически приемлемым аддитивным солям и сольватам. Настоящее изобретение также касается способов получения соединений формулы (I) и фармацевтических композиций, включающих их. Неожиданно было найдено, что настоящие соединения модулируют активность -секретазы in vitro и in vivo и, следовательно, могут быть полезными при лечении или профилактике болезни Альцгеймера(AD), травматического повреждения головного мозга (TBI), умеренного когнитивного нарушения (MCI),старости, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, мультиинфарктной деменции, синдрома Дауна, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциированной с бета-амилоидом, предпочтительно AD и других расстройств с бета-амилоидной патологией (например, глаукомы). Ввиду упомянутой выше фармакологии соединений формулы (I) следует, что они могут быть подходящими для использования в качестве лекарственных средств. Более конкретно, данные соединения могут быть подходящими для лечения или профилактики болезни Альцгеймера, церебральной амилоидной ангиопатии, мультиинфарктной деменции, деменции боксеров или синдрома Дауна. Изобретение относится также к соединениям согласно общей формуле (I), их стереоизомерным формам и их фармацевтически приемлемым аддитивным солям кислот или оснований и сольватам для применения при модулировании активности -секретазы. Настоящее изобретение будет теперь описано дополнительно. В следующих абзацах будут определены более подробно различные аспекты изобретения. Каждый аспект, определенный таким образом,может быть скомбинирован с любым другим аспектом или аспектами, если не указано ясно иное. В частности, любой признак, указанный как являющийся предпочтительным или благоприятным, может быть объединен с любым другим признаком или признаками, указанными как предпочтительные или благоприятные. Подробное описание При описании соединений изобретения используемые термины следует рассматривать в соответствии со следующими определениями, если не указано иное. Термин "замещенный", используемый в настоящем изобретении, если не указано иное или ясно из контекста, указывает на то, что один или более водородов, в частности от 1 до 4 водородов, предпочтительно от 1 до 3 водородов, более предпочтительно 1 водород, у атома или радикала, указываемого в термине, использующем слово "замещенный", заменены радикалом из указанной группы при условии,что нормальная валентность не превышена и что замещение приводит в результате к химически стабильному соединению, т.е. соединению, которое является достаточно крепким, чтобы выдержать выделение из реакционной смеси до полезной степени чистоты и преобразование в терапевтический агент. Термин "галоген" как группа или часть группы является общим для фтора, хлора, брома, йода, если не указано иное. Термин "C1-6 алкил" как группа или часть группы относится к углеводородному радикалу формулыCnH2n+1, в которой n является числом от 1 до 6. C1-6 алкильные группы включают от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, более предпочтительно от 1 до 3 атомов углерода, еще более предпочтительно 1-2 атома углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещены, как указано в описании. Когда после атома углерода используется указание мелкими цифрами, данное указание относится к числу атомов углерода, которое может содержать названная группа. Так, например, С 1-6 алкил включает все линейные или разветвленные алкильные группы с 1-6 атомами углерода и указывает, таким образом, такие группы, как, например, метил, этил, нпропил, изопропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил), пентил и его изомеры, гексил и его изомеры и аналогичные. Термин "С 1-4 алкил" как группа или часть группы относится к углеводородному радикалу формулыCnH2n+1, в которой n является числом от 1 до 4. С 1-4 алкильные группы включают от 1 до 4 атомов углеро-3 019702 да, предпочтительно от 1 до 3 атомов углерода, более предпочтительно от 1 до 2 атомов углерода. Алкильные группы могут быть линейными или разветвленными и могут быть замещены, как указано в описании. Когда после атома углерода используется указание мелкими цифрами, данное указание относится к числу атомов углерода, которое может содержать названная группа. Так, например, С 1-4 алкил включает все линейные или разветвленные алкильные группы с 1-4 атомами углерода и включает, таким образом,такие группы, как, например, метил, этил, н-пропил, изопропил, 2-метилэтил, бутил и его изомеры (например, н-бутил, изобутил и трет-бутил) и аналогичные. Термин "С 1-4 ацил", один или в сочетании, относится к радикалу, содержащему от 1 до 4 атомов углерода, в котором карбонил связан с водородом или с углеводородом с прямой или разветвленной цепью,имеющим от 1 до 3 атомов углерода. Неограничивающие примеры подходящего С 1-4 ацила включают формил, ацетил, пропионил, бутирил и изобутирил. Термин "С 1-4 алкилокси" как группа или часть группы относится к радикалу, имеющему формулу-ORc, в которой Rc представляет собой С 1-4 алкил. Неограничивающие примеры подходящего С 1-4 алкилокси включают метилокси (или метокси), этилокси (или этокси), пропилокси, изопропилокси,бутилокси, изобутилокси, втор-бутилокси и трет-бутилокси. Термин "цикло-С 3-7 алкил", один или в сочетании, относится к циклическому насыщенному углеводородному радикалу, имеющему от 3 до 7 атомов углерода. Неограничивающие примеры подходящего цикло-С 3-7 алкила включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Химические наименования соединений настоящего изобретения производились согласно правилам номенклатуры, согласованным со службой Chemical Abstracts Service. В случае таутомерных форм должно быть ясно, что в объем настоящего изобретения включена также не изображенная таутомерная форма. Когда любая переменная имеет место в любой составляющей более одного раза, каждое определение является независимым. Очевидно понятно, что некоторые из соединений формулы (I) и их фармацевтически приемлемые аддитивные соли и стереоизомерные формы могут содержать один или более центров хиральности и существуют в виде стереоизомерных форм. Термин "стереоизомерные формы", используемый в описании, определяет все возможные изомерные формы, какими могут обладать соединения формулы (I). Если не упомянуто или не указано иное,химическое обозначение соединений показывает смесь всех возможных стереохимически изомерных форм. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители у двухвалентных циклических (частично) насыщенных радикалов могут иметь или цис-, или трансконфигурацию. Соединения, заключающие двойные связи, могут иметь в указанной двойной связи Еили Z-стереохимию. Объемом данного изобретения охватываются стереоизомерные формы соединений формулы (I). Когда указана конкретная стереоизомерная форма, это означает, что указанная форма является, по существу, свободной, т.е. ассоциирована менее чем с 50%, предпочтительно менее 20%, более предпочтительно менее чем 10% и даже еще предпочтительнее менее чем 5%, еще более предпочтительно менее 2% и наиболее предпочтительно менее чем с 1% другого изомера(ов). Для терапевтического применения солями соединений формулы (I) являются соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Имеется в виду, что фармацевтически приемлемые аддитивные соли кислот и оснований, упомянутые в описании выше или ниже, включают терапевтически активные нетоксичные формы аддитивных солей кислот и оснований, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые аддитивные соли кислот могут быть без труда получены путем обработки соединения в форме основания такой соответствующей кислотой. Соответствующие кислоты включают, например,хлористо-водородную или бромисто-водородную кислоту, серную, азотную, фосфорную и аналогичные кислоты; или органические кислоты, такие как, например, уксусную, пропановую, гидроксиуксусную,молочную, пировиноградную, щавелевую (т.е. этандиовую), малоновую, янтарную (т.е. бутандиовую кислоту), малеиновую, фумаровую, яблочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, п-толуолсульфоновую, цикламовую, салициловую, п-аминосалициловую, памовую и аналогичные кислоты. Наоборот, указанные соединения в форме соли могут превращаться путем обработки соответствующим основанием в свободную форму основания. Соединения формулы (I), содержащие кислотный протон, могут также превращаться в нетоксичные формы аддитивных солей металлов или аминов путем обработки соответствующими органическими и неорганическими основаниями. Соответствующие формы оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия, магния, кальция и аналогичные, соли с органическими основаниями, например первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изо-4 019702 пропиламин, четыре бутиламиновых изомера, диметиламин, диэтиламин, диэтаноламин, дипропиламин,диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин,трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; соли бензатина, N-метил-D-глюкамина,гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и аналогичные. Наоборот,солевую форму можно превратить обработкой кислотой в свободную кислотную форму. Термин "сольват" включает гидраты и формы с присоединением растворителя, которые способны образовывать соединения формулы (I), так же как и их соли. Примерами таких форм являются, например, гидраты, алкоголяты и аналогичные. Соединения формулы (I), получаемые в процессах, описанных ниже, могут быть синтезированы в форме рацемических смесей энантиомеров, которые могут быть отделены друг от друга, следуя известным в области техники процедурам разделения. Способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы могут быть также получены из соответствующих чистых стереохимически изомерных форм соответствующих исходных материалов при условии, что реакция проходит стереоспецифично. Предпочтительно, если желаемым является конкретный стереоизомер, указанное соединение синтезировали бы с помощью стереоспецифических методов получения. В данных методах успешно применяют энантиомерно чистые исходные материалы. В объем данного описания неотъемлемо включены все изотопные комбинации их химических элементов. В рамках данного изобретения химический элемент, в частности, когда он упоминается в связи с соединением, соответствующим формуле (I), включает все изотопы и изотопные смеси данного элемента. Например, когда упоминается водород, понятно, что он относится к 1 Н, 2 Н, 3 Н и их смесям. Соединение согласно изобретению, следовательно, неотъемлемо включает соединение с одним или более изотопами одного или более элементов и его смеси, включающие радиоактивное соединение, называемое также радиомеченым соединением, в котором один или более нерадиоактивных атомов заменены одним из его радиоактивных изотопов. Термин "радиомеченое соединение" обозначает любое соединение формулы (I) или его фармацевтически приемлемую соль, которое содержит по крайней мере один радиоактивный атом. Например, соединение может быть меченным позитроном или гаммаизлучающими радиоактивными изотопами. В отношении приемов радиолигандного связывания для замены выбирают 3 Н-атом или 125I-атом. Для визуализации наиболее обычно используемыми позитронизлучающими (PET) радиоактивными изотопами являются 11 С, 18F, 15O и 13N, все из которых являются ускоритель-продуцируемыми и имеют периоды полураспада 20, 100, 2 и 10 мин соответственно. Поскольку периоды полураспада данных радиоактивных изотопов являются такими короткими, их целесообразно использовать только в учреждениях, которые имеют ускоритель на участке их производства,ограничивая, таким образом, их использование. Наиболее широко используемыми из них являются 18F,99mTc, 201Tl и 123I. Обращение с данными радиоактивными изотопами, их производство, выделение и включение в молекулу известны специалистам в данной области. В частности, радиоактивный атом выбирают из группы водорода, углерода, азота, серы, кислорода и галогена. Радиоактивный изотоп, в частности, выбирают из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br,76Br, 77Br и 82Br. Используемые в описании и прилагаемых пунктах формулы изобретения формы в единственном числе включают также ссылки на них во множественном числе, если контекст не указывает ясно иное. Например, выражение "одно соединение", означает одно соединение или более чем одно соединение. Термины, описанные выше, и другие термины, используемые в описании, вполне понятны специалистам в данной области. Представлены предпочтительные признаки соединений данного изобретения. Настоящее изобретение относится, в частности, к новым соединениям формулы (I) и их стереоизомерным формам,где R1 представляет собой C1-6 алкил, необязательно замещенный одним или более заместителями,каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси,цикло-С 3-7 алкила, тетрагидропиранила, тетрагидрофуранила и фенила; цикло-С 3-7 алкил; тетрагидропиранил; тетрагидрофуранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо необязательно замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, С 1-4 алкила, необязательно замещенного одним или более галогенами, и С 1-4 алкилокси, необязательно замещенного одним или более галогенами;R2 представляет собой водород; циано или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из C1-4 алкилокси, галогенаR5 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4;R6 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4, где каждый R3 представляет собой независимо водород; C1-4 алкил или С 1-4 ацил; каждый R4 представляет собой независимо водород; С 1-4 алкил или С 1-4 ацил; при условии, что не более чем два из X1, X2 и X3 представляют собой N; А 1 представляет собой CR7 или N, где R7 представляет собой водород; галоген или С 1-4 алкилокси; А 2, А 3 и А 4, каждый независимо, представляют собой CH или N; при условии, что не более чем два из А 1, А 2, А 3 и А 4 представляют собой N;R8 представляет собой водород или С 1-4 алкил;R9 представляет собой водород или С 1-4 алкил;R10 представляет собой водород или С 1-4 алкил;R11 представляет собой водород или С 1-4 алкил;G2 представляет собой CH или N; и их фармацевтически приемлемые аддитивные соли и сольваты. Воплощение настоящего изобретения относится к тем соединениям формулы (I) и их стереоизомерным формам,где R1 представляет собой С 1-6 алкил, необязательно замещенный одним или более заместителями,выбранными из группы, состоящей из галогена, С 1-4 алкилокси, цикло-С 3-7 алкила, тетрагидропиранила,тетрагидрофуранила и фенила; цикло-С 3-7 алкил; тетрагидропиранил; тетрагидрофуранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо необязательно замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано,С 1-4 алкила, необязательно замещенного одним или более заместителями, каждый из которых независимо выбран из галогена; и С 1-4 алкилокси, необязательно замещенного одним или более заместителями, каждый из которых независимо выбран из галогена;R2 представляет собой водород; циано; С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из C1-4 алкилокси, галогена иR5 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4;R6 представляет собой водород; галоген; циано; C1-4 алкилокси или С 1-4 алкил, необязательно замещенный одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкилокси и NR3R4, где каждый R3 представляет собой независимо водород; C1-4 алкил или С 1-4 ацил; каждый R4 представляет собой независимо водород; C1-4 алкил или С 1-4 ацил; при условии, что не более чем два из X1, X2 и X3 представляют собой N; А 1 представляет собой CR7 или N, где R7 представляет собой водород; галоген или С 1-4 алкилокси;-6 019702 А 2, А 3 и А 4, каждый независимо, представляют собой CH или N,при условии, что не более чем два из А 1, А 2, А 3 и А 4 представляют собой N;R8 представляет собой водород или С 1-4 алкил;R9 представляет собой водород или С 1-4 алкил;R10 представляет собой водород или С 1-4 алкил;R11 представляет собой водород или С 1-4 алкил;G2 представляет собой CH или N,и их фармацевтически приемлемым аддитивным солям и сольватам. Еще одно воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой подгруппе соединений, упомянутой в любых других воплощениях, к которым применяются одно или более, предпочтительно все, из следующих ограничений:(a) R1 представляет собой C1-6 алкил, необязательно замещенный одним или более заместителями,каждый из которых независимо выбран из группы, состоящей из галогена, C1-4 алкилокси,цикло-С 3-7 алкила и фенила; цикло-С 3-7 алкил; тетрагидропиранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо необязательно замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, С 1-4 алкила и С 1-4 алкилокси;(b) R2 представляет собой водород; циано или С 1-4 алкил, необязательно замещенный одним или более NH2 заместителями;(d) R5 представляет собой водород; галоген; циано или C1-4 алкил, необязательно замещенный одним или более NH2 заместителями;(k) R12 представляет собой С 1-4 алкил. Еще одно воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой подгруппе соединений, упомянутой в любых других воплощениях, к которым применяются одно или более, предпочтительно все, из следующих ограничений:(a) R1 представляет собой С 1-4 алкил, необязательно замещенный одним или более заместителями,каждый из которых выбран независимо из группы, состоящей из фтора, метокси, циклопропила и фенила; циклобутил; тетрагидропиранил; 1,3-бензодиоксолил или фенил, где каждый фенил независимо замещен одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из метокси, этокси, С 1-4 алкила и фтора;(b) R2 представляет собой водород; циано; метил, необязательно замещенный одним NH2 заместителем;(d) R5 представляет собой водород; фтор; циано; метил, необязательно замещенный одним NH2 заместителем;(l) R12 представляет собой метил. Еще одно воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой подгруппе соединений, упомянутой в любых других воплощениях, к которым применяются одно или более, предпочтительно все, из следующих ограничений:(a) R1 представляет собой фенил, замещенный одним C1-4 алкилокси заместителем; или R1 представляет собой C1-6 алкил, замещенный одним или более галогенами;(k) R9 представляет собой водород. Еще одно воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой подгруппе соединений, упомянутой в любых других воплощениях, к которым применяются одно или более, предпочтительно все, из следующих ограничений:(i) R9 представляет собой водород. Еще одно воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой подгруппе соединений, упомянутой в любых других воплощениях, к которым применяются одно или более, предпочтительно все, из следующих ограничений:(a) R1 представляет собой C1-6 алкил, замещенный одним или более галогенами, в частности R1 представляет собой C1-6 алкил, замещенный тремя галогенами;(i) R9 представляет собой водород. В дополнительном воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где R1 представляет собой фенил, замещенный одним или более заместителями,каждый из которых независимо выбран из группы, состоящей из С 1-4 алкила, необязательно замещенного одним или более галогенами, и С 1-4 алкилокси, необязательно замещенного одним или более галогенами. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где R1 представляет собой фенил, замещенный одним или более заместителями,каждый из которых независимо выбран из группы, состоящей из С 1-4 алкила и С 1-4 алкилокси. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где R1 представляет собой C1-6 алкил, необязательно замещенный одним или более галогенами. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где R1 представляет собой C1-6 алкил, необязательно замещенный одним или более атомами фтора. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где R1 представляет собой 2,2,2-трифторэтил. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где X1 представляет собой CH. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где X1 представляет собой N. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где X2 представляет собой CH. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где X2 представляет собой N. В дальнейшем воплощении изобретение относится к соединениям, соответствующим любому из других воплощений, где X3 представляет собой N. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где X3 представляет собой CR6. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где R6 представляет собой водород. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где А 1 представляет собой CR7. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где А 1 представляет собой N. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где каждый А 2, А 3 и А 4 независимо представляет собой CH. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где Het1 имеет формулу (а-3). В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где Het1 имеет формулу (а-4). В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где G1 представляет собой S. В другом воплощении изобретение относится к соединениям согласно любому из других воплощений, где G2 представляет собой N. Другое воплощение настоящего изобретения относится к тем соединениям формулы (I) или любой их подгруппы, как упомянуто в любом из других воплощений, где 1,3-бензодиоксолил является ограниченным 1,3-бензодиоксол-5-илом. В воплощении соединение формулы (I) является выбранным из группы, содержащей следующие соединения:N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-2-(3-метоксифенил)-3-метил-2 Н-индазол-7 амин,N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-2-(3-метоксифенил)-3-метил-2 Н-индазол-7 амин.1,9HCl,N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-2-метил-2 Н-индазол-7-амин,2-метил-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-2-(3-метоксифенил)-3-метил-2 Н-пиразол[3,4 с]пиридин-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]-2 Н-индазол-7 амин.2HCl,N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин,N-[4-[2-(1-метилэтил)-5-оксазолил]фенил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин,N-[3-метокси-4-(2-метил-5-тиазолил)фенил]-2-метил-2 Н-индазол-7-амин,2-бутил-7-3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]амин]-2 Н-индазол-5-карбонитрил,2-бутил-7-3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]амин]-2 Н-индазол-5-карбонитрил.2HCl,2-циклобутил-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-циклобутил-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин.1,2HCl,2-(4-фторфенил)-7-4-(2-метил-5-оксазолил)фенил]амин]-2 Н-индазол-3-карбонитрил,2-(2-метоксиэтил)-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(2-метоксиэтил)-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-имидазол-7-амин.1,5HCl.1,25 Н 2 О,2-(2-метоксиэтил)-N-[3-метокси-4-(4-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(2-метоксиэтил)-N-[3-метокси-4-(4-метил-5-оксазолил)фенил]-2 Н-индазол-7 амин.1,5HCl.0,18H2O,2-(циклопропилметил)-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин.2HCl,2-(1,3-бензодиоксол-5-ил)-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(4-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(4-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин.2HCl,2-(3-метоксифенил)-3-метил-N-[4-(2-метил-5-оксазолил)фенил]-2 Н-пиразол[3,4-с]пиридин-7-амин,N-[3-фтор-4-(1-метил-1 Н-пиразол-4-ил)фенил]-2-(3-метоксифенил)-3-метил-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-2 Н-индазол-7-амин.HCl,2-(4-фторфенил)-7-4-(2-метил-5-оксазолил)фенил]амин]-2 Н-индазол-3-метанамин,2-бутил-7-3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]амин]-2 Н-индазол-5-метанамин,2-бутил-7-3-метокси-4-(4-метил-1 Н-имидазол-1-ил)фенил]амин]-2 Н-индазол-5-метанамин.4HCl,2-(циклопропилметил)-N-[6-(2-метил-5-оксазолил)-3-пиридинил]-2 Н-индазол-7-амин,2-(циклопропилметил)-N-[6-(2-метил-5-оксазолил)-3-пиридинил]-2 Н-индазол-7-амин.2HCl,N-[4-(2-метил-5-оксазолил)фенил]-2-(тетрагидро-2 Н-пиран-4-ил)-2 Н-индазол-7-амин,N-[6-(2-метил-5-оксазолил)-3-пиридинил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин,N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин,N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-5-метил-2-(2,2,2-трифторэтил)-2 Н-пиразол[3,4 с]пиридин-7-амин,N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-5-метил-2-(2,2,2-трифторэтил)-2 Нпиразол[3,4-с]пиридин-7-амин,2-(5-метокси-2-метилфенил)-3-метил-N-[6-(2-метил-5-оксазолил)-3-пиридинил]-2 Н-индазол-7-амин,5-фтор-2-(4-фторфенил)-3-метил-N-[6-(2-метил-5-оксазолил)-3-пиридинил]-2 Н-индазол-7-амин,N-[3-метокси-4-(2-метил-5-оксазолил)фенил]-5-метил-2-(2,2,2-трифторэтил)-2 Н-пиразол[4,3b]пиридин-7-амин,N-[3-фтор-4-(4-метил-1 Н-имидазол-1-ил)фенил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин,2-(3-метоксифенил)-3-метил-N-[4-(1-метил-1 Н-пиразол-5-ил)фенил]-2 Н-индазол-7-амин,2-(3-метоксифенил)-3-метил-N-[4-(1-метил-1 Н-пиразол-5-ил)фенил]-2 Н-индазол-7 амин.2HCl.0,5H2O,N-[6-метокси-5-(4-метил-1 Н-имидазол-1-ил)-2-пиридинил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7 амин,N-[3-фтор-4-(4-метил-1 Н-имидазол-1-ил)фенил]-2-(2,2,2-трифторэтил)-2 Н-пиразол[4,3-c]пиридин 7-амин,N-[3-метокси-4-(3-метил-1 Н-1,2,4-триазол-1-ил)фенил]-5-(1-метилэтил)-2-(2,2,2-трифторэтил)-2 Нпиразол[4,3-b]пиридин-7-амин,N-[6-метокси-5-(4-метил-1 Н-имидазол-1-ил)-2-пиридинил]-5-(1-метилэтил)-2-(2,2,2-трифторэтил)2 Н-пиразол[4,3-b]пиридин-7-амин,включающей любую их стереохимически изомерную форму и их фармацевтически приемлемые адди- 10019702 тивные соли и сольваты. В воплощении соединение формулы (I) является выбранным из группы, содержащей N-[3-метокси 4-(2-метил-5-оксазолил)фенил]-2-(2,2,2-трифторэтил)-2 Н-индазол-7-амин и N-[3-метокси-4-(4-метил-1 Нимидазол-1-ил)фенил]-2-(3-метоксифенил)-3-метил-2 Н-индазол-7-амин, включающей любую их стереохимически изомерную форму и их фармацевтически приемлемые аддитивные соли и сольваты. Все возможные комбинации вышеуказанных интересующих воплощений рассматриваются как включенные в объем данного изобретения. Настоящее изобретение также охватывает способы получения соединений формулы (I) и ее подгрупп. В описанных реакциях может быть необходимым защищать реакционно-функциональные группы,например гидрокси, амино или карбоксигруппы, где они являются желательными в конечном продукте,во избежание их нежелательного участия в реакциях. Общепринятые защитные группы могут быть использованы в соответствии со стандартной практикой, например см. T.W. Green and P.G.M. Wuts в"Protective Groups in Organic Chemistry", John WilleySons, 1999. Соединения формулы (I) и ее подгрупп могут быть получены путем последовательности стадий, как описано далее. В основном их получают из исходных материалов, которые или являются коммерчески доступными, или их получают путем стандартных способов, известных специалистам в данной области. Соединения настоящего изобретения могут быть также получены с использованием стандартных процессов синтеза, обычно применяемых специалистами в области органической химии. Основное получение некоторых типичных примеров показано ниже. Все переменные имеют такие значения, как упоминалось выше, если не указано иное. L определена как уходящая группа, такая как,например, Cl, Br, I, тозилат, мезилат или трифлат, особенно Cl, Br или I, если не указано иное. Экспериментальная процедура 1. В основном соединения формулы (I) могут быть получены, как представлено ниже на схеме 1, где все переменные имеют значения, определенные выше. Схема 1 Соединения формулы (I) могут быть получены путем реакции сочетания между промежуточными соединениями формулы (II) и (III), как показано на схеме 1, где все переменные имеют значения, определенные ранее. Данная реакция может осуществляться в присутствии подходящего основания, такого как,например, Cs2CO3 или трет-бутоксида натрия. Реакцию можно осуществлять в реакционно-инертном растворителе, таком как, например, толуол, N,N-диметилформамид (ДМФ), трет-бутанол или диоксан. Реакцию обычно осуществляют в присутствии каталитической системы, содержащей подходящий катализатор, такой как ацетат палладия(II) (Pd(OAc)2) или трис-(дибензилиденацетон)дипалладий (Pd2(dba)3),и лиганд,такой как(Xantphos),[1,1'-бинафталин]-2,2'-диил-бис-[дифенилфосфин] (BINAP) или дициклогексил[2',4',6'-трис-(1-метилэтил)[1,1'-бифенил]-2-ил]фосфин (X-Phos). Предпочтительно данную реакцию осуществляют в инертной атмосфере, такой как атмосфера N2 или Ar. Скорость реакции и выход могут быть увеличены за счет нагревания с помощью микроволнового облучения. Экспериментальная процедура 2. Промежуточное соединение формулы (III), в котором группа R2 ограничена С 1-4 алкилом, таким образом называемое промежуточным соединением формулы (IV), может быть получено с помощью реакции алкилирования промежуточного соединения формулы (V) согласно общепринятым способам реакции, в основном известным в данной области. Реакцию алкилирования осуществляют в присутствии подходящего основания, такого как, например, диизопропиламид лития или бис-(триметилсилил)амид лития, и алкилирующего реагента, такого как, например, С 1-4 алкил-Y, где Y является реакционной группой, такой как, например, Cl, Br или I. Все другие переменные являются такими, как определено выше. Реакция может быть осуществлена в апротонном растворителе, таком как, например, ДМФ (диметилформамид) или тетрагидрофуран (ТГФ). Экспериментальная процедура 3. Промежуточное соединение формулы (III), где R2 ограничен -CH2NH2, таким образом называемое промежуточным соединением формулы (VI), может быть получено путем восстановления промежуточного соединения формулы (VII) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию осуществляют в присутствии подходящего восстанавливающего агента, такого как, например, никель Ренея. Реакция может быть осуществлена в протонном растворителе,таком как, например, метанол (MeOH), в присутствии аммиака. Схема 3 Группа NH2 в промежуточном соединении формулы (VI) затем может быть алкилирована или ацилирована для получения дальнейших промежуточных соединений формулы (III). Экспериментальная процедура 4. Промежуточное соединение формулы (V) может быть получено путем восстановления промежуточного соединения формулы (VIII) согласно общепринятым способам реакции, в основном известным в данной области. Данная реакция может быть осуществлена в присутствии подходящего восстанавливающего агента, такого как, например, SnCl22H2O. Реакция может быть осуществлена в протонном растворителе, таком как, например, этанол (EtOH), при повышенной температуре, обычно между 40 и 50C. Схема 4 В особом случае промежуточного соединения формулы (V), где X1 определен как N и X2 и X3 определены как CH, таким образом называемого промежуточным соединением формулы (V-a), может быть осуществлена реакция гидролиза или этанолиза для замены группы "L" группой -ОН или этокси. Полученное таким образом промежуточное соединение может быть преобразовано обратно в промежуточное соединение формулы (V-a) согласно общепринятым способам реакции, в основном известным в данной области. Экспериментальная процедура 5. Промежуточное соединение формулы (VIII) может быть получено согласно схеме 5 путем восстановительного аминирования промежуточного соединения формулы (IX). Данную реакцию осуществляют в присутствии подходящего восстанавливающего агента, такого как, например, триацетоксиборгидрид натрия (NaBH(OAc)3), и первичного амина, такого как, например, R1-NH2. Реакция может быть осуществлена в апротонном растворителе, таком как, например, 1,2-дихлорэтан. Схема 5 Экспериментальная процедура 6. Промежуточное соединение формулы (IX) может быть получено путем окисления промежуточного соединения формулы (X), как отображено на схеме 6. Данную реакцию осуществляют в присутствии подходящего окисляющего агента, такого как, например, перйодат натрия (NaIO4). Реакция может быть осуществлена в смеси растворителей, таких как, например, вода/ДМФ или вода/ТГФ. Экспериментальная процедура 7. Промежуточное соединение формулы (X) может быть получено путем конденсации диметилформамида диметилацеталя (ДМФ-ДМА) с промежуточным соединением формулы (XI), как отображено на схеме 7. Промежуточное соединение формулы (XI) может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Перемешивание и/или повышенные температуры (например, между 70-100C) могут повысить скорость протекания реакции. Схема 7 Экспериментальная процедура 8. Альтернативно, промежуточное соединение формулы (IX) может быть также получено согласно схеме 8 путем окисления промежуточного соединения формулы (XII), которое может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию осуществляют в присутствии подходящего окисляющего агента, такого как, например, диоксид магния (MnO2) или хлорхромата пиридиния (PPC). Реакция может быть осуществлена в растворителе, таком как, например, дихлорметан (DCM) или хлороформ (CHCl3), обычно при высушивании в присутствии молекулярных сит. Схема 8 Экспериментальная процедура 9. Альтернативно, промежуточное соединение формулы (V) может быть получено путем алкилирования промежуточного соединения формулы (XIII) согласно общепринятым способам реакции, в основном известным в данной области. Данное алкилирование обычно может быть осуществлено в отсутствие или в присутствии подходящего основания, такого как, например, карбонат цезия или третичный амин, такой как, например, N,N-дициклогексил-N-метиламин, и алкилирующего реагента, такого как, например, R1-Y(где Y определен как Cl, Br или I), R1-O-SO2-R (где R может быть выбран из множества групп, хорошо известных специалистам в данной области; обычными, но не ограничивающими примерами для R являются C1-6 алкил, перфтор-С 1-6 алкил или необязательно замещенный фенил; более конкретными примерами для R являются метил или п-метилфенил) или R1-O-SO2-O-R1. Эти алкилирующие агенты могут быть коммерчески доступными или могут быть получены согласно общепринятым способам реакции, в основном известным в данной области. Реакция может быть осуществлена в реакционно-инертном растворителе, таком как, например, толуол или ДМФ (диметилформамид). Перемешивание, повышенные температуры (например, между 70-110C) могут повысить скорость протекания реакции. Схема 9 Экспериментальная процедура 10. Альтернативно, промежуточное соединение формулы (XIII) может быть также получено путем депротонирования промежуточного соединения формулы (XIV) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно осуществляют в присутствии подходящего основания, такого как, например, трет-бутоксид калия (KOtBu), в растворителе, таком как,- 13019702 Экспериментальная процедура 11. Промежуточное соединение формулы (XIV) может быть также получено путем диазотизации промежуточного соединения формулы (XV) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно осуществляют в водном растворе кислоты, таком как,например, раствор хлористо-водородной кислоты, в присутствии нитрита натрия (NaNO2). Реакцию обычно проводят при низких температурах (5C). Частицы диазония затем гасят при низких температурах (5C) трет-бутилмеркаптаном (t-BuSH) в протонном растворителе, таком как, например, EtOH. Схема 11 Экспериментальная процедура 12. Альтернативно, промежуточное соединение формулы (XIII) может быть получено в одну стадию путем диазотизации промежуточного соединения формулы (XV) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно осуществляют в кислотном растворе, таком как, например, ледяная уксусная кислота, в присутствии водного раствора нитрита натрия (NaNO2). Схема 12 Синтез промежуточного соединения формулы (XIII), где X2 представляет N, называемого таким образом промежуточным соединением формулы (XIII-а), требует предварительно защиты аминофункции промежуточного соединения формулы (XV), где X2 представляет N, как описано в WO 2005/016892. Экспериментальная процедура 13. Промежуточное соединение формулы (VII) может быть получено путем восстановления промежуточного соединения формулы (XVI) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно осуществляют в присутствии подходящего восстанавливающего агента, такого как, например, трихлорид фосфора (PCl3) или трифенилфосфин. Реакция обычно может быть осуществлена в реакционно-инертном растворителе, таком как, например, CHCl3, при повышенной температуре (между 50 и 75C). Схема 13 Экспериментальная процедура 14. Промежуточное соединение формулы (XVI) может быть получено путем образования основания Шиффа (Schiff) между промежуточным соединением формулы (IX) и первичным амином R1-NH2 согласно общепринятым способам реакции, в основном известным в данной области. Обработка цианидом натрия или триметилсилилцианидом преобразовывает основание Шиффа в его -аминонитрильное производное, которое, в свою очередь, подвергается основной циклизации. Стадию циклизации осуществляют в присутствии подходящего основания, такого как, например, водный раствор карбоната натрия. Экспериментальная процедура 15. Промежуточное соединение формулы (II) может быть получено путем восстановления промежуточного соединения формулы (XVII), как показано на схеме 15, где все переменные имеют значения, определенные выше. Схема 15 Восстановление соединения (XVII) в соединение (II) может быть осуществлено общепринятыми способами, такими как, например, восстановительное гидрогенирование или восстановление металлом или солью металла и кислотой [например, металлом, таким как железо, или солью металла, такой какSnCl2, и кислотой, такой как неорганическая кислота (хлористо-водородная кислота, серная кислота или аналогичные) или органическая кислота (уксусная или аналогичные)], или другими, хорошо известными способами для преобразования нитрогруппы в соответствующий амин. Экспериментальная процедура 16. Промежуточное соединение формулы (XVII), где Het1 ограничен (а-2), как показано на схеме 16,таким образом называемое промежуточным соединением формулы (XVIII), может быть получено путем нуклеофильного ароматического замещения промежуточного соединения формулы (XIX) необязательно замещенным имидазолом или триазолом формулы (XX) согласно схеме 16, где La определяется как F, Cl или Br и где все другие переменные имеют значения, как упомянуто выше. Реакция может быть осуществлена в защитной атмосфере, такой как, например, атмосфера N2. Перемешивание, повышенные температуры (например, между 70-170C) и/или давление могут повысить скорость протекания реакции. Реакция обычно может быть осуществлена в органическом растворителе, таком как, например, ДМСО,ДМФ или N-метилпирролидинон (NMP) в присутствии основания, такого как, например, K2CO3, Cs2CO3 или Et3N. Схема 16 Промежуточные соединения формулы (XIX) и формулы (XX) являются коммерчески доступными или могут быть легко получены специалистами в данной области. Экспериментальная процедура 17. Промежуточное соединение формулы (XVII), где Het1 ограничен оксазолом, замещенным R8a(С 1-4 алкилом) во 2-положении, как показано в схеме 17, таким образом называемое промежуточным соединением формулы (XXI), может быть получено путем конденсации промежуточного соединения формулы (XXII) с промежуточным соединением формулы (XXIII), которое может быть активировано диацетатом йодбензола в присутствии трифторметансульфоновой кислоты. Перемешивание и/или повышенные температуры (например, между 70-100C) могут повысить скорость протекания реакции. На схеме 17 R8a определяется как С 1-4 алкил, и все другие переменные являются такими, как определено выше. Схема 17 Экспериментальная процедура 18. Промежуточное соединение формулы (XXVII), где Het1 ограничен оксазолом, замещенным R9 в 4-положении, таким образом называемое промежуточным соединением формулы (XXIV), может быть получено путем реакции конденсации промежуточного соединения формулы (XXV) с промежуточным соединением формулы (XXVI), как показано на схеме 18. Промежуточное соединение формулы (XXVI) может быть коммерчески доступным или получено путем общепринятых способов реакции, известных в данной области. Данная реакция конденсации может обычно проводиться в присутствии подходящего основания, такого как, например, K2CO3 или этоксид натрия (NaOEt). Реакция может быть проведена в протонном растворителе, таком как, например, MeOH или EtOH. Перемешивание и/или повышенные температуры (например, между 70-110C) могут повысить скорость протекания реакции. На схеме 18 все переменные являются такими, как упомянуто выше. Схема 18 Альтернативно, реакция, описанная на схеме 18, может быть проведена с бензальдегидным производным промежуточного соединения формулы (XXVI), где NO2 является замещенным Cl, Br или I. Экспериментальная процедура 19. Промежуточное соединение формулы (II) может быть также получено согласно хорошо известным способам реакции путем превращения L-заместителя в промежуточном соединении формулы (XXVII) в аминогруппу или в скрытую или защищенную функциональную аминогруппу, которая может быть последовательно превращена в аминогруппу, согласно схеме 19. На схеме 19 Lx определяется как Cl, Br илиI и все другие переменные являются такими, как определено выше. Схема 19 Экспериментальная процедура 20. Соединения формулы (XVII) могут быть получены путем реакции сочетания между промежуточным соединением формулы (XXVIII) и промежуточным соединением формулы (XXIX) согласно схеме 20, где Ly определяется как Cl, Br или I и все другие переменные имеют значения, определенные ранее. Схема 20 На схеме 20 промежуточное соединение формулы (XXIX) может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Реакция сочетания может быть осуществлена в присутствии подходящего основания, такого как,например, Cs2CO3, Na2CO3 или CsF. Реакцию можно осуществлять в реакционно-инертном растворителе,таком как, например, толуол, ДМФ или диоксан. Реакцию обычно осуществляют в присутствии катализатора,такого как тетракис-(трифенилфосфин)палладий(Pd(PPh3)4) или 1,1-бис(дифенилфосфиноферроцендихлорпалладий(II (Pd(dppf) Cl2). Перемешивание, повышенные температуры (например, между 70-140C) и/или давление могут повысить скорость протекания реакции. Предпочтительно данную реакцию осуществляют в инертной атмосфере, такой как атмосфера азота или аргона. Альтернативно, производное пиканолового эфира бороновой кислоты формулы (XXIX) может быть заменено соответствующим производным бороновой кислоты. Экспериментальная процедура 21. Промежуточное соединение формулы (XVII), где Het1 ограничен, как показано на схеме 21, таким образом называемое промежуточным соединением формулы (XXX), может быть получено путем реакции сочетания между промежуточным соединением формулы (XXXI) и промежуточным соединением формулы (XXXII) согласно схеме 21, где Lb определяется как I или Br и все другие переменные имеют значения, определенные ранее. На схеме 21 промежуточные соединения формул (XXXI) и (XXXII) могут быть коммерчески доступными или могут быть получены согласно общепринятым способам реакции, в основном известным в данной области. Реакция сочетания может быть осуществлена в присутствии подходящего основания,такого как, например, Cs2CO3, Ag2CO3. Реакцию можно осуществлять в реакционно-инертном раствори- 16019702 теле, таком как, например, Н 2 О, CH3CN или ДМФ. Реакцию обычно осуществляют в присутствии каталитической системы, содержащей подходящий катализатор, такой как ацетат палладия(II) (Pd(OAc)2) или 1,1-бис-(дифенилфосфиноферроцендихлорпалладий(II (Pd(dppf)Cl2), и лиганд, такой как трифенилфосфин. Перемешивание, повышенные температуры (например, между 60 и 140C) могут повысить скорость протекания реакции. Схема 21 Экспериментальная процедура 22. Промежуточное соединение формулы (XXVII), где Het1 ограничен, как показано на схеме 22, таким образом называемое промежуточным соединением формулы (XXXIII), может быть получено путем реакции декарбоксилирования соединения формулы (XXXIV), как отображено на схеме 22, где Lx определяется как Br, I или Cl и все другие переменные имеют значения, определенные ранее. Реакция может быть осуществлена в растворителе, таком как хинолин или ДМФ, в присутствии оксида меди(II) (CuO) или в смеси ДМФ/EtOH или в изопропаноле, в обоих случаях в отсутствие CuO. Реакция может быть проведена при микроволновом облучении, содействующем условиям реакции. Для реакции обычно требуются высокие температуры (в пределах 150C). Схема 22 Экспериментальная процедура 23. Промежуточное соединение формулы (XXXIV) может быть получено путем гидролиза эфирной группы карбоновой кислоты соединения формулы (XXXV), как отображено на схеме 23, где Lx определяется как Br, I или Cl и все другие переменные имеют значения, определенные ранее. Данную реакцию могут проводить как в кислотных, так и в основных условиях. Будет предпочтительнее проводить ее в основных условиях в присутствии основания, такого как NaOH или LiOH, в смеси диоксана и воды при комнатной температуре. Схема 23 Экспериментальная процедура 24. Промежуточное соединение формулы (XXXV) может быть получено путем реакции сочетания между промежуточным соединением формулы (XXXVI) и промежуточным соединением формулы(XXXVII), как отображено на схеме 24, где Lx определяется как Br, I или Cl, Lc определяется как Br или I и все другие переменные имеют значения, определенные ранее. Промежуточные соединения формул(XXXVI) и (XXXVII) могут быть коммерчески доступными или могут быть получены согласно общепринятым способам реакции, в основном известным в данной области. Реакцию сочетания проводят в присутствии подходящего основания, такого как, например, Cs2CO3 или Ag2CO3. Реакцию можно осуществлять в реакционно-инертном растворителе, таком как, например, CH3CN, толуол или ДМФ. Реакцию обычно осуществляют в присутствии каталитической системы, содержащей подходящий катализатор,такой как ацетат палладия(II) (Pd(OAc)2) или [1,1-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II)(Pd(dppf)Cl2), и лиганд, такой как, например, трифенилфосфин или три-о-толилфосфин. Перемешивание,повышенные температуры (например, между 60 и 140C) могут повысить скорость протекания реакции. Экспериментальная процедура 25. Промежуточное соединение формулы (III), где X2 ограничен CR5, причем R5 является -CH2NH2, таким образом называемое промежуточным соединением формулы (XXXVIII), может быть получено путем восстановления промежуточного соединения формулы (XXXIX) согласно общепринятым способам реакции, в основном известным в данной области. Данное восстановление могут осуществлять в присутствии подходящего восстанавливающего агента, такого как, например, никель Ренея. Реакция может быть осуществлена в протонном растворителе, таком как, например, MeOH, в присутствии аммиака. Схема 25 Первичная аминогруппа может быть затем алкилирована или ацилирована для получения других промежуточных соединений формулы (III), где X2 ограничен CR5, причем R5 является -CH2NR3R4. Экспериментальная процедура 26. Промежуточное соединение формулы (XV), где X2 ограничен CR5, причем R5 является -CN, таким образом называемое промежуточным соединением формулы (XL), может быть получено путем цианирования опосредуемого металлом промежуточного соединения формулы (XV), где X2 ограничен CR5, причем R5 является Ld (Ld представляет I или Br), таким образом называемого промежуточным соединением формулы (XLI), как проиллюстрировано на схеме 26. Промежуточное соединение формулы (XLI) может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Реакция цианирования обычно может быть осуществлена в присутствии подходящего реагента, такого как, например, цианид цинка (Zn(CN)2). Реакцию обычно осуществляют в присутствии катализатора, такого как тетракис-(трифенилфосфин)палладий (Pd(PPh3)4), в растворителе, таком как, например, ДМФ. Перемешивание и/или повышенные температуры (например, между 50-100C) могут повысить скорость протекания реакции. Схема 26 Экспериментальная процедура 27. Альтернативно, промежуточное соединение формулы (IX) также может быть получено согласно схеме 27 путем восстановления промежуточного соединения формулы (XLII), где R определяется как С 1-4 алкил, которое может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Данная реакция может осуществляться в присутствии подходящего восстанавливающего агента, такого как, например, диизобутилалюминийгидрид (DIBAL). Реакция может быть осуществлена в растворителе, таком как, например, дихлорметан(DCM), при низких температурах (например, -78C). Схема 27 Экспериментальная процедура 28. Промежуточное соединение формулы (XLII), где R определяется как С 1-4 алкил, может быть получено путем реакции алкилирования промежуточного соединения формулы (XLIII) согласно общеприня- 18019702 тым способам реакции, в основном известным в данной области. Как отображено на схеме 28, реакцию алкилирования проводят в присутствии подходящего основания, такого как, например, Cs2CO3 илиI. Все другие переменные являются такими, как определено выше. Реакция может быть осуществлена в апротонном растворителе, таком как, например, ДМФ. Схема 28 Экспериментальная процедура 29. Промежуточное соединение формулы (XLIII) может быть получено путем реакции окисления промежуточного соединения формулы (XLIV), которое может быть коммерчески доступным или может быть получено согласно общепринятым способам реакции, в основном известным в данной области. Окисление проводят в присутствии подходящей окисляющей системы, такой как, например, перекись водорода (Н 2 О 2), в ангидриде трифторуксусной кислоты (TFAA), в растворителе, таком как, например,DCM или CH3CN. Схема 29 Экспериментальная процедура 30. Промежуточное соединение формулы (XIII), в которойX2 ограничен CR5a, где R5a является С 1-4 алкилокси или C1-4 алкилом, необязательно замещенным одним или более заместителями, каждый из которых независимо выбран из группы, состоящей из С 1-4 алкилокси, фтора, хлора и NR3R4;L определяется как Br, I или Cl,таким образом называемое промежуточным соединением формулы (XLV), как показано на схеме 30, может быть получено путем галогенирования промежуточного соединения формулы (XLVI) согласно общепринятым способам реакции, в основном известным в данной области. Данная реакция обычно может проводиться в присутствии галогенирующего реагента, такого как, например, оксихлорид фосфора, в растворителе, таком как, например, CH3CN. Перемешивание и/или повышенные температуры (например,между 50-100C) могут повысить скорость протекания реакции. Схема 30 Экспериментальная процедура 31. Промежуточное соединение формулы (XLVI), где R5a определяется как на схеме 30, может быть получено путем циклизации промежуточного соединения формулы (XLVII) согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно проводят при высокой температуре (выше 220C) в Даутерме А (теплоносителе для обогрева реакционного аппарата) (смесь бифенил-дифениловый эфир). Схема 31 Экспериментальная процедура 32. Промежуточное соединение формулы (XLVII) может быть получено путем конденсации промежуточного соединения формулы (XLVIII) с -кетоэфиром формулы (XLIX), где R5a определяется как на схеме 30, согласно общепринятым способам реакции, в основном известным в данной области. Данную реакцию обычно проводят в присутствии каталитического количества п-толуолсульфоновой кислоты в Экспериментальная процедура 33. Промежуточное соединение формулы (XLVIII) может быть получено общепринятыми способами,такими как, например, восстановительное гидрирование промежуточного соединения формулы (L). Схема 33 Экспериментальная процедура 34. Промежуточное соединение формулы (L) может быть получено общепринятыми способами, такими как, например, нитрование промежуточного соединения формулы (LI) в смеси серной и азотной кислот. Схема 34 Экспериментальная процедура 35. Промежуточное соединение формулы (II), где Het1 ограничен (а-2), как показано на схеме 35, таким образом называемое промежуточным соединением формулы (LII), может быть также получено путем катализируемой медью реакции промежуточного соединения формулы (LIII) с (незамещенным) замещенным имидазолом или триазолом формулы (XX) согласно схеме 35, в которой галоген определяется как Br или I, и где все другие переменные имеют значения, как упомянуто выше. Реакция может быть осуществлена в защитной атмосфере, такой как, например, атмосфера N2. Перемешивание, повышенные температуры (например, между 70-200C) и/или давление могут повысить скорость протекания реакции. Реакция обычно может быть осуществлена в органическом растворителе, таком как, например, ДМСО или ДМФ. Необязательно, реакция может проводиться в присутствии основания, такого как, например,K2CO3, Cs2CO3 или Et3N, и/или лиганда, такого как N,N'-диметилэтилендиамин или 1,10-фенантролин. В качестве медного катализатора в каталитических или стехиометрических количествах могут использоваться соли меди, такие как, например, Cu2O, CuI или CuBr. Аминогруппа в промежуточном соединении формулы (LIII) может быть защищена до реакции, и ее защита снята после реакции путем использования подходящей аминозащищающей группы в соответствии со стандартной практикой, например, см. Экспериментальная процедура 36. Промежуточное соединение формулы (XXVII), где Het1 ограничен (а-2) и G2 представляет в особенности CH, как показано на схеме 36, таким образом называемое промежуточным соединением формулы (LIV), может быть получено путем ацилирования промежуточного соединения формулы (LVIII) с получением промежуточного соединения формулы (LVII). Данная реакция ацилирования может проводиться в присутствии реакционно-инертного растворителя, такого как ТГФ, и необязательно или в подходящем основании, таком как Et3N, или в кислотных условиях, таких как смесь уксусного ангидрида и муравьиной кислоты, согласно схеме 36. Далее, промежуточное соединение формулы (LV) может быть получено путем алкилирования промежуточного соединения формулы (LVII) промежуточным соединением формулы (LVI). Данная реакция может быть проведена в присутствии реакционно-инертного растворителя, такого как, например, ДМФ, и подходящего основания, такого как, например, Cs2CO3 илиK2CO3, и необязательно в присутствии каталитического количества иодидной соли, такой как, например,KI или Nal. Впоследствии реакция конденсации промежуточного соединения (LV) с источником аммиака, таким как, например, ацетат аммония (NH4OAc), дает соединение формулы (LIV). На схеме 36 галоген определяется как С 1 или Br, а все другие переменные имеют значения, определенные, как упомянуто выше. Что касается конструирования имидазольного кольца в промежуточное соединение формулы (LIV),порядок введения R10 и R11 может изменяться на обратный. Данный тип реакции описывается вUS2006/0004013 для 1-(4-бром-2-метоксифенил)-4-метил-1 Н-имидазола. При необходимости или желании, в любом порядке могут проводиться одна или более из следующих стадий. Соединения формулы (I), любая их подгруппа, их аддитивные соли, сольваты и стереохимические изомерные формы могут превращаться в дополнительные промежуточные соединения или в соединения согласно изобретению с использованием известных в данной области процедур. Специалистам в данной области техники очевидно, что в описанных выше процессах функциональные группы промежуточных соединений могут нуждаться в блокировании защитными группами. В случае, если функциональные группы промежуточных соединений были блокированы защитными группами, после стадии реакции защита может быть снята. Фармакология. Было обнаружено, что соединения настоящего изобретения модулируют активность -секретазы. Соединения согласно изобретению и их фармацевтически приемлемые композиции, следовательно, могут быть полезными в лечении или профилактике AD, TBI, MCI, старости, деменции с тельцами Леви,церебральной амилоидной ангиопатии, мультиинфарктной деменции, синдрома Дауна, деменции, ассоциированной с болезнью Паркинсона, и деменции, ассоциируемой с бета-амилоидом, предпочтительноAD. Используемый в описании термин "модулирование активности -секретазы" относится к влиянию на процессинг АРР комплексом -секретазы. Предпочтительно он относится к влиянию, при котором общая скорость процессинга АРР остается, по существу, такой же, как без применения указанных соединений, но при котором относительные количества процессируемых продуктов изменяются, более предпочтительно таким образом, что количество получаемого А 42-пептида снижается. Например, могут получаться различные Абета виды (например, Абета-38 или другие виды Абета пептида с более короткой аминокислотной последовательностью вместо Абета-42) или относительные количества продуктов являются различными (например, отношение Абета-40 к Абета-42 меняется, предпочтительно увеличивается). Ранее было показано, что комплекс -секретазы также вовлечен в процессинг Notch-белка. Notch является сигнальным белком, который играет решающую роль в эволюционных процессах (например,обзор в работе Schweisguth F. (2004), Curr. Biol. 14, R129). Что касается использования модуляторов-секретазы в терапии, для того чтобы избежать предполагаемых нежелательных побочных эффектов,кажется особенно благоприятным не мешать активности Notch-процессинга -секретазы. В то время как ингибиторы -секретазы показывают побочные действия вследствие сопутствующего ингибированияNotch-процессинга, модуляторы -секретазы могут иметь преимущество селективного снижения продуцирования высокоагрегируемых и нейротоксичных форм А, а именно А 42, без снижения продуцирования более мелких, менее агрегируемых форм А, а именно А 38 и без сопутствующего ингибированияNotch-процессинга. Таким образом, предпочтительными являются соединения, которые не оказывают влияния на активность Notch-процессинга комплекса -секретазы. Имеется в виду, что используемый в описании термин "лечение" относится ко всем процессам, в которых может иметь место замедление, прерывание, купирование или приостановление прогрессирования болезни, и необязательно имеются указания на общее устранение всех симптомов. Изобретение относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для применения в качестве лекарственных средств. Изобретение относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для применения при модулировании активности -секретазы. Изобретение также относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для применения при лечении или профилактике заболеваний или состояний, выбранных из AD, TBI, MCI,старости, деменции, деменции с тельцами Леви, церебральной амилоидной ангиопатии, мультиинфарктной деменции или синдрома Дауна. В одном из воплощений заболеванием или состоянием является предпочтительно болезнь Альцгеймера. Изобретение также относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для применения при лечении указанных заболеваний. Изобретение также относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для лечения указанных заболеваний. Изобретение также относится к соединению согласно общей формуле (I), его стереоизомерным формам и их фармацевтически приемлемым кислотно- и основно-аддитивным солям и сольватам для применения при лечении или профилактике, в частности лечения, заболеваний или состояний, опосредуемых -секретазой. Изобретение также относится к использованию соединения согласно общей формуле (I), его стереоизомерных форм и их фармацевтически приемлемых кислотно- и основно-аддитивных солей и сольватов для производства лекарственных средств. Изобретение также относится к использованию соединения согласно общей формуле (I), его стереоизомерных форм и их фармацевтически приемлемых кислотно- и основно-аддитивных солей и сольватов для производства лекарственных средств для модулирования активности -секретазы. Изобретение также относится к использованию соединения согласно общей формуле (I), его стереоизомерных форм и их фармацевтически приемлемых кислотно- и основно-аддитивных солей и сольватов для производства лекарственных средств для лечения или профилактики любого из заболеваний или состояний, упомянутых в описании ранее. Изобретение также относится к использованию соединения согласно общей формуле (I), его стереоизомерных форм и их фармацевтически приемлемых кислотно- и основно-аддитивных солей и сольватов для производства лекарственных средств для лечения любого из заболеваний или состояний, упомянутых в описании ранее. В данном изобретении особенное предпочтение отдается соединениям формулы (I) или любой подгруппе соединений с величиной IC50 для ингибирования продуцирования А 42-пептида менее чем 1000 нМ, предпочтительно менее чем 100 нМ, более предпочтительно менее чем 50 нМ, еще более предпочтительно менее чем 20 нМ, как определяется с помощью подходящего анализа, такого как используется в примерах, представленных ниже. Соединения настоящего изобретения могут быть введены млекопитающим, предпочтительно людям, для лечения или профилактики любого из заболеваний или состояний, упомянутых в описании ранее. Ввиду полезности соединения формулы (I) предоставляется способ лечения теплокровных животных, включая людей, страдающих от заболеваний, или способ профилактики теплокровных животных,включая людей, страдающих от любого из заболеваний, упомянутых в описании выше. Указанные способы включают введение, а именно системное или местное введение, предпочтительно пероральное введение эффективного количества соединения формулы (I), его стереоизомерной формы и его фармацевтически приемлемой аддитивной соли или сольвата теплокровным животным,включая людей. Настоящее изобретение также касается применения соединения формулы (I) для модулирования активности -секретазы, приводящей к снижению в отношении количества продуцируемых А 42-пептидов. Преимущество или польза соединений или части соединений настоящего изобретения заключается в результате их усиленного проникновения в ЦНС. Специалисты в области лечения таких заболеваний могут определить эффективное терапевтическое суточное количество по результатам испытания, представленного в описании ниже. Эффективное терапевтическое суточное количество обычно составляет примерно 0,005-50 мг/кг, в частности 0,01-50 мг/кг веса тела, более конкретно 0,01-25 мг/кг веса тела, предпочтительно примерно 0,01-15 мг/кг, более предпочтительно примерно 0,01-10 мг/кг, еще более предпочтительно примерно 0,01-1 мг/кг, наиболее предпочтительно примерно 0,05-1 мг/кг веса тела. Количество соединения согласно настоящему изобретению, называемого в описании также активным ингредиентом, которое требуется для достижения терапевтического эффекта, конечно, может иногда меняться, например, в зависимости от конкретного соединения, способа введения, возраста и состояния реципиента и от конкретного расстройства или заболевания, подвергаемого лечению. Способ лечения может также предусматривать введение активного ингредиента в режиме приема от одного до четырех раз в день. В этих способах лечения соединения согласно изобретению предпочтительно составлять перед введением. Как описывается ниже, подходящие фармацевтические формы получают с помощью известных процедур с использованием хорошо известных и свободно доступных ингредиентов. Соединения настоящего изобретения, которые могут быть подходящими для лечения или профилактики болезни Альцгеймера или ее симптомов, могут быть введены отдельно или в комбинации с одним или более дополнительными терапевтическими агентами. Комбинационная терапия предусматривает введение одной фармацевтической дозированной формы, которая содержит соединение формулы (I) или один или более дополнительных терапевтических агентов, а также введение соединения формулы (I) и каждого из дополнительных терапевтических агентов в виде своей собственной фармацевтической дозированной формы. Например, соединение формулы (I) и терапевтический агент могут быть введены пациенту вместе в виде единичной оральной дозированной композиции, такой как таблетки или капсулы,или каждый агент может быть введен в отдельных оральных дозированных формах. Хотя активный ингредиент может вводиться один, предпочтительно его применять в виде фармацевтической композиции. Соответственно, настоящее изобретение далее предоставляет фармацевтическую композицию,включающую фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения формулы (I). Носитель или разбавитель должен быть "приемлемым" в том смысле, что он является совместимым с другими ингредиентами композиции и не наносит вреда реципиентам. Для легкости введения соединения, о которых идет речь, могут быть составлены в виде различных фармацевтических форм для целей введения. Соединения согласно изобретению, в частности соединения формулы (I), их фармацевтически приемлемые аддитивные соли кислот или оснований, стереохимически изомерные формы или любая их подгруппа или сочетание, могут быть составлены в виде разнообразных фармацевтических форм для целей введения. В качестве подходящих композиций могут быть названы все композиции, обычно применяемые для системного введения лекарственных средств. Для приготовления фармацевтических композиций данного изобретения эффективное количество конкретного соединения, необязательно в форме аддитивной соли, в качестве активного ингредиента комбинируют в виде тесной смеси с фармацевтически приемлемым носителем, который может принимать широкое множество форм в зависимости от формы, желаемой для введения препарата. Данные фармацевтические композиции желательны в виде единичных дозированных форм, в частности, для введения перорально, ректально, чрескожным путем, путем парентеральной инъекции или путем ингаляции. Например, при получении композиций в виде оральной дозированной формы могут применяться любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае оральных жидких препаратов могут применяться суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, разбавители, смазывающие вещества, связующие, дезинтегрирующие агенты и т.п., в случае порошков, пилюль, капсул и таблеток. Из-за легкости их введения таблетки и капсулы представляют наиболее благоприятные оральные стандартные дозированные формы, в случае которых, конечно, применяются твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по крайней мере в основном,хотя могут быть включены другие ингредиенты, чтобы, например, облегчить растворимость. Могут приготавливаться, например, инъецируемые растворы, в которых носитель включает солевой раствор, раствор глюкозы или смесь солевого раствора и раствора глюкозы. Инъецируемые растворы, содержащие соединения формулы (I), для пролонгированного действия могут быть составлены в масле. Подходящими маслами для данной цели являются, например, арахисовое, кунжутное, хлопковое, кукурузное, соевое масло, синтетические глицериновые эфиры жирных кислот с длинной цепью и смеси этих и других масел. Могут также приготавливаться инъецируемые суспензии, в случае которых могут применяться подходящие жидкие носители, суспендирующие агенты и т.п. Предусматриваются также твердые формы препаратов, которые предназначаются для превращения незадолго до использования в жидкую препаративную форму. В композициях, подходящих для чрескожного введения, носитель необязательно включает агент, усиливающий проникновение, и/или смачивающий агент, необязательно в сочетании в незначительных пропорциях с подходящими добавками любой природы, которые не оказывают существенного вредного воздействия на кожу. Указанные добавки могут облегчать введение в кожу и могут быть полезными для приготовления желаемых композиций. Данные композиции могут быть введены различными путями, например в виде трансдермальных пластырей, в виде спот-он, в виде мази. Аддитивные соли кислот или оснований соединений формулы (I) вследствие их повышенной растворимости в воде по сравнению с соответствующими формами оснований или кислот являются более подходящими при приготовлении водных композиций. Особенно благоприятно составлять упомянутые выше фармацевтические композиции в стандартные дозированные формы для простоты или легкости введения и равномерности дозировки. Используемая в описании стандартная дозированная форма относится к физически дискретным единицам, подхо- 23019702 дящим в качестве единичных доз, причем каждая единица содержит заданное количество активного ингредиента, вычисленного на получение желаемого терапевтического эффекта, в сочетании с требуемым фармацевтическим носителем. Примерами таких стандартных дозированных форм являются таблетки(включая таблетки с риской или таблетки с покрытиями), капсулы, пилюли, пакетики с порошком, облатки, суппозитории, инъецируемые растворы или суспензии и т.п. и их изолированные множественные формы. Поскольку соединения согласно изобретению являются активно вводимыми перорально соединениями, фармацевтические композиции, включающие названные соединения для введения перорально,являются особенно благоприятными. Для того чтобы усилить растворимость и/или стабильность соединений формулы (I), может быть полезным применять -, - или -циклодекстрины или производные, в частности гидроксиалкилзамещенные циклодекстрины, например 2-гидроксипропилциклодекстрин или сульфобутил-циклодекстрин. В фармацевтических композициях также сорастворители, такие как спирты, могут улучшать растворимость и/или стабильность соединений согласно изобретению. В зависимости от способа введения фармацевтическая композиция предпочтительно включает 0,0599 вес.%, более предпочтительно 0,1-70 вес.% и еще более предпочтительно 0,1-50 вес.% соединения формулы (I) и 0,1-99,95 вес.%, более предпочтительно 50-99,9 вес.% фармацевтически приемлемого носителя, причем все процентные содержания основаны на общем весе композиции. Следующие примеры иллюстрируют настоящее изобретение. Примеры Далее в описании приняты следующие аббревиатуры и сокращения:Pd2(dba)3 - трис-[-[(1,2-:4,5-)-(1E,4E)-1,5-дифенил-1,4-пентадиен-3-ондипалладий. А. Получение промежуточных соединений. Пример А 1. а) Получение промежуточного соединения 1N2 в течение 6 ч при 150C. Данную реакцию повторяли дважды, каждый раз с 50 г 1-хлор-2-метокси-4 нитробензола (всего 150 г). 3 реакционные смеси объединяли и выливали в ледяную воду (6 л). Твердое вещество отфильтровывали и промывали Н 2 О. Твердое вещество растворяли в дихлорметане и данный раствор промывали Н 2 О. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали с помощью силикагеля на стеклянном фильтре (элюент: дихлорме- 24019702 тан/MeOH от 100/0 до 97/3). Фракции продукта собирали и растворитель выпаривали. Остаток суспендировали в DIPE, отфильтровывали и сушили в печи. Выход: 48,54 г промежуточного соединения 1 (26%).b) Получение промежуточного соединения 2 а и промежуточного соединения 2 промежуточное соединение 2 а: свободное основание промежуточное соединение 2: соль HCl (.HCl) Промежуточное соединение 1 (13,2 г, 56,6 ммоль) растворяли в MeOH (250 мл). К раствору добавляли Pd/C (0,5 г) и полученную суспензию перемешивали в течение ночи при 50C в Н 2 (при атмосферном давлении). После поглощения Н 2 (1 экв.) катализатор отфильтровывали. Органический слой выпаривали, получая промежуточное соединение 2 а (свободное основание). Промежуточное соединение 2 а растворяли в растворе HCl/EtOH и перемешивали в течение 30 мин. Растворитель удаляли в вакууме. Остаток кристаллизовали из EtOH с небольшим количеством петролейного эфира, получая желаемый продукт. Выход: 4,7 г промежуточного соединения 2 (41%; .HCl). Пример А 2. а) Получение промежуточного соединения 3 и промежуточного соединения 4 Смесь 1-фтор-2-метокси-4-нитробензола (821 мг, 4,8 ммоль), 5-метил-1H-1,2,4-триазола (800 мг,9,63 ммоль), K2CO3 (4,8 ммоль) и ДМСО (8 мл) перемешивали при 120C в течение 1 ч. После охлаждения реакционную смесь выливали в ледяную воду. Твердое вещество отфильтровывали, промывали H2O и сушили (в вакууме; 50C). Выход: 0,554 г промежуточного соединения 3 (49%). Водный слой насыщали NaCl, экстрагировали дихлорметаном и органический слой сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: дихлорметан). Требуемую фракцию собирали и растворитель выпаривали. Выход: 0,147 г промежуточного соединения 4 (13%).b) Получение промежуточного соединения 5MeOH (50 мл) добавляли к Pd/C 10% (150 мг) в атмосфере N2. Затем добавляли 0,4% раствор тиофена в DIPE (1 мл) и промежуточное соединение 3 (550 мг, 2,348 ммоль). Реакционную смесь перемешивали при 25C в атмосфере Н 2 до тех пор, пока не поглощалось 3 экв. Н 2. Катализатор отфильтровывали через диатомовую землю. Фильтрат выпаривали и остаток суспендировали в DIPE, отфильтровывали и сушили в вакууме. Выход: 0,350 г промежуточного соединения 5 (73%). Пример A3. а) Получение промежуточного соединения 6K2CO3 (9,6 г, 69,5 ммоль) и 1-метил-1-тозилметилизоцианид (8 г, 38,2 ммоль) добавляли к раствору 2-формил-5-нитроанизола (6,29 г, 34,7 ммоль) в MeOH (150 мл) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении, остаток растворяли в дихлорметане и органическую фазу промывали Н 2 О,сушили (MgSO4), фильтровали и растворитель выпаривали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: н-гептан/EtOAc от 100/0 до 50/50). Фракции продукта собирали и растворитель выпаривали. Выход: 6,24 г промежуточного соединения 6 (77%).b) Получение промежуточного соединения 7MeOH (150 мл) добавляли к Pd/C 10% (1 г) в атмосфере N2. Затем добавляли 0,4% раствор тиофена в DIPE (1 мл) и промежуточное соединение 6 (6,24 г, 26,6 ммоль). Реакционную смесь перемешивали при 25C в атмосфере Н 2 до тех пор, пока не поглощалось 3 экв. Н 2. Катализатор отфильтровывали через диатомовую землю и фильтрат выпаривали. Выход: 5,4 г промежуточного соединения 7 (99%). Пример А 4. а) Получение промежуточного соединения 8 Диацетат йодбензола (2,47 г, 7,68 ммоль) и трифторметансульфоновую кислоту (1,35 мл,15,3 ммоль) перемешивали в CH3CN (40 мл) при комнатной температуре в течение 1 ч в атмосфере N2. Затем смесь нагревали до температуры кипения с обратным холодильником. К раствору сразу добавляли 2'-метокси-4'-нитроацетофенон (1,0 г, 5,12 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры и растворитель выпаривали. Остаток распределяли между насыщенным водным раствором гидрокарбоната натрия (200 мл) и EtOAc (200 мл). Органический слой отделяли и промывали солевым раствором, сушили(MgSO4), фильтровали и выпаривали, получая коричневое твердое вещество. Продукт очищали с помощью колоночной флэш-хроматографии на силикагеле (элюент: дихлорметан/MeOH от 100/0 до 99/1). Фракции продукта собирали и растворитель выпаривали (при пониженном давлении). Выход: 0,42 г промежуточного соединения 8 (35%).b) Получение промежуточного соединения 9MeOH (50 мл) добавляли к Pd/C 10% (0,250 г) в атмосфере N2. Затем добавляли 0,4% раствор тиофена в DIPE (2 мл) и промежуточное соединение 8 (0,946 г, 4,04 ммоль). Реакционную смесь перемешивали при 25C в атмосфере Н 2 до тех пор, пока не поглощалось 3 экв. Н 2. Катализатор отфильтровывали через диатомовую землю и фильтрат выпаривали. Продукт растирали в DIPE, фильтровали и сушили в вакууме. Выход: 0,66 г промежуточного соединения 9 (80%). Пример А 5. а) Получение промежуточного соединения 10 Сначала K2CO3 (36 г, 262 ммоль) и затем 1-метил-1-тозилметилизоцианид (35 г, 167 ммоль) добавляли к раствору 5-нитропиридин-2-карбоксальдегида (20 г, 131 ммоль) в MeOH (500 мл) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении, остаток растворяли в дихлорметане и органическую фазу промывали Н 2 О, сушили (Na2SO4), фильтровали и растворитель выпаривали в вакууме. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: петролейный эфир/EtOAc 4/1). Фракции продукта собирали и растворитель выпаривали. Выход: 15 г промежуточного соединения 10 (56%).b) Получение промежуточного соединения 11 Раствор промежуточного соединения 10 (10 г, 48,7 моль) в ТГФ (300 мл) добавляли к растворуNH4Cl (2,6 г, 48,7 ммоль) в Н 2 О (100 мл). Затем добавляли железо (16,3 г, 292 ммоль) и реакционную смесь нагревали при температуре кипения с обратным холодильником в течение 4 ч. Осадок удаляли путем фильтрования и фильтрат выпаривали в вакууме. Остаток растворяли в EtOAc и органический слой промывали Н 2 О, сушили (Na2SO4), фильтровали и растворитель выпаривали в вакууме. Остаток растворяли в 2 н. растворе HCl и водную фазу промывали дихлорметаном, подщелачивали путем добавления 2 н. раствора NaOH и продукт экстрагировали EtOAc. Органический слой промывали, сушили 11 (71%). Пример А 6. а) Получение промежуточного соединения 12 Раствор 2-йод-5-бромпиридина (13,7 г, 48,2 ммоль), метилового эфира 2-метил-4 оксазолкарбоновой кислоты (3,4 г, 24,1 ммоль), ацетата палладия(II) (0,54 г, 2,41 ммоль),три-о-толилфосфина (1,47 г, 4,81 ммоль) и Cs2CO3 (15,7 г, 48,2 ммоль) в толуоле (75 мл) продували N2,закупоривали и перемешивали в течение ночи при 110C. Катализатор отфильтровывали через диатомовую землю и фильтрат выпаривали. Сырой продукт очищали с помощью колоночной флэшхроматографии на силикагеле (элюент: DCM/MeOH(NH3) от 100/0 до 98/2). Фракции продукта собирали и растворитель выпаривали. Выход: 5,64 г промежуточного соединения 12 (64%).b) Получение промежуточного соединения 13 Промежуточное соединение 12 (5,64 г, 15,4 ммоль) и LiOH (0,91 г, 38 ммоль) растворяли в смеси диоксана (40 мл) и Н 2 О (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч и затем обрабатывали 1 М раствором HCl до рН 2. Осадок отфильтровывали и сушили в вакууме. Фильтрат экстрагировали CHCl3 и органический слой сушили (MgSO4), фильтровали и растворитель удаляли при пониженном давлении, получая твердое вещество. Две фракции твердого вещества объединяли. Выход: 4,75 г промежуточного соединения 13 (97%). с) Получение промежуточного соединения 14 Раствор промежуточного соединения 13 (3,3 г, 11,65 ммоль) в смеси ДМФ (75 мл) и EtOH (30 мл) нагревали при 150C в течение 4 ч в условиях микроволнового облучения. После охлаждения растворители выпаривали, получая промежуточное соединение 14 (3,1 г, 89%). Данную фракцию использовали на следующей стадии без дополнительной очистки.d) Получение промежуточного соединения 15[(R)-1-[(S)-2-(Дициклогексилфосфино)ферроценил]этил]ди-трет-бутилфосфин (Josi-Phos, 0,492 г,0,89 ммоль) и Pd(OAc)2 перемешивали в DME и затем добавляли к раствору промежуточного соединения 14 (4,25 г, 17,8 ммоль) и трет-бутоксида натрия (2,39 г, 6,69 ммоль) в DME (18 мл). В заключение, добавляли N-бензиламин (2,28 г, 21,33 ммоль) и реакционную смесь перемешивали при 100C в течение 9 ч. После охлаждения реакционную смесь разбавляли дихлорметаном и фильтровали через диатомовую землю. Фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: DCM/MeOH(NH3) от 100/0 до 98/2). Фракции продукта собирали и растворитель удаляли при пониженном давлении. Выход: 3,23 г промежуточного соединения 15 (67%). е) Получение промежуточного соединения 16MeOH (50 мл) добавляли к Pd/C 10% (0,05 г) в атмосфере N2. Добавляли промежуточное соединение 15 (0,15 г, 0,565 ммоль) и реакционную смесь перемешивали в атмосфере Н 2 при 50C, пока не поглощался 1 экв. Н 2. Катализатор отфильтровывали через диатомовую землю. Фильтрат выпаривали. Выход: 0,105 г промежуточного соединения 16 (95%). Пример А 7. а) Получение промежуточного соединения 17N2, закупоривали и перемешивали в течение 8 ч при 100C. После охлаждения растворитель выпаривали. Остаток растворяли в дихлорметане и органическую фазу промывали Н 2 О, сушили (MgSO4), фильтровали и фильтрат концентрировали при пониженном давлении, получая промежуточное соединение 17. Данную фракцию использовали в сыром виде на следующей стадии реакции без дополнительной очистки.b) Получение промежуточного соединения 18AcOH (24 мл) в течение 1,5 ч. Растворитель выпаривали. Остаток добавляли в дихлорметан и органический слой промывали насыщенным раствором Na2CO3, сушили (MgSO4), фильтровали и концентрировали при пониженном давлении. Остаток растирали в DIPE и полученный осадок отфильтровывали. Выход: 0,72 г промежуточного соединения 18 (28%). Пример А 8. а) Получение промежуточного соединения 19 Смесь 3-бром-2-толуола (10,0 г, 42,29 ммоль), диметилформамиддиметилацеталя (15,55 г,139 ммоль) и пирролидина (3,29 г, 46,29 ммоль) перемешивали при 115C в течение 22 ч. Раствор охлаждали до комнатной температуры и использовали как таковой на следующей стадии реакции.b) Получение промежуточного соединения 20 Раствор сырого продукта из предыдущей реакционной стадии, содержащий промежуточное соединение 19, при 0C по каплям добавляли к перемешиваемому раствору перйодата натрия (29,7 г,139 ммоль) в ДМФ (75 мл) и H2O (100 мл). Затем реакционной смеси давали нагреться до комнатной температуры и ее перемешивали в течение 3 ч. Суспензию фильтровали через диатомовую землю, которую тщательно промывали EtOAc. Фильтрат промывали Н 2 О и органическую фазу концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: н-гептан/дихлорметан от 50/50 до 0/100). Фракции продукта собирали и растворитель выпаривали. Выход: 2,72 г промежуточного соединения 20 (20% выход от двух стадий реакции). с) Получение промежуточного соединения 21 Триацетоксиборгидрид натрия (1,38 г, 6,5 ммоль) порциями добавляли к перемешиваемому раствору промежуточного соединения 20 (1,0 г, 4,34 моль), 3-метоксианилина (0,53 г, 4,34 ммоль) и уксусной кислоты (1,3 г, 21,7 ммоль) в 1,2-дихлорэтане (16 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, промывали водным раствором K2CO3 и солевым раствором. Органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: н-гептан/дихлорметан изократно 50/50). Фракции продукта собирали и растворитель выпаривали. Выход: 0,65 г промежуточного соединения 21 (41%).d) Получение промежуточного соединения 22 Смесь промежуточного соединения 21 (5,68 г, 16,8 ммоль) и дигидрата хлорида олова(II) (7,6 г,33,7 ммоль) в EtOH (100 мл) перемешивали при 40C в течение ночи. Растворитель выпаривали и остаток суспендировали в H2O и продукт тщательно экстрагировали дихлорметаном. Органическую фазу сушили(MgSO4), фильтровали и растворитель удаляли (при пониженном давлении). Остаток очищали с помощью хроматографии на силикагеле (элюент: н-гептан/дихлорметан от 40/60 до 0/100). Фракции продукта собирали и растворитель выпаривали. Выход: 3,63 г промежуточного соединения 22 (71%). е) Получение промежуточного соединения 23 2 М раствор диизопропиламида лития в ТГФ по каплям добавляли к раствору промежуточного соединения 22 (3,0 г, 9,9 ммоль) в ТГФ при -78C. Реакционной смеси давали нагреться до 0-5C и перемешивали в течение 15 мин. Смесь снова охлаждали до -78C и добавляли CH3I (2,1 г, 14,8 ммоль). Температуре реакционной смеси давали медленно подняться до комнатной температуры и смесь перемешивали в течение 16 ч. Добавляли Н 2 О и продукт экстрагировали диэтиловым эфиром. Органическую фазу сушили (MgSO4), фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: н-гептан/дихлорметан от 50/50 до 0/100). Фракции продукта собирали и растворитель выпаривали. Выход: 3,63 г промежуточного соединения 23 (71%). Пример А 9. а) Получение промежуточного соединения 24 2-Бром-6-метиланилин (1,18 г, 6,34 ммоль) перемешивали при 60C в 6 н. водном растворе HCl в течение 30 мин и затем реакционную смесь охлаждали до 0C. По каплям добавляли раствор NaNO2(0,481 г, 6,98 ммоль) в Н 2 О (1,5 мл) и реакционную смесь перемешивали при 0C в течение дополнительного часа. Реакционную смесь делали забуференной (рН между 4 и 5) путем добавления насыщенного водного раствора NaOAc и затем смесь всю сразу добавляли в охлажденный льдом раствор третбутилмеркаптана (0,63 г, 6,98 ммоль) в EtOH (25 мл). Реакционной смеси давали нагреться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь распределяли между EtOAc (100 мл) и Н 2 О (100 мл). Водную фазу экстрагировали EtOAc и объединенные органические слои сушили (MgSO4),фильтровали и растворитель удаляли при пониженном давлении. Выход: 1,7 г промежуточного соединения 24 (70%).b) Получение промежуточного соединения 25 Раствор промежуточного соединения 24 (1,7 г, 4,44 ммоль) в ДМСО (20 мл) по каплям добавляли к раствору KOtBu (6,64 г, 59 ммоль) в ДМСО (50 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем выливали на лед (300 г), содержащий 1 н. водный раствор HCl (300 мл). Смесь экстрагировали диэтиловым эфиром. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель удаляли при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: дихлорметан). Фракции продукта собирали и растворитель выпаривали. Выход: 0,55 г промежуточного соединения 25 (63%). с) Получение промежуточного соединения 26 Смесь промежуточного соединения 25 (0,54 г, 2,74 ммоль) и дибутилсульфата (0,493 г, 2,77 ммоль) в толуоле (7 мл) перемешивали при 110C в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры и промывали насыщенным водным раствором NaHCO3. Органическую фазу сушили(MgSO4), фильтровали и растворитель выпаривали. Сырое масло очищали с помощью хроматографии на силикагеле (элюент: н-гептан/дихлорметан от 90/10 до 70/30). Фракции продукта собирали и растворитель выпаривали. Выход: 0,335 г промежуточного соединения 26 (43%). Пример А 12. Получение промежуточного соединения 27 Раствор промежуточного соединения 25 (2 г, 10,1 ммоль, 2,2,2-трифторэтилперфторбутилсульфоната (4,9 г, 12,84 ммоль) и Cs2CO3 (9,92 г, 30,45 ммоль) перемешивали при комнатной тем- 29
МПК / Метки
МПК: C07D 413/12, C07D 471/04, A61P 25/28, C07D 403/14, C07D 413/14, C07D 403/12, C07D 417/12, A61K 31/416
Метки: качестве, замещенные, индазола, производные, gamma;-секретазы, модуляторов, азаиндазола
Код ссылки
<a href="https://eas.patents.su/30-19702-zameshhennye-proizvodnye-indazola-i-azaindazola-v-kachestve-modulyatorov-gamma-sekretazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные индазола и азаиндазола в качестве модуляторов гамма-секретазы</a>
Предыдущий патент: Лекарственное средство на основе дииндолилметана (dim) с повышенной биодоступностью и его использование в лечении гиперпластических и воспалительных заболеваний человека
Следующий патент: Фунгицидная смесь, фунгицидное средство и способ борьбы с фитопатогенными грибами на их основе
Случайный патент: Способ осуществления импульсивной подписки в платном телевидении


































