Новые производные фенилимидазола в качестве ингибиторов фермента pde10a
Номер патента: 18880
Опубликовано: 29.11.2013
Авторы: Ритзен Андреас, Килберн Джон Пол, Ланггор Мортен, Нильсен Якоб, Келер Ян, Фарах Мохамед М.
Формула / Реферат
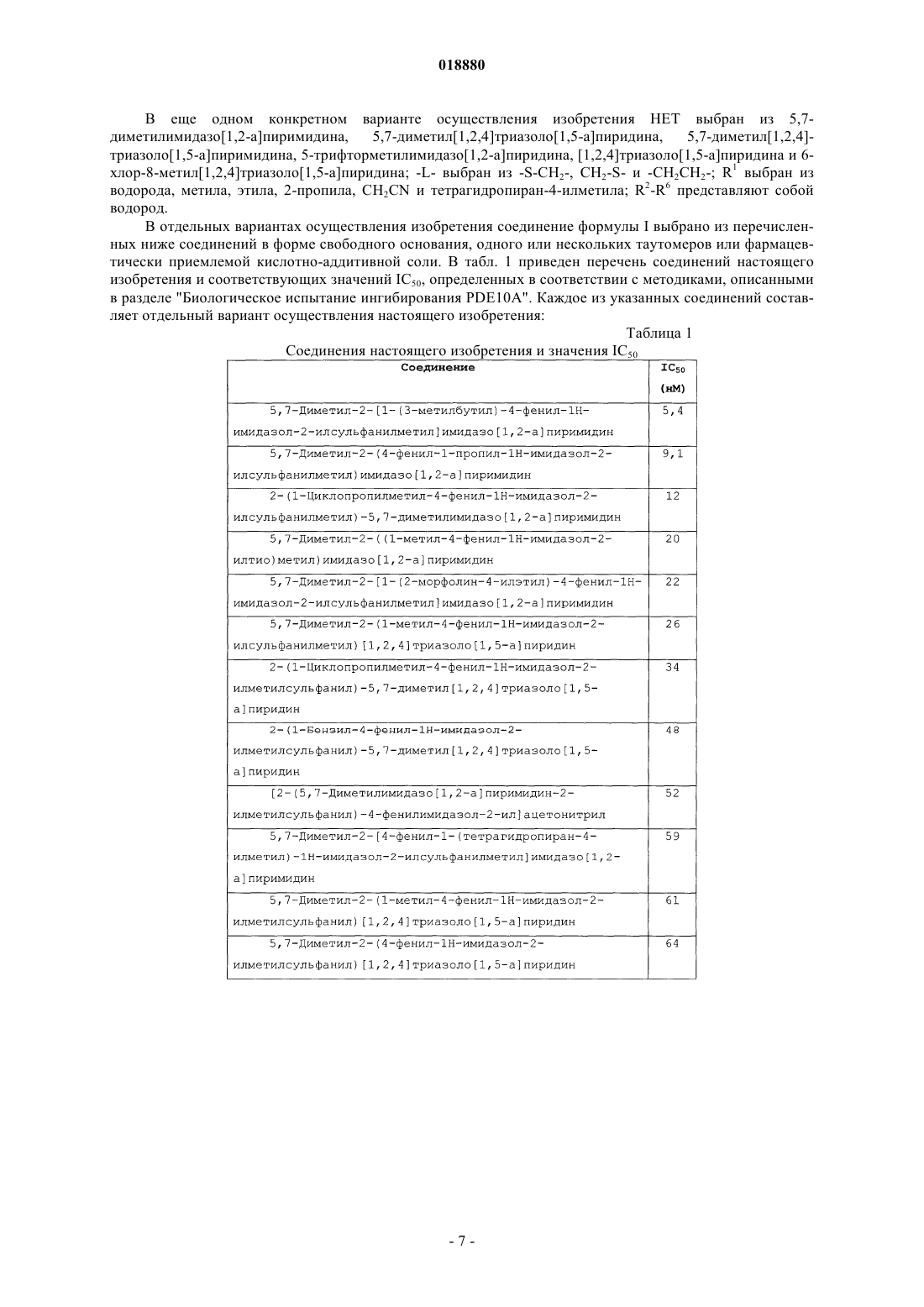
1. Соединение, представленное структурной формулой I
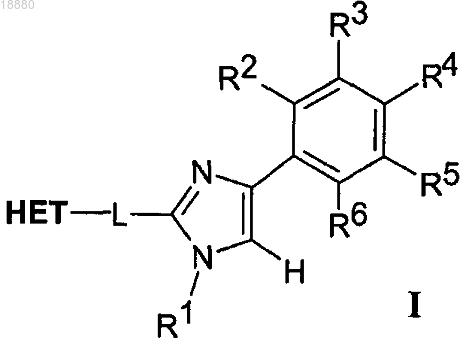
где НЕТ представляет собой гетероароматическую группу формулы II, содержащую от 2 до 4 атомов азота
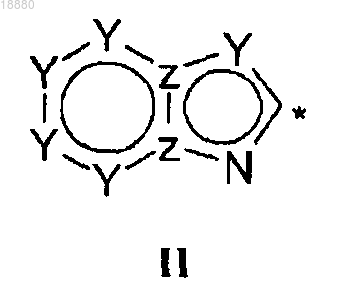
где Y может представлять собой N или СН;
Z может представлять собой N или С;
НЕТ может быть необязательно замещен вплоть до трех заместителями R7-R9, независимо выбранными из Н; C1-C6-алкила; галогена; циано; галоген(C1-C6)алкила; арила; алкокси и C1-C6-гидроксиалкила;
* означает точку присоединения;
-L- представляет собой линкер, выбранный из -СН2-СН2-, -S-СН2-, -CH2-S- или -СН=СН-;
R1 выбран из Н; C1-C6-алкила; C1-C6-алкил(C3-C8)циклоалкила; C1-C6-гидроксиалкила, CH2CN, CH2C(O)NH2, C1-C6-арилалкила; C1-C6-алкилгетероциклоалкила;
R2-R6 независимо выбраны из Н; C1-C6-алкокси и галогена;
и его таутомеры и их фармацевтически приемлемые кислотно-аддитивные соли,
где термин "гетероциклоалкил" означает 4-8-членное кольцо, содержащее атомы углерода и от одного до трех атомов N, О или S, при условии, что 4-8-членное кольцо не содержит соседних атомов О или соседних атомов S;
термин "арил" означает фенильное кольцо, необязательно замещенное галогеном, C1-C6-алкилом, C1-C6-алкокси или галоген(C1-C6)алкилом, как определено выше;
при условии, что соединением не является 2-(5-фенил-1Н-имидазол-2-илметилсульфанил)-1Н-бензимидазол и 2-(5-фенил-1Н-имидазол-2-илсульфанилметил)-1Н-бензимидазол.
2. Соединение по п.1, где НЕТ выбран из группы, включающей [1,2,4]триазоло[1,5-а]пиразин, имидазо[1,2-а]пиримидин, имидазо[4,5-b]пиримидин, [1,2,4]триазоло[1,5-а]пиримидин, [1,2,4]триазоло[1,5-с]пиримидин, 5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин и 5,7-диметилимидазо[1,2-а]пиримидин.
3. Соединение по п.1, где НЕТ выбран из группы, включающей [1,2,4]триазоло[1,5-а]пиридин, имидазо[1,2-а]пиридин, пиразоло[1,5-а]пиридин, 5,7-диметил[1,2,4]триазоло[1,5-а]пиридин, 5,7-диметилимидазо[1,2-а]пиридин, 5-хлоримидазо[1,2-а]пиридин, 5-метилимидазо[1,2-а]пиридин, 5-трифторметилимидазо[1,2-а]пиридин, 6-бром-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин, 6-бром-7-метил[1,2,4]триазоло[1,5-а]пиридин, 6-хлор-8-метил[1,2,4]триазоло[1,5-а]пиридин, 6-хлоримидазо[1,2-а]пиридин, 7-метил[1,2,4]триазоло[1,5-а]пиридин и 8-метилимидазо[1,2-а]пиридин.
4. Соединение по п.1, где НЕТ выбран из группы, включающей 1-метил-1Н-бензимидазол и 1-фенил-1Н-бензимидазол.
5. Соединение по п.1, где НЕТ представляет собой [1,2,4]триазоло[1,5-а]пиридин-6-карбонитрил или имидазо[1,2-а]пиридин-7-карбонитрил.
6. Соединение по п.1, где НЕТ представляет собой 2-(6-хлорбензимидазол-1-ил)этанол.
7. Соединение по любому из пп.1-6, где -L- представляет собой -СН2-СН2-.
8. Соединение по любому из пп.1-6, где -L- представляет собой -CH2-S-.
9. Соединение по любому из пп.1-6, где -L- представляет собой -S-CH2-.
10. Соединение по любому из пп.1-6, где -L- представляет собой -СН=СН-.
11. Соединение по любому из пп.1-10, где R1 представляет собой водород.
12. Соединение по любому из пп.1-10, где R1 не является водородом.
13. Соединение по любому из пп.1-12, где R2, R3, R4, R5 и R6 представляют собой водород.
14. Соединение по любому из пп.1-12, где по меньшей мере один из R2, R3, R4, R5 и R6 представляет собой C1-C6-алкокси, выбранный из метокси.
15. Соединение по любому из пп.1-12, где по меньшей мере один из R2, R3, R4, R5 и R6 представляет собой галоген, выбранный из хлора или фтора.
16. Соединение по любому из пп.1-15, где R7, R8 и R9 представляют собой водород.
17. Соединение по любому из пп.1-15, где по меньшей мере один из R7, R8 и R9 представляет собой C1-C6-алкил, выбранный из метила.
18. Соединение по любому из пп.1-15, где по меньшей мере один из R7, R8 и R9 представляет собой C1-C6-алкокси.
19. Соединение по любому из пп.1-15, где по меньшей мере один из R7, R8 и R9 представляет собой галоген, выбранный из хлора или брома.
20. Соединение по п.1, где соединение выбрано из группы, включающей
5,7-диметил-2-[1-(3-метилбутил)-4-фенил-1Н-имидазол-2-илсульфанилметил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-(4-фенил-1-пропил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиримидин;
2-(1-циклопропилметил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5,7-диметилимидазо[1,2-а]пиримидин;
5,7-диметил-2-((1-метил-4-фенил-1Н-имидазол-2-илтио)метил)имидазо[1,2-а]пиримидин;
5,7-диметил-2-[1-(2-морфолин-4-илэтил)-4-фенил-1Н-имидазол-2-илсульфанилметил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)[1,2,4]триазоло[1,5-а]пиридин;
2-(1-циклопропилметил-4-фенил-1Н-имидазол-2-илметилсульфанил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-(1-бензил-4-фенил-1Н-имидазол-2-илметилсульфанил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
[2-(5,7-диметилимидазо[1,2-а]пиримидин-2-илметилсульфанил)-4-фенилимидазол-2-ил]ацетонитрил;
5,7-диметил-2-[4-фенил-1-(тетрагидропиран-4-илметил)-1Н-имидазол-2-илсульфанилметил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил) [1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-(4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5-трифторметилимидазо[1,2-а]пиридин;
2-(1-этил-4-фенил-1Н-имидазол-2-илметилсульфанил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин;
[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиридин-2-илсульфанилметил)-4-фенилимидазол-1-ил]ацетонитрил;
2-(1-изопропил-4-фенил-1Н-имидазол-2-илметилсульфанил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-(1-бензил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5,7-диметилимидазо[1,2-а]пиримидин;
2-(4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
6-хлор-8-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
транс-5,7-диметил-2-[(Е)-2-(1-метил-4-фенил-1Н-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
2-(1-изопропил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5,7-диметилимидазо[1,2-а]пиримидин;
2-[4-(3-фторфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-(1-этил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5,7-диметилимидазо[1,2-а]пиримидин;
2-(5,7-диметилимидазо[1,2-а]пиримидин-2-илметилсульфанил)-4-фенилимидазол-1-иламин;
5,7-(диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-[4-(3-метоксифенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
7-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-[4-(3-хлорфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-[4-(4-фторфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиридин-2-илсульфанилметил)-4-фенилимидазол-1-ил]ацетамид;
2-[4-(3-метоксифенил)-1-метил-1Н-имидазол-2-илсульфанилметил]-5,7-диметилимидазо[1,2-а]пиримидин;
5-хлор-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
8-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-[4-(2-фторфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-[4-(2-хлорфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-[2-(5,7-диметилимидазо[1,2-а]пиримидин-2-илметилсульфанил)-4-фенилимидазол-1-ил]ацетамид;
2-(1-этил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)-1-фенил-1Н-бензимидазол;
2-[4-(2-метоксифенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин-7-карбонитрил;
2-(1-изопропил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-[1-(4-хлорбензил)-4-фенил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
6-бром-5,7-диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-[4-(3-фторфенил)-1-метил-1Н-имидазол-2-илметилсульфанил][1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)пиразоло[1,5-а]пиридин;
5-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-[4-(4-фторфенил)-1-метил-1Н-имидазол-2-илметилсульфанил][1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)-1-фенил-1Н-бензимидазол;
2-[4-(3-хлорфенил)-1-метил-1Н-имидазол-2-илметилсульфанил][1,2,4]триазоло[1,5-а]пиридин;
2-(6-хлоримидазо[1,2-а]пиридин-2-илметилсульфанил)-4-фенилимидазол-1-иламин;
2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)-1Н-имидазо[4,5-b]пиридин;
6-хлор-8-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-[4-(4-хлорфенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
6-бром-7-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиримидин;
2-[2-(1-амино-4-фенил-1Н-имидазол-2-илсульфанилметил)-6-хлорбензимидазол-1-ил]этанол;
2-(имидазо[1,2-а]пиридин-2-илметилсульфанил)-4-фенилимидазол-1-иламин;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин-6-карбонитрил;
2-[4-(4-метоксифенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
1-метил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)-1Н-бензимидазол;
2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиримидин;
8-метил-2-(4-фенил-1Н-имидазол-2-илсульфанилметил)имидазо[1,2-а]пиридин;
2-[1-(4-хлорбензил)-4-фенил-1Н-имидазол-2-илсульфанилметил]-5,7-диметилимидазо[1,2-а]пиримидин;
4-(2-(2-((8-хлор[1,2,4]триазоло[1,5-а]пиридин-2-ил)метилтио)-4-фенил-1Н-имидазол-1-ил)этил)морфолин;
8-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-{2-[1-(2-морфолин-4-илэтил)-4-фенил-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-{2-[1-(2-морфолин-4-илэтил)-4-фенил-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиридин;
4-(2-(2-((5-хлор[1,2,4]триазоло[1,5-а]пиридин-2-ил)метилтио)-4-фенил-1Н-имидазол-1-ил)этил)морфолин;
5,7-диметил-2-(2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил)[1,2,4]триазоло[1,5-а]пиридин;
4-(2-(2-(2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил)-4-фенил-1Н-имидазол-1-ил)этил)морфолин;
6,8-диметил-2-(2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил)[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-(2-(4-фенил-1Н-имидазол-2-ил)этил)[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин;
2-(2-(1-этил-4-фенил-1Н-имидазол-2-ил)этил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-(2-(4-фенил-1-пропил-1Н-имидазол-2-ил)этил[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-[2-[2-(4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин;
5,7-диметил-2-(4-фенил-1Н-имидазол-2-илсульфанилметил)[1,2,4]триазоло[1,5-а]пиримидин;
5,8-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)[1,2,4]триазоло[1,5-а]пиримидин;
5-метил-2-[2-(4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
2-(1-изобутил-4-фенил-1Н-имидазол-2-илсульфанилметил)-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
5,7-диметил-2-[1-(2-морфолин-4-илэтил)-4-фенил-1Н-имидазол-2-илсульфанилметил][1,2,4]триазоло[1,5-а]пиримидин;
5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил]-7-морфолин-4-ил[1,2,4]триазоло[1,5-а]пиримидин;
2-[2-(1-изобутил-4-фенил-1Н-имидазол-2-ил)этил]-5-метил[1,2,4]триазоло[1,5-а]пиридин;
2-[2-(1-изопропил-4-фенил-1Н-имидазол-2-ил)этил]-5-метил[1,2,4]триазоло[1,5-а]пиридин;
1-метил-3-(2-{2-[2-(5-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-фенилимидазол-1-ил}этил)имидазолидин-2-он;
5-метил-2-{2-[4-фенил-1-(3-пиперидин-1-илпропил)-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиридин;
диизопропил(2-{2-[2-(5-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-фенилимидазол-1-ил}этил)амин;
8-метокси-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)[1,2,4]триазоло[1,5-а]пиридин;
1-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-илметилсульфанил)-4-фенилимидазол-1-ил]этил}-3-метилимидазолидин-2-он;
5,6,7-триметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин;
5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил]-7-фенил[1,2,4]триазоло[1,5-а]пиримидин;
5-метил-2-{2-[4-фенил-1-(2-пиперидин-1-илэтил)-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиридин;
2-[4-(3-метоксифенил)-1-метил-1Н-имидазол-2-илметилсульфанил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
5-этил-2-(1-метил-4-фенил-1Н-имидазол-2-илсульфанилметил)[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-(1-метил-4-фенил-1Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиримидин;
5,7-диметил-2-{2-[4-фенил-1-(2-пиперидин-1-илэтил)-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиримидин;
2-[2-(1-изобутил-4-фенил-1Н-имидазол-2-ил)этил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
2-[2-(1-изопропил-4-фенил-1Н-имидазол-2-ил)этил]-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
1-(2-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}этил)-3-метилимидазолидин-2-он;
(2-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}этил)диизопропиламин;
5,7-диметил-2-{2-[1-(2-морфолин-4-илэтил)-4-фенил-1Н-имидазол-2-ил]этил}[1,2,4]триазоло[1,5-а]пиримидин;
5,7-диметил-2-[2-(4-фенил-1-пропил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин;
1-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}пропан-2-ол;
(S)-1-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}пропан-2-ол;
8-метокси-5-метил-2-(2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
(R)-1-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}пропан-2-ол;
8-фтор-2-(2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил)[1,2,4]триазоло[1,5-а]пиридин;
1-{2-[2-(5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин-2-ил)этил]-4-фенилимидазол-1-ил}-2-метилпропан-2-ол;
8-этил-5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-с]пиримидин;
5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил]-7-пропил[1,2,4]триазоло[1,5-а]пиримидин;
5,8-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиразин;
7-метокси-5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-с]пиримидин;
7-изопропил-5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин;
2-{2-[4-(2,4-дифторфенил)-1-метил-1Н-имидазол-2-ил]этил}-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
7-метокси-5,8-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-с]пиримидин;
5,8-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-с]пиримидин;
2-{2-[4-(2-метоксифенил)-1-метил-1Н-имидазол-2-ил]этил}-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин;
{5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиримидин-7-ил}метанол;
8-этил-5-метил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин;
5,8-диметокси-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиридин,
и их фармацевтически приемлемые кислотно-аддитивные соли.
21. Соединение по любому из пп.1-20 в качестве лекарственного средства для лечения нейродегенеративного или психиатрического расстройства.
22. Соединение по любому из пп.1-20, включая соединения условия исключения, для применения при лечении нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
23. Соединение по любому из пп.1-20, включая соединения условия исключения, для применения при лечении наркотической зависимости у млекопитающего, включая человека, где указанная наркотическая зависимость включает хронический алкоголизм, амфетаминовую наркоманию, кокаиновую наркоманию или опиатную наркоманию.
24. Соединение по любому из пп.1-20, включая соединения условия исключения, для получения лекарственного средства для применения при лечении наркотической зависимости у млекопитающего, включая человека, где указанная наркотическая зависимость включает хронический алкоголизм, амфетаминовую наркоманию, кокаиновую наркоманию или опиатную наркоманию.
25. Соединение по любому из пп.1-20, включая соединения условия исключения, для получения лекарственного средства для применения при лечении нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
26. Способ лечения субъекта, страдающего нейродегенеративным или психиатрическим расстройством, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа, где указанный способ включает введение указанному субъекту эффективного количества соединения по любому из пп.1-20, включая соединения условия исключения.
27. Способ лечения млекопитающего субъекта, включая человека, страдающего наркотической зависимостью, выбранной из хронического алкоголизма, амфетаминовой, кокаиновой или опиатной зависимости, включающий введение указанному субъекту соединения формулы I по любому из пп.1-20 в количестве, эффективном при лечении наркотической зависимости.
28. Способ лечения млекопитающего субъекта, включая человека, страдающего наркотической зависимостью, выбранной из хронического алкоголизма, амфетаминовой, кокаиновой или опиатной зависимости, включающий введение указанному субъекту соединения формулы I по любому из пп.1-20 в количестве, эффективном для ингибирования PDE10A.
29. Фармацевтическая композиция для лечения нейродегенеративного или психиатрического расстройства, содержащая терапевтически эффективное количество соединения по любому из пп.1-20, включая соединения условия исключения, и один или несколько фармацевтически приемлемых носителей, разбавителей и эксципиентов.
Текст
НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА PDE10A Изобретение относится к соединениям, которые являются ингибиторами фермента PDE10A. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения настоящего изобретения и фармацевтически приемлемый носитель. Кроме того, изобретение относится к способу лечения субъекта, страдающего нейродегенеративным расстройством, включающему введение субъекту терапевтически эффективного количества соединения формулы I. Настоящее изобретение также относится к способу лечения субъекта, страдающего наркотической зависимостью, включающему введение субъекту терапевтически эффективного количества соединения формулы I. Настоящее изобретение также относится к способу лечения субъекта, страдающего психиатрическим расстройством, включающему введение субъекту терапевтически эффективного количества соединения формулы I Область техники, к которой относится изобретение Изобретение предоставляет соединения, которые являются ингибиторами фермента PDE10A и полезны при лечении нейродегенеративных и психиатрических расстройств. В частности, изобретение предоставляет соединения, которые являются высокоселективными в отношении PDE10 подтипа по сравнению с другими подтипами PDE. Настоящее изобретение предоставляет также фармацевтические композиции, содержащие соединения настоящего изобретения, и способы лечения расстройств с использованием соединений настоящего изобретения. Предпосылки создания изобретения В данном описании приводятся ссылки на различные публикации во всей их полноте. Таким образом, содержание публикаций включено в данное описание посредством ссылки для более полного описания уровня области техники, к которой относится настоящее изобретение. Циклические нуклеотиды - циклический аденозинмонофосфат (сАМР) и циклический гуанозинмонофосфат (cGMP) - функционируют в качестве вторичных внутриклеточных мессенджеров, регулирующих широкий спектр процессов в нейронах. Внутриклеточные сАМР и cGMP генерируются аденил- и гуанилциклазами и разлагаются циклическими нуклеотидными фосфодиэстеразами (PDE). Внутриклеточные уровни сАМР и cGMP контролируются внутриклеточной передачей сигнала, и стимуляция/репрессия аденил- и гуанилциклаз в ответ на активацию GPCR является конкретно описанным способом контроля концентраций циклических нуклеотидов (Antoni, F.A. Front. Neuroendocrinal. 2000, 21, 103-132). Уровни сАМР и cGMP, в свою очередь, контролируют активность сАМР- и cGMPзависимых киназ, а также других белков с элементами циклических нуклеотидных ответов, которые через последующее фосфорилирование белков и другие процессы регулируют ключевые нейронные функции, такие как синаптическая передача, нейронная дифференциация и выживаемость. Выявлен 21 фосфодиэстеразный ген, которые можно подразделить на 11 генных семейств. Существует десять семейств аденилилциклаз, две гуанилилциклазы и одиннадцать фосфодиэстераз. PDE представляют собой класс внутриклеточных ферментов, которые регулируют уровни сАМР и cGMP посредством гидролиза циклических нуклеотидов в соответствующие нуклеотидмонофосфаты. Некоторые PDE разлагают сАМР, некоторые разлагают cGMP, а некоторые разлагают те и другие. Большинство PDE широко экспрессировано и функционирует во многих тканях, в то время как некоторые являются более тканеспецифичными. Фосфодиэстераза 10 А (PDE10A) является фосфодиэстеразой двойной специфичности, которая может преобразовывать как сАМР в AMP, так и cGMP в GMP (Loughney, K. et al. Gene 1999, 234, 109-117;(n.accumbens) и в обонятельном бугорке (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551557; Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Мышиная PDE10A является первым идентифицированным представителем семейства фосфодиэстераз PDE10 (Fujishige, K. et al. J. Biol. Chem. 1999, 274, 18438-18445; Loughney, K. et al. Gene 1999, 234,109-117), и были идентифицированы N-концевые сплайсированные варианты генов крысы и человека(Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557; Fujishige, K. et al. Eur. J. Biochem. 1999,266, 1118-1127). Существует высокая степень гомологии между видами. Но в отличие от других PDE семейств PDE10 локализована только у млекопитающих. мРНК для PDE10 высокоэкспрессирована в мужской половой железе и в мозге (Fujishige, K. et al. Eur J. Biochem. 1999, 266, 1118-1127; Soderling, S. etal. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076; Loughney, K. et al. Gene 1999, 234, 109-117). Указанные исследования показывают, что экспрессия PDE10 в мозге является наивысшей в стриатруме (хвост и скорлупа чечевидного ядра), прилежащем ядре и обонятельном бугорке. Позднее был проведен анализ конфигурации экспрессии PDE10A мРНК (Seeger, T.F. et al. Abst. Soc. Neurosci. 2000, 26, 345.10) и PDE10A белка (Menniti, F.S. et al. William Harvey Research Conference "Phosphodiesterase in Health and Disease",Porto, Portugal, Dec. 5-7, 2001) в мозге крысы.PDE10A экспрессируется с высокими уровнями средними шипиковыми нейронами (medium spinyneurons - MSN) хвостовых ядер, прилежащим ядром и соответствующими нейронами обонятельного бугорка. Они образуют ядро базальной системы нервных узлов. MSN играют ключевую роль в кортикобазальной ганглиально-таламо-кортикальной петле, интегрируя конвергентный кортикально/таламный вход и посылая эту интегрированную информацию назад в кортикальный слой. MSN экспрессирует два функциональных класса нейронов: класс D1, экспрессирующий D1 дофаминовые рецепторы, и класс D2,экспрессирующий D2 дофаминовые рецепторы. D1 класс нейронов является частью "прямого" стриарного метаболического пути выхода, который свободно функционирует для усиления поведенческих ответов. D2 класс нейронов является частью "непрямого" стриарного пути выхода, который функционирует для подавления поведенческих ответов, конкурирующих с ответами, которым способствует "прямой" путь. Такие конкурирующие проводящие пути действуют подобно тормозу и акселератору в автомобиле. В самом простом представлении ограниченное движение при болезни Паркинсона является результатом сверхактивности "непрямого" пути, в то время как избыточное движение при таких расстройствах, как болезнь Хантингтона, отражает повышенную активность прямого пути метаболизма. PDE10A регуляция проведения сигналов сАМР и/или cGMP в дендритном компартменте этих нейронов может быть вовлечена в фильтрацию кортико/таламного входа в MSN. Кроме того, PDE10A может быть вовлечена в регуляцию высвобождения GABA в черное вещество (substantia nigra) и бледный шар (globus pallidus)(Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Антагонизм дофаминового D2 рецептора четко установлен при лечении шизофрении. Начиная с 1950-х годов, антагонизм дофаминового D2 рецептора был главной основой лечения психоза, и все эффективные нейролептические лекарственные средства противодействуют D2 рецепторам. Действие D2,вероятно, проводится, главным образом, через нейроны в полосатом теле, прилежащем ядре и обонятельном бугорке, поскольку эти области воспринимают наиболее плотные дофаминергические проекции и имеют наиболее сильную экспрессию D2 рецепторов (Konradi, С. and Heckers, S. Society of BiologicalPsychiatry, 2001, 50, 729-742). Антагонизм дофаминовых D2 рецепторов приводит к снижению уровней сАМР в клетках, где они экспрессируются через ингибирование аденилатциклазы, и это является компонентом процесса проведения D2 сигнала (Stoof, J.С.; Kebabian J.W. Nature 1981, 294, 366-368; Neve, K.A.et al. Journal of Receptors and Signal Transduction 2004, 24, 165-205). И наоборот, антагонизм D2 рецептора эффективно повышает уровни сАМР, и этот результат мог бы быть имитирован ингибированием сАМР разлагающих фосфодиэстераз. Большинство из 21 фосфодиэстеразного гена широко экспрессировано; следовательно, ингибирование, вероятно, имеет побочные эффекты. Поскольку PDE10 в данном контексте обладает желаемым профилем экспрессии с высокой и относительно специфической экспрессией в нейронах в полосатом теле,прилежащем ядре и обонятельном бугорке, ингибирование PDE10A, вероятно, обладает эффектами, аналогично антагонизму D2 рецептора, и, следовательно, обладает нейролептическим действием. Хотя ингибирование PDE10, как ожидается, частично имитирует антагонизм D2 рецептора, можно ожидать, что оно имеет иной профиль. D2 рецептор имеет, помимо сАМР, и другие компоненты проведения сигнала (Neve, K.A. et al. Journal of Receptors and Signal Transduction 2004, 24, 165-205), поэтому подавление сАМР через ингибирование PDE10A может негативно модулировать, а не напрямую подавлять проведение дофаминового сигнала через D2 рецептор. Это может снижать риск экстрапирамидальных побочных эффектов, которые наблюдались при сильном D2 антагонизме. И напротив, PDE10A ингибирование может обладать некоторыми эффектами, не наблюдаемыми при антагонизме D2 рецептора.PDE10A также экспрессирована в D1 рецепторах, экспрессирующих стриарные нейроны (Seeger, T.F. etal. Brain Research, 2003, 985, 113-126). Поскольку антагонизм D1 рецептора приводит к стимулированию аденилатциклазы и, как результат, к повышению уровней сАМР, ингибирование PDE10A, вероятно, также обладает эффектами, которые имитируют антагонизм D1 рецептора. И наконец, PDE10A ингибирование будет не только повышать уровни сАМР в клетках, но, как может ожидаться, также повышать уровни cGMP, поскольку PDE10A является фосфодиэстеразой с двойной специфичностью. cGMP активирует ряд целевых белков в клетках, подобных сАМР, а также взаимодействует с путями проведения сАМР сигнала. В заключение, PDE10A ингибирование, вероятно, частично имитирует антагонизм D2 рецептора и, следовательно, обладает нейролептическим действием, но его профиль может отличаться от профиля,который наблюдается у классических антагонистов D2 рецептора. Было показано, что папаверин, ингибитор PDE10A, является активным на некоторых антипсихотических моделях. Папаверин усиливал каталептическое действие антагониста D2 рецептора галоперидола у крыс, но сам по себе не вызывал каталепсии (WO 03/093499). Папаверин снижал повышенную активность крыс, вызванную РСР, в то время как снижение амфетамин-индуцированной гиперактивности было незначительным (WO 03/093499). Эти модели показывают, что PDE10A ингибирование обладает классическим нейролептическим потенциалом, который является ожидаемым из теоретических соображений. В WO 03/093499 дополнительно описано применение селективных PDE10A ингибиторов для лечения ассоциированных неврологических и психиатрических расстройств. Кроме того, ингибированиеPDE10A может ослаблять когнитивные расстройства, связанные с шизофренией. Распределение PDE10A в тканях показывает, что ингибиторы PDE10A могут применяться для повышения уровней сАМР и/или cGMP внутри клеток, которые экспрессируют PDE10A фермент, в частности нейронов, которые включают базальные ганглии, и, следовательно, ингибиторы PDE10A настоящего изобретения могут применяться при лечении различных ассоциированных нейропсихиатрических состояний, в которых задействованы базальные ганглии, таких как неврологические и психиатрические расстройства, шизофрения, биполярное расстройство, обсессивно-компульсивное расстройство и т.п., и могут обладать преимуществом отсутствия побочных эффектов, которые ассоциируются с терапевтическими лекарственными средствами, применяющимися в настоящее время. Кроме того, данные последних публикаций (WO 2005/120514, WO 2005012485, Cantin et al., BioorganicMedicinal Chemistry Letters 17 (2007) 2869-2873) свидетельствуют о том, что ингибиторы PDE10A могут применяться при лечении ожирения и инсулиннезависимого сахарного диабета. Что касается ингибиторов PDE10A, в ЕР 1250923 описано применение селективных PDE10A ингибиторов в целом и папаверина, в частности, для лечения некоторых неврологических и психиатрических расстройств. В WO 05/113517 описаны стереоспецифичные бинзодиазепиновые соединения в качестве ингибиторов фосфодиэстеразы, в частности 2 и 4 типов, и предупреждение и лечение патологий, в которые вовлечены расстройства центральной и периферической нервной системы. В WO 02/88096 описаны производные бензодиазепа и их применение в качестве ингибиторов фосфодиэстеразы, в частности 4 типа, в области терапии. В WO 04/41258 описаны производные бензодиазепинона и их применение в качестве ингибиторов фосфодиэстеразы, в частности 2 типа, в области терапии. Пирролодигидроизохинолины и их производные описаны в качестве ингибиторов PDE10 вWO 05/03129 и WO 05/02579. Пиперидинил-замещенные хиназолины и изохинолины, которые служат в качестве ингибиторов PDE10A, описаны в WO 05/82883. В WO 06/11040 описаны замещенные производные хиназолина и изохинолина, которые служат в качестве ингибиторов PDE10. В US 29950182079 описаны замещенные тетрагидроизохинолинильные производные хиназолина и изохинолина, которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). В частности, в US 29950182079 описаны указанные соединения, которые являются селективными ингибиторами PDE10. Аналогично, вUS 20060019975 описаны пиперидиновые производные хиназолина и изохинолина, которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). US 29950182079 также относится к соединениям, которые являются селективными ингибиторами PDE10. В WO 06/028957 описаны производные циннолина в качестве ингибиторов фосфодиэстеразы 10 типа для лечения психиатрических и неврологических синдромов. Однако в приведенных выше публикациях не описаны соединения настоящего изобретения, которые по своей структуре не относятся ни к одному из известных ингибиторов PDE10 (Kehler, J. et al. Expert Opin. Ther. Patents 2007, 17, 147-158) и которые, как было обнаружено авторами настоящего изобретения, являются высокоэффективными и селективными ингибиторами фермента PDE10A. Соединения - 2-(5-фенил-1 Н-имидазол-2-илметилсульфанил)-1 Н-бензимидазол (регистрационный номер CAS 348125-42-8) и 2-(5-фенил-1 Н-имидазол-2-илсульфанилметил)-1 Н-бензимидазол (регистрационный номер CAS 296791-07-6) - упоминаются в химических библиотеках Scientific Exchange, Inc. иZelinsky Institute of Organic Chemistry соответственно, но фармакологические данные данных соединений, как оказалось, не опубликованы. Оба указанные соединения исключены из объема настоящего изобретения. Соединения настоящего изобретения могут стать альтернативными соединениями лекарственным средствам, продаваемым в настоящее время для лечения нейродегенеративных и/или психиатрических расстройств, которые неодинаково эффективны для всех пациентов. Поэтому все еще существует потребность в альтернативных способах лечения. Сущность изобретения Задачей настоящего изобретения является предоставление соединений, которые являются селективными ингибиторами PDE10A фермента. Дополнительной задачей настоящего изобретения является предоставление соединений, которые обладают такой активностью и которые обладают повышенной растворимостью, метаболической стабильностью и/или биологической доступностью по сравнению с соединениями предшествующего уровня. Еще одной задачей настоящего изобретения является предоставление эффективного лечения, в частности длительного лечения пациента, которым является человек, без побочных эффектов, обычно наблюдаемых у применяемых в настоящее время терапевтических средств для лечения неврологических и психиатрических расстройств. Другие задачи настоящего изобретения станут понятными из настоящего описания. Соответственно, в одном аспекте настоящее изобретение относится к соединениям формулы I где НЕТ представляет собой гетероароматическую группу формулы II, содержащую от 2 до 4 атомов азота где Y может представлять собой N или СН;Z может представлять собой N или С; и-3 018880 НЕТ может быть необязательно замещен вплоть до тремя заместителями R7, R8 и R9, независимо выбранными из Н; C1-C6-алкила, такого как Me; галогена, такого как хлор и бром; циано; галоген(C1C6)алкила, такого как трифторметил; арила, такого как фенил; алкокси, предпочтительно C1-C6-алкокси,такого как метокси, диметокси, этокси, метоксиэтокси и этоксиметокси, и C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН;означает точку присоединения;R1 выбран из Н; C1-C6-алкила, такого как метил, этил, 1-пропил, 2-пропил, изобутил; C1-C6 алкил(C3-C8)циклоалкила, такого как циклопропилметил; C1-C6-гидроксиалкила, такого как гидроксиэтил; CH2CN; CH2C(O)NH2; C1-C6-арилалкила, такого как бензил и 4-хлорбензил; и C1-C6 алкилгетероциклоалкила, такого как тетрагидропиран-4-илметил и 2-морфолин-4-илэтил;R2-R6, каждый независимо, выбраны из Н; C1-C6-алкокси, такого как метокси; и галогена, такого как хлор или фтор; и их таутомерам, фармацевтически приемлемым кислотно-аддитивным солям и полиморфным формам при условии, что соединением не является 2-(5-фенил-1 Н-имидазол-2-илметилсульфанил)-1 Нбензимидазол и 2-(5-фенил-1 Н-имидазол-2-илсульфанилметил)-1 Н-бензимидазол. В конкретном варианте осуществления изобретение относится к соединению формулы I в форме единственного таутомера или полиморфа. В отдельных вариантах осуществления изобретения соединение формулы I выбрано из конкретных соединений, раскрытых в экспериментальной части данного описания. Изобретение также относится к соединению формулы I или его фармацевтически приемлемой кислотно-аддитивной соли для применения в качестве лекарственного средства. В еще одном аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель,разбавитель или эксципиент. Изобретение также относится к применению соединения формулы I или его фармацевтически приемлемой кислотно-аддитивной соли для получения лекарственного средства для лечения нейродегенеративного или психиатрического расстройства. Кроме того, в еще одном аспекте настоящее изобретение относится к способу лечения субъекта,страдающего нейродегенеративным расстройством, включающему введение субъекту терапевтически эффективного количества соединения формулы I. В еще одном аспекте настоящее изобретение относится к способу лечения субъекта, страдающего психиатрическим расстройством, включающему введение субъекту терапевтически эффективного количества соединения формулы I. В еще одном варианте осуществления настоящее изобретение относится к способу лечения субъекта, страдающего наркотической зависимостью, такой как хронический алкоголизм, амфетаминовая, кокаиновая или опиатная наркомания. Подробное описание изобретения Термины "гало" и "галоген", когда используются в контексте настоящего изобретения, являются взаимозаменяемыми и относятся к атому фтора, хлора, брома или йода. Термин "C1-C6-алкил" относится к насыщенному углеводороду с прямой или разветвленной цепью,содержащему от одного до шести атомов углерода включительно. Примеры таких групп включают, но не ограничиваясь ими, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-метил-2-пропил, 2-метил-1-бутил и нгексил. Выражение "C1-C6-гидроксиалкил" относится к C1-C6-алкильной группе, как определено выше,которая замещена одной гидроксильной группой. Термин "галоген(C1-C6)алкил" относится к C1-C6 алкильной группе, как определено выше, которая замещена и содержит в качестве заместителей до трех атомов галогена, например к трифторметильной группе. Выражение "C1-C6-алкокси" относится к насыщенной алкоксигруппе с прямой или разветвленной цепью, содержащей от одного до одного до шести атомов углерода включительно, с открытой валентностью на кислороде. Примеры таких групп включают, но не ограничиваясь ими, метокси, этокси, нбутокси, 2-метилпентокси и н-гексилокси. Термин "C3-C8-циклоалкил" обычно относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу или циклооктилу. Выражение "C1-C6-алкил(C3-C8)циклоалкил" относится к C3C8-циклоалкилу, как определено выше, который замещен C1-C6-алкилом с прямой или разветвленной цепью. Примеры таких групп включают, но не ограничиваясь ими, циклопропилметил. Термин "гетероциклоалкил" относится к четырех-восьмичленному кольцу, содержащему атомы углерода и от одного до трех атомов N, О или S, при условии, что 4-8-членное кольцо не содержит соседних атомов О или соседних атомов S. Открытая валентность находится на гетероатоме или на атоме углерода. Примеры таких групп включают, но не ограничиваясь ими, азетидинил, оксетанил, пиперазинил,морфолинил, тиоморфолинил и [1,4]диазепанил. Термин "гидроксигетероциклоалкил" относится к гетероциклоалкилу, как определено выше, который замещен одной гидроксильной группой. Термин "C1-C6 алкилгетероциклоалкил" относится к гетероциклоалкильной группе, как определено выше, которая замещена C1-C6-алкильной группой. Примеры таких групп включают, но не ограничиваясь ими, тетрагид-4 018880 ропиран-4-илметил и 2-морфолин-4-илэтил. Термин "арил" относится к фенильному кольцу, необязательно замещенному галогеном, C1-C6 алкилом, C1-C6-алкокси или галоген(C1-C6)алкилом, как определено выше. Примеры таких групп включают, но не ограничиваясь ими, фенил и 4-хлорфенил. Термин "C1-C6-арилалкил" относится к арилу, как определено выше, который замещен C1-C6 алкилом с прямой или разветвленной цепью. Примеры таких групп включают, но не ограничиваясь ими,бензил и 4-хлорбензил. Дополнительно, настоящее изобретение также относится к некоторым вариантам осуществления настоящего изобретения, которые описаны ниже. В одном варианте осуществления изобретения группа НЕТ представляет собой гетероароматическую группу формулы II, содержащую 2 атома азота. В другом варианте осуществления изобретения НЕТ представляет собой гетероароматическую группу формулы II, содержащую 3 атома азота. В еще одном варианте осуществления изобретения НЕТ представляет собой гетероароматическую группу формулы II, содержащую 4 атома азота. Группа НЕТ предпочтительно выбрана из представленных ниже гетероароматических групп, гдеозначает точку присоединения: В еще одном варианте осуществления изобретения гетероароматическая группа НЕТ замещена одним заместителем R7, выбранным из Н; C1-C6-алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6 гидроксиалкила, такого как СН 2 СН 2 ОН. В еще одном варианте осуществления изобретения группа НЕТ замещена двумя заместителями R7 и R8, независимо выбранными из Н; C1-C6-алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН. В еще одном варианте осуществления изобретения группа НЕТ замещена тремя заместителями R7, R8 и R9, независимо выбранными из Н; C1-C6 алкила, такого как метил; галогена, такого как хлор или бром; циано; галоген(C1-C6)алкила, такого как трифторметил; арила, такого как фенил; и C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН. В конкретном варианте осуществления изобретения R7, R8 и R9 представляют собой водород. В другом варианте осуществления изобретения по меньшей мере один из R7, R8 и R9 представляет собой C1-C6 алкил, такой как метил. В еще одном варианте осуществления изобретения по меньшей мере один из R7,R8 и R9 представляет собой галоген, такой как хлор или бром. Конкретные варианты осуществления соединения, для которых получен радикал НЕТ, представлены ниже. В конкретном варианте осуществления изобретения НЕТ представляет собой имидазо[1,2 а]пиримидин. В другом конкретном варианте осуществления изобретения НЕТ представляет собой[1,2,4]триазоло[1,5-а]пиридин. В третьем конкретном варианте осуществления изобретения НЕТ представляет собой имидазо[1,2-а]пиридин. В четвертом конкретном варианте осуществления изобретения НЕТ представляет собой имидазо[4,5-b]пиримидин. В пятом конкретном варианте осуществления изобретения НЕТ представляет собой пиразоло[1,5-а]пиридин. В шестом конкретном варианте осуществления изобретения НЕТ представляет собой [1,2,4]триазоло[1,5-а]пиримидин. В седьмом конкретном варианте осуществления изобретения НЕТ представляет собой [1,2,4]триазоло[1,5-с]пиримидин. В восьмом конкретном варианте осуществления изобретения НЕТ представляет собой [1,2,4]триазоло[1,5-а]пиразин. В другом конкретном варианте осуществления изобретения НЕТ представляет собой[1,2,4]триазоло[1,5-а]пиримидин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой [1,2,4]триазоло[1,5-а]пиридин-6-карбонитрил. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 1-метил-1 Н-бензимидазол. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 1-фенил-1 Н-бензимидазол. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 2-(6-хлорбензимидазол-1-ил)этанол. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5,7-диметил[1,2,4]триазоло[1,5-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5,7-диметилимидазо[1,2-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5-хлор-имидазо[1,2-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5-метилимидазо[1,2 а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5 трифторметилимидазо[1,2-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 6-бром-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 6-бром-7-метил[1,2,4]триазоло[1,5-5 018880 а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 6 хлор-8-метил[1,2,4]триазоло[1,5-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 6-хлоримидазо[1,2-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 7-метил[1,2,4]триазоло[1,5-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 8-метилимидазо[1,2-а]пиридин. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой имидазо[1,2 а]пиридин-7-карбонитрил. В еще одном конкретном варианте осуществления изобретения НЕТ представляет собой 5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин. Обычно НЕТ представляет собой 5,7-диметилимидазо[1,2-а]пиримидин или [1,2,4]триазоло[1,5 с]пиримидин или [1,2,4]триазоло[1,5-а]пиразин. В еще одном варианте осуществления изобретения -L- представляет собой -S-CH2-. В еще одном варианте осуществления изобретения -L- представляет собой -CH2-S-. В еще одном варианте осуществления изобретения -L- представляет собой -СН 2-СН 2-. В еще одном варианте осуществления изобретения-L- представляет собой -СН=СН-. В еще одном варианте осуществления изобретения R1 представляет собой Н. В другом варианте осуществления изобретения R1 представляет собой C1-C6-алкил с прямой или разветвленной цепью. В еще одном варианте осуществления изобретения R1 представляет собой C1-C6-гидроксиалкил. В еще одном варианте осуществления изобретения R1 представляет собой C1-C6-алкил(C3-C8)циклоалкил. В еще одном варианте осуществления изобретения R1 представляет собой C1-C6-алкилгетероциклоалкил. В еще одном варианте осуществления изобретения R1 представляет собой C1-C6-арилалкил. В еще одном варианте осуществления изобретения R1 представляет собой CH2CN. В еще одном варианте осуществления изобретения R1 представляет собой CH2C(O)NH2. В конкретном варианте осуществления изобретения R1 представляет собой метил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой этил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой 1-пропил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой 2-пропил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой изобутил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой гидроксиэтил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой циклопропилметил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой тетрагидропиран-4-илметил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой 2-морфолин-4-илэтил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой бензил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой 4-хлорбензил. В еще одном конкретном варианте осуществления изобретения R1 представляет собой CH2CN. В еще одном конкретном варианте осуществления изобретения R1 представляет собой CH2C(O)NH2. В одном варианте осуществления изобретения R2, R3, R4, R5 и R6 представляют собой водород. В другом варианте осуществления изобретения по меньшей мере один из R2, R3, R4, R5 и R6 представляет собой C1-C6-алкокси, такой как метокси. В еще одном варианте осуществления изобретения по меньшей мере один из R2, R3, R4, R5 и R6 представляет собой галоген, такой как хлор или фтор. В одном варианте осуществления изобретения R2 представляет собой водород. В другом варианте осуществления изобретения R2 представляет собой C1-C6-алкокси, такой как метокси. В еще одном варианте осуществления изобретения R2 представляет собой галоген, такой как хлор или фтор. В одном варианте осуществления изобретения R3 представляет собой водород. В другом варианте осуществления изобретения R3 представляет собой C1-C6-алкокси, такой как метокси. В еще одном варианте осуществления изобретения R3 представляет собой галоген, такой как хлор или фтор. В одном варианте осуществления изобретения R4 представляет собой водород. В другом варианте осуществления изобретения R4 представляет собой C1-C6-алкокси, такой как метокси. В еще одном варианте осуществления изобретения R4 представляет собой галоген, такой как хлор или фтор. В одном варианте осуществления изобретения R5 представляет собой водород. В другом варианте осуществления изобретения R5 представляет собой C1-C6-алкокси, такой как метокси. В дополнительном варианте осуществления изобретения R5 представляет собой галоген, такой как хлор или фтор. В одном варианте осуществления изобретения R6 представляет собой водород. В другом варианте осуществления изобретения R6 представляет собой C1-C6-алкокси, такой как метокси. В еще одном варианте осуществления изобретения R6 представляет собой галоген, такой как хлор или фтор. Следует понимать, что различные аспекты, варианты осуществления, реализации и отличительные признаки изобретения, приведенные в данном описании, могут быть заявлены отдельно или в любой комбинации, как показано в приведенных ниже примерах, которые не ограничивают объем настоящего изобретения. В конкретном варианте осуществления изобретения НЕТ представляет собой 5,7 диметилимидазо[1,2-а]пиримидин; -L- представляет собой -S-CH2- или -CH2-S-; R1 выбран из водорода,метила, 1-пропила, изобутила, циклопропилметила, бензила и 2-морфолин-4-илэтила; и R2-R6 все представляют собой водород. В еще одном конкретном варианте осуществления изобретения НЕТ выбран из 5,7 диметилимидазо[1,2-а]пиримидина,5,7-диметил[1,2,4]триазоло[1,5-а]пиридина,5,7-диметил[1,2,4]триазоло[1,5-а]пиримидина, 5-трифторметилимидазо[1,2-а]пиридина, [1,2,4]триазоло[1,5-а]пиридина и 6 хлор-8-метил[1,2,4]триазоло[1,5-а]пиридина; -L- выбран из -S-CH2-, CH2-S- и -СН 2 СН 2-; R1 выбран из водорода, метила, этила, 2-пропила, CH2CN и тетрагидропиран-4-илметила; R2-R6 представляют собой водород. В отдельных вариантах осуществления изобретения соединение формулы I выбрано из перечисленных ниже соединений в форме свободного основания, одного или нескольких таутомеров или фармацевтически приемлемой кислотно-аддитивной соли. В табл. 1 приведен перечень соединений настоящего изобретения и соответствующих значений IC50, определенных в соответствии с методиками, описанными в разделе "Биологическое испытание ингибирования PDE10A". Каждое из указанных соединений составляет отдельный вариант осуществления настоящего изобретения: Таблица 1 Соединения настоящего изобретения и значения IC50 В особом варианте осуществления настоящего изобретения значение IC50 соединений настоящего изобретения составляет менее 50 нМ, например находится в интервале 0,2-20 нМ, конкретно в интервале 0,2-10 нМ, еще более конкретно в интервале 0,2-5 нМ или в интервале 0,2-1 нМ. Выбранные соединения были тестированы на их способность к обратному изменению индуцированной фенилциклидином (РСР) гиперактивности. Результаты экспериментов показали, что соединения настоящего изобретения, тестированные в опытах in vivo, являются активными соединениями, которые обращают индуцированную РСР гиперактивность, значения которой, выраженные в %, представлены в табл. 2. Фармацевтически приемлемые соли. Настоящее изобретение включает также соли соединений, как правило, фармацевтически приемлемые соли. Такие соли включают фармацевтически приемлемые кислотно-аддитивные соли. Кислотноаддитивные соли включают соли неорганических кислот, а также соли органических кислот. Конкретные примеры подходящих неорганических кислот включают хлористо-водородную, бромисто-водородную, йодисто-водородную, фосфорную, серную, сульфаминовую, азотную и т.п. кислоты. Конкретные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую,итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пирусиновую, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памоиновую, бис-метиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспаргиновую, стеариновую, мальмитиновую, EDTA, гликолевую, п-аминобензойную, глютаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, теофиллинуксусные кислоты, а также 8 галогентеофиллины, например 8-бромтеофиллин и т.п. Дополнительные примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей включают фармацевтически приемлемые соли, приведенные в публикации Berge, S.M. et al., J. Pharm. Sci. 1977, 66, 2, содержание которой включено в данное описание посредством ссылки. Кроме того, соединения настоящего изобретения могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Обычно сольватированные формы рассматриваются как эквивалент несольватированным формам для целей настоящего изобретения. Фармацевтические композиции Настоящее изобретение дополнительно относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель или разбавитель. Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество одного из конкретных соединений, раскрытых в экспериментальной части данного описания, и фармацевтически приемлемый носитель или разбавитель. Соединения настоящего изобретения могут вводиться сами по себе или в сочетании с фармацевтически приемлемыми носителями, разбавителями или эксципиентами в разовой или множественных дозах. Фармацевтические композиции настоящего изобретения могут вводиться в препарат с фармацевтически приемлемыми носителями или разбавителями, а также с любыми другими известными адъювантами и эксципиентами в соответствии со стандартными методиками, такими как описано, например, вRemington: The Science и Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA,1995. Фармацевтические композиции могут быть специфически разработаны для введения любым подходящим способом введения, таким как пероральный, ректальный, назальный, легочный, местный (включая трансбуккальный и подъязычный), чрескожный, интрацистернальный, интраперитонеальный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) способы введения. Очевидно, что способ введения будет зависеть от общего состояния и возраста субъекта, подлежащего лечению, природы состояния, подлежащего лечению, и активного ингредиента. Фармацевтические композиции для перорального введения включают твердые дозированные фор- 16018880 мы, такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. Когда это приемлемо,композиции могут быть получены с покрытиями, такими как энтеросолюбильные покрытия, или они могут быть получены для обеспечения контролируемого высвобождения активного ингредиента, такого как постепенное или длительное высвобождение, в соответствии со способами, известными в данной области техники. Жидкие дозированные формы для перорального введения включают растворы, эмульсии, суспензии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии для инъекции, а также стерильные порошки,предназначенные для получения стерильных растворов или дисперсий для инъекции перед применением. Другие подходящие формы для введения включают, но не ограничиваясь ими, суппозитории, спреи, мази, кремы, гели, формы, вводимые при вдыхании, дермальные пластыри и импланты. Конкретные дозировки для перорального введения находятся в интервале примерно от 0,001 до примерно 100 мг/кг массы тела в день. Конкретные дозировки для перорального введения также находятся в интервале примерно от 0,01 до примерно 50 кг/кг массы тела в день. Конкретные дозировки для перорального введения также находятся в интервале примерно от 0,05 до примерно 10 мг/мг массы тела в день. Дозировки для перорального введения обычно вводятся в одной или нескольких дозах, обычно от одного до трех доз в день. Конкретная доза будет зависеть от частоты и способа введения, пола, возраста,массы тела и общего состояния субъекта, подлежащего лечению, природы и тяжести состояния, подлежащего лечению, и любых сопутствующих заболеваний, подлежащих лечению, а также других факторов,очевидных для специалиста данной области техники. Препараты также могут быть представлены в единичной дозированной форме методами, известными специалисту данной области техники. Например, конкретная единичная дозированная форма для перорального введения может содержать примерно от 0,01 до примерно 1000 мг, примерно от 0,05 до примерно 500 мг или примерно от 0,5 до примерно 200 мг. Для парентеральных способов введения, таких как внутривенное, интратекальное, внутримышечного и аналогичные способы введения, конкретные дозы составляют порядка половины дозы, применяемой для перорального введения. Настоящее изобретение также относится к способу получения фармацевтической композиции,включающему смешивание терапевтически эффективного количества соединения формулы I и по меньшей мере одного фармацевтически приемлемого носителя или разбавителя. В варианте осуществления настоящего изобретения соединение, используемое в указанном выше способе, представляет собой одно из конкретных соединений, раскрытых в экспериментальной части данного описания. Соединения настоящего изобретения обычно используются в виде свободного основания или в виде его фармацевтически приемлемой соли. Одним из таких примеров является кислотно-аддитивная соль соединения, обладающая полезными свойствами свободного основания. Когда соединение формулы I содержит свободное основание, такие соли получают стандартным способом путем обработки раствора или суспензии свободного основания формулы I молярным эквивалентом фармацевтически приемлемой кислоты. Конкретные примеры подходящих органических и неорганических кислот определены выше. Для парентерального введения могут использоваться растворы соединений формулы I в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Такие водные растворы должны быть подходящим образом забуферены, если это необходимо, и жидкому разбавителю сначала придается изотоничность с помощью достаточного количествасолевого раствора или глюкозы. Водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и интраперитонеарльного введения. Соединения формулы I могут быть легко введены в известную стерильную водную среду с использованием стандартных методик, известных специалисту данной области. Подходящие фармацевтические носители включают твердые инертные разбавители или эксципиенты, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, каолин, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту и простые низшие алкиловые эфиры целлюлозы. Примеры жидких носителей включают, но не ограничиваясь ими, сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и воду. Аналогично, носитель или разбавитель может включать любой материал для замедленного высвобождения, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, сам по себе или в смеси с воском. Фармацевтические композиции, полученные объединением соединений формулы I и фармацевтически приемлемого носителя, затем легко вводятся в различные дозированные формы, подходящие для указанных способов введения. Препараты могут быть легко получены в единичной дозированной форме способами, известными в области фармации. Препараты настоящего изобретения, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит предопределенное количество активного ингредиента и, необязательно, подходящий эксципиент. Кроме того,перорально доступные препараты могут быть представлены в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости или эмульсии типа "масло в воде" или "вода в масле". Если для перорального введения используется твердый носитель, препарат может быть представлен в виде таблетки, введен в твердую желатиновую капсулу в форме порошка или в форме пеллета или он может быть представлен в форме лепешки или пастилки. Количество твердого носителя будет изменяться в широких пределах, но будет находиться в интервале примерно от 25 мг до примерно 1 г на единицу дозы. Если используется жидкий носитель, препарат может быть представлен в форме сиропа, эмульсии,мягкой желатиновой капсулы или стерильной жидкости для инъекции, такой как водная или неводная жидкая суспензия или раствор. Фармацевтические композиции настоящего изобретения могут быть получены способами, традиционными для данной области техники. Например, таблетки могут быть получены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в стандартном аппарате для таблетирования с получением таблеток. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу,смолы и т.п. Могут использоваться любые другие адъюванты или добавки, обычно используемые для таких целей, такие как красители, вкусовые добавки, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Лечение расстройств. Как указано выше, соединения формулы I являются ингибиторами фермента PDE10A и как таковые могут применяться для лечения связанных с ним неврологических и психиатрических расстройств. Таким образом, изобретение относится к соединению формулы I или его фармацевтически приемлемой кислотно-аддитивной соли, а также к фармацевтической композиции, содержащей такое соединение, для применения при лечении нейродегенеративного расстройства, психического расстройства или наркомании у млекопитающих, включая людей; где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, например расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; и возрастное снижение умственной деятельности; и где психиатрическое расстройство выбрано из группы, включающей шизофрению, например параноидального типа, тяжелую форму шизофрении с преобладанием бессвязности, притуплнными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недефференцированного или резидуального типа; шизофрениформное расстройство; шизоаффективное расстройство, например бредового типа или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное веществом, например психоз, вызванный алкоголем, амфетамином, марихуаной,кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа; и где наркотическая зависимость представляет собой хронический алкоголизм, амфитаминовую, кокаиновую или опиатную зависимость. Соединения формулы I или их фармацевтически приемлемые соли могут применяться в комбинации с одним или несколькими другими лекарственными средствами для лечения заболеваний или состояний, для которых могут быть полезны соединения настоящего изобретения, где комбинации лекарственных средств являются более безопасными или более эффективными, чем любое одно лекарственное средство. Дополнительно, соединения настоящего изобретения могут применяться в комбинации с одним или несколькими другими лекарственными средствами, которые лечат, предупреждают, контролируют, облегчают или снижают риск побочных эффектов или токсичности соединений настоящего изобретения. Следовательно, такие другие лекарственные средства могут вводиться традиционным способом и в традиционно используемом количестве, одновременно или последовательно с соединениями настоящего изобретения. Соответственно, фармацевтические композиции настоящего изобретения включают фармацевтические композиции, которые содержат помимо соединений настоящего изобретения один или несколько других активных ингредиентов. Указанные комбинации могут вводиться как часть комбинированной единичной дозированной формы или в виде набора или в соответствии со схемой лечения, когда одно или несколько дополнительных лекарственных средств вводится(ятся) в отдельных дозированных формах как часть схемы лечения. Настоящее изобретение предоставляет способ лечения млекопитающего, включая человека, страдающего нейродегенеративным расстройством, выбранным из расстройства познавательной способности или расстройства двигательной способности, где способ включает введение субъекту терапевтически эффективного количества соединения формулы I. Настоящее изобретение предоставляет также способ лечения нейродегенеративного расстройства или состояния у млекопитающего, включая человека, включающий введение указанному млекопитающему количества соединения формулы I, эффективного для ингибирования PDE10. Настоящее изобретение предоставляет также способ лечения субъекта, страдающего психиатрическим расстройством, включающий введение субъекту терапевтически эффективного количества соединения формулы I. Примеры психиатрических расстройств, которые могут лечиться в соответствии с настоящим изобретением, включают, но не ограничиваясь ими, шизофрению, например параноидального типа, тяжелую форму шизофрении с преобладанием бессвязности, притуплнными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недефференциированного или резидуального типа; шизофрениформное расстройство; шизоаффективное расстройство,например бредового типа или депрессивного типа; бредовое расстройство; психотическое расстройство,вызванное веществом, например психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином,галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа; расстройство личности шизоидного типа; и невроз страха выбран из невроза страха панического типа; агорафобии; специфической фобии; социальной фобии; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; острого стрессового расстройства и генерализированного тревожного расстройства. Было обнаружено, что соединения формулы I или их фармацевтически приемлемые соли могут преимущественно вводиться в комбинации по меньшей мере с одним нейролептическим средством (которое может представлять собой конкретное или неконкретное нейролептическое средство) для обеспечения улучшенного лечения психиатрических расстройств, таких как шизофрения. Комбинации, применение и способы лечения согласно настоящему изобретению могут также обеспечивать преимущества в лечении тех пациентов, которые неадекватно реагируют на другие известные способы лечения или являются резистентными к ним. Таким образом, настоящее изобретение относится к способу лечения млекопитающего, страдающего психиатрическим расстройством, таким как шизофрения, включающему введение млекопитающему терапевтически эффективного количества соединения формулы I как такового или в виде комбинированной терапии вместе по меньшей мере с одним нейролептическим средством. Термин "нейролептическое средство", когда используется в данном описании, относится к лекарственным средствам, обладающим познавательным и поведенческим действием антипсихотических лекарственных средств, которые снижают спутанность сознания, бред, галлюцинации, психомоторное возбуждение у пациентов с психозами. Нейролептические средства, известные в качестве основных транквилизаторов и антипсихотических лекарственных средств, включают также, но не ограничиваясь ими, конкретные антипсихотические лекарственные средства, такие как фентиазины, которые, в свою очередь,подразделяются на алифатические производные, пиперидины и пиперазины, тиоксантены (например,цисординол), бутирофеноны (например, галоперидол), дибензоксазепины (например, локсапин), дигидроиндолоны (например, молиндон), дифенилбутилпиперидины (например, пимозид) и неконкретные антипсихотичкские лекарственные средства, такие как бензизоксазолы (например, рисперидон), сертиндол, оланзапин, кветиапин, осанетант и зипрасидон. Особенно предпочтительными нейролептическими средствами для применения согласно настоящему изобретению являются сертиндол, оланзапин, рисперидон, квитиапин, арипипразол, галоперидол,клозапин, зипрасидон и осанетант. Настоящее изобретение предоставляет также способ лечения субъекта, страдающего расстройством познавательной способности, указанный способ включает введение субъекту терапевтически эффективного количества соединения формулы I. Примеры расстройств познавательной способности, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами, деменцию, связанную с внутричерепными опухолями или травмой мозга,деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, например, расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/повышенной активности и возрастное снижение умственной деятельности. Настоящее изобретение предоставляет также способ лечения расстройства двигательной функции,включающий введение пациенту терапевтически эффективного количества соединения формулы I. Примеры расстройств двигательной функции, которые могут лечиться согласно настоящему изобретению,включают, но не ограничиваясь ими, болезнь Хантингтона и дискинезию, связанную с терапевтическим лечением агонистами дофамина. Настоящее изобретение предоставляет также способ лечения расстройства двигательной функции, выбранного из болезни Паркинсона и синдрома усталых ног, включающий введение субъекту терапевтически эффективного количества соединения формулы I. Настоящее изобретение предоставляет также способ лечения расстройства настроения, включающий введение субъекту терапевтически эффективного количества соединения формулы I. Примеры расстройств настроения и эпизодов аномального настроения, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, обширный эпизод депрессии слабого, среднего и тяжелого типа, эпизод маниакального или смешанного настроения, эпизод гипоманиакального настроения; эпизод депрессивного настроения с типичными отличительными признаками; эпизод депрессивного настроения с меланхолическими отличительными признаками; эпизод депрессивного настроения с кататоническими отличительными признаками; эпизод послеродового расстройства настроения; постинсультную депрессию; обширное депрессивное расстройство; дистимическое расстройство; незначительное депрессивное расстройство; предменструальное дисфоническое расстройство; постпсихотическое депрессивное расстройство при шизофрении; обширное депрессивное расстройство, наложенное на психическое расстройство, такое как бредовое расстройство или шизофрения; биполярное расстройство, например, биполярное расстройство I типа, биполярное расстройство II типа, и циклотимическое расстройство. Следует представлять, что расстройство настроения является психиатрическим расстройством. Настоящее изобретение относится также к способу лечения наркотической зависимости, например хронического алкоголизма, амфетаминовой, кокаиновой или опиатной наркомании, у млекопитающего,включая человека, где указанный способ включает введение указанному млекопитающему количества соединения формулы I, эффективного в лечении наркотической зависимости. Настоящее изобретение относится также к способу лечения наркотической зависимости, например хронического алкоголизма, амфетаминовой, кокаиновой или опиатной наркомании, у млекопитающего,включая человека, где указанный способ включает введение указанному млекопитающему количества соединения формулы I, эффективного в ингибировании PDE10. Термин "наркотическая зависимость", когда используется в данном описании, означает патологическую потребность в наркотическом средстве и обычно характеризуется мотивационными нарушениями психического равновесия, такими как компульсивные побуждения принимать желаемое наркотическое средство, и эпизодами страстного желания потребления наркотического средства. Наркотическая зависимость является достаточно широко изучаемым патологическим состоянием. Расстройство зависимости включает прогрессирование расстройства от острого употребления наркотических средств до развития поведения изыскания наркотических средств, восприимчивости к рецидиву их приема и сниженной, замедленной способности реагировать на природно-полезные стимулы. Например, в монографии Diagnostic and Statistical Manual of Mental Disorders определены три стадии зависимости: увлечение/антиципация, пьянство/интоксикация и абстиненция/негативная эмоциональная реакция. Эти стадии характеризуются, соответственно, повсеместной постоянной сильной потребностью употребления и озабоченностью в получении вещества; использованием большего количества вещества, чем это необходимо для ощущения эффектов интоксикации; и ощущение симптомов толерантности и абстиненции, а также снижение мотивации к нормальной жизнедеятельности. Настоящее изобретение дополнительно предоставляет способ лечения расстройства, включающего в качестве симптома дефицит внимания и/или познавательной способности, у млекопитающего, включая человека, где указанный способ включает введение указанному млекопитающему количества соединения формулы I, эффективного в лечении указанного расстройства. Другими расстройствами, которые могут быть подвергнуты лечению согласно настоящему изобретению, являются обсессивно-компульсивные расстройства, синдром Тауретта и другие такие расстройства. Термин "нейродегенеративное расстройство или состояние", когда используется в данном описании и если не указано иное, относится к расстройству или состоянию, которое вызвано дисфункцией и/или гибелью нейронов центральной нервной системы. Лечению указанных расстройств и состояний может способствовать введение средства, которое предупреждает дисфункцию или гибель нейронов при риске таких расстройств или состояний и/или повышает функцию поврежденных или здоровых нейронов таким образом, что компенсирует потерю функции, вызванную дисфункцией или гибелью нейронов повышенного риска. Термин "нейротрофическое средство", когда используется в данном описании, относится к веществу или средству, которое обладает некоторыми из указанных свойств или всеми указанными свойствами. Примеры нейродегенеративных расстройств и состояний, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, болезнь Паркинсона, болезнь Хантингтона; деменцию, например деменцию при болезни Альцгеймера, мультиинфарктную деменцию, деменцию,связанную со СПИДом, лобно-височную деменцию; нейродегенерацию, связанную с травмой мозга; нейродегенерацию, связанную с инсультом; нейродегенерацию, связанную с церебральным инфарктом; нейродегенерацию, вызванную гипогликемией; нейродегенерацию, связанную с эпилептическим припадком; нейродегенерацию, связанную с отравлением нейротоксинами; и мультисистемную атрофию. В одном варианте осуществления настоящего изобретения в нейродегенеративное расстройство или состояние вовлечена нейродегенерация стриарных средних шипиковых нейронов у млекопитающих,включая человека. В дополнительном варианте осуществления настоящего изобретения нейродегенеративной расстройство или состояние представляет собой болезнь Хантингтона. В еще одном варианте осуществления изобретение относится к способу лечения субъекта для снижения содержания жира в организме, для снижения массы тела или лечения инсулиннезависимого сахарного диабета (NIDDM), метаболического синдрома или толерантности к глюкозе, включающему вве- 20018880 дение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы I. В предпочтительных вариантах осуществления изобретения субъектом является человек,который имеет избыточный вес или страдает ожирением, и антагонист вводится перорально. В другом предпочтительном варианте осуществления изобретения способ дополнительно включает введение субъекту второго терапевтического средства, предпочтительно лекарственного средства для лечения ожирения, например, римонабанта, орлистата, сибутрамина, бромокриптина, эфедрина, лептина, псевдоэфедрина, пептида YY3-36 или их аналогов. Термин "метаболический синдром", когда используется в данном описании, относится к констелляции состояний, которые приводят к высокому риску возникновения у людей заболевания коронарной артерии. Такие состояния включают диабет 2 типа, ожирение, высокое кровяное давление и плохой липидный профиль с повышенным содержанием LDL ("плохого") холестерина, низким содержание HDL("хорошего") холестерина и повышенным содержанием триглицеридов. Все такие состояния связаны с высокими уровнями содержания инсулина в крови. Основным нарушением при метаболическом синдроме является инсулинорезистентность в жировой ткани и мышце. Все ссылки, включая публикации, патентные заявки и патенты, цитированные в данном описании,включены в данное описание посредством ссылки во всей их полноте и в той же степени, как если бы каждая публикация была отдельно указана как введенная в описание посредством ссылки и внесена в описание во всей полноте (в максимальной степени, разрешенной законом). Заголовки и подзаголовки используются в данном описании только для удобства и не должны рассматриваться как ограничивающие настоящее изобретение каким-либо образом. Применение любого примера или всех примеров или выражений, указывающих на примеры (включая "например" и "такой как"), в настоящем описании предназначено только для более полного освещения настоящего изобретения, но не для ограничения объема изобретения, если не указано иное. Цитирование и введение патентных документов выполнено только для удобства и не отражает какой бы то ни было оценки обоснованности, патентоспособности и/или обладание исковой силой указанных патентных документов. Настоящее изобретение включает все модификации и эквиваленты объектов, указанных в прилагаемой формуле изобретения, насколько это разрешено законом. Экспериментальная часть. Получение соединений настоящего изобретения Соединения общей формулы I настоящего изобретения могут быть получены согласно приведенным ниже схемам реакций. Если не указано иное, на схемах реакций и последующих обсуждениях НЕТ,R1-R9, -L-, Z и Y являются такими, как определено выше. Соединения формулы I, где -L- представляет собой -S-СН 2-, могут быть получены связыванием нуклеофила формулы III или IIIa с электрофилом формулы IV, где X представляет собой удаляемую группу, например Cl, Br, I, метансульфонил, 4-толуолсульфонил, как показано на схеме 1. При взаимодействии соединения IIIa с соединением IV алкилирование атома серы в соединении IIIa под действием соединения IV и закрытие кольца с образованием триазольного кольца происходят в одних и тех же условиях в соответствии с методикой проведения процесса в одном реакторе. Схема 1 Данную реакцию обычно проводят в растворителе, таком как 1-пропанол, толуол, ДМФА или ацетонитрил, необязательно в присутствии карбонатного основания, такого как карбонат калия, или третичного аминного основания, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в интервале примерно от 0 до примерно 200 С, необязательно в закрытом реакторе под давлением. Другие подходящие растворители включают бензол, хлороформ, диоксан, этилацетат, 2-пропанол и ксилол. Альтернативно, могут использоваться смеси растворителей, такие как смесь толуол/2-пропанол. Соединения формулы III являются либо коммерчески доступными, либо могут быть получены как описано в литературе (см., например, Brown et al. Aust. J. Chem. 1978, 31, 397-404; Yutilov et al. Khim.WO 96/01826, из соответствующих 1,2-диаминопиридинов путем взаимодействия тиокарбонилдиимидазола в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как комнатная температура или 40 С. Необходимый 1,2-диаминопиридин может быть легко получен из соответствующих коммерчески доступных 2-аминопиридинов путем взаимодействия с подходящим реагентом Nаминирования, таким как О-(мезитилсульфонил)гидроксиламин, в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как 0 С или комнатная температура (см. WO 96/01826). 2-Галогенметил-4-(арил)-1 Н-имидазолы формулы IV могут быть получены галогенированием соответствующих 2-гидроксиметил-4-(арил)-1 Н-имидазолов с использованием подходящего реагента, например тионилхлорида, трихлорида фосфора или трибромида фосфора, необязательно с использованием подходящего растворителя, такого как дихлорметан, и методов, хорошо известных специалистам данной области. Необходимые 2-гидроксиметил-4-(арил)-1 Н-имидазолы могут быть получены способами, известными в данной области (см., например, Magdolen, P.; Vasella, A. Helv. Chim. Acta 2005, 88, 24542469; Song, Z. et al. J. Org. Chem. 1999, 64, 1859-1867). Соединения формулы I, где -L- представляет собой -СН 2-S-, могут быть получены связыванием нуклеофила формулы X с электрофилом формулы VI, как показано на схеме 2. Схема 2 Данную реакцию обычно проводят в растворителе, таком как 1-пропанол, толуол, ДМФА или ацетонитрил, необязательно в присутствии карбонатного основания, такого как карбонат калия, или третичного аминного основания, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в интервале примерно от 0 до примерно 200 С, необязательно в закрытом реакторе под давлением. Другие подходящие растворители включают бензол, хлороформ, диоксан, этилацетат, 2-пропанол и ксилол. Альтернативно, могут использоваться смеси растворителей, такие как смесь толуол/2-пропанол. Некоторые электрофилы формулы VI являются коммерчески доступными, и многие другие являются известными соединениями (см., например, JP 591762779). Электрофил VI, где X представляет собой удаляемую группу, например Cl, Br, I, метансульфонил, 4-толуолсульфонил, также может быть получен преобразованием группы первичного спирта соединений формулы V в указанную удаляемую группу способами, известными специалистам данной области. Указанные способы могут быть выбраны, например, из взаимодействия соединений формулы V с тионилхлоридом, трихлоридом фосфора, трибромидом фосфора, метансульфонилхлоридом или 4-толуолсульфонилхлоридом, необязательно в присутствии подходящего растворителя, такого как дихлорметан или 1,2-дихлорэтан, и необязательно в присутствии основания, такого как триэтиламин, диизопропилэтиламин или пиридин. Альтернативно, электрофилы формулы VI могут быть получены взаимодействием коммерчески доступных ароматических аминов формулы VII с 1,3-дигалогенацетонами формулы IX, например 1,3-дихлорацетоном, в подходящем растворителе, таком как 1,2-диметоксиэтан или этанол, при подходящей температуре, такой как комнатная температура или температура кипения с обратным холодильником. Некоторые электрофилы формулы V являются коммерчески доступными, и многие другие являются известными соединениями (см., например, Tsuchiya, Т.; Sashida, H. J. Chem. Soc., Chem. Commun.1980, 1109-1110; Tsuchiya, Т.; Sashida, H.; Ko- 22018880noshita, A. Chem. Pharm. Bull. 1983, 31, 4568-4572). Альтернативно, спирты формулы V могут быть получены путем взаимодействия коммерчески доступных ароматических аминов формулы VII с подходящим реагентом N-аминирования, таким как O-(мезитилсульфонил)гидроксиламин, в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как 0 С или комнатная температура (см.WO 96/01826), с получением соединений формулы VIII. Указанные соединения формулы VIII могут быть преобразованы в соединения формулы V путем взаимодействия с метилгликолятом с последующим восстановлением метилового эфира до нужного спирта с использованием подходящего восстановителя,такого как алюмогидрид лития, в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, с использованием способов, известных специалистам данной области. Соединения формулы X являются либо коммерчески доступными соединениями, либо могут быть получены, как описано в литературе (см., например, Kjellin, G.; Sandstrm, J. Acta Chem. Scand. 1969, 23,2879-2887; Laufer, S.A. et al. Synthesis, 2008, 253-266). Соединения формулы I, где R1 не является водородом, могут быть получены алкилированием соединений формулы I, где R1 представляет собой водород, алкилгалогенидом формулы XI, как показано на схеме 3. Схема 3 Данную реакцию обычно проводят в подходящем растворителе, таком как диметилформамид, диметилацетамид или ацетонитрил, в присутствии подходящего основания, такого как карбонатное основание, например карбонат калия, или третичного аминного основания, например триэтиламина или диизопропилэтиламина (DIPEA), при температуре в интервале примерно от 0 до примерно 100 С. Соединения формулы I, где -L- представляет собой -СН=СН- или -СН 2-СН 2-, могут быть получены в соответствии с последовательностью реакций, представленной на схеме 4. Схема 4 В частности, соединения формулы I, где -L- представляет собой -СН 2-СН 2-, могут быть получены восстановлением алкена формулы I, где -L- представляет собой -СН=СН-, путем гидрирования с использованием катализатора переходного металла, такого как металлический палладий, с источником водорода, таким как газообразный водород, гидрокарбоната аммония или циклогексадиена. Указанные алкены формулы I, где -L- представляет собой -СН=СН-, могут быть получены реакцией Виттига между солью фосфония формулы XII и альдегидом формулы XIII в подходящем растворителе, таком как тетрагидрофуран, в присутствии подходящего основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен. Соль фосфония формулы XII является легко доступным соединением, которое может быть получено путем взаимодействия соединений формулы VI (см. схему 2 выше) с трифенилфосфином способами, известными специалистам данной области. Альдегиды формулы XIII могут быть легко получены окислением спиртов формулы V (см. схему 2 выше) способами, известными специалистам данной области, например, путем взаимодействия спиртов формулы V с подходящим окислителем, таким как периодинан Десса-Мартина,в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан. Изобретение, раскрытое в данном описании, дополнительно проиллюстрировано приведенными ниже примерами, которые, тем не менее, не являются примерами, ограничивающими объем настоящего изобретения. Общие способы. Данные анализа ЖХ-МС получают с использованием одного из следующих способов. Способ А. Используют аппарат РЕ Sciex API 150EX, снабженный фотоионизацией атмосферного давления, и ЖХ-систему Shimadzu LC-8A/SLC-10A. Колонка: 4,630 мм Waters Symmetry C18 с размером частиц 3,5 мкм; температура колонки: 60 С; система растворителей: А=вода/трифторуксусная кислота(100:0,05), В=вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); элюирование с линейным градиентом: А:В=от 90:10 до 0:100 в течение 2,4 мин при объемной скорости истечения 3,3 мл/мин. Способ В. Используют ЖХ-МС систему An Agilent 1100 с масс-детектором G1946C или G1946A. Колонка: 2,050 мм YMC ODS-AQ с размером частиц 5 мкм; температура колонки: 50 С; система растворителей: А=вода/трифторуксусная кислота (99,9:0,1), В=ацетонитрил/трифторуксусная кислота (99,95:0,05); элюирование с линейным градиентом: А:В=от 95:5 до 0:100 в течение 3,5 мин при объемной скорости истечения 0,8 мл/мин. Способ С. Используют аппарат РЕ Sciex API 300, снабженный фотоионизацией атмосферного давления, и систему Waters UPLC. Колонка: Acquity UPLC ВЕН C18 1,7 мкм, 2,150 мм (Waters); температура колонки: 60 С; система растворителей: А=вода/трифторуксусная кислота(100:0,05) и В=вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); элюирование с линейным градиентом: А:В=от 90:10 до 0:100 в течение 1,0 мин при объемной скорости истечения 1,2 мл/мин. Способ D. Используют ЖХМС систему Agilent 1100 с масс-детектором G1946C или G1946A. Колонка: 2,050 мм YMC ODS-AQ с размером частиц 5 мкм; температура колонки: 50 С; система растворителей: А=вода/трифторуксусная кислота (99,9:0,1), В=ацетонитрил/трифторуксусная кислота (99,95:0,05); элюирование с линейным градиентом: А:В=от 90:10 до 0:100 в течение 3,4 мин при объемной скорости истечения 0,8 мл/мин. Способ Е. Используют аппарат РЕ Sciex API 150EX, снабженный фотоионизацией атмосферного давления, и ЖХ систему Shimadzu LC-8A/SLC-10A. Колонка: 4,630 мм Waters Symmetry C18 с размером частиц 3,5 мкм; температура колонки: 60 С; система растворителей: А=вода/трифторуксусная кислота (99,95:0,05) и В=метанол/трифторуксусная кислота (99,965:0,035); элюирование с линейным градиентом: А:В=от 83:17 до 0:100 в течение 2,4 мин при объемной скорости истечения 3,0 мл/мин. Очистку с использованием препаративной ЖХ-МС проводят на аппарате РЕ Sciex API 150EX с химической ионизацией при атмосферном давлении. Колонка: 5020 мм YMC ODS-A с размером частиц 5 мкм; элюирование с линейным градиентом: А:В=от 80:20 до 0:100 в течение 7 мин при объемной скорости истечения 22,7 мл/мин. Сбор фракций проводят с помощью МС детектора разделенного потока. 1 Н ЯМР спектры записывают при 500,13 МГц на аппарате Bruker Avance AV500, при 250,13 МГц на аппарате Bruker Avance DPX250. В качестве внутреннего стандарта используют ТМС. Значения химического сдвига выражают в м.д. Для обозначения мультиплетности ЯМР сигналов используют следующие аббревиатуры: с означает синглет, д означает дуплет, т означает триплет, кв означает квартет, квин означает квинтет, г означает гептет, дд означает дуплет дуплетов, дт означает дуплетный триплет, дкв означает квартет дуплетов, тт означает триплет триплетов, м означает мультиплет, уш.с означает уширенный синглет, уш. означает уширенный сигнал. Аббревиатуры соответствуют ACS Styl Guide: "The ACS Styleguide - A manual for authors и editors" Используют адаптированный способ, описанный в публикации Song et al., J. Org. Chem. 1999, 64,1859. В круглодонную колбу, снабженную входным отверстием для ввода азота, отверстием для вывода газа в скруббер и датчиком температуры, загружают ДМСО (113 мл) и ацетофенон 1 (10 г, 83,2 ммоль). Раствор нагревают до 60 С и медленно с помощью капельной воронки добавляют водную HBr, поддер- 24018880 живая температуру реакции в интервале от 60 до 68 С. Для удаления диметилсульфоксида, когда он образуется, используют очистку азотом. После завершения добавления HBr температуру реакционной смеси поддерживают на уровне 65 С с помощью внешнего нагрева до завершения реакции. Реакцию гасят,выливая реакционную смесь в воду, смесь экстрагируют этилацетатом с получением 2,2-дигидрокси-1 фенилэтанона 2. Ход реакции контролируют ТСХ. В круглодонную колбу загружают метил-2-гидрокси-2-метоксиацетат (2,14 г, 25,9 ммоль) и ацетат аммония (4,108 г, 52 ммоль) в метаноле (30 мл), по каплям при перемешивании добавляют уксусную кислоту (30 мл) и затем раствор 2,2-дигидрокси-1-фенилэтанона 2 (2 г, 13 ммоль) в метаноле. Спустя 1,5 ч реакционную смесь концентрируют в вакууме и затем смешивают с 0,5 н. хлористо-водородной кислотой. Раствор промывают этилацетатом. Водный слой подщелачивают 5 н. гидроксидом натрия до рН 9 и экстрагируют этилацетатом 3 раза. Объединенный органический слой сушат над Na2SO4. Раствор упаривают досуха с получением метилового эфира 4-фенил-1 Н-имидазол-2-карбоновой кислоты 3. К раствору соединения 3 (1,0 г, 5 ммоль) в ДМФА (20 мл) добавляют йодметан (4 мл, 7,5 ммоль) иK2CO3 (1,0 г, 7,5 ммоль) и смесь перемешивают при 60 С в течение 1 ч до тех пор, пока ТСХ (петролейный эфир/EtOAc=5/1) не покажет, что соединение 3 полностью израсходовано. Реакционную смесь разбавляют насыщенным раствором соли (20 мл) и экстрагируют этилацетатом (210 мл). Объединенные органические слои сушат над безводным Na2SO4, фильтруют и концентрируют в вакууме с получением соединения 4 (0,83 г, 78%). 1 Н ЯМР (400 МГц, CDC13):7,81-7,78 (м, 2 Н), 7,39-7,35 (м, 2 Н), 7,32 (с, 1 Н), 7,29-7,25 (м, 1 Н), 4,05-5 С в атмосфере N2. Смесь перемешивают при -10 С в течение 2 ч и реакцию гасят водным растворомNH4Cl при 0 С до доведения рН до 6. Полученную смесь экстрагируют EtOAc (320 мл) и объединенные органические слои промывают насыщенным раствором соли (30 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении с получением соединения 5 (0,5 г, 75%). 1 Н ЯМР (400 МГц, ДМСО-d6):7,69-7,67 (м, 2 Н), 7,53 (с, 1 Н), 7,30 (т, J=7,6 Гц, 2 Н), 7,15-7,12 (м,1 Н), 5,30 (т, J=5,6 Гц, 1 Н), 4,48 (д, J=5,6 Гц, 2 Н), 3,65 (с, 3 Н). К раствору (1-метил-4-фенил-1 Н-имидазол-2-ил)метанола 5 (0,2 г, 0,097 ммоль) добавляют SOCl2(0,14 г, 0,121 ммоль) и смесь перемешивают при комнатной температуре в течение ночи. Смесь упаривают с получением 2-хлорметил-1-метил-4-фенил-1 Н-имидазола 6, который используют в следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, ДМСО-d6):8,24 (с, 1 Н), 7,87 (д, J=6,8 Гц, 2 Н), 7,54-7,49 (м, 2 Н), 7,43-7,41 (м,1 Н), 5,24 (с, 2 Н), 3,89 (с, 3 Н). Аналогично получают следующие промежуточные продукты: 2-хлорметил-1-этил-4-фенил-1 Н-имидазол, 95% выход,1 Н ЯМР (400 МГц, ДМСО-d6):8,36 (с, 1 Н), 7,92-7,89 (м, 2 Н), 7,51-7,47 (м, 2 Н), 7,43-7,39 (м, 1 Н),5,26 (с, 2 Н), 4,24 (кв, J=7,2 Гц, 2 Н), 1,46 (т, J=7,2 Гц, 3 Н); 2-хлорметил-1-изопропил-4-фенил-1 Н-имидазол, 100% выход,1 Н ЯМР (400 МГц, ДМСО-d6):8,54 (с, 1 Н), 7,93 (д, J=7,6 Гц, 2 Н), 7,52-7,29 (м, 3 Н), 5,28 (с, 2 Н),4,84-4,75 (м, 1 Н), 1,50 (д, J=6,8 Гц, 6 Н); 2-хлорметил-4-(2-фторфенил)-1-метил-1 Н-имидазол, 80% выход,1 Н ЯМР (400 МГц, ДМСО-d6):8,06-8,02 (м, 1 Н), 7,91 (д, J=3,2 Гц, 1 Н), 7,41-7,38 (с, 1 Н), 7,34-7,29 К раствору (1-метил-4-фенил-1 Н-имидазол-2-ил)метанола 5 (50,0 мг, 0,266 ммоль) в 1,2 дихлорэтане (4,0 мл) в атмосфере Ar добавляют периодинан Десса-Мартина (DMP) (124 мг, 0,292 ммоль) и полученную смесь перемешивают при комнатной температуре в течение 2 ч. К реакционной смеси добавляют насыщенный раствор NaHCO3, органический слой отделяют и водный слой экстрагируют 1,2 дихлорэтаном. Объединенные органические слои сушат над Na2SO4, летучие компоненты выпаривают и остаток очищают хроматографией (силикагель, FlashMaster system, элюирование с градиентом: 0-100% этилацетат в гептане) с получением указанного в заголовке соединения в виде белого твердого вещества Используют адаптированный способ публикации WO 96/01826. К раствору этил-Омезитилсульфонилацетогидроксамата 7 (1,7 г, 6,0 ммоль) в 1,4-диоксане (10 мл), охлажденному на ледяной бане (при 8-9 С), по каплям в течение 15 мин добавляют 70% перхлорную кислоту (7,5 мл), поддерживая температуру реакционной смеси ниже 15 С. Затем смесь разбавляют ледяной водой (100 мл) для осаждения продукта O-(мезитилсульфонил)гидроксиламина 8, который отделяют фильтрованием, тщательно промывают водой и сразу влажным растворяют в хлороформе (10 мл) (Осторожно: соединение 8 взрывоопасно в сухом виде). Органический слой отделяют и пропускают через слой Na2SO4 во фриттовом шприце для удаления воды. Полученный таким образом раствор О(мезитилсульфонил)гидроксиламина 8 по каплям добавляют к раствору 2-амино-4,6-диметилпиридина 9(0,611 г, 5,00 ммоль) в хлороформе (10 мл), охлажденному на ледяной бане. Затем смесь нагревают до комнатной температуры и перемешивают в течение 2 ч для эффективного преобразования в промежуточный продукт 10. Далее в реакционную смесь добавляют 1,1'-тиокарбонилдиимидазол 11 (1,16 г, 6,5 ммоль) и полученную смесь перемешивают при 40 С в течение ночи. Летучие компоненты выпаривают и остаток очищают хроматографией (силикагель, элюирование с градиентом: гептан:этилацетат 100:00:100) с получением (2-имино-4,6-диметил-2 Н-пиразин-1-ил)амида имидазол-1-карботионовой кислоты в виде не совсем белого твердого вещества (0,50 г, 40%), содержащего незначительно количество остаточного имидазола. 1 Н ЯМР (500 МГц, ДМСО-d6):7,88 (с, 1 Н), 7,64 (с, 1 Н), 7,42 (уш.с, 2 Н), 6,93 (с, 1 Н), 6,69 (с, 1 Н),6,67 (с, 1 Н), 2,28 (с, 3 Н), 2,27 (с, 3 Н). Аналогично получают приведенные ниже промежуточные соединения, которые используют для получения конечных соединений без предварительной очистки и идентификации:Scand. 1969, 23, 2879-2887. Смесь гидрохлорида 2-метиламино-1-фенилэтанона (0,754 г, 4,06 ммоль) (см.,например, Hyde et al. J. Am. Chem. Soc. 1928, 50, 2287-2292; Shang et al. Chem. Eur. J. 2007, 13, 7780-7784) и тиоцианата калия (0,434 г, 4,46 ммоль) в уксусной кислоте (12 мл) выдерживают при 140 С в течение 10 мин с использованием микроволнового аппарата синтеза. Разбавление водой (50 мл) с последующим охлаждением на ледяной бане приводит к образованию осадка. Осадок отделяют фильтрованием, промывают водой и сушат в вакууме с получением указанного в заголовке чистого соединения (0,365 г,47%) в виде не совсем белого твердого вещества. 1H ЯМР (500 МГц, ДМСО-d6):12,66 (уш. с, 1 Н), 7,65 (д, J=7,6 Гц, 2H), 7,60 (с, 1 Н), 7,39 (т, J=7,8 Гц, 2 Н), 7,27 (т, J=7,4 Гц, 1 Н), 3,49 (с, 3 Н). Аналогично получают следующий промежуточный продукт: 4-фенил-1,3-дигидроимидазол-2-тион, 80% выход; 1 Н ЯМР (500 МГц, ДМСО-d6):2,53 (уш. с, 1 Н), 12,15 (уш. с, 1 Н), 7,69-7,65 (м, 2 Н), 7,41-7,35 (м,3 Н) 7,27 (т, J=7,4 Гц, 1 Н). 4-Фенил-1 Н-имидазол-2-карбальдегид Раствор моногидрата фенилглиоксаля (102 г, 0,67 моль) и глиоксальдиметилацеталя (60% раствор в воде, 232 мл, 1,54 моль) в метаноле (1,1 л) обрабатывают раствором ацетата аммония (202 г, 2,61 моль) в метаноле (1,1 л) и полученный раствор перемешивают при комнатной температуре в течение 16 ч. Летучие компоненты удаляют в вакууме, остаток суспендируют в 2 н. растворе HCl (1,1 л), суспензию нагревают до 80 С и выдерживают при указанной температуре в течение 30 мин. Охлажденный раствор экстрагируют EtOAc (200 мл) и отделенный водный слой подщелачивают до рН 9 9 н. раствором NaOH. Твердые вещества отфильтровывают, промывают водой и сушат в вакууме с получением указанного в заголовке соединения (97,2 г, 84%) в виде светло-коричневого твердого вещества. ЖХ-МС: m/z=173,0 (МН+),tR=0,66 мин, способ С. 1-(2-Гидроксипропил)-4-фенил-1 Н-имидазол-2-карбальдегид В закрытом реакторе взвесь 4-фенил-1 Н-имидазол-2-карбальдегида (200 мг, 1,16 ммоль) и карбоната натрия (60 мг, 0,6 ммоль) в этаноле (4 мл) обрабатывают пропиленоксидом (170 мкл, 2,4 ммоль), нагревают до 100 С и выдерживают при данной температуре в течение 3 ч. Охлажденный раствор фильтруют и твердые вещества промывают ДХМ. Летучие компоненты удаляют в вакууме с получением указанного в заголовке неочищенного соединения, которое используют далее без дополнительной очистки(250 мг, 63%). ЖХ-МС: m/z=231,5 (MH+), tR=0,41 мин, способ А. Аналогично получают следующие промежуточные продукты, которые используют для получения конечных соединений без дополнительной очистки или идентификации: Раствор 2-амино-4,6-диметилпиримидина (2,46 г, 20,0 ммоль) и 1,3-дихлор-2-пропанона (2,67 г, 21,0 ммоль) в 1,2-диметоксиэтане (20 мл) перемешивают при 45 С в течение ночи. Образуется осадок, который отделяют фильтрованием, и смесь затем кипятят с обратным холодильником с этанолом (15 мл) в течение 2 ч. После охлаждения смеси до комнатной температуры продукт выпадает в осадок в виде белых игл, которые отделяют фильтрованием и сушат в вакууме с получением указанного в заголовке чистого соединения в виде гидрохлоридной соли (883 мг, 19%). 1H ЯМР (500 МГц, ДМС 0-d6):7,84 (с, 1 Н), 6,88 (с, 1 Н), 4,84 (с, 2 Н), 2,60 (с, 3 Н), 2,49 (с, 3 Н). Аналогично, но проводя первую стадию реакции при температуре 90 С, получают следующий промежуточный продукт: гидрохлорид 2-хлорметилимидазо[1,2-а]пиримидина, 62% выход; ЖХ-МС: m/z=168,2 (MH+), tR=0,13 мин, способ А. 2-Хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин 2-Хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин. К раствору 4,6-диметилпиримидин-2-иламина (25 г, 200 ммоль) в 400 мл CH2Cl2 по каплям добавляют раствор гидроксиламин-2,4,6-триметилбензолсульфоната (105 г, 488 ммоль) в 300 мл CH2Cl2 при 0 С, полученную смесь перемешивают при 0 С в течение 1 ч и фильтруют. Отделенный твердый продукт промывают CH2Cl2 (100 мл) с получением 2,4,6-триметилбензолсульфоната 1-амино-4,6-диметил-1 Нпиримидин-2-илиденаммония (40 г, выход: 62%). Смесь 2,4,6-триметилбензолсульфоната 1-амино-4,6-диметил-1 Н-пиримидин-2-илиденаммония (40 г, 0,1 моль) и NaOH (10 г, 0,2 моль) в 500 мл EtOH перемешивают при 50-60 С в течение 1 ч. К смеси добавляют метиловый эфир хлоруксусной кислоты (16,6 г, 0,15 моль) и полученную смесь кипятят с обратным холодильником при перемешивании в течение 4 ч. Смесь концентрируют при пониженном давлении, к остатку добавляют воду (1000 мл) и смесь экстрагируют CH2Cl2 (300 мл 3). Объединенные органические слои промывают насыщенным раствором соли (200 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией (колонка, силикагель; элюирование: петролейный эфир/EtOAc=2/1) с получением 2 г 2-хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидина с выходом 9%. 1 Н ЯМР (300 МГц, ДМСО-d6):8,55 (с, 1 Н), 6,25 (с, 2 Н), 4,05 (с, 3 Н), 3,95 (с, 3 Н); ЖХ-МС (МН+):m/z=196,9, tR (мин, способ А)=0,52. Аналогично получают следующие промежуточные продукты: 7-хлор-2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-с]пиримидин получают из 6-хлор-2,5 диметилпиримидин-4-иламина, как описано в публикации Henze et al. J. Org. Chem 1952, 11, 1320-1327; выход 3,2% выход; ЖХ-МС: m/z=231,5 (MH+), tR=1,13 мин, способ Е; 2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразин получают из 2-амино-3,6-диметилпиразина; выход 60%; 1 Н ЯМР (500 МГц, CDCl3):7,91 (с, 1 Н), 4,87 (с, 2 Н), 2,91 (с, 3 Н), 2,74 (с, 3 Н); ЖХ-МС: m/z=196, 9 Используют способ, описанный Vanelle et al. Tetrahedron 1991, 41, 5173-5184. К раствору 1,3 дихлор-2-пропанона (2,69 г, 21,2 ммоль) в 1,2-диметоксиэтане (5 мл) добавляют 2-аминопиридин и полученную смесь перемешивают при комнатной температуре в течение 2 ч. В течение этого времени образуется густой осадок, который отделяют фильтрованием. Осадок кипятят с обратным холодильником в абсолютном этаноле в течение 2 ч, после чего летучие компоненты удаляют выпариванием. Остаток растворяют в воде (30 мл) и к раствору добавляют твердый NaHCO3 для нейтрализации смеси. Образуется твердый осадок, который отделяют фильтрованием, промывают водой и сушат в вакууме с получением указанного в заголовке чистого соединения в виде светло-кремового твердого вещества (1,43 г, 42%). 1 Н ЯМР (500 МГц, CDCl3):8,08 (д, J=6,7 Гц, 1 Н), 7,62 (с, 1 Н), 7,58 (д, J=9,0 Гц, 1 Н), 7,17-7,22 (м,1 Н), 6,80 (т, J=6,8 Гц, 1 Н), 4,78 (с, 2 Н). Аналогично получают следующий промежуточный продукт: 2-хлорметил-8-метилимидазо[1,2-а]пиридин, выход 53%; 1 Н ЯМР (500 МГц, CDCl3):7,95 (д, J=6,9 Гц, 1 Н), 7,61 (с, 1 Н), 6,97 (дт, J=7,0 Гц, 1,1 Гц, 1 Н), 6,70 К раствору 0,79 г гидроксида натрия в этаноле (20 мл) добавляют 2-имино-4,6-диметил-2 Н-пиразин 1-иламин (1,7 г, 0,012 моль; полученный ВЭЖХ очисткой промежуточного продукта 10). Смесь перемешивают при 50-60 С в течение 1 ч, добавляют метилгликолят (1,4 г, 0,016 моль) и полученную смесь кипятят с обратным холодильником при перемешивании в течение 6 ч. Растворители удаляют при пониженном давлении, остаток очищают хроматографией (колонка, силикагель; элюирование: этилацетат) с получением (5,7-диметил[1,2,4]триазоло[1,5-а]пиридин-2-ил)метанола (0,2 г, 10%); 1 Н ЯМР (300 МГц, ДМСО-d6):7,39 (с, 1 Н), 6,87 (с, 1 Н), 5,38 (т, J=6,3 Гц, 1 Н), 4,59 (д, J=6,3 Гц,2 Н), 2,64 (с, 3 Н), 2,38 (с, 3 Н). Смесь полученного соединения (31 мг, 0,175 ммоль) и SOCl2 (10 мл) в сухом CH2Cl2 (10 мл) перемешивают при комнатной температуре в течение 2 ч. Растворитель и избыток SOCl2 выпаривают в вакууме с получением указанного в заголовке соединения в виде неочищенного продукта, который используют для получения конечных соединений без дополнительной очистки и идентификации. Следующие соединения известны в данной области техники: 2-хлорметил-1-фенил-1 Н-бензимидазол (JP 59176277); 1-метил-1,3-дигидробензимидазол-2-тион (Wilde et al. Bioorg. Med. Chem. Lett. 1995, 5, 167-172); 1-фенил-1,3-дигидробензимидазол-2-тион (Kidwai et al. J. Korean Chem. Soc. 2005, 49, 288-291);[1,2,4]триазоло[1,5-а]пиримидин-2-тион (Brown et al. Aust. J. Chem. 1978, 31, 397-404); 1,3-дигидроимидазо[4,5-b]пиридин-2-тион (Yutilov et al. Khim. Geter. Soedin. 1988, 799-804); пиразоло[1,5-a]пиридин-2-илметанол (Tsuchiya, Т.; Sashida, H.J. Chem. Soc., Chem. Commun. 1980,1109-1110; Tsuchiya, Т.; Sashida, H; Konoshita, A. Chem. Pharm. Bull. 1983, 37, 4568-4572). Получение соединений настоящего изобретения Пример 1. 2-(1-Метил-4-фенил-1 Н-имидазол-2-илметилсульфанил)[1,2,4]триазоло[1,5-а]пиридин Используют способ, описанный в WO 96/01826. (2-Имино-2 Н-пиразин-1-ил)амид имидазол-1 карботионовой кислоты (200 мг, 1,37 ммоль) и 2-хлорметил-1-метил-4-фенил-1 Н-имидазол 6 (300 мг,1,46 ммоль) растворяют в 1-пропаноле (25 мл) и полученную смесь кипятят с обратным холодильником в течение 2 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в дихлорметане. Раствор промывают водой, органический слой сушат над Na2SO4 и концентрируют. Остаток очищают хроматографией (силикагель) с получением указанного в заголовке соединения (273 мг, 62%) в виде желтого твердого вещества. ЖХ-МС: m/z=322,1 (MH+), tR=2,29 мин, способ В. Аналогично получают следующие соединения настоящего изобретения:
МПК / Метки
МПК: A61K 31/4353, C07D 487/04, A61P 25/00, A61K 31/4184, A61K 31/519, C07D 403/12
Метки: фенилимидазола, ингибиторов, новые, pde10a, производные, качестве, фермента
Код ссылки
<a href="https://eas.patents.su/30-18880-novye-proizvodnye-fenilimidazola-v-kachestve-ingibitorov-fermenta-pde10a.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные фенилимидазола в качестве ингибиторов фермента pde10a</a>
Предыдущий патент: Добыча газообразных углеводородов из коллекторов с гидратной шапкой
Следующий патент: Водопроводящий бытовой прибор с системой автоматического дозирования и способ автоматического дозирования
Случайный патент: Способ разделения по размерам кристаллов сульфата аммония, находящихся в суспензии