Новые производные бензимидазолов и бензотиазолов, способ их получения, их применение в качестве лекарственных средств, фармацевтические композиции и новое применение, в частности, в качестве ингибиторов cmet
Формула / Реферат
1. Соединения формулы (I)
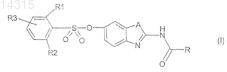
в которой А обозначает NH или S;
R1 и R2, одинаковые или разные, выбирают из атомов водорода, радикала NH2, атомов галогена и алкильных радикалов, необязательно замещенных одним или несколькими атомами галогена,
и R3 обозначает атом водорода или выбран из значений R1 и R2, причем по меньшей мере один из R1, R2 и R3 не является водородом,
R обозначает циклоалкил или алкил, необязательно замещенный фенилом, гетероарилом, NR6R7 или гетероциклоалкилом, которые сами необязательно замещены, алкокси, О-фенил или O-СН2-фенил, где фенил необязательно замещен, или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси, гетероарила, гетероциклоалкила, NR6R7, фенила, необязательно замещенного, фенил-NR6R7 и CONR6R7, где R6 и R7, одинаковые или разные, обозначают атом водорода, алкил или фенил, необязательно замещенный, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен;
при этом все циклоалкильные и гетероциклоалкильные радикалы содержат 3-7 звеньев,
все гетероциклоалкильные, гетероарильные и фенильные радикалы, указанные выше, необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена, гидроксила, оксо, алкокси, NH2; NH-алкила, N(алкил)2 и алкила, СН2-гетероциклоалкила, СН2-фенила и СО-фенила, причем в указанных последних радикалах алкил, гетероциклоалкил и фенил сами необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена и гидроксила, оксо, алкила и алкокси, содержащих 1-4 атома углерода, NH2, NH-алкила и N(алкил)2,
все алкильные и алкокси радикалы содержат 1-6 атомов углерода,
причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
2. Соединения формулы (I) по п.1, в которой A, R1, R2 и R3 имеют значения, указанные в п.1, и R обозначает циклоалкил или алкил, необязательно замещенный пиридилом, NR6R7 или гетероциклоалкилом, необязательно замещенным, алкокси или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила; алкокси; пиридила; гетероциклоалкила; NR6R7; фенила; фенил-NR6R7 и CONR6R7, где R6 и R7, одинаковые или разные, обозначают атом водорода, алкил или фенил, необязательно замещенный, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом все циклоалкильные и гетероциклоалкильные радикалы содержат 3-7 звеньев, все гетероциклоалкильные и фенильные радикалы, указанные выше, необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена, гидроксила, оксо, алкокси, NH2; NH-алкила, N(алкил)2 и алкила, СН2-пирролидинила, СН2-фенила и СО-фенила, в которых алкил, пирролидинил и фенил сами необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена и гидроксила, оксо, алкил и алкокси, содержащих 1-4 атома углерода, NH2; NH-алкила и N(алкил)2, все алкильные и алкокси радикалы содержат 1-6 атомов углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
3. Соединения формулы (I) по любому из пп.1 или 2, в которой А обозначает NH или S; R1 и R2, одинаковые или разные, выбирают из атомов галогена и алкильных радикалов, необязательно замещенных одним или несколькими атомами галогена, и R3 обозначает атом водорода или выбран из значений R1 и R2, R обозначает радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкильный радикал, а другой из R4 и R5 обозначает алкильный радикал, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси и NR6R7, где R6 и R7, одинаковые или разные, обозначают водород или алкил, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом все алкильные и алкокси радикалы содержат 1-6 атомов углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
4. Соединения формулы (I) по любому из пунктов, в которой R1 и R2, одинаковые или разные, выбирают из атомов фтора или хлора и алкильных радикалов и R3 обозначает атом водорода или алкильный радикал, необязательно замещенный одним или несколькими атомами фтора, а радикалы А и R выбирают из значений, указанных для этих радикалов в любом из других пунктов, при этом все алкильные и алкокси радикалы содержат 1-4 атома углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
5. Соединения формулы (I) по любому из пунктов, в которой R1 и R2, одинаковые или разные, выбирают из атомов фтора или хлора и метильного радикала и R3 обозначает атом водорода, радикал метил или CF3, а радикалы А и R выбирают из значений, указанных для этих радикалов в любом из других пунктов, при этом все алкильные и алкокси радикалы содержат 1-4 атома углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
6. Соединения формулы (I) по любому из пунктов, в которой R обозначает радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкильный радикал, а другой из R4 и R5 обозначает алкильный радикал, замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси и NR6R7, где R6 и R7, одинаковые или разные, обозначают водород или алкил, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемых из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; а радикалы A, R1, R2 и R3 выбирают из значений, указанных для этих радикалов в любом из других пунктов, при этом все алкильные и алкокси радикалы содержат 1-4 атома углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
7. Соединения формулы (I) по п.1 или 2, в которой А, R1, R2 и R3 выбирают из значений, указанных в любом из предыдущих пунктов, и R обозначает циклоалкил или алкил, необязательно замещенный пиридилом, морфолинилом или пиперидилом, необязательно замещенным СО-фенилом, в котором фенил необязательно замещен, алкокси или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкильный радикал, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный радикалом, выбираемым из гидроксила; алкокси; пиридила; NH-алкила; N(алкил)2; N-алкфенила; азепанила; морфолинила; пирролидинила; пиперидила; пиперазинила; СО-пиперазинила; фенила; фенила, замещенного морфолинилом, N(алкилом)2 или пиперазинилом; или же R4 и R5 образуют с атомом азота, с которым они соединены, пирролидинил; при этом все указанные выше радикалы пирролидинил; пиперидил и пиперазинил необязательно замещены 1 или 2 группами, выбранными из СН3, СН2-пирролидинила, СН2-фенила или СО-фенила; все пирролидиниловые радикалы, указанные выше, кроме того необязательно замещены группой оксо, все фенильные радикалы, указанные выше, сами необязательно замещены одним или несколькими радикалами, одинаковыми или разными, выбираемыми из атомов галогена и алкила, гидроксила или алкокси; все алкильные и алкокси радикалы содержат 1-4 атома углерода, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
8. Соединения формулы (I) по любому из пунктов, в которой R обозначает NH-алкил, где алкил, содержащий 1-2 атома углерода, замещен алкокси или морфолино, а радикалы A, R1, R2 и R3 выбирают из значений, указанных для этих радикалов в любом из других пунктов, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
9. Соединения формулы (I) по любому из пунктов, в которой А обозначает NH, а радикалы R1, R2 и R3 и R выбирают из значений, указанных для этих радикалов в любом из других пунктов, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
10. Соединения формулы (I) по любому из пунктов, в которой А обозначает S, а радикалы R1, R2 и R3 и R выбирают из значений, указанных для этих радикалов в любом из других пунктов, причем указанные соединения формулы (I) находятся во всех возможных изомерных формах: рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
11. Соединения формулы (I) по пп.1-10, соответствующие следующим наименованиям:
2,6-дихлорбензолсульфонат 2-({[2-(4-бензилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-морфолин-4-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(2-пирролидин-1-илэтил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-пирролидин-1-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-метилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(1-метилпирролидин-2-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(диметиламино)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(2,6-диметилпиперидин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(2-пиперидин-1-илэтил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(2-оксопирролидин-1-ил)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(4-бензилпиперазин-1-ил)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(4-метилпиперазин-1-ил)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-[(метилкарбамоил)амино]-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(2-азепан-1-илэтил)карбамоил]амино}-1,3-бензотиазол-6-ила;
а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
12. Соединения формулы (I) по пп.1-10, соответствующие следующим наименованиям:
2-[3-(2-метоксиэтил)уреидо]-1Н-бензимидазол-5-иловый эфир 2,6-дихлорбензолсульфоновой кислоты;
2-[3-(2-метоксиэтил)уреидо]-1Н-бензимидазол-5-иловый эфир 2-хлор-6-метилбензолсульфоновой кислоты;
2-[3-(2-метоксиэтил)уреидо]-1Н-бензимидазол-5-иловый эфир 2,4,6-триметилбензолсульфоновой кислоты;
2-[3-(2-метоксиэтил)уреидо]-1Н-бензимидазол-5-иловый эфир 2,6-дихлор-4-трифторметилбензолсульфоновой кислоты;
2-[3-(2-морфолин-4-илэтил)уреидо]-1Н-бензимидазол-5-иловый эфир 2,6-дихлорбензолсульфоновой кислоты;
2-[3-(2-морфолин-4-илэтил)уреидо]-1Н-бензотиазол-6-иловый эфир 2,6-дихлорбензолсульфоновой кислоты;
2-[3-(2-морфолин-4-илэтил)уреидо]бензотиазол-6-иловый эфир 2,6-дифторбензолсульфоновой кислоты;
2-[3-(2-метоксиэтил)уреидо]бензотиазол-6-иловый эфир 2,6-дифторбензолсульфоновой кислоты,
а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
13. Соединения формулы (I) по пп.1-10, соответствующие следующим наименованиям:
2,6-дихлорбензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2-хлор-6-метилбензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлор-4-(трифторметил)бензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлорбензолсульфонат 2-{[(2-морфолин-4-илэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлорбензолсульфонат 2-{[(2-морфолин-4-илэтил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-бензилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-морфолин-4-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-пирролидин-1-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-метилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(1-метилпирролидин-2-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(диметиламино)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(2-азепан-1-илэтил)карбамоил]амино}-1,3-бензотиазол-6-ила,
а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
14. Соединения формулы (I) по пп.1-10, соответствующие следующим наименованиям:
2,6-дихлорбензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2-хлор-6-метилбензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлор-4-(трифторметил)бензолсульфонат 2-{[(2-метоксиэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлорбензолсульфонат 2-{[(2-морфолин-4-илэтил)карбамоил]амино}-1Н-бензимидазол-5-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-бензилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-морфолин-4-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-пирролидин-1-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-метилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(1-метилпирролидин-2-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[3-(диметиламино)пропил]карбамоил}амино)-1,3-бензотиазол-6-ила,
а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
15. Соединения формулы (I) по пп.1-10, соответствующие следующим наименованиям:
2,6-дихлорбензолсульфонат 2-[3-(2-морфолин-4-илэтил)уреидо]бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-({[2-(4-бензилпиперазин-1-ил)этил]карбамоил}амино)-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-морфолин-4-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила;
2,6-дихлорбензолсульфонат 2-{[(3-пирролидин-1-илпропил)карбамоил]амино}-1,3-бензотиазол-6-ила,
а также аддитивные соли указанных соединений формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями.
16. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (А)
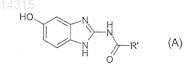
в которой R' имеет значения, указанные в п.1 для R, в которых возможные реакционноспособные группы необязательно защищены,
подвергают взаимодействию с соединением формулы (В)
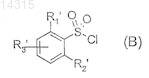
в которой R1', R2' и R3' имеют значения, указанные в п.1 соответственно для R1, R2 и R3, в которых возможные реакционноспособные группы необязательно защищены,
с получением соединения формулы (Ia)

в которой R1', R2', R3' и R' имеют значения, указанные выше,
полученные соединения формулы (Ia) могут представлять собой соединения формулы (I), в которых А обозначает NH,
и для получения других соединений формулы (I) их подвергают, при желании и при необходимости, одной или нескольким следующим реакциям превращения, осуществляемым в любом порядке:
а) реакции этерификации кислотной группы,
б) реакции омыления эфирной группы до кислотной группы,
в) реакции восстановления свободной или этерифицированной карбоксигруппы до спиртовой группы,
г) реакции превращения алкоксигруппы в гидроксильную группу или же гидроксильной группы в алкоксигруппу,
д) реакции удаления защитных групп, которые могут нести защищенные реакционноспособные группы,
е) реакции образования соли обработкой минеральной или органической кислотой или основанием для получения соответствующей соли,
ж) реакции расщепления рацемических форм до получения расщепленных соединений,
причем полученные таким образом соединения формулы (I) находятся во всех возможных изомерных формах: рацемической, энантиомерной и диастереоизомерной.
17. Способ получения соединений формулы (I) по п.1, отличающийся тем, что соединение формулы (D)
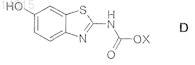
в которой СООХ обозначает защитную группу для NH2, подвергают взаимодействию с амином формулы (G)
H-NR4'R5' (G),
в которой R4' и R5' имеют значения, указанные в п.1 для R4 и R5, в которых возможные реакционноспособные группы необязательно защищены, с получением соединения формулы (F)
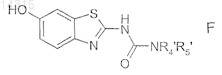
в которой R4' и R5' имеют указанные выше значения,
затем соединение формулы F подвергают взаимодействию с соединением формулы (В)
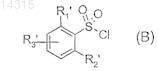
в которой R1', R2' и R3' имеют значения, указанные в п.1 соответственно для R1, R2 и R3, в которых возможные реакционноспособные группы необязательно защищены, с получением соединения формулы (Ib)
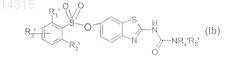
в которой R1', R2', R3', R4' и R5' имеют указанные выше значения,
полученные таким образом соединения формулы (Ib) могут представлять собой соединения формулы (I), в которых А обозначает S, и для получения других соединений формулы (I) их подвергают, при желании и при необходимости, одной или нескольким следующим реакциям превращения, осуществляемым в любом порядке:
а) реакции этерификации кислотной группы,
б) реакции омыления эфирной группы до кислотной группы,
в) реакции восстановления свободной или этерифицированной карбоксигруппы до спиртовой группы,
г) реакции превращения алкоксигруппы в гидроксильную группу или же гидроксильной группы в алкоксигруппу,
д) реакции удаления защитных групп, которые могут нести защищенные реакционноспособные группы,
е) реакции образования соли с помощью минеральной или органической кислоты или с помощью основания для получения соответствующей соли,
ж) реакции расщепления рацемических форм до получения расщепленных соединений,
причем полученные таким образом соединения формулы (I) находятся во всех возможных изомерных формах: рацемической, энантиомерной и диастереоизомерной.
18. Применение соединения формулы (I) по любому из пп.1-10, а также аддитивных солей указанных соединений формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств.
19. Применение соединения формулы (I) по любому из пп.11-15, а также аддитивных солей указанных соединений формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств.
20. Фармацевтические композиции, содержащие в качестве действующего начала по меньшей мере одно из соединений формулы (I), которые определены в любом из пп.1-15, или фармацевтически приемлемую соль этого соединения, или пролекарство этого соединения и фармацевтически приемлемый носитель.
21. Применение соединений формулы (I), которые определены в любом из пп.1-15, или фармацевтически приемлемых солей этих соединений для получения лекарственного средства, предназначенного для ингибирования активности протеинкиназы, выбираемой из следующей группы: AuroraA, AuroraB, члены семейства CDKs (CDK1,2,4,5,7,9), RON, Tie2, члены семейства VEGFRs (VEGFR1 или fit-1, VEGFR2, или KGR, или fik-1, VEGFR3), FGFRs (FGFR1, FGFR2, FGFR3, FGFR4, FGFR5), MET, а также мутанты протеина MET, EGFR, Fak, IGF-1R, PDGFR.
22. Применение по п.21, в котором протеинкиназа представляет собой МЕТ.
23. Применение по п.21, в котором протеинкиназа находится в клеточной культуре.
24. Применение по п.17, в котором протеинкиназа находится в организме млекопитающего.
25. Применение соединения формулы (I) по любому из пп.1-15 для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, выбранного из следующей группы: нарушения пролиферации кровеносных сосудов, фиброзные нарушения, нарушения пролиферации мезангиальных клеток, метаболические, аллергические, астматические, тромбозные нарушения, заболевания нервной системы, ретинопатия, псориаз, ревматоидный артрит, диабет, мышечная дегенерация или рак.
26. Применение соединения формулы (I) по любому из пп.1-15 для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, выбранного из следующей группы: нарушения пролиферации кровеносных сосудов, фиброзные нарушения, нарушения пролиферации мезангиальных клеток, ретинопатия, псориаз, ревматоидный артрит, диабет, мышечная дегенерация или рак.
27. Применение соединения формулы (I) по любому из пп.1-15 для получения лекарственного средства, предназначенного для лечения рака.
28. Применение по п.27, предназначенное для лечения солидных опухолей или лейкозов.
29. Применение по п.27 или 28, предназначенное для лечения форм рака, устойчивых к цитотоксическим агентам.
30. Применение по п.27 или 28, предназначенное для лечения первичных опухолей и/или метастаз, в частности, в случае раков желудка, печени, почек, яичников, прямой кишки, предстательной железы, легких (NSCLC и SCLC), глиобластом, раков щитовидной железы, мочевого пузыря, молочной железы, меланомы, лимфоидных или миелоидных гематопоэтических опухолей, а также сарком, опухолей мозга, гортани, лимфатической системы, рака костей и поджелудочной железы.
31. Применение соединений формулы (I) по пп.1-15 для получения лекарственных средств, предназначенных для химиотерапевтического лечения рака.
32. Применение соединений формулы (I) по пп.1-15 для получения лекарственных средств, предназначенных для химиотерапевтического лечения рака индивидуально или в комбинации.
33. Применение соединений формулы (I) по любому из пп.1-15 в качестве ингибиторов киназ.
34. Применение соединений формулы (I) по любому из пп.1-15 в качестве ингибиторов МЕТ.
Текст
НОВЫЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ И БЕНЗОТИАЗОЛОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И НОВОЕ ПРИМЕНЕНИЕ, В ЧАСТНОСТИ, В КАЧЕСТВЕ ИНГИБИТОРОВ Cmet Изобретение относится к новым продуктам формулы (I), используемым в качестве лекарственных средств, в частности в качестве ингибиторов протеинкиназ, таких как МЕТ. 014315 Настоящее изобретение относится к новым производным бензимидазолов и бензотиазолов, к способу их получения, к новым полученным промежуточным соединениям, к применению их в качестве лекарственных средств, к фармацевтическим композициям, содержащим указанные производные, и к новому применению указанных производных бензимидазолов и бензотиазолов. Более конкретно настоящее изобретение относится к новым сложным сульфоэфирным производным бензимидазолов и бензотиазолов. Настоящее изобретение относится к новым производным, обладающим ингибирующей активностью в отношении протеинкиназ. Продукты согласно настоящему изобретению могут быть, в частности,использованы для профилактики или лечения заболеваний, которые могут модулироваться путем ингибирования протеинкиназ. Продукты согласно изобретению обладают, в частности, противораковой активностью, опосредованной через модуляцию активности протеинов, в частности каназ. Настоящее изобретение относится, таким образом, в применению указанных производных в качестве агентов ингибирования киназ, в частности в качестве противораковых агентов. Настоящее изобретение относится также к применению указанных производных для получения лекарственного средства, предназначенного для лечения человека. В настоящее время большинство соединений, выпускаемых в продажу и используемых в химиотерапии, являются цитотоксическими соединениями, которые создают серьезные проблемы побочных эффектов и их переносимости пациентами. Эти эффекты могут быть лимитированы, поскольку используемые лекарственные средства действуют селективно на раковые клетки, исключая здоровые клетки. Одно из решений для ограничения нежелательных эффектов химиотерапии может заключаться в использовании лекарственных средств, действующих на метаболические пути или конститутивные элементы этих путей, которые экспрессировались бы большей частью в раковых клетках и не экспрессировались или незначительно эксперссировались в здоровых клетках. Указанные протеинкиназы относятся, в частности, к следующей группе: AuroraA, AuroraB, члены семейства CDKs (CDK1, 2, 4, 5, 7, 9), RON, Tie2, члены семейства VEGFRs (VEGFR1 или fit-1, VEGFR2 или KDR или fik-1, VEGFR3), семейства FGFRs (FGFR1, FGFR2, FGFR3, FGFR4, FGFR5), MET, а также мутанты протеина MET, FGFR, Fak, IGF-1R, PDGFR. Более конкретно можно назвать протеинкиназу МЕТ. Протеинкиназы составляют семейство ферментов, которые катализируют фосфорилирование гидроксигрупп специфических остатков протеинов,таких как остатки тирозина, серина или треонина. Такие реакции фосфорилирования могут в широких пределах модифицировать функцию протеинов: так, протеинкиназы играют огромную роль в регуляции большого числа разнообразных клеточных процессов, включая, в частности, метаболизм, пролиферацию клеток, адгезию и подвижность клеток, дифференцировку клеток или продолжительность жизни клеток,причем некоторые протеинкиназы играют основную роль в инициации, развитии и прекращении событий клеточного цикла. Среди различных клеточных функций, в которых задействована активность протеинкиназы, некоторые процессы представляют собой привлекательные мишени для лечения определенных болезней. Например, можно назвать такие процессы как, в частности, ангиогенез и контроль клеточного цикла, а также контроль пролиферации клеток, в которых протеинкиназы играют существенную роль. Эти процессы существенны, в частности, при росте солидных опухолей, а также при других заболеваниях: в частности,ингибирующие молекулы таких киназ способны ограничивать нежелательные клеточные пролиферации,такие, которые наблюдаются при раках, и могут участвовать в предотвращении, регуляции или лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера или нейрональный апоптоз. Ангиогенез является процессом, в котором новые сосуды формируются из уже существующих сосудов. При необходимости, сосудистая система имеет потенциальные возможности генерировать сеть новых сосудов для поддержания правильной функции тканей и органов. Ангиогенез является сложным и многоступенчатым процессом, который включает активацию, миграцию, пролиферацию и жизнеспособность эндотелиальных клеток. У взрослых ангиогенез довольно ограничен и проявляется главным образом только в процессах заживления ран или в процессе васкуляризации эндометрия (Merenmies и сотр., Cell GrowthDifferentiation, 8, 3-10, 1997). И, напротив, неконтролируемый ангиогенез обнаруживается при некоторых патологиях, таких как ретинопатия, псориаз, ревматоидный артрит, диабет, мышечная дегенерация или рак (солидные опухоли) (Folkman, Nature Med., 1, 27-31, 1995). Протеинкиназы, для которых доказана возможность участия в процессе ангиогенеза, включают три представителя семейства тирозинкиназных рецепторов факторов роста (growth factor receptor tyrosine kinase): VEGF-R2 (vascular endothelial growth factorreceptor 2) (рецептор 2 фактора роста эндотелия сосудов), называемый также KDR, FLK-1 (kinase insertdomain receptor) (рецептор встроенного домена киназы), FGF-R (fibroblast growth factor receptor) (рецептор фактора роста фибробластов) и TEK (называемый также Tie-2). В сочетании с другими системами рецепторы факторов роста эндотелиальных сосудов (VEGFRs) участвуют в передаче сигналов, действующих при миграции, пролиферации и влияющих на жизнеспособность эндотелиальных клеток. Семейство VEGFR включат VEGFR-1 (Fit-1), VEGFR-2 (KDR),-1 014315VEGFR3 (Fit-4). Рецептор VEGF-R2, который экспрессируется только в эндотелиальных клетках, связывается с ангиогенным фактором роста VEGF и служит, таким образом, медиатором передачи сигнала посредством активации собственного внутриклеточного домена киназы. Таким образом, прямое ингибирование активности VEGF-R2 в отношении киназы позволяет снизить явление ангиогенеза в присутствии эксогенного VEGF (Strawn и сотр., Cancer Research, 56, 3540-3545, 1996), этот процесс подтвержден, в частности,с помощью мутантов VEGF-R2 (Millauer и сотр., Cancer Research, 56, 1615-1620, 1996). Рецептор VEGFR2, по-видимому, не имеет какой-либо другой функции у взрослых, кроме функции, связанной с ангиогенной активностью VEGF. Таким образом, селективный ингибитор активности VEGF-R2 в отношении киназы должен проявлять только слабую токсичность. Помимо этой главной функции в динамическом процессе ангиогенеза последние данные позволяют предположить, что экспрессия VEGF способствует жизнеспособности опухолевых клеток после химио- и радиотерапевтического лечения, подчеркивая потенциальный синергический эффект ингибиторов KDR с другими агентами (Lee C.G., Heijn M. и сотр., (2000), Cancer Research, 60 (19), 5565-70). Ингибиторы ангиогенеза могут быть использованы в первую очередь против появления или повторного роста злокачественных опухолей. Ингибирование или регуляция VEGF-R2 (KDR) предлагает, таким образом, новый мощный механизм лечения большого числа солидных опухолей. Среди киназ, в отношении которых исследовалась модуляция активности, можно назвать циклинзависимые киназы, такие как Aurora-2 (или Aurora-A). Развитие клеточного цикла часто управляется циклинзависимыми киназами (CDK), которые активируются взаимодействием с протеинами, принадлежащими семейству циклинов, и эта активация заканчивается фосфорилированием субстратов и, в конце концов, делением клеток. Кроме того, активированные эндогенные ингибиторы CDK (семейство INK4 и KIP/CIP) отрицательно регулируют активностьCDKs. Рост нормальных клеток обусловлен балансом между активаторами CDK (циклинами) и эндогенными ингибиторами CDK. Для некоторых типов раков описана аномальная экспрессия или активность нескольких из этих регуляторов клеточного цикла. Циклин Е активирует киназу CGK2, которая затем индуциирует фосфорилирование белка pRb (белок ретинобластомы), приводящее в результате к началу необратимого деления клеток и переходу в фазуS (PL Toogood, Medicinal Research Reviews (2001), 21(6); 487-498). Киназа CDK2 и, возможно, CDK3 необходимы для развития фазы G1 и перехода в фазу S. Во время образования комплекса с циклином Е киназы поддерживают гиперфосфорилирование pRb для того, чтобы способствовать переходу фазы G1 в фазу S. В комплексах с циклином А киназа CDK2 играет определенную роль в инактивации E2F и является необходимой для завершения фазы S (TD. Davies и сотр. (2001) Structure 9, 389-3). Комплекс CDK1/циклин В регулирует развитие клеточного цикла между фазой G2 и фазой М. Отрицательная регуляция комплекса CDK1/циклин В мешает нормальным клеткам вхождению в фазу S до того, как фаза G2 будет корректно и полностью завершена (K.K. Roy and E.A. Sausville Current Pharmaceutical Design, 2001, 7, 1669-1687). Существует уровень регуляции активности CDK. Активаторы циклинзависимых киназ (CAK) вызывают положительную регуляцию CDK. CAK фосфорилируют CDK по остатку треонина, превращая целевой фермент в полностью активную мишень. Поскольку наличие дефектов в молекулах, воздействующих на клеточные циклы, влечет за собой активацию CDK и влияет на динамику цикла, то естественно желание ингибировать активность ферментов CDKs для блокирования роста раковых клеток. Многочисленные протеины, задействованные в сегрегации хромосом и сборке пучка, были идентифицированы в дрожжах и дрозофиле. Дезорганизация этих протеинов приводит к несегрегации хромосом и к монополярным или дезорганизованным пучкам. Среди этих протеинов некоторые киназы, в частности, Aurora и lpl1, происходящие соответственно из дрозофилы и S.cerevisiae, являются необходимыми для сегрегации хромосом и выделения центросомы. Недавно был клонирован и охарактеризован несколькими лабораториями человеческий аналог lpl1 дрожжей. Эта киназа, называемая aurora2, STK15 иAurora2 является онкогенной и амплифицируется в колоректальных злокачественных опухолях человека(EMBO J, 1998, 17, 3052-3065). Это также подтверждается в случае рака, включая злокачественные эпителиальные опухоли, такие как рак молочной железы. Настоящее изобретение относится также к молекулам, ингибирующим активность тирозинкиназы для различных киназ, в частности ингибирующих активность МЕТ. В фармакологической части, описанной ниже, биохимические тесты показывают на линиях клеток,что продукты согласно настоящей заявки ингибируют, в частности, активность аутофосфорилирования МЕТ и пролиферацию клеток. МЕТ или Hepatocyte Growth Factor Receptor (рецептор фактора роста гепатоцитов) является рецептором с активностью тирозинкиназы, экспрессируемым, в частности, эпителиальными и эндотелиальными клетками. HGF, Hepatocyte Growth Factor (фактор рости гепатоцита) описан в качестве специфическо-2 014315 го лиганда МЕТ. HGF секретируется мезенхимальными клетками и активирует рецептор МЕТ, который гомодимеризуется. Следовательно, рецептор аутофосфорилируется по тирозинам каталитического домена Y1230, Y1234 и Y1235. Стимуляция МЕТ с помощью HGF индуцирует пролиферацию, рассеяние (диспергирование), клеточную подвижность, устойчивость к апоптозу, инвазию и ангиогенез. МЕТ, так же как и HGF, оказываются гиперэкспрессируемыми в многочисленных опухолях человека и в большом количестве различных раковых опухолей. МЕТ также способен амплифицироваться в опухолях желудка и в глиобластомах. Многочисленные точечные мутации гена МЕТ были также описаны в опухолях, в частности в киназном домене, а также в близлежащем мембранном домене и в домене SEMA. Гиперэкспрессия, амплификация или мутации вызывают конститутивную активацию рецептора и нарушение регуляции его функций. Настоящее изобретение относится также к новым ингибиторам протеинкиназ, которые определены выше, имеющим, в частности, антипролиферативную активность. Настоящее изобретение относится также к новым ингибиторам протеинкиназ, которые определены выше, в частности к таким, которые могут быть использованы для антипролиферативного и антиметастатического лечения, в частности, в области онкологии. Настоящее изобретение относится также к новым ингибиторам протеинкиназ, которые определены выше, в частности к таким, которые могут быть использованы для антиангиогенного лечения, в частности, в области онкологии. Таким образом, объектом настоящего изобретения являются продукты формулы (I)R1 и R2, одинаковые или разные, выбирают из атомов водорода, радикала NH2, атомов галогена и алкильных радикалов, необязательно замещенных одним или несколькими атомами галогена,R3 обозначает атом водорода или выбран из значений R1 и R2, причем по меньшей мере один изR1, R2 и R3 не является водородом,R обозначает циклоалкил или алкил, необязательно замещенный фенилом, гетероарилом, NR6R7 или гетероциклоалкилом, которые сами необязательно замещены,алкокси, О-фенил или O-СН 2-фенил, где фенил необязательно замещен,или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси, гетероарила, гетероциклоалкила, NR6R7, фенила, необязательно замещенного, фенилNR6R7 и CONR6R7, где R6 и R7, одинаковые или разные, обозначают атом водорода, алкил или фенил,необязательно замещенный, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом все циклоалкильные и гетероциклоалкильные радикалы содержат 3-7 звеньев,все гетероциклоалкильные, гетероарильные и фенильные радикалы, указанные выше, необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена, гидроксила, оксо,алкокси, NH2; NH-алкила, N(алкил)2 и алкила, СН 2-гетероциклоалкила, СН 2-фенила и СО-фенила, причем в указанных последних радикалах алкил, гетероциклоалкил и фенил сами необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена и гидроксила, оксо, алкила и алкокси, содержащих 1-4 атома углерода, NH2, NH-алкила и N(алкил)2,все алкильные и алкоксильные радикалы содержат 1-6 атомов углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Настоящее изобретение относится также к продуктам формулы (I), которые определены выше, в которой A, R1, R2 и R3 имеют значения, указанные выше, и R обозначает циклоалкил или алкил, необязательно замещенный пиридилом, NR6R7 или гетероциклоалкилом,необязательно замещенным,-3 014315 алкокси,или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила; алкокси; пиридила; гетероциклоалкила; NR6R7; фенила; фенил-NR6R7 и CONR6R7, где R6 и R7,одинаковые или разные, обозначают атом водорода, алкил или фенил, необязательно замещенный, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом все циклоалкилы и гетероциклоалкилы содержат 3-7 звеньев,все гетероциклоалкилы и фенилы, указанные выше, необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена, гидроксила, оксо, алкокси, NH2; NH-алкила,N(алкил)2 и алкила, СН 2-пирролидинила, СН 2-фенила и СО-фенила, в которых алкил, пирролидинил и фенил сами необязательно замещены одним или несколькими радикалами, выбираемыми из атомов галогена и гидроксила, оксо, алкила и алкокси, содержащих 1-4 атома углерода, NH2; NH-алкила и N(алкил)2,все алкилы и алкокси содержат 1-6 атомов углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Таким образом, объектом настоящего изобретения являются продукты формулы (I), которые определены выше, в которой А обозначает NH или S;R1 и R2, одинаковые или разные, выбирают из атомов галогена и алкильных радикалов, необязательно замещенных одним или несколькими атомами галогена, и R3 обозначает атом водорода или выбран из значений R1 и R2,R обозначает радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 иR5 обозначает атом водорода или алкильный радикал, а другой из R4 и R5 обозначает алкильный радикал, необязательно замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси и NR6R7, где R6 и R7, одинаковые или разные, обозначают водород или алкил, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; или же R4 и R5 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом все алкилы и алкокси содержат 1-6 атомов углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В продуктах формулы (I) и в последующем тексте термин "алкил" обозначает линейные и, в случае необходимости, разветвленные метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, изогексил, а также гептил, октил, нонил и децил, а также их изомеры положения, линейные или разветвленные; предпочтительны алкилы, содержащие 1-6 атомов углерода, более конкретно алкилы, содержащие 1-4 атома углерода, из вышеуказанного списка; термин "алкокси" обозначает линейные и, в случае необходимости, разветвленные метокси, этокси,пропокси, изопропокси, линейный вторичный или третичный бутокси, пентокси или гексокси, а также их изомеры положения, линейные или разветвленные; предпочтительны радикалы алкокси, содержащие 1-4 атома углерода, из указанного выше списка; термин "атом галогена" обозначает атомы хлора, брома, иода или фтора, предпочтительны атомы хлора, брома или фтора. Карбокси-радикал или радикалы продуктов формулы (I) могут быть переведены в соль или этерифицированы при помощи различных групп, известных специалисту, среди которых можно назвать, например,среди солеобразующих соединений: минеральные основания, такие как, например, эквивалент натрия, калия, лития, кальция, магния или аммония, или органические основания, такие как, например, метиламин,пропиламин,триметиламин,диэтиламин,триэтиламин,N,N-диметилэтаноламин,трис(гидроксиметил)аминометан, этаноламин, пиридин, пиколин, дициклогексиламин, морфолин, бензиламин, прокаин, лизин, аргинин, гистидин, N-метилглюкамин,-4 014315 среди этерифицирующих соединений: алкильные радикалы для образования алкоксикарбонильных групп, таких как, например, метоксикарбонильная, этоксикарбонильная, трет-бутоксикарбонильная или бенилоксикарбонильная, причем эти алкильные радикалы могут быть замещены радикалами, выбираемыми, например, из атомов галогена, гидроксила, алкокси, ацила, ацилокси, алкилтио, амино или арила,например, в хлорметильной, гидроксипропильной, метоксиметильной, пропионилоксиметильной, метилтиометильной, диметиламиноэтильной, бензильной или фенэтильной группах. Аддитивными солями продуктов формулы (I) с минеральными или органическими кислотами могут быть, например, соли, образованные с хлористо-водородной, бромисто-водородной, иодистоводородной, азотной, серной, фосфорной, пропионовой, уксусной, трифторуксусной, муравьиной, бензойной, малеиновой, фумаровой, сукциновой, винной, лимонной, оксалиновой, глиоксиловой, аспарагиновой, аскарбиновой кислотами, с алкилмоносульфоновыми кислотами, такими как, например, метансульфоновая кислота, этансульфоновая кислота, пропансульфоновая кислота, с алкилдисульфоновыми кислотами, такими как, например, метандисульфоновая кислота, -, -этандисульфоновая кислота, с арилмоносульфоновыми кислотами, такими как бензолсульфоновая кислота, и с арилдисульфоновыми кислотами. Можно напомнить, что стереоизомерия может определяться в широком смысле, как, например,изомерия соединений, имеющих одни и те же структурные формулы, но различные группы которых поразному расположены в пространстве, такие как, в частности, в монозамещенных циклогексанах, заместители которых могут находиться в аксиальном или экваториальном положении, и различные возможные ротационные конформации производных этана. Однако существует другой тип стереоизомерии, обусловленный пространственным расположением различных заместителей, соединенных либо с двойными связями, либо с циклами, который называется геометрической изомерией или цис-транс-изомерией. Термин стереоизомеры используется в настоящей заявке в самом широком смысле и относится к совокупности соединений, указанных выше. Таким образом, объектом настоящего изобретения являются продукты формулы (I), в которойR1 и R2, одинаковые или разные, выбирают из атомов фтора или хлора и алкильных радикалов, R3 обозначает атом водорода или алкильный радикал, необязательно замещенный одним или несколькими атомами фтора, а радикалы А и R выбирают из значений, указанных для этих радикалов,при этом все алкилы и алкокси содержат 1-4 атома углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных,а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Таким образом, объектом настоящего изобретения являются продукты формулы (I), в которойR1 и R2, одинаковые или разные, выбирают из атомов фтора или хлора и метила, R3 обозначает атом водорода, метил или CF3, а радикалы А и R выбирают из значений, указанных для этих радикалов,при этом все алкилы и алкокси содержат 1-4 атома углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных,а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Таким образом, объектом настоящего изобретения являются продукты формулы (I), в которойR обозначает радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 иR5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает алкил, замещенный одним или несколькими радикалами, одинаковыми или разными, выбираемыми из гидроксила, алкокси и NR6R7,где R6 и R7, одинаковые или разные, обозначают водород или алкил, или же R6 и R7 образуют с атомом азота, с которым они соединены, циклический радикал, необязательно содержащий один или несколько других гетероатомов, выбираемый(ые) из О, S, N и NH, причем этот радикал, включая возможно содержащийся в нем NH, необязательно замещен; при этом радикалы A, R1, R2 и R3 выбирают из значений, указанных для этих радикалов; все алкилы и алкокси содержат 1-4 атома углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных,а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Циклические радикалы, которые могут образовывать, с одной стороны, радикалы R4 и R5 с атомом азота, с которым они соединены, и, с другой стороны, радикалы R6 и R7 с атомом азота, с которым они соединены, необязательно замещены одним или несколькими радикалами, выбираемыми из радикалов,указанных выше в отношении возможных заместителей гетероциклоалкильных радикалов, т.е. одним или несколькими радикалами, выбираемыми из атомов галогена, гидроксила, оксо, алкокси, NH2, NHалкила, N(алкил)2 и алкила, СН 2-гетероциклоалкила, СН 2-фенила и СО-фенила, причем в этих последних радикалах алкил, гетероциклоалкил и фенил сами необязательно замещены одним или несколькими ра-5 014315 дикалами, выбираемыми из атомов галогена и гидроксила, оксо, алкила и алкокси, содержащих 1-4 атома углерода, NH2; NH-алкила и N(алкил)2. Циклические радикалы, которые могут образовывать, с одной стороны, радикалы R4 и R5 с атомом азота, с которым они соединены, и, с другой стороны, радикалы R6 и R7 с атомом азота, с которым они соединены, являются, в частности, необязательно замещенными одним или несколькими радикалами,одинаковыми или разными, выбираемыми из атомов галогена и алкила, гидроксила, алкокси, СН 2 пирролидинила, СН 2-фенила и фенила, в которых алкил, пирролидинил и фенил сами необязательно замещены одним или несколькими радикалами, одинаковыми или разными, выбираемыми из атомов галогена и алкила, гидроксила, оксо и алкокси. Когда R, который определен выше, обозначает радикал NR4R5 и этот радикал не является циклическим, то настоящее изобретение относится, в частности, к продуктам формулы (I), определенным выше,в которых R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный радикалом,выбираемым из гидроксила; алкокси; пиридила; гетероциклоалкила; NR6R7; фенила; фенил-NR6R7 иCONR6R7, которые определены выше или ниже. Гетероциклоалкильные радикалы, которые определены выше, обозначают, в частности, азепанил,морфолинил и пирролидинил, пиперидил и пиперазинил, которые сами необязательно замещены, так,как описано выше или ниже. Гетероарильные радикалы обозначают, в частности, пиридил. Когда NR4R5 или NR6R7 образуют цикл, который определен выше, то этот аминоцикл может быть выбран, в частности, из пирролидинила, пиразолидинила, пиразолинила, пиперидила, морфолино или пиперазинила, причем эти радикалы сами необязательно замещены как указано выше или ниже: например, одним или несколькими радикалами, одинаковыми или разными, выбираемыми из атомов галогена и алкила, гидроксила, алкокси и фенила, при этом алкил или фенил сами необязательно замещены одним или несколькими радикалами, одинаковыми или разными, выбираемыми из атомов галогена и алкила,гидроксила и алкокси. Цикл NR4R5 или NR6R7 может быть, в частности, выбран из пирролидинила, морфолино или пиперазинила, необязательно замещенного на втором атоме азота алкильным или фенильным радикалом,которые сами необязательно замещены одним или несколькими радикалами, одинаковыми или разными,выбираемыми из атомов галогена и алкила, гидроксила и алкокси. Более конкретно, объектом изобретения являются продукты формулы (I), описанные выше, в которой A, R1, R2 и R3 имеют значения, указанные выше, и R обозначает циклоалкил или алкил, необязательно замещенный пиридилом, морфолинилом или пиперидилом,необязательно замещенным СО-фенилом, где фенил сам необязательно замещен,алкокси,или радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкил, а другой из R4 и R5 обозначает циклоалкил или алкил, необязательно замещенный радикалом, выбираемым из гидроксила; алкокси; пиридила; NH-алкила; N(алкил)2;Nалкфенила; азепанила; морфолинила; пирролидинила; пиперидила; пиперазинила; CO-пиперазинила; фенила; фенила, замещенного морфолинилом, N(алкилом)2 или пиперазинилом; или же R4 и R5 образуют с атомом азота, с которым они соединены, пирролидинил; при этом все указанные выше радикалы: пирролидинил; пиперидил; пиперазинил необязательно замещены 1 или 2 группами, выбранными из СН 3, СН 2-пирролидинила, СН 2-фенила или СО-фенила; все пирролидиниловые радикалы, указанные выше, кроме того, необязательно замещены группой оксо,все фенильные радикалы, указанные выше, сами необязательно замещены одним или несколькими радикалами, одинаковыми или разными, выбираемыми из атомов галогена и алкила, гидроксила и алкокси; все алкилы и алкокси содержат 1-4 атома углерода,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Таким образом, настоящее изобретение относится к продуктам формулы (I), в которойR обозначает NH-алкил, где алкил, содержащий 1-2 атома углерода, замещен алкокси или морфолино,радикалы A, R1, R2 и R3 выбраны из значений, указанных для этих радикалов,причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), в которой А обозначает NH, радикалы R1, R2, R3 и R выбраны из значений, указанных выше или ниже для этих радикалов, причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли продуктов формулы (I) с мине-6 014315 ральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), которые определены выше, в которых А обозначает S, радикалы R1, R2, R3 и R выбраны из любых значений, указанных выше или ниже для этих радикалов, причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и диастереоизомерных, а также аддитивные соли продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), которые определены выше, в которой R1 и R2, одинаковые или разные, обозначают атом хлора или метил, а радикалыR3, А и R выбраны из значений, указанных выше для этих радикалов. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,в которой R1 и R2 обозначают оба атом хлора, а радикалы R3, А и R выбраны из значений, указанных выше для этих радикалов. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,в которой R1 и R2 обозначают оба атом фтора и R обозначает радикал NR4R5, в котором R4 и R5 имеют такие значения, при которых один из R4 и R5 обозначает атом водорода или алкильный радикал, а другой из R4 и R5 обозначает замещенный алкильный радикал, который определен выше, а радикалы R3 и А выбраны из значений, указанных выше для этих радикалов. Более конкретно, объектом настоящего изобретения являются продукты формулы (I), описанной выше, соответствующие следующим наименованиям: 2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-пирролидин-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6 ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-2-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6 ила,2,6-дихлорбензолсульфонат 2-([2-(2,6-диметилпиперидин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-пиперидин-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(2-оксопирролидин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(4-бензилпиперазин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(4-метилпиперазин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(метилкарбамоил)амино]-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-азепан-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,соответствующие следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,4,6-триметилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дифторбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,соответствующие следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,-7 014315 2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-2-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-азепан-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,соответствующие следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-2-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. В частности, объектом настоящего изобретения являются продукты формулы (I), описанной выше,соответствующие следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[3-(2-морфолин-4-илэтил)уреидо]бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,а также аддитивные соли указанных продуктов формулы (I) с минеральными и органическими кислотами или с минеральными и органическими основаниями. Продукты формулы (I), которые определены выше согласно изобретению, могут быть получены в соответствии с обычными способами, известными специалисту. Продукты формулы (I), которые определены выше согласно изобретению, могут быть получены в соответствии со способами, представленными на следующих схемах 1 и 2. Таким образом, в соответствии с представленной выше схемой 1, объектом настоящего изобретения является также способ получения продуктов формулы (I), которые определены выше, отличающийся тем, что подвергают взаимодействию соединение формулы (А) в которой R' имеет значения, указанные выше для R, в которых возможные реакционноспособные группы необязательно защищены,с соединением формулы (В) в которой R1' , R2' и R3' имеют значения, указанные выше соответственно для R1, R2 и R3, в которых возможные реакционноспособные группы необязательно защищены,с получением продукта формулы (Ia) в которой R1' , R2', R3' и R' имеют значения, указанные выше,полученные продукты формулы (Ia) могут быть продуктами формулы (I), в которых А обозначаетNH, и для получения других продуктов формулы (I) их подвергают, при желании и при необходимости,одной или нескольким следующим реакциям превращения, осуществляемым в любом порядке: а) реакции этерификации кислотной группы,б) реакции омыления сложноэфирной группы до кислотной группы,в) реакции восстановления свободной или этерифицированной карбоксигруппы до спиртовой группы,г) реакции превращения алкоксигруппы в гидроксильную группу или же гидроксильной группы в алкоксигруппу,д) реакции удаления защитных групп, которые могут нести защищенные реакционноспособные группы,е) реакции образования соли обработкой минеральной или органической кислотой или основанием для получения соответствующей соли,ж) реакции расщепления рацемических форм до получения расщепленных продуктов,причем полученные таким образом продукты формулы (I) находятся во всех возможных изомерных формах рацемической, энантиомерной и диастереоизомерной.-9 014315 Таким образом, соединения согласно настоящему изобретению общей формулы (Ia) могут быть получены в результате реакции между бензимидазолами общей формулы (А) и сульфонилхлоридом формулы (В) в присутствии основания, такого как водный раствор гидроксида натрия. Производные бензимидазолов общей формулы (А) могут быть получены, в частности, как описано в патенте WO 03028721 A2. Таким образом, в соответствии с представленной выше схемой 2, объектом настоящего изобретения является также способ получения продуктов формулы (I), которые определены выше, отличающийся тем, что соединение формулы (D) в которой СООХ обозначает защитную группу для NH2, подвергают взаимодействию с амином формулыH-NR4'R5' (G),в которой R4' и R5' имеют значения, указанные выше для R4 и R5, в которых возможные реакционноспособные группы необязательно защищены,с получением соединения формулы (F) в которой R4' и R5' имеют указанные выше значения, затем соединение формулы F подвергают взаимодействию с соединением формулы (В), описанным выше, с получением продукта формулы (Ib) в которой R1', R2' , R3', R4' и R5' имеют указанные выше значения,полученные таким образом продукты формулы (Ib) могут представлять собой продукты формулы(I), в которых А обозначает S, и для получения других продуктов формулы (I) их подвергают, при желании и при необходимости, одной или нескольким следующим реакциям превращения, осуществляемым в любом порядке: а) реакции этерификации кислотной группы,б) реакции омыления сложноэфирной до кислотной группы,в) реакции восстановления свободной или этерифицированной карбоксигруппы до спиртовой группы,г) реакции превращения алкоксигруппы в гидроксильную группу или же гидроксильной группы в алкоксигруппу,д) реакции удаления защитных групп, которые могут нести защищенные реакционноспособные группы,е) реакции образования соли обработкой минеральной или органической кислотой или основанием для получения соответствующей соли,ж) реакции расщепления рацемических форм до получения расщепленных продуктов,причем полученные таким образом продукты формулы (I) находятся во всех возможных изомерных формах, рацемической, энантиомерной и диастереоизомерной. Следуя представленной выше схеме 2 соединения общей формулы (Ib) можно получить, исходя из 6-этокси-1,3-бензотиазол-2-амина (доступного в продаже). Соединение 2-амино-1,3-бензотиазол-6-ол (С) может быть получено путем расщепления 6-этокси 1,3-бензотиазол-2-амина в кислотной среде, предпочтительно в смеси уксусная кислота/водный раствор бромисто-водородной кислоты. Эфирные производные (6-гидроксибензотиазол-2-ил)карбаминовой кислоты, т.е. карбаматы общей формулы (D), могут быть получены после обработки водным раствором гидроксида калия смеси эфирных производных 2-метоксикарбониламинобензотиазол-6-илкарбоновой кислоты (Е) и эфирных производных (6-гидроксибензотиазол-2-ил)карбаминовой кислоты (D), т.е. смеси производных общей формулы (Е) и (D). Смесь соединений (Е) и (D) может быть получена взаимодействием алкилхлорформиата в присут- 10014315 ствии основания, такого как пиридин, при температуре около 20 С. Соединения общей формулы (F) получают взаимодействием между карбаминовым производным общей формулы (D) и амином (R" имеет определение, данное для общей формулы (I в присутствии апротоного растворителя, такого как 1-метилпирролидин-2-он. Реакцию можно осуществить при температуре в интервале от 90 до 150 С в герметически закрытой трубке в микроволновой печи. Сложные сульфоэфиры формулы (Ib) получают путем взаимодействия соединений общей формулы(F) с сульфонилхлоридом формулы (В) (R1, R2, R3 имеют определения, данные для общей формулы (I в присутствии основания, такого как водный раствор гидроксида натрия. Продукты формулы (I), которые определены выше согласно изобретению, могут быть также получены в соответствии со способами, описанными на схемах 1 а и 2 а, представленных ниже. Для большей ясности схема 1 а разделена ниже на две части: схему 1 аа и схему 1ab. Схема 1aa Для большей ясности схема 2 а разделена ниже на две части: схему 2 аа и схему 2ab. Таким образом, в соответствии с представленной выше схемой 1 а, объектом настоящего изобретения является также способ получения продуктов формулы (Ia) и (Ia'), которые определены выше, отличающийся тем, что подвергают взаимодействию или продукт формулы (Н) или продукт формулы (J) в котором R1', R2' и R3' имеют значения, указанные выше соответственно для R1, R2 и R3, в которых возможные реакционноспособные группы необязательно защищены,для получения, соответственно, продукта формулы (I) или (L) в котором R1', R2' и R3' имеют значения, указанные выше. Соединение формулы (L) может быть также получено путем восстановления соединения формулы(I). Затем продукт формулы (L) подвергают взаимодействию с соединением формулы (K) в котором СООХ обозначает защитную группу для NH2, с получением продукта формулы (М) в котором R1', R2' и R3' имеют значения, указанные выше. Из соединения формулы (М) путем снятия защитной группы СООХ можно получить продукт формулы (Р) в котором R1', R2' и R3' имеют значения, указанные выше. Указанное соединение формулы (Р) можно ввести в реакцию с кислотой формулы (G'):R'СООН (G'),в которой R' имеет значения, указанные для R, в которых возможные реакционноспособные группы необязательно защищены,чтобы получить соединение формулы (Ia) в которой R', R'1, R'2 и R'3 имеют значения, указанные выше. Продукт формулы (М) можно также ввести в реакцию с амином формулы (G)H-NR4'R5' (G),в которой R4' и R5' имеют значения, указанные выше для R4 и R5, в которых возможные реакционноспособные группы необязательно защищены, для получения соединения формулы (Ia') в которой R'1, R'2, R'3, R'4 и R'5 имеют значения, указанные выше. Продукты формулы (Ia') можно также получить из соединения формулы (J), которое подвергают взаимодействию с соединением формулы (K) для получения продукта формулы (N) в которой СООХ имеет указанные выше значения. Продукт формулы (N) вводят затем во взаимодействие с амином формулы (G) с получением продукта формулы (О) в которой R'4 и R'5 имеют указанные выше значения. Затем продукт формулы (О) можно ввести во взаимодействие с соединением формулы (В) для получения продукта формулы (Ia'). Полученные таким образом продукты формул (Ia) и (Ia') могут представлять собой продукты формулы (I), в которых А обозначает NH, и для получения других продуктов формулы (I) их подвергают,при желании и при необходимости, одной или нескольким реакциям превращения (а)-(ж), указанным выше, осуществляемым в любом порядке. Более конкретно, дианилины общей формулы (L) можно получить, например, путем взаимодействия 3,4-диаминофенола формулы (J) с сульфонилхлоридом формулы (В) (R1, R2, R3 имеют определения,данные для общей формулы (IA в присутствии основания, такого как водный раствор гидроксида натрия или триэтиламин, в растворителе, таком как, например, ацетон, при температуре около 20 С. Продукты формулы (J) могут быть получены, например,путем восстановления, осуществляемого в автоклаве, 4-амино-3-нитрофенола формулы (Н) в присутствии водорода при давлении несколько бар и катализатора, такого как, например, палладий-на-угле,в протонном растворителе, таком как метанол,путем восстановления сложного 4-амино-3-нитробензолсульфонового эфира формулы (I), например, в присутствии железа в виде порошка и уксусной кислоты, в протонном растворителе, таком как метанол, при температуре около 65 С. Продукты формулы (I) могут быть получены в результате реакции 4-амино-3-нитрофенола формулы (Н) с сульфонилхлоридом формулы (В) в присутствии основания, такого как водный раствор гидроксида натрия или триэтиламин, в растворителе, таком как, например, ацетон, при температуре около 20 С. Более конкретно, бензимидазолы общей формулы (Ia') могут быть получены, например, путем взаимодействия амина NHR4R5 (где R4 и R5 определены выше) с карбаматом формулы (М) в присутствии апротонного растворителя, такого как 1-метилпирролидин-2-он. Реакцию осуществляют при температуре в интервале 90-150 С в герметично закрытой трубке в микроволновой печи. Карбаматы формулы (М) могут быть получены, в частности, так, как описано в WO 03028721 A2,путем циклизации продуктов формулы (L) в присутствии псевдотиомочевины формулы (K), в присутствии уксусной кислоты и в протонном растворителе, таком как метанол, при температуре около 65 С,путем взаимодействия мочевины формулы (О) и сульфонилхлорида формулы (В) в присутствии основания, такого как водный раствор гидроксида натрия или триэтаноламин, в растворителе, таком как,например, ацетон, при температуре около 20 С. Мочевины формулы (О) могут быть получены из карбаматов формулы (N) в присутствии аминовNHR4R5 и апротонного растворителя, такого как 1-метилпирролидин-2-он. Реакцию осуществляют при температуре в интервале 90-150 С в герметично закрытой трубке в микроволновой печи. Карбаматы формулы (N) могут быть получены, в частности, так, как описано в WO 03028721 A2,исходя из 3,4-диаминофенола формулы (J) и псевдотиомочевины формулы (K) в присутствии уксусной кислоты, в протонном растворителе, таком как метанол, при температуре около 65 С. Более конкретно, бензимидазолы общей формулы (Ia) могут быть получены, например, путем сочетания 2-аминобензимидазола формулы (Р) с кислотой R'COOH, в которой R' имеет значения, указанные Бензимидазолы формулы (Ia) могут быть получены методом сочетания, осуществляемого в условиях,- 14014315 описанных, например, Bach Т. и сотр. (Synlett, 2002, (8), 1302-1304) в присутствии О-(7-азабензотриазол 1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфата, в растворителе, таком как диметилформамид, и в присутствии основания, такого как диизопропилэтиламин, при температуре около 20 С. Возможные реакционноспособные группы затем необязательно освобождают от защитных групп в классических условиях, описанных Greene и Wuts в Protective Group in Organic Synthesis, 3me edition, Wiley-Interscience,1999. Более конкретно, в случае, когда защитной группой является трет-бутоксикарбонил (ВОС), снятие защиты может осуществляться, например, с помощью трифторуксусной кислоты в дихлорметане. Бензимидазолы формулы (Р) могут быть получены путем снятия защиты с бензимидазолов формулы (М) в классических условиях, описанных Greene и Wuts в Protective Group in Organic Synthesis, 3meedition, Wiley-Interscience, 1999. Более конкретно, в случае, когда защитной группой является третбутоксикарбонил (ВОС), снятие защиты может осуществляться, например, с помощью трифторуксусной кислоты в дихлорметане. Таким образом, в соответствии с представленной выше схемой 2 а, объектом настоящего изобретения является также способ получения продуктов формулы (Ib) и (Ib'), которые определены выше, отличающийся тем, что соединение формулы (D') в которой СООХ обозначает защитную группу для NH2, подвергают взаимодействию с амином формулыH-NR4'R5' (G),в которой R4' и R5' имеют значения, указанные выше для R4 и R5, в которых возможные реакционноспособные группы необязательно защищены, для получения соединения формулы (F) в которой R4' и R5' имеют значения, указанные выше,затем соединение формулы F подвергают взаимодействию с соединением формулы (В), определенным выше, для получения продукта формулы (Ib) в которой R'1, R'2, R3', R4' и R5' имеют значения, указанные выше. Продукты формулы (Ib) и (Ib') могут быть также получены в результате реакции аминобензотиазола формулы (С) с соединениями формулы (В) для получения продуктов формулы (Q) в которой R'1, R'2 и R3' имеют значения, указанные выше. Продукты формулы (Q) подвергают затем взаимодействию либо с кислотой формулы (G') или же с хлорангидридом кислоты формулы (G") с получением продуктов формулы (Ib'),с арилхлорформиатом с получением продуктов формулы (R) в которых СООХ обозначает защитную группу для NH2, затем продукты формулы (R) можно ввести в реакцию с амином формулы (G)H-NR4'R5' (G) с получением продуктов формулы (Ib), в которой R'4 и R'5 имеют значения, указанные выше. Полученные таким образом продукты формул (Ib) и (Ib') могут представлять собой продукты формулы (I), в которых А обозначает S, и для получения других продуктов формулы (I) их подвергают, при желании и при необходимости, одной или нескольким реакциям превращения (а)-(ж), осуществляемым в любом порядке, представленным выше. На представленной выше схеме 2 а бензотиазолы общей формулы (Ib) могут быть получены из 2 аминобензотиазол-6-ола (С). Соединения общей формулы (Е') можно получить в результате реакции алкилхлорформиата, взятого в избытке, с соединением формулы (С), например, в присутствии основания, такого как пиридин, при температуре около 20 С. Более конкретно, эфирные производные (6-гидроксибензотиазол-2-ил)карбаминовой кислоты общей формулы (D') могут быть получены в результате обработки сложного эфира 2 метоксикарбониламинобензотиазол-6-илкарбоновой кислоты (Е'), например, водным раствором гидроксида калия. Соединения общей формулы (F) могут быть получены взаимодействием между производным карбаминовой кислоты общей формулы (D') и амином (G) в присутствии апротонного растворителя, такого как 1-метилпирролидин-2-он. Реакция может быть осуществлена при температуре в интервале 90-150 С в герметически закрытой трубке в микроволновой печи. Бензотиазолы формулы (Ib) могут быть получены взаимодействием между соединениями общей формулы (F) и сульфонилхлоридом формулы (В) (R1, R2, R3 имеют определения, данные для общей формулы (I в присутствии основания, такого как водный раствор гидроксида натрия или триэтаноламин, в растворителе, таком как, например, ацетон, при температуре около 20 С. Бензотиазолы формулы (Ib) могут быть также получены, например, взаимодействием между соединением общей формулы (R) и амином (G) в присутствии растворителя, такого как тетрагидрофуран, при температуре около 20 С. Бензотиазолы формулы (R) могут быть получены взаимодействием между соединением общей формулы (Q) и избытком арилхлорформиата в присутствии основания, такого как гидрокарбонат натрия,в растворителе, таком как тетрагидрофуран, при температуре около 20 С. Бензотиазолы формулы (Q) могут быть получены взаимодействием 2-аминобензотиазола формулы(С) и сульфонилхлорида формулы (В) в присутствии основания, такого как водный раствор гидроксида натрия или триэтиламин, в растворителе, таком как, например, ацетон, при температуре около 20 С. Более конкретно, бензотиазолы общей формулы (Ib') могут быть получены, например, сочетанием 2-аминобензотиазола формулы (Q) с кислотой R'СООН или с хлорангидридом кислоты R'COCl, в которых R' имеет значения, указанные выше для R, в которых возможные реакционноспособные группы необязательно защищены. Бензотиазолы общей формулы (Ib') могут быть получены из 2-аминобензотиазола формулы (Q): реакцией сочетания, осуществляемой в условиях, описанных, например, Bach Т. и сотр. (Synlett,2002, (8), 1302-1304) в присутствии О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфата, в растворителе, таком как диметилформамид, и в присутствии основания, такого как диизопропилэтиламин, при температуре около 20 С. Возможные реакционноспособные группы затем необязательно освобождают от защитных групп в классических условиях, описанных Greene и Wuts вProtective Group in Organic Synthesis, 3me edition, Wiley-Interscience, 1999. Более конкретно, в случае, когда защитной группой является трет-бутоксикарбонил (ВОС), снятие защиты может осуществляться,например, с помощью трифторуксусной кислоты в дихлорметане,взаимодействием с хлорангидридом кислоты R'COCl в присутствии, например, растворителя, такого как пиридин, при температуре около 20 С. Некоторые из исходных продуктов формулы В, G, G', G", Н и K являются известными продуктами и доступны в продаже: исходные продукты могут быть также получены обычными и известными специалисту способами, например, исходя из продуктов, доступных в продаже. В экспериментальной части, представленной ниже, приведены примеры таких исходных продуктов. Таким образом, различные реакционноспособные группы, которые могут нести некоторые соединения, участвующие в реакциях, описанных выше, могут быть, при необходимости, защищены соответ- 16014315 ствующими защитными группами. Ниже приводится следующий список, не являющийся ограничительным, примеров способов защиты реакционных групп: гидроксильные группы могут быть защищены, например, алкильными радикалами, такими как трет-бутил, триметилсилил, трет-бутилдиметилсилил, метоксиметил, тетрагидропиранил, бензил или ацетил,аминогруппы могут быть защищены, например, ацетильным, тритильным, бензильным, третбутоксикарбонильным, ВОС, бензилоксикарбонильным, фталимидо радикалами или другими радикалами, известными в химии пептидов. Кислотные группы могут быть защищены, например, в виде сложных эфиров, образующихся с легко расщепляемыми сложными эфирами, такими как бензиловые или трет-бутиловые сложные эфиры,или сложные эфиры, известные в химии пептидов. Список различных используемых защитных групп можно найти в руководствах, известных специалисту, и, например, в патенте BF 2499995. Реакции а)-ж) можно осуществить в обычных и известных специалисту условиях, таких как, например, условия, описанные ниже. а) Продукты, описанные выше, можно, при желании, подвергнуть реакции этерификации с возможными карбоксильными группами, которую можно осуществить в соответствии с обычными способами,известными специалисту. б) Реакции превращения эфирных групп в кислотную группу в продуктах, описанных выше, могут быть, при желании, осуществлены в обычных условиях, известных специалисту, в частности, путем кислого или щелочного гидролиза, например, с помощью гидроксида натрия или калия в спиртовой среде,такой как, например, среда метанола, или с помощью хлористо-водородной или серной кислоты. Реакцию омыления можно осуществить в соответствии с обычными и известными специалисту способами, как, например, в растворителе, таком как метанол или этанол, диоксан или диметоксиэтан, в присутствии гидроксида натрия или калия. в) Возможные карбоксильные группы, свободные или этерифицированные, в продуктах, описанных выше, могут быть, при желании, восстановлены до спиртовой группы способами, известными специалисту: возможные этерифицированные карбоксильные группы могут быть, при желании, восстановлены до спиртовой группы способами, известными специалисту и, в частности, с помощью литийалюминийгидрида в растворителе, таком как, например, тетрагидрофуран или диоксан или этиловый эфир. В продуктах, описанных выше, возможные свободные карбоксильные группы могут быть, при желании, восстановлены до спиртовой группы, в частности, с помощью гидрида бора. г) Возможные алкоксигруппы, такие как, в частности, метокси, в продуктах, описанных выше, при желании могут быть превращены в гидроксильную группу в обычных и известных специалисту условиях, например, при помощи трибромида бора в растворителе, таком как, например, метиленхлорид, при помощи гидробромида или гидрохлорида пиридина или же бромисто-водородной или хлористоводородной кислотой в воде или трифторуксусной кислоте при температуре кипения с обратным холодильником. д) Удаление защитных групп, таких, например, которые перечислены выше, может быть осуществлено в обычных и известных специалисту условиях, в частности, путем кислого гидролиза, осуществляемого с помощью кислоты, такой как хлористо-водородная кислота, бензолсульфоновая или паратолуолсульфоновая, муравьиная или трифторуксусная кислоты, или же путем каталитического гидрирования. Фталимидные группы могут быть удалены с помощью гидразина. е) Продукты, описанные выше, можно, при желании, подвергнуть реакциям солеобразования, например, с помощью минеральной или органической кислоты или минерального или органического основания в соответствии с обычными и известными специалисту способами: такую реакцию солеобразования можно осуществить, например, в присутствии хлористо-водородной кислоты, или же винной, лимонной или метансульфоновой кислоты, в спирте, таком как, например, этанол или метанол. ж) Возможные оптически активные формы продуктов, описанных выше, можно получить путем расщепления рацематов в соответствии с обычными и известными специалисту способами. Продукты формулы (I), которые определены выше, а также их аддитивные соли с кислотами обладают интересными фармакологическими свойствами, которые обусловлены, в частности, способностью этих продуктов ингибировать киназы, на что указывалось выше. Продукты согласно настоящему изобретению пригодны, в частности, в области опухолевой терапии. Таким образом, продукты согласно изобретению могут усиливать терапевтический эффект при применении широко используемых противоопухолевых агентов. Эти свойства обосновывают применение этих продуктов в терапии, следовательно, более конкретно, изобретение относится к продуктам формулы (I), которые определены выше, причем указанные продукты формулы (I) находятся во всех возможных изомерных формах, рацемических, энантиомерных и- 17014315 диастереоизомерных, а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств. Более конкретно, изобретение относится к продуктам, соответствующим следующим наименованиям: 2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-пирролидин-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(2,6-диметилпиперидин-1-ил)этил]карбамоиламино)-1,3 бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-пиперидин-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(2-оксопирролидин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(4-бензилпиперазин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(4-метилпиперазин-1-ил)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(метилкарбамоил)амино]-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-азепан-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств. Более конкретно, изобретение относится к продуктам, соответствующим следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,4,6-триметилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дифторбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств. Более конкретно, настоящее изобретение относится к продуктам, соответствующим следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-2-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(2-азепан-1-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила,а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств.- 18014315 Более конкретно, настоящее изобретение относится к продуктам, соответствующим следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2-хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(1-метилпирролидин-2-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([3-(диметиламино)пропил]карбамоиламино)-1,3-бензотиазол-6-ила,а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств. Более кокретно, настоящее изобретение относится к продуктам, соответствующим следующим наименованиям: 2,6-дихлорбензолсульфонат 2-[3-(2-морфолин-4-илэтил)уреидо]бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-морфолин-4-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,2,6-дихлорбензолсульфонат 2-[(3-пирролидин-1-илпропил)карбамоил]амино-1,3-бензотиазол-6-ила,а также к аддитивным солям указанных продуктов формулы (I) с фармацевтически приемлемыми минеральными и органическими кислотами или с минеральными и органическими основаниями в качестве лекарственных средств. Изобретение относится также к фармацевтическим композициям, содержащим в качестве действующего начала по меньшей мере один из продуктов формулы (I), таких, которые определены выше, или одну фармацевтически приемлемую соль этого продукта или одно пролекарство этого продукта и, при необходимости, фармацевтически приемлемый носитель. Изобретение относится также к фармацевтическим композициям, содержащим в качестве действующего начала по меньшей мере одно из лекарственных средств, которые определены выше. Названные фармацевтические композиции согласно настоящему изобретению могут, также, при необходимости, содержать действующие начала других антимитотических лекарственных средств, таких как, в частности, лекарственные средства на основе таксола, цис-платины, противораковые агенты на основе ДНК и другие. Эти фармацевтические композиции могут вводиться через рот, парентеральным путем, или местным путем в виде топического нанесения на кожу и слизистые, или путем внутривенной или внутримышечной инъекции. Эти композиции могут быть твердыми или жидкими и находиться во всех обычных фармацевтических формах, используемых в медицине, как, например, в форме простых или дражированных таблеток,пилюль, лепешек, желатиновых капсул, капель, гранул, препаратов для инъекций, мазей, кремов или гелей; композиции готовят в соответствии с практикуемыми способами. Активное начало может быть введено в эксципиенты, обычно используемые для фармацевтических композиций, такие как тальк, гуммиарабик, лактоза, крахмал, стеарат магния, масло какао, водные или неводные носители, жировые вещества животного или растительного происхождения, производные парафинов, гликоли, различные смачивающие агенты, диспергаторы или эмульгаторы, консерванты. Приемлемая дозировка, варьирующая в зависимости от используемого продукта, пациента и конкретного заболевания, может составлять, например, от 0,05 до 5 г в день для взрослого, предпочтительно от 0,1 до 2 г в день. Настоящее изобретение относится также к применению продуктов формулы (I), которые определены выше, или фармацевтически приемлемых солей этих продуктов для получения лекарственного средства, предназначенного для ингибирования активности протеинкиназы. Настоящее изобретение относится также к применению продуктов формулы (I), которые определены выше, для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, характеризующегося нарушением активности протеинкиназы. Такое лекарственное средство предназначено, в частности, для лечения или профилактики заболевания у млекопитающего. Настоящее изобретение относитсятакже к применению, указанному выше, при котором протеин- 19014315 киназа является тирозинкиназой. Настоящее изобретение относится также к применению, указанному выше, при котором протеинкиназа выбрана из следующей группы: AuroraA, AuroraB, представители семейства CDKs (CDK1, 2, 4, 5,7, 9), RON, Tie2, представители семейства VEGFRs (VEGFR1 или fit-1, VEGFR2 или KGR или fik-1,VEGFR3), FGFRs (FGFR1, FGFR2, FGFR3, FGFR4, FGFR5), MET, а также мутанты протеина MET,EGFR, Fak, IGF-1R, PDGFR. В частности, настоящее изобретение относится к применению, указанному выше, при котором протеинкиназа представляет собой МЕТ. Настоящее изобретение относится также к применению, указанному выше, при котором протеинкиназа находится в клеточной культуре. Настоящее изобретение относится также к применению, указанному выше, при котором протеинкиназа находится в организме млекопитающего. Настоящее изобретение относится, в частности, к применению продукта формулы (I), который определен выше, для получения лекарственного средства, предназначенного для профилактики или лечения заболеваний, связанных с неконтролируемой пролиферацией. Настоящее изобретение относится, в частности, к применению продукта формулы (I), который определен выше, для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, выбранного из следующей группы: нарушения пролиферации кровеносных сосудов,фиброзные нарушения, нарушения пролиферации мезангиальных клеток, метаболические, аллергические, астматические, тромбозные нарушения, заболевания нервной системы, ретинопатия, псориаз, ревматоидный артрит, диабет, мышечная дегенерация или рак. Более конкретно, настоящее изобретение относится к применению продукта формулы (I), который определен выше, для получения лекарственного средства, предназначенного для лечения или профилактики заболевания, выбранного из следующей группы: нарушения пролиферации кровеносных сосудов,фиброзные нарушения, нарушения пролиферации мезангиальных клеток, ретинопатия, псориаз, ревматоидный артрит, диабет, мышечная дегенерация или рак. Более конкретно, настоящее изобретение относится, таким образом, к применению продукта формулы (I), который определен выше, для получения лекарственного средства, предназначенного для лечения или профилактики онкологических заболеваний, в частности, предназначенного для лечения рака. Среди различных видов рака представляет интерес лечение солидных опухолей или лейкозов, лечение рака, устойчивого к цитотоксическим агентам. Упомянутые продукты согласно настоящему изобретению могут быть использованы, в частности,для лечения первичных опухолей и/или метастаз, в частности, в случае раков желудка, печени, почек,яичников, прямой кишки, простаты, легких (NSCLC и SCLC), глиобластом, раков щитовидной железы,мочевого пузыря, молочной железы, меланомы, лимфоидных или миелоидных гематопоэтических опухолей, а также сарком, опухолей мозга, гортани, лимфатической системы, рака костей и поджелудочной железы. Настоящее изобретение относится также к применению продуктов формулы (I), описанной выше,для получения лекарственных средств, предназначенных для химиотерапевтического лечения рака. Такие лекарственные средства, предназначенные для химиотерапевтического лечения, могут применяться индивидуально или в комбинации. В частности, продукты, описанные в настоящей заявке, могут вводиться отдельно или в сочетании с химиотерапией или радиотерапией или же в сочетании, например, с другими терапевтическими агентами. Такими терапевтическими агентами могут быть обычно используемые противоопухолевые агенты. В качестве ингибиторов киназ можно назвать бутиролактон, флавопиридол и 2-(2 гидроксиэтиламино)-6-бензиламино-9-метилпурин, называемый оломуцином. Следующие примеры, в которых представлены продукты формулы (I), иллюстрируют изобретение,но не ограничивают его. Экспериментальная часть Используемая микроволновая печь: Biotage, задающее устройство EXP-EU, 300 Вт макс., 2450 МГц. Спектры ЯМР 1 Н при 400 МГц и 1 Н при 300 МГц регистрировали на спектрометре BRUKERAVANCE DRX-400 или BRUKER AVANCE DRX-300 с химическими сдвигами ( в ч./млн) в растворителе диметилсульфоксид-d6 (ДМСО-d6), при эталоне 2,5 ч./млн и при температуре 303 K. Масс-спектры снимали либо при электронном ударе (IE; 70eV; прибор Finnigan SSQ7000), либо при химической ионизации (IC; газ-реагент: аммиак; прибор Finnigan SSQ7000). Спектры при электрораспылении (ES+) регистрировали на приборе Platform II (Micromass). Пример 1. 2,6-Дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5 ила. 2,6-Дихлорбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен следующим образом. К раствору 175 мг 1-(5-гидрокси-1 Н-бензимидазол-2-ил)-3-(2-метоксиэтил)мочевины в 15 см 3 0,1N- 20014315 водного раствора гидроксида натрия прибавляют 189 мг тонкоизмельченного 2,6-дихлорбензолсульфонилхлорида. Суспензию перемешивают приблизительно 20 ч при температуре около 20 С, затем добавляют 10 см 3 воды и охлаждают до температуры около 5 С в течение 15 мин. Выпавший осадок центрифугируют, промывают три раза с помощью 2 см 3 воды, сушат при пониженном давлении (13 кПа) над пентаоксидом фосфора. После флеш-хроматографии на колонке из оксида кремния [элюент: дихлорметан/метанол/ацетонитрил (95/3/2 об.)], получают 65 мг 2,6-дихлорбензолсульфоната 2[(2-метоксиэтил) карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка кремового цвета, имеющего следующие характеристики: температура плавления: 171 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 3,28 (с, 3 Н); 3,34 (м частично экранирован, 2 Н); 3,42 (т, J=5,5 Гц, 2 Н); 6,75 (д шир. J=8,5 Гц, 1 Н); 6,95-7,22 (м ушир. 2 Н); 7,30 (м шир. 1 Н); 7,68-7,79 (м,3 Н); 9,93 (м ушир. 1 Н); 11,75 (м ушир. 1 Н). Масс-спектрометрия: LCMS: m/z 459: [М+Н]+ (основной пик), m/z 917: [2 М+Н]+, m/z 384: [М+Н]+-NHC2H4OCH3. 1-(5-Гидрокси-1 Н-бензимидазол-2-ил)-3-(2-метоксиэтил)мочевину получают согласно способу,описанному в патенте WO 03028721 A2. Пример 2. 2-Хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2-Хлор-6-метилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен согласно способу, описанному в примере 1, но исходя из 175 мг 1-(5-гидрокси-1 Нбензимидазол-2-ил)-3-(2-метоксиэтил)мочевины, 17,5 см 3 0,1N водного раствора гидроксида натрия и 173 мг 2-хлор-6-метилбензолсульфонилхлорида. После флеш-хроматографии на колонке из оксида кремния [элюент: дихлорметан/метанол (96/4 об.)], получают 45 мг 2-хлор-6-метилбензолсульфоната 2-[(2 метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде твердого вещества, имеющего следующие характеристики: температура плавления: 138 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,42 (с, 3 Н); 3,28 (с,3 Н); 3,33 (м частично экранирован, 2 Н); 3,41 (т,J=5,5 Гц, 2 Н); 6,70 (дд, J=2,5 и 8,5 Гц, 1 Н); 6,91-7,31 (м ушир. 2 Н); 7,27 (д шир. J=8,5 Гц, 1 Н); 7,40 (д шир.CI: m/z 439: [М+Н]+. Пример 3. 2,4,6-Триметилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,4,6-Триметилбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен следующим образом. К раствору 200 мг 1-(5-гидрокси-1 Н-бензимидазол-2-ил)-3-(2-метоксиэтил)мочевины в 50 см 3 ацетона прибавляют 0,162 см 3 триэтиламина и 192 мг 2,4,6-триметилбензолсульфонилхлорида. После перемешивания около 20 ч при температуре около 20 С добавляют 95 мг 2,4,6-триметилбензолсульфонилхлорида и 0,08 см 3 триэтиламина. После дополнительного перемешивания в течение 3 ч при той же температуре добавляют 95 мг 2,4,6-триметилбензолсульфонилхлорида и суспензию перемешивают около 20 ч. После концентрирования досуха при пониженном давлении (13 кПа) остаток обрабатывают 50 см 3 воды и экстрагируют три раза с помощью 40 см 3 этилацетата. Органические фазы сушат над сульфатом магния, фильтруют и концентрируют при пониженном давлении. После флешхроматографии на колонке из оксида кремния [элюент: дихлорметан/метанол (95/5 об.)], получают 134 мг смолы, которую загущают в 7 см 3 диизопропилового эфира и 7 см 3 диэтилового эфира. После фильтрации и сушки при пониженном давлении (13 кПа) над петнаоксидом фосфора получают 123 мг 2,4,6 триметилбензолсульфоната 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде твердого вещества, имеющего следующие характеристики: температура плавления: 140 С, затем 162 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 2,29 (с, 3 Н) ; 2,44 (с, 6 Н); 3,22-3,39 (м частично экранирован, 5 Н); 3,42 (т, J=5,5 Гц, 2 Н); 6,60 (дд, J=2,5 и 8,5 Гц, 1 Н); 6,93 (м ушир., 1 Н); 7,12 (с, 2 Н); 7,25 (д шир., J=8,5 Гц,2 Н); 9,90 (м ушир., 1 Н); 11,75 (м ушир., 1 Н). Масс-спектрометрия: LCMS: m/z 433: [М+Н]+ (основной пик) m/z 865: [2 М+Н]+, m/z 431: [М-Н]-,m/z 863: [2 М-Н]-. Пример 4. 2,6-Дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино 1 Н-бензимидазол-5-ила. 2,6-Дихлор-4-(трифторметил)бензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен согласно способу, описанному в примере 1, но исходя из 200 мг 1-(5 гидрокси-1 Н-бензимидазол-2-ил)-3-(2-метоксиэтил)мочевины, 16 см 3 0,1N водного раствора гидроксида натрия и 276 мг 2,6-дихлор-4-(трифторметил)бензолсульфонилхлорида. После флеш-хроматографии на колонке из оксида кремния [элюент: дихлорметан/метанол (95/5 об.)], получают 45 мг 2,6-дихлор-4(трифторметил)бензолсульфоната 2-[(2-метоксиэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в видеRf CCM диоксид кремния = 0,15 [элюент: дихлорметан/метанол (95/5 об.)],спектр ЯМР 1 Н при 400 МГц: 3,29 (с, 3 Н); 3,33 (м частично экранирован, 2 Н); 3,42 (т, J=5,5 Гц, 2 Н); 6,79 (м шир.,1 Н); 7,06-7,20 (м ушир., 2 Н); 7,32 (м шир.,1 Н); 8,23 (с, 2 Н); 9,95 (м ушир., Н); 11,75-11,8 (м ушир., 1 Н). Масс-спектрометрия: LCMS: m/z 527 [М+Н]+ (основной пик), m/z 1053: [2 М+Н]+, m/z 523: [М-Н]-,m/z 1051: [2 М-Н]- (основной пик). Пример 5. 2,6-Дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен согласно способу, описанному в примере 1, но исходя из 250 мг 1-(5-гидрокси-1 Нбензимидазол-2-ил)-3-(2-морфолин-4-илэтил)мочевины, 20,5 см 3 0,1N водного раствора гидроксида натрия и 221 мг 2,6-дихлорбензолсульфонилхлорида. После флеш-хроматографии на колонке из оксида кремния [элюент: дихлорметан/метанол (92/8 об.)], получают 114 мг 2,6-дихлорбензолсульфоната 2-[(2 морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка белого цвета, имеющего следующие характеристики: температура плавления: 149 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,33-2,46 (м,6 Н); 3,22-3,38 (м экранирован, 2 Н); 3,60 (м, 4 Н); 6,75 (дд,J=2,5 и 8,5 Гц, 1 Н); 7,08 (м ушир., 1 Н); 7,29 (д шир., J= 8,5 Гц,2 Н); 7,67-7,79 (м, 3 Н); 10,0 (м ушир., 1 Н); 11,75 (м ушир., 1 Н). Масс-спектрометрия: LCMS: m/z 514: [М+Н]+, m/z 512: [М-Н]-.EI: m/z 100 (основной пик): C4H8NO-CH2+, m/z 146: С 6 Н 3 С 12. 1-(5-Гидрокси-1 Н-бензимидазол-2-ил)-3-(2-морфолин-4-илэтил)мочевину получают согласно способу, описанному в патенте WO 03028721 A2. Пример 6. 2,6-Дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила. а) 2,6-Дихлорбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила может быть получен следующим образом. К раствору 260 мг 1-(6-гидрокси-1,3-бензотиазол-2-ил)-3-(2-морфолин-4-илэтил)мочевины в 19,4 см 3 0,1N водного раствора гидроксида натрия добавляют 209 мг тонко измельченного 2,6 дихлорбензолсульфонилхлорида. После перемешивания около 5 ч при температуре около 20 С прибавляют дополнительно 70 мг 2,6-дихлорбензолсульфонилхлорида. После перемешивания около 18 ч при этой же температуре реакционную смесь концентрируют при пониженном давлении (13 кПа) до достижения объема 5 см 3. Полученную суспензию охлаждают в течение 1 ч до температуры около 5 С. Твердое вещество центрифугируют, промывают три раза с помощью 2 см 3 воды, предварительно охлажденной до температуры около 5 С, сушат при пониженном давлении (13 кПа) над пентаоксидом фосфора. Таким образом получают 216 мг 2,6-дихлорбензолсульфоната 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3 бензотиазол-6-ила в виде порошка кремового цвета, который имеет следующие характеристики: температура плавления: 130-135 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 2,33-2,47 (м, 6 Н); 3,22-2,38 (м экранирован, 2 Н); 3,59 (м, 4 Н); 6,79 (т шир., J=5,5 Гц, 1 Н); 7,01 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,56 (д, J=9,0 Гц, 1 Н); 7,69-7,81 (м, 4 Н); 10,95 (м ушир.,1 Н). Масс-спектрометрия: LCMS: m/z 531: [М+Н]+, m/z 529: [М-Н]-. б) 1-(6-Гидрокси-1,3-бензотиазол-2-ил)-3-(2-морфолин-4-илэтил)мочевина. 1-(6-Гидрокси-1,3-бензотиазол-2-ил)-3-(2-морфолин-4-илэтил)мочевина может быть получена следующим образом. В трубке объемом 10 см 3 суспензируют 200 мг метил-(6-гидрокси-1,3-бензотиазол-2-ил)карбамата в 3 6 см 1-метилпирролидин-2-она и прибавляют 580 мг 2-морфолин-4-илэтиламина. Трубку закрывают и помещают в микроволновую печь при температуре около 150 С в течение 25 мин. После концентрирования досуха при пониженном давлении полученный остаток очищают с помощью флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)]. Таким образом получают 270 мг 1-(6-гидрокси-1,3-бензотиазол-2-ил)-3-(2-морфолин-4-илэтил)мочевины в виде смолистого вещества,которое имеет следующие характеристики:-CONH(CH2)2-C4H8NO, m/z 157: C4H8NO(СН 2)2NHCO+ морфолин, m/z 321: [M-H]-, m/z 643: [2 М-Н]-. в) Метил-(6-гидрокси-1,3-бензотиазол-2-ил)карбамат. Метил-(6-гидрокси-1,3-бензотиазол-2-ил)карбамат может быть получен следующим образом. К раствору 3 г 2-амино-1,3-бензотиазол-6-ола в 50 см 3 пиридина, поддерживая температуру около- 22014315 25 С, добавляют по каплям 1,7 г метилхлорформиата. После приблизительно 3 ч перемешивания в конце прикапывания добавляют 0,37 г метилхлорформиата при температуре около 25 С. Перемешивают 18 ч при этой же температуре, снова добавляют 1,7 г метилхлорформиата и смесь перемешивают дополнительно еще 2 ч. Реакционную смесь выливают в 100 см 3 воды и перемешивают около 15 мин. Выпавший осадок центрифугируют и промывают 3 раза 30 см 3 воды, сушат при пониженном давлении (13 кПа) над пентаоксидом фосфора. Получают 3,5 мг смеси метил-2-[(метоксикарбонил)амино]-1,3-бензотиазол-6-илкарбоната и метил(6-гидрокси-1,3-бензотиазол-2-ил)карбамата, которая имеет следующие характеристики: масс-спектрометрия: LCMS: m/z 225: [М+Н]+ (основной пик), m/z 193: [М+Н]+ -ОСН 3 +50% двузамещенного: m/z 283:[M+H]+ (основной пик), m/z 251: МН+ -ОСН 3. Полученную смесь растворяют в 140 см 3 5N водного раствора гидроксида калия и перемешивают при температуре около 20 С в течение около 18 ч, затем охлаждают приблизительно до 5 С. После доведения рН среды до 5-6 добавлением ледяной уксусной кислоты полученную суспензию выдерживают при температуре около 0 С в течение около 30 мин. Твердый продукт центрифугируют, промывают три раза с помощью 5 см 3 воды, предварительно охлажденной до температуры около 5 С, и сушат при пониженном давлении (13 кПа) над пентаоксидом фосфора. Таким образом получают 2,66 г метил-(6 гидрокси-1,3-бензотиазол-2-ил)карбамата в виде порошка розового цвета, который имеет следующие характеристики: температура плавления: 256 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 3,74 (с, 3 Н); 6,83 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,24 (д, J=2,5 Гц, 1 Н); 7,47(д, J=8,5 Гц, 1 Н); 9,46 (с шир., 1 Н); 11,3 (м ушир., 1 Н). Масс-спектрометрия: EI: m/z 224: [М+.] (основной пик), m/z 192: [М+Н]+ -ОСН 3. г) 2-Амино-1,3-бензотиазол-6-ол. 2-Амино-1,3-бензотиазол-6-ол может быть получен следующим образом. К раствору 7 г 6-этокси-1,3-бензотиазол-2-амина (доступного в продаже) в 65 см 3 ледяной уксусной кислоты прибавляют 130 см 3 48% раствора бромисто-водородной кислоты в воде. Раствор кипятят с обратным холодильником в течение 20 ч. После концентрирования досуха при пониженном давлении (13 кПа) остаток обрабатывают с помощью 50 см 3 воды, доводят рН раствора приблизительно до 8 добавлением твердого гидрокарбоната натрия. Смесь экстрагируют четыре раза с помощью 250 см 3 этилацетата,объединенные органические фазы промывают трижды с помощью 20 см 3 насыщенного водного раствора хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (13 кПа). Полученный твердый продукт обрабатывают 20 см 3 дихлорметана, центрифугируют,промывают три раза 10 см 3 дихлорметана, затем три раза 20 см 3 диэтилового эфира, сушат при пониженном давлении (13 кПа) над пентаоксидом фосфора. Таким образом получают 5,3 г 2-амино-1,3 бензотиазол-6-ола в виде порошка розового цвета, который имеет следующие характеристики: температура плавления: 235-240 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 6,64 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,01 (д, J=2,5 Гц, 1 Н); 7,05 (с шир., 2 Н); 7,12 (д, J=8,5 Гц, 1 Н); 9,07 (с шир., 1 Н). Масс-спектрометрия: EI: m/z 166: [М+.] (основной пик). Пример 7. 2,6-Дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила. а) 2,6-Дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила может быть получен согласно способу, описанному в примере 6 а), но исходя из 330 мг 1-(6-гидрокси-1,3 бензотиазол-2-ил)-3-(2-метоксиэтил)мочевины и 239 мг 2,6-дихлорбензолсульфонилхлорида в 25,6 см 3 0,1N водного раствора гидроксида натрия. После флеш-хроматографии на колонке из диоксида кремния[элюент: дихлорметан/метанол (94/6 об.)] получают 460 мг 2,6-дифторбензолсульфонат 2-[(2-морфолин 4-илэтил)карбамоил]амино-1,3-бензотиазол-6-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 195 С (по Кофлеру),Спектр ЯМР 1 Н при 400 МГц: 2,41 (м, 6 Н); 3,27 (м частично экранирован, 2 Н); 3,59 (м, 4 Н); 6,76 (т шир., J=5,5 Гц, 1H); 7,05 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,42 (т шир., J=9,0 Гц, 2 Н); 7,57 (д, J=9,0 Гц, 1 Н); 7,79 (д,J=2,5 Гц, 1 Н); 7,93 (тт, J=6,0 и 9,0 Гц, 1 Н); 10,9 (м ушир., 1 Н). Пример 8. 2,6-Дифторбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1,3-бензотиазол-6 ила. а) 2,6-Дифторбензолсульфонат 2-[(2-метоксиэтил)карбамоил]амино-1,3-бензотиазол-6-ила может быть получен, как описано в примере 6 а), но исходя из 300 мг 1-(6-гидрокси-1,3-бензотиазол-2-ил)-3-(2 метоксиэтил)мочевины и 262 мг 2,6-дихлорбензолсульфонилхлорида в 28 см 3 0,1N водного раствора гидроксида натрия. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол(95/5 об.)] получают 331 мг 2,6-дифторбензолсульфоната 2-[(2-метоксиэтил)карбамоил]амино-1,3 бензотиазол-6-ила в виде смолы бежевого цвета, которая имеет следующие характеристики: температура плавления: 145 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 3,28 (с, 3 Н); 3,32 (м частично экранирован, 2 Н); 3,41 (м, 2 Н); 6,84 (т- 23014315 шир., J=5,5 Гц, 1 Н); 7,06 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,42 (т шир., J=8,5 Гц, 2 Н); 7,58 (д, J=9,0 Гц, 1 Н); 7,80 (д,J=2,5 Гц, 1 Н); 7,92 (тт, J=6,0 и 8,5 Гц, 1 Н); 10,8 (м ушир., 1 Н). б) 1-(6-Гидрокси-1,3-бензотиазол-2-ил)-3-(2-метоксиэтил)мочевина. 1-(6-Гидрокси-1,3-бензотиазол-2-ил)-3-(2-метоксиэтил)мочевина может быть получена, как описано в примере 6 б), но исходя из 500 мг метил-(6-гидрокси-1,3-бензотиазол-2-ил)карбамата и 1,68 г 2 метоксиэтиламина в 10 см 3 1-метилпирролидин-2-она. Таким образом, получают 300 мг 1-(6-гидрокси 1,3-бензотиазол-2-ил)-3-(2-метоксиэтил)мочевины в виде порошка серого цвета, который имеет следующие характеристики: температура плавления: 225 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 3,28 (с, 3 Н); 3,32 (м частично экранирован, 2 Н); 3,41 (т, J=5,5 Гц, 2 Н); 6,79 (дд, J=2,5 и 8,5 Гц, 1 Н); 6,81 (т шир. частично экранирован, J=5,5 Гц, 1 Н); 7,18 (д, J=2,5 Гц, 1 Н); 7,40(д, J=8,5 Гц, 1 Н); 9,35 (с шир., 1 Н); 10,4 (с шир., 1 Н). Пример 9. 2,6-Дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,6-Дифторбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен следующим образом. К раствору 250 мг 1-(5-гидрокси-1 Н-бензимидазол-2-ил)-3-(2-морфолин-4-илэтил)мочевины в 16,4 см 3 0,1N водного раствора гидроксида натрия добавляют 191 мг 2,6-дифторбензолсульфонилхлорида. Раствор перемешивают 24 ч при температуре около 20 С. После добавления 40 мг 2,6 дифторбензолсульфонилхлорида смесь перемешивают 5 ч при температуре около 20 С. Реакционную среду помещают в ледяную баню, затем выпавший осадок центрифугируют, промывают три раза 5 см 3 ледяной воды и сушат при пониженном давлении над пентаоксидом фосфора. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (93/7 об.)] получают 167 мг 2,6-дифторбензолсульфоната 2-[(2-морфолин-4-илэтил)карбамоил]амино-1,3-бензимидазол-5-ила в виде порошка бледно-желтого цвета, который имеет следующие характеристики: температура плавления: 190-192 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,41 (м, 6 Н); 3,28 (м частично экранирован, 2 Н); 3,59 (м, 4 Н); 6,75 (дд,J=2,0 и 8,5 Гц, 1 Н); 6,98-7,35 (м ушир., 3 Н); 7,41 (т, J=9,0 Гц, 2 Н); 7,90 (м, 1 Н); 10,05 (м ушир., 1 Н), 11,75(м ушир., 1 Н). Масс-спектрометрия: MS (CI): 482: [MH]+. Пример 10. 2-(Трифторметил)бензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Нбензимидазол-5-ила. 2-(Трифторметил)бензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 9, но исходя из 250 мг 1-(5-гидрокси-1 Нбензимидазол-2-ил)-3-(2-морфолин-4-илэтил)мочевины в 13,5 см 3 0,1N водного раствора гидроксида натрия и 335 мг 2-трифторметилбензолсульфонилхлорида. После 5 суток перемешивания при температуре около 20 С реакционную среду выпаривают досуха при пониженном давлении (2 кПа). После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (90/10 об.)] полученный продукт загущают в 5 см 3 диизопропилового эфира, затем фильтруют, промывают три раза 3 см 3 диизопропилового эфира и сушат при пониженном давлении над пентаоксидом фосфора. Получают 128 мг 2(трифторметил)бензолсульфоната 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка кремового цвета, который имеет следующие характеристики: температура плавления: 140-145 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,36-2,45 (м, 6 Н); 3,28 (м частично экранирован, 2 Н); 3,58 (м, 4 Н); 6,65 (дд, J=2,5 и 9,0 Гц, 1 Н); 6,98 (м ушир., 1 Н); 7,27 (м шир., 2 Н); 7,86 (т, J=7,5 Гц, 1 Н); 7,97-8,04 (м, 2 Н); 8,18 (д, J=2,5 Гц, 1 Н); 10,05 (м ушир., 1 Н), 11,7 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=514 [MH+]. Пример 11. 2-Хлор-6-метилбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Нбензимидазол-5-ила. 2-Хлор-6-метилбензолсульфонат 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5 ила может быть получен, как описано в примере 9, но исходя из 200 мг 1-(5-гидрокси-1 Н-бензимидазол 2-ил)-3-(2-морфолин-4-илэтил)мочевины в 13 см 3 0,1N водного раствора гидроксида натрия и 162 мг 2 хлор-6-метилбензолсульфонилхлорида. После 3 суток перемешивания при температуре около 20 С реакционную среду помещают в ледяную баню и образовавшийся осадок центрифугируют, промывают четыре раза 5 см 3 воды и сушат при пониженном давлении над пентаоксидом фосфора. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученный продукт загущают в 5 см 3 диизопропилового эфира, затем центрифугируют, промывают три раза 2 см 3 диизопропилового эфира и сушат при пониженном давлении над пентаоксидом фосфора. Получают 63 мг 2-хлор-6-метилбензолсульфоната 2-[(2-морфолин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5 ила в виде порошка кремового цвета, который имеет следующие характеристики: температура плавления: 168 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 2,40 (м, 6 Н); 2,42 (с, 3 Н); 3,28 (м частично экранирован, 2 Н); 3,59 (м,- 24014315 4 Н); 6,71 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,04 (м ушир., 1 Н); 7,27 (д, J=8,5 Гц, 1 Н); 7,31 (м ушир., 1 Н); 7,39 (д шир., J=7,5 Гц, 1 Н); 7,60 (т, J=7,5 Гц, 1H); 7,65 (дд, J=2,0 и 7,5 Гц, 1 Н); 10,0 (м ушир., 1 Н), 11,7 (м ушир.,1 Н). Масс-спектрометрия: MS (ES+): m/z=494 [MH+]. Пример 12. 2,6-Дихлорбензолсульфонат 2-[(циклопропилкарбамоил)амино]-1 Н-бензимидазол-5 ила. а) 2,6-Дихлорбензолсульфонат 2-[(циклопропилкарбамоил)амино]-1 Н-бензимидазол-5-ила может быть получен следующим образом. К суспензии 300 мг 1-циклопропил-3-(5-гидрокси-1 Н-бензимидазол-2-ил)мочевины в 100 см 3 ацетона прибавляют 186 мг триэтиламина и 349 мг 2,6-дихлорбензолсульфонилхлорида. После перемешивания в течение ночи при температуре около 20 С прибавляют 90 мг 2,6-дихлорбензолсульфонилхлорида и продолжают перемешивают еще в течение 24 ч. Реакционную среду выпаривают досуха при пониженном давлении (2 кПа). Остаток обрабатывают 50 см 3 воды и затем экстрагируют три раза 40 см 3 этилацетата. Органические фазы объединяют, сушат над сульфатом магния, фильтруют и выпаривают досуха при пониженном давлении (0,5 кПа). После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (96,5/3,5 об.)] полученный продукт загущают в 10 см 3 диэтилового эфира, затем фильтруют, промывают три раза 5 см 3 диэтилового эфира и сушат при пониженном давлении над пентаоксидом фосфора. Получают 130 мг 2,6-дихлорбензолсульфоната 2-[(циклопропилкарбамоил)амино]-1 Н-бензимидазол-5-ила в виде порошка кремового цвета, который имеет следующие характеристики: температура плавления: 160-165 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 0,47 (м, 2 Н); 0,68 (м, 2 Н); 2,62 (м, 1 Н); 6,75 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,09 (м ушир., 1 Н); 7,24 (м ушир.,1 Н); 7,30 (д шир., J=8,5 Гц, 1 Н); 7,68-7,79 (м, 3 Н); 9,82 (м ушир., 1 Н),11,75 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=441 [MH+]. б) 1-Циклопропил-3-(5-гидрокси-1 Н-бензимидазол-2-ил)мочевина может быть получена следующим образом. В реактор, предназначенный для микроволновой печи, емкостью 20 см 3 помещают 3 г метил-(5 гидрокси-1 Н-бензимидазол-2-ил)карбамата в 15 см 3 1-метил-2-пирролидинона и 4,19 г циклопропиламина. Герметично закрывают реактор и помещают его на 25 мин при 130 С в емкость микроволновой печи. Реакционную среду выпаривают досуха при пониженном давлении (0,2-0,4 кПа) с температурой бани 85 С. Остаток обрабатывают 100 см 3 воды, загущают, центрифугируют и промывают три раза 80 см 3 воды. Фильтровальную лепешку обрабатывают 30 см 3 смеси дихлорметан/метанол (90/10 об.) и нерастворимую часть фильтруют. Эту операцию повторяют десять раз. Фильтраты выпаривают досуха при пониженном давлении (2 кПа) и при температуре бани 50 С. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (90/10 об.)] получают 300 мг 1-циклопролил-3-(5-гидрокси 1 Н-бензимидазол-2-ил)мочевины в виде кристаллов кремового цвета, которые имеют следующие характеристики: температура плавления: 320 С,спектр ЯМР 1 Н при 300 МГц: 0,47 (м, 2 Н); 0,67 (м, 2 Н); 2,62 (м, 1 Н); 6,48 (дд, J=2,5 и 8,5 Гц, 1 Н); 6,74 (м шир., 1 Н); 7,10 (д, J=8,5 Гц, 1 Н); 7,51 (м ушир., 1 Н); 8,78 (м шир., 1 Н); 9,57 (м очень ушир., 1 Н),12,65 (м очень ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=233 [MH+]. в) Метил-(5-гидрокси-1 Н-бензимидазол-2-ил)карбамат был получен согласно способу, описанному в патенте US 6900235. Пример 13. 2,6-Дихлорбензолсульфонат 2-([2-(1-бензилпиперидин-4-ил)этил]карбамоиламино)1 Н-бензимидазол-5-ила. а) 2,6-Дихлорбензолсульфонат 2-([2-(1-бензилпиперидин-4-ил)этил]карбамоиламино)-1 Нбензимидазол-5-ила может быть получен следующим образом. В реактор, предназначенный для микроволновой печи, помещают 300 мг 2,6-дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 5 см 3 1-метил-2-пирролидинона и 787 мг 2-(1-бензилпиперидин-4-ил)этанамина. Герметично закрывают реактор и помещают на 20 мин при 120 С в емкость микроволновой печи. Реакционную среду выпаривают досуха при пониженном давлении (0,2 кПа) с температурой бани 85 С. Остаток обрабатывают 50 см 3 воды, затем экстрагируют три раза 40 см 3 этилацетата. Органические фазы объединяют и сушат над сульфатом магния, фильтруют и выпаривают при пониженном давлении (2 кПа). После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученный продукт загущают в 5 см 3 диизопропилового эфира, фильтруют, промывают два раза 2 см 3 диизопропилового эфира и сушат при пониженном давлении над пентаоксидом фосфора. Получают 193 мг 2,6-дихлорбензолсульфоната 2-([2-(1 бензилпиперидин-4-ил)этил]карбамоиламино)-1 Н-бензимидазол-5-ила в виде порошка белого цвета,который имеет следующие характеристики: температура плавления: 130 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 1,16 (м, 2 Н); 1,28 (м, 1 Н); 1,41 (м, 2 Н); 1,64 (м, 2 Н); 1,88 (м, 2 Н); 2,77(м, 2 Н); 3,19 (к, J=7,0 Гц, 2 Н); 3,42 (с, 2 Н); 6,75 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,08 (м шир., 2 Н); 7,18-7,34 (м,6 Н); 7,68-7,77 (м, 3 Н); 9,90 (м ушир., 1 Н), 11,7 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=602 [MH+]. б) 2,6-Дихлорбензолсульфонат 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила может быть получен следующим образом. К раствору 5,5 г 2,6-дихлорбензолсульфоната 3,4-диаминофенила в смеси 153 см 3 метанола и 991 мг чистой уксусной кислоты прибавляют 3,4 г диметил-[(Z)-(метилтио)метилиден]бис-карбамата. Смесь кипятят с обратным холодильником в течение 4 ч. После снижения температуры до температуры около 20 С осадок центрифугируют, промывают три раза 10 см 3 метанола и сушат при пониженном давлении над гидроксидом калия. Получают 5,8 г 2,6-дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Нбензимидазол-5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 261 С (по Кофлеру),Масс-спектрометрия: MS (EI): m/z=415 [M+]. в) 2,6-Дихлорбензолсульфонат 3,4-диаминофенила может быть получен следующим образом. К раствору 2 г 2,6-дихлорбензолсульфоната 4-амино-3-нитрофенила в 85 см 3 метанола и 33 см 3 чистой уксусной кислоты прибавляют 2,25 г железа в виде порошка. Реакционную среду кипятят с обратным холодильником в течение 3 ч. Нерастворимые вещества отфильтровывают и промывают три раза 10 см 3 предварительно нагретого метанола. Фильтрат выпаривают досуха при пониженном давлении (2 кПа) и при температуре бани 50 С. Остаток обрабатывают 50 см 3 воды, затем доводят рН до 8-9 добавлением гидрокарбоната натрия и экстрагируют пять раз 80 см 3 дихлорметана. Объединенные органические фазы сушат над сульфатом магния, фильтруют и выпаривают досуха при пониженном давлении (2 кПа). После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (98/2 об.)] получают 900 мг 2,6-дихлорбензолсульфоната 3,4-диаминофенила в виде кристаллов оранжевого цвета, которые имеют следующие характеристики: температура плавления: 100 С (по Кофлеру),Масс-спектрометрия: MS (EI): m/z=332 [M+]. г) 2,6-Дихлорбензолсульфонат 4-амино-3-нитрофенила может быть получен следующим образом. К раствору 3,14 г 4-амино-3-нитрофенола в 50 см 3 ацетона прибавляют 5 г 2,6 дихлорбензолсульфонилхлорида. Оставляют при перемешивании в течение 5 мин, затем помещают реакционную среду в баню с ледяной водой для того, чтобы температура не превышала 30 С во время добавления 2,9 см 3 триэтиламина. Происходит образование осадка, который перемешивают в течение 24 ч при температуре около 20 С. Добавляют 500 мг 2,6-дихлорбензолсульфонилхлорида, затем после 2 ч перемешивания нерастворившуюся часть фильтруют, промывают три раза 30 см 3 ацетона и отставляют. Фильтрат выпаривают досуха при пониженном давлении (2 кПа) и остаток обрабатывают 1 л дихлорметана, затем промывают три раза 40 см 3 воды. Органическую фазу сушат над сульфатом магния, фильтруют и выпаривают досуха при пониженном давлении (2 кПа). Получают 3,28 г 2,6 дихлорбензолсульфоната 4-амино-3-нитрофенила в виде кристаллов оранжевого цвета, которые имеют следующие характеристики: температура плавления: 180 С (по Кофлеру),масс-спектрометрия: MS (ES-): m/z=361 [MH-]. Нерастворившуюся часть обрабатывают 50 см 3 воды, снова фильтруют, промывают три раза 30 см 3 воды, центрифугируют и сушат при пониженном давлении над пентаоксидом фосфора. Получают 3,72 г 2,6-дихлорбензолсульфоната 4-амино-3-нитрофенила в виде порошка желтого цвета, который имеет следующие характеристики: температура плавления: 180 С (по Кофлеру),масс-спектрометрия: MS (ES-): m/z=361 [MH-]. Пример 14. 2,6-Дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-([2-(4-бензилпиперазин-1-ил)этил]карбамоиламино)-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходя из 300 мг 2,6 дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 4,5 см 3 1-метил-2 пирролидинона и 500 мг 2-(4-бензилпиперазин-1-ил)этанамина. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученный продукт перекристаллизовывают при нагревании из 15 см 3 ацетонитрила и центрифугируют при температуре около 20 С, промывают два раза 2 см 3 ацетонитрила и три раза 4 см 3 диэтилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 241 мг 2,6-дихлорбензолсульфоната 2-([2-(4 бензилпиперазин-1-ил)этил]карбамоиламино)-1 Н-бензимидазол-5-ила в виде порошка с фиолетовым оттенком, который имеет следующие характеристики: температура плавления: 190-192 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,34-2,47 (м шир., 10 Н); 3,26 (м частично экранирован, 2H); 3,47 (с,2 Н); 6,74 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,09 (м ушир., 1 Н); 7,20-7,35 (м, 7 Н); 7,68-7,78 (м, 3 Н); 10,0 (м очень ушир., 1 Н), 11,75 (м очень ушир., 1 Н).- 26014315 Масс-спектрометрия: MS (ES+) : m/z=937 [MH+]. Пример 15. 2,6-Дихлорбензолсульфонат 2-[(пиридин-3-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(пиридин-2-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6-дихлорбензолсульфоната 2[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 7 см 3 1-метил-2-пирролидинона и 260 мг 1 пиридин-2-илметанамина, осуществляя реакцию в течение 25 мин при 130 С. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученное твердое вещество загущают в 10 см 3 диизопропилового эфира, центрифугируют, промывают три раза 5 см 3 диизопропилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 160 мг 2,6-дихлорбензолсульфоната 2-[(пиридин-2-илметил)карбамоил]амино-1 Н-бензимидазол 5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 204 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 4,49 (д, J=5,5 Гц, 2 Н); 6,73 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,07 (с шир., 1 Н); 7,24-7,31 (м, 2 Н); 7,37 (д шир., J=8,0 Гц, 1 Н); 7,67-7,81 (м,4 Н); 7,93 (м ушир., 1 Н); 8,53 (д шир., J=5,5 Гц,1 Н); 10,1 (м ушир., 1 Н), 11,85 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=492 [MH+]. Пример 16. 2,6-Дихлорбензолсульфонат 2-[(пиридин-3-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(пиридин-3-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6-дихлорбензолсульфоната 2[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 6 см 3 1-метил-2-пирролидинона и 260 мг 1 пиридин-3-илметанамина, осуществляя реакцию в течение 25 мин при 130 С. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (90/10 об.)] полученное твердое вещество загущают в 10 см 3 диизопропилового эфира, центрифугируют, промывают три раза 5 см 3 диизопропилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 169 мг 2,6-дихлорбензолсульфоната 2-[(пиридин-3-илметил)карбамоил]амино-1 Н-бензимидазол 5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 210 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 4,41 (д, J=6, 0 Гц, 2 Н); 6,75 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,09 (с шир., 1 Н); 7,29 (д, J=8,5 Гц,1 Н); 7,38 (дд, J=5,0 и 8,0 Гц, 1 Н); 7,68-7,76 (м,5 Н); 8,46 (дд, J=2,0 и 5,0 Гц, 1 Н); 8,55 (д,J=2,5 Гц, 1 Н); 10,15 (м ушир., 1 Н), 11,7 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=492 [MH+]. Пример 17. 2,6-Дихлорбензолсульфонат 2-[(пиридин-4-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(пиридин-4-илметил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6-дихлорбензолсульфоната 2[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 7 см 3 1-метил-2-пирролидинона и 260 мг 1 пиридин-4-илметанамина, осуществляя реакцию в течение 25 мин при 130 С. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученное твердое вещество загущают в 10 см 3 диизопропилового эфира, центрифугируют, промывают три раза 5 см 3 диизопропилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 175 мг 2,6-дихлорбензолсульфоната 2-[(пиридин-4-илметил)карбамоил]амино-1 Н-бензимидазол 5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 165-170 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 4,42 (д, J=6,0 Гц, 2 Н); 6,75 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,08 (с шир., 1 Н); 7,26-7,32 (м, 3 Н); 7,66-7,78 (м, 3 Н); 7,85 (м ушир., 1 Н); 8,50 (д шир., J=5,5 Гц, 2 Н); 10,35 (м ушир., 1 Н),11,7 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=492 [MH+]. Пример 18. 2,6-Дихлорбензолсульфонат 2-[(бензилкарбамоил)амино]-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(бензилкарбамоил)амино]-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6-дихлорбензолсульфоната 2[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 10 см 3 1-метил-2-пирролидинона и 0,114 см 3 бензиламина, осуществляя реакцию в течение 25 мин при 130 С. Получают 181 мг 2,6 дихлорбензолсульфоната 2-[(бензилкарбамоил)амино]-1 Н-бензимидазол-5-ила в виде порошка кремового цвета, который имеет следующие характеристики: температура плавления: 195 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 4,39 (д, J=6,0 Гц, 2 Н); 6,74 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,09 (с шир., 1 Н); 7,20-7,39 (м, 6 Н); 7,60-7,80 (м, 4 Н); 10,1 (м ушир., 1 Н), 11,8 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=491 [MH+]. Пример 19. 2,6-Дихлорбензолсульфонат 2-[(2-пиридин-3-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила.- 27014315 2,6-Дихлорбензолсульфонат 2-[(2-пиридин-3-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6-дихлорбензолсульфоната 2[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 6 см 3 1-метил-2-пирролидинона и 147 мг 2 пиридин-3-илэтанамина, осуществляя реакцию в течение 25 мин при 130 С. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученное твердое вещество загущают в 3 см 3 ацетонитрила, центрифугируют, промывают два раза 0,5 см 3 ацетонитрила, затем три раза 5 см 3 диизопропилового эфира и сушат при пониженном давлении. Получают 132 мг 2,6 дихлорбензолсульфоната 2-[(2-пиридин-3-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 131 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,82 (т, J=6,5 Гц, 2 Н); 3,44 (к, J=6,5 Гц, 2 Н); 6,74 (д шир., J=8,5 Гц,1 Н); 7,07 (м ушир., 1 Н); 7,25-7,35 (м, 3 Н); 7,64-7,78 (м, 4 Н); 8,43 (д шир., J=5,5 Гц, 1 Н); 8,47 (с шир., 1 Н); 9,97 (м ушир., 1 Н); 11,8 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=506 [MH+]. Пример 20. 2,6-Дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-([2-(4-метилпиперазин-1-ил)этил]карбамоиламино)-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 а), но исходят из 200 мг 2,6 дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 6 см 3 1-метил-2 пирролидинона и 172 мг 2-(4-метилпиперазин-1-ил)этанамина, осуществляя реакцию в течение 25 мин при 130 С. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол(80/20 об.)] полученное твердое вещество загущают в 10 см 3 диизопропилового эфира, центрифугируют,промывают два раза 3 см 3 диизопропилового эфира, затем сушат досуха при пониженном давлении над пентаоксидом фосфора. Получают 196 мг 2,6-дихлорбензолсульфоната 2-([2-(4-метилпиперазин-1 ил)этил]карбамоиламино)-1 Н-бензимидазол-5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 180 С (по Кофлеру),спектр ЯМР 1 Н при 400 МГц: 2,16 (с, 3 Н); 2,22-2,54 (м частично экранирован, 10 Н); 3,27 (м частично экранирован, 2 Н); 6,75 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,08 (м шир., 1 Н); 7,28 (д, J=9,0 Гц, 1 Н); 7,34 (м, ушир.,1 Н); 7,67-7,79 (м, 3 Н); 10,0 (м ушир., 1 Н), 11,8 (м ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=527 [MH+]. Пример 21. а) 2,6-Дихлорбензолсульфонат 2-[(2-пиперазин-1-илэтил)карбамоил]амино-1 Н-бензимидазол-5 ила. а) 2,6-Дихлорбензолсульфонат 2-[(2-пиперазин-1-илэтил)карбамоил]амино-1 Н-бензимидазол-5 ила может быть получен следующим образом. К раствору 340 мг трет-бутил-4-(2-[(5-[(2,6-дихлорфенил)сульфонил]окси-1 Н-бензимидазол-2 ил)карбамоил]аминоэтил)пиперазин-1-карбоксилата в 60 см 3 дихлорметана добавляют 631 мг трифторуксусной кислоты. Оставляют при перемешивании в течение 24 ч при температуре около 20 С, затем добавляют 590 мг трифторуксусной кислоты. Реакционную среду оставляют при перемешивании в течение трех суток, затем выпаривают досуха при пониженном давлении (2 кПа). Остаток обрабатывают 25 см 3 воды, доводят рН до 9 добавлением карбоната калия, затем экстрагируют три раза 50 см 3 этилацетата. Объединенные органические фазы сушат над сульфатом магния, фильтруют и выпаривают досуха при пониженном давлении (2 кПа). После флеш-хроматографии на колонке из диоксида кремния [элюент: хлороформ/метанол/28%-й водный раствор аммиака (12/6/0,5 об.)] полученную смолу загущают в 25 см 3 диизопропилового эфира, центрифугируют, промывают три раза 2 см 3 диизопропилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 165 мг 2,6 дихлорбензолсульфоната 2-[(2-пиперазин-1-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 145-150 С (по Кофлеру),спектр ЯМР 1 Н при 300 МГц: 2,34 (м, 4 Н); 2,39 (т, J=6,5 Гц, 2 Н); 2,71 (м, 4 Н); 3,26 (м частично экранирован, 2 Н); 6,75 (дд, J=2,5 и 9,0 Гц, 1 Н); 7,09 (м шир., 1 Н); 7,21 (м ушир., 1 Н); 7,29 (д, J=9,0 Гц, 1 Н); 7,66-7,79 (м, 3 Н); 9,98 (м очень ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=513 [MH+]. б) трет-Бутил-4-(2-[(5-[(2,6-дихлорфенил)сульфонил]окси-1 Н-бензимидазол-2-ил)карбамоил] аминоэтил)пиперазин-1-карбоксилат может быть получен, как описано в примере 13 а), но исходя из 300 мг 2,6-дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 8 см 3 1-метил-2 пирролидинона и 827 мг трет-бутил-4-(2-аминоэтил)пиперазин-1-карбоксилата. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (92,5/7,5 об.)] полученную смолу оранжевого цвета загущают в 20 см 3 диизопропилового эфира, твердый продукт центрифугируют, промывают три раза 5 см 3 диизопропилового эфира, затем сушат при пониженном давлении над пентаоксидом фосфора. Получают 353 мг трет-бутил-4-(2-[(5-[(2,6-дихлорфенил)сульфонил]окси-1 Н- 28014315 бензимидазол-2-ил)карбамоил]аминоэтил)пиперазин-1-карбоксилата в виде порошка белого цвета, который имеет следующие характеристики:Rf CCM диоксид кремния=0,307 [элюент: дихлорметан/метанол (90/10 об.)] Масс-спектрометрия: MS (ES+): m/z=613 [MH+]. Пример 22. 2,6-Дихлорбензолсульфонат 2-[(2-пиперидин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила. а) 2,6-Дихлорбензолсульфонат 2-[(2-пиперидин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5 ила может быть получен, как описано в примере 21 а, но исходя из 250 мг трет-бутил-4-(2-[(5-[(2,6 дихлорфенил)сульфонил]окси-1 Н-бензимидазол-2-ил)карбамоил]аминоэтил)пиперазин-1-карбоксилата в 50 см 3 дихлорметана и 835 мг трифторуксусной кислоты. После флеш-хроматографии на колонке из диоксида кремния [элюент: хлороформ/метанол/28%-й водный раствор аммиака (12/3/0,5 об.)] полученную смолу загущают в 8 см 3 дихлорметана, твердое вещество центрифугируют, промывают два раза 3 см 3 дихлорметана и сушат при пониженном давлении над пентаоксидом фосфора. Получают 143 мг 2,6 дихлорбензолсульфоната 2-[(2-пиперидин-4-илэтил)карбамоил]амино-1 Н-бензимидазол-5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 165 С (по. Кофлеру),спектр ЯМР 1 Н при 400 МГц: 1,02 (м, 2 Н); 1,38 (м, 3 Н); 1,61 (м, 2 Н); 2,43 (дт, J=2,5 и 12,0 Гц, 2 Н); 2,91 (м, 4 Н); 3,20 (к, J=6,5 Гц, 2 Н); 6,73 (дд, J=2,5 и 8,5 Гц, 1 Н); 7,07 (д, J=2,5 Гц, 1 Н); 7,27 (д, J=8,5 Гц,1 Н); 7,30 (м ушир., 1 Н); 7,68-7,78 (м, 3 Н); 9,70 (м очень ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=512 [MH+]. б) трет-Бутил-4-(2-[(5-[(2,6-дихлорфенил)сульфонил]окси-1 Н-бензимидазол-2-ил)карбамоил] аминоэтил)пиперидин-1-карбоксилат может быть получен, как описано в примере 13 а, но исходя из 300 мг 2,6-дихлорбензолсульфоната 2-[(метоксикарбонил)амино]-1 Н-бензимидазол-5-ила в 8 см 3 1-метил-2 пирролидинона и 823 мг трет-бутил-4-(2-аминоэтил)пиперидин-1-карбоксилата. После флешхроматографии на колонке из диоксида кремния [элюент: дихлорметан/метанол (95/5 об.)] полученный продукт очищают на колонке из диоксида кремния [элюент: градиент дихлорметан/метанол от 98/2 до 95/5 об.]. Получают 93 мг трет-бутил-4-(2-[(5-[(2,6-дихлорфенил)сульфонил]окси-1 Н-бензимидазол 2-ил)карбамоил]аминоэтил)пиперидин-1-карбоксилата в виде твердого вещества белого цвета, который имеет следующие характеристики:Rf CCM диоксид кремния=0,416 [элюент: дихлорметан/метанол (90/10 об.)]. Масс-спектрометрия: MS (ES+): m/z=612 [MH+]. Пример 23. 2,6-Дихлорбензолсульфонат 2-[(трет-бутоксикарбонил)амино]-1 Н-бензимидазол-5-ила. 2,6-Дихлорбензолсульфонат 2-[(трет-бутоксикарбонил)амино]-1 Н-бензимидазол-5-ила может быть получен, как описано в примере 13 б, но исходя из 900 мг 2,6-дихлорбензолсульфоната 3,4 диаминофенила в 25 см 3 метанола, 162 мг уксусной кислоты и 784 мг ди-трет-бутил-[(Z)(метилтио)метилиден]бис-карбамата. После кипячения с обратным холодильником в течение 3 ч раствор охлаждают, выпаривают досуха при пониженном давлении (2 кПа) и остаток обрабатывают 60 см 3 насыщенного водного раствора гидрокарбоната натрия, затем экстрагируют три раза 50 см 3 дихлорметана. Объединенные органические фазы промывают три раза 20 см 3 воды, затем сушат над сульфатом магния,фильтруют и выпаривают досуха при пониженном давлении. После флеш-хроматографии на колонке из диоксида кремния [элюент: дихлорметан] полученный продукт перекристаллизовывают при нагревании из 5 см 3 ацетонитрила. Затем смесь помещают в водяную баню с температурой около 5 С, затем образовавшийся осадок фильтруют, промывают три раза 2 см 3 ацетонитрила и сушат при пониженном давлении. Получают 193 мг 2,6-дихлорбензолсульфоната 2-[(трет-бутоксикарбонил)амино]-1 Н-бензимидазол 5-ила в виде порошка белого цвета, который имеет следующие характеристики: температура плавления: 205 С (по Кофлеру),Спектр ЯМР 1 Н при 400 МГц: 1,51 (с, 9 Н); 6,79 (дд, J=2,5 и 8,5 Гц,1 Н); 7,10 (м ушир., 1 Н); 7,33 (д,J=8,5 Гц, 1 Н); 7,68-7,78 (м, 3 Н); 11,05 (м очень ушир., 1 Н); 11,95 (м очень ушир., 1 Н). Масс-спектрометрия: MS (ES+): m/z=458 [MH+]. Пример 24. 2,6-Дихлорбензолсульфонат 2-[(циклопропилкарбонил)амино]-1 Н-бензимидазол-5-ила. а) 2,6-Дихлорбензолсульфонат 2-[(циклопропилкарбонил)амино]-1 Н-бензимидазол-5-ила может быть получен следующим образом. К раствору 468 мг N-[(диметиламино)(3 Н-[1,2,3]триазоло[4,5-b]пиридин-3-илокси)метилен]-Nметилметанаминий-гексафторфосфата в 5 см 3 диметилформамида добавляют 159 мг диизопропилэтиламина и 106 мг циклопропанкарбоновой кислоты. После перемешивания реакционной среды в течение 1 ч при температуре около 20 С добавляют 220 мг 2,6-дихлорбензолсульфоната 2-амино-1 Н-бензимидазол 5-ила. Оставляют при перемешивании в течение ночи при температуре около 20 С. Реакционную среду разбавляют с помощью 50 см 3 воды, нерастворившуюся часть фильтруют, промывают три раза 5 см 3 воды, центрифугируют и сушат потоком воздуха. Полученный твердый продукт загущают в 10 см 3 смеси диэтилового эфира с ацетонитрилом (7/3 об.), затем центрифугируют, промывают три раза 2 см 3 диэтилового эфира и сушат при пониженном давлении над пентаоксидом фосфора. Получают 98 мг 2,6 дихлорбензолсульфоната 2-[(циклопропилкарбонил)амино]-1 Н-бензимидазол-5-ила в виде порошка бе- 29
МПК / Метки
МПК: C07D 417/12, C07D 277/82, C07D 401/12, C07D 235/32, C07D 235/30
Метки: бензимидазолов, фармацевтические, бензотиазолов, композиции, производные, качестве, применение, новое, средств, ингибиторов, лекарственных, частности, способ, новые, получения
Код ссылки
<a href="https://eas.patents.su/30-14315-novye-proizvodnye-benzimidazolov-i-benzotiazolov-sposob-ih-polucheniya-ih-primenenie-v-kachestve-lekarstvennyh-sredstv-farmacevticheskie-kompozicii-i-novoe-primenenie-v-chastnosti.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные бензимидазолов и бензотиазолов, способ их получения, их применение в качестве лекарственных средств, фармацевтические композиции и новое применение, в частности, в качестве ингибиторов cmet</a>
Предыдущий патент: Пониженная интерференция между маслосодержащими адъювантами и антигенами, содержащими поверхностно-активные вещества
Следующий патент: Способ получения диарилкарбоната
Случайный патент: Зажимное приспособление












